UJI DISOLUSI TABLET DIAZEPAM
DENGAN METODE KERANJANG
TUGAS AKHIR
OLEH:
DINI FILDZAH LUBIS
NIM 102410080
PROGRAM STUDI DIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Tugas Akhir ini dengan baik.
Pada dasarnya Tugas Akhir ini merupakan salah satu persyaratan untuk
menyelesaikan pendidikan Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara. Tugas Akhir ini disusun
berdasarkan apa yang penulis lakukan pada Praktek Kerja Lapangan (PKL) di Balai Besar Pengawas Obat dan Makanan (BBPOM) Medan.
Selama penyusunan Tugas Akhir ini, penulis banyak mendapat bantuan
dan bimbingan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU.
2. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., selaku Ketua Program
Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi USU. 3. Ibu Marianne, S.Si., M.Si., Apt., selaku dosen pembimbing.
4. Ibu Dra. Saodah,M.Si., Apt.,selaku Dosen Pembimbing Akademik penulis selama melaksanakan pendidikan pada Program Diploma III Analis Farmasi dan Makanan Fakultas Farmasi USU.
5. Bapak dan Ibu dosen beserta seluruh staf di Fakultas Farmasi USU.
6. BapakDrs. Agus Prabowo, M.S., Apt., selaku Kepala BBPOM di Medan
7. Ibu Lambok Oktavia,M.Kes., Apt., selaku Koordinator Pembimbing PKL
di BBPOM di Medan.
8. Seluruh staf dan karyawan BBPOM di Medan yang telah membantu penulisselama melaksanakan PKL.
9. Sahabat penulisFoda Faronadeges Siregar, Fani Tazrina Sinaga dan Ekanitha Sahara yang senantiasa memberi penulis semangat dan bantuan.
10.Teman-teman mahasiswa dan mahasiswi Program Studi Diploma III Analis Farmasi dan Makanan angkatan 2010, yang tidak dapat penulis sebutkan satu persatu, namun tidak mengurangi arti keberadaan mereka.
11.Ayahanda Fajar Syamsu Lubis dan Almarhumah Ibunda Helmi, keempatabang penulis, Kakanda Ferdian Lubis, Fahmi Jouhar Lubis,
Achmad Fauzi Lubis danKakanda Fadli Lubis. Kakak Penulis Kakanda Difaraty, serta seluruh keluarga yang telah memberikan dorongan baik moril maupun materil kepada penulis.
Penulis menyadari bahwa Tugas Akhir ini tidak luput dari kekurangan dan kelemahan.Harapan kritik dan saran yang bersifat membangun sangat penulis
harapkan demi kesempurnaan tulisan ini.Akhirnya penulis berharap semoga Tugas Akhir ini bermanfaat bagi kita semua.
Medan, Juni 2013 Penulis,
UJI DISOLUSI TABLET DIAZEPAM DENGAN METODE KERANJANG
ABSTRAK
Keamanan dan stabilitas mutu obat sangat penting karena menyangkut tentang dosis dan efektivitas obat dalam memberikan efek terapi sesuai dengan fungsinya.Pengujian dan standarisasi obat dilakukan guna memastikan bahwa suatu sediaan obat memenuhi standar yang telah ditetapkan. Pengujian disolusi secarain vitro pada sediaan tablet diazepam adalah untuk memastikan bahwa zat aktif yang terdapat di dalam obat dapat melarut setelah obat hancur agar efek terapi tercapai sesuai dengan persyaratan yang tertera pada Farmakope Indonesia Edisi IV. Pengujian disolusi tablet diazepam dilakukan di laboratorium NAPZA di Balai Besar Pengawasan Obat dan Makanan (BBPOM) Medan. Enam tablet diazepam diuji menggunakan alat disolusi tipe 1 yang menggunakan metode keranjang. Media disolusi adalah media HCl 0,1 N. Pengukuran kadar zat aktif tablet diazepam yang terlepas diukur dengan spektrofotometri UV-Vis pada panjang gelombang 242 nm. Diperoleh toleransi dalam waktu 30 menit dari 6 tablet yaitu : 98,24%; 90,40%; 97,14%; 99,15%; 100,02 %; 99,75 %. Keseluruhan tablet memenuhi persyaratan Farmakope Indonesia Edisi IV yang mensyaratkan toleransi dalam waktu 30 menit harus larut tidak kurang dari 85% (Q) C16H13ClN2O, dari jumlah yang tertera pada etiket.
THE DISSOLUTION TEST FOR DIAZEPAM TABLETS USING BASKET METHOD
ABSTRACT
The security and effectivity of drugs quality is very important because it straight about the dose and effectivity of drugs in giving therapycal effect as the function. The determination and standaritation of drugs is done to ensure the drug’s preparation had fullfil the standard. The in vitro’s dissolution test for diazepam tablet is done to ensure that the active content in the drugs preparation can dissolved after the drugs brake so the therapycal effect can be reached as the condition in the Pharmacope of Indonesia Edition IV. The dissolution test for diazepam tablets is done at NAPZA laboratory in Balai Besar Pengawasan Obat dan Makanan (BBPOM) Medan. Six diazepam tablets has been tested by dissolution’s tester type 1 which is using basket method. The dissolution’s media is HCl 0,1 N. The measuring for consentration of released active content from drugs using the spectrophotometry UV-Vis at wave range 242 nm. The result of tolerance from six drugs in 30 minutes are : 98,24%; 90,40%; 97,14%; 99,15%; 100,02 %; 99,75 %. All of the tablets fullfil the condition from Pharmacope of Indonesia Edition IV that requisited the tolerance of diazepam tablet in 30 minutes must been dissolved not less than 85% (Q) C16H13ClN2O from the mentioned at
the label.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB IPENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
1.3 Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 3
2.1 Tablet ... 3
2.1.1 Definisi Tablet ... 3
2.1.2 Penggolongan Sediaan Tablet ... 3
2.1.3 Pembuatan Granul Tablet ... 4
2.1.4 Metode Pembuatan Tablet ... 5
2.2 Benzodiazepin ... 7
2.2.1 Diazepam ... 7
2.2.2 Farmakologi benzodiazepin ... 8
2.3 Disolusi ... 9
2.3.1 Definisi Disolusi ... 9
2.3.2 Laju Disolusi ... 9
2.3.3 Alat Disolusi ... 9
2.3.4 Metode Disolusi... 10
2.3.5 Interpretasi Disolusi ... 11
2.4 SpektrofotometriUV-Visible ... 12
2.4.1 SerapanCahayaMolekul ... 12
BAB III METODOLOGI PERCOBAAN ... 14
3.1 Tempat Pengujian ... 14
3.2 Uji Disolusi Tablet Diazepam Dengan Metode Keranjang .. 14
3.2.1 Alat ... 14
3.2.2 Bahan ... 14
3.2.3 Prosedur ... 15
BAB IV HASIL DAN PEMBAHASAN ... 17
4.1 Hasil ... 17
4.2 Pembahasan ... 17
BAB V KESIMPULAN DAN SARAN ... 19
5.1 Kesimpulan ... 19
DAFTAR TABEL
Halaman Tabel 1. Penggolongan sediaan tablet ... 3
DAFTAR GAMBAR
Halaman Gambar 1. Rumus bangun diazepam ... 7
DAFTAR LAMPIRAN
Halaman Lampiran 1. Data dan perhitungan ... 21
UJI DISOLUSI TABLET DIAZEPAM DENGAN METODE KERANJANG
ABSTRAK
Keamanan dan stabilitas mutu obat sangat penting karena menyangkut tentang dosis dan efektivitas obat dalam memberikan efek terapi sesuai dengan fungsinya.Pengujian dan standarisasi obat dilakukan guna memastikan bahwa suatu sediaan obat memenuhi standar yang telah ditetapkan. Pengujian disolusi secarain vitro pada sediaan tablet diazepam adalah untuk memastikan bahwa zat aktif yang terdapat di dalam obat dapat melarut setelah obat hancur agar efek terapi tercapai sesuai dengan persyaratan yang tertera pada Farmakope Indonesia Edisi IV. Pengujian disolusi tablet diazepam dilakukan di laboratorium NAPZA di Balai Besar Pengawasan Obat dan Makanan (BBPOM) Medan. Enam tablet diazepam diuji menggunakan alat disolusi tipe 1 yang menggunakan metode keranjang. Media disolusi adalah media HCl 0,1 N. Pengukuran kadar zat aktif tablet diazepam yang terlepas diukur dengan spektrofotometri UV-Vis pada panjang gelombang 242 nm. Diperoleh toleransi dalam waktu 30 menit dari 6 tablet yaitu : 98,24%; 90,40%; 97,14%; 99,15%; 100,02 %; 99,75 %. Keseluruhan tablet memenuhi persyaratan Farmakope Indonesia Edisi IV yang mensyaratkan toleransi dalam waktu 30 menit harus larut tidak kurang dari 85% (Q) C16H13ClN2O, dari jumlah yang tertera pada etiket.
THE DISSOLUTION TEST FOR DIAZEPAM TABLETS USING BASKET METHOD
ABSTRACT
The security and effectivity of drugs quality is very important because it straight about the dose and effectivity of drugs in giving therapycal effect as the function. The determination and standaritation of drugs is done to ensure the drug’s preparation had fullfil the standard. The in vitro’s dissolution test for diazepam tablet is done to ensure that the active content in the drugs preparation can dissolved after the drugs brake so the therapycal effect can be reached as the condition in the Pharmacope of Indonesia Edition IV. The dissolution test for diazepam tablets is done at NAPZA laboratory in Balai Besar Pengawasan Obat dan Makanan (BBPOM) Medan. Six diazepam tablets has been tested by dissolution’s tester type 1 which is using basket method. The dissolution’s media is HCl 0,1 N. The measuring for consentration of released active content from drugs using the spectrophotometry UV-Vis at wave range 242 nm. The result of tolerance from six drugs in 30 minutes are : 98,24%; 90,40%; 97,14%; 99,15%; 100,02 %; 99,75 %. All of the tablets fullfil the condition from Pharmacope of Indonesia Edition IV that requisited the tolerance of diazepam tablet in 30 minutes must been dissolved not less than 85% (Q) C16H13ClN2O from the mentioned at
the label.
BAB I PENDAHULUAN
1.1 Latar Belakang
Untuk menghasilkan efek terapi, obat harus mencapai tempat aksinya dalam kadar yang cukup agar dapat menimbulkan respon. Tercapainya kadar obat
tersebut tergantung pada jumlah obat yang diberikan, keadaan dan kecepatan obat diabsorbsi dari tempat pemberian dan distribusinya oleh aliran darah ke bagian lain dari tubuh. Maka perlu diketahui bagaimana cara tubuh telah menangani obat
dengan proses absorbsi, distribusi, metabolisme, dan ekskresi(ADME) dalam penentuan suatu dosis, rute, dan bentuk obat yang diberikan agar diperoleh efek
terapi yang diinginkan dengan efek toksis yang minimal (Anief, 1994).
Uji disolusi pada dasarnya merupakan sarana fisik yang digunakan dalam pengembangan produk obat dan pengendalian mutu. Uji disolusi digunakan untuk
mengakomodasi kebutuhan nyata guna memenuhi persyaratan resmi untuk sediaan (Charles, 2010).
Uji disolusi menunjukkan informasi mengenai kadar zat aktif yang terlepas dari suatu sediaan farmasi sehingga diketahui dosis yang tercapai pada tubuh. Oleh karena itu penulis membuat tugas akhir yang berjudul “Uji Disolusi Tablet
Diazepam Dengan Metode Keranjang”.Adapun pengujian dilakukan selama penulis melakukan Praktek Kerja Lapangan (PKL) di Balai Besar Pengawas Obat
1.2 Tujuan
Tujuan dari uji disolusi tablet diazepam adalah untuk mengetahui apakah kadar zat aktif yang terlepas dari tablet diazepam memenuhi peryaratan atau tidak sesuai dengan ketentuan uji disolusi tablet diazepam yang tertera pada Farmakope
Edisi IV.
1.3 Manfaat
Manfaat yang diperoleh dari uji disolusi tablet diazepam adalah agar dapat memberi informasi kepada masyarakat bahwa produk sediaan tablet diazepam
BAB II
TINJAUAN PUSTAKA
2.1 Tablet
2.1.1 Defenisi Tablet
Tablet dapat didefenisikan sebagai bentuk sediaan solid yang mengandung
satu atau lebih zat aktif dengan atau tanpa berbagai eksipien (meningkatkan mutu sediaan tablet, kelancaran sifat aliran bebas, sifat kohetivitas, kecepatan disintegrasi, dan sifat antilekat) dan dibuat dengan mengempa campuran serbuk
dalam mesin tablet (Charles, 2010).
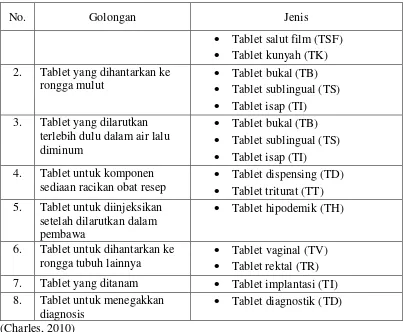
2.1.2 Penggolongan Sediaan Tablet
Penggolongan sediaan tablet didasarkan pada pada metode pembuatan dan pada tujuan penggunaannya adalah sebagai berikut:
Tabel 1. Penggolongan sediaan tablet
No. Golongan Jenis
1. Tablet oral yang dihantarkan ke dalam saluran cerna
• Tablet kempa (tablet kempa standar) (TKS)/tablet kempa konvensional (TKK)
• Tablet multikempa (TMK) • Tablet berlapis (TB) • Tablet salut kempa (TSK) • Tablet kerja cepat (TKC)
• Tablet kerja diperpanjang (tablet lepas-lambat) (TLL)
No. Golongan Jenis • Tablet salut film (TSF) • Tablet kunyah (TK) 2. Tablet yang dihantarkan ke
rongga mulut
• Tablet bukal (TB) • Tablet sublingual (TS) • Tablet isap (TI) 3. Tablet yang dilarutkan
terlebih dulu dalam air lalu diminum
• Tablet bukal (TB) • Tablet sublingual (TS) • Tablet isap (TI) 4. Tablet untuk komponen
sediaan racikan obat resep
• Tablet dispensing (TD) • Tablet triturat (TT) 5. Tablet untuk diinjeksikan
setelah dilarutkan dalam pembawa
• Tablet hipodemik (TH)
6. Tablet untuk dihantarkan ke rongga tubuh lainnya
• Tablet vaginal (TV) • Tablet rektal (TR) 7. Tablet yang ditanam • Tablet implantasi (TI) 8. Tablet untuk menegakkan
diagnosis
• Tablet diagnostik (TD)
(Charles, 2010)
2.1.3 Pembuatan GranulTablet
Dalam pembuatan tablet, zat berkhasiat, dan zat-zat lain kecuali pelicin
dibuat granul (butiran kasar), karena serbuk yang halus tidak mengisi cetakan tablet dengan baik maka dibuat granul agar mudah mengalir mengisi cetakan serta
menjaga agar tablet tidak retak (Anief, 1994). Cara membuat granul ada dua macam, yaitu : 1. Cara basah
pengering pada suhu 400-500C.setelah kering diayak lagi untuk memperoleh
granul dengan ukuran yang diperlukan dan ditambahkan bahan pelicin dan dicetak menjadi tablet dengan mesin tablet (Anief, 1994).
2. Cara kering
Zat berkhasiat, zat pengisi, zat penghancur, bila perlu zat pengikat dan zat pelicin dicampur dan dibuat dengan cara kempa cetak menjadi tablet yang besar,
setelah itu tablet yang terjadi dipecah menjadi granul lalu diayak, akhirnya dikempa cetak tablet yang dikehendaki dengan mesin tablet (Anief, 1994).
2.1.4 Metode Pembuatan Tablet 1. Metode granulasi basah
Masing-masing zat aktif dan eksipien dihaluskan dalam alat penghalus secara terpisah.Zat aktif dan eksipien (fase dalam) dicampur dalam alat pencampur. Cairan penggranulasi disiapkan, lalu dibuat massa granulasi serbuk
dengan cairan penggranulasi (dalam alat campur). Massa basah digranulasi melalui lempeng 6-12 mesh dalam mesin granulator. Granul basah dikeringkan
dalam lemari pengering pada suhu ± 50-600C. Ukuran granul kering dikurangi melalui lempeng 14-20 mesh dalam mesin granulator. Granul dicampur dengan serbuk fase luar (lubrikan, disintegran) dicampur dalam mesin campur khusus
2. Metode granulasi kering
Masing-masing zat aktif dan eksipien dihaluskan (dalam alat penghalus secara terpisah).Semua serbuk (fase dalam dan fase luar) dicampur atau hanya fase dalam saja. Dibuat bongkahan serbuk dalam mesin kompaktor, lalu
bongkahan dikecilkan dengan mesin granulator. Granul dengan serbuk fase luar dicampur dalam mesin pencampur khusus menjadi massa kempa, kemudian massa
kempa dikempa menjadi tablet jadi dalam mesin tablet (Charles, 2010). 3. Metode kempa langsung
Masing-masing zat aktif dan eksipien dihaluskan dalam alat penghalus
secara terpisah lalu semua serbuk dicampur dalam alat campur menjadi massa kempa, kemudian massa kempa dikempa menjadi tablet jadi dalam mesin tablet
(Charles, 2010).
2.1.5Eksipien Formulasi Tablet
Komposisi tablet pada umumnya terdiri atas bahan aktifdan eksipien
(ada sejumlah kecil tablet yang dapat dibuat tanpa eksipien). Untuk dapat menghantarkan obat dalam jumlah (dosis) yang cukup pada penggunaan klinik,
diberikan bentuk sediaan yang dapat diterima pasien.Eksipien ditambahkan dengan berbagai fungsi dan tujuan spesifik sebagai pengisi, pengikat, penghancur, pelincir, antilengket, pelicin, pembasah, zat warna, peningkat rasa, pemanis,
2.2 Benzodiazepin
Benzodizepin merupakan obat kelompok hipnotik sedatif.Rumus umum benzodiazepin terdiri atas cincin benzene yang melekat pada cincin diazepin. Meski demikian, karena obat kelompok benzodiazepin yang penting secara
farmakologis selalu mengandung gugus substitusi 5-aril dan cincin 1,4benzodiazepin, maka rumus struktur golongan ini selalu diidentikkan dengan
5-aril-1,4-benzodiazepin (Rohman, 2012).
Senyawa obat yang digolongkan sebagai transkuilansia adalah yang bersifat menghilangkan kecemasan (anksiolitik) dan sedatif, umumnya juga
bersifat merelaksasi otot. Wakil yang palingefektif dalam golongan obat benzodiazepin adalah senyawa1,4-benzodiazepin. Senyawa barbiturat dan
hipnotika lain,memperlihatkan kerja yang setara pada dosis yang rendah (Schunack,1990).
2.2.1 Diazepam Rumus Bangun :
Gambar 1. Rumus bangun diazepam
Rumus molekul : 7-kloro-1,3-dihidro-1-metil-5-fenil-2H-1,4-benzodiazepin-
2-on (C16H13ClN2O)
Pemerian : Serbuk hablur, hampir putih sampai kuning, praktis tidak
berbau (Ditjen POM, 1995).
2.2.2 Farmakologi Benzodiazepin
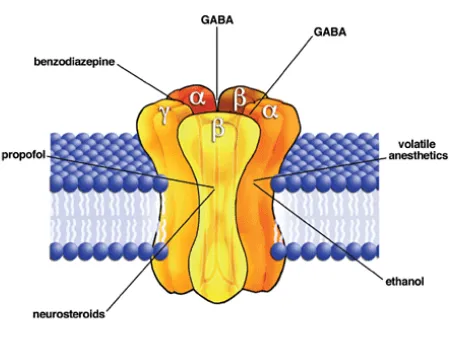
Gambar 2. Reseptor GABA
Di dalam tubuh, benzodiazepin berikatan dengan reseptor GABA (Gamma Aminobutyric Acid) yang ada di dalam membran neuron pada sistem saraf pusat.
Reseptor GABA ini berfungsi sebagai saluran ion klorida. Reseptor GABA memiliki struktur yang tersusun dari 5 subunit polipeptida yang disebut α, β dan γ. Ruang untuk ikatan benzodiazepin ada diantara α3 dan γ2. Studi menunjukkan
bahwa benzodiazepin meningkatkan frekuensi dari pembukaan saluran ion klorida pada reseptor GABA sehingga konduktansi ion klorida pun meningkat. Hal
2.3 Disolusi
2.3.1 Definisi Disolusi
Disolusi adalah proses suatu sediaan zat solid memasuki pelarut untuk menghasilkan suatu larutan. Disolusi secara singkat didefinisikan sebagai proses
suatu solid melarut (Charles,2010).
2.3.2 Laju Disolusi
Laju disolusi adalah jumlah zat aktif yang larut per satuan waktu di bawah kondisi yang dibakukan dari antar permukaan cairan/solid, suhu dan komposisi
pelarut. Laju disolusi zat aktif murni ditentukan oleh tingkat gaya tarik antara pelarut dan zat terlarut untuk mengatasi gaya kohesif yang ada dalam zat terlarut tersebut (Charles,2010).
2.3.3 Alat Disolusi
Alat-alat uji disolusi terdiri dari 2 tipe, yaitu alat tipe 1 dan tipe 2. Alat tipe 1 terdiri dari sebuah wadah bertutup yang terbuat dari kaca atau bahan
transparan lain yang inert, suatu motor, suatu batang logam yang digerakkan oleh motor dan keranjang berbentuk silinder. Wadah tercelup sebagian di dalam suatu
tangas air yang sesuai berukuran sedemikian sehingga dapat mempertahankan suhu dalam wadah pada 37°±0,5°C selama pengujian berlangsung dan menjaga agar gerakan air dalam tangas air halus dan tetap. Bagian dari alat, termasuk
lingkungan tempat alat diletakkan tidak dapat memberikan gerakan, goncangan atau getaran signifikan yang melebihi gerakan akibat perputaran alat pengaduk
Alat tipe 2, sama seperti alat tipe 1, bedanya pada alat ini digunakan
dayung yang terdiri dari daun dan batang sebagai pengaduk. Batang berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus tanpa goyangan yang berarti.
Daun melewati diameter batang sehingga dasar daun dan batang rata. Dayung memenuhi spesifikasi pada jarak 25 mm ± 2 mm antara daun dan bagian dasar
wadah dipertahankan selama pengujian berlangsung. Sediaan dibiarkan tenggelam ke dalam dasar wadah sebelum dayung mulai berputar sepotong kecil bahan yang tidak bereaksi seperti gulungan kawat berbentuk spiral dapat digunakan untuk
mencegah mengapungnya sediaan (Ditjen POM, 1995).
2.3.4 Metode Disolusi
Metode disolusi ada dua, yaitu metode keranjang dan metode dayung. Metode keranjang pada mulanya diusulkan oleh Pernarowski pada tahun 1968. Metode keranjang menunjukkan suatu upaya membatasi posisi bentuk sediaan
untuk memberikan kemungkinan maksimum suatu antar permukaan solid-cairan yang tetap. Metode ini mempunyai beberapa keterbatasan, yaitu kecenderungan
zat bergerak menyumbat kasa keranjang, sangat peka terhadap gas terlarut dalam media disolusi, kecepatan aliran yang kurang memadai ketika partikel meninggalkan keranjang dan mengapung dalam media, dan kesulitan konstruksi
jika diupayakan metode yang diotomatisasi. Metode keranjang disebut juga metode alat 1 (Charles, 2010).
mensyaratkan presisi yang ekstrem dalam geometri dayung , labu, dan perlakuan
variasi yang tidak dapat diterima dalam data disolusi berikutnya, bahkan perubahan yang sangat kecil dalam penempatan dayung. Metode ini sangat baik untuk sistem otomatis (Charles, 2010).
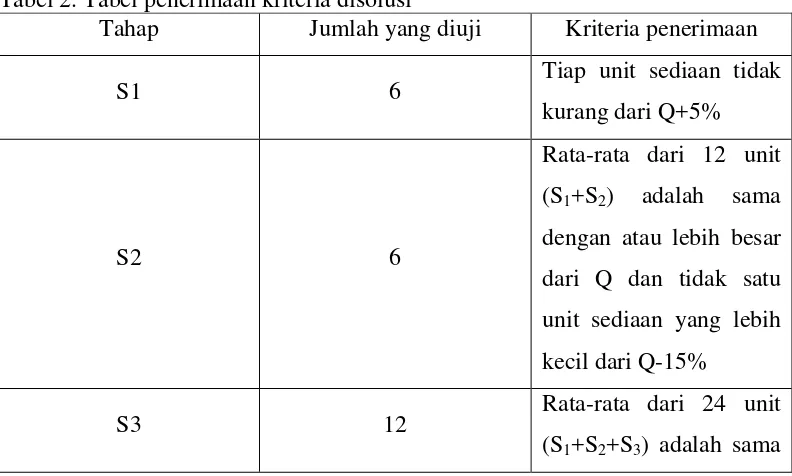
2.3.5 Interpretasi Disolusi
Interpretasi kecuali dinyatakan lain dalam masing-masing monografi,
persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Pengujian dilanjutkan sampai tiga tahap kecuali
bila hasil pengujian memenuhi tahap S1 atau S2. Harga Q adalah jumlah zat aktif
yang terlarut seperti yang tertera dalam masing-masing monografi, dinyatakan dalam persentase kadar pada etiket, angka 5% dan 15% dalam tabel adalah
persentase kadar pada etiket, dengan demikian mempunyai arti yang sama dengan Q (Ditjen POM, 1995).
Tabel 2. Tabel penerimaan kriteria disolusi
Tahap Jumlah yang diuji Kriteria penerimaan
S1 6 Tiap unit sediaan tidak
kurang dari Q+5%
S2 6
Rata-rata dari 12 unit (S1+S2) adalah sama
dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q-15%
S3 12 Rata-rata dari 24 unit
Tahap Jumlah yang diuji Kriteria penerimaan dengan atau lebih besar dari Q, tidak lebih dari 2 unit sediaan yang lebih kecil dari Q-15% dan tidak satu unit pun yang lebih kecil dari Q-25% (Ditjen POM, 1995)
2.4 SpektrofotometriUV-Visible
Spektrofotometri UV-Visible memiliki penyerapan panjang gelombang pada radiasi elektromagnetik antara 200-800 nm oleh molekul yang mempunyai π
elektron atau yang mempunyai joli elektron nir-patungan menjadi dasar spektroskopi serapan elektronik molekuler pada daerah sinar UV-Vis dari spektrum elektromagnet. Spektroskopi serapan elektron (spektrofotometri)
mungkin merupakan metode analisis yang paling luas dalam laboratorium. Hubungan antara kadar analit dan jumlah cahaya terserap merupakan kebanyakan penerapan analisis spektrofotometri (Munson, 1991).
2.4.1 Serapan Cahaya Molekul
Gelombang cahaya dapat dipandang sebagai gangguan elektromagnet yang
berjalan dalam suatu garis lurus dengan kecepatan dalam hampa (c) = 3,0 x1010cm dt-1. Tegak lurus pada arah jalur gelombang terdapat medan listrik berselang dan tegak lurus pada arah gelombang dan bidang alunan vektor
daur vektor listrik tuntas disebut panjang gelombang selama satu daur vektor listrik tuntas disebut panjang gelombang cahaya (λ). Kecepatan, frekuensi dan
panjang gelombang dari gelombang cahaya mempunyai hubungan persamaan [c = λ ν] (Munson, 1991).
Besarnya absorbsi sinar pada panjang gelombang tertentu dapat dihitung dengan menggunakan Hukum Beer. Persamaan ini menyatakan hubungan antara
jumlah sinar yang diabsorbsi (A) dengan konsentrasi zat yang mengabsorbsi (c dalam gram/liter) dan panjangnya jalan dari sinar yang melewati suatu zat (b dalam cm) persamaannya adalah sebagai berikut:
A = abc
a adalah tetapan yang dikenal sebagai daya serap (absorptivity) untuk suatu zat
BAB III
METODE PENGUJIAN
3.1 Tempat Pengujian
Uji disolusi tablet diazepam dilakukan di Balai Besar Pengawas Obat dan Makanan (BBPOM) di Medan yang berada di Jalan Willem Iskandar Pasar V
Barat I No. 2 Medan.
3.2 Uji Disolusi Tablet Diazepam Dengan Metode Keranjang 3.2.1 Alat
Alat-alat yang digunakan adalah alumunium foil, batang pengaduk, beaker glass 1000 ml, dissolution tester (tipe 1), erlenmeyer, gelas ukur 100 ml,
gelas ukur 1000 ml, labu tentukur 25 ml, labu tentukur 100 ml, lemari asam, spektrofotometer UV-Vis Shimadzu UV 1800, spuit 20 ml dan printer Canon IP 1880.
3.2.2 Bahan
Bahan-bahan yang digunakan adalah akuades, HCl Pekat, HCl 0,1 N dan
3.2.3 Prosedur
• Pembuatan media HCl 0,1 N
Dipipet 8,5 ml HCl pekat, lalu ditambahkan dengan akuades sampai
volume 1000 ml. Dibuat sebanyak 7000 ml (digunakan untuk media 6 tablet dan pengenceran).
• Pembuatan larutan baku
Timbang baku secara seksama ± 5 mg, dimasukkan baku kedalam labu
tentukur 25 ml, lalu ditambahkan 10ml media HCl 0,1 N yang telah disonikasi sampai garis tanda, kemudian dipipet 1 ml dari larutan, kemudian dimasukkan ke dalam labu tentukur 100 ml, lalu ditambahkan dengan media HCl 0,1 N sampai
garis tanda.
• Uji disolusi metode keranjang
Disiapkan alat dissolution tester, kemudian diisi 6 wadah disolusi masing-masing dengan 900 ml media HCl 0,1 N dan diatur suhu media pada 370C
dengan kecepatan putaran 100 rpm. Dibiarkan hingga suhu sama rata pada semua media. Setelah suhu tercapai, dimasukkan tiap tablet diazepam ke dalam masing-masing keranjang, keranjang dipasang pada alat dissolution tester, kemudian alat
dissolution testerdijalankan selama 30 menit.Setelah 30 menit diambil aliquot 20 ml dari masing-masing media menggunakan spuit.Dipindahkan masing-masing
Toleransi dari keenam tablet dihitung dengan cara mengalikan faktor
perkalian % zat aktif terlarut (Fk) dengan absorbansi larutan uji yang diperoleh (Au) berdasarkan rumus:
Q = Fk x Au
Faktor perkalian % zat aktif terlarut (Fk) diperoleh berdasarkan rumus: Fk = V x Bb x Fu x 100,47%
Ab x Fp x Ke
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
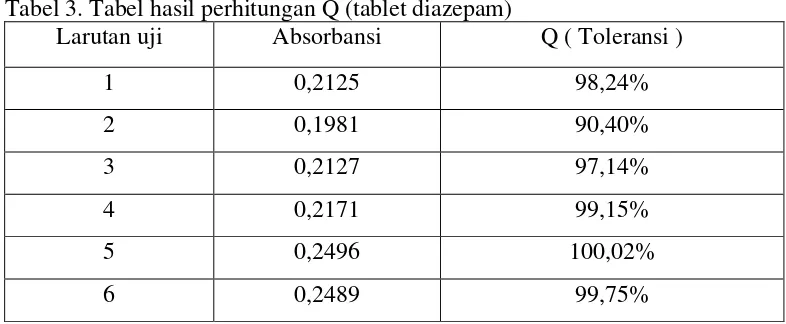
Hasil uji disolusi terhadap enam tablet diazepam yang dilakukan di Balai Besar POM Medan tertera pada Tabel 3.
Tabel 3. Tabel hasil perhitungan Q (tablet diazepam)
Larutan uji Absorbansi Q ( Toleransi )
1 0,2125 98,24%
Q (toleransi) diperoleh dari perkalian Fk dengan absorbansi larutan uji yang diperoleh. Sedangkan nilai Fk yaitu 456,73% diperoleh dari perhitungan
berdasarkan rumus yang tertera pada Lampiran 1 halaman 22.
4.2 Pembahasan
Berdasarkan pengujian disolusi tablet diazepam yang dilakukan di
BBPOM Medan, diperoleh kadar zat aktif yang terlepas dari keenam tablet yang memenuhi persyaratan Farmakope Indonesia Edisi IV yaitu toleransi dalam waktu
30 menit harus tidak larut tidak kurang dari 85% (Q) C16H13ClN2O, dari jumlah
Efek terapi obat biasanya terlihat sesudah zat aktifnya masuk melalui
sistem pembuluh aorta lalu masuk ke hati dan kembali masuk peredaran darah dan didistribusikan ke seluruh jaringan badan. Ketersediaan farmasetik ditentukan secara in vitro dengan mengukur kecepatan disolusi zat aktif dalam waktu
tertentu(Anief,1994).
Hubungan antara aktivitas hayati dan berbagai sifat farmakologinya dapat
diramalkan keberhasilannya dengan metode in vitro. Pendekatan ini adalah metode yang sangat canggih untuk meramalkan kerja obat dalam tubuh meskipun tidak dapat meramalkan toksisitas, efek samping, dan ciri pengangkutan obat di
dalam mekanisme in vivo (Nogrady, 1992).
Ketersediaan biologik dalam arti sempit menunjukkan besarnya bagian
dari dosis suatu obat yang mencapai sirkulasi sistemik. Besaran ini ditulis sebagai presentase (%) dari dosis. Suatu ketersediaan biologik yang tinggi ( misal >80%) menunjukkan bahwa zat aktif dari suatu obat dibebaskan secara sempurna, dan
diabsorbsi sempurna, dan dalam perjalanan pertama melalui usus halus dan hati tanpa mengalami eliminasi yang berarti. Sedangkan ketersediaan biologik yang
rendah (misal <30%) menunjukkan bahwa hanya persentase kecil dari zat aktif yang sampai pada sirkulasi sistemik. Mekanisme yang menyebabkan hal tersebut banyak kemungkinan diantaranya kelarutan obat dalam usus yang jelek. Hal ini
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari pengujian yang dilakukan terhadap 6 tablet diazepam, diperoleh persentase kadar zat aktif yang terlepas adalah sebagai berikut: 98,24%; 90,40%; 97,14%; 99,15%; 100,02%; 99,75%. Tablet diazepam yang diuji
memenuhi persyaratan disolusi karena menurutFarmakope Indonesia edisi IV, toleransidalamwaktu 30 menitharuslaruttidak kurang dari 85% (Q) C16H13ClN2O,
darijumlah yang terterapadaetiket.
5.2 Saran
Disarankankepadamasyarakat agar mengkonsumsiobat yang telahteregistrasidantelahterstandarisasioleh BBPOM. Karena obat yang
DAFTAR PUSTAKA
Agoes, G. (2008). Pengembangan Sediaan Farmasi (Edisi Revisi dan Perluasan). Bandung: Penerbit ITB. Hal. 197.
Anief, M. (1994).Farmasetika. Yogyakarta: Gadjah Mada University Press. Hal.107-114.
Charles, J.P., danWikarsa, S. (2010). TeknologiFarmasiSediaan Tablet Dasar-DasarPraktis. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 1-4,53-85,188.
Ditjen POM.(1995). Farmakope Indonesia edisi IV. Jakarta: Depkes RI. Hal.303-305, 1063, 1083-1085.
Katzung, G. (2004). Basic and Clinical Pharmacology. United States: Mc. Graw-Hill Companies. Hal. 356-357.
Martin, A. (1990). Farmasi Fisik Dasar-Dasar Farmasi Fisik Dalam Ilmu Farmasetik. Jakarta: UI-Press. Hal.240-241.
Munson, W. (1991).AnalisisFarmasiMetode Modern. Surabaya: Airlangga University Press. Hal.334,342.
Nogrady, T. (1992).Kimia Medisinal Pendekatan Secara Biokimia. Bandung: Penerbit ITB. Hal.7,551.
Rohman, A. (2012). AnalisisFarmasi. Yogyakarta: Pustaka Pelajar. Hal.386. Widodo, U. (1993). Kumpulan Data Klinik Farmakologi. Yogyakarta: Gadjah
LAMPIRAN 1
DATA DAN PERHITUNGAN
Sampel
Namacontoh : Diazepam
Bentuk : Tablet
No.kodecontoh : 490 Wadah/kemasan : Pot plastik
Komposisi : Diazepam 2 mg
Fp = Faktorpengenceran = 2500 Fu = FaktorPengenceranlarutanuji = 1
Perhitungan
Fk = Faktorperkalian % zataktifterlarut( Dx) Rumus : Fk = V x Bb x Fu x 100,47%
Ab x Fp x Ke
Fk = 900 x 5,872 x 1 x 100,47% 0,2325 x 2500 x 2
Fk = 456,743%
Rumus : Q = Fk x Au
Q1 = Fk x Au1 = 456,743% x 0,2125 = 98,24% Q2 = Fk x Au2 = 456,743% x 0,1981 = 90,40%
Q3 = Fk x Au3 = 456,743% x 0,2127 = 97,14% Q4 = Fk x Au4 = 456,743% x 0,2171 = 99,15%
LAMPIRAN 2 GAMBAR ALAT
Gambar neraca analitis Gambar dissolution tester
Gambar alat disolusi tipe dayung Gambar alat spektrofotometer