FORMULASI
ORALLY DISINTEGRATING TABLET
(ODT)
METOKLOPRAMIDA HCl MENGGUNAKAN KOMBINASI
KROSPOVIDON DAN Ac-Di-Sol DENGAN METODE CETAK
LANGSUNG
SKRIPSI
OLEH:
SARIATY FARAH DIBA NIM 071501080
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
FORMULASI
ORALLY DISINTEGRATING TABLET
(ODT)
METOKLOPRAMIDA HCl MENGGUNAKAN KOMBINASI
KROSPOVIDON DAN Ac-Di-Sol DENGAN METODE CETAK
LANGSUNG
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SARIATY FARAH DIBA NIM 071501080
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
FORMULASI ORALLY DISINTEGRATING TABLET (ODT) METOKLOPRAMIDA HCl MENGGUNAKAN KOMBINASI KROSPOVIDON DAN Ac-Di-Sol DENGAN METODE CETAK
LANGSUNG
OLEH:
SARIATY FARAH DIBA NIM 071501080
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Desember 2011
Pembimbing I, Panitia Penguji:
Prof. Dr. Karsono, Apt. Prof. Dr. M. T. Simanjuntak, M.Sc., Apt. NIP 195409091982011001 NIP 195212041980021001
Pembimbing II, Prof. Dr. Karsono, Apt. NIP195409091982011001
Dra. Juanita Tanuwijaya, M.Si., Apt. Drs. Agusmal Dalimunthe, MS., Apt NIP195111021977102001 NIP 195406081983031005
Dra. Fat Aminah, M.Sc., Apt NIP 195212041980021001
Medan, Desember 2011 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Formulation of Orally Disintegrating Tablet (ODTs) Metochlopramide HCL use Physical mixture of Crospovidone and Ac-Di-Sol with Direct
Compression Method.
Abstract
Orally Disintegration Tablets are solid dosage forms containing medicinal substances which disintegrate rapidly without need a water and usually less than 3 minute, when placed on the tongue. ODTs give an advantages for the pediatric and geriatric who have difficulties for swallow conventional tablets. ODTs offer convenience for active patients who are busy, travelling, on vacation and may not have acess to water. The aim of this research was to make a formulation of Orally Disintegrating Tablets Metochlopramide HCl which fulfilled the requirement of Pharmacopoeia.
ODTs was formulated by using physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol in the different ratio (1:1; 1:2; 2:1; 1:3; 3:1) then tablets were prepared by direct compression method. The resulting tablets were evaluated for hardness, friability, disintegration time, content uniformity, wetting time, water absorption ratio, in vitro drug release studies and disintegration time in mouth.
The result show that ODT Metochlopramide HCl which is prepared by direct compression method use physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol fulfilled the requirement for hardness, friability, disintegration time, content uniformity, wetting time, water absorption ratio, in vitro drug release, and disintegration time in mouth. Disintegration time from formula tablets which are formulated without superdiisntegrant need longer time (60.28 second) than tablets which are formulated with a crospovidone (34.33 second) or formulated with Ac-Di-Sol (27.5 second). Whereas the formulation of ODTs which are use physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol have disintegration time very fast ( 8-13 second) and better than ODTs which are formulated only use crospovidone or only use Ac-Di-Sol. In vitro drug release of all formulation ODTs shows high drug release in the first minute where the ODT1 release 60.23% metochlopramide HCl, ODT2 release 54.53%, ODT3 release 69.25%, ODT4 release 64.63%, and ODT5 release 72.83%. It so different with generic tablet (Kimia Farma) and Primperan tablet which is only release 18.49% metochlopramide for generic tablet and 14.78% for Primperan tablets. To determinate the presence or absence of significant differences dissolution profiles between all formula ODTs with generic tablets and Primperan tablet performed statistical tests for ANOVA using SPSS program 18.0 (p < 0,05)
Formulasi Oraly Disintegrating Tablet (ODT) Metoklopramida HCl menggunakan Krospovidon dan Ac-Di-Sol dengan metode cetak langsung
Abstrak
Orally Disintegrating Tablet adalah bentuk sediaan padat yang mengandung bahan aktif obat yang hancur atau melarut dengan cepat tanpa memerlukan air dalam waktu kurang dari 3 menit ketika diletakkan di atas lidah.
Orally Disintegrating Tablet (ODT) memberikan keuntungan untuk kelompok pediatri dan geriatri yang mengalami kesulitan dalam menelan tablet konvensional. ODT menawarkan kemudahan bagi pasien yang sedang sibuk, berlibur dan menempuh perjalanan jauh yang kemungkinan besar air minum sulit diperoleh, Tujuan utama dari penelitian ini adalah untuk membuat formulasi
Orally Disintegrating Tablet (ODT) metoklopramida HCL yang memenuhi persyratan Farmakope.
Orally Disintegrating Tablet Metoklopramida HCl dibuat menggunakan campuran superdisintegran Krospovidon dan Ac-Di-Sol dengan perbandingan 1:1 ; 1:2 ; 2:1 ; 1:3 ; 3:1 dengan metode cetak langsung. Tablet yang dihasilkan dievaluasi dengan menggunakan parameter antara lain: kekerasan, friabilitas, waktu hancur, waktu pembasahan (wetting time), rasio absorbsi air, waktu hancur di rongga mulut, penetapan kadar, keseragaman sediaan dan disolusi.
Hasil penelitian menunjukkan bahwa Orally Disintegrating Tablet
Metoklopramida HCl yang dibuat dengan metode cetak langsung menggunakan campuran AcDiSol dan Krospovidon sebagai superdesintegran memenuhi persyaratan penetapan kadar zat berkhasiat, keseragaman kandungan, kekerasan, friabilitas, waktu hancur, uji disolusi, waktu pembasahan ( wetting time), rasio absorbsi air, dan waktu hancur di rongga mulut. Waktu hancur dari formula tablet yang tidak menggunakan superdisintegran lebih lama (60,28 detik) dibandingkan ODT yang menggunakan superdisintegran tunggal (34,33 detik untuk krospovidon dan 27,5 detik untuk Ac-Di-Sol). Sedangkan Formula ODT yang menggunakan campuran superdisintegran memiliki waktu hancur yang sangat cepat (8 detik untuk ODT1, 13 detik untuk ODT2, 13,6 detik untuk ODT3, 13,8 detik untuk ODT4, dan 13 detik untuk ODT5) dan lebih baik dibandingkan dengan ODT yang menggunakan superdisintegran tunggal. Uji pelepasan obat secara in vitro pada semua formula ODT pada menit ke-1 sudah memiliki % kumulatif yang tinggi dimana pada formula ODT1 60,23%; ODT2 54,35%; ODT3 69,25%; ODT4 64,63%; ODT5 72,83%, berbeda jauh dengan tablet generik dan paten yang pada menit ke-1 hanya melepaskan 18,49% untuk generik dan 14,78% pada tablet Primperan (paten). Untuk mengetahui ada atau tidaknya perbedaan bermakna / signifikan profil disolusi dari semua formula ODT dengan tablet Metoklopramida generik dan Primperan maka dilakukan uji ANOVA dengan program SPSS 18.0 (p < 0,05)
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
ABSTRAK ... iv
ABSTRACT ... v
DAFTAR ISI ... vi
DAFTAR TABEL... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 15
1.1 Latar Belakang ... 15
1.2 Perumusan Masalah ... 17
1.3 Hipotesis ... 17
1.4 Tujuan Penelitian ... 18
1.5 Manfaat Penelitian ... 18
BAB II TINJAUAN PUSTAKA ... 19
2.1 Orally Disintegrating Tablet ... 19
2.1.1 Pengertian ... 19
2.1.2 Karakteristik ideal ODT ... 20
2.1.3 Kelebihan dan kekurangan Formulasi ODT ... 22
2.2 Komposisi tablet ... 23
2.3 Uji Preformulasi ... 24
2.5 Metoklopramida Hidrokloridum ... 26
2.5.1 Tinjauan umum ... 26
2.5.2 Farmakologi ... 27
2.5.3 Efek samping dan Interaksi Obat ... 27
2.6 Uraian tentang Ac-Di-Sol ... 27
2.7 Uraian tentang Krospovidon ... 28
2.8 Spektrofotometri Ultraviolet ... 30
BAB III METODE PENELITIAN ... 30
3.1 Alat ... 30
3.2 Bahan ... 30
3.3 Prosedur Kerja ... 31
3.3.1 Pembuatan ODT Metoklopramida HCl ... 31
3.3.2 Uji Preformulasi ... 33
3.3.2.1 Sudut Diam ... 33
3.3.2.2 Waktu Alir ... 33
3.3.2.3 Indeks Tap ... 34
3.3.3 Pembuatan Pereaksi ... 34
3.3.3.1 Pembuatan HCl 0,1 N ... 34
3.3.4 Penentuan kurva serapan dan linearitas kurva kalibrasi metoklopramida HCl dalam larutan HCl 0,1 N .... 34
3.3.4.1 Pembuatan Larutan induk baku I ... 34
3.3.4.2 Pembuatan Larutan induk baku II ... 35
3.3.4.3 Penentuan kurva serapan Metoklopramida HCl ... 35
3.3.5 Penentuan kurva serapan dan linearitas kurva
kalibrasi Metoklopramida HCl dalam air suling ... 35
3.3.5.1 Pembuatan larutan induk baku I... 36
3.3.5.2 Pembuatan larutan induk baku II ... 36
3.3.5.3 Pembuatan kurva serapan Metoklopramida HCl ... 36
3.3.5.4 Penentuan linearitas kurva kalibrasi Metoklopramida HCl dalam air suling ... 37
3.4 Evaluasi Tablet ... 37
3.4.1 Penetapan kadar Metoklopramida HCl dalam tablet ... 37
3.4.2 Uji kekerasan tablet ... 37
3.4.3 Uji Friabilitas Tablet ... 37
3.4.4 Uji Waktu hancur... 38
3.4.5 Uji Keseragaman sediaan ... 38
3.4.6 Uji Penetapan kadar Metoklopramida HCl dalam ODT ... 39
3.4.7 Uji Disolusi tablet ... 40
3.4.8 Uji Waktu pembasahan ... 41
3.4.9 Uji Rasio absorbsi air ... 42
3.4.10 Uji waktu hancur di mulut ... 42
3.5 Analisa Data secara Statistik ... 43
3.5.1 Uji statistik terhadap evaluasi waktu hancur ... 43
3.5.2 Uji statistik terhadap profil pelepasan obat ... 43
BAB IV HASIL DAN PEMBASAHAN ... 44
4.1 Uji preformulasi granul Metoklopramida HCl... 44
4.1.1 Uji Waktu alir ... 44
4.1.3 Uji Indeks tap ... 47
4.2 Hasil evaluasi ODT Metoklopramida HCl ... 47
4.2.1 Kekerasan ... 47
4.2.2 Friabilitas... 47
4.2.3 Waktu hancur ... 48
4.2.4 Penentuan kurva serapan dan linearitas kurva kalibrasi Metoklopramida HCl dalam larutan HCl 0,1 N ... 50
4.2.4.1 Hasil penentuan panjang gelombang maksimum ... 50
4.2.4.2 Hasil penentuan linearitas kurva kalibrasi dalam HCl 0,1 N ... 51
4.2.5 Penentuan kadar Metoklopramida HCl dalam tablet ... 52
4.2.6 Keseragaman Kandungan... 53
4.2.7 Hasil kurva dan data serapan Metoklopramida HCl baku pembanding Metoklopramida HCl dalam air suling .. 53
4.2.8 Hasil penentuan linearitas kurva kalibrasi Metoklopramida HCl baku pembanding dalam air suling .. 54
4.2.9 Disolusi ... 55
4.2.9.1 Hasil uji anova dan duncan disolusi menit ke-1 ... 57
4.2.9.2 Hasil uji anova dan duncan disolusi menit ke-6 ... 59
4.2.9.3 Hasil uji anova dan duncan disolusi menit ke-12 ... . 60
4.2.9.4 Hasil uji anova dan duncan disolusi menit ke-15 .... 61
4.2.10 Waktu pembasahan ... 63
4.2.11 Rasio absorpsi air ... 64
4.2.12 Waktu hancur di mulut ... 64
BAB V KESIMPULAN DAN SARAN... 66
5.2 Saran ... 66
DAFTAR PUSTAKA ... 67
DAFTAR TABEL
Halaman
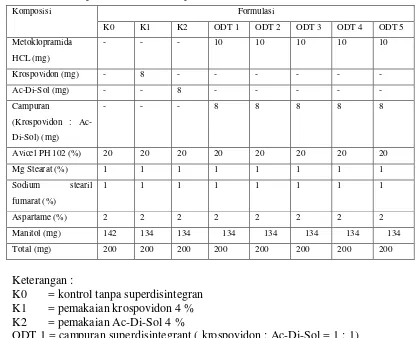
Tabel 3.1Komposisi superdisintegran ODT metoklopramida HCl ... 31
Tabel 3.2 Komposisi ODT Metoklopramida HCl ... 32
Tabel 3.3 Kriteria penerimaan zat aktif yang larut dengan disolusi ... 41
Tabel 4.1 Hasil Uji Preformulasi Granul Metoklopramida HCl ... 44
Tabel 4.2 Hasil Evaluasi ODT Metoklopramida Simulasi ... 46
Tabel 4.3 Hasil uji anova waktu hancur formula ODT ... 49
Tabel 4.4 Hasil uji duncan waktu hancur formula ODT ... 49
Tabel 4.5 Hasil persen kumulatif kuulatif rata-rata uji disolusi ODT Mrtoklopramida HCl... 55
Tabel 4.6 Hasil uji anova disolusi menit ke-1 ... 57
Tabel 4.7 Hasil uji duncan disolusi menit ke-1 ... 58
Tabel 4.8 Hasil uji anova disolusi menit ke-6 ... 59
Tabel 4.9 Hasil uji duncan disolusi menit ke-6 ... 59
Tabel 4.10 Hasil uji anova disolusi menit ke-12 ... 60
Tabel 4.11 Hasil uji duncan disolusi menit ke-12 ... 60
Tabel 4.12 Hasil uji anova disolusi menit ke-15 ... 61
Tabel 4.13 Hasil uji duncan disolusi menit ke-15 ... 62
Tabel 4.14 Hasil uji waktu pembasahan ... 63
Tabel 4.15 Hasil uji Rasio absorpsi air ... 64
DAFTAR GAMBAR
Halaman
Gambar 4.1Diagram waktu hancur ... 47
Gambar 4.2Kurva dan Data Serapan Metoklopramida HCl Baku Pembanding (Hexpharm Jaya Laboratories) Konsentrasi
13 µg/ml dalam Pelarut HCl 0,1 N ... 51
Gambar 4.3 Kurva Kalibrasi Metoklopramida HCl Baku Pembanding (Hexpharm Jaya Laboratories) dalam pelarut HCl 0,1 N
pada Panjang Gelombang 273 nm ... 52
Gambar 4.4Kurva dan Data Serapan Metoklopramida HCl Baku Pembanding (Hexpharm Jaya Laboratories) Konsentrasi
8 µg/ml dalam air suling ... 53
Gambar 4.5 Kurva Kalibrasi Metoklopramida HCl Baku Pembanding (Hexpharm Jaya Laboratories) dalam air suling
pada Panjang Gelombang 272 nm ... 54
Gambar 4.6. Grafik Hasil Persen Kumulatif Rata-Rata Disolusi ODT Metoklopramida HCl dengan Berbagai perbandingan
Krospovidon dan Ac-Di-Sol ... 56
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Perhitungan Pembuatan ODT Metoklopramida HCl ... 69
Lampiran 2. Hasil Penentuan Persamaan Regresi dari Kurva Kalibrasi Metoklopramida (Hexpharm Jaya Laboratories)
pada Panjang Gelombang 273 nm dalam pelarut
HCl 0,1 N ... 70
Lampiran 3. Perhitungan Kadar ODT Metoklopramida HCl ... 72
Lampiran 4. Analisis data statistik untu mencari kadar sebenarnya dari Metoklopramida HCl dalam formula ODT ... 76
Lampiran 5. Data simpangan baku kadar Metoklopramida HCl ... 78
Lampiran 6. Perhitungan Keseragaman Kandungan ODT
Metoklopramida HCL ... 79
Lampiran 7 Data Hasil Keseragaman kandungan
ODT Metoklopramida HCl ... 81
Lampiran 8. Contoh Perhitungan Friabilitas ODT metoklopramida HCl. .. 83
Lampiran 9. Contoh Perhitungan Rasio absorbsi air ODT
metoklopramida HCl. ... 84
Lampiran 10. Hasil Penentuan Persamaan Regresi dari Kurva Kalibrasi Metoklopramida HCl Baku Pembanding (Hexpharm Jaya Laboratories) pada Panjang Gelombang 272 nm
dalam air suling ... 85
Lampiran 11. Contoh Perhitungan Disolusi ODT Metoklopramida HCl ... 87
Lampiran 12. Data disolusi semua formula ODT, Generik, paten ... 88
Lampiran 13. Data % kumulatif disolusi ODT1, ODT2,
ODT3, ODT4 ODT5, generik, paten ... 109
Lampiran 14. Uji anova dan duncan disolusi ODT menit ke 1, 6, 12, 15... 113
Lampiran 15. Uji anova waktu hancur semua formula ODT ... 117
Lampiran 17. Sertifikat analisis Metoklopramida HCl
(Hexpharm Jaya Laboratories) ... 119
Lampiran 18. Daftar Distribusi Nilai t ... 120
Formulation of Orally Disintegrating Tablet (ODTs) Metochlopramide HCL use Physical mixture of Crospovidone and Ac-Di-Sol with Direct
Compression Method.
Abstract
Orally Disintegration Tablets are solid dosage forms containing medicinal substances which disintegrate rapidly without need a water and usually less than 3 minute, when placed on the tongue. ODTs give an advantages for the pediatric and geriatric who have difficulties for swallow conventional tablets. ODTs offer convenience for active patients who are busy, travelling, on vacation and may not have acess to water. The aim of this research was to make a formulation of Orally Disintegrating Tablets Metochlopramide HCl which fulfilled the requirement of Pharmacopoeia.
ODTs was formulated by using physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol in the different ratio (1:1; 1:2; 2:1; 1:3; 3:1) then tablets were prepared by direct compression method. The resulting tablets were evaluated for hardness, friability, disintegration time, content uniformity, wetting time, water absorption ratio, in vitro drug release studies and disintegration time in mouth.
The result show that ODT Metochlopramide HCl which is prepared by direct compression method use physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol fulfilled the requirement for hardness, friability, disintegration time, content uniformity, wetting time, water absorption ratio, in vitro drug release, and disintegration time in mouth. Disintegration time from formula tablets which are formulated without superdiisntegrant need longer time (60.28 second) than tablets which are formulated with a crospovidone (34.33 second) or formulated with Ac-Di-Sol (27.5 second). Whereas the formulation of ODTs which are use physical mixture of superdisintegrant consisting crospovidone and Ac-Di-Sol have disintegration time very fast ( 8-13 second) and better than ODTs which are formulated only use crospovidone or only use Ac-Di-Sol. In vitro drug release of all formulation ODTs shows high drug release in the first minute where the ODT1 release 60.23% metochlopramide HCl, ODT2 release 54.53%, ODT3 release 69.25%, ODT4 release 64.63%, and ODT5 release 72.83%. It so different with generic tablet (Kimia Farma) and Primperan tablet which is only release 18.49% metochlopramide for generic tablet and 14.78% for Primperan tablets. To determinate the presence or absence of significant differences dissolution profiles between all formula ODTs with generic tablets and Primperan tablet performed statistical tests for ANOVA using SPSS program 18.0 (p < 0,05)
Formulasi Oraly Disintegrating Tablet (ODT) Metoklopramida HCl menggunakan Krospovidon dan Ac-Di-Sol dengan metode cetak langsung
Abstrak
Orally Disintegrating Tablet adalah bentuk sediaan padat yang mengandung bahan aktif obat yang hancur atau melarut dengan cepat tanpa memerlukan air dalam waktu kurang dari 3 menit ketika diletakkan di atas lidah.
Orally Disintegrating Tablet (ODT) memberikan keuntungan untuk kelompok pediatri dan geriatri yang mengalami kesulitan dalam menelan tablet konvensional. ODT menawarkan kemudahan bagi pasien yang sedang sibuk, berlibur dan menempuh perjalanan jauh yang kemungkinan besar air minum sulit diperoleh, Tujuan utama dari penelitian ini adalah untuk membuat formulasi
Orally Disintegrating Tablet (ODT) metoklopramida HCL yang memenuhi persyratan Farmakope.
Orally Disintegrating Tablet Metoklopramida HCl dibuat menggunakan campuran superdisintegran Krospovidon dan Ac-Di-Sol dengan perbandingan 1:1 ; 1:2 ; 2:1 ; 1:3 ; 3:1 dengan metode cetak langsung. Tablet yang dihasilkan dievaluasi dengan menggunakan parameter antara lain: kekerasan, friabilitas, waktu hancur, waktu pembasahan (wetting time), rasio absorbsi air, waktu hancur di rongga mulut, penetapan kadar, keseragaman sediaan dan disolusi.
Hasil penelitian menunjukkan bahwa Orally Disintegrating Tablet
Metoklopramida HCl yang dibuat dengan metode cetak langsung menggunakan campuran AcDiSol dan Krospovidon sebagai superdesintegran memenuhi persyaratan penetapan kadar zat berkhasiat, keseragaman kandungan, kekerasan, friabilitas, waktu hancur, uji disolusi, waktu pembasahan ( wetting time), rasio absorbsi air, dan waktu hancur di rongga mulut. Waktu hancur dari formula tablet yang tidak menggunakan superdisintegran lebih lama (60,28 detik) dibandingkan ODT yang menggunakan superdisintegran tunggal (34,33 detik untuk krospovidon dan 27,5 detik untuk Ac-Di-Sol). Sedangkan Formula ODT yang menggunakan campuran superdisintegran memiliki waktu hancur yang sangat cepat (8 detik untuk ODT1, 13 detik untuk ODT2, 13,6 detik untuk ODT3, 13,8 detik untuk ODT4, dan 13 detik untuk ODT5) dan lebih baik dibandingkan dengan ODT yang menggunakan superdisintegran tunggal. Uji pelepasan obat secara in vitro pada semua formula ODT pada menit ke-1 sudah memiliki % kumulatif yang tinggi dimana pada formula ODT1 60,23%; ODT2 54,35%; ODT3 69,25%; ODT4 64,63%; ODT5 72,83%, berbeda jauh dengan tablet generik dan paten yang pada menit ke-1 hanya melepaskan 18,49% untuk generik dan 14,78% pada tablet Primperan (paten). Untuk mengetahui ada atau tidaknya perbedaan bermakna / signifikan profil disolusi dari semua formula ODT dengan tablet Metoklopramida generik dan Primperan maka dilakukan uji ANOVA dengan program SPSS 18.0 (p < 0,05)
BAB I PENDAHULUAN
1.1 Latar Belakang
Salah satu di antara sediaan oral yang banyak digunakan adalah
tablet. Tablet adalah sediaan padat kompak, dibuat secara kempa cetak, dalam
bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung,
mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan. Zat
tambahan yang digunakan dapat berfungsi sebagai zat pengisi, zat pengembang,
zat pengikat, zat pelicin, zat pembasah atau zat lain yang cocok (Ditjen POM.,
1979).
Orally Disintegrating Tablet adalah bentuk sediaan padat yang mengandung bahan aktif obat yang hancur atau melarut dengan cepat dalam
waktu kurang dari 3 menit ketika diletakkan di atas lidah. (MHRA, 2009).
Orally Disintegrating Tablet memberikan keuntungan untuk kelompok
pediatri dan geriatri yang mengalami kesulitan dalam menelan tablet
konvensional. (Bandari, et.al., 2008). ODT juga menawarkan kemudahan bagi pasien yang sedang sibuk, berlibur dan menempuh perjalanan jauh yang
kemungkinan besar sulit memperoleh air minum (Verma dan Garg, 2001). ODT
juga memiliki kelebihan formulasi seperti kemudahan penggunaan obat, tidak ada
resiko sesak nafas (tersedak) akibat obstruksi fisik bentuk solida di tenggorokan
Pada umumnya produk obat mengalami absorbsi sistemik melalui suatu
rangkaian proses. Proses tersebut meliputi (1) disintegrasi produk obat yang
diikuti pelepasan obat; (2) pelarutan obat dalam media “aquaeous”; (3) absorbsi
melewati membran sel menuju sirkulasi sistemik. Untuk obat-obat yang memiliki
kelarutan kecil dlam air, laju pelarutan seringkali merupakan tahap yang paling
lambat, oleh karena itu mengakibatkan terjadinya efek penentu kecepatan
terhadap bioavailabilitas obat. (Shargel, 2005)
Berdasarkan hal tersebut di atas, peneliti mencoba membuat formulasi
tablet dengan menggunakan superdisintegran Ac-Di-Sol dan Krospovidon dengan
maksud untuk mempercepat pecahnya tablet ketika terjadi kontak dengan cairan.
Dimana dengan pecahnya tablet menjadi fragmen-fragmen yang lebih kecil maka
akan meningkatkan luas permukaan tablet yang mempercepat kelarutan bahan
aktif dari tablet.
Adapun dasar pemilihan kedua superdisintegran ini yaitu berdasarkan
mekanismenya, dimana Ac-Di-Sol bekerja dengan cara mengembang sampai 4-8
kali lipat dalam waktu < 10 detik, sedangkan Krospovidon bekerja dengan cara
mengabsorbsi cairan ke dalam pori-pori tablet melalui aksi kapiler yang
memperluas pori-pori dalam tablet (Bhowmik, et.al., 2009). Sebagai pembanding, disini juga dilakukan uji disolusi terhadap tablet metoklopramida HCL generik
1.2 Perumusan Masalah
a. Apakah tablet cepat hancur di mulut (ODT) Metoklopramida HCL yang
dibuat dengan menggunakan campuran superdisintegran Krospovidon dan
Ac-Di-Sol dengan perbandingan tertentu memenuhi persyaratan untuk
British Pharmacopoeia.
b. Apakah ada perbedaan waktu hancur antara ODT yang dibuat dengan
superdisintegran tunggal dibandingkan dengan ODT yang dibuat
menggunakan superdisintegran campuran Krospovidon dan Ac-Di-Sol.
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini
adalah:
a. Formulasi ODT metoklopramida HCL yang dibuat dengan menggunakan
campuran Krospovidon dan Ac-Di-Sol dengan perbandingan tertentu
sebagai superdisintegran memenuhi persyaratan ODT.
b. terdapat perbedaan waktu hancur antara ODT metoklopramida HCL
menggunakan superdisintegran tunggal dengan ODT metoklopramida
HCL yang dibuat dengan superdisintegran campuran Krospovidon dan
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. Membuat formulasi ODT metoklopramida HCL yang memenuhi
persyaratan ODT.
b. Untuk mengetahui perbedaan waktu hancur antara ODT metoklopramida
HCL menggunakan superdisintegran tunggal dengan ODT
metoklopramida HCL yang dibuat dengan superdisintegran campuran
Krospovidon dan Ac-Di-Sol.
1.5 Manfaat Penelitian
Penelitian ini diharapkan memberikan manfaat untuk meningkatkan
BAB II
TINJAUAN PUSTAKA
2.1 Orally Disintegrating Tablets (ODTs) 2.1.1 Pengertian
Rute pemberian obat secara oral adalah rute paling umum dan nyaman
digunakan oleh pasien. Tablet dan kapsul telah muncul sebagai bentuk sediaan
obat solida (padat) yang populer digunakan saat ini, termasuk di dalamnya tablet
konvensional dan pelepasan terkontrol hingga kapsul gelatin keras dan lunak
(hard and soft gelatin capsules) (Sharma, et.al., 2005). Namun di antara keduanya, tablet merupakan bentuk sediaan yang paling disukai dikarenakan
kemudahan penggunaan, kepadatan (compactness) dan flesibilitas produksinya (Rao, et.al., 2009).
Adanya berbagai perubahan fungsi fisiologis terkait usia, termasuk kesulitan
menelan tablet secara utuh, akan menurunkan tingkat kepatuhan dan efektifitas
terapi. Kelompok pasien yang menjadi perhatian atas isu ini terutama adalah
pediatri dan geriatri (Rao, et.al., 2009). Beragam penelitian kemudian dikembangkan untuk mengatasi masalah ini dan tablet hancur di mulut (orally disintegrating tablet) telah ditemukan sebagai satu-satunya bentuk sediaan paling bermanfaat (Koseki, et.al., 2008). Dikenal oleh FDA sebagai orally disintegrating tablets (ODTs), bentuk sediaan ini disebut juga mouth-dissolving, fast-dissolving,
USP, dan ODT adalah singkatan umum untuk suatu tablet yang hancur
(disintegrasi) secara cepat atau serta-merta dalam rongga mulut dan partikel zat
yang ditelan menunjukkan karakteristik pelepasan segera (immediate-release). Sementara itu, Farmakope Eropa (European Pharmacopoeia) mengadopsi istilah
orodispersible tablet sebagai suatu tablet yang diletakkan di mulut yang mana akan terdispersi secara cepat sebelum ditelan (Kundu dan Sahoo, 2008).
Tablet ODT ini dimaksudkan untuk mengalami disintegrasi di mulut ketika
kontak dengan air ludah/saliva dalam waktu kurang dari 60 detik, atau lebih
disukai kurang dari 40 detik (Kundu dan Sahoo, 2008). Zat aktif kemudian akan
melarut atau terdispersi ke dalam air ludah, lalu ditelan oleh pasien dan obat akan
diabsorpsi seperti umumnya (Sharma, et.al., 2005). Untuk proses ini, jumlah air ludah yang sedikit telah cukup untuk memungkinkan terjadinya disintegrasi tablet.
Oleh karena tidak diperlukan air untuk menelan obat, pasien dapat memakan obat
tanpa minum air (Koseki, et.al., 2008). Hal ini tentu akan mempermudah dan meningkatkan kepatuhan pasien pediatri maupun geriatri dalam penggunaan obat.
Selain itu, sejumlah bagian obat juga mungkin diabsorpsi di daerah pra-gastrik
seperti mulut, faring dan esofagus ketika air ludah turun ke lambung (Sharma,
et.al., 2005), sehingga ketersediaan hayati obat akan meningkat dan pada akhirnya juga meningkatkan efektifitas terapi.
2.1.2 Karakteristik Ideal ODT
Oleh karena sediaan ODT berbeda dari tablet konvensional umumnya,
sediaan ODT hendaknya memiliki beberapa karakteristik yang ideal yakni:
a. Disintegrasi yang cepat. Secara umum, hal ini berarti bahwa disintegrasi
akan lebih disukai bila disintegrasi terjadi secepat mungkin di dalam rongga
mulut. ODT harus mengalami disintegrasi dengan sedikit atau tanpa
meminum air sama sekali dan dimaksudkan untuk melarut dengan air ludah
pasien sendiri.
b. Penutupan rasa (taste-masking) dari senyawa aktif. Hal ini dikarenakan obat ODT akan melarut atau mengalami disintegrasi di dalam mulut. Setelah
melarut, sediaan diharapkan tidak atau sedikit meninggalkan residu. Rasa
yang enak di mulut kemudian menjadi persoalan yang kritis. Teknologi
penutupan rasa yang ideal hendaknya mampu menghasilkan mouth-feel yang baik dan tidak memberikan sensasi berpasir (grittiness) di mulut.
c. Kekerasan dan porositas tablet yang optimal. Oleh karena ODT dirancang
memiliki waktu disintegrasi/disolusi yang cepat, dibutuhkan zat tambahan
(excipients) dengan derajat keterbasahan (wettability) yang tinggi dan struktur tablet dengan porositas yang tinggi guna memastikan absorpsi air yang cepat
ke dalam tablet. Kekerasan tablet berbanding terbalik dengan porositasnya,
maka adalah hal penting untuk mendapatkan porositas tablet dengan absorpsi
air yang cepat tanpa mengurangi kekerasan tablet sehingga tidak mudah rusak
selama pengemasan dan pendistribusian dalam blister atau botol tablet
konvensional.
d. Sensitifitas yang rendah terhadap kelembapan. ODT seringkali sensitif
terhadap kelembapan, hal ini dikarenakan zat tambahan dengan kelarutan
dalam air yang tinggi banyak digunakan dalam formulasi ODT, sangat rentan
pengemasan yang baik untuk melindungi tablet dari berbagai pengaruh
lingkungan(Fu, et.al., 2004)
2.1.3 Kelebihan dan Kekurangan Formulasi ODT
ODT memiliki semua kelebihan dari bentuk sediaan solida, antara lain
stabilitas yang baik, ketepatan dosis, kemudahan produksi, ukuran pengemasan
yang kecil dan praktis dibawa bepergian. ODT juga memiliki kelebihan formulasi
cair, seperti kemudahan penggunaan obat, tidak ada resiko sesak nafas (tersendak)
akibat obstruksi fisik bentuk solida di tenggorokan (Fu, et.al., 2004), kecepatan absorpsi dan onset obat yang cepat, serta ketersediaan hayati yang tinggi.
Seperti yang telah disebutkan di atas, zat aktif dapat diabsorpsi baik di
daerah bukal, faring maupun tenggorokan selama larutan obat turun ke lambung.
Karena absorpsi pra-gastrik akan menghindarkan zat aktif dari metabolisme lintas
pertama di hati, maka dosis obat juga dapat dikurangi bila sejumlah besar zat aktif
mengalami metabolisme hepatik selama pemberian tablet konvensional (Fu, et.al., 2004). Oleh karena itu dalam kasus terapi tertentu, ODT memungkinkan
pemberian obat untuk mendapatkan konsentrasi sistemik yang tinggi secara cepat
/ high drug loading (Kundu dan Sahoo, 2008).
ODT menawarkan kemudahan bagi pasien yang mengalami kesulitan
menelan (dysphagia) terutama pasien pediatri dan geriatri serta untuk pasien yang sedang berlibur dan menempuh perjalanan jauh di mana air minum mungkin sulit
diperoleh (Verma dan Garg, 2001).
Di samping berbagai kelebihan ODT seperti yang telah disebutkan di atas,
banyak sediaan ODT memiliki kekurangan dalam hal keterbatasan jumlah obat
diformulasi dengan teknik pengeringan beku atau liofilisasi (freeze drying atau
lyophilisation), formulasi dosis obat secara umum harus kurang dari 400 mg untuk senyawa obat yang tak larut dan kurang dari 60 mg untuk senyawa obat yang larut
air. Selain itu, terkait sifat bentuk sediaan ODT yang rapuh (fragile), diperlukan pengemasan khusus yang mana tentu akan menambah biaya produksi (Ghost,
et.al., 2005).
Metode cetak langsung dapat digunakan untuk membuat sediaan ODT
dengan cara memilih kombinasi bahan tambahan yang tepat, yang mana dapat
menghasilkan disintegrasi cepat dan daya tahan fisik yang baik. Bahan tambahan
yang dimaksudkan di sini adalah bahan penghancur (disintegrant). Beberapa peneliti menggunakan bahan effervescent sebagai disintegrant, sementara yang lain mengkombinasi berbagai disintegrant yang ada (Fu, et.al., 2004).
2.2 Komposisi tablet
Tablet oral umumnya di samping zat aktif mengandung, pengisi, pengikat,
penghancur, dan pelincir. Tablet tertentu mungkin memerlukan pemacu aliran, zat
warna, zat perasa, dan pemanis (Lachman, dkk, 1994).
Komposisi umum dari tablet adalah zat berkhasiat, bahan pengisi, bahan
pengikat atau perekat, bahan pengembang dan bahan pelicin. Kadang-kadang
dapat ditambahkan bahan pewangi (flavoring agent), bahan pewarna (coloring agent) dan bahan-bahan lainnya (Ansel, 1989).
a. Pengisi
Digunakan agar tablet memiliki ukuran dan massa yang dibutuhkan.
dengan baik (Voigt, 1995). Bahan-bahan pengisi yaitu : laktosa, sukrosa, manitol,
sorbitol, amilum, bolus alba, kalsium sulfat, natrium sulfat, natrium klorida,
magnesium karbonat (Soekemi, dkk, 1987).
b. Pengikat
Untuk memberikan kekompakan dan daya tahan tablet, juga untuk
menjamin penyatuan beberapa partikel serbuk dalam butir granulat (Voigt, 1995).
Pengikat yang umum digunakan yaitu: amilum, gelatin, glukosa, gom arab,
natrium alginat, cmc, polivinilpirolidon, dan veegum (Soekemi, dkk, 1987).
c. Penghancur
Untuk memudahkan pecahnya tablet ketika berkontak dengan cairan
saluran pencernaan dan mempermudah absorpsi (Lachman, dkk, 1994). Bahan
yang digunakan sebagai pengembang yaitu: amilum, gom, derivat selulosa,
alginat, dan clays (Soekemi, dkk, 1987).
d. Pelicin
Ditambahkan untuk meningkatkan daya alir granul-granul pada corong
pengisi, mencegah melekatnya massa pada punch dan die, mengurangi pergesekan antara butir-butir granul, dan mempermudah pengeluaran tablet dari die. Bahan pelicin yaitu : metalik stearat, talk, asam stearat, senyawa lilin dengan titik lebur
tinggi, amilum maydis (Soekemi, dkk, 1987).
2.3 Uji preformulasi
Sebelum dicetak menjadi tablet, massa granul perlu diperiksa apakah
memenuhi syarat untuk dapat dicetak. Preformulasi ini menggambarkan sifat
Pengujian waktu alir dilakukan dengan mengalirkan massa granul melalui
corong. Waktu yang diperlukan tidak lebih dari 10 detik, jika tidak maka akan
dijumpai kesulitan dalam hal keseragaman bobot tablet. Hal ini dapat diatasi
dengan penambahan bahan pelicin (Cartensen, 1977).
Pengukuran sudut diam digunakan metode corong tegak, granul dibiarkan
mengalir bebas dari corong ke atas dasar. Serbuk akan membentuk kerucut,
kemudian sudut kemiringannya diukur. Semakin datar kerucut yang dihasilkan,
semakin kecil sudut diam, semakin baik aliran granul tersebut (Voigt, 1995).
Indeks tap adalah uji yang mengamati penurunan volume sejumlah serbuk
atau granul akibat adanya gaya hentakan. Indeks tap dilakukan dengan alat
volumenometer yang terdiri dari gelas ukur yang dapat bergerak secara teratur
keatas dan kebawah. Serbuk atau granul yang baik mempunyai indeks tap kurang
dari 20% (Cartensen, 1977).
2.4 Evaluasi tablet
a. Kekerasan tablet
Ketahanan tablet terhadap goncangan saat pengangkutan, pengemasan dan
peredaran bergantung pada kekerasan tablet. Kekerasan yang lebih tinggi
menghasilkan tablet yang bagus, tidak rapuh tetapi ini mengakibatkan
berkurangnya porositas dari tablet sehingga sukar dimasuki cairan yang
mengakibatkan lamanya waktu hancur. Kekerasan dinyatakan dalam kg tenaga
yang dibutuhkan untuk memecahkan tablet. Kekerasan untuk tablet secara umum
yaitu 4-8 kg, tablet hisap 10-20 kg, tablet kunyah 3 kg (Soekemi, dkk, 1987).
saat pencetakan tablet dan tekanan kompressi. Selain itu, berbedanya nilai
kekerasan juga dapat diakibatkan oleh variasi jenis dan jumlah bahan tambahan
yang digunakan pada formulasi. Bahan pengikat adalah contoh bahan tambahan
yang bisa menyebabkan meningkatnya kekerasan tablet bila digunakan terlalu
pekat (Lachman, dkk, 1994).
b. Friabilitas
Tablet mengalami capping atau hancur akibat adanya goncangan dan
gesekan, selain itu juga dapat menimbulkan variasi pada berat dan keseragaman
isi tablet. Pengujian dilakukan pada kecepatan 25 rpm, menjatuhkan tablet sejauh
6 inci pada setiap putaran, dijalankan sebanyak 100 putaran. Kehilangan berat
yang dibenarkan yaitu lebih kecil dari 0,5 sampai 1% (Lachman, dkk, 1994).
Kerenyahan tablet dapat dipengaruhi oleh kandungan air dari granul dan produk
akhir. Granul yang sangat kering dan hanya mengandung sedikit sekali persentase
kelembapan, sering sekali menghasilkan tablet yang renyah daripada granul yang
kadar kelembapannya 2 sampai 4% (Lachman, dkk, 1994).
2.5 Metoclopramidi Hydrochloridum 2.5.1 Tinjauan umum
Nama kimi : 4-Amino-5-kloro-N-[2-(dietilamino)etil-o-anisamida monohidroklorida, monohidrat [54143-57-6]
Berat molekul : 354,28
Pemerian : Serbuk hablur, putih atau praktis putih; tidak berbau atau praktis
tidak berbau.
Kelarutan : Sangat mudah larut dalam air; mudah larut dalam etanol; agak
sukar larut dalam klorofom; praktis tidak larut dalam eter.
(Ditjen POM, 1995).
2.5.2 Farmakologi
Metoklopramida HCL berkhasiat enti-emetis kuat berdasarkan
pertama-tama blokade reseptor dopamin di CTZ. Di samping itu, zat ini juga memperkuat
pergerakan dan pengosongan lambung. Efektif pada semua jenis muntah,
termasuk akibat kemoterapi dan migrain; pada mabuk darat obat ini tidak ampuh.
Resorpsinya dari usus cepat, mulai kerjanya dalam 20 menit. (Tjay, 2007).
2.5.3 Efek samping dan interaksi obat.
Efek samping yang terpenting adalah sedasi dan gelisah. Efek samping
lainnya berupa gangguan lambung-usus serta gangguan ekstrapiramidal, terutama
pada anak kecil. Interaksi obat, obat-obat seperti digoksin yang terutama diserap
di lambung, dikurangi resorpsinya bila diberikan bersamaan dengan
metoklopramida. (Tjay, 2007).
2.6 Uraian Tentang Ac-Di-Sol
praktis tidak larut dalam aseton, etanol, dan toluena, suspensi 1% dalam air
memiliki pH 5,0 – 7,0.
Ac-Di-Sol digunakan sebagai zat pengemulsi, pengembang, pengikat, dan
zat pelapis pada tablet. Ac-Di-Sol juga digunakan sebagai zat pengemulsi atau
stabilisator dalam industri makanan, namun penggunaan yang paling utama yaitu
sebagai pengembang (disintegran) pada tablet, kapsul, dan serbuk pada formulasi
sediaan oral.
Dalam formulasi sediaan tablet, Ac-Di-Sol dapat digunakan baik dalam
proses cetak langsung maupun granulasi basah. Ketika digunakan dalam proses
granulasi basah, Ac-Di-Sol sebaiknya ditambahkan baik pada saat proses granul
basah dan kering (intra dan ekstragranular), sehingga akan dihasilkan kemampuan
pengembangan yang terbaik. Konsentrasi Ac-Di-Sol yang digunakan sebagai
pengembang pada tablet bisa sampai 5%, walaupun biasanya hanya 2% untuk
proses cetak langsung, dan 3% untuk proses granulasi basah (Rowe, et al., 2006).
2.7 Uraian Tentang Krospovidon
Krospovidon mempunyai nama kimia 1-Ethenyl-2-pyrrolidinone. Serbuk putih
sampai putih kekuningan, mengalir bebas, praktis tidak berasa, tidak berbau atau
hampir tidak berbau, bersifat higroskopis, praktis tidak larut dalam air dan dalam
sebagian besar pelarut organik.
Krospovidon merupakan bahan pengembang dalam tablet yang tidak larut
dalam air, yang biasanya digunakan dengan konsentrasi 2% - 5% pada tablet yang
dibuat dengan metode cetak langsung ataupun granulasi basah dan ggranulasi
kering. Krospovidon memiliki aktivitas kapiler yang tinggi dan cepat. Studi
disintegrasi dari tablet. Partikel yang lebih besar semakin meningkatkan kecepatan
disintegrasi dibandingkan dengan partikel yang lebih kecil. Krospovidon juga
dapat digunakan sebagai peningkat kelarutan. Dengan teknik co-evaporasi,
Krospovidon dapat digunakan sebagai peningkat kelarutan bagi bahan obat yang
sangat sukar larut. Bahan obat diabsorbsi oleh Krospovidon dalam pelarut yang
sesuai dan kemudian pelarut dievaporasi. Teknik ini menunjukkan hasil laju
disolusi yang lebih cepat (Rowe, et al., 2006).
2.8 Spektrofotometri Ultraviolet
Spektrofotometri ultraviolet digunakan untuk analisa kualitatif ataupun
kuantitatif suatu senyawa. Absorpsi cahaya ultraviolet maupun cahaya tampak
mengakibatkan transisi elektron, yaitu perubahan elektron-elektron dari orbital
dasar berenergi rendah ke orbital keadaan tereksitasi berenergi lebih tinggi.
Penyerapan radiasi ultraviolet atau sinar tampak tergantung pada mudahnya
transisi elektron. Molekul-molekul yang memerlukan lebih banyak energi untuk
transisi elektron, akan menyerap pada panjang gelombang yang lebih pendek.
Molekul-molekul yang memerlukan energi lebih sedikit akan menyerap panjang
gelombang lebih panjang.
BAB III
METODE PENELITIAN
Penelitian ini menggunaan metode eksperimental yang meliputi formulasi
Orally Disintegrating Tablet (ODT) metoklopramida HCl dan evaluasi sediaan.
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah mesin pencetak tablet
single punch (Ateliers), Disintegration Tester (Copley), Dissolution Tester
(Veego), Strong Cobb Hardness Tester (Erweka), Roche Friabilator (Erweka),
Spektrofotometer UV-Visible (UV Mini 1240 Shimadzu), Stopwatch, Neraca
listrik (Boeco), alat-alat gelas dan alat laboratorium lainnya.
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah HCl(p) (E.
Merck), Metoklopramida HCl (Hexpharm Jaya Laboratories), Krospovidon,
3.3 Prosedur Kerja
3.3.1 Pembuatan Orally Disintegrating Tablet metoklopramida HCl Formula ODT metoklopramida HCl
R/ Metoklopramida HCl 10 mg
Superdisintegran 4 % Mg Stearat 1 % Sodium stearil fumarat 1 % Avicel PH 102 20 %
Aspartam 2 % Manitol ad 200 mg
Dimana superdisintegran yang digunakan dalam formulasi ini adalah
campuran Krospovidon dengan Ac-Di-Sol dengan perbandingan tertentu.
Perbandingan Krospovidon dengan Ac-Di-Sol yang dicampur berbeda-beda tiap
formula yaitu 1:1 ; 1:2 ; 2:1 ; 1:3 ; 3:1. Adapun formula yang digunakan adalah
sebagai berikut :
Tabel 3.1 Komposisi superdisintegran Orally Disintegrating Tablet
metoklopramida HCl
Perbandingan crospovidone Ac-Di-Sol
1 : 1 0,5 g 0,5 g
1 : 2 0,5 g 0,5 g
2 : 1 1 g 0,5 g
1 : 3 0,5 g 1,5 g
Tabel 3.2 Komposisi ODT metoklopramida HCl
Keterangan :
K0 = kontrol tanpa superdisintegran K1 = pemakaian krospovidon 4 % K2 = pemakaian Ac-Di-Sol 4 %
ODT 1 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 1) ODT 2 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 2) ODT 3 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 2 : 1) ODT 4 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 3) ODT 5 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 3 : 1)
Cara pembuatan :
Ditimbang krosovidon dengan Ac-Di-Sol dengan perbandingan tertentu sesuai
dengan tabel 2.2 diatas, kemudian di masukkan ke dalam botol kaca lalu
dicampur, kemudian diambil 0,8 g sebagai campuran fisika superdisintegran
untuk dicampur dalam pembuatan ODT.
• Magnesium stearat dan sodium staeril fumarat dimasukkan ke dalam botol
kaca kemudian ditambahkan dengan metoklopramida HCL dan campuran
superdisintegran serta Avicel PH 102, campur bahan, kemudian
Komposisi Formulasi
K0 K1 K2 ODT 1 ODT 2 ODT 3 ODT 4 ODT 5
Metoklopramida HCL (mg)
- - - 10 10 10 10 10
Krospovidon (mg) - 8 - - - -
Ac-Di-Sol (mg) - - 8 - - - - - Campuran
(Krospovidon : Ac-Di-Sol) (mg)
- - - 8 8 8 8 8
Avicel PH 102 (%) 20 20 20 20 20 20 20 20
Mg Stearat (%) 1 1 1 1 1 1 1 1
Sodium stearil fumarat (%)
1 1 1 1 1 1 1 1
Aspartame (%) 2 2 2 2 2 2 2 2
Manitol (mg) 142 134 134 134 134 134 134 134
tambahkan sebagian manitol dan aspartam lalu campurkan, ditambahkan
sisa manitol kemudian campurkan. Lakukan uji preformulasi yang
meliputi sudut diam, waktu alir, dan indeks tap. Kemudia massa dicetak
menjadi tablet.
3.3.2 Uji preformulasi
Uji preformulasi dilakukan terhadap granul metoklopramida HCl yang
meliputi sudut diam, waktu alir, dan indeks tap.
3.3.2.1 Sudut diam
Penetapan sudut diam dilakukan dengan menggunakan corong. Seratus
gram granul dimasukkan ke dalam corong, permukaannya diratakan, lalu penutup
bawah corong dibuka dan dibiarkan granul mengalir melalui corong dan
ditentukan besar sudut diamnya dengan rumus :
tg θ = 2h/D
Keterangan : θ = sudut diam
h = tinggi kerucut (cm) D = diameter (cm)
Syarat: 20° < θ < 40° (Cartensen, 1977)
3.3.2.2 Waktu alir
Penetapan laju alir dilakukan dengan menggunakan corong. Seratus gram
granul dimasukkan ke dalam corong yang telah dirangkai, permukaannya
diratakan. Penutup bawah corong dibuka dan secara serentak stopwatch
dihidupkan. Stopwatch dihentikan jika seluruh granul telah habis melewati corong
dan dicatat waktu alirnya.
3.3.2.3 Indeks tap
Granul dimasukkan ke dalam gelas ukur 50 ml dan diukur volume
awalnya (V1) lalu dihentakkan sehingga diperoleh volume akhirnya (V2) yang
konstan. Indeks tap dihitung dengan rumus :
I =
1 1 2
V V V −
x 100%
Keterangan : V1 = volume sebelum hentakan
V2 = volume setelah hentakan
Syarat : I ≤ 20% (Cartensen, 1977)
3.3.3 Pembuatan pereaksi 3.3.3.1 Pembuatan HCl 0,1 N
Diencerkan 8,5 ml asam klorida pekat dengan air suling sampai 1000 ml (Ditjen POM, 1995).
3.3.4 Penentuan kurva serapan dan linieritas kurva kalibrasi metoklopramid HCl dalam larutan HCl 0,1 N
3.3.4.1 Pembuatan larutan induk baku I
Ditimbang Metoklopramida HCl baku sebanyak 50 mg, dimasukkan
kedalam labu 100 ml. Ditambahkan larutan asam klorida 0,1 N, dikocok sampai
larut dan ditambahkan lagi larutan asam klorida 0,1 N sampai garis tanda.
Konsentrasi teoritis 500 µg/ml (larutan induk baku pertama).
3.3.4.2 Pembuatan larutan induk baku II
Dipipet 10 ml Larutan Induk I dimasukkan kedalam labu 50 ml,
ditambahkan larutan asam klorida 0,1 N, dikocok sampai larut dan ditambahkan
lagi larutan asam klorida 0,1 N sampai garis tanda. Konsentrasi teoritis 100 µg/ml
3.3.4.3 Penentuan kurva serapan metoklopramida HCl.
Dipipet larutan baku induk kedua sebanyak 6,5 ml, dimasukkan kedalam
labu 50 ml, ditambahkan larutan asam klorida 0,1 N, dikocok sampai larut dan
ditambahkan lagi larutan asam klorida 0,1 N sampai garis tanda (konsentrasi
teoritis 13 µg/ml), kemudian diukur serapannya pada panjang gelombang 200 nm
sampai 400 nm.
3.3.4.4 Penentuan linieritas kurva kalibrasi metoklopramida HCL dalam larutan HCl 0,1 N
Dipipet larutan induk baku kedua sebanyak 3,5 ml, 5 ml, 6,5 ml, 8 ml dan
9,5 ml; masing-masing dimasukkan ke dalam labu tentukur 50 ml lalu diencerkan
dengan larutan HCl 0,1 N hingga garis tanda. Konsentrasi yang diperoleh
berturut-turut adalah 7 µg/ml, 10 µg/ml, 13 µg/ml, 16 µg/ml dan 19 µg/ml.
Masing-masing larutan kemudian diukur serapannya menggunakan
spektrofotometer UV pada panjang gelombang maksimum. Kurva kalibrasi antara
jumlah serapan dengan konsentrasi dibuat dari data yang diperoleh, lalu dihitung
persamaan regresi dan koefisien korelasinya.
3.3.5 Penentuan kurva serapan dan linieritas kurva kalibrasi metoklopramid HCl dalam air suling.
3.3.5.1 Pembuatan larutan induk baku I
Ditimbang Metoklopramida HCl baku sebanyak 50 mg, dimasukkan
kedalam labu 100 ml. Ditambahkan larutan asam klorida 0,1 N, dikocok sampai
larut dan ditambahkan lagi larutan asam klorida 0,1 N sampai garis tanda.
3.3.5.2 Pembuatan larutan induk baku II
Dipipet 10 ml Larutan Induk I dimasukkan kedalam labu 50 ml,
tambahkan larutan asam klorida 0,1 N, dikocok sampai larut dan ditambahkan lagi
larutan asam klorida 0,1 N sampai garis tanda. Konsentrasi teoritis 100 µg/ml
(larutan induk baku kedua).
3.3.5.3 Penentuan kurva serapan metoklopramida HCl.
Dipipet larutan induk baku kedua sebanyak 4 ml, dimasukkan kedalam
labu 50 ml, ditambahkan larutan asam klorida 0,1 N, dikocok sampai larut dan
ditambahkan lagi larutan asam klorida 0,1 N sampai garis tanda (konsentrasi
teoritis 8 µg/ml), kemudian diukur serapannya pada panjang gelombang 200 nm
sampai 400 nm.
3.3.5.4 Penentuan linieritas kurva kalibrasi metoklopramida HCL dalam air suling.
Dipipet larutan baku induk kedua sebanyak 1,8 ml, 3 ml, 4 ml, 5,3 ml dan
6,5 ml; masing-masing dimasukkan ke dalam labu tentukur 50 ml lalu diencerkan
dengan larutan HCl 0,1 N hingga garis tanda. Konsentrasi yang diperoleh
berturut-turut adalah 3,6 µg/ml, 6 µg/ml, 8 µg/ml, 10,6 µg/ml dan 13 µg/ml.
Masing-masing larutan kemudian diukur serapannya menggunakan
spektrofotometer UV pada panjang gelombang maksimum. Kurva kalibrasi antara
jumlah serapan dengan konsentrasi dibuat dari data yang diperoleh, lalu dihitung
3.4 Evaluasi Tablet
3.4.1 Penetapan kadar metoklopramid HCl dalam tablet
Sebanyak 20 tablet ODT ditimbang seksama lalu diserbukkan. Selanjutnya ditimbang sejumlah serbuk setara dengan 10 mg metoklopramida. Serbuk ini lalu
dimasukkan ke dalam labu tentukur 100 ml, ditambahkan larutan asam klorida 0,1
N sampai garis tanda. Larutan disaring dengan membuang beberapa tetes pertama
filtrat. Dipipet 6,5 ml filtrat dimasukkan ke dalam labu tentukur 50 ml lalu
diencerkan dengan larutan HCl 0,1 N hingga garis tanda. Larutan ini lalu diukur
serapannya dengan menggunakan spektrofotometer UV pada panjang gelombang
analisis.
3.4.2 Uji kekerasan tablet
Alat : Strong Cobb Hardness Tester (Erweka)
Cara :
Sebuah tablet diletakkan tegak lurus di antara anvil dan punch, tablet
dijepit dengan memutar skrup pengatur hingga tanda lampu “stop” menyala, knop
ditekan dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet
pecah. Percobaan ini dilakukan untuk 5 tablet.
Ketentuan umum : Kekerasan tablet 4 – 8 kg (Parrot, 1970).
3.4.3 Uji friabilitas
Alat : Roche Friabilator (Erweka)
Cara :
Ditimbang 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
4 menit (100 kali putaran). Setelah batas waktu yang ditentukan tablet
dikeluarkan dan dibersihkan dari debu, lalu ditimbang beratnya (b gram).
Friabilitas (F) = (a – b) / a x 100 %
Ketentuan umum : Kehilangan berat ≤ 0,8 % (Voight, 1994).
3.4.4 Uji waktu hancur
Alat : Disintegration Tester (Copley)
Cara :
Pengujian dilakukan terhadap 6 tablet. Dmasukkan 1 tablet pada masing –
masing tabung dari keranjang, kemudian alat dijalankan. Digunakan air dengan
suhu 37˚ ± 2˚ C sebagai media. Pada akhir batas waktu seperti yang tertera pada
monografi, angkat keranjang dan amati keenam tablet. Semua tablet harus hancur
sempurna. Bila 1 atau 2 tablet tidak hancur sempurna ulangi pengujian dengan 12
tablet lainnya, tidak kurang dari 16 tablet dari 18 tablet yang diuji harus hancur
sempurna.
Persyaratan : Waktu yang diperlukan untuk menghancurkan tablet tidak lebih dari 1 menit ( Manivannan, 2009).
3.4.5 Uji keseragaman sediaan
Tablet yang dibuat yaitu tablet metoklopramida HCl dengan berat satu
tablet 200 mg dan mengandung metoklopramida HCl 10 mg, berarti 50% jumlah
zat berkhasiat kurang dari 50 mg, karena itu penetapan keseragaman sediaan
dilakukan dengan menetapkan keseragaman kandungan (Ditjen POM, 1995), yang
dilakukan sebagai berikut:
Satu tablet digerus lalu dimasukkan ke dalam labu tentukur 100 ml dan
disaring dengan membuang beberapa tetes pertama filtrat. Dipipet 6,5 ml filtrat,
lalu dimasukkan ke dalam labu tentukur 50 ml dan encerkan dengan larutan HCl
0,1 N sampai garis tanda. Larutan ini lalu diukur serapannya dengan
menggunakan spektrofotometer UV pada panjang gelombang analisis. Uji ini
dilakukan terhadap 10 tablet.
Tablet memenuhi persyaratan dalam keragaman kandungan jika kadarnya
terletak antara 85% hingga 115% dari yang tertera pada etiket dan simpangan
baku relatif kurang dari atau sama dengan 6,0%. Jika tidak memenuhi syarat maka
dilakukan uji 20 satuan tambahan, dan persyaratan di penuhi jika tidak lebih dari 1
satuan dari 30 terletak di luar rentang 85% hingga 115% dari yang tertera pada
etiket dan tidak ada satuan yang tertera pada etiket dan tidak ada satuan yang
terletak di luar rentang 80,0% hingga 120,0% dari yang tertera pada etiket dan
simpangan baku relatif dari 30 satuan sediaan tidak lebih dari 7,8% (Ditjen POM,
1995).
3.4.6 Penetapan kadar Metoklopramida HCl dalam ODT
Sebanyak 20 tablet ODT ditimbang seksama lalu diserbukkan. Selanjutnya ditimbang sejumlah serbuk setara dengan 10 mg metoklopramida. Serbuk ini lalu
dimasukkan ke dalam labu tentukur 100 ml, ditambahkan larutan asam klorida 0,1
N sampai garis tanda. Larutan disaring dengan membuang beberapa tetes pertama
filtrat. Dipipet 6,5 ml filtrat dimasukkan ke dalam labu tentukur 50 ml lalu
diencerkan dengan larutan HCl 0,1 N hingga garis tanda. Larutan ini lalu diukur
serapannya dengan menggunakan spektrofotometer UV pada panjang gelombang
Tablet memenuhi persyaratan dalam keragaman kandungan jika kadarnya
terletak antara 90 % hingga 110 % dari yang tertera pada etiket (Ditjen POM,
1995).
3.4.7 Uji disolusi tablet
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester.
Medium : 900 ml air suling
Alat : tipe 2 (metode dayung)
Kecepatan putara : 50 rpm
Waktu : 30 menit
Cara :
Satu tablet dimasukkan ke dalam wadah disolusi yang telah berisi 900 ml
medium disolusi yang bersuhu 37˚ ± 0,5˚ C. Kemudian dayung diputar dengan
kecepatan 50 rpm. Pada interval waktu 1, 3, 6, 9, 12, 15, 18, 21, 24, 27 dan 30
menit larutan dipipet sebanyak 10 ml cuplikan. Pengambilan cupilkan dilakukan
pada posisi yang sama yaitu pertengahan antara permukaan medium disolusi dan
bagian atas dari dayung tidak kurang 1 cm dari dinding wadah (Ditjen POM,
1995). Larutan cuplikan ini lalu diukur serapannya dengan menggunakan
spektrofotometer UV pada panjang gelombang 272 nm. Selanjutnya diperoleh
persen kumulatif pelepasan obat. Dilakukan uji disolusi terhadap ODT dan tablet
metoklopramida generik dan paten.
Interpretasi : Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Apabila tidak memenuhi persyaratan
maka pengujian dilanjutkan sampai tiga tahap, kecuali bila hasil pengujian
memenuhi tahap S1 atau S2.
Tabel 3.3 Kriteria penerimaan zat aktif yang larut dengan disolusi Tahap Jumlah
yang diuji
Kriteria Penerimaan
S1 6 Rata-rata sediaan tidak kurang dari Q + 10%
S2 6 Rata – rata dari 12 unit (S1 + S2) adalah sama dengan atau
lebih besar dari Q + 5%
S3 12 Rata – rata dari 24 unit (S1 + S2 + S3) adalah sama dengan
atau lebih besar dari Q.
(Interim Revision Announcement, 2007)
3.4.8 Uji waktu pembasahan (weeting time)
Kertas saring yang berbentuk lingkaran diletakkan di kedalam cawan petri
berdiameter 9 cm yang telah berisi 9 ml larutan warna ponceau 0,1 % b/v dalam
air suling. Satu tablet diletakkan perlahan-lahan dibagian tengah cawan petri
tersebut, kemudian dicatat waktu pembasahan sempurna dari tablet. Waktu
pembasahan (wetting time) adalah waktu yang dibutuhkan untuk membuat permukaan atas dari tablet menyerap warna (Bhowmik, et.al., 2009).
3.4.9 Uji Rasio absorbsi air
Kertas saring yang berbentuk lingkaran diletakkan di kedalam cawan petri
berdiameter 9 cm yang telah berisi 9 ml larutan warna ponceau 0,1 % b/v dalam
tersebut, kemudian dicatat waktu pembasahan sempurna dari tablet, kemudian
ditimbang berat tablet sebelum dan sesudah terbasahi. Rasio absorbsi air dihitung
dengan rumus R = 100 x (wa-wb)/ wb dimana wb adalah berat tablet sebelum
menyerap air dan wa adalah berat tablet setelah menyerap air (Bhowmik, et.al., 2009).
3.4.10 Uji waktu hancur di mulut
Uji ini menggunakan 5 sukarelawan untuk 5 kode formula ODT . Sebelum
memulai uji, setiap sukarelawan diharuskan mencuci mulut terlebih dahulu, lalu
diletakkan satu tablet ODT di atas lidah mereka dan dibiarkan tablet hingga
hancur sempurna. Waktu yang dibutuhkan agar tablet hancur tanpa mengunyah
dihitung, setelah itu tablet segera diludahkan. Titik akhir untuk waktu hancur
dimulut adalah waktu dimana tablet yang diletakkan di lidah menjadi hancur
(tablet tidak utuh lagi).
3.5 Analisis Data Secara Statistik
Menurut Gandjar (2007), kadar zat aktif sebenarnya yang terkandung
dalam sampel dapat diketahui menggunakan uji distribusi t. Data diterima atau
ditolak dihitung dengan menggunakan metode standar deviasi dengan rumus:
1
2
− −
=
∑
n X X
SD i
Keterangan: Xi = nilai dari masing-masing pengukuran
Untuk mencari thitung digunakan rumus: t hitung =
n SD
X X −
Menurut Wibisono (2005), sebagai dasar penolakan data hasil uji analisis adalah t
hitung ≥ t tabel atau t hitung ≤ - t tabel. Untuk menentukan kadar zat aktif dalam sampel dengan taraf kepercayaan 99%, α= 0,01, dk= n-1, dapat digunakan rumus:
Kadar sebenarnya: µ = X ± t (α/2,dk) x (SD/ n)
Keterangan:
X = Interval kepercayaan kadar sampel
X = Kadar rata-rata sampel SD = Standar Deviasi
dk = derajat kebebasan (dk = n-1)
α = taraf kepercayaan dan n = jumlah perlakuan
3.5.1 Uji statistik terhadap evaluasi waktu hancur
Evaluasi dari ODT dan sediaan tablet metoklopramida HCl dibandingkan
secara in vitro. Data dibandingkan menggunakan uji anova dengan signifikansi
(p < 0,05). Analisis statistik dilakukan menggunakan program SPSS 18.0.
3.5.2 Uji statistik terhadap profil pelepasan obat.
Profil pelepasan obat dari ODT dan sediaan tablet metoklopramida
dibandingkan secara in vitro. Data dibandingkan menggunakan uji anova dengan signifikansi (p < 0,05). Analisis statistik dilakukan menggunakan program SPSS
BAB IV
HASIL DAN PEMBAHASAN
4.1 Uji Preformulasi Granul Metoklopramida HCl
Uji preformulasi yang dilakukan meliputi sudut diam, waktu alir, dan
indeks tap. Dari hasil uji yang dilakukan dapat diketahui sifat massa yang akan
dicetak menjadi tablet.
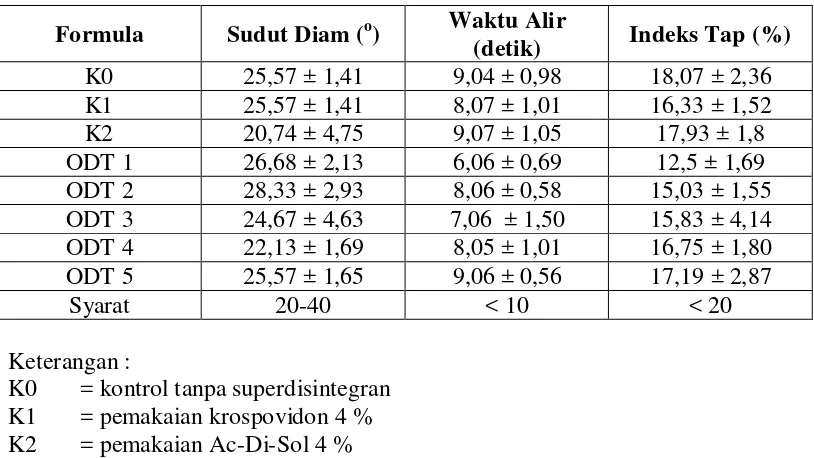
Tabel 4.1 Hasil uji preformulasi granul metoklopramida HCl
Formula Sudut Diam (o) Waktu Alir
(detik) Indeks Tap (%)
K0 25,57 ± 1,41 9,04 ± 0,98 18,07 ± 2,36
K1 25,57 ± 1,41 8,07 ± 1,01 16,33 ± 1,52
K2 20,74 ± 4,75 9,07 ± 1,05 17,93 ± 1,8
ODT 1 26,68 ± 2,13 6,06 ± 0,69 12,5 ± 1,69
ODT 2 28,33 ± 2,93 8,06 ± 0,58 15,03 ± 1,55
ODT 3 24,67 ± 4,63 7,06 ± 1,50 15,83 ± 4,14
ODT 4 22,13 ± 1,69 8,05 ± 1,01 16,75 ± 1,80
ODT 5 25,57 ± 1,65 9,06 ± 0,56 17,19 ± 2,87
Syarat 20-40 < 10 < 20
Keterangan :
K0 = kontrol tanpa superdisintegran K1 = pemakaian krospovidon 4 % K2 = pemakaian Ac-Di-Sol 4 %
ODT 1 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 1) ODT 2 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 2) ODT 3 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 2 : 1) ODT 4 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 3) ODT 5 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 3 : 1)
4.1.1 Uji waktu alir
Dari tabel di atas dapat diketahui bahwa semua formula menunjukkan
hasil uji preformulasi waktu alir yang masih berada dalam batas persyaratan uji
waktu alir, yaitu formula K0 sebagai kontrol sebesar 9,04 detik, K1 sebesar 8,07
ODT 3 sebesar 7,06 detik, ODT 4 sebesar 8,05 detik, ODT 5 sebesar 9,06 detik.
Hal ini sesuai dengan persyaratan uji preformulasi waktu alir, yaitu waktu yang
diperlukan tidak lebih dari 10 detik. Menurut Cartensen (1977), waktu yang
diperlukan dalam uji waktu alir tidak lebih dari 10 detik, karena jika tidak akan
dijumpai kesulitan pada keseragaman bobot tablet. Hal ini dapat diatasi dengan
penambahan bahan pelicin.
4.1.2 Uji sudut diam
Dari tabel 3 di atas juga dapat dilihat hasil uji preformulasi sudut diam dari
semua formula yaitu K0 sebesar 25,59˚, K1 sebesar 25,57˚, K2 sebesar 20,74˚,
ODT 1 sebesar 26,68˚, ODT 2 sebesar 28,23˚, ODT 3 sebesar 24,67˚, ODT 4
sebesar 22,13˚, ODT 5 sebesar 25,57˚. Hasil uji preformulasi sudut diam ini
menunjukkan hasil yang beragam dari semua formula, namun semuanya masih
berada dalam batas persyaratan uji preformulasi sudut diam.
4.1.3 Uji indeks tap
Tabel 3 diatas juga menunjukkan besarnya hasil uji preformulasi indeks
tap dari masing-masing formula. K0 memiliki indeks tap sebesar 18,07%; K1
memiliki indeks tap sebesar 16,33%; K2 sebesar 17,93%; ODT 1 sebesar 12,5%;
ODT 2 sebesar 15,03%; ODT 3 sebesar 15,83%; ODT 4 sebesar 16,75%; ODT 5
sebesar 17,19%. %. Hasil uji preformulasi indeks tap ini menunjukkan hasil yang
beragam dari tiap – tiap formula, namun semuanya masih berada dalam batas
persyaratan uji preformulasi indeks tap. Menurut Guyot (1978), granul yang
bersifat mengalir bebas adalah partikel yang memiliki indeks tap ≤ 20%.
Pengujian indeks tap memiliki peran yang sangat penting dalam hal gambaran
menunjukkan daya tahan granul terhadap daya kompressi yang diberikan oleh alat
pencetak tablet. Semakin rendah persentase indeks tap menunjukkan kualitas yang
lebih baik dari sifat fisis massa granul yang akan di formulasikan kedalam bentuk
tablet.
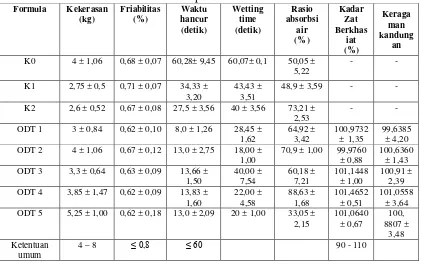
Tabel 4.2 Hasil evaluasi tablet metoklopramida HCl simulasi Formula Kekerasan
(kg)
4.2 Hasil evaluasi ODT Metoklopramida HCl 4.2.1 Kekerasan
Dari tabel 3 dapat dilihat nilai kekerasan tablet dari masing-masing
formula, dimana kekerasan tablet pada formula K0 adalah 4 kg; K1 sebesar 2,75
kg; K2 sebesar 2,76 kg; ODT 1 sebesar 3 kg; ODT 2 sebesar 4 kg; ODT 3 sebesar
3,3 kg; ODT 4 sebesar 3,85; ODT 5 sebesar 5,25 kg. Orally Disintegrating Tablet
(ODT) dirancang mempunyai disolusi/disintegrasi yang cepat, sehingga tablet
umumnya mempunyai porositas yang tinggi untuk menjamin absorpsi air yang
cepat ke dalam tablet (Fu, 2004). Oleh karena itu, pada umumnya ODT
mempunyai kekerasan yang lebih rendah daripada kekerasan tablet pada
umumnya (4-8 kg).
4.2.2 Friabilitas
Friabilitas memberi gambaran ketahanan tablet terhadap benturan mekanis
dalam pada saat pengangkutan dan pengemasan. Nilai friabilitas yang besar
menunjukkan tablet yang rapuh. Menurut Voight, (1994), friabilitas (kehilangan
bobot) dari tablet yang diperbolehkan adalah ≤ 0,8%.
Dari tabel 4 diatas dapat dilihat hasil evaluasi friabilitas tablet, yaitu K0
sebesar 0,68%; K1 sebesar 0,71%; K2 sebesar 0,67%; ODT 1 sebesar 0,62%;
ODT 2 sebesar 0,67%; ODT 3 sebesar 0,63%; ODT 4 sebesar 0,62%; ODT 5
sebesar 0,62%. Hal ini menunjukkan bahwa hasil evaluasi friabilitas tablet dari
semua formula memenuhi persyaratan yang telah ditetapkan. Walaupun hasil yang
ditunjukkan bervariasi tetapi masih berada dalam batas penerimaan evaluasi
4.2.3 Waktu hancur
Tabel 3 diatas juga dapat dilihat bahwa waktu hancur tablet dari semua
formula memiliki waktu hancur yang sangat cepat, yaitu formula K0 sebesar
60,28 detik; K1 sebesar 34,33 detik; K2 sebesar 27,5 detik; ODT 1 sebesar 8
detik; ODT 2 sebesar 13 detik; ODT 3 sebesar 13,66 detik, ODT 4 sebesar 18,83
detik; ODT 5 sebesar 13 detik.
Gambar 4.1 Diagram waktu hancur Keterangan :
K0 = kontrol tanpa superdisintegran K1 = pemakaian krospovidon 4 % K2 = pemakaian Ac-Di-Sol 4 %
ODT 1 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 1) ODT 2 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 2) ODT 3 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 2 : 1) ODT 4 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 1 : 3) ODT 5 = campuran superdisintegrant ( krospovidon : Ac-Di-Sol = 3 : 1)
Dapat dilihat bahwa waktu hancur dari formula tablet yang tidak
menggunakan superdisintegran dan formula tablet yang hanya memakai
superdisintegran tunggal jauh lebih lama dibandingkan dengan formula ODT
yang menggunakan campuran superdisintegran. Formula ODT yang
cepat. Hal ini mungkin disebabkan karena karena Ac-Di-Sol merupakan
superdisintegran yang cepat sekali membengkak hingga 4 – 8 kali ukuran /
volume awalnya dalam waktu kurang dari 10 detik apabila terjadi kontak dengan
air. Sedangkan krospovidon merupakan superdisintegran yang mekanisme
kerjanya dengan bertindak sebagai kapiler (Bhowmik, et.al., 2009).
Tabel 4.3 Hasil uji anova waktu hancur formula ODT.
ANOVA
Tabel 4.4 Hasil uji duncan evaluasi waktu hancur formula ODT.
Waktu
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 6.000.
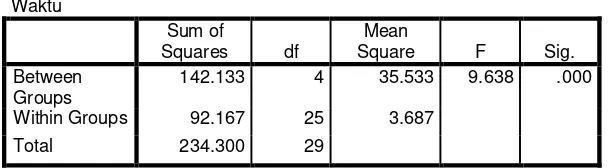
Dari uji ANOVA diatas diperoleh p = 0,00 dapat diartikan bahwa ada
karena p < 0,05. Perbedaan yang signifikan / bermakna itu dapat dilihat pada tabel
duncan dimana menunjukkan antara formula ODT 1 berbeda signifikan / bermakna dengan formula ODT 2, ODT 3, ODT 4, ODT 5, sedangkan tidak ada
perbedaan yang bermakna atau signifikan antara waktu hancur formula ODT 2,
ODT 3, ODT 4, dan ODT 5.
4.2.4 Penentuan kurva serapan dan linieritas kurva kalibrasi metoklopramid HCl dalam larutan HCl 0,1 N
4.2.4.1 Hasil penentuan panjang gelombang maksimum
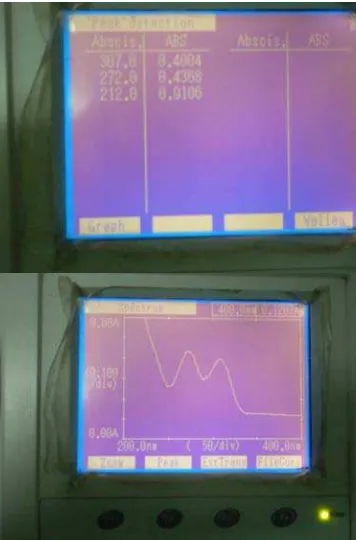
Menurut Moffat (2005), metoklopramida HCl memberikan serapan maksimum dalam pelarut asam pada panjang gelombang 273 nm. Dari hasil
penentuan panjang gelombang maksimum diperoleh pada panjang gelombang
maksimum yang sama dengan literatur yaitu 273 nm.
Gambar kurva dan data serapan Metoklopramida HCL baku pembanding
Gambar 4.2 Kurva dan data serapan metoklopramida HCl baku pembanding (Hexpharm Jaya Laboratories) konsentrasi 13 µg/ml dalam pelarut HCl 0,1 N .
4.2.4.2 Hasil penentuan linieritas kurva kalibrasidalam HCl 0,1 N.
Penentuan linieritas kurva kalibrasi Metoklopramida HCl dalam pelarut
HCl 0,1 N dilakukan pada rentang konsentrasi 0,00 – 19,00 µg/ml. Dari hasil
perhitungan koefisien korelasi diperoleh r = 0,99948, ini menunjukkan bahwa
terdapat hubungan yang linier antara serapan dan konsentrasi dan dari hasil
perhitungan diperoleh persamaan regresi Y = 0,040796 X + 0,006217.
Gambar kurva kalibrasi Metoklopramida HCl baku pembanding (Hexpharm Jaya