Sebagai contoh ODT Formula 1 (Formula dengan primogel : menthol =
12,5 : 0). Dibuat formula untuk 100 tablet dengan bobot per tablet 200 mg dan
dengan penampang tablet 9 mm.
Bobot 100 tablet = 100 tablet x 0,2 gram = 20 gram
- Metoklopramida HCl = 10 mg x 100 = 1 gram
- Primogel = 25 mg x 100 = 2,5 gram
- Aspartam = 5 mg x 100 = 0,5 gram
- Magnesium stearat = 4 mg x 100 = 0,4 gram
F = Friabilitas
a = bobot tablet sebelum diputar dalam alat friabilator selama 4 menit (100
putaran)
b = bobot tablet setelah diputar dalam alat friabilator selama 4 menit (100 putaran)
Syarat friabilitas tablet : Kehilangan bobot tidak boleh lebih dari ≤ 0,9%, sebagai
contoh diambil tablet formula ODT 1
Bobot 20 tablet sebelum diputar = 3875 g
Bobot 20 tablet setelah diputar = 3861 g
Friabilitas = (3875 – 3861) / 3875 x 100% = 0,36%
�� �
Keterangan:
R = Rasio absorbsi air
Wa = Bobot tablet sebelum terbasahi
Wb = Bobot tablet setelah terbasahi
Formula ODT 1
• Bobot 1 tablet sebelum terbasahi = 195 mg
• Bobot 1 tablet setelah terbasahi = 253 mg
R tablet = (253 - 195)/253 x 100% = 22,92%
R = persen menthol yang tersublimasi
a = berat tablet sebelum sublimasi
b = berat tablet setelah sublimasi
Contoh Formula ODT 2 dengan menthol 12,5%
a = 201,3 mg
b = 176,58 mg
R = (201,3 - 176,58)/201,3 x 100%
R = 12,28%
% Menthol yang tersisa = % Menthol - % Menthol tersublimasi
= 12,5% - 12,28%
= 0,22%
% Keberhasilan Proses Sublimasi
= (% Menthol tersublimasi / % Menthol) x 100%
= (12,28% / 12,5%) x 100%
= 98,24%
Y Yi |Yi – Y| | Yi –Y|²
0,0000 0,00000 0,0000 0
0,20158 0,20063 0,00095 902 . 10-9
0,31023 0,30959 0,00064 409 . 10-9
0,40057 0,40039 0,00018 32 . 10-9
0,50836 0,50935 0,00099 98 . 10-9
0,61832 0,61831 0,00001 10-10
Σ| Yi –Y|²= 2323 . 10-9
SBR
=
�
∑| Yi –Y|²�−2
= 2323 . 10-9 = 0,000762069
6-2
LOD =3 x SBR = 3 x 0,000762069
Slope 0,03632
= 0,06295 mcg/mL
LOQ =10 x SBR = 10 x 0,000762069
Slope 0,03632
Berat 20 tablet = 3918,5 mg
Berat metoklopramida HCl dalam 20 tablet = 20 x 10 = 200 mg
Berat setara 10 mg metoklopramida HCl = 10/200 x 3918,5 mg = 195,93 mg
- Pengujian I
Serbuk ditimbang seksama sebanyak mg kemudian dilarutkan sesuai
prosedur yang telah disebutkan sebelumnya dan diukur serapan pada panjang
gelombang maksimum.
Y = 0,03632 x + 0,00087
Diperoleh kensentrasi ( X ) larutan = 10,6379 μg/mL
Diketahui konsentrasi teoritisnya = berat yang ditimbang
berat setara 10 mg metoklopramida HCl
= 196,8 195,93
= 10,0444μg/mL
Kadar = 10,6379μg/mL
10,0444μg/mL
X 100%
= 105,91 %
x 10μg/mL
Berat 20 tablet = 3918,5 mg ( mengandung 200 mg metoklopramida HCl )
Berat 20 tablet = 3534,9 mg ( mengandung 200 mg metoklopramida HCl )
Berat setara 10 mg metoklopramida HCl = 10
Berat 20 tablet = 3755,3 mg ( mengandung 200 mg metoklopramida HCl )
Berat 20 tablet = 3717,1 mg ( mengandung 200 mg metoklopramida HCl )
Berat setara 10 mg metoklopramida HCl = 10 200
Berat 20 tablet = 3598,8 mg ( mengandung 200 mg metoklopramida HCl)
Berat setara 10 mg metoklopramida HCl = 10 200
No.
Berat sampel
yang ditimbang
(mg)
Kons. Teoritis (mcg/ml)
Serapan
Kons. Sampel (mcg/ml)
Kadar (%)
Kadar
rata-rata (%)
Persyaratan
1. 174,8 10,0034 0,39836 10,9441 109,40
109,13
90,00 % - 110,00 % 2. 174,95 10,0120 0,39841 10,9455 109,32
3. 176,11 10,0784 0,39844 10,9463 108,61 4. 176,62 10,1076 0,39853 10,9488 108,32 5. 173,44 9,9256 0,39583 10,8744 109,56 6. 173,59 9,9342 0,39613 10,8827 109,55
Misal untuk formula 1 :
No. Kadar (%) |Xi – �| | Xi – � |²
1. 105,91 0,11 0,0121
2. 105,60 0,20 0,04
3. 105,87 0,07 0,0049
4. 105,67 0,13 0,0169
5. 105,98 0,18 0,0324
6. 105,77 0,03 0,0009
Σ� =105,80 Σ| X – � |²= 0,1072
SD =
�
∑| ��−� | �−1= 0,1072 = 0,15
6-1
Pada tingkat kepercayaan 99% dengan nilai α = 0,01, dk = n – 1 = 6 – 1 = 5
Diperoleh t tabel = 3,365
Dasar penolakan data apabila t hitung≥ t tabel
t
hitung=
�−�
�� √� �
thitungdata 1 = 0,11
0,15/√6
= 1,80
thitungdata 2=0,20
0,15/√6
= 3,27
thitungdata 5= 0,24
0,51/√6
= 2,94
thitungdata 6= 0,01
0,51/√6
= 0,49
Semua data diterima
Jadi kadar sebenarnya terletak antara :
µ
= � ± t (1-1/2 α)dk xSD√n
= 105,80 % ± 3,365 x
√6
0,15
= 105,80 % ± 0,2601
1.199,26 6.198,53
2.198,67 7.199,17
3.199,36 8.199,41
4.199,34 9.199,05
5.199,17 10.198,22
Berat metoklopramida HCl dalam 1 tablet 10 mg
Misal pada tablet 1 dengan berat 199,26 mg
- Pengujian I
Satu tablet digerus dan dilakukan pengujian seperti pada penetapan
kadar,Makadiperoleh serapan ( Y ) = 0,39037
Konsentrasi metoklopramida HCl dapat dihitung dengan memasukkan
nilaiabsorbansi ke persamaan regresi berikut :
Y = 0,03632 X + 0,00087
X = 10,7241 μg/mL
Diketahui konsentrasi teoritisnya =
199,26 199,02
= 9,9880 μg/mL
Maka kadar metoklopramida HCl =
9,9880
10,7241 μg/mL
μg
= 107,37 % /mL
x 10 μg/mL
Kadar metoklopramida HCl = 109,67 %
- Pengujian III
Kadar metoklopramida HCl = 109,67 %
- Pengujian IV
Kadar metoklopramida HCl = 94,26 %
- Pengujian V
Kadar metoklopramida HCl = 98,37 %
- Pengujian VI
Kadar metoklopramida HCl = 105,93 %
- Pengujian VII
Kadar metoklopramida HCl = 106,58 %
SD =
= 0,8219 10-1
= 0,30
SBR = SD x
X 100%
= 100% 0,28%
32 , 107
30 , 0
= x
Perhitungan yang sama dilakukan terhadap formula ODT lainnya.
1. Konsentrasi (C)
Dengan persamaan regresi Y = 0,03632 x + 0,00087
X = Konsentrasi
Y = Absorbansi
Pada t = 3 menit, Y = 0.07884
0,07884= 0,03632 X + 0,00087
X = 2,1468μg/mL
2. Faktor Pengenceran
Fp = (pengenceran dalam labu 25 mL) / jumlah pemipetan aliquot
= 25/5
Fp = 5
3. Konsentrasi dalam 5 mL (Cp x Fp)
Contoh pada t = 3 menit
C = 2,1468mcg/ml x 5 = 10,734 mcg/mL
4. konsentrasi dalam 900 mL
C dalam 900 mL = C dalam 5 mL x 900
Contoh pada t = 3 menit
Faktor penambahan pada tn= C dalam 5 mL pada tn-1 + C dalam 5 mL pada tn-2
Fp = 0
6.Metoklopramida HCl yang terlepas
Metoklopramida HCl yang terlepas = C dalam 900 mL + faktor penambahan
Contoh pada t = 3 menit
Metoklopramida HCl yang terlepas = 9660,60mcg + 0
= 9660,60mcg
= 9660,60mg
7. Persen Kumulatif
% kumulatif =metoklopramida HCl yang terlepas dosis (mg)
x 100%
Dosis metoklopramida HCl= 10 mg
Contoh pada t = 3 menit
% kumulatif =9660,60mcg 10000 mcg
x 100%
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
Percobaan 5
Me dalam medium
(mcg) yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 6
Me dalam medium
(mcg) yang terlarut
Percobaan 2
Me dalam medium
(mcg) yang terlarut
(mcg)
Percobaan 3
Me yang terlarut
(mcg) dalam medium
(mcg) yang terlarut
yang terlarut
(mcg) yang terlarut
(mcg)
Percobaan 6
Me yang terlarut
1 0 0 0 0 0 0 0 0 0
2 3 96.61 95.28 95.59 95.44 94.87 95.13 95.49 0.60
3 6 97.43 95.67 96.03 96.77 95.63 95.63 96.19 0.75
4 9 98.11 97.05 97.46 97.6 96.37 96.2 97.13 0.74
5 12 98.25 98.38 98.72 98.71 97.6 97.7 98.23 0.48
6 15 98.98 100.49 99.55 99.61 99.54 98.62 99.47 0.64
Formula 1
No Waktu
(menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 90.62 91.77 91.1 90.69 90.98 90.78 90.99 0.42
3 6 91.38 92.23 92.23 91.63 92.06 91.56 91.85 0.37
4 9 92.34 93.39 92.85 92.84 93.05 92.2 92.78 0.44
5 12 94.53 93.88 93.48 93.71 94.06 94.53 94.03 0.43
6 15 95.5 95.01 95.21 95.64 94.77 95.72 95.31 0.38
Formula 2
No Waktu
(menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 91.2 91.99 91.65 91.1 91.33 91.14 91.40 0.35
3 6 93.25 93.86 92.57 92.19 92.49 92.63 92.83 0.61
4 9 95.16 94.58 94.01 93.29 94.22 94.33 94.27 0.62
5 12 96.03 95.8 94.75 94.85 95.26 95.29 95.33 0.51
No Waktu (menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 91.99 92.57 92.5 91.89 92.94 92.49 92.40 0.39
3 6 93.19 93.64 94.18 93.57 93.39 93.87 93.64 0.35
4 9 94.17 94.15 95.47 95.41 95.13 94.3 94.77 0.63
5 12 94.68 95.07 96.16 95.94 96.11 95.55 95.59 0.60
6 15 97.02 96.4 96.45 97.12 96.66 97.16 96.80 0.34
Formula 4
No Waktu
(menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 93.07 93.39 92.61 93.19 92.97 93.19 93.07 0.27
3 6 94.39 94.7 93.44 94.37 94.1 93.9 94.15 0.44
4 9 94.96 95.85 94.75 95.16 94.64 95 95.06 0.43
5 12 95.59 96.19 95.5 95.91 95.68 95.91 95.80 0.25
6 15 97.03 96.9 96.85 96.74 97.02 96.27 96.80 0.28
Formula 5
No Waktu
(menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 93.79 93.26 93.54 93.41 93.65 93.33 93.50 0.20
3 6 94.22 93.74 94.5 94.54 98.58 93.71 94.88 1.85
4 9 95.37 95.4 95.44 95.98 95.22 95.44 95.48 0.26
5 12 96.67 96.15 96.2 96.31 96.52 96.94 96.47 0.30
1 0 0 0 0 0 0 0 0 0
2 3 94.2 94.19 93.62 93.77 93.39 94.23 93.90 0.36
3 6 95.35 95.15 93.98 95.65 94.46 94.8 94.90 0.61
4 9 96.73 95.95 94.93 96.01 95.13 96.59 95.89 0.74
5 12 97.21 96.75 96.66 96.56 95.91 96.8 96.65 0.42
6 15 98.07 97.35 97.78 97.63 97.88 97.26 97.66 0.31
Formula 7
No Waktu
(menit)
% kumulatif %
kumulatif rata-rata
Standar Deviasi
1 2 3 4 5 6
1 0 0 0 0 0 0 0 0 0
2 3 95.04 95 94.45 94.52 94.4 94.44 94.64 0.30
3 6 95.51 95.42 95.3 95.42 95.41 95.16 95.37 0.12
4 9 95.84 95.81 95.97 95.87 95.93 96.12 95.92 0.11
5 12 96.35 96.42 96.59 96.83 96.64 96.39 96.54 0.18
Waktu
(menit) % kumulatif I AUCI
(%.menit) % kumulatif II
AUCII
(%.menit) % kumulatif III
AUCIII
(%.menit) % kumulatif IV
AUCIV
(%.menit) % kumulatif V
AUCV (%.menit)
% kumulatif VI
AUCVI (%.menit)
3 96.61 144.915 95.28 142.92 95.59 143.385 95.44 143.16 94.87 142.305 95.13 142.695
6 97.43 291.06 95.67 286.425 96.03 287.43 96.77 288.315 95.63 285.75 95.63 286.14
9 98.11 293.31 97.05 289.08 97.46 290.235 97.6 291.555 96.37 288 96.2 287.745
12 98.25 294.54 98.38 293.145 98.72 294.27 98.71 294.465 97.6 290.955 97.7 290.85
15 98.98 295.845 100.49 298.305 99.55 297.405 99.61 297.48 99.54 295.71 98.62 294.48
AUC total I 1319.67 AUC total II 1309.875 AUC total III 1312.725 AUC total IV 1314.975 AUC total V 1302.72 AUC total VI 1301.91
1310.313
Formula 1
Waktu (menit)
% kumulatif I AUCI (%.menit) % kumulatif II (%.menit) AUCII % kumulatif III (%.menit) AUCIII % kumulatif IV (%.menit) AUCIV % kumulatif V (%.menit) AUCV % kumulatif VI (%.menit) AUCVI
3 90.62 135.93 91.77 137.655 91.1 136.65 90.69 136.035 90.98 136.47 90.78 136.17
6 91.38 273 92.23 276 92.23 274.995 91.63 273.48 92.06 274.56 91.56 273.51
9 92.34 275.58 93.39 278.43 92.85 277.62 92.84 276.705 93.05 277.665 92.2 275.64
12 94.53 280.305 93.88 280.905 93.48 279.495 93.71 279.825 94.06 280.665 94.53 280.095
3 91.2 136.8 91.99 137.985 91.65 137.475 91.1 136.65 91.33 136.995 91.14 136.71
6 93.25 276.675 93.86 278.775 92.57 276.33 92.19 274.935 92.49 275.73 92.63 275.655
9 95.16 282.615 94.58 282.66 94.01 279.87 93.29 278.22 94.22 280.065 94.33 280.44
12 96.03 286.785 95.8 285.57 94.75 283.14 94.85 282.21 95.26 284.22 95.29 284.43
15 97.21 289.86 96.97 289.155 96 286.125 96.15 286.5 96.62 287.82 96.65 287.91
AUC total I 1272.735 AUC total II 1274.145 AUC total III 1262.94 AUC total IV 1258.515 AUC total V 1264.83 AUC total VI 1265.145
1266.385
Formula 3
Waktu (menit)
% kumulatif I AUCI (%.menit) % kumulatif II
AUCII (%.menit)
% kumulatif III
AUCIII (%.menit)
% kumulatif IV
AUCIV (%.menit)
% kumulatif V
AUCV (%.menit)
% kumulatif VI
AUCVI (%.menit) 3 91.99 137.985 92.57 138.855 92.5 138.75 91.89 137.835 92.94 139.41 92.49 138.735
6 93.19 277.77 93.64 279.315 94.18 280.02 93.57 278.19 93.39 279.495 93.87 279.54
9 94.17 281.04 94.15 281.685 95.47 284.475 95.41 283.47 95.13 282.78 94.3 282.255
12 94.68 283.275 95.07 283.83 96.16 287.445 95.94 287.025 96.11 286.86 95.55 284.775
15 97.02 287.55 96.4 287.205 96.45 288.915 97.12 289.59 96.66 289.155 97.16 289.065
AUC total I 1267.62 AUC total II 1270.89 AUC total III 1279.605 AUC total IV 1276.11 AUC total V 1277.7 AUC total VI 1274.37
1273.8
Waktu (menit)
% kumulatif I AUCI (%.menit) % kumulatif II
AUCII (%.menit)
% kumulatif III
AUCIII (%.menit)
% kumulatif IV
AUCIV (%.menit)
% kumulatif V
AUCV (%.menit)
% kumulatif VI
Waktu (menit)
% kumulatif I AUCI (%.menit) %
kumulatifII AUCII(%.menit)
% kumulatif
III AUCIII(%.menit) %
kumulatifIV AUCIV(%.menit) %
3 94.2 141.3 94.19 141.285 93.62 140.43 93.77 140.655 93.39 140.085 94.23 141.345
6 95.35 284.325 95.15 284.01 93.98 281.4 95.65 284.13 94.46 281.775 94.8 283.545
9 96.73 288.12 95.95 286.65 94.93 283.365 96.01 287.49 95.13 284.385 96.59 287.085
12 97.21 290.91 96.75 289.05 96.66 287.385 96.56 288.855 95.91 286.56 96.8 290.085
15 98.07 292.92 97.35 291.15 97.78 291.66 97.63 291.285 97.88 290.685 97.26 291.09
AUC total I 1297.575 AUC total II 1292.145 AUC total
IIII 1284.24
AUC total
IV 1292.415 AUC total V 1283.49
AUC total
VI 1293.15 1290.503
Formula 7
Waktu (menit)
% kumulatif I AUCI (%.menit) % kumulatif II
AUCII (%.menit)
% kumulatif III
AUCIII (%.menit)
% kumulatif IV
AUCIV (%.menit)
% kumulatif V
AUCV (%.menit)
% kumulatif VI
AUCVI (%.menit) 3 95.04 142.56 95 142.5 94.45 141.675 94.52 141.78 94.4 141.6 94.44 141.66
6 95.51 285.825 95.42 285.63 95.3 284.625 95.42 284.91 95.41 284.715 95.16 284.4
9 95.84 287.025 95.81 286.845 95.97 286.905 95.87 286.935 95.93 287.01 96.12 286.92
12 96.35 288.285 96.42 288.345 96.59 288.84 96.83 289.05 96.64 288.855 96.39 288.765
15 97.73 291.12 97.6 291.03 98.28 292.305 97.35 291.27 97.43 291.105 97.63 291.03
AUC total I 1294.815 AUC total II 1294.35 AUC total III 1294.35 AUC total IV 1293.945 AUC total V 1293.285 AUC total VI 1292.775
1293.92
(a) (b)
(c) (d)
(g)
Keterangan:
(a) : Gambar tablet formula 1
(b) : Gambar tablet formula 2
(c) : Gambar tablet formula 3
(d) : Gambar tablet formula 4
(e) : Gambar tablet formula 5
(f) : Gambar tablet formula 6
(a) (b)
(g) (h)
(i) (j)
(m) (n)
Keterangan :
(a) : Gambar ODT formula 1 sebelum uji.
(b) : Gambar ODT formula 1 sesudah uji.
(c) : Gambar ODT formula 2 sebelum uji.
(d) : Gambar ODT formula 2 sesudah uji.
(e) : Gambar ODT formula 3 sebelum uji.
(f) : Gambar ODT formula 3 sesudah uji.
(g) : Gambar ODT formula 4 sebelum uji.
(h) : Gambar ODT formula 4 sesudah uji.
(i) : Gambar ODT formula 5 sebelum uji.
(j) : Gambar ODT formula 5 sesudah uji.
(k) : Gambar ODT formula 6 sebelum uji.
(l) : Gambar ODT formula 6 sesudah uji.
(m) : Gambar ODT formula 7 sebelum uji.
(a) (b)
(e) (f)
(g) (h)
Keterangan :
(a) : Gambar alat uji preformulasi waktu alir (Flowmeter), dan sudut diam
(Copley).
(b) : Gambar mesin pencetak tablet (Erweka).
(c) : Gambar alat uji friabilitas (Copley).
(d) : Gambar alat uji kekerasan (Copley).
(e) : Gambar alat uji waktu hancur (Copley).
(f) : Gambar alat uji disolusi (Copley).
(g) : Gambar oven (Memmert).
System.International Journal of PharmTech Research. 1(3): 790-798. Alysson L. R. dan Wanderley P.O. (2007).Spray Drying Conditions and
Encapsulating Composition Effects on Formation and Properties of Sodium Diclofenac Microparticles. Powder Technol. Dalam: Parkash, V., Saurabh, M., Deepika., Shiv, K. Y., Hemlata. dan Vikas, J. Fast Disintegrating Tablets: Opportunity in Drug Delivery System.
Pharmaceutical Technology and Research.2(4). Halaman 223-235.
Bagul, U. S., Bagul, N. S., Kulkarni, M. S., Sawant, S. D., Guijar, K. N. dan Bikar, A. A. (2006). Manufacturing Technologies for Mouth Dissolving Tablet
dan Sharma, S. Fast Disolving Delivery Sytem On review.2(10): 21-29.
Bagul, U., Kishore, G., Nancy, P., Sanjeevani, A. dan Shalaka, D. (2010).Formulation and Evaluation of Sublimed Fast Melt Tablet of
Levocetirizine Dihydrochloride.International Journal of Pharmaceutical
Science.2(2). 77.
Bhowmik, D., Chiranjib, B., Krisnakanth, Pankaj dan Margret R. (2009). Fast
Dissolving Tablet:An Overview. Journal of Chemical and Pharmaceutical
Research.1(1): 163-177.
Blacow, N. M. (1988). Martindale The Extra Pharmacopeia. Great Britain:
Department of Pharmaceutical Science. Halaman 374, 1093.
British Pharmacopeia.(2002). British Pharmacopoeia.Volume III. London:
Medicines and Healthcare Products Regulatory Agency (MHRA). Halaman 1897.
Cartensen, J.T. (1977). Pharmaceutical of Solid Dosage Forms. New York: A
Wiley Interscience Publication John Wiley and Son. Halaman 133-135, 209, 216-218, 342.
Chang, R. K, Guo, X., Burnside, B. A. dan Couch, R. A. (2000).Fast-Dissolving Tablets. Dalam: Fu, Y.R., Yang, S.C., Seong, H.J., Kimura, S. dan Park,
K. Orally FastDisintegrating Tablets: Developments, Technologies,
Taste-Making and ClinicalStudies. Therapeutic Drug Carrier Systems.21(6):
433- 475.
Day, R. A., dan Underwood, A. L. (2002). Analisis Kimia Kuantitatif.
Formulation.International Journal of PharmTech Research.3(1): 515-525.
Ditjen, POM. (1979). Farmakope Indonesia.Edisi III. Jakarta: Departemen
Kesehatan RI. Halaman 639, 746, 748, 755.
Ditjen, POM. (1995). Farmakope Indonesia.Edisi IV. Jakarta: Departemen
Kesehatan RI. Halaman 4, 1085, 1144.
Dobetti L. (2001). Fast-melting tablets: Developments and technologies. Dalam:
Fu, Y.R., Yang, S.C., Seong, H.J., Kimura, S. dan Park, K. Orally
FastDisintegrating Tablets: Developments, Technologies, Taste-Making
and ClinicalStudies. Therapeutic Drug Carrier Systems.21(6): 433- 475.
Donald L.W. (2005). Handbook of Pharmaceutical Controlled Release Technology.Dalam: Parkash, V., Saurabh, M., Deepika., Shiv, K. Y., Hemlata. dan Vikas, J. Fast Disintegrating Tablets: Opportunity in Drug
Delivery System. Pharmaceutical Technology and Research.2(4).
Halaman 223-235.
Fu, Y., Yang, S., Seong, H.J., Kimura, S., dan Park, K. (2004). Orally
FastDisintegrating Tablets: Developments, Technologies, Taste-Making
and Clinical Studies. Therapeutic Drug Carrier Systems.21(6): 433- 475.
Gandjar, I. G. dan Rohman A. (2007).Kimia Analisis Farmasi. Cetakan I.
Yogyakarta: Pustaka Pelajar. Halaman 255.
Giunchedi, P., Conti B., Genta I., Conte U. dan Puglisi G. (2001).Emulsion Spray Drying for the Preparation of Albumin-loaded PLGA Microspheres. Dalam: Parkash, V., Saurabh, M., Deepika., Shiv, K. Y., Hemlata. dan Vikas, J. Fast Disintegrating Tablets: Opportunity in Drug Delivery
System. Pharmaceutical Technology and Research.2(4). Halaman
223-235.
Kumar, A. dan A.G. Agrawal.(2009). Formulation, Development, and Evaluation
of Orally Disintegrating Tablets by Sublimation Technique.International
Journal of PharmTech Research.1(4): 998.
Pharmaceutical Technology and Research.2(4): 223-235.
Peter, R., Shashank, N. N., Shwetha, S. K. K. dan A. R. Shabaraya. (2014). Formulation and Evaluation of Fast Dissolving Tablets of Flunarizine Hydrochloride by Sublimation Method using Sodium Starch Glycolate as
Superdisintegrant.International Journal of PharmTech Research. 6(3):
1085-1095.
Que, L., Wu, W., Cheng, X. dan Hu, T. (2006). Evaluation of Disintegrating Tablets By a Paddle Method. Dalam: Parkash, V., Saurabh, M., Deepika., Shiv, K. Y., Hemlata. dan Vikas, J. Fast Disintegrating Tablets:
Opportunity in Drug Delivery System. Pharmaceutical Technology and
Research.2(4): 223-235.
Rao,N.G.R.dan Gandhi, S.(2009).Development and Evaluation ofCarbamazepine Fast Disolving Tablets Prepared with A Complex byDirect Compression Technique.Asian J. Pharma.3(2): 97-103.
Rowe, R. C., Sheskey, P. J. dan Queen, M. E. (2009). Handbook of
Pharmaceutical Exipients. Edisi VI. Chicago: Pharmaceutical Press. Halaman 663-664.
Seager H. (1998). Drug-Delivery Products and the Zydis Fast-Dissolving Dosage Form. Dalam: Fu, Y.R., Yang, S.C., Seong, H.J., Kimura, S. dan Park, K. Orally FastDisintegrating Tablets: Developments, Technologies,
Taste-Making and ClinicalStudies. Therapeutic Drug Carrier Systems.21(6):
433- 475.
Sharma, D. (2013). Formulation Development and Evaluation of Fast Disintegrating Tablets of Salbutamol Sulphate for respiratory disorders. Dalam: Sharma, D., Singh, G., Kumar, D. dan Singh, M. Formulation Development and Evaluation of Fast DisintegratingTablets of Salbutamol Sulphate, Cetirizine Hydrochloride inCombined Pharmaceutical Dosage Form: A New Era in NovelDrug Delivery for Pediatrics and Geriatrics. Journal of Drug Delivery.2015(10): 1-10.
Sharma, V., Vandana, A. dan Chanda, R. (2010).Use of Natural Superdisintegrant
in Mouth Dissolving Tablet – And Emerging Trend.International Bulletin
of Drug Research.1(2): 46-54.
Sutradhar, B. K., Akhter, D. T. dan Riaz, U. (2012). Formulation and Evaluation of Taste Masked Oral Dispersible Tablets of Domperidone Using
Sublimation Method.International Journal of Pharmacy and
United States Pharmacopeia. (2004). The United States Pharmacopeia Convention. Edisi XXVII. Rockville: United States Pharmacopeial Convention, Inc. Halaman 1228.
Vijayanand, P., J. S. Patil. dan Venkata, R. (2015). Formulation characterization and In-Vitro/In-Vivo Evaluation of Orodispersible Tablets of Nebivolol HCl.Pelagia Research Library.16(4):107.
Vikas, A., Bhavesh, H. K., Derek, V. M. dan Rajendra, K. K. (2007). Drug delivery: Fast dissolve systems. Dalam: Parkash, V., Saurabh, M., Deepika., Shiv, K. Y., Hemlata. dan Vikas, J. Fast Disintegrating Tablets:
Opportunity in Drug Delivery System. Pharmaceutical Technology and
Research.2(4). Halaman 223-235.
Wibisono, Y. 2005. Metode Statistik. Cetakan I. Yogyakarta: Gadjah Mada
formulasi Orally Disintegrating Tablet (ODT) Metoklopramida HCl dan evaluasi
sediaan.
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah mesin pencetak tablet
(Erweka), disintegration tester tipe dayung (Copley), dissolution tester (Copley),
hardness tester (Copley), friabilator (Copley), spektrofotometer UV (Shimadzu),
stopwatch, neraca listrik (Boeko), alat-alat gelas dan alat laboratorium lainnya.
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah metoklopramida
HCl (IPCA), primogel (Amishi Drugs & Chemicals), menthol (Shanghai), Mg
Stearat (Faci Asia Pacific), maltodekstrin (Sorini Agro Asia Corp.), aspartam
(Changzou Kelong Chemicals).
3.3 Prosedur Kerja 3.3.1 Pembuatan pereaksi
3.3.1.1 Air bebas karbondioksida
Akuades yang telah dididihkan kuat-kuat selama beberapa menit.Selama
pendinginan dan penyimpanan harus terlindung dari udara (Ditjen POM., 1979).
3.3.1.2 Natrium hidroksida 0,2 N
Dilarutkan 8,001 gram natrium hidroksida dalam air bebas
karbondioksida dan encerkan hingga 1000 mL (Ditjen POM., 1979).
3.3.1.4 Dapar fosfat pH 6,8
Dimasukkan 50 mL kalium dihidrogen fosfat 0,2 M ke dalam labu
tentukur 200 mL, kemudian ditambahkan NaOH 0,2 N sebanyak 22,4 mL lalu
diencerkan dengan air bebas karbondioksidahingga 200 mL (Ditjen POM., 1979).
3.3.2 Pembuatan ODT metoklopramida HCl
Tabel 3.1 Komposisi formulasi ODT metoklopramida HCl
Komposisi (mg) Formula
F1 F2 F3 F4 F5 F6 F7
Metoklopramida
HCl
10 10 10 10 10 10
10
Primogel 25 - 25 25 25 25 25
Menthol - 25 5 10 15 20 25
Maltodekstrin 156 156 151 146 141 136 131
Aspartam 5 5 5 5 5 5 5
Mg Stearat 4 4 4 4 4 4 4
Total 200 200 200 200 200 200 200
Keterangan (dalam %) :
F1 = Primogel : Menthol (12,5 : 0)
F2 = Primogel : Menthol (0 : 12,5)
F3 = Primogel : Menthol (12,5 : 2,5)
F4 = Primogel : Menthol (12,5 : 5)
F5 = Primogel : Menthol (12,5 : 7,5)
F6 = Primogel : Menthol (12,5 : 10)
dicampur dengan bahan-bahan lain yang jumlahnya lebih kurang sama yang
ada di dalam botol, begitu seterusnya sampai semua bahan tercampur lalu
dibolak-balikkan sampai homogen.
4. Dilakukan uji preformulasi terhadap massa.
5. Dicetak massa menjadi tablet dengan diameter 9 mm dan berat 200 mg.
6. Disublimasi tablet di dalam oven pada suhu 70ºC selama 5 jam (Bagul, et.al.,
2010).
7. Dilakukan evaluasi terhadap tablet yang sudah disublimasi.
Formulasi tablet cepat hancur dibuat dengan metode sublimasi
menggunakan primogel dan menthol dengan perbandingan yang berbeda-beda.
Adapun berbagai formula yang dirancang seperti yang ditunjukkan Tabel 3.1.
3.3.3 Uji preformulasi
Uji preformulasi dilakukan terhadap campuran massa tablet
metoklopramida HCl yang meliputi sudut diam, waktu alir, dan indeks tap.
3.3.3.1 Waktu alir
Penetapan laju alir dilakukan dengan menggunakan corong.Seratus gram
granul dimasukkan ke dalam corong yang telah dirangkai, permukaannya
diratakan.Penutup bawah corong dibuka dan secara serentak stopwatch
dihidupkan.Stopwatch dihentikan jika seluru granul telah habis melewati corong
dan dicatat waktu alirnya.
gram granul dimasukkan ke dalam corong, permukaannya diratakan, lalu penutup
bawah corong dibuka dan dibiarkan granul mengalir melalui corong dan
ditentukan besar sudut diamnya dengan rumus:
Tgθ = 2h/D
Keterangan: θ = sudut diam
h = tinggi kerucut (cm) D = diameter (cm)
Syarat: 20o <θ< 40o (Cartensen, 1977).
3.3.3.3 Indeks tap
Granul dimasukkan ke dalam gelas ukur 50 mL dan diukur volume
awalnya (V1) lalu dihentakkan sehingga diperoleh volume akhirnya (V2) yang
konstan. Indeks tap dihitung dengan rumus:
I = V1-V2 V2
X 100%
Keterangan: I = indeks tap
V1 = volume sebelum hentakan V2 = volume setelah hentakan
Syarat : I ≤ 20% (Cartensen, 1977).
3.3.4 Analisa kuantitatif
3.3.4.1Pembuatan larutan induk baku I
Ditimbang 50 mg metoklopramida HCl, dimasukkan ke dalam labu
tentukur 100 mL, ditambahkan dapar fosfat pH 6,8dan dikocok sampai homogen,
pH 6,8sampai garis tanda sehinggga diperoleh larutan dengan konsentrasi 50
µg/mL.
3.3.4.3 Penentuan kurva serapan metoklopramida HCl
Dipipet LIB II sebanyak 13 mL ke dalam labu tentukur 50 mL diencerkan
dengan dapar fosfat pH 6,8 sampai garis tanda (konsentrasi 13 µg/mL), kemudian
diukur serapannya pada panjang gelombang 200-400 nm.
3.3.4.4 Pembuatan kurva kalibrasi metoklopramida HCl dalam dapar fosfat pH 6,8
Dipipet LIB II sebanyak 5,5 mL; 8,5 mL; 11 mL; 14 mL dan 17 mL
dimasukkan ke dalam labu tentukur 50 mL, diencerkan dengan dapar fosfat pH
6,8 hingga garis tanda, sehingga diperoleh konsentrasi 5,5 µg/mL; 8,5 µg/mL; 11
µg/mL; 14 µg/mL dan 17 µg/mL. Masing-masing larutan kemudian diukur
serapannya dengan menggunakan spektrofotometer ultraviolet pada panjang
gelombang maksimum.Kurva kalibrasi antara jumlah serapan dengan konsentrasi
dibuat dari data yang diperoleh lalu dihitung persamaan regresi dan koefisien
korelasinya.
3.4Evaluasi Tablet
3.4.1 Penetapan kadar metoklopramida HCl dalam tablet
Ditimbang seksama 20 tablet, kemudian digerus menjadi serbuk.
Selanjutnya ditimbang sejumlah serbuk setara dengan 10 mg metoklopramida
HCl. Serbuk ini kemudian dimasukkan ke dalam labu tentukur 100 mL,
ditambahkan dapar fosfat pH 6,8 dan dikocok hingga larut dan diencerkan dengan
Larutan ini lalu diukur serapannya dengan menggunakan spektrofotometer
ultraviolet pada panjang gelombang yang dianalisis. Tablet metoklopramida HCl
mengandung zat berkhasiat tidak kurang dari 90,0% dan tidak lebih dari hingga
110,0% dari yang tertera pada etiket (United States Pharmacopeia, 2004).
3.4.2 Uji kekerasan tablet
Alat: Hardness Tester (Copley)
Cara: Sebuah tablet diletakkan tegak lurus di antara anvil dan puch, tablet dijepit
dengan memutas sekrup pengatur hingga tanda lampu “stop” menyala, knop
ditekan dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet
pecah. Percobaan ini dilakukan untuk 6 tablet.
Ketentuan umum: kekerasan tablet 0,1-3 kg (Abu-Izza, 2004).
3.4.3 Uji friabilitas
Alat: Friabilator (Erweka)
Cara: Ditimbang 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
gram). Tablet dimasukkan ke dalam alat friabilator, lalu alat dijalankan selama 4
menit (100 kali putaran).Setelah batas waktu yang telah ditentukan, tabet
dikeluarkan dan dibersihkan dari debu, lalu ditimbang beratnya (b gram).
Friabilitas (F) = (a-b)/ a x 100%
Ketentuan umum: kehilangan berat ≤ 0,9 % (Sharma, 2013).
lainnya, tidak kurang dari 16 tablet dari 18 tablet yang harus diuji harus sempurna.
Persyaratan: Waktu yang dibutuhkan untuk menghancurkan tablet tidak lebih dari
1 menit (Manivannan, 2009).
3.4.5 Uji keseragaman kandungan
Tablet yang dibuat yaitu tablet metoklopramida HCl dengan berat 200 mg
dan mengandungmetoklopramida HCl 10 mg, berarti 50% jumlah zat
berkhasiatnya kurang dari 50 mg, karena itu penetapan keseragaman sediaan yang
dilakukan dengan menetapkan keseragaman kandungan (Ditjen POM., 1995),
yang dilakukan sebagai berikut:
Satu tablet digerus lalu dimasukkan ke dalam labu tentukur 100 mL, ditambahkan
dapar fosfat pH 6,8 dan dikocok, kemudian ditambah dapar fosfat pH 6,8 hingga
garis tanda.Larutan disaring dengan membuang beberapa tetespertama filtrat.
Dipipet 5 mL filtrat dimasukkan ke dalam labu tentukur 50 mL lalu diencerkan
dengan dapar fosfat pH 6,8 sampai garis tanda.Larutan ini lalu diukur serapannya
dengan menggunakan spektrofotometer ultraviolet pada panjang gelombang yang
dianalisis.Uji dilakukan terhadap 10 tablet.
Tablet memenuhi persyaratan dalam keseragaman kandungan jika
kadarnya terletak antara 85% hingga 115% dari yang tertera pada etiket dan
simpangan baku relatif kurang dari atau sama dengan 6,0%. Jika tidak memenuhi
persyaratan maka dilakukan uji 20 satuan tambahan, dan persyaratan dipenuhi jika
tidak lebih dari 1 satuan dari 30 yang terletak di luar rentang 85% hingga 115%
7,8% (Ditjen POM., 1995).
3.4.6 Uji disolusi obat
Alat: Dissolution Tester (Veego)
Medium : 900 mL dapar fosfat pH 6,8
Alat : tipe 2 (metode dayung)
Kecepatan putaran : 50 rpm
Waktu : 15 menit
Cara: satu tablet dimasukkan ke dalam wadah disolusi yang telah berisi 900 mL
medium disolusi (dapar fosfat pH 6,8) yang bersuhu 37o ± 0,5o C, lalu dayung
diputar dengan kecepatan 50 rpm. Pada interval waktu 3, 6, 9, 12, dan 15 menit
larutan dipipet sebanyak 5 mLcuplikan dan dimasukkan ke dalam labu tentukur 25
mL lalu diencerkan dengan dapar fosfat pH 6,8sampai garis tanda. Serapan diukur
pada panjang gelombang maksimum dengan menggunakan dapar fosfat pH
6,8sebagai blanko. Volume medium disolusi diusahakan tetap dengan
menambahkan dapar fosfat pH 6,8 dengan jumlah yang sama dengan yang
diambil. Pengambilan cuplikan dilakukan pada posisi yang sama, yaitu
pertengahan antara permukaan medium disolusi dan bagian atas dari dayung tidak
kurang dari 1 cm dari dinding wadah (Ditjen POM., 1995).
Persyaratan: dalam waktu kurang dari 30 menit harus larut tidak kurang dari 75%
persentase kadar pada etiket, dengan demikian mempunyai arti yang sama dengan
Q. Kriteria penerimaan zat aktif yang larut dengan disolusi dapat dilihat pada
Tabel 3.2 sebagai berikut:
Tabel 3.2. Kriteria penerimaan zat aktif yang larut dengan disolusi (Ditjen POM., 1995)
Tahap Jumlah yang diuji Kriteria Penerimaan
S1 6 Rata-rata tidak kurang dari Q + 5%
S2 6 Rata-rata dari 12 unit (S1 + S2) adalah sama
dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q-15%.
S3 12 Rata-rata dari 24 unit (S1 + S2 + S3) adalah
sama dengan atau lebih besar dari Q tidak lebih dari 2 unit sediaan yang lebih kecil dari Q-15% dan tidak satu unit pun yang lebih kecil dari Q-25%.
3.4.7 Uji waktu pembasahan
Kertas saring yang berbentuk lingkaran diletakkan ke dalam cawan petri
berdiameter 9 cm yang telah berisi 9 mL larutan berwarna metilen biru 0,1% b/v
dalam air suling. Satu tablet diletakkan perlahan-lahan di bagian bawah cawan
petri tersebut, kemudian dicatat waktu pembasahan sempurna dari tablet. Waktu
pembasahan (wetting time) adalah waktu yang dibutuhkan untuk membuat
permukaan atas dari tablet menyerap warna (Bhowmik, et al., 2009).
3.4.8 Uji absorpsi air
Kertas saring yang berbentuk lingkaran diletakkan ke dalam cawan petri
berdiameter 9 cm yang telah berisi 9 mL larutan berwarna metilen biru 0,1% b/v
R= 100 x (wa-wb)/ wb
Keterangan: wa = berat tablet sebelum menyerap air
wb = berat tablet sesudah menyerap air
3.4.9 Uji waktu hancur di mulut
Uji ini menggunakan 7 sukarelawan untuk 7 kode formula tablet cepat
hancur. Sebelum melakukan pengujian, setiap sukarelawan diharuskan mencuci
mulut terlebih dahulu, lalu diletakkan 1 tablet cepat hancur di atas lidah mereka
dan biarkan tablet hingga tablet hancur sempurna. Waktu yang dibutuhkan agar
tablet hancur tanpa dikunyah dihitung, setelah itu tablet segera diludahkan. Titik
akhir untuk waktu hancur di mulut adalah waktu dimana tablet yang diletakkan di
lidah menjadi hancur (tidak utuh lagi).
3.5 Analisis Data Secara Statistik
Menurut Gandjar (2007), kadar zat aktif sebenarnya yang terkandung
dalam sampel dapat diketahui menggunakan uji distribusi t. Data diterima atau
ditolak dihitung dengan menggunakan metode standar deviasi dengan rumus:
SD = �
∑| ��−� |�−1
Keterangan: Xi = nilai dari masing-masing pengukuran
� = rata-rata dari pengukuran
Untuk mencari thitung digunakan rumus:
Kadar sebenarnya : µ = �± t (α/2;dk) x (SD/√� ).
Keterangan: x = interval kepercayaan kadar sampel
� = kadar rata-rata sampel SD = standar deviasi
dk = derajat kebebasan (dk = n-1)
α = taraf kepercayaan ; dan
n = jumlah perlakuan
3.5.1 Uji statistik terhadap evaluasi waktu hancur
Evaluasi dari ODT dan sediaan tablet metoklopramida HCl dibandingkan
secara in vitro. Data dibandingkan menggunakan uji anova dengan signifikansi (p
< 0,05). Analisis statistik dilakukan menggunakan program SPSS 18,0.
3.5.2 Uji statistik terhadap profil pelepasan obat
Profil pelepasan obat dari ODT dan sediaan tablet metoklopramida HCl
dibandingkan secara in vitro. Data dibandingkan menggunakan uji anova dengan
signifikansi (p < 0,05). Analisa statistik dilakukan menggunakan program SPSS
4.1 Hasil Uji Preformulasi Granul Metoklopramida HCl
Uji preformulasi yang dilakukan meliputi sudut diam, waktu alir, dan
indeks tap. Dari hasil uji yang dilakukan dapat diketahui sifat massa yang akan
dicetak menjadi tablet. Hasil uji preformulasi granul metoklopramida HCl dapat
dilihat pada Tabel 4.1.
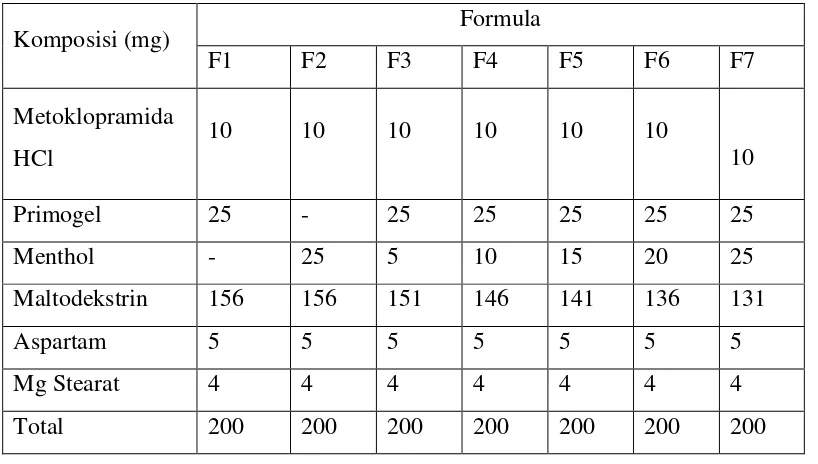
Tabel 4.1.Hasil uji preformulasi granul metoklopramida HCl
Formula Waktu Alir
(detik) Sudut Diam (
o
) Indeks Tap (%)
F1 5,36±0,14 29,93±0,47 11,90±0,56
F2 5,15±0,11 29,43±0,20 11,77±0,42
F3 5,55±0,10 29,56±0,08 12,07±0,42
F4 5,52±0,07 29,52±0,28 11,58±0,46
F5 5,47±0,06 29,35±0,22 12,02±0,45
F6 5,44±0,08 29,37±0,22 12,10±0,08
F7 5,16±0,13 29,30±0,08 12,01±0,56
Syarat <10 20-40 ≤20
4.1.1 Uji waktu alir
Berdasarkan Tabel 4.1 di atas dapat diketahui bahwa semua
formulamenunjukkan hasil uji preformulasi waktu alir yang masih berada dalam
batas persyaratan uji waktu alir yaitu formula 1 sebesar 5,36 detik; formula 2
sebesar 5,15 detik; formula 3 sebesar 5,55 detik; formula 4 sebesar 5,52 detik;
Gambar 4.1.Diagram batang waktu alir
4.1.2 Uji sudut diam
Berdasarkan Tabel 4.1 juga dapat dilihat hasil uji preformulasi sudut diam
semua formula ODT, yaitu formula 1 sebesar29,93˚;formula 2 sebesar 29,43˚;
formula 3 sebesar 29,56˚; formula 4 sebesar 29,52˚;formula 5 sebesar 29,35˚;
formula 6 sebesar 29,37˚; formula 7 sebesar 29,30˚. Hasil uji preformulasi sudut
diam ini memenuhi persyaratan uji preformulasi sudut diam.
Syarat: 20° < θ < 40° (Cartensen, 1977).
Gambar 4.2.Diagram batang sudut diam
5,36 5,15 5,55 5,52 5,47 5,44 5,16
0,00 1,00 2,00 3,00
F1 F2 F3 F4 F5 F6 F7
W
ak
tu A
li
r (
Formula
29,93 29,43 29,56 29,52 29,35 29,37 29,30
0,00 5,00 10,00 15,00 20,00 25,00 30,00
F1 F2 F3 F4 F5 F6 F7
Sudut
D
iam
(
o )
indeks tap semua formula ODT, yaitu formula 1 memiliki indeks tap sebesar
11,90%; formula 2 sebesar 11,77%; formula 3 sebesar 12,07%; formula 4 sebesar
11,58%; formula 5 sebesar 12,02%; formula 6 sebesar 12,10%; formula 7 sebesar
12,01%. Hasil uji preformulasi indeks tap ini menunjukkan hasil yang beragam
dari tiap–tiap formula, namun semuanya masih berada dalam batas persyaratan uji
preformulasi indeks tap. Granul yang bersifat mengalir bebas adalah partikel yang
memiliki indeks tap ≤ 20% (Cartensen, 1977).
Gambar 4.3. Diagram batang indeks tap
4.2 Hasil Evaluasi ODT Metoklopramida HCl
Evaluasi ODT metoklopramida HCl meliputiuji kekerasan, uji friabilitas,
uji waktu hancur secara in vitro, uji waktu hancur di mulut,uji waktu pembasahan,
uji absorbsi air, uji penetapan kadar zat berkhasiat, uji keseragaman kandungan
dan uji disolusi (profil pelepasan obat).
Evaluasi terhadap ODT metoklopramida HCl dilakukan untuk mengetahui
11,90 11,77 12,07 11,58 12,02 12,10 12,01
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00
F1 F2 F3 F4 F5 F6 F7
Inde
ks
T
ap
(
%
)
la san
4.2.1 Kekerasan
Dari Tabel 4.2 di atas dan Gambar 4.4 dapat dilihat nilai kekerasan tablet
dari masing-masing formula, dimana kekerasan tablet pada formula 1 adalah 1,60
kg; formula 2 sebesar 1,20 kg; formula 3 sebesar 1,11 kg; formula 4 sebesar 1,09
kg; formula 5 sebesar 1,02 kg; formula 6 sebesar 0,97 kg; formula 7 sebesar 0,96
kg.
Kekuatan tablet ditentukan dengan cara mengukur kekerasan dankeregasan
tablet. Uji kekerasan tablet merupakan salah satu parameter pentingdalam
masih memenuhi syarat kekerasan untuk ODT. Syaratkekerasan ODT adalah0,1-3
kg (Abu-Izza, et al., 2004).
Dapat dilihat bahwa tablet yang mengandung menthol dengan konsentrasi
lebih besar memiliki kekerasan tablet yang lebih rendah. Kekerasan dari tablet
akan menurun seiring bertambahnya jumlah dari komponen yang menguap
(menthol) karena bertambahnya porositas dari matriks tablet (Peter, et al., 2014).
Data hasil pengujiankekerasan tablet dapat dilihat pada Gambar 4.4.
Gambar 4.4.Diagram batang hasil uji kekerasan tablet
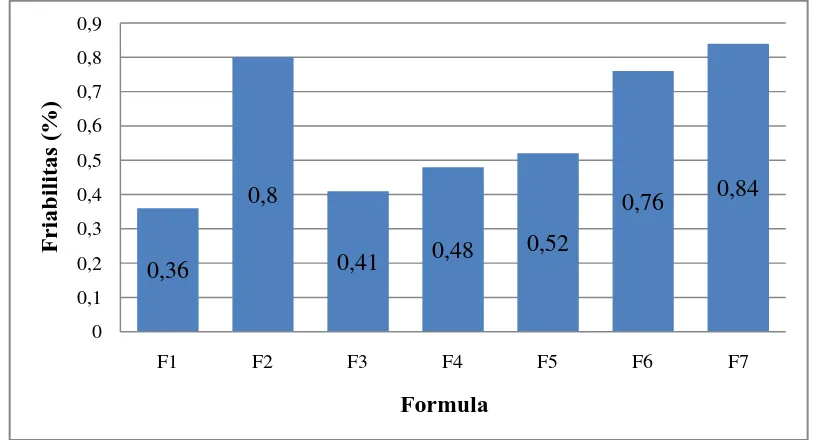
4.2.2 Friabilitas
Friabilitas memberi gambaran ketahanan tablet terhadap benturanmekanis
pada saat pengemasan dan pendistribusian.Nilai friabilitas yang besar
menunjukkan tablet yang rapuh. Hasil evaluasifriabilitas tablet dari Tabel 4.2 1,60
1,20 1,11 1,09
1,02 0,97 0,96
0,00 0,50 1,00 1,50 2,00
F1 F2 F3 F4 F5 F6 F7
K
ek
eras
an
(
k
g)
yang diperbolehkan adalah ≤ 0,9% (Sharma, et al., 2013).
Dapat dilihat bahwa tablet yang mengandung menthol dengan konsentrasi
lebih besar memiliki nilai friabilitas yang lebih besar. Penggunaan dari bahan
pensublimasi (menthol) menunjukkan bahwa terjadi peningkatan nilai friablitas
yang dikarenakan bertambahnya porositas dari tablet (Peter, et al., 2014).
Diagram hasil uji friabilitas tablet dapat dilihat pada Gambar 4.5.Contoh
perhitungan friabilitas ODT metoklopramida HCl dapat dilihat pada Lampiran 2,
halaman 55.
Gambar 4.5.Diagram batang hasil uji friabilitas tablet
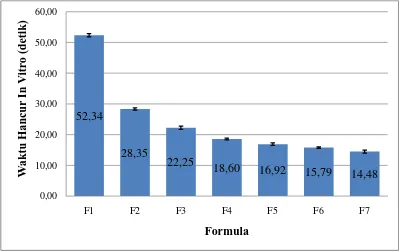
4.2.3 Waktu hancur ( in vitro, dan diatas lidah )
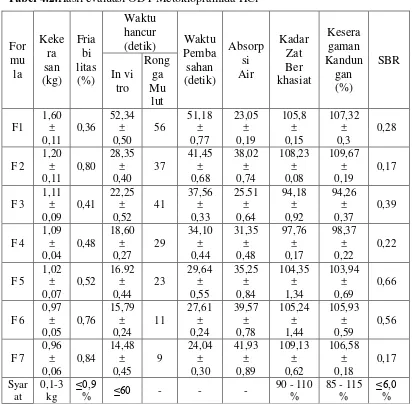
Hasil uji waktu hancur secara in vitro dapat dilihat pada Tabel 4.2 dan
diagram waktu hancur secara invitro pada Gambar 4.6. Dari data tersebut dapat
dilihat bahwa waktu hancur tablet dari semua formula memiliki waktu hancur
yang cepat, yaitu formula 1 sebesar 52,34 detik; formula 2 sebesar 28,35 detik; 0,36
0,8
0,41 0,48 0,52
0,76 0,84
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
F1 F2 F3 F4 F5 F6 F7
F
riabilit
as
(
%
)
Dapat dilihat bahwa waktu hancur tablet semakin menurun seiring
meningkatnya jumlah agen pensublimasi (menthol). Menthol sebagai agen
pensublimasi meningkatkan porositas dari tablet sehingga meningkatkan absorbsi
air yang membuat ODT larut (Kumar, et al., 2009).
Begitu pula dengan formula yang mengandung primogel dan menthol
yang paling banyak, memiliki waktu hancur yang lebih cepat dibandingkan
formula lainnya.Tablet yang mengandung primogel dan menthol memiliki waktu
hancur yang lebih cepat, mungkin disebabkan oleh aktivitas mengembang dan
pecah yang dapat memproduksi pembentukan gel (Vijayanand, et al., 2015),
sesuai dengan data formula 7 yang memiliki bobot tablet lebih rendah.Karena
bahan pengisinya lebih sedikit dibandingkan formula lainnya, maka hal ini
membuat waktu hancur semakin cepat.Diagram hasil uji waktu hancur in vitro
dapat dilihat pada Gambar 4.6.
52,34
28,35
22,25
18,60 16,92 15,79
14,48
10,00 20,00 30,00 40,00 50,00 60,00
W
ak
tu H
an
cur
I
n V
it
ro
(de
ti
Hancur (detik)
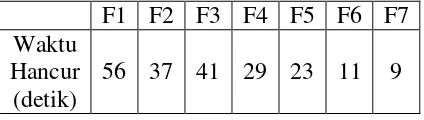
56 37 41 29 23 11 9
Berdasarkan tabel 4.3 dapat dilihat bahwa uji waktu hancur diatas lidah
yang tercepat adalah formula 7, hal ini mungkin disebabkan karena pada formula
7 menggunakan bahan penghancur primogel dan bahan pensublimasimenthol
yang paling besar sehingga menyebabkan ODT semakin cepat hancur karena
primogel memiliki kemampuan menarik air yang baik dan juga karena
peningkatan porositas dari tablet akibat pengunaan bahan pensublimasi. Dapat
dilihat juga bahwa formula 2 dan 7 memiliki bobot yang paling rendah. Karena
bahan pengisi tablet lebih sedikit dibandingkan formula lainnya, maka hal tersebut
dapat mempercepat waktu hancur diatas lidah.
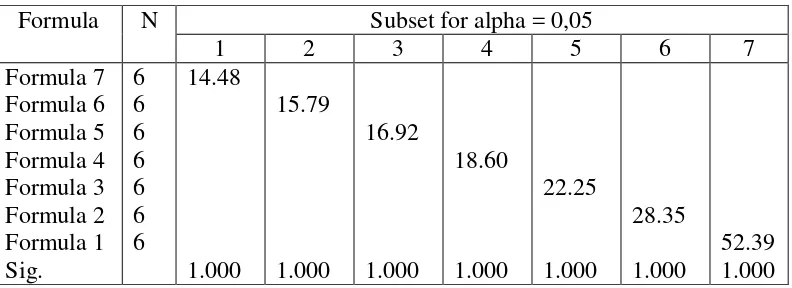
4.2.4 Hasil uji ANOVA dan duncanwaktu hancur in vitro formula ODT
Berdasarkan data waktu hancur dari berbagai formula ODT, untuk
mengetahui apakah ada perbedaan yang signifikan atau bermakna dari waktu
hancur pada semua formula maka dilakukan uji statistik ANOVA menggunakan
program SPSS 18,0 dengan p < 0,05 pada Tabel 4.4.
Tabel 4.4. Hasil uji anova waktu hancur formula ODT Sum of
Squares df Mean Square F Sig.
Between Groups 6391.199 6 1065.200 6255.806 ,000
Within Groups 5.960 35 .170
Total 6397.159 41
Dari hasil uji ANOVA diatas dapat diketahui bahwa terdapat perbedaan
dilakukan juga uji duncan.
Tabel 4.5. Hasil uji duncan evaluasi waktu hancur
Formula N Subset for alpha = 0,05
Dari hasil uji duncan pada Tabel 4.5 diatas maka dapat diketahui bahwa
terdapat perbedaan yang signifikan terhadap semua formula.
4.2.5 Waktu pembasahan
Proses disolusi suatu tablet tergantung pada pembasahan tablet yangdiikuti
dengan disintegrasi tablet, maka waktu pembasahan merupakan salahsatu
parameter penting dalam evaluasi ODT (Rao dan Gandhi, 2009). Zat berkhasiat
akan terdisolusi setelah mengalami proses pembasahan dan disintegrasi tablet
sangat terpengaruh pada proses pembasahan.
Berdasarkan Tabel 4.2 halaman 33 dan Gambar 4.7 dapat dilihat hasil
evaluasi waktu pembasahan tablet yaitu pada formula 1 sebesar 51,18 detik;
formula 2 sebesar 41,45 detik; formula 3 sebesar 37,56 detik; formula 4 sebesar
34,10 detik; formula 5 sebesar 29,64 detik; formula 6 sebesar 27,61 detik; formula
formula lainnya, maka hal ini membuat waktu pembasahan semakin cepat.
Diagram hasil uji waktu pembasahan dapat dilihat pada Gambar 4.7.
Gambar 4.7.Diagram batang hasil uji waktu pembasahan
4.2.6 Uji absorbsi air
Absorbsi air juga merupakan parameter penting dalam evaluasipengujian
tablet ODT (Rao dan Gandhi, 2009).Pada Tabel 4.2 halaman 33 dan Gambar 4.8
dapat dilihat bahwa absorbsi air tablet dari semua formula, yaitu pada formula 1
sebesar 23,05%; formula 2 sebesar 38,02%; formula 3 sebesar 25,51%; formula 4
sebesar 31,35%; formula 5 sebesar 35,25%; formula 6 sebesar 39,57%; formula 7
sebesar 41,93%.
Dapat dilihat bahwa absorpsi meningkat seiring meningkatnya jumlah
bahan pensublimasi (menthol) karena adanya peningkatan porositas tablet. Dapat
dilihat pula bahwa tablet yang mengandung primogel dan menthol dengan jumlah
paling banyak memiliki absorbsi air yang lebih besar dibandingkan dengan yang
hanya menggunakan menthol saja. Tablet yang mengandung primogel memiliki
absorbsi air yang lebih besar, mungkin disebabkan oleh primogel yang dapat 51,18
41,45 37,56 34,10
29,64 27,61 24,04
0,00 10,00 20,00 30,00 40,00 50,00 60,00
F1 F2 F3 F4 F5 F6 F7
W
ak
tu P
em
bas
ah
an
(d
eti
k
)
bahan pengisi tablet lebih sedikit dibandingkan formula lainnya, maka hal tersebut
dapat meningkatkan absorpsi air dalam waktu yang cepat.
Diagram hasil uji absorbsi air dapat dilihat pada Gambar 4.8.Contoh
perhitungan absorbsi air ODT metoklopramida HCl dapat dilihat pada Lampiran
3, halaman 56.
Gambar 4.8.Diagram batang hasil uji absorbsi air
4.2.7 Penentuan kurva serapan dan pembuatan kurva kalibrasi metoklopramida HCldalam dapar fosfat pH 6,8
4.2.7.1 Hasil penentuan panjang gelombang maksimum dalam dapar fosfat pH 6,8
Menurut Deepak (2011), metoklopramida HCl memberikan
serapanmaksimum dalam pelarut dapar fosfat pH 6,8 pada panjang gelombang 23,05
38,02
25,51 31,35
35,25 39,57
41,93
0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00 45,00
F1 F2 F3 F4 F5 F6 F7
Ab
sorp
si
Ai
r
(%
)
yang linier antara serapan dan konsentrasi dan dari hasil pengukuran diperoleh
persamaan regresi Y = 0.03632 X + 0.00087. Gambarkurva kalibrasi
metoklopramida HClbaku pembanding dapat dilihat pada Lampiran 6, halaman
59.
4.2.8 Penentuan kadarmetoklopramida HCldalam tablet
Berdasarkan hasil penentuan kadar metoklopramida HCldalam ODT untuk
formula 1 sebesar 105,80% ± 0,15; formula 2 sebesar 108,23% ± 0,08; formula 3
sebesar 94,18% ± 0,92; formula 4 sebesar 97,76% ± 0,17; formula 5 sebesar
104,35% ± 1,34; formula 6 sebesar 105,24% ± 1,44; formula 7 sebesar 109,13% ±
0,62. Ternyata kadar yang diperoleh ini memenuhi persyaratan kadar yang tertera
yaitu tablet metoklopramida HCl mengandung zat berkhasiat tidak kurang dari
90,0% dan tidak lebih dari hingga 110,0% dari yang tertera pada etiket (United
States Pharmacopeia, 2004).
Diagram hasil uji penetapan kadar dapat dilihat pada Gambar 4.9.
Gambar 4.9.Diagram batang hasil uji penetapan kadar
4.2.9 Keseragaman kandungan
105,8 108,23
94,18 97,76
104,35 105,24 109,13
85 90 95 100 105 110 115
F1 F2 F3 F4 F5 F6 F7
K
ad
ar
M
et
ok
lop
ram
id
a
HC
l (
%
)
kurang dari 50% dari bobot satuan sediaan, maka pengujian dilakukandengan uji
keseragaman kandungan.Dari hasil penentuan keseragaman kandungan
metoklopramida HCl dalam ODT untuk formula 1 sebesar 107,32% ± 0,30;
formula 2 sebesar 109,67% ± 0,18; formula 3 sebesar 94,26% ± 0,37; formula 4
sebesar 98,37% ± 0,22; formula 5 sebesar 103,94% ± 0,69; formula 6 sebesar
105,93% ± 0,59; formula 7 sebesar 106,58% ±0,18. Hasil yang diperoleh
memenuhi persyaratan keseragaman kandungan menurut Farmakope Indonesia
Edisi IV (1995) yaitu antara 85% hingga 115% dari yang tertera pada etiket.
Diagram hasil uji keseragaman kandungan dapat dilihat pada Gambar 4.10.
Gambar 4.10.Diagram hasil uji keseragaman kandungan
4.2.10 Disolusi
Uji disolusi dari ke-7 formulasi ODT metoklopramida HCl dilakukan pada
107,32 109,67
94,26 98,37
103,94 105,93 106,58
85 90 95 100 105 110 115
F1 F2 F3 F4 F5 F6 F7
K
es
er
agam
an
K
an
d
u
n
gan
(
%
)
HCl
0 0 0 0 0 0 0 0 0
3 95.49 90.99 91.4 92.4 93.07 93.5 93.9 94.64
6 96.19 91.85 92.83 93.64 94.15 94.88 94.9 95.37
9 97.13 92.78 94.27 94.77 95.06 95.48 95.89 95.92
12 98.23 94.03 95.33 95.59 95.80 96.47 96.65 96.54
15 99.47 95.31 96.60 96.80 96.80 97.65 97.66 97.67
Gambar 4.11. Grafik hasil persen kumulatif rata-rata disolusi tablet metoklopramida HCldari berbagai formula
Uji pelepasan obat secara in vitro dengan Dissolution Tester dari serbuk
metoklopramida HCl dan semua formulasi ODT dapat dilihat pada Tabel
4.6.Dapat dilihat secara keseluruhan bahwa persentasi kumulatif formula ODT
lebih rendah dibanding serbuk metoklopramida HCl. Hal ini terjadi mungkin
karena zat aktif membutuhkan waktu untuk dapat terlepas dari bahan pengisinya.
Dapat dilihat juga formula 2 dan 7 memiliki bobot tablet yang paling rendah. Hal
0 20 40 60 80 100
0 3 6 9 12 15
%
K
u
m
u
lat
if
Waktu (menit)
Profil Disolusi
Serbuk
Formula 1
Formula 2
Formula 3
Formula 4
Formula 5
Formula 6
apakahadaperbedaan bermakna dari profil disolusi pada semua formula maka
dilakukan uji statistik ANOVA mengggunakan program SPSS 18,0 dengan p <
0,05.
4.2.10.1 Hasil uji disolusi pada menit ke-3 berdasarkan uji statistik ANOVAdan duncan
Berdasarkan hasil uji disolusi yang diperoleh dari berbagai formula pada
menit ke-3, untuk mengetahui apakah ada perbedaan yang signifikan atau
bermakna dari uji disolusi pada semua formula maka dilakukan uji statistik
ANOVA menggunakan program SPSS 18,0 dengan p < 0,05 pada Tabel 4.7.
Tabel 4.7. Uji ANOVA disolusi menit ke-3 Sum of
Squares df
Mean
Square F Sig.
Between Groups 99.958 7 14.280 99.720 .000
Within Groups 5.728 40 143
Total 105.686 47
Berdasarkan hasil uji statistik ANOVA pada uji disolusi menit ke-3 dapat
diketahui bahwa terdapat perbedaan bermakna atau signifikan antara serbuk
metoklopramida HCl, ODTformula 1, formula 2, formula 3, formula 4, formula 5,
formula 6, dan formula 7 karena p = 0,000 (p < 0,05). Untuk mengetahui
dimanakah letak perbedaan bermakna / signifikan dari formula maka dilakukan
juga uji duncan.
Berdasarkan hasil uji duncan pada menit ke-3 dapat diketahui bahwa tidak
Formula 2
4.2.10.2. Hasil uji disolusi pada menit ke-9 berdasarkan uji statistik ANOVA dan duncan
Berdasarkan hasil uji disolusi yang diperoleh dari berbagai formula pada
menit ke-9, untuk mengetahui apakah ada perbedaan yang signifikan atau
bermakna dari uji disolusi pada semua formula maka dilakukan uji statistik
ANOVA dengan menggunakan program SPSS 18,0 dengan p < 0,05 pada Tabel
4.9.
Tabel 4.9. Uji ANOVA disolusi menit ke-9 Sum of
Berdasarkan hasil uji statistik ANOVA pada uji disolusi menit ke-9 dapat
diketahui bahwa terdapat perbedaan bermakna atau signifikan antara serbuk
metoklopramida HCl, ODTformula 1, formula 2, formula 3, formula 4, formula 5,
formula 6, dan formula 7 karena p = 0,000 (p < 0,05). Untuk mengetahui
dimanakah letak perbedaan bermakna / signifikan dari formula maka dilakukan
1 2 3 4 5 6
Berdasarkan hasil uji Duncan maka dapat diketahui pada menit ke-9
terdapat perbedaan bermakna pada formula 1 dan serbuk metoklopramida HCl
terhadap semua formula. Sedangkan untuk formula 2 dengan formula 3, formula 3
dengan formula 4, formula 4 dengan formula 5; formula 5, formula 6 dengan
formula 7 tidak terdapat perbedaan yang bermakna.
4.2.10.3 Hasil uji disolusi pada menit ke-15berdasarkan uji statistik ANOVA dan duncan
Berdasarkan hasil uji disolusi yang diperoleh dari berbagai formula pada
menit ke-15, untuk mengetahui apakah ada perbedaan yang signifikan atau
bermakna dari uji disolusi pada semua formula maka dilakukan uji statistik
ANOVA menggunakan program SPSS 18,0 dengan p < 0,05 pada Tabel 4.11.
Tabel 4.11. Uji ANOVA disolusi menit ke-15 Sum of
Formula N Subset for alpha = 0,05
Berdasarkan hasil uji Duncan maka dapat diketahui pada menit ke-15
terdapat perbedaan bermakna pada formula 1 dan serbuk metoklopramida HCl
terhadap semua formula. Sedangkan untuk formula 2, formula 3 dengan formula
4; formula 5, formula 6 dengan formula 7 tidak ada perbedaan bermakna atau
signifikan. Untuk hasil uji statistik ANOVA dan uji Duncan pada menit ke-6 dan
12 dapat kita lihat pada bagian Lampiran 16, halaman 98.
Tabel 4.13. Hasil AUC
Jenis Formula AUC (%.menit)
Serbuk Metoklopramida HCl 1310,313
Formula 1 1251,908
Formula 2 1266,385
Formula 3 1273,8
Formula 4 1279,433
Formula 5 1287,423
Formula 6 1290,503
Formula 7 1293,92
Berdasarkan Tabel 4.13 dapat dilihat bahwa jumlah metoklopramida HCl
yang terlepas ke dalam medium lebih besar pada formula 7 yang mengandung
primogel dan menthol yang paling banyak dibandingkan formula lainnya dan
terdapat bahan penghancur dan bahan pensublimasi. Bahan pensublimasi dapat
meningkatkan disolusi dari ODT dikarenakan bertambahnya porositas dari tablet
(Peter, et al., 2014). Dapat kita lihat juga bahwa formula 2 dan 7 memiliki bobot
tablet yang paling rendah dibanding formula lainnya. Hal ini dapat meningkatkan
AUC karena waktu yang dibutuhkan metoklopramida HCl untuk dapat terlepas
dari bahan pengisi semakin cepat karena jumlah bahan pengisinya lebih sedikit
dibandingkan formula lainnya.
4.2.11 Uji berat tablet setelah sublimasi
Uji ini dilakukan dengan menghitung berat tablet sebelum dan setelah
sublimasi sehingga diperoleh berapa persen menthol yang tersublimasi, berapa
persen menthol yang tersisa dalam tablet, dan berapa persen keberhasilan
sublimasi.
Tabel 4.14. Hasil uji berat tablet setelah sublimasi Jenis
Formula
% Menthol yang tersublimasi
% Menthol yang tersisa
% Keberhasilan Proses Sublimasi
Formula 1 - - -
Formula 2 12,28 0,22 98,24
Formula 3 2,33 0,17 93,20
Formula 4 4,81 0,19 98,53
Formula 5 7,39 0,11 98,53
Formula 6 9,75 0,25 97,5
Formula 7 12,38 0,12 99,04
Berdasarkan beberapa pengujian yang telah dilakukan, maka kesimpulan
untuk penelitian ini adalah:
1. Diperolehlah hasil penelitian sebagai berikut yakni kekerasan 0,96-1,60
kg; friabilitas 0,36-0,84%; waktu hancur in vitro 14,48-52,34 detik; waktu
hancur pada lidah 9-56 detik; waktu pembasahan 24,04-51,18 detik;
absorpsi air 23,05-41,93%; kadar zat berkhasiat 94,18-109,19%;
keseragaman kandungan 94,26-109,67%; SBR sebesar 0,17-0,66%.
2. Semakin meningkatnya konsentrasi menthol maka akan mempercepat
waktu hancur ODT dan juga menghasilkan persen kumulatif pelepasan
metoklopramida HCl yang semakin meningkat tetapi pelepasan obat
tersebut tetap lebih rendah dibandingkan serbuk metoklopramida HCl.
5.2 Saran
1. Untuk peneliti selanjutnya, disarankan untuk melakukan uji in vivo
terhadap ODT.
2. Untuk peneliti selanjutnya, disarankan untuk melihat apakah ada pengaruh
2.1 Metoklopramida HCl 2.1.1 Uraian bahan
Rumus bangun :
Rumus molekul : C14H22ClN3O2.HCl.H2O
Berat molekul : 354,3
Nama kimia :
4-amino-5-kloro-N-[2-(dietilamino)etil]-2-metoksibenzamida hidroklorida
Pemerian : Serbuk putih atau hampir putih
Kelarutan : Sangat mudah larut dalam air, mudah larut dalam etanol,
agak sukar larut dalam kloroform, praktis tidak larut dalam
eter
Titik Lebur : 182,5º - 184ºC (Moffat, et al., 2011).
pKa : 9,3 (Moffat, et al., 2011)
2.1.2 Farmakologi metoklopramida HCl
Antiemetika digolongkan sesuai afinitasnya terhadap reseptor-reseptor dari