FORMULASI ORALLY DISINTEGRATING TABLET (ODT)
DOMPERIDON MENGGUNAKAN SUPERDISINTEGRAN
KROSPOVIDON DAN PRIMOGEL DENGAN
METODE SUBLIMASI
SKRIPSI
OLEH:
JULIYANTI
NIM 111501042
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
FORMULASI ORALLY DISINTEGRATING TABLET (ODT)
DOMPERIDON MENGGUNAKAN SUPERDISINTEGRAN
KROSPOVIDON DAN PRIMOGEL DENGAN
METODE SUBLIMASI
SKRIPSI
OLEH:
JULIYANTI
NIM 111501042
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
2015
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
PENGESAHAN SKRIPSI
FORMULASI ORALLY DISINTEGRATING TABLET (ODT)
DOMPERIDON MENGGUNAKAN SUPERDISINTEGRAN
KROSPOVIDON DAN PRIMOGEL DENGAN
METODE SUBLIMASI
OLEH:
JULIYANTI
NIM 111501042
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 18 Juni 2015
Medan, Juli 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
Prof. Dr. Julia Reveny, M.Si., Apt. NIP 195807101986012001
Disetujui Oleh: Pembimbing I,
Dra. Fat Aminah, M.Sc., Apt. NIP 195011171980022001
Pembimbing II,
Dra. Juanita Tanuwijaya, M.Si., Apt. NIP 195111021977102001
Panitia Penguji,
Prof. Dr. Karsono, Apt.
NIP 195409091982011001
iv
KATA PENGANTAR
Puji syukur ke hadirat Tuhan Yang Maha Kuasa yang telah memberikan
berkah karunia yang berlimpah sehingga penulis dapat meyelesaikan penyusunan
skripsi yang berjudul Formulasi Orally Disintegrating Tablet (ODT) Domperidon
Menggunakan Superdisintegran Krospovidon dan Primogel dengan Metode
Sublimasi. Skripsi ini diajukan untuk melengkapi salah satu syarat untuk
memperoleh gelar Sarjana Farmasi di Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini, dengan segala kerendahan hati penulis mengucapkan
terima kasih kepada Ibu Dra. Fat Aminah, M.Sc., Apt. dan Ibu Dra. Juanita
Tanuwijaya, M.Si., Apt., selaku dosen pembimbing yang telah mengarahkan
penulis dengan penuh kesabaran dan tanggung jawab, memberikan petunjuk dan
saran-saran selama penelitian hingga selesainya skripsi ini. Penulis mengucapkan
terima kasih kepada Bapak Prof. Dr. Sumadio Hadisaputra, Apt., selaku Dekan
Fakultas Farmasi dan Ibu Prof. Dr. Julia Reveny, M.Si., Apt., selaku Wakil Dekan
I yang telah memberikan fasilitas selama masa pendidikan dan penelitian. Penulis
juga menyampaikan ucapan terima kasih kepada Bapak Prof. Dr. Karsono, Apt.
selaku ketua penguji, Bapak Drs. Agusmal Dalimunthe, M.S., Apt., dan Bapak
Drs. Suryanto, M.Si., Apt., selaku anggota penguji yang telah memberikan saran
dan arahan untuk menyempurnakan skripsi ini serta Ibu Aminah Dalimunthe,
M.Si., Apt., selaku dosen penasehat akademik yang telah banyak membimbing
v
Penulis mengucapkan terima kasih dan penghargaan yang tiada terhingga
kepada Ayahanda Tjin Moij dan Ibunda Suryani yang telah memberikan cinta dan
kasih sayang yang tidak ternilai dengan apapun, pengorbanan baik materi maupun
motivasi beserta doa yang tulus yang tidak pernah berhenti, kakakku tercinta
Juliana, dan adikku tercinta Indriyani serta seluruh keluarga yang selalu
mendoakan dan memberikan semangat. Penulis dengan tulus mengucapkan terima
kasih kepada abang-kakak senior, sahabat tercinta Jelsen Tjandra, Sri Wahyuni,
Linda Margata, Jeriko Anggono, Ardiansyah, dan sahabat lainnya yang tidak
dapat disebutkan satu persatu terutama kawan-kawan Farmasi angkatan 2011.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih
jauh dari kesempurnaan, Oleh karena itu dengan segala kerendahan hati, penulis
menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis
berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, Juni 2015
Penulis,
Juliyanti
vi
FORMULASI ORALLY DISINTEGRATING TABLET (ODT) DOMPERIDON MENGGUNAKAN SUPERDISINTEGRAN KROSPOVIDON DAN PRIMOGEL DENGAN METODE SUBLIMASI
ABSTRAK
Latar Belakang: Metode sublimasi adalah salah satu teknik pembuatan Orally
Disintegrating Tablet yang berdasarkan prinsip untuk meningkatkan porositas dan/atau penambahan superdisintegran dan bahan tambahan yang larut dalam air kedalam tablet. Oleh karena itu, perlu dikembangkan suatu formulasi Orally Disintegrating Tablet (ODT) yang memenuhi persyaratan.
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh camphora terhadap
waktu hancur dan disolusi Orally Disintegrating Tablet yang mengandung domperidon sebagai bahan obat.
Metode: Pada penelitian ini dibuat Orally Disintegrating Tablet dengan metode
sublimasi yang mengandung domperidon sebagai bahan obat dengan superdisintegran krospovidon dan primogel dengan bahan volatil camphora. Konsentrasi camphora yang diformulasi yaitu 5, 10, dan 15%. Orally Disintegrating Tablet yang telah diformulasi diuji yaitu uji preformulasi meliputi waktu alir, sudut diam, dan indeks tap; dan uji evaluasi meliputi kekerasan, friabilitas, waktu hancur, waktu pembasahan, absorbsi air, penetapan kadar, keseragaman kandungan, dan disolusi.
Hasil: Dari hasil penelitian menunjukkan bahwa Orally Disintegrating Tablet
domperidon memenuhi persyaratan British Pharmacopoeia untuk uji waktu hancur. Uji waktu hancur dan uji disolusi menunjukkan adanya perbedaan yang signifikan antara semua formula Orally Disintegrating Tablet domperidon yang diuji (p < 0,05). Waktu hancur formula 1 (18,68 detik), formula 2 (17,11 detik), formula 3 (15,31 detik), formula 4 (14,13 detik), formula 5 (14,93 detik), formula 6 (13,09 detik), formula 7 (12,22 detik), formula 8 (16,13 detik), formula 9 (14,37 detik), dan formula 10 (13,83 detik). Hasil uji disolusi pada menit ke-3 memiliki persen kumulatif: formula 1 (18,77%), formula 2 (20,62%), formula 3 (20,70%), formula 4 (23,40%), formula 5 (35,71%), formula 6 (26,23%), formula 7 (29,36%), formula 8 (26,68%), formula 9 (24,26%), dan formula 10 (22,40%).
Kesimpulan: Hasil penelitian ini menunjukkan bahwa camphora mempercepat
waktu hancur tetapi tidak mempercepat disolusi dari Orally Disintegrating Tablet domperidon.
vii
FORMULATION ORALLY DISINTEGRATING TABLET (ODT) OF DOMPERIDONE USING SUPERDISINTEGRANT CROSSPOVIDONE
AND PRIMOGEL WITH SUBLIMATION METHOD
ABSTRACT
Background: Sublimation method is one of techniques for preparing Orally
Disintegrating Tablet that based on principle can increase porous structure in the tablets and/or adding superdisintegrant and other water soluble ingredients into tablets. Hence, it is necessary to develop a formulation of Orally Disintegrating Tablet that fulfilled the requirement.
Purpose: The aim of this study was to evaluate the effect of Camphor to
disintegrating time and dissolution of Orally Disintegrating Tablet containing domperidone as drug.
Methods: In this study, Orally Disintegrating Tablets were formulated by
sublimation method with domperidone as drug using superdisintegrant crosspovidone and primogel and camphor as sublimating agent. In this formulation, camphor (5, 10, and 15%) was used as sublimating agent. The prepared formulations were evaluated by preformulation test for flow time, angle of repose, and tapped index; and physical characteristic for hardness, friability, disintegration time, wetting time, water absorption, drug content, uniformity of content, and dissolution.
Results: The result showed that Orally Disintegrating Tablet domperidone
suitable to characteristic British Pharmacopoeia to disintegration time. Disintegration time test and dissolution test showed a significant differences between all the formulas Orally Disintegrating Tablet domperidone characterized by values (p < 0.05). Disintegration time for formula 1 (18.68 second), formula 2 (17.11 second), formula 3 (15.31 second), formula 4 (14.13 second), formula 5 (14.93 second), formula 6 (13.09 second), formula 7 (12.22 second), formula 8 (16.13 second), formula 9 (14.37 second), and formula 10 (13.83 second). The results of dissolution test in the third minute to have a cumulative percent: formula 1 (18.77%), formula 2 (20.62%), formula 3 (20.70%), formula 4 (23.40%), formula 5 (35.71%), formula 6 (26.23%), formula 7 (29.36%), formula 8 (26.68%), formula 9 (24.26%), and formula 10 (22.40%).
Conclusion: The results of this study show that camphor can accelerate
disintegrating time, but not the dissolution of Orally Disintegrating Tablet (ODT) domperidone.
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Domperidon ... 6
2.1.1 Uraian bahan ... 6
2.1.2 Farmakologi Domperidon ... 6
2.1.3 Efek samping ... 7
ix
2.1.5 Sediaan ... 8
2.2 Orally Disintegrating Tablet (ODT) ... 8
2.2.1 Pengertian ... 8
2.2.2 Karakteristik ideal ODT ... 9
2.2.3 Kelebihan dan kekurangan formulasi ODT ... 10
2.2.4 Teknologi forrmulasi ODT ... 11
2.2.4.1 Teknik paten ... 11
2.2.4.2 Teknik konvensional ... 12
2.3 Superdisintegrants ... 15
2.4 Uraian tentang Primogel ... 17
2.5 Uraian tentang Krospovidon ... 18
2.6 Uraian tentang Selulosa Mikrokristalin (Avicel) ... 19
2.7 Uraian tentang Camphora ... 19
2.8 Spektrofotometer ... 20
BAB III METODE PENELITIAN ... 23
3.1 Alat ... 23
3.2 Bahan ... 23
3.3 Prosedur Kerja ... 23
3.3.1 Pembuatan Orally Disintegrating Tablet Domperidon ... 23
3.3.2 Uji preformulasi ... 26
3.3.2.1 Waktu alir ... 26
3.3.2.2 Sudut diam ... 26
3.3.2.3 Indeks tap ... 26
x
3.3.3.1 Pembuatan larutan induk baku (LIB) ... 27
3.3.3.2 Penentuan kurva serapan Domperidon ... 27
3.3.3.3 Penentuan linearitas kurva kalibrasi Domperidon dalam etanol ... 27
3.4 Evaluasi Tablet ... 28
3.4.1 Penetapan kadar Domperidon dalam tablet ... 28
3.4.2 Uji kekerasan tablet ... 28
3.4.3 Uji friabilitas ... 29
3.4.4 Uji waktu hancur ... 29
3.4.5 Uji keseragaman kandungan ... 29
3.4.6 Uji disolusi tablet ... 30
3.4.7 Uji waktu pembasahan ... 32
3.4.8 Uji absorbsi air ... 32
3.4.9 Uji waktu hancur di mulut ... 33
3.5 Analisis Data secara Statistik ... 33
3.5.1 Uji stastistik terhadap evaluasi waktu hancur ... 34
3.5.2 Uji statistik terhadap profil pelepasan obat ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Uji Preformulasi Granul Domperidon ... 35
4.1.1 Uji waktu alir ... 35
4.1.2 Uji sudut diam ... 36
4.1.3 Uji indeks tap ... 37
4.2 Hasil Evaluasi ODT Domperidon ... 38
4.2.1 Kekerasan ... 49
xi
4.2.3 Waktu hancur in vitro ... 42
4.2.3.1 Waktu hancur di atas lidah ... 43
4.2.4 Hasil uji ANOVA dan uji duncan waktu hancur in vitro formula ODT ... 44
4.2.5 Waktu pembasahan ... 45
4.2.6 Uji absorbsi air ... 46
4.2.7 Penentuan kurva serapan dan linieritas kurva kalibrasi Domperidon dalam larutan HCl 0.1 N ... 48
4.2.7.1 Hasil penentuan panjang gelombang maksimum dalam HCl 0,1 N ... 48
4.2.7.2 Hasil penentuan linieritas kurva kalibrasi dalam HCl 0,1 N ... 48
4.2.8 Penentuan kadar Domperidon dalam tablet ... 48
4.2.9 Keseragaman kandungan ... 49
4.2.10 Disolusi ... 50
4.2.10.1 Hasil Uji disolusi pada menit ke-3 berdasarkan uji statistik ANOVA dan duncan ... 51
4.2.10.2 Hasil Uji disolusi pada menit ke-9 berdasarkan uji statistik ANOVA dan duncan ... 52
4.2.10.3 Hasil Uji disolusi pada menit ke-15 berdasarkan uji statistik ANOVA dan duncan ... 53
4.2.11 Uji berat tablet setelah sublimasi ... 55
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 57
DAFTAR PUSTAKA ... 58
xii
DAFTAR TABEL
Halaman
Tabel 3.1 Komposisi formulasi ODT Domperidon ... 25
Tabel 3.2 Kriteria penerimaan zat aktif yang larut dengan disolusi ... 32
Tabel 4.1 Hasil uji preformulasi granul Domperidon ... 35
Tabel 4.2 Hasil evaluasi ODT Domperidon ... 39
Tabel 4.3 Hasil uji waktu hancur di atas lidah ... 43
Tabel 4.4 Hasil uji ANOVA waktu hancur formula ODT ... 44
Tabel 4.5 Hasil uji duncan evaluasi waktu hancur ... 44
Tabel 4.6 Tabel hasil persen kumulatif rata-rata uji disolusi tablet ... 50
Tabel 4.7 Uji ANOVA disolusi menit ke – 3 ... 51
Tabel 4.8 Hasil uji duncan disolusi menit ke – 3 ... 52
Tabel 4.9 Uji ANOVA disolusi menit ke – 9 ... 52
Tabel 4.10 Hasil uji duncan disolusi menit ke – 9 ... 53
Tabel 4.11 Uji ANOVA disolusi menit ke – 15 ... 53
Tabel 4.12 Hasil uji duncan disolusi menit ke – 15 ... 54
Tabel 4.13 Tabel hasil AUC ... 55
xiii
DAFTAR GAMBAR
Halaman
Gambar 2.1 Proses sublimasi ... 14
Gambar 2.2 Proses aksi kapiler (wicking) ... 15
Gambar 2.3 Proses pengembangan (swelling) ... 16
Gambar 2.4 Proses perubahan bentuk (deformation) ... 16
Gambar 2.5 Proses perenggangan (repulsion) ... 17
Gambar 4.1 Diagram batang waktu alir ... 36
Gambar 4.2 Diagram batang sudut diam ... 37
Gambar 4.3 Diagram batang indeks tap ... 38
Gambar 4.4 Diagram batang hasil uji kekerasan tablet ... 40
Gambar 4.5 Diagram batang hasil uji friabilitas tablet ... 42
Gambar 4.6 Diagram batang hasil uji waktu hancur in vitro ... 43
Gambar 4.7 Diagram batang hasil uji waktu pembasahan ... 46
Gambar 4.8 Diagram batang hasil uji absorbsi air ... 47
Gambar 4.9 Diagram batang hasil uji penetapan kadar ... 49
Gambar 4.10 Diagram batang hasil uji keseragaman kandungan ... 50
xiv
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Perhitungan pembuatan Orally Disintegrating Tablet (ODT)
Domperidon ... 61
Lampiran 2 Contoh perhitungan friabilitas ODT Domperidon ... 62
Lampiran 3 Contoh perhitungan absorbsi air ODT Domperidon ... 63
Lampiran 4 Contoh perhitungan berat tablet setelah sublimasi ... 64
Lampiran 5 Kurva dan data serapan dari Domperidon baku pembanding konsentrasi 10 μg/ml dalam pelarut HCl 0,1N ... 65
Lampiran 6 Hasil penentuan persamaan regresi dari kurva kalibrasi Domperidon pada panjang gelombang 284 nm dalam pelarut HCl 0,1 N ... 66
Lampiran 7 Perhitungan kadar ODT Domperidon ... 67
Lampiran 8 Analisis data statistik untuk mencari kadar sebenarnya dari Domperidon dalam formulasi ODT ... 73
Lampiran 9 Data simpangan baku kadar tablet Domperidon ... 75
Lampiran 10 Perhitungan keseragaman kandungan tablet Domperidon ... 77
Lampiran 11 Data hasil keseragaman kandungan tablet Domperidon ... 79
Lampiran 12 Perhitungan disolusi ODT Domperidon ... 82
Lampiran 13 Data perhitungan uji disolusi semua formula ODT ... 84
Lampiran 14 Data % kumulatif disolusi semua formula ODT ... 104
Lampiran 15 Uji ANOVA disolusi ODT menit ke 3, 6, 9, 12, 15 ... 108
Lampiran 16 Sertifikat analisis Domperidon ... 113
Lampiran 17 Daftar distribusi nilai t ... 115
Lampiran 18 Gambar ODT Domperidon ... 116
vi
FORMULASI ORALLY DISINTEGRATING TABLET (ODT) DOMPERIDON MENGGUNAKAN SUPERDISINTEGRAN KROSPOVIDON DAN PRIMOGEL DENGAN METODE SUBLIMASI
ABSTRAK
Latar Belakang: Metode sublimasi adalah salah satu teknik pembuatan Orally
Disintegrating Tablet yang berdasarkan prinsip untuk meningkatkan porositas dan/atau penambahan superdisintegran dan bahan tambahan yang larut dalam air kedalam tablet. Oleh karena itu, perlu dikembangkan suatu formulasi Orally Disintegrating Tablet (ODT) yang memenuhi persyaratan.
Tujuan dari penelitian ini adalah untuk mengetahui pengaruh camphora terhadap
waktu hancur dan disolusi Orally Disintegrating Tablet yang mengandung domperidon sebagai bahan obat.
Metode: Pada penelitian ini dibuat Orally Disintegrating Tablet dengan metode
sublimasi yang mengandung domperidon sebagai bahan obat dengan superdisintegran krospovidon dan primogel dengan bahan volatil camphora. Konsentrasi camphora yang diformulasi yaitu 5, 10, dan 15%. Orally Disintegrating Tablet yang telah diformulasi diuji yaitu uji preformulasi meliputi waktu alir, sudut diam, dan indeks tap; dan uji evaluasi meliputi kekerasan, friabilitas, waktu hancur, waktu pembasahan, absorbsi air, penetapan kadar, keseragaman kandungan, dan disolusi.
Hasil: Dari hasil penelitian menunjukkan bahwa Orally Disintegrating Tablet
domperidon memenuhi persyaratan British Pharmacopoeia untuk uji waktu hancur. Uji waktu hancur dan uji disolusi menunjukkan adanya perbedaan yang signifikan antara semua formula Orally Disintegrating Tablet domperidon yang diuji (p < 0,05). Waktu hancur formula 1 (18,68 detik), formula 2 (17,11 detik), formula 3 (15,31 detik), formula 4 (14,13 detik), formula 5 (14,93 detik), formula 6 (13,09 detik), formula 7 (12,22 detik), formula 8 (16,13 detik), formula 9 (14,37 detik), dan formula 10 (13,83 detik). Hasil uji disolusi pada menit ke-3 memiliki persen kumulatif: formula 1 (18,77%), formula 2 (20,62%), formula 3 (20,70%), formula 4 (23,40%), formula 5 (35,71%), formula 6 (26,23%), formula 7 (29,36%), formula 8 (26,68%), formula 9 (24,26%), dan formula 10 (22,40%).
Kesimpulan: Hasil penelitian ini menunjukkan bahwa camphora mempercepat
waktu hancur tetapi tidak mempercepat disolusi dari Orally Disintegrating Tablet domperidon.
vii
FORMULATION ORALLY DISINTEGRATING TABLET (ODT) OF DOMPERIDONE USING SUPERDISINTEGRANT CROSSPOVIDONE
AND PRIMOGEL WITH SUBLIMATION METHOD
ABSTRACT
Background: Sublimation method is one of techniques for preparing Orally
Disintegrating Tablet that based on principle can increase porous structure in the tablets and/or adding superdisintegrant and other water soluble ingredients into tablets. Hence, it is necessary to develop a formulation of Orally Disintegrating Tablet that fulfilled the requirement.
Purpose: The aim of this study was to evaluate the effect of Camphor to
disintegrating time and dissolution of Orally Disintegrating Tablet containing domperidone as drug.
Methods: In this study, Orally Disintegrating Tablets were formulated by
sublimation method with domperidone as drug using superdisintegrant crosspovidone and primogel and camphor as sublimating agent. In this formulation, camphor (5, 10, and 15%) was used as sublimating agent. The prepared formulations were evaluated by preformulation test for flow time, angle of repose, and tapped index; and physical characteristic for hardness, friability, disintegration time, wetting time, water absorption, drug content, uniformity of content, and dissolution.
Results: The result showed that Orally Disintegrating Tablet domperidone
suitable to characteristic British Pharmacopoeia to disintegration time. Disintegration time test and dissolution test showed a significant differences between all the formulas Orally Disintegrating Tablet domperidone characterized by values (p < 0.05). Disintegration time for formula 1 (18.68 second), formula 2 (17.11 second), formula 3 (15.31 second), formula 4 (14.13 second), formula 5 (14.93 second), formula 6 (13.09 second), formula 7 (12.22 second), formula 8 (16.13 second), formula 9 (14.37 second), and formula 10 (13.83 second). The results of dissolution test in the third minute to have a cumulative percent: formula 1 (18.77%), formula 2 (20.62%), formula 3 (20.70%), formula 4 (23.40%), formula 5 (35.71%), formula 6 (26.23%), formula 7 (29.36%), formula 8 (26.68%), formula 9 (24.26%), and formula 10 (22.40%).
Conclusion: The results of this study show that camphor can accelerate
disintegrating time, but not the dissolution of Orally Disintegrating Tablet (ODT) domperidone.
1
BAB I
PENDAHULUAN
1.1Latar Belakang
Bentuk sediaan tablet dan kapsul adalah bentuk sediaan obat solid (padat)
yang paling banyak digunakan saat ini. Namun diantara penggunaan keduanya,
tablet merupakan bentuk sediaan yang paling disukai karena mudah diproduksi,
mudah pengemasan begitu juga penggunaannya (Rao dan Gandhi, 2009).
Tablet terbagi menjadi beberapa jenis yaitu tablet kempa, tablet kempa
berulang, tablet salut gula, tablet salut film, tablet salut gelatin, tablet salut enterik,
tablet bukal dan sublingual, tablet kunyah, tablet effervescent, tablet triturasi,
tablet hipodermik, tablet dengan pelepasan segera, tablet cepat hancur atau cepat
larut, tablet dengan pelepasan terkontrol, dan tablet vaginal (Ansel, et al., 2011).
Orally Disintegrating Tablet adalah bentuk sediaan padat yang
mengandung bahan aktif obat yang hancur atau melarut dengan cepat dalam
waktu kurang dari 3 menit ketika diletakkan di atas lidah (British Pharmacopoeia,
2009). Waktu yang dibutuhkan orally disintegrating tablet untuk hancur
umumnya kurang dari 1 menit (Klancke, 2003).
Perkembangan teknologi terkini dalam dunia farmasi telah mendorong
para ilmuan untuk mengembangkan orally disintegrating tablet (ODT). ODT
adalah tablet yang didesain untuk cepat hancur di dalam rongga mulut ketika
diletakkan pada lidah dan berkontak dengan saliva tanpa perlu dikunyah atau
tanpa bantuan air minum untuk kemudian dapat melepaskan obat (Fu, et al.,
2004). ODT memberikan keuntungan terutama untuk pasien geriatri dan pediatri
2
sehingga dapat meningkatkan kepatuhan pasien geriatri dan pediatri. ODT juga
menawarkan keuntungan pada beberapa kasus seperti pada saat serangan alergi
tiba-tiba, dimana onset obat yang sangat cepat dibutuhkan (Bhowmik, et al.,
2009). Selain itu, sejumlah bagian obat juga mungkin diabsorbsi di daerah pra -
gastrik seperti mulut, faring, dan esophagus ketika air ludah turun ke lambung
sehingga ketersediaan hayati obat akan meningkat dan pada akhirnya juga
meningkatkan efektivitas terapi (Sharma, et al., 2011).
Tablet terdisintegrasi cepat menawarkan keuntungan dibandingkan dengan
tablet effervescent karena tablet terdisintegrasi cepat tidak seperti tablet
effervescent yang memerlukan media air untuk proses disintegrasi dan
disolusinya. Itu semua ditujukan untuk meningkatkan penerimaan pasien. Pada
formulasi tablet terdisintegrasi cepat yang dibuat juga memperhatikan rasa yang
dihasilkan dari produk tablet yang dibuat. Karena rasa yang manis pada tablet
akan membuat penerimaan pasien meningkat terutama pediatri dan geriatri yang
dalam tujuannya mencegah muntah (emesis) sehingga menggunakan bahan
pengisi manitol untuk meningkatkan rasa manis pada tablet ini dalam formulasi
tablet terdisintegrasi cepat (Kuccherkar, et al., 2003).
Metode sublimasi adalah salah satu teknik pembuatan Orally
Disintegrating Tablet yang berdasarkan prinsip untuk meningkatkan porositas
dan/atau penambahan superdisintegran dan bahan tambahan yang larut dalam air
kedalam tablet (Sutradhar, et al., 2012).
Untuk mendapatkan matriks berpori, bahan-bahan volatil ditambahkan
pada formulasi yang kemudian akan diproses dengan sublimasi. Bahan yang
3
camphora, dan urea dapat dikompresi bersama eksipien lainnya hingga
membentuk tablet. Bahan volatil ini kemudian dihilangkan dengan sublimasi dan
akan meningkatkan matriks yang berpori. Tablet yang dihasilkan dengan teknik
ini dilaporkan biasanya terdisintegrasi dalam waktu 10-20 detik (Bhowmik, et al.,
2009).
Sebelumnya telah dilakukan penelitian dengan menggunakan
superdisintegran Kollidon CL dan pengisi Kollidon 30, Ispaghula Husk, dan Guar
gam serta menggunakan Avicel pH 101 dengan zat aktif Domperidon. Setelah
tablet dicetak, tablet disublimasi pada suhu 60°C selama 6 jam. Tablet yang
diformulasi terdisintegrasi dalam waktu 20-40 detik (Sutradhar, et.al., 2012).
Domperidon telah digunakan secara luas sebagai obat anti-emetik,
domperidon digunakan sampai sekarang karena dinilai cukup aman dikarenakan
sedikitnya keluhan dan kasus dari konsumen (Parmar, et al. 2009).
Oleh karena hal tersebut, penelitian ini menggunakan domperidon sebagai
zat aktif dalam pembuatan tablet terdisintegrasi cepat dan diharapkan hasil dari
penelitian ini berguna untuk masyarakat banyak. Berdasarkan hal tersebut di atas,
peneliti mencoba membuat formulasi tablet dengan menggunakan
superdisintegran Primogel dan Krospovidon dan menggunakan bahan volatil yaitu
camphora dengan maksud untuk meningkatkan porositas dari tablet sehingga
mempercepat pecahnya tablet atau mempercepat waktu hancur tablet.
Adapun dasar pemilihan kedua superdisintegran ini yaitu berdasarkan
mekanismenya, dimana Primogel bekerja dengan cara mengembang sampai 7-12
4
mengabsorbsi cairan ke dalam pori-pori tablet melalui aksi kapiler yang
memperluas pori-pori dalam tablet (Bhowmik, et al., 2009).
1.2Perumusan Masalah
a. Apakah ada perbedaan waktu hancur antara semua formula Orally
Disintegrating Tablet (ODT) Domperidon.
b. Apakah ada pengaruh konsentrasi camphora terhadap waktu hancur dan
disolusi dari semua formula Orally Disintegrating Tablet (ODT)
Domperidon.
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian ini
adalah :
a. Terdapat perbedaan waktu hancur antara semua formula Orally
Disintegrating Tablet (ODT) Domperidon.
b. Terdapat pengaruh konsentrasi camphora yang signifikan terhadap waktu
hancur dan disolusi dari semua formula Orally Disintegrating Tablet
(ODT) Domperidon.
1.4 Tujuan Penelitian
Tujuan dari penelitian ini adalah :
a. Untuk mengetahui perbedaan waktu hancur antara semua formula Orally
Disintegrating Tablet (ODT) Domperidon.
b. Untuk mengetahui pengaruh konsentrasi camphora terhadap waktu hancur
dan disolusi dari semua formula Orally Disintegrating Tablet (ODT)
5
1.5Manfaat Penelitian
Penelitian ini diharapkan memberikan manfaat untuk meningkatkan
6
BAB II
TINJAUAN PUSTAKA
2.1 Domperidon
2.1.1 Uraian bahan
Rumus bangun :
Rumus molekul : C22H24ClN5O2
Berat molekul : 425,9
Nama kimia :
5-kloro-1-[1-[3-(2-okso-2,3-dihidro-1H-benzimidazol-1-il) propil] piperidin-4-il]-1,3-dihidro-2H-benzimidazol-2-on
Pemerian : Serbuk putih atau hampir putih
Kelarutan : Praktis tidak larut dalam air, larut dalam
dimetilformamida, sedikit larut etanol (96%) dan methanol
Titik Lebur : 242,5ºC (British Pharmacopeia, 2009).
pKa : 7,9 (Moffat, et al., 2005)
2.1.2 Farmakologi Domperidon
Domperidon merupakan antiemetik pilihan pertama di banyak negara.
Domperidon menjadi obat antiemetik dengan mekanisme kerja menghambat aksi
7
afinitas yang cukup kuat pada reseptor dopamin D2 dan D3 yang ditemukan
dalam CTZ (Chemoreseptor Trigger Zone) yang berada pada bagian luar sawar
darah otak yang meregulasi nausea dan vomit. Domperidon tidak dapat menembus
sawar darah otak sehingga tidak menimbulkan gangguan ekstrapiramidal sehingga
lebih aman digunakan bila dibandingkan metoklopramid. Domperidon juga efektif
dalam mengatasi gastroparesis, gastroesophageal pediatrik (muntah bayi). Saat
digunakan secara peroral, domperidon mengalami metabolisme lintas pertama di
lambung dan hepatik sehingga menghasilkan bioavailabilitas yang rendah (sekitar
15%) yang artinya pada konsentrasi tersebut tidak akan meminimalisir laju
muntah pada pasien (Champion, et al., 1986).
Walaupun domperidon dinyatakan lebih aman namun pemberiannya tetap
perlu mendapat perhatian khusus terutama karena ternyata domperidon memiliki
efek samping dapat merangsang kadar prolaktin plasma yang dalam jangka
panjang dapat menyebabkan galaktore dan ginekomastia. Di samping itu,
domperidon dilaporkan dapat menyebabkan reaksi alergi kulit seperti rush dan
urtikaria. Domperidon dikontraindikasikan dengan penderita yang hipersensitif
dengan domperidon, penderita prolaktinoma dan pada pasien yang mendapat
pendarahan, obstruksi mekanik perforasi gastrointestinal saat terdapat serangan
motilitas lambung (Champion, et al., 1986).
2.1.3 Efek samping
8
2.1.4 Dosis
Dispepsia fungsional: dewasa dan usia lanjut: 3 kali sehari 20-30 mg dan 10-20 mg sekali sebelum tidur malam tergantung respon klinik, pengobatan jangan melebihi 12 minggu. Dewasa dan usia lanjut: 20-30 mg dengan interval waktu 4-8 jam; anak-anak: 0,2-0,4 mg/kgBB sehari dengan interval waktu 4-8 jam; obat diminum 15-30 menit sebelum makan dan sebelum tidur malam (ISO, 2010).
2.1.5 Sediaan
Dalam perdagangan domperidon tersedia dalam bentuk tablet setara 10 mg, kaplet setara 10 mg, sirup setara 5 mg/5 ml, suspensi setara 5 mg/5 ml, dan drop setara 5 mg/ml (ISO, 2010).
2.2 Orally Disintegrating Tablet (ODT)
2.2.1 Pengertian
Bentuk sediaan padat banyak digunakan karena mudahnya pemberian,
memiliki dosis yang akurat dan dapat digunakan sendiri tanpa adanya rasa sakit.
Bentuk sedian padat yang umum adalah tablet dan kapsul, bentuk sediaan ini bagi
beberapa pasien sulit untuk ditelan. Pasien harus minum air untuk dapat menelan
bentuk sediaan tersebut. Pasien sering sekali merasa kesulitan dan tidak nyaman
dalam menelan tablet konvensional (Parmar, et al., 2009).
Adanya berbagai perubahan fungsi fisiologis terkait usia, termasuk
kesulitan menelan tablet secara utuh, akan menurunkan tingkat kepatuhan.
Kelompok pasien yang menjadi perhatian atas isu ini terutama adalah pediatri dan
geriatri (Rao dan Gandhi, 2009).
Banyak penelitian yang kemudian dikembangkan untuk mengatasi
masalah ini dan tablet cepat hancur di mulut (Orally Disintegrating Tablet) telah
9
2008). Sediaan ODT ini mempunyai beberapa karakteristik yang membedakannya
dari bentuk sediaan yang lain. Penutupan rasa adalah hal yang sangat penting
dalam formulasi ODT yang bisa diterima. Umumnya formulasi tablet tidak
dipengaruhi oleh penutupan rasa, karena diasumsikan bahwa sediaan tersebut
tidak akan melarut sampai sediaan tersebut melewati rongga mulut. Kebanyakan
suspensi oral, sirup, dan tablet kunyah hanya mengandung flavor dan pemanis lain
untuk menyamarkan rasa pahit obat pada sediaan (Kundu dan Sahoo, 2008).
Tablet terdisintegrasi cepat juga dikenal sebagai tablet yang meleleh di
mulut, tablet orodispersibel, rapid melt, melarut cepat, dan lain-lain. Tablet
terdisintegrasi cepat merupakan tablet yang ketika diletakkan pada lidah akan
terdisintegrasi secara instan melepaskan obat dan terlarut pada saliva. Semakin
cepat obat terlarut, semakin cepat obat diabsorbsi sehingga efek terapi dapat
tercapai. Beberapa obat diabsorpsi dari mulut, faring dan esophagus ketika saliva
turun menuju perut. Pada beberapa kasus, bioavailabilitas obat lebih besar
dibandingkan dengan sediaan tablet konvensional. Keuntungan yang dimiliki
tablet terdisintegrasi cepat dikenal dalam industri maupun akademik (Bhowmik,
et al., 2009).
2.2.2 Karakteristik ideal ODT
Oleh karena sediaan ODT berbeda dari tablet konvensional umumnya, sediaan
ODT hendaknya memiliki beberapa karakteristik yang ideal diantaranya yaitu (Fu,
et al., 2004):
a. Disintegrasi yang cepat. Secara umum, hal ini berarti bahwa disintegrasi tablet
ODT harus terjadi dalam waktu kurang dari 1 menit. Namun demikian, akan lebih
10
harus mengalami disintegrasi dengan sedikit atau tanpa meminum air sama sekali
dan dimaksudkan untuk melarut dengan air ludah pasien sendiri.
b. Penutupan rasa (taste-masking) dari senyawa aktif. Hal ini dikarenakan obat
ODT akan melarut atau mengalami disintegrasi di dalam mulut. Setelah melarut,
sediaan diharapkan tidak atau sedikit meninggalkan residu. Rasa yang tidak enak
di mulut kemudian menjadi persoalan yang kritis. Teknologi penutupan rasa yang
ideal hendaknya mampu menghasilkan mouth-feel yang baik dan tidak
memberikan sensasi berpasir (grittiness) di mulut.
c. Kekerasan dan porositas tablet yang optimal. Oleh karena ODT dirancang
memiliki waktu disintegrasi/disolusi yang cepat, dibutuhkan zat tambahan
(excipients) dengan derajat keterbasahan (wettability) yang tinggi dan struktur
tablet dengan porositas yang tinggi guna memastikan absorpsi air yang cepat ke
dalam tablet. Kekerasan tablet berbanding terbalik dengan porositasnya, maka
adalah hal penting untuk mendapatkan porositas tablet dengan absorpsi air yang
cepat tanpa mengurangi kekerasan tablet sehingga tidak mudah rusak selama
pengemasan dan pendistribusian dalam blister atau botol tablet konvensional.
d. Sensitifitas yang rendah terhadap kelembapan. ODT seringkali sensitif terhadap
kelembapan, hal ini dikarenakan zat tambahan dengan kelarutan dalam air yang
tinggi banyak digunakan dalam formulasi ODT. Untuk mengatasi hal ini,
diperlukan strategi pengemasan yang baik untuk melindungi tablet dari berbagai
pengaruh lingkungan.
2.2.3 Kelebihan dan kekurangan formulasi ODT
ODT memiliki beberapa kelebihan dan kekurangan. Kelebihan dari tablet
11
a. Diberikan tanpa air kapan pun dan dimana pun.
b. Mudah diberikan kepada pasien yang sulit menelan seperti penderita stroke,
pasien geriatri dan pediatri.
c. Keuntungan pada beberapa kasus seperti pada saat serangan alergi tiba-tiba, dan
pada saat mabuk perjalanan, dimana onset obat yang sangat cepat dibutuhkan.
d. Peningkatan bioavailabilitas pada obat-obat yang sukar larut dan hidrofobik,
karena disintegrasi dan disolusi yang cepat dari sediaan ini.
e. Rasa yang enak dimulut sehingga dapat mengurangi persepsi bahwa obat itu
pahit untuk anak-anak dan dengan rasa yang enak tersebut dapat pula
meningkatkan kepatuhan pasien.
f. Absorbsi pra-gastrik akan menghindari zat aktif dari metabolisme lintas pertama
di hati, sehingga dapat meningkatan bioavailabilitas obat dan dosis obat dapat
dikurangi; peningkatan terapi sebagai hasil pengurangan dari efek yang tidak
diinginkan.
Kekurangan dari tablet ODT diantaranya adalah:
a. Tablet biasanya tidak mempunyai kekuatan mekanik yang cukup. Oleh karena
itu penanganan yang hati-hati sangat dibutuhkan.
b. Tablet mungkin meninggalkan rasa yang tidak enak dimulut jika tidak
diformulasi dengan baik.
2.2.4 Teknologi formulasi tablet ODT
2.2.4.1 Teknik paten
Teknik paten adalah teknik yang sudah dipatenkan oleh beberapa industri
farmasi dalam memproduksi Orally Disintegrating Tablet (ODT).
12 a. Zydis oleh R.P.Scherer Inc.
b. Quicksolv oleh Jansen Pharmaceutical
c. Flashtab oleh Ethypharm
d. Lyoc oleh Farmlyoc
e. Orasolv oleh Cima Labs Inc.
f. Durasolv oleh Cima Lab Inc.
g. RapiTab oleh Schwarz Pharma
h. Wow Tab oleh Yamanouchi Pharma Technologies, Inc.
i. Fast melt oleh Elan Corp.
j. Ziplets oleh Eurand
k. FlashDose oleh Fuisz Technology Ltd.
l. Oraquick oleh KV Pharm, Co., Inc.
m. Advatab oleh Eurand International
2.2.4.2 Teknik konvensional
a. Freeze drying
Freeze drying merupakan proses dimana air disublimasi dari produk
setelah dibekukan. Teknik ini menciptakan suatu struktur amorf berpori yang
dapat melarut dengan cepat (Lailla dan Sharma, 1993).
Bahan aktif dilarutkan atau didispersikan dalam suatu larutan sebagai
carrier/polimer. Campuran ini ditimbang lalu dituang pada dinding kemasan
blister. Kemasan blister dilewatkan pada saluran pembeku nitrogen cair untuk
membekukan larutan obat. Kemudian kemasan blister beku diletakkan pada
lemari pembeku untuk melanjutkan pengeringan beku. Setelah pengeringan beku
13
Terakhir blister dikemas dan didistribusikan (Renon dan Corveleyn, 2000).
Teknik kering beku menunjukkan peningkatan absorbs dan meningkatkan
bioavailabilitas. Kekurangan utama dari teknik liofilisasi adalah mahal dan
membutuhkan waktu yang lama; kerapuhan membuat kemasan konvensional tidak
sesuai untuk produk ini dan stabilitas buruk pada kondisi di bawah tekanan
(Bhowmik, et al., 2009).
b. Tablet molding
Proses molding terbagi menjadi dua yaitu metode pelarut dan metode
panas. Metode pelarut dilakukan dengan membasahi campuran massa dengan
pelarut hidroalkohol kemudian dikompres dengan tekanan yang rendah. Tablet
yang terbentuk kemudian dikeringkan untuk menghilangkan pelarut yang
digunakan. Metode panas dilakukan dengan menyiapkan suspensi yang
mengandung bahan obat, agar-agar, dan gula (contohnya manitol atau laktosa)
lalu suspensi dituangkan ke dalam blister dan dibiarkan mengeras pada suhu
kamar sehingga terbentuk jelly dan kemudian dikeringkan secara vakum pada
suhu 30ºC (Bhowmik, et al., 2009).
c. Spray drying
Pada teknik ini, gelatin dapat digunakan sebagai bahan pendukung dan
sebagai matriks, maltodekstrin sebagai bahan pengisi dan Crosscarmellosa serta
crosspovidone digunakan sebagai superdisintegran. Tablet yang dibuat selama 20
detik dalam medium berair. Serbuk semprot kering ini yang dikompresi menjadi
tablet menunjukkan disintegrasi secara cepat dan meningkatkan disolusi
14 d. Sublimation (sublimasi)
Untuk mendapatkan matriks berpori, bahan-bahan volatil ditambahkan
pada formulasi yang kemudian akan diproses dengan sublimasi. Bahan yang
sangat mudah menguap seperti ammonium bikarbonat, ammonium karbonat,
camphora, dan urea dapat dikompresi bersama eksipien lainnya hingga
membentuk tablet. Bahan volatil ini kemudian dihilangkan dengan sublimasi dan
akan meningkatkan matriks yang berpori. Tablet yang dihasilkan dengan teknik
ini dilaporkan biasanya terdisintegrasi dalam waktu 10-20 detik (Bhowmik, et al.,
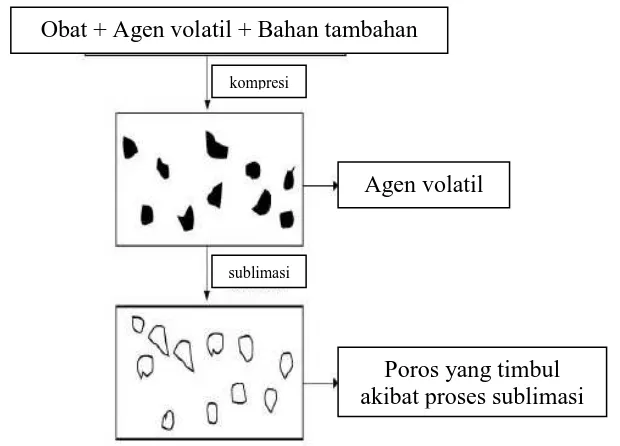
[image:30.595.175.485.334.557.2]2009).
Gambar 2.1. Proses sublimasi
e. Direct compression (cetak langsung)
Metode cetak langsung dapat digunakan untuk membuat sediaan ODT
dengan cara memilih kombinasi bahan tambahan yang tepat, yang mana dapat
menghasilkan disintegrasi cepat dan daya tahan fisik yang baik. Bahan tambahan
yang dimaksudkan di sini adalah bahan penghancur (disintegrant). Beberapa Agen volatil
kompresi
Obat + Agen volatil + Bahan tambahan
sublimasi
15
peneliti menggunakan bahan effervescent sebagai disintegrant, sementara yang
lain mengkombinasi berbagai disintegrant yang ada (Fu, et al., 2004).
f. Mass extrusion
Teknologi ini termasuk pencampuran aktif dengan menggunakan
campuran pelarut yang bercampur dengan air dari polietilen glikol (Bhowmik, et
al., 2009).
2.3 Superdisintegrants
Bahan penghancur atau superdisintegrants merupakan bahan utama dalam
formulasi ODT. Superdisintegrants ditambahkan untuk memudahkan pecahnya
atau hancurnya tablet saat kontak dengan air. Daya mengembang
superdisintegrants sangat tinggi dan cepat sehingga mampu mendesak kearah luar
secara cepat yang akan menyebabkan tablet cepat hancur. Terdapat 4 mekanisme
umum yang digunakan oleh superdisintegrants dalam mendistegrasikan tablet,
antara lain (Bhowmik, et al., 2009):
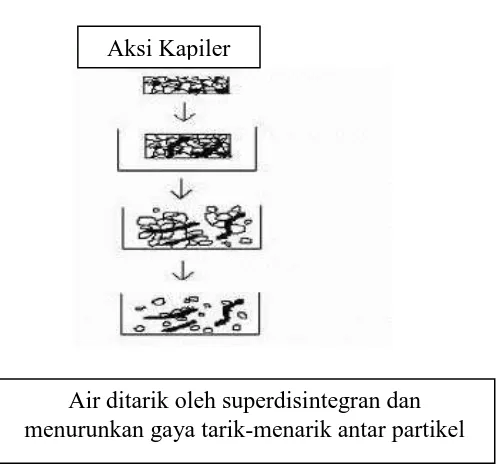
[image:31.595.202.453.489.724.2]1) Aksi kapiler (Wicking)
Gambar 2.2. Proses aksi kapiler (wicking)
Aksi Kapiler
16
Tablet yang merupakan hasil pengempaan dari granul, memiliki pori-pori
kapiler. Dan pada saat tablet bersinggungan dengan medium air, maka air akan
berpenetrasi masuk ke dalam pori-pori tablet. Akibatnya ikatan antar partikel
menjadi lemah dan pada akhirnya tablet akan pecah (Bhowmik, et al.,2009).
2) Pengembangan (Swelling)
Gambar 2.3. Proses pengembangan (swelling)
Beberapa bahan penghancur apabila terkena air maka akan mengembang,
akibatnya partikel penyusun tablet akan terdesak dan pecah. Hancurnya tablet
dengan mekanisme ini dipengaruhi oleh struktur pori-pori tablet. Semakin kecil
pori-pori granul yang ada di dalam tablet, maka semakin besar tenaga untuk
menghancurkan tablet (Bhowmik, et al., 2009).
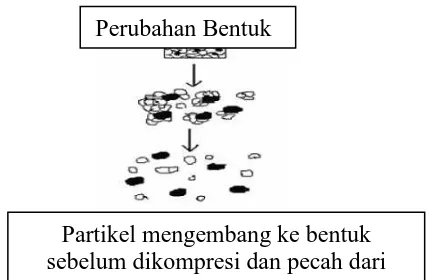
[image:32.595.220.437.588.728.2]3) Perubahan bentuk (Deformation)
Gambar 2.4. Proses perubahan bentuk (deformation)
Pengembangan
Partikel mengembang dan pecah dari bentuk matrik
Perubahan Bentuk
17
Partikel yang mengalami penekanan pada proses pengempaan akan
berubah bentuknya. Apabila tablet terkena air maka partikel yang membentuk
tablet akan kembali ke bentuk asalnya, maka partikel tablet akan berdesakan
sehingga tablet dapat hancur (Bhowmik, et al., 2009).
[image:33.595.206.449.214.408.2]4) Perenggangan (Repulsion)
Gambar 2.5. Proses perenggangan (repulsion)
Teori ini menerangkan bahwa partikel tidak mengembang tetapi dengan
adanya air yang masuk melalui jaringan kapiler yang tersusun di dalam tablet
maka partikel akan tolak menolak sehingga akan saling memisahkan diri
kemudian lepas dari susunannya di dalam tablet. Proses ini akan membantu
terjadinya disintegrasi (Bhowmik, et al., 2009).
2.4 Uraian tentang Primogel
Primogel mempunyai nama kimia sodium starch glycolate atau sodium
carboxymethyl starch. Serbuk higroskopis yang berwarna putih atau hampir putih,
mempunyai sifat alir yang baik. Apabila dilihat dengan mikroskop, primogel
berupa granul yang bentuknya tidak teratur dengan ukuran 30-100 mikrometer.
Granul primogel menunjukkan pengembangan (swelling) yang besar ketika Perenggangan
18
kontak dengan air. Menurut Farmakope Eropa, Primogel terbagi menjadi tiga jenis
yaitu tipe A, tipe B, dan tipe C. Pembagian jenis ini berdasarkan pH, kandungan
Natrium, dan kandungan Natrium Klorida. Primogel biasanya digunakan sebagai
disintegran pada tablet atau kapsul. Primogel biasanya diformulasi untuk tablet
yang dicetak langsung atau dengan granulasi basah. Konsentrasi primogel yang
umum digunakan yaitu antara 2% - 8%, dimana konsentrasi optimum adalah 4%.
Primogel juga dapat digunakan sebagai agen pensuspensi. Primogel mempunyai
kemampuan untuk mengembang sampai 300 kali (Rowe, et al., 2009).
2.5 Uraian tentang Krospovidon
Krospovidon mempunyai nama kimia 1-Ethenyl-2-pyrrolidinone. Serbuk
putih sampai putih kekuningan, mengalir bebas, praktis tidak berasa, tidak berbau
atau hampir tidak berbau, bersifat higroskopis, praktis tidak larut dalam air dan
dalam sebagian besar pelarut organik. Krospovidon merupakan bahan
pengembang dalam tablet yang tidak larut dalam air, yang biasanya digunakan
dengan konsentrasi 2% - 5% pada tablet yang dibuat dengan metode cetak
langsung ataupun granulasi basah dan ggranulasi kering. Krospovidon memiliki
aktivitas kapiler yang tinggi dan cepat. Studi menunjukkan bahwa ukuran partikel
dari Krospovidon sangat mempengaruhi disintegrasi dari tablet. Partikel yang
lebih besar semakin meningkatkan kecepatan disintegrasi dibandingkan dengan
partikel yang lebih kecil. Krospovidon juga dapat digunakan sebagai peningkat
kelarutan. Dengan teknik co-evaporasi, Krospovidon dapat digunakan sebagai
peningkat kelarutan bagi bahan obat yang sangat sukar larut. Bahan obat
19
dievaporasi. Teknik ini menunjukkan hasil laju disolusi yang lebih cepat (Rowe,
et al., 2009).
2.6 Uraian tentang Selulosa mikrokristalin (Avicel)
Selulosa mikrokristal adalah selulosa yang dimurnikan secara parsial,
berwarna putih, tidak berbau, tidak berasa, serbuk kristal yang terdiri atas
partikel-partikel yang menyerap (Rowe, et.al., 2009).
Selulosa mikrokristalin sering juga disebut dengan avicel, suatu zat yang
dapat dicetak langsung. Sifat mengalirnya baik, dan sifat pencetakan langsungnya
juga bagus sekali. Harganya cukup mahal bila digunakan sebagai pengisi dengan
kadar tinggi, karena itu sering dikombinasi dengan zat lain. Zat ini merupakan
bahan pengisi yang banyak digunakan (Lachman, dkk., 1994).
Selulosa mikrokristal secara luas digunakan dalam farmasi, terutama
sebagai pengikat/pengisi dalam formulasi tablet dan kapsul yang dapat digunakan
dalam proses granulasi basah dan kempa langsung. Selain digunakan sebagai
pengikat/pengisi, selulosa mikrokristalin juga mempunyai sifat lubrikan dan
disintegran yang dapat berguna dalam pembuatan tablet (Rowe, et al., 2009).
2.7 Uraian tentang Camphora
Camphora adalah produk alami yang berasal dari kayu pohon
Cinnamomum camphora. Camphora diperoleh melalui destilasi uap dan
pemurnian dengan sublimasi. Pohon Cinnamomum camphora yang digunakan
setidaknya harus berumur 50 tahun. Camphora juga dapat disintesis dengan
menggunakan vinil klorida dan siklopentadiena (Zuccarini, 2009).
Camphora dapat digunakan sebagai antiseptik, analgesik, antipruritus,
20
pengobatan, terutama dalam bentuk topikal, hal ini berkaitan dengan aksi anastesi
lokal dan kemampuan untuk menimbulkan sensasi panas sehingga menjadi dasar
yang kuat dan efektif untuk menjadi obat. Saat ini camphora paling banyak
digunakan dalam bentuk inhalasi dan minyak camphora dengan menambahkan
19% atau 20% camphora kedalam minyak pembawa, serta sebagai bahan aktif
utama dalam pembuatan obat gosok dan balsam untuk pemakaian topikal sebagai
analgesik (Zuccarini, 2009).
Dosis oral untuk camphora yang digunakan secara oral adalah 120-300 mg
dan dosis parenteral adalah 60-200 mg (dosis yang melebihi tidak disarankan).
Sedangkan dalam bentuk minyak camphora tidak terdapat batasan dosis dan dapat
digunakan tanpa resiko apabila digunakan sesuai petunjuk. Tanda-tanda toksisitas
camphora yaitu menyebabkan konvulsi, letargi, ataksia, pusing berlebihan, mual,
dan koma (Zuccarini, 2009).
2.8 Spektrofotometer
Spektrofotometer adalah alat untuk mengukur transmitans atau serapan
suatu sampel sebagai fungsi panjang gelombang. Alat ini terdiri dari spektrometer
yang menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan
fotometer sebagai alat pengukur intensitas cahaya yang ditransmisikan atau yang
diabsorpsi (Day and Underwood, 1999).
Dalam aspek kuantitatif, suatu berkas radiasi dikenakan pada cuplikan
(larutan sampel) dan intensitas sinar radiasi yang diteruskan diukur besarnya.
Radiasi yang diserap oleh cuplikan ditentukan dengan membandingkan intensitas
sinar yang diteruskan dengan intensitas sinar yang diserap jika tidak ada spesies
21
jumlah foton yang melalui satu satuan luas penampang perdetik. Serapan dapat
terjadi jika foton/radiasi yang mengenai cuplikan memiliki energi yang sama
dengan energi yang dibutuhkan untuk menyebabkan terjadinya perubahan tenaga.
Penetapan kadar dilakukan dengan mengukur absorban pada panjang gelombang
maksimum, agar dapat memberikan absorban tertinggi untuk setiap konsentrasi.
Bila suatu senyawa mempunyai lebih dari satu puncak, lebih diutamakan panjang
gelombang maksimum yang absorptivitasnya terbesar dan memberikan kurva
kalibrasi linier dalam rentang konsentrasi yang relatif lebar dan meningkat yang
ditentukan dengan persamaan regresi yang merupakan hubungan antara
konsentrasi dan serapan dan dapat dinyatakan sebagai berikut :
Y = aX + b
Dimana : Y = absorbansi
X = konsentrasi
a = koefisien regresi (juga menyatakan slope/kemiringan)
b = tetapan regresi dan juga disebut dengan intersep
Unsur - unsur terpenting suatu spektrofotometer adalah sebagai berikut:
1. Sumber cahaya: lampu deuterium untuk daerah UV dari 190 sampai 350 nm,
sementara lampu halogen kuartz atau lampu tungsten daerah visibel dari 350
sampai 900 nm.
2. Monokromotor: digunakan untuk menghamburkan cahaya ke dalam panjang
gelombang unsur-unsurnya, yang diseleksi lebih lanjut dengan celah.
Monokromator berotasi sehingga rentang panjang gelombang dilewatkan melalui
22
3. Kuvet (sel): digunakan sebagai wadah sampel yang akan di analisis. Pada
pengukuran di daerah sinar tampak, kuvet kaca dapat digunakan, tetapi untuk
pengukuran pada daerah ultraviolet harus menggunakan sel kuarsa karena gelas
tidak tembus cahaya pada daerah ini. Kuvet umumnya mempunyai ketebalan 1
cm.
4. Detektor: berperan untuk memberikan respon terhadap cahaya pada berbagai
panjang gelombang. Detektor akan mengubah cahaya menjadi sinyal listrik yang
selanjutnya akan ditampilkan oleh penampil data dalam bentuk angka digital.
5. Recorder: digunakan sebagai perekam absorbansi yang dihasilkan dari
23
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental yang meliputi formulasi
Orally Disintegrating Tablet (ODT) Domperidon dan evaluasi sediaan.
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah mesin pencetak tablet
single punch (Erweka), Disintegration Tester (Copley), Dissolution Tester
(Veego), Hardness Tester (Copley), Friabilator (Copley), Oven (Memmert),
Spektrofotometer UV (Shimadzu), Stopwatch, Neraca listrik (Ohaus), alat-alat
gelas dan alat laboratorium lainnya.
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah Domperidon
(Vasudha Pharma Chem Limited), Krospovidon (Amishi Drugs&Chemicals),
Primogel (Amishi Drugs&Chemicals), Avicel pH102 (Gujarat Microwax),
Camphora (Fujian Green Fine Co., Ltd), Mg Stearat (Faci Asia Pacific), PEG
6000 (NOF Corporation), Aspartam (Changzou Kelong Chemicals),
Maltodekstrin (Sorini Agro Asia Corp.).
3.3 Prosedur Kerja
3.3.1 Pembuatan Orally Disintegrating Tablet Domperidon
Formula ODT domperidon
R/ Domperidon 10 mg
Avicel pH 102 20%
Superdisintegran 8%
Camphora X
Mg stearat 1%
PEG 6000 1%
Aspartam 2%
24
Pada formulasi ini superdisintegran yang digunakan adalah campuran
Primogel dengan Krospovidon. Pada formulasi ini massa tablet yang akan
diformulasikan adalah 200 mg, dimana pada formulasi akan dibuat formula
dengan konsentrasi camphora yang berbeda yaitu 5%, 10%, dan 15%.
Camphora yang divariasikan:
Camphora (5%) : 5/100 x 200 = 10 mg
Camphora (10%) : 10/100 x 200 = 20 mg
Camphora (15%) : 15/100 x 200 = 30 mg
Cara pembuatan:
1. Digerus bahan yang berbentuk kristal seperti camphora dan PEG 6000
menjadi partikel yang halus.
2. Ditimbang bahan-bahan yang sesuai dengan perbandingan yang tertera
pada tabel 3.1.
3. Dimasukkan bahan-bahan yang jumlahnya sedikit ke dalam botol kaca
lalu dicampur dengan bahan-bahan lain yang jumlahnya lebih kurang
sama yang ada di dalam botol, begitu seterusnya sampai semua bahan
tercampur lalu dibolak-balikkan sampai homogen.
4. Diayak massa yang sudah homogen dengan mesh ukuran 60.
5. Dilakukan uji preformulasi terhadap massa yang sudah diayak.
6. Dicetak massa menjadi tablet dengan diameter 9 mm dan berat 200
mg.
7. Dikeringkan tablet di dalam oven pada suhu 80ºC selama 30 menit
(Peh, et.al., 2013).
25
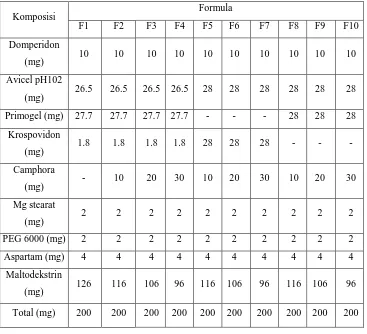
Tabel 3.1. Komposisi formulasi ODT Domperidon
Komposisi Formula
F1 F2 F3 F4 F5 F6 F7 F8 F9 F10
Domperidon
(mg) 10 10 10 10 10 10 10 10 10 10
Avicel pH102
(mg) 26.5 26.5 26.5 26.5 28 28 28 28 28 28
Primogel (mg) 27.7 27.7 27.7 27.7 - - - 28 28 28
Krospovidon
(mg) 1.8 1.8 1.8 1.8 28 28 28 - - -
Camphora
(mg) - 10 20 30 10 20 30 10 20 30
Mg stearat
(mg) 2 2 2 2 2 2 2 2 2 2
PEG 6000 (mg) 2 2 2 2 2 2 2 2 2 2
Aspartam (mg) 4 4 4 4 4 4 4 4 4 4
Maltodekstrin
(mg) 126 116 106 96 116 106 96 116 106 96
Total (mg) 200 200 200 200 200 200 200 200 200 200
Keterangan: (dalam %)
F1 = campuran Avicel : Primogel : Krospovidon : Camphora = 47,3 : 49,5 : 3,2 : 0
F2 = campuran Avicel : Primogel : Krospovidon : Camphora = 47,3 : 49,5 : 3,2 : 5
F3 = campuran Avicel : Primogel : Krospovidon : Camphora = 47,3 : 49,5 : 3,2 : 10
F4 = campuran Avicel : Primogel : Krospovidon : Camphora = 47,3 : 49,5 : 3,2 : 15
F5 = campuran Avicel : Primogel : Krospovidon : Camphora = 50 : 0 : 50 : 5
F6 = campuran Avicel : Primogel : Krospovidon : Camphora = 50 : 0 : 50 : 10
F7 = campuran Avicel : Primogel : Krospovidon : Camphora = 50 : 0 : 50 : 15
F8 = campuran Avicel : Primogel : Krospovidon : Camphora = 50 : 50 : 0 : 5
F9 = campuran Avicel : Primogel : Krospovidon : Camphora = 50 : 50 : 0 : 10
26
3.3.2 Uji preformulasi
Uji preformulasi dilakukan terhadap campuran massa tablet domperidon
yang meliputi sudut diam, waktu alir, dan indeks tap.
3.3.2.1 Waktu alir
Penetapan laju alir dilakukan dengan menggunakan corong. Seratus gram
granul dimasukkan ke dalam corong yang telah dirangkai, permukaannya
diratakan. Penutup bawah corong dibuka dan secara serentak stopwatch
dihidupkan. Stopwatch dihentikan jika seluru granul telah habis melewati corong
dan dicatat waktu alirnya.
Syarat: talir < 10 detik (Cartensen, 1977)
3.3.2.2 Sudut diam
Penetapan sudut diam dilakukan dengan menggunakan corong. Seratus
gram granul dimasukkan ke dalam corong, permukaannya diratakan, lalu penutup
bawah corong dibuka dan dibiarkan granul mengalir melalui corong dan
ditentukan besar sudut diamnya dengan rumus:
Tg Ɵ = 2h/D
Keterangan: Ɵ = sudut diam
h = tinggi kerucut (cm)
D = diameter (cm)
Syarat: 20o < Ɵ < 40o (Cartensen, 1977)
3.3.2.3 Indeks tap
Granul dimasukkan ke dalam gelas ukur 50 ml dan diukur volume awalnya
(V1) lalu dihentakkan sehingga diperoleh volume akhirnya (V2) yang konstan.
27 I = Ẋ 100%
Keterangan: I = indeks tap
V1 = volume sebelum hentakan
V2 = volume setelah hentakan
Syarat : I ≤ 20% (Cartensen, 1977)
3.3.3 Analisa kuantitatif
3.3.3.1 Pembuatan larutan induk baku (LIB)
Ditimbang seksama sejumlah 10 mg domperidon, dimasukkan ke dalam
labu tentukur 100 ml, dilarutkan dengan 2 ml larutan etanol dan diencerkan
dengan HCl 0,1 N hingga garis tanda sehingga diperoleh larutan dengan
konsentrasi 100 µg/ml (LIB).
3.3.3.2 Penentuan kurva serapan Domperidon
Dipipet LIB I sebanyak 5 ml ke dalam labu tentukur 25 ml diencerkan
dengan HCl 0,1 N sampai garis tanda (konsentrasi teoritis 20 µg/ml), kemudian
diukur serapannya pada panjang gelombang 200 sampai 400 nm.
3.3.3.3 Penentuan linearitas kurva kalibrasi Domperidon dalam etanol
Dipipet LIB I sebanyak 2,5 ml; 5,0 ml; 7,5 ml; 10,0 ml dan 12,5 ml,
dimasukkan ke dalam labu tentukur 50 ml, diencerkan dengan HCl 0.1 N hingga
garis tanda. Kocok sehingga diperoleh konsentrasi 5,0 µg/ml; 10,0 µg/ml, 15,0
µg/ml, 20,0 µg/ml dan 25,0 µg/ml. Masing-masing larutan kemudian diukur
serapannya menggunakan spektrofotometer ultraviolet pada panjang gelombang
28
3.4 Evaluasi Tablet
3.4.1 Penetapan kadar Domperidon dalam tablet
Sebanyak 20 tablet ODT ditimbang seksama lalu diserbukkan. Selanjutnya
ditimbang sejumlah serbuk setara dengan 10 mg domperidon. Serbuk ini lalu
dimasukkan ke dalam labu tentukur 100 ml, dilarutkan dengan 2 ml larutan etanol
dan diencerkan dengan HCl 0,1 N sampai garis tanda. Larutan disaring dengan
membuang pertama filtrat kira-kira 5 ml. Dipipet 5 ml filtrat dimasukkan ke
dalam tentukur 50 ml lalu diencerkan dengan larutan HCl 0,1 N hingga garis
tanda. Larutan ini lalu diukur serapannya dengan menggunakan spektrofotometer
ultraviolet pada panjang gelombang yang dianalisis. Tablet domperidon
mengandung zat berkhasiat tidak kurang dari 90,0% dan tidak lebih dari hingga
110,0% dari yang tertera pada etiket (The United States Pharmacopoeia
Convention XXX, 2007).
3.4.2 Uji kekerasan tablet
Alat: Hardness Tester (Copley)
Cara: Sebuah tablet diletakkan tegak lurus di antara anvil dan punch, tablet dijepit
dengan memutar sekrup pengatur hingga tanda lampu “stop” menyala, knop
ditekan dan dicatat angka yang ditunjukkan jarum penunjuk skala pada saat tablet
pecah. Percobaan ini dilakukan untuk 6 tablet.
Ketentuan umum: Kekerasan tablet cepat hancur 0,1 – 3 kg (Abu-Izza, et.al.,
29
3.4.3 Uji friabilitas
Alat: Friabilator (Erweka)
Cara:
Ditimbang 20 tablet yang telah dibersihkan dari debu, dicatat beratnya (a
gram). Tablet dimasukkan ke dalam alat friabilator, lalu alat dijalankan selama 4
menit (100 kali putaran). Setelah batas waktu yang ditentukan tablet dikeluarkan
dan dibersihkan dari debu, lalu ditimbang beratnya (b gram).
Friabilitas (F) = (a – b)/a x 100%
Ketentuan umum: Kehilangan berat ≤ 0.9% (Sharma, et.al., 2011).
3.4.4 Uji waktu hancur
Alat: Disintegration Tester (Copley)
Cara:
Pengujian dilakukan terhadap 6 tablet. Dimasukkan 1 tablet
masing-masing tabung dari keranjang, lalu dimasukkan cakram kemudian alat dijalankan.
Digunakan air dengan suhu 37o ± 2oC sebagai media. Pada akhir batas waktu
seperti yang tertera pada monografi, angkat keranjang dan amati keenam tablet.
Semua tablet harus hancur sempurna. Bila 1 atau 2 tablet tidak hancur sempurna
ulangi pengujian dengan 12 tablet lainnya, tidak kurang dari 16 tablet dari 18
tablet yang diuji harus hancur sempurna (Ditjen POM, 1995).
Persyaratan: Waktu yang diperlukan untuk menghancurkan tablet tidak lebih dari
1 menit (Manivannan, 2009).
3.4.5 Uji keseragaman kandungan
Tablet yang dibuat yaitu tablet domperidon dengan berat satu tablet 200
30
kurang dari 50 mg, karena itu penetapan keseragaman sediaan yang dilakukan
dengan menetapkan keseragaman kandungan (Ditjen POM, 1995), yang dilakukan
seperti berikut:
Satu tablet digerus lalu dimasukkan ke dalam labu tentukur 100 ml dan
dilarutkan dengan 2 ml larutan etanol dan diencerkan dengan HCl 0,1 N hingga
garis tanda. Larutan disaring dengan membuang filtrat pertama kira-kira 5 ml.
Dipipet 5 ml fitrat ke dalam labu tentukur 50 ml dan encerkan dengan larutan HCl
0,1 N sampai garis tanda. Larutan ini lalu diukur serapannya dengan
menggunakan spektrofotometer ultraviolet pada panjang gelombang analisis. Uji
ini dilakukan terhadap 10 tablet.
Tablet memenuhi persyaratan dalam keseragaman kandungan jika
kadarnya terletak antara 85% hingga 115% dari yang tertera pada etiket dan
simpangan baku relatif kurang dari atau sama dengan 6,0%. Jika tidak memenuhi
syarat maka dilakukan uji 20 satuan tambahan, dan persyaratan dipenuhi jika tidak
lebih dari 1 satuan dari 30 yang terletak di luar rentang 85% hingga 115% dari
yang tertera pada etiket dan tidak ada satuan yang tertera pada etiket dan tidak ada
satuan yang terletak di luar rentang 75% hingga 125% dari yang tertera pada
etiket dan simpangan baku relatif dari 30 satuan sediaan tidak lebih dari 7,0%
(Ditjen POM, 1995).
3.4.6 Uji disolusi tablet
Untuk menguji laju disolusi tablet dilakukan dengan menggunakan alat
Dissolution Tester.
Medium : 900 ml HCl 0,1N
Alat : tipe 2 (metode dayung)
Kecepatan putaran : 50 rpm
31 Cara:
Satu tablet dimasukkan ke dalam wadah disolusi yang telah berisi 900 ml
medium disolusi (larutan HCl 0,1 N) yang bersuhu 37o ± 0,5oC. Kemudian dayung
diputar dengan kecepatan 50 rpm. Pada interval waktu 3, 6, 9, 12, dan 15 menit,
dipipet sebanyak 5 ml cuplikan kedalam labu tentukur 25 ml lalu dicukupkan
dengan larutan HCl 0,1 N sampai garis tanda. Setiap pemipetan 5 ml cuplikan
maka ditambahkan 5 ml larutan HCl 0,1 N kedalam wadah disolusi. Pengambilan
cuplikan dilakukan pada posisi yang sama yaitu pertengahan antara permukaan
medium disolusi dan bagian atas dari dayung tidak kurang 1 cm dari dinding
wadah (Ditjen POM, 1995). Larutan cuplikan ini diukur serapannya dengan
menggunakan spektrofotometer ultraviolet pada panjang gelombang analisis.
Selanjutnya diperoleh persen kumulatif pelepasan obat.
Persyaratan: Dalam waktu 30 menit harus larut tidak kurang dari 75% (Q) dari
jumlah yang tertera pada etiket (The United States Pharmacopoeia Convention
XXX, 2007).
Interpretasi: Kecuali dinyatakan lain dalam masing-masing monografi,
persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji
sesuai dengan tabel penerimaan. Lanjutkan pengujian sampai tiga tahap kecuali
bila hasil pengujian memnuhi tahap S1 atau S2. Harga Q adalah jumlah zat aktif
yang terlarut seperti yang tertera dalam masing-masing monografi, dinyatakan
dalam persentase kadar pada etiket, angka 5% dan 15% dalam tabel adalah
persentase kadar pada etiket, dengan demikian mempunyai arti yang sama dengan
Q. Kriteria penerimaan zat aktif yang larut dengan disolusi dapat dilihat pada
32
Tabel 3.2. Kriteria penerimaan zat aktif yang larut dengan disolusi
Tahap Jumlah yang diuji Kriteria Penerimaan
S1 6 Rata-rata tidak kurang dari Q + 5%
S2 6 Rata-rata dari 12 unit (S1 + S2) adalah sama
dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q-15%.
S3 12 Rata-rata dari 24 unit (S1 + S2 + S3) adalah
sama dengan atau lebih besar dari Q tidak lebih dari 2 unit sediaan yang lebih kecil dari Q-15% dan tidak satu unit pun yang lebih kecil dari Q-25%.
(Ditjen POM, 1995).
3.4.7 Uji waktu pembasahan (wetting time)
Kertas saring yang berbentuk lingkaran diletakkan ke dalam cawan petri
berdiameter 9 cm yang telah berisi 9 ml larutan metil biru 0,1% b/v dalam air
suling. Satu tablet diletakkan perlahan-lahan dibagian tengah cawan petri tersebut,
kemudian dicatat waktu pembasahan sempurna dari tablet. Waktu pembasahan
(wetting time) adalah waktu yang dibutuhkan untuk membuat permukaan atas dari
tablet menyerap warna (Bhowmik, et al., 2009).
3.4.8 Uji absorbsi air
Kertas saring yang berbentuk lingkaran diletakkan kedalam cawan petri
berdiameter 9 cm yang telah berisi 9 ml larutan metil biru 0,1% b/v dalam air
suling. Satu tablet diletakkan perlahan-lahan dibagian tengah cawan petri tersebut,
kemudian dicatat waktu pembasahan sempurna dari tablet, kemudian ditimbang
berat tablet sebelum dan sesudah terbasahi. Absorbsi air dihitung dengan rumus:
R =
Keterangan: wa = berat tablet sebelum menyerap air
33
3.4.9 Uji waktu hancur di mulut
Uji ini menggunakan 10 sukarelawan untuk 10 kode formula ODT.
Sebelum memulai uji, setiap sukarelawan diharuskan mencuci mulut terlebih
dahulu, lalu diletakkan satu tablet ODT diatas lidah mereka dan dibiarkan tablet
hingga hancur sempurna. Waktu yang dibutuhkan agar tablet hancur tanpa
mengunyah dihitung, setelah itu tablet segera diludahkan. Titik akhir untuk waktu
hancur di mulut adalah waktu dimana tablet yang diletakkan di lidah menjadi
hancur (tablet tidak utuh lagi).
3.5 Analisis Data Secara Statistik
Menurut Gandjar (2007), kadar zat aktif sebenarnya yang terkandung
dalam sampel dapat diketahui menggunakan uji distribusi t. Data diterima atau
ditolak dihitung dengan menggunakan metode standar deviasi dengan rumus:
SD =
Keterangan: Xi = nilai dari masing-masing pengukuran
= rata-rata dari pengukuran
Untuk mencari thitung digunakan rumus:
thitung =
Menurut Wibisono (2005), sebagai dasar penolakan data hasil uji analisis adalah
thitung ≥ ttabel atau thitung - ttabel. Untuk menentukan kadar zat aktif dalam sampel dengan taraf kepercayaan 99%, α = 0.01, dk= n-1, dapat digunakan rumus:
34 Keterangan:
x = Interval kepercayaan kadar sampel
= Kadar rata-rata sampel
SD = Standar Deviasi
dk = derajat kebebasan (dk = n-1) α = taraf kepercayaan ; dan
n = jumlah perlakuan
3.5.1 Uji statistik terhadap evaluasi waktu hancur
Evaluasi dari ODT dan sediaan tablet domperidon dibandingkan secara in
vitro. Data dibandingkan menggunakan uji anova dengan signifikansi (p< 0,05).
Analisis statistik dilakukan menggunakan program SPSS 17,0.
3.5.2 Uji statistik terhadap profil pelepasan obat
Profil pelepasan obat dari ODT dan sediaan tablet domperidon
dibandingkan secara in vitro. Data dibandingkan menggunakan uji anova dengan
signifikansi (p < 0,05). Analisa statistik dilakukan menggunakan program SPSS
35
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Uji Preformulasi Granul Domperidon
Uji preformulasi yang dilakukan meliputi sudut diam, waktu alir, dan
indeks tap. Dari hasil uji yang dilakukan dapat diketahui sifat massa yang akan
dicetak menjadi tablet. Hasil uji preformulasi granul domperidon dapat dilihat
[image:51.595.119.507.319.598.2]pada Tabel 4.1.
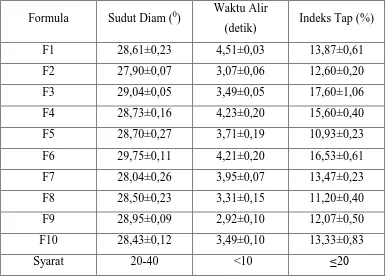
Tabel 4.1. Hasil Uji preformulasi granul Domperidon
Formula Sudut Diam (0) Waktu Alir
(detik) Indeks Tap (%)
F1 28,61±0,23 4,51±0,03 13,87±0,61
F2 27,90±0,07 3,07±0,06 12,60±0,20
F3 29,04±0,05 3,49±0,05 17,60±1,06
F4 28,73±0,16 4,23±0,20 15,60±0,40
F5 28,70±0,27 3,71±0,19 10,93±0,23
F6 29,75±0,11 4,21±0,20 16,53±0,61
F7 28,04±0,26 3,95±0,07 13,47±0,23
F8 28,50±0,23 3,31±0,15 11,20±0,40
F9 28,95±0,09 2,92±0,10 12,07±0,50
F10 28,43±0,12 3,49±0,10 13,33±0,83
Syarat 20-40 <10 ≤20
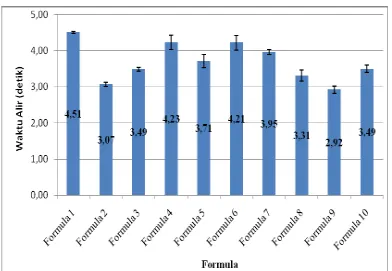
4.1.1 Uji waktu alir
Dari Tabel 4.1 di atas dapat diketahui bahwa semua formula menunjukkan
hasil uji preformulasi waktu alir yang masih berada dalam batas persyaratan uji
waktu alir yaitu formula 1 sebesar 4,51 detik; formula 2 sebesar 3,07 detik;
36
3,71 detik; formula 6 sebesar 4,21 detik; formula 7 sebesar 3,95 detik; formula 8
sebesar 3,31 detik; formula 9 sebesar 2,92 detik; formula 10 sebesar 3,49 detik.
Hal ini sesuai dengan persyaratan uji preformulasi waktu alir yaitu waktu yang
[image:52.595.117.509.189.460.2]diperlukan tidak lebih dari 10 detik tiap 100 gram granul (Cartensen, 1977).
Gambar 4.1. Diagram Batang Waktu Alir
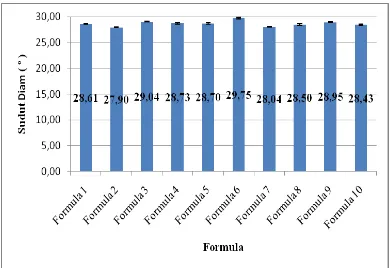
4.1.2 Uji sudut diam
Dari Tabel 4.1 juga dapat dilihat hasil uji preformulasi sudut diam dari
semua formula ODT, yaitu formula 1 sebesar 28,61˚; formula 2 sebesar 27,90˚;
formula 3 sebesar 29,04˚; formula 4 sebesar 28,73˚; formula 5 sebesar 28,70˚;
formula 6 sebesar 29,75˚; formula 7 sebesar 28,04˚; formula 8 sebesar 28,50˚;
formula 9 sebesar 28,95˚; formula 10 sebesar 28,43˚. Hasil uji preformulasi sudut
diam ini menunjukkan hasil yang beragam dari semua formula, namun semuanya
37
Gambar 4.2. Diagram Batang Sudut Diam
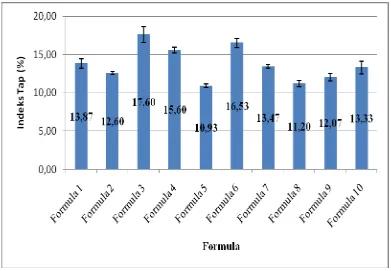
4.1.3 Uji indeks t