UJI AKTIVITAS ANTIINFLAMASI
EKSTRAK ETANOL MAJAKANI
(
Quercus infectoria
G. Olivier)
TERHADAP
TIKUS PUTIH YANG DIINDUKSI KARAGENAN
SKRIPSI
OLEH:
KHAIRUNNISA RAMBE
NIM 091501008
PROGRAM SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
UJI AKTIVITAS ANTIINFLAMASI
EKSTRAK ETANOL MAJAKANI
(
Quercus infectoria
G. Olivier)
TERHADAP
TIKUS PUTIH YANG DIINDUKSI KARAGENAN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
KHAIRUNNISA RAMBE
NIM 091501008
PROGRAM SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
UJI AKTIVITAS ANTIINFLAMASI
EKSTRAK ETANOL MAJAKANI (Quercus infectoria G. Olivier) TERHADAP TIKUS PUTIH YANG DIINDUKSI KARAGENAN
OLEH:
KHAIRUNNISA RAMBE NIM 091501008
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 31 Agustus 2013
Pembimbing I, Panitia Penguji,
Dr. Kasmirul Ramlan Sinaga, M.S., Apt. Prof. Dr. Urip Harahap, Apt. NIP 195504241983031003 NIP 194908111976031001
Pembimbing II, Dr. Kasmirul Ramlan Sinaga, M.S., Apt. NIP 195504241983031003
Dr. Marline Nainggolan, M.S., Apt. Dra. Suwarti Aris, M.Si., Apt. NIP 195709091985112001 NIP 195107231982032001
Drs. Rasmadin Mukhtar, M.S., Apt. NIP 194909101980031002
Medan, Oktober 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Bismillaahirrohmaanirrohiim
Penulis mengucapkan puji syukur kepada Allah SWT, yang senantiasa
melimpahkan rahmat dan hidayah-Nya sehingga penulis berhasil
menyelesaikan penelitian skripsi ini dengan judul “Uji Aktivitas
Antiinflammasi Ekstrak Etanol Majakani (Quercus infectoria G. Olivier)
Terhadap Tikus Putih yang Diinduksi Karagenan”. Skripsi ini diajukan sebagai
salah satu syarat untuk memperoleh gelar sarjana farmasi pada Fakultas
Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih yang tulus dan
ikhlas kepada Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan
Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga
penulis dapat menyelesaikan pendidikan. Bapak Dr. Kasmirul Ramlan Sinaga,
M.S., Apt., dan Ibu Dr. Marline Nainggolan, M.S., Apt., selaku pembimbing
yang telah memberikan waktu, bimbingan, dan nasehat selama penelitian
hingga selesainya penyusunan skripsi ini serta kepada Ibu Prof. Dr. Siti Morin
Sinaga, M.Sc, Apt., selaku penasehat akademik yang telah memberikan
bimbingan kepada penulis. Bapak Prof. Dr. Urip Harahap, Apt., Ibu Dra.
Suwarti Aris, M.Si., Apt., dan Bapak Drs. Rasmadin Mukhtar, M.S., Apt.,
selaku dosen penguji yang telah memberikan saran dan arahan kepada penulis
dalam menyelesaikan skripsi ini. Kepada Bapak dan Ibu staf pengajar Fakultas
Laboratorium Farmakologi yang telah memberikan bantuan dan fasilitas
selama penulis melakukan penelitian.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada
terhingga kepada Ayahanda dan Ibunda tercinta, Bakhtiar Rambe dan
Elyawati, yang tiada hentinya berkorban dengan tulus ikhlas bagi kesuksesan
penulis, juga kepada abang Ilmansyah Rambe, S.Kom dan adik Nurhayati
Rambe yang selalu setia memberi doa, dukungan dan motivasi selama
melakukan penelitian.
Penulis menyadari skripsi ini masih belum sempurna, oleh karena itu
diharapkan kritik dan saran yang membangun untuk penyempurnaannya.
Harapan saya semoga skripsi ini dapat bermanfaat bagi ilmu pengetahuan
kefarmasian.
Medan, Oktober 2013 Penulis
UJI AKTIVITAS ANTIINFLAMASI EKSTRAK ETANOL MAJAKANI
(Quercus infectoria G. Olivier) TERHADAP TIKUS PUTIH YANG DIINDUKSI KARAGENAN
ABSTRAK
Obat-obat antiinflamasi non-steroid(OAINS) termasuk obat analgesik, antipiretik dan antiinflamasi yang mempunyai efek samping terhadap gastrointestinal, sehingga perlu dicari obat alami yang lebih aman. Majakani (Quercus infectoria G. Olivier) telah lama digunakan untuk pengobatan inflamasi secara tradisional yang diharapkan mempunyai efek yang sama dengan OAINS. Tujuan penelitian ini adalah untuk mengetahui efek antiinflamasi ekstrak etanol majakani terhadap udem kaki tikus yang diinduksi karagenan 1%.
Ekstrak etanol majakani (EEM) dilakukan uji efek antiinflamasi menggunakan metode paw edema terhadap tikus jantan galur wistar sebanyak 30 ekor yang dibagi 5 kelompok. Kelompok kontrol (K) diberi Na CMC 0,5%, kelompok perlakuan (P) diberi EEM berturut-turut, dosis 200, 300, 400 mg/kg bb dan sebagai pembanding diberi Na-diklofenak dosis 2,25 mg/kg bb. Setelah 30 menit diinjeksikan 0,1 ml karagenan 1% secara subplantar pada telapak kaki tikus. Volume kaki tikus diukur secara berkala dengan pletismometer. Data yang diperoeh dianalisis secara statistik menggunakan ANAVA satu arah dan dilanjutkan dengan uji Duncan.
EEM memberikan efek antiinflamasi pada dosis 300 dan 400 mg/kg bb dengan nilai AUC secara berturut-turut 14025,74 dan 11040,34. Hasil uji
Duncan antara EEM dosis 300, 400 mg/kg bb dengan pembanding (AUC sebesar 13732,13) tidak berbeda nyata (p > 0,05), namun berbeda nyata dengan kontrol (AUC sebesar 22288,50) (p ≤ 0,05). EEM dosis 200 mg/kg bb (AUC sebesar 18537,98) dibandingkan dengan pembanding, EEM dosis 300 dan 400 mg/kg bb berbeda nyata (p ≤ 0,05), namun tidak berbeda nyata dengan kontrol (p > 0,05). Hasil yang dapat disimpulkan adalah EEM dosis 300 mg/kg bb mempunyai efek yang sama dengan Na-diklofenak.
TEST ETHANOL EXTRACT OF MAJAKANI (Quercus infectoria G. Olivier) AS ANTI-INFLAMMATORY ON WHITE RAT WHICH INDUCED WITH CARRAGEENAN
ABSTRACT
Non-steroidal anti-inflammatory drugs (NSAIDs) including analgesic, antipyretic and anti-inflammatory that have adverse effects in gastrointestinal. It is necessary to find a natural medication that safer. Majakani (Quercus infectoria G. Olivier) had been long using for treatment of traditional inflammatory that expected to have same effect with NSAIDs. The purpose of this study is to determine the anti-inflammatory effects of majakani ethanol extract which induced to rat foot and become edema that caused by carrageenan 1%.
Ethanol extract of majakani (EEM) to test the anti-inflammatory effects using paw edema’s method on 30 male tail of rat in wistar ways which is devided into 5 groups. Control group (K) using 0.5% CMC Na, treatment group (P) using EEM respectively doses of 200, 300, 400 mg/kg bw, and as comparator using Na-diclofenac dose 2.25 mg/kg bw. After 30 minutes injected 0.1 ml of carrageenan subplantar in surface of the hind paw. The volume rat feet is measured regularly with pletismometer. The data has obtained statistically analyzed using one-way ANOVA, followed by Duncan test.
EEM provides anti-inflammatory effect on doses of 300 and 400 mg/kg bw with AUC values respectively 14025.70 and 11040.34. The results of Duncan test between EEM doses of 300 and 400 mg/kg bw with comparator (AUC amounted 13732.13) were not significantly different (p > 0.05), but they were significantly different with control (AUC amounted 22288.50) (p ≤ 0.05). EEM dose of 200 mg/kg bw (AUC amounted 18537.98) compared to comparator, EEM doses of 300 and 400 mg/kg bw was significantly different (p ≤ 0.05), but it was not significantly different with control (p > 0.05). The conclusion of the results is EEM dose of 300 mg/kg bw has the same effect with Na-diclofenac.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRAC ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.2 Jenis-jenis gal ... 8
2.1.3 Karakteristik makroskopik gal majakani ... 10
2.1.4 Karakteristik mikroskopik gal majakani ... 10
2.1.5 Kandungan kimia gal majakani ... 10
2.1.6 Uji kualitatif gal majakani ... 11
2.1.7 Kegunaan gal majakani ... 11
2.2 Simplisia ... 12
2.2.1 Tahap pembuatan simplisia ... 12
2.3 Ektrak dan Ekstraksi ... 16
2.3.1 Metode ekstraksi dengan menggunakan pelarut ... 16
2.3.2 Pengeringan ekstrak dengan metode freeze drying 18
2.4 Inflamasi ... 19
2.4.1 Definisi inflamasi ... 19
2.4.2 Mediator inflamasi ... 19
2.4.3 Sistem pertahanan tubuh pada inflamasi ... 22
2.4.4 Mekanisme terjadinya inflamasi ... 23
2.4.5 Macam-macam inflamasi ... 24
2.4.6 Golongan obat antiinflamasi ... 26
2.4.7 Natrium diklofenak ... 28
2.4.8 Beberapa metode uji antiinflamasi ... 30
2.4.9 Karagenan ... 32
BAB III METODE PENELITIAN ... 33
3.2 Bahan ... 34
3.3 Pengolahan Sampel dan Pembuatan Ekstrak ... 34
3.3.1 Pengambilan sampel ... 35
3.3.2 Pembuatan ekstrak ... 35
3.4 Uji Efektivitas Antiinflamasi ... 35
3.4.1 Penyiapan hewan percobaan ... 35
3.4.2 Penyiapan bahan ... 36
3.4.2.1 Pembuatan larutan Na CMC 0.5% ... 36
3.4.2.2 Pembuatan suspensi EEM 5% ... 36
3.4.2.3 Pembuatan suspensi natrium diklofenak 0,25% 36 3.4.2.4 Pembuatan karagenan 1% ... 36
3.4.3 Pengujian efek antiinflamasi ... 36
3.5 Analisis Data ... 38
BAB IV HASIL DAN PEMBAHASAN ... 39
4.1 Hasil Pengujian EEM Sebagai Antiinflamasi ... 39
4.1.1 Persentase radang ... 39
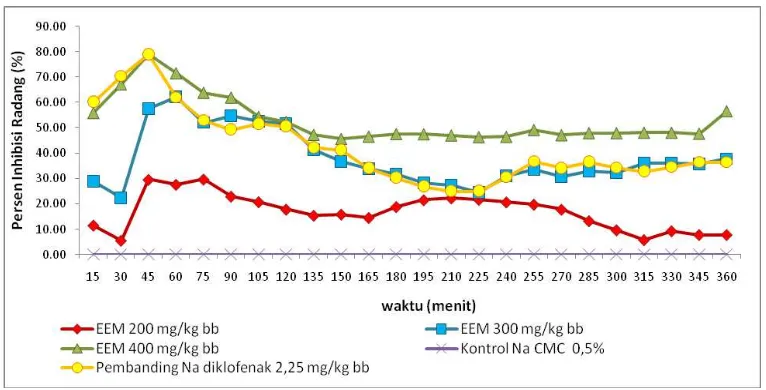
4.1.2 Persentase inhibisi radang ... 42
4.1.3. Area under the curve (AUC) ... 44
4.2 Analisis Data Secara Statistik ... 45
4.2.1 Analisis variansi satu arah persen radang ... 45
4.2.3 Uji rata-rata Duncan AUC persentase radang ... 48
BAB V KESIMPULAN DAN SARAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Halaman Tabel 4.1 Persentase radang rata-rata tiap waktu pengamatan ekstrak
etanol majakani ... 40
Tabel 4.2 Persentase inhibisi radang tiap waktu pengamatan ekstrak
etanol majakani ... 43
Tabel 4.3 Hasil uji beda rata-rata Duncan antar kelompok pada menit
ke-225 ... 46
Tabel 4.4 Hasil uji beda rata-rata Duncan antar kelompok pada menit
ke-240 ... 47
Tabel 4.5 Hasil analisis variansi satu arah AUC persentase radang .... 48
DAFTAR GAMBAR
Halaman
Gambar 1.1 Skema kerangka pikir penelitian ... 5
Gambar 2.1 Struktur kimia komponen gal majakani ... 11
Gambar 2.2 Patogenesis dan gejala peradangan ... 24
Gambar 2.3 Mekanisme system imun nonspesifik dan spesifik pada
inflamasi akut dan kronis ... 26
Gambar 2.4 Bagan penghambatan obat anti radang terhadap
pembentukan mediator radang ... 27
Gambar 2.5 Selektif penghambat COX2 dan beberapa OAINS
berdasarkan logaritmaperbandingan inhibitory concentration (IC80). Garis 0 menunjukkan potensi
yang sama dimana hasil perbandingan IC80 antara
COX-2 dan COX-1 adalah 1) (Kerr dan Gailer, 2010) ... 29
Gambar 4.1 Grafik rata-rata persen radang tiap waktu pengamatan ... 39
Gambar 4.2 Grafik inhibisi persen radang tiap waktu pengamatan ... 42
Gambar 4.3 Grafik hasil analisis data AUC persentase radang setiap
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil identifikasi sampel ... 59
Lampiran 2. Bagan kerja uji antiinflamasi ... 60
Lampiran 3. Contoh perhitungan dosis natrium diklofenak yang akan diberikan pada tikus secara per oral (p.o.) ... 61
Lampiran 4. Perhitungan dosis pemberian ekstrak etanol majakani (EEM) yang akan diberikan terhadap tikus secara peroral (p.o.) ... 62
Lampiran 5. Tabel volume maksimum larutan sediaan uji yang dapat diberikan pada hewan uji ... 63
Lampiran 6. Tabel konversi dosis hewan dengan manusia ... 64
Lampiran 7. Contoh perhitungan persen radang, persen inhibisi radang dan AUC persentase radang ... 65
Lampiran 8. Data hasil pengukuran penambahan volume kaki tikus, persentase radang dan persentase inhibisi radang pada t (menit) setelah pemberian bahan uji dalam bentuk suspense dan penyuntikan karagenan ... 66
Lampiran 9. Data AUC persentase radang ... 77
Lampiran 10. Uji normalitas nilai persen radang dengan uji Kolmogorov-Smirnov ... 82
Lampiran 11. Hasil analisis deskriptif persen dengan SPSS ... 84
Lampiran 12. Hasil ANAVA secara SPSS persen radang ... 89
Lampiran 15. Gambar alat yang digunakan ... 94
UJI AKTIVITAS ANTIINFLAMASI EKSTRAK ETANOL MAJAKANI
(Quercus infectoria G. Olivier) TERHADAP TIKUS PUTIH YANG DIINDUKSI KARAGENAN
ABSTRAK
Obat-obat antiinflamasi non-steroid(OAINS) termasuk obat analgesik, antipiretik dan antiinflamasi yang mempunyai efek samping terhadap gastrointestinal, sehingga perlu dicari obat alami yang lebih aman. Majakani (Quercus infectoria G. Olivier) telah lama digunakan untuk pengobatan inflamasi secara tradisional yang diharapkan mempunyai efek yang sama dengan OAINS. Tujuan penelitian ini adalah untuk mengetahui efek antiinflamasi ekstrak etanol majakani terhadap udem kaki tikus yang diinduksi karagenan 1%.
Ekstrak etanol majakani (EEM) dilakukan uji efek antiinflamasi menggunakan metode paw edema terhadap tikus jantan galur wistar sebanyak 30 ekor yang dibagi 5 kelompok. Kelompok kontrol (K) diberi Na CMC 0,5%, kelompok perlakuan (P) diberi EEM berturut-turut, dosis 200, 300, 400 mg/kg bb dan sebagai pembanding diberi Na-diklofenak dosis 2,25 mg/kg bb. Setelah 30 menit diinjeksikan 0,1 ml karagenan 1% secara subplantar pada telapak kaki tikus. Volume kaki tikus diukur secara berkala dengan pletismometer. Data yang diperoeh dianalisis secara statistik menggunakan ANAVA satu arah dan dilanjutkan dengan uji Duncan.
EEM memberikan efek antiinflamasi pada dosis 300 dan 400 mg/kg bb dengan nilai AUC secara berturut-turut 14025,74 dan 11040,34. Hasil uji
Duncan antara EEM dosis 300, 400 mg/kg bb dengan pembanding (AUC sebesar 13732,13) tidak berbeda nyata (p > 0,05), namun berbeda nyata dengan kontrol (AUC sebesar 22288,50) (p ≤ 0,05). EEM dosis 200 mg/kg bb (AUC sebesar 18537,98) dibandingkan dengan pembanding, EEM dosis 300 dan 400 mg/kg bb berbeda nyata (p ≤ 0,05), namun tidak berbeda nyata dengan kontrol (p > 0,05). Hasil yang dapat disimpulkan adalah EEM dosis 300 mg/kg bb mempunyai efek yang sama dengan Na-diklofenak.
TEST ETHANOL EXTRACT OF MAJAKANI (Quercus infectoria G. Olivier) AS ANTI-INFLAMMATORY ON WHITE RAT WHICH INDUCED WITH CARRAGEENAN
ABSTRACT
Non-steroidal anti-inflammatory drugs (NSAIDs) including analgesic, antipyretic and anti-inflammatory that have adverse effects in gastrointestinal. It is necessary to find a natural medication that safer. Majakani (Quercus infectoria G. Olivier) had been long using for treatment of traditional inflammatory that expected to have same effect with NSAIDs. The purpose of this study is to determine the anti-inflammatory effects of majakani ethanol extract which induced to rat foot and become edema that caused by carrageenan 1%.
Ethanol extract of majakani (EEM) to test the anti-inflammatory effects using paw edema’s method on 30 male tail of rat in wistar ways which is devided into 5 groups. Control group (K) using 0.5% CMC Na, treatment group (P) using EEM respectively doses of 200, 300, 400 mg/kg bw, and as comparator using Na-diclofenac dose 2.25 mg/kg bw. After 30 minutes injected 0.1 ml of carrageenan subplantar in surface of the hind paw. The volume rat feet is measured regularly with pletismometer. The data has obtained statistically analyzed using one-way ANOVA, followed by Duncan test.
EEM provides anti-inflammatory effect on doses of 300 and 400 mg/kg bw with AUC values respectively 14025.70 and 11040.34. The results of Duncan test between EEM doses of 300 and 400 mg/kg bw with comparator (AUC amounted 13732.13) were not significantly different (p > 0.05), but they were significantly different with control (AUC amounted 22288.50) (p ≤ 0.05). EEM dose of 200 mg/kg bw (AUC amounted 18537.98) compared to comparator, EEM doses of 300 and 400 mg/kg bw was significantly different (p ≤ 0.05), but it was not significantly different with control (p > 0.05). The conclusion of the results is EEM dose of 300 mg/kg bw has the same effect with Na-diclofenac.
BAB I
PENDAHULUAN
1.1Latar Belakang
Inflamasi merupakan suatu respon protektif normal terhadap luka
jaringan yang disebabkan oleh trauma fisik, zat kimia yang merusak, atau
zat-zat mikrobiologik. Hal ini menyebabkan tubuh untuk menginaktivasi atau
merusak organisme yang menyerang, menghilangkan zat iritan dan mengatur
derajat perbaikan jaringan. Inflamasi dicetuskan oleh p
Pelepasan mediator kimiawi dari jaringan yang rusak dan migrasi sel
(Mycek, dkk., 2001; Corwin, 2008; Soenarto, 2010). Pada bentuk akut
inflamasi ditandai oleh adanya nyeri (dolor), panas (kalor), kemerahan (rubor),
bengkak (tumor) dan hilangnya fungsi (fungsiolesa) (Corwin, 2008; Soenarto,
2010)
Obat sintetis yang banyak digunakan untuk mengatasi inflamasi antara
lain kelompok obat-obat antiinflamasi non-steroid (OAINS). Diperkirakan
1,5% populasi dunia menggunakan OAINS yang dapat menimbulkan reaksi
obat tidak diinginkan contohnya penderita yang mengalami perporasi (71%)
dan pendarahan (50%) pada gastrointestinal (Tellez, et al., 2001). Penggunaan
OAINS pada anak yang kekurangan cairan tubuh atau dehidrasi juga
dilaporkan dapat menyebabkan gagal ginjal akut (Cheri, et al., 2008).
Efek samping OAINS lain yang dilaporkan, seperti turunan asam
turunan asam propionate (ibuprofen) menyebabkan nyeri kepala dan pusing.
Turunan asam indolasetat (indometasin) menyebabkan mual, muntah,
anoreksia, diare, dan nyeri abdomen. Turunan oksikam (piroksikam)
menyebabkan gangguan saluran cerna. Turunan fenamat (asam mefenamat)
menyebabkan diare, peradangan abdomen serta anemia hemolitik (Mycek,
dkk., 2001). Obat-obat AINS tersebut ternyata banyak menimbulkan reaksi
yang merugikan dan sering terjadi gangguan pada saluran cerna (Wilmana dan
Gan, 2007).
Berdasarkan hal tersebut perlu dilakukan penelitian untuk mencari
terapi alternatif yang lebih aman, terutama dari bahan alam yang berkhasiat
obat. Salah satu bahan alam yang telah dikenal sejak jaman kuno dan
berkhasiat obat adalah majakani (Quercus infectoria G. Olivier) yang
digunakan dalam perawatan pasca persalinan (Soon, et al., 2007; Satirapathkul,
et al., 2011). Orang Arab, Persia, India, Malaysia serta Cina menggunakannya
secara tradisional setelah melahirkan untuk mengobati keputihan yang terkait
dengan infeksi pada pasca persalinan (Soon, et al., 2007).
Di negara-negara Asia, rebusan majakani telah digunakan sebagai obat
kumur yang efektif untuk melawan inflamasi tonsil, juga efektif
menyembuhkan pembengkakan atau inflamasi pada kulit serta salep serbuk
simplisia majakani dapat menyembuhkan pendarahan yang disebabkan oleh
inflamasi pada kulit (Aroonrerk, et al., 2009; Pithayanukul, et al., 2009).
Majakani (Quercus infectoria G. Olivier) juga mempunyai aktifitas
terhadap respon imun mencit (Sinaga, 2012) dan antidiare dengan metode
transit intestinal (Sihombing, dkk., 2012). Ekstrak metanol kulit kayu Quercus
infectoria G. Olivier dapat menghambat inflamasi akut yang diinduksi
karagenan dan inflamasi kronik yang diinduksi formalin pada hewan
percobaan (Khauzami, et al., 2008). Majakani merupakan obat tradisional
sebagai astringen alami yang terdiri atas komponen-komponen antiseptik dan
antioksidan (Pratt, et al., 1956; Pin, et al., 2006; Soon, et al., 2007; Hapidin, et
al., 2012).
Komponen utama majakani adalah tanin (50-70%) terutama asam
galotanin yang merupakan asam tanin, asam galat (2-4%), asam elagat, asam
siringat, kalsium oksalat, resin dan pati (Rangari, 2007; Claus, 1962). Hasil
skrining fitokimia ekstrak etanol majakani (EEM) dijumpai adanya tanin,
alkaloid, flavonoid, dan glikosida (Sihombing, dkk., 2012).
Majakani putih adalah salah satu jenis majakani yang banyak dijual di
pasaran dengan harga yang relatif lebih murah dibandingkan dengan majakani
jenis lainnya. Gal ini mempunyai lubang yang menandakan serangga telah
keluar. Melalui lubang ini, oksigen dan kelembaban udara mempunyai akses
langsung dengan jaringan gal sebelah dalam dan ini menyebabkan hidrolisis
tanin. Karenanya, terjadi peningkatan jumlah asam galat dan terbentuknya
senyawa phlobotanin yang tidak larut (Claus, 1962; Trease, et al., 1983).
Soon, et al., (2007), menyebutkan bahwa majakani aman untuk
digunakan sehingga peneliti tertarik untuk menguji efek antiinflamasi dari
diperoleh dianalisis dengan ANAVA satu arah dan dilanjutkan dengan uji
Duncan untuk melihat perbedaan nyata antar perlakuan.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka perumusan masalah pada penelitian
ini adalah:
a. Apakah EEM mempunyai efek antiinflamasi terhadap udem kaki tikus
yang diinduksi karagenan 1%?
b. Apakah EEM mempunyai efek antiinflamasi yang sebanding dengan
natrium diklofenak terhadap udem kaki tikus yang diinduksi karagenan
1%?
c. Berapakah dosis terapi optimum EEM sebagai antiinflamasi?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
a. EEM diduga mempunyai efek terhadap udem kaki tikus yang diinduksi
karagenan 1%.
b. EEM diduga mempunyai efek antiinflamasi yang sebanding dengan
natrium diklofenak.
c. Diperoleh dosis terapi optimum EEM sebagai antiinflamasi.
1.4 Tujuan Penelitian
b. Mengetahui perbandingan efek antiinflamasi EEM dengan natrium
diklofenak.
c. Mengetahui dosis terapi optimum EEM sebagai antiinflamasi.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang
efek antiinflamasi dari EEM terhadap udem kaki tikus putih yang diinduksi
karagenan 1%. Sehingga menambah khasanah obat antiinflamasi alami yang
diperoleh dari bahan tumbuhan.
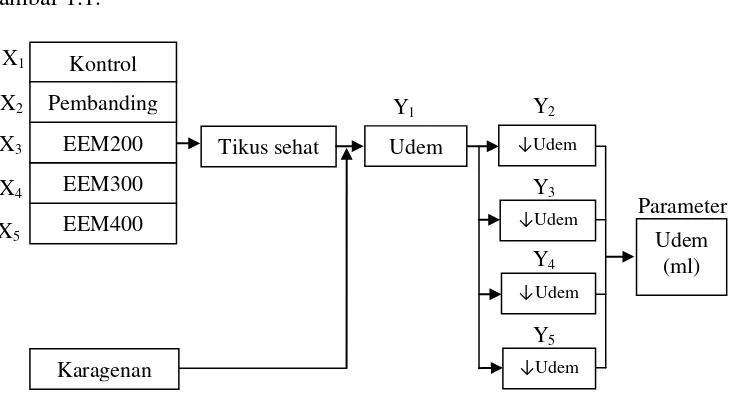
1.6 Kerangka Pikir Penelitian
Penelitian ini dilakukan terhadap tikus putih jantan Galur Wistar
menggunakan metode paw edema. Dalam penelitian ini yang disebut variabel
bebas (X) yaitu pengaruh pemberian EEM dosis 200, 300, 400 mg/kg bb,
pembanding (Na diklofenak dosis 2,25 mg/kg bb) dan kontrol (Na CMC 0,5%)
sedangkan variabel terikat (Y) adalah udem seperti yang ditunjukkan pada
Gambar 1.1.
Parameter Y1
Udem (ml) Tikus sehat
Karagenan
Udem
Y2
Y3
Y4
Y5 ↓Udem
↓Udem
↓Udem
↓Udem
X1
X5
X4
X3
X2
EEM400 Kontrol
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Tumbuhan majakani pada dasarnya berasal dari daerah Allepo di
Asiatic Turkey, juga ditemukan di Syria, Iran, Cyprus, dan Yunani (Claus,
1962; Rangari, 2007).
Gal majakani bukan merupakan jenis buah-buahan atau bagian
tumbuhan lainnya tetapi merupakan pertumbuhan abnormal (pembesaran
menjadi bongkol) dari ranting tumbuhan Quercus infectoria G. Olivier atau
disebut majakani.
Sinonim : Nutgall,Aleppo gall, Smyrna gall, Turkey
gall, Oak warts, Mad-Apple, Dead Sea-Apple,
Apple of Sodom, Dyers’ Oak.
Tumbuhan asli : Quercus infectoria G.Olivier
Famili : Fagaceae
Bagian yang digunakan : gal yang diperoleh dari ranting muda (Rangari,
2007) dan disebut juga “cecidia” atau “galla”
(Tjitrosoepomo, 1994).
Majakani dalam taksonomi tumbuhan dliklasifikasikan sebagai:
Devisi
Sub devisi
Suku : Fagaceae
Marga : Quercus
Jenis : Quercus infectoria G.Olivier (EOL, 2013)
2.1.1 Proses pembentukkan gal
Gal merupakan perkembangan patologi yang dibentuk pada ranting
pohon. Gal timbul sebagai reaksi akibat tusukan serangga kecil pada kulit
rantingnya (Claus, 1962). Serangga tersebut adalah Cynips gallaetinctoria
Hartig atau Adleria galaetinctoriae Olivier, famili Cynipidae (Rangari, 2007).
Serangga lain yaitu Aphis (kutu tanaman), dan beberapa oleh jamur.
Tahap pembentukkan gal (Pratt dan Herber, 1956):
a. Pada awal musim semi, serangga meletakkan telur-telurnya pada
ranting
b. Larva menetas dari telur dan mensekresikan enzim yang menghidrolisis
pati di daerah ranting tersebut sehingga dihasilkan gula dan
peninggkatan potensial energi.
c. Hal ini memicu pertumbuhan larva dan pembelahan sel di daerah
ranting
d. Pada tahap pupa, terbentuk komponen polifenol dari tanin berupa asam
tanat pada jaringan gal sebelah luar dan asam galat pada jaringan gal
disebelah dalam.
e. Kemudian rongga tengah terbentuk dimana pupa tumbuh dan menjadi
serangga dewasa
2.1.2 Jenis-jenis gal
Gal merupakan pertumbuhan abnormal pada tanaman akibat
pertumbuhan telur serangga yang diletakkan oleh induknya pada pada bagian
tanaman tertentu. Gal terdapat di beberapa negara, perbedaan gal dari
negara-negara ini terletak pada jenis serangga yang menginduksi ataupun berbeda
pada jenis tanamannya. Berdasarkan hal ini gal dapat dibedakan menjadi:
a. Gal Cina dan Jepang
Gal ini dihasilkan oleh induksi kutu (Schlechtendalia chinensis), pada
tangkai daun Rhus chinensis family Anacardiaceae. Banyak terdapat
dipasaran mengandung 55-77% tanin dan digunakan sebagai astringen
juga obat anti pendarahan (Claus, 1962; Trease, et al., 1983).
b. Gal Aleppo atau gal Turki
Gal ini diinduksi oleh serangga Adleria gallaetinctoriae Olivier (=
Cynips gallaetinctoriae Hartig) pada ranting muda Quercus infectoria
G. Olivier (majakani)
c. Gal mahkota Aleppo
Gal ini berasal dari Aleppo Syiria utara, berukuran seperti kacang dan
memiliki mahkota tertegak mengarah ke pucuk. Serangga yang
menginduki adalah Cynips polycera (Trease, et al., 1983).
d. Gal Amerika
Dibentuk oleh Quercus coccinea dan Quercus imbricaria oleh Cynips
aciculate berdiameter 1,5-3 cm, berbintik-bintik dan berwarna
kecoklatan dan banyak kerutan. Gal Texas dibentuk pada oak Quercus
virens dan menghasilkan 40% asam tanat. Gal California dibentuk pada
Quercus lobata dan banyak mengadung asam tanat (Claus, 1962).
e. Gal Hungaria
Gal ini diinduksi oleh serangga Cynips lignicola pada Quercus robur
yang tumbuh di Yugoslavia dan digunakan untuk penyamakan (Trease,
et al., 1983).
f. Gal oak Inggris
Gal ini diinduksi oleh Adleria kollari pada Quercus robur, berisi
15-20% tanin (Trease, et al., 1983).
Menurut kandungan tanin gal dapat dibagi menjadi 2 yaitu:
a. Gal biru
Gal ini sebenarnya berwarna abu-abu atau abu-abu kehitaman (Trease,
et al., 1983) sehingga juga disebut gal hitam, mempunyai kandungan
tanin yang tinggi dan masih terdapat serangga didalamnya. Kandungan
tanin pada gal ini tergantung pada pertumbuhan serangga. Jika telur
gagal menetas, tidak ada tanin yang dihasilkan dan gal tidak terbentuk.
Jika larva mati maka produksi tanin terhenti juga. Serangga mengalami
masa pertumbuhan didalam gal selama 5-6 bulan (Walis, 1955).
b. Gal putih
Gal ini mempunyai lubang yang menandakan serangga telah keluar.
Melalui lubang ini, oksigen dan kelembaban udara mempunyai akses
oksidasi tanin sehingga kandungan tanin pada gal ini lebih sedikit dari
gal biru (Claus, 1962; Trease, et al., 1983).
2.1.3Karakteristik makroskopik gal majakani
Bentuk gal bulat dan berdiameter 10-25 mm, memiliki tangkai yang
pendek, batang bebentuk basal, dan mempunyai banyak tonjolan pada
permukaanya. Gal ini berat dan biasanya tenggelam dalam air. Beberapa
memiliki lubang yang melingkar untuk serangga keluar (Trease, et al., 1983).
2.1.4Karakteristik mikroskopik gal majakani
Penampang melintang gal menunjukkan parenkim berdinding tipis di
sebelah luar lebih banyak dibandingkan sebelah dalam. Setelah parenkim,
kemudian diikuti oleh sebuah cincin sklerenkim yang terdiri atas satu atau dua
lapis sel. Bagian dalam terdiri atas jaringan parenkim berdinding tebal yang
mengelilingi rongga tengah. Jaringan parenkim berisi banyak pati, gumpalan
tanin, kristal dalam bentuk rose atau prisma dari kalsium oksalat (Trease, et al.,
1983)
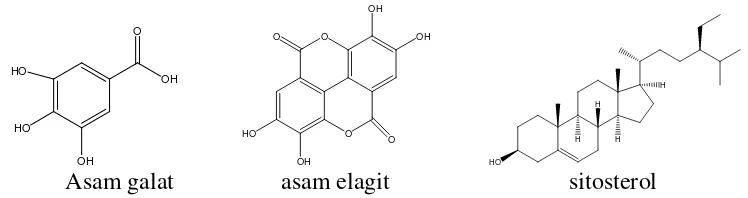
2.1.5Kandungan kimia gal majakani
Gal terdiri atas 50 – 70% tanin terutama asam galotanin yang merupakan
tanin. Selain itu juga terdapat 2 – 4% asam galat, asam elagit, sitosterol, metil
belulat dan metil oleanolat yang merupakan ester dari betulit dan asam
oleanolit. Baru-baru ini beberapa komponen seperti asam niktantik, asam
roburit, asam siringat dan pati (Rangari, 2007).Rumus struktur komponen gal
OH HO HO
OH O
O O
HO
OH
OH OH
O
O
H H
H
HO
H
Asam galat asam elagit sitosterol
Gambar 2.1 Rumus struktur komponen gal majakani (Pratt dan Herber, 1956)
2.1.6 Uji kualitatif gal majakani
Campuran air dengan serbuk gal (1:10.000) menunjukkan endapan biru
gelap dengan 5% larutan feri sulfat, endapan berwarna coklat gelap dengan 1%
larutan feri asetat, warna orange kecoklatan dan sedikit endapan dengan kalium
dikromat jenuh ditambah sedikit asam asetat; serta coklat kekuningan dan
endapan dengan 1% larutan natrium karbonat (Claus, 1962).
2.1.7Kegunaan gal majakani
Secara tradisional gal majakani (Quercus infectoria G.Olivier)
digunakan sebagai bahan astringen alami yang mengandung komponen
antiseptik dan antioksidan (Pratt dan Herber, 1956). Beberapa penelitian juga
telah membuktikan beberapa efek farmakologinya seperti sebagai antidiabetes
(Hwang, et al., 2000), anastetik lokal, antivirus (Hussein, et al., 2000), dan
antibakteri (Fatima, et al., 2001).
Berbagai penelitian telah dilakukan untuk menguji manfaat gal majakani
(Quercus infectoriaG. Olivier), seperti khasiatnya sebagai obat luka bakar
(Umachigi, et al., 2008) dan penelitian tentang daya antibakteri ekstrak alkohol
gal majakani terhadap bakteri gram positif dan gram negatif (Leela dan
2.2 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain
simplisia merupakan bahan yang dikeringkan. Simplisia dapat berupa simplisia
nabati, simplisia hewani, dan simplisia pelican atau mineral. Simplisia nabati
adalah simplisia yang berupa tanaman utuh, bagian tanaman atau eksudat
tanaman. Yang dimaksud dengan eksudat tanaman ialah isi sel yang secara
spontan keluar dari tanaman atau yang dengan cara tertentu dikeluarkan dari
selnya, atau zat-zat nabati lainnya yang dengan cara tertentu dipisahkan dari
tanamannya. Untuk menjamin keseragaman senyawa aktif, keamanan maupun
kegunaannya, maka simplisia harus memenuhi persyaratan minimal. Dan untuk
dapat memenuhi persyaratan minimal tersebut, ada beberapa faktor yang
berpengaruh, antara lain bahan baku simplisia, proses pembuatan simplisia
(termasuk cara penyimpanan simplisia), cara pengepakan dan penyimpanan
simplisia (Depkes, 1985).
2.2.1 Tahap pembuatan simplisia
Agar simplisia memenuhi persyaratan minimal yang ditetapkan, maka
dilakukan tahapan kegiatan berikut ini.
a. Sortasi Basah
Sortasi basah dilakukan untuk memisahkan kotoran-kotoran atau
bahan-bahan asing lainnya dari bahan simplisia. Misalnya simplisia
yang dibuat dari akar suatu tanaman obat, bahan-bahan asing seperti
pengotoran lainnya harus dibuang. Tanah mengandung
bermacam-macam mikroba dalam jumlah yang tinggi, oleh karena itu pembersihan
simplisia dari tanah yang terikut dapat mengurangi jumlah mikroba
awal (Depkes, 1985).
b. Pencucian
Pencucian dilakukan untuk menghilangkan tanah dan pengotoran
lainnya yang melekat pada bahan simplisia. Pencucian dilakukan
dengan air bersih, misalnya air dari mata air, air sumur atau air PAM.
Bahan simplisia yang mengandung zat yang mudah larut di dalam air
yang mengalir, pencucian hendaknya dilakukan dalam waktu yang
sesingkat mungkin (Depkes, 1985).
c. Perajangan
Beberapa jenis bahan simplisia perlu mengalami proses perajangan.
Perajangan bahan simplisia dilakukan untuk mempermudah proses
pengeringan, pengepakan dan penggilingan. Semakin tipis bahan yang
akan dikeringkan, semakin cepat penguapan air, sehingga mempercepat
waktu pengeringan. Akan tetapi irisan yang terlalu tipis juga dapat
menyebabkan berkurangnya atau hilangnya zat berkhasiat yang mudah
menguap, sehingga mempengaruhi komposisi, bau dan rasa yang
diinginkan (Depkes, 1985).
Tujuan pengeringan ialah untuk mendapatkan simplisia yang tidak
mudah rusak, sehingga dapat disimpan dalam waktu yang lebih lama.
Dengan mengurangi kadar air dan menghentikan reaksi enzimatik akan
dicegah penurunan mutu atau perusakan simplisia. Air yang masih
tersisa dalam simplisia pada kadar tertentu dapat merupakan media
pertumbuhan kapang dan jasad renik lainnya. Proses pengeringan sudah
dapat menghentikan proses enzimatik dalam sel bila kadar airnya dapat
mencapai kurang dari 10%. Hal-hal yang perlu diperhatikan selama
proses pengeringan adalah suhu pengeringan, kelembapan udara, aliran
udara, waktu pengeringan, dan permukaan bahan. Suhu yang terbaik
dalam pengeringan adalah tidak melebihi 60°C, tetapi bahan aktif yang
tidak tahan panas atau mudah menguap harus dikeringkan pada suhu
serendah mungkin, misalnya 30°C sampai 45°C. Terdapat dua cara
pengeringan yaitu pengeringan alamiah (dengan panas sinar matahari
langsung atau dengan diangin-anginkan) dan pengeringan buatan
(menggunakan instrument). Dengan menggunakan pengeringan buatan
dapat diperoleh simplisia dengan mutu yang lebih baik karena
pengeringan akan lebih cepat dan merata, tanpa dipengaruhi cuaca
(Depkes, 1985).
e. Sortasi Kering
Sortasi setelah pengeringan sebenarnya merupakan tahap akhir
pembuatan simplisia. Tujuan sortasi untuk memisahkan benda-benda
pengotoran-pengotoran lain yang masih ada dan tertinggal pada
simplisia kering. Proses ini dilakukan sebelum simplisia dibungkus
untuk kemudian disimpan. Pada simplisia bentuk rimpang, sering
jumlah akar yang melekat pada rimpang terlampau besar dan harus
dibuang. Demikian pula adanya partikel-partikel pasir, besi dan
benda-benda tanah lain yang tertinggal harus dibuang sebelum simplisia
dibungkus (Depkes, 1985).
f. Penyimpanan
Selama penyimpanan ada kemungkinan terjadi kerusakan pada
simplisia. Kerusakan tersebut dapat mengakibatkan kemunduran mutu,
sehingga simplisia bersangkutan tidak lagi memenuhi syarat yang
diperlukan atau yang ditentukan. Oleh karena itu pada penyimpanan
simplisia perlu diperhatikan beberapa hal yang dapat mengakibatkan
kerusakan simplisia, yaitu cara pengepakan, pembungkusan, dan
pewadahan, persyaratan gudang simplisia, cara sortasi dan pemeriksaan
mutu, serta cara pengawetannya. Penyebab kerusakan pada simplisia
yang utama adalah air dan kelembapan. Cara menyimpan simplisia
yang kurang tepat akan menyebabkan rusaknya simplisia akibat hewan
pengerat. Cara pengemasan simplisia tergantung pada jenis simplisia
dan tujuan penggunaan pengemasan. Bahan dan bentuk pengemasan
harus sesuai. Wadah harus bersifat tidak beracun dan tidak bereaksi
serta penyimpanan warna, rasa, bau, dan sebagainya pada simplisia
(Depkes, 1985).
2.3 Ekstrak dan Ekstraksi
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi zat
aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau
serbuk yang tersisa diperlakukan sedemikian hingga memenuhi baku yang
telah ditetapkan (Depkes, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
Simplisia yang akan diekstrak mengandung senyawa aktif yang dapat larut dan
senyawa yang tidak dapat larut dan mempunyai struktur kimia yang
berbeda-beda yang dapat mempengaruhi kelarutan dan stabilitas senyawa-senyawa
tersebut terhadap suhu, udara, cahaya, dan logam berat (Depkes, 2000).
2.3.1 Metode ekstraksi dengan menggunakan pelarut
a. Cara dingin
i. Maserasi
Maserasi adalah suatu metode ekstraksi menggunakan pelarut dengan
beberapa kali pengocokan atau pengadukan pada temperatur ruangan
(kamar). Secara teknologi termasuk ekstraksi dengan prinsip metode
pencapaian konsentrasi pada keseimbangan. Maserasi kinetik berarti
dilakukan pengulangan penambahan pelarut setelah dilakukan
penyaringan maserat pertama dan seterusnya (Depkes, 2000).
ii. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada
temperatur ruangan. Proses terdiri dari tahapan pengembangan bahan,
tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus menerus sampai diperoleh
ekstrak (perkolat) yang jumlahnya 1-5 kali bertahan (Depkes, 2000).
b. Cara panas
i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses
pada residu pertama sampai 3-5 kali sehingga dapat termasuk proses
ekstraksi sempurna (Depkes, 2000).
ii.Soxhlet
Soxhlet adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi
kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin
iii. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu
secara umum dilakukan pada temperature 40 – 50°C (Depkes, 2000).
iv. Infus
Infus adalah ekstraksi dengan pelarut air pada temperature penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
96-98°C selama waktu tertentu (15 – 20 menit) (Depkes, 2000).
v. Dekok
Dekok adalah infus pada waktu yang lebih lama ≥ 30 °C dan temperatur
sampai titik didih air (Depkes. 2000).
2.3.2 Pengeringan ekstrak dengan metode freeze drying
Pengeringan secara umum bermaksud untuk menghilangkan pelarut
dari material yang akan dikeringkan. Salah satu tipe pengeringan yaitu
freeze-drying. Pengeringan-beku adalah proses pengeringan di mana pelarut dan atau
media suspensi yang mengkristal pada temperatur rendah dan sesudahnya
mensublimasi dari padat langsung ke fase uap. Pengeringan-beku lebih banyak
dilakukan dengan air sebagai pelarut. Pengeringan mengubah es atau air dalam
fase amorf menjadi uap. Karena tekanan uap es rendah, volume uap menjadi
besar. Tujuan pengeringan-beku adalah untuk memproduksi suatu substansi
dengan stabilitas yang baik dan tidak berubah setelah rekonstitusi dengan air,
meskipun hal ini sangat tergantung juga pada langkah terakhir proses
2.4 Inflamasi
2.4.1 Definisi inflamasi
Inflamasi adalah respon protektif setempat yang ditimbulkan oleh
cedera atau kerusakan jaringan, yang berfungsi menghancurkan, mengurangi,
atau mengurung suatu agen pencedera maupun jaringan yang cedera itu. Pada
bentuk akut ditandai oleh tanda klasik yaitu: nyeri (dolor), panas (kalor),
kemerahan (rubor), bengkak (tumor), dan hilangnya fungsi (fungsiolesa).
Secara histologis, menyangkut rangkaian kejadian yang rumit, yaitu mencakup
dilatasi arteri, kapiler dan venula, disertai peningkatan permeabilitas aliran
darah, eksudasi cairan, termasuk protein plasma dan migrasi leukosit kedalam
fokus peradangan. Respon ini disebabkan oleh pembebasan mediator
(histamin, serotonin, prostaglandin, kinin) yang berperan mengatur,
mengaktifkan sel-sel, baik dari darah maupun jaringan dan kemudian dapat
timbul gelaja dari jaringan yang cidera (Soenarto, 2007).
2.4.2Mediator inflamasi
Banyak substansi endogen yang ditemukan dikenal sebagai mediator
peradangan di antaranya adalah histamin, bradikinin, kalidin, serotonin,
prostaglandin, dan leukotrien. Histamin merupakan mediator pertama yang
dilepaskan dari sekian banyak mediator lain dan segera muncul dalam
beberapa detik setelah diinduksi yang berperan meningkatkan permeabilitas
kapiler. Histamin merupakan produk dekarboksilasi asam amino histidin yang
terdapat dalam semua jaringan tubuh. Konsentrasi tertinggi terdapat dalam
basofil adalah dalam bentuk tak aktif secara biologik dan tersimpan terikat
pada heparin dan protein basa. Histamin akan dibebaskan dari sel tersebut pada
reaksi hipersensitivitas, kerusakan sel (misalnya pada luka) serta akibat
senyawa kimia pembebas histamin (Mutschler, 1999).
Bradikinin dan kalidin adalah mediator radang yang secara lokal
menimbulkan rasa nyeri, vasodilatasi, meningkatkan permeabilitas kapiler dan
berperan meningkatkan potensi prostaglandin (Mansjoer, 2003). Serotonin
(5-hidroksitriptamin, 5-HT), berasal dari asam amino esensial triptamin melalui
hidroksilasi dan dekarboksilasi, terdapat dalam platelet darah, mukosa usus dan
di beberapa bagian otak dengan konsentrasi tinggi. Serotonin disimpan dalam
granula, terikat dengan ATP serta protein dan dibebaskan jika sel dirangsang
melalui eksositosis dan mengaktifkan reseptor spesifik. Pada trombosit,
serotonin berfungsi meningkatkan agregasi dan mempercepat penggumpalan
dara sehingga mempercepat hemostasis (Mutschler, 1999).
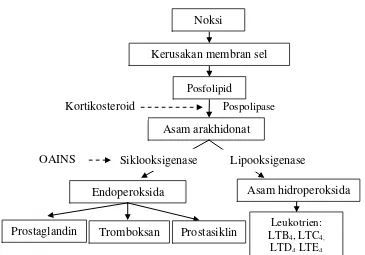
Asam arakhidonat merupakan precursor sejumlah besar mediator
inflamasi. Senyawa ini merupakan komponen utama lipid seluler dan hanya
terdapat dalam keadaan bebas dalam jumlah kecil, sebagian besar berada dalam
bentuk posfolipid membrane sel. Bila membran sel kerusakan oleh suatu noksi
(rangsangan kimiawi, fisis atau mekanis) maka enzim posfolipase akan
diaktifasi untuk mengubah posfolipid menjadi asam arakhidonat. Asam lemak
C20 ini selanjutnya akan diubah menjadi senyawa mediator melalui dua alur
Pada alur siklooksigenase sebagian asam arakhidonat akan diubah oleh
enzim siklooksigenase menjadi endoperoksida dan seterusnya menjadi
prostaglandin (PG), prostasiklin dan tromboksan, sebagian lagi asam
arakhidonat akan diubah menjadi enzim lipooksigenase menjadi asam
hidroperoksida dan seterusnya menjadi leukotrien yang disebut juga Slow
Reacting Subtances of Anaphilaxis (SRSA). Baik prostaglandin maupun
leukotrien, bertanggung jawab bagi sebagian besar gejala peradangan
(Mutschler, 1999).
Prostaglandin bekerja lemah, berpotensi kuat setelah bergabung dengan
mediator atau subtansi lain yang dibebaskan secra lokal seperti histamin,
serotonin dan leukotrien. Prostaglandin mampu menginduksi vasodilatasi
pembuluh darah dalam beberapa menit dan terlibat menjadi nyeri, radang,
demam dan diare. Dari alur lipooksigenase dihasilkan mediator leukotrien.
Mediator LTB4 potensial kemotaktik terhadap leukosit polimorfonuklear,
eosinofil dan monosit. Pada konsentrasi tinggi, LTB4 menstimulasi agregasi
leukosit polimorfonuklear. Selain itu LTB4 mempunyai kemampuan
meningkatkan eksudasi plasma dan mengakibatkan hiperalgesia. Kombinasi
dua senyawa leukotrien yaitu LTC4 dan LTD4 dapat menyebabkan peradangan,
reaksi anafilaksis, reaksi alergi dan asma. LTE4 menyebabkan gejala
hipersensitifitas, bronkokronstriksi, kontraksi otot polos dan permeabilitas
vascular. Aktivitasnya jauh lebih kecil dari prazatnya yaitu LTC4 dan LTD4
2.4.3Sistem pertahanan tubuh pada inflamasi
Pertahanan tubuh dapat dibagi menjadi dua:
a. Sistem imun nonspesifik (bawaan)
Sel-sel dari sistem ini adalah neutrofil fagositosis, makrofag, basofil, sel-sel
mast, eosinofil, trombosit, monosit dan sel-sel pembunuh alami (Natural
Killer (NK) sel). Faktor-faktor yang larut adalah lisozim sitokin, INF,
komplemen, protein fase akut (Soenarto, 2010).
b. Sistem imun spesifik (penyesuaian)
Zat yang larut termasuk pada sistem ini adalah antibody, immunoglobulin
yang dihasilkan oleh limposit B dan sel plasma, dan limpokin-limpokin
yang kebanyakan diproduksi oleh limposit T. Sedangkan faktor-faktor yang
larut lainya adalah lisosim, interferon, sitokin, komplemen protein fase akut
(Soenarto, 2010).
Fungsi makrofag, sel mast, neutrofil dan limposit dalam proses
inflamasi yaitu menangkap, menghalau, memangsa, membersihkan dan
berusaha menyingkirkan antigen pada jaringan cidera. Usaha tersebut dapat
dilaksanakan karena sel-sel yang berfungsi melawan antigen atau protogen
telah memiliki zat-zat yang ada dalam sel yang telah siap dibentuk sebelum ada
rangsang atau pacu. Kemudian dapat dikeluarkan dan berfungsi dalam
pertahanan tubuh untuk mengatasi inflamasi, dengan zat atau bahan yang
Sel-sel pemangsa (fagosit) merupakan pertahanan dalam lini pertama
guna membinasakan zat-zat pathogen. Dan yang berfungsi dalam hal ini
termasuk makrofag dan neutrofil (Soenarto, 2010).
Sel-sel yang ada didalam tubuh dilengkapi dengan reseptor-reseptor
yang ada dipermukaan sel. Disamping itu dari sel-sel dilengkapi pula zat yang
dapat dikeluarkan dengan fungsi untuk pengaktifan atau pemicu terhadap sel
lain agar menjadi aktif. Zat-zat tersebut merupakan mediator (Soenarto, 2010).
2.4.4Mekanisme terjadinya inflamasi
Inflamasi terjadi dengan diawali adanya stimulus yang merusak
jaringan (noksi), baik karena bakteri, trauma, bahan kimiawi, panas atau
fenomena lainnya, mengakibatkan sel mast pecah dan terlepasnya
mediator-mediator inflamasi. Kemudian terjadi vasodilatasi dari seluruh pembuluh darah
pada daerah inflamasi sehingga aliran darah meningkat. Perubahan volume
darah dalam kapiler dan venula, yang menyebabkan sel-sel endotel pembuluh
darah meregang dan kemudian meningkatkan permeabilitas pembuluh darah,
protein plasma keluar dari pembuluh darah lalu menimbulkan udem. Infiltrasi
leukosit ke tempat inflamasi, pada tingkat awal infiltrasi oleh neutrofil,
selanjutnya infiltrasi oleh sel monosit. Sel monosit akan berubah menjadi
makrofag. Baik neutrofil maupun makrofag dapat melepaskan enzim lisosom
untuk membantu mencerna eksudat radang. Bila tidak terjadi resolusi, maka
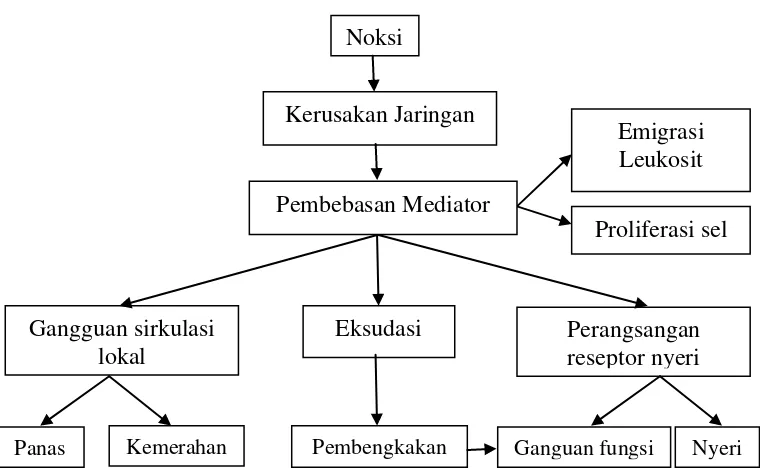
dapat meningkat menjadi inflamasi kronik (Underwood, 1999). Patogenesis
Gambar 2.2 Patogenesis dan gejala peradangan (Mutschler,1999)
2.4.5Macam-macam inflamasi
Berdasarkan waktu kejadiannya, inflamasi terbagi atas 2 macam:
a. Inflamasi Akut
Inflamasi ini merupakan respon langsung dari tubuh terhadap cedera atau
kematian sel. Tanda-tanda pokok peradangan akut mencakup kemerahan
(rubor), panas (kalor), rasa sakit (dolor), pembengkakan (tumor), dan
perubahan fungsi (fungsio laesa). Peristiwa penting pada peradangan akut
adalah dilatasi pembuluh darah dan perubahan permeabilitas
pembuluh-pembuluh yang sangat kecil yang mengakibatkan kebocoran protein,
sehingga terjadi pembentukan eksudat seluler berupa emigrasi neutrofil
polimmorf ke dalam rongga ekstravaskuler yang kemudian menimbulkan
pembengkakan jaringan (Price dan Wilson, 1995; Underwood, 1999). Emigrasi
Leukosit
Proliferasi sel Noksi
Kerusakan Jaringan
Pembebasan Mediator
Gangguan sirkulasi lokal
Eksudasi Perangsangan reseptor nyeri
b. Inflamasi kronik
Inflamasi kronik didefinisikan sebagai proses radang dimana limfosit, sel
plasma, dan makrofag lebih banyak ditemukan, dan biasanya disertai pula
dengan pembentukan jaringan granulasi, yang menghasilkan fibrosis.
Radang akut dapat menjadi radang kronik apabila pusat membentuk rongga
abses yang terletak di dalam, dan pembuangannya berlangsung lama atau
tidak lancar, sewaktu proses pembuangan berlangsung, terbentuk pula
penebalan dinding abses yang terdiri dari jaringan granulasi dan jaringan
ikat fibrosa. Oleh karena itu dinding abses yang kaku menyebabkan tidak
terjadinya penyatuan sewaktu pembuangan berlangsung, dan sisa pus di
dalam rongga abses mengalami organisasi dengan tumbuhnya jaringan
granulasi, yang pada akhirnya akan diganti dengan jaringan parut fibrosa.
Contoh inflamasi kronik adalah inflamasi akibat tuberkolosis (Underwood,
1999).
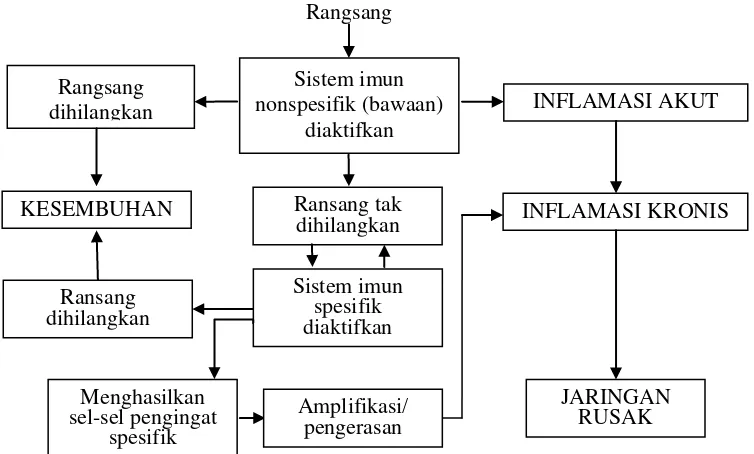
Inflamasi akut secara normal terjadi apabila faktor-faktor yang
mempengaruhi dapat dihilangkan oleh respon imun nonspesifik (respon imun
bawaan), maka inflamasi terhenti, jika tidak maka respon imun spesifik akan
diaktifkan untuk mengatasinya. Inflamasi kronis dapat terjadi karena
faktor-faktor yang mempengaruhi tersebut tidak dapat dihilangkan oleh respon imun
spesifik, dikarenakan faktor-faktor tersebut melengkapi diri atau mengekalkan
diri, atau melalui mekanisme tubuh yang gagal dalam proses inflamasi.
Kemudian proses inflamasi akan berubah bentuk dari mekanisme protektif, dan
normal (Santoso, 1999; Soenarto, 2010). Mekanisme sistem imun nonspesifik
[image:43.595.113.490.159.386.2]dan spesifik pada inflamasi akut dan kronis dapat dilihat pada Gambar 2.3.
Gambar 2.3 Mekanisme sistem imun nonspesifik dan spesifik pada inflamasi akut dan kronis (Santoso, 1999; Soenarto, 2010).
2.4.6Golongan obat antiinflamasi
Obat-obat antiinflamasi memiliki aktivitas menekan atau mengurangi
peradangan. Aktivitas ini dapat dicapai melalui berbagai cara yaitu
menghambat pembentukan mediator radang prostaglandin, menghambat
migrasi sel-sel leukosit ke daerah radang, menghambat pelepasan
prostaglandin dari sel-sel tempat pembentukannya. Bagan penghambatan
obat-obat antiradang terhadap pembentukan mediator radang dapat dilihat pada
Gambar 2.4.
Rangsang
Sistem imun nonspesifik (bawaan)
diaktifkan
INFLAMASI AKUT Rangsang
dihilangkan
KESEMBUHAN
Ransang dihilangkan
Ransang tak dihilangkan
Sistem imun spesifik diaktifkan
Menghasilkan sel-sel pengingat
spesifik
Amplifikasi/ pengerasan
INFLAMASI KRONIS
Gambar 2.4 Bagan penghambatan obat anti radang terhadap pembentukan mediator radang (Mansjoer, 2003).
Keterangan: = efek penghambatan LTB4 = dihidroksi leukotrien B4,
LTC4 = leukotrien C4
LTD4 = leukotrien D4
LTE4 = leukotrien E4
Berdasarkan mekanisme kerjanya, obat-obat antiinflamasi terbagi ke dalam
golongan:
a. Antiinflamasi Steroid
Obat ini bekerja dengan cara menghambat posfolipase, suatu enzim yang
bertanggung jawab terhadap pelepasan asam arakidonat dari membran lipid.
Termasuk golongan obat ini adalah prednison, hidrokortison, deksametason,
dan betametason (Katzung, 1996).
Pospolipase Posfolipid
Asam arakhidonat Kortikosteroid
Endoperoksida Asam hidroperoksida
Tromboksan
Prostaglandin Prostasiklin LTBLeukotrien: 4, LTC4,
LTD4 LTE4 Siklooksigenase
OAINS Lipooksigenase
Noksi
b. Antiinflamasi Non Steroid
Obat ini bekerja dengan menghambat enzim siklooksigenase sehingga
konversi asam arakidonat menjadi PGG2 terganggu. Termasuk golongan
obat ini adalah ibuprofen, indometasin, diklofenak, fenilbutazon, dan
pirosikam (Wilmana dan Gan, 2007).
2.4.7Natrium diklofenak
Natrium diklofenak merupakan obat antiinflamasi nonsteroid. Obat ini
bekerja menghambat aktivitas enzim siklooksigenase yang berperan dalam
metabolisme asam arakidonat menjadi prostaglandin yang merupakan salah
satu mediator inflamasi (Kertia, 2009). Natrium diklofenak merupakan derivat
fenilasetat yang termasuk NSAID yang daya antiradangnya paling kuat dengan
efek samping yang kurang dibandingkan dengan obat lainnya (seperti
indometasin, piroxicam) (Tjay dan Raharja, 2002).
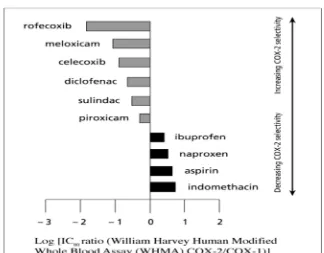
Penghambatan OAINS terhadap enzim COX dapat ditunjukkan dengan
logaritma perbandingan IC80 COX-2/COX-1. Inhibitory concentration 80
(IC80) adalah konsentrasi yang dapat menghambat 80% aktivitas COX.
Berdasarkan logaritma perbandingan tersebut diklofenak mempunyai nilai
logaritma perbandingan IC80 COX-2 /COX-1 lebih kecil dari 0 dan lebih besar
dari -1, hal ini berarti diklofenak lebih cenderung menghambat aktivitas
COX-2 tetapi juga masih mempengaruhi aktivitas COX-1 pada konsentrasi yang
lebih besar, sehingga efek samping pada gastrointestinal lebih kecil (Kerr dan
Gailer, 2010). Tingkat selektivitas dari diklofenak dan beberapa OAINS dapat
Gambar 2.5 Selektif penghambat COX2 dan beberapa OAINS berdasarkan
logaritmaperbandingan inhibitory concentration (IC80). Garis 0
menunjukkan potensi yang sama dimana hasil perbandingan IC80 antara COX-2 dan COX-1 adalah 1) (Kerr dan Gailer,
2010).
Absorpsi obat ini melalui saluran cerna berlangsung cepat dan lengkap
yang terikat 99% pada protein plasma dan mengalami efek lintas awal
(first-pass) sebesar 40-50%. Walaupun waktu paruh singkat yakni 1-3 jam, Na
diklofenak diakumulasi di cairan sinovilia yang menjelaskan efek terapi di
sendi jauh lebih panjang dari waktu paruh obat tersebut. Efek samping yang
lazim terjadi ialah mual, gastritis, eritema kulit, dan sakit kepala. Dosis orang
2.4.8Beberapa metode uji antiinflamasi
a. Metode pembentukan udem buatan
Salah satu teknik yang paling umum digunakan berdasarkan
kemampuan agen tersebut untuk menghambat produksi udem di kaki belakang
tikus setelah injeksi agen radang yang kemudian diukur volume radang.
Volume udem diukur sebelum dan sesudah pemberian zat yang diuji. Beberapa
iritan yang dipakai sebagai penginduksi udem antara lain formalin, kaolin, ragi,
dan dekstran. Iritan yang umum digunakan dan memiliki kepekaan yang tinggi
adalah karagen (Vogel, 2008).
b. Metode pembentukan eritema
Metode ini berdasarkan pengamatan secara visual terhadap eritema
pada kulit hewan yang telah dicukur bulunya. Marmot secara kimiawi
dihilangkan bulunya dengan suspense barium sulfat, 20 menit kemudian
dibersihkan dengan air hangat. Hari esoknya senyawa uji disuspensikan dan
setengah dosisnya diberikan 30 menit sebelum pemaparan UV. Setengahnya
lagi setelah 2 menit berjalan pemaparan UV. Eritema dibentuk akibat iritasi
sinar UV berjarak 20 cm diatas marmot. Eritema dinilai 2 dan 4 jam setelah
pemaparan (Vogel, 2008).
c. Metode iritasi dengan panas
Metode ini berdasarkan pengukuran luas radang dan berat udem yang
terbentuk setelah diiritasi dengan panas. Mula-mula hewan diberi zat warna
tripan biru yang disuntik secara IV, dimana zat ini akan berikatan dengan
dengan panas yang cukup tinggi. Panas menyebabkan pembebasan histamin
endrogen sehingga timbul inflamasi. Zat warna akan keluar dari pembuluh
darah yang mengalami dilatasi bersama-sama dengan albumin plasma sehingga
jaringan yang meradang kelihatan berwarna. Penilaian derajat inflamasi
diketahui dengan mengukur luas radang akibat perembesan zat ke jaringan
yang meradang. Pengukuran juga dapat dilakukan dengan menimbang udem
yang terbentuk, dimana jaringan yang meradang dipotong kemudian ditimbang
(Vogel,2008).
d. Metode pembentukan kantong granuloma
Metode ini berdasarkan pengukuran volume eksudat yang terbentuk di
dalam kantong granuloma. Mula-mula benda terbentuk pellet yang terbuat dari
kapas yang ditanam di bawah kulit abdomen tikus menembus lapisan linia
alba. Respon yang terjadi berupa gejala iritasi, migrasi leukosit dan makrofag
ke tempat radang yang mengakibatkan kerusakan jaringan dan timbul
granuloma (Vogel, 2008).
e. Metode iritasi pleura
Metode ini berdasarkan pengukuran volume eksudat yang terbentuk
karena iritasi dengan inductor radang. Adanya aktivitas obat yang diuji
ditandai dengan berkurangnya volume eksudat. Obat diberikan secara oral.
Satu jam kemudian disuntik dengan inductor radang seperti formalin secara
intra pleura. Setelah 24 jam, hewan dibunuh dengan eter lalu rongga pleura
f. Metode induksi oxazolon udem telinga mencit
Pada percobaan ini tikus telinga tikus diinduksi 0.01 ml 2% larutan
oxazolon ke dalam telinga kanan. Inflamasi terjadi dalam 24 jam. Kemudian
hewan dikorbankan dibawah anastesi lalu dibuat preparat dengan 8 mm dan
perbedaan berat preparat menjadi indicator inflamasi udem (Vogel, 2008).
2.4.9Karagenan
Karagenan diperoleh dari ekstrak rumput laut merah (Rhodopyceace).
Penggunaan karagenan sebagai penginduksi radang memiliki beberapa
keuntungan antara lain tidak meninggalkan bekas, tidak menimbulkan
kerusakan jaringan dan memberikan respon yang lebih peka terhadap obat
antiinflamasi dibanding senyawa iritan lain seperti dextran 1% dan egg white
BAB III
METODE PENELITIAN
Metode yang digunakan pada penelitian ini adalah metode
eksperimental (experimental research). Metode penelitian ini adalah
suatu=bservasi yang dilakukan di laboratorium dengan kondisi buata (artificial
condition), yang diatur oleh peneliti. Metode eksperimental dimaksudkan
untuk mengetahui pengaruh atau hubungan antara variabel bebas (X) yang
disebut faktor perlakuan dengan variabel terikat (Y) yang disebut faktor
pengamatan (Hanafiah, 2005). Dalam penelitian ini yang disebut variabel
bebas yaitu pengaruh pemberian EEM dosis 200, 300, 400 mg/kg bb, Na
diklofenak dosis 2,25 mg/kg bb, Na CMC 0,5%, dan tikus sedangkan variabel
terikat adalah udem. Dengan cara memberikan perlakuan pada kelompok
eksperimen menggunakan kontrol dan pembanding akan dapat diramalkan efek
bahan yang diuji. Pengujian ekstrak etanol majakani terhadap efek
antiinflamasi menggunakan metode paw edema. Hasil yang diperoleh diolah
homogenitas variannya dengan uji Kolmogorof-Smirnov, analisis variansi
(ANAVA) satu arah dengan taraf kepercayaan 95%. Selanjutnya dilanjutkan
uji beda rata-rata Duncan . Jika data tidak terdistribusi normal dan tidak
homogen dilanjutkan uji Kruskall Wallis dan Mann-Whitney. Analisis data
dikerjakan dengan program Statistical Product and Service Solution SPSS
versi 16 utnuk menyatakan secara signifikan atau tidak parameter-parameter
3.1 Alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas,
neraca listrik, stopwatch, neraca hewan (Presica Geniweigher, GW-1500), Rat
strainer, kandang tikus, spuit, spatula dan pletismometer. Alat-alat yang
digunakan dapat dilihat pada Lampiran 15, halaman 94.
3.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah ekstrak etanol
majakani (Quercus infectoria G. Olivier), natrium diklofenak, Na CMC, λ
-karagenan, larutan fisiologis (natrium klorida 0.9%) dan akuades.
3.3 Pengolahan Sampel dan Pembuatan Ekstrak
Ekstrak etanol majakani yang digunakan dalam penelitian ini dari
peneliti sebelumnya yaitu Sihombing, dkk., (2012). Cara yang dilakukannya
adalah sebagai berikut:
3.3.1 Pengambilan sampel
Pengambilan sampel majakani (Quercus infectoria G. Olivier)
dilakukan secara purposif yang diperoleh dari toko obat tradisional di Pasar
Sambu, Medan. Jenis majakani yang diteliti adalah majakani putih dari Turki.
Identifikasi sampel majakani dilakukan di Herbarium Bogoriense, Bidang
Botani Pusat, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
3.3.2 Pembuatan ekstrak
Pembuatan ekstrak etanol majakani (EEM) dilakukan secara maserasi
menggunakan etanol 80% Depkes, (1979), dilakukan oleh Sihombing, dkk.,
(2012).
Cara kerja:
Sebanyak 1800 g serbuk simplisia majakani dimasukkan ke dalam wadah kaca
berwarna gelap, kemudian dituangi dengan 7500 ml etanol 80%. Ditutup dan
dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, diserkai
dan diperas. Ampas dicuci dengan 1500 ml etanol 80%, dipindahkan ke dalam
bejana tertutup, dibiarkan di tempat sejuk, terlindung dari cahaya selama 2
hari, selanjutnya disaring. Maserat etanol yang diperoleh diuapkan dengan
menggunakan rotary evaporator pada temperatur ± 40oC sampai diperoleh
ekstrak kental kemudian dikeringkan menggunakan freeze dryer.
3.4 Uji Efektivitas Antiinflamasi
Pengujian efek antiinflamasi ini terdiri dari beberapa tahap, yaitu
penyiapan hewan percobaan, penyiapan bahan, dan pengujian efek
antiinflamasi.
3.4.1 Penyiapan hewan percobaan
Hewan percobaan yang digunakan adalah tikus jantan putih galur
Wistar dengan berat badan 150-200 g sebanyak 30 ekor, dibagi dalam 5
kelompok, setiap kelompok terdiri dari 6 ekor. Dua minggu sebelum pengujian
mempunyai ventilasi baik dan selalu dijaga kebersihannya. Hewan yang sehat
ditandai dengan pertumbuhan normal dan suhu badan normal (Depkes, 1979).
3.4.2 Penyiapan bahan
Penyiapan bahan-bahan meliputi larutan suspensi CMC 0,5%,
karagenan sebagai penginduksi, suspensi Na-diklofenak dosis 2,25 mg/kg bb,
suspensi ekstrak etanol majakani (Quercus infectoria G.Olivier).
3.4.2.1 Pembuatan larutan Na CMC 0,5%
Sebanyak 0,5 g Na CMC ditaburkan ke dalam lumpang berisi air suling
panas sebanyak 10 ml, ditutup dan dibiarkan selama 30 menit hingga diperoleh
massa yang transparan, digerus lalu diencerkan dengan air suling hingga 100
ml (Anief, 1999).
3.4.2.2 Pembuatan suspensi EEM 5%
Ditimbang 500 mg EEM kemudian disuspensikan dengan larutan Na
CMC 0,5% sehingga didapat volume 10 ml.
3.4.2.3 Pembuatan suspensi natrium diklofenak 0,25%
Satu tablet natrium diklofenak yang mengandung 25 mg natrium
diklofenak dilarutkan dalam 10 ml suspensi Na CMC 0,5%.
3.4.2.4 Pembuatan karagenan 1%
Ditimbang 0,05 g karagenan kemudian dilarutkan dengan larutan garam
fisiologis (NaCl 0,9%) sehingga didapat volume 5 ml.
3.4.3 Pengujian efek antiinflamasi
Pengujian efek antiinflamasi ini menggunakan metode paw edema.
diberi minum secukupnya. Perlakuan diberikan pada tikus secara peroral
dengan bahan uji sebagai berikut: Kontrol (K): Na CMC 0,5 %, Perlakuan (P)I:
EEM dosis 200 mg/kg bb, PII: EEM dosis 300 mg/kg bb, PIII: EEM dosis 400
mg/kg bb dan Pembanding: Na-diklofenak 2,25 mg/kg bb. Bagan kerja uji
antiinflamasi dapat dilihat pada Lampiran 2. Contoh perhitungan dosis sediaan
uji terhadap tikus secara peroral dapat dilihat pada Lampiran 3 dan 4. Tiga
puluh menit setelah perlakuan, masing-masing hewan uji diinduksi dengan
larutan 0,1 ml karagenan 1% diberikan secara subplantar pada telapak kaki
tikus. Sesaat setelah penyuntikan karagenan diukur volume kaki dengan cara
dicelupkan ke dalam kolom air raksa pada pletismometer sampai batas yang
telah ditandai yaitu pada ruas kaki tikus. Kemudian volume udem kaki tikus
diukur selama 6 jam setiap 15 menit sekali. Setiap kelompok tikus dihitung
persentase radang rata-rata dengan rumus dibawah ini (Vogel, 2008):
% 100 Vo
Vo -Vt
%R = x
Keterangan:
%R = persentase radang Vo = volume kaki mula-mula
Vt = volume udem kaki pada waktu ke-t
Persentase inhibisi radang (%IR) dapat dihitung menggunakan rumus sebagai
berikut (Turner, 1965):
% 100 a
b -a
%IR= x
Keterangan:
%IR = persentase inhibisi radang
a = persentase radang rata-rata kelompok kontrol
Setelah diperoleh kurva persentase radang versus waktu, selanjutnya
digunakan untuk menghitung AUC (Area Under the Curve), Rumus yang
digunakan untuk menghitung AUC adalah sebagai berikut (Prayoga, 2008):
[ ]
(
)
2
%
%R
1 1
-n
1 −
−
+
=
− n n
n t
t
t
t
R
AUC
nn
Keterangan:
[AUC] = Area under the curve
tn = waktu pengamatan dari persentase radang ke n
tn-1 = waktu pengamatan sebelumnya yang berhubungan dengan
persentae radang ke n-1 %Rn-1 = persen radang ke n-1
%Rn = persen radang ke n
3.5 Analisis Data
Data hasil persen radang dan AUC persen radang dianalisis secara
ANAVA pada tingkat kepercayaan 95% dilanjutkan dengan uji Duncan untuk
melihat perbedaan nyata antar kelompok perlakuan. Analisis statistik ini
menggunakan program Statistical Product and Service Solution (SPSS ) versi
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengujian EEM Sebagai Antiinflamasi
Hasil identifikasi sampel yang digunakan pada penelitian ini
menunjukkan bahwa sampel adalah benar majakani (Quercus infectoria G.
Olivier) (Sihombing, dkk., 2012), hasil dapat dilihat pada Lampiran 1, halaman
59. Pengujian efek antiinflamasi digunakan alat pletismometer dengan prinsip
hukum Archimedes yaitu benda yang dimasukkan kedalam zat cair akan
memberikan gaya atau tekanan keatas sebesar volume yang dipindahkan. Data
hasil pengukuran penambahan volume kaki tikus, persen radang dan persen
inhibisi radang dapat dilihat pada Lampiran 8, halaman 67.
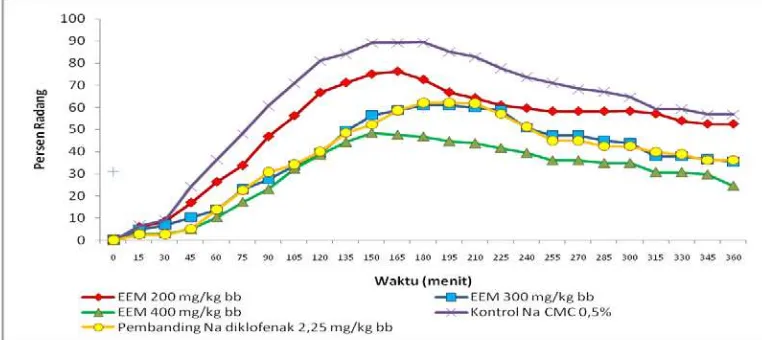
4.1.1 Persentase radang
Hasil persentase radang rata-rata yang terjadi dapat dilihat pada Gambar
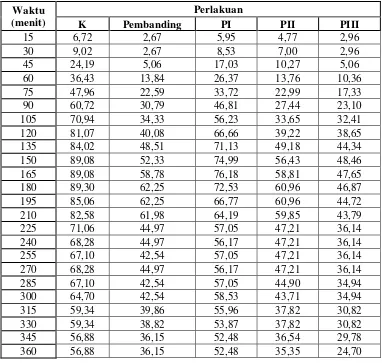
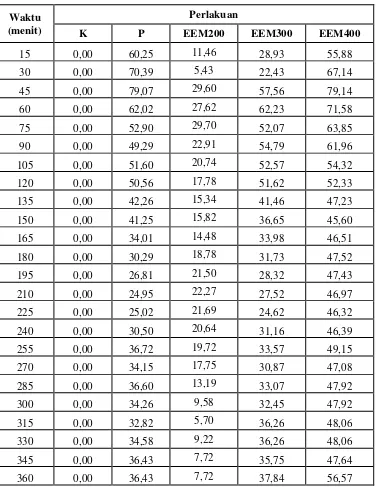
[image:56.595.113.494.514.684.2]4.1 dan Tabel 4.1.
Tabel 4.1. Persentase radang rata-rata tiap waktu pengamatan ekstrak etanol majakani
Waktu (menit)
Perlakuan
K Pembanding PI PII PIII
15 6,72 2,67 5,95 4,77 2,96
30 9,02 2,67 8,53 7,00 2,96
45 24,19 5,06 17,03 10,27 5,06
60 36,43 13,84 26,37 13,76 10,36
75 47,96 22,59 33,72 22,99 17,33
90 60,72 30,79 46,81 27,44 23,10
105 70,94 34,33 56,23 33,65 32,41
120 81,07 40,08 66,66 39,22 38,65
135 84,02 48,51 71,13 49,18 44,34
150 89,08 52,33 74,99 56,43 48,46
165 89,08 58,78 76,18 58,81 47,65
180 89,30 62,25 72,53 60,96 46,87
195 85,06 62,25 66,77 60,96 44,72
210 82,58 61,98 64,19 59,85 43,79
225 71,06 44,97 57,05 47,21 36,14
240 68,28 44,97 56,17 47,21 36,14
255 67,10 42,54 57,05 47,21 36,14
270 68,28 44,97 56,17 47,21 36,14
285 67,10 42,54 57,05 44,90 34,94