EKSPLORASI DAN POTENSI JAMUR PELARUT FOSFAT
PADA EKOSISTEM LAHAN GAMBUT FIBRIK DAN HEMIK
SKRIPSI
OLEH
MARTHA HEARTY PRATIWI SITANGGANG
081202052
BUDIDAYA HUTAN
PROGRAM STUDI KEHUTANAN
FAKULTAS PERTANIAN
EKSPLORASI DAN POTENSI JAMUR PELARUT FOSFAT
PADA EKOSISTEM LAHAN GAMBUT FIBRIK DAN HEMIK
SKRIPSI
OLEH
MARTHA HEARTY PRATIWI SITANGGANG
081202052
BUDIDAYA HUTAN
Sripsi sebagai salah satu syarat untuk
memperoleh gelar sarjana di Fakultas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI KEHUTANAN
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul : Eksplorasi dan Potensi Jamur Pelarut Fosfat pada Ekosistem Lahan Gambut Fibrik dan Hemik
Nama : Martha Hearty Pratiwi Sitanggang
NIM : 081202052
Minat : Budidaya Hutan
Disetujui oleh Komisi Pembimbing
Dr. Deni Elfiati, SP, MP Dr.Ir. Hamidah Hanum, MP
Ketua Anggota
Mengetahui,
ABSTRAK
MARTHA HEARTY PRATIWI SITANGGANG: Eksplorasi dan Potensi Jamur Pelarut Fosfat pada Ekosistem Lahan Gambut Fibrik dan Hemik. Dibawah bimbingan DENI ELFIATI dan HAMIDAH HANUM.
Penelitian ini dilakukan untuk mengeksplorasi, menguji potensi serta mengidentifikasi jamur pelarut fosfat (JPF) unggul dari lahan gambut Fibrik dan Hemik. Sampel di ambil dari 5 petak secara acak pada kedalaman 0-20 cm di sekitar rhizosfer. Analisis sifat kimia tanah gambut dilakukan di Badan Penelitian Teknologi Pertanian Sumatera Utara sedangkan kegiatan isolasi, uji potensi serta identifikasi dilaksanakan di Laboratorium Biologi Tanah Program Studi Agroeko teknologi Fakultas Pertanian Universitas Sumatera Utara. Isolasi menggunakan media pikovskaya dengan sumber fosfat Ca3(PO4)2, sedangkan pada media uji potensi sumber fosfat dari AlPO4, FePO4,
Hasil isolasi diperoleh 12 isolat JPF murni. Selanjutnya ujipotensi pada isolat yang diperoleh. Diameter holozone terbesar yaitu1,52 cm dihasilkan isolat JF10 dan diameter terkecil sebesar 0,31 dihasilkan isolat JH7. Hasil pengukuran kadar fosfat tersedia paling besar adalah isolat JF1 yaitu 28,63 ppm (sumber fosfat AlPO
dan Batuan Fosfat. Evaluasi potensi JPF secara kualitatifdenganmengukur diameter holozone menggunakan nilai indeks pelarutan. Pengukuran potensi JPF secara kuantitatif dengan mengukur kadar fosfat terlarut dengan metode Bray II.
4) dan paling kecil oleh isolat JF12 yaitu 8,97 ppm (sumber fosfat FePO4). Berdasarkan hasil uji potensi disimpulkan isolat JF1, JF4, JF10, dan JF12 memiliki kemampuan paling baik dalam melarutkan fosfat. Hasil identifikasi baik secara makroskopis dan mikroskopis menunjukkan bahwa isolate JF1, JF4, JF10 dan JF12 termasuk genus Aspergillus.
ABSTRACT
MARTHA HEARTY PRATIWI SITANGGANG.Exploration and Potential Mushroom Phosphates Solvents on Peatland Ecosystems in Fibris and Hemis, under the guidance of DENI ELFIATI and HAMIDAH HANUM.
The research was conducted to explore, examine and identify potential phosphate solubilizing fungi (PSF) to solubilize insoluble phosphate from peat of Fibris and Hemis. Samples taken from five random plots at 0-20 cm depth around rhizosfir. The chemical analyze properties of peat soils conducted in North Sumatra Seed Research Center while the activities of isolation, and identification of potential trials conducted at the Laboratory of Soil Biology Agroekoteknologi Studies Program Faculty of Agriculture, University of North Sumatra. Isolation using Pikovskaya media with the source fosfat from Ca3(PO4)2, whereas in the
potential test media using Ca3(PO4)2, AlPO4, FePO4,
The results obtained 12 isolates of isolation of pure PSF. The next test conducted on the potential of isolates obtained. Largest diameter of 1,52 cm holozone generated isolates JF10 and the smallest diameter of 0,31 cm isolates produced JH7. The measurement results are available most of the phosphate levels were JF1 isolates of 28,63 ppm (AlPO
and Rock Phosphate (RP) as source of insoluble phosphate. Evaluate the potential JPF qualitatively by measuring the diameter of holozone extensive use of the dilution index. JPF potential measurements quantitatively by measuring levels of dissolved phosphate with Bray-II method.
4 ) and the smallest by JF12 isolates
of 8,97 ppm (FePO4
Key wosds: phosphate, Aspergillus, phosphate solubilizing fungi
RIWAYAT HIDUP
Martha Hearty Pratiwi Sitanggang, dilahirkan di Binjai pada tanggal 09 Juni 1990 dari ayah R. Sitanggang dan ibu M. Br. Hutagaol. Penulis merupakan anak kelima dari lima bersaudara.
Tahun 2002 penulis lulus sekolah dasar dari SD 101755 Binjai, dan pada tahun 2005 penulis lulus dari SMP Negeri 3 Binjai. Tahun 2008 penulis lulus dari SMA Negeri 2 Binjai, dan pada tahun yang sama lulus masuk Universitas Sumatera Utara melalui jalur SNMPTN. Penulis memilih program studi Budidaya Hutan, Departemen Kehutanan, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis aktif sebagai anggota Himpunan Mahasiswa Sylva. Penulis melaksanakan Praktik Pengenalan Ekosistem Hutan (P2EH) di Gunung Sinabung dan Taman Wisata Alam (TWA) Deleng Lancuk Tahun 2010. Penulis melaksanakan Praktik Kerja Lapangan (PKL) di Taman Nasional Gunung Ciremai kabupaten Kuningan, Jawa Barat Tahun 2012.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa, karena kasih dan karunia-Nyalah penulis dapat menyelesaikan skripsi yang berjudul “Eksplorasi dan Potensi Jamur Pelarut Fosfat Pada Ekosistem Lahan Gambut Fibrik dan Hemik
Dengan segala kerendahan hati, penulis mengucapkan terima kasih kepada banyak pihak yang turut membantu penulis menyelesaikan skripsi ini. Ayahanda R. Sitanggang dan Ibunda M. Br. Hutagaol serta keluarga besar yang telah membesarkan, mendidik serta selalu mendukung penulis lewat doanya yang tulus.
Komisi pembimbing saya, Dr. Deni Elfiati, SP, MP selaku ketua dan Dr.Ir. Hamidah Hanum, MP selaku anggota yang membimbing, memberi
masukan yang sangat bermanfaat selama penelitian hingga penulisan skripsi ini selesai, serta teman-teman Budidaya Hutan stambuk 2008 dan seluruh pegawai di program Studi Kehutanan yang memberi dukungan hingga skripsi ini selesai.
”.
Penulis menyadari bahwa penulisan skripsi ini tidak luput dari kekurangan, oleh sebab itu penulis mengharapkan saran dan kritik yang membangun demi penyempurnaan skripsi ini. Penulis mengharapkan skripsi ini dapat bermanfaat bagi pengembangan ilmu pengetahuan khususnya di bidang kehutanan, akhir kata penulis mengucapkan terima kasih.
Medan, Januari 2013
DAFTAR ISI
Hlm.
RIWAYAT HIDUP ... i
KATA PENGANTAR ... ii
DAFTAR ISI ... iii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN ... vi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesis Penelitian ... 4
Kegunaan Penelitian... 4
TINJAUAN PUSTAKA Tanah Gambut ... ... 5
Peranan dan Sumber Fosfor ... 6
Mikroba Pelarut Fosfat ... 8
Kondisi Umum Lokasi Pengambilan Sampel ... 12
METODE PENELITIAN Waktu dan Tempat Penelitian ... 13
Bahan dan Alat Penelitian ... 13
Prosedur Penelitian ... 14
Pembuatan Petak ... 14
Pengambilan ContohTanah ... 14
Isolasi Jamur Pelarut Fosfat ... 15
UjiPotensi pada Media Padat ... 16
UjiPotensi pada Media Cair ... 16
Identifikasi jamur pelarut fosfat yang potensial melarutkan fosfat ... 17
HASIL DAN PEMBAHASAN Karakteristik Sifat Kimia Sampel Tanah Gambut ... 18
Isolasi Jamur Pelarut fosfat dari Bahan Tanah Gambut ... 22
Kemampuan JPF Melarutkan P pada Media Pikovskaya Padat... 26
Kemampuan JPF Melarutkan P pada Media Pikovskaya Cair... 31
Identifikasi Jamur Pelarut Fosfat dari Bahan Tanah Gambut ... 38
Aspergillus sp ... 40
KESIMPULAN DAN SARAN Kesimpulan ... 43
Saran.... ... 43
DAFTAR PUSTAKA ... 44
DAFTAR TABEL
No. Hlm
1. Hasil analisis sifat kimia sampel tanah gambut ... 18
2. Hasil perhitungan jumlah koloni JPF dan BPF ... 23
3. Hasil pengukuran indeks pelarutan dalam media pikovskaya padat ... 28
4. Hasil pengukuran P tersedia yang dilarutkan oleh JPF ... 32
DAFTAR GAMBAR
No. Hlm
LAMPIRAN
No. Hlm 1. Dokumentasi tahap penelitian ... 47 2. Hasil pengukuran diameter rata-rata holozone pada media padat……... 49 3. Kriteria penilaian sifat kimia tanah Staf Pusat Penelitian Tanah Bogor
(1983) dan BPP-Medan (1982) ... 50 4. Prosedur penetapan P-tersedia tanah dengan metode Bray-II... 50 5. Tabel Hasil Pengukuran P-tersedia ... 52
6. Waktu pembentuk holozone dan diameter pada media Pikovskaya padat…… 54
7. Hasil pengukuran diameter rata-rata holozone dan diameter koloni pada media padat………...57 8. Tabel hasil pengukuran Indeks Pelarutan dalam media pikovskaya
ABSTRAK
MARTHA HEARTY PRATIWI SITANGGANG: Eksplorasi dan Potensi Jamur Pelarut Fosfat pada Ekosistem Lahan Gambut Fibrik dan Hemik. Dibawah bimbingan DENI ELFIATI dan HAMIDAH HANUM.
Penelitian ini dilakukan untuk mengeksplorasi, menguji potensi serta mengidentifikasi jamur pelarut fosfat (JPF) unggul dari lahan gambut Fibrik dan Hemik. Sampel di ambil dari 5 petak secara acak pada kedalaman 0-20 cm di sekitar rhizosfer. Analisis sifat kimia tanah gambut dilakukan di Badan Penelitian Teknologi Pertanian Sumatera Utara sedangkan kegiatan isolasi, uji potensi serta identifikasi dilaksanakan di Laboratorium Biologi Tanah Program Studi Agroeko teknologi Fakultas Pertanian Universitas Sumatera Utara. Isolasi menggunakan media pikovskaya dengan sumber fosfat Ca3(PO4)2, sedangkan pada media uji potensi sumber fosfat dari AlPO4, FePO4,
Hasil isolasi diperoleh 12 isolat JPF murni. Selanjutnya ujipotensi pada isolat yang diperoleh. Diameter holozone terbesar yaitu1,52 cm dihasilkan isolat JF10 dan diameter terkecil sebesar 0,31 dihasilkan isolat JH7. Hasil pengukuran kadar fosfat tersedia paling besar adalah isolat JF1 yaitu 28,63 ppm (sumber fosfat AlPO
dan Batuan Fosfat. Evaluasi potensi JPF secara kualitatifdenganmengukur diameter holozone menggunakan nilai indeks pelarutan. Pengukuran potensi JPF secara kuantitatif dengan mengukur kadar fosfat terlarut dengan metode Bray II.
4) dan paling kecil oleh isolat JF12 yaitu 8,97 ppm (sumber fosfat FePO4). Berdasarkan hasil uji potensi disimpulkan isolat JF1, JF4, JF10, dan JF12 memiliki kemampuan paling baik dalam melarutkan fosfat. Hasil identifikasi baik secara makroskopis dan mikroskopis menunjukkan bahwa isolate JF1, JF4, JF10 dan JF12 termasuk genus Aspergillus.
ABSTRACT
MARTHA HEARTY PRATIWI SITANGGANG.Exploration and Potential Mushroom Phosphates Solvents on Peatland Ecosystems in Fibris and Hemis, under the guidance of DENI ELFIATI and HAMIDAH HANUM.
The research was conducted to explore, examine and identify potential phosphate solubilizing fungi (PSF) to solubilize insoluble phosphate from peat of Fibris and Hemis. Samples taken from five random plots at 0-20 cm depth around rhizosfir. The chemical analyze properties of peat soils conducted in North Sumatra Seed Research Center while the activities of isolation, and identification of potential trials conducted at the Laboratory of Soil Biology Agroekoteknologi Studies Program Faculty of Agriculture, University of North Sumatra. Isolation using Pikovskaya media with the source fosfat from Ca3(PO4)2, whereas in the
potential test media using Ca3(PO4)2, AlPO4, FePO4,
The results obtained 12 isolates of isolation of pure PSF. The next test conducted on the potential of isolates obtained. Largest diameter of 1,52 cm holozone generated isolates JF10 and the smallest diameter of 0,31 cm isolates produced JH7. The measurement results are available most of the phosphate levels were JF1 isolates of 28,63 ppm (AlPO
and Rock Phosphate (RP) as source of insoluble phosphate. Evaluate the potential JPF qualitatively by measuring the diameter of holozone extensive use of the dilution index. JPF potential measurements quantitatively by measuring levels of dissolved phosphate with Bray-II method.
4 ) and the smallest by JF12 isolates
of 8,97 ppm (FePO4
Key wosds: phosphate, Aspergillus, phosphate solubilizing fungi
PENDAHULUAN
Latar Belakang
Gambut merupakan tanah yang terbentuk dari bahan organik pada fisiografi cekungan atau rawa, akumulasi bahan organik pada kondisi jenuh air, anaerob, menyebabkan proses perombakan bahan organik berjalan sangat lambat, sehingga terjadi akumulasi bahan organik yang membentuk tanah gambut. Sifat-sifat fisik gambut sangat erat kaitannya dengan pengelolaan air gambut. Bahan penyusun gambut terdiri dari empat komponen yaitu bahan organik, bahan mineral, air dan udara. Perubahan kandungan air karena reklamasi gambut akan ikut merubah sifat-sifat fisik lainnya (Andriesse, 1988).
Kandungan bahan organik gambut yang tinggi merupakan sumber hara makro dan mikro yang bermanfaat bagi organisme gambut. Kondisi tanah gambut yang masam menyebabkan hara berada pada kondisi tidak tersedia bagi tanaman maupun mikroba tanah. Gambut juga mengandung beragam asam organik bermanfaat serta derivate fenolat yang bersifat racun bagi tanaman. Lahan gambut umumnya mempunyai tingkat kemasaman yang relatif tinggi dengan kisaran pH 3-5 (Hartatik et al., 2004).
Sifat kimia tanah gambut yang berpengaruh penting terhadap pertumbuhan tanaman yaitu kemasaman tanah, kapasitas tukar (KTK) kation dan basa-basa, fosfor, unsur mikro, komposisi kimia dan asam fenolat gambut. Tingkat kemasaman tanah gambut berhubungan erat dengan kandungan asam-asam organiknya, yaitu asam humat dan asam fulvat. Bahan organik yang telah mengalami dekomposisi mempunyai gugus reaktif seperti karboksil (-COOH) dan fenol (C6H4
Sifat P dalam tanah tidak mobil karena tingkat ketersediaannya dalam tanah dipengaruhi oleh: reaksi tanah (pH), kadar Al dan Fe oksida, kadar Ca, kadar bahan organik, tekstur dan pengelolaan lahan. Fosfat tanah dapat dalam bentuk P larutan, P labil, P difiksasi oleh Al, Fe atau Ca, dan P organik. Fosfat dalam larutan dapat berbentuk HR2RPOR4R־ atau HPOR4RP
2
P
־, tergantung dari kemasaman
keseimbangan, artinya apabila bentuk P tidak tersedia dalam jumlah sedikit akan terjadi aliran hara P dari bentuk-bentuk yang tidak tersedia (Havlin et al., 1997).
OH) yang mendominasi kompleks pertukaran dan dapat bersifat sebagai asam lemah sehingga dapat terdisosiasi dan menghasilkan ion H dalam jumlah banyak. Diperkirakan bahwa 85 – 95% muatan pada bahan organik disebabkan karena kedua gugus karboksil dan (Miller dan Donahue, 1990).
Lingkungan gambut yang sesuai untuk pertumbuhan jamur pelarut fosfat (JPF) serta potensinya dalam melarutkan ikatan fosfat pada kondisi masam, menjadi peluang untuk mengembangkan JPF pada areal gambut. Lokasi pengambilan sampel yang merupakan lahan bekas perkebunan sawit menginginkan hasil maksimal dengan memberi pupuk kimia tanpa memperhatikan sifat pengikatan hara gambut. Bila hal ini terus dilakukan selain akan merugikan secara ekonomi juga dapat membuat tanah gambut rusak dan tidak dapat digunakan untuk masa tanam yang lebih lama. Jamur pelarut fosfat dapat dijadikan starter pupuk hayati untuk merehabilitasi lahan gambut. Penggunaan biofertilizer seperti jamur pelarut fosfat (JPF) selain murah juga tidak menimbulkan dampak negatif terhadap tanah dan lingkungan.
Status hara P dapat ditingkatkan secara efektif dan efisiensi dengan memanfaatkan mikroba pelarut fosfat yang mampu membebaskan P-terikat dari tanah dan meningkatkan serapan P oleh akar tanaman. Mikroba pelarut fosfat adalah mikroba yang mampu melarutkan ikatan fosfat menjadi bentuk tersedia. Mikroba pelarut fosfat dapat berupa bakteri pelarut fosfat (BPF), jamur pelarut fosfat (JPF), aktinomisetes dan khamir (Premono, 1998).
Tujuan Penelitian
1. Mengeksplorasi jamur pelarut fosfat pada lahan gambut.
2. Mengkaji kemampuannya dalam melarutkan fosfat pada media padat dan media cair yang terikat dalam bentuk Al-P, Fe-P, dan batuan fosfat.
3. Mengidentifikasi jamur pelarut fosfat paling potensial.
Kegunaan Penelitian
TINJAUAN PUSTAKA
Tanah Gambut
Tanah gambut adalah tanah-tanah jenuh air, terbentuk dari endapan yang
berasal dari penumpukan sisa-sisa (residu) jaringan tumbuhan masa lampau yang
melapuk. Secara umum dalam klasifikasi tanah, tanah gambut dikenal sebagai Organosol atau Histosol yaitu tanah yang memiliki lapisan bahan organik dengan berat jenis (BD) dalam keadaan lembab < 0,1 g cm-3 dengan tebal > 60 cm atau lapisan organik dengan BD > 0,1 g cm-3
Tingkat kesuburan tanah gambut sangat dipengaruhi oleh kandungan basa
berupa unsur Ca, Mg, K dan Na - dan kejenuhan basa rendah. Kandungan Al
umumnya rendah sampai sedang dan semakin berkurang dengan menurunnya pH
tanah. Kandungan unsur mikro khususnya Cu, Bo, dan Zn sangat rendah,
sebaliknya kandungan Fe cukup tinggi. Kandungan N total termasuk tinggi, tetapi
sebagian besar dalam bentuk tidak tersedia bagi tanaman karena rasio C/N yang
tinggi (Noor, 2001).
dengan tebal > 40 cm. Gambut diklasifikasikan lagi berdasarkan berbagai sudut pandang yang berbeda; dari tingkat kematangan, kedalaman, kesuburan dan posisi pembentukannya (Hardjowigeno, 1992).
Peranan dan Sumber Fosfat
Unsur fosfat (P) adalah unsur esensial kedua setelah N yang berperan penting dalam fotosintesis dan perkembangan akar. Ketersediaan fosfat dalam tanah jarang yang melebihi 0,001% dari total P. Sebagian besar bentuk fosfat terikat oleh koloid tanah sehingga tidak tersedia bagi tanaman. Tanah dengan kandungan organik rendah seperti oxsisol dan ultisol yang banyak terdapat di Indonesia kandungan fosfat bervariasi dari 20-80%, bahkan bisa kurang dari 20% tergantung tempat (Rao, 1994).
Fosfat berperan penting dalam sintesis protein, pembentukan bunga, buah dan biji serta mempercepat pemasakan. Kebutuhan tanaman akan hara P dapat dipenuhi dari berbagai sumber antara lain pupuk TSP, SP-36, DAP, P-alam dan NPK yang pada umumnya diberikan sekaligus pada awal tanam. Adapun gejala kekurangan fosfor yaitu daun berubah berwarna tua atau tampak mengkilap kemerahan. Tepi daun, cabang dan batang berwarna merah ungu, dan dapat berubah menjadi kuning, buah kecil, pematangan buah lambat, Perkembangan bentuk dan warna buah jelek, biji berkembang tidak normal, dan akar lambat berkembang. Kekurangan P pada tanaman akan mengakibatkan berbagai hambatan metabolisme, diantaranya dalam proses sintesis protein, yang menyebabkan terjadinya akumulasi karbohidrat dan ikatan-ikatan nitrogen (Rosmarkam dan Yuwono, 2002).
mengatur proses-proses enzimatik dalam tanaman. Fosfat berperan dalam pembentukan asam nukleat (RNA dan DNA), menyimpan serta memindahkan energi ATP dan ADP, merangsang pembelahan sel dan membantu proses asimilasi dan respirasi (Poerwowidodo, 2000).
Fosfat terdapat dalam dua bentuk, yaitu senyawa fosfat organik (pada tumbuhan dan hewan) dan senyawa fosfat anorganik (pada air dan tanah). Fosfat organik dari hewan dan tumbuhan yang mati diuraikan oleh dekomposer (pengurai) menjadi fosfat anorganik. Fosfat anorganik yang terlarut di air tanah atau air laut akan terkikis dan mengendap di sedimen laut. Oleh karena itu, fosfat banyak terdapat di batu karang dan fosil. Fosfat dari batu dan fosil terkikis dan membentuk fosfat anorganik yang larut di air tanah dan laut. Fosfat anorganik ini kemudian akan diserap oleh akar tumbuhan lagi. Siklus ini berulang terus menerus (Goenadi dan Saraswati, 1993).
Ketersediaan P dalam tanah pada umumnya rendah. Hal ini disebabkan P terikat menjadi Fe-fosfat dan Al-fosfat pada tanah masam atau Ca3(PO4)2
Asam organik dapat meningkatkan ketersediaan P di dalam tanah melalui beberapa mekanisme, diantaranya adalah: (1) anion organik bersaing dengan ortofosfat pada permukaan tapak jerapan koloid yang bermuatan positif, sehingga memperbesar peluang ortoposfat dapat diserap oleh tanaman; (2) pelepasan
ortoposfat dari ikatan logam P melalui pembentukan kompleks logam organik;
dan (3) modifikasi muatan permukaan jerapan oleh ligan organik (Havlin et al., 1999).
Pelarutan P terjadi melalui dua cara, yakni melalui penurunan pH tanah yang mengakibatkan terjadinya dissolusi ikatan berbagai senyawa fosfat di dalam
tanah, dan melalui proses khelasi dari berbagai asam hidroksi dengan berbagai ion
metal yang mengikat fosfat (Al, Ca, Fe). Batuan fosfat merupakan salah satu
sumber pupuk P yang bersifat stabil dan tidak larut air. Kelarutannya dalam asam
sitrat berkisar antara 5 hingga 17 % dari total konsentrasi P yang di kandungnya
(Hanafiah, 2001).
Mikroba Pelarut Fosfat
Mikroba pelarut fosfat (MPF) merupakan salah satu jenis pupuk hayati yang dapat mengefisiensikan pupuk P anorganik, sehingga dapat mengatasi rendahnya P-tersedia tanah, dan meningkatkan konsentrasi P tanaman. Kemampuan MPF sangat beragam tergantung dari jenis mikroba, daya adaptasi,hingga kemampuan dalam memproduksi asam-asam organik dan enzim (Whitelaw, 2000).
biologis mikroba itu sendiri. Terdapat mikroba yang hidup pada kondisi masam dan ada pula yang hidup pada kondisi netral dan basa, ada yang hipofilik, mesofilik dan termofilik ada yang hidup aerob maupun anaerob (Ginting, 2006).
Aktivitas mikroba pelarut fosfat perlu dimanfaatkan untuk penyediaan unsur hara bagi pertumbuhan dan hasil tanaman yang optimal. Aktivitas dan kepadatan populasi mikroba tanah ditentukan oleh perubahan kondisi fisika dan kimia tanah, jenis tanaman yang dibudidayakan, nutrisi tanah, pH, kelembaban, bahan organik, serta teknik budidaya yang diterapkan. Populasi MPF berbeda pada beberapa jenis tanah serta sesuai dengan keragaman tanaman yang dibudidayakan (Mehrvarz et al., 2008).
Mikroba pelarut fosfat mensekresikan sejumlah asam organik seperti asam-asam format, asetat, propionat, laktonat, glikolat, fumarat, dan suksinat yang mampu membentuk khelat dengan kation-kation seperti Al dan Fe pada Ultisol sehingga berpengaruh terhadap pelarutan fosfat yang efektif sehingga P menjadi tersedia dan dapat diserap oleh tanaman (Rao, 1994).
Mikroba pelarut fosfat juga memiliki kemampuan dalam mensekresikan enzim fosfatase yang berperan dalam proses hidrolisasi P organik manjadi P anorganik. Bakteri pelarut fosfat (BPF) antara lain Bacillus, Pseudomonas, Arthrobacter, Micrococcus, Streptomyces, dan Flavobacterium (Whitelaw, 2000).
Beberapa bakteri tanah seperti bakteri pelarut fosfat mempunyai kemampuan untuk melarutkan P organik menjadi bentuk fosfat terlarut yang tersedia bagi tanaman. Efek pelarutan umumnya disebabkan oleh adanya produksi asam organik seperti asam asetat, asam format, asam laktat, asam oksalat, asam malat dan asam sitrat yang dihasilkan oleh mikroba tersebut. Mikroba tersebut juga memproduksi asam amino, vitamin dan growth promoting substance seperti IAA dan asam giberelin yang dapat meningkatkan pertumbuhan tanaman (Ponmugaran, 2006).
Mineralisasi fosfat organik juga melibatkan peran mikroba tanah melalui produksi enzim fosfatase seperti fosfatase asam dan basa. Beberapa enzim
fosfatase seperti fosfomonoesterase, fosfodiesterase, trifosfomonoesterase dan
fosfoamidase pada umumnya terdapat didalam tanah. Enzim-enzim tersebut bertanggung jawab pada prosses hidrolisis P organik menjadi fosfat anorganik (HR2RPOR4R־, HPO־ ) yang tersedia bagi tanaman (Marlina, 1997).
Jamur pelarut fosfat merupakan salah satu anggota mikroba tanah yang dapat meningkatkan ketersediaan dan pengambilan P oleh tumbuhan. Bentuk ikatan P yang umum ditemui pada kondisi masam adalah AlPO4 dan FePO4. Jamur pelarut fosfat mampu melarutkan P dalam bentuk AlPO4
Kemampuan mikroba pelarut fosfat dalam melarutkan fosfat terikat dapat
diketahui dengan mengembangkan biakan murni pada media pikovskaya yang
berwarna putih keruh, karena mengandung P tidak larut air seperti kalsium fosfat
Ca
lebih baik di banding bakteri pelarut fosfat pada kondisi masam. Jamur pelarut fosfat memiliki 3 mekanisme dalam meningkatkan penyerapan P yaitu : (1) secara fisik dimana infeksi jamur pada akar tanaman dapat membantu pengambilan fosfor dengan memperluas permukaan sampai akar; (2) secara kimia jamur diduga mendorong perubahan pH perakaran. Jamur juga menghasilkan asam sitrat dan asam oksalat yang menggantikan posisi ion fosfat yang terfiksasi; (3) secara fisiologi, jamur
menghasilkan hormon auksin, sitokinin dan giberalin yang mampu memperlambat
proses penuaan akar sehingga memperpanjang masa penyerapan unsur hara
(Premono, 1998).
3(PO4)2. Pertumbuhan mikroba pelarut fosfat dicirikan dengan zona bening
(holozone) di sekeliling koloni mikroba. Mikroba pelarut fosfat yang potensial
dapat diseleksi dengan melihat luas zona bening paling besar pada media padat.
Pengukuran potensial pelarutan fosfat secara kualitatif ini menggunakan nilai
indeks pelarutan (dissolving index), yaitu nisbah antara diameter zona jernih
terhadap diameter koloni. Kemampuan pelarut fosfat terikat secara kuantitatif
Kandungan P terlarut dalam media cair tersebut diukur setelah masa inkubasi
(Setiawati, 1997).
Kondisi Umum Lokasi Pengambilan Sampel
Pengambilan sampel dilakukan di Dusun XVI Pasar Banjar, kecamatan Simpang Empat, Tanjung Balai, Kabupaten Asahan. Kecamatan Simpang Empat ini terletak ± 3 km dari kota Tanjung Balai. Dusun ini memiliki 841 jiwa dengan jumlah kepala keluarga sebanyak 189. Pekerjaan masyarakat dominan adalah petani, yaitu sebanyak 50%, 48% adalah pedagang, 0.05% adalah Pegawai Negeri Sipil dan selebihnya adalah wiraswasta.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juli sampai November 2012. Pengambilan sampel tanah dilakukan di Dusun XVI Pasar Banjar, Kecamatan Simpang Empat, Tanjung Balai, Kabupaten Asahan. Analisis tanah dilaksanakan di laboratorium Balai Pengkajian Teknologi Pertanian Sumatera Utara. Isolasi jamur, uji potensi dan identifikasi jamur pelarut fosfat dilakukan di Laboratorium Biologi Tanah Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara.
Bahan dan Alat
Bahan yang digunakan adalah contoh tanah gambut di daerah rhizosfer rumput, kapas, akuades, kantung plastik, label, alkohol 96%, plastik kraf, aluminium foil, kaca preparat dan kaca objek. Media padat pikovskaya untuk komposisi per liter akuades: (glukosa 10 g; Ca3(PO4)2 5 g; (NH4)2SO4 0,5 g; KCl 0,2 g; MgSO4.7H2O 0,1 g; MnSO4 0,002 g; FeSO4 0,002 g; ekstrak khamir 0,5 g; agar 20 g; akuades), larutan fisiologis ( 8,5 g NaCl per liter akuades), Batuan Fosfat 5 gr, AlPO4 5 gr dan FePO4
Alat yang digunakan adalah cangkul, Erlenmeyer 250 ml, pipet tetes, cawan petri, tabung reaksi, timbangan, inkubator, laminar air flow, gelas ukur volume 100 ml, autoklaf, rotarimixer, sentrifuse 6000 rpm, shaker, jarum ose,
sprayer, kamera digital, masker, sarung tangan, bunsen, kotak es (cool box) dan mikroskop.
Prosedur Penelitian 1. Pembuatan Petak
Petak pengambilan sampel yang dibuat berdasarkan metode ICRAF (Ervayenri et al., 1999). Ukuran petak pengambilan sampel adalah 20 m x 20 m. Penetapan petak contoh dilakukan secara acak sebanyak lima petak.
20 m
20 m
Gambar 1. Ilustrasi petak contoh pengambilan sampel tanah
Keterangan :
: Tempat Pengambilan sampel tanah
2. Pengambilan contoh tanah
3. Isolasi jamur pelarut fosfat
Sepuluh (10) g tanah dimasukkan ke dalam Erlenmeyer 250 ml yang berisi 90 ml larutan fisiologis steril (pengenceran 10־¹), kemudian dikocok selama 30 menit pada shaker. Dibuat pengenceran secara serial, dari pengenceran 10־¹ diambil 1 ml dan dimasukkan ke dalam tabung reaksi yang telah berisi 9 ml larutan fisiologis steril (pengenceran 10־²) selanjutnya dikocok di atas rotarimixer sampai homogen. Dari pengenceran 10־² dipipet sebanyak 1 ml dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml larutan fisiologis (disebut pengenceran 10־³) dilakukan hal serupa berturut-turut sampai pengenceran 10־P
5
P
. Dari pengenceran 10־³ dipipet sebanyak 1 ml, masukkan kedalam cawan petri yang telah steril dan dilakukan hal yang sama pada pengenceran 10־P
4
P
dan 10־P
5
P
. Dipakai suspensi tanah dari 3 pengenceran sebagai antisipasi bila pengenceran tersebut tidak diperoleh jamur pelarut fosfat. Selanjutnya tuangkan 12 ml media pikovskaya ( suhu sekitar 45-50ºC) kedalam cawan petri yang telah berisi 1 ml suspensi tanah, lalau putar cawan petri kearah kanan 3 kali dan kearah kiri 3 kali agar media bercampur dengan suspensi tanah merata, biarkan sampai media mengeras (padat). Setelah media mengeras, cawan petri diinkubasi pada inkubator dalam keadaan terbalik selama 3 hari dengan suhu 28-30ºC. Setelah diinkubasi selama 3 hari dilakukan pengamatan pada jamur yang tumbuh pada media. Keberadaan jamur pelarut fosfat ditunjukan dengan terbentuknya daerah bening
4. Uji potensi pada media padat
Jamur pelarut fosfat yang murni selanjutnya diuji kemampuannya melarutkan fosfat dalam cawan petri berisi media pikovskaya padat steril. Bahan yang digunakan dalam pembuatan media uji ini sama dengan bahan media pikovskaya pada tahap isolasi, namun Ca3(PO4)2 g/L pada media isolasi diganti dengan AlPO4 dengan dosis 5 g/L media, FePO4 dengan dosis 5 g/L media dan Batuan Fosfat dengan dosis 5 g/L. Media uji dimasukkan dalam cawan petri dibiarkan mengeras. Selanjutnya biakan murni ditumbuhkan pada media uji. Tiap biakan murni diberi 3 ulangan untuk mendapatkan rataan hasil yang valid. Inkubasi dilaksanakan selama 7 hari. Jamur pelarut fosfat yang membentuk
holozone paling cepat dengan diameter paling besar secara kualitatif di sekitar koloni menunjukkan besar kecilnya potensi jamur pelarut fosfat dalam melarutkan unsur P dari bentuk yang tidak terlarut. Dihitung potensi jamur dengan menggunakan nilai indeks pelarutan yaitu nisbah antara diameter zona jernih terhadap diameter koloni (Premono, 1998).
5. Uji potensi pada media cair
pemisahan antara filtrat dan endapan Jamur Pelarut Fosfat. Diambil filtrat menggunakan pipet untuk mengukur kandungan P tersedia. Filtrat ditentukan kadar P-tersedianya dengan metode kolorimetri dan dihitung dengan Bray-2. Hal serupa dilakukan juga pada kontrol yaitu media tanpa inokulum dan dibandingkan hasil yang diperoleh. Jamur yang paling besar meningkatkan P terlarut secara kuantitatif pada media (dibandingkan dengan hasil kontrol) merupakan jamur yang efektif dan potensial. Setelah itu diukur pH dengan menggunakan pH meter untuk mengetahui pengaruh pelarutan fosfat oleh jamur terhadap pH media.
6. Identifikasi jamur pelarut fosfat yang potensial melarutkan fosfat
HASIL DAN PEMBAHASAN
Karakteristik Sifat Kimia Sampel Tanah Gambut
Jenis tanah gambut yang di analisis yaitu jenis gambut kasar (Fibris ) dan gambut sedang (Hemis). Gambut kasar (Fibris) yaitu gambut yang memiliki lebih dari 2/3 bahan organik kasar, gambut kasar mempunyai porositas yang tinggi, daya memegang air tinggi, namun unsur hara masih dalam bentuk organik dan sulit tersedia bagi tanaman. Gambut kasar mudah mengalami penyusutan yang besar jika tanah direklamasi. Jenis gambut sedang (Hemis) yaitu gambut yang memiliki 1/3 – 2/3 bahan organik kasar. Hasil analisis sifat kimia tanah dapat dilihat pada Tabel 1.
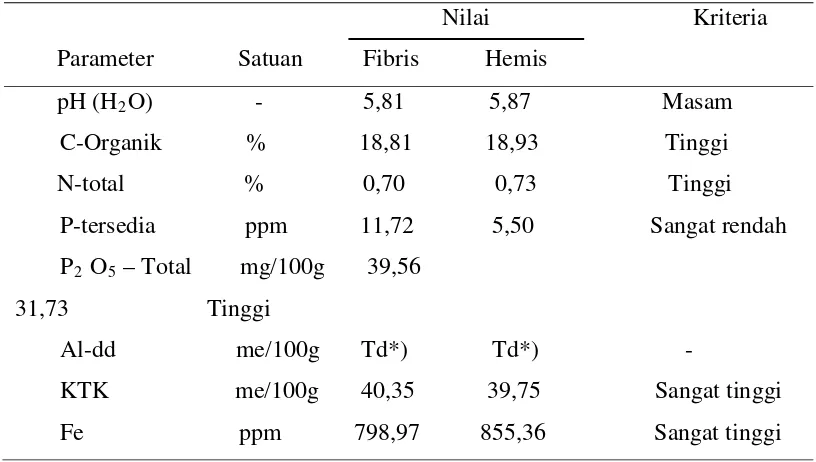
Tabel 1. Hasil analisis sifat kimia sampel tanah gambut fibris dan hemis
Nilai Kriteria Parameter Satuan Fibris Hemis
pH (H2
C-Organik % 18,81 18,93 Tinggi O) - 5,81 5,87 Masam
N-total % 0,70 0,73 Tinggi P-tersedia ppm 11,72 5,50 Sangat rendah P2 O5
Al-dd me/100g Td*) Td*) - – Total mg/100g 39,56 31,73 Tinggi
KTK me/100g 40,35 39,75 Sangat tinggi Fe ppm 798,97 855,36 Sangat tinggi
Lampiran 3
Keterangan : Td*) = Tidak terdeteksi
disebabkan tingginya asam fenolat dan asam-asam organik lain hasil dekomposisi bahan organik yang banyak mengandung lignin. Tapak pertukaran tanah gambut didominasi ion hidrogen yang merupakan kation yang berperan dalam pertukaran kation (KTK). Kation gambut akan mengikat basa-basa yang umumnya adalah hara yang dibutuhkan tanaman. Jumlah ion H+
Hasil analisis kapasitas tukar kation (KTK) tanah menunjukkan dari kedua sempel tanah yang digunakan termasuk sangat tinggi, Hal ini disebabkan oleh muatan negatif bergantung pH yang sebagian besar dari gugus karboksil dan gugus hidroksil dari fenol. Menurut Andriesse (1988) KTK tanah gambut di Indonesia sebagian besar ditentukan oleh fraksi lignin dan senyawa humat. Terutama tanah gambut ombrogen mempunyai komposisi vegetasi penyusun gambut yang didominasi oleh tumbuhan yang berasal dari bahan kayu-kayuan. Bahan kayu-kayuan umumnya banyak mengandung senyawa lignin yang dalam proses degradasinya akan menghasilkan asam-asam fenolat, sehingga menyebabkan pH tanah rendah dan sejumlah pupuk yang diberikan ke dalam tanah relatif sulit terserap oleh akar tanaman.
yang tinggi menyebabkan hara terikat semakin tinggi serta diikuti pula dengan penurunan pH. Penurunan pH akan diikuti kejenuhan basa yang rendah. Hal ini juga berarti ketersediaan hara yang semakin kecil.
tanah. Hal ini disebabkan oleh muatan negatif bergantung pH yang sebagian besar dari gugus karboksil dan gugus hidroksil dari fenol. Menurut Andriesse (1988) KTK tanah gambut di Indonesia sebagian besar ditentukan oleh fraksi lignin dan senyawa humat. Terutama tanah gambut ombrogen mempunyai komposisi vegetasi penyusun gambut yang didominasi oleh tumbuhan yang berasal dari bahan kayu-kayuan. Bahan kayu-kayuan umumnya banyak mengandung senyawa lignin yang dalam proses degradasinya akan menghasilkan asam-asam fenolat.
Ketersediaan fosfat dalam tanah sangat dipengaruhi pH karena P sangat rentan diikat pada kondisi masam maupun alkalin. Ketersediaan fosfat akan menurun pada pH <5,5 atau >7,0. Pada kondisi masam aktivitas besi dan aluminium yang tinggi menjadi unsur pengikat P yang utama. Pada kondisi aktivitas fiksasi atau jerapan dilakukan oleh kalsium dan magnesium yang banyak tersedia dan larut. Menurut poerwowidodo (2000), umumnya ketersediaan fosfat dalam tanah maksimum dijumpai pada kisaran pH 5,5-7,0.
tersebut akan tersedia kembali bila pH diturunkan. Jadi ketersediaan P sangat dipengaruhi oleh pH tanah.
Hasil pengukuran C-organik sampel tanah gambut fibris adalah 18,81 % dan tanah gambut hemis adalah 18,93 %. Nilai tersebut menggambarkan pada lahan gambut memiliki simpanan karbon yang tinggi. Kadar C-organik dapat memberi gambaran kandungan bahan organik dalam tanah. Bahan organik sebagai sumber hara makro dan mikro tanaman juga menjadi sumber nutrisi bagi kehidupan mikroba tanah yang akan mempengaruhi populasi dan aktivitasnya.
Hasil analisis menunjukkan bahwa ketersediaan fosfat dalam tanah pada tanah gambut fibris adalah 11,72 ppm dan gambut hemis sebesar 5,50 ppm ini menunjukkan bahwa kandungan P tersedia sangat rendah. Ketersediaan P ini sesuai dengan ketersediaan P pada tanah gambut secara umum. Mikroba tanah mampu menghasilkan enzim ekstraseluler yaitu kelompok enzim fosfatase dan fitase yang berperan dalam mekanisme pelarutan P-organik menjadi P-anorganik secara biologis. Hal ini didukung oleh hasil penelitian Rao (1994) yang menunjukkan bahwa mikroba pelarut fosfat mampu meningkatkan ketersediaan unsur P melalui aktivitas enzim. Enzim ini diproduksi selama proses dekomposisi bahan organik berlangsung. Dengan kata lain enzim fosfatase yang dihasilkan berbanding lurus dengan besar bahan organik yang didekomposisi.
dekomposisi baik dalam bentuk P-terikat ataupun P-tersedia. Besarnya bahan organik yang terdekomposisi dipengaruhi keadaan lingkungan seperti pH dan keberadaan oksigen tanah. Jika lingkungan mendukung, jumlah dan aktivitas dekomposer akan meningkat yang diikuti pelepasan hara kedalam tanah. Gambut juga mengandung beragam asam organik bermanfaat serta derivate fenolat yang bersifat racun bagi tanaman.
Sampel tanah gambut yang di ambil merupakan lahan bekas perkebunan sawit yang sudah lama tidak di olah, sehingga keadaan tanah hanya ditutupi vegetasi tanaman tumbuhan bawah dan tergenang air. Hal ini yang menyebabkan kandungan Fe pada gambut fibris sangat tinggi yaitu 798,97 dan 855,36 pada gambut hemis, sementara kandungan Al-dd tidak terdeteksi.
Isolasi Jamur Pelarut Fosfat dari Bahan Tanah Gambut
Hasil isolasi Jamur Pelarut Fosfat (JPF) dan Bakteri Pelarut Fosfat (BPF) dari tanah gambut Fibris dan hemis, diperoleh 30 sampel tanah yang diambil dari 5 petak contoh dilapangan dengan kedalaman 0-20 cm, dari tanah gambut fibris sebanyak 4 petak yaitu petak 1,2,3,4 dan pada tanah hemis satu petak yaitu petak 5. Diperoleh 12 isolat jamur pelarut fosfat, isolat JF1, JF2, JF3, JF4, JF5, JF8, JF9, JF10, JF11, dan JF 12 berasal dari tanah gambut fibris, sedangkan dari gambut hemis ada 2 isolat yaitu JH6 dan JH7 . Mikroba yang tumbuh di media isolasi baik itu jamur pelarut fosfat dan bakteri pelarut fosfat diamati dan dihitung jumlah total koloni dari setiap petak. Jumlah koloni total Jamur Pelarut Fosfat (JPF) dan Bakteri Pelarut Fosfat (BPF) dihitung agar dapat dibandingkan antara jumlah koloni jamur pelarut fosfat dengan bakteri pelarut fosfat sehingga dapat
dilihat mana yang paling banyak tumbuh pada media isolasi disajikan pada Tabel 2.
Tabel 2. Hasil perhitungan jumlah koloni JPF dan BPF
Petak Jenis Gambut Jumlah Koloni JPF Jumlah Koloni BPF
1 2 3 4 5
Fibris 15,87 × 10 Fibris 24,36 ×10
3
Fibris 25,22 × 10
3
Fibris 10,75 × 10
3
Hemis 12,27 × 10
3
78,32 × 10
3
67,40 × 10
3
36,93 × 10
3
54,29 × 10
3
75,16 × 10
3 3
Total Fibris 76,2 × 103 236,81× 103
pelarut fosfat yang diperoleh dari gambut fibris sebesar 313,01 x 103 SPK/ml dan pada jenis gambut hemis total populasi mikroba pelarut fosfat yang diperoleh sebesar 87,43 x 103 SPK/ml, jumlah ini tergolong rendah dibandingkan dengan hasil penelitian yang dilakukan sebelumnya. Berdasarkan penampakan struktur tumbuhnya, mikroba pelarut fosfat hasil isolasi dibedakan atas bakteri pelarut fosfat dan jamur pelarut fosfat. Populasi jamur pelarut fosfat yang diperoleh pada tanah gambut fibris yaitu 236,81 x 103 SPK/ml, populasi bakteri pelarut fosfat tampak tumbuh pada gambut fibris dengan jumlah koloni 76,2 x 103 SPK/ml. Populasi jamur pelarut fosfat yang diperoleh pada tanah gambut hemis yaitu 12,27 x 103 SPK/ml, populasi bakteri pelarut fosfat yang diperoleh pada tanah gambut hemis yaitu dengan jumlah koloni 75,16 x 103 SPK/ml. Dominannya keberadaan Bakteri Pelarut Fosfat dibanding Jamur Pelarut Fosfat diperkirakan karena populasi mikroba pelarut fosfat dari kelompok bakteri di dalam tanah lebih besar dibanding kelompok jamur. Hal ini sesuai pernyataan Ginting (2006) yang menyatakan bahwa populasi bakteri pelarut fosfat dapat mencapai 12x106 organisme per gram tanah, sedangkan populasi jamur pelarut fosfat berkisar 2x104 – 1x106
Sampel tanah yang digunakan memiliki pH yang masam yaitu 5,81. Dengan keadaan pH demikian pertumbuhan BPF berkembang baik dan pertumbuhan JPF menurun. Tingginya populasi BPF dibanding JPF dikarenakan pertumbuhan mikroorganisme pelarut fosfat sangat dipengaruhi oleh kemasaman tanah, pada tanah masam aktifitas mikroba didominasi oleh kelompok bakteri sebab pertumbuhan optimium bakteri pada pH 5-5,5. Sebaliknya JPF kurang berpotensi tumbuh pada pH yang netral karena dapat menghambat metabolisme
dalam pertumbuhannya. Hal ini sesuai dengan pernyataan Hardjowigeno (1996) yang menyatakan bahwa bakteri berkembang baik pada pH 5,5 atau lebih, sedangkan pada pH kurang dari 5,5 perkembangannya sangat terhambat.
Kondisi media inilah yang menyebabkan BPF dapat berkembang pesat karena kondisi pH yang netral tidak menghambat pertumbuhannya serta nutrisi yang tercukupi membuat BPF mampu berkembang maksimal. Populasi BPF yang tinggi selain didukung media tumbuh yang sesuai juga didukung sifat genetiknya yang berkembang lebih cepat dibanding jamur. Kondisi ini memungkinkan terjadinya penghambatan pertumbuhan JPF oleh BPF pada media isolasi. Menurut Foth (1994), bakteri dapat berkembang biak sangat cepat dengan pembelahan biner yang dapat berlangsung tiap menit bahkan lebih cepat bila kondisi lingkungan dan nutrisi mendukung. Media isolasi yang digunakan mengandung nutrisi lengkap untuk pertumbuhan mikroba. Kelengkapan nutrisi inilah yang kemungkinan turut mendukung tingginya perkembangbiakan BPF.
biak sangat cepat dengan pembelahan biner yang dapat berlangsung tiap menit bahkan lebih cepat bila kondisi lingkungan dan nutrisi yang mendukung. Selain itu diduga JPF kurang mampu berkompetisi dalam mempertahankan hidupnya dan membentuk koloni pada media isolasi, alasan lain adalah pembuatan media Pikovskaya harus steril dan teliti dan juga pada saat penuangan media Pikovskaya kedalam cawan petri steril harus dilakuakan secara aseptis dan digoyang terus menerus agar kekeruhan dalam media dapat merata. Hal ini sudah diterapkan pada saat penelitian tetapi, ada kemungkinan dalam pembuatan media Pikovskaya bahan dan alat yang digunakan tidak dalam kondisi kondisi steril, penuangan media kedalam cawan petri untuk setiap ulangan tidak sama dan juga ada kemungkinan setelah media dituang ke cawan petri ada sebagian yang belum digoyang sehingga tingkat kekeruhan dalam medium tidak merata. Hal ini berpengaruh dalam memudahkan pengamatan zona bening yang terbentuk apabila isolat JPF maupun BPF yang diinokulasikan berpotensi mereduksi fosfat.
sedangkan jamur pelarut fosfat berpotensi tumbuh pada kondisi masam hingga sangat masam, masing-masing mikroorganisme memiliki sifat-sifat khusus dan kondisi lingkungan optimal yang berbeda-beda yang mempengaruhi efektifitasnya melarutkan fosfat.
Mikroorganisme pelarut fosfat dapat diisolasi dari tanah yang kandungan fosfatnya rendah terutama disekitar perakaran tanaman, karena mikroorganisme ini menggunakan fosfat dalam jumlah yang sedikit untuk keperluan metabolismenya. Kondisi inilah yang medukung pengambilan sampel tanah diambil disekitar rhizosfir tanaman karena disekitar perakaran tanaman merupakan habitat yang sesuai dan mendukung untuk pertumbuhan mikroba karena adanya eksudat akar tanaman yang dapat menstimulir pertumbuhan, lisat akar maupun musigel yang secara langsung mempengaruhi kehidupan mikroba secara biologis dan pada umumnya populasi mikroba disekitar perakaran tanaman lebih tinggi dibandingkan bagian tanaman lainnya.
Kemampuan JPF Melarutkan P dalam Media Pikovskaya Padat
Jamur yang tumbuh pada media akan melarutkan P yang ditandai dengan terbentuknya holozone yang mengelilingi JPF. Holozone terbentuk sebagai akibat terjadinya pelarutan butiran aluminium fosfat, besi fosfat dan batuan fosfat dari media. Evaluasi kemampuan JPF dilakukan dengan mengukur lebar sempitnya diameter holozone yang disekelilingi koloni. Cara ini umum dilakukan, namun karena tidak memperhitungkan faktor pertumbuhan koloni, sering menghasilkan hubungan korelasi yang rendah antara lebar holozone dengan jumlah P-terlarut secara kualitatif. Menurut Premono (1994), hal tersebut dapat diatasi dengan menggunakan nilai indeks pelarutan (dissolving indeks) yaitu nisbah antara diameter holozone terhadap diameter koloni. Hasil indeks tersebut terbukti berkorelasi tinggi terhadap jumlah P yang dapat dilarutkan secara kualitatif. Maka pengukuran holozone dilakukan dengan menghitung nilai indeks pelarutan tiap isolat. Data hasil pengukuran indeks pelarutan dalam media pikovskaya padat selama 7 hari dapat dilihat pada Lampiran 7.
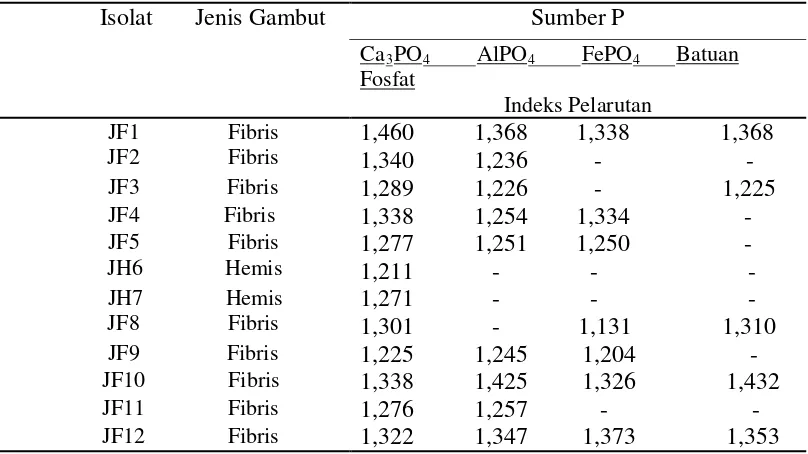
Tabel 3. Hasil pengukuran indeks pelarutan dalam media pikovskaya padat Isolat Jenis Gambut
Sumber P
Ca3PO4 AlPO4 FePO4
Indeks Pelarutan
Batuan Fosfat
JF1 Fibris JF2 Fibris
1,460 1,368 1,338 1,368 1,340 1,236 - -
JF3 Fibris 1,289 1,226 - 1,225
JF4 Fibris 1,338 1,254 1,334 -
JF5 Fibris
JH6 Hemis
1,277 1,251 1,250 - 1,211 - - -
JH7 Hemis JF8 Fibris
1,271 - - - 1,301 - 1,131 1,310
JF9 Fibris 1,225 1,245 1,204 -
JF10 Fibris 1,338 1,425 1,326 1,432
JF11 Fibris 1,276 1,257 - -
JF12 Fibris 1,322 1,347 1,373 1,353
Keterangan : (- ) tidak terbentuk holozone
JF Jamur dari gambut Fibris
1-12 asal isolat JPF
Hasil pengukuran indeks pelarutan AlPO4 menunjukkan dari 12 isolat JPF hanya 9 isolat JPF diantaranya yang mampu melarutkan fosfat dari persenyawaan aluminium fosfat. Hal ini menunjukkan bahwa JPF yang mampu melarutkan ikatan Ca3(PO4)2 , belum tentu memiliki kemampuan untuk melarutkan fosfat yang terikat aluminium. Hal ini sesuai dengan pernyataan Elfiati (2005) yang menyatakan setiap jamur memiliki kemampuan yang berbeda-beda dalam melarutkan ikatan fosfat Ca3(PO4)2, AlPO4, dan FePO4. Pernyataan tersebut terbukti oleh isolat yang mampu melarutkan Ca3(PO4)2 Pada media isolasi, namun tidak banyak yang mampu melarutkan AlPO4
Di antara JPF yang mampu melarutkan P dari AlPO
pada media uji potensi.
4
Hasil pengukuran indeks pelarutan dalam media pikovskaya padat menunjukkan dari 12 isolat JPF hanya 7 isolat JPF diantaranya yang mampu melarutkan fosfat dari persenyawaan FePO
didapatkan isolat yang paling besar indeks pelarutan yaitu isolat 1 dan 10. Indeks pelarutanterbesar ditunjukkan oleh isolat 10 yaitu sebesar 1,425 cm. Indeks pelarutan terkecil dibentuk oleh isolat 3 yaitu sebesar 1,226 cm. Perbedaan kemampuan tiap isolat JPF membentuk holozone di duga karena isolat berasal dari titik pengambilan sampel tanah yang berbeda dari tiap petak. Titik pengambilan sampel yang berbeda tentunya memiliki kondisi lingkungan, kelembaban, dan keadaan nutrisi dari bahan organik. Spesies jamur yang berbeda baik yang berasal dari tanah yang sama, maupun yang berasal dari tanah yang berbeda, bisa sama ataupun berbeda kemampuannya dalam melarutkan fosfat.
dari FePO4
Hasil pengukuran indeks pelarutan menunjukkan dari 12 isolat JPF hanya 5 isolat JPF diantaranya yang mampu melarutkan fosfat dari persenyawaan batuan fosfat. Hal ini menunjukkan bahwa JPF yang mampu melarutkan ikatan Ca
didapatkan 2 isolat yang paling besar membentuk holozone yaitu isolat 1 dan 12. Indeks pelarutan terbesar ditunjukkan oleh isolat 12 yaitu sebesar 1,373 cm. Indeks pelarutan terkecil dibentuk oleh isolat 8 yaitu sebesar 1,131 cm.
3(PO4)2 ,AlPO4, FePO4,
Keduabelas isolat berasal dari rhizosfir sama yaitu tumbuhan bawah/rumput, namun dari kedua belas isolat tersebut berasal dari tanah gambut yang berbeda. Isolat JF1, JF2, JF3, JF4, JF5, JF8, JF9, JF10, JF11, JF12 berasal dari tanah gambut fibris sedangkan isolat JH6 dan JH7 berasal dari tanah gambut
hemis. Dari data diatas dapat dilihat bahwa isolat JH6 dan JH7 yang berasal dari tanah gambut hemis tidak dapat melarutkan media pikovkaya padat pada media AlPO
belum tentu memiliki kemampuan untuk melarutkan fosfat yang terikat batuan fosfat.
4, FePO4
Indeks pelarutan fosfat sesuai digunakan untuk screening awal mikroba pelarut fosfat. Metode ini mudah dan murah untuk dilakukan. Tetapi jika tidak hati-hati metode ini bisa menimbulkan bias. Menurut Goenadi (1994), variasi indeks pelarutan fosfat dipengaruhi oleh beberapa hal, antara lain:
dan Batuan Fosfat.
1. Konsentrasi fosfat AlPO4 tidak larut dalam air, untuk menuang medium ini ke dalam cawan petri perlu digoyang-goyang terlebih dahulu. Ada kemungkinan bahwa konsentrasi AlPO4
zona jernih. AlPO4
3. Kecepatan pertumbuhan mikroba. Ada mikroba yang tumbuh dengan cepat dan ada mikroba yang tumbuh lambat. Misalnya, Penicillium sp umumnya memiliki diamater koloni yang lebih kecil daripada Aspergillus sp. Indeks
Penicillium sp lebih besar dari Aspergillus sp, tetapi kemampuannya melarutkan fosfat in vitro Penicillium sp lebih kecil daripada Aspergillus sp.
di agar yang lebih tebal tentunya lebih sulit untuk dilarutkan daripada di agar yang tipis.
Lahan gambut yang masam sesuai untuk pertumbuhan JPF karena umumnya jamur tumbuh optimal pada kondisi masam. Hal ini memungkinkan efektifitas JPF melarutkan fosfat pada gambut menjadi tinggi. JPF melarutkan fosfat secara kimia dan biologi walau secara umum pelarutan dilakukan secara kimia. Mekanisme pelarutan fosfat secara kimia dimulai saat JPF mengekresikan sejumlah asam organik berbobot molekul rendah hasil metabolismenya kedalam media. Asam-asam organik tersebut dapat membentuk kompleks stabil dengan kation-kation pengikat P pada tanah masam. Setiap JPF memiliki kemampuan yang berbeda secara genetik dalam mengekskresikan jenis dan jumlah yang dihasilkan. Hal ini terlihat dari perbedaan kemampuan tiap jenis JPF dalam melarutkan P.
Menurut Ginting (2006), kemampuan tiap mikroba pelarut fosfat tumbuh dan melarutkan fosfat berbeda-beda yang diidentifikasi dari luas holozone dan waktu terbentuknya. Mikroba pelarut fosfat yang unggul akan menghasilkan diameter holozone yang paling besar dan lebih cepat dibanding koloni lain.
dari yang sukar larut. Ke empat isolat yang digunakan dalam pengujian media cair adalah isolat JF1, JF4, JF10 dan JF12 (lampiran 2). Inilah yang mendasari pemilihan 4 isolat untuk dapat di uji kembali pada media cair. Hal ini diperkuat Tatiek (1991) yang menyatakan daerah bening pada media padat tidak dapat menunjukkan banyak sedikitnya jumlah P terlarut yang dihasilkan JPF, namun luas sempitnya daerah bening pada media padat belum dapat menunjukkan besar kecilnya jamur dalam melarutkan P, untuk itu perlu dilakukan uji lebih lanjut pada media cair untuk mengetahui kemampuan isolat melarutkan fosfat secara kuantitatif sehingga diperoleh informasi yang lengkap tentang JPF hasil isolasi dalam melarutkan fosfat.
Kemampuan JPF Melarutkan P dalam Media Pikovskaya Cair
Empat isolat unggul dari uji media padat yaitu JF1, JF4, JF10 JF12, selanjutnya diuji pada media Pikovskaya cair. Inkubasi dilakukan selama 7 hari pada suhu ruang (27ºC) karena pelarutan fosfat optimum pada kisaran 25-35ºC. Sebagai sumber P terikat digunakan Ca3PO4, AlPO4 ,FePO4
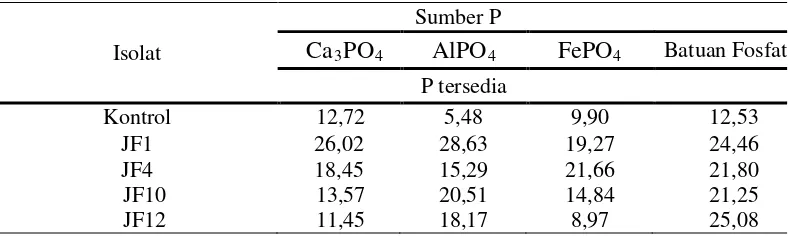
Table 4. Hasil pengukuran P tersedia yang dilarutkan oleh JPF
dan Batuan Fosfat. Hasil pengukuran P tersedia yang dilarutkan oleh JPF dapat dilihat pada Tabel 4 di bawah ini.
Isolat
Sumber P
Ca3PO4 AlPO4 FePO4 Batuan Fosfat P tersedia
Kontrol 12,72 5,48 9,90 12,53
JF1 26,02 28,63 19,27 24,46
JF4 18,45 15,29 21,66 21,80
JF10 JF12
13,57 11,45
20,51 18,17
14,84 8,97
Kemampuan JPF dalam melarutkan fosfat pada uji media cair sangat berbeda-beda, pada kontrol di temukan P terlarut bervariasi yaitu pada media Ca3PO4 kontrolnya sebesar 12,72 ppm, pada AlPO4 sebesar 5,48 ppm, pada FePO4 sebesar 9,90 ppm dan pada batuan fosfat kontrolnya sebesar 12,53 ppm. Pelarutan fosfat pada kontrol ini kemungkinan disebabkan pemanasan saat sterilisasi media. Isolat yang menghasilkan P tersedia paling besar adalah isolat JF1 dengan P tersedia dari AlPO4
Isolat yang menghasilkan P tersedia paling kecil adalah isolat JF12 dengan jumlah P terbebas dari FePO
sebesar 28,63 ppm dan ini tergolong dalam kriteria tinggi kemampuannya dalam membebaskan fosfat dari bentuk terikat menjadi bentuk yang tersedia.
tersedia dibandingkan dengan kontrol tanpa inokulasi.
Tidak diketahui dengan pasti mengapa isolat JF1 pada AlPO4 lebih tinggi kemampuannya dalam meningkatkan pelarutan fosfat dibanding pada Ca3PO4, tetapi diduga hal ini berkaitan erat dengan kemampuan JPF dalam menghasilkan asam organik yang berbobot molekul rendah karena jumlah asam organik yang diekskresikan oleh jamur pelarut fosfat berbeda-beda, asam organik ini berperan membentuk khelat organik yang stabil sehingga dapat membebaskan ion fosfat dari bentuk tidak tersedia menjadi bentuk yang tersedia. Sedangkan pada pH media Ca3PO4 dan AlPO4
Dari hasil yang diperoleh bahwa besar fosfat terlarut yang dihasilkan tiap isolat JPF bervariasi satu dengan yang lainnya. Besar P tersedia pada media diukur menggunakan metode Bray II, dan pembacaannya menggunakan
spectrometer dengan panjang gelombang 660 nm.
mengalami penurunan pH yang drastis, penurunan pH ini sesuai dengan peningkatan P tersedia diikuti penurunan pH media.
meskipun luas sempitnya daerah bening dapat menunjukkan besar kecilnya jamur melarutkan P sukar larut.
Pada pengujian media cair perbandingan kontrol tanpa inokulasi dengan diberi inokulasi terlihat jelas perbedaan warnanya (pada lampiran), pada kontrol filtrat yang dihasilkan pada hari 1 terlihat sama sampai hari ke 7 uji media cair, tidak ada perbedaan warna sama sekali tetap saja keruh artinya P yang ada dalam larutan tersebut tetap saja dalam keadaan terikat, sedangkan pada yang diberi inokulasi JPF terlihat jelas perbedaan filtratnya, pada pengujian hari 1 filtratnya berwarna keruh tetapi pada hari terahir pengujian setelah diamati warnanya telah menjadi agak bening, hal ini disebabkan bahwa JPF telah mampu melarutkan fosfat dari bentuk tidak tersedia menjadi tersedia sehingga tanpa dilakukan uji P- tersedia sekalipun kita sudah dapat menduga bahwa JPF tersebut telah mampu melarutkan fosfat.
Urutan kemampuan asam organik dalam melarutkan fosfat adalah asam sitrat > asam oksalat = asam tartarat = asam malat > asam laktat = asam fumarat = asam asetat. Asam organik yang mampu membentuk komplek yang lebih mantap dengan kation logam lebih efektif dalam melepas Al dan Fe mineral tanah sehingga akan melepas P yang lebih besar. Urutan kemudahan fosfat terlepas mengikuti ukuran Ca3(PO4)2 > AlPO4 > FePO4
Menurut Rao (1994), selain mikroba, akar tumbuhan juga melepaskan asam-asam organik yang dapat meningkatkan P tersedia. Asam organik tersebut dikeluarkan sebagai bentuk toleransi tumbuhan terhadap jumlah logam yang berlebihan sehingga bersifat racun dalam tanah. Asam organik yang dihasilkan akar tanaman di tanah masam berperan dalm penolakan Al melalui pelepasannya dari akar dan detoksifikasi Al dalam simpals. Asam organik seperti asam sitrat dapat mengkhelat Al dan mereduksi pengaruh racunnya pada tumbuhan (Prasetiyono dan Tasliah, 2003).
(Premono, 1994).
Ca, serta menutup tapak jerapan P pada komplek jerapan tanah.
Mikroba pelarut fosfat banyak dihasilkan pupuk hayati yang mengandung
mikroba pelarut fosfat. Mikroba ini ada yang hidup bebas di dalam tanah atau
hidup di daerah perakaran (rhizobakteri). Mikroba tersebut dapat menghasilkan
senyawa organik yang dapat melarutkan P-tanah, sehingga ketersediaan P bagi
tanaman meningkat dan mengurangi takaran penggunaan pupuk P. Selain
mengukur kadar P-tersedia, dilakukan juga pengukuran pH media untuk mengetahui perubahan yang terjadi (Tabel 5).
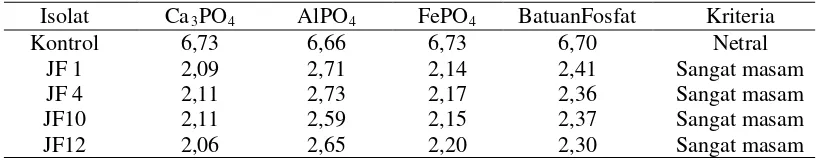
Tabel 5. Hasil pengukuran pH media.
Isolat Ca3PO4 AlPO4 FePO4 BatuanFosfat Kriteria
Kontrol JF 1 JF 4 JF10 JF12
6,73 2,09 2,11 2,11 2,06
6,66 2,71 2,73 2,59 2,65
6,73 2,14 2,17 2,15 2,20
6,70 2,41 2,36 2,37 2,30
Netral Sangat masam Sangat masam Sangat masam Sangat masam Sumber kriteria : Staf Penelitian Tanah-Bogor dan BPP-Medan (Lampiran 2)
Pengukuran pH media untuk mengetahui perubahan yang terjadi. Pada media yang tidak diberi isolat yaitu kontrol, pH media tetap pada kisaran netral sedangkan pada semua media yang diberi isolat JPF, nilai pH media cenderung menurun menjadi sangat masam.
adaptasi JPF terhadap media yang mengandung P terikat yang lebih tinggi dari P terlarut. Hubungan antara pH dengan P terlarut dimana pelarutan P tergantung dari banyaknya dan jenis asam organik yang dikeluarkan oleh isolat JPF tersebut yang ditandai dengan penurunan pH. Terlihat dari Tabel 4 bahwa peningkatan P tersedia diikuti penurunan pH media (Tabel 5). Hal ini sesuai dengan pernyataan (Ginting dkk, 2006) yang menyatakan mekanisme reduksi fosfat secara kimia dilakukan oleh mikroorganisme dengan cara mengekskresikan asam organik yang yang berbobot molekul rendah seperti sitrat, oksalat, malat dan tartrat akibat banyaknya asam organik yang diekskresikan membuat pH menjadi turun. Asam organik akan bereaksi dengan bahan pengikat fosfat seperti Al3+, Fe3+, Ca2+ atau Mg2+
Menurut Premono (1994) menyatakan bahwa mikroba menghasilkan asam-asam organik tersebut melalui proses katabolisme glukosa dalam siklus asam trikarboksilat (TCA), yang merupakan kelanjutan reaksi glikolisis. Asam-asam ini merupakan substrat untuk proses anabolisme dalam sintesis Asam-asam amino dan makromolekul lain yang dibutuhkan JPF untuk kelangsungan metabolismenya. Akibat reflex genetik, JPF menghasilkan asm-asam organik ini dalam jumlah berlebih, sehingga sebagian dari asam organik tersebut berdifusi keluar sel sebagai reaksi keseimbangan osmosis (Premono, 1994).
Identifikasi Jamur Pelarut Fosfat dari Bahan Tanah Gambut
Identifikasi dilakukan pada Jamur Pelarut Fosfat yang mampu membentuk
holozone paling cepat, berwarna bening dengan diameter paling tinggi pada media padat. Hal ini dilakukan karena banyaknya JPF yang diperoleh dari hasil isolasi namun tidak semuanya mampu melarutkan AlPO4, FePO4,
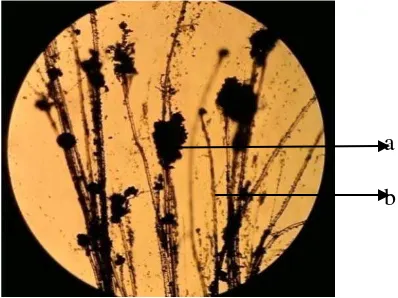
dan Batuan Fosfat dengan baik. Dan karena penelitian ini bertujuan untuk mencari JPF paling potensial, sehingga hanya JPF yang menunjukkan potensi paling baik selama pengujian saja yang diidentifikasi. Berdasarkan hasil identifikasi setelah diamati ciri makroskopis dan mikroskopisnya meliputi warna, ciri hifa, tipe percabangan hifa serta ciri konidia dibawah mikroskop dan dicocokkan dengan buku identifikasi jamur Gilman (1971) maka isolat JF1, JF4, JF10 dan JF12 termasuk dalam genus Aspergillus (Gambar 2).
a
b
Gambar 2. Aspergillus asal JF4
Keterangan :
Gambar 2. Penampakan Aspergillus sp. Dibawah mikroskop (perbesaran 10 kali)
(a. Spora, b. Tangkai konidia)
JF4 jamur dari gambut fibris 4
melarutkan fosfat, keempat isolat ini selanjutnya diidentifikasi dengan cara diamati ciri makroskopisnya dan mikroskopisnya disajikan pada Tabel 6.
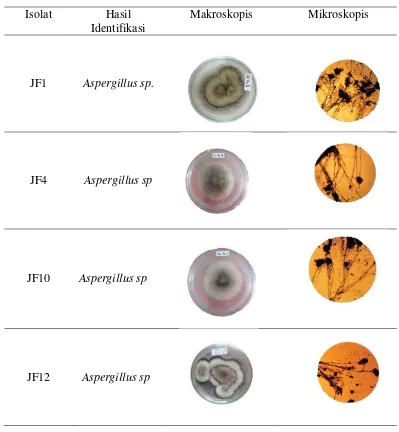
Tabel 6. Hasil isolasi dan identifikasi jamur pelarut fosfat
Isolat Hasil Identifikasi
Makroskopis Mikroskopis
JF1 Aspergillus sp.
JF4 Aspergillus sp
JF10 Aspergillus sp
JF12 Aspergillus sp
Ciri penampakan mikroskopis genus Aspergillus. di uraikan sebagai berikut :
Aspergillus sp.
Falid terbentuk langsung pada vesikula atau pada metula (pada kepala konidia yang besar), dan berukuran (10-15) x (4-8) µm. Metula berukuran (7-10) x (4-6) µm. Konidia berbentuk bulat hingga semibulat, berdiameter 5-6,5 µm, hitam. Aspergilus sp tergolong mikroba mesofilik dengan pertumbuhan pada suhu 35ºC-37ºC (optimum), 6ºC-8ºC (minimum), 45ºC-47ºC (maksimum). Derajat keasaman untuk pertumbuhannya adalah 2-8,5 tetapi pertumbuhan akan lebih baik pada kondisi keasaman atau pH yang rendah (Gilman, 1971).
Taksonomi fungi Aspergillus sp :
Kingdom : Myceteae (Fungi) Divisio : Ascomycota Kelas : Ascomycetes Ordo : Moniliales Famili : Moniliaceae Genus : Aspergillus
Spesies : Aspergillus sp.
Jenis Jamur Pelarut Fosfat Aspergillus sp berdasarkan penelitian-penelitian yang telah dilakukan tentang JPF memberikan hasil banyak spesies dari genus tersebut yang berkemampuan tinggi dalam melarutkan fosfat. Pada penelitian-penelitian tersebut diketahui bahwa Aspergillus sp mampu meningkatkan ketersediaan P sekitar 18 %. Aspergillus sp dapat dijumpai pada berbagai habitat dan kondisi yang berbeda serta tahan terhadap kondisi kelembaban yang rendah dan suhu ekstrim.
perekat partikel tanah. Sehingga dapat dijelaskan bahwa keberadaan Aspergillus sp di tanah gambut dapat membantu menyediakan unsur hara bagi tanaman dengan cara mendekomposisikan sisa-sisa bahan organik, kemudian diubah menjadi unsur yang dapat dimanfaatkan oleh tanaman.
Aspergillus sp, dapat ditemukan pada tanah, dan serasah dedaunan dengan cara mengisolasi fungi tersebut dari habitatnya. Peran penting Aspergillus sp
adalah dalam proses dekomposisi bahan organik tanah dan membantu pertumbuhan tanaman. Seperti diketahui bahwa sisa-sisa tanaman memiliki kandungan selulosa dan lignin yang tinggi yang merupakan sumber makanan bagi sebagian fungi termasuk di dalamnya Aspergillus sp, hal ini sesuai dengan pernyataan Rao (1994) yang menyebutkan bahwa beberapa mikroba seperti
KESIMPULAN DAN SARAN
Kesimpulan
1. Hasil eksplorasi jamur pelarut fosfat didapatkan 12 isolat jamur pelarut fosfat yang ditemukan pada lahan gambut, pada gambut fibris di dapatkan 10 isolat yaitu JF1, JF2, JF3, JF4, JF5, JF8, JF9, JF10, JF11 dan JF12, dan 2 isolat JH6, JH7 berasal dari gambut hemis.
2. Kemampuan Keduabelas isolat JPF yaitu JF1, JF2, JF3, JF4, JF5, JF8, JF9, JF10, JF11 dan JF12 berasal dari gambut fibris, dan isolat JH6, JH7 berasal dari gambut hemis dalam melarutkan fosfat pada uji media padat sangat tinggi dari bentuk Ca3PO4 dan AlPO4 tetapi rendah pada FePO4 dan Batuan Fosfat. Indeks pelarutan tertinggi JF1 pada Ca3PO4 yaitu 1,460 dan JF10 pada AlPO4 yaitu 1,425. Sedangkan indeks pelarutan terendah JF8 pada FePO4
3. Pada uji media cair keempat isolat mampu meningkatkan P tersedia yaitu JF1, JF4, JF10 dan JF12.
yaitu 1,131 dan JF3 pada batuan fosfat yaitu 1,225.
4. Hasil Identifikasi JPF didapatkan isolat JF1, JF4, JF10 dan JF12 termasuk dalam genus Aspergillus sp.
Perlu dilakukan pengaplikasian terhadap tanaman secara langsung untuk mengetahui seberapa besar kemampuan JPF dalam melepaskan ikatan AlPO4, FePO4, dan batuan fosfat sehingga menjadi tersedia bagi tanaman.
DAFTAR PUSTAKA
Andriesse, J.P. 1988. Nature and management of tropical peat soils. Soil resourcesManagement and Conservation service FAO Land and Water Development Division.FAO Soils Bulletine. 59. Rome.
Barchia, M.F. 2006. Gambut Agroekosistem dan Transformasi Karbon. UGM Pres, Yogyakarta.
Dawes, I.W and I.W. Sutherland. 1976. Microbial Physiology. Jhon Wiley and Sons. New York. Toronto.
Elfiati, D. 2005. Peranan Mikroba Pelarut Fosfat Terhadap Pertumbuhan Tanaman. USU e-Repository. Medan. [Diakses 15 Desember 2012]. Ervayenri, S., Sukarno. N., dan Kusmana. C. 1999. Arbuskula Mycorrhiza Fungi
(AMF) Diversity in Peat Soil Influenced by Vegetation: Types Procedings of International Conference on Mycorrhiza in Sustainable Tropical Agriculture and Forest Ecosystem 27-30 Oktober 1997. Bogor, Indonesia.
Gandjar, Indrawati, Wellyzar Sjamsuridzal dan Ariyanti Oetari. 2006. Mikologi Dasar dan Terapan. Yayasan Obor Indonesia. Jakarta.
Gilman, J.C. 1971. A Manual of soil Fungi. The Lowa State Adisoemarto. Airlangga. Jakarta.
Ginting, R.C., Badia, R. Saraswati dan E.F. Husen. 2006. Mikroorganisme Pelarut Fosfat. Pupuk Organik dan Pupuk Hayati. Balai Besar Litbang Sumber Daya Lahan Pertanian. Badan Penelitian dan Pengembangan Pertanian, Bogor. 144-146.
Perlu dilakukan pengaplikasian terhadap tanaman secara langsung untuk mengetahui seberapa besar kemampuan JPF dalam melepaskan ikatan AlPO4, FePO4, dan batuan fosfat sehingga menjadi tersedia bagi tanaman.
DAFTAR PUSTAKA
Andriesse, J.P. 1988. Nature and management of tropical peat soils. Soil resourcesManagement and Conservation service FAO Land and Water Development Division.FAO Soils Bulletine. 59. Rome.
Barchia, M.F. 2006. Gambut Agroekosistem dan Transformasi Karbon. UGM Pres, Yogyakarta.
Dawes, I.W and I.W. Sutherland. 1976. Microbial Physiology. Jhon Wiley and Sons. New York. Toronto.
Elfiati, D. 2005. Peranan Mikroba Pelarut Fosfat Terhadap Pertumbuhan Tanaman. USU e-Repository. Medan. [Diakses 15 Desember 2012]. Ervayenri, S., Sukarno. N., dan Kusmana. C. 1999. Arbuskula Mycorrhiza Fungi
(AMF) Diversity in Peat Soil Influenced by Vegetation: Types Procedings of International Conference on Mycorrhiza in Sustainable Tropical Agriculture and Forest Ecosystem 27-30 Oktober 1997. Bogor, Indonesia.
Gandjar, Indrawati, Wellyzar Sjamsuridzal dan Ariyanti Oetari. 2006. Mikologi Dasar dan Terapan. Yayasan Obor Indonesia. Jakarta.
Gilman, J.C. 1971. A Manual of soil Fungi. The Lowa State Adisoemarto. Airlangga. Jakarta.
Ginting, R.C., Badia, R. Saraswati dan E.F. Husen. 2006. Mikroorganisme Pelarut Fosfat. Pupuk Organik dan Pupuk Hayati. Balai Besar Litbang Sumber Daya Lahan Pertanian. Badan Penelitian dan Pengembangan Pertanian, Bogor. 144-146.
Havlin, J.L., J.D. Beaton., S.L. Tisdale., and W.L. Nelson. 1999. Soil Fertility and Fertilizers. An Introduction to Nutrient Management. Sixth ed. Prentice Hall, New Jersey.
Hardjowigeno, S. 1992. Ilmu Tanah. Mediyatama Sarana Perkasa, Jakarta.
Harjowigeno, S. 1996. Pengembangan lahan gambut untuk pertanian suatu peluang dan tantangan. Orasi Ilmiah Guru Besar Tetap Ilmu Tanah Fakultas Pertanian IPB.22 Juni1996.
Hanafiah, A.S. 2001. Penggunaan Pupuk Biologi di Perkebunana. Dibawakan Pada Panel Diskusi Permasalahan Pemupukan di Perkebunan, Fakultas Pertanian USU, pada tanggal 24 februari 2001 di Medan. 8p.
Hartatik, 1998. Erapan Fosfat, Kelarutan Hara Makro dan Mikroserta Pengaruh Besi terhadap Padi Sawah. Tesis ProgramPasca Sarjana. Institut Pertanian Bogor.
Malloch, D. 1997. Moulds, Isolation, Cultivation and Identification Methods. Departement of Biologi University of Taronto. Taronto.
Marlina, M.1997. Keragaman Bakteri Pelarut Fosfat pada Tanah di Lahan Hutan Primer, Hutan Sekunder, Pertanaman Kopi dan Lahan Kritis di Sumber Jaya Lampung Barat. Skripsi, Universitas Lampung. [Diakses 15 Desember 2012].
Mehrvarz, S., M. R. Chaichi and H. A. Alikhani. 2008. Effect of Phosphate Solubilizing Microorganisms and Phosphorus Chemical Fertilizer on Yield and Yield Components of Barely (Hordeum vulgare L.).
American-Eurasian J. Agric. &Environ. Sci., 3 (6): 822- 828.
Miller, M.H. And R. L. Donahue. 1990. Soils. An Introduction toSoils and Plant
Growth. Prentice Hall Englewood Cliffs.New Jersey. 768 p.
Noor, M. 2001. Pertanian lahan Gambut Potensi dan Kendala. Penerbit Kanisius. Poerwowidodo. 2000. Telaah Kesuburan Tanah. Angkasa, Bandung.
Ponmurugan, P., and C. Gopi. 2006. Distribution Pattern and Screening of Phosphate Solubilizing Bacteria Isolated from Different Food and Forage Crops. Journal of Agronomy. Asian Network for Scientific Information 5 (4): 600-604.
Premono, E.M. 1998. Ulas Balik: Mikroba Pelarut Fosfat untuk Mengefisienkan pupuk Fosfat dan Prospeknya di Indonesia (Enchancement of Phosphate Fertilizer Efficiency by Phosphate Solubilizing Microbes and Its Prospect in Indonesia).Hayati 5(4):89-94.
Rao, N.S.S. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. UI Press, Jakarta.
Rosmarkam, A., dan N.W.Yuwono. 2002. Ilmu Kesuburan Tanah. Kanisius, Yogyakarta.
Setiawati, T.C. 1998. Efektifitas Mikroba Pelarut P dalam Meningkatkan Ketersediaan P dan Pertumbuhan Tembakau Basuki Na-Oogst (Nicotiana tabacum L.). Tesis. Program Pascasarjana. IPB. Bogor. Sotanto, N. 2002. Penerapan Pertanian Organik. Kanisius, Jakarta.
Tatiek, H. 1991 .Bakteri Pelarut Fosfat Asal Beberapa Jenis Tanah dan Efeknya terhadap Pertumbuhan dan Hasil Jagung (Zea mays L). Disertasi Universitas Padjajaran. Bandung.
Whitelaw. 2000. Growth promotion of plants inoculated with phosphate solubilizing fungi. Adv. Agron. 69 : 99-151.
Lampiran 1. Dokumentasi tahap penelitian
Gambar 1. Pengambilan sampel Gambar 2. Isolasi mikroba pelarut fosfat
Gambar 5. Uji potensi hari 1 Gambar 6. Uji potensi hari ke 2
Gambar 3. Uji potensi hari ke 3 Gambar 4. Uji potensi hari ke 4