ABSTRACT
EFFECT OF ACTIVATED CHARCOAL AND COCONUT WATER IN MEDIUM ½ MS GROWTH OF PROTOKORM
ORCHID Dendrobium sp. IN VITRO
by MAIYULIS
Orchid is a plant that grows as an epiphyte with a ride on a stem or stalk of the parent plant without harming the mother. However, orchids are plants that are already familiar. One type is the famous orchid orchid Dendrobium sp. By color, size, fragrant, and a variety of flower shapes, thus making orchid Dendrobium sp. much in demand by orchid lovers. However, the request was not accompanied by the production of orchid seedlings, especially in Lampung. This is due in
Lampung orchid seed availability is limited and is derived from the outer islands. Tissue culture is one alternative way of providing orchid seeds with good quality, except that we can create a new hybrid orchid to a cross between elders orchids. Method for multiplication is performed by adding additional material such as activated charcoal and coconut water as adenda. Thus the provision of material adenda additional and are expected to have a positive effect on the growth of orchid culture.
This study aims to (1) Knowing the effect of activated charcoal administration of 2 g/l in ½ MS medium on the growth of the orchid Dendrobium sp. protokorm. (2) Knowing the effect of coconut water concentrations (0, 50, 100 and 200 ml/l) on ½ MS medium on the growth of the orchid Dendrobium sp. protokorm. (3) Knowing the interaction between activated charcoal and coconut water concentrations (0, 50, 100, and 200 ml/l) on ½ MS medium on the growth of the orchid Dendrobium sp. protokorm.
range between treatments were tested with the Bartlett test, while additivity was tested with the Tukey test. If both assumptions are met, then proceed with data analysis sidikragam. Mean separation by LSD at 5% level.
The results showed that (1) Addition of activated charcoal 2 g/l in ½ MS medium can increase the height of shoots, leaf length and plant wet weight, but had no effect on leaf length, and number of leaves of the orchid Dendrobium sp. (2) Provision of coconut water on ½ MS media can increase the height of shoots, leaf length, and weight of the explants, but had no effect on leaf number and root length orchid Dendrobium sp. (3) Effect of increasing concentrations of between 50 to 200 ml/l as well in enhancing the growth of orchids Dendrobium sp. on ½ MS medium. (4) In general, there is no interaction between the administration of activated charcoal and coconut water affect plant growth in the orchid
Dendrobium sp.
ABSTRAK
PENGARUH ARANG AKTIF DAN AIR KELAPA PADA MEDIA ½ MS TERHADAP PERTUMBUHAN PROTOKORM
ANGGREK Dendrobium sp. IN VITRO
Oleh MAIYULIS
Anggrek merupakan tanaman yang tumbuh secara epifit dengan menumpang pada batang atau tangkai tanaman induk tanpa merugikan induknya. Walaupun
demikian, anggrek merupakan tanaman hias yang sudah tidak asing lagi. Salah satu jenis anggrek yang terkenal adalah jenis anggrek Dendrobium sp. Dengan warna, ukuran, aroma khas, dan bentuk bunga yang bervariasi, sehingga membuat anggrek Dendrobium sp. diminati oleh banyak pecinta anggrek. Namun,
permintaan yang tinggi tidak diimbangi dengan produksi bibit anggrek khususnya di Lampung. Hal ini disebabkan bibit anggrek di Lampung ketersediaannya terbatas dan masih berasal dari luar pulau.
Kultur jaringan merupakan salah satu cara alternatif dalam menyediakan bibit anggrek dengan kualitas yang baik, selain itu kita dapat menciptakan anggrek hibrida baru dengan persilangan antar tetua anggrek. Metode yang dilakukan untuk perbanyakan yaitu dengan menambahkan bahan tambahan seperti arang aktif dan air kelapa sebagai adenda. Dengan demikian pemberian bahan
tambahan dan adenda diharapkan dapat berpengaruh positif terhadap pertumbuhan kultur anggrek.
Penelitian ini bertujuan untuk (1) Mengetahui pengaruh pemberian arang aktif 2 g/l pada media ½ MS terhadap pertumbuhan protokorm anggrek Dendrobium sp. (2) Mengetahui pengaruh konsentrasi air kelapa (0, 50, 100 dan 200 ml/l) pada media ½ MS terhadap pertumbuhan protokorm anggrek Dendrobium sp. (3) Mengetahui interaksi antara arang aktif dan konsentrasi air kelapa (0, 50, 100, dan 200 ml/l) pada media ½ MS terhadap pertumbuhan protokorm anggrek
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian, Universitas Lampung, dari bulan Oktober 2011 hingga Maret 2012. Penelitian ini dilaksanakan dengan menggunakan rancangan perlakuan faktorial (2x4). Faktor pertama adalah (menggunakan arang aktif 2 g/l dan tidak
menggunakan arang aktif 0 g/l). Faktor kedua penggunaan air kelapa (0, 50, 100, 200 ml/l). Homogenitas ragam antar perlakuan diuji dengan uji Barlett,
sedangkan aditivitas diuji dengan uji Tukey. Bila kedua asumsi terpenuhi, maka analisis data dilanjutkan dengan sidikragam. Pemisahan nilai tengah dengan uji BNT pada taraf 5%.
Hasil penelitian menunjukkan bahwa (1) Penambahan arang aktif 2 g/l pada media ½ MS dapat meningkatkan tinggi tunas, panjang daun dan bobot basah tanaman, tetapi tidak berpengaruh terhadap panjang daun, dan jumlah daun anggrek
Dendrobium sp. (2) Pemberian air kelapa pada media ½ MS dapat meningkatkan tinggi tunas, panjang daun, dan bobot eksplan, tetapi tidak berpengaruh terhadap jumlah daun dan panjang akar anggrek Dendrobium sp. (3) Pengaruh peningkatan konsentrasi antara 50 sampai 200 ml/l sama baiknya dalam meningkatkan
pertumbuhan tanaman anggrek Dendrobium sp. pada media ½ MS. (4) Secara umum, tidak terdapat interaksi antara pemberian arang aktif dan air kelapa dalam mempengaruhi pertumbuhan tanaman anggrek Dendrobium sp.
PENGARUH ARANG AKTIF DAN AIR KELAPA PADA MEDIA ½ MS TERHADAP PERTUMBUHAN PROTOKORM
ANGGREK Dendrobium sp. IN VITRO (Skripsi)
Oleh MAIYULIS
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
PENGARUH ARANG AKTIF DAN AIR KELAPA PADA MEDIA ½ MS TERHADAP PERTUMBUHAN PROTOKORM
ANGGREK Dendrobium sp. IN VITRO
Oleh MAIYULIS
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Program Studi Agroteknologi Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Ukuran protokorm sebagai bahan tanam yang digunakan. ... 2. Gambar persilangan tetua anggrek yang dijadikan bahan
perbanyakan tanaman. ... 3. Perkembangan protokorm anggrek Dendrobium sp. ... 4. Perkembangan tanaman anggrek Dendrobium sp. bulan ke-1
setelah tanam pada media ½ MS dengan perlakuan masing-masing media. ... 5. Perkembangan tanaman anggrek Dendrobium sp. bulan ke-2
setelah tanam pada media ½ MS dengan perlakuan masing-masing media. ... 6. Perkembangan tanaman anggrek Dendrobium sp. bulan ke-3
setelah tanam pada media ½ MS dengan perlakuan masing-masing media. ... 7. Perkembangan tanaman anggrek Dendrobium sp. bulan ke-4
setelah tanam pada media ½ MS dengan perlakuan masing-masing media. ... 8. Penampakan tanaman berumur 4 bulan setelah tanam pada
media A = ½ MS + arang aktif; B = ½ MS. ... 9. Penampakan tanaman berumur 4 bulan pada media ½ MS
setelah tanam. ………... 10.Pengaruh penambahan dengan atau tanpa arang aktif 2 g/l
pada tinggi tanaman pada 4 BST. Nilai diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji BNT 0,05. ... 11.Pengaruh konsentrasi air kelapa pada tinggi tanaman pada 4
12.Pengaruh konsentrasi air kelapa pada panjang daun tanaman pada 4 BST. Nilai diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji BNT 0,05. .………... 13.Pengaruh pemberian atau tanpa arang aktif pada 3 akar
terpanjang tanaman pada 4 BST. Nilai diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji BNT 0,05. ... 14.Pengaruh pemberian atau tanpa arang aktif pada bobot
tanaman pada 4 BST. Nilai diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji BNT 0,05. …... 15.Pengaruh konsentrasi air kelapa pada bobot tanaman pada 4
BST. Nilai diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji BNT 0,05. ……….………...
45
46
47
Dengan Nama Alloh Yang Maha Pengasih Lagi Maha Penyayang
Demi malam apabila menutupi cahaya siang,
Demi siang apabila terang benderang,
Demi penciptaan laki-laki dan perempuan,
Sungguh usahamu beraneka macam,
Maka barang siapa memberikan hartanya di
jalan
Alloh dan bertakwa,
Dan membenarkan adanya pahala yang
terbaik (Surga)
Maka akan kami mudahkan baginya jalan
menuju kemudahan (Kebahagiaan)
MENGESAHKAN
1. Tim Penguji
Ketua : Ir. Sri Ramadiana, M. Si.
Sekretaris : Dr. Ir. Yusnita, M. Sc.
Penguji : Dr. Ir. Dwi Hapsoro, M. Sc.
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M. S. NIP. 196108261987021001
PERSEMBAHAN
Kupersembahkan karya kecilku yang tidak ada artinya ini
untuk mengungkapkan rasa cinta dan kasih sayang dan
pengabdian penulis kepada;
Bapak dan Mamahku tercinta yang selalu memberikan
semangat dengan doa, pengorbanan dan kasih sayangnya;
adikku Rita Mastuti, Aeni Tri Kusumawati, Chosifa Nidia;
mamasku Ahmad Pulung Ramadoni S. Hut.;
Judul Skripsi : PENGARUH ARANG AKTIF DAN AIR KELAPA PADA MEDIA ½ MS
TERHADAP PERTUMBUHAN
PROTOKORM ANGGREK Dendrobium sp. IN VITRO
Nama Mahasiswa : Maiyulis No. Pokok Mahasiswa : 0814013036 Fakultas : Pertanian Jurusan : Agroteknologi
MENYETUJUI Komisi Pembimbing
Ir. Sri Ramadiana, M. Si. Dr. Ir. Yusnita, M. Sc.
NIP. 196912051994032002 NIP. 196108031986032002
Ketua Program Studi Agroteknologi
RIWAYAT HIDUP
Penulis dilahirkan di Natar tanggal 1 Juni 1990, yang merupakan anak pertama dari empat bersaudara pasangan dari Bapak Saryadi dan Ibu Faridah, dengan anak kedua bernama Rita Mastuti, ketiga Aeni Trikusumawati dan keempat Chosifa Nidia. Kami hidup bersama di rumah kami yang bertempat tinggal di Jln. Raya Natar Srimulyo 1 No. 5, Pemanggilan, Lampung Selatan.
Penulis menyelesaikan pendidikan di TK. Darma Wanita Natar pada tahun 1995, Sekolah Dasar Negeri 5 Rajabasa pada tahun 2001, SLTP Negeri 8 Bandar Lampung (2004), SMA Negeri 1 Natar (2008). Pada Tahun 2008 penulis
diterima di Jurusan Budidaya Pertanian Program Studi Agroekoteknologi Fakultas Pertanian Universitas Lampung melalui jalur PMKA. Selama masa perkuliahan penulis pernah mengikuti organisasi UKM-Penelitian sebagai Sekretaris Umum periode 2009/2010.
SANWACANA
Segala puji hanyalah untuk ALLAH subhanahu wataa’la atas rahmat dan
hidayah-Nya, yang telah memberikan karunia dan talenta sehingga Penulis dapat menyelesaikan tugas akhir yang berjudul ‘Pengaruh Arang Aktif Dan Air Kelapa Pada Media ½ MS Terhadap Pertumbuhan Protokorm Anggrek Dendrobium sp. In Vitro’. Sholawat dan salam selalu senantiasa tercurahkan kepada Baginda Rosululloh Muhammad shallallahu ‘alaihi wassallam dan keluarga serta para sahabat.
Dalam menyelesaikan Tugas akhir ini banyak pihak yang telah memberikan perhatian, bantuan, bimbingan, motivasi dan arahan serta nasihat kepada Penulis. Oleh karena itu, Penulis mengucapkan terima kasih kepada:
2.Ibu Dr. Ir. Yusnita M. Sc., Selaku Sekretaris Tim Penguji atas bimbingan, saran, ilmu pengetahuan, kesabaran, kebaikan, pengertian, dan pengarahan selama melaksanakan penelitian hingga penulisan skripsi ini;
3.Bapak Dr. Ir. Dwi Hapsoro M. Sc., selaku Penguji atas bimbingan, saran dan kritikan yang bermanfaat untuk perbaikan skripsi ini;
4.Proyek Hibah Bersaing 2011, atas dana yang diberikan untuk terlaksananya penelitian ini hingga selesai;
5.Bapak Ir. Kushendarto M. P., selaku Pembimbing Akademik, terimakasih atas pengarahan dan gambaran perkuliahan sampai menyelesaikan skripsi;
6.Bapak Dr. Kuswanta F. Hidayat, M.P., selaku Ketua Program studi Agroteknologi;
7.Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas Pertanian Universitas Lampung;
8.Kedua orang tua, Bapak dan Mamah, atas seluruh doa, cinta dan kasih sayang, dukungan moril maupun materilnya, perjuangan, semangat, motivasi,
pengorbanan, perhatian, dan pengertian untuk meraih impian dan cita-cita penulis.
9.Adik-adikku Rita Mastuti, Aeni Trikusumawati dan Chosifa Nidia, yang telah memberikan motivasi, semangat, serta dukungan dan doa;
10.Mamas Ahmad Pulung Ramadoni S. Hut., sebagai orang yang saya sayangi yang telah banyak memberikan semangat, motivasi, dan dukungan;
12.Rindang Andam Suri, Intan Rahayu Ningtias, Ananda Yasinta R, Sigit Ardiansyah, Herlina Levilia dan seluruh rekan-rekan AGT 2008-2011. Semoga Allah SWT membalas kebaikan mereka dan semoga skripsi ini bermanfaat. Amin.
Bandar Lampung, Agustus 2012
I. PENDAHULUAN
I.I Latar Belakang dan Masalah
Anggrek merupakan tanaman hias yang tergolong ke dalam famili Orchidaceae yang tumbuh secara epifit atau menempel pada batang tanaman tanpa merugikan tanaman induknya (Gunawan, 2005). Keluarga anggrek termasuk kerajaan tumbuhan terbesar yaitu sekitar 750 jenis yang berbeda dengan sedikitnya 25.000 jenis asli (spesies) dan lebih dari 30.000 kultivar hibrida hasil persilangan (Hew dan Yong, 2008). Dendrobium meliputi 1000 spesies berasal dari kaki gunung Himalaya menyebar melalui Asia Tenggara ke Jepang, Australia, Tasmania, dan kepulauan Pasifik (Kamemoto et al., 2004).
Dendrobium merupakan salah satu dari jenis anggrek yang banyak dibudidayakan
Permintaan anggrek Dendrobium hibrida meningkat di setiap tahunnya. Menurut BPS (2010), produksi anggrek di Indonesia pada tahun 2010 sebanyak 14.050.445 tangkai. Produksi bunga anggrek di Propinsi Lampung tahun 2009 mencapai 206.954 tangkai meningkat menjadi 219.669 tangkai di tahun 2010. Sedangkan, produksi dan produktivitas tanaman anggrek khususnya di Lampung pada tahun 2009 yaitu produksi (206.954 tangkai/tahun), dan produktivitas (5.33 tangkai/m2) meningkat menjadi produksi (219.669 tangkai/tahun) dan produktivitas
(6.81 tangkai/m2) di tahun 2010 (BPS, 2010).
Selain produksinya meningkat di setiap tahunnya, Indonesia merupakan salah satu penyedia plasma nutfah anggrek yang melimpah. Sehingga, Indonesia berpotensi sebagai negara penghasil anggrek dengan menciptakan hibrida-hibrida baru. Hibrida-hibrida anggrek dapat tercipta jika adanya pemuliaan dan teknologi perbanyakan anggrek yang baik. Pemuliaan anggrek yang baik dan benar dapat menghasilkan hibrida dengan karakter yang baru dan sifat yang unggul.
Sebagian besar biji merupakan organ tanaman yang memiliki cadangan makanan yang digunakaan untuk metabolisme sel di dalam biji, sehingga dapat terus tumbuh hingga nutrisi di dalam sel habis. Apabila nutrisi yang berada pada -+ -cadangan makanan di biji habis, maka suplai habis dan sel mati yang akan mengakibatkan biji mati. Oleh karena itu, jika cadangan makanan di dalam biji habis, tanaman akan segera mencari nutrisi lain yang berada disekitarnya.
Namun, anggrek memiliki biji dengan ukuran sangat kecil dan tanpa adanya cadangan makanan (Hartmann et al., 2002), sehingga untuk kelangsungan
mendapatkan nutrisi. Ketiadaan cadangan makanan pada biji anggrek membuat anggrek sangat sulit berkecambah di lingkungan alami dengan kondisi normal (Yusnita, 2010).
Kultur jaringan merupakan salah satu cara untuk menumbuh kembangkan biji anggrek in vitro secara aseptik. Karena pada media kultur jaringan terdapat nutrisi dan sumber hara makro dan mikro yang dibutuhkan biji anggrek untuk berkecambah. Mengecambahkan anggrek dengan kultur jaringan menguntungkan secara ekonomi dengan jumlah yang banyak dalam waktu yang singkat
dibandingkan penanaman secara konvensional yang membutuhkan waktu yang lama dan mahal (Hew dan Yong, 2008).
Media dasar yang digunakan dalam kultur jaringan ada beberapa macamnya. Beberapa media dasar yang digunakan untuk perbanyakan anggrek Dendrobium adalah Vacin-Went medium (Vacin and Went, 1949), Knudson C medium (Knudson, 1946), Woody Plant Medium (Lloyd and McCown, 1981) dan
Murashige-Skoog medium (Murashige and Skoog, 1962). Beberapa media yang digunakan media dasar MS adalah media yang sering digunakan.
Pemakaian unsur makro yang lebih rendah dari pada konsentrasi yang terdapat pada media MS terbukti lebih baik (George, 1996). Zhang et al. (1993) yang dikutip dalam Piria et al., (2008) melaporkan bahwa ½ MS dapat mendukung
dengan cepat memproduksi protokorm anggrek, karena terkandung ion tinggi dan nutrisi. Yusnita (2010) menyatakan bahwa penggunaan media ½ MS baik
(Mo) yang tidak terdapat pada media Knudson C dan Vacin-Went. Media ½ MS juga mengandung myo inositol dalam jumlah yang cukup besar (100 mg/l) (Yusnita, 2003).
Media ½ MS terbukti lebih baik dibandingkan dengan media dengan konsentrasi hara makro dan mikronya ¼ MS dan MS penuh (Fadel et al., 2010). Dari
berbagai penelitian yang telah dilakukan, penggunaan media dasar ½ MS telah memberikan efek yang baik untuk pertumbuhan protokorm anggrek Dendrobium sp., sehingga digunakanlah media dasar ½ MS. Media ½ MS artinya konsentrasi hara makro dan mikronya setengah dari yang terdapat pada media MS (Yusnita, 2010).
Arang aktif (activated charcoal) juga sering digunakan untuk menggelapkan media kultur. Penambahan arang aktif pada media kultur dapat meningkatkan pertumbuhan plantlet dan arang aktif dapat menyerap etilen atau senyawa - senyawa toksik lain dalam media yang dapat menghalangi pembelahan dan pertumbuhan planlet (Arditti dan Ernst, 1993). Pemberian arang aktif dapat meningkatkan pertumbuhan protokorm anggrek Dendrobium menjadi seedling (Yusnita, 2010).
pertumbuhan protokorm yang lebih baik, semua formulasi media dasar diperkaya dengan 150 ml/l air kelapa (Yusnita, 2010).
Penelitian ini dilakukan untuk menjawab pertanyaan sebagai berikut: 1. Apakah pemberian arang aktif 2 g/l pada media ½ MS meningkatkan pertumbuhan protokorm anggrek Dendrobium sp. ?
2. Apakah penambahan air kelapa pada media ½ MS meningkatkan
pertumbuhan protokorm dan apakah peningkatan konsentrasi air kelapa dari 50 menjadi 100 dan 200 ml/l meningkatkan pertumbuhan kultur anggrek Dendrobium sp. ?
3. Apakah terdapat interaksi antara perlakuan arang aktif dan air kelapa (0, 50, 100 dan, 200 ml/l) dalam pengaruhnya terhadap pertumbuhan protokorm anggrek Dendrobium sp. ?
1.2 Tujuan Penelitian
Berdasarkan identifikasi dan perumusan masalah yang telah dibuat, maka disusun tujuan penelitian sebagai berikut:
1. Mengetahui pengaruh pemberian arang aktif 2 g/l pada media ½ MS terhadap pertumbuhan protokorm anggrek Dendrobium sp. 2. Mengetahui pengaruh konsentrasi air kelapa (0, 50, 100 dan 200 ml/l)
pada media ½ MS terhadap pertumbuhan protokorm anggrek Dendrobium sp.
1.3 Landasan Teori
Bunga anggrek setelah penyerbukan, indung telur akan berkembang ke dalam kapsul buah yang terdapat berjuta- juta benih yang berukuran sangat kecil yang terdiri dari massa sel yang dipisahkan oleh mantel benih (Hew dan Yong, 2008). Jutaan biji anggrek yang tidak mempunyai kotiledon dan endosperm, sehingga sulit berkecambah dalam keadaan alami yang normal (Yusnita, 2010).
Kelangsungan hidup biji anggrek di alam sangat tergantung pada cendawan mikoriza (Darmono, 2004). Pada kondisi sesuai hifa dari mikoriza akan menembus embrio anggrek melalui sel suspensor yang akan dicerna oleh biji anggrek, sehingga terjadi pelepasan nutrisi yang akan digunakan sebagai bahan energi untuk pertumbuhan dan perkembangan perkecambahan biji anggrek.
Sistem kultur in vitro atau tissue culture merupakan salah satu cara untuk menumbuhkan biji anggrek yang sulit berkecambah. Kultur jaringan itu adalah menumbuhkan jaringan atau organ tanaman secara aseptic dimana diberikan nutrisi dan hormon pertumbuhan tanamannya yang dapat dikendalikan (Hartmann et al., 2002).
media agar-agar yang aseptik (Yusnita, 2010). Media agar-agar mengandung suplai energi dan hara makro, hara mikro serta berbagai adenda lain supaya perkecambahan biji dan pertumbuhan protokorm menjadi seedling optimal.
Pertumbuhan dan perkembangan tanaman anggrek Dendrobium sangat dipengaruhi oleh media. Beberapa media yang dapat digunakan untuk
perbanyakan anggrek adalah Knudson C (Knudson, 1946), Wimber (Wimber, 1963) atau Fonnesbech (Fonnesbech, 1972) atau media MS (Murashige and Skoog, 1962) (Widoastoety et al., 2005).
Media dasar MS adalah media yang sering digunakan pada kultur jaringan. Media Murashige dan Skoog mengandung 60 mM nitrogen dalam bentuk NO3 dan NH4, sedangkan kalium sampai 20 mM dan pospat 1,25 mM dalam bentuk HPO4-2 dan H2PO4-(George, 2008), sehingga dapat menjadikan MS sebagai media dasar yang baik digunakan untuk berbagai kultur in vitro. Yusnita (2008) membuktikan bahwa media MS baik untuk pertumbuhan protokorm anggrek Dendrobium hibrida. Namun, pemakaian konsentrasi unsur-unsur makro yang lebih rendah dari pada konsentrasi yang terdapat pada media MS terbukti lebih baik (Gunawan, 1988).
dari penelitiannya bahwa media dasar ½ MS merupakan media dasar terbaik menghasilkan pertumbuhan protokorm dibandingkan media Vacin and Went dan Hiponex.
Sumber karbohidrat misalnya gula merupakan komponen yang selalu ada dalam media tumbuh. Sukrosa adalah karbohidrat yang paling baik, dibandingkan fruktosa, galaktosa, manosa dan laktosa yang tidak efektif pada media tumbuh. Sukrosa dalam media dihidrolisa menjadi monosakharida selama kultur.
Hidrolisa terjadi karena aktifitas enzim invertase yang terdapat pada dinding sel. Hidrolisa sukrosa paling efektif dalam media dengan pH rendah. Dalam kultur embrio, konsentrasi gula digunakan 12 % (Gunawan, 1988). Gula juga berfungsi sebagai meningkatkan tekanan osmotik dalam media (George, 2008).
Arang aktif (activated charcoal) juga sering digunakan pada media kultur. Pengaruh arang aktif pada perkecambahan digunakan untuk menyerap senyawa penghambat seperti ethylene, phenolics dan carboxylic yang bersifat toksik yang dapat menghambat pertumbuhan. Arang aktif juga berfungsi menggelapkan warna media sehingga pengakarannya masuk ke dalam media. Selain itu, arang aktif juga dapat mengurangi pencoklatan pada media yang diakibatkan oleh pemanasan tinggi setelah proses sterilisasi (Arditti dan Ernst, 1993).
Selain media dasar, diperlukan adenda sebagai bahan tambahan. Cairan air kelapa yang masih muda adalah komponen yang efektif untuk media kultur jaringan yang dapat meningkatkan pertumbuhan sel, organ, jaringan ataupun seedling anggrek in vitro (Arditti dan Ernst, 1993). Air kelapa digunakan untuk perbanyakan in vitro
tanaman hias misalnya anggrek karena mengandung zat pengatur tumbuh alami yaitu sitokinin dan auksin (George, 2008).
Air kelapa mengandung ion anorganik (klorin, tembaga, besi, magnesium, phosphorus, potassium, sodium, sulfur), komponen nitrogen (thanolamine dan ammonia), asam amino, enzim, dan asam organik (George, 2008). Selain itu, air kelapa juga mengandung gula antara 1,7 – 2,6% dan protein 0,07 – 0,55%. Selain kaya mineral, air kelapa juga menggandung bermacam-macam vitamin seperti asam sitrat, asam nikotinat, asam pantotenat, asam folat, niasin, riboflavin, dan tiamin (Arditti dan Ernst, 1992).
Penggunaan air kelapa yang efektif untuk media yaitu sekitar 10 – 15% dari volume medianya dan konsentrasi yang paling tinggi yaitu 20% air kelapa untuk media (George, 2008). Air kelapa dengan konsentrasi 15% yang sama efektifnya dengan BA 1,5 mg/l dalam multiplikasi tunas, maka peran sitokinin sintetik dapat digantikan oleh air kelapa (Seswita, 2010).
Air kelapa dapat berefek menstimulasi pertumbuhan dan perkembangbiakan seedling anggrek serta dapat merangsang tumbuhnya tunas dengan konsentrasi 10
– 15% dimana penggunaannya tidak dicampur dengan daging buah (Arditti dan
seperti air kelapa merupakan salah satu faktor yang dapat mempengaruhi pembesaran protokorm anggrek Dendrobium.
Setelah pembuatan larutan media, diperlukan agar sebagai pemadat media. Agar yang digunakan merupakan campuran polisakharida yang diperoleh dari spesies alga dengan kandungan unsur Ca, Mg, K, dan Na. Keuntungan agar-agar yaitu membeku pada temperatur < 45o C dan mencair pada 100o C, tidak dicerna oleh enzim tanaman dan tidak bereaksi dengan persenyawaan penyusun media
(George, 2008). Konsentrasi agar yang sering digunakan antara 0,5 – 1,0% pada media kultur (Gunawan, 1988).
1.4 Kerangka Pemikiran
Untuk menjelaskan perumusan masalah dalam penelitian ini disusunlah kerangka pemikiran sebagai berikut:
Dendrobium adalah salah satu jenis anggrek yang banyak diminati oleh
konsumen. Permintaan anggrek sebagai bunga potong dan bunga pot meningkat setiap tahunnya. Hal ini disebabkan oleh tipe bunga yang menarik dengan warna yang beragam. Anggrek Dendrobium juga mempunyai penampilan yang cantik dan elegan serta bentuknya yang unik dan indah, mengakibatkan permintaan akan bunga potong anggrek meningkatkan di Indonesia.
Untuk memenuhi kebutuhan permintaan yang tinggi terhadap anggrek
Dendrobium, perlu dilakukan perbanyakan yang dapat menghasilkan anggrek
yang berkualitas dengan waktu singkat dan menghasilkan tanaman yang seragam. Salah satu cara perbanyakan generatif yaitu menggunakan biji anggrek
lingkungan alami yang normal, dikarenakan biji anggrek yang terlalu kecil dan tidak memiliki endosperem ataupun kotiledon, sehingga, untuk dapat tumbuh secara alami di lingkungan normal diperlukan adanya simbiosis dengan jamur yang berada di alam misalnya mikoriza.
Kultur jaringan merupakan alternatif yang dapat digunakan untuk
mengecambahkan biji anggrek Dendrobium yang sulit untuk berkecambah. Teknik kultur in vitro memerlukan media dan lingkungan tumbuh yang optimal untuk anggrek, sehingga biji anggrek dapat tumbuh dengan baik. Media sangat berperan dalam mensuplai nutrisi dan unsur hara yang digunakan untuk
perkecambahan biji dan pembesaran protokorm anggrek Dendrobium. Jenis dan komposisi media harus mengandung unsur hara makro dan mikro dalam bentuk garam-garam, vitamin, glukosa atau sukrosa sebagai sumber karbon serta bahan pemadat berupa agar-agar.
Beberapa penelitian sebelumnya pembesaran protokorm anggrek Dendrobium dilakukan pada media padat MS untuk mendapatkan seedling dengan
pertumbuhan yang baik. Pada media MS (Murashige dan Skoog,1962)
mengandung unsur hara makro, mikro, vitamin, dan gula membuat media MS ini sering digunakan untuk pembesaran protokorm secara in vitro.
Penggunaan media MS dengan konsentrasi hara makro dan mikro setengahnya dari banyak penelitian telah mampu dengan baik mempercepat pertumbuhan berbagai jenis tanaman yang salah satunya protokorm anggrek Dendrobium. Media ½ MS telah banyak dilakukan pada penelitian sebelumnya dan
menghasilkan pertumbuhan protokorm anggrek Dendrobium yang baik.
Biji anggrek dihasilkan dari persilangan bunga anggrek secara selfing. Jika persilangan berhasil bunga akan layu dan membentuk polong yang berisi biji-biji anggrek. Biji anggrek yang dihasilkan memiliki karakter baru dari kedua
induknya. Setelah polong anggrek telah matang dilakukan penanaman biji anggrek ke media ½ MS. Setelah biji anggrek berkecambah menjadi protokorm dilakukan subkultur dengan memindahkan protokorm ke media baru. Eksplan yang digunakan pada pembesaran ini harus dicirikan dengan protokorm yang sudah primordian daun sudah muncul sekitar dua bulan umur protokormnya.
Selain itu, pada media kultur dapat dikombinasikan dengan pemberian arang aktif. Arang aktif dan berbagai konsentrasi air kelapa yang dimasukkan ke dalam
formulasi media dapat mempengaruhi pertumbuhan anggrek Dendrobium. Arang aktif yang ditambahkan dalam formulasi media dapat menstimulasi pertumbuhan sel dengan kemampuan arang aktif mengikat senyawa fenol yang bersifat toksik yang diproduksi biakan selama dalam kultur yang dapat menghambat
pertumbuhan protokorm anggrek Dendrobium.
Arang aktif juga dapat merangsang perakaran dan mengurangi intensitas cahaya yang sampai ke media pembesaran protokorm. Pada penelitian sebelumnya penambahan arang aktif 2 g/l berpengaruh positif dalam meningkatkan
Untuk meningkatkan pertumbuhan eksplan protokorm anggrek Dendrobium, media kultur biasanya ditambahkan dengan air kelapa yang diketahui
mengandung ZPT sitokinin, natrium, vitamin, gula, asam-asam organik, dan senyawa-senyawa lain yang mampu merangsang respon untuk tumbuh dan perkembangan protokorm anggrek Dendrobium. Pada penelitian sebelumnya air kelapa yang digunakan sebagai adenda tambahan terbukti dapat meningkat pekecambahan biji dan menigkatkan protokorm anggrek serta baik untuk pertumbuhan protokorm anggrek Dendrobium menjadi seedling, sehingga digunakanlah adenda air kelapa dalam penelitian ini.
1.5 Hipotesis
Berdasarkan kerangka pemikiran yang telah dikemukakan dapat disimpulkan hipotesis sebagai berikut:
1. Pemberian arang aktif 2 g/l pada media ½ MS mampu meningkatkan pertumbuhan protokorm anggrek Dendrobium.
2. Penambahan air kelapa pada media ½ MS dan konsentrasi air kelapa 100 ml/l merupakan konsentrasi terbaik dalam meningkatkan pertumbuhan protokorm anggrek Dendrobium.
3. Terdapat interaksi antara perlakuan arang aktif dan air kelapa
II. TINJAUAN PUSTAKA
2.1 Gambaran Umum Tanaman Anggrek Dendrobium sp.
Famili anggrek merupakan salah satu kelompok terbesar diantara tumbuhan lainnya di dunia. Tidak seorang pun mengetahui berapa banyak jenis dan spesies yang tergolong ke dalam jenis anggrek-anggrekan (Cribb, 2008). Anggrek
termasuk keluarga besar dari kelompok (sub divisi) tanaman berbunga atau berbiji tertutup (Angiospermae), kelas tanaman berbiji tunggal (Monocotyledoneae), ordo Orchidales, dan famili Orchidaceae (Hew dan Yong, 2008).
Orchidaceae merupakan tanaman yang ditemukan pada daerah tropis dan
subtropis terutama pada pegunungan tropis Amerika dan Asia Tenggara (Chen dan Chen, 2005). Dalam kingdom Plantae, anggrek diwakili oleh sejumlah genera, yaitu sekitar 600 – 800 genera yang terdiri dari 25.000 hingga 35.000 spesies dan sekarang anggrek hibrida di seluruh dunia mencapai 80.000
(Sugapriya, 2009). Indonesia memiliki sekitar 5.000 spesies anggrek (Yusnita, 2010).
Negara Indonesia termasuk salah satu negara terkaya dalam koleksi spesies anggrek. Salah satu anggrek yang terkenal di Indonesia adalah anggrek
Dendrobium. Genus inilah yang paling banyak diminati konsumen, paling banyak
Dendrobium berasal dari kata dendros yang artinya pohon dan bios yang artinya
hidup, sehingga anggrek Dendrobium tanaman yang hidup menempel di batang atau ranting pohon (Rentoul, 2003).
2.2 Klasifikasi Tanaman Anggrek Dendrobium sp.
Menurut Dressler dan Dodson (2000) yang dikutip dalam Widiastoety et al, (2010), sistematika tanaman anggrek Dendrobium yaitu:
Kingdom : Plantae
Divisi : Spermathophyta Sub-divisi : Angiospermae Ordo : Orchidales
Kelas : Monocotyledonae Famili : Orchidaceae Sub-famili : Epidendroideae
Tribes (suku) : Epidendrae dendrobieae Genus : Dendrobium
Spesies : Dendrobium sp.
2.3 Karakteristik Tanaman Anggrek Dendrobium sp.
Berdasarkan tempat tumbuhnya anggrek yang tergolong epifit tumbuh secara menempel pada tumbuhan lain (Watthana dan Pedersen, 2008), tetapi tidak merugikan tanaman sebagai tempat tumbuhnya, contohnya berbagai spesies Dendrobium. Akar anggrek yang habitatnya epifit memiliki kebiasaan yang
berbeda-beda berdasarkan genera dan spesiesnya dan memiliki karakteristik yang khas dengan adanya lapisan velamen (Arditti, 1992). Anggrek epifit umumnya berakar lunak dan mudah patah, dengan ujung meruncing, licin dan sedikit lengket serta lapisan velamen yang bersifat spongy (berongga) (Gunawan, 2005).
Anggrek Dendrobium yang habitatnya epifit membutuhkan kisaran intensitas cahaya optimal 2.400 – 3.600 fc dengan kisaran suhu optimal 15,5 – 30 oC dan kisaran kelembaban 40 – 55% (Yusnita, 2010). Darmono (2004) menambahkan bahwa anggrek Dendrobium membutuhkan naungan dari cahaya matahari
sebanyak 55 – 65% dengan suhu siang antara 27 – 30 oC dan suhu malam 21 oC.
2.4 Morfologi Tanaman Anggrek Dendrobium sp.
Anggrek, merupakan tanaman herba tahunan yang mempunyai karakteristik unik (Gunawan, 2005). Bunga anggrek Dendrobium mempunyai ciri-ciri terdiri dari lima bagian utama yaitu sepal (kelopak bunga) dan petal (mahkota bunga), benang sari, putik dan ovari (bakal buah). Sepal pada anggrek tidak seperti bunga pada umumnya yang seperti daun berwarna hijau. Sepal anggrek berbentuk segitiga dengan letaknya simetris yang paling atas lebih besar dari dua bagian lain yang berada di samping (Hew dan Yong, 2008).
disebut dengan labellum atau bibir (lip) (Yusnita, 2010). Labellum membentuk semacam platform tempat hinggapnya serangga (Gunawan, 2005). Platform adalah gumpalan-gumpalan seperti massa sel (callus) yang mengandung protein, minyak, dan zat pewangi yang berfungsi untuk menarik serangga (Darmono, 2004). Stigma sendiri berada pada rongga di depan kolom, rostellum
menghasilkan kantung rapuh sebagai perekat, dan anter berisi empat pollinia (Kong et al., 2007)
Buah anggrek Dendrobium dikenal sebagai polong dimana polong tersebut adalah suatu terminal yang terdiri dari tiga carpel. Kapsul atau polong anggrek yang matang akan merobek dan terpisah berdasarkan klep-klep, dengan demikian akan melepaskan benihnya. Beberapa jenis anggrek klep memisah sepenuhnya pada pucuk kulminasi dan menyebar terpisah secara luas (Arditti, 1992).
Pada umumnya bentuk dan ukuran batang anggrek sangat beragam. Batang anggrek Dendrobium termasuk batang semu yang disebut dengan pseudobulbs dengan ukuran sangat besar yaitu lebih dari 2,5 meter dengan diameter 3 cm (Yusnita, 2010). Pseodobulbs adalah posisi pembesaran dari batang dimana semua daun dan bakal bunga muncu. Berdasarkan jumlah ruas (internode), batang semu anggrek diklasifikasikan menjadi dua, yaitu yang mempunyai banyak ruas (type homoblastic) dan yang mempunyai satu ruas (type heteroblastic). Anggrek spesies Dendrobium tergolong ke dalam batang semu type homoblastic (Hew dan Yong, 2008).
(Darmono, 2004). Anggrek Dendrobium digolongkan ke dalam anggrek dengan daun yang tebal yang susunan daun anggrek berhadap-hadapan atau berselang-seling (Yusnita, 2010).
Pada umumnya morfologi akar suatu jenis anggrek dipengaruhi habitatnya (Yusnita, 2010). Pada anggrek Dendrobium, akar terdapat pada batang semu dengan warna hijau atau hijau kemerahan pada ujungnya sedangkan pada bagian lain berwarna putih hingga abu-abu. Akar anggrek Dendrobium memiliki perbedaan velamen dengan yang tidak bervelamen. Bentuk sel pada velamen yaitu melintang secara radikal stabil berbentuk sekrup dengan pori-pori relatif kecil (Arditti, 1992).
2.5 Perbanyakan Anggrek Dendrobium sp.
Anggrek Dendrobium dapat diperbanyak secara vegetatif dan generatif. Perbanyakan secara vegetatif dapat dilakukan dengan menanam bagian batang, akar dan rhizom atau umbi pada tanaman itu sendiri. Perbanyakan vegetatif dapat dilakukan dengan cara splitting (pemisahan anakan), pemotongan anak tanaman yang muncul dari batang (stek), dan pemotongan anak tanaman yang keluar dari tangkai bunga atau disebut dengan keiki (Yusnita, 2010). Namun, perbanyakan secara vegetatif tidak menguntungkan karena membutuhkan waktu yang lama (Hew dan Yong, 2008).
Tanaman anggrek selain perbanyakan vegetatif dapat juga diperbanyak secara generatif yaitu melalui proses penyerbukan atau persilangan yang akan
akan bersifat heterozigot, sehingga benih yang dihasilkan memiliki sifat yang bervariasi. Buah anggrek yang masak memiliki biji dengan jumlah yang sangat banyak hingga jutaan jumlahnya. Namun, pada biji anggrek tidak memiliki kotiledon dan endosperm (cadangan makanan), sehingga, biji anggrek tidak dapat tumbuh pada lingkungan alami yang normal. Teknik kultur jaringan dapat
digunakan untuk menumbuh kembangkan benih anggrek Dendrobium (Yusnita, 2010).
2.6 Pembiakan In Vitro Anggrek Dendrobium sp.
Kultur jaringan tanaman merupakan teknik menumbuhkan bagian tanaman, baik berupa sel, jaringan, organ, dan protoplasma secara in vitro (Arditti dan Ernst, 1993). Kultur jaringan adalah menumbuh-kembangkan bagian tanaman misalnya sel, jaringan, dan organ pada media cultur yang aseptik dan bebas microorganisme secara in vitro (Yusnita, 2003).
setelah polinasi yaitu 65 hari sebesar 87,5% dan 60 hari setelah polinasi sebesar 69,5% (Widiastoety et al., 1998).
Faktor-faktor yang mempengaruhi keberhasilan perbanyakan tanaman dengan teknik kultur jaringan yaitu eksplan. Eksplan yang digunakan harus diambil dari induk pilihan dengan satu atau beberapa karakter unggul. Penggunaan eksplan yang semakin kecil ukurannya juga mempengaruhi keberhasilan perbanyakan tanaman. Pada eksplan dengan ukuran kecil tingkat keterbebasan dari
kontaminasi makin besar (Yusnita, 2010). Perbanyakan kultur jaringan
diusahakan menggunakan jaringan muda, karena jaringan tersebut lebih mudah berproliferasi dibandingkan jaringan yang tua (Pierik, 1997).
2.7 Media Kultur In Vitro Anggrek Dendrobium sp.
Faktor yang kedua dalam mempengaruhi keberhasilan perbanyakan tanaman dengan kultur jaringan yaitu media kultur berupa media dasar (Yusnita, 2010). Pertumbuhan tanaman akan berhasil dengan baik apabila media yang digunakan sesuai dengan kebutuhan eksplan untuk beregenerasi. Sumber karbohidrat terutama gula merupakan komponen yang selalu ada dalam media tumbuh. Gula putih yang digunakan sehari-hari dapat digunakan untuk mendukung pertumbuhan kultur (Gunawan, 1988).
ekplan anggrek Dendrobium berkisar 4,8 – 5,8 (Darmono, 2004). Agar-agar juga mampu memberikan ketersediaan air pada media agar terjaga kelembaban pada media kultur (Pierik, 1987).
Pertumbuhan tanaman tergantung pada pentingnya pH yang sesuai dalam
ketersediaannya nutrisi. Media dengan pH yang terlalu rendah atau tinggi saat di autoklaf, semua komponen terjadi proses hydrolyzed dan atau destroyed.
Hydrolyzed pada agar terjadi karena pelepasan komponen makro, yaitu sugars
D- dan L- galaktose dimana besifat toksik bagi tanaman secara umum, sehingga,
dalam penyesuaian pH harus dilakukan secara perlahan dan hati-hati. Penggunaan pH secara umum direkomendasikan antara 4,8 – 6.0 (Arditti dan Ernst, 1992).
Komposisi medium terdiri dari zat-zat anorganik dalam bentuk garam, sumber energi dalam bentuk gula seperti sukrosa, persenyawaan organik kompleks berupa bahan-bahan alami misalnya air kelapa, bahan pemadat berupa agar-agar, serta arang aktif (Darmono, 2004). Komponen media kultur yang lengkap yaitu air destilata (aquades) atau air bebas ion sebagai pelarut, hara makro berupa N, P, K, Ca, Mg, dan S dan hara mikro berupa Fe, Cu, Mn, Zn, Mo, dan Co, gula, vitamin, arang aktif, zat pengatur tumbuh dan bahan pemadat berupa agar-agar (Yusnita, 2003).
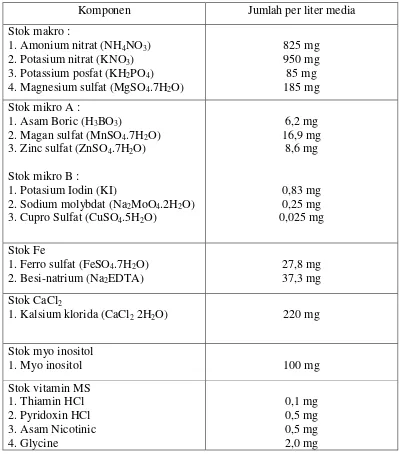
Tabel 1. Komposisi media yang telah di modifikasi ½ MS (1962). Komponen Jumlah per liter media Stok makro : 3. Cupro Sulfat (CuSO4.5H2O)
6,2 mg 2. Besi-natrium (Na2EDTA)
27,8 mg
2.8 Kondisi Lingkungan Kultur
Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan dan
Murashige mengasumsikan bahwa lama penyinaran pada kutur jaringan merupakan pencerminan dari kebutuhan periodisitas tanaman di lapang (Yusnita, 2003).
Panjang gelombang cahaya, intensitas cahaya, dan lama penyinaran
mempengaruhi pertumbuhan dan morfogenesis serta mempengaruhi total energi yang diterima tanaman secara in vitro (George, 2008). Cahaya yang dibutuhkan dapat digantikan dengan mengunakan lampu fluoresens dengan kuat penerangan antara 1.000 – 10.000 lux, yang fotoperiodisitasnya biasa diatur antara penyinaran terus menerus hingga 16 jam terang atau 8 jam gelap setiap harinya (Yusnita, 2010).
Faktor lingkungan mempengaruhi pertumbuhan tanaman yang dikulturkan seperti suhu dan kelembapan (Hew dan Yong, 2008). Suhu yang umum digunakan dalam pengaturan yaitu 26 ± 2 oC untuk berbagai jenis tanaman. Namun, suhu yang lebih rendah misalnya kurang dari 20 oC dapat menghambat pertumbuhan dan suhu yang terlalu tinggi dapat membuat tanaman merana (Yusnita, 2003).
Kondisi ruang kultur dapat berpengaruh langsung terhadap pertumbuhan dan proses diferensiasi tanaman dan secara tidak langsung dapat mempengaruhi petumbuhan pada generasi tanaman berikutnya yang dikulturkan secara in vitro (Yusnita, 2010). Alat yang dapat digunakan untuk mempertahankan kelembaban yaitu AC (air conditioner). Dengan menghidupkan AC (air conditioner),
Atmosphere sangat mempengaruhi pertumbuhan tanaman untuk dapat tumbuh
dimana terdapat jumlah N (78%), O2 (21%), CO2 (0,035%), dan gas lainnya (Hew dan Yong, 2008). Oksigen juga berfungsi di dalam proses respirasi jaringan tanaman yang dikulturkan. Dengan adanya enzim peroksidase dan oksidase dapat mengkatalis terjadinya proses oksidasi pada bagian jaringan yang terluka akibat pemotongan. Keadaan ini dapat mengakibatkan terganggunya pengambilan hara, terjadi pembengkakan sel, dan parahnya terjadi pelepasan plasma dari dinding sel (Darmono, 2004). Kultur tanaman yang tertutup di dalam botol kultur
menyebabkan keterbatasan dalam pertukaran CO2, sehingga terjadinya penurunan CO2 yang digunakan untuk fotosintesis (Hew dan Yong, 2008).
2.9 Arang Aktif
Arang aktif dapat digunakan sebagai bahan tambahan ke media pada berbagai tahapan perkembangan kultur. Penggunaan arang aktif yaitu menyerap
persenyawaan toksik dan fenolik yang dapat menghambat pertumbuhan tanaman (Gunawan, 1988). Senyawa fenol berwarna coklat atau hitam tersebut berasal dari hasil oksidasi. Usaha untuk menekan senyawa fenol yaitu menggunakan asam askorbat sebagai anti oksidan. Namun, cara ini kurang berhasil, cara lain yang digunakan yaitu dengan penambahan senyawa karbon aktif (Darmono, 2004).
Penggunaan arang aktif 3 g/l dapat meningkatkan pertumbuhan dan perkembangan kultur Cymbidium (Kaur dan Butani, 2012).
2.10 Bahan Adenda (Bahan Tambahan)
Media kultur jaringan sering ditambahkan persenyawaan yang kompleks, yang komposisinya dapat berbeda dari sumber yang satu dengan yang lainnya. Persenyawaan organik kompleks yang dimaksud salah satunya air kelapa
(Gunawan, 1998). Senyawa organik ini digunakan untuk merangsang pembelahan sel dan mendorong proses diferensiasi. Disamping itu, senyawa organik
merupakan sumber hara dan zat yang menstimulir pertumbuhan tanaman pada media kultur (Darmono, 2004).
Air kelapa juga dapat menstimulasi pertumbuhan embrio dalam kultur jaringan in vitro (Pierik, 1987). Kandungan zat-zat yang terdapat pada air kelapa mendorong
pembelahan sel dan proses deferensiasi (Arditti dan Ernst, 1992). Pemberian air kelapa (200 m1/1) ke media tumbuh berpengaruh positif meningkatkan
Tabel 2. Komponen bahan kimia yang terkandung pada air kelapa. Bahan kimia Komponen bahan kima
Kandungan nitrogen Ammonium, etanol-amin, dihidroksi, fenilalanin Asam amino Aspartat, glutamate, serin, aspargin, glisin,
threonin, β-alanin, histidin, arginin, lisin, valin, metionin, tirosin, prolin, homo-serin, fenilalanin, hidroksi prolin.
Gula Sukrosa, glukosa, fruktosa, manitol Gula alkohol Surbitol, mioinositol, skiloinositol.
Vitamin Asam nikotinat, asam pantotenat, biotin, riboflavin, asam folt, tiamin, piridoksin, asam askorbat.
Substansi pertumbuhan Auksin, giberelin, zeatin, 1,3-dipenil urea, zeatin glukosida, zeatin ribosida, promotor pertumbuhan, sitokinin.
Sumber: George (1996)
Air kelapa dalam media kultur terbukti efektif untuk meningkatkan pengembagan kutur, karena memiliki spectrum yang luas mengenai faktor pertumbuhan dan telah berhasil digunakan dalam produksi anggrek (Pyati et al., 2002 yang dikutip dalam Baque et al., 2011). Air kelapa yang ditambahkan ke dalam medium berefek menguntungkan pada perkecambahan benih anggrek langka seperti Rhynchostylis retisa dan Vanda coerlea (Murdad et al., 2010).
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan hasil rekapitulasi data dan pembahasan yang telah dikemukakan, maka dapat disimpulkan sebagai berikut:
1. Penambahan arang aktif 2 g/l pada media ½ MS dapat meningkatkan tinggi tunas, panjang daun dan bobot basah tanaman, tetapi tidak berpengaruh terhadap panjang daun, dan jumlah daun anggrek Dendrobium sp.
2. Pemberian air kelapa pada media ½ MS dapat meningkatkan tinggi tunas, panjang daun, dan bobot eksplan, tetapi tidak berpengaruh terhadap jumlah daun dan panjang akar anggrek Dendrobium sp.
3. Pengaruh peningkatan konsentrasi antara 50 sampai 200 ml/l sama baiknya dalam meningkatkan pertumbuhan tanaman anggrek Dendrobium sp. pada media ½ MS.
4. Secara umum, tidak terdapat interaksi antara pemberian arang aktif dan air kelapa dalam mempengaruhi pertumbuhan tanaman anggrek
5.2 Saran
Berdasarkan hasil penelitian yang telah dilakukan, maka disarankan penggunaan air kelapa dengan konsentrasi 50 ml/l pada media ½ MS sudah baik dalam meningkatkan pertumbuhan tanaman anggrek Dendrobium sp. Sedangkan penambahan arang aktif 2 g/l disarankan tidak digunakan pada media
DAFTAR PUSTAKA
Arditti, J. 1992. Fundamentals of Orchid Biology. John Willey and So Inc. United States of America. 682 p.
Arditti, J. and R. Ernest. 1993. Mikcroproragation of Orchids. New York. John Wiley and Sons. 682 p.
Baque, Md. A., Y. K. Shin, T. Elshmari, E. J. Lee, and K. Y. Paek. 2011. Effect of light quality, sucrose and coconut water concentration on the
microporpagation of Calanthe hybrids (‘Bukduseong’ × ‘Hyesung’ and ‘Chunkwang’ × ‘Hyesung’). Australian Journal vol 5(10): 1247 – 1254 (2011). Australia.
BPS. 2010. Luas Panen, Produksi dan Produktivitas Tanaman Anggrek, 2009 – 2010. http://www.bps.go.id/tab_ sub/view.php?tabel =1&dafta r=1&id_subyek=55¬ab=10. Tanggal akses: 28 Oktober 2011.
BPS. 2010. Tanaman Hias Menurut Provinsi (Tangkai), 2009 2010.
http://www.bps.go.id/tab_sub/view.php?tabel=1&daftar=1&id_suby ek=55¬ab=12Produksi. Tanggal akses: 28 Oktober 2011.
BPS. 2010. Produksi Tanaman Hias di Indonesia. http://www.bps.go.id/tab _sub/viewphp?tabel=1&daftar=1&id_subyek=55¬ab=13. Tanggal akses 28 Oktober 2011.
Chen, W. H., Hong, H. C., 2007. Orchid Biotechnology. World Scientific. Sigapore. P. 258.
Cribb, P. 2008. The New Encyclopedia of Orchids.British library: Amerika. Darmono, W. D. 2004. Permasalahan Anggrek dan Solusinya. Penebar
Swadaya. Jakarta. 96 hlm.
Fadel, D., S. Kintzios, A. S. Economou., G. Moschopoulou., dan H. A.
George, E.F. 1996. Plant propagation by tissue culture in Practice, Part I and II (2nd edition). Ebgland: Exegeticc Limited.
George, E.F. 2008. Plant propagation by tissue culture. Handbook and directory of commercial laboratories. Exegetics Ltd., Basingstoke. England. 546 p.
Gunawan, L.W. 1988. Teknik Kultur In Vitro Tumbuhan. Laboratorium Kultur In Vitro Tumbuhan, Pusat Antar Universitas. Institut Pertanian Bogor. Bogor. 304 hlm.
Gunawan, L.W. 2005. Budidaya Anggrek. Penebar Swadaya. Jakarta. 91 hlm. Hew, S. C. and W. H. Yong. 2008. The physiology of tropical orchid in relation
to the industry, Second Edition. World Scientific. National Institute of Education Nanyang Technological University. Singapore. 370.p. Hartmann, H.T., D.E. Kester, F.T. Davies Jr., and R.L. Geneve. 2002. Plant
Propagation: Principles and Practices. Seventh Edition. Prentice-Hall. Englewood Cliffs, New Jersey. 880 p.
Indani, M. 2007. Pengaruh Pepton dan media dasar terhadap pertumbuhan protokorm anggrek Dendrobium hibrida in vitro. Tesis. Fakultas Pertanian. Universitas lampung. Lampung. 59 hlm.
Indrawati, W. 2008. Hibridisasi berbagai tetua anggrek Dendrobium optimasi pengecambahan biji serta aklimatisasi Planlet untuk menghasilkan hibrida Dendrobium baru. Tesis. Fakultas Pertanian. Universitas Lampung. Lampung. 48 hlm.
Kamemoto, H. Teresita D. A, And, Adelheid R. K., 2004. Breeding Denrobium orchid in Hawai. Universitas of Hawai’I Press. Honolulu. P. 166.
Kaur, S, and K. K. Bhutani. 2012. Organic growth supplement stimulants for in vitro multiplication of Cymbidium pendulum (Roxb.) Sw. Journal vol. 39, 2012, No. 1: 47–52. Plant Tissue Culture Laboratory, Department of Natural Products, National Institute of Pharmaceutical Education and Research, Mohali, India.
Kong, Q., S. Y. Yuang, And Gy. Vegvari. 2007. Micropropagation of an orchid Dendrobium strongylanthum Rchb. F. International Journal of Horticultural Science 2007 vol 13(1): 61 – 64. Corvinus Universitas of Budapest. Hungary.
Larassati, I. S. 20011. Pengaruh berbagai jenis pisang dan arang aktif terhadap pembesaran anggrek Dendrobioum sp. in vitro.Tesis. Fakultas Pertanian. Universitas Lampung. Lampung.
Paraphalaeonopsis serpentilingua from West Kalimantan. Journal vol. 2(2): 62 – 66. University of Tanjungpura (UNTAN), Pontianak, West Kalimantan, Indonesia.
Murashige, T. And F. Skoog. 1962. A revised medium for rapid growth and bioasays with Tobacco tissue culture. Physiol Plant. 15:473 – 497. Murdad, R., M. A. Latip, Z. A. Aziz, And R. Ripin. 2010.
Effects Of Carbon
Source And Potato Homogenate On In Vitro Growth And
Development Of Sabah’s Endangered Orchid:
Phalaenopsis Gigantea
. AsPac Journal Mol. Biol.
Biotechnol 2010 vol 18(1): 199
–
202. Ischool of Science
and Technology, University Malaysia Sabah. Kinabalu,
Sabah.
Nambiar, N. C. S. Tee and M. Mazahl. 2012. Effects of organic additives and different carbohydrate sources on proliferation of protocormlike bodies in Dendrobium Alya Pink. Journal vol 5(1) :10 – 18. Agric Journal 29 (1) : 40 - 47, 2008. Horticultural Research Station, Pechiparai. Tamil Nadu, India.
Ramadiana, S. 2009. Upaya mendapatkan tanaman anggrek Dendrobium unggul baru melalui persilangan, pengecambahan biji dan seleksi progeny serta perbanyakan klonal in vitro. Lembaga penelitian.
http://anggrekdendrobiumunilablogspot.com/2009/05/upaya-mendapatkan-tanaman-anggrek.html. Tanggal akses: 30 Oktober 2011.
Rentoul, J.N. 2003. Growing Orchids, Complete and Unbridged. Publishing solutions. Singapure.190 p.Dordrecht. P. 67-70.
Seswita, D. 2010. Penggunaan air kelapa sebagai zat pengatur tumbuh pada multiplikasi tunas temulawak (curcuma xanthorrhizaroxb.) In vitro. Jurnallittri vol. 16(4) 135 – 140. Balai Penelitian Tanaman Obat dan Aromatik. Bogor.
Sugapriya, 2009. Eavaluation of Dendrobium Orchid Under Greenhouse Condition. Thesis. Universitas of Agricultural Science Dharwad. Dharwad. 75 hlm.
Watthana, S dan H. Æ Pedersen. 2008. Phorophyte Diversity, Substrate Requirements and Fruit Set in Dendrobium scabrilingue Lindl. (Asparagales: Orchidaceae): Basic Observations for Re-introduction Experiments. The Natural History Journal 8(2): 135 – 142. Chulalongkorn University. Denmark.
Tawaro, S, P. Suraninpong, And S. Champrame. 2008. Germination and Regeneration of Cymbidium findlaysonianum Lindl.on a Medium Supplemented with Some Organic Sources. Walailak Journal Sci and Tech 2008; 5(2): 125 – 135. Walailak University. Thailand.
Widiastoety, D., S. Kartikaningrum, dan Purbadi. 2005. Pengaruh pH Media Terhadap Pertumbuhan Planlet Anggrek Dendrobium. Jurnal Hortikultura.15(1): 18-21.
Widiastoety, D, N. Solvia, And M. Soedarjo, 2010. Potensi Anggrek Dendrobium dalam Meningkatkan variasi dan Kualitas Anggrek Bunga Potong. Jurnal Litbang Pertanian vol. 29(3) 101 – 106. Balai Penelitian Tanaman Hias. Cianjur.
Yusnita. 2003. Kultur Jaringan Cara Memperbanyak Tanaman Secara Efisien. Agromedia Pustaka. Jakarta. 105 hlm.
III. BAHAN DAN METODE
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di laboratorium Kultur Jaringan Tanaman, Fakultas Pertanian, Universitas Lampung mulai bulan Oktober 2011 hingga Maret 2012.
3.2 Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini adalah protokorm anggrek Dendrobium yang telah dikecambahkan selama 2 – 3 bulan (Gambar 1).
Gambar 1: Ukuran protokorm sebagai bahan tanam yang digunakan
Tanaman tersebut berasal dari Laboratorium Kultur Jaringan Fakultas Pertanian
Untuk pembesaran ini, protrokorm disubkultur secara aseptik dengan menyendok 10 protokorm ke dalam botol kultur yang telah berisikan media.
.
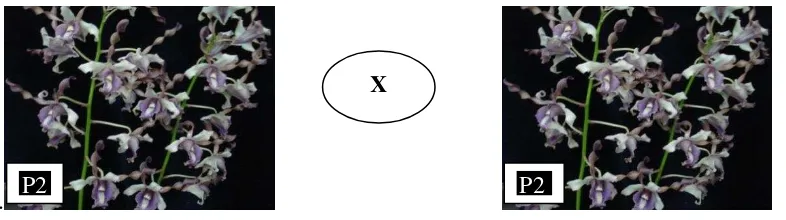
Gambar 2: Gambar persilangan tetua anggrek yang dijadikan bahan perbanyakan tanaman.
Bahan lain yang digunakan yaitu spirtus, aquades, agar-agar, air kelapa, garam-garam makro dan mikro ½ MS dan arang aktif. Alat-alat yang digunakan dalam penelitian ini yaitu laminar air flow cabinet (LAFC), pembakar bunsen,
timbangan elektrik, pH meter, autoklaf, gelas ukur, erlenmeyer, alat-alat diseksi, alat-alat gelas, magnetic stirer, kereta dorong, dan alat tulis. Sementara alat yang digunakan saat tahap pemeliharaan yaitu rak kultur dengan ruangan bersuhu 25o ± 2 oC dan lampu fluoresens (TL) berintensitas 1000 lux.
3.3 Metode Penelitian
Percobaan dilakukan menggunakan rancangan acak kelompok (RAL) dengan 8 perlakuan, masing-masing perlakuan memiliki 5 ulangan. Dalam 1 ulangan, setiap perlakuan terdiri dari 8 botol kultur, dan dalam 1 botol kultur terdapat 10 tanaman (protokorm).
X
Rancangan perlakuan yang digunakan adalah rancangan perlakuan faktorial 2 x 4. Faktor pertama adalah (tanpa arang aktif 2 g/l dan arang aktif 2 g/l). Faktor kedua penggunaan air kelapa (0, 50, 100, 200 ml/l). Homogenitas ragam antar perlakuan diuji dengan uji Barlett, sedangkan aditivitas diuji dengan uji Tukey. Bila kedua asumsi terpenuhi, maka analisis data dilanjutkan dengan sidikragam. Pemisahan nilai tengah dengan uji BNT pada taraf 5%.
3.4 Pelaksanaan Penelitian 3.4.1 Sterilisasi Alat
Alat-alat yang digunakan yaitu botol kultur, cawan petri, alat-alat diseksi seperti: gunting, pinset, spatula, gagang skapel, pisau bedah, dan alat-alat gelas lainnya. Peralatan tersebut dicuci terlebih dahulu dengan air yang mengalir dan diberi sabun lalu dibungkus dengan kertas dan dibalut dengan plastik setelah kering. Kemudian disterilisasi menggunakan autoklaf selama 30 menit pada tekanan 1,2 kg/cm2 dengan suhu 121 0C.
3.4.2 Media Perlakuan
Media dasar yang digunakan untuk perlakuan dalam penelitian ini adalah media ½ MS (Murashige dan Skoog, 1962). Media dasar tersebut ditambahkan dengan air kelapa dengan konsentrasi 0, 50, 100 dan 200 ml sesuai dengan perlakuan dan dikombinasikan dengan atau tanpa 2 g/l arang aktif.
(100 x = 10 ml/l), vitamin (100 x= 10 ml/l) dan myo inositol (10 x = 100 ml/l) tetap dengan formulasi utuh ke dalam akuades, kemudian ditambahkan air kelapa sebanyak 0, 50, 100, 200 ml/l air kelapa pada masing-masing perlakuan dan ditambahkan gula sebanyak 20 g/l, lalu ditera hingga 1 liter.
Setelah larutan media dibuat, diatur pH-nya hingga 5,8 dengan menambahkan KOH 1 N bila pH kurang dari 5,8 dan HCl 1 N bila pH lebih dari 5,8. Untuk media yang diberi 2 g/l arang aktif, waktu pemberiannya bersamaan saat menyampurkan agar-agar sebanyak 7 g/l, lalu media dimasak hingga mendidih selama 10 menit. Setelah mendidih, larutan media dimasukkan ke dalam botol-botol kultur sebanyak 20 ml/botol-botol, lalu tutup dengan plastik dan diikat dengan karet gelang. Botol-botol berisi media tersebut kemudian diautoklaf dengan tekanan 1,2 kg/cm2 dengan suhu 1210C selama 15 menit.
3.4.3 Bahan Tanam
Tanaman yang digunakan adalah protokorm anggrek Dendrobium yang berasal
dari pengecambahan protokorm dari persilangan P2 selfing atau tergolong anggrek jenis Spatulata (Kamemoto et al., 2004). Penanaman protokorm tersebut
dilakukan seperti metode subkultur, dengan cara mengambil dari media
sebelumnya secara aseptik di dalam laminar air flow cabinet lalu menanamnya pada media perlakuan. Protokorm yang digunakan dengan memiliki bobot awal 10 protokorm yaitu 0,023 g.
3.4.4 Pemeliharaan Kultur
1000 Lux. Kultur dipelihara selama 4 bulan tanpa di subkultur, lalu dilakukan pengamatan setiap bulanyanya dengan pengambilan gambar menggunakan kamera digital terhadap tanaman pada masing-masing perlakuan.
3.4.5 Pengamatan
Pengamatan dilakukan pada kultur berumur empat bulan atau sekitar 16 minggu setelah tanam dan sudah dikeluarkan dari botol kultur.
Variable yang diamati yaitu:
1. Tinggi tanaman
Tinggi tanaman diukur dari pangkal daun tanaman sampai ujung daun terpanjang dengan menggunakan mistar lalu dirata-rata dalam satuan senti meter (cm).
2. Jumlah daun
Penghitungan jumlah daun dilakukan dengan menghitung jumlah daun tanaman yang membuka sempurna dalam satuan helai.
3. Panjang daun
Pengamatan panjang daun dilakukan dengan menghitung panjang daun tanaman anggrek Dendrobium sp. Penghitungan panjang akar dilakukan pada akhir pengamatan dalam satuan helai daun terpanjang.
4. Panjang akar
Pengukuran panjang akar dilakukan dengan mengukur tiga akar terpanjang dan dirata-ratakan.
5. Bobot basah
Pengukuran bobot basah tanaman dilakukan dengan cara menimbang tanaman tersebut dalam satuan gram (g).
6. Foto