UIN SYARIF HIDAYATULLAH JAKARTA
ANALISIS PROFIL PROTEIN DAN ASAM AMINO
SARANG BURUNG WALET PUTIH (Collocalia
fuciphago) DENGAN MENGGUNAKAN SDS-PAGE
DAN KCKT
SKRIPSI
METHAREZQI SUCI ARSIH
1110102000024
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
ANALISIS PROFIL PROTEIN DAN ASAM AMINO
SARANG BURUNG WALET PUTIH (Collocalia
fuciphago) DENGAN MENGGUNAKAN SDS-PAGE
DAN KCKT
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
METHAREZQI SUCI ARSIH
1110102000024
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi UIN Syarif Hidayatullah Jakarta ABSTRAK
Nama : Metharezqi Suci Arsih Program Studi : Farmasi
Judul : Analisis Profil Protein dan Asam Amino Sarang Walet Putih (Collocalia fuciphago) dengan Menggunakan SDS-PAGE dan KCKT
Sarang burung walet terbuat dari saliva burung walet jantan (Collocalia fuciphago) sering dikonsumsi sebagai makanan kesehatan karena memiliki efek yang baik terhadap kesehatan. Penelitian ini bertujuan untuk mengetahui kadar dan profil protein serta asam amino pada sarang burung walet putih. Analisis profil protein dengan SDS-PAGE menunjukkan bahwa terdapat enam pita protein dengan berat molekul masing-masing sebesar 96,6276 kDa, 67,0907 kDa, 48,5096 kDa, 10,8217 kDa, 9,5826 kDa, dan 7,5137 kDa. Pengukuran kadar protein dengan metode semi-mikro Kjeldahl menghasilkan kandungan protein sebesar 50,176%. Sedangkan untuk analisis asam amino dengan KCKT menunjukkan terdapat 16 asam amino yang terdiri dari sembilan jenis asam amino esensial dan tujuh jenis asam amino nonesensial dengan kandungan total sebesar 40,310%. Kadar sembilan asam amino esensial yaitu histidin 1,718%, arginin 3,037%, treonin 2,810%, valin 3,677%, metionin 0,426%, lisin 2,121%, isoleusin 1,562%, leusin 3,245%, dan fenilalanin 2,987%. Sedangkan kadar tujuh asam amino non esensial yaitu asam aspartat 4,140%, serin 2,944%, asam glutamat 3,276%, glisin 1,799%, alanin 1,718%, prolin 3,330%, dan tirosin 2,044%
vii UIN Syarif Hidayatullah Jakarta ABSTRACT
Name : Metharezqi Suci Arsih Program Study : Pharmacy
Judul : Analysis of Protein Profile and Amino Acid of White Edible Bird’s Nest (Collocalia fuciphago) Using SDS-PAGE and HPLC
Edible Bird’s Nest which made of male swiftlets’saliva (Collocalia fuciphago) is widely consumed as a health food due to its good effects for human health. The aim of this research was to determine profile and concentration of protein and amino acids on white edible bird’s nest. Analysis of protein profile used SDS-PAGE indicated six molecular weight respectively 96,6276 kDa, 67,0907 kDa, 48,5096 kDa, 10,8217 kDa, 9,5826 kDa, and 7,5137 kDa. Measurement of protein concentration using semi-mikro Kjeldahl method has been showed protein concentration by 50,176%. As for amino acids, white edible bird’s nest (Collocalia fuciphago) were analyzed using HPLC. The results indicated white edible bird’s nest has 16 amino acids with total concentration 40,310%. There were nine essential amino acids, they are histidine 1,718%, arginine 3,037%, threonine 2,810%, valine 3,677%, methionine 0,426%, lysin 2,121%, isoleucine 1,562%, leucine 3,245%, phenylalanine 2,987%, and seven non essential amino acids, aspartic acid 4,140%, serine 2,944%, glutamic acid 3,276%, glycine 1,799%, alanine 1,718%, proline 3,330%, and tyrosine 2,044%.
viii UIN Syarif Hidayatullah Jakarta KATA PENGANTAR
Alhamdulillahirabbil`alamiin, segala puji dan syukur kepada Allah SWT yang selalu melimpahkan rahmat dan ridho-Nya kepada penulis sehingga penulis dapat menyelesaikan penyusunan skripsi ini. Penulisan skripsi yang berjudul “Analisis Profil Protein dan Asam Amino Sarang Burung Walet Putih (Collocalia fuciphago) dengan Menggunakan SDS-PAGE dan KCKT” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa, keberhasilan pengerjaan penelitian, penulisan dan penyusunan skripsi ini tidak lepas dari bantuan dan bimbingan serta do’a dari berbagai pihak, dari masa perkuliahan hingga skripsi ini selesai. Oleh karena itu, penulis mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada: 1. Lina Elfita, M.Si., Apt dan Prof. Dr. Atiek Soemiati, M.S., Apt., selaku dosen
pembimbing yang telah banyak memberikan bimbingan, saran, waktu, tenaga dan dukungan dalam penelitian ini.
2. Prof. Dr. (hc) dr. M. K. Tadjudin, Sp.And., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Drs. Umar Mansur, M.Sc., Apt., selaku Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta.
4. Ofa Suzanti Betha, M.Si., Apt., selaku pembimbing akademik.
5. Seluruh dosen Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah atas ilmu pengetahuan dan motivasi yang diberikan kepada penulis selama masa perkuliahan.
ix UIN Syarif Hidayatullah Jakarta 7. Kakak-kakak laboran Pusat Laboratorium Terpadu dan laboratorium FKIK UIN Syarif Hidayatullah Jakarta, Kak Prita, Kak Pipit, Kak Eris, Kak Rani, dan Kak Anis atas kerjasamanya selama penelitian berlangsung.
8. Kedua orang tua tercinta, ayahanda Yusuf Jumarhanoka Karnon dan ibunda Dra. Nuryati yang selalu memberikan cinta, kasih sayang, dukungan baik moril dan materil, serta do’a yang tiada henti. Terima kasih bapak dan ibu. Tiada apapun di dunia ini yang dapat membalas semua kebaikan yang telah kalian berikan, semoga Allah SWT membalas semua kebaikan dengan surga-Nya.
9. Kakak-kakak dan adik tersayang, Metharum Nur Arsih, S.E., Kemas Muhammad Fahreza, S.T., Methasona Dian Arsih, Yudhi Eka Putra, ST., dan Methaswari Fadillah Arsih yang selalu memberikan do’a dan dukungan sehingga penelitian ini berjalan dengan lancar.
10. Keponakan-keponakan tersayang, Fahmi Kurnia Azzuhri, Nyimas Jasmine Khairunnisa, dan Sekar Ayu Larasati.
11. Sahabat-sahabat penulis, Delvina Ginting, S.Far., Adina Siti Maryam Talogo, Liana Puspita Cahyaningrum, Mayta Ravika, Syarifatul Mufidah, dan Diah Azizah yang selalu saling memberikan bantuan, dukungan dan semangat selama masa perkuliahan dan selama menyelesaikan penelitian masing-masing.
12. Sahabat dari SMA hingga sekarang, Yeyen Armelianti, A.Md., yang selalu berkenan mendengarkan segala keluh kesah dan memberikan doa dan dukungan pada penulis.
13. Teman-teman seperjuangan Farmasi FKIK UIN Syarif Hidayatullah Jakarta angkatan 2010, atas kebersamaan selama empat tahun ini. Semoga silaturahim tetap terjalin dan semoga rahmat Allah SWT selalu menyertai langkah kita.
14. Kakak-kakak dan adik-adik kelas Farmasi FKIK UIN Syarif Hidayatullah Jakarta, yang telah banyak memberikan bantuan kepada penulis.
x UIN Syarif Hidayatullah Jakarta 16. Serta pihak lain yang tidak dapat penulis sebutkan satu persatu, yang telah
memberikan dukungan hingga skripsi ini selesai.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan dan semoga Allah SWT membalas semua kebaikan yang telah diberikan kepada penulis. Aamiin Ya Rabbal Alamin.
Ciputat, Juli 2014
xi UIN Syarif Hidayatullah Jakarta HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS
AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Metharezqi Suci Arsih NIM : 1110102000024 Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan Jenis Karya : Skripsi
demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya, dengan judul:
ANALISIS PROFIL PROTEIN DAN ASAM AMINO SARANG BURUNG WALET PUTIH (Collocalia fuciphago) DENGAN MENGGUNAKAN
SDS-PAGE DAN KCKT
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di: Ciputat Pada tanggal: 11 Juli 2014
Yang menyatakan,
xii UIN Syarif Hidayatullah Jakarta DAFTAR ISI
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... xi
DAFTAR ISI ... xii
2.1.1 Klasifikasi Burung Walet Putih (Collocalia fuciphago) ... 5
2.2.5 Sodium Dodecyl Sulfate-Polyacrilamide Gel Electrophoresis (SDS-PAGE) ... 15
xiii UIN Syarif Hidayatullah Jakarta 3.3.4 Analisis Profil Protein dengan Menggunakan
SDS-PAGE ... 20
3.3.5 Pengukuran Kadar Protein dengan Metode Semi-mikro Kjeldahl ... 22
3.3.6 Analisis Asam Amino dengan Menggunakan KCKT ... 22
BAB IV HASIL DAN PEMBAHASAN ... 24
4.1 Determinasi Sampel ... 24
4.2 Ekstraksi Protein pada Sampel ... 24
4.3 Analisis Profil Protein dengan Menggunakan SDS-PAGE ... 24
4.4 Pengukuran Kadar Protein dengan Metode Semi-mikro Kjeldahl ... 27
4.5 Analisis Asam Amino dengan Menggunakan KCKT ... 30
BAB V KESIMPULAN DAN SARAN ... 34
5.1 Kesimpulan ... 34
5.2 Saran ... 34
xiv UIN Syarif Hidayatullah Jakarta DAFTAR GAMBAR
Halaman
Gambar 2.1 Morfologi Sarang Walet ... 7
Gambar 2.2 Struktur Primer Protein ... 10
Gambar 2.3 Struktur Sekunder Protein ... 10
Gambar 2.4 Struktur Protein ... 11
Gambar 2.5 Pemisahan Protein dengan SDS-PAGE ... 15
Gambar 2.6 Struktur Kimia SDS ... 15
Gambar 2.7 Pemutusan Ikatan Disulfida Protein oleh SDS ... 16
Gambar 2.8 Struktur Umum Asam Amino ... 16
Gambar 2.9 Skema Alat KCKT ... 18
xv UIN Syarif Hidayatullah Jakarta DAFTAR TABEL
Halaman Tabel 2.1 Kandungan Kimia Sarang Walet Putih, Sarang Walet
Merah, Rumput Laut Merah dan Jamur Tremella ... 7 Tabel 2.2 Kandungan Asam Amino pada Sarang Burung Walet
Rumah dan Sarang Burung Walet Gua ... 8 Tabel 2.3 Faktor Konversi untuk Mengkonversi Persen Nitrogen
xvi UIN Syarif Hidayatullah Jakarta DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Penelitian ... 41
Lampiran 2. Hasil Determinasi Sarang Burung Walet Putih ... 42
Lampiran 3. Reagent SDS-PAGE ... 43
Lampiran 4. Data Terkait Analisis Profil Protein dengan SDS-PAGE ... 45
Lampiran 5. Data Pengukuran Kadar Protein Sarang Burung Walet Putih (Collocalia fuciphago) dengan Metode Semi-mikro Kjeldahl ... 47
Lampiran 6. Kromatogram Standar Asam Amino ... 48
Lampiran 7. Kromatogram Asam Amino Sampel ... 49
Lampiran 8. Perhitungan Kandungan Asam Amino ... 51
xvii UIN Syarif Hidayatullah Jakarta DAFTAR ISTILAH
AABA : Alpha Amino Butyric Acid
AOAC : Association of Analytical Communities
APS : Amonium Per Sulfat
KCKT : Kromatografi Cair Kinerja Tinggi HAD : Hexadecenoic Acid
HPLC : High Performance Liquid Chromatography
ODA : 9-Octadecenoic Acid
SDS : Sodium Dodecyl Sulfate
SDS-PAGE : Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoresis
1 UIN Syarif Hidayatullah Jakarta BAB I
PENDAHULUAN
1.1 Latar Belakang
Sarang burung walet terbuat dari saliva burung walet jantan (Collocalia fuciphago) yang disekresikan oleh kelenjar ludah burung walet (Liu et al., 2012). Sarang burung walet sering dikonsumsi sebagai makanan kesehatan karena memiliki efek yang baik terhadap kesehatan manusia dan telah dianggap sebagai salah satu makanan yang paling berharga oleh bangsa Cina selama ribuan tahun. Konsumsi sarang burung walet oleh manusia merupakan simbol kekayaan, kekuasaan, dan martabat, serta digunakan dalam pengobatan tradisional Cina pada Dinasti Tang pada tahun 618-907 M dan Dinasti Sung pada tahun 960-1279 M (Marcone, 2005). Mayoritas sarang burung walet yang dapat dimakan berasal dari dua spesies, yaitu burung walet putih (Aerodramus fuciphagus
atau Collocalia fuciphago) dan burung walet hitam (Aerodramus maximus
atau Collocalia maximus), yang habitatnya di sekitar Kepulauan Nicobar di Samudera Hindia hingga di gua pinggir laut di daerah pesisir Thailand, Vietnam, Indonesia, Kalimantan dan Kepulauan Palawan di Filipina (Marcone, 2005).
2
UIN Syarif Hidayatullah Jakarta kandungannya. Perbedaan kandungan nutrisi dapat dipengaruhi oleh jenis makanan yang dimakan oleh burung walet (Marcone, 2005).
Sarang burung walet dibangun hampir secara eksklusif oleh burung walet jantan seberat 7-20 g selama sekitar 35 hari. Bahan pembangun sarang burung walet terdiri dari zat lengket yang terdapat pada air liur yang disekresikan dari dua kelenjar ludah sublingual burung walet (Goh et al., 2001). Sarang burung walet yang berbentuk setengah mangkuk, dengan berat 1-2 kali berat tubuh burung walet, biasanya melekat pada dinding cekung pedalaman atau gua pantai (Koon & Cranbook, 2002). Sarang burung walet dapat diambil atau dipanen jika keadaannya sudah memungkinkan untuk dipetik. Hal ini dikaitkan dengan beberapa faktor, yaitu musim, keadaan walet, dan kualitas sarang burung walet. Untuk melakukan pemetikan, cara dan ketentuannya perlu diketahui agar hasil yang diperoleh bisa memenuhi mutu sarang burung walet yang baik (Panduan Lengkap Walet, 2011).
Penelitian-penelitian terdahulu menunjukkan bahwa sarang burung walet memiliki beberapa manfaat, antara lain memiliki efek menghambat hemaglutinasi terhadap virus influenza (Howe, 1961; Howe, Lee, & Rose, 1960) dan sebagai faktor pertumbuhan epidermal burung (Kong et al., 1987; Ng, Chan, & Kong, 1986). Selain itu, Matsukawa (2011) menemukan bahwa pemberian oral ekstrak sarang burung walet meningkatkan kekuatan tulang dan kadar kalsium. Berdasarkan hasil tersebut, protein diperkirakan sebagai faktor kunci, karena protein merupakan zat utama yang berperan dalam aktivitas kehidupan (Liu et al., 2012). Adapun nutrisi yang terkandung dalam sarang burung walet berupa protein yang berkisar 59,8-65,4%, karbohidrat 8,5-65,4%, dan lemak 0,01-0,07%. Sedangkan kadar air dan abu yang dimiliki sarang burung walet sebesar 5,58-13,88% (Hamzah et al., 2013).
3
UIN Syarif Hidayatullah Jakarta yang telah diteliti oleh peneliti terdahulu dan tersebarnya budidaya walet di berbagai daerah di Indonesia telah mendorong peneliti untuk melakukan penelitian lebih lanjut terhadap profil protein dan asam amino sarang burung walet yang diperoleh dari salah satu daerah di Indonesia, yaitu daerah Kediri di Jawa Timur. Penelitian ini merupakan penelitian awal di Indonesia yang nantinya akan dilanjutkan dengan sampel sarang burung walet yang berasal dari sumber yang berbeda di Indonesia untuk melihat pengaruh letak geografi terhadap profil protein dan asam amino sarang burung walet.
Pada penelitian ini, akan dilakukan analisis profil protein dan asam amino dari sarang burung walet dengan menggunakan sodium dodecyl sulfate polyacrilamide gel electrophoresis (SDS-PAGE) dan kromatografi cair kinerja tinggi (KCKT). Sarang burung walet yang digunakan sebagai sampel adalah sarang walet putih berasal dari air liur burung walet putih (Collocalia fuciphago) yang diperoleh dari daerah Kediri, Jawa Timur. Analisis profil protein dilakukan dengan menggunakan SDS-PAGE. Identifikasi dengan SDS-PAGE merupakan teknik elektroforesis yang menggunakan gel poliakrilamida yang bertujuan untuk memisahkan protein dalam sampel berdasarkan berat molekul (Janson et al., 1998). SDS-PAGE umum digunakan untuk analisis profil protein. Selanjutnya penetapan kadar protein dari sarang burung walet dilakukan dengan metode semi-mikro Kjeldahl. Semi-mikro Kjeldahl merupakan metode yang umum digunakan untuk menentukan kadar protein pada pangan dalam jumlah yang besar. Untuk analisis asam amino dilakukan dengan menggunakan KCKT, dimana KCKT umum digunakan untuk analisis profil dan kadar asam amino.
4
UIN Syarif Hidayatullah Jakarta 1.2 Perumusan Masalah
Dalam penelitian ini, yang menjadi perumusan masalah adalah:
1. Bagaimana profil protein pada sarang burung walet yang dianalisis menggunakan SDS-PAGE?
2. Berapa kadar protein yang terkandung dalam sarang burung walet dengan metode semi-mikro Kjeldahl?
3. Bagaimana profil dan kadar asam amino pada sarang burung walet yang dianalisis menggunakan metode KCKT?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui profil protein dan asam amino yang terkandung dalam sarang burung walet putih asal Kediri, Jawa Timur, Indonesia.
1.4 Manfaat Penelitian
5 UIN Syarif Hidayatullah Jakarta BAB II
TINJAUAN PUSTAKA
2.1 Sarang Burung Walet
Sarang burung walet terbuat dari saliva burung walet yang disekresikan oleh kelenjar ludah burung walet (Liu et al., 2012). Sebagai bahan makanan, sarang burung walet mengandung gizi yang lengkap dengan nilai yang tinggi. Sarang burung walet mengandung kalori, protein, lemak, karbohidrat, kalsium, fosfor, vitamin, dan mineral. Asam amino yang dikandung dalam sarang walet juga lengkap, mulai dari asam amino esensial, asam amino semiesensial, dan asam amino nonesensial. Sarang walet juga berkhasiat sebagai obat. Zat yang terkandung dalam sarang walet antara lain ODA (9-octadecenoic acid) dan HAD (hexadecenoic acid). Zat ini digunakan tubuh untuk meningkatkan stamina (Panduan Lengkap Walet, 2011).
2.1.1 Klasifikasi Burung Walet Putih (Collocalia fuciphago)
Berdasarkan ilmu taksonomi, klasifikasi burung walet penghasil sarang walet putih adalah sebagai berikut (Panduan Lengkap Walet, 2011):
Kingdom : Animal Filum : Chordata Subfilum : Vertebrata Kelas : Aves
Ordo : Apodiformes Famili : Apodidae Genus : Aerodramus
6
UIN Syarif Hidayatullah Jakarta 2.1.2 Morfologi Sarang Burung Walet
Sarang burung walet terdiri dari beberapa bagian, yaitu kaki sarang, fondasi sarang, dinding sarang, bibir sarang, dan dasar sarang. Kaki sarang terletak di kedua ujung sarang walet. Jarak antarkaki berkisar 6-10 cm, tergantung ukuran sarang. Kaki sarang dibangun dari air liur yang bertumpuk-tumpuk dan tidak beraturan karena berfungsi sebagai paku yang menempel pada papan sirip dan tempat sarang menggantung. Kedua kaki sarang dihubungkan oleh fondasi sarang. Fondasi sarang juga menempel pada papan sirip. Fungsi fondasi adalah untuk mendukung kaki dalam memperkuat sarang (Panduan Lengkap Walet, 2011).
Dasar sarang merupakan bagian alas sarang sebagai tempat untuk bertelur, mengeram, dan kasur bagi anak walet (piyik). Pada bagian ini, terdapat rongga yang suhunya lebih hangat dan berguna saat pengeraman. Akan tetapi, bagian rongga ini sering dijadikan oleh kutu busuk atau kepinding untuk berkembang biak. Di dasar sarang ini pula, banyak pecahan cangkang telur yang terselip (Panduan Lengkap Walet, 2011).
Dinding sarang berbentuk lekukan, seperti mangkuk dan berfungsi untuk menampung telur atau piyik. Ukuran dinding sarang bervariasi, berkisar 2-5 cm dengan ketebalan 1-2 mm. Dinding sarang dibangun dari serat-serat air liur yang sejajar dan melekat satu sama lain. Oleh karena serat yang sejajar dan jalinan serat padat dan kuat maka dinding sarang mampu menampung telur atau piyik (Panduan Lengkap Walet, 2011).
7
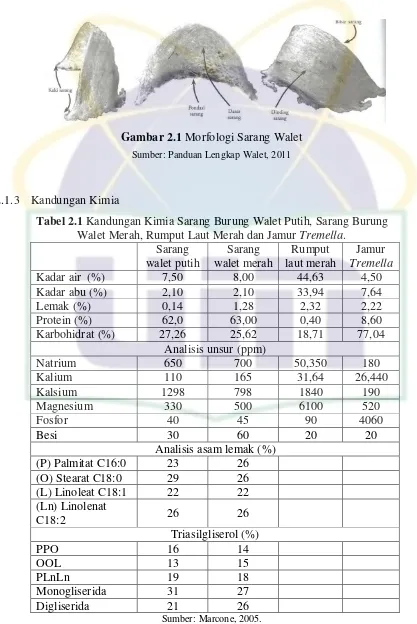
UIN Syarif Hidayatullah Jakarta Gambar 2.1 Morfologi Sarang Walet
Sumber: Panduan Lengkap Walet, 2011
2.1.3 Kandungan Kimia
Tabel 2.1 Kandungan Kimia Sarang Burung Walet Putih, Sarang Burung Walet Merah, Rumput Laut Merah dan Jamur Tremella.
8
UIN Syarif Hidayatullah Jakarta Tabel 2.2 Kandungan Asam Amino pada Sarang Burung Walet Rumah
dan Sarang Burung Walet Gua
Asam amino
Mean dan standar deviasi (% w/w) Sarang burung walet
Sarang burung walet merupakan makanan berkhasiat yang dihormati oleh bangsa Cina yang telah terbukti memiliki nutrisi yang baik (protein larut air, karbohidrat, besi, garam inorganik, dan serat) dan manfaat dari sisi medis (anti-aging, antikanker, dan meningkatkan imunitas. Sarang walet dari genus Aerodramus mengandung lemak (0,14-1,28%), abu (2,1%), karbohidrat (25,62-27,26%), dan protein (62-63%) (Marcone, 2005).
Salah satu glikonutrien utama pada sarang walet adalah sialic acid
(9%) (Colombo et al., 2003; Kathan dan Weeks, 1969). Sialic acid
9
UIN Syarif Hidayatullah Jakarta berbahaya. Dalam hal kandungan nutrisi, komponen utama dari sarang burung walet meliputi protein yang larut dalam air, karbohidrat, elemen seperti kalsium, fosfor, besi, natrium, dan kalium dan asam amino yang memainkan peran penting dalam meningkatkan kekuatan tubuh. Sarang burung walet mengandung jumlah tertinggi dari kalsium dan natrium dibandingkan dengan mineral lain. Telah dilaporkan bahwa jumlah kandungan kalsium dalam olahan sarang burung walet berkisar antara 503,6 sampai 2071,3 mg/g dan natrium konten berkisar antara 39,8 sampai 509,6 mg/g yang lebih tinggi dari mineral lainnya (Norhayati et al., 2010).
Selain manfaat di atas, sarang burung walet terbukti dapat menghambat hemaglutinasi terhadap virus influenza (Howe, 1961; Howe, Lee, & Rose, 1960) dan sebagai faktor pertumbuhan epidermal burung (Kong et al., 1987; Ng, Chan & Kong, 1986). Selain itu, Matsukawa (2011) menemukan bahwa pemberian oral ekstrak sarang burung walet meningkatkan kekuatan tulang dan kadar kalsium tulang.
2.2 Protein
Protein adalah molekul makro yang mempunyai berat molekul antara lima ribu hingga beberapa juta. Protein terdiri atas rantai-rantai asam amino yang terikat satu sama lain dalam ikatan peptida. Asam amino yang terdiri atas unsur-unsur karbon, hidrogen, oksigen, dan nitrogen; beberapa asam amino disamping itu mengandung unsur-unsur fosfor, besi, iodium, dan cobalt. Unsur nitrogen adalah unsur utama protein, karena terdapat di dalam semua protein akan tetapi tidak terdapat di dalam karbohidrat dan lemak. Unsur nitrogen merupakan 16% dari berat protein. Molekul protein lebih kompleks daripada karbohidrat dan lemak dalam hal berat molekul dan keanekaragaman unit-unit asam amino yang membentuknya (Almatsier, 1989).
2.2.1 Struktur Protein
10
UIN Syarif Hidayatullah Jakarta dirangkaikan melalui reaksi gugusan karboksil asam amino yang satu dengan gugusan amino dari asam amino yang lain, sehingga terjadi ikatan yang disebut ikatan peptida. Bila tiga molekul asam amino berikatan, disebut tripeptida dan bila lebih banyak lagi disebut polipeptida. Polipeptida yang hanya terdiri dari sejumlah beberapa molekul asam amino disebut oligopeptida. Molekul protein adalah suatu polipeptida, dimana sejumlah besar asam-asam aminonya saling dipertautkan dengan ikatan peptida tersebut (Gaman, 1992).
Berdasarkan strukturnya, protein dibentuk oleh:
1. Struktur primer, dibentuk oleh ikatan peptida antar asam amino. Struktur ini mengacu pada jumlah, jenis, serta urutan asam amino yang membentuk rantai polipeptida.
Gambar 2.2 Struktur primer protein Sumber: Brown, 2002.
2. Struktur sekunder, dibentuk oleh ikatan hidrogen intramolekular yang terjadi di antara oksigen karbonil dan nitrogen amida pada perangkat peptida.
Gambar 2.3Struktur sekunder protein; (a) α helix; (b) β sheet
Sumber:Brown, 2002.
3. Struktur tersier, merupakan rangkaian molekular yang menggambarkan bentuk keseluruhan dari protein.
11
UIN Syarif Hidayatullah Jakarta 4. Struktur kuartener dibentuk oleh beberapa polipeptida yang berikatan
satu sama lain tidak secara kovalen (Bintang, 2010).
Gambar 2.4 Struktur protein; (a) struktur tersier; (b) struktur kuartener Sumber: Russel, 2010.
2.2.2 Fungsi Protein
Berdasarkan fungsi biologinya, protein dapat diklasifikasikan sebagai enzim (dehidrogenase, kinase), protein penyimpanan (feritin, mioglobin), protein pengatur (protein pengikat DNA, hormon peptida), protein struktural (kolagen, proteoglikan), protein pelindung (faktor pembekuan darah, imunoglobulin), protein pengangkut (hemoglobin, lipoprotein plasma), dan protein kontraktil/motil (aktin, tubulin) (Murray, 2003). Protein yang mempunyai fungsi sebagai media perambatan impuls saraf ini biasanya berbentuk reseptor; misalnya rodopsin, suatu protein yang bertindak sebagai reseptor penerima warna atau cahaya pada sel – sel mata (Winarno, 1997).
2.2.3 Pengukuran Kadar Protein
12
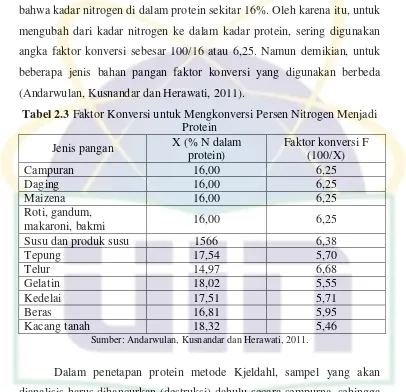
UIN Syarif Hidayatullah Jakarta bahwa kadar nitrogen di dalam protein sekitar 16%. Oleh karena itu, untuk mengubah dari kadar nitrogen ke dalam kadar protein, sering digunakan angka faktor konversi sebesar 100/16 atau 6,25. Namun demikian, untuk beberapa jenis bahan pangan faktor konversi yang digunakan berbeda (Andarwulan, Kusnandar dan Herawati, 2011).
Tabel 2.3 Faktor Konversi untuk Mengkonversi Persen Nitrogen Menjadi Protein
Sumber: Andarwulan, Kusnandar dan Herawati, 2011.
13
UIN Syarif Hidayatullah Jakarta (a) Tahap penghancuran (destruksi)
Tahap penghancuran (destruksi) dilakukan dengan menambahkan asam kuat, yaitu asam sulfat dan dilakukan proses pemanasan pada suhu sekitar 370⁰C. Tahap ini sangat penting karena akan membebaskan nitrogen dari sampel. Supaya proses penghancuran ini berjalan sempurna dan berjalan lebih cepat, maka sering ditambahkan seperti merkuri oksida (HgO). Dalam metode AOAC 988.05, campuran tembaga (Cu) dan titanium (Ti) dioksida juga telah digunakan dalam proses destruksi pada analisis protein. Untuk mempercepat proses destruksi ini, juga ditambahkan potasium sulfat yang berperan untuk meningkatkan titik didih asam sulfat. Selama proses destruksi ini, nitrogen akan bereaksi dengan asam sulfat menghasilkan amonium sulfat.
Reaksi yang terjadi selama proses destruksi adalah sebagai berikut: Pemanasan
N (contoh) + H2SO4 (NH4)2SO4 Katalis
(b) Netralisasi dan destilasi
Setelah proses destruksi selesai, larutan yang mengandung amonium sulfat diperlukan dengan penambahan alkali (NaOH) pekat untuk menetralkan asam sulfat. Dengan adanya larutan NaOH pekat ini, maka amonium sulfat akan dipecah menjadi gas amoniak. Dengan melalui proses destilasi, gas amoniak ini kemudian akan menguap ditangkap oleh asam borat (H3BO3).
(c) Titrasi
Dalam tahap titrasi, senyawa NH4H2BO3 dititrasi dengan menggunakan asam klorida encer (0,02 N), sehingga asam borat terlepas kembali dan terbentuk amonium klorida. Jumlah asam klorida yang digunakan untuk titrasi setara dengan jumlah gas NH3 yang dibebaskan dari proses titrasi. Reaksi yang terjadi selama proses titrasi adalah sebagai berikut (Andarwulan, Kusnandar dan Herawati, 2011):
14
F = faktor konversi (Sudarmadji, 1989)
2.2.4 Analisis Profil Protein
Pemisahan protein merupakan tahap yang harus dilakukan untuk mempelajari sifat dan fungsi protein. Protein dapat dipisahkan dari protein jenis lain atau dari molekul lain berdasarkan ukuran, kelarutan, muatan, dan afinitas ikatan (Nelson, 2004). Salah satu teknis yang digunakan untuk melihat profil protein dan menentukan bobot molekulnya menggunakan SDS-PAGE (Stryer, 1995).
Elektroforesis adalah suatu teknik pemisahan molekul selular berdasarkan ukurannya, dengan menggunakan medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Jika molekul yang bermuatan negatif dilewatkan melalui satu medium, misalnya gel agarosa, kemudian dialiri arus listrik dari satu kutub ke kutub yang berlawanan muatannya, maka molekul tersebut akan bergerak dari kutub negatif ke kutub positif. Kecepatan gerak molekul tersebut tergantung pada rasio muatan terhadap massanya, serta tergantung pula pada bentuk molekulnya (Yuwono, 2005).
15
UIN Syarif Hidayatullah Jakarta Gambar 2.5 Pemisahan Protein dengan SDS-PAGE
Sumber: Stryer, 1995.
2.2.5 Sodium Dodecyl Sulfate-Polyacrilamide Gel Electrophoresis (SDS-PAGE) Salah satu jenis elektroforesis yang digunakan secara luas pada saat ini adalah sodium dodecyl sulfate-polyacrilamide gel electrophoresis
(SDS-PAGE). Pemisahan protein dengan metode SDS-PAGE bertujuan untuk memisahkan protein dalam sampel berdasarkan berat molekul. Prinsip dasar SDS-PAGE adalah denaturasi protein oleh sodium dedosil sulfat yang dilanjutkan dengan pemisahan molekul berdasarkan berat molekulnya dengan metode elektroforesis yang menggunakan gel, dalam hal ini yang digunakan adalah poliakrilamid (Janson et al., 1998).
Gambar 2.6 Struktur Kimia SDS
Sumber:
http://chemistry.about.com/od/factsstructures/ig/Chemical-Structures---S/Sodium-Dodecyl-Sulfate.htm
16
UIN Syarif Hidayatullah Jakarta biasanya digunakan poliakrilamid dengan resolusi yang tinggi dan membutuhkan biaya yang lebih mahal serta preparasi yang lebih lama. SDS-PAGE dapat memisahkan protein dengan ukuran 5—200 kDa (Konservasi Biodiversitas Raja4, 2012).
Gambar 2.7 Pemutusan ikatan disulfida protein oleh SDS
Sumber:
http://www.bio-rad.com/en-id/applications-technologies/protein-electrophoresis-methods
2.3 Asam Amino
Asam amino merupakan unit dasar struktur protein. Suatu asam amino α terdiri dari gugus amino, gugus karboksil, atom H dan gugus R tertentu, yang semuanya terikat pada atom karbon α. Atom karbon ini
disebut α karena bersebelahan dengan gugus karboksil (asam). Gugus R menyatakan rantai samping (Stryer, 1995).
Gambar 2.8 Struktur umum asam amino Sumber: Nelson dan Cox, 2004.
17
UIN Syarif Hidayatullah Jakarta serin, treonin, tirosin, aspargin, glutamin, sistein dan glisin, (3) asam amino dengan gugus –R bermuatan positif, seperti lisin, arginin, histidin, dan (4) asam amino dengan gugus –R bermuatan negatif, seperti asam aspartat dan asam glutamat (Bodanszky, 1993; Sumarno et al., 2002).
2.3.1 Analisis Profil Asam Amino
Pemisahan kromatografi kolom klasik secara khas dilakukan dengan menggunakan kolom kaca yang dikemas bersama suatu penyangga kompresibel sehingga menghindarkan diperlukannya penggunaan tekanan tinggi. Pemisahan dengan cara ini menuntut kecepatan alir pelarut dan karenanya, kecepatan analisis, yang lebih tinggi. Ada dua pilihan untuk pemeriksaan analisis. Asam amino dapat direaksikan dengan reagen yang memudahkan deteksi dan penentuan kuantitas sebelum, atau sesudah KCKT. Deteksi pasca-kolom umumnya menggunakan ninhidrin, yang dengan asam amino akan membentuk warna ungu. Meskipun demikian, metode deteksi pasca-kolom ini sekarang diganti dengan pereaksi campuran asam-asam amino dengan reagen seperto 6-aminokuinolil-N-hidroksisuksinimidil karbamat (AQC) sebelum KCKT; reaksi ini akan membentuk derivat asam amino fluoresen yang menyerap sinar UV. Sensitivitas pendekatan pasca-kolom ini memungkinkan analisis material dengan jumlah pikomolar yaitu, umumnya 1-2 µg protein murni atau 0,2 µg peptida pendek (Rodwell, 2003).
2.3.2 Kromatografi Cair Kinerja Tinggi (KCKT)
18
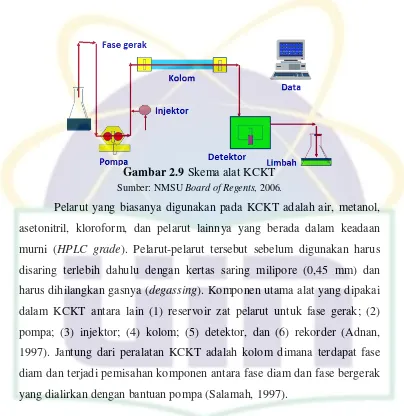
UIN Syarif Hidayatullah Jakarta Gambar 2.9 Skema alat KCKT
Sumber: NMSU Board of Regents, 2006.
19 UIN Syarif Hidayatullah Jakarta BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Pangan Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta, Laboratorium PT. Saraswanti Indo Genetech Bogor, Laboratorium Penelitian II, dan Laboratorium Kesehatan Lingkungan FKIK UIN Syarif Hidayatullah Jakarta yang berlangsung sejak bulan Maret hingga Juni 2014.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat Penelitian
Satu set alat elektroforesis (Bio-Rad), satu set perangkat KCKT (Waters tipe Breeze), alat destilasi lengkap dengan erlenmeyer berpenampung berukuran 250 mL, buret 50 mL, pemanas Kjeldahl lengkap yang dihubungkan dengan pengisap uap melalui aspirator, labu Kjeldahl berukuran 50 mL, freeze dry, mikropipet beserta tip, erlenmeyer, labu ukur, sentrifuge Eppendorf 5417R beserta tabungnya, waterbath ultrasonic
(Branson), peralatan gelas, pinset, spatula, syringe, batang pengaduk, vial, timbangan analitik (Wiggen Hauser), pipet volumetrik, pipet tetes.
3.2.2 Bahan Penelitian
20
UIN Syarif Hidayatullah Jakarta
Red (BCG+MR), indikator fenolftalein (PP), metanol teknis, larutan HCl 6N, internal standar AABA (alpha amino butyric acid), AccQ•Tag Reagen Kit dari Waters, reagen kit terdiri dari Waters AccQ-Tag. Fluor Borate Buffer, Waters AccQ•Tag Fluor Reagen serbuk (6-aminoquinolil-Nhidroksi-suksinimidil karbamat–AQC), Waters AccQ•Tag Fluor Reagen Diluen, dan Hidrolisat Asam Amino Standar dari Waters, asetonitril grade
HPLC, aquabides. dideterminasi di Herbarium Bogoriense, Puslit Biologi Bidang Zoologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong, Bogor, Jawa Barat.
3.3.3 Ekstraksi Protein pada Sampel (Liu et al., 2012)
Sampel yang telah dideterminasi, dibersihkan dari bulu burung walet yang menempel pada sampel dengan menggunakan pinset. Setelah sampel bersih, sampel dihaluskan dengan menggunakan lumpang dan alu. Sebanyak 1 gram sampel dilarutkan dengan 50 mL aquabides lalu disonikasi selama 30 menit dan disentrifugasi dengan kecepatan 10000 rpm selama 30 menit. Supernatan yang diperoleh dikeringkan dengan metode pengeringan freeze dry dan disimpan pada suhu -20⁰C (Liu et al, 2012).
3.3.4 Analisis Profil Protein dengan Menggunakan SDS-PAGE
Profil protein dianalisis menggunakan SDS-PAGE berdasarkan metode Laemmli dalam Coligan et al. (1995) dengan sistem buffer
21
UIN Syarif Hidayatullah Jakarta digunakan sebesar 12%. Gel poliakrilamid yang telah dibuat dengan komposisi tertentu (dapat dilihat pada lampiran 3), dicetak diantara dua buah lempeng kaca. Larutan separating gel yang telah dibuat, dimasukkan ke dalam cetakan gel dengan menggunakan mikropipet sampai batas tertentu, kemudian ditambahkan dengan aquades sampai penuh agar permukaan gel rata. Setelah gel mengering, aquades dibuang dan sisa air pada cetakan gel diserap dengan kertas saring. Larutan stacking gel yang telah dibuat, dimasukkan ke dalam cetakan. Permukaan gel dipasang sisir, lalu didiamkan sampai gel mengeras. Setelah gel keras, sisir dilepaskan dan cetakan gel dipindahkan ke perangkat elektroforesis kemudian running buffer dimasukkan ke dalam alat elektroforesis hingga gel terendam.
Ekstrak protein sarang burung walet putih yang telah disiapkan, dimasukkan ke dalam tabung Eppendorf dan ditambahkan dengan sample buffer dengan perbandingan 1:1, 1:2, dan 2:1. Ketiga tabung dipanaskan pada suhu 100⁰C selama 5 menit. Elektroforesis dilakukan dengan cara 5 µ l marker protein dimasukkan ke sumur pertama dan 10 µ L campuran ekstrak protein sarang walet dan sample buffer dengan perbandingan yang telah ditentukan, dimasukkan ke dalam sumur berikutnya yang telah dicetak pada gel poliakrilamid, kemudian alat elektroforesis dihubungkan ke power supply dengan tegangan 175 V hingga sampel mencapai bagian dasar gel.
22
UIN Syarif Hidayatullah Jakarta 3.3.5 Pengukuran Kadar Protein dengan Metode Semi-mikro Kjeldahl (SNI
01-2782-1998)
Sebelum sampel dianalisis, terlebih dahulu dilakukan standarisasi HCl. Standarisasi dilakukan dengan mentitrasi HCl dengan 10 mL natrium tetraborat 0,05 N. Pengukuran kadar protein dimulai dengan tahap destruksi. Sebanyak 0,5 gram sarang burung walet putih yang telah dibersihkan dan dihaluskan, dimasukkan ke dalam labu Kjeldahl, lalu ditambahkan 2 gram katalisator (campuran dari 0,8 gram CuSO4, 0,1 gram SeO2, dan 4 gram K2SO4) dan 25 mL H2SO4 pekat. Labu Kjeldahl tersebut kemudian dididihkan di atas pemanas listrik selama 1,5 jam sampai cairan menjadi jernih kehijauan, kemudian didinginkan.
Setelah larutan hasil destruksi dalam labu Kjeldahl dingin, larutan ditambah aquabides hingga volume mencapai 100 mL. Sebanyak 12,5 mL larutan dipipet lalu dimasukkan ke dalam labu destilasi kemudian ditambah dengan 12,5 mL NaOH 30% dan tiga tetes indikator Bromcresol Green + Methyl Red (BCG+MR). Destilat ditampung dalam erlenmeyer yang berisi 12,5 mL larutan asam borat 2% dan tiga tetes indikator PP. Destilat yang tertampung di dalam erlenmeyer kemudian dititrasi dengan menggunakan larutan HCl 0,05 N sampai terjadi perubahan warna dari biru menjadi merah muda. Penetapan kadar protein dilakukan secara triplo. Kadar protein dihitung dengan menggunakan rumus sebagai berikut:
Kadar Pr otein ( %) = x 100% x F
Keterangan:
N = Normalitas HCl
F = faktor konversi (Sudarmadji, 1989)
23
UIN Syarif Hidayatullah Jakarta sebanyak 10 µL kemudian ditambah dengan 7 µL AccQ-Fluor Borate, dihomogenkan dengan menggunakan vortex, lalu ditambah dengan 20 µL
reagent Fluor A dan dihomogenkan lagi. Setelah homogen, larutan didiamkan selama satu menit dan diinkubasi pada suhu 55⁰C selama sepuluh menit. Setelah inkubasi selesai, larutan standar disuntikkan ke KCKT dengan menggunakan kolom C18, temperatur 37⁰C, fase gerak asetonitril 60% dan AccqTag Eluent A dengan sistem gradien komposisi, detektor fluorescence, laju alir 1 mL/menit dan volume penyuntikan 5µL.
Setelah diperoleh kromatogram larutan standar asam amino, sebanyak 0,5 g sarang burung walet putih yang telah dibersihkan dan dihaluskan, ditambahkan dengan 5 mL HCl 6N. Campuran divortex, lalu dialiri dengan gas nitrogen dan dihidrolisis pada suhu 110⁰C selama 22 jam. Hidrolisat yang diperoleh didinginkan pada suhu kamar, lalu dipindahkan ke labu ukur 100 mL, dan ditambahkan aquabides sampai tanda batas. Sampel disaring dengan filter 0,45μm. Filtrat dipipet sebanyak
500 μL lalu ditambah dengan 40 μL AABA ± 460 μL aquabides. Larutan dipipet sebanyak 10 μL, lalu ditambah dengan 70 μL AccQ-Fluor Borate, vortex. Setelah divortex, larutan ditambah dengan 20 μL reagen fluor A, lalu divortex lagi dan didiamkan selama 1 menit. Larutan sampel diinkubasi selama 10 menit pada suhu 55⁰C, lalu disuntikkan pada KCKT dengan kondisi kromatografi yang sama seperti saat penyuntikan larutan standar asam amino.
24 UIN Syarif Hidayatullah Jakarta BAB IV
HASIL DAN PEMBAHASAN
4.1 Determinasi Sampel
Sampel sarang burung walet putih yang diperoleh dari Kediri, Jawa Timur dideterminasi di Herbarium Bogoriense, Puslit Biologi Bidang Zoologi LIPI Cibinong, Bogor, Jawa Barat, dimana hasil menunjukkan bahwa sampel benar merupakan sarang burung walet putih dari burung walet putih (Collocalia fuciphago). Determinasi dilakukan dengan tujuan untuk mengidentifikasi sampel. Hasil determinasi dapat dilihat pada lampiran 2.
4.2 Ekstraksi Protein pada Sampel
Proses ekstraksi dilakukan setelah sampel dibersihkan dari bulu burung walet yang menempel kemudian dihaluskan. Sebanyak 1 gram sampel dilarutkan dalam 50 mL aquabidest, kemudian disonikasi selama 30 menit untuk memecah ikatan antar molekul dan merusak sel sehingga menyebabkan protein di dalam sel akan keluar (Lacoma, 2009). Hasil sonikasi kemudian disentrifugasi dengan kecepatan 10000 rpm selama 30 menit untuk memisahkan substansi berdasarkan berat molekul sehingga larutan protein dapat dipisahkan dengan endapan (Holme and Peck, 1993). Larutan protein yang diperoleh dipekatkan dengan cara pengeringan freeze dry selama 9 jam yang kemudian disimpan pada suhu -20⁰C. Dari hasil ekstraksi diperoleh sebanyak 32 mL larutan protein hasil sentrifugasi dan 0,4 mg ekstrak kering protein.
4.3 Analisis Profil Protein dengan Menggunakan SDS-PAGE
25
UIN Syarif Hidayatullah Jakarta elektroforesis gel poliakrilamid dapat dilakukan dengan menambahkan detergen ionik dan menambahkan tahap denaturasi (Kurniati dan Wanadi, 2001). Pada proses persiapan sampel, sampel ditambahkan dengan suatu detergen anionik, sodium dodesil sulfat (SDS). Sebelum elektroforesis, sampel yang akan dipisahkan dilarutkan terlebih dahulu dalam suatu dapar yang mengandung Tris-HCl, SDS, gliserol, bromfenol biru, dan merkaptoetanol.
Tujuan penggunaan SDS dan merkaptoetanol disertai dengan pemanasan akan memecah struktur tiga dimensi dari protein, terutama ikatan disulfida menjadi subunit-subunit polipeptida secara individual. SDS juga membungkus rantai protein yang terikat dengan muatan negatif yang sama membentuk kompleks SDS-protein. Kompleks SDS-protein memiliki densitas muatan yang identik dan bergerak pada gel hanya berdasarkan ukuran protein (Wijaya dan Rohman 2005; Fatmawati et al., 2009). Oleh karena itu, kompleks SDS-protein yang lebih besar mempunyai mobilitas yang lebih rendah dibandingkan dengan kompleks SDS-protein yang lebih kecil (Fatmawati et al., 2009).
Adapun dalam penelitian, elektroforesis diatur dengan tegangan 175 V konstan dengan arus sebesar 400 mA. Pengaturan ini dapat dimodifikasi sesuai dengan keperluan percobaan. Pengaturan tersebut dipilih karena memberikan hasil yang paling baik berdasarkan percobaan-percobaan yang telah dilakukan. Elektroforesis dilakukan hingga sampel mencapai bagian dasar gel selama 50 menit.
26
UIN Syarif Hidayatullah Jakarta Diketahui bahwa Y adalah log bobot molekul protein dan x adalah Rf (nisbah bagi antara migrasi pita protein sampel dengan migrasi pita protein
marker).
Berdasarkan hasil elektroforesis, ekstrak protein sarang burung walet putih menunjukkan pemisahan sebanyak enam pita protein. Pita-pita protein yang tampak memiliki berat molekul sebesar 96,6276 kDa, 67,0907 kDa, 48,5096 kDa, 10,8217 kDa, 9,5826 kDa, dan 7,5137 kDa. Pita protein muncul baik dari perbandingan 1:1, 1:2, dan 2:1. Tetapi dapat dilihat bahwa pita protein dari perbandingan 2:1 sedikit lebih jelas dibanding perbandingan 1:1 dan 1:2. Hal ini dipengaruhi oleh volume pemipetan sampel yang lebih banyak.
Gambar 4.1 Hasil analisis SDS-PAGE ekstrak sarang burung walet putih Keterangan: 1 = marker protein Prestained SDS-PAGE standards Board Range dari
Bio-Rad; 2 dan 3 = Ekstrak protein sarang burung walet putih dan sample buffer dengan
perbandingan 1:1; 4 dan 5 = Ekstrak protein sarang burung walet putih dan sample buffer
dengan perbandingan 1:2; 6 dan 7 = Ekstrak protein sarang burung walet putih dan
sample buffer dengan perbandingan 2:1
27
UIN Syarif Hidayatullah Jakarta kDa, dan 7,5137 kDa. Sedangkan penelitian Liu et al. menunjukkan bahwa protein dari sarang burung walet yang berasal dari Malaysia, Thailand, Indonesia, dan Vietnam memiliki berat molekul yang berkisar antara 128 kDa – 20 kDa. Begitu pula dengan hasil penelitian Elfita tahun 2013 yang menunjukkan bahwa sarang burung walet yang berasal dari Painan, Sumatera Barat, memiliki protein dengan berat molekul 147,2 kDa, 142,4 kDa, 133,4 kDa, 73,3 kDa, 66,2 kDa, dan 37,7 kDa.
Perbedaan ini dapat disebabkan oleh perbedaan cara preparasi perolehan ekstrak protein yang dilakukan dan perbedaan daerah asal sampel. Liu et al. melakukan pemisahan protein berdasarkan titik isoelektrik protein dengan metode Liquid-phase Isoelectric Focusing
(LIEF) setelah sampel dikeringkan dengan metode pengeringan freeze dry
dan dianalisis dengan elektroforesis dua dimensi. Metode LIEF digunakan untuk mengurangi kompleksitas protein pada sarang burung walet dan memperjelas pemisahan protein yang jumlahnya sedikit pada saat elektroforesis. Sedangkan Elfita pada saat ekstraksi menggunakan membran dialisis 3500 cutoff molecular weight sebelum dikeringkan dengan metode pengeringan freeze dry.
4.4 Pengukuran Kadar Protein dengan Metode Semi-mikro Kjeldahl
Pengukuran kadar kandungan protein yang terdapat dalam sarang burung walet putih (Collocalia fuciphago) ditentukan dengan menggunakan metode semi-mikro Kjeldahl. Metode ini didasarkan pada pengukuran kadar nitrogen total yang ada di dalam sampel. Kandungan protein dihitung dengan mengasumsikan rasio tertentu antara protein terhadap nitrogen untuk produk tertentu yang dianalisis (Andarwulan, Kusnandar dan Herawati, 2011).
28
UIN Syarif Hidayatullah Jakarta ditangkap oleh asam. Dalam tahap titrasi, senyawa NH4H2BO3 dititrasi dengan menggunakan asam klorida encer, sehingga asam borat terlepas kembali dan terbentuk amonium klorida. Jumlah asam klorida yang digunakan untuk titrasi setara dengan jumlah gas NH3 yang dibebaskan dari proses titrasi (Andarwulan, Kusnandar dan Herawati, 2011).
Pengukuran kadar protein dilakukan dengan metode semi-mikro Kjeldahl karena dalam metode ini sampel tidak diekstraksi terlebih dahulu sehingga semua protein dapat terukur kadarnya. Selain itu, metode ini masih merupakan metode standar untuk penentuan kadar protein dan memiliki pedoman standar nasional, yaitu SNI 01-2782-1998. Metode Kjeldahl tidak menghitung kadar protein secara langsung, diperlukan faktor konversi (F) untuk menghitung kadar protein total dan kadar nitrogen. Faktor konversi 6,25 berasal dari angka konversi serum albumin yang biasanya mengandung 16% nitrogen.
Berbeda dengan metode pengukuran kadar protein dengan metode Lowry dan metode Bradford, dimana sampel harus diekstraksi sebelum diukur kadar proteinnya, sehingga ada kemungkinan di dalam sampel masih terdapat protein yang tidak terekstraksi dan menyebabkan kadar protein yang terukur menjadi lebih kecil. Elfita pada tahun 2013 telah membandingkan pengukuran kadar protein pada sarang burung walet dengan metode semi-mikro Kjeldahl dan metode Lowry, hasilnya menunjukkan bahwa kadar protein pada sarang burung walet yang diukur dengan metode Lowry jauh lebih kecil dibandingkan dengan metode semi-mikro Kjeldahl.
Pada penelitian ini, HCl distandarisasi terlebih dahulu dengan 10 mL natrium tetraborat 0,05 N, sehingga konsentrasi HCl yang diperoleh sebesar 0,066 N. Standarisasi dilakukan karena HCl merupakan larutan baku sekunder yang sifatnya tidak stabil. Data titrasi standarisasi HCl dengan natrium tetraborat dapat dilihat pada lampiran 5.
29
UIN Syarif Hidayatullah Jakarta karbon dan hidrogen teroksidasi menjadi CO, CO2, dan H2O. Sedangkan nitrogen akan berubah menjadi (NH4)2SO4. Katalisator berperan untuk mempercepat proses destruksi. Dengan penambahan katalisator, titik didih asam sulfat akan dipertinggi sehingga destruksi berlangsung lebih cepat. Reaksi yang terjadi yaitu sebagai berikut:
N(Sampel) + H2SO4 (NH4)2SO4 + H2O + CO2 + matriks sampel lainnya
Setelah proses destruksi selesai, larutan didinginkan dahulu, baru kemudian diencerkan dengan aquabides hingga volume mencapai 100 mL. Sebanyak 12,5 mL hasil destruksi dipipet dan dicampur dengan 12,5 mL NaOH dan 3 tetes indikator BCG-MR, kemudian didestilasi dengan 12,5 mL asam borat yang diberi indikator PP selama 30 menit hingga warna larutan berubah menjadi biru muda. Dengan adanya NaOH pekat, asam sulfat dinetralkan dan ammonium sulfat dipecah menjadi gas amoniak. Proses destilasi menyebabkan gas amoniak menguap dan ditangkap oleh asam borat (H3BO3) sehingga terbentuk senyawa NH4H2BO3. Reaksi yang terjadi sebagai berikut:
(NH4)2SO4 + 2 NaOH 2NH3 + Na2SO4 + 2 H2O
Setelah destilasi selesai, asam borat yang telah mengandung ammonia segera dititrasi dengan HCl. Reaksi yang terjadi yaitu sebagai berikut:
NH3 + H3BO3 NH4H2BO3 + H3BO3 2 NH4H2BO3 + 2 HCl 2 NH4Cl + 2 H3BO3
30
UIN Syarif Hidayatullah Jakarta Perbedaan kadar protein yang diperoleh dapat disebabkan karena perbedaan daerah asal sampel. Tingginya kadar protein merupakan indikator bahwa lingkungan habitat burung walet merupakan lingkungan yang baik bagi burung walet untuk hidup memperoleh makanan (Marcone, 2005).
4.5 Analisis Asam Amino Sarang Burung Walet Putih dengan KCKT
Asam amino esensial sangat dibutuhkan oleh manusia karena tidak dapat disintetis sendiri oleh tubuh. Semakin lengkap dan tinggi kandungan gizi asam amino dalam biji maka nilai gizi semakin baik dan diharapkan dapat menyamai protein hewani (Richana, 2000).
Analisis asam amino dilakukan untuk menduga jenis dan kadar asam amino yang terdapat sarang burung walet putih (Collocalia fuciphago) yang sudah dihaluskan. Analisis asam amino diawali dengan hidrolisis. Pada tahap ini, hidrolisis sempurna rantai polipeptida dilakukan dengan pelarut HCl 6 N pada suhu 110⁰C selama 22 jam. HCl digunakan untuk hidrolisis karena HCl dapat memecah ikatan peptida secara sempurna dan dapat dengan mudah hilang dari hidrolisat dengan adanya penguapan (Masuda dan Dohmae, 2011). Setelah larutan dihidrolisis, hidrolisat yang diperoleh kemudian didinginkan pada suhu kamar dan ditera volumenya dengan aquabidest kemudian disaring. Sampel asam amino ditambahkan dengan AABA (Alpha amino butyric acid) sebagai internal standar dan digenapkan volumenya dengan aquabidest. Penambahan larutan standar internal digunakan untuk mengoreksi hilangnya residu asam amino selama proses hidrolisis karena aliran atau penghancuran.
31
UIN Syarif Hidayatullah Jakarta menghasilkan derivat fluoresen dengan eksitasi 250 nm dan emisi 395 nm (Bosch et al., 2006; Eriksson et al., 2009). Kelebihan reagen AQC dapat bereaksi dengan air dan membentuk 6-aminoquinolin (AMQ), N-hidroksi suksinimidi (NHS) dan karbondioksida (CO2) (Salazar et al., 2012). AMQ bereaksi sangat lambat dengan reagen AQC berlebih membentuk bis-aminoquinolin urea. Produk-produk samping tidak mengganggu identifikasi dan kuantifikasi dari asam amino.
Tabel 4.1 Kadar Asam Amino dalam Sarang Burung Walet Putih
No Asam Amino Kandungan Asam Amino (perlakuan duplo) (%)
32
UIN Syarif Hidayatullah Jakarta Hasil analisis asam amino dari sarang burung walet putih dengan menggunakan KCKT menunjukkan bahwa sarang burung walet putih mengandung 16 jenis asam amino yang terdiri dari sembilan jenis asam amino esensial dan tujuh jenis asam amino nonesensial dengan kandungan total rata-rata sebesar 40,310%. Kadar sembilan asam amino esensial yang terkandung dalam sarang burung walet putih yaitu histidin 1,718%, arginin 3,037%, treonin 2,810%, valin 3,677%, metionin 0,426%, lisin 2,121%, isoleusin 1,562%, leusin 3,245%, dan fenilalanin 2,987%. Sedangkan kadar tujuh asam amino nonesensial yang terkandung dalam sarang burung walet putih yaitu asam aspartat 4,140%, serin 2,944%, asam glutamat 3,276%, glisin 1,799%, alanin 1,718%, prolin 3,330%, dan tirosin 2,044%. Berdasarkan hasil yang diperoleh, dapat disimpulkan bahwa asam amino esensial dan nonesensial yang paling tinggi kandungannya dalam sarang burung walet putih (Collocalia fuciphago) adalah valin 3,677% dan asam aspartat 4,140%.
Valin tergolong asam amino rantai bercabang, memiliki efek menstimulasi metabolisme otot, perbaikan jaringan, dan menjaga keseimbangan nitrogen di dalam tubuh. Selain itu, valin juga menstimulasi sistem saraf pusat dan berperan penting dalam fungsi mental. Sementara itu, asam aspartat merupakan asam amino yang bersifat asam, digolongkan sebagan asam karboksilat. Asam aspartat merupakan bahan bakar utama sel-sel otak bersama glukosa dan mampu mengurangi ketergantungan alkohol dan menstabilkan kesehatan mental. (Harli, 2008).
Hasil analisis asam amino pada penelitian ini berbeda dengan hasil penelitian Ismail et al. (2013) dan Elfita pada tahun 2013. Ismail et al.
33
34 UIN Syarif Hidayatullah Jakarta BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Analisis profil protein pada sarang burung walet putih (Collocalia fuciphago) dengan menggunakan SDS-PAGE menunjukkan bahwa terdapat enam pita protein yang muncul dengan bobot molekul masing-masing sebesar 96,6276 kDa, 67,0907 kDa, 48,5096 kDa, 10,8217 kDa, 9,5826 kDa, dan 7,5137 kDa.
2. Hasil penentuan kadar protein menggunakan metode semi-mikro Kjeldahl menunjukkan bahwa pada sarang burung walet putih (Collocalia fuciphago) memiliki kandungan protein sebesar 50,176%. 3. Asam amino yang terkandung dalam sarang burung walet putih
(Collocalia fuciphago) yang dianalisis dengan menggunakan KCKT menunjukkan bahwa terdapat 16 jenis asam amino yang terdiri dari sembilan jenis asam amino esensial dan tujuh jenis asam amino nonesensial dengan kandungan total sebesar 40,310%. Kadar sembilan asam amino esensial yang terkandung dalam sarang burung walet putih yaitu histidin 1,718%, arginin 3,037%, treonin 2,810%, valin 3,677%, metionin 0,426%, lisin 2,121%, isoleusin 1,562%, leusin 3,245%, dan fenilalanin 2,987%. Sedangkan kadar tujuh asam amino nonesensial yang terkandung dalam sarang burung walet putih yaitu asam aspartat 4,140%, serin 2,944%, asam glutamat 3,276%, glisin 1,799%, alanin 1,718%, prolin 3,330%, dan tirosin 2,044%.
5.2 Saran
35
36 UIN Syarif Hidayatullah Jakarta DAFTAR PUSTAKA
Adnan, M. 1997. Teknik Kromatografi untuk Analisis Bahan Makanan.
Yogyakarta: Andi Yogyakarta.
Almatsier, S. 1989. Prinsip Dasar Ilmu Gizi. Jakarta : Penerbit Gramedia.
Andarwulan, Nuri, Feri Kusnandar, Dian Herawati. 2011. Analisis Pangan. Jakarta: Dian Rakyat.
Bintang, Maria. 2010. Biokimia Teknik Penelitian. Jakarta: Erlangga. Hal: 99, 103-106.
Bodanszky, M. 1993. Chemistry of Peptide. Berlin: Spinger-Verlag. Hal: 47-52.
Bosch L, Alegria A, Farre R. 2006. Application of the 6-Aminoquinolyl-Nhydroxysccinimidil Carbamate (AQC) Reagent to the RP-HPLC
Determination of Amino Acid in Infant Foods. J.Chromatogr B Analyt Technol Biomed Life Sci. 831 (1-2):176-183.
Brown, T.A. 2002. DNA in Genomes, 2nd Ed. Manchester, UK: Garland Science.
Buletin Konservasi Biodiversitas Raja4 Edisi Oktober 2012. Universitas Negeri Papua.
Chau, Q., S.B. Cantor, E. Caramel, M. Hicks, D. Kurtin, T. Grover dan L.S. Elting. 2003. Cost effectiveness of the bird‟s nest filter for preventing pulmonary embolism among patients with malignant brain tumors and
deep venous thrombosis of the lower extremities. Support Care Cancer, 11: 795-799.
Colombo, J.P., C. Garcia-Rodenas, P.R. Guesry dan J.Rey. 2003. Potential effects of supplementation with amino acids, choline or sialic acid on cognitive
37
UIN Syarif Hidayatullah Jakarta Coligan, J, Dunn, B, Ploengh, H, Speicher, D, and Wingfield, P. 2007. Current Protocols in Protein Sciences. Vol. 1. New York: John Willey & Sons Inc. Pub. Hal: 332-340.
Elfita, Lina. 2013. Analisis Profil Protein dan Asam Amino Sarang Burung Walet (Collocalia fuciphago) Asal Painan. Laporan Penelitian Individu Lembaga Penelitian UIN Syarif Hidayatullah Jakarta.
Eriksson J, Janasson S, Papaefthimiou D, Rasmussen U and bergman B. 2009.
Improving Derivatization Efficiency of BMAA Utilizing AccQ-Tag in a
Complex Cyanobacterial Matrix. Departement of Botany, Stockholm University. 36:43-48.
Gaman, P.M. 1992. Ilmu Pangan Pengantar Ilmu Pangan Nutrisi dan Mikrobiologi. Edisi Kedua. Yogyakarta: Gadjah Mada University Press.
Goh, D. L. M., Chua, K.-Y., Chew, F.-T., Seow, T. K., Ou, K. L., Yi, F. C., dan Lee, B. W. 2001. Immunochemical characterization of edible bird’s nest allergens. Journal of Allergy and Clinical Immunology, 107(6), 1082– 1088.
Harli M. (2008). Asam Amino Esensial. http://www.suparmas.com. Diakses tanggal 28 Juni 2014 pukul: 21:00.
Hamzah, Zainab, Nur H.I., Sarojini J., Kamaruddin H., Othman H., dan Boon-Beng Lee. 2013. Nutritional properties of edible bird nest. Journal of Asian Scientific Research, 3(6), 600-607.
Howe, C., Lee, L. T., dan Rose, H. M. 1961. Collocalia mucoid: a substrate for Myxovirus neuraminidase. Archives of Biochemistry and Biophysics, 95, 512–520.
Howe, C., Lee, L. T., dan Rose, H. M. 1960. Influenza virus sialidase. Nature, 188, 251–252.
38
UIN Syarif Hidayatullah Jakarta Ismail, Azilawati M., Aina Amin, Dzulkifly M.H., dan Amin Ismail. 2013. Using amino acids composition combined with principle component analysist
differentiate house and cave bird’s nests. Current Trends in Technology and Science, Volume II, Issue VI.
International Organization for Standardization (ISO) 1871-2009. 2009. Food and feed products - General guidelines for the determination of nitrogen by the
Kjeldahl method.
Janson, J.C dan Ryden, L. 1998. Protein Purification: Principles, High Resolution Methodes, and Applications, 2nd Edition. John Willey & Sons Inc. Pub. Hal: 464-484.
Kathan, R.H. dan D.I. Weeks. 1969. Structure studies of collocalia mucoid . I. Carbohydrate and amino acid composition. Arch Biochem Biophys, 134: 572-576.
Kong, Y. C., Keung, W. M., Tip, T. T., Ko, K. K., Tsao, S. W., dan Ng, M. H. 1987. Evidence that epidermal growth factor is present in Swiflet’s (Collocalia) nest. Comparative Biochemistry and Physiology, 87(2), 221– 226.
Koon, L.C. 2000. Features-bird‟s nest soup-market demand for this expensive gastronomic delicacy threatens the aptly named edible-nest swiflet with
extinction in the east. Wildlife Conservation, 103(1), 30-35.
Koon, L. C., dan Cranbrook. 2002. Earl ofSwiftlets of Borneo – Builders of edible nests (pp. 1–171). Sabah, Malaysia: Natural History Publication (Borneo) SDN., B.H.D.
39
UIN Syarif Hidayatullah Jakarta Linder M. C. (1992). Biokimia, Nutrisi dan Metabolisme (diterjemahkan oleh Aminuddin dan Amwila A,Y). Universitas Indonesia Press. Jakarta 89-115.
Liu, Xiaoqing, dkk. 2012. Proteomic Profile of Edible Bird’s Nest Proteins. Journal of Agricultural and Food Chemistry, 60, 12477−12481.
Masuda, A dan Dohmae, N. (2011). Amino Acid Analysis Of Sub-Picomolar Amounts of Proteins by Precolom Fluoresence Derivatization with
6-Aminoquinolyl-N-Hydroxysuccinimidyl Carbamate. Jepang. Bioscience Trends; 5(6):231-238. DOI: 10.5582/bst.v5.6.231.
Marcone, M.F. 2005. Characterization of the edible bird‟s nest the “caviar of the east”. Food Research International, 38(11), 25–1134.
Menefee, S.G. dan O.R. Overman. 1940. A Semimicro-Kjeldahl Method for The Determination of Total Nitrogen in Milk. Journal of Dairy Science, Volume 23, Issue 12, Halaman 1177-1185.
Murray, R.K., Granner, D.K., Mayes, P.A., dan Rodwell, V.W. 2003. Biokimia Harper. Edisi 25. Jakarta : Penerbit Buku Kedokteran EGC. Halaman 270.
Nelson, D.L. dan Michael M.Cox. 2004. Lehninger Principles of Biochemistry. 4th Edition. New York: W.H. Freeman & Company.
Ng, M. H., Chan, K. H., dan Kong, Y. C. 1986. Potentiation of mitogenic response by extracts of the Swiftlet’s (Collocalia) nest. Biochemistry International, 13(3), 521–531.
NMSU Board of Regents. 2006. New Mexico State University.
http://web.nmsu.edu/~kburke/Instrumentation/Waters_HPLC_MS_TitlePg .html
40
UIN Syarif Hidayatullah Jakarta Richana, Nur. 2000. Prospek dan Produksi Enzim Alfa-amilase dari Mikroorganisme. Buletin AgroBio Jurnal Tinjauan Ilmiah Riset Biologi dan Bioteknologi Pertanian. Volume 3 Nomor 2 Tahun 2000.
Salamah, E. 1997. Analisis Kimia Menggunakan HPLC Bagian-I. Buletin Teknologi Hasil Perikanan. Vol 3:1.
SNI 01-2782-1998. Metode Pengujian Susu Segar/Rev.1992. Jakarta: Badan Standarisasi Nasional.
Stryer, L. 1995. Biokimia. Jakarta: Penerbit EGC. Terjemahan dari Biochemistry.
Sudarmadji, S., Haryono B., dan Suhardi. 1981. Analisa Bahan Makanan dan Pertanian. Cetakan ke-3. Yogyakarta: Pusat Antar Universitas, Universitas Gajah Mada.
Sumarno, Noegrohati S, Narsito dan Falah II. 2002. Estimasi Kadar Protein dalam Bahan Pangan Melalui Analisis Nitrogen Total dan Analisis Asam
Amino. Majalah Farmasi Indonesia, 13(1), 34-43.
Russel, PJ. 2010. iGenetics 3rd ed. https://www.mun.ca/biology/scarr/iGen3_06-04.html
Tim Penulis PS. 2011. Panduan Lengkap Walet. Jakarta: Penebar Swadaya.
Winarno FG. 2008. Kimia Pangan dan Gizi. Jakarta: PT. Gramedia.
Yuwono, T. 2005. Biologi Molekuler. Erlangga. Jakarta.
http://www.bio-rad.com/en-id/applications-technologies/protein-electrophoresis-methods
41
UIN Syarif Hidayatullah Jakarta Lampiran 1. Alur Penelitian
Lampiran 2. Hasil Determinasi Sarang Burung Walet Putih Destruksi
Destilasi
Titrasi
Perhitungan kadar protein
Sampel sarang burung walet putih dibersihkan dan dihaluskan
42
43
UIN Syarif Hidayatullah Jakarta Pembuatan Larutan Stok 30% akrilamid/0,8% bisakrilamid
Sebanyak 30 gram akrilamid ditambahkan dengan 0,8 gram N’,N’-metilen bisakrilamid, kemudian dilarutkan dengan aquabidest sampai volume 100 mL. Setelah itu, larutan disaring dengan kertas saring dan disimpan pada suhu 40⁰C dalam wadah gelap.
Pembuatan Buffer 4x Tris-HCl/SDS, pH 6,8 (Stacking Buffer)
Sebanyak 6,05 gram Tris dilarutkan dalam 60 mL aquabidest. pH diatur menjadi 6,8 dengan menambahkan HCl 6 N secukupnya. Total volume digenapkan sampai 100 mL dengan penambahan aquabidest. Larutan disimpan pada suhu 40⁰C.
Pembuatan Buffer 4x Tris-HCl/SDS, pH 8,8 (Resolving/Separating Buffer) Sebanyak 18,15 gram Tris dilarutkan dalam 75 mL aquabidest. Atur pH 8,8 dengan menambahkan HCl 6 N secukupnya, kemudian ditambahkan aquabidest hingga volume totalnya 100 mL. Larutan disimpan pada suhu 40⁰C.
Pembuatan Buffer Sampel
Larutan dibuat dengan mencampurkan 2 mL larutan SDS 10%, 2,5 mL gliserol, 1,25 mL buffer Tris HCl pH 6,8, 3,55 aqubidest dan 0,2 mL larutan bromofenol biru 0,5% atau secukupnya sampai terbentuk warna biru gelap pada larutan. Terakhir ditambahkan 0,5 mL 2-merkaptoetanol.
Pembuatan 10x Buffer Elektroforesis (Running Buffer)
Sebanyak 30,3 gram Tris, 144 gram glisin, 10 gram SDS dilarutkan dalam 1000 mL aquabidest. Larutan disimpan pada suhu 40⁰C.
44
UIN Syarif Hidayatullah Jakarta Pembuatan Separating Gel 12%
Larutan separating gel dibuat dengan cara 4 mL larutan stok akrilamid 30% ditambahkan dengan 2,5 mL separating gel buffer (1,5 M Tris HCl pH 8,8), 3,4 mL aquabidest, 0,1 mL SDS 10%, 0,5 mL Ammonium Per Sulfate (APS) 10%, 0,05 mL TEMED.
Pembuatan Stacking Gel 4%
Larutan stacking gel dibuat dengan cara 0,75 ml larutan stok akrilamid 30% ditambahkan dengan 1,25 mL stacking gel buffer (1,5 M Tris HCl pH 6,8), 3,05 mL aquabidest, 0,05 mL SDS 10%, 0,5 mL Ammonium Per Sulfate (APS) 10%, dan 0,05 mL TEMED.
45
UIN Syarif Hidayatullah Jakarta 1. Gambar Katalog Prestained SDS-PAGE Standards Broad Range dari Bio-Rad
2. Tabel dan Kurva Standar Protein antara Rf terhadap Log BM Pita Standar Protein Prestained SDS-PAGE Standards Board Range
Protein d (cm) BM (kDa) Rf Log BM
Myosin 0,45 198,820 0,0909 5,298
BSA 1,5 57,542 0,3030 4,759
Soybean trypsin inhibitor 3 20,666 0,6060 4,315
Lysozime 3,85 15,000 0,7778 4,176
Aprotinine 4,25 6,427 0,8586 3,808
Loading dye (cm) 4,95
(lanjutan)
y = -1,743x + 5,390 r = 0,983 0
1 2 3 4 5 6
0 0,2 0,4 0,6 0,8 1
lo
g
B
M
46
UIN Syarif Hidayatullah Jakarta Tabel Bobot Molekul Protein Sampel
d (cm) Rf Log BM BM (kDa)
1,15 0,2323 4,9851 96,6276
1,6 0,3232 4,8267 67,0907
2 0,4040 4,6858 48,5096
3,85 0,7778 4,034 10,8217
4 0,8081 3,9815 9,5826
4,3 0,8687 3,8758 7,5137
Loading dye (cm) 4,95
47
UIN Syarif Hidayatullah Jakarta 1. Tabel Data Standarisasi HCl dengan Natrium Tetraborat
Volume awal HCl (mL) Volume akhir HCl (mL) Volume HCl (mL)
14,70 22,20 7,5
22,20 29,80 7,6
29,80 37,30 7,5
Volume HCl rata-rata (mL) 7,53
V1 x N1 = V2 x N2
2. Tabel Data Titrasi HCl 0,066 N dengan Sampel
Volume awal HCl (mL) Volume akhir HCl (mL) Volume HCl (mL)
18,00 23,20 5,2
23,40 28,80 5,4
8 13,7 5,7
Volume HCl rata-rata (mL) 5,433
3. Perhitungan Kadar Protein Sampel
Dalam 12,5 mL, sampel yang terkandung sebanyak:
12,5 mL