ANALISIS MERKURI DALAM KOSMETIK KRIM
SARANG BURUNG WALET (
Collocalia fuciphago
)
YANG DIPEROLEH MELALUI INTERNET
SKRIPSI
LAILA NOVILIA MAKMUN
1111102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ANALISIS MERKURI DALAM KOSMETIK KRIM
SARANG BURUNG WALET (
Collocalia fuciphago
)
YANG DIPEROLEH MELALUI INTERNET
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
LAILA NOVILIA MAKMUN
1111102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK
Nama : Laila Novilia Makmun Program Studi : Farmasi
Judul Skripsi : Analisis Merkuri dalam Kosmetik Krim Sarang Burung Walet (Collocalia fuciphago) yang Diperoleh Melalui Internet
Krim sarang burung walet (Collocalia fuciphago) merupakan krim pemutih kulit yang banyak dijual melalui internet. Terdapat kemungkinan penambahan merkuri ke dalam krim sebagai pengganti sarang burung walet yang harganya mahal. Penelitian ini bertujuan untuk menganalisis merkuri dalam krim sarang burung walet yang diperoleh melalui internet. Krim sarang burung walet yang dianalisis terdiri atas 2 merek yaitu merek A dan B. Masing-masing merek krim terdiri atas krim siang (kode-1) dan krim malam (kode-2) sehingga jumlah total sampel adalah 4 sampel (A-1, A-2, B-1, dan B-2). Sebelum proses penyiapan sampel, dilakukan pemeriksaan organoleptis dan pengukuran pH sampel serta pemilihan panjang gelombang merkuri. Penyiapan sampel dilakukan dengan metode digesti basah dan dengan alat refluks. Analisis merkuri dilakukan dengan metode ICP-OES (Inductively Coupled Plasma Optical Emission Spectrometry). Panjang gelombang yang digunakan yaitu pada 194,227 nm. Hasil pengukuran pH menunjukkan bahwa keempat sampel tidak memenuhi syarat nilai rentang pH berdasarkan SNI 16-4954-1998 mengenai krim pemutih kulit. Hasil validasi metode menunjukkan nilai linearitas r = 0,999; nilai LOD dan LOQ adalah 0,460
μg/L dan 1,532 μg/L; nilai KV (Koefisien Variasi) yaitu 0,918%; dan nilai persen perolehan kembali rata-rata adalah 75,658%. Metode yang digunakan dalam penelitian ini memenuhi persyaratan linearitas, LOD, LOQ, presisi, dan akurasi. Hasil uji kualitatif menunjukkan bahwa keempat sampel positif mengandung merkuri. Kandungan merkuri rata-rata dalam krim sarang burung walet merek A-1, A-2, B-1, dan B-2 secara berturut-turut adalah 3577,370 μg/g; 4685,715 μg/g;
0,503 μg/g; dan 4007,172 μg/g.
ABSTRACT
Name : Laila Novilia Makmun Major : Pharmacy
Title : Analysis of Mercury in Bird‟s Nest (Collocalia fuciphago) Cream Cosmetic Obtained Over the Internet
Cream of bird's nest (Collocalia fuciphago) is a skin-whitening cream. It is sold over the internet. There is possibility of adding mercury into the creams instead of expensive bird‟s nest. The aim of this research was to analyze mercury in bird‟s nest creams obtained over the internet. The bird‟s nest creams analyzed were consist of two brands namely brand A and B. Each cream brand was consisting of day cream (code-1) and night cream (code-2) so that the total number of the samples were 4 samples (A-1, A-2, B-1 and B-2). Organoleptic examination, pH measurement of the samples, and mercury wavelength selection was done before the process of samples preparation. The samples preparation was done by wet digestion method and reflux as its apparatus. Mercury analysis was conducted using ICP-OES (Inductively Coupled Plasma Optical Emission Spectrometry). Wavelength used is at 194.227 nm. pH measurement results showed that the four samples did not meet pH range value requirement based on SNI 16-4954-1998 about skin-whitening cream. The results of method validation showed linearity value r = 0.999; LOD and LOQ value were 0.460 μg/L and 1.532 μg/L; CV (Coefficient of Variation) value was 0.918%; and the value of average recovery percent was 75.658%. The methods used in this study meet the requirements of linearity, LOD, LOQ, precision, and accuracy. Qualitative test results showed that the four samples contained mercury. Average mercury contents in the bird's nest creams with brands of A-1, A-2, B-1, and B-2 were 3577.370 μg/g; 4685.715
μg/g; 0.503 μg/g; and 4007.172 μg/g respectively.
KATA PENGANTAR
Alhamdulillahirabbil„alamiin, atas segala nikmat iman, islam, kesempatan, serta kekuatan yang telah diberikan Allah SWT sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini. Shalawat dan salam kepada Rasulullah Muhammad SAW sebagai tauladan umat manusia, semoga kita dapat menjunjung nilai-nilai Islam yang beliau ajarkan dan semoga kita mendapatkan syafaat beliau.
Skripsi ini dibuat sebagai salah satu syarat untuk mendapat gelar sarjana farmasi dari Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. Judul skripsi ini adalah
“Analisis Merkuri dalam Kosmetik Krim Sarang Burung Walet yang
Diperoleh Melalui Internet”.
Penulis menyadari bahwa keberhasilan tugas akhir ini adalah atas bimbingan dan bantuan berbagai pihak. Dalam kesempatan ini, penulis menyampaikan terimakasih kepada :
1. Ibu Lina Elfita, M.Si., Apt. dan Ibu Dra. Herdini, M.Si., Apt. selaku dosen pembimbing yang senantiasa sabar dan ikhlas dalam memberikan ilmu, waktu, nasehat, arahan serta semangat selama proses penyelesaian penelitian dan skripsi ini.
2. Bapak Dr. H. Arif Soemantri, SKM, M.Kes selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Bapak Yardi, Ph.D., Apt. selaku Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Ibu Puteri Amelia M.Farm., Apt. selaku pembimbing akademik yang telah membimbing dan memberikan dukungan dalam menghadapi permasalahan-permasalahan akademik.
Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
6. Kedua orang tua tercinta, Ayahanda Makmun, Ibunda Mauliah serta adik-adik tercinta Anggi, Dede, dan Eki atas kasih sayang, perhatian, semangat, doa yang tiada henti serta dukungan baik moral maupun materil. Semoga selalu dalam lindungan Allah SWT.
7. Mba Srim, Mba Ika, dan Mba Sandra dari pihak Laboratorium Kesehatan Daerah Provinsi DKI Jakarta atas ilmu, tenaga, nasehat, serta kerjasamanya selama penelitian berlangsung.
8. Teman-teman terdekat Silvia, Athiyah, Tari, Karimah, Sonia, Arini, Meryza, Sheila, dan Puput serta teman-teman Farmasi 2011 “effervescent” yang dengan sabar menemani, mendukung, membantu serta sebagai tempat berbagi keluh kesah.
9. Semua pihak yang turut membantu yang tidak bisa penulis sebutkan satu per satu.
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna. Oleh karena itu, dengan segala kerendahan hati, penulis sangat mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat bermanfaat dan memberikan sumbangan pengetahuan khususnya di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, Universitas Islam Negeri Syarif Hidayatullah Jakarta dan pembaca pada umumnya.
Jakarta, Oktober 2015
DAFTAR ISI
2.5 Inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES) ... 17
2.5.1 Prinsip Kerja ... 17
2.5.2 Instrumentasi ... 19
2.5.3 Analisis Kualitatif dan Kuantitatif dengan ICP-OES ... 27
2.6 Metode Destruksi ... 29
2.6.1 Metode Destruksi Basah ... 30
2.6.2 Metode Destruksi Kering ... 30
2.7 Teknik Sampling ... 31
2.7.1 Definisi Populasi, Sampel, dan Sampling ... 31
2.7.2 Tipe Sampling Menurut Peluang Pemilihannya ... 31
2.8 Validasi Metode Analisis ... 32
3.3.2 Pemeriksaan Organoleptis dan Pengukuran pH ... 39
3.3.2.1 Pemeriksaan Organoleptis ... 39
3.3.6.2 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 41
3.3.6.3 Uji Presisi ... 42
3.3.6.4 Uji Akurasi dengan Persen Perolehan Kembali ... 43
3.3.7 Penyiapan Sampel ... 44
3.3.8 Uji Kualitatif dan Uji Kuantitatif Merkuri dalam Sampel ... 44
BAB 4. HASIL DAN PEMBAHASAN ... 45
4.1 Perolehan Sampel ... 45
4.2 Pemeriksaan Organoleptis dan Pengukuran pH ... 46
4.3 Pemilihan Panjang Gelombang ... 47
4.4 Pembuatan Kurva Kalibrasi dan Uji Linearitas ... 49
4.5 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 50
4.6 Uji Presisi ... 51
4.7 Uji Akurasi dengan Persen Perolehan Kembali ... 51
4.8 Penyiapan Sampel ... 52
4.9 Uji Kualitatif dan Uji Kuantitatif Merkuri dalam Sampel ... 53
BAB 5. KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
DAFTAR GAMBAR
Halaman
Gambar 2.1 Morfologi Sarang Walet ... 10
Gambar 2.2 Penampang Sebuah Torch dan Load Coil ICP yang Menggambarkan Urutan Penyalaan ... 19
Gambar 2.3 Komponen Utama dan Susunan Instrumen ICP-OES ... 19
Gambar 2.4 Beberapa Contoh Nebulizer yang Digunakan untuk ICP-OES ... 20
Gambar 2.5 Pompa Peristaltik yang Digunakan untuk ICP-OES ... 21
Gambar 2.6 Spray Chamber yang Digunakan untuk ICP-OES ... 21
Gambar 2.7 Skema Generator Hidrida ... 22
Gambar 2.8 Torch yang Digunakan untuk ICP-OES ... 23
Gambar 2.9 Kekisi Difraksi Memisahkan Dua Panjang Gelombang Cahaya ... 24
Gambar 2.10 Polikromator Rowland Circle ... 25
Gambar 2.11 Monokromator Czerny-Turner (a) dan Ebert (b) ... 26
Gambar 2.12 Tata Letak Photocathode, Dynode dan Anoda pada Sebuah Tabung Photomultiplier ... 27
Gambar 4.1 Kurva Kalibrasi Standar Merkuri (Konsentrasi VS Intensitas) ... 50
DAFTAR TABEL
Halaman Tabel 2.1 Kandungan Kimia Sarang Burung Walet Putih dan
Sarang Burung Walet Merah ... 10
Tabel 2.2 Kandungan Asam Amino pada Sarang Burung Walet Rumah dan Sarang Burung Walet Gua ... 11
Tabel 2.3 Kelebihan dan Kekurangan Teknik-Teknik Analisis Unsur ... 29
Tabel 2.4 Rentang Kesalahan yang Diijinkan pada Setiap Konsentrasi Analit pada Matriks ... 34
Tabel 4.1 Informasi Sampel ... 46
Tabel 4.2 Hasil Pemeriksaan Organoleptis ... 46
Tabel 4.3 Hasil Pengukuran pH ... 47
Tabel 4.4 Hasil Pengukuran Intensitas Larutan Standar Merkuri pada Panjang Gelombang 184,950 nm dan 194,227 nm ... 48
Tabel 4.5 Hasil Pengukuran Intensitas Larutan Standar Merkuri pada Panjang Gelombang 194,227 nm dan 253,652 nm ... 48
Tabel 4.6 Data Kurva Kalibrasi ... 50
Tabel 4.7 Hasil Uji Akurasi ... 52
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Alur Penelitian ... 64
Lampiran 2. Hasil Pemeriksaan Organoleptis Sampel Krim Sarang Burung Walet A dan B ... 65
Lampiran 3. Hasil Pengukuran pH Sampel Krim Sarang Burung Walet A dan B ... 65
Lampiran 4. Perhitungan Pengenceran Larutan ... 65
Lampiran 5. Data Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ) ... 67
Lampiran 6. Data Uji Presisi ... 68
Lampiran 7. Data Uji Akurasi dengan Persen Perolehan Kembali ... 69
Lampiran 8. Data Uji Kuantitatif Merkuri dalam Sampel ... 72
Lampiran 9. Alat ICP-OES ... 73
Lampiran 10. Proses Destruksi Sampel ... 74
DAFTAR ISTILAH
AOAC : Association of Analytical Communities
ATSDR : Agency for Toxic Substances and Disease Registry BPOM : Badan Pengawas Obat dan Makanan
b/v : Bobot per volume v/v : Volume per volume
DepKes RI : Departemen Kesehatan Republik Indonesia
Ditjen Binfar dan Alkes :iDirektorat Jenderal Bina Kefarmasian dan Alat Kesehatan
FSSAI : Food Safety and Standards Authority of India ICH : International Conference on Harmonisation
ICP-OES :iInductively Coupled Plasma Optical Emission Spectrometry
LOD : Limit of Detection LOQ : Limit of Quantitation NRC : National Research Council ppb : Part per billion
ppm : Part per million
1.1 Latar Belakang
Begitu banyak wanita yang terobsesi terlihat cantik dan memiliki kulit putih. Mayoritas menganggap bahwa wanita yang memiliki kulit putih lebih terlihat cantik, dan selalu melakukan perawatan kecantikan ke salon-salon mahal (Crownia, 2014). Keinginan untuk mempunyai kulit putih tersebut kemudian mendorong penggunaan produk-produk kosmetik pemutih kulit.
Salah satu bahan alam yang saat ini banyak digunakan untuk mencerahkan kulit adalah sarang burung walet (Aerodramus fuciphagus) (Rohmah, 2013). Sarang burung walet mengandung EGF (Epidermal Growth Factor) atau Faktor Pertumbuhan Epidermal (Kong et al., 1987). EGF banyak digunakan dalam kosmetik dan cosmeceuticals (paduan antara kosmetik dan obat) sebagai pelembab atau bahan pemutih (Yun et al., 2013).
Seiring berjalannya waktu, orang-orang mulai melirik bisnis sarang burung walet. Salah satu contoh produk sarang burung walet yaitu krim pemutih kulit yang diklaim mengandung sarang burung walet sebagai bahan alami untuk memutihkan kulit. Saat ini, krim sarang burung walet banyak dipasarkan melalui situs internet.
Krim sarang burung walet yang banyak dipasarkan melalui internet perlu diteliti kandungannya sebab jika mempertimbangkan harga sarang burung walet yang mahal, terdapat kemungkinan produsen-produsen curang yang bisa saja mengklaim bahwa krim produksinya mengandung sarang burung walet walaupun sebenarnya tidak. Jika demikian maka terdapat kemungkinan pula untuk dilakukan penambahan bahan kimia pemutih kulit yang harganya lebih murah sebagai pengganti sarang burung walet.
Sebagian besar produk pemutih kulit mengandung salah satu dari dua bahan aktif yaitu hidrokuinon dan merkuri (Hg) (Olumide et al., 2008). Produk OTC (over-the-counter) hidrokuinon dapat mengandung hidrokuinon dengan konsentrasi 0,5% sampai 2% (konsentrasi 4% atau kadang-kadang lebih tinggi hanya tersedia dari dokter). Kadar maksimum merkuri dalam kosmetik yang dapat diterima yaitu 1 μg/g berdasarkan United States Food and Drug Administration (US FDA) (Amponsah, 2010). Menurut Peraturan Menteri Kesehatan Republik Indonesia No. 445/MENKES/PER/V/1998 tentang Bahan, Zat Warna, Substratum, Zat Pengawet dan Tabir Surya pada Kosmetika, raksa dan senyawanya dilarang digunakan dalam kosmetika kecuali fenilraksa nitrat dan tiomersal sebagai pengawet dalam sediaan sekitar mata, maksimum 0,007%, dihitung sebagai Hg. Merkuri termasuk logam berat berbahaya yang dalam konsentrasi kecil pun dapat bersifat racun (BPOM, 2009). Berdasarkan hal tersebut, analisis merkuri dalam sediaan kosmetik pemutih kulit lebih diutamakan dibandingkan hidrokuinon.
Merkuri mulai dimanfaatkan dalam bidang kosmetik sebagai bahan pencerah kulit karena kemampuannya dalam menghambat pembentukan melanin pada permukaan kulit. Merkuri mampu menjadikan kulit putih mulus dalam waktu yang relatif singkat, akan tetapi zat ini memberikan efek negatif bagi kesehatan karena dapat terakumulasi di bawah kulit (Syafnir & Putri, 2011).
pemakaian dengan dosis tinggi dapat menyebabkan kerusakan permanen otak, ginjal, dan gangguan perkembangan janin bahkan paparan jangka pendek dalam dosis tinggi juga dapat menyebabkan muntah-muntah, diare dan kerusakan paru-paru serta merupakan zat karsinogenik (dapat menyebabkan kanker) pada manusia (BPOM, 2009).
Berdasarkan latar belakang di atas maka dilakukan analisis merkuri dalam kosmetik krim sarang burung walet (Collocalia fuciphago) yang diperoleh melalui internet. Terdapat beberapa metode dalam analisis merkuri yaitu dengan titrasi ditizon dan spektrofotometri serapan atom (DepKes RI, 1995). Selain itu, berbagai teknik analisis yang dapat menjangkau analit dalam jumlah yang relatif kecil telah banyak dilaporkan, antara lain adalah ICP-MS (Inductively Coupled Plasma Mass Spectrometry), ICP-AES (Inductively Coupled Plasma Atomic Emission Spectrometry), GC-AAS (Gas Chromatography Coupled Atomic Absorption Spectrometry), CV-AAS (Cold Vapor Atomic Absorption Spectrometry), AFS (Atomic Fluorescence Spectrometry), dan ASV (Anodic Stripping Voltammetry) (Kristianingrum, 2009). Pada penelitian ini, analisis merkuri dilakukan dengan metode ICP-OES (Inductively Coupled Plasma Optical Emission Spectrometry) karena ICP-OES memiliki suhu atomisasi yang lebih tinggi, lingkungan yang lebih inert, lebih tahan terhadap gangguan matriks, batas deteksi rendah, serta stabilitas yang tinggi (Hou & Jones, 2000).
1.2 Rumusan Masalah
1. Bagaimana metode analisis merkuri yang valid?
2. Apakah dalam sampel krim sarang burung walet yang diuji mengandung merkuri?
1.3 Tujuan Penelitian
1. Mendapatkan metode analisis merkuri yang valid.
2. Menentukan apakah di dalam sampel krim sarang burung walet yang diuji mengandung merkuri atau tidak.
3. Menentukan kadar rata-rata merkuri yang terkandung dalam sampel krim sarang burung walet yang diuji.
1.4 Manfaat Hasil Penelitian
1. Menjadikan masyarakat lebih berhati-hati dalam membeli maupun menggunakan krim sarang burung walet yang diperoleh melalui internet.
2. Sebagai masukan kepada BPOM agar dilakukan pemantauan kembali situs-situs internet yang masih memasarkan produk melalui internet khususnya produk kosmetik krim sarang burung walet.
2.1 Kosmetik
2.1.1 Definisi Kosmetik
Definisi kosmetik dalam Peraturan Menteri Kesehatan RI No. 445/MenKes/Permenkes/1998 adalah sediaan atau paduan bahan yang siap untuk digunakan pada bagian luar badan (epidermis, rambut, kuku, bibir, dan organ kelamin bagian luar), gigi, dan rongga mulut untuk membersihkan, menambah daya tarik, mengubah penampakan, melindungi supaya tetap dalam keadaan baik, memperbaiki bau badan tetapi tidak dimaksudkan untuk mengobati atau menyembuhkan suatu penyakit (Tranggono & Latifah, 2007).
2.1.2 Penggolongan Kosmetik
Menurut Peraturan Menteri Kesehatan RI, kosmetik dibagi ke dalam 13 kelompok (Tranggono & Latifah, 2007) :
1. Preparat untuk bayi, misalnya minyak bayi, bedak bayi, dll. 2. Preparat untuk mandi, misalnya sabun mandi, bath capsule, dll. 3. Preparat untuk mata, misalnya maskara, eye-shadow, dll. 4. Preparat wangi-wangian, misalnya parfum, toilet water, dll. 5. Preparat untuk rambut, misalnya cat rambut, hair spray, dll. 6. Preparat pewarna rambut, misalnya cat rambut, dll.
7. Preparat make-up (kecuali mata), misalnya bedak, lipstick, dll.
8. Preparat untuk kebersihan mulut, misalnya pasta gigi, mouth washes, dll.
9. Preparat untuk kebersihan badan, misalnya deodorant, dll. 10. Preparat kuku, misalnya cat kuku, losion kuku, dll.
2.1.3 Jenis-Jenis Reaksi Negatif oleh Kosmetik
Ada beberapa reaksi negatif yang disebabkan oleh kosmetik yang tidak aman, baik pada kulit maupun pada sistem tubuh, antara lain (Tranggono & Latifah, 2007) :
1. Iritasi
Reaksi langsung timbul pada pemakaian pertama kosmetik karena salah satu atau lebih bahan yang dikandungnya bersifat iritan.
2. Alergi
Reaksi negatif pada kulit muncul setelah kosmetik dipakai beberapa kali, kadang-kadang setelah bertahun-tahun, karena kosmetik itu mengandung bahan yang bersifat alergenik bagi seseorang meskipun mungkin tidak bagi yang lain.
3. Fotosensitisasi
Reaksi negatif muncul setelah kulit yang ditempeli kosmetik terkena sinar matahari karena salah satu atau lebih dari bahan, zat pewarna atau zat pewangi yang dikandung oleh kosmetik itu bersifat photosensitizer.
4. Jerawat (Acne)
Beberapa kosmetik pelembab kulit (moisturizer) yang sangat berminyak dan lengket pada kulit, seperti yang diperuntukkan bagi kulit kering di iklim dingin, dapat menimbulkan jerawat bila digunakan pada kulit yang berminyak, terutama di negara-negara tropis seperti Indonesia karena kosmetik demikian cenderung menyumbat pori-pori kulit bersama kotoran dan bakteri. Jenis kosmetik demikian disebut kosmetik aknegenik. 5. Intoksikasi
Keracunan dapat terjadi secara lokal atau sistemik melalui penghirupan lewat mulut dan hidung, atau lewat penyerapan via kulit, terutama jika salah satu atau lebih bahan yang dikandung oleh kosmetik itu bersifat toksik.
6. Penyumbatan Fisik
(foundation) terhadap pori-pori kulit atau pori-pori kecil pada bagian-bagian tubuh yang lain.
2.1.4 Reaksi Negatif Kosmetik pada Kulit
Hebatnya reaksi negatif pada kulit akibat kosmetik tergantung pada berbagai faktor, antara lain (Nater, 1983 dalam Tranggono & Latifah, 2007) :
1. Lamanya Kontak Kosmetik dengan Kulit
Kosmetik yang dikenakan pada kulit untuk waktu lama, misalnya pelembab dan dasar bedak lebih mudah menimbulkan reaksi negatif daripada yang hanya sebentar saja dikenakan pada kulit untuk kemudian segera dihilangkan atau diangkat kembali, misalnya sabun atau sampo yang cepat dibilas dengan air sampai bersih.
2. Lokasi Pemakaian
Kulit daerah sekitar mata, misalnya, lebih sensitif terhadap kosmetik karena lebih tipis daripada kulit bagian tubuh lainnya.
3. pH Kosmetik
Semakin jauh beda antara pH kosmetik dan pH fisiologis kulit (dapat jauh lebih tinggi atau jauh lebih rendah), semakin hebat kosmetik itu menimbulkan reaksi negatif pada kulit. Karena itu yang terbaik adalah jika pH kosmetik disamakan dengan pH fisiologis kulit, yaitu antara 4,5-6,5 (disebut kosmetik dengan pH Balanced).
4. Kosmetik yang Mengandung Gas
Menyebabkan konsentrasi bahan aktif di dalam kosmetik itu lebih tinggi setelah menguap.
2.2 Krim
2.2.1 Definisi Krim
emulsi setengah padat baik bertipe air dalam minyak atau minyak dalam air (Ansel, 2008).
2.2.2 Krim Pemutih Kulit
Krim pemutih merupakan campuran bahan kimia dan atau bahan lainnya dengan khasiat bisa memucatkan noda hitam (coklat) pada kulit. Tujuan penggunaannya dalam jangka waktu lama agar dapat menghilangkan atau mengurangi hiperpigmentasi pada kulit. Tetapi, penggunaan yang terus-menerus justru akan menimbulkan pigmentasi dengan efek permanen (Wasitaatmadja, 1997).
Mekanisme memutihkan kulit pada krim pemutih adalah dengan cara mencegah proses pigmentasi kulit. Senyawa-senyawa yang terdapat dalam krim pemutih dapat memutihkan kulit dengan salah satu atau beberapa aksi berikut (Wasitaatmadja, 1997):
1. Menghancurkan melanosit secara selektif.
2. Menghambat pembentukan melanosom dan mengatur struktur melanosom tersebut.
3. Menghambat biosintesis enzim tirosinase. 4. Menghambat pembentukan melanin.
5. Mengganggu transfer melanosom ke sel-sel keratinosit di sekelilingnya.
6. Dapat mempunyai efek kimia pada melanin atau meningkatkan proses degradasi melanosom di sel keratinosit.
Kosmetik pemutih kulit yang ada saat ini mempunyai dua cara pencegahan proses pigmentasi untuk mencerahkan warna kulit yaitu menghilangkan warna pada melanin yang sudah ada dan menghambat terjadinya pembentukan melanin baru (Wasitaatmadja, 1997).
Produk tersebut tidak dapat membuat orang yang hitam menjadi putih (Al-Saleh & Al-Doush, 1997).
2.3 Sarang Burung Walet
Sarang walet, khususnya sarang putih yang dibuat oleh Aerodramus fuciphagus, sudah sangat terkenal di masyarakat dunia, terutama di daratan Cina. Sarang walet ini terbentuk dari air liur walet (Panduan Lengkap Walet, 2011). Menurut Kong et al. (1987), sarang burung walet dibuat oleh walet laut jantan dari genus Collocalia.
Jenis walet yang menghasilkan sarang tidak dapat dimakan adalah walet gunung, walet besar, walet sarang lumut, dan walet sapi. Sementara sarang walet sarang hitam masih dapat dimakan, setelah terlebih dahulu dibersihkan dari bahan lain yang terdapat di dalamnya. Walet putih menghasilkan sarang burung yang seluruhnya terbuat dari air liur. Harga sarang walet putih tentu menjadi paling mahal jika dibandingkan dengan jenis sarang walet lainnya (Panduan Lengkap Walet, 2011).
2.3.1 Morfologi Sarang Burung Walet
Gambar 2.1 Morfologi Sarang Walet
[Sumber : Panduan Lengkap Walet, 2011]
2.3.2 Kandungan dan Khasiat
Tabel 2.1 Kandungan Kimia Sarang Burung Walet Putih dan Sarang Burung Walet Merah
Kandungan Sarang Walet Putih Sarang Walet Merah
Kadar air (%) 7,50 8,00 Kadar abu (%) 2,10 2,10
Lemak (%) 0,14 1,28
Protein (%) 62,0 63,00 Karbohidrat (%) 27,26 25,62
Analisis unsur (ppm)
Natrium 650 700
Kalium 110 165
Kalsium 1298 798
Magnesium 330 500
Fosfor 40 45
Besi 30 60
Analisis asam lemak (%)
(P) Palmitat C16:0 23 26 (O) Stearat C18:0 29 26 (L) Linoleat C18:1 22 22 (Ln) Linolenat C18:2 26 26
Triasilgliserol (%)
PPO 16 14
OOL 13 15
PLnLn 19 18
Monogliserida 31 27
Digliserida 21 26
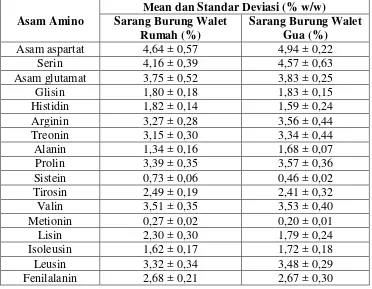
Tabel 2.2 Kandungan Asam Amino pada Sarang Burung Walet Rumah dan Sarang Burung Walet Gua
Asam Amino
Mean dan Standar Deviasi (% w/w) Sarang Burung Walet
[Sumber : Ismail et al., 2013 dalam Arsih, 2014]
Sarang burung walet merupakan makanan berkhasiat yang dihormati oleh bangsa Cina yang telah terbukti memiliki nutrisi yang baik (protein larut air, karbohidrat, besi, garam inorganik, dan serat) dan manfaat dari sisi medis (anti-aging, antikanker, dan meningkatkan imunitas) (Marcone, 2005). Sarang burung walet juga terbukti dapat menghambat hemaglutinasi terhadap virus influenza (Howe, Lee, & Rose, 1960; 1961). Matsukawa et al. (2011) menemukan bahwa pemberian oral ekstrak sarang burung walet meningkatkan kekuatan tulang dan kadar kalsium tulang.
Selain kandungan dan khasiat yang telah disebutkan di atas, sarang burung walet juga mengandung EGF (Epidermal Growth Factor) atau Faktor Pertumbuhan Epidermal (Kong et al., 1987). EGF adalah peptida yang mendorong pertumbuhan berbagai jenis sel setelah mengikat reseptor EGF pada permukaan sel (Yun et al., 2013).
pemutih) dan dalam sediaan topikal untuk mempercepat penyembuhan luka. Berdasarkan hasil penelitian Yun et al. (2013), ditemukan adanya EGFR (Epidermal Growth Factor Receptor) pada melanosit yang memediasi aksi EGF untuk mengurangi peradangan yang disebabkan melanogenesis dan hiperpigmentasi. Hasil penelitian tersebut menunjukkan bahwa EGF dapat berpotensi untuk digunakan dalam kosmetik pemutih untuk mencegah terjadinya PIH (postinflammatory hyperpigmentation), yaitu gangguan hiperpigmentasi umum (Yun et al., 2013).
2.4 Merkuri
Logam merkuri atau air raksa mempunyai nama kimia hydrargyrum yang berarti perak cair. Logam merkuri dilambangkan dengan Hg. Pada tabel peroksida menempati urutan (NA) 80 dan mempunyai bobot atom (BA) 200,59 (Palar, 1994).
2.4.1 Sumber Merkuri
a. Di Alam
Sebagai hasil tambang, merkuri dijumpai dalam bentuk mineral HgS. Terdapat sebagai batuan dan lapisan batuan yang terhampar di Spanyol, Itali dan bagian Amerika, serta banyak didistribusikan sebagai batuan, abu dan larutan (Ariens, 1993).
b. Hasil Aktivitas Manusia
Dalam hal ini dapat dicontohkan dari hasil penambangan emas, dimana penambangan tersebut mengandung bahan merkuri (Hg) yang masuk ke aliran sungai sehingga menyebabkan air sungai tersebut menjadi tercemar dan dapat menimbulkan penyakit yang membahayakan kesehatan manusia (Ariens, 1993).
2.4.2 Jenis-Jenis Merkuri
merkuri murni (yaitu tidak dikombinasikan dengan unsur-unsur lain). Pada suhu kamar, sebagian dari logam merkuri akan menguap dan membentuk uap merkuri. Uap merkuri tidak berwarna dan tidak berbau. Semakin tinggi suhu, semakin banyak uap yang akan dilepaskan dari logam merkuri cair (ATSDR, 1999).
Senyawa merkuri anorganik terbentuk ketika merkuri berikatan dengan unsur-unsur seperti klorin, sulfur, atau oksigen. Senyawa merkuri ini juga disebut garam merkuri. Kebanyakan senyawa merkuri anorganik berupa serbuk atau kristal putih, kecuali merkuri sulfida (yang juga dikenal sebagai sinabar) yang berwarna merah dan berubah warna menjadi hitam setelah terpapar cahaya (ATSDR, 1999).
Ketika merkuri berikatan dengan karbon, senyawa yang terbentuk disebut senyawa merkuri "organik" atau organomercurial. Sejauh ini senyawa merkuri organik yang paling umum di lingkungan adalah metilmerkuri (dikenal juga sebagai monometilmerkuri). Dahulu, senyawa merkuri organik yang disebut fenilmerkuri digunakan dalam beberapa produk komersial. Senyawa merkuri organik lain yang disebut dimetilmerkuri juga digunakan dalam jumlah kecil sebagai standar acuan untuk beberapa uji kimia. Seperti senyawa merkuri anorganik, baik metilmerkuri dan fenilmerkuri terdapat sebagai "garam" (misalnya, metilmerkuri klorida atau fenilmerkuri asetat). Jika dalam keadaan murni, kebanyakan bentuk metilmerkuri dan fenilmerkuri adalah zat padat kristal putih. Namun, dimetilmerkuri adalah cairan tak berwarna (ATSDR, 1999).
2.4.3 Kegunaan
Logam merkuri cair digunakan dalam memproduksi gas klorin dan soda kaustik, dan dalam ekstraksi emas dari bijih yang mengandung emas. Digunakan juga dalam termometer, barometer, baterai, dan saklar listrik (ATSDR, 1999).
digunakan secara luas dalam produk obat pencahar, obat cacing, dan serbuk gigi. Sejak saat itu telah digantikan oleh agen yang lebih aman dan lebih efektif. Bahan kimia lainnya yang mengandung merkuri masih digunakan sebagai antibakteri. Produk tersebut termasuk mercurochrome (mengandung sejumlah kecil merkuri, 2%), timerosal dan fenilmerkuri nitrat, yang digunakan dalam jumlah kecil sebagai pengawet dalam beberapa obat resep dan obat bebas (ATSDR, 1999). Timerosal digunakan sebagai pengawet dalam larutan lensa kontak lunak sedangkan fenilmerkuri nitrat digunakan sebagai pengawet dalam sediaan tetes mata (Rowe, Sheskey & Owen, 2006).
2.4.4 Persyaratan Kadar
United States Food and Drug Administration (US FDA) pada tahun 1992 menetapkan kadar maksimum merkuri dalam kosmetik yang dapat diterima yaitu 1 μg/g (Amponsah, 2010). Sedangkan menurut Peraturan Menteri Kesehatan Republik Indonesia No. 445/MENKES/PER/V/1998 tentang Bahan, Zat Warna, Substratum, Zat Pengawet dan Tabir Surya pada Kosmetika, raksa dan senyawanya dilarang digunakan dalam kosmetika kecuali fenilraksa nitrat dan tiomersal sebagai pengawet dalam sediaan sekitar mata, maksimum 0,007%, dihitung sebagai Hg.
2.4.5 Toksisitas
Merkuri anorganik dan ionik (misalnya, merkuri klorida) dapat menyebabkan toksisitas akut berat. Pengendapan protein selaput lendir akibat garam merkuri mengakibatkan warna mulut, faring dan saluran cerna keabu-abuan disertai nyeri hebat dan muntah. Efek korosif Hg anorganik pada mukosa usus menyebabkan hematoschezia yang ditandai dengan mukosa lepas dalam tinja. Efek sistemik paling serius dan paling sering terjadi akibat Hg anorganik ialah toksisitas renal. Terjadi nekrosis tubuli ginjal disertai oliguria atau anuria; namun kerusakan glomerular lebih menonjol (Gunawan, 2009).
Sindrom akrodinia (pink disease) umumnya juga akibat pajanan kronis terhadap ion merkuri anorganik. Sindrom akrodinia berupa eritem ekstremitas, dada dan wajah, dengan fotofobia, diaforesis, mual, takikardia, dan sembelit atau diare. Kompleks gejala ini terlihat secara eksklusif akibat termakannya merkuri dan diduga merupakan reaksi hipersensitivitas terhadap merkuri (Gunawan, 2009).
Kebanyakan data toksikologi Hg organik pada manusia menyangkut metilmerkuri sebagai akibat pajanan tidak sengaja. Gejala pajanan metilmerkuri sebagian besar bersifat neurologis seperti gangguan penglihatan (skotoma atau penyempitan medan penglihatan), ataksia, parestesia, neurastenia, kehilangan pendengaran, disartri, kemunduran mental, tremor, gangguan motorik, paralisis dan kematian. Efek metilmerkuri pada fetus dapat terjadi walaupun ibunya asimtomatik, yaitu berupa kemunduran mental dan gangguan neuromuskular (Gunawan, 2009).
2.4.6 Merkuri dalam Produk Pemutih Kulit
Senyawa merkuri telah digunakan dengan berbagai keberhasilan dalam mencerahkan pigmen kulit. Ion-ion merkuri diduga menghambat sintesis melanin, pigmen hitam yang bertanggung jawab untuk penggelapan kulit (Giunta et al., 1983 dalam Amponsah, 2010).
kulit; khususnya di ginjal terutama menumpuk di wilayah tubular, sehingga menyebabkan terjadinya reaksi parah (Giunta et al., 1983 dalam Amponsah, 2010).
Merkuri yang diaplikasikan pada kulit akan bereaksi dengan sinar ultraviolet dan tereoksidasi, mengarah ke pigmentasi yang lebih banyak dan penuaan dini jika produk tersebut semakin banyak yang digunakan untuk mengatasi munculnya noda gelap (Olumide et al., 2008).
Pada orang berkulit hitam, pigmentasi adalah perlindungan alami kulit dari matahari. Setelah kulit diputihkan, ia kehilangan pelindung alaminya, sehingga rentan terhadap kerusakan oleh sinar matahari. Inilah alasan mengapa banyak produk pemutih mengandung tabir surya atau berisi petunjuk yang menyarankan orang untuk menggunakan krim pelindung sinar matahari (sun protection creams) bersama dengan produk tersebut. Dengan menghambat produksi melanin, kulit lebih rentan terhadap kanker kulit (Giunta et al., 1983 dalam Amponsah, 2010).
Orang-orang yang menggunakan produk pemutih dapat berakhir dengan kulit kasar dan bernoda, dan kemudian terjebak dalam "perangkap pemutih" dengan menggunakan lebih banyak krim untuk mencoba mengatasi masalah tersebut, dan dengan demikian, mereka sendiri yang menyebabkan semakin rusaknya kulit mereka. Atau mereka mungkin menemukan bahwa karena paparan sinar matahari, kulit mereka yang telah putih menjadi lebih gelap (Giunta et al., 1983 dalam Amponsah, 2010).
2.4.7 Metode Analisis Merkuri
Sejumlah metode telah digunakan untuk menentukan kadar merkuri dalam sampel biologis dan lingkungan. Metode yang paling umum atau sering digunakan yaitu spektrometri serapan atom (SSA), spektrometri fluoresensi atom (SFA), atau analisis aktivasi neutron (AAN). Selain itu, metode berdasarkan spektrometri massa (MS), spektrofotometri, kromatografi gas dan anodic stripping voltammetry (ASV) juga telah diuji (Amponsah, 2010).
(Inductively Coupled Plasma Mass Spectrometry), ICP-AES (Inductively Coupled Plasma Atomic Emission Spectrometry), GC-AAS (Gas Chromatography Atomic Absorption Spectrometry) , CV-AAS (Cold Vapor Atomic Absorption Spectrometry), AFS (Atomic Fluorescence Spectrometry), dan ASV (Anodic Stripping Voltammetry) (Kristianingrum, 2009).
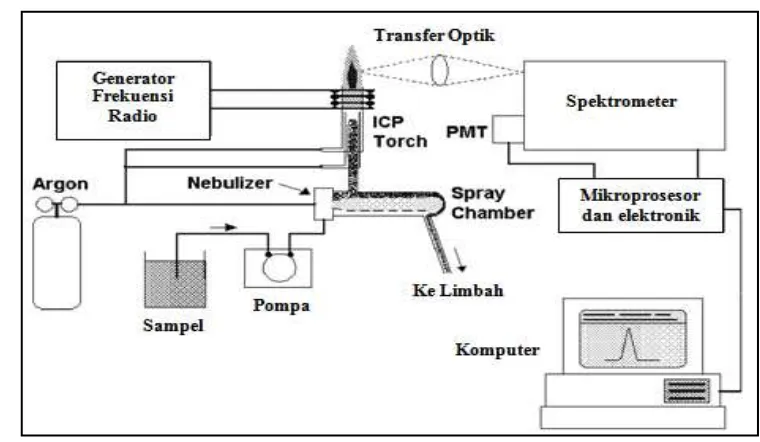
2.5 Inductively Coupled Plasma-Optical Emission Spectrometry (ICP-OES)
ICP-OES merupakan perangkat canggih untuk penentuan logam dalam berbagai matriks sampel yang berbeda. ICP dikembangkan untuk spektrometri emisi optik oleh Fassel et al. di Iowa State University, Amerika Serikat dan oleh Greenfield et al. di Albright & Wilson, Ltd, Inggris pada pertengahan 1960-an. Instrumen ICP-OES yang tersedia secara komersial pertama kali diperkenalkan pada tahun 1974 (Hou & Jones, 2000).
2.5.1 Prinsip Kerja
Total jumlah foton berbanding lurus dengan konsentrasi unsur dalam sampel (Hou & Jones, 2000).
Pada ICP-OES, gas argon diarahkan melalui torch yang terdiri atas tiga tabung konsentris yang terbuat dari kuarsa atau beberapa bahan lain yang sesuai. Sebuah kumparan tembaga, yang disebut load coil, mengelilingi ujung atas torch dan terhubung ke generator frekuensi radio (radio frequency, RF). Bila daya RF diterapkan pada load coil, arus bolak-balik bergerak di dalam kumparan, atau berosilasi, pada tingkat yang sesuai dengan frekuensi generator. Osilasi RF dari arus dalam kumparan ini menyebabkan terbentuknya medan listrik dan medan magnet RF di bagian atas torch. Dengan gas argon yang berputar melalui torch, bunga api yang diterapkan pada gas menyebabkan beberapa elektron akan terlepas dari atom argonnya. Elektron ini kemudian terperangkap dan diakselerasi dalam medan magnet. Menambahkan energi pada elektron dengan menggunakan kumparan dengan cara ini dikenal sebagai inductive coupling. Elektron berenergi tinggi ini selanjutnya bertumbukan dengan atom argon lainnya, menyebabkan lepasnya lebih banyak elektron. Ionisasi tumbukan gas argon ini berlanjut dalam reaksi berantai, mengubah gas menjadi plasma yang terdiri atas atom argon, elektron, dan ion argon, membentuk apa yang dikenal sebagai inductively coupled plasma(ICP) discharge. ICP discharge tersebut kemudian dipertahankan dalam torch dan load coil selama energi RF masih terus ditransfer melalui proses inductive coupling (Boss & Fredeen, 1997).
harus dipromosikan ke tingkat energi yang lebih tinggi melalui proses eksitasi (Boss & Fredeen, 1997).
Keterangan :
A : Gas argon berputar melalui torch. B : Daya RF diterapkan pada load coil.
C : Sebuah percikan bunga api menghasilkan beberapa elektron bebas dalam argon tersebut.
D : Elektron bebas diakselerasi oleh medan RF menyebabkan ionisasi lebih lanjut dan membentuk plasma.
E : Aliran nebulizer pembawa aerosol sampel menghasilkan lubang dalam plasma.
Gambar 2.2 Penampang Sebuah Torch dan Load Coil ICP yang
Menggambarkan Urutan Penyalaan
[Sumber : Boss & Fredeen, 1997]
2.5.2 Instrumentasi
Gambar 2.3 Komponen Utama dan Susunan Instrumen ICP-OES
a. Nebulizer
Nebulizer adalah alat yang mengubah cairan menjadi aerosol yang dapat dibawa ke plasma. Banyak gaya yang dapat digunakan untuk memecah cairan menjadi aerosol; namun, hanya dua yang berhasil digunakan dengan ICP, gaya pneumatik dan gaya mekanik ultrasonik. Kebanyakan nebulizer ICP komersial adalah dari jenis pneumatik. Nebulizer ini menggunakan aliran gas berkecepatan tinggi untuk membuat aerosol (Boss & Fredeen, 1997).
Gambar 2.4 Beberapa Contoh Nebulizer yang Digunakan untuk ICP-OES
[Sumber : Boss & Fredeen, 1997]
b. Pompa
Gambar 2.5 Pompa Peristaltik yang Digunakan untuk ICP-OES
[Sumber : Boss & Fredeen, 1997]
c. Spray Chamber
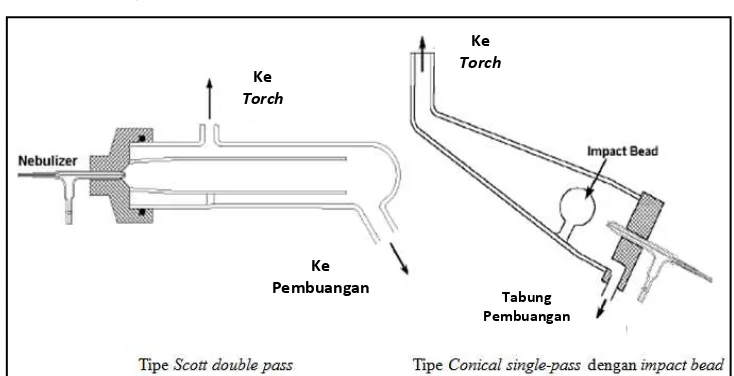
Spray chamber ditempatkan diantara nebulizer dan torch. Fungsi utama dari spray chamber adalah menghilangkan tetesan besar dari aerosol. Fungsi kedua dari spray chamber adalah untuk melancarkan pulse yang terjadi selama nebulisasi yang sering disebabkan oleh pemompaan larutan. Secara umum, spray chamber ICP dirancang untuk memungkinkan tetesan dengan diameter sekitar 10 mm atau lebih kecil lolos ke plasma (Boss & Fredeen, 1997).
Gambar 2.6 Spray Chamber yang Digunakan untuk ICP-OES
[Sumber : Boss & Fredeen, 1997]
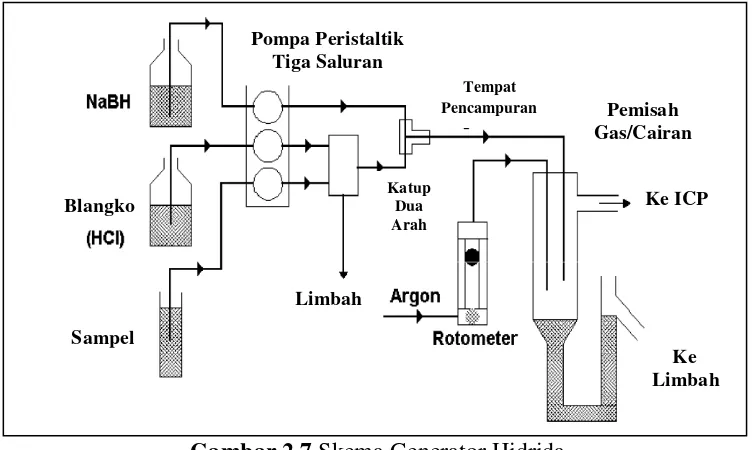
Beberapa alternatif untuk nebulizer dan spray chambers telah digunakan sebagai sistem penghantar sampel untuk ICP-OES. Teknik alternatif yang paling banyak digunakan adalah hydride generation
Dari wadah sampel
Ke nebulizer
Ke Torch
Ke Torch
Ke
Pembuangan Tabung
(generasi hidrida). Dengan teknik ini, sampel, dalam asam encer, dicampur dengan zat pereduksi, biasanya larutan natrium borohidrida dalam natrium hidroksida encer. Reaksi natrium borohidrida dengan asam menghasilkan atom hidrogen. Atom hidrogen kemudian bereaksi dengan Hg, Sb, As, Bi, Ge, Pb, Se, Te, dan Sn dalam larutan untuk membentuk hidrida stabil dari unsur-unsur tersebut. Senyawa gas ini kemudian dipisahkan dari sisa campuran reaksi dan dibawa ke plasma (Boss & Fredeen, 1997).
Gambar 2.7 Skema Generator Hidrida
[Sumber : Boss & Fredeen, 1997]
Perbaikan dalam batas deteksi dengan faktor hingga 1000 untuk unsur-unsur yang tercantum di atas telah dicapai dengan menggunakan generasi hidrida. Alasan kemajuan besar dalam sensitivitas untuk unsur ini adalah tingkat penghantaran sampel untuk generator hidrida seringkali sebanyak sepuluh kali tingkat dibandingkan nebulizer pneumatik, dan efisiensi dengan hidrida yang mudah menguap yang dihantarkan ke plasma mendekati 100%, dibandingkan dengan efisiensi 1 - 5% bila menggunakan nebulizer pneumatik dan spray chamber (Boss & Fredeen, 1997).
d. Torch
Torch teridiri atas tiga tabung konsentris untuk aliran argon dan injeksi aerosol. Jarak antara dua tabung luar dipertahankan sempit sehingga gas yang dihantarkan diantaranya mengalir dengan kecepatan tinggi. Salah
Untuk ICP argon, aliran gas luar biasanya sekitar 7-15 L/menit. Ruang antara aliran luar dan aliran dalam menghantarkan gas langsung di bawah toroid plasma. Dalam operasi normal torch, aliran ini, sebelumnya disebut aliran tambahan tapi sekarang disebut aliran gas menengah, sekitar 1,0 L/menit. Aliran menengah biasanya digunakan untuk mengurangi pembentukan karbon pada ujung tabung injektor ketika sampel organik sedang dianalisis. Namun, hal tersebut juga dapat meningkatkan kinerja dengan sampel air. Aliran gas yang membawa aerosol sampel diinjeksikan ke plasma melalui tabung atau injektor pusat. Karena diameter di ujung injektor kecil, kecepatan gas argon 1 L/menit yang digunakan untuk nebulisasi dapat membentuk lubang melalui plasma (Boss & Fredeen, 1997).
Gambar 2.8Torch yang Digunakan untuk ICP-OES
[Sumber : Boss & Fredeen, 1997]
f. Generator Radio Frequency
Generator Radio Frequency (RF) adalah alat yang menyediakan daya untuk pembentukan dan pemeliharaan plasma discharge. Daya ini, biasanya berkisar antara 700-1500 watt, ditransfer ke gas plasma melalui load coil di sekitar bagian atas torch. Load coil, yang bertindak sebagai antena untuk mentransfer daya RF ke plasma, biasanya terbuat dari tabung tembaga dan didinginkan dengan air atau gas selama pengoperasian. Kebanyakan generator RF yang digunakan untuk ICP-OES beroperasi pada frekuensi antara 27 dan 56 MHz (Boss & Fredeen, 1997).
Celah Pengamatan
Load coil
Tabung Injektor Aliran
Nebulizer
g. Transfer Optik
Radiasi emisi dari daerah plasma yang dikenal sebagai zona analitis normal (NAZ) disampel untuk pengukuran spektrometri. Radiasi tersebut biasanya dikumpulkan oleh fokus optik seperti lensa cembung atau cermin cekung. Optik ini kemudian memfokuskan citra plasma ke celah masuk dari alat pendispersi panjang gelombang atau spektrometer (Boss & Fredeen, 1997).
h. Pendispersi Panjang Gelombang
Tahapan selanjutnya dalam ICP-OES adalah diferensiasi radiasi emisi suatu unsur dari radiasi yang dipancarkan oleh unsur dan molekul lainnya. Pemilihan emisi ini dapat dilakukan dengan beberapa cara. Dispersi panjang gelombang yang berbeda secara fisik dengan diffraction grating (kekisi difraksi) adalah yang paling umum. Perangkat lain yang kurang umum digunakan yaitu prisma, filter dan interferometer (Boss & Fredeen, 1997).
Kekisi difraksi refleksi adalah sebuah cermin dengan garis yang berjarak sangat dekat di permukaannya. Kebanyakan kekisi yang digunakan pada instrumen ICP-OES memiliki garis, atau alur, kepadatan 600-4200 garis per milimeter. Ketika cahaya mengenai kekisi tersebut, cahaya terdifraksi dengan sudut yang tergantung pada panjang gelombang cahaya dan kepadatan garis kekisi (Boss & Fredeen, 1997).
Gambar 2.9 Kekisi Difraksi Memisahkan Dua Panjang Gelombang Cahaya
[Sumber : Boss & Fredeen, 1997]
Untuk memisahkan cahaya polikromatik, kekisi digabungkan dalam instrumen optik yang disebut spektrometer. Spektrometer menerima cahaya
monokromatik. Satu atau lebih celah keluar pada bidang atau lingkaran keluar kemudian digunakan untuk memungkinkan panjang gelombang tertentu lolos ke detektor sambil menghalangi panjang gelombang yang lain (Boss & Fredeen, 1997).
Ketika beberapa celah keluar dan detektor digunakan dalam spektrometer yang sama, perangkat ini disebut polikromator. Setiap celah keluar di polikromator sejajar dengan garis emisi atom atau ion dari unsur tertentu yang memungkinkan analisis multiunsur secara bersamaan. Di sisi lain, sebuah monokromator biasanya hanya menggunakan satu celah keluar dan detektor. Monokromator digunakan dalam analisis multiunsur dengan pemindaian secara cepat, atau slewing, dari satu garis emisi ke garis emisi yang lain. Hal ini dapat dilakukan dengan mengubah sudut difraksi kisi dengan cara memutarnya atau dengan memindahkan detektor di bidang keluar dari monokromator dan membiarkan kisi berada pada posisi tetap (Boss & Fredeen, 1997).
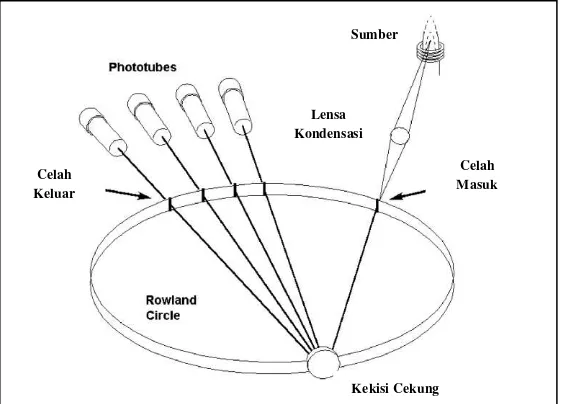
Gambar 2.10Polikromator Rowland Circle
[Sumber : Boss & Fredeen, 1997]
Celah Masuk Celah
Keluar
Lensa Kondensasi
Sumber
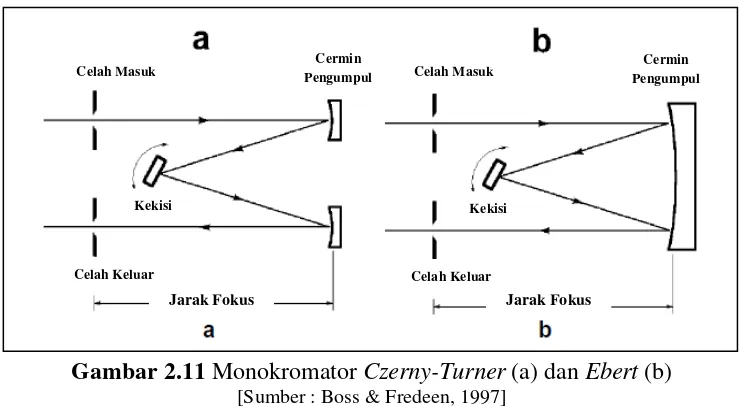
Gambar 2.11 Monokromator Czerny-Turner (a) dan Ebert (b)
[Sumber : Boss & Fredeen, 1997]
i. Detektor
Setelah garis emisi yang tepat diisolasi oleh spektrometer, detektor dan elektronik yang terkait digunakan untuk mengukur intensitas garis emisi. Sejauh ini detektor yang paling banyak digunakan untuk ICP-OES adalah tabung photomultiplier atau PMT. PMT adalah tabung vakum yang berisi bahan fotosensitif yang disebut photocathode, yang melepaskan elektron ketika terkena cahaya. Elektron yang dilepaskan dipercepat menuju dynode yang melepaskan 2-5 elektron sekunder untuk setiap satu elektron yang mengenai permukaannya. Elektron sekunder tersebut mengenai dynode yang lain, sehingga melepaskan lebih banyak lagi elektron yang mengenai dynode lainnya, menyebabkan efek penggandaan di sepanjang perjalanannya. PMT biasanya memiliki 9 sampai 16 tahap dynode. Tahap terakhir adalah pengumpulan elektron sekunder dari dynode terakhir dengan menggunakan anoda. Sebanyak 106 elektron sekunder dapat dikumpulkan sebagai hasil dari foton tunggal yang mengenai photocathode PMT yang memiliki sembilan dynode. Arus listrik yang dihasilkan diukur pada anoda kemudian digunakan sebagai ukuran relatif dari intensitas radiasi yang mencapai PMT (Boss & Fredeen, 1997).
Celah Masuk Celah Masuk
Celah Keluar Celah Keluar
Kekisi Kekisi
Cermin Pengumpul
Cermin Pengumpul
Gambar 2.12 Tata Letak Photocathode, Dynode dan Anoda pada Sebuah Tabung Photomultiplier
[Sumber : Boss & Fredeen, 1997]
j. Komputer dan Prosesor
Setiap instrumen ICP-OES komersial yang tersedia saat ini menggunakan beberapa jenis komputer untuk mengendalikan spektrometer dan untuk mengumpulkan, memanipulasi, dan melaporkan data analitis (Boss & Fredeen, 1997).
2.5.3 Analisis Kualitatif dan Kuantitatif dengan ICP-OES
Untuk mendapatkan informasi kualitatif, yaitu unsur apa yang terdapat dalam sampel, melibatkan identifikasi adanya emisi pada panjang gelombang khas dari unsur yang dituju. Secara umum, setidaknya tiga garis spektrum dari unsur yang diperiksa untuk memastikan bahwa emisi yang diamati memang benar merupakan milik unsur yang dituju. Terkadang gangguan garis spektral dari unsur lain mungkin membuat suatu ketidakpastian tentang adanya unsur dalam plasma. Untungnya, dari sejumlah besar garis emisi yang tersedia untuk sebagian besar unsur memperbolehkan salah satu garis emisi yang dapat mengatasi gangguan tersebut dengan cara memilih diantara beberapa garis emisi yang berbeda untuk unsur yang dituju (Boss & Fredeen, 1997).
Elektron Sekunder
Anoda
Untuk mendapatkan informasi kuantitatif, yaitu, seberapa banyak suatu unsur terdapat dalam sampel, dapat dicapai dengan menggunakan plot intensitas emisi terhadap konsentrasi yang disebut kurva kalibrasi. Larutan dengan konsentrasi analit yang diketahui, disebut larutan standar, dimasukkan ke dalam ICP dan intensitas emisi khas untuk setiap unsur, atau analit, diukur. Intensitas ini kemudian dapat diplot terhadap konsentrasi standar untuk membentuk kurva kalibrasi bagi setiap unsur. Ketika intensitas emisi dari analit diukur, intensitas diperiksa terhadap kurva kalibrasi unsur tersebut untuk menentukan konsentrasi sesuai dengan intensitasnya (Boss & Fredeen, 1997).
2.5.4 Kelebihan dan Kekurangan
Dibandingkan dengan teknik lain, ICP-OES memiliki suhu atomisasi yang lebih tinggi, lingkungan yang lebih inert, dan kemampuan alami untuk penentuan hingga 70 elemen secara bersamaan. Hal ini membuat ICP lebih tahan terhadap gangguan matriks, dan lebih mampu untuk mengoreksinya ketika terjadi gangguan matriks. ICP-OES menyediakan batas deteksi serendah, atau lebih rendah dari pesaing terbaiknya, GFAAS. Selain itu, ICP tidak menggunakan elektroda, sehingga tidak ada kontaminasi dari pengotor yang berasal dari bahan elektroda. ICP juga relatif lebih mudah dalam perakitannya dan murah, dibandingkan dengan beberapa sumber lain, seperti LIP (laser-induced plasma). Berikut ini adalah beberapa sifat yang paling menguntungkan dari sumber ICP (Hou & Bradley, 2000):
a. Suhu tinggi (7000-8000 K).
b. Kerapatan elektron tinggi (1014 -1016 cm3).
c. Derajat ionisasi yang cukup besar untuk banyak unsur.
d. Kemampuan analisa multiunsur secar bersamaan (lebih dari 70 unsur termasuk P dan S).
e. Emisi backgroud (latar belakang) rendah, dan gangguan kimia yang relatif rendah.
g. Batas deteksi yang sangat baik untuk sebagian besar unsur (0,1- 100 ng/mL).
h. Linear dynamic range (LDR) yang lebar (4-6 kali lipat). i. Dapat diterapkan untuk unsur-unsur refraktori.
j. Analisis dengan biaya efektif.
Tabel 2.3 Kelebihan dan Kekurangan Teknik-Teknik Analisis Unsur
Teknik Kelebihan Kekurangan
AAS (Atomic Absorption Spectrometry)
Batas deteksi rendah Beberapa unsur, membutuhkan waktu
lama, efek matriks NAA (Neutron
Activation Analysis)
Batas deteksi rendah Beberapa unsur, membutuhkan
2.6.1 Metode Destruksi Basah
Destruksi basah adalah perombakan sampel dengan asam-asam kuat baik tunggal maupun campuran, kemudian dioksidasi dengan menggunakan zat oksidator. Pelarut-pelarut yang dapat digunakan untuk destruksi basah antara lain asam nitrat, asam sulfat, asam perklorat, dan asam klorida. Kesemua pelarut tersebut dapat digunakan baik tunggal maupun campuran. Kesempurnaan destruksi ditandai dengan diperolehnya larutan jernih pada larutan destruksi, yang menunjukkan bahwa semua konstituen yang ada telah larut sempurna atau perombakan senyawa-senyawa organik telah berjalan dengan baik. Senyawa-senyawa garam yang terbentuk setelah destruksi merupakan senyawa garam yang stabil dan disimpan selama beberapa hari (Raimon, 1993).
2.6.2 Metode Destruksi Kering
Destruksi kering merupakan perombakan organik logam di dalam sampel menjadi logam-logam anorganik dengan jalan pengabuan sampel dalam muffle furnace dan memerlukan suhu pemanasan tertentu. Pada umumnya dalam destruksi kering ini dibutuhkan suhu pemanasan antara 400-800oC, tetapi suhu ini sangat tergantung pada jenis sampel yang akan dianalisis. Untuk menentukan suhu pengabuan dengan sistem ini terlebih dahulu ditinjau jenis logam yang akan dianalisis. Bila oksida-oksida logam yang terbentuk bersifat kurang stabil, maka perlakuan ini tidak memberikan hasil yang baik. Untuk logam Fe, Cu, dan Zn oksidanya yang terbentuk adalah Fe2O3, FeO, CuO, dan ZnO. Semua oksida logam ini cukup stabil
2.7 Teknik Sampling
2.7.1 Definisi Populasi, Sampel, dan Sampling
Populasi adalah keseluruhan objek yang akan/ingin diteliti. Anggota populasi dapat berupa benda hidup maupun benda mati, dimana sifat-sifat yang ada padanya dapat diukur atau diamati (Nasution, 2003).
Sampel adalah bagian dari populasi yang menjadi objek penelitian (sampel sendiri secara harfiah berarti contoh) (Nasution, 2003).
Sampling adalah proses pengambilan atau memilih n buah elemen/objek/unsur dari populasi yang berukuran N (Setiawan, 2005).
2.7.2 Tipe Sampling Menurut Peluang Pemilihannya
a. Sampling Non-Probabilitas
Pada saat melakukan pemilihan satuan sampling tidak dilibatkan unsur peluang, sehingga tidak diketahui besarnya peluang sesuatu unit sampling terpilih ke dalam sampel. Sampling tipe ini tidak boleh dipakai untuk menggeneralisasi hasil penelitian terhadap populasi, karena dalam penarikan sampel sama sekali tidak ada unsur probabilitas (Setiawan, 2005).
Termasuk sampling non-probabilitas antara lain (Setiawan, 2005): a) Haphazard Sampling : Satuan sampling dipilih sembarangan atau
seadanya, tanpa perhitungan apapun tentang derajat kerepresentatipannya.
b) Snowball Sampling : Satuan sampling dipilih atau ditentukan berdasarkan informasi dari responden sebelumnya.
c) Purposive Sampling : Disebut juga Judgment Sampling. Satuan sampling dipilih berdasarkan pertimbangan tertentu dengan tujuan untuk memperoleh satuan sampling yang memiliki karakteristik yang dikehendaki.
b. Sampling Probabilitas
terhadap populasi walaupun data yang didapat hanya berasal dari sampel (Setiawan, 2005).
Termasuk sampling probabilitas antara lain (Setiawan, 2005):
a) Simple Random Sampling : Satuan sampling dipilih secara acak. Peluang untuk terpilih harus diketahui besarnya, dan untuk tiap satuan sampling besarnya harus sama.
b) Stratified Random Sampling : Populasi dibagi ke dalam sub populasi (strata), dengan tujuan membentuk sub populasi yang didalamnya membentuk satuan-satuan sampling yang memiliki nilai variabel yang tidak terlalu bervariasi (relatif homogen). Selanjutnya dari setiap stratum dipilih sampel melalui proses simple random sampling. c) Cluster Random Sampling : Populasi dibagi ke dalam satuan-satuan
sampling yang besar, disebut Cluster. Berbeda dengan pembentukan strata, satuan sampling yang ada dalam tiap kluster harus relatif heterogen. Pemilihan dilakukan beberapa tingkat.
2.8 Validasi Metode Analisis
Validasi metoda analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis yaitu : kecermatan (accuracy), keseksamaan (precision), selektivitas (spesifisitas), linearitas dan rentang, batas deteksi dan batas kuantitasi, ketangguhan metode (ruggedness), serta kekuatan (robustness) (Harmita, 2004).
2.8.1 Kecermatan (Akurasi)
Dalam metode simulasi, sejumlah analit bahan murni (senyawa pembanding kimia CRM atau SRM) ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya). Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel dicampur dan dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan). Dalam kedua metode tersebut, persen peroleh kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya (Harmita, 2004).
Persen Perolehan Kembali dapat ditentukan dengan cara membuat sampel plasebo (eksepien obat, cairan biologis) kemudian ditambah analit dengan konsentrasi tertentu (biasanya 80% sampai 120% dari kadar analit yang diperkirakan), kemudian dianalisis dengan metode yang akan divalidasi. Tetapi bila tidak memungkinkan membuat sampel plasebo karena matriksnya tidak diketahui seperti obat-obatan paten, atau karena analitnya berupa suatu senyawa endogen misalnya metabolit sekunder pada kultur kalus, maka dapat dipakai metode adisi (Harmita, 2004).
Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
Perhitungan perolehan kembali dapat ditetapkan dengan rumus sebagai berikut (Harmita, 2004):
Persen Perolehan Kembali = %
Keterangan :
CF = Konsentrasi total sampel yang diperoleh dari pengukuran
CA = Konsentrasi sampel sebenarnya
Tabel 2.4 Rentang Kesalahan yang Diijinkan pada Setiap Konsentrasi Analit pada Matriks
Analit pada matrik sampel (%) Rata-rata yang diperoleh (%)
100
Akan tetapi kriteria ini sangat fleksibel tergantung pada konsentrasi analit yang diperiksa, jumlah sampel, dan kondisi laboratorium (Harmita, 2004).
Keseksamaan dapat dihitung dengan cara sebagai berikut:
1. Hasil analisis adalah x1, x2, x3, x4, ... xn maka simpangan bakunya
adalah :
SD = ∑(x−x)² n−1
Keterangan :
x = Nilai dari masing-masing pengukuran
x = Rata-rata (mean) dari pengukuran n = Frekuensi penentuan
2. Simpangan baku relatif atau koefisien variasi (KV) adalah : KV = SD x 100%
Percobaan keseksamaan dilakukan terhadap paling sedikit enam replika sampel yang diambil dari campuran sampel dengan matriks yang homogen. Sebaiknya keseksamaan ditentukan terhadap sampel sebenarnya yaitu berupa campuran dengan bahan pembawa sediaan farmasi (plasebo) untuk melihat pengaruh matriks pembawa terhadap keseksamaan ini. Demikian juga harus disiapkan sampel untuk menganalisis pengaruh pengotor dan hasil degradasi terhadap keseksamaan ini (Harmita, 2004).
2.8.3 Linearitas
Dalam praktek, digunakan satu seri larutan yang berbeda konsentrasinya antara 50 – 150% kadar analit dalam sampel. Di dalam pustaka, sering ditemukan rentang konsentrasi yang digunakan antara 0 – 200% (Harmita, 2004).
Sebagai parameter adanya hubungan linier digunakan koefisien korelasi r pada analisis regresi linier Y = a + bX. Hubungan linier yang ideal dicapai jika nilai b = 0 dan r = +1 atau –1 bergantung pada arah garis. Sedangkan nilai a menunjukkan kepekaan analisis terutama instrumen yang digunakan. Dengan menggunakan kalkulator atau perangkat lunak komputer, semua perhitungan matematik tersebut dapat diukur (Harmita, 2004).
2.8.4 Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blangko. Batas deteksi merupakan parameter uji batas. Batas kuantitasi merupakan parameter pada analisis renik dan diartikan sebagai kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Batas deteksi dan kuantitasi dapat dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi. Nilai pengukuran akan sama dengan nilai b pada persamaan garis linier y = a + bx, sedangkan simpangan baku blanko sama dengan simpangan baku residual (Sy/x) (Harmita, 2004).
LOD = 3Sy x
Sl
LOQ = 10Sy x
Sl
Sy x= ∑(Y−Yi)² n−2
Keterangan :
Sy/x = Simpangan Baku Residual
Sl = Slope (b pada persamaan garis y = a+bx) Y = Intensitas yang terbaca
3.1 Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kesehatan Daerah Provinsi DKI Jakarta yang berlangsung sejak bulan Maret hingga Oktober 2015.
3.2 Alat dan Bahan Penelitian
3.2.1 Alat Penelitian
Seperangkat alat ICP-OES (Thermo, iCAP 7000 Series), seperangkat alat refluks, batu didih (Merck), peralatan gelas (untuk laboratorium), mikropipet beserta tip, pipet volumetrik, pipet tetes, kertas saring Whatman No.42, spatula, batang pengaduk, timbangan analitik (Sartorius), pH meter (Thermo), lemari asam, lemari pendingin.
3.2.2 Bahan Penelitian
Larutan standar merkuri (Hg) 1000 mg/L (Merck), larutan HNO3 p
(Merck), larutan H2SO4 p (Merck), larutan H2O2 (Merck), larutan HCl p
(Merck), SnCl2 (Merck), sediaan kosmetik krim sarang burung walet
merek A dan B, air demineralisasi (aquadem), larutan dapar pH 4 dan pH 10.
3.3 Prosedur Penelitian
3.3.1 Perolehan Sampel
3.3.2 Pemeriksaan Organoleptis dan Pengukuran pH
3.3.2.1 Pemeriksaan Organoleptis
Pemeriksaan organoleptis yang dilakukan meliputi pemeriksaan tekstur, warna, dan bau sediaan sampel.
3.3.2.2 Pengukuran pH
Pengukuran pH dilakukan dengan menggunakan alat pH meter. Alat tersebut dikalibrasi terlebih dahulu sebelum digunakan. Kalibrasi dilakukan dengan menggunakan larutan dapar pH 4 dan pH 10. Pemeriksaan pH dilakukan dengan mencelupkan elektroda ke dalam 1 gram sediaan krim yang diencerkan dengan air suling hingga 10 ml (DepKes RI, 1985).
3.3.3 Pembuatan Larutan Standar dan Pereaksi
Pembuatan larutan HCl : aquadem (1:1) sebanyak 1000 mL dilakukan dengan mencampurkan 500 mL HCl p dan 500 mL aquadem dalam labu ukur 1000 mL. Setelah itu larutan dikocok sampai homogen.
Pembuatan larutan standar merkuri 1 mg/L dilakukan dengan mengambil sebanyak 50 µL larutan standar merkuri 1000 mg/L ke dalam labu ukur 50 mL, ditambahkan sebanyak 5 mL (10%) campuran HCl : aquadem (1:1), dicukupkan volumenya dengan aquadem sampai tanda batas, kemudian dikocok sampai homogen.
Larutan SnCl2 2% (b/v) dalam HCl 4% (v/v) dibuat dengan
menimbang sebanyak 20 g SnCl2 lalu dipindahkan ke dalam beaker glass
500 mL. Setelah itu ditambahkan 40 mL HCl dan 250 mL aquadem lalu diaduk hingga warna larutan bening. Kemudian dipindahkan ke labu ukur 1000 mL, dicukupkan volumenya dengan aquadem sampai tanda batas dan dikocok sampai homogen.
3.3.4 Pemilihan Panjang Gelombang
volumenya dengan aquadem sampai tanda batas, kemudian dikocok sampai homogen sehingga didapat larutan standar merkuri dengan konsentrasi 1 μg/L, 5 μg/L, 15 μg/L, dan 20 μg/L. Masing-masing larutan standar merkuri dipindahkan ke wadah sampel untuk diinjeksikan ke alat ICP-OES. Disiapkan juga larutan SnCl2 2% dan HCl : aquadem
(1:1). Larutan standar merkuri, SnCl2 2%, dan HCl : aquadem (1:1)
diinjeksikan ke alat ICP-OES dalam waktu yang sama. Larutan standar merkuri 1 μg/L dan 5 ppb digunakan untuk mengamati intensitas larutan merkuri pada panjang gelombang 184,950 nm dan 194,227 nm. Selanjutnya larutan standar merkuri 15 ppb dan 20 ppb digunakan untuk mengamati intensitas larutan merkuri pada panjang gelombang 194,227 nm dan 253,652 nm. Panjang gelombang untuk analisis merkuri dengan ICP-OES dipilih berdasarkan garis emisi (panjang gelombang) yang paling sensitif.
3.3.5 Pembuatan Kurva Kalibrasi
Diambil sebanyak 0 μL, 50 μL, 250 μL; 500 μL, 750 μL, dan 1000
μL dari larutan standar merkuri 1 mg/L ke dalam 6 labu ukur 50 mL, ditambahkan sebanyak 5 mL (10%) campuran HCl : aquadem (1:1), dicukupkan volumenya dengan aquadem sampai tanda batas, kemudian dikocok sampai homogen sehingga didapat larutan standar merkuri dengan konsentrasi 0 μg/L, 1 μg/L, 5 μg/L, 10 μg/L, 15 μg/L, dan 20
μg/L. Masing-masing larutan standar merkuri dipindahkan ke wadah sampel untuk diinjeksikan ke alat ICP-OES. Disiapkan juga larutan SnCl2 2% dan HCl : aquadem (1:1). Larutan standar merkuri, SnCl2 2%
3.3.6 Validasi Metode
3.3.6.1 Uji Linearitas
Uji ini dilakukan setelah pembuatan kurva kalibrasi standar merkuri dan didapatkan persamaan garis regresi. Selanjutnya, koefisien korelasi (r) dihitung dari analisis regresi linier y = a + bx pada kurva kalibrasi (ICH Guideline, 2005; Harmita, 2004).
Keterangan :
y = Intensitas yang terbaca
a = Tetapan regresi dan disebut juga dengan intersep
b = Koefisien regresi (juga menyatakan slope = kemiringan) x = Konsentrasi
3.3.6.2 Penentuan Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Sama seperti pada uji linearitas, penentuan LOD dan LOQ juga dilakukan setelah pembuatan kurva kalibrasi standar merkuri dan didapatkan persamaan garis regresi. Selanjutnya, LOD dan LOQ dihitung secara statistik melalui garis regresi linier dari kurva kalibrasi berdasarkan rumus (ICH Guideline, 2005; Harmita, 2004):
LOD = 3Sy x
Sl
LOQ = 10Sy x
Sl
Sy x = ∑(y−yi)² n−2
Keterangan :
LOD = Batas Deteksi LOQ = Batas Kuantitasi
Sy/x = Simpangan Baku Residual
Sl = Slope (b pada persamaan garis y = a+bx) y = Intensitas yang terbaca
![Gambar 2.1 Morfologi Sarang Walet [Sumber : Panduan Lengkap Walet, 2011]](https://thumb-ap.123doks.com/thumbv2/123dok/1079625.753442/27.595.143.511.330.686/gambar-morfologi-sarang-walet-sumber-panduan-lengkap-walet.webp)
![Gambar 2.4 Beberapa Contoh Nebulizer yang Digunakan untuk ICP-OES [Sumber : Boss & Fredeen, 1997]](https://thumb-ap.123doks.com/thumbv2/123dok/1079625.753442/37.595.148.502.241.498/gambar-beberapa-contoh-nebulizer-digunakan-untuk-sumber-fredeen.webp)
![Gambar 2.8 Torch yang Digunakan untuk ICP-OES [Sumber : Boss & Fredeen, 1997]](https://thumb-ap.123doks.com/thumbv2/123dok/1079625.753442/40.595.154.495.322.502/gambar-torch-yang-digunakan-untuk-sumber-boss-fredeen.webp)
![Gambar 2.9 Kekisi Difraksi Memisahkan Dua Panjang Gelombang Cahaya [Sumber : Boss & Fredeen, 1997]](https://thumb-ap.123doks.com/thumbv2/123dok/1079625.753442/41.595.185.468.512.658/gambar-kekisi-difraksi-memisahkan-panjang-gelombang-cahaya-fredeen.webp)