EFEK PEMBERIAN EKSTRAK SARANG BURUNG
WALET (Collocalia fuciphaga) TERHADAP
AKTIVITAS ENZIM KATALASE JANTUNG TIKUS
Sprague dawley
Laporan Penelitian ini ditulis sebagai salah satu syarat untuk memperoleh gelar SARJANA KEDOKTERAN
OLEH :
Afdalia Rani Nasution
NIM: 11151030000072
PROGRAM STUDI KEDOKTERAN
FAKULTAS KEDOKTERAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
Dengan ini saya menyatakan bahwa:
1.
Laporan penelitian ini merupakan hasil karya saya sendiri yang diajukanuntuk memenuhi salah satu persyaratan memperoleh gelar Sarjana Kedokteran di UIN Syarif Hidayatullah Jakarta.
2.
Semua sumber yang saya gunakan dalam penulisanini
telah sayacantumkan sesuati dengan ketentuan yang berlaku
di
UIN
SyarifHidayatullah Jakarta.
3.
Jika dikemudian hari terbukti bahwa karya ini bukan karya asli saya atau merupakan hasil jiplakan dari karya orang lain, maka saya bersedia menerima sanksi yang berlaku di UIN Syarif Hidayatullah Jakarta.EFEK PEMBERIAN EKSTRAK SARANG BURUNG WALET (Collocalia
fuciphaga) TERHADAP
AKTI\ITAS
ENZIM KATALASE JANTUNGTIKUS Sprague dawley
Laporan Penelitian
Diajukan kepada Program Studi Pendidikan Dokter, Fakultas Kedokteran untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran (S.Ked)
Oieh
Afdalia Rani Nasution
NIM:11151030000072
Rr. Ayu Fitri i, S.Si., M.Biomed
NtP . 1 g 7 20 4 o 620 OZ t ZZ]LOO S
PROGRAM
STUDI
KEDOKTERAN
FAKULTAS KEDOKTERAN
UNIVERSITAS
ISLAM
NEGERI SYARIF
HIDAYATULLAH
\
JAKARTA
1440Ht20t8iM
111 Dr- Endah NrP. 1971 1009200s0i2005BURUNG WALET (Collocalia fuciphaga) TENHADAP
AKTMTAS
ENZIM KATALASE JANTUNG TIKUS .9pragz e dawley yang diajukan oleh AfdaliaRani Nasution (NIM: 11151030000072), telah diujikan dalam sidang di Fakultas Kedokteran pada 02 November 2018. Laporan penelitian ini telah diterima sebagai salah satu syarat memperoleh gelar Saq'ana Kedokteran (S.Ked) pada Program Studi Kedokteran. Ciputat, 02 November 2018 DEWAN PENGUJI NIP. 1 971 10092005012005 Dr- Endah NIP. 19711 92005012005 Penguji
I
l)
<Alt"
U
Dr. Zeti Harriyati, S.Si, M.Biomed
NIP.-FK UIN
., Sp.PD-KEMD
andari, S.Si., .Biomed Rr. Ayu Fitri
NIP. 1 dr. NrP. 197 21 1032006041 00 1 PIMPINAN FAKULTAS Penguji
II
, Ph. D,Kaprodi Kedokteran FK UIN
dr. Achmad Zaki, M.Epid, Sp.OT
NiP. 19780507200s01 1 00s 121003
1V
Dr. Endah S.Si, M.Biomed
v
KATA PENGANTAR
Assalamualaikum wr wb,
Puji syukur penulis panjatkan ke hadirat Allah swt, karena berkat rahmat dan karunia-Nya penelitian yang berjudul “EFEK PEMBERIAN EKSTRAK SARANG BURUNG WALET (Collocalia fuciphaga thunberg) TERHADAP KADAR ENZIM KATALASE JANTUNG PADA TIKUS Sprague dawley” ini dapat terselesaikan oleh penulis.
Dalam proses penelitian ini, penulis mendapatkan bantuan, bimbingan, motivasi, dan inspirasi dari beberapa pihak. Maka, penulis mengucapkan terimakasih kepada:
1. dr. Hari Hendarto, Ph.D., Sp.PD-KEMD, selaku Dekan Fakultas Kedokteran Universitas Islam Negeri Syarif Hidayatullah Jakarta.
2. dr. Achmad Zaki,M.Epid., Sp.OT, selaku Ketua Program Studi Kedokteran dan Profesi Dokter Preklinik, Fakultas Kedokteran Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3. Dr. Endah Wulandari, S.Si, M.Biomed dan Rr. Ayu Fitri Hapsari, S.Si, M.Biomed sebagai pembimbing penulis pada penelitian ini.
4. dr. Siti Nur Aisyah Jauharoh, Ph.D selaku pembimbing akademik penulis, yang selalu memberi semangat agar penulis menyelesaikan penelitian ini. 5. Kedua orang tua penulis tercinta, H. Rajali Nasution, SE., MM dan Hj.
Betriani Siregar, A.Md.Keb, karena memberi semangat dan motivasi pada penulis untuk menyelesaikan penelitian ini.
6. Laboran laboratorium FK UIN, yaitu Mbak Ayi, Mbak Din, Mbak Suryani, Mas Panji, Mas Rahmadi, dan Pak Mardi yang telah banyak membantu penulis dalam proses penelitian.
7. Teman-teman kelompok riset yaitu Shiella Fauzia, Ikrima Wulanuri, Latifa Syifa, dan Kharisna Afrida.
vi
8. Sahabat-sahabat saya yaitu Naura Andini Fadhila, Adita Hadining Putri, Hasna Aqilah, dan Megawati yang selalu memberi semangat kepada penulis. 9. Untuk Muhammad Huda Ardo (mahasiswa Farmasi angkatan 2011), selaku
pemilik tikus yang mengizinkan saya menggunakan tikus penelitiannya 10. Teman sejawat Amigdala FK UIN 2015 yang memberi dukungan dan
motivasi pada penelitian ini.
11. Teman-teman Official CIMSA UIN 2017/2018 yang memberi dukungan kepada penulis.
12. Member SCOPE CIMSA FK UIN angkatan 2015, 2016, dan 2017 yang telah memberi motivasi dalam penulisan penelitian ini.
13. Dan pihak lain yang tidak dapat penulis sebutkan satu persatu, terima kasih banyak atas dukungan dan motivasi yang telah diberikan kepada penulis.
Demikian kata pengantar dari penulis, dan tidak menutup kemungkinan bahwa penelitian ini masih belum sempurna. Kritik dan saran yang membangun penulis harapkan dari pembaca.
Wassalamualaikum, wr, wb
Jakarta, 02 November 2018
vii ABSTRAK
Afdalia Rani Nasution. Program Studi Kedokteran. Efek Pemberian Ekstrak Sarang Burung Walet (Collocalia fuciphaga) Terhadap Aktivitas Enzim Katalase Jantung Tikus Sprague dawley. 2018.
Latar Belakang : Burung walet merupakan hewan yang membuat sarang menggunakan air liurnya. Sarang burung wallet memiliki nutrisi berupa asam amino dan vitamin yang berfungsi sebagai antioksidan. Enzim katalase merupakan antioksidan endogen yang dapat menetralisir radikal bebas. Semakin tinggi kadar antioksidan maka aktivitas enzim katalase akan meningkat.
Metode : Tikus diberi ekstrak sarang burung walet dengan dosis berbeda (10,20,40 mg/kgBB p.o) selama 30 hari, diikuti induksi H2O2 1% dosis 1
mg/kgBB pada hari ke 31 dan 32. Tiap organ jantung diukur aktivitas enzim katalase menggunakan spektrofotometer.
Hasil : Aktivitas enzim katalase meningkat dengan pemberian ekstrak sarang burung wallet dosis rendah.
Kesimpulan : Pemberian ekstrak sarang burung wallet dosis 10 mg/kgBB dapat meningkatkan aktivitas enzim katalase jantung.
Kata kunci : Ekstrak sarang burung walet, enzim katalase, jantung, antioksidan.
ABSTRACT
Afdalia Rani Nasution. Medical Study Program. The Effect of Administration of Swiftlet’s Nest Extract (Collocalia fuciphaga) on the Activity of Catalase Enzyme in the Heart of Sprague dawley’s Mice. 2018. Introduction : Swiftlet is one of an animal that use their saliva to make their nest. Edible swiflet bird’s nest has some nutritional components such as amino acid and vitamin, which functionate as an antioxidant. Catalase enzyme is an endogenous antioxidant which can neutralize the free radical. The higher antioxidant levels, the higher catalase enzyme activity increasement.
Method : Mice were given edible swiftlet bird’s nest extract in a different doses (10, 20, 40 mg/kgBM orally) for 30 days, followed by induction of H2O2 1% in 1
mg/kgBM dose in the 31st and 32nd day. Each heart’s catalase enzyme activity measured using spectrophotometer.
Result : Catalase enzyme activity increased in the administration of low dose edible swiftlet bird’s nest extract.
Conclusion : The administration of edible swiftlet’s nest extract in dose of 10 mg/kgBM increase the activity of catalase enzyme in heart.
viii DAFTAR ISI
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN KEASLIAN KARYA ... ii
LEMBAR PERSETUJUAN PEMBIMBING ... iii
LEMBAR PENGESAHAN ... iv
KATA PENGANTAR ... v
ABSTRAK ... vii
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
DAFTAR SINGKATAN ... xiii
BAB I PENDAHULUAN 1.1. Latar Belakang ……….... 1 1.2. Rumusan Masalah ………... 2 1.3. Hipotesis Penelitian ………... 3 1.4. Tujuan Penelitian ………...…….. 3 1.4.1. Tujuan Umum ... 3 1.4.2. Tujuan Khusus ... 3 1.5. Manfaat Penelitian ……….………...………... 3 BAB II TINJAUAN PUSTAKA 2.1. Sarang Burung Walet ………...…... 4
2.1.1. Klasifikasi Burung Walet ………....….. 4
2.1.2. Morfologi Sarang Burung Walet ………. 5
2.1.3. Kandungan Sarang Burung Walet ……….………... 6
2.1.4. Manfaat Sarang Burung Walet ……... 8
2.2. Jantung Manusia………..………. 8
2.2.1. Anatomi Jantung .………. 9
2.2.2. Histologi Jantung...……….... 10
2.2.3. Fisiologi Jantung... 11
2.3. Jantung Tikus ... 12
2.3.1.Anatomi Jantung Tikus... 14
2.3.2. Histologi Jantung Tikus... 14
2.3.3. Fisiologi Jantung Tikus... 15
2.4. Radikal Bebas... 15
2.4.1. Reactive Oxygen Species (ROS)... 16
2.4.2. Hidrogen Peroksida... 19
2.5. Antioksidan... 19
2.6. Katalase (CAT)... 21
2.7. Tikus Putih Galur Sprague Dawley ... 22
ix
2.9. Kerangka Konsep ... 24
2.10. Definisi Operasional... 25
BAB III METODE PENELITIAN 3.1. Desain Penelitian ………...……… 26
3.2. Waktu dan Tempat Penelitian ………... 26
3.2.1. Waktu Penelitian ……….... 26
3.2.2. Tempat Penelitian ………....……... 26
3.3. Sampel Penelitian dan Populasi ..……….. 26
3.3.1. Kriteria Inklusi ... 28
3.3.2. Kriteria Eksklusi ... 28
3.4. Variabel Penelitian ... 28
3.4.1. Variabel Bebas ... 28
3.4.2. Variabel Terikat ... 28
3.5. Cara Kerja Penelitian ………... 28
3.5.1. Alat dan Bahan Penelitian ………...….. 28
3.5.1.1. Alat Penelitian ... 28
3.5.1.2. Bahan Penelitian ………... 28
3.5.2. Pembuatan Ekstrak Sarang Burung Walet... 29
3.5.3. Proses Terminasi Tikus... 29
3.5.4. Alur Penelitian Pengukuran Aktivitas Katalase... 30
3.5.4.1. Penimbangan Bobot Total Organ ... 30
3.5.4.2. Pengambilan Jaringan ... 30
3.5.4.3. Pembuatan Homogenat Jaringan ... 30
3.5.4.4. Pengukuran Kadar Protein... 30
3.5.4.5. Pengukuran Aktivitas Katalase... 31
3.5.4.6. Analisis Data... 31
3.5.5. Alur Pembuatan Preparat Histologi Jaringan Jantung. 31 3.5.5.1. Fiksasi Jaringan ... 31
3.5.5.2. Dehidrasi ... 32
3.5.5.3. Clearing ... 32
3.5.5.4. Embedding ... 32
3.5.5.5. Blocking... 33
3.5.5.6. Pemotongan Blok Jaringan ... 33
3.5.5.7. Pewarnaan dengan Hematoksilin-Eosin ... 33
3.5.5.8. Foto Preparat Jaringan... 35
3.6. Alur Penelitian ... 36
BAB IV HASIL DAN PEMBAHASAN 4.1. Hasil dan Pembahasan... 37
BAB V PENUTUP 5.1. Kesimpulan ... 46
5.2. Saran ... 46
DAFTAR PUSTAKA ... 47
x
DAFTAR GAMBAR
Gambar Halaman
2.1.1. Walet spesies Collocalia fuciphaga... 5
2.1.2. Sarang Burung Walet Putih (Collocalia fuciphaga)... 6
2.2. Struktur Jantung Secara Anterior... 9
2.2.1. Jantung Sebagai Pemompa Ganda ... 10
2.2.2. Otot Jantung (Potongan Longitudinal)...11
2.2.3. Komponen Sistem Konduksi Pada Jantung... 12
2.3.1. Jantung Tikus yang Telah Dibelah Menampilkan Ruangan Jantung Secara Interior... 14
2.3.1.1.Permukaan Exterior Jantung dan Vaskulatur Jantung... 14
2.3.2. Potongan Melintang Serat Otot Jantung Tikus... 15
2.4.1. Pathway pembentukan ROS... 17
2.5. Klasifikasi Antioksidan... 20
4.1. Grafik Rata-Rata Aktivitas Katalase... 37
4.2. Gambar Preparat Jantung... 43
4.3. Gambar Preparat Jantung... 43
9.1. Sampel Jaringan Jantung... 64
9.2. Pemotongan Jaringan... 64
9.3. Penimbangan Organ Jantung... 64
9.4. Pengukuran Protein... 64
xi
DAFTAR TABEL
Tabel Halaman
2.1.3. Kandungan Sarang Burung Walet (Collocalia fuciphaga)... 6
2.3. Sistem kardiovaskular manusia dan tikus... 12
2.10. Definisi Operasional... 25
xii
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Determinasi ... 51
2. Alur Pembuatan Ekstrak Sarang Burung Walet... 52
3. Perhitungan Volume Administrasi (VAO) ... 53
4. Alur Pengukuran Kadar Protein... 55
5. Alur Pengukuran Aktivitas Enzim Katalase... 56
6. Alur Pembuatan Preparat ... 57
7. Penghitungan Pengenceran Alkohol... 58
8. Analisis Statistik Aktivitas Katalase... 59
9. Gambar Proses Penelitian ... 64
xiii
DAFTAR SINGKATAN
Ad Adipose Tissue
ANOVA Analysis of Variance
Ao Aorta
AV Node Atrioventricular Node
CAT Katalase
CG Coronary Groove
CVC Caudal Vena Cava
DNA Deoxyribonucleate Acid
EGF Epidermal Growth Factor
gaINAc N-acetylgalactosaminase
gIcNAc N-acetylglucosamine
GCV Great Cardiac Vein
GPx Glutathione Peroxidase
GSH Glutation
GSSG Glutathione Disulfide
GRed Glutation Reduktase
H Hidrogen
H2O Air
H2O2 Hidrogen Peroksida
I.M. Intramuskular
IVS Interventricular Septum
LA Left Atrium
LAD Left Anterior Descending Coronary Artery
LCVC Left Cranial Vena Cavae
LCX Left Circumflex Coronary Artery
LCV Left Coronary Veins
LMA Left Main Coronary Artery
LV Left Ventricle
MCV Middle Coronary Vein
MDA Malondialdehid
NaCMC Natrium Carboxyl Methyl Cellulose
NaIO3 Sodium Iodate
O2 Oksigen
O2- Superoksida
OH- Hidroksil
ONOO- Peroksinitrit
PA Pulmonary Artery
PBS Phosphate Buffer Saline
PDA Posterior Descending Coronary Artery
p.o. Peroral
PBS Phosphate Buffered Saline
PUFA Poly Unsaturated Fatty Acid
RA Right Atrium
RCV Right Coronary Veins
RCVC Right Circumflex Coronary Artery
xiv
RV Right Ventricle
ROS Reactive Oxygen Species
RNS Reactive Nitrogen Species
RSS Reactive Sulphur Species
SA Node Sinoatrial Node
SCV Small Cardiac Vein
SOD Superoksida Dismutase TBA Thiobarbiturate Acid
TCA Trichloroacetic Acid
1 BAB 1 PENDAHULUAN 1.1 Latar Belakang
Burung walet merupakan burung pemakan serangga yang hidup di dalam gua sepanjang garis pantai negara-negara Asia Tenggara, yaitu Thailand, Vietnam, Indonesia, Borneo, Malaysia, dan Filipina.1,2 Daerah di Indonesia yang memproduksi sarang burung walet terbesar yaitu di provinsi Jawa Tengah, Jawa Timur, dan Jawa Barat.3 Pembuatan sarang burung walet dilakukan oleh burung walet jantan dan betina, dan durasi yang dibutuhkan untuk pembuatannya berkisar antara 30-60 hari.1 Lokasi pembuatan sarang burung walet yaitu di tempat yang lembab, dengan suhu ruangan sekitar 26-29 C.1 Sarang burung walet yang dapat dikonsumsi adalah spesies burung walet putih (Collocalia fuciphaga) dan burung walet hitam (Collocalia maximus). 1,3
Sarang burung walet memiliki beberapa kandungan nutrisi yaitu glikoprotein, asam amino, karbohidrat, dan beberapa jenis mineral yaitu kalsium, sodium, magnesium, zinc, mangan, magnesium, dan besi.4,5 Sarang burung walet memiliki efek antivirus, antioksidan, dan meningkatkan imunitas tubuh.3,5 Pada penelitian yang dilakukan oleh Matsukawa et al (2011), disebutkan bahwa ekstrak sarang burung walet dapat mempertebal kulit di lapisan dermal, dan meningkatkan kekuatan tulang Femur karena peningkatan kadar kalsium di dalam tulang.5,6 Kandungan nutrisi sarang burung walet dipengaruhi oleh tempat berkembangbiak, suhu, dan asupan makanan.7
Radikal bebas merupakan molekul yang terdiri dari elektron tidak berpasangan, bersifat reaktif, dan tidak stabil. Radikal bebas dapat bertindak sebagai oksidan maupun reduktan.8,9 Secara fisiologis, ketika radikal bebas berada di dalam tubuh, tubuh akan melakukan pertahanan diri dengan memicu pengeluaran antioksidan. Tetapi, jika keseimbangan antara antioksidan dan radikal bebas terganggu, maka akan terjadi mekanisme stres oksidatif yang akan merusak molekul yaitu lipid, protein, dan asam nukleat, baik secara struktur maupun fungsi, sehingga terjadi kerusakan oksidatif pada sel tubuh yang menimbulkan penyakit.10,11,12
Antioksidan merupakan molekul yang dapat mendonorkan elektron agar bisa menetralkan radikal bebas, karena antioksidan bersifat low-molecular-weight dan dapat berinteraksi dengan radikal bebas untuk memutus rantai reaksi sebelum terjadinya kerusakan sel pada organ.13 Antioksidan bertindak sebagai donor hidrogen, donor elektron, penghambat enzim, dan dekomposer peroksida. Antioksidan terdiri dari dua jenis, yaitu enzimatik (superoksida dismutase, katalase, dan glutathion) dan nonenzimatik (asam askorbat, glutathion, melatonin, vitamin E, dan asam urat).13,14
Katalase disebut juga hidroperoksidase, merupakan antioksidan enzimatik endogen yang mengkatalisis radikal bebas yaitu hidrogen peroksida (H2O2)
menjadi air (H2O) dan oksigen (O2), sehingga mampu membantu mencegah stres
oksidatif dan kerusakan jaringan.15,16 Enzim katalase ditemukan dalam jumlah besar di dalam darah, sumsum tulang, membran mukosa, ginjal, dan hati, dan dalam jumlah kecil terdapat di otak, jantung, dan otot rangka.17,18
Jantung adalah organ tubuh yang fungsi utamanya adalah untuk mengedarkan darah ke seluruh tubuh. Darah pada dasarnya memiliki beberapa komponen yang diperlukan tubuh, dan berfungsi sebagai pengedar zat yaitu metabolisme, oksigen, dan hasil proses metabolisme berupa radikal bebas yang terdistribusi melalui pembuluh darah tubuh.19 Radikal bebas yang beredar di dalam tubuh ini dapat mempengaruhi fungsi organ, salah satunya adalah organ jantung, yang dapat menimbulkan kerusakan sel jantung karena terjadinya stres oksidatif yang memicu penyakit jantung yang mengganggu fungsi fisiologisnya.20
Penelitian efek kardioprotektif ini dilakukan dengan tujuan untuk mengetahui kemampuan dari sarang burung walet dalam melindungi jantung dari kerusakan. Parameter yang digunakan adalah pengukuran aktivitas enzim katalase.
1.2 Rumusan Masalah
Bagaimana efek pemberian ekstrak sarang burung walet terhadap aktivitas enzim katalase jantung tikus Sprague dawley?
1.3 Hipotesis Penelitian
Ekstrak sarang burung walet (Collocalia fuciphaga) dapat meningkatkan aktivitas enzim katalase jantung tikus Sprague dawley.
1.4. Tujuan Penelitian 1.4.1. Tujuan Umum
Tujuan penelitian ini untuk mengetahui pengaruh pemberian ekstrak sarang burung walet (Collocalia fuciphaga) terhadap aktivitas enzim katalase jantung tikus Sprague dawley.
1.4.2. Tujuan Khusus
Tujuan khusus penelitian ini yaitu:
1. Mengetahui adanya perubahan aktivitas enzim katalase jantung tikus Sprague
dawley setelah pemberian ekstrak sarang burung walet (Collocalia fuciphaga)
dalam dosis yang berbeda-beda.
2. Mengetahui gambaran histologi jaringan jantung tikus Sprague dawley setelah pemberian ekstrak sarang burung walet (Collocalia fuciphaga).
1.5. Manfaat Penelitian
Manfaat yang diharapkan oleh penulis dari penelitian ini adalah:
1. Memberikan informasi ilmiah mengenai peran ekstrak sarang burung walet terhadap kesehatan.
2. Hasil penelitian yang diperoleh dapat dijadikan sebagai rujukan penelitian selanjutnya.
3. Informasi dari hasil penelitian ini dapat dijadikan dasar penatalaksanaan kasus-kasus terkait jantung.
BAB 2
TINJAUAN PUSTAKA
2.1. Sarang Burung Walet
Sarang burung walet terbentuk dari saliva burung walet, yang banyak ditemukan di gua sepanjang pantai wilayah Asia Tenggara.1 Burung walet
(Collocalia fuciphaga) merupakan pemakan serangga, dan bermigrasi dari
samudera Hindia melalui Asia Tenggara.3 Burung walet (Collocalia fuciphaga) hidup berkelompok dan tinggal di gua yang terletak di tebing yang curam dekat laut lepas. Dalam membuat sarangnya, burung walet (Collocalia fuciphaga) memerlukan tempat yang lembap, yaitu kelembapan 85-95% dan suhu 26-29 C.1 Sarang burung walet dapat dikonsumsi dalam bentuk sup, diawali dengan merendam sarang di dalam air hingga berbentuk halus dan untaiannya melonggar. Lalu, untaian yang telah dibersihkan dibentuk, dikeringkan, dan dapat direbus dengan gula batu sehingga menjadi sup sarang burung walet.1,3
Sarang burung walet pada awalnya diperkenalkan oleh bangsa Cina, dan mulai diperdagangkan sejak dahulu. Indonesia merupakan salah satu eksportir sarang burung walet terbesar, dengan importir sarang burung walet terbesar yaitu Cina dan Hongkong.1 Sarang burung walet yang dapat dikonsumsi adalah sarang burung walet putih (Collocalia fuciphaga) dan sarang burung walet hitam
(Collocalia maximus).4
2.1.1. Klasifikasi Burung Walet (Collocalia fuciphaga)
Burung Walet memiliki sistem taksonomi sebagai berikut:1 Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata Kelas : Aves Ordo : Apodiformes Famili : Apodidae Genus : Collocalia
Collocalia berasal dari bahasa Yunani, yaitu Kolla: lem, dan Kalia:
sarang. Sedangkan Aerodramus berasal dari kata aer: udara dan dromos: berpindah cepat.22 Terdapat beberapa jenis lain spesies burung walet, yaitu
sebagai berikut: Aerodramus gigas (walet besar), Aerodramus maximus (walet sarang hitam), Aerodramus brevirostris (walet gunung), Aerodramus vanikorensis (walet sarang lumut), Aerodramus esculata (walet sapi), Aerodramus germanicus, dan Aerodramus unicolor (walet yang berasal dari India).1
Gambar 2.1.1. Walet spesies Collocalia fuciphaga Sumber : Kennedy, Robert S. 2000. 2.1.2. Morfologi Sarang Burung Walet (Collocalia fuciphaga)
Sarang burung Walet terdiri dari beberapa bagian, yaitu kaki sarang, fondasi sarang, dinding sarang, dan dasar sarang. Kaki sarang, merupakan bagian dasar sarang burung walet, dan jarak antar kakinya yaitu 6-10 cm, tergantung ukuran tiap sarang. Fondasi sarang berfungsi sebagai penyokong kaki dan memperkuat sarang burung walet. Dasar sarang merupakan bagian alas sarang dan berguna untuk bertelur, mengeram, dan tempat istirahat bagi anak-anak burung walet. Pada dasar sarang burung ini, banyak ditemukan pecahan cangkang telur burung walet. Dinding sarang berbentuk seperti mangkok, dan berfungsi sebagai penampung telur dan anak burung walet. Ukuran dinding bervariasi, yaitu 2 hingga 5 cm, dengan ketebalan 1 hingga 2 mm. Terdapat juga bibir atau bukaan sarang, yang berbentuk seperti setengah lingkaran, dan berfungsi untuk tempat keluar masuknya burung walet, dan sebagai pembatas agar telur dan pinyik tidak jatuh dari sarang. Keempat komponen ini (kaki sarang, fondasi sarang, dinding sarang, dan dasar sarang) terbuat dari air liur burung Walet.1
Gambar 2.1.2. Sarang Burung Walet Putih (Collocalia fuciphaga)
Sumber: Panduan Lengkap Walet, 2009.
2.1.3. Kandungan Sarang Burung Walet
Kandungan kimia utama pada sarang burung walet adalah karbohidrat dan glikoprotein, diikuti asam lemak, dan mikronutrien yaitu kalsium, sodium, magnesium, zinc, mangan, dan besi. Glikoprotein mengandung asam amino (paling banyak adalah jenis serine, threonine, asam aspartat, asam glutamat, prolin, dan valin), karbohidrat khususnya fruktosa dan galaktosa, sialic acid, N-
acetylgalactosaminase (gaINAc), dan N- acetylglucosamine (gIcNAc).6 Zat-zat tersebut memiliki fungsinya masing-masing dalam sistem imun tubuh dan sebagai antioksidan1,5
Tabel 2.1.3. Kandungan sarang burung walet (Collocalia fuciphaga)
Komponen Nilai Analisis proksimat (%) Air 7.5-12.9 Abu 2.1-7.3 Karbohidrat 10.63-27.26 Protein 42-63 Nitrogen total 25.62-27.26 Lemak 0.14-1.28
Asam Amino (% molar basis)
Aspartat + Asparagin 2.8-10.0 Serin 2.8-15.9 Threonin 2.7-5.3 Glutamat + Glutamin 2.9-7.0 Glisin 1.2-5.9 Alanin 0.6-4.7 Valin 1.9-11.1 Methionin 0-0.8 Isoleusin 1.2-10.7 Leusin 2.6-3.8 Prolin 2.0-3.5
Lysin 1.4-3.5
Sistein 2.44
Arginin 1.4-6.1
Histidin 1.0-3.3
Triptofan 0.02-0.08
Analisis asam lemak (%)
Palmitrat 23-26 Steric 26-29 Linoleic 22 Linolenic 26 Triasilgliserol (%) PPO 14-16 OOL 13-15 PLnLn 18-19 Monogliserida 27-31 Digliserida 21-26 Vitamin Vitamin A (IU/mg) 2.57-30.40 Vitamin D (IU/mg) 60.00-1280.00 Vitamin C (mg/100 g) 0.12-29.30 Analisis elemental (ppm) Sodium (Na) 330-20.554 Potassium (K) 110-2645 Kalsium (Ca) 798-14.850 Magnesium (Mg) 330-2980 Fosfor (P) 40-1080 Besi (Fe) 30-1860 Sulfur (S) 6244-8840 Barium (Ba) 4.79-41.09 Strontium (Sr) 4.25-21.90 Silikon (Si) 8.34-62.02 Aluminium (Al) 15-2368 Mangan (Mn) 3.58-122.10 Zinc (Zn) 19.95-72.40 Copper (Cu) 4.69-110.65 Molybdenum (Mo) 0-0.94 Cobalt (Co) 0-0.63 Germanium (Ge) 0.05-0.97 Selenium (Se) 0.12-0.77 Nikel (Ni) 0-0.47 Vanadium (V) 0.03-2.84 Krom (Cr) 0-7.45 Timbal (Pb) 0.50-4.08 Kadmium (Cd) 0-0.83 Merkuri (Hg) 0.001-0.160 Determinasi Hormon Testosteron (T) (ng/g) 4.293-12.148
2.1.4. Manfaat Sarang Burung Walet
Sarang burung walet memiliki berbagai manfaat. Menurut Kong et al, sarang burung walet memiliki epidermal growth faktor (EGF) yang dapat meningkatkan proliferasi sel.23 Pada penelitian Matsukawa et al, sarang burung walet dapat meningkatkan konsentrasi kalsium dalam tulang dan mempertebal kulit di lapisan dermal.24 Sarang burung walet juga memiliki efek antioksidan, sehingga memperlambat proses degeneratif sel. Pada penelitian yang dilakukan Hou et al, sarang burung walet dapat memperlambat proses neurodegenerasi hipokampus dan korteks pada tikus, sehingga berfungsi sebagai neuroprotektor.25 Sarang burung walet juga memiliki efek dalam menurunkan penyakit kardiometabolik, karena dapat meregulasi gen yang berhubungan dengan koagulasi dan gen pemberi sinyal pengeluaran insulin.26,27,28
2.2. Jantung Manusia
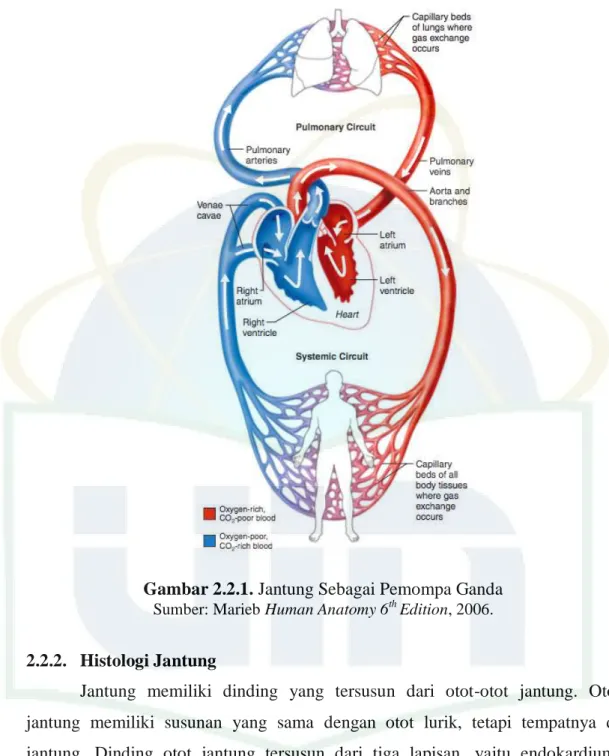
Sistem kardiovaskular manusia terdiri dari darah, jantung, dan pembuluh darah. Darah mengandung beberapa komponen sel darah, dan berfungsi sebagai transporter oksigen dan nutrien ke seluruh tubuh, homeostasis cairan tubuh, dan proteksi ketika tubuh mengalami luka melalui pembekuan darah oleh sel platelet. Jantung merupakan organ yang memompa darah ke seluruh tubuh melalui pembuluh darah. Pembuluh darah pada tubuh terdiri dari arteri, vena, dan kapiler. Pembuluh darah yang terdapat di jantung yaitu vena cava superior dan inferior yang bersama-sama mengalirkan darah ke jantung dari seluruh tubuh, dan terdapat vena pulmonalis yang mengalirkan darah dari paru ke jantung.29
Gambar 2.2. Struktur Jantung Secara Anterior
Sumber: Van de Graaf Human Anatomy, 2006.
2.2.1. Anatomi Jantung
Jantung secara anatomis terletak di mediastinum, dengan massa rata-rata 250 - 300 gram. Jantung pada bagian anterior berbatasan dengan sternum, berbatasan inferior dengan diafragma, berbatasan dextra dengan pulmo kanan, dan berbatasan sinistra dengan pulmo kiri.31 Jantung memiliki empat ruang, yaitu atrium (menerima darah) dan ventrikel (memompa darah), dan di permukaan jantung terdapat beberapa sulkus yang mengandung pembuluh darah dan lemak. Atrium kanan memiliki ketebalan 2-3 mm, dan berfungsi menerima darah dari vena cava superior, vena cava inferior, dan sinus koronarius. Darah akan melewati atrium kanan ke ventrikel kanan melalui katup trikuspidalis (katup atrioventrikular). Ventrikel kanan memiliki ketebalan 4-5 mm, dan berfungsi sebagai pemompa darah, yang akan dialirkan ke trunkus pulmoner dan arteri pulmoner. Pertukaran gas oksigen dan karbon dioksida terjadi di paru kanan dan kiri. Darah yang telah teroksigenasi akan meninggalkan arteri menuju atrium kiri. Atrium kiri memiliki ketebalan 2-3 mm, dan mengalirkan darah teroksigenasi dari paru menuju ventrikel kiri. Diantara atrium kiri dan ventrikel kiri terdapat katup bikuspidalis/mitral/atrioventrikular kiri. Ventrikel kiri merupakan ruang di jantung yang paling besar. Darah dari ventrikel kiri akan dialirkan ke arkus aorta, lalu melewati tiga percabangan yaitu arteri subklavia sinistra, arteri karotis komunis, dan trunkus brachiocephalica, hingga akan dialirkan ke seluruh tubuh.31,32
Gambar 2.2.1. Jantung Sebagai Pemompa Ganda
Sumber: Marieb Human Anatomy 6thEdition, 2006.
2.2.2. Histologi Jantung
Jantung memiliki dinding yang tersusun dari otot-otot jantung. Otot jantung memiliki susunan yang sama dengan otot lurik, tetapi tempatnya di jantung. Dinding otot jantung tersusun dari tiga lapisan, yaitu endokardium, miokardium, dan perikardium. Endokardium terdiri dari epitel gepeng selapis dan lapisan jaringan ikat subepitel yang melapisi lumen jantung. Dibawah lapisan endokardium terdapat lapisan subendokardium, yang terdiri dari jaringan ikat yang mengandung pembuluh darah kecil, persarafan, dan serat Purkinje. Miokardium adalah lapisan tengah dinding otot jantung, merupakan lapisan dinding otot jantung yang paling tebal dan tersusun dari otot-otot jantung dan jumlahnya lebih tebal di ventrikel dibandingkan dengan di atrium karena fungsi
ventrikel yaitu memompa darah. Epikardium disebut juga sebagai lapisan perikardium viseral, merupakan lapisan terluar dinding jantung yang dilapisi epitel gepeng selapis dan jaringan ikat. Pada lapisan jaringan ikat longgarnya, dapat ditemukan pembuluh darah, persarafan, dan ganglion. Diantara lapisan perikardium viseral dan perikardium parietal, dapat ditemukan ruangan yang mengandung cairan serosa yang berfungsi untuk memudahkan pergerakan jantung.33,34
Gambar 2.2.2. Otot Jantung (Potongan Longitudinal) pewarnaan Masson
Trichrome
Sumber: Atlas Histologi diFiore, 2013.
2.2.3. Fisiologi Jantung
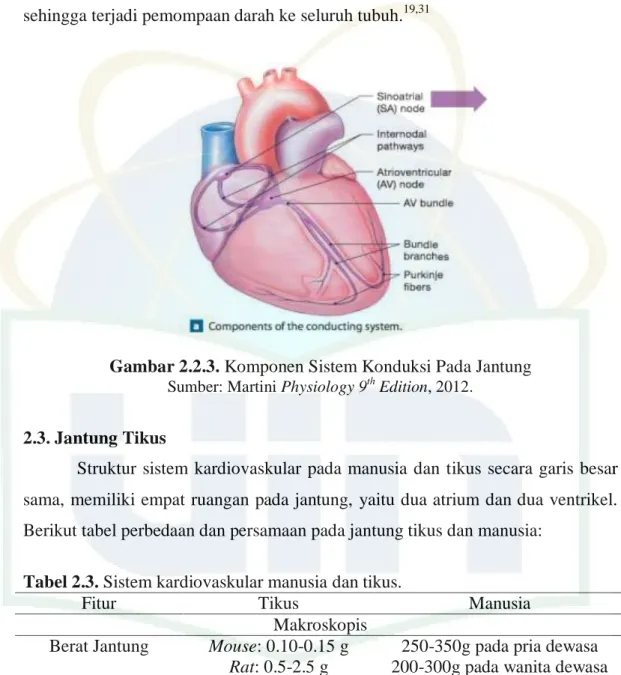
Jantung menimbulkan denyut jantung, yang merupakan hasil dari kontraksi kedua atrium dan ventrikel. Terdapat beberapa unsur sel otot jantung yang memproduksi denyut jantung, yaitu sel otot itu sendiri dan sel kontraktil yang memicu kontraksi darah agar bergerak terpompa ke seluruh tubuh. Konduksi jantung dimulai dari nodus sinoatrial (SA Node) yang berada di dinding atrium kanan, letaknya inferior lateral terhadap pembukaan vena cava superior. Potensial aksi ini akan muncul dan melewati atrium di gap junction di diskus interkalaris di serat-serat otot atrium, sehingga akan menimbulkan kontraksi pada kedua atrium. Potensial aksi selanjutnya akan mencapai nodus atrioventricular
(AV Node) yang terletak di septum interatrium, dan impuls disini akan melambat
karena sel-sel yang di AV Node bervariasi jenisnya. Lalu potensial aksi akan merambat memasuki bundle of his yang terletak diantara atrium dan ventrikel, dan menghantarkan impuls diantara keduanya, dan selanjutnya impuls akan memasuki
right and left bundle branches yang terdapat di septum interventrikular di apeks
jantung. Serat Purkinje akan mengonduksikan potensial aksi secara cepat di apeks jantung hingga ke lapisan miokardium ventrikel, yang memicu kontraksi ventrikel sehingga terjadi pemompaan darah ke seluruh tubuh.19,31
Gambar 2.2.3. Komponen Sistem Konduksi Pada Jantung
Sumber: Martini Physiology 9th Edition, 2012. 2.3. Jantung Tikus
Struktur sistem kardiovaskular pada manusia dan tikus secara garis besar sama, memiliki empat ruangan pada jantung, yaitu dua atrium dan dua ventrikel. Berikut tabel perbedaan dan persamaan pada jantung tikus dan manusia:
Tabel 2.3. Sistem kardiovaskular manusia dan tikus.
Fitur Tikus Manusia
Makroskopis Berat Jantung Mouse: 0.10-0.15 g
Rat: 0.5-2.5 g
250-350g pada pria dewasa 200-300g pada wanita dewasa Berat Jantung (%
dari berat badan)
Mouse: 0.40-0.60% Rat: 0.20-0.50%
45% pada pria dewasa 40% pada wanita dewasa Ketebalan dinding ventrikel kiri Mouse: 1.5-1.8 mm Rat: 1.5-2.7 mm 1.2-1.5 cm Ketebalan dinding ventrikel kanan Mouse: 0.5-0.6 mm Rat: 0.5-0.9 mm 0.4-0.5 cm Ketebalan septum interventrikular Mouse: 1.5-1.8 mm Rat: 1.5-2.5 mm 1.2-1.5 cm
beats/min Rat: 300-400 beats/min Output ventrikel kiri Mouse: 11-19mL/min
Rat: 70-80 mL/min
5 l/min pada pria dewasa 4.5 l/min pada wanita dewasa
Stroke volume
ventrikel kiri
Mouse: 30-36 L/beat
Rat: 70-80 l/min
70 ml/beat pada pria dewasa 60 ml/beat pada wanita dewasa
Bentuk Jantung Oval - Spherical Conical
Kantung Perikardial Tebal beberapa lapis sel Ketebalannya 1-3 mm Lemak Epikardial Tidak ada - tipis Sedang - berlimpah Vena cava anterior Dua (kiri dan kanan) Satu
Jumlah arteri koroner primer
Mouse: 2-3 Rat: 2
Dua cabang dari aorta proksimal Asal arteri koroner Didalam atau diatas
sinus koronarius
Didalam sinus koronarius Septum arteri
koronarius
Ada Tidak ada
Lokasi arteri koronarius
Intramiokardial Secara proksimal epicardial dan menjadi mid-miokardial secara
distal Suplai darah
ekstrakoroner
Mouse: Tidak ada Rat: Ada
Tidak ada Lokasi nodus
atrioventrikular
Septum interatrial Septum interatrial Lokasi bundle his Septum basal
interventrikular
Badan fibrosa sentral – septum interventrikular basal Lokasi cabang
bundle kiri dan kanan
Subendokardial Subendokardial
Katup atrioventrikular
Terdapat korda tendinae Terdapat korda tendinae Katup Semilunaris Tidak ada korda
tendinae
Tidak ada korda tendinae Mikroskopis
Epikardium Tipis Tebal
Endokardium Tipis Tebal
Jaringan ikat subendokardial
Tidak ada – tipis Tebal
Cardiac skeleton Mouse: Jelas Rat: Lebih jelas
daripada tikus
Tidak jelas
Lapisan katup Tidak ada lapisan yang jelas, terdapat area fibrosa dan spongiosa
Terdapat tiga lapisan jelas: atrial/ventrikularis, fibrosa, dan
spongiosa Kardiomiosit
binukleat
>75% <25%
2.3.1. Anatomi Jantung Tikus
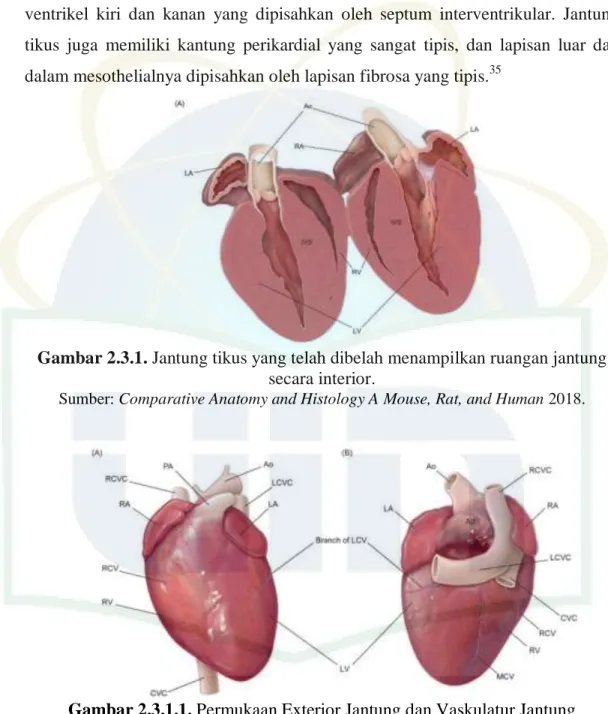
Jantung tikus terletak di mediastinum, dan terbagi menjadi empat ruangan yaitu atrium kiri, atrium kanan yang dipisahkan oleh septum interatrial, dan ventrikel kiri dan kanan yang dipisahkan oleh septum interventrikular. Jantung tikus juga memiliki kantung perikardial yang sangat tipis, dan lapisan luar dan dalam mesothelialnya dipisahkan oleh lapisan fibrosa yang tipis.35
Gambar 2.3.1. Jantung tikus yang telah dibelah menampilkan ruangan jantung secara interior.
Sumber: Comparative Anatomy and Histology A Mouse, Rat, and Human 2018.
Gambar 2.3.1.1. Permukaan Exterior Jantung dan Vaskulatur Jantung
Sumber: Comparative Anatomy and Histology A Mouse, Rat, and Human , 2018.
2.3.2. Histologi Jantung Tikus
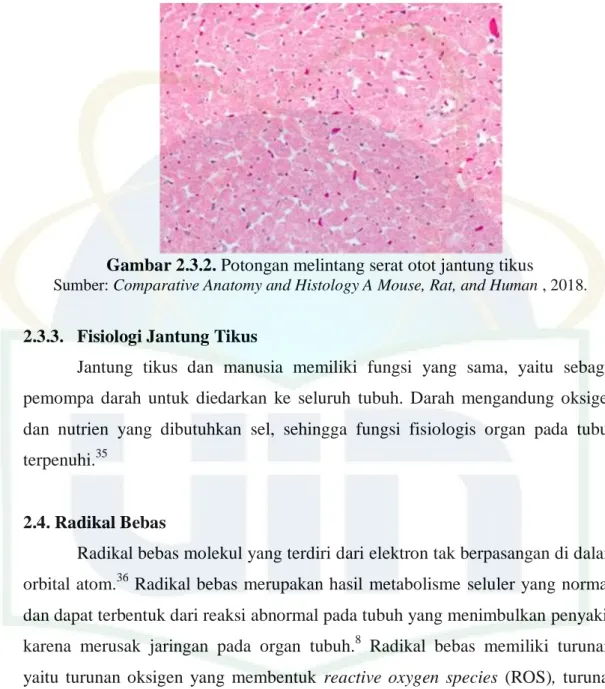
Jantung tikus memiliki kemiripan dengan jantung manusia. Jantung tikus memiliki lapisan miokardium, dengan dinding atrium yang lebih tipis dan kardiomiosit atrium yang lebih kecil dan lebih tipis daripada daerah ventrikel. Kardiomiosit pada tikus umumnya berbentuk binukleat, sedangkan pada manusia
umumnya mononukleat. Lapisan epikardium dan endokardium tikus lebih tipis daripada manusia.35
Gambar 2.3.2. Potongan melintang serat otot jantung tikus
Sumber: Comparative Anatomy and Histology A Mouse, Rat, and Human , 2018.
2.3.3. Fisiologi Jantung Tikus
Jantung tikus dan manusia memiliki fungsi yang sama, yaitu sebagai pemompa darah untuk diedarkan ke seluruh tubuh. Darah mengandung oksigen dan nutrien yang dibutuhkan sel, sehingga fungsi fisiologis organ pada tubuh terpenuhi.35
2.4. Radikal Bebas
Radikal bebas molekul yang terdiri dari elektron tak berpasangan di dalam orbital atom.36 Radikal bebas merupakan hasil metabolisme seluler yang normal, dan dapat terbentuk dari reaksi abnormal pada tubuh yang menimbulkan penyakit, karena merusak jaringan pada organ tubuh.8 Radikal bebas memiliki turunan, yaitu turunan oksigen yang membentuk reactive oxygen species (ROS), turunan nitrogen yang membentuk reactive nitrogen species (RNS), dan turunan sulfur yang membentuk reactive sulphur species (RSS).37
Pembentukan radikal bebas dalam tubuh dapat dimediasi oleh faktor internal (mitokondria, xantin oksidase, peroksisom, inflamasi, fagositosis, jalur arakidonat, olahraga, dan iskemi) dan faktor eksternal (asap rokok, polutan lingkungan, radiasi, obat-obatan, pestisida, limbah industri, dan ozon).38
Radikal bebas yang sangat reaktif dihasilkan dari oksigen (ROS), yaitu superoksida (O2-), hidrogen peroksida (H2O2), dan hidroksil (HO).39 Radikal
bebas turunan nitrogen dapat dipicu dengan reaksi ROS dengan tiol, dengan reaksi NO dan superoksida (O2-), membentuk ONOO--. Radikal bebas turunan sulfat
terbentuk dari tiol yang membentuk disulfida, sehingga menghasilkan disulfida-S-monoksida atau disulfida-S-dioksida dan di dalam kondisi teroksidasi. Jika tiol tereduksi, akan terjadi pembentukan sulfinic acid.37
Radikal bebas bereaksi dengan beberapa mekanisme, yaitu donor elektron, reduksi radikal, menerima elektron, dan oksidasi radikal. Kadar radikal bebas yang berlebih dapat dikurangi dengan kadar antioksidan dalam tubuh, sehingga jumlahnya harus seimbang. Jika kadar radikal bebas dalam tubuh berlebih, akan memicu terjadinya stres oksidatif yang menyebabkan penyakit.37
Stres oksidatif adalah ketidakseimbangan antara kadar antioksidan dan radikal bebas. Stres oksidatif dapat memicu kerusakan lipid, protein, dan asam nukleat, sehingga merusak struktur dan fungsi sel sehingga terjadi kerusakan organ, yang menyebabkan penyakit degeneratif, penyakit metabolik, inflamasi, kanker, dan iskemi.36
2.4.1. Reactive Oxygen Species (ROS)
Radikal bebas secara fisiologis dapat terbentuk di dalam mitokondria, proses yang dikatalisir xantin oksidase, dan peroksisom. Superoksida merupakan radikal anion, dan dihasilkan dari reduksi elektron dari molekul oksigen. Superoksida dapat dikatalisir oleh enzim superoksida dismutase menjadi oksigen dan hidrogen peroksida. Hidrogen peroksida merupakan produk reduksi dua elektron dari oksigen, dan hasil dismutase superoksida. Hidrogen peroksida dapat dikatalisir dibantu oleh enzim katalase dan glutathione peroksidase. Jika hidrogen peroksida tidak dikatalisir oleh enzim katalase dan glutathione peroksidase, maka akan terjadi reaksi Fenton, yaitu reaksi antara logam transisi Fe2+ dengan hidrogen peroksida menghasilkan radikal hidroksil.37 Radikal hidroksil merupakan ROS yang paling reaktif, dan dapat terbentuk dengan reaksi Haber-Weiss, yaitu perubahan superoksida (O2-) dengan ion besi (Fe3+) menjadi Fe2+ dan oksigen.
Fe2+ ini merupakan sumber logam transisi yang memicu terjadinya reaksi Fenton.39 Jika kadar radikal hidroksil tidak dapat diimbangi oleh antioksidan, akan terjadi proses peroksidasi lipid, yang menyebabkan stres oksidatif.37
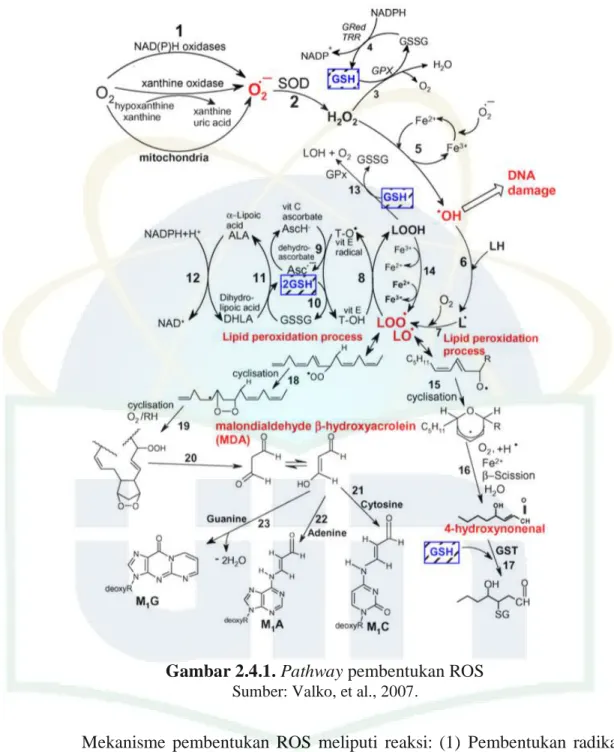
Gambar 2.4.1. Pathway pembentukan ROS
Sumber: Valko, et al., 2007.
Mekanisme pembentukan ROS meliputi reaksi: (1) Pembentukan radikal anion superoksida dari proses reduksi molekul oksigen yang dibantu oleh NAD(P)H oksidase dan xantin oksidase, atau secara non-enzimatik oleh senyawa reaktif redoks yaitu senyawa semi-ubiquinone dari rantai transpor elektron mitokondria. (2) Radikal superoksida didismutasi oleh enzim superoksida dismutase (SOD) menjadi hidrogen peroksida. (3) Hidrogen peroksida (H2O2)
secara efisien dibersihkan oleh enzim glutathion peroksidase (GPx) dengan donor elektron yaitu GSH. (4) Glutathion yang teroksidasi (GSSG) direduksi kembali menjadi GSH oleh enzim glutathion reduktase (Gred) yang menggunakan
NADPH sebagai donor elektron. (5) Beberapa logam transisi (Fe2+, Cu2+, dan lain-lain) dapat menimbulkan kerusakan pada hidrogen peroksida sehingga menjadi radikal hidroksil reaktif (disebut reaksi Fenton). (6) Radikal hidroksil (OH-) tidak dapat memisahkan elektron dari asam lemak tak jenuh ganda/polyunsaturated fatty acid (LH) menjadi radikal lipid yang carbon-centred (L). (7) Radikal lipid (L) berinteraksi dengan oksigen molekular untuk membentuk radikal lipid peroksil (LOO). Jika hasil radikal lipid peroksil LOO tidak direduksi oleh antioksidan, maka akan terjadi proses peroksidasi lipid (reaksi 18-23 dan 15-17). (8) Radikal lipid peroksil (LOO) direduksi di dalam membran dengan proses reduksi yang dibentuk vitamin E (T-OH) yang menghasilkan pembentukan hidroperoksida lipid dan radikal vitamin E (TO). (9) Regenerasi vitamin E oleh vitamin C: radikal vitamin E (TO) direduksi kembali menjadi vitamin E (T-OH) oleh asam askorbat (bentuk fisiologis askorbat adalah monoanion askorbat (AscH-)) yang meninggalkan radikal askorbil (Asc-). (10) Regenerasi vitamin E oleh GSH: radikal vitamin E yang teroksidasi (T-OH) direduksi oleh GSH. (11) Glutathion yang teroksidasi (GSSG) dan radikal askorbil (Asc-) direduksi kembali menjadi GSH dan monoanion askorbat Asch -oleh asam dihidrolipoat (DHLA), dimana DHLA itu sendiri dikonversi menjadi α-lipoat (ALA). (12) Regenerasi ALA menjadi DHLA menggunakan NADPH. (13) Lipid hidroperoksida direduksi menjadi alkohol dan dioksigen oleh GPx menggunakan GSH sebagai donor elektron.
Proses peroksidasi lipid: (14) Lipid hidroperoksida secara cepat dapat bereaksi dengan Fe2+ membentuk radikal lipid alkoksil (LO) atau lebih lambat bereaksi dengan Fe3+ untuk membentuk radikal lipid peroksil (LOO). (15) Derivat radikal lipid alkoksil (LO) yaitu asam arakidonat yang mengalami reaksi siklisasi untuk membentuk enam cincin hidroperoksida. (16) Hidroperoksida bercincin 6 mengalami reaksi lebih jauh (melibatkan pemotongan beta) untuk membentuk 4-hidroksil-nonenal. (17) 4-hidroksil-nonenal lalu diubah menjadi glutathyl aduksi (GST). (18) Radikal peroksil yang berada di rantai lipid dapat bereaksi secara siklisasi membentuk peroksida siklik yang berdampingan dengan radikal dengan inti karbon. (19) Radikal ini dapat direduksi membentuk hidroperoksida atau mengalami siklisasi kedua membentuk peroksida bisiklik.
(20) Senyawa yang terbentuk merupakan produk antara dalam pembentukan MDA. (21) MDA bereaksi dengan basa DNA Cytosine membentuk M1C. (22)
MDA bereaksi dengan basa DNA Adenine membentuk M1A. (23) MDA bereaksi
dengan basa DNA Guanine membentuk M1.40
2.4.2. Hidrogen Peroksida
Hidrogen peroksida disebut juga hidrogen dioksida, merupakan senyawa tak berwarna dan tak berbau.47 Hidrogen peroksida dibentuk dalam peroksisom, mitokondria, mikrosom, dan membran sel. Hidrogen peroksida dapat dibentuk dengan dua mekanisme, yaitu reduksi elektron dari superoksida (O2 + 2e + 2H+ ->
H2O2) dan dismutasi enzimatik dari superoksida oleh enzim superoksida
dismutase (SOD).9,39 Senyawa hidrogen peroksida dapat dikatalisir oleh enzim katalase menjadi air dan oksigen. Jika tidak dikatalisir, hidrogen peroksida akan bereaksi dengan logam transisi yang dapat menimbulkan stres oksidatif.40
2.5. Antioksidan
Antioksidan merupakan substansi yang menghambat, mencegah, atau menghilangkan gangguan oksidatif pada molekul yang menjadi target (Halliwell, 2007).18 Aktivitas antioksidan dapat terjadi dengam beberapa cara, yaitu sebagai inhibitor reaksi oksidasi radikal bebas, menghambat penyebaran rantai reaksi autooksidasi, sebagai penetral oksigen bekerjasama dengan antioksidan lain, agen reduktor yang mengubah hidroperoksida menjadi senyawa yang stabil, sebagai agen pengikat logam pro-oksidan dan mengubahnya menjadi senyawa stabil, dan sebagai inhibitor enzim pro-oksidatif.41,42,43,44,45
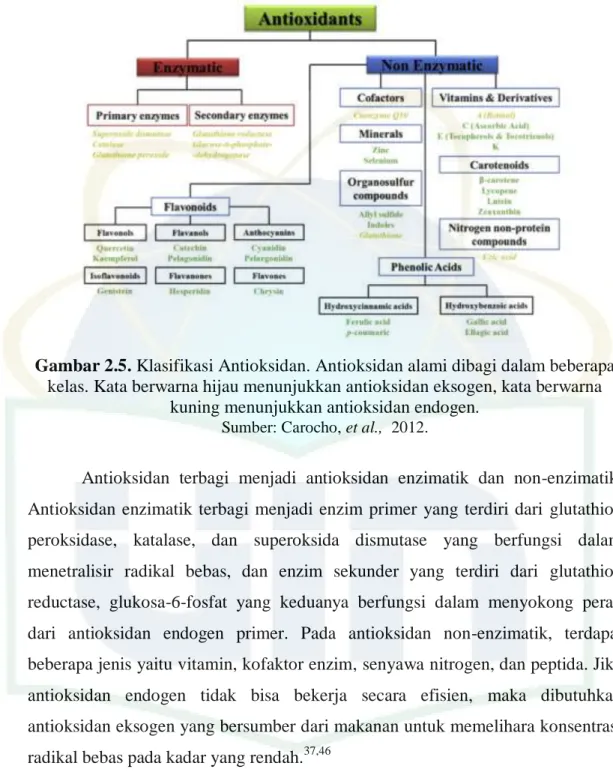
Gambar 2.5. Klasifikasi Antioksidan. Antioksidan alami dibagi dalam beberapa kelas. Kata berwarna hijau menunjukkan antioksidan eksogen, kata berwarna
kuning menunjukkan antioksidan endogen.
Sumber: Carocho, et al., 2012.
Antioksidan terbagi menjadi antioksidan enzimatik dan non-enzimatik. Antioksidan enzimatik terbagi menjadi enzim primer yang terdiri dari glutathion peroksidase, katalase, dan superoksida dismutase yang berfungsi dalam menetralisir radikal bebas, dan enzim sekunder yang terdiri dari glutathion reductase, glukosa-6-fosfat yang keduanya berfungsi dalam menyokong peran dari antioksidan endogen primer. Pada antioksidan non-enzimatik, terdapat beberapa jenis yaitu vitamin, kofaktor enzim, senyawa nitrogen, dan peptida. Jika antioksidan endogen tidak bisa bekerja secara efisien, maka dibutuhkan antioksidan eksogen yang bersumber dari makanan untuk memelihara konsentrasi radikal bebas pada kadar yang rendah.37,46
Antioksidan bekerja dalam beberapa tingkatan. Pada tingkat pertama, antioksidan beraksi sebagai pencegah pembentukan radikal bebas dengan mengurangi hidroperoksida dan hidrogen peroksida dalam air dan alkohol. Tingkat kedua, antioksidan akan menghambat pembentukan radikal aktif
(scavenge) untuk menekan pembentukan rantai, dan/atau merusak rantai radikal
bebas yang telah tersebar. Antioksidan yang bekerja di tingkat kedua terbagi menjadi hidrofilik (vitamin C, asam urat, bilirubin, albumin, dan tiol) dan lipofilik
(vitamin E dan ubiquinol). Pada tingkat ketiga, antioksidan beraksi sebagai de
novo antioksidan dan repair, dibantu oleh enzim proteolitik, proteinase, protease,
dan peptidase yang berfungsi untuk mencegah akumulasi protein yang telah teroksidasi. Fungsi lain yaitu adaptasi, ketika reaksi radikal bebas merangsang pembentukan dan transport antioksidan ke tempat terjadinya kerusakan.36
2.6. Katalase
Katalase merupakan hemoprotein, yang memiliki empat grup heme. Katalase dalam fungsinya yaitu memiliki aktivitas peroksidase yang menggunakan satu molekul H2O2 sebagai substrat elektron, dan molekul lain
H2O2 sebagai oksidan.48,46 Katalase merupakan suatu enzim antioksidan yang
terdapat di semua organisme, baik yang prokaryote uniseluler maupun eukariot multiseluler. Pada manusia, katalase banyak ditemukan di darah, sumsum tulang, membran mukosa, ginjal, dan hepar dan dalam jumlah kecil terdapat di otak, jantung, dan otot rangka. Fungsi utama dari katalase adalah mengubah hidrogen peroksida yang dibentuk oleh proses oksidatif menjadi H2O dan O2.17,18
Katalase terbentuk dalam beberapa jenis isoform, yaitu CAT 1, CAT 2, dan CAT 3 dan dikode oleh beberapa gen yaitu Cat1, Cat2, Cat3. Katalase memiliki struktur yang berukuran tetramerik dengan empat monomer yang identik dan subunit 220,000-350,000 kD. Kunci dari aktivitas enzimatik distimulasi oleh heme, yang tipe monomernya terdiri dari atom besi yang terpusat menempel di cincin protoporfirin. Atom besi yang terletak di pusat ini dapat terlihat dalam bentuk ion ferrous (Fe2+) atau ion ferric (Fe3+). Cincin protoporfirin ini memiliki empat cincin yang terhubung melalui jembatan methene, dan sisi samping dari cincin ini terbuat dari empat methyl, dua vinyl, dan dua propionat.48 Katalase dapat dibagi menjadi tiga kelas berdasarkan struktur dan susunannya, yaitu katalase monofungsional, katalase peroksidase, dan pseudokatalase atau Mn-katalase. Di dalam sel, katalase banyak terdapat di peroksisom dan mitokondria, karena struktur kedua komponen sel ini yang bersifat polar dan terikat pada membran.48
Terdapat beberapa faktor yang memengaruhi aktivitas enzim katalase, yaitu suhu (dibawah 40-50C), pH antara 6.8 – 7.5, dan tidak ada inhibitor
(inhibitor kompetitif katalase adalah sianida, dapat berikatan dengan heme katalase sehingga menghentikan aktivitas enzim).48 Katalase bekerja dengan dua mekanisme, yaitu sebagai peroksidase dan katalisator. Pada mekanisme katalase peroksidase, katalase akan mengubah hidrogen peroksida dengan donor hidrogen (fenol, formaldehid, nitrat, asam askorbat, dan metanol) agar teroksidasi dalam konsentrasi substrat yang rendah. Mekanisme katalase sebagai katalisator, katalase akan mengubah hidrogen peroksida menjadi air dan oksigen dalam konsentrasi substrat yang tinggi. Berikut skema reaksi perubahan hidrogen peroksida oleh enzim katalase:48,49
Reaksi peroksidasi : RH2 + H2O2 -> R + 2H2O
Reaksi katalisis : 2H2O2 -> 2H2O + O2
2.7. Tikus Putih Galur Sprague dawley
Tikus dimasukkan ke dalam ordo Rodentia (hewan pengerat), family Muridae dari kelompok mamalia. Tikus sering digunakan sebagai objek penelitian karena mewakili kelompok mamalia, dengan sistem tubuh yang mirip dengan manusia.50
Tikus putih galur Sprague dawley merupakan tikus yang pertama kali ditemukan di perusahaan Sprague dawley, Wisconsin. Tikus ini memiliki ciri bertubuh panjang, berkepala kecil, telinga tebal dan pendek, rambut halus. Tikus
Sprague Dawley memiliki sifat yaitu cepat berkembangbiak, mudah dipelihara
dan diatur karena sifatnya yang lebih tenang, dan kebutuhan nutrisinya hampir menyerupai manusia.50
2.8. Kerangka Teori
Faktor Eksogen: Asap rokok Induksi zat kimia
Radiasi Polutan lingkungan Sinar UV Faktor Endogen: Mitokondria Fagosit Xantin oksidase Jalur arakidonat Olahraga Inflamasi Iskemia Proses metabolik dan degeneratif Oksigen yang digunakan dalam respirasi sel menjadi reaktif Superoksi da (O2-) NADPH Oksidase Xantin Oksidase Hidrogen peroksida (H2O2) Dipecah dibantu enzim Kandungan antioksidan Enzim Katalase (CAT) Superoksida dismutase (SOD) Enzim Glutathion Peroksidase (GPx) Induksi H2O2
pada hewan uji
Membentuk senyawa radikal lipid carbon centered (L) Mencegah proses stres oksidatif Merangsang pembentukan radikal bebas Terjadi reaksi Fenton dibantu logam transisi Hidroksil reaktif menuju membran lipid Membentuk senyawa hidroksil (OH-) yang reaktif Terdapat pada jantung H2O + O2 Dibantu glutathion Berikatan dengan PUFA Ekstrak sarang burung walet Menjadi radikal askorbat (Asc) Vitamin C yang tertinggal Antioksidan eksogen Antioksidan endogen 2H2O Jika tidak dipecah Vitamin E Vitamin C Asam amino Interaksi dengan 02 membentuk senyawa radikal lipid peroksida (LOO) Reduksi oleh vitamin E dalam membran Radikal lipid peroksida (LOO) tidak direduksi antioksidan Reduksi kembali TO Terjadi proses peroksidasi lipid Radikal vitamin E (TO) Menjadi vitamin E Meningkatkan aktivitas antioksidan enzimatik
2.9. Kerangka Konsep
Diinduksi radikal bebas H202
Diberi ekstrak sarang burung walet (Collocalia fuciphaga) Radikal bebas eksogen Vitamin C dan E Mengandung antioksidan Pengukuran aktivitas katalase (CAT) Antioksidan dan radikal bebas berikatan Meningkatkan aktivitas antioksidan enzimatik Asam amino Katalase (CAT) Penyusun antioksidan enzimatik
2.10. Definisi Operasional Tabel 2.10. Definisi Operasional
No Variabel Definisi Alat Ukur Cara Pengukuran Operasional Skala Pengukuran 1 Katalase (CAT) (mg/dl) Kadar biomarker stres oksidatif pada homogenat organ jantung tikus Sprague Dawley dalam satuan µmol/L Spektro- Fotometer UV Pembuatan homogenat jantung dengan kadar 50 mikroliter, masukkan tiap homogenat sebanyak 50 l ke dalam kuvet, lalu ditambahkan dengan larutan PBS sebanyak 50 l, dan diberi larutan H2O2 sebanyak 950 l. Masukkan ke dalam spektrofotometer UV dengan panjang gelombang 240 nm dan hitung aktivitas katalase pada menit ke 0, 1, 2, dan 3.
BAB 3
METODOLOGI PENELITIAN
3.1. Desain Penelitian
Desain yang digunakan pada penelitian ini adalah desain eksperimental
3.2. Waktu dan Tempat Penelitian 3.2.1. Waktu Penelitian
Penelitian akan dilaksanakan pada bulan Februari-September 2018. 3.2.2. Tempat Penelitian
Penelitian ini akan dilaksanakan di laboratorium Histologi untuk pemeriksaan gambaran mikroskopik sel jantung, dan laboratorium Biokimia untuk melakukan uji enzim katalase, di Fakultas Kedokteran Universitas Islam Negeri Syarif Hidayatullah Jakarta.
3.3. Sampel Penelitian dan Populasi
Sampel yang digunakan pada penelitian ini adalah jaringan organ jantung pada tikus putih jantan galur Sprague Dawley yang telah dilakukan oleh kelompok penelitian Muhammad Huda Ardo tahun 2017. Pada penelitian tersebut, digunakan hewan uji coba y aitu tikus putih jantan galur Sprague dawley yang telah diinduksi dengan pemberian ekstrak sarang burung walet putih (Collocalia
fuciphaga). Hewan uji diperoleh dari Animal Facility and Modelling Provider,
Institut Pertanian Bogor. Hewan uji merupakan tikus yang berusia 5-6 minggu, kondisi sehat, berbobot 150-220 gram dan berjumlah total 15 ekor dengan diberi lima perlakuan yang berbeda. Masing-masing perlakuan diberi pada tiga ekor tikus putih jantan. Hewan uji dikelompokkan menjadi lima kelompok sebagai berikut: (1) kelompok tikus normal dengan pemberian NaCMC 0,5% 10ml/kgBB peroral selama tigapuluh hari, (2) kelompok tikus kontrol positif dengan pemberian Vitamin E (1000 IU 4,08 mL/g) peroral selama tigapuluh hari dan diinduksi H2O2 1% dengan dosis 1 mg/kgBB intramuskular pada hari ke 31 dan
10 mg/kgBB peroral selama tiga puluh hari dan diinduksi H2O2 1% dengan dosis
1 mg/kgBB intramuskular pada hari ke 31 dan 32, (4) kelompok tikus perlakuan dengan pemberian ekstrak sarang burung walet berdosis sedang diberikan ekstrak sarang burung walet 20 mg/kgBB peroral selama tiga puluh hari dan diinduksi H2O2 1% dengan dosis 1 mg/kgBB intramuskular pada hari ke 31 dan 32, dan (5)
kelompok tikus perlakuan dengan pemberian ekstrak sarang burung walet berdosis tinggi diberikan ekstrak sarang burung walet 40 mg/kgBB peroral selama tiga puluh hari dan diinduksi H2O2 1% dengan dosis 1 mg/kgBB intramuskular
pada hari ke 31 dan 32.
Jumlah sampel disesuaikan dengan menggunakan rumus MEAD, yaitu:
Keterangan:
E : Derajat kebebasan komponen kesalahan (10-20) N : Jumlah sampel (dikurangi 1)
B : Blocking Component yang menggambarkan pengaruh
lingkungan yang diperbolehkan dalam penelitian (dikurangi 1)
T : Jumlah kelompok perlakuan (dikurangi 1)
10 = (N-1)-0-(5-1) 20 = (N-1)-0-(5-1)
N = 10+1+0+4 N = 20 +1+0+4
= 15 Sampel = 25 sampel
Berdasarkan hasil perhitungan sampel menggunakan rumus MEAD, ditemukan jumlah total hewan uji yaitu antara 15-25 sampel. Dan pada penelitian ini, dilakukan uji menggunakan hewan uji dengan total 15 ekor tikus, yang diberi 5 perlakuan berbeda pada masing-masing kelompok, dan tiap kelompok terdiri dari tiga ekor tikus.
3.3.1. Kriteria Inklusi
1. Tikus putih jantan galur Sprague Dawley. 2. Berperilaku dan beraktivitas normal.
3. Kondisi sehat dan tidak terdapat kelainan anatomis dan fisiologis sebelum perlakuan.
3.3.2. Kriteria Eksklusi
1. Hewan uji tampak sakit saat keberlangsungan penelitian. 2. Hewan uji mati saat penelitian berlangsung.
3.4. Variabel Penelitian 3.4.1. Variabel Bebas
Variabel bebas pada penelitian ini adalah pemberian ekstrak sarang burung walet (Collocalia fuciphaga) yang diberi secara per oral.
3.4.2. Variabel Terikat
Variabel terikat pada penelitian ini adalah aktivitas enzim katalase pada jantung tikus putih jantan galur Sprague Dawley.
3.5. Cara Kerja Penelitian 3.5.1. Alat dan Bahan Penelitian 3.5.1.1. Alat Penelitian
Alat yang digunakan pada penelitian ini pada uji aktivitas katalase adalah kuvet (30 buah), rak tabung, micropipet 100 mikroliter dan 1000 mikroliter, micro
tip, spektrofotometer UV, nanodrop, spatula, dan beaker glass. Pada penelitian ini
yang digunakan dalam pembuatan preparat histologi adalah botol kaca (1), beaker
glass 100 mL, timer, pinset, kaset, inkubator, pemanas, gelas ukur 100 mL, staining jar, corong kaca, paraffin wax, sendok berlubang, dan pensil 2B.
3.5.1.2. Bahan Penelitian
Bahan yang digunakan pada penelitian ini pada uji katalase adalah homogenat sebanyak 50 l, H202 950 l, dan larutan PBS 0,05 M pH 7 sebanyak
50 l. Bahan yang digunakan dalam pembuatan preparat histologi adalah jaringan jantung dalam larutan fiksatif, alkohol (30%, 50%, 70%, 80%, 90%, 95%) masing-masing dibuat tiga botol, alkohol absolut, alkohol toluol 1:1, kertas saring, toluol murni, toluol paraffin, paraffin cair, aquadest, xylol, larutan PBS pH 7,4 , larutan formalin 37%, silet, kertas label, larutan hematoksilin, acid alcohol, dan larutan eosin.
3.5.2. Pembuatan Ekstrak Sarang Burung Walet
Penelitian ini menggunakan ekstrak sarang burung walet putih (Collocalia
fuciphaga) yang diperoleh dari Painan, Sumatra Barat. Dilakukan uji determinasi
di Laboratorium Ornithologi, Pusat Penelitian Biologi bidang Zoologi LIPI Cibinong, Bogor (Lampiran 1). Proses pembuatan ekstrak diawali dengan pembersihan sarang burung walet dengan memisahkan bulu yang menempel pada sarang dengan pinset, lalu dialiri dengan air mengalir selama 5 menit, dan dikeringkan dalam suhu ruangan. Kemudian, sarang burung walet yang telah kering dihaluskan dengan blender. Setelah itu, dilakukan penimbangan serbuk sarang burung walet dengan hasil 511 gram. Setelah itu, serbuk sarang burung walet dilarutkan ke dalam aquabidest sebanyak 15,5 L dan dipanaskan dalam suhu 60ºC selama tigapuluh menit, lalu dihomogenisasi dengan kecepatan 800 rpm selama lima belas menit, dan dilanjutkan proses sonikasi selama tiga puluh menit. Dilakukan penyaringan menggunakan dua lapis kain kasa yang bertujuan untuk memisahkan ampas dan filtrat sarang burung walet. Filtrat yang didapat lalu dipekatkan dengan metode freeze dry selama empat belas hari disimpan dalam suhu -20ºC. Hasilnya didapatkan ekstrak sarang burung walet dengan berat sebanyak 26,607 gram dengan regimen 5,199%. (Lampiran 2).
3.5.3. Proses Terminasi Tikus
Penelitian ini menggunakan hewan uji berupa tikus putih jantan galur
Sprague dawley, yang diberi perlakuan selama 32 hari. Pada hari ke-33, seluruh
tikus dilakukan terminasi dengan pembiusan eter secara inhalasi. Tikus dimasukkan ke dalam wadah yang dilapisi kapas yang telah dibasahi oleh eter. Tikus yang telah mati dilakukan nekropsi untuk diambil organnya. Organ jantung dimasukkan ke dalam wadah, dan disimpan dalam suhu -80C.
3.5.4. Alur Penelitian Pengukuran Kadar Katalase
Siapkan organ jantung tikus yang akan dibuat menjadi homogenat, dan tetap dibiarkan dalam suhu dingin dengan dimasukkan ke dalam cooler box. Lalu, siapkan larutan buffer, timbangan analitik, kaca wadah, microtip, dan wadah penampung homogenat (microtube).
3.5.4.1. Penimbangan Bobot Total Organ
Organ jantung tikus ditimbang menggunakan timbangan analitik, dan dicatat masing-masing sampel berurutan dengan kode perlakuan.
3.5.4.2. Pengambilan Jaringan
Organ jantung tikus yang telah ditimbang dan dicatat, dipotong menggunakan pisau cutter hingga berbobot 50 miligram tiap sampel, lalu dimasukan kedalam microtube yang sesuai dengan kode sampel masing-masing tikus.
3.5.4.3. Pembuatan Homogenat Jaringan
Masukkan organ yang telah dipotong berukuran 0,05 gram ke dalam
microtube, lalu beri larutan PBS pH 7,4 sebanyak 1000 mikroliter menggunakan
micropipet, dan homogenisasi dengan menghancurkan menggunakan spatula. Simpan wadah di tempat yang dingin yang bersuhu -70C. Langkah berikutnya dilakukan pengukuran aktivitas Katalase (CAT).
3.5.4.4. Pengukuran Kadar Protein
Pengukuran kadar protein menggunakan nanodrop di laboratorium Biologi FK UIN, dan dimulai dengan persiapan alat yaitu nanodrop, micropipette,
microtube, microtip. Dan siapkan bahannya yaitu alcohol swab, tissue,
akuabidest, larutan PBS pH 7, dan sampel homogenat. Pengukuran dimulai dengan menyalakan nanospektrofotometer, lalu memilih software uji protein. Kemudian bersihkan nanodrop dengan aquabidest dan tutup dengan tissue. Pada nanodrop, klik blank, lalu tambahkan sampel yang akan diuji pada nanodrop sebanyak 1 L menggunakan mikropipet. Lalu klik measure pada nanodrop, dengan panjang gelombang 280 nm, dan catat berapa jumlah protein pada
masing-masing organ sesuai dengan kode sampel. Setelah selesai digunakan, bersihkan kembali nanodrop menggunakan aquabidest dan tutup software, dan matikan alat nanodrop. (Lampiran 4).
3.5.4.5. Pengukuran Aktivitas Katalase (CAT)
Pengukuran kadar katalase dimulai dengan mencairkan homogenat organ jantung tikus yang telah dibuat, dengan tetap didiamkan dalam suhu dingin di dalam cooler box. Lalu, dengan menggunakan mikropipet, masukkan tiap homogenat sebanyak 50 l ke dalam kuvet, lalu ditambahkan dengan larutan PBS sebanyak 50 l, dan diberi larutan H2O2 sebanyak 950 l. Masukkan ke dalam
spektrofotometer UV dengan panjang gelombang 240 nm dan hitung aktivitas katalase pada menit ke 0, 1, 2, dan 3. (Lampiran 5).
3.5.4.6. Analisis Data
Data pengukuran katalase yang telah tercatat dilakukan uji kemaknaannya dengan menggunakan program statistik SPSS versi 23. Pengujian dimulai dengan uji normalitas Shapiro-Wilk, diikuti uji homogenitas Levene. Jika data terdistribusi normal dan data memiliki varians yang sama, maka dapat dilakukan uji one way ANOVA. Jika data tidak terdistribusi normal dan varians tidak sama, maka dilakukan uji transformasi data. Jika pada uji normalitas dan homogenitas data tidak terdistribusi normal dan varians data tidak sama, maka dilakukan uji Kruskal-Wallis. Lalu, dilakukan pengukuran untuk membandingkan kemaknaan antar kelompok menggunakan uji Mann-Whitney.
3.5.5. Alur Pembuatan Preparat Histologi Jaringan Jantung 3.5.5.1. Fiksasi Jaringan
Tujuan dari fiksasi adalah untuk mempertahankan struktur dari jaringan agar tidak rusak. Fiksasi dapat dilakukan dengan cara yaitu menggunakan bahan kimia dan dengan menggunakan suhu. Pada penelitian ini, metode yang digunakan adalah dengan menggunakan bahan kimia yaitu formalin 10%. Lakukan pemotongan organ menggunakan pisau cutter, lalu masukkan potongan organ yang telah dibuat ke dalam cairan formalin 10%, dan diberi tambahan
larutan Phosphate-Buffered-Saline (PBS) dengan pH 7,4 sebagai penyangga agar mempertahankan integritas sel yang terdapat di dalam jaringan. Jaringan harus terlarut di dalam botol dengan perbandingan 1:20. Beri nama pada botol yang telah berisi organ dan larutan sesuai kode masing-masing tikus. Simpan jaringan di dalam suhu ruangan minimal dua jam.
3.5.5.2. Dehidrasi
Proses dehidrasi dilakukan menggunakan alkohol yang memiliki konsentrasi yang bervariasi, yaitu 30%, 50%, 70%, 80%, 90%, 95%, dan alkohol absolut. Lalu dilakukan penempatan dari setiap alkohol yang telah memiliki konsentrasi berbeda-beda ke dalam botol kaca. (Lampiran 7). Tiap larutan yang telah dibuat dengan varian konsentrasi dimasukkan ke tiga buah botol, dan diberi label I, II, dan III untuk mengurutkan proses dehidrasi. Tahap dehidrasi dimulai dari memasukkan potongan organ jantung ke dalam larutan dengan konsentrasi alkohol paling rendah hingga ke yang tinggi, diikuti dengan alkohol absolut. Mulai dari memasukkan ke dalam botol I alkohol 30%, lalu setelah 20 menit pindahkan potongan organ ke dalam botol II alkohol 30%, dan setelah 20 menit masukkan potongan dari botol II ke dalam botol III alkohol 30%. Dan setelah selesai di konsentrasi 30%, masukkan potongan organ jantung ke dalam larutan alkohol botol I 50% dan lakukan perendaman seperti sebelumnya secara berurutan. Lakukan perendaman berurutan dari larutan alkohol 30%, 50%, 70%, 80%, 90%, 95%, dan alkohol absolut.
3.5.5.3. Clearing
Proses clearing dilakukan dengan tujuan memisahkan alkohol dari jaringan. Proses ini dilakukan dengan memasukkan jaringan yang telah di dehidrasi ke dalam campuran larutan alkohol 25 ml dan toluol 25 ml selama 25 menit dengan perbandingan 1:1. Setelah itu ambil jaringan dan keringkan dengan kertas saring, lalu diikuti dengan memasukkan ke dalam toluol murni 100 ml selama 60 menit atau hingga jaringan menjadi bening.
3.5.5.4. Embedding
Proses embedding dilakukan dengan tujuan untuk mengeluarkan cairan dari proses clearing. Tahapannya yaitu mengambil jaringan yang telah diproses di clearing, lalu masukkan ke dalam larutan campuran toluol-paraffin sebanyak 50
ml dan rendam organ dalam larutan tersebut di suhu ruangan, diamkan dalam 24 jam. Lalu, siapkan paraffin cair yang telah dipanaskan dalam suhu 60 derajat, bagi dalam paraffin I, II, III, dan IV. Pindahkan jaringan yang telah direndam ke dalam paraffin cair I selama 15 menit. Lakukan pengulangan pada paraffin II, III, dan IV.
3.5.5.5. Blocking
Proses blocking bertujuan untuk membuat blok jaringan dalam tissue
casset, agar jaringan dapat dipotong dengan mikrotom. Ambil cairan parafin yang
telah dibuat, lalu tuangkan ke dalam cetakan blok tissue casset yang dibawahnya dilapisi oleh kertas tebal yang berukuran sama dengan tiap tissue casset. Masukkan potongan organ yang telah di embedding ke dalam cetakan secara perlahan, lalu tuangkan parafin hingga organ terendam di dalam cetakan. Tulis masing-masing dengan kode tiap tikus. Biarkan cetakan membeku di suhu ruangan, lalu lepas blok paraffin dari cetakan dan simpan blok dalam suhu dingin (4C).
3.5.5.6. Pemotongan Blok Jaringan
Pemotongan jaringan dilakukan menggunakan mikrotom. Blok paraffin dipotong menggunakan mikrotom dengan ketebalan 6 m. Lalu masukkan potongan yang mengandung jaringan ke dalam waterbath yang bersuhu 46C secara hati-hati. Siapkan kaca objek, oleskan dengan albumin dan gliserin sebagai bahan perekat. Tempatkan potongan jaringan dari waterbath ke atas kaca objek dan letakkan di atlas slide dryer bersuhu 60C hingga preparat siap untuk diwarnai.
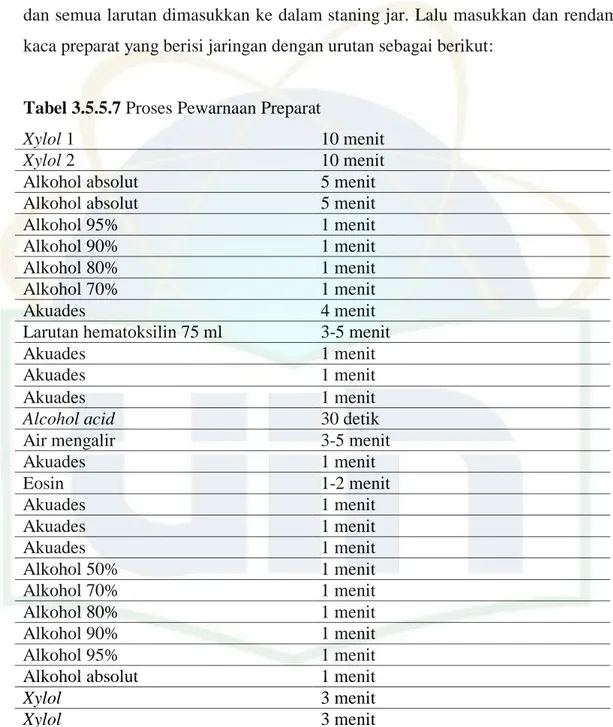
3.5.5.7. Pewarnaan dengan Hematoksilin-Eosin
Pewarnaan jaringan dilakukan untuk memberi warna pada irisan jaringan. Bahan yang digunakan adalah larutan hematoksilin dan larutan eosin. Larutan Hematoksilin dibuat dengan penimbangan 1 gram serbuk hematoksilin, potassium aluminium sulfat 50 gram, dan sodium iodate (NaIO3) 0,2 gram dilarutkan dalam satu liter akuades dengan magnetic stirrer dan diaduk. Diamkan satu malam di suhu ruangan. Lalu, tambahkan asam sitrat 50 gram dan chloral hydrate 50 gram, dan panaskan larutan diiringi diaduk selama lima menit, lalu dinginkan dan saring. Larutan Eosin dibuat dengan penimbangan serbuk eosin sebanyak 7,5