UIN SYARIF HIDAYATULLAH JAKARTA
PENETAPAN KADAR DAN ANALISIS PROFIL
PROTEIN DAN ASAM AMINO EKSTRAK AMPAS
BIJI JINTEN HITAM (
Nigella sativa
Linn.) DENGAN
METODE SDS-PAGE DAN KCKT
SKRIPSI
NIA YULIANI DEWI
NIM.108102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
PENETAPAN KADAR DAN ANALISIS PROFIL
PROTEIN DAN ASAM AMINO EKSTRAK AMPAS
BIJI JINTEN HITAM (
Nigella sativa
Linn.) DENGAN
METODE SDS-PAGE DAN KCKT
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi (S.Far)
NIA YULIANI DEWI
NIM.108102000030
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ABSTRAK
Nama : Nia Yuliani Dewi Program Studi : Farmasi
Judul : Penetapan Kadar dan Analisis Profil Protein dan Asam Amino Ekstrak Ampas Biji Jinten Hitam (Nigella sativa Linn.) dengan Metode SDS-PAGE dan KCKT.
Biji jinten hitam (Nigella sativa Linn.) merupakan salah satu tumbuhan obat yang antara lain berkhasiat sebagai pelancar ASI, peluruh buang angin, pencegah muntah, pencahar, pengelat, pengobatan pasca persalinan dan immunomodulator. Penelitian ini bertujuan untuk mengetahui kadar dan profil protein serta asam amino pada ekstrak ampas biji jinten hitam. Ekstraksi protein dari ampas biji jinten hitam (Nigella sativa Linn.) menggunakan PBS (phosphate buffer saline) pH 7,2 dan di sentrifuge dengan kecepatan 10.000 rpm pada suhu 40C selama 30 menit. Pengukuran kadar protein digunakan dengan metode Lowry menggunakan pereaksi folin-ciocalteu yang di ukur pada panjang gelombang 737,5 nm. Hasil pengukuran kadar protein dengan metode Lowry didapatkan kandungan protein pada ekstrak ampas biji jinten hitam yaitu 8,5848 mg/ml. Analisis profil protein dilakukan dengan menggunakan sodium dedosil sulfat poliakrilamid gel elektroforesis (SDS-PAGE). Elektroforesis gel poliakrilamid digunakan untuk mengetahui profil protein serta bobot molekul dari ampas biji jinten hitam (Nigella sativa Linn.). Pewarnaan pita protein menggunakan comassie brilliant blue. Data dianalisis secara deskriftif berdasarkan nilai migrasi pita protein sampel dibandingkan dengan pita protein marker (Rf). Hasil analisis profil protein dengan menggunakan SDS-PAGE menunjukkan pada ampas biji jinten hitam (Nigella sativa Linn.) terdapat pita protein dengan berat molekul 67,4839 kDa – 8,0872 kDa. Penentuan kandungan asam amino dilakukan dengan menggunakan KCKT. Hasil analisis kandungan asam amino pada ampas biji jinten hitam (Nigella sativa Linn.) menunjukkan terdapat 16 asam amino dengan kandungan total 1,055%. Diantaranya 9 asam amino esensial, yaitu histidin 0,015%, arginin 0,035%, treonin 0,021%, valin 0,032%, metionin 0,001%, lisin 0,182%, isoleusin 0,020%, leusin 0,030%, fenilalanin 0,013%; serta 7 asam amino non esensial, yaitu aspartat 0,058%, serin 0,064%, glutamat 0,071%, glisin 0,053%, alanin 0,219%, prolin 0,148%, dan tirosin 0,005%.
ABSTRACT facilitator milk, laxative flatulence, preventing vomiting, laxatives, postpartum treatment and immunomodulator. The aims of this research is to determine protein concentration and profile protein and amino acids on black cumin seeds waste extract. The extraction of proteins from the black cumin seeds waste (Nigella sativa Linn.) using PBS (phosphate buffer saline) pH 7.2 and centrifuged at 10,000 rpm at a 40C for 30 minutes. Measurement of protein concentration using the Lowry method using Folin-Ciocalteu reagent is measured at a wavelength of 737.5 nm. Protein measurement results obtained by the method of Lowry protein content from black cumin seed waste extrac is 8.5848 mg/ml. Poliacrylamide gel electrophoresis is used to know determine the molecular weight of the protein profile of black cumin seeds waste (Nigella sativa Linn.). Staining the protein comassie brilliant blue was used. Data were analyzed descriptively, based on score of the migration of the sample protein band compared marker protein band (Rf). Results of analysis of protein profiles using SDS-PAGE showed the of black cumin seeds waste (Nigella sativa Linn.) There is a protein band with BM 67.4839 – 8.0872 kDa. Determination of the amino acid content is done using HPLC. Results of analysis of amino acid content in the black cumin seeds waste (Nigella sativa Linn.) Shows are 16 amino acids with total amino acid 1,055%. Nine of them are assential amino acids, they are histidine 0,015%, arginine 0,035%, threonine 0,021%, valine 0,032%, metheonine 0,001%, lysin 0,182%, isoleucine 0,020%, leucine 0,030%, phenylalanine 0,013%. And the other seven are non-essential, they are aspartic acid 0,058%, serine 0,064%, glutamic acid 0,071%, glycine 0,053%, alanine 0,219%, proline 0,148%, dan tyrosine 0,005%.
KATA PENGANTAR
Puji syukur kepada Allah SWT. Atas segala rahmat-Nya, penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Kadar dan Analisis Profil Protein dan Asam Amino Ekstrak Ampas Biji Jinten Hitam (Nigella sativa Linn.) dengan Metode SDS-PAGE dan KCKT”. Skripsi ini disusun untuk memenuhi salah satu syarat menempuh ujian akhir guna memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penulis menyadari bahwa, keberhasilan penulisan dan penyusunan skripsi ini tidak lepas dari bantuan dan bimbingan serta do’a dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini. Oleh karena itu, penulis mengucapkan terima kasih kepada:
(1) Ibu Farida Sulistiawati, M.Si, Apt selaku pembimbing pertama dan Ibu Lina Elfita, M.Si, Apt selaku pembimbing kedua, yang memiliki andil besar dalam proses penelitian dan penyelesaian tugas akhir penulis ini, semoga segala pengarahan, nasehat, dukungan serta bantuan kedua pembimbing mendapat imbalan yang jauh lebih baik di sisi-NYA.
(2) Bapak Prof. Dr. (hc). Dr. M. K. Tadjudin, Sp. And. selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
(3) Bapak Drs. Umar Mansur, M.Sc, Apt, selaku ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
(4) Ibu Eka Putri, M.Si, Apt selaku pembimbing akademik.
(6) Para staf dan karyawan program studi Farmasi. Staf Administrasi Farmasi, Kak Pia yang telah banyak membantu dalam kelancaran studi kuliah.
(7) Pihak laboratorium Program Studi Farmasi Kak Eris, Mba Rani, Kak Yopi dan Kak Liken; Pihak Laboratorium Terpadu UIN Kak Prita, Kak Pipit; pihak Laboratorium PT. Saraswanti Indo Genetech Bogor. Terima kasih karena telah banyak membantu selama proses penelitian.
(8) Kedua Orang Tua, Ayahanda H. Anan Ardiansyah dan Ibunda Hj. Eni Suherti yang telah membesarkan, memberikan kasih sayang, mendoakan dan memberikan dukungan luar biasa baik moril maupun materil kepada penulis untuk segera menyelesaikan Skripsi ini. Terima kasih bapak dan mamah. Tiada apapun di dunia ini yang dapat membalas semua kebaikan yang telah bapak dan mamah berikan, hanya Allah yang bisa membalas dengan Jannah-Nya.
(9) Kakak penulis Teh Dian yang telah banyak memotivasi, menghibur dan memberikan do’a serta semangat hingga penulis dapat menyelesaikan skripsi ini dan adik-adik penulis Epul dan Thalita.
(10) Sahabat penulis Wiwin, Sinthi, Ade, Sivia dan Nurma yang telah menjadi sahabat-sahabat paling baik dan menjadikan hari-hari berwarna. Serta Imam Maulana yang telah memberikan dukungan dan doa serta semangat hingga penulis dapat menyelesaikan skripsi ini.
(11) Teman seperjuangan penelitian Sinthi Ayesha dan Zikriah atas perhatian, kerjasama dan kebersamaan selama penelitian ini.
(12) Teman-teman seperjuangan Farmasi angkatan 2008 yang sama-sama berjuang bersama untuk menyelesaikan pendidikan ini.
(13) Teman-teman Komda FKIK dan teman-teman akhwat Al-Kahfi 2008, terimakasih untuk motivasi dan semangat yang selalu kalian tularkan. Tiada kata yang dapat penulis ucapkan selain I love u all coz Allah.
(15) Pihak-pihak lain yang terlibat langsung maupun tidak dalam penulisan ini yang namanya tidak dapat disebutkan.
Semoga apa yang telah diberikan kepada penulis, baik dalam bentuk doa, dukungan, motivasi, dan tenaga atau apapun bentuknya. Semoga Allah membalas kebaikan ini. Aamiin Ya Rabb..
Ciputat, September 2013
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, saya yang bertanda tangan dibawah ini :
Nama : Nia Yuliani Dewi
NIM : 108102000030
Program Studi : Farmasi
Fakultas : Fakultas Kedokteran dan Ilmu Kesehatan Jenis karya : Skripsi
Demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah saya dengan judul:
PENETAPAN KADAR DAN ANALISIS PROFIL PROTEIN DAN ASAM AMINO EKSTRAK AMPAS BIJI JINTEN HITAM (Nigella sativa Linn.)
DENGAN METODE SDS-PAGE DAN KCKT.
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta. Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan sebenarnya.
Dibuat di : Jakarta
Pada Tanggal : 26 September 2013 Yang menyatakan,
DAFTAR ISI
Halaman
HALAMAN JUDUL………...…...…... ii
HALAMAN PERNYATAAN ORISISNALITAS………... iii
HALAMAN PERSETUJUAN PEMBIMBING………..... iv
HALAMAN PENGESAHAN………... v
ABSTRAK………...... vi
ABSTRACT ………...…....... vii
KATA PENGANTAR………...……….... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH... xi
DAFTAR ISI………..... xii
2.3.3 Pengukuran Kadar Protein... 10
2.3.4 Analisis Profil Protein... 11
2.3.5 SDS-PAGE... 12
2.4 Asam Amino…...………..………..…….. 13
BAB 3. METODOLOGI PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian... 17
3.2 Alat dan Bahan... 17
3.2.1 Alat... 17
3.2.2 Bahan... 17
3.3 Prosedur Penelitian... 18
3.3.1 Perolehan Simplisia... 18
3.3.2 Pembuatan Ekstrak Protein... 18
3.3.3 Pengukuran Kadar Protein dengan Metode Lowry... 19
3.3.4 Analisis Profil Protein Ekstrak Ampas Biji Jinten Hitam... 20
3.3.5 Analisis Asam Amino Ekstrak Ampas Biji Jinten Hitam... 21
BAB 4. HASIL DAN PEMBAHASAN... 23
4.1 Determinasi Biji Jinten Hitam ... 23
4.2 Ekstraksi Protein Ampas Biji Jinten Hitam... 23
4.3 Hasil Pengukuran Kandungan Protein Ekstrak Ampas Biji Jinten Hitam dengan Metode Lowry... 24
4.4 Analisis Profil Protein Ekstrak Ampas Biji Jinten Hitam dengan SDS-PAGE... 28
4.5 Analisis Asam Amino Ekstrak Ampas Biji Jinten Hitam dengan KCKT... 30
BAB 5. KESIMPULAN DAN SARAN... 34
5.1 Kesimpulan.………. 34
5.2 Saran...………. 34
DAFTAR TABEL
Halaman
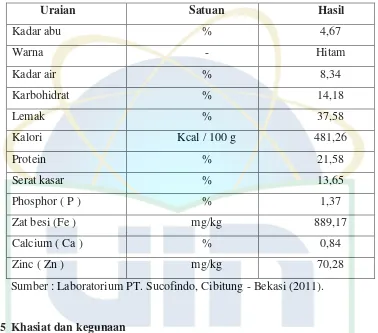
Tabel 2.1. Kandungan Nilai Gizi Ampas Biji Jinten Hitam ... 7
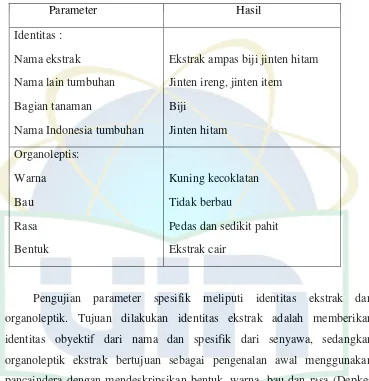
Tabel 4.1 Hasil Pengujian Identitas dan Organoleptik Ekstrak... . 24
Tabel 4.2. Nilai Serapan Spektrofotometri Seri Konsentrasi Larutan BSA ... 25
Table 4.3. Hasil Pengujian Kandungan Protein dengan Metode Lowry ... 27
DAFTAR GAMBAR
Halaman
Gambar 2.1. Jinten Hitam (Nigella sativa Linn.).. ... 6
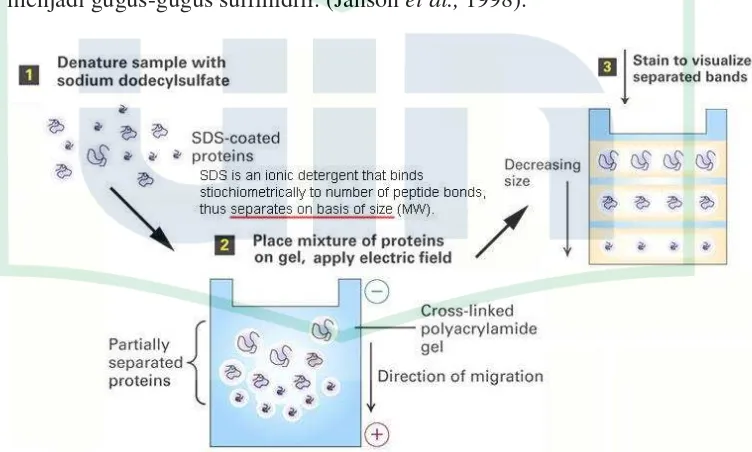
Gambar 2.2 Prinsip Kerja SDS-PAGE... 12
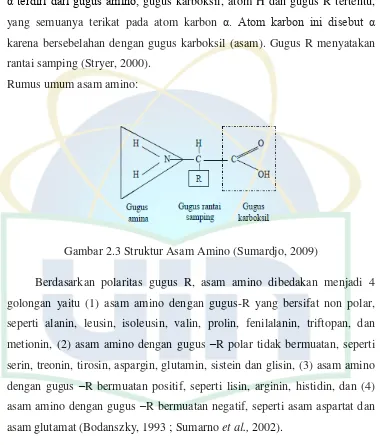
Gambar 2.3 Struktur Asam Amino ... 13
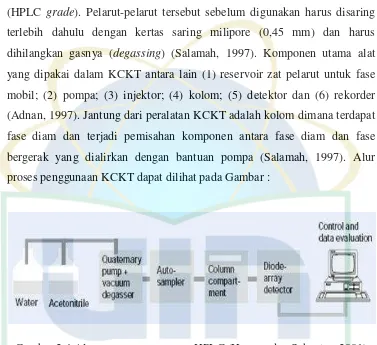
Gambar 2.4 Alur Proses Penggunaan HPLC ... 14
Gambar 4.1 Kurva dan Persamaan Kalibrasi Konsentrasi terhadap Serapan Larutan BSA ... ... 26
DAFTAR ISTILAH
SDS-PAGE : Sodium Dedosil Sulfat Poliakrilamid Gel Elektroforesis KCKT : Kromatgrafi Cair Kinerja Tinggi
BSA : Bouvine Serum Albumin UV-VIS : Ultra Violet – Visibel
LAF : Laminar Air Flow
TEMED : Tetramethylethylene Diamine PBS : Phospate Buffer Saline AABA : Alpha Amino Butiric Acid
AQC : 6-Aminoquinolyl-N-Hidroxysuccsinimidil Carbamate
AMQ : 6-Aminoquinolin
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Skema Prosedur Penelitian Secara Umum ... 41
Lampiran 2. Skema Kerja Penetapan Kadar Protein ... ... 42
Lampiran 3. Analisis Profil Protein dengan SDS-PAGE ... 43
Lampiran 4. Analisis Asam Amino dengan KCKT ... 44
Lampiran 5. Hasil Determinasi Biji Jinten Hitam ... 45
Lampiran 6. Spektrum Panjang Gelombang Maksimum ... 46
Lampiran 7. Bahan Pereaksi untuk SDS-PAGE ... 47
Lampiran 8. Bahan dan Alat Penelitian ... ... 49
Lampiran 9. Beberapa Hal Terkait SDS-PAGE ... 52
Lampiran 10. Kromatogram Standar Asam Amino ... 55
Lampiran 11. Kromatogram Ekstrak Ampas Biji Jinten Hitam ... 56
Lampiran 12. Hasil Analisis Asam Amino menggunakan KCKT ... 58
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Protein merupakan suatu zat makanan yang amat penting bagi tubuh, karena zat ini disamping berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai zat pembangun dan pengatur (Winarno, 1992).
Jinten hitam merupakan tanaman semusim, famili Ranunculaceae. Tanaman asli dari daerah Asia Barat, dan banyak tumbuh disekitar Laut Tengah. Secara tradisional, jinten hitam telah lama dikenal sebagai obat berbagai macam penyakit di banyak negara, termasuk Indonesia (Indriati dan Khaerati, 2009).
Selama berabad-abad biji dari tanaman jinten hitam (Nigella sativa Linn.) telah digunakan sebagai obat herbal untuk meningkatkan kesehatan dan melawan penyakit terutama di Timur Tengah dan Asia Tenggara (Gilani et al., 2004).
Jinten hitam diketahui memiliki banyak manfaat sesuai dengan sabda Rasulullah SAW didalam sebuah hadist Bukhari mengenai khasiat jinten hitam. Didalam kitab Shahih Bukhari Muslim, Abu Hurairah r.a. berkata bahwa dia mendengar Rasulullah S.A.W. bersabda sebagai berikut:
:لوقي س و هي ع ها ى ص ها لوسر ع س ه أ ه ع ها يضر ريره يبأ ع bersabda,”Sesungguhnya biji hitam itu mengandung obat untuk segala penyakit, kecuali sam (kematian).” (HR. Bukhari).
yang dimurnikan dengan kromatografi ion exchange juga ditemukan memiliki efek immunomodulator (Haq et al., 1999).
Dalam penelitian Al- Gaby, A.M, (1998) (tidak dilaporkan jenis biji jinten hitamnya), dikatakan bahwa biji jinten hitam mengandung konsentrasi protein sebesar 22,7%. Asam amino yang terkandung meliputi lisin, leusin, isoleusin, valine, glycine, alanin, fenilalanin, arginin, asparagin, cystine, asam glutamat, asam aspartat, prolin, serin, treonin, triptopan dan tirosin.
Berdasarkan hasil analisis ampas biji jinten hitam yang dilakukan oleh Laboratorium Sucofindo, Bekasi (2011) menyatakan bahwa ampas biji jinten hitam masih mengandung nutrisi penting bagi tubuh, diantaranya mengandung karbohidrat 14,18%, lemak 37,58%, protein 21,58%, phosphor, Fe, Ca dan Zn.
Berbagai studi telah dilakukan untuk menganalisa kadar protein dan asam amino dari ampas biji jinten hitam. Michel et al (2010) melakukan analisa profil protein ampas biji jinten hitam yang diekstraksi dengan menambahkan Tris-HCl kemudian di analisa menggunakan SDS-PAGE dengan konsentrasi akrilamid 12%. Dari penelitian tersebut, diperoleh hasil bahwa berat molekul protein ampas biji jinten hitam berkisar antara 91,97 kDa-29,00 kDa. Sedangkan untuk analisis asam amino dilakukan dengan menggunakan kromatografi penukar ion. Diperoleh hasil bahwa, ampas biji jinten hitam mengandung 16 asam amino. Diantaranya, asam aspartat 3,07%, Treonin 1,21%, serin 1,31%, asam glutamat 7,78%, prolin 1,58%, glisin 1,89%, alanin 1,47%, sistein 0,75%, valin 1,34%, metionin 0,53%, isoleusin 1,06%, leusin 2,04%, fenilalanin 1,16%, histidin 1,05%, lisin 1,10% dan arginin 2,86% (Michel et al., 2010).
Silvia et al (2012) melakukan analisa asam amino dari ampas biji jinten hitam berdasarkan perbedaan temperatur ekstraksi menggunakan HPLC dengan derivatisasi AQC (6-Aminoquinolyl-N-Hidroxysuccsinimidil Carbamate). Diperoleh hasil bahwa, ampas biji jinten hitam mengandung
Pada penelitian ini dilakukan penetapan kadar dan profil protein serta asam amino dari ekstrak ampas biji jinten hitam (Nigella sativa Linn.) dengan metode SDS-PAGE dan KCKT. Pelarut yang digunakan untuk mengekstraksi ampas biji jinten hitam adalah PBS (Phosphate Buffer Saline). Adapun penetapan kadar protein dari ekstrak ampas biji jinten
hitam (Nigella sativa Linn.) dilakukan dengan metode Lowry. Berdasarkan studi literatur, penetapan kadar protein ekstrak ampas biji jinten hitam (Nigella sativa Linn.) menggunakan metode Lowry belum pernah dilakukan. Metode Lowry merupakan metode yang paling banyak digunakan untuk menentukan kandungan protein suatu sediaan tumbuhan (Harbone, 1987). Selain itu, uji Lowry seratus kali lebih sensitif dibandingkan dengan reaksi Biuret (Coligan et al., 2007).
Selanjutnya dilakukan analisis profil protein dengan menggunakan SDS-PAGE. Identifikasi SDS-PAGE merupakan teknik elektroforesis yang menggunakan gel poliakrilamida yang bertujuan untuk memisahkan protein dalam sampel berdasarkan berat molekul (Janson et al., 1998). SDS-PAGE dinilai lebih menguntungkan dibandingkan elektroforesis kertas dan elektroforesis pati. Hal ini disebabkan karena besarnya medium penyangga, serta perbandingan konsentrasi akrilamida dan bis-metilen akrilamida. Selain itu, gel ini tidak menimbulkan konveksi dan transparan (Bintang, 2010). Selanjutnya dilakukan analisis asam amino secara kromatografi. Cara kromatografi telah memiliki banyak pengembangan, salah satu yang umum yaitu kromatografi cair kinerja tinggi (KCKT). KCKT mampu memisahkan senyawa yang serupa dengan resolusi yang baik serta dapat bekerja lebih cepat sehingga waktu yang dibutuhkan singkat (Adnan, 1997).
1.2 Perumusan Masalah
Berdasarkan latar belakang tersebut di atas, maka dapat dirumuskan beberapa permasalahan sebagai berikut:
1. Berapakah kadar protein ekstrak ampas biji jinten hitam?
2. Bagaimanakah profil protein ekstrak ampas biji jinten hitam yang dianalisa dengan SDS-PAGE?
3. Bagaimanakah profil asam amino ekstrak ampas biji jinten hitam yang dianalisa dengan KCKT ( Kromatografi Cair Kinerja Tinggi)?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mengetahui kadar protein ekstrak ampas biji jinten hitam. 2. Mengetahui profil protein ekstrak ampas biji jinten hitam.
3. Mengetahui jenis dan kadar asam amino ekstrak ampas biji jinten hitam.
1.4 Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Jinten Hitam (Nigella sativa Linn.)
2.1.1 Klasifikasi Tanaman
Berdasarkan ilmu taksonomi, klasifikasi tanaman jinten hitam adalah sebagai berikut (Depkes RI, 1979):
Sumatera : Jinten item (Melayu) (Anonim, 1983)
2.1.3 Morfologi
kelopak bunga, berbulu jarang dan pendek. Bibir bunga dua, bibir bagian atas agak pendek, lanset, ujung memanjang berbentuk benang, ujung bibir bunga bagian bawah tumpul. Benang sari banyak, gundul. Kepala sari jorong dan sedikit tajam, berwarna kuning. Buah bulat telur atau agak bulat. Biji hitam, jorong bersudut tiga tak beraturan dan sedikit berbentuk kerucut, panjang 3 mm, berkelenjar (Depkes RI, 1989).
Gambar 2.1. Jinten Hitam (Nigella sativa Linn.) Sumber : Bamusa dan Al-Hujaj, 2011.
2.1.4 Kandungan Kimia
Bijinya juga mengandung lipase, fitosterol, dan β-sitosterol (Hasan Gilani et al., 2004).
Tabel 2.1. Kandungan nilai gizi ampas biji jintan hitam (Nigella sativa Linn.)
Sumber : Laboratorium PT. Sucofindo, Cibitung - Bekasi (2011).
2.1.5 Khasiat dan kegunaan
Biji jinten hitam digunakan sebagai pelancar ASI, peluruh buang angin, pencegah muntah, pencahar, pengelat, dan pengobatan pasca persalinan (Depkes RI, 1985). Selain itu, biji jinten hitam menunjukkan aktivitas imunopotentiating, immunomodulasi dan memiliki aktivitas seperti interferon (Hailat et al., 1995). Protein dari biji jinten hitam yang dimurnikan dengan kromatografi ion exchange juga ditemukan memiliki efek immunomodulator (Haq et al., 1999).
leukimia karsinoma (Norsharina et al., 2011), peningkat sistem imun (Swamy et al., 2000) dan anti bakteri (Halawani, 2009).
2.2 Ekstrak
2.2.1 Pengertian Ekstrak
Ekstrak adalah sediaan kental yang diperoleh dengan menarik senyawa aktif dari simplisia nabati ataupun hewani menggunakan pelarut yang sesuai. Ragam ekstraksi yang tepat sudah tentu bergantung pada tekstur dan kandungan air bahan tumbuhan yang diekstraksi dan pada jenis senyawa yang diisolasi (Harbone, 1987).
Ekstraksi tanaman obat adalah pemisahan secara kimia atau fisika suatu bahan padat atau bahan cair dari suatu padatan, yaitu tanaman obat (Depkes RI, 2000).
Ekstraksi merupakan kegiatan penarikan kandungan kimia yang terdapat pada simplisia. Karena didalam simplisia mengandung senyawa aktif yang berbeda-beda dan mempunyai struktur kimia yang berbeda-beda, sehingga metode didalam penarikan senyawa aktif didalam simplisia harus memperhatikan faktor seperti: udara, suhu, cahaya, logam, berat. Proses ekstraksi dapat melalui tahap menjadi: pembuatan serbuk, pembasahan, penyarian, dan pemekatan (Depkes RI, 1978).
2.3 Protein
Istilah protein yang dikemukakan pertama kali oleh pakar kimia Belanda, G.J.Mulder pada tahun 1939, yang berasal dari bahasa Yunani
“proteios”. Proteios sendiri mempunyai arti yang pertama atau yang paling utama. Protein memegang peranan yang sangat penting pada organisme, yaitu dalam struktur, fungsi, dan reproduksi (Sumardjo, 2009).
2.3.1 Struktur Protein
Berdasarkan strukturnya, protein dibentuk oleh:
1. Struktur primer, dibentuk oleh ikatan peptida antar asam amino. Struktur ini mengacu pada jumlah, jenis, serta urutan asam amino yang membentuk rantai polipeptida.
2. Struktur sekunder, dibentuk oleh ikatan hidrogen intramolekular yang terjadi di antara oksigen karbonil dan nitrogen amida pada perangkat peptida.
3. Struktur tersier, merupakan rangkaian molekular yang menggambarkan bentuk keseluruhan dari protein.
4. Struktur kuartener dibentuk oleh beberapa polipeptida yang berikatan satu sama lain tidak secara kovalen (Bintang, 2010).
2.3.2 Fungsi Protein
Protein memegang peranan penting dalam hampir semua proses biologi. Peran dan aktivitas protein terlihat dalam contoh berikut ini:
1. Katalis enzimatik.
Hampir semua reaksi kimia dalam sistem biologi dikatalisis oleh makromolekul spesifik yang disebut enzim. Enzim mempunyai daya katalitik yang besar, umumnya meningkatkan kecepatan reaksi sampai jutaan kali. Fakta menunjukkan bahwa hampir semua enzim yang dikenal adalah protein. Jadi protein merupakan pusat dalam menetapkan pola transformasi kimia dalam sistem biologis.
2. Transport dan penyimpanan.
Berbagai molekul kecil dan ion ditransport oleh protein spesifik. 3. Koordinasi gerak.
Protein merupakan komponen utama dalam otot. Kontraksi otot berlangsung akibat pergeseran dua jenis filamen protein.
4. Penunjang mekanis.
Ketegangan kulit dan tulang disebabkan oleh kolagen yang merupakan protein fibrosa.
Antibodi merupakan protein yang sangat spesifik dan dapat mengenal serta berkombinasi dengan benda asing seperti virus, bakteri dan sel yang berasal dari organisme lain.
6. Membangkitkan dan menghantar impuls saraf.
Respons sel saraf terhadap rangsang spesifik diperantai oleh protein reseptor.
7. Pengaturan pertumbuhan dan diferensiasi.
Pengaturan urutan ekspresi informasi genetik sangat penting bagi pertumbuhan yang beraturan serta diferensiasisel.
2.3.3 Pengukuran Kadar Protein
Adapun metode yang dilakukan untuk penetapan kadar protein pada penelitian ini yaitu dengan metode Lowry.
Metode Lowry dikembangkan pada tahun 1951 dengan menggunakan reagen pendeteksi Folin-ciocalteu. Reagen ini biasa digunakan untuk mendeteksi gugus-gugus fenolik. Dalam keadaan basa, ion tembaga divalen (Cu2+) dengan ikatan peptida yang mereduksi Cu2+ menjadi tembaga monovalen (Cu+) (Bintang, 2010). Dalam analisa protein reagen Folin-Ciocalteu dapat mendeteksi residu oksidasi dimana gugus fenolik tirosin akan mereduksi fosfotungstat dan fosfomolibdat yang terdapat pada reagen tersebut menjadi tungsten dan molibden yang berwarna biru. Hasil reduksi ini dapat dianalisa lebih lanjut dengan melihat puncak absorpsi yang lebar pada daerah panjang gelombang sinar tampak (600-800nm).
2.3.4 Analisis Profil Protein dengan Elektroforesis Gel Poliakrilamid SDS
(Sodium Dodesil Sulfat)
Pemisahan protein merupakan tahap yang harus dilakukan untuk mempelajari sifat dan fungsi protein. Protein dapat dipisahkan dari protein jenis lain atau dari molekul lain berdasarkan ukuran, kelarutan, muatan, dan afinitas ikatan (Nelson, 2004). Salah satu teknis yang digunakan untuk melihat profil protein dan menentukan bobot molekulnya menggunakan SDS-PAGE (Stryer, 1995).
Elektroforesis adalah suatu teknik pemisahan molekul selular berdasarkan ukurannya, dengan menggunakan medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Jika molekul yang bermuatan negatif dilewatkan melalui satu medium, misalnya gel agarosa, kemudian dialiri arus listrik dari satu kutub ke kutub yang berlawanan muatannya, maka molekul tersebut akan bergerak dari kutub negatif ke kutub positif. Kecepatan gerak molekul tersebut tergantung pada nisbah (rasio) muatan terhadap massanya, serta tergantung pula pada bentuk molekulnya (Yuwono, 2005).
Elektroforesis pada umumnya digunakan untuk menentukan berat molekul (BM), mendeteksi kemurnian dan kerusakan protein atau asam nukleat, menetapkan titik isoelektrik, serta memisahkan spesies-spesies yang berbeda secara kualitatif dan kuantitatif (Bintang, 2010).
2.3.5. SDS PAGE (Sodium Dedosil Sulfat Poliakrilamid Gel Elektroforesis).
Salah satu jenis elektroforesis yang digunakan secara luas pada saat ini adalah elektroforesis SDS gel poliakrilamida (SDS PAGE).
Pemisahan protein dengan metode SDS-PAGE bertujuan untuk memisahkan protein dalam sampel berdasarkan berat molekul. Prinsip dasar SDS-PAGE ini adalah denaturasi protein oleh sodium dedosil sulfat yang dilanjutkan dengan pemisahan molekul berdasarkan berat molekulnya dengan metode elektroforesis yang menggunakan gel, dalam hal ini yang digunakan adalah poliakrilamid (Janson et al., 1998).
SDS-PAGE dilakukan pada pH netral. Pada metode ini digunakan SDS dan beta-merkaptoetanol. SDS merupakan anionic detergent yang bersama dengan beta-merkaptoetanol dan pemanasan menyebabkan rusaknya struktur tiga dimensi protein menjadi konfigurasi random coil. Hal ini disebabkan oleh terpecahnya ikatan disulfida yang selanjutnya tereduksi menjadi gugus-gugus sulfihidril. (Janson et al., 1998).
Gambar 2.2 Prinsip Kerja SDS PAGE (Sobti, et al 2008 dan Stryer, 2002) ((1) Denaturasi sampel dengan sodium dedocyl sulfate (SDS) menyelubungi
protein. (2) Penempatan protein sampel pada gel kemudian dialiri listrik.
2.4 Asam Amino
Asam amino merupakan unit dasar struktur protein. Suatu asam amino α terdiri dari gugus amino, gugus karboksil, atom H dan gugus R tertentu, yang semuanya terikat pada atom karbon α. Atom karbon ini disebut α karena bersebelahan dengan gugus karboksil (asam). Gugus R menyatakan rantai samping (Stryer, 2000).
Rumus umum asam amino:
Gambar 2.3 Struktur Asam Amino (Sumardjo, 2009)
Berdasarkan polaritas gugus R, asam amino dibedakan menjadi 4 golongan yaitu (1) asam amino dengan gugus-R yang bersifat non polar, seperti alanin, leusin, isoleusin, valin, prolin, fenilalanin, triftopan, dan metionin, (2) asam amino dengan gugus –R polar tidak bermuatan, seperti serin, treonin, tirosin, aspargin, glutamin, sistein dan glisin, (3) asam amino dengan gugus –R bermuatan positif, seperti lisin, arginin, histidin, dan (4) asam amino dengan gugus –R bermuatan negatif, seperti asam aspartat dan asam glutamat (Bodanszky, 1993 ; Sumarno et al., 2002).
2.4.1 Kromatografi Cair Kinerja Tinggi (KCKT)
distribusi/absorbsi/adsorbsi komponen di antara dua fase yang berbeda, yaitu fase diam (stasioner) dan fase gerak (mobil) (Salamah, 1997).
Pelarut yang biasanya digunakan pada KCKT adalah air, metanol, asetonitril, kloroform, dan pelarut lainnya yang berada dalam keadaan murni (HPLC grade). Pelarut-pelarut tersebut sebelum digunakan harus disaring terlebih dahulu dengan kertas saring milipore (0,45 mm) dan harus dihilangkan gasnya (degassing) (Salamah, 1997). Komponen utama alat yang dipakai dalam KCKT antara lain (1) reservoir zat pelarut untuk fase mobil; (2) pompa; (3) injektor; (4) kolom; (5) detektor dan (6) rekorder (Adnan, 1997). Jantung dari peralatan KCKT adalah kolom dimana terdapat fase diam dan terjadi pemisahan komponen antara fase diam dan fase bergerak yang dialirkan dengan bantuan pompa (Salamah, 1997). Alur proses penggunaan KCKT dapat dilihat pada Gambar :
Gambar 2.4 Alur proses penggunaan HPLC (Husgen dan Schuster, 2001)
pada suhu 1000C. Hidrolisis basa menghasilkan destruksi arginin, sistein, serin, dan treonin (Bailey, 1990). Dengan hidrolisis asam, triptofan tidak stabil dalam lingkungan asam, sehingga rusak dalam hidrolisis asam dan sedikit kerusakan juga terjadi pada serin dan treonin, sedangkan asparagin dan glutamin akan terhidrolisa sempurna menjadi asam aspartat dan asam glutamat dengan membebaskan ion amonium (Linder, 1992 ; Sumarno et al., 2002). Selain itu, ada pula hidrolisis enzim. Peristiwa ini terjadi didalam
tubuh. Untuk menghancurkan makanan, perut memiliki enzim dengan kadar tertentu yang dapat dikatalisi untuk memotong ikatan peptida yang dikenal sebagai peptidase. Amino peptidase bekerja cepat dan efisien dalam hidrolisis ikatan peptida sekaligus memotong suatu residu asam amino mulai dari ujung N (Bailey, 1990). Pemisahan yang umum dilakukan adalah dengan cara kromatografi. Di antara teknik kromatografi yang dapat dilakukan dengan pemisahan, yaitu kromatografi penukar ion, kromatografi kertas, dan kromatografi cair kinerja tinggi. Selain itu, pemisahan asam amino dapat pula dilakukan dengan elektroforesis kertas (Bailey, 1990).
derivatization), atau sesudah pemisahan dari kolom (post colomn
derivatization) (Adnan, 1997).
BAB 3
METODOLOGI PENELITIAN
3. 1 Tempat dan Waktu Penelitian
Penelitian dilakukan dilaboratorium Jurusan Farmasi UIN Syarif Hidayatullah Jakarta, Laboratorium Mikrobiologi Pusat Laboratorium Terpadu Kampus UIN Syarif Hidayatullah Jakarta, Laboratorium PT. Saraswanti Indo Genetech, waktu penelitian ini berlangsung dari bulan Januari sampai Agustus 2013.
3.2 Alat dan Bahan
3.2.1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer UV-VIS (ParkinElmer Lambda 25), pH meter, 1 set alat elektroforesis (Bio-Rad), mikropipet beserta tipnya, erlenmeyer, labu ukur, sentrifuge beserta tabungnya, peralatan gelas, pinset, spatula, syringe, tabung reaksi, tabung ulir, batang pengaduk, vial, oven, timbangan analitik (Wiggen Hauser), pipet volumetrik, vortex, pipet tetes, gelas piala, gelas ukur, tabung reaksi, Laminar Air Flow (LAF), 1 set perangkat KCKT (Waters tipe Breeze).
3.2.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah ampas biji jinten hitam (diperoleh dari PT. Lantabura Internasional, Depok, berasal dari negara Ethiopia), aquabidest, dinatrium hidrogen fosfat, natrium klorida, natriumm dihidrogen posfat, Bovin Serum Albumin (BSA), natrium karbonat, natrium hidroksida, CuSO4.H2O, Na.K-tartrat, pereaksi folin
30% akrilamid, 0,8% bisakrilamid, buffer Tris-HCL 1,5 M pH 8,8, buffer Tris-HCL 0,5 M pH 6,8, larutan 10% ammonium persulfat, larutan 10% (w/v) SDS, TEMED (tetramethylethylenediamine), sample buffer, buffer elektroforesis, metanol, AccQ•Tag Reagen Kit dari Waters (Milford, Massachusetts, USA). Reagen kit terdiri dari Waters AccQ-Tag. Fluor Borate Buffer, Waters AccQ•Tag Fluor Reagen serbuk (6 -aminoquinolil-N-hidroksi-succinimidil karbamat–AQC), Waters AccQ•Tag Fluor Reagen Diluent, dan Hidrolisat Asam Amino Standar dari Waters (tiap ampul
mengandung 2.5 mM campuran hidrolisat asam amino yaitu asam aspartat (Asp), serin (Ser), asam glutamat (Glu), glisin (Gly), histidin (His), arginin (Arg), treonin (Thr), alanin (Ala), prolin (Pro), tirosin (Tyr), valin (Val), metionin (Met), lisin (Lys), isoleusin (Ile), leusin (Leu), fenilalanin (Phe), triptofan, kecuali sistein (Cys) 1.25 mM, asetonitril grade HPLC, aquabidest.
3.3 Prosedur Penelitian.
3.3.1 Perolehan Simplisia
Bahan yang digunakan adalah ampas biji jinten hitam (Nigella sativa Linn.) yang diperoleh dari lempeng biji yang dihaluskan. Pembuatan ampas dilakukan dengan menghaluskan lempeng menggunakan blender hingga diperoleh serbuk berukuran 40 mesh
3.3.2 Pembuatan Ekstrak Protein (Afrozul Haq et al., 1995)
3.3.3 Pengukuran Kadar Protein dilakukan dengan Metode Lowry
Pengukuran kandungan protein ekstrak ampas biji jinten hitam (Nigella sativa Linn.) dilakukan di Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta.
a. Pembuatan Spektrum
Kuvet diisi dengan salah satu larutan protein standar dengan konsentrasi 200 ppm. Larutan blanko disiapkan dengan menggunakan aquades. Absorban larutan dibaca pada kisaran panjang gelombang 400-800 nm dengan interval 5 mm. Pada setiap interval panjang gelombang diukur dengan larutan standar dan blanko. Dibuat kurva hubungan panjang gelombang dengan absorbans standar terkoreksi. Panjang gelombang yang tepat untuk larutan tersebut kemudian ditentukan dan digunakan untuk pengukuran selanjutnya.
b. Pembuatan kurva kalibrasi
Dibuat larutan stok BSA konsentrasi 1000 ppm dengan menimbang serbuk BSA sebanyak 50 mg kemudian dilarutkan dengan aquades sebanyak 50 ml. Kemudian dilakukan pengenceran dengan seri konsentrai 0, 40, 80, 120, 160, 200 ppm.
Sebanyak 1000 µl larutan protein standar BSA dengan seri pengenceran konsentrasi (0, 40, 80, 120, 160, 200 ppm). Larutan standar dimasukkan kedalam tabung. Campuran 50:1 (Na2CO3 2% dalam NaOH 0,1
N dan larutan CuSO4 0,5% dalam larutan Na.K tartrat 1%) disiapkan.
Kemudian campuran tersebut ditambahkan sebanyak 5 ml ke dalam larutan standar dan dibiarkan selama 10 menit, lalu ditambahkan 0,5 ml pereaksi folin-ciocalteau, kocok dan dibiarkan selama 30 menit. Absorbannya di ukur dengan spektrofotometer pada panjang gelombang 737,5 nm.
c. Pengukuran kadar protein ekstrak ampas biji jinten hitam
Campuran 50:1 larutan (Na2CO3 2% dalam NaOH 0,1 N dan larutan CuSO4
0,5% dalam larutan Na.K tartrat 1%) disiapkan. Kemudian campuran tersebut ditambahkan sebanyak 5 ml ke dalam larutan sampel dan dibiarkan selama 10 menit, lalu ditambahkan 0,5 ml pereaksi folin-ciocalteau, kocok dan dibiarkan selama 30 menit. Absorbannya di ukur dengan spektrofotometer pada panjang gelombang 737,5 nm.
3.3.4 Analisis Profil Protein Ekstrak Ampas Biji Jinten Hitam
Analisis profil protein ekstrak ampas biji jinten hitam (Nigella sativa Linn.) dilakukan di Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta.
Pada penelitian ini, profil protein dianalisis dengan menggunakan Sodium dodecyl sulphate polyacrilamyde gel electrophoresis (SDS-PAGE)
berdasarkan metode Laemmli dalam Coligan et al (1995) dengan sistem buffer Laemmli dan konsentrasi gel poliakrilamid yang digunakan adalah
12%. Gel poliakrilamid dicetak diantara dua buah lempengan kaca. larutan separating gel yang telah dibuat, disiapkan dimasukkan ke dalam cetakan
gel dengan menggunakan mikro pipet sampai batas tertentu, kemudian ditambahkan dengan aquades sampai penuh agar permukaan gel rata. Setelah gel mengering, aquades dibuang dan sisa air pada cetakan gel diserap dengan kertas saring. Kemudian larutan stacking gel yang telah dibuat dimasukkan ke dalam cetakan dan permukaan gel dipasang sisir berlubang lalu didiamkan sampai mengeras. Setelah gel mengeras, cetakan gel dipindahkan ke perangkat elektroforesis.
Preparasi sampel dilakukan dengan memasukkan ekstrak ampas biji jinten hitam yang telah disiapkan sebelumnya ke dalam tabung eppendorf dan ditambahkan masing-masing sampel buffer dengan perbandingan 1:1 dan 2:1. Kedua tabung dipanaskan pada suhu 1000C selama 5 menit.
dihubungkan ke power supply dengan tegangan 200 V selama 55 menit sampai pewarna mencapai ujung gel.
Visualisasi gel menggunakan coomassie briliant blue selama semalam dan digoyangkan dengan alat penggoyang shaker. Selanjutnya, gel dicuci sebanyak dua kali dengan menggunakan larutan destaining masing-masing selama 15 menit. Setelah pita terlihat, gel dicuci dengan aquades.
Identifikasi dan analisis SDS PAGE membandingkan antara pita protein yang telah dipisahkan sebelumnya dengan protein standar. Bobot molekul dari masing-masing protein ditentukan dengan cara menghitung nilai Rf dari masing-masing pita protein yang tampak. Kemudian dibuat kurva standar hubungan antara log BM dengan Rf dari protein standar sehingga nilai BM protein sampel dapat dihitung.
3.3.5 Analisis Asam Amino Ekstrak Ampas Biji Jinten Hitam
Analisis asam amino dilakukan di Laboratorium PT. Saraswanti Indo Genetech Bogor.
Sebelum dianalisis, preparasi sampel dilakukan dengan cara: sebanyak 0,1 - 0,5 gram ekstrak ampas biji jinten hitam ditimbang lalu ditambahkan 5 mL HCl 6 N, vortex kemudian ditambahkan gas nitrogen dan dihidrolisis pada suhu 1100 selama 22 jam. Hidrolisat yang diperoleh didinginkan pada suhu kamar, lalu dipindahkan ke labu ukur 100 ml, kemudian ditambahkan aquabidest sampai tanda batas. Lalu disaring dengan filter 0,45µm. Pipet 500 µl filtrat lalu tambahkan 40 µL AABA ± 460 µl aquabidest. Pipet 10 µl larutan kemudian tambahkan 70 µl AccQ-Fluor Borate, vortex. Tambahkan 20 µl reagen fluor A, vortex, diamkan 1 menit. Inkubasi selama 10 menit pada suhu 550C, lalu suntikan pada HPLC. Dengan kondisi kromatografi menggunakan kolom C18, temperatur 370C, fase gerak asetonitril 60%, detektor fluorescence, laju alir 1 ml/menit dan volume penyuntikan 5µl.
AA (mg/100 gram) =
Keterangan:
Area komponen sampel = area asam amino sampel Cstd = Konsentrasi standar (
BM = Berat Molekul
BAB 4
HASIL DAN PEMBAHASAN
4.1. Determinasi Biji Jinten Hitam
Sampel biji jinten hitam yang diperoleh dari PT. Lantabura International, Depok, Jawa Barat, dideterminasi di Herbarium Bogoriense, Puslit Biologi Bidang Botani LIPI Cibinong, Bogor, Jawa Barat, menunjukkan bahwa jenis sampel yang digunakan pada penelitian ini adalah benar biji jinten hitam (Nigella sativa Linn.) dengan family (suku) Ranunculaceae. Tujuan dilakukan determinasi adalah untuk mengidentifikasi simplia. Hasil determinasi dapat dilihat pada lampiran 5.
4.2 Ekstraksi Protein Ampas Biji Jinten Hitam
Ampas biji jinten hitam memiliki ukuran partikel 40 mesh, bau aromatik, rasa pedas dan pahit. Proses ekstraksi yang dilakukan terhadap ampas biji jinten hitam menggunakan pelarut PBS (Phosphate Buffer Saline) pH 7,2 kemudian disentrifuge pada kecepatan 10.000 rpm, pada
suhu 40C selama 30 menit. Menurut Janson dan Ryden (1998) masalah utama dalam hal ekstraksi protein adalah dapat mengeluarkan protein dari dalam sel tanpa terdegradasi atau terdenaturasi dan tidak kontaminasi sehingga hal tersebut dapat diatasi dengan pemilihan medium ekstraksi yang tepat, waktu persiapan cepat dan pada kondisi temperatur yang rendah. Adapun sentrifuge digunakan untuk memisahkan protein berdasarkan berat molekul. Ekstraksi dilakukan menggunakan PBS (Phosphate Buffer Saline) pH 7,2 karena buffer ekstraksi yang ideal untuk target protein biasanya antara pH 7,0 dan pH 8,5 hal ini bertujuan untuk membantu kestabilan target protein atau menghalangi dari aktivitas protein yang tidak dikehendaki (Bonner, 2007).
Pengujian parameter spesifik meliputi identitas ekstrak dan organoleptik ekstrak.
Tabel 4.1 Hasil Pengujian Identitas Ekstrak dan Organoleptik. Parameter Hasil
Pengujian parameter spesifik meliputi identitas ekstrak dan organoleptik. Tujuan dilakukan identitas ekstrak adalah memberikan identitas obyektif dari nama dan spesifik dari senyawa, sedangkan organoleptik ekstrak bertujuan sebagai pengenalan awal menggunakan pancaindera dengan mendeskripsikan bentuk, warna, bau dan rasa (Depkes RI, 2000).
4.3 Hasil Pengukuran Kandungan Protein Ekstrak Ampas Biji Jinten
Hitam dengan Metode Lowry
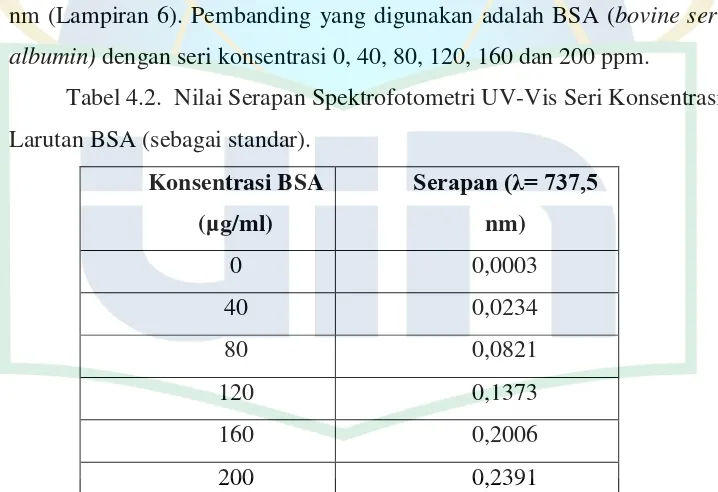
dalam NaOH, ion tembaga divalen (Cu2+) membentuk suatu kompleks dengan ikatan peptida yang mereduksi Cu2+ menjadi tembaga monovalen (Cu+) (Gornall et al., 1949 dan Coligan et al., 2007). Reaksi yang kedua adalah reaksi reduksi oleh reagen folin-Ciocalteu (fosfomolibdat dan fosfotungstat). Ion Cu+ dan gugus radikal dari tirosin dan triftopan bereaksi dengan pereaksi folin untuk menghasilkan suatu produk yang tidak stabil yang mereduksi molibdenum atau tungsten blue. Protein akan bereaksi dengan pereaksi folin-ciocalteu membentuk senyawa kompleks yang memberikan warna biru (Coligan et al., 2007). Warna yang diperoleh diukur absorbannya dengan menggunakan spektrofotometer pada panjang gelombang maksimum antara 400-800 nm. Adapun saat penelitian, panjang gelombang serapan maksimum hasil optimasi yang digunakan adalah 737,5 nm (Lampiran 6). Pembanding yang digunakan adalah BSA (bovine serum albumin) dengan seri konsentrasi 0, 40, 80, 120, 160 dan 200 ppm.
Tabel 4.2. Nilai Serapan Spektrofotometri UV-Vis Seri Konsentrasi Larutan BSA (sebagai standar).
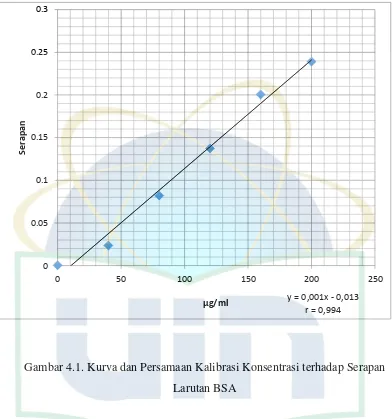
Tujuan dari pembuatan larutan standar dengan berbagai seri konsentrasi adalah untuk menentukan kadar protein dalam suatu sampel dengan menggunakan persamaan regresi linear garis lurus yang diperoleh dari grafik larutan standar.
Gambar 4.1. Kurva dan Persamaan Kalibrasi Konsentrasi terhadap Serapan Larutan BSA
Dari gambar diatas, kurva menunjukkan slop positif dengan gradien garis mendekati 1 (0,994). Dengan regresi linear, diperoleh pula nilai a = -1,343 x 10-2 dan b = 1,272 x 10-3. Sehingga, untuk persamaan garis y = bx + a diperoleh persamaan y = 1,272 x 10-3 - 1,343 x 10-2.
Berdasarkan persamaan dan kurva kalibrasi, kandungan protein dari ekstrak cair protein ampas biji jinten hitam yang di uji secara duplo dan diambil nilai rata-ratanya, yaitu 8,5848 mg/ml atau 0,0923% terhadap ekstrak cair atau 0,8 % terhadap serbuk ampas.
y = 0,001x - 0,013 r = 0,994 0
0.05 0.1 0.15 0.2 0.25 0.3
0 50 100 150 200 250
S
e
rap
an
Tabel 4.3. Hasil Pengujian Kandungan Protein Ekstrak Ampas Biji Jinten Hitam Nigella sativa Linn dengan Metode Lowry.
Adapun kelemahan dalam metode Kjehdal bahwa purin, pirimidin, vitamin-vitamin, asam amino besar, kreatin serta kreatinin ikut teranalis dan terukur sebagai nitrogen protein (Bintang, 2010).
4.4 Analisis Profil Protein Ekstrak Ampas Biji Jinten Hitam dengan
SDS-PAGE
Analisis profil protein ekstrak ampas biji jinten hitam ini dilakukan dengan teknik elektroforesis menggunakan gel poliakrilamid sebagai medium pemisahan. Pada sistem ini, gel yang digunakan terdiri dari dua jenis gel berbeda, yaitu separating gel (gel pemisah) dan stacking gel (gel penumpuk). Pemisahan protein dengan elektroforesis gel poliakrilamid berdasarkan pada perbedaan muatan dan ukuran molekul dapat dilakukan dengan menambahkan detergen ionik dan menambahkan tahap denaturasi (Kurniati dan Wanadi, 2001). Pada proses persiapan sampel, sampel ditambahkan dengan suatu detergen anionik seperti sodium dodesil sulfat (SDS). Sebelum elektroforesis, sampel yang akan dipisahkan dilarutkan terlebih dahulu dalam suatu dapar yang mengandung Tris-HCl, SDS, gliserol, bromfenol biru dan merkaptoetanol.
Tujuan penggunaan SDS dan merkaptoetanol disertai dengan pemanasan akan memecah struktur tiga dimensi dari ptotein, terutama ikatan disulfida menjadi subunit-subunit polipeptida secara individual. SDS juga membungkus rantai protein yang terikat dengan muatan negatif yang sama membentuk kompleks SDS-protein. Kompleks SDS-protein memiliki densitas muatan yang identik dan bergerak pada gel hanya berdasarkan ukuran protein (Wijaya dan Rohman 2005; Fatmawati et al., 2009). Oleh karena itu, kompleks SDS-protein yang lebih besar mempunyai mobilitas yang lebih rendah dibandingkan dengan kompleks SDS-protein yang lebih kecil (Fatmawati et al., 2009).
percobaan. Pengaturan tercatat tersebut dipilih karena telah memberikan hasil yang paling baik di antara percobaan-percobaan yang telah dilakukan. Elektroforesis dilakukan sampai pewarna mencapai bagian dasar gel. Waktu yang diperlukan adalah 55 menit.
Elektroforesis dilakukan terhadap sampel berupa ekstrak ampas biji jinten hitam hasil ekstraksi dengan menggunakan PBS (phosphate buffer saline) pH 7,2 dan menggunakan standar berat molekul pembanding
(marker protein) Prestained SDS-PAGE Standars Broad Range dari Bio-Rad. Hasil SDS - PAGE berdasarkan perhitungan berat molekul sesuai dengan kurva standar protein (Lampiran 10.2), menunjukkan bahwa terdapat beberapa protein yang tampak. Marker protein yang digunakan adalah miosin 250 kDa, Β-galaktosidase 150 kDa, BSA 75 kDa, Ovalbumin 50 kDa dan soybin tripsin inhibitor 25 kDa. Kurva standar yang dihasilkan dari marker protein ini memiliki persamaan linier Y = -1,469 X + 2,352; R = 0,971; r = 0,985. Dengan Y adalah log bobot molekul (BM) dan X adalah Rf (nisbah antara migrasi pita protein sampel dengan migrasi pita protein marker).
No. 1 = Marker Prestained SDS-PAGE standars Broad Range No. 2 = Ekstak ampas biji jinten hitam hasil Freeze dry 10 µl 1:1 No. 3 = Ekstak ampas biji jinten hitam hasil Freeze dry 10 µl 1:1 No. 4 = Ekstak ampas biji jinten hitam hasil Freeze dry 10 µl 2:1 No. 5 = Ekstak ampas biji jinten hitam hasil Freeze dry 10 µl 2:1
4.5
Analisis Asam Amino Ekstrak Ampas Biji Jinten Hitam dengan KCKT Asam amino esensial sangat dibutuhkan oleh manusia karena tidak dapat disintetis sendiri oleh tubuh. Semakin lengkap dan tinggi kandungan gizi asam amino dalam biji maka nilai gizi semakin baik dan diharapkan dapat menyamai protein hewani (Richana, 2000) .Linn.). Analisis asam amino diawali dengan hidrolisis. Pada tahap ini, hidrolisis rantai polipeptida yang sempurna dilakukan dengan HCl 6 N pada suhu 1100C selama 22 jam. Hidrolisis dilakukan dengan HCl karena HCl dapat memecah ikatan peptida secara sempurna dan dapat dengan mudah hilang dari hidrolisat dengan adanya pengupan (Masuda dan Dohmae, 2011). Setelah larutan di hirdolisis, hidrolisat yang diperoleh kemudian didinginkan pada suhu kamar dan ditera volume nya dengan aquabidest. Setelah itu larutan disaring. Sampel asam amino ditambahkan dengan AABA (Alpha amino butyric acid) sebagai internal standar dan digenapkan volumenya dengan aquabidest. Penambahan larutan standar internal digunakan untuk mengoreksi hilangnya residu asam amino selama proses hidrolisis karena aliran atau penghancuran.
Sampel mulai di derivatisasi dengan reagen AQC (6-aminoquinolyl-N-hidroxysucsinimidil carbamate) yang sering dilakukan secara prakolom di
ikuti oleh pemisahan fase terbalik KCKT dengan menggunakan detektor fluoresensi. Penderivat AQC ini merupakan penderivat yang paling stabil jika dibandingkan dengan agen penderivat yang lainnya. Agen penderivat AQC dapat bereaksi dengan asam amino primer dan asam amino sekunder dan menghasilkan derivat fluoresen dengan eksitasi 250 nm dan emisi 395 nm (Bosch et al., 2006 ; Eriksson et al., 2009). Kelebihan reagen AQC dapat bereaksi dengan air dan membentuk 6-aminoquinolin (AMQ), N hidroksi succsinimidi (NHS) dan karbondioksida (CO2) (Salazar et al,
2012). AMQ bereaksi sangat lambat dengan reagen AQC berlebih membentuk bis aminoquinolin urea. Produk-produk samping tidak mengganggu identifikasi dan kuantifikasi dari salah satu asam amino.
Analisis asam amino dengan metode KCKT menunjukkan data kandungan asam amino ekstrak ampas biji jinten hitam Nigella sativa Linn sebagaimana pada tabel 4.2.
Tabel 4.4. Hasil Analisis Kandungan (% b/b) Asam Amino dalam Ekstrak Ampas Biji Jinten Hitam Nigella sativa Linn.
Dari tabel diatas, hasil analisis asam amino dari ampas biji jinten hitam dengan menggunakan KCKT, menunjukkan bahwa ekstrak ampas biji jinten hitam mengandung 16 asam amino dengan kandungan total 1,055%. Diantaranya 9 asam amino esensial, yaitu histidin 0,015%, arginin 0,035%, treonin 0,021%, valin 0,032%, metionin 0,001%, lisin 0,182%, isoleusin 0,020%, leusin 0,030%, fenilalanin 0,013%; serta 7 asam amino non esensial, yaitu aspartat 0,058%, serin 0,064%, glutamat 0,071%, glisin 0,053%, alanin 0,219%, prolin 0,148%, dan tirosin 0,005%.
Kandungan asam amino esensial yang tertinggi pada ampas biji jinten hitam adalah lisin dengan nilai 0,182%. Lisin merupakan asam amino degan No Asam Amino Kandungan Asam Amino (perlakuan duplo)
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dari hasil penentuan kadar menggunakan metode Lowry diketahui kadar protein pada ekstrak ampas biji jinten hitam (Nigella sativa Linn.) adalah 8,5848 mg/ml.
2. Hasil analisis profi protein dengan metode SDS-PAGE terhadap ekstrak ampas biji jinten hitam (Nigella sativa Linn.) menunjukkan adanya pita protein dengan bobot molekul 67,4839 kDa – 8,0872 kDa.
3. Hasil analisis asam amino dengan menggunakan KCKT terhadap ekstrak ampas biji jinten hitam (Nigella sativa Linn.) terdapat 16 asam amino dengan kandungan total 1,055%. Diantaranya 9 asam amino esensial, yaitu histidin 0,015%, arginin 0,035%, treonin 0,021%, valin 0,032%, metionin 0,001%, lisin 0,182%, isoleusin 0,020%, leusin 0,030%, fenilalanin 0,013%; serta 7 asam amino non esensial, yaitu aspartat 0,058%, serin 0,064%, glutamat 0,071%, glisin 0,053%, alanin 0,219%, prolin 0,148%, dan tirosin 0,005%.
5.2 Saran
1. Perlu dilakukan ekstraksi dengan menggunakan komposisi buffer ekstraksi yang lain sehingga hasil kandungan protein dan asam amino yang didapatkan lebih besar.
DAFTAR PUSTAKA
Adnan M. (1997). Teknik Kromatografi untuk Analisis Bahan Makanan. Yogyakarta : Andi Yogyakarta.
Al-gaby, A. M. (1998). Amino Acid Composition and Biological Effects of Supplementing Broad Been and Com Protein with Nigella sativa (Black Cumin)
Cake Protein,Nahrung. 42: 290-294.
Bachrudin Z. (1999). Petunjuk Laboratorium: Isolasi, Identifikasi, dan Pewarnaan Protein. PAU BioteknologiUGM. Yogyakarta.
Bailey, P.D. (1990). An Introduction to Peptide Chemistry. Wiley interscience. New York.
Bamusa U.A dan Al-Hujaj A.Y. (2011). Sembuh dan Sehat dengan
Habbatussauda’ Obat Segala Penyakit. Aqwamedika. Solo. Hal : 34
Bintang, Maria. (2010). Biokimia Teknik Penelitian. Erlangga, Jakarta. Hal : 99, 103-106.
Bodanszky, M. (1993). Chemistry of Peptide, Spinger-Verlag, Berlin. Hal : 47-52.
Bonner, Philip, L.R. (2007). Protein Purification The Basics. Nottingham Trent University. Taylor & Francis Group. Hal : 31.
Bosch L, Alegria A, Farre R. (2006). Application of the 6-Aminoquinolyl-N-Hydroxysccinimidil Carbamate (AQC) Reagent to the RP-HPLC Determination of
Coligan, J, Dunn, B, Ploengh, H, Speicher, D, and Wingfield, P. (2007). “Current
Protocols in Protein Sciences,” Vol. 1.John Wiley & Sons, New York. Hal : 332-340.
Departemen Kesehatan RI. (1979). Materia Medika Indonesia Jilid III. Direktorat Jendral Pengawasan Obat dan Makanan. Jakarta. Hal : 114-117.
Departemen Kesehatan RI. (1985). Tanaman Obat Indonesia Jilid I. Direktorat Jendral Pengawasan Obat dan Makanan : Jakarta. Hal. 33.
Departemen Kesehatan Republika Indonesia. (1989). Vademekum Bahan Obat Alam.Direktorat Jendral Pengawasan Obat dan Makanan. Jakarta. Hal : 99-100.
Fatmawati, U, Suranto dan Sajidan. (2009). Ekspresi Protein pada Mikroorganisme Resisten Cr dengan Metode Elektroforesis. Bioteknologi. 6 (1): 40-48.
Eriksson J, Janasson S, Papaefthimiou D, Rasmussen U and bergman B. (2009). Improving Derivatization Efficiency of BMAA Utilizing AccQ-Tag in a Complex
Cyanobacterial Matrix.Departement of Botany, Stockholm University. 36:43-48.
Gilani Hassan A. (2004). A Review of Medicinal Uses and Pharmacological Activities of Nigella sativa L,. Departement of Biological and Biomedical Science.
7(4): 441-451.
Gornall, A.G., Bardawill, C.S., and David, M.M.(1949). Determination of Serum Proteins by Means of the Biuret Method.J. Biol. Chem. 177:751-766.
Hailat, N., Bataineh, Z., Lafi, S. et al. (1995). Effect of Nigella sativa volatile oil on Jurkal T cell leukemia polypeptides. International Journal of Pharmacognosy,
Halawani, Eman. (2009). Antibacterial Activity of Thymoquinone and Thymohydroquinone of Nigella sativa L. and Their Interaction with Some Antibiotics.Department of Biology Faculty of Science Taif University. 3 (5-6):
148-152.
Harborne, J.B. (1987). Metode Fitokimia Penuntun Cara Modern Menganalisis Tumbuhan. Penerbit ITB : Bandung. Hal 6-9.
Harli M. (2008). Asam Amino Esensial. http://www.suparmas.com. [4 september 2013 pukul: 07:00].
Haq, A., Remo, N. R., and Al-Sedairy, S. T. (1996). Fractionation of Black seed (Nigella sativa Linn) proteins byusing Rotofor. J. Liq. Chrom. Rel. Technol., 19,
593-599.
Haq, A, Abdullatif Mohammad, Lobob Peter I., Khabar, S.A. Khalid, Shet V. Kirtikant and Al-sedairy T.sultan. (1995). Nigella sativa: Effect on Human Lymphocytes and Polymorphonuclear Leukocyte Phagocytic Activity.International
Journal of Immunopharmacology 30. 147-155.
Haq, A, Lobob Peter I., Al-Tufailc Mohammad, Nona R. Ramaa, and Al-Sedairya, S.T. (1999). Immunomodulatory effect of Nigella Sativa Proteins Fractionated by Ion Exchange Chromatography.International Journal of Immunopharmacology
21. 283-295.
Haq, A, Abdullatif M, Lobo IP, Khabar, S.A.K, Sheth. V.K and Al-sedairy T.S. (1995). Nigella sativa; Effect on Human Lymphocytes and Polymorphonuclear Leukocyte Phagocytic Activity.Immunopharmacology 30 (1995) 147-155.
Indriati G dan Khaerati. (2009). Peluang Budidaya dan Manfaat Jintan Hitam (Nigella sativa). Warta Penelitian dan Pengembangan Tanaman Industri, Volume 15 Nomor 1. Hal 23-24.
Janson, J.C and Ryden, L. (1998). Protein Purification: Principles, High Resolution Methodes, and Applications, 2nd edition. A john willey & Sons Inc.
Pub., Hal: 464-484.
Khanza, Abu. (2010). Fit and Fresh Through Habbatussauda. Cicero Publishing : Jakarta. Hal. 45-56.
Kurniati, Vita dan Wanadi, I,S. (2001). Pemisahan Protein Berdasarkan Berat Molekul dalam Buku Biokimia: Eksperimen Laboratorium.Biokimia FKUI. Hal.
35-37.
Linder M. C. (1992). Biokimia, Nutrisi dan Metabolisme (diterjemahkan oleh Aminuddin dan Amwila A,Y). Universitas Indonesia Press. Jakarta 89-115.
Masuda, A dan Dohmae, N. (2011). Amino Acid Analysis Of Sub-Picomolar Amounts of Proteins by Precolom Fluoresence Derivatization with
6-Aminoquinolyl-N-Hydroxysuccinimidyl Carbamate. Jepang. Bioscience Trends;
5(6):231-238. DOI: 10.5582/bst.v5.6.231.
Michel, G. C. et al. (2010). Phytochemical and Biological Investigation of the Extracts of Nigella sativa L. Seed Waste.Drug Testing and Analysis. John Wiley
& Sons, Ltd. DOI 10.1002/dta.225.
Norsharina, ismail et al (2011). Thymoquinone Rich Fraction from Nigella sativa and Thymoquinone are Cytotoxic Towards Colon and Leukemic Carcinoma Cell
Lines. Academic Journals. pp. 3359-3366.
Paarakh, Padmaa M. (2010). A Comprehensive Review Nigella sativa Linn. Department of Pharmacognosy, The Oxford College of Pharmacy. pp.409- 429.
Poedjiadi Anna, Supriyanti Titin F.M. (1994). Dasar-Dasar Biokimia Edisi Revisi. Penerbit Universitas Indonesia (UI Press): Jakarta. Hal. 81, 109.
Salamah E. (1997). Analisis Kimia Menggunakan HPLC Bagian-I.Buletin Teknologi Hasil Perikanan. Vol 3:1.
Salazar. C, Armenta JM, Cortes FD, and Shulaev V. (2012). Chapter :2 Combination of an AccQ-Tag Ultra Performance Liquid Chromatoghraphic
Method with Tandem Mass Spectrometry for the Analysis of Amino acids dalam Amino Acid Analysis: Methods and Protocols, Method in Molecular Biology.http://www.spinger.com/978-1-61779-444-5 diakses pada tanggal 4 September 2013 pukul 4:00.
Sastrohamidjojo, Hardjono. (1996). Sintesis Bahan Alam.Gadjah Mada University Press. Yogyakarta. Hal : 169.
Silvia. D. et al. (2012). The Effect of Different Extraction Temperature of the Screw Press on Proximate Compositions, Amino Acid Contens and Mineral
Contents of nigella sativa Meal. American Journal of Food Technology.
7(4).180-191.
Singh, gurdip. et al(2005). Chemical Constituents and Antimicrobial and Antioxidant Potentials of Essential Oil and Acetone Extract of Nigella sativa
Stryer L. (1995). Biokimia. Sadikin et al, penerjemah; Soebianto S, editor.Jakarta: EGC. Terjemahan dari:Biochemistry.
Sudarmadji S, Haryono B, dan Suhardi. (1981). Analisa Bahan Makanan dan Pertanian. Cetakan ke-3. Yogyakarta: Pusat Antar Universitas, Universitas Gajah
Mada.
Sumardjo Damin. (2009). Pengantar Kimia. Buku Panduan Kuliah Mahasiswa Kedokteran dan Program Strata I Fakultas Bioeksakta. Penerbit Buku
Kedokteran EGC: Jakarta. Hal. 161-172.
Sumarno, Noegrohati S, Narsito dan Falah II (2002). Estimasi Kadar Protein dalam Bahan Pangan Melalui Analisis Nitrogen Total dan Analisis Asam Amino.
Majalah Farmasi Indonesia. 13 (1), 34 – 43.
Swamy S.M.K. (1998). Cytotoxic and Immunopotentiating Effects of Ethanolic Extract of Nigella sativa L. Seeds.Department of Pharmacology, Faculty
ofMedicine, National University of Singapore. 70 (2000) 1–7.
Wijaya SKS, Rahman L. (2005). Fraksinasi dan Karakterisasi Protein Utama Biji Kedelai. Fakultas MIPA Universitas Jember. Jember.
Winarno FG. (2008). Kimia Pangan dan Gizi. Jakarta: PT. Gramedia.
Yeheya M. (2009). A Review Therapeutic Role of Phrophetic Medicine Habbat El Baraka (Nigella sativa L.). Departement of Pharmacy. 7 (9): 1203-1208.
Lampiran 1. Skema Prosedur Penelitian Secara Umum
Ampas biji jinten hitam
Ampas biji jinten hitam dilarutkan dalam phospahate buffer saline (pH 7,2)
Sentrifuge pada 10.000 rpm selama 30 menit pada suhu 40C
Pelet Supernatan
Freeze dry
Penetapan Kadar Protein Analisis Profil Protein Analisis Asam Amino
Lampiran 2. Skema Kerja Penetapan Kadar Protein dengan Metode Lowry
a. Pembuatan Kurva Kalibrasi
Absorbannya di ukur dengan spektrofotometer pada panjang gelombang 737,5 nm.
Pembuatan Larutan Induk BSA 1000 ppm
Ditambahkan 5 ml Campuran 50:1 (Na2CO3 2% dalam NaOH 0,1 N
dan larutan CuSO4 0,5% dalam larutan Na.K tartrat 1%). Kocok dan
dibiarkan selama 10 menit.
Pembuatan seri konsentrasi BSA ( 0, 40, 80, 120, 160, 200 ppm)
Ditambahkan 0,5 ml pereaksi folin-ciocalteau, kocok dan dibiarkan selama 30 menit
Lampiran 3. Analisis Profil Protein dengan SDS-PAGE dipanaskan pada suhu 1000C selama
5 menit.
Elektroforesis dilakukan dengan cara sampel dimasukkan ke dalam sumur yang telah dicetak pada gel
Lampiran 7. Bahan Pereaksi untuk SDS PAGE (berdasarkan metode
Laemmli 1970 dalam Coligan et al 1995)
Pembuatan Larutan Stok 30% akrilamid/0,8% bisakrilamid
Sebanyak 30 gram akrilamid ditambahkan dengan 0.8 gram N’, N’-metilen bisakrilamid ditimbang, kemudian dilarutkan dengan aquabidest sampai volume 100 ml. Setelah itu, larutan tersebut disaring dengan kertas saring dan disimpan pada suhu 40C dalam kondisi gelap. dan larutan siap digunakan.
Pembuatan Buffer 4x Tris-HCl/SDS, pH 6,8 (Stacking Buffer)
Sebanyak 6.05 gram Tris dilarutkan dalam 60 ml aquabidest. pH diatur menjadi 6,8 dengan HCl 6 N. total volume digenapkan sampai 100 ml dengan penambahan aquabidest. Larutan disimpan pada suhu 40C dan larutan siap digunakan.
Pembuatan Buffer 4x Tris-HCl/SDS, pH 8,8 (Resolving / Separating)
Sebanyak 18,15 gram Tris dilarutkan dalam 75 ml aquabidest. Atur pH 8,8 dengan HCl 6 N, kemudian ditambahkan aquabidest hingga volume totalnya 100 ml. Larutan disimpan pada suhu 40Cdan larutan siap digunakan.
Pembuatan Buffer Sampel
Larutan dibuat dengan mencampurkan 2 ml larutan SDS 10%, 2,5 ml gliserol, 1,25 ml buffer Tris HCl pH 6,8, 3,55 aqubidest dan 0,2 ml larutan bromofenol biru 0,5% atau secukupnya sampai terbentuk warna biru gelap pada larutan. Terakhir ditambahkan 0,5 ml 2-merkaptoetanol.
Pembuatan 10x Buffer Elektroforesis (Running Buffer)
Pembuatann Separating Gel 12%
Larutan separating gel dibuat dengan cara 30% acrylamide solution 4 ml ditambahkan separating gel buffer (1,5 M Tris HCl pH 8,8) sebanyak 2,5 ml kemudian aquabidest 3,4 ml, 10 % SDS 0,1 ml dan Ammonium PerSulfate (APS) 0,2 ml serta TEMED 0,01 ml.
Pembuatan stacking gel (5%)
Lampiran 8. Bahan dan Alat Penelitian
5.1 Bahan Penelitian
Gambar 1. Ampas biji jinten hitam
Gambar 2. Serbuk ampas biji jinten hitam
Gambar 3. Larutan induk BSA 10.000 ppm
Gambar 4. Ekstrak terlarut ampas biji jinten
hitam Gambar 5. Ekstrak Cair Ampas Biji Jinten Hitam
Gambar 6. Standar BSA untuk Lowry
Gambar 7. Sampel
untuk Lowry Gambar 8. Pereaksi folin
ciocalteu Gambar 9. Standar marker
Gambar 13. Tris-HCl pH 8,8
Gambar 14. Bromophenol Blue
Gambar 15. Larutan stok acrilamid
Gambar 16. Sampel buffer + β merkaptoetanol
5.2 Alat Penelitian
Gambar 1. J2-H5 Sentrifuse BECKMAN
Gambar 2. Bagian dalam J2-H5 Sentrifuse
BECKMAN Gambar 3. Vortex
Gambar 4.
Spektrofotometer Gambar 5. Tip mikropipet
Gambar 6. Elektroforesis gel poliakrilamid
Gambar 7.
Power Supply Gambar 8.
Wadah Elektroforesis
Gambar 9.
Lampiran 9. Beberapa Hal Terkait Analisis Protein dengan SDS-PAGE
1) Gambar Sticker Katalog Prestained SDS-PAGE Standards, Broad Range.
Pita Marker yang Muncul pada saat Elektroforesis
Protein MW ( kDa)
Miosin 250
Β-galaktosidase 150
BSA 75
Ovalbumin 50
2) Tabel dan Kurva Rf terhadap Log BM Pita Marker Protein Prestained SDS-PAGE Standars – Broad Range
Protein d ( cm ) MW (kDa) Rf Log MW
Miosin 0,1 250 0,016949152 2,397940009
Β-galaktosidase 0,7 150 0,118644067 2,176091259
BSA 1,5 75 0,254237288 1,875061263
Ovalbumin 2,6 50 0,440677966 1,698970004
Soybean trypsin inhibitor
4,0 25 0,677966101 1,397940009
Loading dye 5,9 cm
y = -1,469x + 2,352 r = 0,985 0
0.5 1 1.5 2 2.5 3
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
Lo
g
BM
Bobot molekul protein ampas biji jinten hitam
Sampel Migrasi Band Rf b a Log BM BM Kda