VALIDASI METODE ANALISIS TIMOKUINON
SERTA PENETAPAN KADAR TIMOKUINON DALAM
MINYAK BIJI JINTEN HITAM (
Nigella sativa
L
.
)
SECARA KROMATOGRAFI CAIR KINERJA TINGGI
(KCKT)
SKRIPSI
BOY REYNALDI NOOR
1112102000071
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
ii
VALIDASI METODE ANALISIS TIMOKUINON
SERTA PENETAPAN KADAR TIMOKUINON DALAM
MINYAK BIJI JINTEN HITAM (
Nigella sativa
L
.
)
SECARA KROMATOGRAFI CAIR KINERJA TINGGI
(KCKT)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar sarjana farmasi
BOY REYNALDI NOOR
1112102000071
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
vi Nama : Boy Reynaldi Noor Program Studi : Farmasi
Judul Skripsi : Validasi Metode Analisis Timokuinon serta Penetapan Kadar Timokuinon dalam Minyak Biji Jinten Hitam (Nigella sativa
L.) secara Kromatografi Cair Kinerja Tinggi (KCKT)
Penetapan kadar timokuinon menjadi penting untuk dilakukan karena timokuinon telah diketahui sebagai senyawa marker aktif dalam minyak biji jinten hitam. Kandungan kimia yang terdapat di dalam minyak biji jinten hitam ini cukup banyak, maka dari itu diperlukan suatu metode analisis yang dapat memisahkan senyawa-senyawa tersebut yang bersifat selektif dan sensitif. Pada penelitian ini, telah dilakukan optimasi kondisi dan validasi metode analisis timokuinon menggunakan kromatografi cair kinerja tinggi (KCKT). Hasil optimasi metode menggunakan sistem kromatografi terdiri dari kolom Acclaim® Polar Advantage II (C18) dengan
kecepatan alir 1,5 mL/menit, detektor UV, panjang gelombang 252 nm, dan volume
penyuntikan 20 μL dengan sistem isokratik pada komposisi eluen metanol : air (70:30). Metode yang divalidasi memperlihatkan nilai linearitas yang baik (r = 0,9997) pada rentang 0,5 – 500 μg/ml. Batas deteksi dan batas kuantitasi 8,67
μg/mL dan 28,9 μg/mL, (%diff) sekitar -1,864 sampai 1,562, presisi (% RSD) berkisar 0,052 sampai 0,113% dan perolehan kembali 98,135 sampai 101,563 %. Hasil validasi metode telah memenuhi persyaratan dan dapat diaplikasikan untuk penetapakan kadar timokuinon dalam minyak biji jinten hitam. Pada pengujian sampel, kandungan timokuinon dalam minyak biji jinten hitam adalah 3,968 %.
vii Name : Boy Reynaldi Noor Program Study: Pharmacy
Title : Validation of Analytical Method of Thymoquinone for the Estimation of Thymoquinone in Black Cumin Seed Oil (Nigella sativa L.) by High Performance Liquid Chromatography (HPLC)
Analysis thymoquinone be important to be done because thymoquinone had been known as marker compound in black cumin seed oil. Since the number of chemical constituents present in the black cumin seed oil, it would require an analytical method that can separate compounds that are selective and sensitive. In this study, the optimization condition analysis and validation of analytical method thymoquinone by High Performance Liquid Chromatography (HPLC). The results of the optimization method using column chromatography systems consist of column Acclaim® Polar Advantage II (C18) with a flow rate of 1.5 mL / min, UV detector, wavelength 252 nm, and the injection volume of 20 μL with isocratic system in the eluent composition of methanol: water (70:30). Validation methods showed good linearity values (r = 0.9997) in the range of concentration 0.5 to 500
μg/ml. The limits of detection and limit of quantitation 8,67 μg / mL and 28,9
μg/mL, (% diff ) has ranged -1,864 to 1,562%, coefficient variation of precision (%
RSD) ranged between 0.052 to 0.113% and the recovery value has a range 98,135 to 101,563%. The results of the validation method has met the requirements and can be applied to the analysis thymoquinone in black cumin seed oil. In the samples, the content of thymoquinone in black cumin seed oil is 3.968 %.
viii
Alhamdulillahirabbil’alamiin, segala puji dan syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini hingga selesai. Penulisan
skripsi yang berjudul “Validasi Metode Analisis Timokuinon serta Penetapan Kadar Timokuinon dalam Minyak Biji Jinten Hitam (Nigella sativa L. ) secara Kromatografi Cair Kinerja Tinggi (KCKT)” bertujuan untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Pada kesempatan ini penulis menyadari bahwa, tanpa bantuan dan bimbingan dari berbagai pihak, dari masa perkuliahan sampai pada penyusunan skripsi ini, sangatlah sulit bagi saya untuk menyelesaikan skripsi ini. Oleh karena itu, saya mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada :
1. Orang tua saya, Papa terbaik Ir. Dewa Yuniardi M.B.A dan Mama tercinta Nooraini Ratna Dewi serta bunda Irma Dwi Iryaningsih yang selalu memberikan kasih sayang, doa yang tidak pernah putus dan dukungan baik moril maupun materil. Tidak ada apapun di dunia ini yang dapat membalas kasih sayang yang telah kalian berikan kepada anakmu, semoga Allah selalu memberikan keselamatan dan perlindungan kepada orang tua hamba tercinta.
2. Prof. Dr. Arief Sumantri, M.Kes., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Dr. Nurmeilis, M.Si., Apt., selaku Ketua Program Studi Farmasi UIN Syarif Hidayatullah Jakarta.
4. Ofa Suzanti Betha, M.Si., Apt dan Supandi, M.Si., Apt., selaku dosen pembimbing yang telah banyak memberikan bimbingan, waktu, tenaga, saran, dan dukungan dalam penelitian ini.
5. Seluruh dosen di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
ix
7. Kepada partner penelitian “Tim Jinten”, Addina Syahida, Ayu Nopita, Anis Khilyatul, Chalila Deli Gayo, dan Alamsyah Putra yang telah melewati suka duka bersama terima kasih atas ilmu, tenaga, kerjasama, dan dukungannya selama penelitian.
8. Seluruh keluarga besar Prodi Farmasi FKIK yang telah memberikan kesempatan dan kemudahan untuk melakukan penelitian serta dukungan yang amat besar.
9. Teman- teman “Kontrakan Ceria” Adia, Benny, Galih, Brendi, Fadil, Ghilman, Gunawan, Irham, Ivan, Okin, Santo, Thantowi, Hary, Apri dan Agung yang telah bersama-sama melewati dari awal perkuliahan hingga penyusunan skripsi ini.
10.Teman-teman seperjuangan “Digoxyn” Farmasi UIN 2012 atas kebersamaan kita.
11.Teman-teman PMC UIN Jakarta sebagai mood booster di kala suntuk komunitas ini selalu membuat mood menjadi meningkat lagi, terimakasih atas dukungan dan semangat kalian.
12.Serta pihak-pihak lain yang tidak dapat disebutkan satu persatu, yang telah memberikan dukungan hingga terwujudnya skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, namun penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan pada umumnya dan farmasi pada khususnya. Akhir kata, penulis berharap Allah SWT berkenan membalas segala kebaikan dari semua pihak yang telah membantu penulis dalam penelitian ini.
Ciputat, 8 Agustus 2016
xi
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI... x
DAFTAR ISI ... xi
2.1.4. Bagian Tanaman Yang Digunakan 6
2.1.5. Kandungan Kimia Biji Jinten Hitam 7
2.1.6. Timokuinon 8
2.2.Kromatografi Cair Kinerja Tinggi 9
2.2.1. Pengertian Umum 9
2.2.2. Jenis Kromatografi Cair Kinerja Tinggi 10
2.2.3. Proses Pemisahan Dalam Kolom KCKT 10
xii
3.3.1. Pembuatan Larutan Induk Timokuinon 22 3.3.2. Penentuan Panjang Gelombang Untuk Analisis 22 3.3.3. Penentuan Komposisi Fase Gerak 22
3.3.4. Uji Kesesuaian Sistem 22
3.4.Validasi Metode 23
3.4.1. Pembuatan Kurva Kalibrasi dan Uji Linieritas 23 3.4.2. Limit Deteksi (LOD) dan Limit Kuantitfikasi (LOQ) 23
3.4.3. Selektivitas 23
3.4.4. Akurasi 23
3.4.5. Presisi 24
3.4.6. Analisis Kadar Timokuinon 25
BAB 4 HASIL DAN PEMBAHASAN 26
4.1 Penentuan Panjang Gelombang Untuk Analisis 26
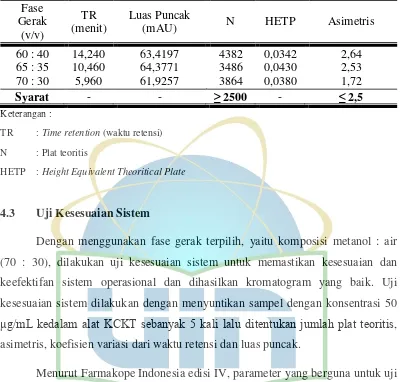
4.2 Penentuan Komposisi Fase Gerak 26
4.3 Uji Kesesuaian Sistem 27
4.4 Validasi Metode 29
4.4.1 Pembuatan Kurva Kalibrasi dan Uji Linieritas 29 4.4.2 Limit Deteksi dan Limit Kuantitfikasi 30
4.4.3 Selektivitas 31
4.4.4 Akurasi 32
4.4.5 Presisi 34
4.4.6 Analisis Kadar Timokuinon 35
BAB 5 PENUTUP 36
5.1.Kesimpulan 36
5.2.Saran 36
DAFTAR PUSTAKA 37
xiii
Gambar 2.1. Biji Jinten Hitam 5
Gambar 2.2. Tanaman Jinten Hitam 6
Gambar 2.3. Struktur Kimia Timokuinon 9
Gambar 2.4. Instrumen KCKT 12
Gambar 4.1. Kurva Kalibrasi Timokuinon 29
xiv
Tabel 2.1. Kandungan Minyak Atsiri Biji Jinten Hitam 7 Tabel 2.2. Kandungan Minyak Statis Pada Biji Jinten Hitam 8 Tabel 4.1. Hasil penentuan komposisi fase gerak 25
Tabel 4.2. Hasil Uji Kesesuaian Sistem 26
Tabel 4.3. Hasil Uji Batas Deteksi, Batas Kuantitasi dan Koefisien Fungsi 28
Tabel 4.4. Hasil Rata-Rata Uji Akurasi 30
Tabel 4.5. Hasil Rata-Rata Uji Presisi 31
Tabel 4.6. Analisis Kadar Timokuinon 31
Tabel 6.1. Hasil Uji Linieritas 46
Tabel 6.2. Data Hasil Uji Batas Deteksi dan Batas Kuantitasi 47
xv
Lampiran 2. Spektrum Serapan Timokuinon Pada Spektrofotometer 43
Lampiran 3. Gambar Kromatogram 44
Lampiran 6. Uji Linieritas dan Pembuatan Kurva Kalibrasi 47 Lampiran 7. Uji Batas Deteksi dan Batas Kuantitasi 48
Lampiran 8. Uji Akurasi dan Presisi 49
Lampiran 9. Perhitungan Uji Akurasi 50
Lampiran 10. Perhitungan Uji Presisi 53
Lampiran 11. Perhitungan Pembuatan Larutan Standar Timokuinon 54 Lampiran 12. Perhitungan Kadar Timokuinon dalam Minyak Jinten Hitam 56 Lampiran 13. Sertifikat Analisis Standar Timokuinon 57 Lampiran 14. Sertifikat Analisis Minyak Jinten Hitam 58 Lampiran 15. Sertifikat Analisis Metanol HPLC Grade 59 Lampiran 16. Sertifikat Analisis Air HPLC Grade 60
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN
1.1 Latar Belakang
Pengobatan herbal masih menjadi pilihan utama oleh sekitar 75-80%
populasi dunia sebagai kebutuhan primer kesehatan mereka, karena mudah diterima
tubuh dan efek samping yang rendah (Kamboj, 2000). Penggunaan obat bahan alam
terus meningkat dari tahun ke tahun, baik yang digunakan untuk menjaga dan
meningkatkan kesehatan, maupun untuk pengobatan penyakit. Hal ini terjadi pada
negara-negara berkembang seperti Indonesia dan juga pada negara-negara maju
(BPOM, 2011). Salah satu obat bahan alam yang sering digunakan dalam
pengobatan alternatif adalah habbatussauda atau jinten hitam (Nigella sativa L.)
(Yulianti dan Junaedi, 2006).
Jinten hitam (Nigella sativa L.) merupakan salah satu tanaman yang tumbuh subur di wilayah tropis. Tanaman ini termasuk famili Ranunculaceae, yang merupakan tanaman berbiji. Jinten hitam juga tergolong tanaman gulma yang tumbuh semusim dengan tinggi 20-50 cm. Penyebaran tanaman ini meliputi wilayah Mediterania Timur hingga ke wilayah India dan Asia Tenggara termasuk Indonesia. Jinten hitam telah lama dimanfaatkan sebagai tanaman obat khususnya pada bagian biji. Selain telah lama digunakan sebagai obat tradisional, tanaman ini juga banyak digunakan sebagai bumbu masakan di daerah Timur Tengah. Menurut sejarah, jinten hitam ini telah digunakan sebagai obat tradisional sejak 2000-3000 tahun sebelum Masehi di daerah Timur Tengah (Gilani, et al., 2004).
Sebagian besar aktivitas farmakologis jinten hitam dihasilkan dari minyak atsiri dan minyak statis ( fixed oils ) (Nickaver, et al., 2003). Minyak atsiri jinten hitam terbukti memiliki efek antihelmintik (Agarwal et al., 1979), antinematodal (Akhtar dan Riffat, 1991), antimikroba (Hanafy dan Hatem, 1991) dan antivirus (Salem dan Hossain, 2000). Selain itu, minyak yang diekstraksi dari biji menghasilkan berbagai aktivitas farmakologis seperti antihistamin (El-Dakhakhny, 1965), diuretik, antihipertensi (Zaoui et al, 2000), hipoglikemik (Al-Hader, et al.,
UIN Syarif Hidayatullah Jakarta 1993), hepatoprotektif (Daba dan Abdel-Rahman, 1998), sakit kepala, perut kembung, pembekuan darah, rematik dan radang (Boulos, 1983).
Senyawa utama dari tanaman jinten hitam adalah timokuinon (TQ) yang terkandung dalam essential oil nya (volatile oil, atau minyak atsiri). Timokuinon adalah senyawa yang terbukti bertanggung jawab terhadap berbagai aktivitas farmakologis yang dimiliki oleh Nigella sativa. Sifat terapeutik dari timokuinon meliputi anti-oksidan (Mansoor, et al., 2002), anti-inflamasi (Umar, et al., 2012), anti-diabetes (Pari, 2009), hepatoprotektif (Abdel-Wahab, 2013 ), saraf (Al-Majed,
et al., 2006), anti-kanker (Gali-Muhtasib et al., 2006), anti-ulseratif (Arslan, et al.,
2005), antimikroba (Harzallah, et al., 2011), imunomodulator (El-Mahmoudy, et al., 2002).
Produk minyak jinten hitam sangat populer di Indonesia, sehingga banyak
produsen obat herbal yang memproduksi minyak jinten hitam dengan harga yang
bervariasi. Klaim khasiat jinten hitam yang disetujui oleh BPOM adalah untuk
memelihara kesehatan (BPOM, 2009). Burits dan Bucar (2000) menemukan adanya
perbedaan kadar timokuinon minyak jinten hitam yang telah dipasarkan. Perbedaan
kadar timokuinon dapat berpengaruh pada aksi farmakologinya karena timokuinon
telah diketahui sebagai senyawa marker aktif sehingga penting untuk diketahui
kadar timokuinon dalam minyak jinten hitam karena belum adanya standarisasi
kadar timokuinon pada setiap produk minyak jinten yang beredar. Oleh karena itu,
penting untuk dilakukan analisis kadar timokuinon dalam minyak jinten hitam.
Dalam analisis kadar senyawa timokuinon, adanya komponen atau
senyawa lain dalam minyak jinten hitam membutuhkan suatu metode analisis yang
mempunyai selektivitas dan sensitivitas tinggi. Metode analisis dengan
Kromatografi Cair Kinerja Tinggi merupakan perkembangan teknik pemisahan
menggunakan teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang
sensitif, sehingga menjadi suatu sistem pemisahan dengan kecepatan dan efisiensi
yang tinggi (Gandjar dan Rohman, 2007).
Sebelumnya, telah dilakukan penelitian oleh Hadad (2012) tentang
pengembangan metode analisis timokuinon dalam minyak biji jinten hitam dengan
menggunakan instumen Kromatografi Cair Kinerja Tinggi. Kondisi analisis
UIN Syarif Hidayatullah Jakarta gerak air : metanol (40 : 60), kolom C18 (250 × 4,6 mm), panjang gelombang
deteksi uv pada 254 nm, menghasilkan waktu retensi sekitar 10 menit.
Suatu metode analisis baru dapat dipakai atau digunakan bila telah dilakukan validasi yang kondisinya disesuaikan dengan laboratorium dan peralatan yang tersedia, meskipun metode yang akan dipakai tersebut telah dipublikasikan pada jurnal, buku teks atau buku resmi seperti farmakope. Hal ini dikarenakan adanya perbedaan dan keterbatasan alat, bahan kimia atau kondisi lain yang menyebabkan metode tersebut tidak dapat diterapkan secara keseluruhan, sehingga sering dilakukan modifikasi, penyederhanaan maupun perbaikan metode, akibatnya metode tersebut harus divalidasi dengan cara yang benar. Oleh karena itu, penelitian ini bertujuan untuk memperoleh kondisi optimum dan metode analisis timokuinon dalam minyak jinten hitam (Nigella sativa L.) secara Kromatografi Cair kinerja Tinggi dengan nilai validitas yang baik, sehingga dapat digunakan untuk penetapan kadar timokuinon dalam minyak biji jinten hitam.
1.3 Rumusan Masalah
Bagaimanakah kondisi optimum dan metode yang valid untuk menganalisis kadar timokuinon dalam minyak biji jinten hitam (Nigella sativa L.) secara Kromatografi Cair Kinerja Tinggi?
1.4 Tujuan Penelitian
Adapun tujuan dari penelitian ini untuk mendapatkan kondisi yang optimum dan metode yang valid dalam menganalisis kadar timokuinon pada minyak biji jinten hitam (Nigella sativa L.) secara Kromatografi Cair Kinerja Tinggi.
1.5 Manfaat Penelitian
UIN Syarif Hidayatullah Jakarta BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Jinten Hitam (Nigella sativa L.) 2.11 Taksonomi
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Ranunculales
Famili : Ranunculaceae
Marga : Nigella
Spesies : Nigella sativa (Hutapea, 1994).
2.1.2 Sejarah Tumbuhan
Tumbuhan ini telah digunakan sebagai pengobatan herbal selama lebih dari 2000 tahun (Hawsawi, et al., 2001). Bagian tumbuhan yang digunakan untuk pengobatan adalah bijinya. Biji Nigella sativa memiliki peran medis dan telah diaplikasikan dalam sistem pengobatan herbal tradisional di Arab dan Yunani. Akhir-akhir ini, biji Nigella sativa dilaporkan telah menunjukkan efek farmakologis yang meliputi antihelmintik, anticestoda, dan antischistosoma, antibakterial, antifungi, antiviral, antioksidan, memiliki aktivitas antiinflamasi, serta dapat meningkatkan respon imun yang dimediasi sel T (Abdulelah dan Abidin, 2007).
2.1.3 Deskripsi Tumbuhan
Nama lainnya adalah Black Seed (Inggris) atau Habattusauda (Arab).
Nigella sativa merupakan tumbuhan berbunga yang berasal dari Asia Barat Daya. Meskipun Nigella sativa merupakan tumbuhan asli daerah mediterania, namun juga
UIN Syarif Hidayatullah Jakarta telah banyak tumbuh di belahan dunia lain, yang meliputi Arab Saudi, Afrika Utara, dan sebagian Asia (Hosseinzadeh, et al., 2007).
Tumbuhan ini tumbuh hingga mencapai tinggi 20-30 cm, dengan daun hijau lonjong, ujung dan pangkal runcing, tepi beringgit, dan pertulangan menyirip. Bunganya majemuk, bentuk karang, kepala sari berwarna kuning, mahkota berbentuk corong berwarna antara biru sampai putih, dengan 5-10 kelopak bunga dalam satu batang pohon (Hutapea, 1994). Tanaman jinten hitam juga memiliki mahkota bunga pada umumnya delapan dan bentuk agak memanjang namun lebih kecil dari kelopak bunga. Memiliki bibir bunga dua, bibir bagian atas pendek, lanset, ujung memanjang berbentuk benang dan bibir bagian bawah bawah memiliki ujung tumpul. Benang sari banyak dan gundul, kepala sari jorong, berwarna kuning, dan sedikit tajam. Memiliki buah dengan bentuk bulat telur atau agak bulat. Biji hitam, jorong bersundut tiga dan tidak beraturan yang sedikit membentuk kerucut, panjang 3 mm, berkelenjar (Materia Medika Jilid III, 1979).
Biji jinten hitam agak berbentuk limas ganda dengan kedua ujunganya meruncing, limas yang satu lebih pendek dari yang lain, bersudut 3 sampai 4, panjang 1,5 mm sampai 2 mm. Lebih kurang lebih 1 mm. Permukaan luar biji berwarna hitam kecoklatan, berbintik-bintik, kasar dan berkerut, terkadang dengan beberapa rusuk membujur atau melintang. Pada penampang melintang biji akan terlihat kulit biji berwarna coklat kehitaman sampai hitam (Departemen Kesehatan Republik Indonesia, 1979)
Gambar 2.1 Biji Jinten Hitam (Nigella sativa L.)
UIN Syarif Hidayatullah Jakarta Gambar 2.2 Tanaman Nigella sativa L (a) Bunga (b) Biji (c) Struktur kimia
komponen bioaktif dari biji, thymoquinone (TQ) (d).
Sumber : Darakhshan et al., 2015
Buahnya berupa kapsul yang besar dan menggembung terdiri dari 3- 7 folikel yang menjadi satu, dimana masing-masing folikel ini mengandung beberapa biji. Biji ini biasanya digunakan sebagai bumbu dapur (Anonim, 2000). Biji jintan hitam berujung tajam saperti bentuk biji wijen, keras, dan lebih menggelembung. Memiliki bau khas seperti rempah-rempah dan agak pedas, yang akan semakin tajam baunya setelah dikunyah (Katzer, 2004).
2.1.4 Bagian Tanaman yang Digunakan
UIN Syarif Hidayatullah Jakarta 2.1.5 Kandungan Kimia Biji Jinten Hitam ( Nigella sativa L.)
Sebagian besar aktivitas farmakologis minyak jintan hitam dihasilkan dari minyak atsiri dan minyak statis ( fixed oils ) (Nickaver et al., 2003). Komposisi minyak jintan hitam secara umum dapat dilihat pada tabel berikut ini :
Tabel 2.1 Kandungan minyak atsiri pada biji jinten hitam ( Nigella sativa L.)
UIN Syarif Hidayatullah Jakarta
Asam Lemak Kandungan (%)
Asam Laurat
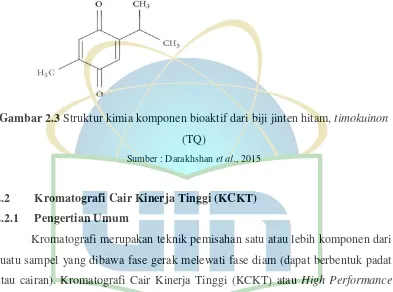
Senyawa yang memiliki Bobot Molekul 164.20 ini memiliki rumus molekul C10H12O2. TQ memiliki titik leleh antara 45°C-47°C, dan titik didih antara 230° C-232°C (Willy, et al., 2003).TQ larut dalam eter, kloroform, metanol dan air (0,87 mg/ml pada suhu 25°) (YT, 2015). TQ merupakan senyawa yang terdapat dalam minyak atsiri biji Nigella sativa L. TQ adalah monoterpen keton yang merupakan komponen utama dalam penyusunan minyak atsiri pada Nigella sativa, sehingga TQ dapat menjadi indikator kuantitatif untuk mengetahui jumlah dari minyak atsiri
UIN Syarif Hidayatullah Jakarta segar. Sifat terapeutik dari TQ termasuk anti-oksidan (Mansoor, et al., 2002), anti-inflamasi (Umar, et al., 2012), anti-diabetes (Pari dan Sankaranarayanan, 2009) dan hepatoprotektif (Abdel-Wahab, 2013 ), saraf (Al-Majed, et al., 2006; Al Hebshi, et al., 2013), anti-kanker (Gali-Muhtasib, et al., 2006; Woo, et al., 2012), anti-ulseratif (Arslan, et al., 2005; Magdy, et al., 2012), antimikroba (Harzallah, et al., 2011), imunomodulator (El-Mahmoudy, et al., 2002).
Gambar 2.3 Struktur kimia komponen bioaktif dari biji jinten hitam, timokuinon
(TQ)
Sumber : Darakhshan et al., 2015
2.2 Kromatografi Cair Kinerja Tinggi (KCKT) 2.2.1 Pengertian Umum
UIN Syarif Hidayatullah Jakarta KCKT merupakan metode yang sering digunakan untuk menganalisis senyawa obat. KCKT dapat digunakan untuk pemeriksaan kemurnian bahan obat, pengawasan proses sintesis dan pengawasan mutu (Quality Control) (Gandjar & Rohman, 2007)
2.2.2 Jenis Kromatografi Cair Kinerja Tinggi
Kromatografi Cair Kinerja Tinggi (KCKT) dapat dibagi menjadi beberapa metode, yakni: kromatografi fase normal (normal phase chromatography), kromatografi fase balik (reversed-phase chromatography), kromatografi penukar ion (ion-exchange chromatography) dan kromatografi eksklusi ukuran ( size-exclusion chromatography) (Kazakevich, 2007). Kromatografi fase balik merupakan kebalikan dari kromatografi fase normal. Kromatografi fase balik menggunakan fase diam yang bersifat hidrofobik, dan fase geraknya yang relatif lebih polar daripada fase diam. Fase diam yang populer digunakan adalah oktadesilsilan (ODS atau C18) Hampir 90% senyawa kimia dapat dianalisis dengan kromatografi jenis ini (Meyer, 2004; Kazakevich, 2007).
2.2.3 Proses Pemisahan dalam Kolom KCKT
UIN Syarif Hidayatullah Jakarta 2.2.4 Keuntungan KCKT
KCKT mempunyai banyak keuntungan , yaitu: a. Kecepatan waktu analisis,
b. Daya pisahnya baik dan selektif,
c. Peka, karena detektor dapat mendeteksi konsentrasi yang kecil,
d. Kolom dapat dipakai kembali, Ideal untuk molekul besar dan ion, dan Mudah memperoleh kembali cuplikan (Johnson & Stevenson, 1991).
2.2.5 Cara Kerja KCKT
Kromatografi merupakan teknik yang mana solut atau zat-zat terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi solut dalam fase gerak dan fase diam. Penggunaan kromatografi cair secara sukses terhadap suatu masalah yang dihadapi membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom, dan ukuran sampel. Instrumentasi KCKT pada dasarnya terdiri atas delapan komponen pokok, yaitu: wadah fase gerak, sistem penghantaran fase gerak, alat untuk memasukkan sampel, kolom, detektor, wadah penampung buangan fase gerak, tabung penghubung, dan suatu komputer atau integrator atau perekam (Gandjar & Rohman, 2007).
2.2.6 Instrumen KCKT
UIN Syarif Hidayatullah Jakarta Gambar 2.4 Instrumen KCKT
Sumber : McMaster, 2007
2.2.6.1 Wadah Fase Gerak pada KCKT
Wadah fase gerak harus bersih dan lembab (inert). Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut. Fase gerak sebelum digunakan harus dilakukan degassing (penghilangan gas) yang ada pada fase gerak, sebab adanya gas akan berkumpul dengan komponen lain terutama di pompa dan detektor sehingga akan mengacaukan analisis (Gandjar & Rohman, 2007).
2.2.6.2 Fase Gerak pada KCKT
UIN Syarif Hidayatullah Jakarta 2.2.6.3 Pompa pada KCKT
Pompa yang cocok digunakan untuk KCKT adalah pompa yang mempunyai syarat sebagaimana syarat wadah pelarut yakni: pompa harus inert terhadap fase gerak. Bahan yang umum dipakai untuk pompa adalah gelas, baja tahan karat, Teflon, dan batu nilam. Pompa yang digunakan sebaiknya mampu memberikan tekanan sampai 5000 psi dan mampu mengalirkan fase gerak dengan kecepatan alir 3 ml/menit. Untuk tujuan preparatif, pompa yang digunakan harus mampu mengalirkan fase gerak dengan kecepatan 20 ml/menit (Gandjar & Rohman, 2007).
2.2.6.4 Penyuntikan Sampel pada KCKT
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir di bawah tekanan menuju kolom menggunakan alat penyuntik yang terbuat dari tembaga tahan karat dan katup teflon yang dilengkapi dengan keluk sampel (sample loop) internal atau eksternal. Pada saat pengisian sampel sampel digelontor melewati keluk sampel dan kelebihannya dikeluarkan ke pembuang. Pada saat penyuntikan, katup diputar sehingga fase gerak mengalir melewati keluk sampel dan menggelontor sampel ke kolom. Presisi penyuntikan dengan keluk sampel ini dapat mencapai nilai RSD 0,1%. Penyuntik ini mudah digunakan untuk otomatisasi dan sering digunakan untuk autosampler pada KCKT (Gandjar & Rohman, 2007).
2.2.6.5 Kolom pada KCKT
Ada 2 jenis kolom pada KCKT yaitu kolom konvensional dan kolom mikrobor. Kolom mikrobor mempunyai 3 keuntungan yang utama dibandingkan dengan kolom konvensional, yakni:
a. Konsumsi fase gerak kolom mikrobor hanya 80% atau lebih kecil dibanding dengan kolom konvensional karena pada kolom mikrobor kecepatan alir fase gerak lebih lambat (10-100 μl/menit).
b. Adanya aliran fase gerak yang lebih lambat membuat kolom mikrobor lebih ideal jika digabung dengan spektrometer massa.
UIN Syarif Hidayatullah Jakarta Meskipun demikian, dalam prakteknya, kolom mikrobor ini tidak setahan kolom konvensional dan kurang bermanfaat untuk analisis rutin (Gandjar & Rohman, 2007).
2.2.6.6 Fase Diam Pada KCKT
Kebanyakan fase diam pada KCKT berupa silika yang dimodifikasi secara kimiawi, silica yang tidak dimodifikasi, atau polimer-polimer stiren dan divinilbenzen. Permukaan silica adalah polar dan sedikit asam karena adanya residu gugus silanol (Si-OH). Silika dapat dimodifikasi secara kimiawi dengan menggunakan reagen reagen seperti klorosilan. Reagen-reagen ini akan bereaksi dengan gugus silanol dan menggantinya dengan gugus-gugus fungsional yang lain. Hasil reaksi yang diperoleh disebut dengan silika fase terikat yang stabil terhadap hidrolisis karena terbentuk ikatan-ikatan siloksan (Si-O-O-Si). Silika yang dimodifikasi ini mempunyai karakteristik kromatografik dan selektifitas yang berbeda jika dibandingkan dengan silika yang tidak dimodifikasi (Gandjar & Rohman, 2007).
2.2.6.7 Detektor KCKT
Detektor pada KCKT dikelompokkan menjadi 2 golongan yaitu: detektor universal (yang mampu mendeteksi zat secara umum, tidak bersifat spesifik, dan tidak bersifat selektif) seperti detektor indeks bias dan detektor spektrometri massa; dan golongan detektor yang spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi, dan elektrokimia. Idealnya, suatu detektor harus mempunyai karakteristik sebagai berikut:
a. Mempunyai respon terhadap solut yang cepat dan reprodusibel,
b. Mempunyai sensitifitas yang tinggi, yakni mampu mendeteksi solut pada kadar yang sangat kecil,
c. Stabil dalam pengoperasiannya,
UIN Syarif Hidayatullah Jakarta e. Signal yang dihasilkan berbanding lurus dengan konsentrasi solute pada kisaran yang luas (kisaran dinamis linier), dan
f. Tidak peka terhadap perubahan suhu dan kecepatan alir fase gerak (Gandjar & Rohman, 2007).
2.3 Validasi Metode Analisis
Validasi merupakan suatu proses yang terdiri atas paling tidak 4 langkah nyata, yaitu: (1) validasi perangkat lunak (software validation), (2) validasi perangkat keras/instrument (instrument/hardware validation), (3) validasi metode, dan (4) kesesuaian sistem (system suitability). Validasi metode analisis menurut United States Pharmacopeia (USP) dilakukan untuk menjamin bahwa metode analisis akurat, spesifik, reprodusibel, dan tahan pada kisaran analit yang akan dianalisis. Suatu metode analisis harus divalidasi untuk melakukan verifikasi bahwa parameter-parameter kinerjanya cukup mampu untuk mengatasi problem analisis, karenanya suatu metode harus divalidasi, ketika:
a. Metode baru dikembangkan untuk mengatasi problem analisis tertentu.
b. Metode yang sudah baku direvisi untuk menyesuaikan perkembangan atau karena munculnya suatu problem yang mengarahkan bahwa metode baku tersebut harus direvisi.
c. Penjaminan mutu yang mengindikasikan bahwa metode baku telah berubah seiring dengan berjalannya waktu.
d. Metode baku digunakan di laboratorium yang berbeda, dikerjakan oleh analis yang berbeda, atau dikerjakan dengan alat yang berbeda.
e. Untuk mendemonstrasikan kesetaraan antar 2 metode, seperti antara metode baru dan metode baku (Gandjar & Rohman, 2007).
2.3.1 Ketepatan (akurasi)
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004).
UIN Syarif Hidayatullah Jakarta a. Metode simulasi (spiked-placebo recovery), yaitu pengukuran sejumlah analit bahan murni yang ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) dan hasilnya dibandingkan dengan kadar analit yang sebenarnya. Penentuan persen perolehan kembali dapat ditentukan dengan menggunakan tiga macam konsentrasi antara 80%-120% dari kadar analit yang diperkirakan.
b. Metode penambahan standar atau pembanding (standard addition method), yaitu menambahkan sejumlah tertentu analit dalam sampel yang telah dianalisis untuk selanjutnya dianalisis kembali. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya, atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel. Untuk pengujian senyawa obat, akurasi diperoleh dengan membandingkan hasil pengukuran dengan bahan rujukan standar (standard reference material, SRM). Suatu metode dikatakan tepat jika ia menghasilkan hasil yang sama dalam sederet penentuan ulangan (Gandjar & Rohman, 2007; Johnson & Stevenson, 1991). Menurut (Harmita, 2006) Rentang kesalahan yang diijinkan pada setiap konsentrasi analit pada matriks dapat dilihat pada tabel 2.1.
Tabel 2.1 Syarat perolehan kembali untuk tiap konsentrasi dalam matriks Analit pada matriks sampel (%) Rata-rata yang diperoleh (%)
100 98-102
0,000.0001 (10 ppb) 60-115
UIN Syarif Hidayatullah Jakarta 2.3.2 Presisi
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik. Sesuai dengan ICH (International Conference on Harmanization), presisi harus dilakukan pada 3 tingkatan yang berbeda yaitu: keterulangan (repeatibility), presisi antara (intermediate precision) dan ketertiruan (reproducibility).
a. Keterulangan yaitu ketepatan (precision) pada kondisi percobaan yang sama (berulang) baik orangnya, peralatannya, tempatnya, maupun waktunya.
b. Presisi antara yaitu ketepatan (precision) pada kondisi percobaan yang berbeda, baik orangnya, peralatannya, tempatnya, maupun waktunya.
c. Ketertiruan merujuk pada hasil-hasil dari laboratorium yang lain.
Dari ketiga kategori di atas, yang wajib dilakukan adalah repeatibilitas (Indrayanto & Yuwono, 2003). Dokumentasi presisi seharusnya mencakup: simpangan baku, simpangan baku relatif (RSD) atau koefisien variasi (CV), dan kisaran kepercayaan. Reprodusibilitas biasanya dilakukan ketika akan melakukan uji banding antar laboratorium. Presisi seringkali diekspresikan dengan SD atau standar deviasi relatif (RSD) dari serangkaian data. Data untuk menguji presisi seringkali dikumpulkan sebagai bagian kajiankajian lain yang berkaitan dengan presisi seperti linearitas atau akurasi. Biasanya replikasi 6-15 dilakukan pada sampel tunggal untuk tiap-tiap konsentrasi. Kriteria seksama diberikan jika metode memberikan simpangan baku relatif atau koefisien variasi 2% atau kurang. Akan
UIN Syarif Hidayatullah Jakarta Tabel 2.1 Kadar analit berbanding % RSD
2.3.3 Batas Deteksi (limit of detection, LOD)
Batas deteksi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi. LOD merupakan batas uji yang secara spesifik menyatakan apakah analit di atas atau di bawah nilai tertentu. Definisi batas deteksi yang paling umum digunakan dalam kimia analisis adalah bahwa batas deteksi merupakan kadar analit yang memberikan respon sebesar respon blangko (yb) ditambah dengan 3 simpangan baku blangko (3Sb). LOD seringkali diekspresikan sebagai suatu konsentrasi pada rasio signal terhadap derau (signal to noise ratio) yang biasanya rasionya 2 atau 3 dibanding 1. ICH mengenalkan suatu konversi metode signal to noise ratio ini, meskipun demikian ICH juga menggunakan 2 metode pilihan lain untuk menentukan LOD yakni: metode non instrumental visual dan dengan metode perhitungan. Metode non instrumental visual digunakan pada teknik kromatografi lapis tipis dan pada metode titrimetri. LOD juga dapat dihitung berdasarkan pada standar deviasi (SD) respon dan kemiringan (slope, S) kurva baku pada level yang mendekati LOD sesuai dengan rumus, LOD = 3 (SD/S). Standar deviasi respon dapat ditentukan berdasarkan pada standar deviasi blanko, pada standar deviasi residual dari garis regresi, atau standar deviasi intersep y pada garis regresi (Gandjar & Rohman, 2007).
UIN Syarif Hidayatullah Jakarta 2.3.4 Batas Kuantitasi (limit of quantification, LOQ)
Batas kuantitasi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan. Sebagaimana LOD, LOQ juga diekspresikan sebagai konsentrasi (dengan akurasi dan presisi juga dilaporkan). Kadang-kadang rasio signal to noise 10:1 digunakan untuk menentukan LOQ. Perhitungan LOQ dengan rasio signal to noise 10:1 merupakan aturan umum, meskipun demikian perlu diingat bahwa LOQ merupakan suatu kompromi antara konsentrasi dengan presisi dan akurasi yang dipersyaratkan. Jadi, jika konsentrasi LOQ menurun maka presisi juga menurun. Jika presisi tinggi dipersyaratkan, maka konsentrasi LOQ yang lebih tinggi harus dilaporkan. ICH mengenalkan metode rasio signal to noise ini, meskipun demikian sebagaimana dalam perhitungan LOD, ICH juga menggunakan 2 metode pilihan lain untuk menentukan LOQ yaitu: (1) metode non instrumental visual dan (2) metode perhitungan. Sekali lagi, metode perhitungan didasarkan pada standar deviasi respon (SD) dan slope (S) kurva baku sesuai rumus: LOQ = 10 (SD/S). Standar deviasi respon dapat ditentukan berdasarkan standar deviasi blanko pada standar deviasi residual garis regresi linier atau dengan standar deviasi intersep-y pada garis regresi (Gandjar & Rohman, 2007).
2.3.5 Liniearitas
UIN Syarif Hidayatullah Jakarta 2.3.6 Uji Kesesuaian Sistem
Seorang analis harus memastikan bahwa sistem dan prosedur yang digunakan harus mampu memberikan data yang dapat diterima. Hal ini dapat dilakukan dengan percobaan kesesuaian sistem yang didefinisikan sebagai serangkaian uji untuk menjamin bahwa metode tersebut dapat menghasilkan akurasi dan presisi yang dapat diterima. Persyaratan-persyaratan kesesuaian sistem biasanya dilakukan setelah dilakukan pengembangan metode dan validasi metode. United States Pharmacopeia (USP) menentukan parameter yang dapat digunakan untuk menetapkan kesesuaian sistem sebelum analisis. Parameter parameter yang
digunakan meliputiμ bilangan lempeng teori (N), faktor tailing, kapasitas (k’ atau α)
UIN Syarif Hidayatullah Jakarta BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Bioavailibilitas dan Bioekivalensi (PBB) serta laboratorium-laboratorium penunjang lainnya di Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta sejak bulan Maret hingga bulan Juni 2016.
3.2 Alat dan Bahan 3.2.1 Alat
Penelitian ini menggunakan alat-alat berupa Kromatografi Cair Kinerja Tinggi (Dionex UltiMate® 3000) yang terdiri dari; pompa, autosampler, kolom
Acclaim® Polar Advantage II (C18; 3 μm; 4,6 x 150 mm), detektor UV, program
komputer PC (Chromeleon®). Spektrofotometer Ultraviolet-Visibel (Hitachi
U-2910), ultrasonik (Branson 5510), dry vacuum pump (Welch), labu ukur, erlenmeyer, gelas piala, batang pengaduk, spatula, mikropipet, pipet tetes, aluminium foil, neraca analitik, vortex, syringe.
3.2.2 Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah, timokuinon standar 99,0% (Sigma Aldrich), minyak biji jinten hitam (diperoleh dari perusahaan lokal), aquadest, metanol HPLC Grade (Merck), air HPLC Grade.
UIN Syarif Hidayatullah Jakarta 3.3 Prosedur Kerja
3.3.1 Pembuatan Larutan Induk Timokuinon
Ditimbang sebanyak 12,5 mg timokuinon. Dilarutkan dalam metanol hingga volume akhir 25 ml. Diperoleh konsentrasi sebesar 500 μg/mL. Konsentrasi 500
μg/mL digunakan sebagai larutan induk. Dilakukan pengenceran untuk mendapatkan larutan dengan konsentrasi tertentu.
3.3.2 Penentuan Panjang Gelombang Maksimum Analisis Timokuinon Dibuat spektrum serapan ultraviolet larutan timokuinon dengan konsentrasi 2 μg/mL. Dipipet 0,1 mL larutan induk timokuinon dalam labu ukur 25 mL kemudian dilarutkan dalam metanol hingga volume akhir 25 mL. Diukur pada panjang gelombang 200 – 400 nm menggunakan Spektrofotometer UV-Visibel, ditentukan panjang gelombang maksimumnya (Hadad et al ., 2012).
3.3.3 Penentuan Komposisi Fase Gerak Analisis Timokuinon
Dibuat larutan standar timokuinon pada konsentrasi 50 μg/mL. Dipipet 2,5 mL larutan induk timokuinon dalam labu ukur 25 mL kemudian dilarutkan dalam metanol hingga volume akhir 25 mL. Diinjeksikan sebanyak 20 μL pada komposisi fase gerak metanol : air pada perbandingan 60:40, 65:35, dan 70:30 dengan kecepatan alir 1,5 mL/menit dan dideteksi pada panjang gelombang terpilih, kemudian dicatat waktu retensi, luas puncak, jumlah plat teoritis, HETP (Height Equivalent Theoritical Plate), asimetrisitas, dan % RSD (Relative Standard Deviation) (Gandjar & Rohman, 2007).
3.3.4 Uji Kesesuaian Sistem
UIN Syarif Hidayatullah Jakarta 3.4 Validasi Metode (Gandjar & Rohman, 2007; Harmita, 2006; Food Drug and Administration, 2001; United Nations Office on Drug and Crime, 2009)
3.4.1 Pembuatan Kurva Kalibrasi dan Uji Linearitas
Ditimbang sebanyak 12,5 mg timokuinon. Dilarutkan ke dalam metanol hingga volume akhir 25 mL sehingga konsentrasi larutan induk 500 μg/mL. Kemudian dibuat seri konsentrasi dengan range 0,5 – 500 μg/mL sebanyak 0,5 , 10 , 20 , 30 , 50 , 100 , 500 μg/mL (Hadad et al ., 2012). Lalu larutan standar sebanyak 20 μL diinjeksikan ke alat KCKT pada kondisi terpilih. Setelah itu dianalisis regresi perbandingan luas puncak terhadap konsentrasi timokuinon dari masing-masing konsentrasi dan dibuat kurva kalibrasi dengan persamaan garis regresi linier (y = a + bx). Dihitung koefisien korelasi (r) dari kurva tersebut.
3.4.2 Limit Deteksi (LOD) dan Limit Kuantitfikasi (LOQ)
LOQ dihitung melalui persamaan garis regresi linear dari kurva kalibrasi. Dapat dihitung dengan mengukur respon standar beberapa kali lalu dihitung simpangan baku respon standar dengan formula di bawah ini:
LOQ = �
sedangkan nilai batas deteksi (LOD) diperoleh dengan rumus :
LOD = , �
dimana (Sy/x) adalah simpangan baku residual, b adalah slope dari persamaan regresi.
3.4.3 Selektivitas
Larutan standar timokuinon konsentrasi 10 μg/mL diinjeksikan ke dalam
KCKT sebanyak 20 μL. Kromatogram yang dihasilkan diamati peak
timokuinonnya, pada waktu retensi (Rt) berapa ia muncul. Sampel sebanyak 100
UIN Syarif Hidayatullah Jakarta berukuran 0,45 μm. Kemudian diinjeksikan ke dalam KCKT dengan volume 20 μL. Kromatogram yang dihasilkan diamati peak timokuinonnya, apakah waktu retensinya sama dengan waktu retensi pada larutan standar.
3.4.4 Akurasi
Untuk uji akurasi dibuat 3 seri larutan dengan menggunakan metoda spiking
standar dengan sampel yang sudah diketahui pasti konsentrasinya. Ditimbang sebanyak 25 mg Timokuinon. Dilarutkan ke dalam metanol hingga volume akhir 25 mL sehingga konsentrasi larutan induk 1000 μg/mL. Seri 1 (spiking sampel + standar 80 ppm): dipipet 0,8 ml larutan induk timokuinon dalam labu ukur 10 mL, lalu ditambahkan 50 μL sampel, dan dilarutkan dengan metanol ad 10 mL.Seri 2 (spiking sampel + standar 200 ppm):dipipet 2 mL larutan induk timokuinon dalam labu ukur 10 mL, lalu ditambahkan 50 μL sampel, dan dilarutkan dengan metanol ad 10 mL.Seri 3 (spiking sampel + standar 375 ppm): dipipet 3,75 mL larutan induk timokuinon dalam labu ukur 10 mL, lalu ditambahkan 50 μL sampel, dan dilarutkan dengan metanol ad 10 mL. Masing-masing seri dihomogenkan dengan vortex selama 2 menit, didiamkan selama 1 menit, diambil lapisan metanol bagian atas (Enein, et al., 1995). Setelah itu sampel disaring menggunakan syringe filter berukuran 0,45 μm. Kemudian masing-masing seri diinjeksikan ke dalam KCKT dengan volume injeksi 20 μL. Luas puncak yang didapat disubstitusikan ke dalam persamaan regresi pada kurva kalibrasi sebagai nilai Y, sehingga didapat konsentrasi dari masing-masing seri. Kemudian dihitung % diff dan perolehan kembalinya.
3.4.5 Presisi
Untuk uji presisi dibuat 3 seri larutan dengan menggunakan metoda spiking
UIN Syarif Hidayatullah Jakarta labu ukur 10 mL, lalu ditambahkan 50 μL sampel, dan dilarutkan dengan metanol ad 10 mL.Seri 3 (spiking sampel + standar 375 ppm): dipipet 3,75 mL larutan induk timokuinon dalam labu ukur 10 mL, lalu ditambahkan 50 μL sampel, dan dilarutkan dengan metanol ad 10 mL. Masing-masing seri dihomogenkan dengan vortex selama 2 menit, didiamkan selama 1 menit, diambil lapisan metanol bagian atas (Enein, et al., 1995). Setelah itu sampel disaring menggunakan syringe filter berukuran 0,45 μm. Kemudian masing-masing seri diinjeksikan ke dalam KCKT dengan volume injeksi 20 μL. Setelah itu diamati luas puncaknya. Nilai luas puncak kemudian disubstitusikan ke dalam persamaan linear dari kurva kalibrasi sebagai nilai Y, sehingga didapat konsentrasi dari masing-masing nilai luas puncak. Kemudian dihitung besarnya simpangan deviasi dari masing-masing konsentrasi dengan rumus:
SD =√∑ − �−̅ 2
Dimana x merupakan luas dari masing-masing konsentrasi, �̅ merupakan rerata konsentrasi, dan N merupakan jumlah injeksi. Setelah mendapat nilai SD kemudian
dihitung nilai RSD dengan rumus: RSD = �
̅ x 100%
Syarat dari nilai RSD adalah < 2%.
UIN Syarif Hidayatullah Jakarta BAB 4
HASIL DAN PEMBAHASAN
4.1 Penentuan Panjang Gelombang Maksimum Analisis Timokuinon Sebelum memasuki tahap analisis, perlu dilakukan penentuan panjang gelombang maksimum analisis timokuinon. Penentuan panjang gelombang maksimum dilakukan dengan menggunakan spektrofotometer ultraviolet, diperoleh serapan maksimum timokuinon yaitu pada panjang gelombang 252 nm. Berdasarkan penelitian Hadad (2012) panjang gelombang timokuinon berada pada kisaran 250-260 nm. Penentuan panjang gelombang analisis ini guna meningkatkan selektivitas dan sensitivitas senyawa yang dianalisa. Spektrum serapan timokuinon dapat dilihat pada lampiran 2.
4.2 Penentuan Komposisi Fase Gerak Analisis Timokuinon
Untuk menghasilkan kromatogram yang baik maka dilakukan pemilihan fase gerak dengan kondisi optimum KCKT. Pada percobaan pertama, fase gerak yang digunakan adalah metanol : air (60 : 40) v/v dengan detektor UV-Vis, panjang
gelombang 252 nm, laju alir 1,5 mL/ menit dengan volume injeksi 20 μL. Pada percobaan kedua, fase gerak yang digunakan adalah metanol : air (65 : 35) v/v dengan detektor UV-Vis, panjang gelombang 252 nm, laju alir 1,5 mL/ menit dengan volume injeksi 20 μL. Pada percobaan ketiga, fase gerak yang dicobakan adalah metanol : air (70 : 30) v/v dengan detektor UV-Vis, panjang gelombang 252 nm, laju alir 1,5 mL/ menit dengan volume injeksi 20 μL. Berdasarkan percobaan yang dilakukan, komposisi fase gerak yang dipilih adalah percobaan yang ketiga, yaitu pada komposisi fase gerak metanol : air (70 :30). Komposisi fase gerak ini dipilih karena menghasilkan nilai asimetrisitas yang memenuhi syarat jika dibandingkan dengan komposisi fase gerak lainnya dan memiliki waktu retensi paling cepat dibanding dengan komposisi fase gerak lainnya sehingga waktu analisis lebih cepat dan efisien. Gambar masing-masing kromatogram tercantum pada lampiran 3. Data mengenai komposisi fase gerak tercantum pada tabel 4.1.
UIN Syarif Hidayatullah Jakarta Tabel 4.1. Hasil penentuan komposisi fase gerak timokuinon standar pada
konsentrasi 50 μg/mL, laju alir 1,5 mL/menit, panjang gelombang 252 nm, dan volume penyuntikan 20 μL.
HETP : Height Equivalent Theoritical Plate
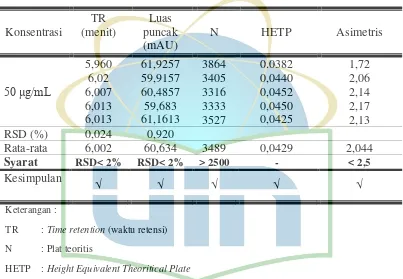
4.3 Uji Kesesuaian Sistem
Dengan menggunakan fase gerak terpilih, yaitu komposisi metanol : air (70 : 30), dilakukan uji kesesuaian sistem untuk memastikan kesesuaian dan keefektifan sistem operasional dan dihasilkan kromatogram yang baik. Uji kesesuaian sistem dilakukan dengan menyuntikan sampel dengan konsentrasi 50
μg/mL kedalam alat KCKT sebanyak 5 kali lalu ditentukan jumlah plat teoritis, asimetris, koefisien variasi dari waktu retensi dan luas puncak.
Menurut Farmakope Indonesia edisi IV, parameter yang berguna untuk uji kesesuaian sistem adalah keberulangan dari penyuntikan ulang larutan baku dinyatakan dalam simpangan baku relatif yang dinyatakan dalam persen bila tidak dinyatakan lain dalam monografi buku yang digunakan maka untuk perhitungan digunakan data kromatogram lima kali hasil penyuntikan ulang dengan nilai RSD kurang dari 2,0 %.
UIN Syarif Hidayatullah Jakarta Dari hasil percobaan, diperoleh nilai rata- rata : jumlah plat teoritis 3489 (persyaratan > 2500), asimetris 2,044 (persyaratan < 2,5) dan RSD luas area 0,92 dan waktu retensi 0,024 (persyaratan < 2%). Hasil ini telah memenuhi persyaratan uji, yang menunjukan bahwa sistem alat yang digunakan telah memenuhi kesesuaian dan keefektifan sistem operasional. Data mengenai uji kesesuaian sistem tercantum pada tabel 4.2
Tabel 4.2 Hasil uji kesesuaian sistem timokuinon standar konsentrasi 50 μg/mL, laju alir 1,5 mL/menit, panjang gelombang 252 nm, dan volume penyuntikan 20
μL.
HETP : Height Equivalent Theoritical Plate
UIN Syarif Hidayatullah Jakarta 4.4.1 Validasi Metode Analisis Timokuinon
4.4.2 Pembuatan Kurva Kalibrasi dan Uji Linieritas
Pembuatan kurva kalibrasi dilakukan dengan melihat respon KCKT terhadap analit timokuinon dengan tujuh seri konsentrasi standar, yaitu 0,5 , 10 , 20 , 30 , 50 , 100 , 500 μg/mL (Hadad , et al ., 2012). Mula- mula dibuat larutan induk 500 μg/mL pada labu ukur 25 mL, kemudian dilakukan pengenceran hingga mendapatkan 7 seri konsentrasi standar. Dari hasil analisis deret standar tersebut didapat luas puncak kromatogram yang berbeda-beda. Nilai dari luas puncak diplotkan ke dalam sumbu-y, sedangkan deret konsentrasi standar diplotkan ke dalam sumbu-x, sehingga terbentuklah kurva kalibrasi dengan persamaan y =1,278x + 1,7567.
Gambar 4.1 Kurva kalibrasi timokuinon
Linieritas merupakan kemampuan metode analisis yang memberikan respon yang secara langsung proporsional terhadap konsentrasi analit dalam sampel. Berdasarkan hasil kurva kalibrasi, diperoleh persamaan y =1,278x + 1,7567. Dari persamaan tersebut diperoleh nilai intersep yang dilambangkan dengan a =1,7567 yang berarti kurva tersebut memotong sumbu-y di titik + 1,7567. Sedangkan nilai b = 1,278. Nilai b mempresentasikan nilai slope atau kemiringan atau gradien dari kurva tersebut, sedangkan untuk nilai r = 0,9997. Nilai r merupakan koefisien korelasi. Syarat diterimanya nilai koefisien korelasi adalah jika nilai r > 0,9990 (FDA, 2001) . Jika ditinjau dari hasil nilai r pada percobaan ini yaitu 0,9997, maka kurva kalibrasi tersebut telah memenuhi syarat.
UIN Syarif Hidayatullah Jakarta 4.4.3 Pengukuran Batas Deteksi (LOD) dan Batas Kuantitasi (LOQ)
Dengan menggunakan data kurva kalibrasi, kemudian dihitung nilai LOD dan LOQ. Hasil uji LOD dan LOQ dapat dilihat pada tabel 4.3.
Tabel 4.3. Hasil uji batas deteksi, batas kuantitasi dan koefisien fungsi
Parameter Nilai
Simpangan Baku Residual (S y/x) 3,69
Batas deteksi (LOD) 8,67 μg/mL
Batas Kuantitasi (LOQ) 28,9 μg/mL
Di antara keunggulan teknik analisis menggunakan instrumen adalah kemampuannya mendeteksi dan menentukan kadar analit yang sangat kecil dibandingkan dengan metode analisis klasik. Batas deteksi dan batas kuantitasi metode perlu ditentukan kalau metode tersebut digunakan untuk menganalisis sampel yang mengandung analit berkadar rendah, seperti pada analisis obat dalam cairan tubuh, analisis metabolit sekunder dalam kultur jaringan, atau analisis pada uji disolusi obat, sedangkan untuk sampel dengan konsentrasi analit tinggi tidak mutlak diperlukan pengujian LOD dan LOQ, hanya saja dalam penelitian ini uji LOQ tetap dilakukan dengan tujuan untuk mengetahui kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria akurasi dan presisi yang baik, sehingga dari hasil pengujian LOQ ini akan menjadi acuan dalam pemilihan sampel mana yang akan diuji presisi dan akurasinya. Dari hasil uji LOD dan LOQ ini didapat konsentrasi terendah yang dapat memenuhi kriteria presisi dan akurasi yang baik adalah 8,67 μg/mL dan 28,9 μg/mL.
4.4.4 Selektivitas
UIN Syarif Hidayatullah Jakarta
Gambar 4.2 Kromatogram timokuinon standar 10 ppm
Gambar 4.3 Kromatogram sampel Minyak biji jinten hitam
UIN Syarif Hidayatullah Jakarta 4.4.5 Akurasi
Akurasi atau kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai % diff dan persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004). Akurasi dapat dilakukan dengan dua metode yaitu metode simulasi dan penambahan standar (spiking). Pada penelitian ini digunakan metode penambahan standar (spiking) karena metode simulasi memerlukan pembuatan plasebo, sedangkan pembuatan plasebo (minyak biji jinten hitam tanpa timokuinon) sebagai matriks tidak bisa dilakukan. Akurasi diperiksa dengan cara menghitung perbedaan nilai yang terukur dengan nilai sebenarnya (% diff) dan persentase perolehan kembali (% recovery). Pada penelitian ini, uji akurasi dilakukan dengan mengukur 3 konsentrasi dengan masing-masing konsentrasi sebanyak 3 kali pada konsentrasi rendah (3× ���) , sedang (35-50% dari standar kalibrasi tertinggi), dan tinggi (75 % dari standar kalibrasi tertinggi) (FDA, 2001) . Uji akurasi pada percobaan ini dilakukan dengan mengukur konsentrasi sampel terlebih dahulu dan kemudian konsentrasi sampel dan standar pada konsentrasi 80
μg/mL, 200 μg/mL, dan 375 μg/mL masing-masing sebanyak 3 kali.
Pada pengujian % diff konsentrasi 80 μg/mL didapatkan hasil % diff rata rata sebesar -0,155%, pada konsentrasi 200 μg/mL didapatkan % diff rata-rata sebesar 1,562 % dan pada konsentrasi 375 μg/mL didapatkan % diff rata-rata sebesar -1,864 %.
UIN Syarif Hidayatullah Jakarta Tabel 4.4 Hasil rata-rata uji Akurasi (% diff dan perolehan kembali)
Konsentrasi
Presisi atau keseksamaan adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari campuran yang homogen (Harmita, 2004). Pada penentuan presisi dapat dilakukan pada 3 kategori yaitu repeatibilitas, presisi antara dan reprodusibilitas. Dari ketiga kategori di atas, yang wajib dilakukan adalah repeatibilitas (Indrayanto & Yuwono, 2003). Untuk uji presisi repeatibilitas dilakukan dengan pengukuran sampel sebanyak 3 replikasi pada 3 konsentrasi uji. Dari data yang diperoleh kemudian dihitung nilai RSD-nya. Uji presisi pada penelitian ini dilakukan dengan mengukur konsentrasi sampel dan standar pada
konsentrasi 80 μg/mL, 200 μg/mL, dan 375 μg/mL masing-masing sebanyak tiga kali. Pada konsentrasi 80 μg/mL didapatkan hasil % RSD (Relative Standard Deviation) sebesar 0,078 % , pada konsentrasi 200 μg/mL didapatkan didapatkan hasil % RSD (Relative Standard Deviation) sebesar 0,113 % dan pada konsentrasi
UIN Syarif Hidayatullah Jakarta Tabel 4.5 Hasil rata-rata uji presisi
Konsentrasi
4.4.6 Analisis Kadar Timokuinon pada Sampel Minyak Biji Jinten Hitam Setelah parameter validasi metode yang ditetapkan telah memenuhi persyaratan maka dapat diaplikasikan untuk penetapan kadar timokuinon dalam minyak biji jinten hitam. Penetapan kadar timokuinon dalam sampel minyak jinten hitam dilakukan sebanyak 3 kali pengulangan pada bobot yang sama. Sampel dipreparasi dengan menimbang sampel minyak biji jinten hitam sebanyak 42,6 mg (100 ��) replikasi 3 kali kemudian dilarutkan dalam metanol hingga volume akhir 10 mL. Campurkan dengan vortex selama 2 menit, didiamkan selama 1 menit, diambil lapisan metanol bagian atas (Enein, et al., 1995). Setelah itu sampel disaring menggunakan syringe filter berukuran 0,45 μm. Sampel diinjeksikan ke
dalam KCKT dengan volume injeksi sebanyak 20 μL dilihat luas puncaknya. Luas puncak yang didapat kemudian disubstitusikan ke dalam persamaan regresi pada kurva kalibrasi sebagai nilai Y, sehingga didapat konsentrasi sampel dalam satuan ppm. Kemudian dilakukan perhitungan kadar % b/b.Hasil penetapan kadar dengan 3 kali pengulangan disajikan pada Tabel 4.6.
Tabel 4.6 Analisis kadar timokuinon dalam minyak biji jinten hitam
UIN Syarif Hidayatullah Jakarta BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Kondisi optimum untuk analisis timokuinon dalam minyak biji jinten hitam menggunakan sistem kromatografi terdiri dari kolom Acclaim® Polar
Advantage II (C18) dengan kecepatan alir 1,5 mL/menit, detektor UV dengan panjang gelombang 252 nm, volume penyuntikan 20 μL dengan sistem isokratik pada komposisi eluen metanol : air (70:30)
2. Validasi metode yang dilakukan memberikan hasil nilai linearitas (r = 0,9997) pada rentang 0,5 – 500 μg/ml. Batas deteksi dan batas kuantitasi 8,67 μg/mL dan 28,9 μg/mL, (% diff) sekitar -1,864 sampai 1,562, presisi (% RSD) berkisar 0,052 sampai 0,113% dan perolehan kembali 98,135 sampai 101,563 %.
3. Analisis timokuinon pada sampel minyak biji jinten hitam memiliki kadar sebesar 3,968 % (b/b).
5.2 Saran
Perlu dilakukan pengembangan metode analisis Timokuinon dalam suatu sediaan atau pengembangan metode analisis dengan instrumen lain, misalnya GCMS (Gas Chromatography Mass Spectrometry).
UIN Syarif Hidayatullah Jakarta DAFTAR PUSTAKA
Abdulelah, H.A.A. and Abidin, Z.B.A.H. 2007. In vivo Anti-malarial Tests of Nigella sativa (Black Seed) Different Extracts. American Journal of Pharmacology and Toxicology2(2): 46-50
Abdel-Wahab, W.M. 2013. Protective effect of thymoquinone on sodium fluoride-induced hepatotoxicity and oxidative stress in rats. The Journal of Basic and Applied Zoology, (In Press).
Agarwal R, Kharya MD, Shrivastava R. 1979. Antimicrobial and anthelminthic activities of the essential oil of Nigella sativa Linn. Indian J Exp Biol 17:1264–5
Akhtar MS, Riffat S. 1991. Field trial of Saussurea lappa roots against nematodes and Nigella sativa seeds against cestodes in children. J Pak Med Assoc 41:185–7.
Al-Hader AA, Aqel MB, Hasan ZA. 1993. Hypoglycemic effects of the volatile oil of Nigella sativa seeds. Int J Pharmacogn 31:96–100. Boulos L. (1983) Medicinal plants of North Africa. Algonac, MI: Reference Publications, p. 103.
Al-Majed, A., Al-Omar, F.A. and Nagi, M.N. 2006. Neuroprotective effects of thymoquinone against transient forebrain ischemia in the rat hippocampus. European Journal of Pharmacology, 543, 1-3, 14, 40-47.
AOAC. 1998. Peer-Verified Methods Program Manual on Policies and Procedures. USA : Arlington, Virginia
Arslan, S.O., Gelir, E., Armutcu, F., Coskun, O., Gurel, A., Sayan, H. and Celik, I.L. 2005. The protective effect of thymoquinone on ethanol-induced acute gastric damage in the rat. Nutrition Research, 25, 673-680
Anonim. 2000. Domestication of plants in the Old World, 3, Oxford University Press, p. 206. ISBN 0198503563.
Benhaddou- Andaloussi , A., L.C. Martineau, D.spoor,T. Vuong, C. Leduce, E.joly, A. Burt, B.meddah , A.settaf , J.T arnason, M.prenkti, P.S. Haddad. 2008.
Antidiabetic activity of Nigella sativa seed extract in cultured pancreatic
UIN Syarif Hidayatullah Jakarta Boulos, L. 1983. Medicinal Plants of North Africa. Reference Publication.
BPOM. 2009. Mengenal Jinten Hitam sebagai Obat Bahan Alam, Naturakos, Vol.IV No.12.
BPOM. 2011. Mari Minum Obat Bahan Alam Dan Jamu dengan Baik dan Benar, InfoPOM, Vol. 12 No. 3
Burits, M., dan Bucar, F. 2000. Antioxidant activity of Nigella sativa essential oil. Phytother. Res., 14: 323–328
Daba MH, Abdel-Rahman MS. 1998. Hepatoprotective activity of thymoquinone in isolated rat hepatocytes. Toxicol Lett 16:23–9.
Darakhsan, Sara., Pour, Ali bidmeshki., Colagar, Abasalt hosseinzadeh. 2015.
Thymoquinone and its Therapeutic Potentials. Pharmacol Res (2015). Departemen Kesehatan Republik Indonesia. 1979. Materia Medika Indonesia Jilid
III. Jakarta : Direktorat Jendral Pengawasan Obat da Makanan.
El-Dakhakhny M. 1965. Studies on the Egyptian Nigella sativa L. IV Some pharmacological properties of seeds active principle in comparison to its
dihydro compound and its polymer. Arzneim Forsch (Drug Res Germ) 15:1227–9.
El-Mahmoudy, A., Matsuyama, H., Borgan, M.A., Shimizu, Y., El-Sayed, M.G., Minamoto, N. and Takewaki T.2002. Thymoquinone suppresses expression of inducible nitric oxide synthase in rat macrophages International
Immunopharmacology, 2, 11, 1603-1611.
Faisal,Rizwan, et al.2015. Anti inflammatory effect of thymoquinone in comparison with methotrexate on pristane induced arthritis in rats. J Pak Med Assoc,Vol
65.
Farmakope Indonesia Edisi IV. 1995. halaman 1016-1017.
Food and Drug Administration. 2001. Bioanalytical Method Validation. Rockville: Center for Veterinary Medicine.
Gali-Muhtasib, H., Roessner, A. and Chneider-Stock, R. 2006. Thymoqui-none : A promising anti-cancer drug from natural sources. The International Journal of Biochemistry and Cell Biology, 38, 8, 1249-1253.
UIN Syarif Hidayatullah Jakarta Gharby, S. et al., 2013. Chemical investigation of Nigella sativa L. seed oil produced in Morocco. Journal of the Saudi Society of Agricultural Sciences. Gilani Hassan A. 2004. A Review of Medicinal Use and Pharmacological Activities
of Nigella sativa L,.Departement of Biological and Biomedical Sciences. Goreja,W.G.2003.Black seed Nature’s Miracle Remedy. New York: Amazing Herb
Press.
Hanafy MS, Hatem ME. 1991. Studies on the antimicrobial activity of Nigella sativa seed (black cumin). J Ethnopharmacol 34:275–8.
Hassan Y. Aboul-Enein & Laila I. Abou-Basha. 1995. Simple HPLC Method for the Determination of Thymoquinone in Black Seed Oil(Nigella Sativa Linn), Journal of Liquid Chromatography, 18:5, 895-902, DOI:10.1080/1082 6079508010400.
Hassan, sohair A., et al.,2008. The in vitro promising therapeutic activity of thymoquinone on hepatocelullar carcinoma (HepG2) cell line. Department of Medicinal Chemistry, National Research Centre, Dokki, Giza, Egypt. Global Veterinaria 2 (5).
Harmita. 2006. Analisis Fisikokimia. Departemen Farmasi FMIPA UI.
Harzallah, H.J., Kouidhi, B., Flamini, G., Bakhrouf, A. and Mahjoub, T. (2011).Chemical composition, antimicrobial potential against cariogenic bacteria and cytotoxic activity of Tunisian Nigella sativa essential oil and
thymoquinone. Food Chemistry, 129, 4, 15, 1469-1474.
Hosseinzadeh., Fahimeh, Moghim. 2007. Effect of Nigella Nigella sativa seed extracts on Ischemia-Reperfusion in Rat Skeletal Muscle. Pharmacologyonline 2 : 326-335.
Hutapea, J.R. 1994. Inventaris Tanaman Obat Indonesia (III), Badan Penelitian dan Pengembangan Kesehatan Departemen Kesehatan Republik Indonesia, p: 163.
Indrayanto, G. dan Yuwono, M. 2003. Validation of TLC Analyses in Encyclopedia of Chromatography. Surabaya: Airlangga University Indonesia.
Johnson, E.L. dan Stevenson, R. 1991. Dasar Kromatografi Cair. Penerjemah: Kosain Padmawinata. Penerbit ITB. Bandung. Hal. 70, 119-121.
UIN Syarif Hidayatullah Jakarta Katzer, Gernot. (2004) Nigella (Nigella sativa)
http://www.uni-graz.at/%7Ekatzer/spice_icon.ico
Kazakevich, Y., dan R. LoBrutto. 2007. Method Validation. In LoBrutto, R., dan T. Patel., Editors. HPLC for Pharmaceutical Scientist. New Jersey: Jhon Wiley & Sns, Inc. Hal.455.
Khopkar, S. M. 1990. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Magdy, M.A., Hanan, El-A. dan Nabila, el-M. 2012. Thymoquinone: Novel gastroprotective mechanisms. European Journal Pharmacology. 15, 697(1-3), 126-31.
Mansour, M.A., Nagi, M.N., El-Khatib, A.S. and Al-Bekairi, A.M. 2002. Effects of thymoquinone on antioxidant enzyme activities, lipid peroxidation and
DT-diaphorase in different tissues of mice: a possible mechanism of action. Cell Biochemistry and Function, 20(2), 143-51.
Meyer, V.R. 2004. Practical High Performance Liquid Chromatography. 4th Edition. St. Gallen: John Wiley & Sons. Ltd. Hal 20-24, 52-55.
M.Hadad, Ghada., Randa., Salam,Abdel. 2012. High-Performance Liquid Chromatography Quantification of Principal Antioxidants in Black seed
(Nigella sativa L.) Phytopharmaceuticals. Egypt : Journal of AOAC International Vol. 95, No. 4, 2012.
Moffat, A. C. 1986. Clarke's Isolation and Identification of Drugs (2nd ed.). London: The Pharmaceutical Press. 936-937.
Nickavar, B. Mojaba, F. Javidniab, K. Amolia, M.A. 2003. Chemical composition of the fixed and volatile oil of nigella sativa L. From Iran Z. Naturforsch 58c. Pari, L. and Sankaranarayanan, C. 2009. Beneficial effects of thymoqui-none on hepatic key enzymes in streptozotocin-nicotinamide induced diabetic rats. Life Sciences, 85, 23-26, 830 834.
Rajsekhar, Saha, Bhupendar Kuldeep. 2011. Pharmacognosy and pharmacology of Nigella sativa-a review. India. 2(11).
UIN Syarif Hidayatullah Jakarta
of Valproate. Department of Pharmacology and Therapeutics, Saudi Arabia. Scientia Pharmaceutica (Sci.pharm).
Salem ML, Hossain MS. 2000. Protective effect of black seed oil from Nigella sativa against murine cytomegalovirus infection. Int J Immunopharmacol 22(9):729–40.
Sari, Ni Ketut. 2010. Analisis Instrumentasi.Klaten : Yayasan Humaniora
Umar, S., Zargan, J., Umar, K., Ahmad, S., Katiyar, C.K. and Khan, H.A. 2012.
Modulation of the oxidative stress and inflammatory cytokine response by
thymoquinone in the collagen induced arthritis in Wistar rats. Chemico- Biological Interactions, 15, 197(1), 40-6.
Willy, John et al.2003. The Merck Index. Maryadeledeμ O’ Meil. 13th Edition. Hal: 8166.
Woo, C.C., Kumar, A.P., Sethi, G. and Tan, K.H.B. 2012. Thymoquinone : Potential cure for inflammatory disorders and cancer. Biochemical Pharmacology, 83, 4, 15, 443-451.
Yulianti, S., dan Junaedi, E. 2006. Sembuhkan Penyakit dengan Habbatussauda (jinten hitam), Agromedia, jakarta.
YT. 2015.http://www.scbt.com/datasheet-215986-thymoquinone.html, diakses 28 Juli 2015.
Zaoui A, Cherrah Y, Lacaille-Dubois MA, Settaf A, Amarouch H, Hassar M. 2000.
Diuretic and hypotensive effects of Nigella sativa in the spontaneously