UJI STABILITAS FISIK DAN KOMPONEN KIMIA
MENGGUNAKAN GCMS PADA EMULSI TIPE
MINYAK DALAM AIR PADA MINYAK BIJI JINTEN
HITAM (Nigella sativa L.) YANG DIKEMAS
MENGGUNAKAN BOTOL GELAP
SKRIPSI
NICKY ANNISIANA FORTUNITA
NIM : 1111102000004
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
i
UJI STABILITAS FISIK DAN KOMPONEN KIMIA
MENGGUNAKAN GCMS PADA EMULSI TIPE
MINYAK DALAM AIR PADA MINYAK BIJI JINTEN
HITAM (Nigella sativa L.) YANG DIKEMAS
MENGGUNAKAN BOTOL GELAP
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
NICKY ANNISIANA FORTUNITA
NIM : 1111102000004
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
v
Nama : Nicky Annisiana Fortunita Program Studi : Farmasi
Judul Skripsi : Uji Stabilitas Fisik dan Komponen Kimia Menggunakan GCMS pada Emulsi Tipe Minyak Dalam Air Pada Minyak Biji Jinten Hitam (Nigella sativa L.) yang Dikemas
Menggunakan Botol Gelap
Suatu sediaan farmasi ketika diformulasikan harus stabil dalam penyimpanan, sehingga sediaan tersebut tidak berkurang efek terapeutiknya. Tujuan dari penelitian ini adalah untuk mengetahui pengaruh penggunaan botol gelap terhadap stabilitas sifat fisik dan komponen kimia sediaan emulsi minyak biji jinten hitam yang diformulasikan menggunakan emulgator tragakan 1,5% pada penyimpanan selama 21 hari. Penelitian ini dilakukan dengan membandingkan emulsi yang dikemas menggunakan botol gelap dan botol bening sebagai kontrol. Sifat fisik yang dievaluasi meliputi organoleptis, nilai pH, viskositas, diameter globul, tipe emulsi dan pemisahan. Sifat kimia dievaluasi terhadap komponen senyawa antioksidan minyak biji jinten hitam menggunakan Gas Chromatography – Mass Spectrometry. Sifat fisik menunjukkan terjadi penurunan baik pada emulsi kontrol dan sampel, akan tetapi penurunan pada emulsi sampel lebih rendah dibandingkan emulsi kontrol. Evaluasi sifat kimia komponen senyawa antioksidan pada emulsi minyak biji jinten hitam (p-cymene, thymoquinon, terpinen-4-ol, dan longifolen) mengalami peningkatan dan penurunan persen area selama 21 hari penyimpanan, baik pada emulsi kontrol dan sampel. Namun, penggunaan botol gelap dapat mengurangi penurunan persen area thymoquinon yang merupakan senyawa utama emulsi minyak biji jinten hitam, dibandingkan dengan botol bening. Hasil penelitian menunjukkan bahwa terdapat pengaruh penggunaan botol gelap terhadap stabilitas fisik dan komponen kimia emulsi minyak biji jinten hitam
vi
Major : Pharmacy
Title : Physical Stability And Chemical Component Test By Using GCMS In Oil In Water Emulsion Of Black Cumin Seed Oil (Nigella sativa, L) Which Is Packed In Dark Bottle
Pharmaceutical products have to be stable during storage, so the therapeutical effect of the products would not decrease. The aims of this study were to analyze the effect of the dark bottle againts the physical stability and chemical compounds black cumin seed oil emulsion which formulated using 1.5% tragacanth as emulgator in 21 days of storage. This study was conducted by comparing emulsions that were packaged using dark bottles and clear bottles as a control. Physical characteristics that were analyzed are organoleptic, pH value, viscosity, globule diameter, emulsion type, and the separation. Chemical properties were analyzed against the antioxidant compounds of black cumin seed oil using Gas Chromatography – Mass Spectrometry. Physical characteristics showed a decrease in both of the sample and control emulsion, but a decrease in the sample emulsion was lower than the control emulsion. Chemical characteristics evaluation of the antioxidant compounds of black cumin seed oil emulsion (p-cymene, thymoquinone, terpinene-4-ol, dan longipholene) showed increased and decreased in area percentage during 21 days of storage, both of sample and control emulsion. However, the usage of the dark bottles can decreased the area percentage of thymoquinone, the main compound of black cumin seed oil emulsion, than the clear ones. The result of this study showed that there was an influence of the dark bottles against physical stability and chemical compounds of black cumin seed oil emulsion.
vii
Alhamdulillah, segala puji bagi Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi yang berjudul “Uji Stabilitas Fisik Dan Komponen Kimia Menggunakan GCMS Pada Emulsi Tipe Minyak Dalam Air Pada Minyak Biji Jinten Hitam (Nigella Sativa L.) Yang Dikemas Menggunakan Botol Gelap” sebagai salah satu syarat untuk menyelesaikan program pendidikan tingkat Strata 1 (S1) pada Program Studi Farmasi. Penulis menyadari bahwa dalam penelitian sampai penyusunan skripsi ini tidak akan terwujud tanpa adanya bimbingan, dukungan, dan bantuan dari berbagai pihak. Penulis ingin menyampaikan ucapan terima kasih yang sebesar-besarnya kepada :
1. Ibu Ofa Suzanti Betha, M.Si, Apt. dan Ibu Ismiarni Komala, M. Sc., Ph.D., Apt. selaku pembimbing saya, yang dengan sabar memberikan bimbingan, waktu, tenaga, pikiran, masukan, dukungan, dan semangat kepada penulis.
2. Bapak Dr. H. Arif Sumantri, S.KM., M.Kes., selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
3. Bapak Yardi, PhD., Apt selaku Ketua Program Studi Farmasi dan Ibu Nelly Suryani, PhD, M.Si., Apt selaku Sekretaris Program Studi Farmasi UIN Syarif Hidayatullah Jakarta Fakultas Kedokteran dan Ilmu Kesehatan. 4. Bapak Yardi, PhD., Apt selaku Penasehat Akademik yang selalu
membimbing penulis.
5. Bapak dan Ibu Dosen yang telah memberikan ilmu dan pengetahuan hingga penulis dapat menyelesaikan studi di jurusan Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
6. Mamah tercinta Pariyah dan Papah tercinta Munaji Fajari selaku orang tua dan adik tersayang Rizqon Jifa Syabana yang senantiasa memberikan kasih sayang, support baik moril maupun materil, serta doa tanpa henti yang dipanjatkan dalam setiap langkah yang penulis lakukan untuk menyelesaikan skripsi ini.
7. M. Syahid Ali yang selalu ada untuk memberikan semangat, motivasi, nasihat, serta dukungan tanpa henti dalam suka dan duka kepada penulis. 8. Sahabat Kesayangan (Ayu, Henny, Icob, Gina, Wina, dan Meri) yang
selalu memberikan semangat, motivasi, dan kasih sayang kepada penulis. 9. Teman seperjuangan penelitian Wafa dan Raihana atas kebersamaan, dan
bantuan. Reza yang dengan ikhlas membantu penulis selama penelitian. 10.Ayunop, Vica, Filda, Fio, Indri, Rika, Rianisa, Rhesa, dan Rambe yang
selalu memberikan semangat, bantuan, dan motivasi kepada penulis. 11.Teman-teman Farmasi 2011 atas kebersamaan dan memotivasi penulis
baik selama pengerjaan skripsi maupun selama perkuliahan.
viii
Semoga Allah SWT memberikan balasan yang berlipat ganda atas semua bantuan, dan dukungan yang diberikan.Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna dan banyak kekurangan. Oleh karena itu saran serta kritik yang membangun sangat diharapkan. Semoga skripsi ini dapat bermanfaat bagi penulis pada khususnya dan bagi pembaca pada umumnya.
Amin Ya Robbal’alamin
Ciputat, Juni 2015
x
HALAMAN JUDUL ... i
HALAMAN PERNYATAAN ORSINILITAS ... ii
HALAMAN PERSETUJUAN PEMBIMBING ... iii
HALAMAN PENGESAHAN ... iv
ABSTRAK ...v
ABSTRACT ... vi
KATA PENGANTAR ... vii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... ix
DAFTAR ISI ...x
1.4Tujuan Penelitian ...2
1.5Manfaat Penelitian ...3
BAB 2 TINJAUAN PUSTAKA ...4
2.1Tanaman Jinten Hitam ...4
2.1.1 Klasifikasi ...4
2.1.2 Morfologi Tanaman Jinten Hitam ...4
2.1.3 Bagian Tanaman yang Digunakan ...5
2.1.4 Kandungan Kimia Biji Jinten Hitam ...5
2.1.5 Aktivitas Farmakologi Minyak Biji Jinten Hitam ...7
2.2Minyak Atsiri ...9
2.3Penguraian dan Penstabilan Bahan Obat ...10
2.3.1 Reaksi Hidrolisis ...10
2.3.2 Reaksi Isomerisasi ...10
2.3.3 Reaksi Oksidasi ...10
2.4.6 Sifat Fisik Sediaan Emulsi yang Baik ...18
2.5Metode Demulsifikasi ...18
2.6Ekstraksi Cair – Cair ...20
2.7 Gas Chromatography - Mass Spectrometry (GCMS) ...20
2.7.1 Kromatografi Gas ...21
xi
BAB 3 METODOLOGI PENELITIAN ...24
3.1Waktu dan Tempat Penelitian...24
3.2Alat ...24
3.3Bahan ...24
3.4Prosedur Penelitian ...24
3.4.1 Penyiapan Bahan ...24
3.4.2 Pembuatan Emulsi Minyak Biji Jinten Hitam ...25
3.4.3 Evaluasi Fisik Emulsi Minyak Biji Jinten Hitam ...26
3.4.4 Analisa Komponen Kimia Emulsi Minyak Biji Jinten Hitam ...27
BAB 4 HASIL DAN PEMBAHASAN ...29
4.1 Evaluasi Fisik Emulsi Minyak Biji Jinten Hitam ...29
4.1.1 Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam ...29
4.1.2 Pengukuran Nilai pH dari Emulsi Minyak Biji Jinten Hitam ...33
4.1.3 Pengukuran Nilai Viskositas dari Emulsi Minyak Biji Jinten Hitam ...35
4.1.4 Pengukuran Nilai Diameter Globul dari Emulsi Minyak Biji Jinten Hitam ...37
4.1.5 Uji Tipe Emulsi dari Emulsi Minyak Biji Jinten Hitam ...38
4.1.6 Uji Sentrifugasi dari Emulsi Minyak Biji Jinten Hitam ...39
4.2 Analisa Komponen Kimia Emulsi Minyak Biji Jinten Hitam ...40
4.2.1 Kondisi Optimasi GCMS ...40
4.2.2 Analisa Stabilitas Komponen Kimia Emulsi Minyak Biji Jinten Hitam ...40
BAB 5 KESIMPULAN DAN SARAN ...49
5.1 Kesimpulan ...49
5.2 Saran ...49
DAFTAR PUSTAKA ...50
xii
Gambar 1.2 Tanaman dan Biji Jinten Hitam (Nigella sativa L.) ... 4 Gambar 4.1 Grafik Nilai pH Rata-Rata Emulsi Minyak Biji Jinten
Hitam Kontrol dan Sampel ... 34 Gambar 4.2 Grafik Nilai Viskositas Rata-Rata Emulsi Minyak Biji
Jinten Hitam Kontrol dan Sampel ... 36 Gambar 4.3 Grafik Nilai Diamter Globul Rata-Rata Emulsi Minyak
Biji Jinten Hitam Kontrol dan Sampel ... 37 Gambar 4.4 Hasil Sentrifugasi Emulsi Minyak Biji Jinten Hitam
Kontrol Dan Sampel ... 39 Gambar 4.5 Grafik Nilai Rendemen Rata- Rata Ekstaksi Emulsi
Minyak Biji Jinten Hitam Kontrol dan Sampel Fase
Heksan ... 42 Gambar 4.6 Grafik Nilai Rendemen Rata- Rata Ekstaksi Emulsi
Minyak Biji Jinten Hitam Kontrol dan Sampel Fase
Etil ... 43 Gambar 4.7 Grafik Nilai Persen Area Thymoquinone Fase Heksan
Emulsi Minyak Biji Jinten Hitam Kontrol dan
Sampel ... 47 Gambar 4.8 Grafik Nilai Persen Area Thymoquinone Fase Etil
Emulsi Minyak Biji Jinten Hitam Kontrol dan
xiii
Tabel 2.1 Kandungan Minyak Atsiri Dan Minyak Statis Pada
Minyak Biji Jinten Hitam (Nigella Sativa L.) ... 5 Tabel 2.2 Kandungan Minyak Atsiri Pada Biji Jinten Hitam ... 6 Tabel 2.3 Kandungan Minyak Statis Pada Biji Jinten Hitam ... 7 Tabel 3.1 Komposisi Emulsi Minyak Biji Jinten Hitam Yang Telah
Dioptimasi ... 25 Tabel 4.1 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten
Hitam Kontrol 1 ... 29 Tabel 4.2 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten
Hitam Kontrol 2 ... 30 Tabel 4.3 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten
Hitam Sampel 1 ... 31 Tabel 4.4 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten
Hitam Sampel 2 ... 32 Tabel 4.5 Hasil Pengukuran Nilai Ph Emulsi Minyak Biji Jinten Hitam Kontrol ... 33 Tabel 4.6 Hasil Pengukuran Nilai Ph Emulsi Minyak Biji Jinten Hitam Sampel ... 34 Tabel 4.7 Hasil Pengukuran Nilai Viskositas Emulsi Minyak Biji Jinten Hitam Kontrol ... 35 Tabel 4.8 Hasil Pengukuran Nilai Viskositas Emulsi Minyak Biji Jinten Hitam Sampel ... 35 Tabel 4.9 Hasil Pengukuran Nilai Diameter Globul Emulsi Minyak Biji Jinten Hitam Kontrol ... 37 Tabel 4.10 Hasil Pengukuran Nilai Diameter Globul Emulsi Minyak Biji Jinten Hitam Sampel ... 37 Tabel 4.11 Hasil Pengujian Tipe Emulsi Dari Emulsi Minyak Biji
Jinten Hitam Kontrol dan Sampel ... 38 Tabel 4.12 Hasil Uji Sentrifugasi Emulsi Minyak Biji Jinten Hitam
Kontrol Dan Sampel ... 39 Tabel 4.13 Hasil Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Kontrol Fase Heksan ... 41 Tabel 4.14 Hasil Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Sampel Fase Heksan ... 42 Tabel 4.15 Hasil Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Kontrol Fase Etil ... 42 Tabel 4.16 Hasil Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Sampel Fase Etil ... 43 Tabel 4.17 Kandungan Senyawa Kimia Antioksidan Emulsi Minyak Biji Jinten Hitam Kontrol Fase Heksan ... 45 Tabel 4.18 Kandungan Senyawa Kimia Antioksidan Emulsi Minyak Biji
xiv
Antioksidan Emulsi Minyak Biji Jinten Hitam Kontrol Dan
xv
1. Prosedur Penelitian... 54
2. Perhitungan Bahan Emulsi Kontrol dan Sampel ... 55
3. Dokumentasi Alat dan Bahan Yang Digunakan ... 56
4. Perhitungan Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Kontrol ... 58
5. Perhitungan Rendemen Ekstraksi Emulsi Minyak Biji Jinten Hitam Sampel ... 63
6. Perhitungan Diameter Globul Emulsi Minyak Biji Jinten Hitam Kontrol ... 68
7. Perhitungan Diameter Globul Emulsi Minyak Biji Jinten Hitam Sampel ... 73
8. Hasil Kromatogram Emulsi Minyak Biji Jinten Hitam Kontrol Fase Heksan ... 78
9. Hasil Kromatogram Emulsi Minyak Biji Jinten Hitam Sampel Fase Heksan ... 83
10.Hasil Kromatogram Emulsi Minyak Biji Jinten Hitam Kontrol Fase Etil ... 88
11.Hasil Kromatogram Emulsi Minyak Biji Jinten Hitam Sampel Fase Etil ... 93
12.Sertifikat Analisa Tragakan... 98
13.Sertifikat Analisa Sukrosa ... 99
14.Sertifikat Analisa Natrium Benzoat ... 100
15.Sertifikat Analisa Minyak Biji Jinten Hitam ... 101
16.Sertifikat Analisa Etil Asetat ... 102
UIN Syarif Hidayatullah Jakarta BAB 1
PENDAHULUAN 1.1 Latar Belakang
Jinten hitam adalah tanaman herbal berbunga tahunan, berasal dari Asia Barat dan dibudidayakan di negara-negara Mediterania Timur Tengah, Eropa Selatan, Suriah, Turki, Arab Saudi, Pakistan dan India. Biji jinten hitam telah digunakan sejak dulu sebagai stimulan tubuh dan membantu memulihkan kondisi tubuh yang lelah. Biji jinten hitam mempunyai efek sebagai astringen, stimulan, diuretik, antelmetik, dan terapi penyakit lainnya. Adapun efek farmakologisnya, yaitu sebagai obat rheumatik, dan penyakit inflamasi lainnya. Minyak jinten hitam telah terbukti memiliki efek sebagai antioksidan, antiinflamasi, antikanker, analgesik, antimikroba, dan dapat digunakan sebagai bahan kosmetik. Minyak biji jinten hitam yang telah beredar di pasaran pada umumnya berupa sediaan minyak yang dikemas dalam botol, dalam bentuk soft kapsul, dan dalam bentuk serbuk yang dicampur dengan minyak zaitun, sari kurma, serta madu (Nagi, et al., 2010 ; Saha and Bhupendar, 2011 ; Sree Harsha, et al., 2011).
Berbagai kondisi lingkungan dapat mempengaruhi stabilitas sediaan, seperti adanya cahaya, suhu, kelembaban, dan siklus freeze/thaw yang secara signifikan dapat mempengaruhi stabilitas kimia dari zat aktif selama penyimpanan dan distribusi (Lopez, et al., 2012).
Pada penelitian sebelumnya yang dilakukan oleh Indayanti, senyawa utama minyak biji jinten hitam, yaitu thymoquinon mengalami penurunan persen area dalam formulasi emulsi minyak biji jinten hitam yang dikemas menggunakan botol bening yang disimpan selama 21 hari dalam suhu ruang (Indayanti, 2014). Senyawa terpen mudah mengalami proses oksidasi dibawah pengaruh cahaya, udara dan pada kondisi penyimpanan yang kurang baik, sehingga dapat merusak aroma minyak atsiri (Syarifudin, 2012), oleh karena itu akan dilakukan modifikasi penyimpanan menggunakan wadah gelap atau wadah kuning kecoklatan.
Obat atau produk obat yang sensitif terhadap cahaya maka harus disimpan dalam wadah yang tahan terhadap cahaya seperti vial berwarna kecoklatan untuk melindungi obat atau produk obat dari cahaya (Hanne, 2004).
UIN Syarif Hidayatullah Jakarta Kestabilan suatu produk obat merupakan hal yang penting untuk mengetahui kualitas dari suatu produk obat tersebut (Lopez, et al., 2012).
1.2 Batasan Masalah
Dalam penelitian uji stabilitas fisik dan komponen kimia menggunakan GCMS pada emulsi tipe minyak dalam air pada minyak biji jinten hitam(Nigella sativa l.) yang dikemas menggunakan botol gelap hanya sebatas untuk menguji stabilitas fisik dari emulsi minyak jinten hitam dan stabilitas dari komponen senyawa antioksidan penyusun minyak jinten hitam selama penyimpanan 21 hari pada suhu ruang.
1.3 Perumusan Masalah
1. Bagaimana stabilitas fisik sedian emulsi minyak biji jinten hitam tipe minyak dalam air yang dikemas menggunakan botol gelap selama penyimpanan 21 hari pada suhu ruang ?
2. Bagaimana stabilitas kimia dari komponen penyusun minyak atsiri biji jinten hitam dalam formulasi emulsi tipe minyak dalam air yang dikemas menggunakan botol gelap selama penyimpanan 21 hari pada suhu ruang ?
1.4 Tujuan Penelitian
1. Untuk menguji stabilitas fisik sedian emulsi minyak biji jinten hitam tipe minyak dalam air yang dikemas menggunakan botol gelap selama penyimpanan 21 hari pada suhu ruang.
UIN Syarif Hidayatullah Jakarta 1.5 Manfaat Penelitian
UIN Syarif Hidayatullah Jakarta BAB 2
TINJAUAN PUSTAKA
2.1 Tanaman Jinten Hitam (Nigella sativa L.) 2.1.1 Klasifikasi (USDA)
Kingdom : Plantae Sub Kindom : Tracheobionta Super Divisi : Spermatopita Divisi : Magnoliophyta Kelas : Magnoliopsida Sub Kelas : Magnoliidae Ordo : Ranunculales Family : Ranunculaceae Genus : Nigella L Spesies : Nigella sativa L
2.1.2 Morfologi Tanaman Jinten Hitam (Nigella sativa L.)
Jinten hitam merupakan jenis tanaman terna setahun berbatang tegak. Batang biasanya berusuk dan berbulu tegak, rapat atau jarang-jarang dengan disertai adanya bulu-bulu berkelenjar. Bentuk daun lanset, berbentuk garis dengan panjang 1,5-2 cm, ujung lancip dan terdapat tiga tulang daun berbulu. Daun bagian bawah bertangkai dan bagian atas duduk. Memiliki daun pembalut bunga kecil. Tanaman jinten hitam ini memiliki jumlah kelopak bunga lima dengan bentuk bundar telur yang ujungnya agak melancip sampai agak tumpul. Pangkal mengecil membentuk sudut yang pendek dan besar. Tanaman jinten hitam juga memiliki mahkota bunga pada umumnya delapan dan bentuk agak memanjang namun lebih kecil dari kelopak bunga. Memiliki bibir bunga dua, bibir bagian atas pendek, lanset, ujung memanjang berbentuk benang dan bibir bagian bawah memiliki ujung tumpul. Benang sari banyak dan gundul, kepala sari jorong, berwarna kuning, dan sedikit tajam. Memiliki buah dengan bentuk bulat telur atau agak bulat. Biji hitam, jorong bersudut tiga dan tidak beraturan yang sedikit membentuk kerucut, panjang 3 mm, berkelenjar (Materia Medika Jilid III, 1979).
UIN Syarif Hidayatullah Jakarta Gambar 2.1Tanaman dan biji jinten hitam (Nigella sativa L.)
[Sumber : Padma 2010 and Rajshekar, et al., 2011, yang telah dikelola kembali]
2.1.3 Bagian Tanaman yang Digunakan
Bagian tanaman yang digunakan pada tanaman jinten hitam adalah bagian bijinya. Biji jinten hitam mengandung minyak atsiri sampai 1,5 %, karven 45-60 %, d-limonena, simena dan terpen-terpen lainnya, glukosida saponin, glukosida beracun melantin, minyak lemak 37,5 % dan zat pahit. Penggunaan sebagai stimulan, karminatif, emenagoga, galaktatoga, dan diaforetika (Materia Medika Jilid III, 1979).
2.1.4 Kandungan Kimia Biji Jinten Hitam (Nigella sativa L.)
Sebagian besar aktifitas farmakologis minyak jinten hitam dihasilkan dari minyak atsiri dan minyak statis ( fixed oils) (Nickavar, et al , 2003). Komposisi minyak jinten hitam secara umum dapat dilihat pada tabel berikut ini :
UIN Syarif Hidayatullah Jakarta
Komponen Prosentasi (%)
UIN Syarif Hidayatullah Jakarta Tabel 2.3 Kandungan minyak statis pada biji jinten hitam (Nigella sativa L.)
Asam Lemak Prosentase (%)
Lauric acid 2.1.5 Aktivitas Farmakologi Minyak Biji Jinten Hitam a. Antikanker
Penelitian Rajsekhar, Saha et al., 2011 tentang thymoquinone yang memiliki aktivitas penghambatan antineoplastik telah dilakukan. Dimana minyak esensial diinjeksikan langsung ke tumor untuk mengurangi volume tumor dengan cara menghambat perkembangan metastatis dan menunda kematian dari aktivitas tumor P815 pada tumor tikus Thymoquinone menunjukkan pertumbuhan aktivitas penghambatan antineoplastik in vitro dan in vivo terhadap variasi sel tumor dan aktivitas penghambatan pada pertumbuhan sel kanker serta kemampuan untuk menginduksi apoptosis. Thymoquinone didapatkan aktif terhadap variasi sel kanker pada manusia yang resisten terhadap multidrug. Thymoquinone juga menunjukkan aktivitas antineoplastik pada sel kanker prostat yang telah dibuktikan dengan senyawa yang secara efektif memblok fase G1 sel kanker prostat dengan memasuki fase S, oleh karena itu dapat digunakan dalam pengobatan kanker prostat, khususnya dalam kasus hormon yang sulit disembuhkan. Thymoquinone juga memproduksi destruksi selular yang signifikan dan gangguan fungsi metabolik selular dari SW-626 sel kanker colon pada manusia, dan hasilnya dapat dibandingkan dengan efek 5-fluorourasil.
Pada jurnal Hassan, et al., 2008, telah dilakukan penelitian tentang efek thymoquinone sebagai antikanker pada sel karsinoma hepatoseluler (HepG2). Studi ini dilakukan dengan memberikan pengobatan pada sel karsinoma hepatoseluler (HepG2) dengan konsentrasi thymoquinone yang bertingkat (25-400
UIN Syarif Hidayatullah Jakarta diamati. Hasil dari studi ini dapat dilihat berdasarkan data yang menunjukkan bahwa pengobatan sel karsinoma dengan thymoquinone konsentrasi < 200 μM menghasilkan penghambatan yang signifikan dari kelangsungan hidup sel pada 12-24 jam dibandingkan dengan kontrol percobaan.
b. Antioksidan
Berdasarkan penelitian yang dilakukan oleh Muhamma Raza, et al., 2006 senyawa thymoquinone yang terdapat dalam minyak atsiri biji jinten hitam dalam bentuk minuman yang diberikan selama 5 hari (8 mg/kg/day p.o.) terbukti dapat melindungi mencit dari hepatotoksisitas yang diinduksi oleh CCl4. Efek hepatoprotektif dari thymoquinone terhadap hepatotoksisitas yang diinduksi oleh CCl4 ditunjukkan oleh adanya pencegahan yang signifikan terhadap peningkatan serum ALT, AST dan LDH yang terkait dengan penghambatan dalam produksi peroksida oleh lipid pada hati.
c. Aktivitas Antidiabetes
Dalam studi yang dilakukan oleh Rajsekhar, Saha et al., 2011 melakukan penelitian tentang aktivitas antidiabetes yang dievaluasi pada sukarelawan manusia. Biji Nigella sativa digunakan sebagai terapi adjuvant untuk pengobatan diabetes. Sejumlah 94 pasien dibagi secara acak dalam 3 grup menurut dosis penggunaan. Kapsul yang berisi Nigella sativa diberikan secara oral dalam dosis 1, 2, dan 3 mg/hari selama 3 bulan. Nigella sativa pada dosis 2 mg/hari menyebabkan penurunan yang signifikan terhadap FBG, 2hPG, dan HbA tanpa mempengaruhi berat badan secara signifikan. Gula darah puasa menurun, dan
fungsi sel β meningkat pada 12 minggu pengobatan.
UIN Syarif Hidayatullah Jakarta dengan kontrol diabetes. Leptin dan adinopektin tidak berubah. Pengobatan Nigella sativa menurunkan OGTT dan menurunkan kadar trigliserida pada hati dan otot (Rajsekhar,Saha et al., 2011).
d. Aktivitas Antimikroba
Aktivitas antimikroba telah dievaluasi menggunakan metode disc diffusion. Minyak atsiri dengan konsentrasi 20 μg untuk test diaplikasikan ke disc. Hasil aktivitas antimikroba dari minyak atsiri Nigella sativa dibandingkan berdasarkan dengan standard, efikasi minyak atsiri jauh lebih baik daripada standard (Rajsekhar,Saha et al, 2011).
2.2 Minyak atsiri
Minyak atsiri memiliki bagian utama yaitu terpenoid. Terpenoid terdapat pada fraksi atsiri yang tersuling uap yang menyebabkan wangi, harum, atau bau yang khas pada banyak tumbuhan. Beberapa jenis tumbuhan yang kaya akan minyak atsiri diantaranya Compositae, Matricaria, Labiatak, misalnya ; Mentha sp, Myrtaceae, Eucaliptus, Rosaceae, Citrus sp, Umbeliferaceae dll. Terpen juga seringkali terdapat dalam fraksi yang memiliki bau bersama-sama dengan senyawa aromatik seperti fenil propanoid (Harborne, 1987).
Secara kimia, terpen dari minyak atsiri dapat dibagi menjadi dua golongan yaitu monoterpen dan sesquiterpen yang berupa isoprenoid C10 dan C15 yang mempunyai titik didih yang berbeda (titik didih monoterpen 140-180 °C dan titik didih sesquiterpen lebih dari 200 °C). Monoterpen dibagi menjadi tiga golongan, yaitu monoterpen struktur asiklik (geraniol), monosiklik (limonen), dan bisiklik (alfa dan beta pinen) (Harborne, 1987).
UIN Syarif Hidayatullah Jakarta 2.3 Penguraian dan Penstabilan Bahan Obat
Bahan-bahan farmasi kebanyakan mengalami proses penguraian seperti hidrolisis ataupun oksidasi. Kebanyakan obat mengandung lebih dari satu gugus fungsional yang menyebabkan obat mungkin dapat terhidrolisis ataupun teroksidasi bersama-sama. Reaksi lain seperti isomerisasi, epimerisasi dan fotolisis juga dapat mempengaruhi kestabilan obat dalam berbagai produk cairan, padatan dan semisolid (Martin, et al., 1993).
2.3.1 Reaksi Hidrolisis
Reaksi hidrolisis adalah reaksi air dengan ester ataupun reaksi antara air dengan ion-ion garam dari asam lemah dan basa lemah (Martin, et al., 1993). Reaksi hidrolisis adalah reaksi yang terjadi bila garam dimasukan kedalam air dan larutan tersebut bersifat netral dan garam-garam lain seperti amonium klorida, alumunium klorida, akan memberikan larutan yang sedikit bersifat asam. Hidrolisis dapat dipandang juga sebagai penarikan ion hidrogen dari air oleh anion dari asam lemah yang meninggalkan ion hidroksi dari air dan membentuk larutan alkali atau penarikan OH- oleh kation dari basa lemah yang meninggalkan H+ dan membentuk larutan asam (Hardjono, 2005).
2.3.2 Reaksi Isomerisasi
Reaksi isomerisasi merupakan suatu proses kimia dari suatu senyawa yang
berubah menjadi bentuk senyawa isomer lainnya namun tetap memiliki komposisi
kimia yang sama dengan senyawa asalnya hanya memiliki perbedaan pada
struktur atau konfigurasi sehingga memiliki sifat fisika dan kimia yang berbeda
juga dengan senyawa asalnya. Senyawa isomer yang terbentuk ini mungkin juga
memiliki sifat farmakologi atau toksikologi yang berbeda (Fathima, et al., 2011).
2.3.3 Reaksi Oksidasi
Merupakan reaksi pelepasan elektron dalam molekul. Oksidasi sering melibatkan radikal bebas yang diikuti reaksi-reaksi berantai. Radikal bebas adalah molekul atau atom yang mengandung satu atau lebih elektron tidak berpasangan
UIN Syarif Hidayatullah Jakarta untuk menarik elektron dari zat lain sehingga terjadi oksidasi. Reaksi oksidasi
dikatalis oleh logam berat dalam jumlah kecil dan peroksida organik. Oksidasi lemak tak jenuh dan minyak terjadi dengan adanya oksigen dari atmosfer, cahaya, dan katalis dalam jumlah kecil (Martin, et al., 1993).
2.4 Emulsi
2.4.1 Pengertian Emulsi
Emulsi adalah suatu dispersi dimana fase terdispersi terdiri dari bulatan- bulatan kecil zat cair yang terdistribusi keseluruh pembawa yang tidak bercampur. Fase terdispersi disebut sebagai fase dalam dan medium dispersi disebut fase luar. Emulsi terbagi menjadi dua, emulsi minyak dalam air dan emulsi air dalam minyak. Emulsi minyak dalam air adalah emulsi yang memiliki fase dalam minyak dan fase luar air, sedangkan emulsi air dalam minyak adalah emulsi yang memiliki fase dalam air dan fase luar minyak (Ansel, 2008). Sistem emulsi terdiri dari emulsi cair yang mempunyai viskositas relatif rendah serta salep atau krim yang mmepunyai viskositas tinggi. Diameter partikel dari fase terdispersi umumnya berkisar antara 0,1µm-10µm (Martin, et al., 1993).Untuk membuat suatu emulsi yang stabil memerlukan fase ketiga, yaitu zat pengemulsi. Berdasarkan konstituen dan pemakaiannya, emulsi cair bisa digunakan secara oral, topikal maupun parenteral (Ansel, 2008 ).
UIN Syarif Hidayatullah Jakarta Sedangkan penutup rasa ditujukan untuk mengurangi rasa tidak enak dan secara ideal dilakukan dengan cara mengurangi rasa pahit, menggunakan penghambat rasa khasiat, stabilitas, penampilan sediaan, serta memberi rasa tertentu untuk mencirikan suatu produk (Effionora, 2012). Cara penutupan rasa pahit sediaan oral secara umum dapat dilakukan dengan menggunakan pemanis dan flavor. Pemanis dapat memainkan peranan penting dalam formulasi sediaan yang digunakan melalui mulut seperti dengan cara menambah rasa, menutupi rasa yang tidak dapat diterima oleh masyarakat umum. Contoh pemanis yang biasa digunakan di antaranya: sukrosa, dekstrosa, fruktosa, gliserin, maltitol, manitol, sorbitol dan xylitol (Effionora, 2012).
2.4.2 Tujuan Emulsi dan Emulsifikasi
Secara farmasetik, proses emulsifikasi memungkinkan seorang farmasis dapat membuat suatu sediaan yang stabil dari dua cairan yang tidak dapat bercampur, memecah fase dalam menjadi tetesan-tetesan dan menstabilkan tetesan-tetesan tersebut dalam fase pendispersi dan ditujukan untuk pemberian obat yang mempunyai rasa lebih enak walaupun yang diberikan sebenarnya minyak yang tidak enak rasanya. Dengan adanya penambahan pemanis dan pemberi rasa pada fase airnya sehingga mudah dikonsumsi dan ditelan sampai ke lambung. Ukuran partikel yang diperkecil dari bola-bola minyak dapat mempertahankan minyak tersebut agar lebih dapat dicernakan dan memudahkan absorpsi obat (Ansel, 2008 ; Lachman, et al., 1994).
2.4.3 Komponen Pembentuk Emulsi Komponen pembentuk emulsi : a. Fase Minyak
UIN Syarif Hidayatullah Jakarta benzil benzoat biasa diformulasikan untuk emulsi penggunaan eksternal (Aulton and Taylor, 2001).
Dalam penelitian ini fase minyak yang digunakan adalah minyak biji jinten hitam. Sampel minyak biji jinten hitam didapatkan dari CV.Cipta Anugrah. Dibeli sebanyak 3 liter pada tanggal 16 Desember 2014. Sampel minyak biji jinten hitam yang dibeli memiliki Certificate of Analysis (COA). Pada COA minyak biji jinten hitam terdapat data karakterisasi dari minyak biji jinten hitam tersebut yang meliputi:
a) Organoleptis : cairan berminyak, berwarna kuning pucat sampai kuning dan kuning kehijauan, berbau khas dan memiliki rasa khas minyak biji jinten hitam. b) Berat jenis : 0.9152 - 0.9260
c) Nilai asam : maksimal 10
d) Nilai peroksida : maksimal 45 ml oksigen dalam setiap kg sampel. e) Titik nyala : 148oC
f) Penyimpanan : Dalam ruang gelap, dingin, kering, dan ruangan berventilasi.
g) Waktu simpan : 24 bulan dalam penyimpanan yang benar. h) Komponen utama : asam stearat 2-3%, asam oleat 20-30%, asam
linoleat 50-65%. b. Fase Air
Fase air atau pelarut yang digunakan dalam pembuatan emulsi adalah aquademineralisata. Aqua demineralisata ini diperoleh dengan cara penyulingan, pertukaran ion, osmosis terbalik, atau cara lain yang sesuai. Air yang digunakan harus bebas mineral, partikel, dan mikroba. (Rowey, Sheskey dan Owen, 2006).
c. Emulsifying Agent ( Emulgator )
UIN Syarif Hidayatullah Jakarta emulsi dan menjaga stabilitas dari emulsi tersebut agar mecapai shelf life dari produk ( Ansel, 2008 )
Bahan pengemulsi yang digunakan dalam penelitian adalah tragakan. Dimana tragakan 1,5% dipilih karena merupakan emulgator alam dan berdasarkan penelitian sebelumnya dihasilkan sediaan emulsi dengan viskositas yang paling baik (Indayanti, 2014). Tragakan tidak larut dalam air, etanol 95%, dan pelarut organik lain. Meskipun tidak larut dalam air namun tragakan dapat mengembang 10 kali dari beratnya baik di dalam air panas ataupun air dingin (Rowey, Sheskey dan Owen, 2006).
Data praformulasi dari tragakan yaitu : (HOPE, 6th Edition) Sinonim : gum tragacanth, tragacantha.
Organoleptis : serbuk, berwarna putih hingga kekuningan, tidak
berbau, membentuk lapisan transparan.
Kelarutan : praktis tidak larut dalam air, ethanol (95%), dan
pelarut organik lain. Bisa mengembang dengan
cepat dengan sepuluh kali beratnya dalam air baik
air panas atau dingin.
Keasaman-kebasaan : pH 5-6 pada larutan terdispersi 1% w/v
Nilai keasaman : 2-5
Kandungan air : < 15% w/w
Manfaat penggunaan : agen pensuspensi, agen peningkat viskositas.
Stabilitas dan penyimpanan : stabil pada pH 4-8 dan pada wadah tertutup rapat
dengan kondisi sejuk dan kering.
Inkompatibilitas : menurunkan efek sebagai pengawet pada benzal
konium klorida, klorbutanol, dan metil paraben.
Selain emulgator tragakan, zat lain yang digunakan sebagai emulgator dan penstabil untuk sistem emulsi farmasi adalah sebagai berikut: ( Ansel, 2008 ).
1. Bahan-bahan karbohidrat : akasia, agar, kondrus, dan pektin. 2. Zat – zat protein : gelatin, kuning telur, dan kasein. 3. Alkohol dengan BM tinggi : streil alkohol, setil alkohol, dan
UIN Syarif Hidayatullah Jakarta 4. Zat –zat pembasah : anionik natrium laurilsulfat
(bersifat kationik ,anionik kationik benzalkonium klorida dan nonionik) nonionik ester-ester sorbitan
dan turunan poli etilen. 5. Zat terbagi halus : tanah liat koloid termasuk
bentonit, magnesium hidroksida, dan alumunium hidroksida. d. Pengawet
Pengawet yang digunakan disini adalah Natrium benzoat dengan konsentrasi 0,1%. Natrium benzoat dipilih sebagai pengawet karena cocok dengan tragakan. Natrium benzoat larut dalam etanol 95% (1:75), etanol 90% (1:50), dan air (pada suhu 20 °C 1:1,8 dan pada suhu 100 °C 1:1,4). Natrium benzoat memiliki aktivitas sebagai bakteriostatik dan anti jamur yang optimal pada pH 2-5 serta pada kondisi basa hampir tidak memiliki efek (Rowey, Sheskey and Owen, 2006). Data praformulasi dari natrium benzoat adalah :
Sinonim : sodium benzoic acid, benzoic acid sodium salt.
Organoleptis : berupa serbuk, granul, atau kristal yang sedikit
higroskopis,berwarna putih, tidak berbau.
Kelarutan : ethanol 95% (1 dalam75), ethanol 90% (1 dalam
50), air (1 dalam 1,8 ; 1 dalam 1,4 pada suhu
100oC)
Keasaman-kebasaan : pH 8
Densitas : 1,497-1,527 g/cm3 at 24oC
Manfaat penggunaan : pengawet, lubrikan tablet dan kapsul
Stabilitas dan penyimpanan : penyimpanan pada wadah tertutup rapat dengan
kondisi sejuk dan kering.
Inkompatibilitas : inkompatibel dengan senyawa kuartener, gelatin,
garam Fe,garam kalsium, logam berat seperti
merkuri dan perak.
e. Pemanis
UIN Syarif Hidayatullah Jakarta Sukrosa disini berfungsi untuk menutupi rasa dari sediaan yang kurang enak. Konsentrasi sukrosa sebagai pemanis pada sediaan oral yaitu 50 - 67%. Sukrosa praktis tidak larut dalam kloroform, larut dalam etanol (1:400), etanol 95% (1:170), propan-2-ol (1:400), dan air (pada suhu 20oC 1:0,5 dan pada suhu 100oC 1:0,2) (Rowey, Sheskey and Owen, 2006).
2.4.4 Evaluasi Sediaan Emulsi
Evaluasi dari sediaan emulsi dilakukan untuk mengetahui stabilitas dari suatu sediaan emulsi dalam jangka waktu penyimpanan tertentu. Evaluasi sediaan emulsi ini dilakukan melalui pengamatan organoleptis (bau, warna, rasa), pengamatan secara fisik (viskositas, diameter globul rata- rata, pH, dan volume creaming), serta pengamatan secara kimia (degradasi zat aktif) (Ansel, 2008 ; Lachman, et al., 1994; Martin, et al., 1993).
2.4.5 Stabilitas Sediaan Emulsi
Kestabilan dari emulsi farmasi berciri tidak adanya penggabungan fase dalam, tidak adanya creaming, dan memberikan penampilan (bau dan warna ) serta sifat-sifat fisik lainnya yang baik. Ketidakstabilan suatu emulsi hanya dalam hal terbentuknya penimbunan dari fase dalam dan pemisahannya dari produk. Penampilan suatu emulsi dipengaruhi oleh creaming dan merupakan suatu masalah jika terjadi pemisahan dari fase dalam. Fenomena penting lainnya dalam pembuatan dan penstabilan dari emulsi adalah inversi fase. Inversi fase meliputi perubahan tipe emulsi dari o/w menjadi w/o atau sebaliknya (Martin, et al., 1993).
Faktor yang menyebabkan ketidakstabilan sediaan obat dapat dikelompokkan menjadi dua. Pertama adalah kecocokan bahan aktif dan bahan pembantunya sendiri yang dihasilkan oleh bangun kimiawi dan kimia-fisikanya. Kedua adalah faktor luar seperti suhu, kelembaban udara dan cahaya yang dapat menginduksi atau mempercepat jalannya reaksi. Hal penting lainnya adalah kemasan, khususnya jika digunakan wadah yang terbuat dari bahan sintetis
UIN Syarif Hidayatullah Jakarta Emulsi tipe M/A dapat mengalami destabilisasi emulsi seperti beberapa tipe perubahan fisik, berbeda dengan tipe A/M yang mungkin cenderung mengalami sedimentasi daripada creaming. Destabilisasi emulsi ini di antaranya:
a. Creaming
Creaming adalah pertumbuhan dari droplet karena aktivitas gravitasi sehingga droplet terpisah ketika disentuh. Creaming berada pada fase kontinyu jika fase terdispersi tidak memiliki berat jenis yang sebanding. Kecepatan creaming dapat dikontrol dengan memperkecil ukuran droplet, menyamakan berat jenis dari kedua fase dan menambah viskositas dari fase kontinyu (Martin, et al., 1993).
b. Flokulasi
Flokulasi adalah suatu bentuk pelekatan satu atau lebih droplet bersama dan membentuk suatu agregasi. Hal ini merupakan proses dari droplet sebagai hasil dari benturan kombinasi gaya antar droplet (Martin, et al., 1993).
c. Koalesen
Penyebab koalesen adalah rusaknya lapisan tipis antar droplet yang berdekatan. Hal ini akan mengurangi tegangan antarmuka dan luas permukaan droplet. Kemungkinan terjadinya koalesen sebanding dengan lama droplet itu saling berdekatan. Koalesen jarang terjadi pada droplet yang kecil atau pada lapisan yang tebal karena droplet ini memiliki luas lapisan yang lebih kecil atau memiliki gaya tolak antardroplet. Koalesen menyebabkan droplet menjadi lebih besar dan terjadi pemisahan fase (Martin, et al., 1993)
Selain uji stabilitas fisik, uji stabilitas kimia pada emulsi juga dilakukan. Uji stabilitas kimia pada emulsi salah satunya adalah dengan cara menganalisis perolehan kembali zat aktif yang terkandung dalam emulsi. Stabilitas kimia dari molekul sediaan merupakan hal yang sangat penting karena berhubungan dengan efek dan keamanan dari suatu produk obat.
UIN Syarif Hidayatullah Jakarta umur simpan. Studi stabilitas ini mencakup studi stabilitas jangka panjang dan studi stabilitas dipercepat. Studi jangka panjang dilakukan selama 12 bulan dan studi dipercepat dilakukan dalam waktu 6 bulan. Selain itu, ada juga forced degradation studies yang dilakukan dalam waktu yang lebih singkat, yaitu dalam hitungan minggu. Hasil dari forced degradation studies ini dapat digunakan untuk pengembangan indikasi dari metode yang digunakan dalam studi jangka panjang dan dipercepat (M. Blessy, et al., 2013).
2.4.6 Sifat Fisik Sediaan Emulsi yang Baik (Aulton, 2008)
a) Sediaan emulsi harus tetap homogen pada saat waktu pengocokan dalam wadah sampai saat penuangan dari wadah.
b) Creaming yang terjadi pada saat penyimpanan harus mudah di
redispersikan kembali.
c) Sediaan emulsi sebaiknya dibuat agak kental agar dapat menurunkan laju pembentukan creaming globul minyak, namun viskositas sediaan emulsi tersebut jangan terlalu tinggi karena dapat menyulitkan pada saat penuangan.
d) Terlihat dalam satu fase.
e) Ukuran globul yang dihasilkan seragam dan kecil.
2.5. Metode Demulsifikasi
Metode demulsifikasi dibagi menjadi dua, yaitu metode fisika dan metode kimia. Metode fisika dapat dilakukan melalui beberapa cara yaitu melalui pemanasan, mekanik,dan elektrik (Anil, Syed, and Ana, 2008).
a. Metode Kimia
Pada metode ini dilakukan penambahan demulsifier pada emulsi.Misalnya yaitu aseton, n-butanol, dan 2-propanol yang telah terbukti berfungsi sebagai demulsifier yang efektif pada aplikasi tertentu (Anil, Syed, and Ana, 2008), juga HCl pekat untuk memecah krim kosmetik (Rohman and Che man, 2011).
b. Metode Fisika
UIN Syarif Hidayatullah Jakarta bertegangan tinggi. Metode non konvensional lainnya yang telah banyak diteliti yaitu dengan menggunakan microwave dan membran kaca berpori (Anil, Syed, and Ana, 2008).
1. Pemanasan
Prinsip dari metode pemanasan ini adalah terjadi penurunan viskositas serta peningkatan kelarutan dari surfaktan. Hal ini akan mengakibatkan melemahkan lapisan film pada sediaan (Anil, Syed, and Ana, 2008). Abdurahman dan Rosli, 2011 dalam penelitiannya membandingkan antara metode pemanasan untuk demulsifikasi antara modern yang menggunakan microwave dengan konvensional dan didapatkan hasil bahwa metode modern dengan microwave lebih efisien dalam pemisahan emulsi air dalam minyak.
2. High Shear
Metode demulsifikasi ini menggunakan alat High Shear. Prinsip kerja dari alat ini yaitu akan merusak membran atau lapisan dari globul emulsi (Anil, Syed, and Ana, 2008).
3. Medan Elektrostatik Bertegangan Tinggi
Secara umum dengan adanya medan listrik akan membuat droplet mengalami polarisasi dan elongasi, begitu juga dengan droplet yang berada di dekatnya, sehingga mereka akan menarik satu sama lain dan membentuk droplet yang lebih besar. Metode ini merupakan metode demulsifikasi yang paling efisien dan ekonomis dilihat dari peralatan yang digunakan dan parameter pengoperasiannya (Anil, Syed, and Ana, 2008).
4. Sentrifugasi
UIN Syarif Hidayatullah Jakarta 2.6 Ekstraksi Cair-cair
Ekstraksi adalah suatu proses pemisahan dari suatu bahan berupa padatan ataupun berupa cairan. Ekstraksi merupakan salah satu teknik yang sangat penting untuk isolasi dan pemurnian dari suatu bahan organik. Ekstraksi dengan pelarut adalah pemisahan antar bagian dari suatu bahan berdasarkan pada perbedaan dari sifat melarut dari masing-masing bagian bahan terhadap pelarut yang digunakan. Pelarut organik yang biasa digunakan adalah senyawa hidrokarbon pelarut lemak dan minyak seperti alkohol dan aseton (Harborne, 1987).
Ekstraksi dapat dibedakan menjadi dua cara berdasarkan wujud bahannya, yaitu ekstraksi padat cair dan ekstraksi cair-cair. Ekstraksi padat cair biasanya digunakan untuk sampel yang berupa padatan dengan pelarutnya berupa cairan. Ekstraksi cair-cair digunakan untuk memisahkan dua zat cair yang saling bercampur dengan menggunakan pelarut yang dapat melarutkan salah satu zat. Metode ekstraksi pelarut menggunakan pelarut yang dapat bercampur dengan sampel untuk menarik senyawa target yang berada pada sampel. Pelarut yang dipilih biasanya memiliki polaritas yang dekat dengan senyawa target. Pelarut mudah menguap seperti heksan, benzen, ether, etil asetat, dan dikloro metan biasanya digunakan untuk ekstraksi senyawa yang mudah menguap. N- heksan cocok untuk ekstraksi senyawa non polar seperti hidrokarbon alifatik, benzen cocok untuk senyawa aromatik, serta eter dan etil asetat cocok untuk senyawa yang relatif polar mengandung oksigen. Ekstraksi umumnya dilakukan dengan mengocok sampel dan pelarut di dalam corong pisah. Metode ekstraksi ini merupakan metode yang efisien namun waktu ekstraksi dengan metode ini panjang (Handbook of Analytical Method).
2.7 Gas Chromatography - Mass Spectrometry (GCMS)
Kromatografi gas dan spektrometri massa dapat digunakan untuk memisahkan komponen dengan memberikan waktu retensi dan puncak elusi yang dapat dimasukkan ke dalam spektrofotometer massa untuk memperoleh berat molekul, karakteristik dan informasi fragmentasi (Heinrich, 2004).
UIN Syarif Hidayatullah Jakarta massa sebagai metode deteksi yang memberikan data yang bermakna, yang diperoleh dari penentuan langsung molekul zat atau fragmen (Heinrich, 2004).
2.7.1 Kromatografi Gas
Kromatografi gas merupakan metode yang dinamis untuk pemisahan senyawa-senyawa organik yang mudah menguap dan senyawa-senyawa gas anorganik dalam suatu campuran. Sampel yang mudah menguap dan stabil terhadap panas akan bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang terantung pada rasio distribusinya. Pada umumnya solut dari ujung kolom menghantarkan ke detektor (McNair, et al., 1998).
Kromatografi gas penggunaan utamanya ialah pada pemisahan senyawa atsiri, yaitu : asam lemak, mono dan seskuiterpen, hidrokarbon dan senyawa belerang tinggi (Harborne, 1987).
2.7.2 Spektrometri Massa
Teknik ini memungkinkan untuk mengukur berat molekul dari senyawa dan ion molekular yang diidentifikasi, teknik ini memungkinkan untuk mengukur ion secara akurat untuk memastikan jumlah dari atom hidrogen, karbon, oksigen dan atom lain yang terdapat dalam suatu molekul. Teknik ini akan memberikan hasil data berupa rumus molekul (Heinrich, 2004).
Sejumlah teknik ionisasi terdapat dalam spektrometri massa, yang mana electron impact digunakan secara luas. Teknik ini memberikan fragmentasi yang baik dari molekul dan berguna untuk menentukan struktur dengan menetapkan fragmentasi untuk kelompok fungsional yang terdapat dalam senyawa (Heinrich, 2004).
2.8 Wadah
2.8.1 Pengertian Wadah
UIN Syarif Hidayatullah Jakarta
kekuatan, mutu atau kemurnian hingga tidak memenuhi persyaratan resmi ( Farmakope Indonesia Jilid IV, 1995 ).
Sistem wadah dan penutup harus cukup melindungi bentuk sediaan dari temperatur dan cahaya yang dapat menyebabkan penurunan mutu bentuk sediaan. Penyebab dari degradasi sediaan diantaranya adalah terpapar sinar matahari. Perlindungan terhadap paparan cahaya dilakukan pengemasan dengan wadah gelap atau wadah kuning kecoklatan ( amber ) (Patrick, 2011 ).
2.8.1 Macam-Macam Wadah a) Wadah Tertutup Baik
Wadah tertutup baik harus melindungi isi terhadap masuknya bahan padat dan mencegah hilangnya isi selama penanganan, pengangkutan, penyimpanan, dan pendistribusian (Farmakope Indonesia Jilid IV, 1995).
b) Wadah Tertutup Rapat
Wadah tertutup rapat harus melindungi isi terhadap masuknya bahan cair, bahan padat, atau uap dan mencegah hilangnya isi selama penanganan, pengangkutan, penyimpanan, dan pendistribusian dan harus dapat ditutup rapat kembali. Wadah tertutup rapat dapat diganti dengan wadah tertutup kedap untuk bahan dosis tunggal (Farmakope Indonesia Jilid IV, 1995).
c) Wadah Tidak Tembus Cahaya
Wadah tidak tembus cahaya harus dapat melindungi isi dari pengaruh cahaya, dibuat dari bahan khusus yang mempunyai sifat menahan cahaya atau dengan melapisi wadah tersebut. Wadah yang bening dan tidak berwarna atau wadah yang tembus cahaya dapat dibuat tidak tembus cahaya dengan cara
memberi pembungkus yang buram. Jika dalam monografi dinyatakan “terlindung
dari cahaya” dimaksudkan agar penyimpanan dilakukan dalam wadah tidak tembus cahaya (Farmakope Indonesia Jilid IV, 1995).
d) Wadah Tahan Dirusak
UIN Syarif Hidayatullah Jakarta e) Wadah Tertutup Kedap
Wadah tertutup kedap harus dapat mencegah menembusnya udara atau gas selama penanganan, pengangkutan, penyimpanan, dan distribusi (Farmakope Indonesia Jilid IV, 1995).
f) Wadah Satuan Tunggal
Wadah satuan tunggal digunakan untuk produk obat yang dimaksudkan untuk digunakan sebagai dosis tunggal yang harus digunakan segera setelah dibuka. Wadah atau pembungkus sebaiknya dirancang sedemikian rupa hingga dapat diketahui apabila wadah tersebut pernah dibuka (Farmakope Indonesia Jilid IV, 1995).
g) Wadah Dosis Tunggal
Wadah dosis tunggal adalah wadah satuan tunggal untk bahan yang hanya digunakaan secara parenteral (Farmakope Indonesia Jilid IV, 1995).
h) Wadah Dosis Satuan
Wadah dosis satuan adalah wadah satuan tunggal untuk bahan yang digunakan bukan secara parenteral dalam dosis tunggal, langsung dari wadah (Farmakope Indonesia Jilid IV, 1995).
i) Wadah Satuan Ganda
Wadah satuan ganda adalah wadah yang memungkinkan dapat diambil isinya beberapa kali tanpa mengakibatkan perubahan kekuatan mutu atau kemurnian sisa zat dalam waktu tersebut (Farmakope Indonesia Jilid IV,1995)
j) Wadah Dosis Ganda
UIN Syarif Hidayatullah Jakarta BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Analisa Obat dan Pangan Halal,
Laboratorium Farmakognosi Fitokimia, Laboratorium Penelitian I, dan
Laboratorium Penelitian II Program Studi Farmasi, Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta. Di mulai dari
bulan Februari sampai Mei 2015.
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah GCMS (Agilent Technologies 7890A), stirer homogenizer (STIRER IKA), alat sentrifugasi, pH meter (Horiba pH meter F-52), viskometer (HAAKE Visco Tester 6R), evaporator(Eyela), timbangan analitik (AND GH-202), mikroskop optik (Olympus), corong pisah (Pyrex), gelas ukur (Pyrex), beacker glass (Pyrex), erlenmeyer (Pyrex), botol amber 100 ml (Duran), botol bening 100 ml (Duran), hot plate, vial, magnetic stirer, cawan penguap, kaca arloji, pipet tetes, batang pengaduk, dan spatula.
3.3 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah minyak biji jinten hitam (Nigella sativa, L seed oil) (CV Cipta Anugrah), tragakan (Brataco), sukrosa (CV Cipta Anugrah), natrium benzoat (CV Cipta Anugrah), aquades. Untuk pereaksi kimia yang digunakan adalah n-heksan pro analisis (Merck), etil asetat pro analisis (Merck), dan HCl pekat pro analisis (Smart Lab).
3.4 Prosedur Penelitian 3.4.1 Penyiapan Bahan
Bahan – bahan yang akan digunakan untuk membuat emulsi minyak biji jinten hitam yang diperoleh dari CV Cipta Anugerah dan Brataco disiapkan.
UIN Syarif Hidayatullah Jakarta 3.4.2 Pembuatan Emulsi Minyak Biji Jinten Hitam
A.Formula Emulsi
Formula dari emulsi minyak biji jinten hitam dapat dilihat pada tabel 3.1 berikut ini. Formula yang digunakan untuk membuat emulsi minyak biji jinten hitam sudah dioptimasi ( Nabiela, 2013).
Tabel 3.1. Komposisi Emulsi Minyak Biji Jinten Hitam yang Telah di Optimasi
[Sumber : Indayanti, 2014 dengan pengelolahan kembali ]
B. Pembuatan Emulsi Minyak Biji Jinten Hitam Dengan Hasil Optimasi Kecepatan Spindel Homogenizer (Indayanti, 2014 ).
Setelah didapatkan kondisi optimasi kecepatan spindel
homogenizer kemudian emulsi dibuat dengan tahapan sebagai berikut : 1. Alat dan bahan disiapkan, kemudian bahan-bahan yang akan
digunakan ditimbang yang terdapat pada tabel 3.1.
2. Sukrosa dilarutkan dalam aquades sebanyak 62,5 ml dan diaduk menggunakan magnetic stire.
3. Natrium benzoat dilarutkan dalam 1 ml aquades didalam beaker glas dan diaduk menggunakan batang pengaduk.
4. Dispersikan tragakan dengan aquades sebanyak 150 ml di dalam
beacker glass kemudian homogenkan menggunakan
homogenizer dengan kecepatan 980rpm selama 30 menit. 5. Setelah homogen ditambahkan minyak biji jinten hitam sedikit
demi sedikit sambil terus dihomogenkan hingga terbentuk korpus emulsi.
6. Kemudian ditambahkan larutan sukrosa, larutan natrium benzoat dan sisa aquades sebanyak 103,6 ml sambil terus dihomogenkan dengan kecepatan 1980 rpm selama 35 menit.
Bahan Konsentrasi (%)
Minyak Biji Jinten Hitam 10
Tragakan 1,5
Sukrosa 25
Natrium Benzoat 0,1
UIN Syarif Hidayatullah Jakarta 7. Emulsi yang dihasilkan kemudian ditempatkan dalam botol
tertutup rapat dan disimpan pada suhu ruang selama 21 hari. Pengemasan dengan botol bening untuk emulsi kontrol dan botol gelap untuk emulsi sampel.
8. Masing-masing botol pengemas dari emulsi kontrol dan sampel diberi label untuk membedakan hari evaluasi. Dimana evaluasi dilakukan pada hari ke 0, 2, 7, 14, dan 21.
3.3.3. Evaluasi Fisik Emulsi Minyak Biji Jinten Hitam Parameter untuk uji stabitas yaitu :
A. Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam (Baby, et al., 2007).
Pengamatan organoleptis emulsi minyak biji jinten hitam dilakukan dengan mengamati warna, bau, dan pemisahan dari sediaan emulsi pada hari ke 0, 2, 7, 14, dan 21 (Lopes, 2012).
B. Pengukuran Nilai pH Emulsi Minyak Biji Jinten Hitam (Baby, et al., 2007).
Pengukuran pH emulsi minyak biji jinten hitam dilakukan dengan menggunakan pH meter. Pengukuran pH dilakukan pada hari ke 0, 2, 7, 14, dan 21 (Lopes, 2012).
C. Pengukuran Nilai Viskositas Emulsi Minyak Biji Jinten Hitam Dengan Kondisi Optimasi Spindel Viskometer (Baby, et al., 2007).
Pengukuran viskositas emulsi minyak biji jinten hitam dilakukan dengan menggunakan viskometer HAAKE ViscoTester 6R. Sediaan emulsi ditempatkan ke dalam beacker glass 100 ml kemudian dipilih spindel nomor 3. Pengukuran viskositas ini dilakukan pada hari ke 0, 2, 7, 14 dan 21(Lopes, 2012).
D. Pengukuran Nilai Diameter Globul Rata-rata Emulsi Minyak Biji Jinten Hitam (Sinko, J. Patrick.2011).
UIN Syarif Hidayatullah Jakarta Pengukuran diameter partikel rata-rata dilakukan pada hari ke 0, 2, 7, 14, dan 21 (Lopes, 2012).
E. Uji Tipe Emulsi Minyak Biji Jinten Hitam
Tipe emulsi dilakukanan dengan metode pengenceran dengan aquades. Emulsi ditempatkan dalam beaker glass 100 ml, lalu ditambahkan aquades sedikit demi sedikit. Jika larut sempurna maka tipe minyak dalam air, tetapi bila tidak larut maka tipe air dalam minyak (Aulton, 2001). Pengukuran tipe emulsi dilakukan pada hari ke 0, 2, 7, 14, dan 21 (Lopes,2012).
F. Uji Sentrifugasi Emulsi Minyak Biji Jinten Hitam
Sediaan emulsi minyak biji jinten hitam diambil sebanyak 5 gram dan dimasukkan ke dalam tabung sentrifugasi, kemudian dilakukan sentrifugasi pada kecepatan 3500 rpm selama 3 menit. Hasil sentrifugasi dapat diamati dengan adanya pemisahan atau tidak ( Suraweera, 2014 )
3.3.4. Analisis Komponen Kimia Emulsi Minyak Biji Jinten Hitam
A.Pemilihan Kondisi Optimasi GCMS Minyak Biji Jinten Hitam (Kostadinovic,et al., 2011).
Optimasi GCMS dilakukan dengan menyuntikan sampel minyak biji jinten hitam sebanyak 1 μl. Pengaturan kondisi alat GCMS dilakukan berdasarkan jurnal Kostadinovic, et al., 2011 yang telah dimodifikasi. Mode split yang digunakan adalah 1 : 50, laju alir 1 ml/menit dan suhu oven diatur 100°C ditahan 3 menit, lalu dinaikan hingga 260°C dan laju kenaikan 10°C ditahan 1 menit.
B. Analisis Komponen Kimia Emulsi Minyak Biji Jinten Hitam Sebelum dan Setelah Penyimpanan
1. Preparasi Sampel
a. Demulsifikasi Emulsi Minyak Biji Jinten Hitam
UIN Syarif Hidayatullah Jakarta ditambahkan 5 ml HCl pekat dan 9 ml aquades kemudian dikocok (Indayanti,2014 ).
b. Ekstraksi Cair-cair Emulsi Minyak Biji Jinten Hitam
Setelah dikocok kemudian sampel dipindahkan ke dalam corong pisah dan ditambahkan 15 ml n-heksan lalu diekstraksi. Ekstraksi dilakukan sebanyak 3 kali. Lalu fase heksan yang didapat digabung dan dilakukan evaporasi sampai didapatkan minyak pekat (Indayanti, 2014 ). Fase air yang didapat ditampung dan dimasukkan ke dalam corong pisah lalu dilakukan ekstraksi menggunakan etil asetat sebanyak 15 ml dan dilakukan sebanyak 3 kali. Fase etil yang didapat ditampung dan dilakukan evaporasi sampai didapat minyak pekat.
2. Analisis Komponen Kimia Emulsi Minyak Biji Jinten Hitam Sebelum dan Setelah Penyimpanan.
UIN Syarif Hidayatullah Jakarta BAB 4
HASIL DAN PEMBAHASAN
4.1 Evaluasi Fisik Emulsi Minyak Biji Jinten Hitam
4.1.1 Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam
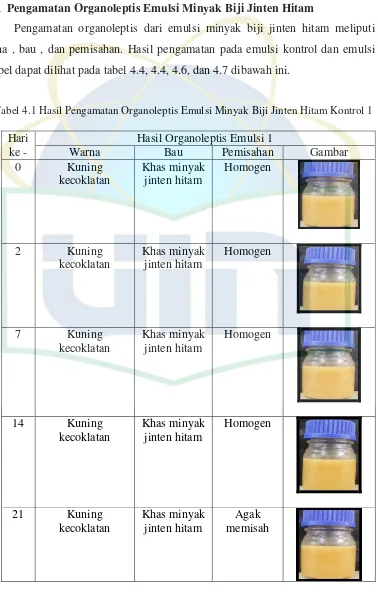
Pengamatan organoleptis dari emulsi minyak biji jinten hitam meliputi warna , bau , dan pemisahan. Hasil pengamatan pada emulsi kontrol dan emulsi sampel dapat dilihat pada tabel 4.4, 4.4, 4.6, dan 4.7 dibawah ini.
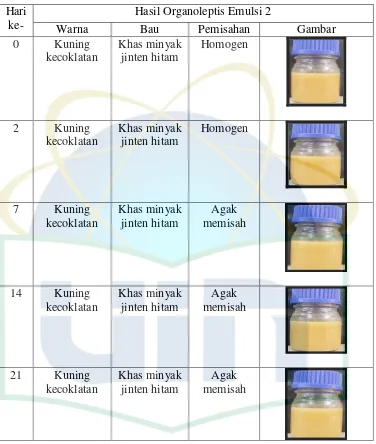
UIN Syarif Hidayatullah Jakarta Tabel 4.2 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam Emulsi
Kontrol 2
Hari ke-
Hasil Organoleptis Emulsi 2
Warna Bau Pemisahan Gambar
0 Kuning
kecoklatan
Khas minyak jinten hitam
Homogen
2 Kuning
kecoklatan
Khas minyak jinten hitam
Homogen
7 Kuning
kecoklatan
Khas minyak jinten hitam
Agak memisah
14 Kuning
kecoklatan
Khas minyak jinten hitam
Agak memisah
21 Kuning
kecoklatan
Khas minyak jinten hitam
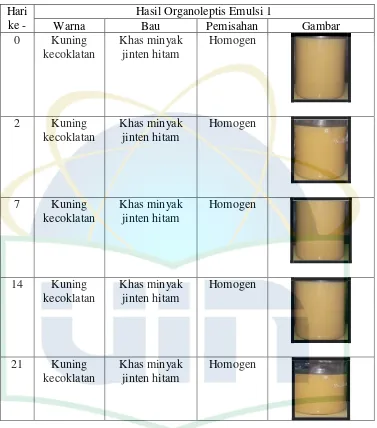
UIN Syarif Hidayatullah Jakarta Tabel 4.3 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam Emulsi Sampel 1
Hari ke -
Hasil Organoleptis Emulsi 1
Warna Bau Pemisahan Gambar
0 Kuning
kecoklatan
Khas minyak jinten hitam
Homogen
2 Kuning
kecoklatan
Khas minyak jinten hitam
Homogen
7 Kuning
kecoklatan
Khas minyak jinten hitam
Homogen
14 Kuning kecoklatan
Khas minyak jinten hitam
Homogen
21 Kuning kecoklatan
Khas minyak jinten hitam
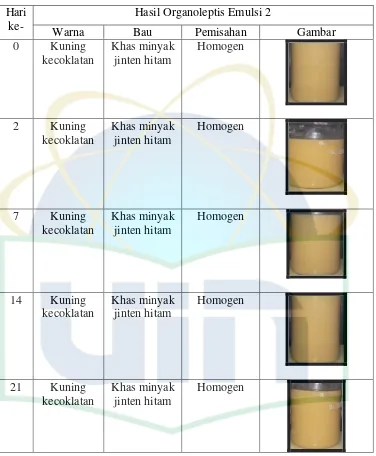
UIN Syarif Hidayatullah Jakarta Tabel 4.4 Hasil Pengamatan Organoleptis Emulsi Minyak Biji Jinten Hitam
UIN Syarif Hidayatullah Jakarta homogen pada penyimpanan selama 21 hari menggunakan botol bening. Pemisahan pada emulsi kontrol merupakan fenomena ketidakstabilan pada tahap flokulasi dimana terjadinya pemisahan antara fase air dan minyak dalam bentuk flokul-flokul kecil dan pada saat pengocokan dapat kembali homogen (Sinko, J. Patrick.2011).
Berdasarkan tabel 4.3 dan tabel 4.4 dapat dilihat bahwa pengamatan organoleptis dari emulsi minyak biji jinten hitam sampel selama penyimpanan 21 hari tidak menujukan perubahan pada warna, bau, dan homogenitas. Warna dari emulsi minyak biji jinten hitam tetap kuning kecokelatan, bau dari emulsi minyak jinten hitam tetap bau khas minyak biji jinten hitam dan tidak mengalami ketengikan. Emulsi minyak biji jinten hitam tidak mengalami pemisahan antara fasa minyak dan fasa air sehingga emulsi sampel yang dikemas menggunakan botol gelap tetap homogen selama penyimpanan 21 hari. Senyawa terpen mudah mengalami proses oksidasi dibawah pengaruh cahaya sehingga dapat merusak aroma minyak atsiri (Syarifudin, 2012). Penggunaan dari botol gelap dapat meminimalisir paparan cahaya terhadap sediaan sehingga selama penyimpanan 21 hari emulsi minyak biji jinten hitam tetap stabil.
4.1.2 Pengukuran Nilai pH dari Emulsi Minyak Biji Jinten Hitam
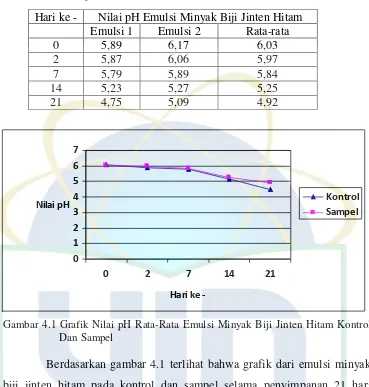
Pengukuran nilai pH dari sedian emulsi minyak biji jinten hitam dengan menggunakan pH meter. Hasil nilai pH sediaan emulsi sampel dan kontrol minyak biji jinten hitam dapat dilihat pada tabel 4.8 dan 4.9
Tabel 4.5 Hasil Pengukuran Nilai pH Emulsi Minyak Jinten Hitam Kontrol
Hari ke - Nilai pH Emulsi Minyak Biji Jinten Hitam Emulsi 1 Emulsi 2 Rata-rata
0 5,99 6,19 6,09
2 5,93 5,80 5,81
7 5,63 5,99 5,81
14 5,13 5,19 5,16
UIN Syarif Hidayatullah Jakarta Tabel 4.6 Hasil Pengukuran Nilai pH Emulsi Minyak Jinten Hitam
Sampel mengalami penurunan pH sediaan. Penurunan nilai pH emulsi pada kontrol selama penyimpanan 21 hari sebesar 1,60 dan penurunan nilai pH emulsi pada sampel selama penyimpanan 21 hari sebesar 1,10. Penurunan pH pada sediaan oral biasanya disebabkan oleh penguraian lemak akibat hidrolisis, oksidasi dengan adanya oksigen dari atmosfer dan cahaya, serta pertumbuhan mikroorganisme (Martin, et al., 1993). Penggunaan botol yang berbeda maka penurunan nilai pH menjadi berbeda. Emulsi yang dikemas menggunakan botol gelap dan botol bening memiliki selisih penurunan nilai pH sebanyak 0,5. Penggunaan botol gelap pada sedian emulsi memberikan perlindungan terhadap cahaya sehingga emulsi yang dikemas menggunakan botol gelap lebih sedikit mengalami penurunan nilai pH dibanding dengan emulsi yang dikemas menggunakan botol bening. Namun pada penelitian ini
UIN Syarif Hidayatullah Jakarta tidak dilakukan pengujian lebih lanjut penyebab dari penurunan pH pada sediaan emulsi. Perubahan nilai pH pada sediaan selama penyimpanan menandakan bahwa sediaan tersebut tidak stabil. Ketidakstabilan ini dapat merusak produk selama penyimpanan dan penggunaan (Young et al., 2002).
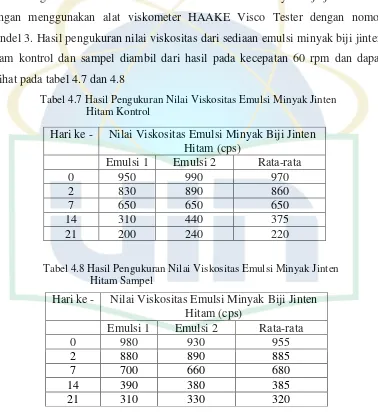
4.1.3 Pengukuran Nilai Viskositas dari Emulsi Minyak Biji Jinten Hitam Pengukuran nilai viskositas dari sediaan emulsi minyak biji jinten hitam dengan menggunakan alat viskometer HAAKE Visco Tester dengan nomor spindel 3. Hasil pengukuran nilai viskositas dari sediaan emulsi minyak biji jinten hitam kontrol dan sampel diambil dari hasil pada kecepatan 60 rpm dan dapat dilihat pada tabel 4.7 dan 4.8
Tabel 4.7 Hasil Pengukuran Nilai Viskositas Emulsi Minyak Jinten Hitam Kontrol
Tabel 4.8 Hasil Pengukuran Nilai Viskositas Emulsi Minyak Jinten Hitam Sampel
Hari ke - Nilai Viskositas Emulsi Minyak Biji Jinten Hitam (cps)
Emulsi 1 Emulsi 2 Rata-rata
0 950 990 970
2 830 890 860
7 650 650 650
14 310 440 375
21 200 240 220
Hari ke - Nilai Viskositas Emulsi Minyak Biji Jinten Hitam (cps)
Emulsi 1 Emulsi 2 Rata-rata
0 980 930 955
2 880 890 885
7 700 660 680
14 390 380 385
UIN Syarif Hidayatullah Jakarta 0
200 400 600 800 1000 1200
0 2 7 14 21 Hari
ke-Nilai Viskositas (Cps)
Kontrol
Sampel
Gambar 4.2 Grafik Nilai Viskositas Rata-Rata EmulsiMinyak Biji Jinten Kontrol Dan Sampel Hitam
Dari grafik pada gambar 4.2 terlihat perbandingan nilai viskositas pada emulsi kontrol dan emulsi sampel semakin lama penyimpanan semakin turun nilai viskositasnya. Menurut teori, seiring dengan lamanya penyimpanan maka viskositas emulsi akan semakin meningkat (Lachman, et al., 1994). Pada pengukuran nilai viskositas setelah penyimpanan selama 21 pada emulsi sampel dan emulsi kontrol mengalami penurunan nilai viskositas. Penurunan nilai viskositas emulsi kontrol sebesar 750 cps dan pada emulsi sampel sebesar 635 cps. Hal ini menandakan bahwa pengemasan emulsi menggunakan botol gelap memberikan efek penurunan nilai viskositas yang lebih kecil dibandingkan dengan pengemasan emulsi menggunakan botol bening yang menandakan emulsi sampel lebih stabil dari pada emulsi kontrol.
UIN Syarif Hidayatullah Jakarta 4.1.4 Pengukuran Nilai Diameter Globul dari Emulsi Minyak Biji Jinten Hitam
Pengukuran diameter globul emulsi minyak biji jinten dilakukan menggunakan mikroskop Olympus DX 1 x 71 dengan perbesaran 10 x 10. Hasil dari diameter globul dapat dilihat ditabel 4.9 dan 4.10.
Tabel 4.9 Hasil Pengukuran Nilai Diameter Globul Emulsi Minyak Biji Jinten Hitam Emulsi Kontrol
Hari ke - Nilai Diameter Globul Emulsi Minyak Jinten (µm)
UIN Syarif Hidayatullah Jakarta Berdasarkan grafik pada gambar 4.9 dan 4.10 terlihat nilai rata-rata diameter globul dari emulsi minyak biji jinten hitam kontrol dan sampel selama penyimpanan 21 hari mengalami kenaikan ukuran globul. Peningkatan nilai diameter globul pada emulsi kontrol sebesar 2,90 µm dan pada emulsi sampel sebesar 2,76 µm. Hal ini menandakan bahwa peningkatan ukuran globul pada emulsi sampel lebih kecil dibandingkan dengan emulsi kontrol selama penyimpanan 21 hari. Ukuran globul merupakan indikator utama untuk kecenderungan terjadinya pemisahan emulsi (creaming) atau pemisahan dua fase tersendiri (breaking). Peningkatan ukuran globul menandakan bahwa kestabilan emulsi menjadi berkurang. Sesuai hukum Stoke, semakin besar ukuran globul maka akan semakin cepat laju sedimentasinya sehingga akan menurunkan viskositasnya (Dzuhro, 2011).
4.1.5 Uji Tipe Emulsi dari Emulsi Minyak Biji Jinten Hitam
Pengujian tipe emulsi dilakukan dengan cara pengenceran menggunakan aquades. Hasil dari uji tipe emulsi dapat dilihat pada tabel 4.11 dibawah ini. Tabel 4.11 Hasil Pengujian Tipe Emulsi dari Emulsi Minyak Biji Jinten Hitam
Hari
UIN Syarif Hidayatullah Jakarta emulsi kontrol dan emulsi sampel tetap minyak dalam air yang menandakan emulsi tersebut stabil.
4.1.6 Uji Sentrifugasi dari Emulsi Minyak Biji Jinten Hitam
Pegujian sentrifugasi dilakukan menggunakan alat uji sentrifugasi. Hasil uji sentrifugasi pada emusli sampel dan kontrol dapat dilihat pada tabel 4.12 berikut ini.
Tabel 4.12 Hasil Uji Sentrifugasi Emulsi Minyak Jinten Hitam Emulsi Kontrol dan Sampel
Sediaan Awal Akhir
Emulsi kontrol 1 Homogen dan tidak ada pemisahan antara dua fase
(fase air dan fase minyak)
Terjadi pemisahan antara dua fase (bagian atas :
fase minyak ; bagian bawah : fase air) Emulsi kontrol 2 Homogen dan tidak ada
pemisahan antara dua fase (fase air dan fase minyak)
Terjadi pemisahan antara dua fase (bagian atas :
fase minyak ; bagian bawah : fase air) Emulsi sampel 1 Homogen dan tidak ada
pemisahan antara dua fase (fase air dan fase minyak)
Terjadi pemisahan antara dua fase (bagian atas :
fase minyak ; bagian bawah : fase air) Emulsi sampel 2 Homogen dan tidak ada
pemisahan antara dua fase (fase air dan fase minyak)
Terjadi pemisahan antara