ALFIDA ZAKIYAH
JURUSAN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Jurusan Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
ALFIDA ZAKIYAH
1110095000039
JURUSAN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, Desember 2014
Biologi Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta. 2014.
Mikroorganisme endofit adalah mikroorganisme yang hidup di dalam jaringan tanaman dan tidak membahayakan inangnya salah satunya ialah kapang endofit. Kapang endofit dapat menghasilkan senyawa yang sama seperti tanaman inangnya. Tanaman kina menghasilkan alkaloid kuinin sulfat yang berpotensi menghambat pertumbuhan bakteri Staphylococcus aureus dan Escherichia coli.
Penelitian ini bertujuan menguji potensi kapang endofit tanaman kina dalam menghasilkan kuinin sulfat dan sebagai antibakteri. Metode yang digunakan untuk uji antibakteri adalah paper disc diffusion, sedangkan metode untuk menganalisis kandungan kuinin sulfat adalah HPLC dan GCMS. Hasil analisis data menggunakan Anova satu arah menunjukkan bahwa terdapat perbedaan yang signifikan antar diameter zona hambat ekstrak kapang endofit. Kapang fusarium
oxysporum menghasilkan zona hambat terbesar terhadap S. aureus sebesar 14,9
mm. Kapang endofit sp.1 menghasilkan zona hambat terbesar terhadap E. coli
sebesar 9,2 mm. Isolat kapang endofit yang dapat menghasilkan alkaloid kuinin sulfat sebanyak 6 isolat yaitu kapang endofit sp.1, Fusarium equiseti,
Leptosphaerulina sp., Neofusicoccum sp., Pestalotiopsis sp.,Leptosphaerulina sp.
masing-masing sebesar 300,1; 249,1; 26,68; 20,6; 14,37 dan 0,65 ppm.
Technology. State Islamic University Syarif Hidayatullah Jakarta. 2014.
Endophytic microorganisms are microorganisms that live in the plant tissue and not harmful to the host, one of those is endophytic fungi. Endophytic fungi could produce the same compound as the host plant. Cinchona plant produce quinine alkaloid and has the potential to inhibit Staphylococcus aureus
and Escherichia coli. This research purposed to test the potential of endophytic fungi in produce quinine sulfate as antibacterial. The used method for antibacterial test was paper disc diffusion, where as the method for analyzing the quinine and other content was HPLC and GCMS. Results of data analysis using one-way ANOVA showed that there are significant differences between the diameter of inhibition zone of extracts endophytic fungi. The genus Fusarium oxysporum
produced the largest inhibition zone against Staphylococcus aureus 14,9 mm and sp. 1 of endophytic fungi produced the largest inhibition zone against Escherichia coli 9,2 mm. There are 6 isolates of endophytic fungi that could produce alkaloid quinine sulfate that is sp. 1 of endophytic fungi, Fusarium equiseti,
Leptosphaerulina sp., Neofusicoccum sp., Pestalotiopsis sp., Leptosphaerulina
sp., they are produced 300,1; 249,1; 26,68; 20,6; 14,37 and 0,65 ppm of alkaloid quinine respectively.
i
rahmat dan hidayah-Nya sehingga penyusun dapat menyelesaikan penyusunan skripsi yang berjudul “Aktivitas Antibakteri dan Kandungan Alkaloid Kuinin
Kapang Endofit Tanaman Kina (Cinchona calisaya Wedd.)”. Skripsi ini sebagai salah satu syarat memperoleh gelar Sarjana Sains pada Jurusan Biologi, Fakultas Sains dan Teknologi, Universitas Islam Negeri Syarif Hidayatullah Jakarta. Shalawat serta salam kita haturkan kepada junjungan nabi besar Muhammad SAW pembawa risalah Dinul Islam serta pengetahuan dunia akhirat.
Skripsi ini dapat diselesaikan berkat dukungan dari berbagai pihak baik moril dan materialnya, untuk itu penyusun menghaturkan ucapan terima kasih yang sebesar-besarnya kepada:
1. Mama, Ayah, Alfiana, Alfian dan Alfan yang senantiasa memberikan bantuan baik materil dan materil atas segala doa dan keikhlasannya serta dukungannya sehingga penulis dapat menyelesaikan laporan ini.
2. Bapak Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan Teknologi yang telah menyetujui skripsi ini.
3. Ibu Dr. Dasumiati, M.Si selaku Ketua Jurusan Biologi Fakultas Sains dan Teknologi yang telah memberikan izin untuk melaksanakan penelitian ini. 4. Ibu Nani Radiastuti, M.Si selaku dosen pembimbing I yang telah bersedia
ii
seminar proposal, seminar hasil penelitian dan sidang yang memberi bimbingan dan saran saat penyusunan skripsi.
7. Seluruh dosen Biologi yang telah mendidik penulis selama menuntut ilmu di Jurusan Biologi UIN Syarif Hidayatullah Jakarta.
8. Seluruh staf Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta yang telah membantu penulis melaksanakan penelitian ini.
9. Nisa, Uty, Tias, Nur Aolia, Fitri, Dimar, Arif, Farida yang selalu memberi semangat dan dukungan kepada penyusun.
10. Dali, Ario, Ayu yang telah bekerjasama membantu dan mendukung penyusun melakukan penelitian.
11. Teman-teman Biologi 2010 yang saling mendoakan dan memberi semangat. 12. Pihak lain yang membantu penyusun sehingga skripsi ini dapat terselesaikan.
Penyusun sangat mengharapkan kritik dan saran yang membangun dari berbagai pihak untuk memperbaiki dan menyempurnakan penyusunan skripsi ini. Penyusun berharap semoga skripsi ini berguna dan bermanfaat bagi semua pihak. Amin.
Jakarta, Desember 2014
iii
2.7. Karakteristik Bakteri Staphylococcus aureus ... 12
2.8. Karakteristik Bakteri Escherichia coli ... 14
2.9. High Pressure Liquid Chromatography (HPLC) ... 15
2.10. Gas Chromatography Mass Spectrophotometry (GCMS) ... 15
BAB III METODOLOGI PENELITIAN
3.5.1 Persiapan Isolat Kapang Endofit ... 18
3.5.2 Pembuatan Media ... 18
3.5.2.1 Pembuatan Media dan PDB ... 18
3.5.2.2 Pembuatan Media NA dan NB ... 18
3.5.2.3 Pembuatan Media Preservasi Kapang Endofit ... 19
3.5.3 Subkultur Kapang Endofit ... 19
3.5.3.1 Pengamatan Makroskopis ... 19
iv
3.5.9 Analisis Ekstraksi Metabolit Sekunder Kuinin Dengan
HPLC ... 23
3.5.9 Analisis Ekstraksi Metabolit Sekunder dengan GCMS ... 23
3.6. Analisis Data ... 24
BAB IV HASIL DAN PEMBAHASAN 4.1. Karakteristik Makroskopis dan Mikroskopis Kapang Endofit ... 25
4.2. Aktivitas Antibakteri Kapang Endofit terhadap Bakteri Uji .. 29
4.3. Analisis Kandungan Alkaloid Kuinin Kapang Endofit dengan HPLC ... 36
4.4. Analisis GCMS Ekstrak Kloroform dan Etil Asetat Kapang Endofit ... 38
BAB V KESIMPULAN DAN SARAN 5.1. Kesimpulan ... 44
5.2. Saran ... 44
DAFTAR PUSTAKA ... 45
v
Tabel 1. Daftar Isolat Kapang Endofit Tanaman Kina ... 7 Tabel 2. Tabel Verifikasi Pengamatan Makroskopis dan
Mikroskopis Kapang ... 25 Tabel 3. Analisis Metabolit Sekunder Kuinin Kapang Endofit
dengan HPLC ... 36 Tabel 4. Senyawa dalam Ekstrak Kloroform Kapang Endofit
F. oxysporum yang diidentifikasi dengan GCMS ... 39 Table 5. Senyawa dalam Ekstrak Etil Asetat Kapang Endofit
vi
Gambar 1. Morfologi Bunga, Daun dan Batang C. Calisaya Wedd. ... 8
Gambar 2. Struktur Alkaloid Kuinin ... 11
Gambar 3. Bakteri S. aureus ... 13
Gambar 4. Bakteri E. coli ... 14
Gambar 5. Bagan Kerja Penelitian ... 17
Gambar 6. Grafik Zona Hambat Bakteri Hasil Ekstraksi Etil Asetat ... 29
vii
Lampiran 1. Kerangka Berfikir ... 50
Lampiran 2. Skema Alur Penelitian ... 51
Lampiran 3. Preservasi Kapang Endofit ... 52
Lampiran 4. Proses Fermentasi dan Ekstraksi ... 53
Lampiran 5. Zona Hambat Ekstrak Kapang Endofit terhadap Bakteri Escherichia coli ... 54
Lampiran 6. Zona Hambat Ekstrak Kapang Endofit terhadap Bakteri Staphylococcus aureus ... 55
Lampiran 7. Standar Deviasi Zona Hambat Ekstrak Kapang Terhadap Bakteri Uji ... 56
Lampiran 8. Analisis Antibakteri menggunakan ANOVA Ekstrak Kloroform Terhadap Bakteri Uji ... 58
Lampiran 9. Analisis Antibakteri menggunakan ANOVA Ekstrak Etil Asetat Terhadap Bakteri Uji ... 60
Lampiran 10.Analisis Kromatogram Alkaloid Kuinin Sulfat menggunakan HPLC ... ` 62
Lampiran 11.Hasil GCMS Kapang Endofit Ekstrak Etil Asetat ... 66
1
1.1 Latar Belakang
Tanaman obat merupakan salah satu sumber bahan baku obat. Sebagian besar komponen kimia yang berasal dari tanaman yang digunakan sebagai bahan baku obat ialah metabolit sekunder. Tanaman menghasilkan metabolit sekunder dengan struktur molekul dan aktivitas biologi yang beraneka ragam serta berpotensi untuk dikembangkan menjadi obat berbagai penyakit (Semangun, 1996). Tanaman kina (Cinchonacalisaya Wedd.) sudah dikenal sebagai salah satu jenis tanaman obat yang berkhasiat untuk mengobati penyakit malaria. Khasiat dari tanaman ini berasal dari senyawa metabolit sekunder berupa alkaloid kuinin yang terkandung di dalamnya. Senyawa alkaloid lain yang terkandung dalam tanaman kina adalah kinidin, sinkonidin dan sinkonin (Winarno, 2006).
yang sangat baik (Petrini et al., 1992). Pemanfaatan mikroorganisme endofit diharapkan dapat melestarikan tanaman inangnya yang membutuhkan waktu bertahun-tahun untuk tumbuh dan berkembang.
Metabolit sekunder yang dihasilkan oleh mikroorganisme endofit diduga sama seperti yang terkandung di tanaman inangnya (Petrini et al., 1992). Hal ini terjadi karena adanya kemungkinan transfer genetik antara tanaman inang dan mikroorganisme endofit, sehingga zat-zat yang bermanfaat di tanaman juga dapat dihasilkan oleh mikroorganisme endofitnya (Syarmalina et al., 2007). Mikroorganisme endofit yang berpotensi memiliki metabolit yang sama dengan tanaman inangnya salah satunya kapang endofit. Beberapa penelitian mengenai kandungan kuinin pada tanaman kina dan kapang endofitnya telah dilakukan. Kapang endofit yang diisolasi dari bagian batang tanaman kina (Cinchona
ledgeriana) mengandung kuinin sebesar 0,423 mg/L sedangkan kapang endofit
dari batang kina (Cinchona succirubra) menghasilkan kuinin sebesar 0,080 mg/L (Winarno, 2006). Kapang endofit pada tanaman kina berpotensi menghasilkan alkaloid kuinin khususnya yang diisolasi dari batang tanaman kina (Winarno, 2006; Maehara, 2011; Simanjuntak, 2002). Kapang endofit Colletotrichum sp. dan
Phomopsis sp. yang diisolasi dari tanaman kina (C. calisaya Wedd.) dapat
Kuinin sulfat dari tanaman kina diketahui berpotensi menghambat bakteri Gram positif dan Gram negatif seperti Staphylococcus aureus, Enterobacter
agglomerans, Klebsiella pneumonia dan Escherichia coli (Kharal et al., 2009).
Kapang endofit Colletotrichum sp. dan Phomopsis sp. dari tanaman kina (C.
calisaya Wedd.) berpotensi menghambat pertumbuhan bakteri S.aureus dan E.coli
(Mutiea, 2010; Pamungkas, 2010). Saat ini informasi mengenai potensi antibakteri kapang endofit tanaman kina (C. calisaya Wedd.) masih sedikit informasinya.. Penelitian ini diharapkan dapat melaporkan beberapa genus kapang endofit dari tanaman kina (C. calisaya Wedd.) seperti fusarium, cercospora dan
leptosphaerulina yang berpotensi sebagai antibakteri. Oleh karena itu perlu diteliti
lebih lanjut apakah kapang endofit dari beberapa genus yang diisolasi dari tanaman kina dapat menghasilkan alkaloid kuinin sulfat.
1.2 Rumusan Masalah
Rumusan masalah pada penelitian ini adalah:
1. Apakah kapang endofit yang diisolasi dari tanaman kina berpotensi sebagai antibakteri?
1.3 Hipotesis
Hipotesis pada penelitian ini adalah:
1. Kapang endofit yang diisolasi dari tanaman kina memiliki potensi untuk dijadikan antibakteri.
2. Kuinin sulfat yang dihasilkan kapang endofit tanaman kina memiliki konsentrasi sebesar 100 ppm.
1.4 Tujuan Penelitian
1. Mengetahui apakah produksi metabolit sekunder kapang endofit pada tanaman kina berpotensi untuk dijadikan senyawa antibakteri.
2. Mengetahui konsentrasi kandungan alkaloid kuinin sulfat yang dihasilkan kapang endofit tanaman kina.
1.5 Manfaat Penelitian
5
BAB II
TINJAUAN PUSTAKA
2.1 Karakteristik Kapang
Kapang merupakan fungi multiseluler yang memiliki filamen. Kapang terdiri dari suatu talus yang bercabang disebut hifa. Hifa yang saling berhubungan kemudian membentuk suatu struktur semacam jala disebut miselium. Kapang dapat bereproduksi secara seksual dan aseksual. Kapang merupakan mikroorganisme kemoheterotrof yaitu mengasimilasi karbon organik sebagai sumber energi dengan bantuan oksidasi senyawa organik (Gandjar, 2006). Kapang akan bersifat saprofit jika sumber nutrisi diperoleh dari bahan organik mati.
Kapang biasanya tumbuh pada benda-benda organik yang lembab. Kapang mempunyai inti eukariotik, tidak mengandung klorofil atau pigmen fotosintesis dan kapang membutuhkan bahan organik untuk pertumbuhannya. Bahan organik ini disediakan oleh organisme autotrof yang memiliki kemampuan melangsungkan proses fotosintesis dengan bantuan cahaya matahari dengan produk akhir bahan organik (Tjitrosomo et al., 1996). Kapang dapat bereproduksi secara seksual dan aseksual. Spora seksual yang dapat dihasilkan kapang antara lain basidiospora, askospora, zigospora dan oospora. Spora aseksual yang dihasilkan kapang antara lain sporangiospora, klamidospora, arthospora dan konidia (Gandjar et al., 2006). Spesies kapang banyak yang sudah dimanfaatkan contohnya Penicillium notatum Westling sebagai antibiotik, Rhizopus sp. dan
2.2 Kapang Endofit
Endofit secara bahasa berasal dari kata endon yang berarti di dalam dan
phyton yang berarti tanaman. Secara umum,endofit adalah makhluk hidup yang
berada di dalam tanaman dapat bersifat parasitik atau simbiotik (Gandjar, 2006). Cendawan atau fungi adalah suatu organisme heterotrof dan memerlukan senyawa organik untuk pertumbuhannya. Cendawan dapat dibagi menjadi dua bagian yaitu khamir (yeast) yang berbentuk uniselular dan kapang (mold) yang berbentuk benang (filamen). Kapang ada yang hidup sebagai parasit dan juga saprofit dalam jaringan (Gandjar, 2006).
Kapang endofit adalah fungi yang menginfeksi jaringan tanaman yang sehat tanpa menyebabkan sakit tanaman inangnya (Clay, 2004). Kapang endofit terdapat dalam sistem jaringan tumbuhan seperti daun, ranting dan akar. Kemampuan kapang endofit memproduksi senyawa metabolit sekunder sesuai dengan tanaman inang karena adanya transfer genetik dari tanaman inangnya ke dalam kapang endofit (Petrini et al., 1992). Kapang endofit berkembang biak di dalam tanaman inangnya tanpa menyebabkan penyakit. Hubungan simbiosis mutualisme yang terjadi ialah kapang endofit memperoleh nutrisi dari tanaman inang, sedangkan tanaman inang diproteksi atau dilindungi dari berbagai penyakit oleh kapang endofit (Gandjar, 2006).
Trichoderma sp. dan Gliocladium sp. merupakan kapang dengan anggota
spesies yang banyak digunakan dalam perlindungan tanaman alami sebagai fungi biokontrol. Isolat kapang endofit daun jambu biji (Psidium guajava L.)
Winarno (2006) menemukan bahwa hasil pemurnian mikroorganisme endofit dari batang kina (C. calisaya Wedd) diperoleh jenis kapang yang dapat menghasilkan senyawa alkaloid kuinin dan sinkonin. Kapang endofit dari tanaman kina (C.
ledgeriana) dapat memproduksi kuinin dengan baik dalam media PDB sebesar
0,423 mg/L (Winarno, 2006).
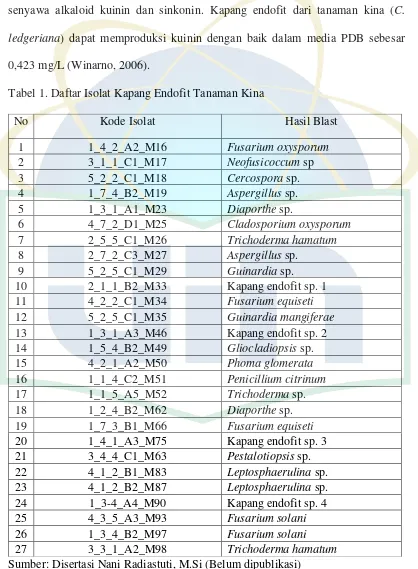
Tabel 1. Daftar Isolat Kapang Endofit Tanaman Kina
Sumber: Disertasi Nani Radiastuti, M.Si (Belum dipublikasi)
No Kode Isolat Hasil Blast
1 1_4_2_A2_M16 Fusarium oxysporum
2 3_1_1_C1_M17 Neofusicoccum sp
3 5_2_2_C1_M18 Cercospora sp.
4 1_7_4_B2_M19 Aspergillus sp.
5 1_3_1_A1_M23 Diaporthe sp.
6 4_7_2_D1_M25 Cladosporium oxysporum
7 2_5_5_C1_M26 Trichoderma hamatum
8 2_7_2_C3_M27 Aspergillus sp.
9 5_2_5_C1_M29 Guinardia sp.
10 2_1_1_B2_M33 Kapang endofit sp. 1
11 4_2_2_C1_M34 Fusarium equiseti
12 5_2_5_C1_M35 Guinardia mangiferae
13 1_3_1_A3_M46 Kapang endofit sp. 2 14 1_5_4_B2_M49 Gliocladiopsis sp.
15 4_2_1_A2_M50 Phoma glomerata
16 1_1_4_C2_M51 Penicillium citrinum
17 1_1_5_A5_M52 Trichoderma sp.
18 1_2_4_B2_M62 Diaporthe sp.
19 1_7_3_B1_M66 Fusarium equiseti
20 1_4_1_A3_M75 Kapang endofit sp. 3 21 3_4_4_C1_M63 Pestalotiopsis sp. 22 4_1_2_B1_M83 Leptosphaerulina sp. 23 4_1_2_B2_M87 Leptosphaerulina sp. 24 1_3-4_A4_M90 Kapang endofit sp. 4
25 4_3_5_A3_M93 Fusarium solani
26 1_3_4_B2_M97 Fusarium solani
2.3 Tanaman Kina
Kina merupakan tanaman obat berupa pohon yang berasal dari Amerika Selatan di sepanjang pegunungan Andes yang meliputi wilayah Venezuela, Colombia, Equador, Peru sampai Bolivia. Daerah tersebut terletak pada ketinggian 900-3000 mdpl. Tanaman kina masuk ke Indonesia tahun 1852 berasal dari Bolivia (Tao dan Taylor, 2011).
Klasifikasi tanaman kina adalah sebagai berikut: Kelas : Magnoliopsida
Suku : Rubiaceae Genus : Cinchona
Spesies : Cinchona calisaya Wedd. (www.plantamor.com)
Tinggi pohon antara 4-15 m, cabang bentuk segi empat, berbulu halus atau lokos. Daun elip sampai lanset, bagian pangkal dan ujung daun lancip, berwarna ungu terang, tangkai daun tidak berbulu, panjang tangkai 3-6 mm. Mahkota bunga berwarna kuning agak putih, bentuk melengkung panjang 8-12 mm. Buah lanset sampai bulat telur dengan ukuran panjang 8-12 mm dan lebar 3-4 mm (Tao dan Taylor, 2011).
Gambar 1. Morfologi Bunga, Daun dan Batang C. calisaya Wedd.
(Sumber: Dokumen Pribadi)
)
Skala 1:1.6
Tanaman kina tumbuh baik dengan curah hujan tahunan ideal yaitu 2.000-3.000 mm/tahun dan merata sepanjang tahun, penyinaran matahari yang tidak terlalu terik, temperatur antara 13,5-21°C, kelembaban relatif 68-97%. Tanaman kina di Indonesia dapat tumbuh di daerah dengan ketinggian 800-2.000 mdpl, namun ketinggian optimum untuk budidaya tanaman kina adalah 1.400-1.700 mdpl. Tanaman kina yang ada di Indonesia diantaranya C. succirubra Pavon., dan
C. calisaya Wedd. (Tao dan Taylor, 2011).
Kulit kina banyak mengandung alkaloid-alkaloid yang berguna untuk obat seperti saponin, flavonoida dan polifenol. Ada empat jenis alkaloid utama pada tanaman kina yaitu kuinin, kinidin, sinkonin dan sinkonidin. Alkaloid tersebut dapat mengobati penyakit malaria dan penyakit jantung. Manfaat lain dari kulit kina ini antara lain adalah untuk disentri, diare dan tonik (Wibisana, 2010).
2.4 Metabolit Sekunder
Produk metabolisme pada organisme dapat dibedakan menjadi dua kelompok yaitu metabolit primer dan metabolit sekunder. Senyawa yang tergolong metabolit primer adalah polisakarida, protein, lemak dan asam nukleat. Metabolit primer merupakan senyawa-senyawa utama penyusun tanaman (makhluk hidup) yang diperlukan untuk proses pertumbuhan dan perkembangan. Metabolit sekunder digunakan untuk pertahanan diri suatu organisme dari penyakit (Pratiwi, 2008).
Mikroorganisme endofit yang banyak berasosiasi dengan tanaman salah satunya kapang endofit (Petrini et al., 1992). Kapang endofit menginfeksi tanaman sehat pada jaringan tertentu tanpa menimbulkan tanda-tanda adanya infeksi lalu menghasilkan enzim dan metabolit sekunder yang bermanfaat bagi fisiologi dan ekologi tanaman inang seperti mikotoksin dan antibiotik (Clay, 2004) yang dimanfaatkan tanaman inang untuk melawan penyakit yang ditimbulkan oleh patogen tanaman. Kapang endofit juga dapat membantu tanaman inangnya untuk memperoleh senyawa anorganik seperti karbon dan nitrogen (Gandjar, 2006).
Spesies mikroorganisme tertentu mungkin memproduksi beberapa macam metabolit sekunder atau hanya memproduksi satu sampai dua macam metabolit sekunder. Metabolit sekunder dapat berfungsi sebagai nutrien darurat untuk bertahan hidup (Pratiwi, 2008). Kapang endofit berperan penting karena kemampuannya dalam memproduksi senyawa metabolit yang bervariasi, baik dari struktur maupun fungsinya. Berbagai golongan senyawa metabolit sekunder yang dihasilkan ialah alkaloid, flavonoid, kuinon, tanin dan antrakuinon (Wibisana, 2010).
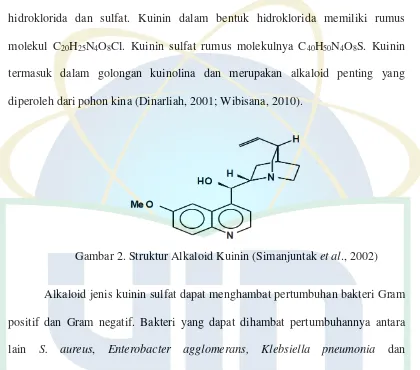
2.5 Alkaloid Kuinin
Kuinin merupakan senyawa alkaloid berbentuk kristal halus putih, tidak berbau dan memiliki rasa pahit. Kuinin bersifat basa dan dalam bentuk hidroklorida dan sulfat. Kuinin dalam bentuk hidroklorida memiliki rumus molekul C20H25N4O8Cl. Kuinin sulfat rumus molekulnya C40H50N4O8S. Kuinin termasuk dalam golongan kuinolina dan merupakan alkaloid penting yang diperoleh dari pohon kina (Dinarliah, 2001; Wibisana, 2010).
Alkaloid jenis kuinin sulfat dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif. Bakteri yang dapat dihambat pertumbuhannya antara lain S. aureus, Enterobacter agglomerans, Klebsiella pneumonia dan
Pseudomonas aeruginosa (Rennie et al., 2003). Alkaloid jenis kuinin sulfat juga
dapat menghambat pertumbuhan bakteri E. coli (Kharal et al., 2009).
Kapang endofit tanaman kina (C. calisaya Wedd.) pada medium PDB menghasilkan kuinin sebesar 0,128 mg/L. Kapang endofit tanaman kina (C.
succirubra) menghasilkan 0,080 mg/L (Winarno, 2006). Maehara (2011) dan
Simanjuntak (2002) melaporkan kapang endofit yang diisolasi dari tanaman kina juga menghasilkan alkaloid kuinin sulfat.
2.6 Aktivitas Antibakteri
Antimikroba merupakan zat yang mampu menghambat pertumbuhan mikroba Antimikroba terbagi menjadi antibakteri, antivirus dan antifungi. Mekanisme kerja dari senyawa antibakteri adalah merusak dinding sel, menghambat kerja enzim serta menghambat sintesis asam nukleat dan protein (Pratiwi, 2008). Apabila suatu zat antibakteri dapat menghambat aktivitas atau pertumbuhan bakteri Gram positif maupun Gram negatif berarti termasuk ke dalam jenis spektrum luas.
Berbagai galur Trichoderma sp. dan Gliocladium sp. memproduksi berbagai senyawa metabolit sekunder yang bersifat antibakteri, antinematoda, antifungi atau antikhamir (Wipf dan Kerekes, 2003). Metabolit sekuder hasil fermentasi kapang endofit Fusarium sp. pada lengkuas merah (Alpinia galanga
(L.) Wild) dapat menghambat pertumbuhan bakteri S. aureus. Metabolit sekuder kapang endofit Cladosporium sp. pada lengkuas merah (Alpinia galanga (L.) Wild) dapat menghambat pertumbuhan bakteri E. coli (Kusumaningtyas et al., 2010).
2.7 Karakteristik Bakteri Staphylococcus aureus
S. aureus adalah bakteri yang bersifat Gram positif dan tidak motil (Martin
Bakteri ini juga sering terdapat pada pori-pori dan permukaan kulit, kelenjar keringat dan saluran usus (Pratiwi, 2008). Struktur dan komposisi dinding sel bakteri Gram positif seperti S. aureus ialah lapisan peptidoglikan tebal, memiliki asam tekoat, tidak terdapat ruang periplasmik dan sedikit mengandung protein (Pratiwi, 2008).
Klasifikasi S. aureus adalah Kingdom: Bacteria, Divisi: Firmicutes, Kelas: Bacilli, Ordo: Bacillales, Familia: Staphylococcaceae. Genus: Staphylococcus, Species: Staphylococcus aureus (www.ncbi.com)
Bakteri S. aureus tumbuh optimum pada suhu sekitar 37°C dan mampu bertahan pada suhu rendah di bawah 8°C, sehingga digolongkan menjadi bakteri mesofilik. Derajat keasaman (pH) yang optimum antara 7,0 dan 7,5 (Martin dan Landolo, 1999). Metabolit sekunder seperti tannin dan flavonoid dapat mencegah pertumbuhan bakteri S. aureus (Doughari, 2006). Bakteri ini telah resisten terhadap penisilin, oksasilin dan antibiotik beta laktam lainnya. Di Asia, S. aureus
yang resisten terhadap siprofloksasin mencapai 37%. Persentase galur S. aureus
yang telah resisten terhadap metisilin (MRSA) cukup tinggi di Asia (Mardiastuti
et al., 2007).
2.8 Karakteristik Bakteri Escherichia coli
E. coli adalah bakteri Gram negatif yang resisten terhadap beberapa
antibakteri hal ini disebabkan karena tiga lapisan dinding sel pada bakteri ini, sehingga beberapa senyawa tidak mampu merusak jaringan dari dinding sel bakteri E. coli (Pratiwi, 2008). Bakteri ini yang bersifat patogen pada manusia yang menyebabkan gangguan pencernaan pada manusia dan mengganggu sistem kerja dari organ lambung. Bakteri ini sangat merugikan, paling banyak ditemukan di usus manusia dan hewan. Struktur dan komposisi dinding sel bakteri Gram negatif seperti E. coli ialah lapisan peptidoglikan tipis, tidak memiliki asam tekoat, terdapat ruang periplasmik dan mengandung protein (Pratiwi, 2008).
Klasifikasi E. coli yaitu Kingdom: Bacteria, Divisi: Proteobacteria. Kelas: Gammaproteobacteria, Ordo: Enterobacteriales, Famili: Enterobacteriaceae, Genus: Escherichia, Species: Escherichia coli
(www.ncbi.com)
Metabolit sekunder seperti tannin dan flavonoid dapat mencegah pertumbuhan bakteri E. coli (Doughari, 2006). Alkaloid aflatoksin dan penisilin yang dihasilkan dari umbi bawang putih juga berpotensi menghambat pertumbuhan E. coli (Hidayahti, 2010). Bakteri ini cukup resisten terhadap antibiotik Ceftazidime dan Cefotaxime (Anggraini et al., 2013).
2.9 High Pressure LiquidChromatography (HPLC)
High Pressure Liquid Chromatography (HPLC) atau Kromatografi Cair
Kinerja Tinggi (KCKT) merupakan salah satu metode kimia untuk menganalisis suatu senyawa. Metode ini termasuk metode analisis terbaru yaitu suatu teknik kromatografi dengan fase gerak cairan dan fase diam cairan atau padat (Putra, 2004). Ada beberapa metode analisis kuantitatif yang dapat digunakan untuk suatu komponen zat dalam kromatogram, diantaranya yaitu baku luar dan baku dalam Baku luar menggunakan larutan baku berbagai konsentrasi disuntikkan ke kolom KCKT. Baku dalam dengan senyawa baku yang diketahui jumlahnya ditambah larutan sampel dan standar disuntikkan ke kolom KCKT (Putra, 2004).
2.10 Gas Chromatography Mass Spectrophotometry (GCMS)
16
BAB III
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2013 sampai bulan Agustus 2014. Lokasi penelitian di Laboratorium Fisiologi dan Laboratorium Pangan, Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta.
3.2 Alat dan Bahan
Alat yang digunakan adalah Laminar Air Flow Cabinet (ESCI), cryotube, kertas saring, rotary evaporator (Heidolph), HPLC (Perkin Elmer Series 200,
Detector UV-Vis Series 200), GCMS (Shimadzu QP 2010), magnetic stirer, hot
plate (Merck MR300 1K), vortex, mikroskop cahaya dan mikroskop stereo
(Olympus), autoklaf (ALP), oven (Memmert), timbangan analitik, dan kamera. Bahan yang digunakan adalah kapang endofit sebanyak 27 subkultur dengan genus berbeda, kultur bakteri S. aureus ATCC 6538 dan bakteri E. coli
ATCC 8739, plastik tahan panas, kertas cakram steril, antibiotik kloramfenikol, aquades, NaCl, HCl, media Nutrient Agar (NA), media Potato Dextrose Agar
(Merck), media Potato Dextrose Broth, etil asetat PA (EtOAc), kloroform PA (CHCl3), shear’s, standar kuinin sulfat, alkohol 70%.
3.3 Rancangan Penelitian
3.4 Sumber Subkultur
Kapang endofit yang digunakan sebanyak 27 subkultur yaitu genus
Fusarium, Neofusicoccum, Cercospora, Cladosporium, Trichoderma, Guignardia,
Gliocladiopsis, Diaporthe, Phoma, Penicillium, Pestalotiopsis, Lestosphaerulina
dan Aspergillus. Subkultur kapang sudah diidentifikasi secara molekuler. Kapang
diisolasi dari tanaman kina di Pusat Perkebunan Teh dan Kina (PPTK), Gambung, Ciwidey, Bandung, Jawa Barat. Isolasi kapang dilakukan tanggal 29 September 2012 oleh Nani Radiastuti, M.Si dosen Biologi Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta. Isolasi pukul 09.00-12.00 WIB. Lokasi Sampling l7° 8'35.78"S 107°30'59.55"E. pH tanah 6,8 dan kelembaban tanah 35%.
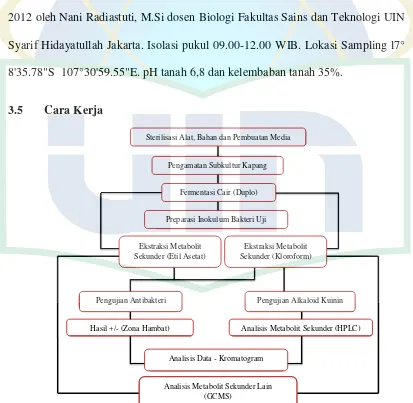
3.5 Cara Kerja
Gambar 5. Bagan kerja Penelitian
3.5.1 Persiapan Subkultur Kapang Endofit
Subkultur kapang endofit sebanyak 27 dengan genus berbeda ditumbuhkan pada cawan petri berisi media Potato Dextrose Agar (PDA). Proses peremajaan subkultur ke media PDA baru bertujuan agar kapang tidak mati. Subkultur kapang dari media PDA lama dicetak menggunakan sedotan steril. Kapang lalu dipindahkan ke media PDA baru menggunakan tusuk gigi steril. Subkultur kapang ditumbuhkan di media PDA cawan dan PDA tabung.
3.5.2 Pembuatan Media
3.5.2.1 Pembuatan Media PDA dan PDB
Sebanyak 39,0 g PDA dilarutkan di dalam 1000 ml akuades menggunakan erlenmeyer. Larutan dihomogenisasi dan dididihkan menggunakan hot plate dan
magnetic stirer. Media PDA lalu disterilisasi menggunakan autoklaf pada suhu
121°C selama ± 15 menit pada tekanan 1,5 atm.
Sebanyak 26,4 g PDB dilarutkan di dalam 1000 ml akuades menggunakan erlenmeyer. Larutan dihomogenisasi menggunakan hot plate dan magnetic stirer.
Media dituang ke dalam botol besar sebanyak 200 ml. Media PDB disterilisasi menggunakan autoklaf pada suhu 121°C selama ± 15 menit pada tekanan 1,5 atm.
3.5.2.2 Pembuatan Media Nutrient Agar (NA) dan Nutrient Broth (NB)
Media NA sebanyak 28 g dilarutkan dalam 1000 ml akuades. Larutan dihomogenisasi menggunakan hot plate dan magnetic stirer. Media disterilisasi dengan autoklaf pada suhu 121°C selama ± 15 menit pada tekanan 1,5 atm.
disterilisasi menggunakan autoklaf pada suhu 121°C selama ± 15 menit pada tekanan 1,5 atm.
3.5.2.3 Pembuatan Media Preservasi Kapang Endofit
Gliserol sebanyak 10 ml dan trehalosa 1 g ditera hingga 100 ml dengan aquades lalu dihomogenkan menggunakan hot plate dan magnetic stirer.
Campuran tersebut dimasukkan ke dalam cryotube sebanyak 0,8 ml, lalu disterilisasi menggunakan autoklaf pada suhu 121°C selama ± 15 menit pada tekanan 1,5 atm (LIPI, 2006).
3.5.3 Subkultur Kapang Endofit
Masing-masing subkultur kapang endofit ditanam pada media PDA di cawan petri selama 7 hari (Arisanti et al., 2011). Miselium kapang yang telah tumbuh diambil dan ditanam kembali pada media PDA miring. Pengamatan morfologi kapang secara makroskopis dan mikroskopis untuk verifikasi.
3.5.3.1Pengamatan Makroskopis
Pengamatan makroskopis dilakukan dengan cara menumbuhkan subkultur kapang dalam cawan petri sekitar ±7 hari. Miselium yang terbentuk diamati karakteristik morfologi koloninya. Warna miselium dicatat, bentuk area miselium, bentuk tepi miselium. Hasil pengamatan didokumentasikan menggunakan kamera.
3.5.3.2 Pengamatan Mikroskopis
perbesaran 100-400 kali. Hasil pengamatan didokumentasikan menggunakan kamera.
3.5.4 Preservasi Kapang Endofit
Miselium subkultur kapang endofit dari tiap cawan petri ditanam di dalam botol vial berisi PDA. Kapang endofit yang telah tumbuh dilapisi bagian permukaannya dengan parafin oil steril agar kondisi aerob. kapang endofit juga ditanam di dalam cryotube berisi campuran gliserol 10 ml dan trehalosa 1 g. Preservasi ini bertujuan agar subkultur kapang tersebut dapat digunakan kembali dalam jangka waktu yang panjang atau untuk dijadikan stok kultur (LIPI, 2006).
3.5.5 Fermentasi Cair
Kapang yang sudah diremajakan selama ± 7 hari pada media PDA di cawan petri diambil menggunakan sedotan steril sebanyak 3 cuplikan. Kapang lalu ditumbuhkan secara duplo di dalam media PDB sebanyak 200 ml. Medium berisi kapang dalam kondisi statis dan diletakkan pada suhu ruang (Zaini, 2012). Proses fermentasi ini berlangsung selama ± 21 hari (Kharismaya, 2010; Bungihan
et al., 2013).
3.5.6 Ekstraksi Metabolit Sekunder
kali dengan perbandingan kultur : pelarut = 1:1. Filtrat (fraksi air) dan miselium (biomassa) dipisahkan (Kharismaya, 2010).
Bagian biomassa kapang dihancurkan hingga halus lalu dicampur kembali dengan filtrat dan ditambahkan pelarut (Bungihan et al., 2013). Campuran dikocok atau dishaker agar tercampur sempurna. Ekstrak yang didiamkan selama ± 2 hari akan membentuk 2 fase (Kharismaya, 2010). Ekstraksi dengan kloroform diambil fase bagian bawah, sedangkan ekstraksi dengan etil asetat diambil fase bagian atas.
Hasil ekstraksi lalu dipekatkan menggunakan rotary evaporator. Ekstrak dengan kloroform dipekatkan pada suhu ≤ 45°C, sedangkan hasil ekstraksi dengan
etil asetat dipekatkan pada suhu ≤ 60°C (Winarno, 2006; Bungihan et al., 2013). Bobot ekstrak diperoleh dari selisih antara bobot botol berisi ekstrak dan bobot botol kosong (Azhari, 2012).
3.5.7 Preparasi Inokulum Bakteri Uji
Teknik inokulasi bakteri yang dilakukan dalam penelitian ini adalah pour
plate. Sebanyak 1 ml suspensi masing-masing bakteri uji diinokulasikan ke dalam
erlenmeyer 200 ml yang berisi 100 ml media NA yang masih cair (≤45°C) (Huda
et al., 2012). Campuran dihomogenkan dengan sedikit pengocokan seperti angka
delapan agar suspensi tercampur rata, kemudian dituang ke dalam cawan petri dan didiamkan hingga campuran suspensi bakteri uji membeku.
3.5.8 Pengujian Aktivitas Antibakteri
Hasil sampel yang sudah dipekatkan lalu ditimbang dan dilarutkan kembali dengan pelarut organik dengan konsentrasi yang sama. Sekitar 10 l sampel (1000 ppm) diteteskan ke kertas cakram steril berukuran diameter 6 mm, yang selanjutnya digunakan untuk uji aktivitas antibakteri (Azizah, 2008).
Pengujian aktivitas antibakteri dilakukan dengan metode Kirby-Bauer atau metode difusi cakram. Setiap kertas cakram steril yang ditetesi sampel ekstraksi didiamkan ±15 menit (Azizah, 2008). Secara aseptik kertas cakram diletakkan dalam cawan petri yang berisi bakteri uji. Kontrol positif yang digunakan yaitu cakram kloramfenikol 10 l dan kuinin 10 l (1000 ppm). Kontrol negatif yang digunakan adalah cakram yang ditetesi akuades steril, kloroform dan etil asetat.
3.5.9 Analisis Ekstraksi Metabolit Sekunder Kuinin Dengan HPLC
Hasil ekstraksi dengan pelarut kloroform selanjutnya dianalisis Kromatografi Cair Kinerja Tinggi (KCKT). Kloroform adalah suatu pelarut non polar yang dapat digunakan untuk ekstraksi alkaloid (Winarno 2006). Alat yang digunakan ialah HPLC merk PerkinElmer Series 200, eluen KH2PO4 20 mM (pH 2.5) : CH3CN = 9:1. Detektor yang digunakan ialah UV-VIS Detector Series 200, jenis kolom C18, kecepatan alir 2 ml/menit, tekanan alir 143-145 kg/cm2, standar kuinin sulfat 0,1 mg/l, ( μ 230 nm) volume injeksi 10,0 µl. (Simanjuntak et al., 2002; Winarno, 2006).
Pembuatan larutan fasa gerak yaitu 6,8 g KH2P04 dan 3 g Hexylamin dilarutkan dengan 700 ml H2O diatur pH dengan H3PO4 sampai pH 2,8, kemudian ditambah H2O sampai 940 ml dan 60 ml Acetonitrile (Wibisana, 2010). Pembuatan larutan standar untuk uji alkaloid yaitu dengan melarutkan standar kuinin sulfat sebanyak 5 mg di dalam labu ukur 10 ml (500 ppm) dilarutkan dalam larutan fase gerak (Wibisana, 2010).
Preparasi sampel dilakukan dengan menimbang sampel hasil ekstraksi lalu dilarutkan dengan larutan fase gerak, campuran disonikasi selama 30 menit. Tahapan selanjutnya campuran disaring dengan membran filter 0,45 l, lalu filtrat
dinjeksikan ke HPLC sebanyak 10 l (Wibisana, 2010).
3.5.10 Analisis Ekstraksi Metabolit Sekunder Dengan GCMS
mengetahui kandungan senyawa yang berperan sebagai antibakteri selain kuinin sulfat. Sampel sebanyak 1 µl diinjeksikan ke dalam GCMS yang dioperasikan menggunakan kolom kaca panjang 25 m, diameter 0,25 mm dan ketebalan 0,25 µl dengan fasa diam CP-Sil 5 CB dengan temperatur 10ºC/menit, gas pembawa helium bertekanan 12 kPa, total laju 30 mL/menit dan split ratio sebesar 1:50 (Sastrohamidjojo, 2001).
3.6 Analisis Data
Analisis hasil aktivitas antibakteri pada penelitian ini menggunakan uji
Analysis of Variance (ANOVA) satu arah (One-way) menggunakan batas
kepercayaan sebesar λ5% (αμ0,05). Pengujian antibakteri dilakukan sebanyak 3 kali pengulangan. Jika terdapat perbedaan nyata maka dilakukan uji lanjutan Duncan. Pengujian hipotesis berdasarkan pada ketetapan H1 dan H0.
H0: Aktivitas antibakteri kapang terhadap bakteri uji tidak berbeda signifikan H1: Aktivitas antibakteri kapang terhadap bakteri uji berbeda signifikan Penarikan kesimpulan berdasarkan nilai signifikansi, yaitu:
25
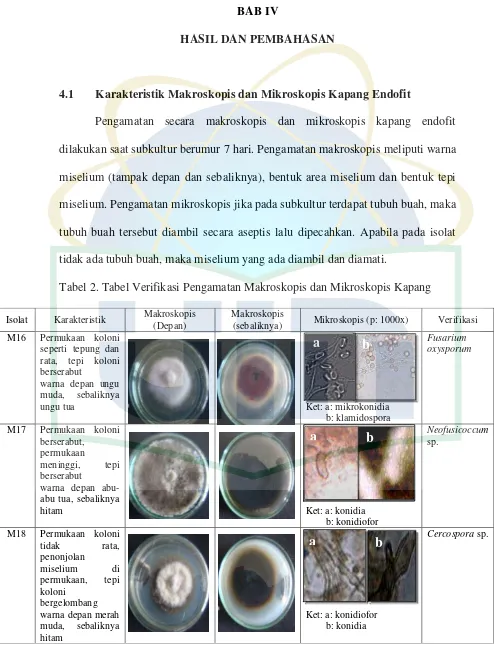
4.1 Karakteristik Makroskopis dan Mikroskopis Kapang Endofit
Pengamatan secara makroskopis dan mikroskopis kapang endofit dilakukan saat subkultur berumur 7 hari. Pengamatan makroskopis meliputi warna miselium (tampak depan dan sebaliknya), bentuk area miselium dan bentuk tepi miselium. Pengamatan mikroskopis jika pada subkultur terdapat tubuh buah, maka tubuh buah tersebut diambil secara aseptis lalu dipecahkan. Apabila pada isolat tidak ada tubuh buah, maka miselium yang ada diambil dan diamati.
Tabel 2. Tabel Verifikasi Pengamatan Makroskopis dan Mikroskopis Kapang
Isolat Karakteristik Makroskopis
(Depan)
Makroskopis
(sebaliknya) Mikroskopis (p: 1000x) Verifikasi M16 Permukaan koloni
seperti tepung dan
M17 Permukaan koloni berserabut,
M18 Permukaan koloni
Isolat Karakteristik Makroskopis (Depan)
Makroskopis
(sebaliknya) Mikroskopis (p: 1000x) Verifikasi M19 Permukaan koloni
seperti tepung dan
M23 Permukaan koloni
kasar dan
M25 Permukaan koloni rata dan tebal
M26 Permukaan koloni seperti kapas. Area
Isolat Karakteristik Makroskopis (Depan)
Makroskopis
(sebaliknya) Mikroskopis (p: 1000x) Verifikasi M35 Permukaan koloni
tidak rata dan
M51 Permukaan koloni kasar dan rata, tepi
M63 Permukaan koloni
tidak rata,
M66 Permukaan koloni rata dengan warna
coklat. Ket: a: mikrokonidia
Isolat Karakteristik Makroskopis (Depan)
Makroskopis
(sebaliknya) Mikroskopis (p: 1000x) Verifikasi M83 Permukaan koloni
seperti tepung dan
M93 Permukaan koloni menggunung,
tua. Ket: a: makrokonidia
b: mikrokonidia
Fusarium solani
M97 Permukaan koloni rata seperti kapas,
4.2 Aktivitas Antibakteri Kapang Endofit Terhadap Bakteri Uji
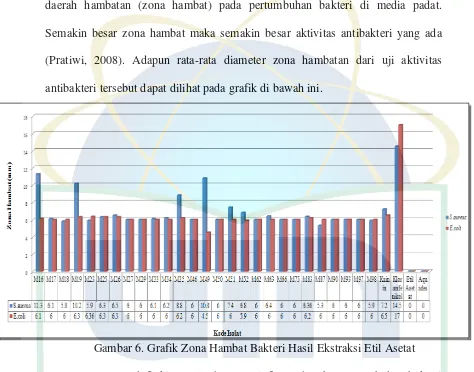
Aktivitas antibakteri dapat diketahui dengan melihat ada atau tidaknya daerah hambatan (zona hambat) pada pertumbuhan bakteri di media padat. Semakin besar zona hambat maka semakin besar aktivitas antibakteri yang ada (Pratiwi, 2008). Adapun rata-rata diameter zona hambatan dari uji aktivitas antibakteri tersebut dapat dilihat pada grafik di bawah ini.
Kapang endofit kina seluruhnya positif menghambat pertumbuhan bakteri uji. Daya hambat ekstrak kapang menggunakan etil asetat terhadap bakteri uji ditampilkan pada gambar 6. Hasil zona hambat ekstrak etil asetat terhadap bakteri
S.aureus cukup besar dihasilkan oleh kapang M16 (F. oxysporum), M19
(Aspergillus sp.), M35 (G. mangifera), M49 (Gliocladiopsis sp.), M51 (P.
citrinum).
Etil asetat dan akuades steril yang digunakan sebagai kontrol negatif tidak menghasilkan zona hambat karena keduanya terbukti tidak memiliki kemampuan
dalam menghambat pertumbuhan bakteri (Jauhari, 2010). Kontrol positif kuinin sulfat dan antibiotik kloramfenikol digunakan untuk membandingkan zona hambat yang dihasilkan oleh ekstrak kapang. Ekstrak kapang M16 (F.
oxysporum), M19 (Aspergillus sp.), M35 (G. mangifera), M49 (Gliocladiopsis
sp.), M51 (P. citrinum) menghasilkan zona hambat yang lebih besar dari kontrol kuinin sulfat terhadap bakteri S.aureus masing-masing sebesar 11,26 mm, 10,20 mm, 8,83 mm, 10,80 mm, 7,40 mm (Gambar 6). Hal ini karena kapang endofit menghasilkan senyawa kuinin sulfat yang lebih besar jumlahnya dibandingkan dengan kontrol atau kapang endofit menghasilkan senyawa lain yang berperan sebagai antibakteri. Mikroorganisme endofit dapat menghasilkan senyawa bioaktif selain senyawa yang terkandung di dalam tanaman inangnya (Pratiwi, 2008). Zona hambat ekstrak kapang endofit menggunakan etil asetat seluruhnya lebih kecil daripada zona hambat antibiotik kloramfenikol, jadi ekstrak kapang endofit tidak ada yang memiliki potensi sebesar antibiotik kloramfenikol dalam menghambat bakteri uji. Zona hambat kapang endofit terhadap bakteri E. coli
seluruhnya lebih kecil dari zona hambat yang dihasilkan oleh kuinin sulfat (Gambar 6).
Berdasarkan hasil analisis data menggunakan SPSS ANOVA satu arah (One way) pada uji Duncan, kapang endofit M16 (F. oxysporum) memiliki zona hambat terhadap bakteri S. aureus paling besar (Lampiran 9). Kapang M16 (F.
oxysporum) menghasilkan zona hambat terhadap S. aureus sebesar 11,2 mm.
Kapang endofit M23 (Diaporthe sp.) memiliki zona hambat terbesar terhadap bakteri E. coli sebesar 6,3 mm. Berdasarkan hasil tersebut diketahui bahwa kapang endofit lebih efektif dalam menghambat pertumbuhan bakteri S. aureus
daripada E. coli (Gambar 6). Kapang endofit tanaman kina Colletotrichum sp. dan
Phomopsis sp. yang diekstrak menggunakan etil asetat menghasilkan zona hambat
lebih besar terhadap bakteri S. aureus daripada bakteri E. coli (Mutiea, 2010; Pamungkas, 2010).
7. Hasil zona hambat kapang ekstrak kloroform terhadap bakteri S.aureus cukup besar dihasilkan oleh kapang M16 (F. oxysporum), M25 (C. oxysporum), M33 (Kapang endofit sp. 1), M63 (Pestalotiopsis sp.). Zona hambat ekstrak kapang terhadap bakteri E.coli cukup besar dihasilkan oleh kapang M16 (F. oxysporum) dan M33 (Kapang endofit sp. 1) (Gambar 7). Pelarut kloroform dan akuades sebagai kontrol negatif terbukti tidak menghasilkan area zona hambat terhadap bakteri uji. Hal ini karena keduanya tidak memiliki kemampuan sebagai antibakteri.
Hasil zona hambat kapang endofit ekstrak kloroform terhadap bakteri S. aureus dan E. coli. dari analisis data menunjukkan nilai Ftabel < Fhitung dan nilai P < 0,05 (Lampiran 8) dengan kesimpulan yang diperoleh adalah H0 ditolak dan H1 diterima. Hal ini dapat dikatakan bahwa terdapat perbedaan yang signifikan pada diameter zona hambat antar isolat ekstrak kloroform. Berdasarkan hasil analisis data mengguanakan SPSS ANOVA satu arah (One way) uji lanjut Duncan, kapang endofit M16 (F. oxysporum) memiliki zona hambat terhadap bakteri S.
aureus paling besar (Lampiran 8). Kapang M16 (F. oxysporum) menghasilkan
zona hambat terhadap S. aureus sebesar 14,6 mm. Kapang endofit M33 (kapang endofit sp. 1) menunjukkan zona hambat terbesar terhadap bakteri E. coli sebesar 9,2 mm (Gambar 7). Hasil ini menunjukkan zona hambat yang dihasilkan ekstrak kapang endofit menggunakan kloroform ternyata lebih efektif dalam menghambat bakteri S. aureus dan E. coli dibandingkan ekstrak kapang endofit dengan etil asetat. Kapang endofit M16 (F. oxysporum) dan kapang endofit sp. 4 menghasilkan zona hambat 2x potensinya terhadap bakteri S. aureus
dibandingkan dengan kontrol positif kuinin sulfat (Gambar 7).
kapang endofit ekstrak kloroform rata-rata lebih besar dibandingkan ekstrak etil asetat. Hal ini karena senyawa yang ada pada kapang endofit lebih mudah larut atau ditarik oleh pelarut non polar seperti kloroform. Sebagian besar senyawa alkaloid dapat larut atau disari oleh pelarut non polar seperti kloroform (Wibisana, 2010).
Hasil pengujian antibakteri kontrol positif antibiotik kloramfenikol terhadap bakteri S. aureus dan E. coli menunjukkan adanya zona hambat. Antibiotik kloramfenikol memiliki kemampuan dalam menghambat pertumbuhan bakteri Gram positif dan bakteri Gram negatif. Besar zona hambat yang dihasilkan pada penelitian ini terhadap bakteri S. aureus dan E. coli ialah sebesar 14,5 mm dan 17 mm (Gambar 6 dan 7). Kerja dari antibiotik kloramfenikol ialah menghambat proses sintesis protein dengan cara menyerang subunit 30S yang berada di ribosom. Subunit tersebut berperan dalam proses sintesis protein, E. coli
mensintesis semua asam amino yang dibutuhkan untuk sintesis protein yang terjadi di ribosom. Ribosom E. coli memiliki 2 jenis subunit yaitu partikel 50S dan partikel 30S yang akan mengalami penggabungan menjadi ribosom 70S untuk proses sintesis protein. Hal ini menyebabkan zona hambat yang dihasilkan oleh antibiotik kloramfenikol lebih besar terhadap bakteri E. coli daripada bakteri
S.aureus (Pratiwi, 2008).
Ekstraksi kapang endofit menggunakan pelarut kloroform dan etil asetat menghasilkan rata-rata diameter zona hambat yang lebih besar terhadap pertumbuhan bakteri S. aureus dibandingkan bakteri E. coli. Bakteri S. aureus
coli. Hal ini disebabkan adanya perbedaan struktur dinding sel bakteri. Struktur dinding sel bakteri Gram positif relatif sederhana yang terdiri atas tiga lapis yaitu selaput sitoplasmik, lapisan peptidoglikan dan lapisan luar yang disebut simpai. Sebaliknya, bakteri Gram negatif mempunyai struktur yang berlapis-lapis dan sangat kompleks (Pratiwi, 2008). Hal lain karena senyawa yang dihasilkan oleh ekstrak kapang menghambat proses sintesis peptidoglikan dengan cara memutus ikatan silang peptida. Beberapa peptidoglikan pada tiap bakteri berbeda dalam hal bahwa rantai-rantai peptidanya tidak langsung terikat silang dengan sesamanya, melainkan terikat oleh jenis peptida lain membentuk jembatan penghubung. Bakteri S. aureus memiliki jembatan penghubung yang terdiri dari lima molekul glisin yang dapat menghubungkan dua peptide asam asetilmuramat (AAM) bersama-sama, sehingga apabila ikatan peptida diputus maka proses sintesis peptidoglikan pada bakteri S. aureus gagal terbentuk. Hal ini yang menyebabkan zona hambat kapang terhadap bakteri S. aureus lebih besar dibandingkan bakteri
E. coli (Pelczar dan Chan, 2006).
menghambat bakteri S. aureus, sedangkan kemampuan antibakteri kapang endofit hasil ekstrak kloroform ataupun etil terhadap bakteri E. coli lebih rendah dibandingkan dengan kloramfenikol.
4.3 Analisis Kandungan Alkaloid Kuinin Kapang Endofit dengan HPLC
Analisis kandungan alkaloid kuinin sulfat menggunakan HPLC yaitu secara kuantitatif. Hal ini untuk mengetahui secara pasti jumlah kandungan kuinin sulfat pada kapang. Proses ekstraksi alkaloid kuinin kapang endofit tanaman kina dilakukan menggunakan pelarut yang bersifat non polar yaitu kloroform. Sebagian besar alkaloid tidak dapat larut (beberapa sedikit larut) di air, tetapi dapat larut dalam pelarut organik seperti kloroform (Wibisana, 2010). Kapang endofit yang diuji kandungan kuinin sulfatnya menggunakan HPLC hanya kapang yang diekstrak menggunakan pelarut kloroform.
Tabel 3. Analisis Metabolit Sekunder Kuinin Kapang Endofit dengan HPLC
Tanaman kina telah diketahui menghasilkan 30 jenis alkaloid. Alkaloid tanaman kina yang saat ini diketahui mempunyai nilai komersial ialah kuinin sulfat. Hasil skrining HPLC pada penelitian ini, dari 27 isolat kapang endofit yang diekstrak, terdapat hanya 6 isolat yang menghasilkan alkaloid kuinin sulfat. Keenam isolat kapang tersebut diisolasi dari bagian tanaman kina (C. calisaya
Leptosphaerulina sp. 62,29 26,68 Daun
Neofusicoccum sp. 31,07 20,6 Ranting
Pestalotiopsis sp. 39,99 14,37 Batang
Wedd.) yang berbeda yaitu ranting, buah, daun dan batang. Kapang endofit yang mengandung alkaloid kuinin sulfat yaitu F. equiseti, Leptosphaerulina sp.,
Neofusicoccum sp., Pestalotiopsis sp., kapang endofit sp. 1 dan Leptosphaerulina
sp. Keenam isolat tersebut dikatakan menghasilkan alkaloid kuinin sulfat karena waktu retensi yang ada mendekati waktu retensi alkaloid kuinin sulfat standar yaitu 1,90 menit. Parameter yang digunakan untuk analisis kandungan alkaloid selain waktu retensi ialah luas area (Lampiran 10).
Hasil pada tabel di atas menunjukkan isolat M33 (Kapang endofit sp. 1) mengandung kuinin sulfat paling banyak yaitu sebesar 300,1 ppm, sedangkan kapang endofit yang mengandung kuinin paling sedikit yaitu isolat M83
(Leptosphaerulina sp.) sebesar 0,65 ppm. Kapang endofit sp. 1 diisolasi dari
terlalu mempengaruhi jumlah kandungan kuinin sulfat pada kapang. Kapang endofit genus Colletotrichum isolasi dari beberapa bagian tanaman kina (C.
calisaya Wedd.) menunjukkan bahwa kapang endofit yang mengandung kuinin
sulfat terbesar diisolasi dari bagian buah yaitu sebanyak 138 ppm (Mutiea, 2010). Kapang endofit genus Phomopsis dari beberapa bagian tanaman kina (C. calisaya
Wedd.) menunjukkan bahwa kapang yang diisolasi dari bagian batang mengandung kuinin sulfat terbesar yaitu 45 ppm (Pamungkas, 2010).
4.4 Analisis GCMS Ekstrak Kloroform dan Etil Asetat Kapang Endofit
Analisis kandungan senyawa ekstrak kapang endofit menggunakan alat GCMS. Ekstrak kapang yang dianalisis dengan GCMS yaitu kapang M16 (F.
oxysporum). Hal ini karena ekstrak kapang tersebut menghasilkan zona hambat
Tabel 4. Senyawa dalam Ekstrak Kloroform Kapang Endofit F. oxysporum yang diidentifikasi dengan GCMS.
No. Nama Senyawa % Area Golongan
1 n-Tetratetrakontan 18,33 Alkana
2 Oktakosan* 8,85 Alkana
3 Heksatriakontan 14,47 Alkana
4 E-15-Heptadesen 0,93 Alkena
19 2,21-Dimetildokosan 2,80 Alkana
Ket : *) memiliki aktivitas antibakteri
oktakosan memiliki nilai similaritas sebesar 96%. Hasil tersebut dapat mengindikasikan bahwa senyawa tersebut berperan cukup besar dalam menghambat bakteri uji S.aureus dan E.coli.
Senyawa golongan alkena seperti 1-heksadesen yang terkandung pada ekstrak kulit buah manggis (Garcinia mangostana L.) dan 1-nonadesen pada ekstrak air bunga kecombrang (Etlingera elatior) terbukti dapat menghambat pertumbuhan bakteri S. aureus dan E. coli (Putra, 2010; Sukandar, 2010). Senyawa dari golongan alkana dan alkanol seperti trikosanol, dokosan, eikosan, oktakosan yang terkandung pada ekstrak Sargassum polycystum dapat menghambat bakteri E. coli dan S.aureus (Ebtananto dan Bagoes, 2011).
Senyawa golongan fenolik seperti fenol 2,4-bis (1,1 dimetiletil) yang terkandung pada ekstrak kulit buah manggis (Garcinia mangostana L.) juga diketahui berpotensi menghambat bakteri Gram positif seperti S. aureus dan bakteri Gram negatif E. coli (Putra, 2010). Bakteri Gram positif seperti S. aureus
Tabel 5. Senyawa dalam Ekstrak Etil Asetat Ekstrak Kapang Endofit F.oxysporum yang diidentifikasi dengan GCMS.
No. Nama Senyawa % Area Golongan
1 Benzena, 1,3,5-trimetil 2,59 Aromatik
2 Undekan 16,73 Alkana
3 Dekan 4,56 Alkana
4 Dokosan* 4,02 Alkana
5 n-dodekan* 9,83 Alkana
6 Benzen, 1,2,3-trimetil 2,49 Aromatik
7 Dekan, 2-metil 1,98 Alkana
8 1,3 Dimetil-5-etil benzene 3,35 Aromatik
9 Tridekan 1,66 Alkana
15 2-6-Dimetilundekan 1,76 Alkena
16 Heksakosan 3,33 Alkana
17 Dekana, 3,7-Dimetil 1,38 Alkana
18 Asam Heksanedioik, bis (2-etilheksil)
ester 1,80
Ester alifatik
19 Naptalen 2,02 Aromatik
20 1,2-Dimetil-4-etilbenzen 3,45 Aromatik
21 4-7 Dimetilindan 1,32 -
22 Heptana, 5-etil-2-metil 2,30 Alkana
23 5,9,9- Trimetilspiro (3,6) deka-5,7-dien-1 2,16 -
24 Butilbenzen sekunder 3,30 Aromatik
25 2-(4-metil-6-(2,6,6-trimetilsikloneks-enil) 6,13 Aromatik 26 Benzena 1,3-dietil-5-metil 3,39 Aromatik
Ket : *) memiliki aktivitas antibakteri
tertinggi yaitu senyawa n-dodekan yaitu sebesar 9,83%. Senyawa n-dodekan memiliki nilai similaritas sebesar 96%. Hasil tersebut dapat mengindikasikan bahwa senyawa n-dodekan berperan cukup besar dalam menghambat bakteri uji
S. aureus dan E. coli.
Senyawa dari golongan alkana seperti heneikosan, eikosan dan dokosan yang terkandung pada ekstrak Sargassum polycystum terbukti dapat menghambat pertumbuhan bakteri E. coli dan Vibrio parahaemolyticus (Ebtananto dan Bagoes, 2011). Senyawa golongan alkana seperti n-dodekan yang terkandung pada ekstrak kulit buah manggis (Garcinia mangostana L.) terbukti dapat menghambat pertumbuhan bakteri S. aureus dan E. coli (Putra, 2010).
Adanya perbedaan antara ekstrak kloroform dan etil asetat kapang endofit disebabkan oleh sifat suatu pelarut dan senyawa yang terkandung. Pelarut yang bersifat polar dapat menyerap senyawa yang bersifat polar dan sebaliknya. Senyawa-senyawa yang tersari oleh kedua pelarut tersebut memiliki kualitas penyarian yang berbeda-beda, sehingga hasilnya pun berbeda. Pelarut etil asetat merupakan pelarut yang memiliki sifat universal dapat menyerap senyawa polar dan non polar, sehingga senyawa yang didapatkan lebih banyak dan lebih kompleks. Berbeda dengan pelarut kloroform yang hanya dapat menyerap senyawa bersifat nonpolar saja, sehingga hasil yang didapat tidak terlalu banyak (Winarno, 2006). Ekstrak kloroform menghasilkan 19 senyawa, sedangkan ekstrak etil asetat menghasilkan 26 senyawa.
44
5.1 Kesimpulan
1. Kapang endofit dari tanaman kina (C. calisaya Wedd.) memiliki potensi sebagai senyawa antibakteri. Kapang endofit F. oxysporum memiliki zona hambat terbesar terhadap bakteri S. aureus yaitu sebesar 14,9 mm dan kapang endofit sp. 1 memiliki zona hambat terbesar terhadap bakteri E. coli yaitu sebesar 9,2 mm.
2. Kapang endofit dari tanaman kina menghasilkan alkaloid kuinin sulfat yang cukup besar. Kapang endofit sp. 1, F. equiseti, Leptosphaerulina sp.,
Neofusicoccum sp., Pestalotiopsis sp., dan Leptosphaerulina sp. masing-masing menghasilkan kuinin sebesar 300,1; 249,1; 26,68; 20,6; 14,37 dan 0,65 ppm.
5.2 Saran
45
DAFTAR PUSTAKA
Anggraini, F. 2013. Isolasi dan Uji Antimikroba Metabolit Sekunder Ekstrak Kultur Jamur Endofit AFKR-5 dari Tumbuhan Akar Kuning
(Arcangelisia flava (L) Merr. Skripsi. Departemen Kimia. Fakultas
Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Arisanti, S., N.D. Kuswytasari, M. Shovitri. 2011. Uji Antimikroba Isolat Kapang Tanah Wonorejo Surabaya. Journal of Microbiology.
Astuti, P., D. Apristiani. 2005. Isolasi Komponen Aktif Antibakteri Ekstrak Kloroform Daun Mimba (Azadirachta indica A.Juss) dengan Bioautografi.
3(2): 43-46.
Azhari, A. 2012. Aktivitas Sitotoksik dan Apoptosis Sel Khamir Ekstrak Kloroform Kapang Endofit Evodia suaveolens. Skripsi. Departemen Biokimia. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Azizah, N.N. 2008. Isolasi dan Identifikasi Jamur Endofit dari Daun Jambu Biji
(Psidium guajava L.) Penghasil Antibakteri Terhadap Bakteri Escherichia
coli dan Staphylococcus aureus. Skripsi. Departemen Biologi. Fakultas
Sains dan Teknologi. Universitas Islam Negeri. Malang.
Bungihan, E.M., M.A. Tan, H. Takayama, T.E. Dela, M.G. Nonato. 2013. A new macrolide isolated from the endophytic fungus Colletotrichum sp.
Philippine Science Letters6(1): 57-73.
Clay, K. 2004. Fungi and the food of the gods.Nature 427: 401-402.
Dinarliah, I. 2001. Produksi Senyawa Kinin oleh Mikroorganisme Endofitik pada Tanaman Cinchona ledgeriana Moens dengan Berbagai Konsentrasi Sukrosa. Skripsi. Jurusan Tenologi Pertanian. Fakultas Teknologi Pertanian. Institut Pertanian Bogor. Bogor.
Doughari, J.H. 2006. Antimicrobial activity of Tamarandus indica linn.
Tropical journal of pharamaceutical research5(2): 597-603.
Ebtananto, Bagoes. 2011. Daya Antibakteri Ekstrak Sargassum Polycystum
dengan Berbagai Pelarut Terhadap Escherechia coli dan Vibrio
parahaemolyticus. Tesis. Program Pasca Sarjana. Universitas Brawijaya.
Gandjar I., R.A. Samson, K.V.D.T. Vermeulen, A. Oetari, I. Santoso. 1999.
Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia. Jakarta.
Gandjar, I., W. Sjamsuridzal, A. Oetari. 2006. Mikologi Dasar dan Terapan. Edisi ke-1. Yayasan Obor Indonesia. Jakarta.
Hidayahti, N. 2010. Isolasi dan identifikasi jamur endofit pada umbi bawang putih
(Allium sativum) sebagai penghasil senyawa antibakteri terhadap bakteri
Streptococcus mutans dan Escherichia coli. Skripsi. Jurusan biologi.
Fakultas Sains dan Teknologi. Universitas Islam Negeri. Malang.
Huda, C., Salni, Melki. 2012. Penapisan aktivitas antibakteri dari bakteri yang berasosiasi dengan karang lunak Sarcophyton sp. Marpari Journal 4(1): 69-76.
Jauhari, L.T. 2010. Seleksi dan Identifikasi Kapang Endofit Penghasil Antimikroba Penghambat Pertumbuhan Mikroba Patogen. Skripsi. Departemen Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri. Jakarta.
Kharal, A.S., Q. Hussain, S. Ali, Fakhuruddin. 2009. Quinine is bactericidal.
Journal Pakistan Medical Assoiation59(4): 208-211.
Kharismaya, W. 2010. Biotransformasi Palmatin oleh Jamur Endofit dari Tumbuhan Akar Kuning (Arcangelisia flava L.Merr: Menispermaceae). Skripsi. Departemen Farmasi. Fakultas Kedokteran dan Ilmu Kesehatan. Universitas Islam Negeri. Jakarta.
Khotimah, F.K. 2010. Isolasi Senyawa Aktif Antibakteri Minyak Atsiri Bunga Cengkeh (Syzygium aromaticum). Skripsi. Program Studi Kimia. Fakultas Sains dan Teknologi. Universitas Islam Negeri. Jakarta.
Komalasari, D. 2012. Isolasi Identifikasi dan Pengujian Kemampuan Kapang Selulolitik dari Naskah Kuno Kertas Eropa Asal Keraton Kasepuhan Cirebon. Skripsi. Departemen Biologi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Indonesia. Depok.
Kusumaningtyas, E., M. Natasia, Darmono. 2010. Potensi Metabolit Kapang Endofit Rimpang Lengkuas Merah dalam Menghambat Pertumbuhan
Escherichia coli dan Staphylococcus aureus dengan Media Fermentasi
Potato Dextrose Broth (PDB) dan Potato Dextrose Yeast (PDY). Prosiding Teknologi Peternakan dan Veteriner Ramah Lingkungan dalam Mendukung Program Swasembada Daging dan Peningkatan Ketahanan
LIPI, 2006. Seri Panduan Teknik Isolasi Fungi. Lembaga Ilmu Pengetahuan Indonesia. Bogor.
Machmud, M. 2001. Teknik Penyimpanan dan Pemeliharaan Mikroba. AgroBio
4(1): 24-32.
Maehara, S., P. Simanjuntak, C. Kitamura, K. Ohashi, H. Shibuya. 2011. Cinchona alkaloids are also produced by an endophytic filamentous fungus living in cinchona plant. Chemical Pharmaceutical Bull 59(8): 1073-1074.
Mardiastuti, H.W., A. Karuniawati, A. Kiranasari, Ikaningsih, A. Kadarsih. 2007. Emerging resistance pathogen: situasi terkini di Asia, Eropa, Amerika Serikat, Timur Tengah dan Indonesia. Majalah Kedokteran
Indonesia57(3): 75-79.
Martin, S.E., J.J. Landolo. 1999. Staphylococcus . Dalam Robinson RK, editor,
Encyclopedia of Food Microbiology. San Diego: Academic Pr.
Mutiea, D. 2014. Aktivitas Antibakteri dan Produksi Kuinin dari Kapang Endofit
(Colletotrichum spp.) Tanaman Kina (Cinchona calisaya Wedd.). Skripsi.
Jurusan Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri. Jakarta.
Pamungkas, A.P. 2014. Senyawa Bioaktif Kuinin dan Antibakteri Kapang Endofit
(Phomopsis spp.) dari Tanaman Kina (Cinchona calisaya Wedd.). Skripsi.
Jurusan Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri. Jakarta.
.
Meggitt, C. 2003. Food Hygiene and Safety. Roma. Heinemann Educational Pub. Pavia, D.L., G.M. Lampman, G.S. Kriz, R.G. Engel. 2006. Introduction to
Organic Laboratory Techniques: A Microscale Approach, Edisi 4. Brooks
Cole Pub Co. United Kingdom.
Petrini, O., T.N. Sieber, L. Toti, O. Viret. 1992. Ecology metabolite production and substrate utilization in endophytic fungi. Natural Toxins
1:185-196.
Pratiwi, S.T. 2008. Mikrobiologi Farmasi. Erlangga. Jakarta.
Putra, E.D.L. 2004. Kromatografi Cair Kinerja Tinggi dalam Bidang Farmasi. USU digital Library. 1-22.
Putra, K.N.I. 2010. Aktivitas Antibakteri Ekstrak Kulit Buah Manggis (Garcinia
Rennie, R.P., R.N. Jones, A.H. Mutnick. Occurrence and antimicrobial susceptibility patterns of pathogens isolated from skin and soft tissue infections: report from the Sentry antimicrobial surveillance Program (United States and Canada, 2000). Diagn Microbiol Infect Dis 2003.
Sastrohamidjojo, H. 2001. Kromatografi. Liberty. Yogyakarta
Semangun, H. 1996. Pengantar Ilmu Penyakit Tumbuhan. UGM Press. Yogyakarta
Simanjuntak, P., Bustanussalam, T.K. Prana, K. Ohashi, H. Shibuya. 2002. Biotransformasi senyawa alkaloid kinkona oleh kapang Xylaria sp. menjadi alkaloid kinkona N-oksida [Studi Mikroba Endofit Tanaman
Cinchona spp. (5)]. Majalah Farmasi Indonesia13(2): 95-100.
Simanjuntak, P., Bustanussalam, T.K. Prana, K. Ohashi, H. Shibuya. 2002. Production of quinine alkaloid by some endophytic microbes with addition of inducer substances [Studies on Endophytic Microbes of Cinchona sp. plants (2)]. Majalah Farmasi Indonesia13(1): 1-6.
Sufiriyanto, M. Indraji. 2005. Uji in vitro dan in vivo ekstrak campuran mengkudu (Morinda citrifolia) dan bawang putih (Allium sativum) pada sapi perah penderita mastitis sub klinis. J. Anim. Prod. 7: 101-105.
Sukasmono, 1997. Manfaat Kina Bagi Kehidupan Manusia. Warta Pusat Penelitian Teh dan Kina. 8(2): 81-89.
Sukandar, D., N. Radiastuti, I. Jayanegara, A. Hudaya. 2010. Karakterisasi Senyawa Aktif Antibakteri Ekstrak Air Bunga Kecombrang (Etlingera
elatior) Sebagai Bahan Pangan Fungsional. 2(1): 333-339.
Syarmalina, W. Lely, N. Laupa. 2007. Uji sitotoksik hasil fermentasi kapang endofit buah mahkota dewa (Phaleria macrocarpa) terhadap sel MCF-7.
Jurnal Ilmu Kefarmasian Indonesia5(1): 23-30.
Tao, C., M.C. Taylor. 2011. Cinchona linnaeus. Fl China 19: 88–89.
Tjitrosomo, S. Soetarmi, N. Sugiri. 1996. Biologi Edisi Kelima. Erlangga. Jakarta. Wibisana, A. 2010. Difusi teknologi ekstraksi kinin dan sinkonin dari produk
Wipf, P., A.D. Kerekes. 2003. Structure reassignment of the fungal metabolite TAEMC161 as the phytotoxin viridiol. Journal National Production 66: 716-718.
Winarno, E.K. 2006. Produksi alkaloid oleh mikroba endofit yang diisolasi dari batang kina Cinchona ledgeriana Moens dan Cinchona pubescens Vahl (Rubiaceae). Jurnal Kimia Indonesia 1(2): 59-66.
www.learning.covcollege.ac.uk. Diakses tanggal 12-1-2014 pukul 16.00 WIB.
www.ncbi.com. http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi. Diakses tanggal 10 Januari 2014 pukul 14.00 wib.
www. plantamor.com. Diakses tanggal 29-2-2014 pukul 12.30 WIB.
Zaini, N.C., G. Indrayanto, N.E.N Sugijanto. 2012. Produksi Antibiotika Baru
Dari Jamur Endofit Tumbuhan Aglaia odorata Lour Cladosporium
50
Kapang Endofit Tanaman Kina
Antibakteri Memproduksi Metabolit
sekunder
Staphylococcus aureus Escherichia coli
Alkaloid Kuinin Tanaman Kina (Cinchona calisaya Wedd.)
45 senyawa
Lampiran 2. Skema Alur Penelitian
Pengamatan Subkultur Kapang (Makroskopis dan Mikroskopis)
Preservasi dan Peremajaan Kapang
Fermentasi Cair (Duplo)
Preparasi Inokulum Bakteri Uji
Ekstraksi Metabolit Sekunder (Kloroform) Ekstraksi Metabolit
Sekunder (Etil Asetat)
Pengujian Alkaloid Pengujian
Antibakteri
Hasil Zona Hambat (+/-)
Analisis Data - Kromatogram
Analisis Metabolit Sekunder (GCMS)
Sterilisasi Alat dan Bahan, Pembuatan Media