KINERJA PERTUMBUHAN BENIH IKAN GURAME YANG DIBERI PERENDAMAN HORMON PERTUMBUHAN REKOMBINAN DENGAN
MASA PEMELIHARAAN BERBEDA DI AKUARIUM
WAHYUNI FANGGI TASIK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis dengan judul “Kinerja Pertumbuhan Benih Ikan Gurame yang Diberi Perendaman Hormon Pertumbuhan Rekombinan dengan Masa Pemeliharaan Berbeda di Akuarium” adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
RINGKASAN
WAHYUNI FANGGI TASIK. Kinerja Pertumbuhan Benih Ikan Gurame yang Diberi Perendaman Hormon Pertumbuhan Rekombinan dengan Masa Pemeliharaan Berbeda di Akuarium. Dibimbing oleh: ALIMUDDIN, DINAR TRI SOELISTYOWATI, dan MIA SETIAWATI
Pertumbuhan yang lambat pada ikan gurame merupakan permasalahan utama dalam pengembangan budidayanya. Waktu pemeliharaan yang lama sudah tentu akan meningkatkan resiko dan biaya produksi. Oleh karena itu, diperlukan suatu teknologi untuk meningkatkan laju pertumbuhan ikan gurame. Penelitian ini bertujuan untuk menganalisis kinerja pertumbuhan benih ikan gurame terhadap perendaman dalam hormon pertumbuhan rekombinan ikan gurame (rOgGH) dengan dosis 120 mg/L selama 60 menit pada stadia benih (2 hari setelah mulai makan) dan pada saat yang sama juga untuk mengevaluasi lama pemeliharaan yang tepat dalam akuarium.
Hasil aplikasi rOgGH menunjukkan adanya peningkatan level ekspresi mRNA IGF-I sesaat setelah perendaman yaitu sebesar 208,3% dibandingkan dengan kontrol (sebelum direndam) dan setelah 24 jam kembali pada level awal. Demikian, pada analisis aktivitas enzim lipase tidak terdapat perbedaan yang signifikan pada ikan yang telah direndam dalam rOgGH dan kontrol BSA yaitu masing-masing 0,055 unit/menit.g bobot tubuh dan 0,053 unit/menit.g bobot tubuh. Selanjutnya, ditemukan adanya perubahan pemanfaatan pakan serta penyimpanan lemak, protein dan karbohidrat. Hasil menunjukkan adanya perbedaan yang signifikan (P < 0,05) untuk nilai retensi nutrien antara perlakuan perendaman dalam rOgGH dengan perlakuan kontrol BSA. Ikan yang telah direndam dalam rOgGH memiliki retensi lemak yang lebih tinggi (15,92±0,37%) jika dibandingkan dengan perlakuan kontrol BSA (6,52±0,38%). Untuk retensi protein, perlakuan perendaman dalam rOgGH juga memiliki nilai yang lebih tinggi yaitu 23,58±2,33% jika dibandingkan dengan kontrol BSA yang memiliki nilai retensi sebesar 19,75±1,00%. Perlakuan perendaman dalam rOgGH memiliki nilai retensi karbohidrat (diwakili oleh kandungan BETN dalam tubuh) yang lebih kecil yaitu sebesar 2,86±0,21% jika dibandingkan dengan kontrol BSA 10,63±0,92%.
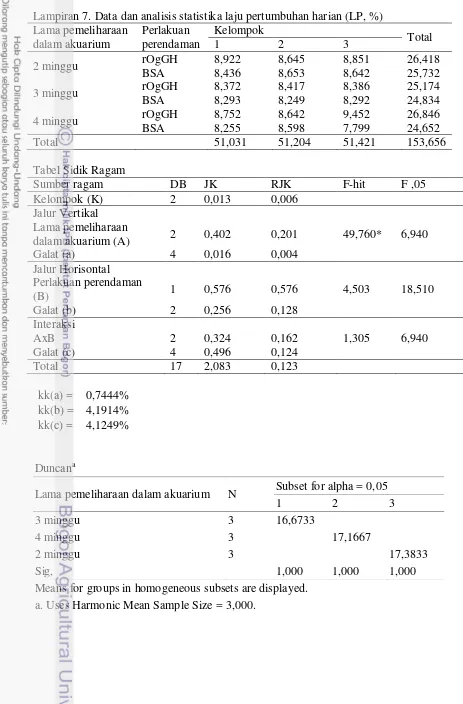
15,6±2,1% dan 7,9±4,4% untuk pakan cacing serta 30,7±5,0% dan 49,0±16,5% untuk pakan pelet halus/crumble. Efisiensi pakan pelet ketiga perlakuan lama perendaman dalam akuarium tidak memberikan pengaruh yang signifikan (P>0,05).
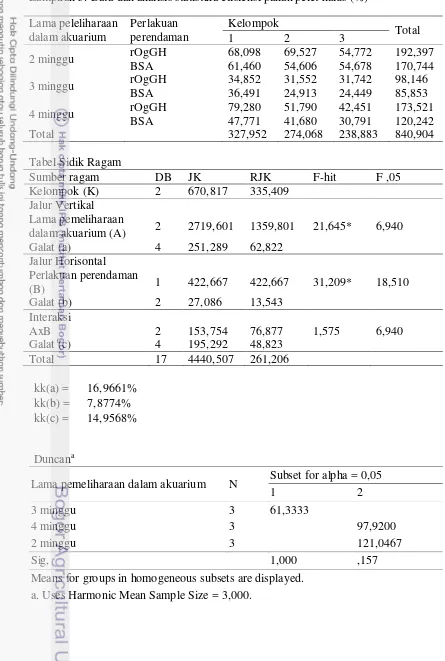
Perendaman dalam rOgGH diharapkan dapat meningkatkan laju pertumbuhan ikan, tetapi hasil yang didapatkan ternyata tidak berbeda (P > 0,05) dengan ikan kontrol BSA yaitu sebesar 8,7±0,3% dan 8,4±0,3%. Lama pemeliharaan dalam akuarium terlihat memberikan pengaruh yang signifikan (P < 0,05) terhadap laju pertumbuhan ikan, terlihat kelompok ikan yang dipelihara selama 2 minggu dalam akuarium memiliki laju pertumbuhan yang lebih cepat yaitu sebesar 8,7±0,2% jika dibandingkan dengan kelompok ikan yang dipelihara selama 3 dan 4 minggu dengan nilai masing-masing sebesar 8,3±0,1% dan 8,6±0,5%.
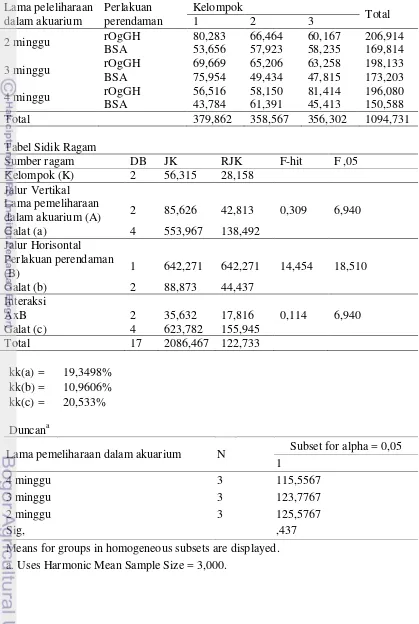
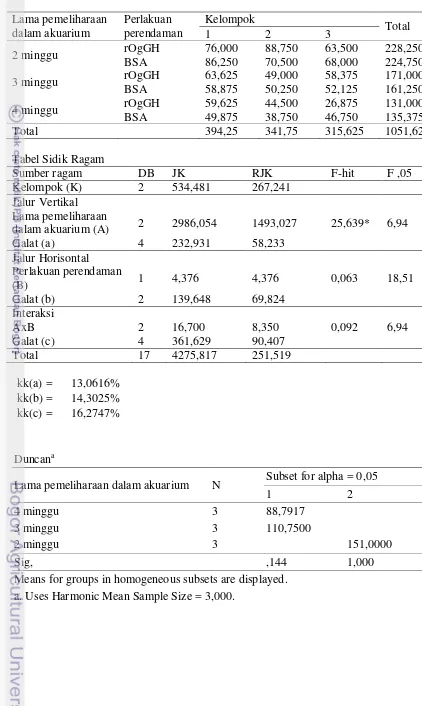
Hasil penelitian juga menunjukkan perendaman dalam rOgGH tidak memberikan pengaruh yang signifikan (P > 0,05) jika dibandingkan dengan nilai kelangsungan hidup ikan yang direndam dalam BSA (kontrol) yaitu rata-rata nilai kelangsungan hidup (KH) masing-masing sebesar 58,9±17,9% dan 57,9±14,6%. Lama pemeliharaan dalam akuarium memberikan pengaruh yang signifikan (P < 0,05) dengan nilai KH tertinggi terdapat pada ikan yang dipelihara selama 2 minggu dalam akuarium yaitu sebesar 75,5±10,2% jika dibandingkan dengan ikan yang dipelihara selama 3 dan 4 minggu dengan nilai KH sebesar 55,4±5,8% dan 44,4±11,0%.
Berdasarkan hasil penelitian disimpulkan bahwa pemberian rOgGH melalui perendaman dengan dosis 120 mg/L sebanyak 1 kali di awal pemeliharaan dapat meningkatkan ekspresi IGF-I dan mengarahkan sistem metabolisme untuk lebih memanfaatkan karbohidrat sebagai sumber energi sehingga lebih banyak lemak dan protein yang disimpan. Dari percobaan yang sama juga dapat disimpulkan bahwa ikan gurame sudah mampu dipindahkan ke kolam sejak umur 2 minggu setelah perendaman (16 hari setelah habis kuning telur) dan dapat beradaptasi terhadap pemaparan yang lebih cepat pada lingkungan kolam yang tidak terkontrol sehingga mampu memberikan hasil nilai derajat kelangsungan hidup di atas 70%.
SUMMARY
WAHYUNI FANGGI TASIK. Growth Performance of Giant Gourami
Osphronemous goramy Juvenile to Recombinant Growth Hormone by Immersion and Different Aquarium-rearing Period. Supervised by ALIMUDDIN, DINAR TRI SOELISTYOWATI, and MIA SETIAWATI
Slow growth of giant gourami became the main problem in cultivation of this commodity. Long rearing period surely would increase the risk and cost of production. Therefore, a technology is required to enhance growth rate of giant gourami. The aims of this experiment were to analyse growth performance of giant gourami to the recombinant giant gourami growth hormone (rOgGH) immersion at a dose of 120 mg/L for 60 minutes at juvenile stage and to evaluate the proper aquarium-rearing period. After immersed, fish were reared in aquarium for 2 weeks, 3 weeks and 4 weeks before moved to fish pond (aquarium-rearing period became the second factor on this experiment, in term to design a proper method to apply this technology). There were 3 replications for every treatment.
RT-PCR analysis showed that IGF-I mRNA expression level increased just after rOgGH immersion about 208,3% compared with control. However, lipase analysis showed no differences between treated fish and control fish that is 0,055 unit/minute.g body weight and 0,053 unit/minute.g body weight for each group. Furthermore, treatment of rOgGH also altered the utilization of dietary and stored lipid, protein and carbohydrates. The results showed significant differences (P<0,05) for nutrient retention between treated fish and control fish. Fish that immersed by rOgGH had higher fat retention (15,92±0,37%) if compared with the control BSA fish (6,52±0,38%). Immersion treatment with rOgGH also had a higher protein retention that was 23,58±2,33% compared with BSA control fish 19,75±1,00%. Immersion treatment with rOgGH had a lower carbohydrate retention that was 2,86±0,21% if compared with BSA control 10,63±0,92%.
Observation to feed efficiency value showed that immersion in rOgGH had no statistically significant affect (P>0,05) compared with BSA control for 3 types of feed. For tubifex worms, the feed efficiency value that reached was 14,8±5,6% (rOgGH) and 12,7±5,0% (BSA). So that crumble feed, 51,6±17,8% (rOgGH) and 41,9±13,6% (BSA), for small feed (2mm) 66,8±9,0% (rOgGH) and 54,8±10,0% (BSA). Treatment that gave a significant affect was aquarium-rearing period, it showed that fish which reared in aquarium for 2 weeks had a higher feed efficiency value for tubivex worm and crumble feed that were ,7±2,8% and 60,5±7% if compared with fish which reared in aquarium for 3 and 4 weeks with efficiency value for each were 15,6±2,1% and 7,9±4,4% for tubifex worms and 30,7±5,0% and 49,0±16,5% for crumble feed.
Results also showed that immersion in rOgGH had no significant affect (P>0,05) if compared with BSA control for survival rate (58,9±17,9% and 57,9±14,6% for each group). Aquarium-rearing period seemed to have significant affect (P<0,05) for survival rate which fish that reared in aquarium for 2 weeks had a higher survival rate (75,5±10,2%) if compared with fish that reared for 3 and 4 weeks (55,4±5,8% and 44,4±11,0% for each group).
By the results it was suggested that immersion in rOgGH with dose at 120 mg/L once at the early rearing-time could increase the IGF-I expression level and influences metabolic pathways towards higher use of carbohydrates for energy production and lipid synthesis, and increasing utilization of lipids and proteins for retention. Results also showed that giant gourami juvenile could be reared in aquarium for 2 weeks after treatment (16 days after first feeding) and then moved to fish pond for next rearing stage.
Hak Cipta milik IPB, tahun 2013 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar bagi IPB.
KINERJA PERTUMBUHAN BENIH IKAN GURAME YANG DIBERI PERENDAMAN HORMON PERTUMBUHAN REKOMBINAN DENGAN
MASA PEMELIHARAAN BERBEDA DI AKUARIUM
WAHYUNI FANGGI TASIK
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
JlIdlil Tesis
Nama NIM
Kine, ja Perllllllblihan Benih Ikan Gurame yang Diberi r)erendal11Eln Honnon Pe,"tllll1bllhEln Rek omb inan dengan Masa Pemeliha,"aan BerbedEl di Akliarillill
WahYlIni Fanggi Tasik CI51090251
Di se tujui oleh Komisi Pembimbing
Dr Alimllddin. SPi. MSc KetLia
Anggo ta
Dr Ir Dinar Tri Soelistyowati. DEA Anggota
Diketahui oleh
Ketua Depa,"temen Budidaya Perairan
Judul Tesis : Kinerja Pertumbuhan Benih Ikan Gurame yang Diberi Perendaman Hormon Pertumbuhan Rekombinan dengan Masa Pemeliharaan Berbeda di Akuarium
Nama : Wahyuni Fanggi Tasik
NIM : C151090251
Disetujui oleh
Komisi Pembimbing
Dr Alimuddin, SPi, MSc Ketua
Dr Ir Mia Setiawati, MSi Anggota
Dr Ir Dinar Tri Soelistyowati, DEA Anggota
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr Ir Sukenda, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah Yang Maha Kuasa karena kasih dan penyertaan-NYA yang tiada ternilai, sehingga penulisan tesis ini dapat terselesaikan. Tesis “Kinerja Pertumbuhan Benih Ikan Gurame yang Diberi Perendaman Hormon Pertumbuhan Rekombinan dengan Masa Pemeliharaan Berbeda di Akuarium” ini dilaksanakan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, Laboratorium Nutrisi Ikan, Kolam Percobaan Departemen Budidaya Perairan-FPIK, dan Laboratorium Biokimia PAU-IPB pada bulan Juni 2011-Februari 2012.
Penulis mengucapkan terimakasih kepada Dr Alimuddin, SPi, MSc, Dr Ir Dinar Tri Soelistyowati, DEA dan Dr Ir Mia Setiawati, MSi selaku dosen pembimbing; Dr Agus Oman Sudrajat, SPi, MSc selaku penguji luar komisi; rekan-rekan Ilmu Akuakultur 2009: Erna Thalib Martapure, Zuraida, Iko Imelda Arisa, Aras Syazili, Jacqueline Sahetapi, Muliyani, Riri Ezraneti, Jeni Abidin, Sefti Heza Dwinanti, Muznah Toatubun, Novi Mayasari, Safrizal Putra, Harri Kretiawan, Rahman, Reza Samsudin, Mariana Beruatjaan, Jacomina Metungun, Dian Febriani, A. H. Condro Haditomo, Tanbiyaskur, Anwar Hasan, Eulis Marlina, Dewi Puspaningsih, Romeos Kalvari, dan Ari S, senior-senior di laboratorium Genetika Ikan: kak Anna Octavera, ibu Irmawati, dan ibu Yulintine Liwat; serta ungkapan terimakasih terbesar kepada bapak Christian Fanggi Tasik dan ibu Renny Selfiani Fanggi Tasik-Amalo serta adik tersayang Alchristo Darlian Fanggi Tasik atas semua doa, dukungan dan semangat yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan dan Manfaat 2
TINJAUAN PUSTAKA 2
Hormon Pertumbuhan (Growth Hormone, GH) 2
Peranan Hormon Pertumbuhan dalam Metabolisme 4
Insulin-Like Growth Factor-I (IGF-I) 5
Teknologi Protein Rekombinan Hormon Pertumbuhan (Recombinant Growth Hormone, rGH) 6
BAHAN DAN METODE 7
Penyediaan rGH 7
Percobaan 8
Evaluasi Respons Ikan 10
Analisis Data 13
HASIL DAN PEMBAHASAN 13
Ekspresi Gen IGF-I 14
Aktivitas Enzim Lipase 15
Retensi Nutrien 15
Efisiensi Pakan 17
Laju Pertumbuhan 18
Kelangsungan Hidup 20
Efektivitas Aplikasi rOgGH melalui Metode Perendaman dalam Meningkatkan Laju Pertumbuhan Ikan Gurame 21
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 22
LAMPIRAN 28
DAFTAR TABEL
1 Rancangan percobaan petak berjalur 8
2 Aktivitas enzim lipase 15
3 Retensi nutrien 15
4 Nilai rataan efisiensi pakan 16
5 Nilai rataan laju pertumbuhan benih ikan gurame yang diberi perlakuan perendaman (rOgGH dan BSA) dan lama pemeliharaan dalam akuarium
yang berbeda 17
6 Nilai rataan kelangsungan hidup benih ikan gurame yang diberi perlakuan perendaman (rOgGH dan BSA) dan lama pemeliharaan
dalam akuarium yang berbeda 19
7 NIlai rataan kelangsungan hidup benih ikan gurame yang diberi perlakuan perendaman (rOgGH dan BSA) dan lama pemeliharaan
dalam akuarium yang berbeda 20
DAFTAR GAMBAR
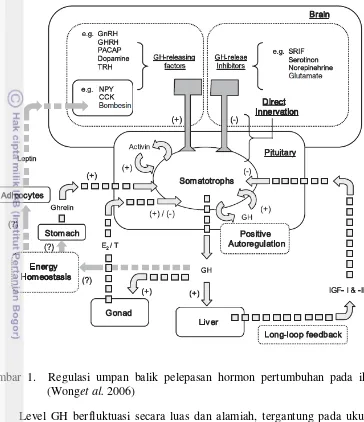
1 Regulasi umpan balik pelepasan hormon pertumbuhan pada ikan
(Wong et al. 2006) 3
2 Diagram kontrol neuroendokrin GH terhadap metabolisme (Chappel
dan Murphy 2000) 5
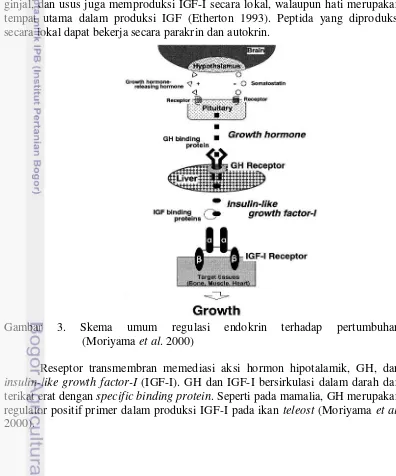
3 Skema umum regulasi endokrin terhadap pertumbuhan
(Moriyama et al. 2000) 6
4 Waktu perlakuan, pemeliharaan ikan, dan pengambilan data 9
5 Skema pemberian pakan pada ikan selama pemeliharaan 10
6 Level ekspresi IGF-I/β-aktin benih gurame 14
DAFTAR LAMPIRAN
1 Hasil analisis SDS-PAGE 28
PENDAHULUAN Latar Belakang
Pada kegiatan budidaya, mempercepat laju pertumbuhan merupakan kunci utama dalam meningkatkan efisiensi produksi, sehingga pertumbuhan yang lambat pada ikan gurame menjadi kendala utama dalam pengembangan budidayanya. Waktu pemeliharaan yang lebih lama untuk mencapai ukuran konsumsi (±1,5 tahun) sudah tentu akan meningkatkan risiko pemeliharaan dan juga meningkatkan biaya produksi. Kendala lainnya yang juga dihadapi adalah tingkat kelangsungan hidup yang cukup rendah ketika ikan dipindahkan ke kolam pembesaran yaitu sekitar 50%. Pada umumnya, ikan dipindahkan ke kolam pada usia 10-14 hari.
Perkembangan teknologi saat ini telah mendukung penerapan teknik eksperimental untuk memanipulasi pertumbuhan ikan, salah satu produk bioteknologi yang telah dihasilkan adalah hormon pertumbuhan rekombinan (recombinant growth hormone, rGH). Walaupun teknologi ini telah lama diujicobakan oleh para peneliti di bidang peternakan dan perikanan untuk meningkatkan kinerja pertumbuhan komoditas ternak dan ikan, namun di Indonesia masih merupakan suatu teknologi baru yang memiliki keterbatasan dalam informasi dasar yang bisa mendukung pengembangan dan penerapannya. Kloning dan ekspresi rGH telah berhasil didapatkan dari beberapa ikan di Indonesia antara lain ikan mas, gurame, dan kerapu kertang (Lesmana 2010). Pemanfaatan rGH untuk menstimulasi pertumbuhan ikan juga telah banyak dilakukan baik melalui penyuntikan, perendaman maupun pemberian melalui pakan, dan terbukti dapat meningkatkan laju pertumbuhan ikan jika dibandingkan dengan ikan kontrol tanpa pemberian rGH (Ben-Atia et al. 1999, Silverstein et al. 2000, Kajimura et al. 2002, Acosta et al. 2007, 2009; Alimuddin et al. 2010, Lesmana 2010, Utomo 2010, Handoyo 2012, Safir 2012, dan Syazili 2012).
rGH memiliki fungsi yang sama dengan GH ketika masuk ke dalam tubuh. Hormon ini mempengaruhi pertumbuhan tubuh, juga berkaitan dengan reproduksi, imunitas, dan pengaturan osmoregulasi pada ikan teleost, serta berperan dalam pengaturan metabolisme melalui aktivitas lipolitik dan anabolisme protein pada vertebrata (Rousseau dan Dufour, 2007). Kinerja hormon pertumbuhan, baik dalam bentuk rekombinan maupun yang disintesis dalam tubuh, secara spesifik dipengaruhi oleh spesies, jenis kelamin, kematangan seksual dan lingkungan pemeliharaan (Dunham 2004). Oleh karena itu, informasi mengenai kinerja pertumbuhan ikan gurame yang diberi perendaman hormon pertumbuhan rekombinan dengan masa pemeliharaan dalam akuarium yang berbeda sangat diperlukan. Informasi ini dapat berguna untuk merancang metode aplikasi teknologi yang tepat dalam proses kegiatan akuakultur di Indonesia khususnya ikan gurame.
Rumusan Masalah
laju pertumbuhan ikan gurame sehingga menjadi lebih cepat. Teknologi rekombinan hormon pertumbuhan (rGH) sudah lama diujicobakan oleh para peneliti di bidang peternakan dan perikanan untuk meningkatkan kinerja pertumbuhan komoditas ternak maupun ikan, namun di Indonesia masih merupakan suatu wacana teknologi baru yang memiliki keterbatasan dalam informasi dasar yang bisa mendukung pengembangan dan penerapannya.
Tujuan dan Manfaat
Tujuan penelitian ini adalah untuk mengevaluasi respons benih ikan gurame terhadap perendaman dalam hormon pertumbuhan rekombinan dan masa pemeliharaan yang berbeda di akuarium. Hasil penelitian ini diharapkan dapat memberikan informasi pendukung dalam pengembangan dan penerapan teknologi ini untuk meningkatkan laju pertumbuhan ikan gurame.
TINJAUAN PUSTAKA
Hormon Pertumbuhan (Growth Hormone, GH)
GH merupakan polipeptida rantai tunggal yang diproduksi oleh kelenjar pituitary dengan fungsi pleiotropic (memiliki banyak pengaruh) pada vertebrata. Hormon ini mempengaruhi pertumbuhan tubuh, juga berkaitan dengan reproduksi, imunitas, dan pengaturan osmoregulasi pada ikan teleost, serta berperan dalam pengaturan metabolisme melalui aktivitas lipolitik dan anabolisme protein pada vertebrata (Rousseau dan Dufour 2007). Selain itu juga meningkatkan retensi kalsium, meningkatkan massa otot, merangsang lipolisis, meningkatkan sintesis protein, merangsang pertumbuhan dari seluruh organ internal kecuali otak, berperan dalam pemenuhan homeostasi, mengurangi pengambilan glukosa oleh hati, merangsang glukoneogenesis dalam hati, berkontribusi dalam pemeliharaan dan fungsi dari islet pankreatik, dan merangsang sistem imun (Utomo 2010).
ikan tetapi juga dapat bertindak pada tingkat pituitari dan/atau tingkat hipotalamus untuk menginduksi pelepasan GH dari somatotrophs (Wong et al. 2006).
Gambar 1. Regulasi umpan balik pelepasan hormon pertumbuhan pada ikan (Wonget al. 2006)
Level GH berfluktuasi secara luas dan alamiah, tergantung pada ukuran dan umur ikan, kondisi lingkungan dan spesies. Ekspresi GH diduga meningkat bila distimulasi oleh perubahan lingkungan, stress, atau reproduksi (Dunham 2004). Suhu, kematangan seksual dan salinitas dapat menyebabkan perubahan pada level plasma GH, dan faktor-faktor ini dapat menyebabkan perubahan dua sampai lima kali lipat pada channel catfish (Tang et al. 2001). Secara umum, ekspresi GH tertinggi pada benih ikan (fingerling), menurun setengah pada ikan yang sudah dapat menerima pakan dan meningkat sampai pada level seimbang ditemukan pada benih yang lebih tua sampai permulaan musim pemijahan pada ikan dewasa. Peningkatan salinitas menstimulasi peningkatan GH pada catfish dan spesies lainnya. Level GH menjadi minimum pada catfish
Peranan Hormon Pertumbuhan dalam Metabolisme
Hormon pertumbuhan (GH) merupakan hormon pluripoten (mampu berdiferensiasi menjadi fungsi yang berbeda) yang menstimulasi proses anabolis dan katabolis. Pada ikan, GH meningkatkan pertumbuhan dengan meningkatkan nafsu makan dan konversi pakan (Markert et al. 1977, Johnsson dan Bjornsson 1994). GH menstimulasi hati untuk memproduksi dan melepaskan insulin-like growth factor I (IGF-I) ke dalam darah. Selain berpengaruh terhadap pelepasan IGF-I secara endokrin, GH juga menstimulasi produksi IGF-I lokal dan parakrin sinyal IGF-I di hati, tulang dan jaringan otot. Peningkatan pertumbuhan sebagai pengaruh dari GH sebagian dimediasi oleh IGF-I. Hal ini dapat dibuktikan, walaupun dinyatakan sebagai pengaruh langsung GH terhadap metabolisme (Björnsson et al. 2002).
Pembuktian pertama dari keterlibatan GH terhadap metabolisme lemak adalah adanya perubahan yang teramati pada komposisi tubuh tikus dari gemuk menjadi massa otot (Lee dan Schaffer 1934). GH dapat bersifat lipogenik dan lipolitik dengan mempengaruhi pleura enzim. Pengaturan metabolik oleh GH sangat kompleks dan pengaruhnya sering tergantung pada jaringan dan konteks Norrelund (2005). Dietz (1991), Albalat et al. (2005), dan Sakharova (2008) menyatakan bahwa GH memiliki peranan penting dalam pengontrolan lipolisis adipose terutama pada saat pemuasaan. GH meningkatkan rasio sintesis protein, mobilisasi asam lemak dari jaringan adipose dan pemanfaatan asam lemak sebagai sumber energi, dan menurunkan rasio pemanfaatan glukosa, semua hal tersebut berpengaruh terhadap peningkatan pertumbuhan, peningkatan protein tubuh, pemanfaatan lemak yang tersimpan dan penyimpanan karbohidrat (Guyton 1981).
Gambar 2. Diagram kontrol neuroendoktrin GH terhadap metabolisme (Chappel dan Murphy 2000)
F
Insulin-Like Growth Factor-I (IGF-I)
Sumbu growth hormone (GH)/insulin-like growth factor-I (IGF-I) telah lama diketahui memiliki peranan penting dalam pertumbuhan dan perkembangan banyak sistem organ yang berbeda di dalam tubuh. GH tidak bekerja sendiri dalam menstimulasi mitogenesis dan diferensiasi pada semua jaringan. Reseptor khusus untuk GH ditemukan pada hati dan setelah aktivasi reseptor GH, hepatosit memproduksi IGF-I. IGF-I juga diproduksi secara lokal oleh sejumlah jaringan lainnya (Daniels dan Martin 1991).
IGF-I terlibat dalam regulasi protein, lemak, karbohidrat, metabolisme mineral di dalam sel, diferensiasi dan proliferasi sel, dan pada akhirnya pertumbuhan tubuh (Moriyama et al. 2000). Aksi biologis IGF dimediasi oleh reseptor IGF-I (Gambar 3). Jaringan yang sangat beragam, seperti otak, otot, ginjal, dan usus juga memproduksi IGF-I secara lokal, walaupun hati merupakan tempat utama dalam produksi IGF (Etherton 1993). Peptida yang diproduksi secara lokal dapat bekerja secara parakrin dan autokrin.
Gambar 3. Skema umum regulasi endokrin terhadap pertumbuhan (Moriyama et al. 2000)
Reseptor transmembran memediasi aksi hormon hipotalamik, GH, dan
Teknologi Rekombinan Hormon Pertumbuhan (rGH)
Rekombinan Hormon pertumbuhan adalah protein yang berasal dari DNA rekombinan. Teknologi DNA rekombinan, kloninggen atau kloning molekular, merupakan suatu istilah yang merangkum sejumlah prosedur percobaan yang mengarah pada transfer informasi genetik (DNA) dari satu organisme ke organisme yang lain. DNA yang berasal dari organisme sumber dipotong dengan menggunakan restriction endonuclease dan diinsersikan ke dalam vektor kloning. Konstruksi vektor kloning yang telah diinsersikan DNA ini kemudian dimasukkan ke dalam sel inang target, dan sel-sel yang membawa konstruksi tersebut kemudian diidentifikasi dan ditumbuhkan. Jika diperlukan, gen yang telah diklon tersebut dapat diekspresikan (transkripsi dan translasi) di dalam sel inang, dan kemudian protein (protein rekombinan) dapat dipanen (Glick dan Pasternak 2003).Kloning dan ekspresi GH rekombinan telah berhasil didapatkan dari beberapa ikan di Indonesia antara lain ikan mas, gurame, dan kerapu kertang (Lesmana 2010).
Pemanfaatan rGH untuk menstimulasi pertumbuhan ikan telah banyak dilakukan baik melalui penyuntikan, perendaman maupun pemberian melalui pakan, dan terbukti dapat meningkatkan laju pertumbuhan ikan jika dibandingkan dengan ikan kontrol tanpa pemberian rGH (Wilson et al. 1988; Down et al. 1988, Schulte et al. 1989, Moriyama dan Kawauchi 1990, Moriyama et al. 1993, McLean et al. 1997, Jeh et al. 1998, Ben-Atia et al. 1999, Silverstein et al. 2000, Kajimura et al. 2002, Acosta et al. 2007, 2009, Lesmana 2010, Utomo 2010, Syazili 2012, Handoyo 2012, Safir 2012).
BAHAN DAN METODE Penyediaan rGH Produksi dalam Bakteri Escherichia coli
Produksi hormon pertumbuhan rekombinan dilakukan sesuai dengan metode Alimuddin et al. (2010) dan dilakukan di Laboratorium Reproduksi dan Genetika Ikan, FPIK, IPB. Pada penelitian ini digunakan bakteri E.coli BL 21 yang mengandung konstruksi pCold-1/ogGH yang dibuat oleh Lesmana (2010). Protein rekombinan yang dihasilkan adalah rGH ikan gurame (rOgGH). Koloni tunggal yang telah terinsersi vector pCold yang mengandung fragmen DNA GH dipilih dari media 2xYT-agar kemudian diinokulasi ke dalam 20 ml media LB yang mengandung 20 µ l ampisilin dan diinkubasi selama 16-18 jam pada suhu 37oC di dalam shaker. Selanjutnya dilakukan subkultur sebanyak 1% dan ditumbuhkan ke dalam 60 ml media LB yang mengandung 60 µ l ampisilin pada suhu 37oC dalam shaker, setelah 2 jam kultur E.coli diberikan kejutan suhu dingin pada suhu 15oC selama 30 menit. Ekspresi rekombinan GH kemudian diinduksi dengan isopropyl-b-D-thiogalac-Topyranoside (IPTG) sebanyak 750 µ l dan selanjutnya diinkubasi dalam shaker pada suhu 15oC. Setelah 24 jam, sel bakteri kemudian dipanen dengan sentrifugasi pada 10000 rpm selama 5 menit, dan kemudian disimpan pada suhu -80oC hingga digunakan.
Lisis dinding sel bakteri bertujuan untuk mendapatkan protein bakteri yang mengandung rGH. Lisis dilakukan secara kimiawi dengan menggunakan lisozim. Pelet bakteri hasil sentrifugasi dicuci menggunakan 1 ml TE buffer per 200 mg bakteri dan diinkubasi pada suhu 37oC selama 20 menit, disentrifugasi pada 12000 rpm (4oC) selama 1 menit dan supernatan yang terbentuk dalam tabung mikro dibuang. Kemudian ditambahkan 500 µ l larutan lisozim (10 mg dalam 1 ml buffer TE) ke dalam tabung mikro yang terdapat pelet bakteri, lalu diinkubasi pada suhu 37oC selama 20 menit, selanjutnya disentrifugasi pada 12000 rpm selama 1 menit. Supernatan dibuang dan pelet rGH yang terbentuk dicuci dengan PBS sebanyak 1 kali. Pelet yang dihasilkan pada akhir proses ini merupakan protein rGH dalam bentuk badan inklusi. Badan inklusi selanjutnya dapat digunakan untuk analisa SDS-PAGE dan digunakan untuk uji bioaktivitas. Pelet disimpan pada suhu -80oC.
Analisis Protein rGH dengan SDS-PAGE
Prinsip kerja dari teknik SDS-PAGE adalah memisahkan protein berdasarkan bobot molekulnya yang dapat dilihat melalui posisi pita yang terbentuk yang menyatakan bobot protein sampel yang dianalisa, hasil yang terbaca kemudian dicocokkan dengan bobot protein GH yang telah diketahui (sekitar 22kDa) untuk meyakinkan bahwa produksi rGH berhasil dilakukan dan siap untuk digunakan dalam perlakuan berikutnya.
Gel yang dibuat dalam PAGE terdapat 2 lapisan dalam proses SDS-PAGE yaitu running gel mengandung 4,62 ml H2O; 5,60 ml acrilamide/Bis 29:1;
3,5 ml gel buffer 1,5 M (pH 8,8); 140 µ l SDS 10%; 140 µ l APS 10%; dan 5,6 µ l TEMED, stacking gel (5%) mengandung 3,4 ml H2O; 0,83 ml acrilamide/Bis
29:1; 0,63 ml gel buffer 1,5 M (pH 6,8); 50 µl SDS 10%; 50 µl APS 10%; dan 50 µ l TEMED. Protein rGH sebanyak 1 mg ditambahkan 10 µ l PBS dan 10 µ l
loading buffer, kemudian diinkubasi pada suhu 100 oC selama 10 menit, loading buffer mengandung 1,5 M tris-HCL (pH 6,8), 2 m DDT, SDS 10%, bromophenol blue, glycerol 87% dan ddH2O, coomassie brilliant blue R-250 dan asam asetat
glasial) selama 3 jam. Lalu gel dimasukkan ke dalam de-staining solution
(ethanol, ddH2O, asam asetat glacial) selama 24 jam.
Percobaan Rancangan Percobaan
Tabel 1. Rancangan percobaan petak berjalur Lama pemeliharaan
dalam akuarium (A)
Perlakuan perendaman (B)
BSA (kontrol) rOgGH
2 minggu A1B1 A1B2
3 minggu A2B1 A2B2
4 minggu A3B1 A3B2
Untuk parameter retensi nutrien dan aktivitas enzim lipase menggunakan rancangan acak lengkap dengan mengambil salah satu kelompok “lama pemeliharaan dalam akuarium” sebagai satu rancangan percobaan. sedangkan percobaan untuk parameter ekspresi gen IGF-I dirancang tersendiri, sampel jaringan (10 ekor benih) diambil sebelum perendaman, setelah kejut salinitas, sesaat setelah perendaman, 12 jam setelah perendaman, dan 24 jam setelah perendaman. Percobaan dilakukan selama 8 minggu dengan rancangan waktu perendaman, pemeliharaan dan pengambilan sampel sebagai berikut:
Perendaman Ikan
Penelitian menggunakan larva ikan gurame yang berumur 2 hari setelah habis kuning telur dan dipuasakan selama 1 malam sebelum dilakukan perendaman. Pemuasaan dilakukan untuk meminimalkan pemanfaatan energi untuk metabolisme, sehingga ketika perlakuan diterapkan diharapkan energi hanya digunakan untuk homeostasis.
Larva ikan gurame (800 ekor/ulangan) direndam dalam media air bersalinitas 30 ppt (kejut salinitas) selama 2 menit, lalu dimasukkan ke dalam media yang mengandung NaCl 0,9%, bovine serum albumin (BSA) 0,01% dan rOgGH dengan dosis 120 µg/L; untuk kontrol BSA tanpa penambahan rOgGH. Perendaman dilakukan selama 60 menit. Selanjutnya larva dipindahkan ke dalam akuarium untuk pemeliharaan. Dosis rGH yang digunakan berdasarkan hasil penelitian Syazili (2012) dengan metode perendaman dimodifikasi dari Moriyama dan Kawauchi (1990)
Pemeliharaan Ikan dan Pengumpulan Data
Ikan dipelihara dalam akuarium selama 2 minggu, 3 minggu dan 4 minggu (kelompok perlakuan). Setelah masa pemeliharaan di akuarium dengan ukuran (100 x 60 x 60) cm3, ikan kemudian dipindahkan ke kolam pemeliharaan dan dipelihara dalam hapa berukuran (2 x 1.5 x 1) m3. Selama pemeliharaan 4 jenis pakan yang diberikan kepada ikan setelah kuning telur habis yaitu artemia, cacing tubifex, pelet halus dan pelet kecil. Pola pemberian pakan dilakukan seperti terlihat pada Gambar 4. Pemberian pakan dilakukan 3 kali sehari secara at satiation.
Gambar 5. Skema pemberian pakan pada ikan selama pemeliharaan
Evaluasi Respons Ikan Analisis Ekspresi Gen IGF-I
Analisis ini dilakukan dengan tujuan untuk melihat pengaruh perendaman dalam rOgGH terhadap ekspresi gen IGF-I, IGF-I berperan dalam sebagian besar proses pertumbuhan melalui rangsangan oleh sekresi GH. Ada empat tahap dalam melakukan analisis ekspresi gen IGF-I yaitu ekstraksi RNA, sintesis cDNA, PCR dan elektroforesis. Sampel ikan gurame dikumpulkan pada waktu sesaat, 12, 24 dan 36 jam setelah perendaman. Sampel kemudian dimasukkan ke dalam
dimasukkan ke dalam microtube yang berisi sampel. Sampel dihancurkan dengan penggerus yang telah disterilkan dengan DEPC 1%. Jika belum hancur, ditambahkan lagi 200µ isogen lalu digerus. Jika semua jaringan sampel telah hancur, selanjutnya ditambahkan 400 µ l isogen sehingga volume akhir menjadi 800 µ l. Kemudian sampel disimpan di suhu ruang selama 5 menit. Setelah itu, disentrifugasi dengan kecepatan fullspeed selama 10 menit, supernatant (lapisan bagian atas) diambil dan jangan sampai menyentuh pelet di bagian bawah. Selanjutnya ditambahkan 200 µ l chloroform (CHCl3) lalu dihomogenasi dengan
vortex selama 15 detik pada kecepatan sedang (sampai tercampur). Kemudian disimpan dalam es selama 2-3 menit. Selanjutnya disentrifugasi selama 2 menit, dan supernatan yang terbentuk dipindahkan ke tube baru yang telah berisi 400 µ l isopropanol. Setelah itu sampel dihomogenasi dengan vorteks perlahan lalu disimpan pada suhu ruang selama 5-10 menit. Selanjutnya disentrifugasi pada suhu 4oC dengan kecepatan 12000 rpm selama 15 menit. Supernatan yang terbentuk dibuang, lalu ditambahkan 1ml ethanol 70% dingin tanpa dihomogenasi. Sampel kembali disentrifugasi pada suhu 4oC dengan kecepatan 12000 rpm selama 15 menit dan supernatan yang terbentuk dibuang, lalu pelet dikering udarakan, setelah kering ditambahkan DEPC 20-50 µl. Konsentrasi larutan RNA kemudian diukur dengan menggunakan alat Gene Quant.
Prosedur selanjutnya adalah sintesis cDNA menggunakan sampel RNA dengan konsentrasi 3 µg/30 µ l yang dimasukkan ke dalam microtube 600 µ l. Kemudian dihomogenasi dengan vortex pelan dan dipanaskan pada suhu 65oC selama 10 menit. Setelah itu disimpan dalam es selama 2 menit. Selanjutnya sampel RNA sebanyak 30 µ ldimasukkan ke dalam tube “Ready-to-go-you-prime first-strand beads” dan ditambahkan 3 µl primer 3-RACE Vect. [1 µg/3 µl] dan dibiarkan selama 1 menit. Sampel kemudian divortex pelan lalu diinkubasi pada suhu 37oC selama 1 jam. Kemudian hasil cDNA (33 µ l) ditambahkan dengan 50 µ l SDW steril. Hasil sintesis cDNA kemudian diamplifikasi dengan PCR dan dielektroforesis dengan agarosa 1% untuk melihat ekspresi gen IGF-I. Pengukuran level ekspresi gen IGF-1 dilakukan dengan mengukur ketebalan pita DNA hasil elektroforesis menggunakan software UN-SCAN-IT gel 6.1. Hasil pengukuran level ekspresi gen IGF-1 dibandingkan dengan gen β-aktin yang berfungsi sebagai kontrol loading RNA.
Analisis Aktivitas Enzim Lipase
Dietz (1991), Albalat et al. (2005), dan Sakharova (2008) menyatakan bahwa GH memiliki peranan penting dalam pengontrolan lipolisis adipose. Salah satu enzim yang bekerja saat lipolisis adalah enzim lipase. Sehingga analisis enzim lipase ini dipandang perlu dilakukan untuk melihat pengaruh rGH terhadap lipolisis/metabolisme lemak, yang selanjutnya hasil analisa ini diharapkan dapat sebanding dengan nilai retensi nutrien lemak tubuh ikan setelah masa pemeliharaan berakhir.
disentrifugasi, dan 4,0 ml supernatan kemudian dicampur dengan 1,0 ml 5% copper asetat (m/v; pH 6,1). Absorban dari supernatan kemudian dicatat pada panjang gelombang 710 nm untuk mengukur jumlah asam lemak yang dihasilkan, dengan menggunakan asam oleat sebagai referensi standar. Satu unit dari aktivitas spesifik ditentukan/ditetapkan sebagai enzim yang dibutuhkan untuk menghasilkan 1 µ mol asam lemak per menit per milligram dari larutan enzim pada suhu 37oC (U/mg protein).
Laju Pertumbuhan Harian
Laju pertumbuhan harian merupakan persentase pertumbuhan bobot ikan setiap harinya, dihitung dengan menggunakan rumus:
Wt = Wo (1 + 0,01α)t
Keterangan : Wt = bobot rata-rata individu pada waktu t (g)
Wo = bobot rata-rata individu pada waktu awal (g) α = laju pertumbuhan harian individu (%) t = waktu pemeliharaan (hari)
Efisiensi Pakan (%)
Nilai efisiensi pakan merupakan persentase jumlah pakan yang dimanfaatkan oleh ikan untuk pertumbuhan bobot tubuh, dihitung berdasarkan persamaan berikut:
Keterangan : Wt = bobot rata-rata individu pada waktu t (g)
Wo = bobot rata-rata individu pada waktu awal (g)
D = bobot total ikan yang mati selama pemeliharaan (g) F = jumlah pakan yang diberikan (g)
Retensi nutrisi
Retensi nutrien merupakan persentase jumlah nutrien akhir yang tersimpan di dalam tubuh ikan, dihitung berdasarkan formula sebagai berikut:
Keterangan: Nutrien = Protein (g), Lemak (g), Karbohidrat (g)
Derajat Kelangsungan Hidup
Derajat kelangsungan hidup (KH) merupakan persentase jumlah ikan yang hidup di akhir pemeliharaan dibandingkan dengan jumlah ikan pada awal pemeliharaan, dihitung dengan rumus:
Analisis Data
Data yang diperoleh dianalisis dengan menggunakan sidik ragam pada tingkat kepercayaan 95%, dan dilanjutkan dengan uji Duncan untuk melihat pengaruh antar perlakuan terhadap masing-masing parameter yang diuji. Analisis data menggunakan piranti lunak SPSS ver. 17.00 dan Microsoft Excel 2007.
HASIL DAN PEMBAHASAN
Pertumbuhan hewan ditentukan oleh tingkat dan durasi proses pertumbuhan, yang sebagian besar dikontrol secara genetik pada vertebrata. Pertumbuhan hewan juga sangat dipengaruhi oleh faktor lingkungan dan nutrisi. Informasi dari kedua rangsangan baik itu kondisi eksternal maupun internal diproses, dipadukan dan ditanggapi oleh otak untuk modifikasi pertumbuhan yang sesuai melalui jalur mediasi secara hormonal. Pusat tahapan dari jalur endokrin ini adalah sumbu hormon pertumbuhan (growth hormone, GH) dan insulin-like growth factor-I (IGF-I) (Duan 1998).
Pemanfaatan rOgGH dalam penelitian ini dimaksudkan agar hormon rekombinan langsung masuk ke dalam aliran darah sehingga dapat langsung mempengaruhi kinerja pertumbuhan ikan gurame. Dalam hal ini terjadi pemotongan jalur, dimana perangsangan pertumbuhan tidak menunggu sekresi GH dari pituitary (Gambar 1), namun langsung melalui pemanfaatan rOgGH yang ada dalam media perendaman yang diserap (diduga melalui insang dan kulit) masuk ke dalam aliran darah kemudian diedarkan ke jaringan target dan diikat oleh reseptor GH. Aktivasi reseptor GH akan merangsang hati untuk memproduksi IGF-I (Gambar 3) yang berperan penting dalam regulasi pertumbuhan (Ohlsson et al. 2009).
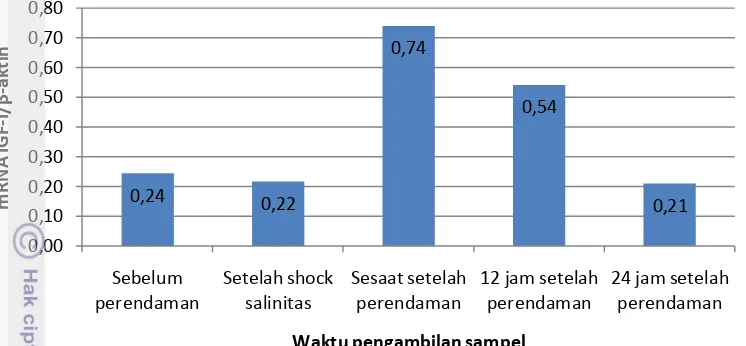
Ekspresi Gen IGF-I
Gambar 6. Level ekspresi IGF-I/β-aktin benih gurame.
Terjadinya peningkatan IGF-I setelah diberikan perlakuan rGH juga dilaporkan oleh Pedroso et al. (2009) yang melakukan percobaan pada ikan
yellowtail (Seriola quinguerradiata) secara in vivo melalui penyuntikan rGH ikan salmon (rsGH). Pemberian GH salmon pada ikan salmon melalui penyuntikan juga meningkatkan plasma IGF-I sampai puncaknya pada 24 jam setelah pemberian dan tetap tinggi selama 78 jam, ketika pemberian GH dilakukan secara oral peningkatan plasma IGF-I terjadi secara signifikan setelah 48 jam dan tetap tinggi sampai 96 jam (Moriyama 1995). Demikian halnya pada ikan rainbow trout
(Oncorhynchus mykiss) yang disuntik rGH bovine (rbGH) (Biga et al. 2005) juga memberikan peningkatan level plasma IGF-I setelah 12 jam setelah penyuntikan. Sejumlah penelitian lain yang telah dilakukan juga menyatakan hal yang serupa bahwa pemberian GH atau rGH dapat meningkatkan level plasma IGF-I (Mathews et al. 1986, Moriyama et al. 2000, Björnsson et al. 2002, Woelfle et al. 2003, Volkoff et al. 2005). IGF-I diketahui berperan dalam regulasi protein, lemak, karbohidrat, metabolisme mineral dalam sel, diferensiasi dan proliferasi sel, dan pada akhirnya pertumbuhan tubuh (Moriyama et al. 2000). Sehingga apabila telah terbukti perendaman dalam rOgGH dapat meningkatkan level ekspresi IGF-I, maka selanjutnya dapat dinyatakan rOgGH ini berpotensi untuk meningkatkan laju pertumbuhan ikan gurame.
Aktivitas Enzim Lipase
Pendapat pada umumnya menyatakan bahwa GH terlibat dalam metabolisme lemak sehingga terjadi penurunan massa lemak dalam tubuh (Lee dan Schaffer 1934, Dietz 1991, Kersten 2001, Albalat et al. 2005, Sakharova 2008). Namun hasil pengamatan terhadap aktivitas enzim lipase (Tabel 3) menyatakan hal yang sebaliknya dimana aktivitas enzim lipase pada ikan yang telah direndam dalam rOgGH dan kontrol BSA tidak memiliki perbedaan yang signifikan yaitu masing-masing 0,055 unit/menit.g bobot tubuh dan 0,053 unit/menit.g bobot tubuh. Hal ini diduga terjadi karena pada saat pengambilan sampel untuk analisis ikan tidak dipuasakan terlebih dahulu. Dietz (1991), Albalat
0,24 0,22 0,74 0,54 0,21 0,00 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 Sebelum perendaman Setelah shock salinitas Sesaat setelah perendaman
12 jam setelah perendaman
24 jam setelah perendaman m R N A IG F -I/ β -a k ti n
et al. (2005) dan Sakharova (2008) menyatakan bahwa GH berperan penting dalam lipolisis terutama pada saat pemuasaan.
Tabel 3. Aktivitas enzim lipase.
Perlakuan Aktivitas unit/menit.g bobot tubuh
rGH.Og 0,055
BSA 0,053
Pemuasaan menyebabkan terjadinya penurunan konsentrasi plasma IGF-I (de Azevedo figueiredo et al. 2007), yang secara langsung akan berpengaruh terhadap peningkatan sekresi GH (Small et al. 2002) melalui loop umpan balik (Gambar 1) . Melalui sifat lipolitiknya, GH kemudian terlibat dalam lipolisis terutama pada jaringan adipose. Hasil penelitian Albalat et al. (2005) menunjukkan adanya perbedaan lipolisis yang signifikan antara ikan yang dipuasakan dan tidak dipuasakan, dinyatakan bahwa ikan yang dipuasakan memiliki konsentrasi asam lemak bebas dalam tubuh yang lebih tinggi jika dibandingkan dengan ikan yang tidak dipuasakan. Kandungan asam lemak bebas dalam tubuh menunjukkan tingkat aktivitas lipolisis yang terjadi.
Retensi Nutrien
Tabel 4. Retensi nutrien
Parameter (%) Perlakuan
BSA (kontrol) rOgGH P
Retensi lemak 6,52 ± 0,38 15,92 ± 0,37* 0,00
Retensi protein 19,75 ± 1,00 23,58 ± 2,33* 0,05
Retensi karbohidrat 10,63 ± 0,92* 2,86 ± 0,21 0,00
Ket: P < 0,05 menyatakan perlakuan memberikan pengaruh yang berbeda nyata, (*) menunjukkan nilai yang lebih besar.
Melalui pendekatan teori yang dihasilkan oleh Leggatt et al. (2009) dalam penelitiannya mengenai pengaruh transgenesis GH terhadap kapasitas metabolisme karbohidrat, lemak dan protein untuk produksi energi pada coho
salmon (Oncorhynchus kisutch), diasumsikan mekanisme GH dalam mempengaruhi metabolisme nutrien adalah sama (hanya jalur insersi/pemberian ke dalam tubuh yang berbeda), yang menyatakan bahwa salmon GH transgenik mengarahkan jalur metabolismenya untuk lebih memanfaatkan karbohidrat dalam menghasilkan energi dan sintesis lemak, serta meningkatkan pemanfaatan lemak dan protein untuk mempertahankan peningkatan laju pertumbuhan. Ohlsson et al. (2009) menyatakan bahwa IGF-I terlibat dalam metabolisme karbohidrat, diduga dengan cara menginduksi pengaruh insulin-like dalam penyerapan glukosa secara langsung pada jaringan yang memiliki reseptor IGF-I. Pendapat lain yang juga dikemukakan adalah diduga IGF-I meningkatkan sensitivitas insulin dengan cara menekan pelepasan GH, melalui istilah yang dikenal sebagai umpan balik negatif (negative feedback) dari GH, namun hal ini masih belum diketahui dengan jelas.
Glukosa merupakan senyawaan penting dalam proses lipogenesis atau sintesis lemak (Kersten 2001), sehingga apabila konsentrasi metabolit glukosa dalam tubuh tinggi maka sintesis lemak pun akan meningkat dan hasil selanjutnya adalah lebih banyak lemak yang diretensi dalam tubuh ikan. Dari hasil pengamatan terhadap nilai retensi nutrien pada Tabel 4. terlihat ikan yang direndam dalam rOgGH memiliki nilai retensi lemak dan protein yang lebih tinggi dan retensi karbohidrat yang lebih rendah jika dibandingkan dengan kontrol BSA, dengan kata lain telah terjadi protein dan lemak “sparing effect” sehingga ikan gurame lebih banyak memanfaatkan karbohidrat sebagai sumber energi. Hal ini diduga terjadi karena ikan gurame merupakan ikan yang dikenal cenderung herbivor sehingga mampu mencerna karbohidrat dengan lebih baik.
Efisiensi Pakan
Metabolisme yang berjalan baik sudah tentu akan berpengaruh terhadap nilai efisiensi pakan yang dikonsumsi oleh ikan. Nilai efisiensi pakan menunjukkan persentasi pakan yang dimanfaatkan oleh ikan untuk pertumbuhan (diwakili oleh penambahan bobot tubuh) berbanding dengan jumlah pakan yang dikonsumsi.
cacing, nilai efisiensi pakan yang didapatkan untuk ikan yang direndam dalam rOgGH adalah 14,8±5,6% dan ikan kontrol BSA adalah 12,7±5,0%. Demikian juga halnya dengan pakan pelet halus/crumble masing-masing 51,6±17,8% dan 41,9±13,6%, serta pelet kecil berukuran sekitar 2mm adalah 66,8±9,0% dan 54,8±10,0%. Perlakuan yang memberikan pengaruh yang signifikan adalah lama pemeliharaan dalam akuarium, terlihat ikan yang dipelihara selama 2 minggu dalam akuarium memiliki nilai efisiensi pakan yang tertinggi untuk pakan cacing dan pelet halus/crumble yaitu sebesar 17,7±2,8% dan 60,5±7% jika dibandingkan dengan ikan yang dipelihara selama 3 dan 4 minggu dalam akuarium dengan nilai efisiensi yang didapat masing-masing sebesar 15,6±2,1% dan 7,9±4,4% untuk pakan cacing serta 30,7±5,0% dan 49,0±16,5% untuk pakan pelet halus/crumble. Sedangkan untuk pakan pelet berukuran sekitar 2mm ketiga perlakuan lama perendaman dalam akuarium tidak memberikan pengaruh yang signifikan (P > 0,05).
Tabel 5. Nilai rataan efisiensi pakan (cacing, pelet halus/crumble dan pelet berukuran sekitar 2mm; %)
Jenis Pakan Lama
pemeliharaan dalam akuarium
Perlakuan perendaman
BSA (kontrol) rOgGH A
Cacing 2 minggu 16,8±4,0 18,7±3,2 17,7±2,8b
3 minggu 14,8±0,9 16,4±2,9 15,6±2,1b
4 minggu 6,6±2,3 9,3±6,1 7,9±4,4a
B 12,7±5,0a 14,8±5,6a
Pelet
halus/crumble
2 minggu 56,9±3,9 64,1±8,1 60,5±7,0b 3 minggu 28,6±6,8 32,7±1,9 30,7±5,0a 4 minggu 40,1±8,6 57,8±19,1 49,0±16,5b
B 41,9±13,6a 51,6±17,8b
Pelet berukuran sekitar 2mm
2 minggu 56,6±2,6 69,0±10,3 62,8±9,5a 3 minggu 57,7±15,8 66,0±3,3 61,9±11,2a 4 minggu 50,2±8,0 65,4±13,9 57,8±13,6a
B 54,8±10,0a 66,8±9,0a
Ket: A merupakan nilai rataan dari faktor lama pemeliharaan dalam akuarium, B merupakan
nilai rataan dari faktor perlakuan perendaman, huruf yang berbeda pada kolom dan baris yang sama menunjukkan adanya pengaruh perlakuan terhadap parameter uji (P<0.05)
laju pertumbuhan ikan dengan cara memperbaiki kinerja metabolisme nutrien dalam tubuh ikan dan juga meningkatkan komsumsi pakan. Peningkatan konsumsi pakan ini berkaitan dengan semakin meningkatnya energi yang diperlukan untuk menunjang peningkatan laju pertumbuhan yang distimulasi oleh pemberian rGH. Pertumbuhan selain didukung oleh faktor internal (genetis, yang berkaitan dengan kinerja fisiologi dalam tubuh) juga didukung oleh faktor eksternal berupa pakan dan lingkungan yang berkualitas sehingga ikan dapat tumbuh maksimal. Pemberian rGH dapat terlihat tidak memberikan perbedaan yang nyata jika dibandingkan dengan ikan kontrol yang hanya direndam dalam BSA bila faktor internal, dalam hal ini konsentrasi hormon pertumbuhan, telah diperbaiki namun tidak didukung oleh ketersediaan pakan yang memadai untuk memenuhi jumlah energi yang dibutuhkan dalam meningkatkan pertumbuhan.
Lebih lanjut, pada tabel hasil yang sama (Tabel 5) terlihat perlakuan “lama pemeliharaan dalam akuarium” memberikan pengaruh yang signifikan. Benih ikan yang dipelihara selama 2 minggu di dalam akuarium memiliki nilai efisiensi pakan (cacing dan pelet halus) yang lebih tinggi jika dibandingkan dengan benih ikan yang dipelihara selama 3 dan 4 minggu. Pemeliharaan dalam akuarium memberikan keuntungan berupa lingkungan pemeliharaan yang dapat dikontrol. Namun, di lain pihak juga memiliki kekurangan dimana ikan sangat bergantung terhadap pemberian pakan tanpa adanya makanan alami sebagai makanan tambahan pendamping makanan utama. Hal ini dapat digunakan sebagai penjelasan mengapa pada ikan yang hanya dipelihara selama 2 minggu di dalam akuarium memiiliki nilai efisiensi pakan yang lebih tinggi terutama pada saat masih mengkonsumsi cacing dan pelet halus pada masa awal pemeliharaan, karena ikan sudah lebih dahulu dipindahkan ke kolam sehingga ikan gurame dapat mengkonsumsi pakan alami lain yang ada di kolam selain cacing yang diberikan sebagai pakan utama.
Laju Pertumbuhan
Tabel 6. Nilai rataan laju pertumbuhan (%) benih ikan gurame yang diberi perlakuan perendaman (rOgGH dan BSA) dan lama pemeliharaan dalam akuarium yang berbeda
Lama pemeliharaan dalam akuarium
Perlakuan perendaman
BSA (kontrol) rOgGH A
2 minggu 8,6±0,1 8,9±0,1 8,7±0,2c
3 minggu 8,3±0,0 8,4±0,0 8,3±0,1a
4 minggu 8,2±0,4 9,0±0,4 8,6±0,5b
B 8,4±0,3a 8,7±0,3a
Ket: A merupakan nilai rataan dari faktor lama pemeliharaan dalam akuarium, B merupakan
nilai rataan dari faktor perlakuan perendaman, huruf yang berbeda pada kolom dan baris yang sama menunjukkan adanya pengaruh perlakuan terhadap parameter uji (P<0,05)
Hasil yang tidak berbeda (P > 0,05) antara ikan yang direndam dalam rOgGH dan ikan kontrol-BSA ini diduga terjadi karena seperti yang telah dijelaskan pada hasil penelitian mengenai efisiensi pakan pada Tabel 5, telah diketahui bahwa peningkatan pertumbuhan juga dipengaruhi oleh faktor eksternal berupa ketersediaan dan kualitas pakan yang diberikan yang seharusnya disesuaikan dengan kebutuhan ikan untuk meningkatkan laju pertumbuhannya.
Lama pemeliharaan dalam akuarium terlihat memberikan pengaruh yang signifikan terhadap laju pertumbuhan ikan,terlihat kelompok ikan yang dipelihara selama 2 minggu dalam akuarium memiliki laju pertumbuhan yang lebih cepat jika dibandingkan dengan kelompok ikan yang dipelihara selama 3 dan 4 minggu. Hal ini diduga terjadi karena ikan yang lebih cepat dipindahkan ke kolam memiliki waktu yang lebih lama untuk dapat beradaptasi dengan lingkungan kolam sehingga ikan sudah mampu mengalihkan konsumsi energi untuk mempertahankan kondisi tubuh dari perubahan lingkungan ke penyimpanan energi untuk pertumbuhan.
Selain karena jumlah pakan yang tidak mendukung untuk percepatan laju pertumbuhan, diduga faktor kualitas air pemeliharaan terutama di kolam tidak mendukung (tidak optimum) untuk menghasilkan pertumbuhan yang maksimum. Pada saat penelitian tidak dilakukan pengukuran kualitas air media pemeliharaan, namun berdasarkan pengamatan secara langsung ketika pemeliharaan di kolam terlihat volume air yang ada pada saat itu sedikit.Keterbatasan volume air menyebabkan tidak dapat dilakukan pergantian air secara berkala untuk mempertahankan kualitas air media pemeliharaan. Pergantian air diperlukan untuk membuang sisa-sisa metabolit dan sisa-sisa pakan yang tidak termakan oleh ikan.Hal ini terjadi karena penelitian dilakukan pada musim kemarau.
Kelangsungan Hidup
sebesar 58,9±17,9% dan 57,9±14,6%. Sedangkan dari tabel hasil yang sama (Tabel 7) terlihat lama pemeliharaan dalam akuarium memberikan pengaruh yang signifikan (P < 0,05) dengan nilai KH tertinggi terdapat pada ikan yang dipelihara selama 2 minggu dalam akuarium yaitu sebesar 75,5±10,2% jika dibandingkan dengan ikan yang dipelihara selama 3 dan 4 minggu dengan nilai KH sebesar 55,4±5,8% dan 44,4±11,0%.
Tabel 7. Nilai rataan kelangsungan hidup benih ikan gurame yang diberi perlakuan perendaman (rOgGH dan BSA) dan lama pemeliharaan dalam akuarium yang berbeda
Lama
pemeliharaan dalam akuarium
Perlakuan perendaman
BSA rGHOg A
2 minggu 75,0±9,9 76,1±12,6 75,5±10,2b
3 minggu 53,8±4,5 57±7,4 55,4±5,8a
4 minggu 45,1±5,7 43,7±16,4 44,4±11,0a
B 57,9±14,6a 58,9±17,9a
Ket: A merupakan nilai rataan dari faktor lama pemeliharaan dalam akuarium, B merupakan
nilai rataan dari faktor perlakuan perendaman, huruf yang berbeda pada kolom dan baris yang sama menunjukkan adanya pengaruh perlakuan terhadap parameter uji (P<0,05).
Selama pemeliharaan ikan baik itu di akuarium maupun di kolam terjadi banyak kematian pada ikan yang dipelihara. Terutama pada saat ikan memasuki usia 2 minggu setelah perendaman dan ketika ikan mulai diberikan pakan cacing, Hal ini diduga terjadi karena ikan diberi pakan cacing yang didapat dari petani berasal dari parit dan selokan,diketahui cacing dapat berperan sebagai inang beberapa parasit, sehingga terjadipenularan penyakit pada ikan danmenyebabkan banyak ikan yang sakit kemudian mengalami kematian.
Hasil pada Tabel 7 memperlihatkan nilai derajat kelangsungan hidup yang lebih tinggi pada kelompok ikan yang dipelihara selama 2 minggu di dalam akuarium jika dibandingkan dengan kelompok 3 dan 4 minggu.Pemeliharaan dalam akuarium memiliki kelemahan yaitu penularan penyakit yang lebih cepat jika dibandingkan dengan pemeliharaan di kolam. Hal ini dapat terjadi berkaitan dengan volume air yang ada, dimana dalam akuarium volume air lebih sedikit sehingga kelimpahanmikroorganisme yang bersifat parasit bagi ikan lebih tinggi jika dibandingkan dengan lingkungan kolam dan menyebabkan peluang ikan tertular penyakit lebih tinggi jika dipelihara di dalam akuarium.
Efektivitas Aplikasi rOgGH melalui Metode Perendaman dalam Meningkatkan Laju Pertumbuhan Ikan Gurame
Untuk lebih memperjelas potensi rGH dalam meningkatkan laju pertumbuhan ikan pada kegiatan budidaya diperlukan kajian-kajian yang lebih dalam mengenai faktor-faktor pendukung dalam optimasi pemanfaatan teknologi ini, antara lain: metode pemberian hormon, dosis hormon yang efektif, regimen pemberian hormon, kebutuhan nutrisi untuk mendukung pengaruh dari pemberian hormon terhadap laju metabolisme, pengaruh dari faktor lingkungan, dan pengaruh kronik dan akut dari pemberian rGH.
Dari hasil penelitian yang telah diperoleh terlihat bahwa rOgGH dapat diaplikasikan untuk meningkatkan laju pertumbuhan ikan gurame jika didasarkan pada kemampuan rOgGH untuk meningkatkan ekspresi IGF-I serta meningkatkan nilai retensi nutrien dalam tubuh ikan gurame. Peningkatan ekspresi IGF-I menunjukkan bahwa rOgGH terbukti dapat masuk ke dalam sistem peredaran darah ikan melalui metode perendaman, lalu terikat dengan reseptor GH dalam tubuh yang kemudian menginduksi produksi IGF-I. IGF-I inilah yang bertanggung jawab dalam serangkaian reaksi metabolisme yang penting untuk menunjang laju pertumbuhan tubuh. Nilai retensi nutrien yang terlihat pada Tabel 4 menunjukkan bahwa ikan gurame yang direndam dalam rOgGH dosis 120 mg/L selama 1 jam pada usia 2 hari setelah habis kuning telur mampu mengarahkan sistem metabolismenya untuk lebih memanfaatkan karbohidrat sebagai sumber energi dan mengalihkan pemanfaatan lemak dan protein untuk pertumbuhan.
Hasil yang tidak memuaskan dalam mempercepat laju pertumbuhan pada penelitian ini diyakini terjadi bukan karena kegagalan dari rOgGH untuk mempercepat laju pertumbuhan namun diduga disebabkan oleh faktor eksternal seperti: ketersediaan pakan yang tidak memadai/mencukupi untuk menunjang percepatan laju pertumbuhan dan juga karena lingkungan pemeliharaan yang kurang optimal untuk mendukung potensi teknologi ini.
SIMPULAN DAN SARAN Simpulan
Pemberian rOgGH pada benih ikan gurame melalui perendaman dengan dosis 120 mg/L sebanyak 1 kali di awal pemeliharaan dapat meningkatkan ekspresi IGF-I dan mengarahkan sistem metabolisme untuk lebih memanfaatkan karbohidrat sebagai sumber energi sehingga lebih banyak lemak dan protein yang disimpan. Dari percobaan yang sama juga dapat disimpulkan bahwa ikan gurame sudah mampu dipindahkan ke kolam sejak umur 2 minggu setelah perendaman (16 hari setelah habis kuning telur) dan dapat beradaptasi terhadap pemaparan yang lebih cepat pada lingkungan kolam yang tidak terkontrol sehingga mampu memberikan hasil nilai derajat kelangsungan hidup di atas 70%.
Saran
DAFTAR PUSTAKA
Acosta J, Morales R, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates of the growth of tilapia.
Biotechnology Letter 29:1671-1676.
Acosta J, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinéz E, Valdés J, Borroto C, Besada V, Sánchez A, Herrera F. 2009. Tilapia somatotropin polypeptides: potent enhancer of fish growth and innate immunity,
Biotecnología Aplicada 26:267-272.
Albalat A, Gómez-Requeni P, Rojas P, Médale F, Kaushik S, Vianen GJ, Van den Thillart G, Gutiérrez J, Pérez-Sánchez J, Navarro I. 2005. Nutritional and hormonal control of lipolysis in isolated gilthead seabream (Sparus aurata) adipocytes. American Journal of Physiology 289:R259-65.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faizal I. 2010. Production and bioactivity potential of three recombinant hormones of farmed fish.
Indonesian Aquaculture Journal 5:11-17.
Ben-Atia I, Fine M, Tandler A, Funkenstein B, Maurice S, Cavari B, Gertler A. 1999. Preparation of recombinant gilthead seabream (Sparus aurata) growth hormone and its use for stimulation of larvae growth by oral administration. General and Comparative Endocrinology 113:155-164.
Biga PR, Peterson BC, Schelling GT, Hardy RW, Cain KD, Overturf K, Ott T. 2005. Bovine growth hormone treatment increased igf-i in circulation and induced the production of a specific immune response in rainbow trout (Oncorhynchus mykiss). Aquaculture 246:437-445.
Björnsson BTH, Johansson V, Benedet S, Einarsdottir IE, Hildahl J, Agustsson T, Jönsson E. 2002. Growth hormone endocrinology of salmonids: regulatory mechanisms and mode of action. Fish Physiology and Biochemistry 27:227-242.
Chappel S, Murphy W. 2000. Growth Hormone. DOI 10.1006:251-265.
Daniels G, Martin JB. 1991. Neuroendocrine regulation and diseases of the anterior pituitary and hypothalamus. New Yoek (US). Principle of Internal Medicine 1660-1664.
de Azevedo Figueiredo M, Lanes CFC, Almeida DV, Proietti MC, Marins LF. 2007. The effect of gh overexpression on ghr and igf-i gene regulation in different genotypes of gh-transgenic zebrafish. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics 2: 228– 233.
Dietz J, Schwartz J. 1991. Growth hormone alters lipolysis and hormone-sensitive lipase activity in 3T3-F442A adipocytes. Metabolism 40:800-806.
(Oncorhynchus kisutch) acclimated to seawater and ambient winter conditions. Aquaculture 68:141-155.
Duan C. 1998. Nutritional and developmental regulation of insulin-like growth factors in fish. American Society for Nutritional Sciences: 306-314.
Dunham RA. 2004. Aquaculture and fisheries biotechnology: Genetic approaches. CABI Publishing.
Etherton TD, Kris-Etherteon PM, Mills EW. 1993. Recombinant bovine and porchine somatotropine: Safety and benefits of these biotechnologies.
American Dietetic Association 93:177-180.
Farbridge KJ, Leatherland JF. 1992. Temporal changes in plasma thyroid hormone, growth hormone and free fatty acid concentration, and hepatic 5’-monodeiodinase activity, lipid and protein content during chronic fasting and refeeding in rainbow throut (Oncorhynchus mykiss). Fish Physiology and Biochemistry 10:245-257.
Glick BR, Pasternak JJ. 2003. Molecular Biotechnology, Principles and Aplications of Recombinant DNA: Third Edition. ASM Press.
Handayani S. 2006. Studi efisiensi pemanfaatan karbohidrat pakan bagi pertumbuhan ikan gurame (Osphronemus goramy Lac) sejalan dengan perubahan enzim pencernaan dan insulin [tesis]. Bogor (ID): Institut Pertanian Bogor.
Handoyo B. Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral [tesis]. Bogor (ID): Institut Pertanian Bogor.
Halver JE, Hardy RW. 2002. Fish Nutrition: Third Edition. Academic Press.
Jeh HS, Kim CH, Lee HK, Han K. 1998. Recombinant flounder growth hormone from Escherichia coli: overexpression, efficient recovery, and growth-promoting effect on juvenile flounder by oral administration.
Biotecnology 60:183-193.
Ji H, Sun HT, Xiong DM. 2011. Studies on activity, distribution, and zymogram of protease, α-amylase, and lipase in the paddlefish Polyodon spathula.
Fish Physiology and Biochemistry 38:603-613.
Johnsson JI, Björnsson BTH. 1994. Growth hormone increases growth rate, appetite and dominance in juvenile rainbow trout, Oncorhynchus mykiss.
Animal Behavior 48:177-186.
Juskevich JC, Guyer CG. 1990. Bovine growth hormone: Human food safety evaluation. Science 249:875-884.
Kajimura S, Uchida K, Yada T, Riley LG, Byatt JC, Collier RJ, Aida K, Hirano T, Grau EG. 2002. Stimulation of insulin-like growth factor-I production by recombinant bovine growth hormone in Mozambique tilapia,
Kersten S. 2001. Mechanisms of Nutritional and Hormonal Regulation of Lipogenesis; Review. European Molecular Biology Organization
(EMBO) Report 2:282-286.
Leedom TA, Uchida K, Yada T, Richman III NH, Byatt JC, Collier RJ, Hirano T, Grau EG. 2002. Recombinant bovine growth hormone treatment of tilapia: growth response, metabolic clearance, receptor binding and immunoglobulin production. Aquaculture 207:359-380.
Lee MO, Schaffer NK. 1934. Anterior pituitary growth hormone and the composition of growth. Journal Nutrition 7:337-363.
Leggatt RA, Raven PA, Mommsen TP, Sakhrani D, Higgs D, Devlin RH. 2009. Growth hormone transgenesis influences carbohydrate, lipid and protein metabolism capacity for energy production in coho salmon (Oncorhynchus kisutch). Comparative Biochemistry and Physiology Part B 154:121-133.
Lesmana I. 2010. Produksi dan bioaktivitas protein rekombinan hormon pertumbuhan dari tiga jenis ikan budidaya [tesis]. Bogor (ID): Institut Pertanian Bogor.
Markert JR, Higgs DA, Dye HM, MacQuarrie DW. 1977. Influence of bovine growth hormone on growth rate, appetite, and food conversion of yearling coho salmon (Oncorhynchus kisutch) fed two diets of different composition. Canadian Journal of Zoology 55:74-83.
Mathews LS, Norstedt G, Palmiter RD. 1986. Regulation of insulin-like growth factor i gene expression by growth hormone (little mice/transcriptional control). Proc. Nat., Acal. Sci. USA 83:9343-9347.
McLean E, Devlin RH, Byatt JC, Clarke WC, Donaldson EM. 1997. Impact of a controlled release formulation of recombinant bovine growth hormone upon growth and seawater adaptation in coho (Oncorhynchus kisutch) and Chinook (Oncorhynchus tshawytscha) salmon. Aquaculture 156:113-128.
Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by immersion in recombinant salmon growth hormone. Nippon Suisan Gakkaishi 56:31-34.
Moriyama S, Yamamoto H, Sugimoto S, Abe T, Hirano T, Kawauchi H. 1993. Oral administration of recombinant salmon growth hormone to rainbow trout, Oncorhynchus mykiss. Aquaculture 112:99-106.
Moriyama S. Increased plasma insulin-like growth factor-i (igf-i) following oral and intraperiponeal administration of growth hormone to rainbow trout
Oncorhynchus mykiss. Growth Regulation 5:164-167.
Moriyama S, Ayson FG, Kawauchi H. 2000. Growth regulation by insulin-like growth factor-I in fish. Biosciences, Biotechnology, and Biochemical
Norrelund H. 2005. The metabolic role of growth hormone in humans with particular reference to fasting. Growth Hormone and IGF Research
15:95-122.
Ohlsson C, Mohan S, Sjögren K, Tivesten A, Isgaard J, Isaksson O, Jansson JO, Svensson J. 2009. The role of liver-derives insulin-like growth factor-I.
Endocrine Review 30:494-535.
Pecl GT, Moltschaniwskyj NA. 1999. Somatic growth processes: how are they altered in captivity?. Proceeding on the Royal Society B: Biological Sciences 266: 1133-1139.
Pedroso FL, Fukada H, Masumoto T. 2009. In vivo and in vitro effect of recombinant salmon growth hormone treatment on IGF-I and IGFbps in yellowtail Seriola Quinqueradiata. Fisheries Science 75: 887–894
Pérez-sánchez J. 2000. The involvement of growth hormone in growth regulation, energy homeostasis and immune function in the gilthead sea bream (Sparus aurata): a short review. Fish Physiology and Biochemistry
22:135-144.
Peterson BC, Small BC, Bosworth BG. 2004. Effects of bovine growth hormone (PosilacR) on growth performance, body composition, and IGFBPs in two strains of channel catfish. Aquaculture 232:651-663.
Pickering AD, Pottinger TG, Sumpter JP, Carragher JF, Le Bail PY. 1991. Effects of acute and chronic stress on the levels of circulating growth hormone in the rainbow throut, Oncorhyncus mykiss. General and Comparative Endocrinology 83:86-93.
Raven PA, Sakhrani D, Beckman B, Neregard L, Sundström LF, Björnsson B Th, Devlin RH. 2012. Growth and endocrine effects of recombinant bovine growth hormone treatment in non-transgenic and growth hormone transgenic coho salmon. General and Comparative Endocrinology
177:143-152.
Rousseau K, Dufour S. 2007. Comparative aspects of GH and metabolic regulation in lower vertebrates: mini review. Neuroendocrinology
86:165-74.
Safir M. 2012. Respons benih ikan gurame (Osphronemus goramy) yang diberi hormone pertumbuhan rekombinan melalui oral pada dosis berbeda [tesis]. Bogor (ID): Institut Pertanian Bogor.
Sakharova AA, Horowitz JF, Surya S, Goldenberg N, Harber MP, Symons K, Barkan A. 2008. Role of growth hormone in regulating lipolysis, proteolysis, and hepatic glucose production during fasting. The Journal of Clinical Endocrinology and Metabolism 93:2755-2759.
Schulte PM, Down NE, Donaldson EM, Souza LM. 1989. Experimental administration of recombinant bovine growth hormone to juvenile rainbow trout (Salmo gairdneri) by injection or by immersion.
Silverstein JT, Wolters WR, Shimizu M, Dickhoff WW. 2000. Bovine growth hormone treatment of channel catfish: strain and temperature effects on growth, plasma IGF-I levels, feed intake and efficiency, and body composition. Aquaculture 190:77-78.
Small BC, Soares Jr JH, Woods III LC, Dahl GE. 2002. Effect of fasting on pituitary growth hormone expression and circulating growth hormone levels in striped bass. North American Journal of Aquaculture 64: 278– 283.
Syazili A. 2012. Aplikasi hormon pertumbuhan rekombinan melalui perendaman untuk memacu pertumbuhan benih gurami (Osphronemus goramy) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Tang Y, Shepherd BS, Nichols AJ, Dunham R, Chen TT. 2001. Influence of environmental salinity messenger RNA levels of growth hormone, prolactin, and somatolactin pituitary of the channel catfish (Ictalurus punctatus). Marine Biotechnology 3:205-217.
Utomo DSC. 2010. Produksi dan uji bioaktivitas protein rekombinan hormon pertumbuhan ikan mas [tesis]. Bogor (ID): Institut Pertanian Bogor.
Volkoff H, Canosa LF, Unniappan S, Cerdá-Reverterfer JM, Bernier NJ, Kelly SP, Peter RE. 2005. Neuropeptides and the control of food intake in fish.
General and Comparative Endocrinology 142:3–19.
Willard C. 2006. Welfare effects of the use of recombinant bovine somatotropine in the USA. Journal of Dairy Research 14:1-12.
Wilson RP, Poe WE, Nemetz TG, MacMillan. 1988. Effect of recombinant bovine growth hormone administration on growth and body composition of channel catfish. Aquaculture 73:229-236.
Woelfle J, Billiard J, Rotwein P. 2003. Acute control of insulin-like growth factor-i gene transcription by growth hormone through stat5b. The Journal of Biological Chemistry 278:22696-22702.
Wong AOL, Zhou H, Jiang Y, Ko WKW. 2006. Feedback regulation of growth hormone synthesis and secretion in fish and the emerging concept of intrapituitary feedback loop. Comparative Biochemistry and Physiology
Lampiran 1. Hasil analisis SDS-PAGE
Keterangan : M = Marker dan P = Protein rOgGH
Lampiran 2. Hasil elektroforesis RT-PCR dan kuatifikasi ekspresi gen IGF-I
Keterangan: A = ekspresi gen IGF-I, B = ekspresi gen β-aktin, M = marker, 1 = sebelum perendam