AKTIVITAS INSEKTISIDA EKSTRAK BUAH CABAI JAWA
(Piper retrofractum, PIPERACEAE) TERHADAP
Helopeltis antonii SIGN. (HEMIPTERA: MIRIDAE)
GUSTI INDRIATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Aktivitas Insektisida
Ekstrak Buah Cabai Jawa (Piper retrofractum, Piperaceae) terhadap Helopeltis antonii Sign. (Hemiptera: Miridae)” adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum pernah diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Gusti Indriati
ii
RINGKASAN
GUSTI INDRIATI. Aktivitas Insektisida Ekstrak Buah Cabai Jawa (Piper retrofractum, Piperaceae) terhadap Helopeltis antonii Sign. (Hemiptera: Miridae). Dibimbing oleh DADANG dan DJOKO PRIJONO.
Helopeltis antonii Sign (Hemiptera: Miridae) merupakan salah satu hama utama tanaman kakao, teh, dan jambu mete. Hama ini menyebabkan kerusakan pada pucuk dan buah dengan gejala berupa bercak-bercak berwarna cokelat kehitaman. Aplikasi insektisida sintetik merupakan cara pengendalian yang umum dilakukan terhadap Helopeltis spp. karena hasilnya cepat terlihat. Penggunaan insektisida sintetik secara terus-menerus dapat menyebabkan resistensi dan resurjensi hama, munculnya hama sekunder, serta meracuni makhluk hidup bukan sasaran dan lingkungan. Oleh karena itu diperlukan alternatif pengendalian yang lebih aman baik terhadap manusia maupun lingkungan, di antaranya penggunaan insektisida nabati.
Penelitian bertujuan menguji toksisitas ekstrak buah cabai jawa (Piper retrofractum) terhadap imago H. antonii, menguji pengaruh konsentrasi subletal ekstrak terhadap jumlah nimfa keturunan H. antonii, dan menguji persistensi ekstrak tersebut dalam kaitan dengan efek mortalitas dan oviposisi terhadap imago
H. antonii. Perbanyakan serangga uji dilakukan di laboratorium menggunakan inang alternatif buah mentimun (Cucumis sativus). Bahan tumbuhan yang digunakan sebagai sumber ekstrak adalah buah cabai jawa. Penelitian dilakukan melalui beberapa tahap, yaitu perbanyakan serangga uji, ekstraksi, uji toksisitas, uji pengaruh konsentrasi subletal, dan uji persistensi.
Uji toksisitas ekstrak cabai jawa dilakukan pada konsentrasi 0.05%, 0.10%, 0.15%, 0.20%, 0.25%, dan 0.30% berdasarkan hasil uji pendahuluan. Ekstrak diencerkan dalam campuran aseton, metanol, dan Tween 80 (5:5:2 v/v) [konsentrasi akhir 1.2%] kemudian ditambahkan akuades sampai volume yang diinginkan. Larutan kontrol berupa akuades yang mengandung campuran aseton, metanol, dan Tween 80 (5:5:2 v/v) sebanyak 1.2%.
Pengujian pengaruh konsentrasi subletal ekstrak cabai jawa dilakukan pada konsentrasi LC25 dan LC50. Sediaan ekstrak disemprotkan pada permukaan buah
mentimun secara merata, lalu dikeringanginkan. Selanjutnya nimfa instar-4 H. antonii dimasukkan ke dalam wadah plastik tersebut dan dibiarkan selama 48 jam. Setelah 48 jam, buah mentimun perlakuan diganti dengan buah mentimun tanpa perlakuan hingga nimfa menjadi imago. Imago yang muncul dipasangkan hingga diperoleh 10 pasang untuk setiap taraf konsentrasi uji dan kontrol. Setiap pasang imago dipelihara dalam wadah plastik dan diberi pakan buah mentimun tanpa perlakuan. Imago dipelihara hingga mati. Pengamatan dilakukan terhadap jumlah nimfa keturunan H. antonii pada setiap perlakuan.
Pengujian persistensi ekstrak cabai jawa dilakukan pada konsentrasi 0.49% (LC95) dan 0.98% (2 x LC95) serta kontrol ([aseton + metanol + Tween 80, 5:5:2]
iii
melalui penyemprotan imago H. antonii menggunakan alat semprot tangan. Pada setiap perlakuan digunakan 10 imago H. antonii dengan lima ulangan. Pengamatan dilakukan dengan mencatat jumlah imago H. antonii yang mati pada 1, 2, 3, 4, dan 5 hari setelah perlakuan
Pada uji pengaruh ekstrak dalam kaitan dengan efek oviposisi imago H. antonii, ekstrak cabai jawa yang telah dipajankan disemprotkan pada buah mentimun (pakan) hingga basah merata menggunakan alat semprot tangan. Buah mentimun kontrol disemprot larutan kontrol seperti pada uji toksisitas. Pengujian ini dilakukan dengan metode pilihan, satu buah mentimun perlakuan dan satu buah mentimun kontrol diletakkan dalam satu wadah plastik (tinggi 13 cm, diameter 14 cm) lalu dua pasang imago H. antonii berumur 2 hari dimasukkan ke dalam wadah plastik tersebut. Jumlah telur yang diletakkan pada buah perlakuan dan buah kontrol dibandingkan dengan uji-t berpasangan.
Hasil penelitian menunjukkan bahwa kematian imago H. antonii akibat perlakuan ekstrak buah cabai jawa 0.05%-0.3% sudah terjadi sejak 24 jam setelah perlakuan (JSP), dan setelah 24 JSP sudah tidak terjadi peningkatan kematian yang nyata. LC50 dan LC95 ekstrak cabai jawa pada 120 JSP masing-masing
0.20% dan 0.49%. Jumlah nimfa keturunan yang dihasilkan pada perlakuan konsentrasi subletal ekstrak cabai jawa 0.203% (LC50) lebih sedikit dibandingkan
dengan perlakuan pada konsentrasi 0.141% (LC25). Ekstrak cabai jawa yang
dipajankan di bawah sinar matahari hingga 5 hari masih efektif dalam mematikan imago H. antonii (mortalitas 80%) tetapi tidak efektif dalam menghambat peletakan telur oleh betina H. antonii. Penghambatan peletakan telur terhadap imago H. antonii hanya teramati pada perlakuan ekstrak cabai jawa 0.98% (2 x LC95) yang dipajankan di bawah matahari selama 0 dan 1 hari, dengan indeks
penghambatan oviposisi masing-masing 22.7% dan 23.8%. Keefektifan ekstrak cabai jawa perlu diuji di lapangan untuk menilai kelayakan penggunaannya dalam pengendalian hama H. antonii.
iv
SUMMARY
GUSTI INDRIATI. Insecticidal Activity of Piper retrofractum (Piperaceae) Extract on Helopeltis antonii Sign. (Hemiptera: Miridae). Supervised by DADANG and DJOKO PRIJONO.
Helopeltis antonii Sign. (Hemiptera: Miridae) is an important pest of cocoa, tea, and cashew nuts. This insect pest sucks shoot and nut saps of plants causing blackish brown spots. Application of synthetic insecticides is commonly used to control Helopeltis spp. due to insecticide fast action. However, use of synthetic chemical insecticides can cause pest resistance and resurgence and outbreak of secondary pests, killing of non-target organisms as well as environmental contamination. Therefore, it is necessary to search for environmental friendly strategy to control H. antonii. The objectives of this study were to test the toxicity of Piper retrofractum extract to H. antonii adults, evaluate the effect of sublethal concentrations of the extract on the number of progeny nymphs of H. antonii, and to evaluate the persistence of the extract against mortality and oviposition of H. antonii. Cucumber was used as an alternate host for mass rearing and testing medium. The study was conducted in several stages: insect rearing, extraction, toxicity test, effects of sublethal, and persistency test.
Toxicity test of P. retrofractum extract was conducted at concentrations of 0.05%, 0.10%, 0.15%, 0.20%, 0.25% and 0.3% based on the result of preliminary test. The extract was diluted in a mixture of acetone, methanol, and Tween 80 (5:5:5 v/v) [final concentration of 1.2%] and then diluted with distilled water until the desired volume. In addition, control solution was also prepared containing distilled water and a mixture of acetone, methanol, and Tween 80 (5:5:2 v/v) 1.2%. For each treatment, 10 individuals of H. antonii adults were used with five replications.
The effect of sublethal test was conducted at concentrations equivalent to LC25 and LC50. The extract was sprayed on the whole surface of cucumber. Then
the treated cucumbers and fourth instar nymphs were put in a plastic container (13 cm and diameter 14 cm) and the insects were held for 48 hours. After 48 hours, the treated cucumbers were replaced with untreated cucumbers until the nymphs became adults. The adult insects were then paired to obtain 10 pairs for each concentration level and control. Each pair of adult insects was placed into plastic containers and fed with untreated cucumbers. All of the adult insects were maintained until they died. Observations were made by counting the number of progeny nymphs in each treatment.
Persistence test of P. retrofractum extract was conducted at concentrations of 0.49% (LC95), 0.98% (2 x LC95) and control ([aceton + methanol + Tween
v
for each treatment and each treatment was replicated five times. The percentage of mortality was counted at 1, 2, 3, 4, and 5 days after treatment (DAT).
Effect of extract on oviposition test was done by spraying sunlight exposed
P. retrofractum extract on cucumber (diet) to complete wetness using a hand sprayer. Control cucumber was sprayed with control solution as in the toxicity test. This test used choice method, one treated cucumber and control cucumber were put in the same at plastic container (13 cm high, 14 cm diameter) then two pairs of 2 day old H. antonii adults were put in that plastic container. Total number of eggs laid on treated and control cucumbers were compared using paired t-test.
Result showed that mortality of H. antonii adults which caused by P. retrofractum extract 0.05%-0.3% had occurred since 24 hours after treatment (HAT), and after that the mortality of the test insects did not increase markedly. LC50 and LC95 of P. retrofractum extract at 120 HAT were 0.20% and 0.49%
respectively. Total number of nymphs progeny in the treatment with sublethal concentration of P. retrofractum extract 0.203% (LC50) was lower than that in the
the treatment with the concentration 0.141% (LC25). P. retrofractum extract
exposed to sunlight for 5 days was still effective against H. antonii adults (80% mortality) but was not effective in inhibiting female H. antonii in laying their eggs. Inhibition of oviposition by H. antonii adults were only observed in the treatment with P. retrofractum extract 0.98% (2 x LC95) exposed to sunlight for 0
and 1 day, with oviposition inhibition index of 22.7% dan 23.8% respectively. Further research on the effectiveness P. retrofractum extract is needed in order to assess its feasibility to be used for controlling H. antonii .
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
vii
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi
AKTIVITAS INSEKTISIDA EKSTRAK BUAH CABAI JAWA
(Piper retrofractum, PIPERACEAE) TERHADAP
Helopeltis antonii SIGN. (HEMIPTERA: MIRIDAE)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
viii
J
Aktivitas Insektisida Ekstrak Buah Cabai Jawa (Piper
x
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu wa Ta’ala yang atas segala karunia-Nya penulis dapat menyelesaikan penelitian dan penulisan tesis ini. Tesis yang berjudul “Aktivitas Insektisida Ekstrak Buah Cabai Jawa (Piper retrofractum, Piperaceae) terhadap Helopeltis antonii Sign. (Hemiptera:
Miridae)” merupakan salah satu syarat untuk memperoleh gelar Magister Sains
pada Sekolah Pascasarjana Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman dan Balai Penelitian Tanaman Industri dan Penyegar (Balittri), Sukabumi dari Mei 2013 hingga April 2014.
Terima kasih penulis ucapkan kepada Komisi Pembimbing, Prof. Dr. Ir. Dadang, M.Sc sebagai ketua dan Ir. Djoko Prijono, MAgrSc, sebagai anggota, atas teladan, bimbingan, arahan, perhatian dan ide yang diberikan kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Dr. Agus Wahyudi atas izin melanjutkan studi S2 di Institut Pertanian Bogor dan Dr. Ir. Rubiyo, M.Si sebagai Kepala Balai Penelitian Tanaman Industri dan Penyegar atas dukungan, motivasi, dan saran yang diberikan kepada penulis. Ucapan terima kasih juga disampaikan kepada Ayahanda (almarhum) dan Ibunda tercinta atas doanya, suami dan anak-anak tersayang atas pengertian serta doanya demi kelancaran studi.
Teman-teman seperjuangan Yeni Midel Februalita, Ratna Rubiana, Diana Agustina, Evawati Sri Ulina, Risnawati, dan Vani Nur Oktaviany serta yang lainnya yang tidak dapat disebutkan satu per satu, bahagia mengenal kalian semua.
Semoga hasil penelitian ini bermanfaat.
Bogor, Agustus 2015
xi
Cabai Jawa (Piper retrofractum) 3
Ciri Umum dan Kegunaan 3
Sifat Insektisida dan Senyawa Aktif 3
Helopeltis antonii sebagai Hama Tanaman 4
Arti Ekonomi 4
Toksisitas Ekstrak Cabai Jawa terhadap Imago H. antonii 13 Pengaruh Subletal Ekstrak Cabai Jawa terhadap Jumlah Nimfa Keturunan
H. antonii 14
Persistensi Ekstrak Cabai Jawa dalam Kaitan dengan Efek terhadap
Mortalitas Imago H. antonii 15 Persistensi Ekstrak Cabai Jawa dalam Kaitan dengan Efek terhadap
Oviposisi H. antonii 16
xii
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 25
DAFTAR TABEL
1 Beberapa jenis gulma yang menjadi inang alternatif Helopeltis spp. 7 2 Penduga parameter toksisitas ekstrak cabai jawa terhadap imago H.
antonii 14
3 Rata-rata kematian imago H. antonii yang diperlakukan ekstrak cabai jawa yang dipajankan di bawah sinar matahari selama 0,1, 3,
dan 5 hari 16
4 Pengaruh ekstrak cabai jawa yang dipajankan di bawah sinar matahari selama 0, 1, 3, dan 5 hari terhadap oviposisi H. antonii 6 Peneluran H. antonii pada inang alternatif. Buah mentimun sebagai
pakan alternatif (a), buah mentimun yang diinfestasi imago H.
antonii (b) 10
7 Perbanyakan H. antonii pada buah mentimun di laboratorium 10 8 Perkembangan tingkat mortalitas imago H. antonii akibat perlakuan
ekstrak cabai jawa 13
9 Pengaruh konsentrasi subletal ekstrak cabai jawa terhadap jumlah
nimfa keturunan H. antonii 15
DAFTAR LAMPIRAN
1 Mortalitas imago H. antonii pada ekstrak buah cabai jawa (uji
pendahuluan) 26
2 Mortalitas imago H. antonii pada ekstrak buah cabai jawa (uji lanjut) 26 3 Pengaruh konsentrasi subletal ekstrak buah cabai jawa terhadap nimfa
keturunan H. antonii 27
4 Oviposisi H. antonii pada perlakuan persistensi ekstrak cabai jawa yang dipajankan 0, 1, 3, dan 5 hari di bawah sinar matahari (metode
1
PENDAHULUAN
Latar Belakang
Helopeltis spp. (Hemiptera: Miridae) merupakan salah satu hama utama pada tanaman kakao, teh, dan jambu mete. Hama tersebut juga dapat menyerang beberapa tanaman lainnya seperti kina, akasia, mimba, dan kayumanis. Spesies yang dilaporkan terdapat di Asia ialah H. antonii, H. bakeri, H. clavifer, H. sulawesi, H. sumatranus, dan H. theivora (sinonim H. theobromae) (Bateman 2007). Di antara spesies Helopeltis tersebut, spesies yang telah dilaporkan menyerang tanaman kakao ialah H. antonii, H. clavifer, H. sulawesi, dan H. theivora (Karmawati et al. 2010; CABI 2012).
H. antonii menyerang pucuk dan buah kakao dengan cara menusukkan stiletnya untuk mengisap cairan. Aktivitas makan tersebut meninggalkan gejala serangan berupa bercak-bercak berwarna cokelat kehitaman. Serangan pada pucuk dan buah muda dapat menyebabkan kematian pucuk dan penghambatan pembentukan buah bahkan dapat menyebabkan buah gugur sehingga menurunkan kuantitas dan kualitas hasil kakao. Serangan hama H. antonii dapat menurunkan produksi buah kakao 50%-60% (Atmadja 2003; Sulistyowati 2015).
Cara pengendalian yang umum dilakukan terhadap hama Helopeltis spp. adalah pengendalian menggunakan insektisida sintetik, terutama karena hasilnya cepat terlihat. Pengendalian hama dengan insektisida sintetik secara terus-menerus dapat menyebabkan resistensi dan resurjensi hama, munculnya hama sekunder, serta meracuni makhluk hidup bukan sasaran dan lingkungan. Sebagai contoh, Roy et al. (2011) melaporkan bahwa H. theivora dari perkebunan teh di daerah Kalchini, Bengali Barat, India telah resisten terhadap 11 jenis insektisida sintetik dari empat golongan (hidrokarbon berklor, organofosfat, piretroid sintetik, dan neonikotinoid) dengan nisbah resistensi 20 – 17564 kali.
Tanaman menghasilkan senyawa sekunder yang dapat dimanfaatkan untuk melindungi dirinya dari organisme pengganggu tanaman (OPT). Hasil ekstraksi senyawa kimia ini berpotensi untuk dimanfaatkan sebagai pestisida nabati. Lebih dari 1500 tanaman berkhasiat sebagai bahan pestisida nabati untuk pengendalian hama (Grainge dan Ahmed, 1988). Insektisida nabati merupakan sarana pengendalian alternatif yang umumnya lebih aman dibandingkan dengan insektisida sintetik dan sejalan dengan konsep pengendalian hama terpadu. Kelebihan insektisida nabati di antaranya relatif aman terhadap makhluk bukan sasaran, mudah terurai di alam, dapat memperlambat laju resistensi serangga, dan tidak menimbulkan resurjensi (Dadang dan Prijono 2008). Piperaceae merupakan salah satu famili tumbuhan yang potensial digunakan sebagai sumber insektisida nabati.
2
Aktivitas insektisida ekstrak cabai jawa terhadap hama H. antonii belum pernah diteliti. Bahan tumbuhan lain yang telah diteliti keefektifannya terhadap
Helopeltis spp. di antaranya minyak selasih (Ocimum basilicum), minyak jahe merah (Zingiber officinale), minyak pala (Myristica fragrans), dan minyak masoyi (Massoia aromatica) (Atmadja 2008; Atmadja et al. 2009). Perlakuan dengan minyak selasih 10% dapat mematikan imago H. antonii 83.3% pada 6 hari setelah aplikasi (Atmadja dan Suriati 2009). Hasil penelitian Kardinan dan Sondang (2012) menunjukkan bahwa formula insektisida nabati sitronela 5% + cengkih 10% + azadiraktin 0.15% + rotenon 0.33% efektif mengendalikan
Helopeltis spp. pada pucuk teh. Darwis dan Atmadja (2010), melaporkan bahwa penggunaan insektisida nabati serai wangi pada konsentrasi 1.6% dan 3.2% dapat menyebabkan mortalitas H. theivora sebesar 60% dan 83%.
Tujuan Penelitian
Penelitian ini bertujuan (1) menguji toksisitas ekstrak buah cabai jawa terhadap imago H. antonii, (2) menguji pengaruh konsentrasi subletal ekstrak tersebut terhadap jumlah nimfa keturunan H. antonii, dan (3) menguji persistensi ekstrak tersebut dalam kaitan dengan efek mortalitas dan oviposisi terhadap imago
H. antonii.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai potensi ekstrak buah cabai jawa untuk pengendalian hama H. antonii.
Ruang Lingkup Penelitian
1 Pengujian efek racun kontak dengan metode semprot serangga ekstrak buah cabai jawa terhadap imago H. antonii.
2 Pengujian efek konsentrasi subletal ekstrak cabai jawa terhadap jumlah nimfa keturunan H. antonii.
3
TINJAUAN PUSTAKA
Cabai Jawa (Piper retrofractum)
Ciri Umum dan KegunaanCabai jawa merupakan tumbuhan asli Indonesia yang terdapat hampir di seluruh wilayah Indonesia dan dapat tumbuh optimal pada ketinggian 0-600 m dpl (Heyne 1987). Di Sumatera tumbuhan ini disebut lada panjang, di Sulawesi disebut cabia dan di Jawa dinamakan cabe jamu, cabe jawa, cabe panjang, chabean, chabe alas, cabe sula (Lim 2012). Selain di Indonesia, tumbuhan ini juga terdapat di Malaysia, Filipina, Thailand, Vietnam, dan China (Lim 2012). Buah muda berwarna hijau dan keras, kemudian menguning, kemerahan dan lunak (Gambar 1). Buah tanaman ini digunakan untuk bahan obat tradisional sebagai stimulan, antihipertensi (Vinay et al. 2012), sampo herbal untuk membunuh kutu kepala manusia Pediculus capitis (Phthiraptera: Pediculidae) (Rassami dan Soonwera 2011). Bagian akarnya digunakan sebagai obat sakit perut dan antijamur (bagian batang) (Vinay et al. 2012).
Gambar 1 Buah cabai jawa (Piper retrofractum)
Sifat Insektisida dan Senyawa Aktif
Cabai jawa memiliki sifat insektisida dan akarisida. Prijono et al. (2006) melaporkan bahwa ekstrak metanol cabai jawa pada konsentrasi 0.5% dapat mematikan larva Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) sebesar 100%. Lebih lanjut Zarkani et al. (2009). melaporkan bahwa ekstrak etil asetat cabai jawa menyebabkan kematian larva C. pavonana sebesar 84.6% pada konsentrasi 0.12%. Perlakuan ekstrak cabai jawa 1% terhadap Paracoccus marginatus menyebabkan kematian 62% - 96% (Dewi 2010). Rassami dan Soonwera (2011) melaporkan bahwa ekstrak buah cabai jawa 3% + natrium laureat sulfat 87% + air destilasi 87% menyebabkan mortalitas kutu kepala manusia Pediculus capitis 70% setelah 20 detik aplikasi dan 100% setelah 30 detik, dengan LT50 sebesar 16.7 detik.
-4
9-(3,4-metilendioksifenil) nonadienoilpiperidin, 1-(2E,4E,12E)-N -oktadekatrienoilpiperidin, 1-(2E,4E)-N-oktadekatrienoilpiperidin, pelitorin, pipereikosalidin, pipersida, piperin, piperlonguminin, piperoktadekalidin, piplartin, retrofractamida A, retrofractamida C, retrofractamida D, dan silvatrin (Ahn et al. 1992; Kikuzaki et al. 1993; Parmar et al. 1997). Miyakado et al. (1989) melaporkan bahwa senyawa piperamida yang memiliki gugus isobutilamida dan metilendioksifenil, seperti guininsin dan pipersida, memiliki aktivitas insektisida yang kuat yang bekerja sebagai racun saraf dengan menghambat aliran impuls saraf pada akson.
Helopeltis antonii sebagai Hama Tanaman
Arti Ekonomi
Helopeltis spp. (Hemiptera:Miridae) merupakan salah satu hama utama pada tanaman kakao (Theobroma cocoa), jambu mete (Anacardium occidentale), dan teh (Camellia sinensis). Hama tersebut juga menyerang beberapa tanaman lain seperti kina, akasia, mimba, dan kayu manis. Daerah sebaran hama meliputi Afrika, Srilanka, Semenajung Malaysia, Jawa, Sumatera, Kalimantan, Sulawesi, Papua, Sabah, Papua Nugini dan Filipina (Sulistyowati 2015). Serangan hama ini dapat menurunkan produksi buah kakao 50%-60% (Atmadja 2003; Sulistyowati 2015).
Spesies Helopeltis yang dilaporkan terdapat di Asia ialah H. antonii, H. clavifer, H. sulawesi, H. sumatranus, dan H. theivora (sinonim H. theobromae) (Bateman 2007). Di antara spesies Helopeltis tersebut, spesies yang dilaporkan menyerang tanaman kakao ialah H. antonii, H. clavifer, H. sulawesi, dan H. theivora (Karmawati et al. 2010; CABI 2012).
Populasi H. antonii dilaporkan paling dominan (82%) dibandingkan H. brady (12%) dan H. theivora (6%) pada tanaman jambu mete. Nisbah kelamin pada H. antonii lebih tinggi dibandingkan lainnya yaitu H. antonii 1 : 3.76 sedangkan H. brady 1: 1.27 dan H. theivora 1: 1.17. Tingkat kelangsungan hidup
H. antonii lebih tinggi dibandingkan H. brady dan H. theivora, yaitu pada H. antonii 86.12%, H. brady dan H. theivora masing-masing 64.59% dan 62.5% (Srikumar dan Bhat 2012).
Bioekologi
5
Nimfa terdiri atas lima instar (Gambar 3) dan stadium nimfa berkisar 10-11 hari (Sulistyowati 2015). Atmadja (2012) melaporkan bahwa instar pertama berwarna cokelat bening, yang kemudian berubah menjadi coklat. Tubuh nimfa instar kedua berwarna cokelat muda, antena cokelat tua, tonjolan toraks mulai terlihat. Nimfa instar ketiga tubuhnya berwarna cokelat muda, antena cokelat tua, tonjolan pada toraks terlihat jelas dan bakal sayap mulai terlihat. Nimfa instar keempat dan kelima ciri morfologinya sama. Nimfa dan imago menyerang pucuk dan buah muda tanaman, dengan menusukkan alat mulutnya ke jaringan kemudian mengisap cairan di dalamnya.
Imago (Gambar 4) aktif pada pagi dan sore hari. Imago jantan dan betina kawin pada umur 2 hari dan nisbah jantan dengan betina yang cenderung menghasilkan lebih banyak telur adalah 2:1 dan 1:2 (Siswanto et al. 2009). Siklus hidup H. antonii bervariasi bergantung pada jenis tanaman seperti pada tanaman kakao 25.42 hari, mimba 26.52 hari, Lawsonia alba 22.81 hari, dan Mutingia calabura 35-38 hari (Srikumar dan Bath 2013a; Srikumar dan Bath 2013b).
Gambar 3
a b c
d e
0.14 mm
1 mm
1 mm
1 mm
1 mm
Gambar 2 Telur H. antonii pada buah mentimun setelah 5 hari peletakan
1 mm
6
(
Kerusakan
Nimfa dan imago menyerang pucuk dan buah muda tanaman kakao dengan menusukkan alat mulutnya (stilet) ke jaringan kemudian mengisap cairan di dalamnya. Stilet membentuk dua saluran, yaitu saluran makanan dan saluran air liur. Ketika stilet melakukan penetrasi ke jaringan tanaman inang, air liur akan dipompa ke bagian tersebut menyebabkan jaringan tanaman menjadi lebih basah sehingga cairannya lebih mudah untuk diisap (Wheeler 2001). Pada kelenjar ludah dan saluran makanan H. theivora dijumpai enzim amylase, protease dan lipase. Adanya enzim ini akan membantu merombak jaringan tanaman dan penetrasi stilet serta melawan pertahanan kimia tanaman inang (Sarker dan Mukhopadhyay 2006).
Gejala buah kakao terserang Helopeltis spp. berupa bercak-bercak berwarna cokelat kehitaman (Gambar 5). Serangan pada pucuk dan buah muda dapat menyebabkan kematian pucuk dan penghambatan pembentukan buah bahkan dapat menyebabkan buah gugur sehingga menurunkan kuantitas dan kualitas hasil kakao.
Gambar 5 Gejala serangan Helopeltis spp. pada buah kakao
1 mm 1 mm
Gambar 4 Imago H. antonii (a) beberapa saat dari nimfa instar ke-5, (b) beberapa jam dari nimfa instar ke-5
7
Pengendalian
Beberapa tindakan pengendalian yang dilakukan untuk mengurangi populasi
Helopeltis spp. yaitu pengendalian mekanis, kultur teknis, pengendalian hayati dan pengendalian secara kimiawi.
Pengendalian mekanis. Perlindungan mekanis dengan menggunakan
lapisan mineral kaolin yang diperkaya dengan mikroba entomopatogen efektif untuk perlindungan buah selama masa pertumbuhan dari serangan hama maupun penyakit. Hasil penelitian Kresnawaty et al. (2010) menunjukkan bahwa aplikasi penyemprotan biokaolin setiap dua minggu memberikan perlindungan terbaik dari serangan Helopeltis spp.
Kultur teknis. Beberapa teknik budidaya yang dilakukan yaitu
pemangkasan dan sanitasi kebun. Pemangkasan dengan membuang tunas air (wiwilan) di sekitar cabang-cabang utama setiap dua minggu dapat mengurangi populasi Helopeltis spp. karena tunas air merupakan salah satu tempat peletakan telur Helopeltis spp. Beberapa jenis gulma dilaporkan menjadi inang alternatif
Helopeltis spp. (Tabel 1). Oleh karena itu perlu dilakukan pembersihan gulma di sekitar pertanaman kakao.
Tabel 1 Beberapa jenis gulma yang menjadi inang alternatif Helopeltis spp. Famili Jenis tumbuhan Nama umum
Asteraceae Mikania micrantha Sembung rambat (Jawa)
Mikania cordata Capituheur (Jawa Barat),
Chromolaena odorata Kirinyuh
Bidens biternata Hareuga (Jawa Barat), Verbenaceae Lantana camara Tembelekan
Melastomataceae Melastoma malabethricum
Oxalidaceae Oxalis acetosella
Sumber: Debnath dan Rudrapal (2011), Mamun dan Ahmed (2011), Gogoi et al. (2012).
Pengendalian hayati. Barthakur (2011) melaporkan beberapa musuh alami
golongan predator yang berperan sebagai pengendali Helopeltis spp. pada pertanaman teh di India, yaitu Chrysoperla carnea (Neuroptera: Chrysopidae),
Mallada sp. (Neuroptera: Chrysopidae), Oxyopes sp. (Arachnida: Oxyopidae). Semut hitam (Dolichoderus thoracicus) dan semut merah (Oecophylla smaragdina) mengganggu imago Helopeltis spp. untuk meletakkan telur pada buah kakao (Wiryadiputra 2007).
Pengendalian hayati dengan digunakan musuh alami golongan patogen yaitu cendawan Beauveria bassiana dengan dosis 25 - 50 gram spora per hektar menyebabkan kematian Helopeltis spp. pada 2 - 5 hari setelah aplikasi (Siswanto dan Karmawati 2012) . Sudarmadji dan Gunawan (1994) melaporkan bahwa penggunaan suspensi spora B. bassiana terhadap H. antonii menghasilkan mortalitas lebih tinggi pada imago dibandingkan dengan nimfa, LC50 terhadap
imago 1.4 x 108 dan LC50 terhadap nimfa 6.4 x 108 spora/ml. Kerapatan konidia
106 spora/ml Lecanicillium lecanii menyebabkan mortalitas nimfa instar ke-3
8
Pengendalian Helopeltis spp. juga dapat dilakukan memanfaatkan parasitoid telur Erythmelus helopeltidis Gahan (Hymenoptera: Mymarida) dan parasitoid nimfa Leiophron (Euphorus). Bhat dan Srikumar (2013), melaporkan bahwa parasitoid telur H. theivora pada tanaman kakao adalah Telenomus sp. (Hymenoptera: Platygastridae) dengan parasitisasi 3.2% dan Chaetostricha sp. (Hymenoptera: Trichogrammatidae) dengan parasitisasi 0.8%. T. cuspis juga dilaporkan sebagai parasitoid telur H. antonii pada jambu mete dengan parasitisasi maksimum 28.21% (Srikumar et al. 2014).
Pengendalian H. antonii juga dapat dilakukan dengan memanfaatkan insektisida nabati seperti minyak biji mimba, ekstrak biji srikaya, minyak selasih dan limbah tembakau. Minyak selasih (Ocimum basilicum) efektif terhadap H. antonii dengan tingkat kematian mencapai 83.33% pada 6 hari setelah aplikasi (Atmadja dan Suriati 2009). Sulityowati et al. (2014) melaporkan bahwa esktrak bawang putih (Allium sativum), serai (Cymbopogon nardus), dan paitan (Tithonia diversifolia) pada konsentrasi 5% menyebabkan mortalitas H. antonii berturut-turut 65.8%, 65%, dan 63.8% .
Pengendalian kimiawi. Pengendalian dengan insektisida sintetik
9
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Institut Pertanian Bogor (IPB) dan Balai Penelitian Tanaman Industri dan Penyegar (Balittri) Pakuwon, Sukabumi mulai Mei 2013 sampai April 2014.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah buah cabai jawa, buah mentimun, serangga Helopeltis antonii, akuades, etil asetat, metanol, tween-80. Alat-alat yang digunakan meliputi wadah plastik, kain kasa, kertas saring, kuas halus, labu erlenmeyer, labu takar, alat semprot, pipet volumetrik, dan rotary evaporator.
Metode
Perbanyakan Serangga Uji
Serangga uji H. antonii diperoleh dari pertanaman kakao di Jampangtengah, Sukabumi, kemudian dilakukan identifikasi di Laboratorium Entomologi, Bidang Zoologi, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong untuk menginformasi bahwa serangga uji adalah H. antonii. Serangga uji diperbanyak pada inang alternatif buah mentimun (Cucumis sativus) mengikuti metode Kilin dan Atmadja (2000).
Peneluran. Untuk peneluran dipilih mentimun dengan kualitas baik agar mentimun dapat bertahan selama periode peneluran (6 - 7 hari). Mentimun dimasukkan ke dalam wadah plastik berdiameter 13 cm dan tinggi 14 cm dengan cara disandarkan pada dinding wadah plastik (Gambar 6a). Ke dalam wadah plastik tersebut dimasukkan imago dengan nisbah betina jantan 2:1 (Gambar 6b) , kemudian wadah plastik ditutup dengan kain kasa (Gambar 7). Mentimun diganti tiap hari dengan yang baru dan mentimun yang mengandung telur dipindahkan ke wadah plastik berukuran diameter 16 cm, tinggi 16 cm untuk diinkubasi selama 6 - 7 hari hingga telur menetas menjadi nimfa.
Pemeliharaan nimfa. Nimfa yang baru muncul dipindahkan menggunakan
kuas halus secara hati-hati ke buah mentimun yang diletakkan dalam wadah plastik, lalu ditutup dengan kain kasa. Buah mentimun diganti setiap hari dengan yang baru dan nimfa dipelihara hingga menjadi imago. Pemeliharaan nimfa dalam wadah plastik berdiameter 16 cm dan tinggi 17 cm dengan jumlah maksimum 20 nimfa akan memperoleh serangga dewasa yang banyak (Kilin dan Atmadja 2000).
10
Gambar 6 Peneluran H. antonii pada inang alternatif. Buah mentimun sebagai pakan alternatif (a), buah mentimun yang diinfestasi imago H. antonii
(b)
Ekstraksi Bahan Tumbuhan
Bahan tumbuhan yang digunakan sebagai sumber ekstrak adalah buah cabai jawa yang diperoleh dari kebun Agro Widya Wisata Ilmiah Balittri, Sukabumi. Buah cabai jawa dikeringanginkan, kemudian digiling menggunakan blender hingga menjadi serbuk lalu diayak menggunakan pengayak kawat kasa berjalinan 0.5 mm.
Serbuk buah cabai jawa sebanyak 200 g direndam dalam pelarut etil asetat (perbandingan 1:10, w/v) selama 48 jam. Cairan hasil rendaman disaring menggunakan corong kaca yang dialasi kertas saring Whatman No. 41 diameter 185 mm dan ditampung dalam labu penguap. Larutan hasil saringan diuapkan menggunakan rotary evaporator pada suhu 50 0C dan tekanan 240 mbar sehingga diperoleh ekstrak kasar. Ekstrak yang diperoleh disimpan dalam lemari es (suhu ± 4 0C) hingga digunakan untuk pengujian (Dadang dan Prijono 2008).
Uji Toksisitas
Pengujian dilakukan melalui dua tahap, yaitu uji pendahuluan dan uji lanjutan. Serangga uji yang digunakan adalah imago H. antonii. Pada uji pendahuluan ekstrak cabai jawa diuji pada konsentrasi 1%, 0.5%, 0.25%, 0.125%,
Gambar 7 Perbanyakan H. antonii pada buah mentimun di laboratorium
11
dan 0.0625%. Ekstrak diencerkan dalam campuran aseton, metanol, dan Tween 80 (5:5:2 v/v) [konsentrasi akhir 1.2%] kemudian ditambahkan akuades sampai volume yang diinginkan (Dewi 2010). Larutan kontrol berupa akuades yang mengandung campuran aseton, metanol, dan Tween 80 (5:5:2 v/v) sebanyak 1.2%. Untuk setiap perlakuan, 10 imago H. antonii dimasukkan ke dalam wadah plastik (tinggi 10 cm, diameter atas 8 cm, dan diameter bawah 5.5 cm) lalu disemprot dengan sediaan ekstrak pada konsentrasi tertentu atau larutan kontrol menggunakan alat semprot tangan dengan dosis 0.5 ml/10 serangga uji. Setelah penyemprotan, serangga uji dibiarkan selama 5 menit, lalu dimasukkan ke dalam wadah plastik (tinggi 13 cm, diameter 14 cm) yang berisi buah mentimun. Setiap perlakuan diulang lima kali. Pengamatan dilakukan pada 24, 48, 72, 96, dan 120 jam setelah perlakuan (JSP) dengan menghitung jumlah imago yang mati.
Uji lanjutan dilakukan pada konsentrasi 0.3%, 0.25%, 0.2%, 0.15%, 0.1%, 0.05% ditambah kontrol. Setiap perlakuan terdiri atas enam ulangan. Cara perlakuan dan pengamatan pada uji lanjutan sama seperti uji pendahuluan. Data kematian serangga uji diolah dengan analisis probit menggunakan program POLO-PC (LeOra Software 1987).
Uji Pengaruh Subletal Ekstrak Cabai Jawa
Ekstrak cabai jawa diuji pada konsentrasi LC25 dan LC50 berdasarkan hasil
uji toksisitas. Buah mentimun disemprot pada seluruh permukaannya secara merata dengan sediaan ekstrak pada konsentrasi yang telah ditentukan, lalu dibiarkan beberapa saat, dan selanjutnya buah mentimun tersebut dimasukkan ke wadah plastik (tinggi 13 cm, diameter 14 cm). Nimfa instar-4 H. antonii
dimasukkan ke dalam wadah plastik tersebut dan dibiarkan selama 48 jam. Setelah 48 jam, buah mentimun perlakuan diganti dengan buah mentimun tanpa perlakuan hingga nimfa menjadi imago. Imago yang muncul dipasangkan hingga diperoleh 10 pasang untuk setiap taraf konsentrasi uji dan kontrol. Setiap pasang imago dipelihara dalam wadah plastik dan diberi pakan buah mentimun tanpa perlakuan. Imago dipelihara hingga mati. Pengamatan dilakukan dengan menghitung jumlah nimfa yang muncul pada setiap perlakuan.
Uji Persistensi Ekstrak Cabai Jawa
Ekstrak cabai jawa diuji pada konsentrasi 0.49% (LC95) dan 0.98% (2 x
LC95) serta kontrol ([aseton + methanol + Tween 80, 5:5:2] + akuades). Sediaan
ekstrak uji disiapkan dengan cara seperti pada uji toksisitas. Ekstrak uji sesuai konsentrasi yang digunakan dimasukkan ke dalam botol semprot kaca bening berukuran 3 cm x 3 cm dan tinggi 9 cm kemudian ekstrak uji tersebut dipajankan di bawah sinar matahari selama 7 jam/hari mulai pukul 08:00 sampai15:00 WIB selama 0, 1, 3, dan 5 hari.
Ekstrak hasil pemajanan di atas digunakan untuk pengujian mortalitas dan penghambatan oviposisi H. antonii. Pada uji mortalitas, sediaan ekstrak cabai jawa yang telah dipajankan disemprotkan pada imago H. antonii menggunakan alat semprot tangan. Pada setiap perlakuan digunakan 10 imago H. antonii dengan lima ulangan. Setelah penyemprotan, serangga uji dibiarkan selama ± 5 menit lalu dimasukkan ke dalam wadah plastik yang diberi buah mentimun tanpa perlakuan selama 24 jam. Pengamatan dilakukan dengan mencatat jumlah imago H. antonii
12
serangga uji diolah dengan sidik ragam yang dilanjutkan dengan uji selang berganda Duncan pada taraf 0.05% mengggunakan program SAS versi 9.1 (SAS Institute 1990).
Pada uji penghambatan oviposisi, sediaan ekstrak cabai jawa yang telah dipajankan pada sinar matahari disemprotkan pada buah mentimun (pakan) hingga basah merata menggunakan alat semprot tangan. Buah mentimun kontrol disemprot dengan larutan kontrol seperti pada uji toksisitas. Pengujian ini dilakukan dengan metode pilihan (pakan kontrol dan perlakuan diletakkan dalam satu wadah plastik). Sebanyak dua buah mentimun yang terdiri atas satu buah mentimun perlakuan dan satu buah mentimun kontrol diletakkan dalam satu wadah plastik (tinggi 13 cm, diameter 14 cm) lalu dua pasang imago H. antonii
yang berumur 2 hari dimasukkan ke dalam wadah plastik tersebut selama 24 jam. Jumlah telur yang diletakkan pada buah perlakuan dan buah kontrol dibandingkan dengan uji-t berpasangan. Indeks penghambatan oviposisi (IPO) dihitung dengan rumus berikut (Akhtar et al. 2010):
IPO = [(k – p) / (k + p)] x 100% IPO = indeks penghambatan oviposisi
K = jumlah telur pada buah kontrol p = jumlah telur pada buah perlakuan.
Analisis Data
Data yang diperoleh diolah dengan sidik ragam yang dilanjutkan dengan uji selang berganda Duncan pada taraf nyata 5%. Analisis data tersebut dilakukan dengan menggunakan program SAS (SAS Institute 1990). Data mortalitas yang diperoleh juga diolah dengan metode probit (Finney 1971) untuk menghitung nilai LC50 dan LC95 tiap ekstrak menggunakan program POLO-PC (LeOra Software
13
HASIL DAN PEMBAHASAN
Toksisitas Ekstrak Cabai Jawa terhadap Imago H. antonii
Kematian imago H. antonii akibat perlakuan ekstrak buah cabai jawa 0.05% - 0.3% sudah terjadi pada 24 JSP. Sementara itu, antara 24 dan 48 JSP terjadi kematian serangga uji. Setelah 48 JSP hanya terjadi sedikit peningkatan kematian serangga uji pada proporsi yang lebih rendah (Gambar 8). Kematian serangga uji meningkat seiring dengan bertambahnya waktu dan makin tingginya konsentrasi ekstrak. Pada akhir pengamatan (120 JSP), perlakuan ekstrak cabai jawa konsentrasi 0.05% - 0.3% mengakibatkan kematian H. antonii 10% - 80% dengan kematian serangga kontrol 8% (Gambar 8).
LC50 ekstrak cabai jawa makin rendah pada pengamatan dari 24 sampai 120
JSP sementara LC95 ekstrak tersebut makin kecil dari 24 sampai 72 JSP tetapi
meningkat pada 96 dan 120 JSP (Tabel 2). Peningkatan LC95 pada dua
pengamatan terakhir disebabkan oleh peningkatan kematian serangga uji pada konsentrasi rendah dalam proporsi yang lebih besar dibandingkan dengan peningkatan kematian serangga uji pada konsentrasi yang lebih tinggi (Gambar 8). LC50 dan LC95 ekstrak cabai jawa pada 120 JSP masing-masing 0.20% dan 0.49%
(Tabel 2). Berdasarkan nilai LC95 tersebut dapat dikemukakan bahwa ekstrak
cabai jawa memenuhi batas kelayakan untuk penggunaan ekstrak dengan pelarut organik di lapangan, yaitu konsentrasi 0.50% (Dadang dan Prijono 2008).
Gambar 8 Perkembangan tingkat mortalitas imago H. antonii akibat perlakuan ekstrak cabai jawa
Kematian imago H. antonii setelah penyemprotan dengan ekstrak cabai jawa menunjukkan bahwa ekstrak tersebut memiliki efek kontak yang baik dan bersifat mematikan. Zarkani et al. (2009) melaporkan bahwa ekstrak cabai jawa memiliki efek kontak sedang terhadap larva Crocidolomia pavonana. Buah cabai jawa telah dilaporkan mengandung sejumlah senyawa piperamida yang bersifat insektisida seperti guininsin, pipersida, dan retrofraktamida A (Kikuzaki et al. 1993; Scott et
90.0
67.5
45.0
14
al. 2008). Miyakado et al. (1989) melaporkan bahwa pipersida bekerja sebagai racun saraf dengan efek knockdown yang cepat.
Tabel 2 Penduga parameter toksisitas ekstrak cabai jawa terhadap imago H. antonii
Pengaruh Subletal Ekstrak Cabai Jawa terhadap Jumlah Nimfa Keturunan
H. antonii
Perlakuan dengan ekstrak cabai jawa pada konsentrasi 0.141% (LC25) dan
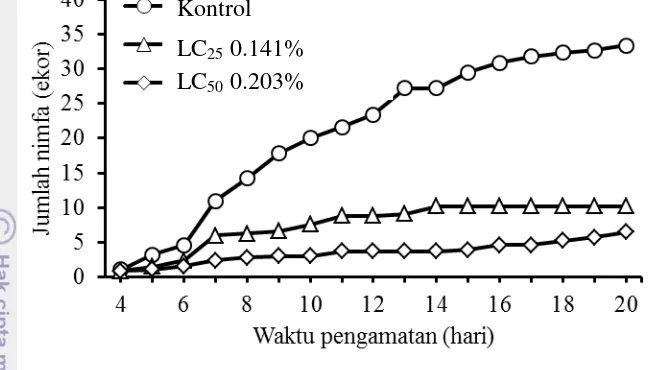
0.203% (LC50) menurunkan jumlah nimfa H. antonii yang dihasilkan jika
dibandingkan dengan kontrol (Gambar 9). Nimfa instar-1 H. antonii keturunan yang berkembang dari nimfa instar-4 yang diberi perlakuan pada konsentrasi subletal baru mulai muncul pada pengamatan hari keempat. Jumlah nimfa keturunan yang dihasilkan pada perlakuan ekstrak cabai jawa 0.203% lebih sedikit dibandingkan dengan perlakuan ekstrak tersebut pada konsentrasi 0.141%.
15
Gambar 9 Pengaruh konsentrasi subletal ekstrak cabai jawa terhadap jumlah nimfa keturunan H. antonii
Persistensi Ekstrak Cabai Jawa dalam Kaitan dengan Efek terhadap Mortalitas Imago H. antonii
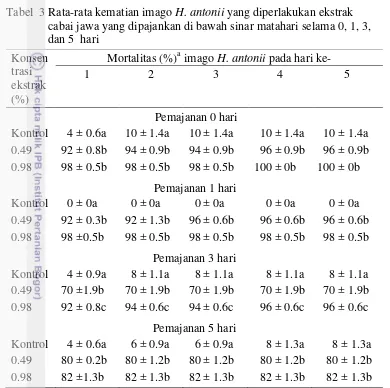
Perlakuan dengan ekstrak cabai jawa pada konsentrasi 0.49% (LC95) dan
0.98% (2 x LC95) yang tidak dipajankan pada sinar matahari (pemajanan 0 hari)
mengakibatkan kematian imago H. antonii masing-masing 92% dan 98% pada 1 hari setelah perlakuan (HSP) yang meningkat menjadi 96% dan 100% pada 5 HSP, sementara kematian serangga kontrol berkisar dari 4% pada 1 HSP sampai 10% pada 5 HSP (Tabel 3). Perlakuan dengan ekstrak cabai jawa yang dipajankan pada sinar matahari selama 1 hari masih dapat mengakibatkan kematian imago H. antonii lebih dari 95% pada 5 HSP, sementara pada kontrol tidak ada kematian serangga uji. Perlakuan dengan ekstrak cabai jawa 0.98% yang dipajankan pada sinar matahari selama 3 hari juga masih dapat mengakibatkan kematian imago H. antonii lebih dari 95% pada 5 HSP sementara keefektifan ekstrak 0.49% sudah menurun (kematian serangga uji 70%) dengan kematian serangga kontrol sebesar 8%. Kematian serangga uji menurun menjadi sekitar 80% pada perlakuan ekstrak cabai jawa 0.49% dan 0.98% yang dipajankan pada sinar matahari selama 5 hari (Tabel 3).
Bagian spektrum cahaya matahari yang dapat memutuskan ikatan kimia adalah sinar ultraviolet (Matsumura 1985). Hasil pengujian ini menunjukkan bahwa pemajanan sediaan ekstrak cabai jawa dalam botol kaca bening pada sinar matahari tidak mengakibatkan penurunan efek mortalitas yang cepat. Hal ini mungkin karena bahan kaca botol yang digunakan sebagai tempat sediaan ekstrak yang dipajankan tidak meneruskan sinar ultraviolet 100% atau karena bahan aktif ekstrak terlindung dalam suspensi ekstrak bukan dalam bentuk lapisan tipis seperti pada permukaan daun. Pebrulita et al. (2013) melaporkan bahwa residu ekstrak
Piper aduncum yang disemprotkan pada tanaman brokoli kehilangan aktivitasnya terhadap larva C. pavonana hanya dalam waktu 24 jam pemajanan, yaitu mortalitas serangga tersebut menurun dari 100% pada perlakuan dengan deposit ekstrak segar (pemajanan 0 hari) menjadi 0% - 11% pada perlakuan dengan residu ekstrak pada daun brokoli yang terpajan pada sinar matahari selama 24 jam. Perbedaan persistensi tersebut dapat disebabkan oleh perbedaan cara pemajanan
LC50 0.203%
LC25 0.141%
16
ekstrak atau perbedaan persistensi bahan aktif kedua ekstrak tersebut terhadap pajanan cahaya matahari. Untuk memastikan persistensi ekstrak cabai jawa di lapangan, perlu dilakukan uji persistensi dengan perlakuan penyemprotan ekstrak pada permukaan daun.
Tabel 3 Rata-rata kematian imago H. antonii yang diperlakukan ekstrak cabai jawa yang dipajankan di bawah sinar matahari selama 0, 1, 3,
Untuk setiap kelompok pemajanan, rataan pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
Persistensi Ekstrak P. retrofractum dalam Kaitan dengan Efek terhadap Oviposisi H. antonii
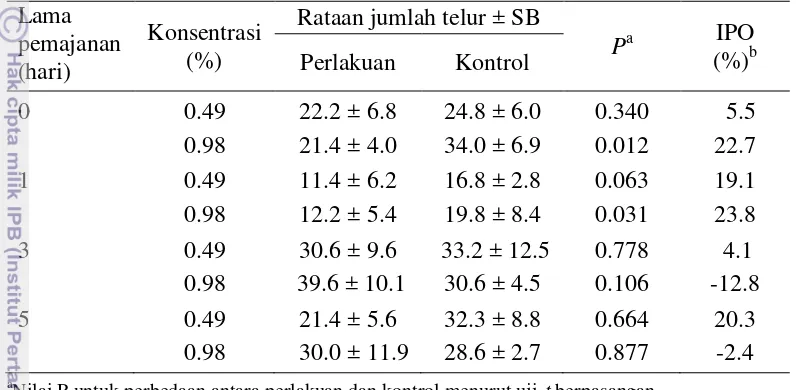
Perlakuan ekstrak cabai jawa konsentrasi 0.98% (2 x LC95) dengan
pemajanan 0 dan 1 hari menekan secara nyata jumlah telur yang diletakkan oleh imago H. antonii dibandingkan dengan kontrol, dengan indeks penghambatan oviposisi masing-masing 22.7% dan 23.8% (Tabel 4), sedangkan pada pemajanan ekstrak cabai jawa selama 3 dan 5 hari, jumlah telur yang diletakkan pada buah mentimun perlakuan tidak berbeda nyata dengan jumlah telur pada buah mentimun kontrol.
Dolui et al. (2012) melaporkan bahwa aplikasi ekstrak metanol daun
17
penghambatan oviposisi pada Trichoplusia ni. Penerimaan tanaman inang oleh serangga sebagai tempat peletakan telur bergantung pada pengaturan sistem saraf kemosensori dan mekanosensori serangga yang menentukan keseimbangan respons terhadap senyawa stimulan dan deteren yang terdapat pada permukaan tanaman (Schoonhoven et al. 2005).
Tabel 4 Pengaruh ekstrak cabai jawa yang dipajankan di bawah sinar matahari selama 0, 1, 3, dan 5 hari terhadap oviposisi H. antonii (metode pilihan)
Nilai P untuk perbedaan antara perlakuan dan kontrol menurut uji-t berpasangan,
b
IPO = indeks penghambatan oviposisi.
Pembahasan Umum
Toksisitas ekstrak etil asetat cabai jawa dalam penelitian ini (LC50 dan LC95)
pada 120 JSP masing-masing 0.203% dan 0.493%. Ekstrak buah cabai jawa ini cukup potensial untuk dikembangkan lebih lanjut karena LC95 dicapai pada
konsentrasi < 0.5%. Menurut Dadang dan Prijono (2008) ekstrak kasar tumbuhan pada konsentrasi 0.5% cukup efisien untuk dikembangkan sebagai sumber insektisida nabati. Ekstrak buah cabai jawa memiliki senyawa aktif isobutilamida tidak jenuh, seperti pipersida dengan aktivitas insektisida yang kuat dan bekerja sebagai racun saraf sehingga efek mematikannya berlangsung cepat (Scott at al. 2008). Kelebihan lain dari buah cabai jawa adalah adanya efek sinergisme. Hal tersebut terjadi karena adanya senyawa yang mengandung gugus metilendioksifenil yang bersifat sinergis seperti guininsin, pipersida, dan dihidropipersida (Scott et al. 2008). Buah cabai jawa juga mengandung senyawa lain yang memiliki gugus metilendioksifenil termasuk piperin, retrofractamida A, C, dan D, sesamin dan metil piperat (Parmar et al. 1997). Berdasarkan hasil tersebut, ekstrak cabai jawa diharapkan dapat bersifat sinergis apabila dicampurkan dengan insektisida lain. Beberapa hasil penelitian melaporkan sinergisme cabai jawa dengan insektisida nabati lainnya seperti ekstrak P. retrofractum + A. squamosa (1 : 2) terhadap kutu putih pepaya P. marginatus
(Asnan 2014), dan ekstrak P. retrofractum + T. vogelii (1 : 1) terhadap ulat krop kubis C. pavonana (Nurfajrina 2014).
Perlakuan dengan konsentrasi subletal ekstrak cabai jawa 0.141% (LC25)
dan 0.203% (LC50) menyebabkan penurunan jumlah nimfa keturunan H. antonii.
18
menimbulkan resurjensi sehingga insektisida nabati tersebut dapat diintegrasikan dalam program pengendalian hama terpadu terhadap H. antonii.
Persistensi merupakan jangka waktu senyawa aktif insektisida masih memiliki aktivitas biologi. Radiasi sinar matahari terutama sinar ultraviolet dan curah hujan dapat memengaruhi persistensi insektisida di alam. Pengujian persistensi pada insektisida nabati perlu dilakukan karena senyawa insektisida nabati mudah terurai bila dipajankan di bawah sinar matahari khususnya bagian spektrum ultraviolet (Dadang dan Prijono 2008). Persistensi insektisida nabati yang singkat menyebabkan aplikasi yang berulang-ulang sehingga tidak menguntungkan dari segi ekonomi. Akan tetapi sifat insektisida nabati yang memiliki persistensi singkat memungkinkan aplikasi beberapa saat menjelang panen. Hasil penelitian ini menunjukkan bahwa ekstrak cabai jawa yang dipajankan di bawah sinar matahari selama 5 hari masih efektif dalam mematikan imago H. antonii. Dadang et al. (2007) melaporkan bahwa campuran ekstrak cabai jawa + A. squamosa (3:7) pada konsentrasi 0.1% yang dipajankan di bawah sinar matahari selama 10 hari menyebabkan mortalitas larva C. pavonana lebih dari 97%. Akan tetapi hasil penelitian Asnan (2014) menunjukkan bahwa aktivitas formulasi ekstrak P. retrofractum + A. squamosa (1 : 2) terhadap P. marginatus
semakin menurun seiring dengan lamanya formulasi tersebut dipajankan di bawah sinar matahari.
Serangga dewasa betina memilih untuk meletakkan telur pada bagian tumbuhan yang akan mendukung pertumbuhan optimal keturunannya. Morfologi permukaan tanaman berpengaruh terhadap penentuan serangga betina sebagai tempat peletakan telur. Permukaan daun yang kasar lebih cenderung dipilih
Plutella xylostella dari pada yang halus (Schoonhoven et al. 2005). Permukaan buah kakao yang kasar diharapkan dapat menahan aliran permukaan ekstrak insektisida nabati yang disemprotkan sehingga mampu menghambat peletakan telur oleh serangga betina Helopeltis spp.
SIMPULAN DAN SARAN
Simpulan
Ekstrak etil asetat buah cabai jawa memiliki efek kontak terhadap imago H. antonii dengan LC95 sebesar 0.49% pada 5 hari setelah perlakuan. Ekstrak tersebut
pada konsentrasi subletal dapat menekan jumlah nimfa keturunan yang dihasilkan. Ekstrak cabai jawa yang dipajankan di bawah sinar matahari hingga 5 hari masih efektif terhadap imago H. antonii (mortalitas 80%) tetapi tidak efektif dalam menghambat peletakan telur.
Saran
20
DAFTAR PUSTAKA
Ahn JW, Lee CO, Kim EJ, Zee OP, Kim HJ. 1992. Piperoctadecalidine, a new piperidine alkaloid from Piper retrofractum fruits. Bul Kor Chem Soc. 13(4):388-391.
Akhtar Y, Yu Y, Isman MB, Pletner E. 2010. Dialkoxybenzene and dialkoxyallyl benzene feeding and oviposition deterrents against the cabbage looper,
Trichoplusia ni: potential insect behavior agents. J Agric Food Chem. 58(8):4983-4991.
Anggarawati SH. 2014. Upaya pengendalian hayati Helopeltis sp. hama penting tanaman Acacia crassicarpa dengan cendawan Beauveria bassiana dan
Lecanicillium lecanii [tesis]. Bogor (ID): Institut Pertanian Bogor.
Asnan TAW. 2014. Keefektifan campuran ekstrak tumbuhan untuk pengendalian hama kutu putih Paracoccus marginatus Williams and Granara de Willink (Hemiptera: Pseudococcidae) [tesis]. Bogor (ID): Institut Pertanian Bogor. Atmadja WR. 2003. Status Helopeltis antonii sebagai hama pada beberapa
tanaman perkebunan dan pengendaliannya. J Litbang Pertanian. 22(2):57-63.
Atmadja WR. 2008. Pengaruh minyak jahe merah, pala dan selasih terhadap
Helopeltis antonii Sign. pada inang alternatif. Bul Littro. 19(2):154-163. Atmadja WR. 2012. Pengendalian Helopeltis secara terpadu pada tanaman
perkebunan. Sirkuler Teknologi Tanaman Rempah dan Obat. Bogor. (ID): Unit Penerbitan dan Publikasi Balittro.
Atmadja WR, Ma’mun, Suriati S. 2009. Efektifitas minyak masoyi (Massoia aromatica) terhadap Helopeltis antonii Sign. pada jambu mete dan
Chrysocoris javanus pada jarak pagar. Bul Littro. 20(2):141-147.
Atmadja WR, Suriati S. 2009. Keefektifan minyak selasih (Ocimum basilicum
dan Ocimum minimum) terhadap mortalitas Helopeltis antonii Sign. pada inang alternatif. Di dalam: Prosiding Simposium V Penelitian dan Pengembangan Perkebunan; 2009 Agustus 14; Bogor, Bogor (ID): Pusat Penelitian dan Pengembangan Perkebunan. hlm 393-396.
Barthakur BK. 2011. Recent approach of tocklai to plant protection in tea in North East India. Science and Culture. 77(9-10):381-384.
Bateman R. 2007. Overview of cocoa pests in Asia and Pasific Islands. SEA Cocoa Overview 1.1. London. (GB): IPARC.
Bath PS, Srikumar KK. 2013. Record of egg parasitoids Telenomus sp. laricis group (Hymenoptera: Platygastridae) and Chetostricha sp. (Hymenoptera: Trichogrammatidae) from Helopeltis theivora Waterhouse (Heteroptera: Miridae) infesting cocoa. Int J Agric Sci. 3(5):510-512.
Bernard CB, Krishnamurty HG, Chauret D, Durst T, Philogene BJR, Sanchez-Vindas P, Hasbun C, Poveda L, Roman LS, Arnason JT. 1995. Insecticidal defenses of Piperaceae from the Neotropics. J Chem Ecol. 21(6):801-814. [CABI] Centre for Agriculture and Biosciences International. 2012. Crop
Protection Compendium. Wallingford (GB): CABI.
Chowdhury RS, Ahmed M, Mamun MSA, Paul SK. 2013. Relative efficacy of some insecticides for the control of tea mosquito bug, Helopeltis theivora
21
Dadang, Isnaeni N, Oshawa K. 2007. Ketahanan dan pengaruh fitotoksik campuran ekstrak Piper retrofractum dan Annona squamosa pada pengujian semi lapangan. J HPT Tropika. 7(2):91-99.
Dadang, Prijono D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan, dan Pengembangan. Bogor (ID): Departemen Proteksi Tanaman. Institut Pertanian Bogor.
Darwis M, Atmadja WR. 2010. Pemanfaatan sepuluh jenis tanaman obat dan aromatik untuk pengendalian hama Helopeltis theivora Watch. Di dalam:
Prosiding Seminar Nasional VI: Peranan Entomology dalam Mendukung Pengembangan Pertanian Ramah Lingkungan dan Kesehatan Masyarakat; 2010 Juni 24; Bogor. Bogor (ID): Perhimpunan Entomologi Indonesia (PEI). hlm 328-336.
Debnath M, Rudrapal M. 2011. Tea mosquito bug Helopeltis theivora
Waterhouse: A threat for tea plantation in North East India. Asian J Biochem and Pharm Res. 4(1):70-73.
Dewi RS. 2010. Keefektifan ekstrak tiga jenis tumbuhan terhadap Paracoccus marginatus dan Tetranychus sp. pada tanaman jarak pagar (Jatropha curcas
L.) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Dolui AK, Debnarth M, De B, Kumar A. 2012. Reproductive activities of
Heliotropium indicum isolate against Helopeltis theivora and toxicity evaluation in mice. J Environ Biol. 33:603-607.
Finney DJ. 1971. Probit Analysis. Ed ke-3. Cambridge: Cambridge Univ Press. Gogoi B, Choudhury K, Sharma M, Rahman A, Borthakur M. 2012. Studies on
the host range of Helopeltis theivora. Two and a Bud. 59:31-34.
Grainge M, Ahmed S. 1988. Handbook of Plants with Pest Control Properties. New York.(US): John Wiley and Sons.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Jilid ke-2. Badan Litbang Kehutanan, penerjemah. Jakarta (ID): Yayasan Sarana Warna Jaya. Terjemahkan dari: De Nuttige Planten van Ned-Indie.
Jalgaonkar VN, Gawankar MS, Bendale VW, Patil PD. 2009. Efficacy of some insecticides against cashew tea mosquito bug Helopeltis antonii Sign. J Plant Protec Sci. 1(1):96-97.
Kardinan A, Sondang S. 2012. Efektivitas pestisida nabati terhadap serangan hama pada teh (Camellia sinensis L.). Bul Littro. 23(2):148-152.
Karmawati E, Mahmud Z, Syakir M, Munarso J, Ardana K, Rubiyo. 2010.
Budidaya dan Pascapanen Kakao. Bogor (ID): Pusat Penelitian dan Pengembangan Perkebunan.
Kikuzaki H, Kawabata M, Ishida E, Akazawa Y, Takei Y, Nakatani N. 1993. LC-MS analysis and structural determination of new amides from Javanese long pepper (Piper retrofractum). Biosci Biotech Biochem. 57(8):1329–1333. Kilin D, Atmaja WR. 2000. Perbanyakan serangga Helopeltis antonii SIGN. pada
buah ketimun dan pucuk jambu mete. Jurnal Littri. 5(4):119-122.
Kresnawaty I, Budiani A, Wahab A, TW Darmono. 2010. Aplikasi biokaolin untuk perlindungan buah kakao dari serangan PBK, Helopeltis spp. dan
Phytophthora palmivora. Menara Perkebunan. 78(1):25-31.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (US): LeOra Software. Lim TK. 2012.Piper retrofractum. Edible Medicinal and Non-Medicinal Plants.
22
Matsumura F. 1985. Toxicology of Insecticides. Ed ke-2. New York (US): Plenum Press.
Mamun MSA, Ahmed M. 2011. Integrated pest management in tea: prospects and future strategies in Bangladesh. J Plant Protec Sci. 3(2):1-13.
Miyakado M, Nakayama I, Ohno N. 1989. Insecticidal unsaturated isobutylamides. Di dalam: Arnason JT, Philogene BJR, Morand P, editor.
Insecticides of Plant Origin. Washington DC (US): American Chemical Society. hlm 173-187.
Nurfajrina A. 2014. Kesesuaian ekstrak Piper spp. (Piperaceae) untuk meningkatkan toksisitas ekstrak Tephrosia vogelii terhadap ulat krop kubis
Crocidolomia pavonana [skripsi]. Bogor (ID): Institut Pertanian Bogor. Parmar VS, Jain SC, Bisht KS, Jain R, Taneja PO, Jha A, Tyagi OD, Prasad AK,
Wengel J, Olsen CE, Boll PM. 1997. Phytocehmistry of the genus Piper.
Phytochemistry. 46(4):97-673.
Pebrulita YM, Dadang, Prijono D. 2013. Aktivitas insektisida ekstrak Piper aduncum asal Riau terhadap larva Crocidolomia pavonana. Di dalam:
Prosiding Seminar Nasional dan Lokakarya Forum Komunikasi Perguruan Tinggi Pertanian Indonesia; 2013 Sep 2-4; Bogor, Indonesia. Bogor (ID): Fakultas Pertanian, Institut Pertanian Bogor. hlm 605-614.
Prijono D, Sudiar JI, Irmayetri. 2006. Insecticidal activity of Indonesian plant extracts against the cabbage head caterpillar, Crocidolomia pavonana (F.). (Lepidoptera: Pyralidae). J ISSAAS. 12(1):25-34.
Rassami W, Soonwera M. 2011. Effect of herbal shampoo long pepper fruit extract to control human head louse of the Ladkrabang childrens, Bangkok, Thailand. J Agric Technol. 7(2):331-338.
Roy S, Mukhopadhyay A, Gurusubramanian G. 2011. Resistance to insecticides in field-collected populations of tea mosquito bug (Helopeltis theivora
Waterhouse) from the Dooars (North Bengal, India) tea cultivations. J Entomol Res Soc. 13(2):37-44.
SAS Institute. 1990. SAS/STAT User’s Guide, Version 6, Volume 2. Ed ke-4. Cary (US): SAS Institute.
Sarker M, Mukhopadhyay A. 2006. Studies on salivary and midgut enzymes of a major sucking pest of tea, Helopeltis theivora (Hemiptera: Miridae) from Darjeeling plains, India. J Ent Res Soc. 8(1):27-36.
Schoonhoven LM, van Loon JJA, Dicke M. 2005. Insect-Plant Biology. New York (US): Oxford University Press.
Scott IM, Jensen HR, Philogene BJR, Arnason JT. 2008. A review of Piper spp. (Piperaceae) phytocemistry, insecticidal activity and mode of action.
Phytocem Rev. 7(1):65-75.
Siswanto, Muhamad R, Omar D, Karmawati E. 2009. The effect of mating on the eggs’ fertility and fecundity of Helopeltis antonii (Heteroptera: Miridae).
Trop Life Sci Res. 20(1):89–97.
Siswanto, Karmawati E. 2012. Pengendalian hama utama kakao (Conopomorpha cramerella dan Helopeltis spp.) dengan pestisida nabati dan agens hayati.
Perspektif Review Penelitian Tanaman Industri. 11(2):69-78.
Solikha DR. 2013. Infektivitas cendawan Lecanicillium lecanii terhadap telur
23
Srikumar KK, Bhat PS. 2012. Field survey and comparative biology of tea mosquito bug (Helopeltis spp.) on cashew (Anacardium occidentale Linn,).
J Cell Anim Biol. 6(14):200-206.
Srikumar KK. dan Bhat PS. 2013a. Biology and feeding behavior of Helopeltis antonii (Hemiptera:Miridae) on Singapore cherry (Muntingia calabura) - a refuge host. J Ent Res. 37(1):11-16.
Srikumar KK, Bhat PS. 2013b. Demographic parameters of Helopeltis antonii
Signoret (Heteroptera: Miridae) on neem, cocoa and henna. Afr J Agric Res. 8(35):4466-4473.
Srikumar KK, Bhat PS, Vanitha K, Rajmohana K, and Raviprasad TN. 2014. Phenology and parasitization behavior of Telenomus cuspis (Hymenoptera: Platygastridae) an egg parasitoid of Helopeltis antonii (Hemiptera: Miridae) in cashew. Proc. Natl. Acad. Sci. DOI 10.007/s40011-014-0365-0.
Sudarmadji D, Gunawan S. 1994. Patogenisitas fungi entomopatogen Beauveria bassiana terhadap Helopeltis antonii. Menara Perkebunan. 62(1):1-5. Sulistyowati E, Ghorir M, Wardani S, Purwoko S. 2014. Keefektifan serai,
bawang putih, dan bunga paitan sebagai insektisida nabati terhadap pengisap buah kakao, Helopeltis antonii. Pelita Perkebunan. 30(1):35-46. Sulistyowati E. 2015. Hama utama tanaman kakao.dan pengendaliannya. Di
dalam: Wahyudi T, Pujiyanto, Misnawi editor. Kakao Sejarah, Botani, Proses Produksi, Pengolahan, dan Perdagangan Yogyakarta (ID): Gajah Mada University Press. hal 307-334.
Vinay S, Renuka K, Palak V, Harisha CR, Prajapati PK. 2012. Pharmacognostical and phytochemical study of Piper longum and Piper retrofractum Vahl. J Pharm Sci Inov. 1(1):62-66.
Wheeler AG. 2001. Biologi of the plant bugs (Hemiptera: Miridae). New York (US): Cornell University Press.
Wiryadiputra S. 2007. Pemaparan semut hitam (Dolichoderus thoracicus) pada perkebunan kakao dan pengaruhnya terhadap serangan hama Helopeltis spp.
Pelita Perkebunan. 23(1):57-71.
Zarkani A, Prijono D, Pudjianto. 2009. Pengujian ekstrak Piper retrofractum
26
Lampiran 1 Mortalitas imago H. antonii pada perlakuan ekstrak etil asetat buah cabai jawa (uji pendahuluan)
Konsentrasi (%)
Mortalitas kumulatif (%) pada JSPa
24 48 72 96 120
JSP = jam setelah perlakuan. Jumlah serangga uji pada awal perlakuan adalah 10 ekor imago H. antonii
Lampiran 2 Mortalitas imago H. antonii pada perlakuan ekstrak etil asetat buah cabai jawa (uji lanjut)
Konsentrasi (%)
Mortalitas kumulatif (%) pada JSPa
24 48 72 96 120
27
Lampiran 3 Pengaruh konsentrasi subletal ekstrak cabai jawa terhadap jumlah nimfa keturunan H. antonii
Konsentrasi
Rata-rata jumlah nimfa keturunan H. antonii pada n hari setelah kemunculan imago
4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 K 1.1 3.2 4.6 11.0 14.2 17.8 20 21.6 23.4 27.2 27.2 29.5 30.9 31.8 32.3 32.7 33.4
0.141% (LC25) 0.9 1.5 2.4 6.0 6.3 6.6 7.6 8.8 8.8 9.1 10.2 10.2 10.2 10.2 10.2 10.2 10.2
0.203% (LC50) 0.9 1.1 1.6 2.4 2.8 3.0 3.0 3.7 3.7 3.7 3.7 3.9 4.6 4.6 5.2 5.7 6.5
28
29
Lampiran 4 lanjutan
15 13
17 28
5 0.49 27 30
21 12
27 14
26 19
15 26
5 0.98 40 19
44 29
28
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 2 Januari 1965 sebagai anak ketiga dari empat bersaudara dari pasangan Bapak Chatib Abidin dan Ibu Nursiam. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 39 Jakarta pada tahun 1984 dan pendidikan sarjana di Jurusan Hama dan Penyakit Tanaman, Fakultas Pertanian, Universitas Jenderal Soedirman Purwokerto pada tahun 1990.