INISIASI, PROLIFERASI, DAN PEMBESARAN
PROTOCORM-LIKE BODIES
ANGGREK
DENDROBIUM
KLON 22/25
DWI RETNO ARYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Inisiasi, Proliferasi, dan Pembesaran Protocorm-like Bodies Anggrek Dendrobium klon 22/25 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
Dwi Retno Aryati
RINGKASAN
DWI RETNO ARYATI. Inisiasi, Proliferasi, dan Pembesaran Protocorm-like Bodies Anggrek Dendrobium klon 22/25. Dibimbing oleh AGUS PURWITO, DINY DINARTI dan SRI RIANAWATI.
Embrio somatik tanaman anggrek lebih dikenal dengan nama Protocorm-like bodies (plb). Produksi plb adalah salah satu metode perbanyakan anggrek secara cepat. Plb dapat diperbanyak secara langsung (embriogenesis langsung) dan tidak langsung (embriogenesis tidak langsung). Keberhasilan perbanyakan melalui plb tergantung dari eksplan, genotipe dan media kultur. Media yang tidak tepat dapat menyebabkan plb gagal terbentuk atau beregenerasi. Tujuan dari penelitian ini adalah 1) untuk mendapatkan media yang tepat untuk menginisiasi kalus dan plb Dendrobium klon 22/25, 2) mendapatkan media dan ukuran eksplan yang tepat untuk proliferasi plb Dendrobium klon 22/25 dan 3) mendapatkan media yang tepat untuk perkecambahan dan pembesaran plb Dendrobium klon 22/25.
Penelitian dilakukan pada November 2012 sampai Desember 2013 dan terdiri atas tiga percobaan. Percobaan 1.a adalah inisiasi kalus yang berasal dari eksplan daun. Percobaan disusun berdasarkan rancangan acak lengkap. Faktor 1.b adalah inisiasi plb dengan menggunakan kalus hasil dari percobaan pertama sebagai eksplan. Percobaan disusun berdasarkan rancangan acak lengkap. Faktor yang digunakan adalah media asal inisiasi kalus yang terdiri atas media MS ditambah dengan 10 mg L-1 6-benzil-amino purin, media ½ MS ditambah dengan 4 mg L-1 thidiazuron dan media ½ MS ditambah dengan 1 mg L-1 6-benzil-amino purin. Setiap perlakuan diulang sebanyak 3 ulangan (satu eksplan per botol untuk setiap ulangan).
Percobaan kedua adalah proliferasi plb anggrek Dendrobium klon 22/25. Percobaan disusun berdasarkan rancangan acak lengkap faktorial dua faktor. Faktor pertama adalah konsentrasi NAA (0.0, 0.1, 0.3 dan 0.5 mg L-1) sedangkan faktor kedua adalah ukuran eksplan plb (0.5, 1.0 dan 1.5 cm2). Setiap perlakuan diulang sebanyak 3 ulangan (satu eksplan per botol untuk setiap ulangan). Percobaan ketiga adalah perkecambahan dan pembesaran plb anggrek Dendro-bium klon 22/25. Percobaan disusun berdasarkan rancangan acak lengkap fakto-rial dua faktor. Faktor pertama adalah jenis dan konsentrasi sitokinin (0.0, 0.5, 1.0 dan 2.0 mg L-1 adenin sulfat serta 0.5, 1.0 dan 2.0 mg L-1 kinetin) sedangkan fak-tor kedua adalah konsentrasi sukrosa (10, 20 dan 30 g L-1). Setiap perlakuan di-ulang sebanyak 10 di-ulangan (satu eksplan per botol untuk setiap di-ulangan).
persentase eksplan berkalus adalah 20-42%, dan inisiasi tertinggi didapatkan dari media MS ditambah dengan 10 mg L-1 6-benzil-amino purin. Hasil pada percobaan 1.b menunjukkan bahwa kalus yang berasal dari media ½ MS ditambah dengan 1 mg L-1 6-benzil-amino purin beregenerasi menghasilkan jumlah plb tertinggi, yaitu 81 plb dalam dua bulan. Hasil pada percobaan ke-2 menunjukkan bahwa eksplan dengan ukuran cluster plb 0.5 cm2 menghasilkan rataan pertam-bahan luas cluster plb tertinggi yaitu 1.95 cm2 pada 12 MST. Ukuran eksplan 1.5 cm2 menghasilkan jumlah plb tertinggi yaitu 148.17 plb pada 12 MST. Hasil percobaan ke-3 menunjukkan bahwa media tanpa penambahan sitokinin dengan penambahan 20 g L-1 sukrosa menghasilkan rataan jumlah tunas yang cukup tinggi pada 12 MST, masing-masing 62 tunas per botol.
Media Murashige dan Skoog yang ditambahkan dengan 10 mg L-1 6-benzil- aminopurin merupakan media yang tepat untuk menginisiasi kalus Dendrobium
klon 22/25. Kalus yang dihasilkan oleh media ½ MS yang ditambah dengan 1 mg L-1 benzilamino purin mampu beregenerasi menjadi plb dengan jumlah plb tertinggi. Media Vacin dan Went tanpa auksin merupakan media yang paling baik untuk proliferasi plb Dendrobium klon 22/25 dengan cluster plb berukuran 1 cm2 (10 plb). Media Vacin dan Went tanpa sitokinin dengan penambahan sukrosa 20 g L-1 merupakan media yang paling baik untuk pembesaran plb Dendrobium klon 22/25.
SUMMARY
DWI RETNO ARYATI. Initiation, Proliferation, and Maturation Protocorm-like Bodies of Dendrobium orchid’s Clone 22/25. Supervised by AGUS PURWITO, DINY DINARTI dan SRI RIANAWATI.
Production of somatic embryo of orchid also known as protocorm-like bodies (plb), is one of the orchid micropropagation techniques. Plb was produced through direct formation (direct embryogenesis) and intermediary callus phase (indirect embryogenesis). The aim of this research was to obtained 1) appro-ppriate medium for callus and plb initiation, 2) approappro-ppriate medium and explant size for plb proliferation and 3) approppriate medium for regeneration of Dendrobium clone 22/25.
This study was conducted from November 2012 until December 2013, and consisted of three experiment. The first experiment (1.a) was callus initiation from leaf explant. This research was arranged in single randomized complete design. The factor was initiation medium i.e : MS supplemented with 10 mg L-1 6-benzil-amino purine (K1), ½ MS supplemented with 4 mg L-1 thidiazuron (K2), ½ MS supplemented with 1 mg L-1 6-benzil-amino purine (K3), and VW supplemented with 2 mg L-1 thidiazuron dan 1 mg L-1 2,4-dichlorophenoxy-acetic acid. All treatments were carried out with 10 replications (5 explants for each). The next experiment (1.b) was plb initiation using the same medium as in the first experiment. This experiment was arranged in single randomized complete design. The factor was medium i.e : MS supplemented with 10 mg L-1 6-benzil-amino purine, ½ MS supplemented with 4 mg L-1 thidiazuron, ½ MS supplemented with 1 mg L-1 6-benzil-amino purine. All treatments were carried out with three replications (1 explant for each).
Second experiment was plb’s proliferation. This research was arranged in factorial randomized complete design. The factor was four concentration of NAA (0.0, 0.1, 0.3, 0.5 mg L-1) and size of plb (0.5, 1.0, 1.5 cm2). All treatments were carried out with 3 replications (1 explants for each). Third experiment was plb’s maturation. This research was arranged in factorial randomized complete design. The factor was concentration of cytokinin (0.0, 0.5, 1.0, 2.0 mg L-1 adenine sulfate, and 0.5, 1.0, 2.0 mg L-1 kinetin) and concentration of sucrose (10, 20 and 30 g L-1). All treatments were carried out with 10 replications (1 explants for each).
The result from experiment 1.a showed that calli was obtained from medium MS supplemented with 10 mg L-1 6-benzil-amino purine, ½ MS supplemented with 4 mg L-1 thidiazuron, and ½ MS supplemented with 1 mg L-1 6-benzil-amino purine. The highest percentage of callused explant was 20-42% and the highest initiation obtained on medium MS supplemented with 10 mg L-1 6-benzil-amino purine. The result from experiment 1.b showed that callus obtained from ½ MS supplemented with 1 mg L-1 6-benzil-amino purine regenerated and produced the highest number of plbs, 81 plbs in two months.
size 1.0 cm2 showed unsignificantly different number of plb’s with size 1.5 cm2, 112.40 plb. The result from experiment 3 showed medium without sitokinin added with 20 g L-1 sucrose produce high amount of shoot in 12 weeks, 62 shoot per bottle.
Murashige dan Skoog medium supplemented with 10 mg L-1 6-benzil- aminopurin was the best medium for callus initiation of Dendrobium clone 22/25. Calli from ½ Murashige dan Skoog medium supplemented with 1 mg L-1 6-benzil-aminopurin was regenerated to plbs with the highest average number of plbs. Vacin and Went medium without NAA was the best medium for plb’s proliferation of Dendrobium clone 22/25 with size of plb 1 cm2 (approximately 10 plb). Vacin and Went medium without sitokinin supplemented with 20 g L-1 sucrose was the best medium for maturation Dendrobium clone 22/25.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
INISIASI, PROLIFERASI, DAN PEMBESARAN
PROTOCORM-LIKE BODIES
ANGGREK
DENDROBIUM
KLON 22/25
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Inisiasi, Proliferasi, dan Pembesaran Protocorm-like Bodies
Anggrek Dendrobium Klon 22/25
Nama : Dwi Retno Aryati
NIM : A253110091
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Purwito, MScAgr Ketua
Dr Dra Sri Rianawati, MSi Anggota
Dr Ir Diny Dinarti, MSi Anggota
Diketahui oleh Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr Ir Yudiwanti Wahyu EK, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Alhamdulillah segala puji penulis panjatkan ke hadirat Allah swt., Tuhan Yang Maha Esa, atas segala curahan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan Tesis yang berjudul : Inisiasi, Proliferasi, dan Pembesaran
Protocorm-like Bodies Anggrek Dendrobium Klon 22/25. Tesis ini merupakan salah satu syarat dalam rangka penyelesaian program Magister pada Sekolah Pascasarjana Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada :
1. Dr Ir Agus Purwito, MScAgr sebagai Ketua Komisi Pembimbing yang telah memberikan arahan dan bimbingan dalam rangka penyelesaian studi melalui penyelesaian Tesis ini.
2. Dr Ir Diny Dinarti, MSi sebagai Anggota Komisi Pembimbing yang telah memberikan arahan dan bimbingan, sehingga Tesis ini dapat diselesaikan dengan baik.
3. Dr Dra Sri Rianawati, MSi sebagai Anggota Komisi Pembimbing yang telah memberikan arahan dan bimbingan, sehingga Tesis ini dapat diselesaikan dengan baik.
4. Dr Ir Yudiwanti Wahyu EK, MS, sebagai Ketua Program Studi Pemu-liaan dan Bioteknologi Tanaman, Sekolah Pascasarjana IPB, yang telah memberikan arahan dan kesempatan kepada penulis untuk menyelesaikan Tesis ini.
5. Dr Dewi Sukma, SP MSi sebagai Penguji Luar Komisi, yang telah bersedia untuk menguji dan memberikan arahan serta masukan kepada penulis.
6. Dr Ir Abdul Qadir, MSi, yang telah memberikan arahan dan kesempatan kepada penulis untuk menyelesaikan Tesis ini.
7. Program Diploma IPB yang telah memberikan bantuan dana bantuan pendidikan.
8. LPDP Kementerian Keuangan Republik Indonesia yang telah memberi-kan bantuan dana penelitian.
9. Semua pihak yang telah membantu penulis dalam penyelesaian Tesis ini. Demikian Tesis ini dibuat dalam rangka penyelesaian program Magister Sekolah Pascasarjana Institut Pertanian Bogor.
Bogor, Mei 2015
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 5
Teknik Kultur Jaringan 5
Inisiasi, Proliferasi, dan Regenerasi Embrio Somatik 6
BAHAN DAN METODE 8
Waktu dan Tempat Pelaksanaan 8
Bahan dan Alat 8
Pelaksanaan Percobaan 9
HASIL DAN PEMBAHASAN 12
Inisiasi Kalus Dendrobium Klon 22/25 12
Inisiasi Protocorm-like Bodies Dendrobium Klon 22/25 17 Proliferasi Protocorm-like Bodies Dendrobium Klon 22/25 21 Pembesaran Protocorm-like Bodies Dendrobium Klon 22/25 27
PEMBAHASAN UMUM 37
Inisiasi, Proliferasi dan Pembesaran Protocorm-like Bodies
Dendrobium Klon 22/25 37
Pengembangan Teknologi Produksi Dendrobium Klon 22/25 melalui
Protocorm-like Bodies 39
SIMPULAN DAN SARAN 41
Simpulan 41
Saran 41
DAFTAR PUSTAKA 42
LAMPIRAN 47
DAFTAR TABEL
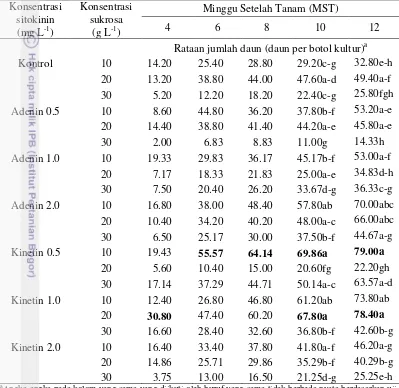
1 Persentase eksplan hidup, eksplan mati dan eksplan berwarna cokelat
Dendrobium klon 22/25 pada empat perlakuan media inisiasi pada 8
MST 12
2 Persentase eksplan berkalus pada 8 MST dan waktu munculnya kalus
Dendrobium klon 22/25 pengaruh media inisiasi kalus 13 3 Nilai rataan diameter kalus Dendrobium klon 22/25 pengaruh media
inisiasi kalus pada 4, 6 dan 8 MST 15
4 Nilai rataan bobot, ukuran dan jumlah plb total pengaruh media asal
inisiasi kalus pada 8 MST 20 pengaruh ukuran eksplandan konsentrasi NAA pada 12 MST 25 8 Nilai rataan jumlah daun Dendrobium klon 22/25 pengaruh
konsen-trasi sitokinin dan sukrosa pada 4, 6, 8, 10 dan 12 MST 28 9 Nilai rataan jumlah akar Dendrobium klon 22/25 pengaruh
konsen-trasi sitokinin dan sukrosa pada 12 MST 30
10 Nilai rataan jumlah tunas Dendrobium klon 22/25 pengaruh
konsen-trasi sitokinin dan sukrosa pada 4-12 MST 33
11 Nilai rataan tinggi tunas Dendrobium klon 22/25 pengaruh konsen-trasi sitokinin dan sukrosa pada 4 sampai dengan 12 MST 36
DAFTAR GAMBAR
4 Eksplan daun pada umur 3 MST pengaruh empat media inisiasi kalus 14 5 Kalus yang terbentuk 8 MST pada tiga media inisiasi 16 6 Proembryogenic mass (PEM) Dendrobium klon 22/25 18 7 Tahapan regenerasi kalus Dendrobium klon 22/25 menjadi plb 19 8 Plb Dendrobium klon 22/25 pada umur 12 MST pengaruh perlakuanukuran eksplan (cluster plb) 22
9 Rataan jumlah plb anggrek Dendrobium klon 22/25 pengaruh
perlakuan ukuran cluster 23
10 Tunas yang muncul pengaruh perlakuan ukuran cluster pada umur 12
MST 25
11 Tunas Dendrobium klon 22/25 pada media kinetin 0.5 mg L-1 pada
umur 12 MST 29
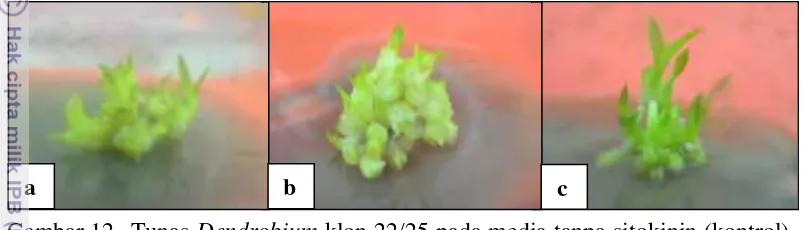
12 Tunas Dendrobium klon 22/25 pada media tanpa sitokinin (kontrol)
13 Tunas Dendrobium klon 22/25 pada umur 12 MST 34 14 Planlet Dendrobium klon 22/25 pada umur 12 MST 35 15 Planlet Dendrobium pada umur 12 MST pada media aklimatisasi 37 16 Teknologi perbanyakan Dendrobium klon 22/25 melalui plb 40
DAFTAR LAMPIRAN
1 Deskripsi Dendrobium klon 22/25 47
2 Komposisi media dasar Murashige dan Skoog 48
PENDAHULUAN
Latar Belakang
Tanaman anggrek merupakan salah satu tanaman hias yang banyak dimi-nati masyarakat, sebagai tanaman hias dalam pot dan bunga potong. Indonesia memiliki tanaman anggrek yang beragam, mencakup anggrek spesies dan anggrek hasil persilangan (hibrida). Warna dan bentuk bunga menjadi salah satu karakter yang membuat anggrek menjadi tanaman hias yang diminati masyarakat. Salah satu jenis yang banyak diminati adalah tanaman anggrek Dendrobium. Dendro-bium memiliki kesegaran yang relatif lama, warna dan bentuk bunganya bervariasi dan produktivitas yang tinggi (Widiastoety et al. 2010). Dendrobium klon 22/25 merupakan salah satu klon harapan hasil seleksi Balai Penelitian Tanaman Hias yang diharapkan menjadi salah satu tanaman hias unggulan. Klon ini memiliki beberapa keunggulan yaitu, warna bunga ungu tua yang menarik (Gambar 1), sepal bunga yang tebal sehingga dapat bertahan dari serangan hama, dan lama kesegaran bunga selama tiga bulan (Lampiran 1).
Gambar 1 Tanaman anggrek Dendrobium klon 22/25. a) Bibit Dendrobium
klon 22/25; b) Rangkaian bunga Dendrobium klon 22/25; c) Bunga Dendrobium klon 22/25
a c
2
Indonesia masih mengimpor bunga anggrek untuk memenuhi kebutuhan dalam negeri, yaitu 7 783 kg (110 442 US$) untuk periode bulan Januari hingga Desember 2014 (Basisdata Statistik Pertanian 2015). Kendala yang dihadapi adalah produksi bibit yang belum mampu menyediakan tanaman anggrek secara massal dan cepat, sehingga diperlukan metode untuk mengatasi hal tersebut.
Teknik mikropropagasi digunakan sebagai metode produksi tanaman anggrek secara massal dan cepat melalui perbanyakan embrio somatik atau yang lebih dikenal dengan sebutan protocorm-like bodies atau plb (Martin & Mada-ssery 2006; Kong et al. 2007; Julkiflee et al. 2014). Plb merupakan struktur seperti corm, yang memiliki karakter pembelahan sel yang cepat dengan kutub bipolar yang akan terinduksi menjadi tunas dan akar, sehingga akan berkembang menjadi planlet dalam jumlah yang banyak dan waktu yang cepat (Gunawan 1992). Penggunaan plb juga dimanfaatkan untuk teknologi benih sintetik dalam rangka konservasi plasma nutfah atau perdagangan (Siew et al. 2013).
Perbanyakan plb mencakup proses inisiasi, proliferasi dan maturasi (maturation). Faktor utama yang menentukan keberhasilan rangkaian ketiga proses tersebut adalah media kultur. Kombinasi antara unsur hara, karbon, dan zat pengatur tumbuh dalam media akan menentukan tingkat keberhasilan proses perbanyakan. Media kultur sangat berpengaruh terhadap keberhasilan pertum-buhan dan perbanyakan plb (Ori et al. 2014).
Proses inisiasi memerlukan media kultur yang sesuai untuk pembentukan plb. Inisiasi plb memerlukan komponen zat pengatur tumbuh dan karbon yang lebih banyak dibanding proses proliferasi dan regenerasi (Chung et al. 2005). Ketidaksesuaian media kultur akan mengakibatkan plb tidak terbentuk. Zat pengatur tumbuh yang sering digunakan untuk pembentukan plb adalah NAA (Akter et al. 2008; Niknejad et al. 2011; Julkiflee et al. 2014), thidiazuron (Ferreira et al. 2006; Chung et al. 2007), 2,4-D (Hoesen et al. 2008; Shroti & Upadhyay 2014) dan kinetin (Luo et al. 2009). Zat pengatur tumbuh tersebut digunakan pada beberapa spesies Dendrobium yang berbeda.
Keberhasilan tahapan inisiasi tergantung pada eksplan yang digunakan. Eksplan yang umum digunakan untuk menginisiasi plb adalah mata tunas (Rianawati et al. 2009; Sinha et al. 2009), kecambah anggrek (Tao et al. 2011) dan ujung jaringan meristem (Roy et al. 2007; Chugh et al. 2009). Ketersediaan tanaman induk sebagai sumber eksplan menjadi kendala tersendiri. Diperlukan waktu yang lama untuk mendapatkan tanaman induk sebagai sumber eksplan pada anggrek hasil silangan. Daun yang diambil dari planlet merupakan sumber eksplan yang dapat dijadikan sebagai alternatif.
Proliferasi plb memerlukan media yang tepat agar mendapatkan tingkat multiplikasi yang tinggi. Jenis media dan zat pengatur tumbuh menjadi faktor yang menentukan. Zat pengatur tumbuh yang dapat digunakan adalah auksin, sitokinin ataupun kombinasi keduanya. Auksin yang umumnya digunakan adalah NAA (Shroti & Upadhyay 2014; Julkiflee et al. 2014; Sinha & Jahan 2012; Chung et al. 2007; Roy et al. 2007) dan 2,4-D (Shroti & Upadhyay 2014; Niknedjad et al. 2011). Sitokinin yang digunakan antara lain TDZ (Shroti & Upadhyay 2014; Luo et al. 2009), BAP (Sinha & Jahan 2012; Long et al. 2010; Luo et al. 2009; Akter et al. 2008; Roy et al. 2007).
3 2% menghasilkan jumlah plb bertunas terbanyak dibandingkan dengan sukrosa 0, 1, 3, dan 4%. De-Faria (2014) menjelaskan bahwa konsentrasi sukrosa (1 sampai dengan 6%) tidak berpengaruh terhadap jumlah plb bertunas dan panjang akar. Auksin eksogen yang diberikan pada planlet P. amabilis berpengaruh terhadap kandungan karbohidrat daun, akar dan tunas yang akan mempengaruhi siklus hidup planlet (Ori et al. 2014). Proses inisiasi, proliferasi dan pembesaran plb perlu dipelajari melalui penggunaan zat pengatur tumbuh, sumber karbon dan ukuran plb yang dipakai sebagai eksplan untuk menghasilkan metode yang tepat dalam perbanyakan anggrek.
Proses inisiasi, proliferasi dan pembesaran plb perlu dipelajari melalui penggunaan zat pengatur tumbuh, sumber karbon dan ukuran plb yang dipakai sebagai eksplan untuk menghasilkan metode yang tepat dalam perbanyakan anggrek secara cepat.
Tujuan Penelitian
Tujuan dari penelitian adalah untuk memperoleh media yang tepat pada proses inisiasi kalus, proliferasi dan pembesaran plb melalui pengaturan media dasar, jenis dan konsentrasi zat pengatur tumbuh serta konsentrasi sukrosa yang digunakan.
Hipotesis Penelitian Hipotesis yang diajukan pada penelitian ini antara lain :
1. Terdapat media yang tepat untuk inisiasi kalus dan plb Dendrobium klon 22/25;
2. Terdapat konsentrasi NAA dan ukuran eksplan kalus yang tepat pada proli-ferasi plb Dendrobium klon 22/25;
3. Terdapat jenis dan konsentrasi sitokinin serta sukrosa yang tepat pada pembe-saran plb Dendrobium klon 22/25.
Manfaat Penelitian
Penelitian yang dilaksanakan ini dapat bermanfaat terutama dalam hal : 1. Pengembangan perbanyakan plantlet anggrek melalui proses embriogenesis
somatik;
2. Produksi tanaman anggrek secara cepat dan massal dengan menggunakan teknik embriogenesis yang tepat.
Ruang Lingkup Penelitian
4
dilakukan melalui proses organogenesis dan embriogenesis. Inisiasi tunas anggrek Dendrobium yang dilakukan selama ini melalui proses organogenesis. Produksi tanaman anggrek melalui proses organogenesis menghasilkan jumlah planlet yang rendah.
Peningkatan jumlah planlet dapat dilakukan melalui proses embriogenesis dalam inisiasi tunas. Proses embriogenesis akan menghasilkan suatu bentuk kalus yang umum disebut dengan Protocorm-like bodies (plb). Perbanyakan plb meli-puti proses inisiasi, proliferasi dan pembesaran plb menjadi planlet anggrek dewasa, dan aklimatisasi. Efisiensi dan efektifitas dari masing-masing kegiatan dalam produksi tanaman anggrek merupakan hal yang sangat penting terutama dalam pengembangan teknik perbanyakan plantlet anggrek.
Inisiasi plb dapat dilakukan secara langsung dan tidak langsung. Inisiasi plb secara langsung adalah proses pembentukan plb melalui jaringan somatik tanpa melalui fase kalus. Inisiasi plb secara langsung dapat menggunakan eksplan ke-cambah dan mata tunas. Pada tanaman anggrek hasil persilangan, ketersediaan ta-naman induk sebagai sumber eksplan sangat terbatas. Inisiasi plb secara langsung menjadi sulit dilakukan karena masalah tersebut. Inisiasi secara tidak langsung merupakan alternatif cara untuk mendapatkan plb.
Inisiasi plb secara tidak langsung adalah proses pembentukan embrio melalui jaringan somatik melalui fase kalus. Sumber eksplan yang dapat diguna-kan pada inisiasi tidak langsung antara lain, daun, kecambah, dan ujung tunas. Inisiasi plb secara tidak langsung memerlukan dua tahap, inisiasi kalus kemudian inisiasi plb melalui kalus. Keberhasilan inisiasi kalus dan plb sangat tergantung pada sumber eksplan.
Media sangat berperan penting pada proses inisiasi kalus dan plb. Penambahan zat pengatur tumbuh mutlak diperlukan pada proses inisiasi. Kombinasi sitokinin dan auksin umumnya digunakan untuk inisiasi kalus dan plb. Formulasi media dan zat pengatur tumbuh yang tidak tepat akan mengakibatkan kalus menjadi browning atau kecoklatan sehingga plb tidak terinisiasi, plb menjadi nekrosis, atau bahkan eksplan sama sekali tidak membentuk kalus. Ketepatan formulasi media menjadi faktor penentu keberhasilan inisiasi plb, selain eksplan.
Plb yang dihasilkan melalui kalus memiliki jumlah yang terbatas. Proses proliferasi atau perbanyakan plb adalah tahapan selanjutnya pada perbanyakan anggrek melalui plb. Proliferasi plb tergantung pada beberapa faktor, salah satu-nya adalah media kultur. Penelitian untuk meningkatkan efisiensi proliferasi plb masih perlu dilakukan. Penambahan bahan organik pada media dilakukan untuk mengurangi biaya produksi dalam rangka peningkatan efisiensi. Ukuran plb men-jadi salah satu faktor yang masih perlu diteliti dalam rangka peningkatan efisiensi perbanyakan plb.
5 Penelitian ini dilakukan untuk mempelajari kemampuan eksplan daun pada proses inisiasi plb melalui kalus. Jenis sitokinin juga dimasukkan sebagai faktor perlakuan untuk mengetahui jenis dan konsentrasi sitokinin yang tepat untuk pembesaran plb. Diagram alir penelitian dapat dilihat pada Gambar 2.
TINJAUAN PUSTAKA
Teknik Kultur Jaringan
Kultur jaringan merupakan teknik perbanyakan vegetatif yang dilakukan pada kondisi aseptik dengan cara mengisolasi bagian tanaman, seperti organ, jaringan atau bahkan sel dan protoplas (Gunawan 1992). Teknik kultur jaringan dimanfaatkan untuk perbanyakan tanaman secara cepat dan dalam jumlah banyak. Teknik ini dikenal juga dengan teknik in vitro. Teknik kultur jaringan pada awalnya merupakan pembuktian dari teori totipotensi sel, bahwa bagian tanaman mempunyai kemampuan untuk tumbuh dan berkembang menjadi individu atau
Persiapan bahan tanam
Inisiasi kalus (Percobaan 1.a) Inisiasi plb (Percobaan 1.b)
Proliferasi plb (Percobaan 2)
Pembesaran plb (Percobaan 3)
Planlet anggrek Dendobium klon 22/25
Aklimatisasi
Tanaman anggrek Dendrobium
klon 22/25
6
tanaman yang lengkap. Pada perkembangannya teknik ini digunakan sebagai al-ternatif perbanyakan tanaman secara vegetatif (Efendi & Khumaida 2011).
Kultur jaringan memiliki keunggulan dibanding dengan teknik perbanyak-an vegetatif secara konvensional. Teknik ini dapat memperbperbanyak-anyak tperbanyak-anamperbanyak-an seca-ra massal dalam waktu yang singkat, tidak tergantung pada musim, dan memer-lukan bahan tanam dalam jumlah sedikit (Thorpe 1990). Teknik kultur jaringan selain dimanfaatkan untuk perbanyakan tanaman secara vegetatif, juga diman-faatkan pada bidang pemuliaan tanaman dan bioteknologi. Tanaman yang meng-alami kesulitan dalam pemuliaan tanaman secara konvensional kemudian meman-faatkan teknik kultur jaringan, seperti fusi protoplas dan kultur haploid untuk menciptakan keragaman (Wattimena 2011).
Faktor yang mempengaruhi keberhasilan kultur jaringan antara lain, teknik sterilisasi, eksplan sebagai bahan tanam dan media kultur. Eksplan adalah bagian tanaman yang digunakan sebagai bahan perbanyakan dalam kultur jaringan. Eksplan yang digunakan akan mempengaruhi pertumbuhan atau kecepatan per-tumbuhan tanaman (Efendi & Khumaida 2011). Pada anggrek, eksplan yang ber-beda digunakan untuk tujuan yang berber-beda. Jaringan meristem digunakan sebagai eksplan untuk mendapatkan planlet yang bebas virus. Protocorm-like bodies (plb) digunakan untuk perbanyakan cepat (Chugh et al. 2009). Faktor lain yang juga mempengaruhi keberhasilan kultur jaringan adalah media.
Media pada kultur jaringan mempengaruhi arah pertumbuhan tanaman. Tanaman dalam kultur in vitro ini bersifat autotrof, artinya tanaman tidak mampu membuat makanannya sendiri. Tanaman kultur sangat bergantung pada media untuk menyediakan unsur hara yang dibutuhkan tanaman. Unsur hara yang terda-pat dalam media kultur terdiri atas garam-garam anorganik, vitamin, karbohidrat dan hormon pertumbuhan. Garam anorganik berupa hara makro dan mikro, serta vitamin akan berpengaruh terhadap pertumbuhan dan perkembangan organ tanam-an. Karbohidrat merupakan sumber energi untuk pertumbuhan tanaman, semen-tara hormon pertumbuhan akan berpengaruh terhadap arah dan jenis pertumbuhan tanaman (Efendi & Khumaida 2011).
Auksin adalah salah satu hormon pertumbuhan yang terdapat dalam tanaman. Wattimena et al. (1992) mendefinisikan auksin sebagai hormon yang menginduksi pemanjangan dari jaringan koleoptil tanaman. Fungsi lain dari auk-sin adalah pembesaran sel dan pertumbuhan akar. Aukauk-sin auk-sintetik ditambahkan pada media kultur untuk membantu fungsi-fungsi tersebut apabila auksin endogen dalam tanaman tidak mencukupi. Hormon pertumbuhan lain yang memiliki pe-ngaruh besar terhadap pertumbuhan tanaman adalah sitokinin. Hormon ini memi-liki fungsi untuk mendorong pembelahan sel dan perkembangan embrio tanaman. Gamborg dan Phillips (1995) menyatakan bahwa kombinasi auksin bersama sito-kinin akan mempengaruhi arah pertumbuhan dan diferensiasi sel tanaman.
Inisiasi, Proliferasi, dan Regenerasi Embrio Somatik
7 dilihat melalui perbedaan strukturnya, mulai dari struktur globular, jantung, kotiledon, pro-embrio dan embrio dewasa (Businge 2014). Embriogenesis somatik adalah perkembangan sel somatik atau sel tubuh menjadi embrio. Sel somatik berkembang melalui pembelahan sel membentuk embrio yang analog dengan perkembangan embrio zigotik. Embrio somatik akan melalui tahapan struktur yang sama dengan embrio zigotik. Embrio somatik dapat diinduksi dari sel somatik secara langsung dan tidak langsung (Lee et al. 2009).
Pembentukan embrio somatik dapat diinduksi secara langsung maupun tidak langsung. Embrio somatik yang diinduksi secara langsung dapat diartikan bahwa sel somatik diinduksi membentuk embrio tanpa melalui tahap pengkalusan. Embrio somatik yang diinduksi secara tidak langsung memiliki arti bahwa sel somatik berproliferasi membentuk kalus yang kemudian akan berkembang men-jadi embrio (Lee et al. 2009).
Media menjadi faktor yang sangat menentukan dalam keberhasilan pembentukan embrio, baik itu embrio zigotik maupun embrio somatik. Pemilihan media yang kurang tepat dapat menyebabkan kegagalan pembentukan embrio, terutama embrio somatik. Karbohidrat menjadi salah satu unsur penting yang akan mempengaruhi perkembangan embrio secara umum. Karbohidrat akan digu-nakan sel pada tahap awal pembentukan embrio sebagai sumber energi (Finer 1990). Pembentukan embrio umumnya akan membutuhkan karbohidrat yang lebih tinggi dari pembentukan organ lain. Ketidaktepatan zat pengatur tumbuh dalam media kultur embrio dapat menyebabkan embrio tidak berkembang menjadi dewasa, atau embrio akan berkembang menjadi abnormal. Pemilihan zat pengatur tumbuh sebaiknya disesuaikan dengan tujuan induksi embrio, perbanyakan atau maturasi embrio (Monnier 1990).
Induksi embrio somatik secara langsung dan tidak langsung, membutuh-kan zat pengatur tumbuh yang berbeda. Pembentukan embrio somatik secara tidak langsung membutuhkan auksin yang lebih tinggi dibanding dengan pembentukan embrio somatik secara langsung (Haq & Zafar 2004). Hal ini disebabkan karena sel-sel yang membentuk embrio somatik secara langsung merupakan embrio-genically predetermined cells. Sel ini secara alami memiliki kemampuan atau kompetensi untuk membentuk sel proembriogenik. Sel proembriogenik kemudian akan berkembang menjadi embrio somatik yang memiliki struktur yang analog dengan embrio zigotik.
Pembentukan embriogenesis somatik secara tidak langsung akan ber-kembang melalui fase kalus. Sel yang terbentuk pada fase kalus tersebut merupa-kan induced embriogenically determined cells. Artinya, sel-sel tersebut tidak me-miliki kompetensi alami membentuk sel proembriogenik. Sel proembriogenik harus diinduksi dengan bantuan zat pengatur tumbuh eksogen (Dodeman et al.
1997).
Arnold et al. (2002) membagi tahapan pada regenerasi tanaman melalui embriogenesis somatik menjadi lima tahap, antara lain:
8
2. Proliferasi kultur embriogenik pada media padat atau cair yang ditambahkan dengan zat pengatur tumbuh yang sama dengan tahap inisiasi kultur embriogenik. Sel-sel embriogenik yang terbentuk pada tahap inisiasi akan terus berproliferasi membentuk Pro-embryogenic Mass (PEM). Auksin sangat dibutuhkan pada tahap proliferasi karena mencegah atau menghambat perkembangan PEM menjadi embrio somatik. Semakin lama waktu kultur pada tahapan proliferasi akan mengakibatkan auksin dalam media habis, sehingga akan memacu regenerasi PEM menjadi embrio somatik.
3. Pra-maturasi embrio somatik pada media tanpa zat pengatur tumbuh yang akan menghambat proses proliferasi. Media ini akan membantu pembentukan embrio somatik dan perkembangan awal tunas tanaman. Perubahan PEM menjadi embrio tidak boleh terjadi sebelum sel mencapai tahapan perkem-bangan yang sesuai. Perubahan pada media proliferasi yang banyak mengan-dung auksin menjadi media tanpa auksin akan memacu sel embriogenik bentuk globular berkembang menjadi sel bentuk jantung. Sel embriogenik bentuk jantung kemudian berkembang menjadi sel dengan bentuk torpedo yang kemudian membentuk kotiledon.
4. Maturasi embrio somatik dengan mengkulturkan pada media yang ditambah-kan dengan zat pengatur tumbuh ABA dan dengan mengurangi teditambah-kanan osmo-tik potensial media. Embrio somaosmo-tik mengalami berbagai perubahan secara morfologi dan biokimia selama tahap pematangan. Organ penyimpanan, koti-ledon dan calon akar berkembang. Umumnya tahap pematangan ini distimula-si oleh media dengan potendistimula-sial osmotik yang rendah, yang diikuti oleh tahap desikasi pada media.
5. Perkembangan tanaman pada media dengan zat pengatur tumbuh konsentrasi rendah.
BAHAN DAN METODE
Waktu dan Tempat Pelaksanaan
Penelitian dilakukan pada November 2012 sampai dengan Desember 2013. Penelitian dilakukan di Laboratorium Kultur Jaringan, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor, dan Laboratorium Fisiologi Jaringan, LIPI, Cibinong.
Bahan dan Alat
Bahan yang digunakan adalah planlet anggrek Dendrobium klon 22/25hasil seleksi Balai Penelitian Tanaman Hias Segunung Jawa Barat, media dasar
Murashige and Skoog (MS), media dasar Vacin and Went (VW), sukrosa,
9 Pelaksanaan Percobaan
Percobaan 1a. Inisiasi kalus Dendrobium klon 22/25
Percobaan dirancang menggunakan Rancangan Acak Lengkap (RAL) satu faktor. Faktor yang digunakan adalah jenis media inisiasi (K) yang terdiri atas empat macam media yaitu, media Murashige dan Skoog (Murashige & Skoog 1962; Lampiran 2) ditambah dengan 10 mg L-1 benzilamino purin (Chugh et al.,
2009), media ½ MS ditambah dengan 4 mg L-1 thidiazuron (Chugh et al., 2009), media ½ MS ditambah dengan 1 mg L-1 benzilamino purin (Chung et al., 2007), dan media Vacin dan Went (Vacin & Went 1949; Lampiran 3) ditambah dengan 2 mg L-1 thidiazuron dan 1 mg L-1 2,4-dichlorophenoxy-acetic acid. Masing-masing perlakuan diulang sebanyak 10 kali dengan setiap ulangan terdiri dari satu botol kultur yang berisi satu eksplan, sehingga terdapat 40 satuan percobaan. Eksplan berupa daun yang berasal dari planlet berumur satu bulan dengan ukuran sekitar satu cm. Kultur diinkubasi selama 8 minggu dalam ruang gelap.
Model rancangan yang digunakan untuk percobaan ini adalah : Yij = + i + ij; i = 1, 2, 3, 4
j = 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 untuk :
Yij = nilai pengamatan pengaruh jenis media ke-i ulangan ke-j = rataan umum
i = nilai tambah pengaruh jenis media ke-i ij = galat percobaan
Pengamatan terhadap peubah-peubah dilakukan selama delapan minggu. Peubah ukuran kalus, warna kalus dan bentuk atau struktur kalus diamati setiap dua minggu sekali. Peubah persentase eksplan hidup dan persentase eksplan membentuk kalus diamati pada minggu ke-8. Peubah waktu muncul dan posisi kalus ditentukan pada minggu pertama eksplan berkalus.
Data hasil percobaan dianalisis dengan analisis ragam (ANOVA) dan uji nilai tengah Duncan’s Multiple Range Test (DMRT). Analisis data dilakukan menggunakan program StatisticalAnalysis Software (SAS versi 9.1).
Percobaan 1.b Inisiasi Protocorm-like Bodies Dendrobium klon 22/25
ku-10
Model rancangan yang digunakan untuk percobaan ini adalah : Yij = + i + ij; i = 1, 2, 3
j = 1, 2, 3, untuk :
Yij = nilai pengamatan pengaruh media asal inisiasi ke-i ulangan ke-j = rataan umum
i = nilai tambah pengaruh faktor media asal inisiasi ke-i ij = galat percobaan
Pengamatan terhadap peubah-peubah dilakukan selama delapan minggu. Peubah ukuran dan bobot kalus diamati pada awal pengamatan. Peubah ukuran, jumlah dan bobot plb diamati pada 8 MST. Analisis data menggunakan program SAS versi 9.1.
Plb yang terbentuk diamati secara histologi untuk melihat perkembangan yang terjadi selama pembentukan plb (Struckmeyer & Berger 1950). Pengamatan secara histologi dilakukan pada kalus yang membentuk plb. Jaringan didehidrasi menggunakan alkohol, pra parafinasi dan parafinasi menggunakan alkohol-xylol dan xylol-parafin. Pewarnaan menggunakan safranin dan alcianblue.
Percobaan 2. Proliferasi Protocorm-like Bodies Dendrobium klon 22/25
Percobaan ini merupakan percobaan faktorial dua faktor, yang disusun dengan menggunakan Rancangan Acak Lengkap (RAL). Faktor pertama adalah ukuran eksplan (cluster plb) terdiri atas tiga ukuran eksplan, yaitu cluster plb
berukuran 0.5 cm2 (±5 plb), cluster plb berukuran 1 cm2 (±10 plb), dan cluster plb berukuran 1.5 cm2 (±20 plb). Faktor kedua adalah konsentrasi zat pengatur tumbuh NAA (N) yang terdiri atas empat konsentrasi yaitu 0.0 mg L-1 (N1), 0.1 mg L-1 (N2), 0.3 mg L-1 (N3), dan 0.5 mg L-1 (N4). Kombinasi dua faktor tersebut menghasilkan 12 perlakuan. Masing-masing perlakuan diulang sebanyak 10 kali dengan setiap ulangan terdiri dari satu erlenmeyer yang berisi satu eksplan sehingga terdapat 120 satuan percobaan. Media dasar yang digunakan adalah media VW yang ditambahkan thiamin 0.1 mg L-1, air kelapa 150 ml L-1, dan sukrosa 20 g L-1. Media yang digunakan adalah media cair (tidak menggunakan bahan pemadat), sehingga perlu digoyang di atas shaker dengan kecepatan 80 rpm selama 24 jam. Kultur diinkubasi di ruang kultur dengan suhu sekitar 24 0C, intensitas penyinaran 1500 lux dan lama penyinaran 24 jam per hari.
Bahan tanaman atau eksplan yang digunakan adalah cluster Dendrobium
klon 22/25 hasil perbanyakan dengan menggunakan media VW tanpa zat pengatur tumbuh yang ditambahkan air kelapa 150 ml L-1. Eksplan yang digunakan adalah
cluster plb yang dipisahkan dengan ukuran sesuai perlakuan (Gambar 3).
Gambar 3 Eksplan cluster plb yang digunakan pada percobaan proliferasi plb anggrek Dendrobium klon 22/25. a) eksplan berukuran 0.5 cm2; b) eksplan berukuran 1.0 cm2; c) eksplan berukuran 1.5 cm2
11 Model rancangan yang digunakan untuk percobaan ini adalah :
Yijk = + i + j + ()ij + ijk; i = 1, 2, 3 j = 1, 2, 3, 4
k = 1, 2, 3, 4, 5, 6, 7, 8 untuk :
Yijk = nilai pengamatan pengaruh faktor ukuran cluster ke-i, faktor konsentrasi NAA ke-j, dan ulangan ke-k
= rataan umum
i = nilai tambah pengaruh faktor ukuran cluster ke-i j = nilai tambah pengaruh faktor konsentrasi NAA ke-j
()ij = nilai tambah pengaruh interaksi faktor ukuran cluster ke-i dengan faktor konsentrasi NAA ke-j
ijk = galat percobaan
Pengamatan terhadap peubah-peubah dilakukan selama 12 minggu. Peubah pertambahan luas cluster, jumlah plb dan persentase eksplan bertunas diukur setiap dua minggu. Peubah bobot basah basah cluster dihitung pada akhir pengamatan.
Data dari percobaan 2 dianalisis dengan analisis ragam (ANOVA) dan uji nilai tengah DMRT. Analisis data dilakukan menggunakan program SAS versi 9.1.
Percobaan 3. Pembesaran Protocorm-like Bodies Dendrobium klon 22/25
Percobaan ini merupakan percobaan faktorial dua faktor, menggunakan Rancangan Acak Lengkap (RAL). Faktor pertama adalah jenis dan konsentrasi perlakuan. Masing-masing perlakuan diulang sebanyak 10 kali dengan setiap ulangan terdiri atas tiga eksplan, sehingga terdapat 210 satuan percobaan.
Bahan tanam yang digunakan adalah cluster Dendrobium klon 22/25.
Cluster plb yang digunakan dipisahkan menjadi berukuran kurang lebih satu cm2 (kira-kira ±10 plb). Eksplan kemudian ditanam pada botol kultur yang berisi media dasar yang sudah ditambahkan dengan jenis dan konsentrasi sitokinin serta sukrosa sesuai perlakuan. Media dasar yang digunakan pada percobaan 3 adalah media VW yang ditambahkan thiamin 1 mg L-1, air kelapa 100 mL L-1, bubur pisang ambon lumut 75 g L-1, dan phytagel 2.4 g L-1 sebagai bahan pemadat. Semua kultur disimpan di rak pada ruang kultur dengan suhu sekitar 240C, intensitas penyinaran 1500 lux dan lama penyinaran 24 jam/hari.
Model rancangan yang digunakan untuk percobaan ini adalah : Yijk = + i + j + ()ij + ijk; i = 1, 2, 3, 4, 5, 6, 7
j = 1, 2, 3
k = 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 untuk :
12
= rataan umum
i = nilai tambah pengaruh faktor jenis dan konsentrasi sitokinin ke-i j = nilai tambah pengaruh faktor konsentrasi sukrosa ke-j
()ij = nilai tambah pengaruh interaksi faktor jenis dan konsentrasi sitokinin ke-i dengan faktor konsentrasi sukrosa ke-j
ijk = galat percobaan
Pengamatan terhadap peubah-peubah dilakukan selama 12 minggu. Peubah jumlah tunas, jumlah daun, jumlah akar dan tinggi tunas dihitung setiap dua minggu. Waktu munculnya tunas ditentukan pada minggu pertama eksplan bertu-nas.
Data dari percobaan 3 dianalisis dengan analisis ragam (ANOVA) dan uji nilai tengah DMRT. Analisis data dilakukan menggunakan program SAS versi 9.1.
Aklimatisasi Planlet Anggrek Dendrobium Klon 22/25
Aklimatisasi dilakukan dengan cara memindahkan planlet ke dalam polibag ukuran 10 cm x 15 cm yang berisi campuran pakis dan arang sekam dengan perbandingan 1 : 1. Planlet dalam polybag dipelihara di screenhouse akli-matisasi Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura Institut Pertanian Bogor.
HASIL DAN PEMBAHASAN
Inisiasi Kalus Dendrobium Klon 22/25
Persentase eksplan hidup terendah diperoleh pada media inisiasi VW ditambah 2 mg L-1 thidiazuron dan 2 mg L-1 2,4-D, sebesar 48.33%. Media ini juga menghasilkan persentase eksplan mati dan eksplan berwarna cokelat tertinggi. Eksplan mati dapat disebabkan oleh jaringan eksplan yang terlalu muda atau eksplan yang digunakan terlalu kecil. Persentase eksplan hidup, eksplan mati dan eksplan berwarna cokelat pada 8 MST tersaji pada Tabel 1.
Tabel 1 Persentase eksplan hidup, eksplan mati dan eksplan berwarna cokelat
13 Tabel 1 menunjukkan bahwa media ½ MS yang ditambahkan 4 mg L-1 thidiazuron (K2) menghasilkan persentase eksplan hidup tertinggi yaitu 96.6%, dari total 50 eksplan yang ditanam. Media MS yang ditambahkan 10 mg L-1 BAP (K1) dan media ½ MS yang ditambahkan 1 mg L-1 BAP (K3) menghasilkan per-sentase eksplan hidup yang sama yaitu 95.0%. Media VW yang ditambahkan 2 mg L-1 thidiazuron dan 2 mg L-1 2,4-D menghasilkan persentase eksplan hidup te-rendah yaitu 48.3% dari total 50 eksplan. Sebanyak 6.7% dari total eksplan yang ditanam pada media VW yang ditambahkan 2 mg L-1 thidiazuron dan 2 mg L-1 2,4-D menghasilkan eksplan berwarna cokelat yang sampai dengan akhir penga-matan tidak menghasilkan kalus, sehingga dikategorikan sebagai eksplan mati.
Empat media inisiasi yang digunakan pada percobaan ini menghasilkan persentase eksplan berkalus yang berbeda dengan waktu muncul kalus yang berbeda pula (Tabel 2). Kalus anggrek Dendrobium klon 22/25 muncul mulai dari 3 MST.
Tabel 2 Persentase eksplan berkalus pada 8 MST dan waktu munculnya kalus
Dendrobium klon 22/25 pengaruh media inisiasi kalus
Media inisiasi kalus Jumlah
Keterangan : MST = Minggu Setelah Tanam
Tabel 2 menunjukkan bahwa media MS yang ditambahkan 10 mg L-1 BAP menghasilkan persentase eksplan berkalus tertinggi yaitu 41.7%. Kalus pada media ini mulai terbentuk pada 3 MST. Media ½ MS yang ditambahkan 1 mg L-1 BAP menghasilkan persentase eksplan berkalus sebesar 36.7%, sedangkan media ½ MS yang ditambahkan 4 mg L-1 thidiazuron menghasilkan persentase eksplan berkalus sebesar 20.0%. Kedua media tersebut menghasilkan kalus mulai pada 3 MST. Media VW yang ditambahkan 2 mg L-1 thidiazuron dan 2 mg L-1 2,4-D menghasilkan persentase eksplan berkalus terendah di antara keempat media, yaitu sebesar 3.0% dengan waktu muncul kalus pada 6 MST. Kalus pada media ini kemudian tidak berkembang, menjadi kalus berwarna cokelat dan akhirnya mati.
14
Persentase eksplan berkalus tertinggi dihasilkan pada media inisiasi dengan kombinasi auksin dan sitokinin. Penambahan sitokinin saja pada media inisiasi menghasilkan persentase eksplan berkalus yang lebih rendah, akan tetapi mengha-silkan persentase eksplan nekrosis yang lebih rendah dibandingkan dengan kombi-nasi auksin dan sitokinin (Roy et al. 2007).
Percobaan Rianawati et al. (2009) pada anggrek Phalaenopsis mengha-silkan eksplan berkalus yang hanya terjadi pada media yang mengandung konsen-trasi auksin dan sitokinin yang seimbang. Media dengan kandungan auksin atau sitokinin saja tidak mampu menginduksi kalus. Berbeda dengan hasil percobaan ini, kalus dapat terbentuk pada media yang mengandung auksin dan sitokinin serta media dengan kandungan sitokinin saja. Eksplan pada empat media perlakuan inisiasi kalus tersaji pada Gambar 4.
Gambar 4 Eksplan daun pada umur 3 MST pengaruh empat media inisiasi kalus. a) daun pada MS + 10 mg L-1 BAP; b) daun pada ½ MS + 4 mg L-1 Tdz; c) daun pada ½ MS + 1 mg L-1 BAP; d) daun pada media VW + 2 mg L-1 Tdz + 1 mg L-1 2,4-D
Kalus mulai terbentuk pada 3 MST pada media MS dengan 10 mg L-1 BAP, media ½ MS dengan 4 mg L-1 Tdz serta media ½ MS dengan 1 mg L-1 BAP. Kalus muncul diawali dengan bagian daun yang membesar pada 3 MST (Gambar 4). Percobaan ini menghasilkan kalus yang muncul di pangkal daun pada semua media perlakuan. Pangkal daun yang membesar berwarna putih susu pada akhir-nya tidak menyerupai struktur daun lagi dan membentuk struktur kalus globular. Kalus yang muncul kemudian berwarna putih susu atau transparan yang memiliki struktur globular dan kompak. Media VW yang ditambah dengan 2 mg L-1 Tdz dan 1 mg L-1 2,4-D menghasilkan kalus dengan kondisi kecokelatan atau brow-ning, kemudian mati. Hal ini diduga bahwa zat pengatur tumbuh dalam media terlalu kuat sehingga kalus menjadi mati. Kalus muncul mulai 3 MST, dan terus bermultiplikasi sampai minggu terakhir pengamatan. Kalus yang muncul umum-nya berwarna transparan dan bentuk globular kompak.
a b
15 Hasil yang serupa didapatkan oleh Chung et al. (2005) pada percobaan
Dendrobium”Chiengmai Pink”. Semua media dengan kandungan sitokinin (2-IP, thidiazuron, BA, kinetin dan zeatin) yang dicobakan mampu menghasilkan embrio somatik tanpa melalui kalus pada 20-30 hari setelah subkultur. Embrio somatik kemudian beregenerasi membentuk tunas setelah 30 hari pada media yang sama. Khumaida dan Handayani (2010) melaporkan bahwa pada embriogenesis kedelai, rendahnya diferensiasi kalus diduga akibat rendahnya kandungan nitrogen dalam media. Hal ini dapat diatasi dengan penambahan nitrogen organik seperti aspara-gin, glutamin atau kasein hidrolisat pada media kultur.
Media inisiasi kalus memberikan pengaruh yang tidak nyata terhadap dia-meter kalus pada 4, 6 dan 8 MST. Nilai rataan diadia-meter kalus Dendrobium klon 22/25 pengaruh media inisiasi kalus pada 4, 6 dan 8 MST tersaji pada Tabel 3. Tabel 3 Nilai rataan diameter kalus Dendrobium klon 22/25 pengaruh media MS yang ditambahkan 1 mg L-1 BAP. Pada media VW yang ditambahkan dengan 2 mg L-1 Tdz dan 2 mg L-1 2,4-D kalus muncul pada 8 MST kemudian mengalami kondisi kecokelatan dan mati. Media ½ MS yang ditambahkan 4 mg L-1 Tdz menghasilkan diameter kalus terbesar pada 8 MST, yaitu 14.5 mm. Media ½ MS yang ditambahkan 1 mg L-1 BAP menghasilkan diameter kalus sebesar 14.0 mm, diikuti oleh media MS yang ditambahkan 10 mg L-1 BAP menghasilkan diameter kalus sebesar 12.0 mm.
Pada percobaan ini semua kalus muncul di pangkal daun pada semua media perlakuan. Pangkal daun yang membesar berwarna putih susu pada akhirnya tidak menyerupai struktur daun lagi dan membentuk struktur kalus globular. Kalus yang muncul kemudian berwarna putih susu atau transparan yang memiliki struktur globular dan kompak. Fu et al. (2010) menyatakan bahwa beberapa ciri dari kalus embriogenik adalah kalus tersebut memiliki sitoplasma yang rapat, vakuola yang kecil dan nukleus atau inti sel yang besar.
16
Kalus muncul mulai 3 MST, dan terus bermultiplikasi sampai 8 MST. Kalus yang muncul umumnya berwarna transparan dan berbentuk globular kompak, seperti terlihat pada Gambar 5.
Gambar 5 Kalus yang terbentuk 8 MST pada tiga media inisiasi. K1) MS + 10 mg L-1 BAP; K2) ½ MS + 4 mg L-1 Tdz; K3) ½ MS + 1 mg L-1 BAP Gambar 5 menunjukkan bahwa media inisiasi MS yang ditambah dengan 10 mg L-1 BAP, ½ MS ditambah 4 mg L-1 Tdz dan ½ MS ditambah 1 mg L-1 BAP, menghasilkan kalus dengan bentuk globular kompak berwarna putih kekuningan. Kalus terus bermultiplikasi sampai dengan 8 MST di media inisiasi kalus. Sampai dengan minggu terakhir pengamatan tidak terdapat eksplan yang langsung berege-nerasi menjadi embrio somatik atau plb. Semua eksplan yang hidup hanya mem-bentuk kalus.
Chung et al. (2005) mendapatkan hasil yang berbeda dengan percobaan ini. Percobaan tersebut menggunakan anggrek jenis Dendrobium Chiengmai Pink. Semua media percobaan yang ditambahkan beberapa jenis sitokinin (2-ip, thidia-zuron, BA, kinetin dan zeatin) yang dicobakan mampu menghasilkan somatik embrio tanpa melalui kalus pada 20-30 hari setelah subkultur. Somatik embrio kemudian beregenerasi membentuk tunas setelah 30 hari pada media yang sama.
Vinogradova dan Andronova (2002) menyatakan bahwa pada saat perke-cambahan di media yang sesuai, embrio anggrek akan membengkak, ukuran membesar, testa pecah dan protokorm globular berwarna putih akan terbentuk. Rendahnya diferensiasi kalus diduga akibat rendahnya kandungan nitrogen dalam media. Hal ini dapat diatasi dengan penambahan nitrogen organik seperti aspara-gin, glutamin atau kasein hidrolisat pada media kultur (Khumaida dan Handayani 2008).
Tambunan (2012) mengungkapkan bahwa kandungan N-organik dalam media yang merupakan unsur hara makro dalam kultur berperan penting pada proses inisiasi sel embrionik. Media MS yang memiliki kandungan N-organik lebih tinggi dari media Bac memiliki respon yang lebih baik dalam menginduksi sel embrionik nenas Smooth Cayenne. Pernyataan ini juga didukung oleh Ferreira
et al. (2011) yang menyatakan bahwa keseimbangan antara N-organik dalam bentuk ion NO3- dan NO4+ berperan penting dalam diferensiasi dan pertumbuhan kalus.
17 meningkatkan tingkat pembelahan sel, selain dapat mengatur arah pertumbuhan pada tanaman kultur (Sharma et al. 2013).
Jenis eksplan mempengaruhi keberhasilan inisiasi kalus dan plb. Kaur dan Bhutani (2009) menggunakan eksplan yang sama dengan percobaan ini. Eksplan daun yang lebih tua (kira-kira berukuran lebih dari satu cm) tidak bermorfogenesis menjadi kalus ataupun plb sampai dengan akhir pengamatan. Eksplan daun yang lebih muda (kira-kira berukuran kurang dari sama dengan satu cm) bereaksi terhadap zat pengatur tumbuh dalam media. Sinha dan Jahan (2011) menggu-nakan daun muda dari tanaman dewasa anggrek Phalaenopsis amabilis cv. Golden horizon sebagai eksplan. Sebanyak 15 plb dihasilkan pada 12 MST.
Setiap bagian dari tanaman memiliki kemampuan yang berbeda dalam bere-generasi. Tidak hanya jenis eksplan dan umur eksplan yang digunakan, penem-patan eksplan pada permukaan media kultur juga menjadi salah satu faktor penting penentu keberhasilan inisiasi kalus (Martin & Madassery 2006; Anbari et al. 2007). Eksplan yang ditempatkan dalam posisi abaksial pada permukaan me-dia menghasilkan embrio somatik yang lebih banyak dibandingkan dengan eksplan pada posisi adaksial (Anbari et al. 2007). Keberhasilan perbanyakan mikropropagasi dengan menggunakan daun tergantung dari beberapa faktor antara lain, komposisi nutrisi dalam media, zat pengatur tumbuh, sumber daun yang di-gunakan (in vitro atau in vivo), bagian daun yang diambil, orientasi atau posisi eksplan dan yang terpenting adalah umur daun. Umur daun sebagai eksplan akan mempengaruhi kemampuannya untuk menyerap nutrisi hara dari media dan kemampuannya beregenerasi. Daun muda mampu merespon lebih baik dari daun tua. Hal ini disebabkan oleh aktivitas merismatik terjadi pada seluruh permukaan daun muda, sedangkan pada daun tua aktivitas hanya terjadi pangkal daun saja (Martin & Madassery 2006).
Penambahan BAP atau Kinetin secara individu pada media menginisiasi plb secara langsung, sedangkan penambahan BAP dan NAA atau Kinetin dan NAA secara berpasangan menginisiasi kalus pada eksplan yang digunakan. Kaul dan Sabharwal (1971) menyatakan bahwa pertumbuhan kalus dan produksi klorofil pada kalus dipengaruhi oleh sukrosa dan kinetin dalam jumlah tertentu. Produksi klorofil pada kalus terhambat pada konsentrasi kinetin yang rendah dan konsentra-si sukrosa yang tinggi. Produkkonsentra-si klorofil meningkat bila konsentrakonsentra-si kinetin juga ditingkatkan dan konsentrasi sukrosa diturunkan, akan tetapi sukrosa dalam kon-sentrasi tinggi dibutuhkan kalus agar tetap memproduksi klorofil. Media dengan konsentrasi sukrosa yang tinggi dan konsentrasi kinetin yang rendah mampu me-nyajikan pertumbuhan terbaik dari kalus.
Inisiasi Protocorm-like Bodies Dendrobium Klon 22/25
18
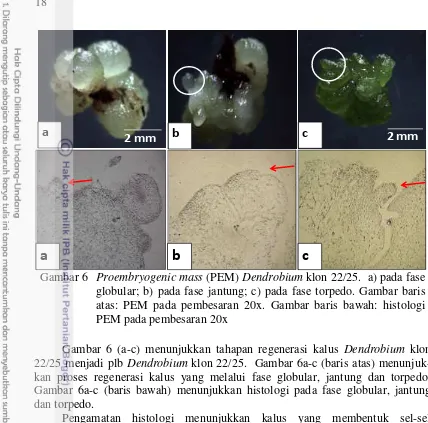
Gambar 6 Proembryogenic mass (PEM) Dendrobium klon 22/25. a) pada fase globular; b) pada fase jantung; c) pada fase torpedo. Gambar baris atas: PEM pada pembesaran 20x. Gambar baris bawah: histologi PEM pada pembesaran 20x
Gambar 6 (a-c) menunjukkan tahapan regenerasi kalus Dendrobium klon 22/25 menjadi plb Dendrobium klon 22/25. Gambar 6a-c (baris atas) menunjuk-kan proses regenerasi kalus yang melalui fase globular, jantung dan torpedo. Gambar 6a-c (baris bawah) menunjukkan histologi pada fase globular, jantung dan torpedo.
Pengamatan histologi menunjukkan kalus yang membentuk sel-sel merismatik yang rapat yang dikenal sebagai Proembryogenic mass (PEM). Tambunan (2012) mendapati hal yang sama pada nenas kultivar Smooth Cayenne. Terdapatnya sel-sel yang isodiametris dan merismatik yang kemudian membentuk agregat PEM mengindikasikan dimulainya tahapan inisiasi embriogenesis soma-tik. Sel-sel ini akan berkembang menjadi embrio globular.
Berdasarkan hasil pengamatan histologi terhadap irisan melintang kalus pada media VW cair, media ini sudah mampu meregenerasi kalus menjadi plb. Sel-sel kalus beregenerasi dengan melewati proses embriogenesis somatik mem-bentuk pro embrio fase globular dan fase torpedo (Gambar 6). Penggunaan auksin seperti 2,4-D atau pikloram umumnya digunakan pada proses regenerasi kalus menjadi embrio. Penambahan auksin jenis NAA pada media umumnya diguna-kan pada proses pematangan embrio somatik. Pada percobaan ini, penambahan air kelapa pada media VW sudah cukup mampu menginduksi embrio somatik sampai proses pematangan tanpa perlu penambahan auksin sintetik.
Air kelapa telah banyak digunakan sebagai senyawa tambahan dalam perbanyakan berbagai tanaman in vitro, termasuk anggrek. Penggunaan air kelapa pada berbagai tanaman diduga terkait dengan kandungan bahan aktif di dalamnya yang memiliki komposisi yang unik. Gula, vitamin, mineral, asam amino dan fitohormon adalah komponen terbesar dari air kelapa. Auksin dan sitokinin
b c 2 mm
a
2 mm
19 adalah dua jenis fitohormon dalam air kelapa (Gunawan 1992; Akter et al. 2007; Jean et al. 2009).
Auksin yang terkandung dalam air kelapa berfungsi sebagai regulator dalam berbagai fase perkembangan tanaman, termasuk embriogenesis, organoge-nesis dan pembentukan jaringan (Akter et al. 2007; Jean et al. 2009). Mekanisme trans-port molekul yang unik dari auksin menyebabkan perkembangan elastisitas naman. Perkembangan ini kemudian memungkinkan pertumbuhan dan bentuk ta-naman yang dapat menyesuaikan dengan perubahan lingkungan tata-naman tersebut (Jean at al. 2009).
Sitokinin dalam air kelapa mendukung pembelahan sel mengakibatkan pertumbuhan sel dengan cepat (Akter et al. 2007; Jean et al. 2009). Sitokinin merupakan zat pengatur tumbuh yang paling banyak digunakan dalam perba-nyakan atau produksi Protocorm-like bodies tanaman anggrek. Penambahan sito-kinin sintetik tidak dapat mensubstitusi peran sitosito-kinin yang terkandung dalam air kelapa. Hal ini diduga karena keberadaan fitohormon lain dalam air kelapa seperti auksin dan giberelin. Komponen atau senyawa organik lain yang terkandung dalam air kelapa juga diduga menciptakan efek sinergis dengan sitokinin. Keun-tungan yang lain dalam penggunaan air kelapa adalah tahapan proliferasi sel terja-di tanpa peningkatan jumlah mutan yang tidak terja-diinginkan (Jean et al. 2009).
Perubahan terjadi pada eksplan kalus yang beregenerasi menjadi plb. Peru-bahan warna terlihat mulai dari 2 MST. Kalus yang berwarna putih mulai menun-jukkan warna putih kehijauan. Kalus beregenerasi menjadi plb mulai pada 4 MST dan terus bermultiplikasi sampai dengan 8 MST. Proses perubahan eksplan kalus menjadi cluster plb tersaji pada Gambar 7.
Gambar 7 Tahapan regenerasi kalus Dendrobium klon 22/25 menjadi plb. a) kalus berukuran 1 cm2; b) kalus yang beregenerasi menjadi plb pada 2 MST; c) plb pada 8 MST
Gambar 7 menunjukkan bahwa kalus yang digunakan sebagai eksplan mulai berubah warna pada 2 MST. Hal ini mengindikasikan regenerasi kalus menjadi plb telah terjadi. Pada 4 MST, kalus telah beregenerasi sepenuhnya menjadi plb. Percobaan yang dilakukan oleh Puchooa (2004) menghasilkan respon yang sama. Media MS cair mampu menghasilkan plb dalam waktu 8 minggu, sedangkan media dalam bentuk padat mampu menghasilkan plb dalam waktu 6 minggu. Media MS cair yang ditambahkan dengan 1 mg L-1 BA dan 1 mg L-1 NAA meng-hasilkan jumlah plb tertinggi, yaitu 54 plb.
Tao et al. (2011) pada percobaannya dengan menggunakan benih anggrek
Cymbidium faberi Rolfe sebagai eksplan mendapatkan inisiasi plb tertinggi
20
didapatkan dari media MS yang ditambahkan 2 mg L-1 BA dan 2 mg L-1 NAA. Media ½ MS yang ditambahkan 1 mg L-1 NAA kemudian digunakan sebagai media yang paling optimum untuk menghasilkan plb berwarna hijau.
Kalus telah beregenerasi menjadi plb pada 8 MST. Media asal inisiasi kalus memberikan pengaruh yang tidak nyata terhadap bobot akhir plb dan ukuran akhir plb pada 8 MST. Media asal inisiasi kalus memberikan pengaruh yang nyata ter-hadap jumlah total plb pada 8 MST. Nilai rataan bobot, ukuran dan jumlah total plb Dendrobium klon 22/25 pengaruh media asal inisiasi kalus pada 8 MST tersaji pada Tabel 4.
Kalus beregenerasi menjadi plb mulai pada 2 MST. Tabel 4 menunjukkan bahwa kalus yang berasal dari media K3 (½ MS ditambah 1 mg L-1 BAP) berege-nerasi menghasilkan jumlah plb tertinggi (81 plb) dan berbeda nyata terhadap kalus yang berasal dari media K1 dan K2. Kalus yang berasal dari media K1 (MS ditambah 10 mg L-1 BAP) beregenerasi menghasilkan 66 plb dan tidak berbeda nyata terhadap kalus yang berasal dari media K2 (½ MS ditambah 4 mg L-1 Tdz) yang beregenerasi menghasilkan 56 plb.
Penempatan kalus embriogenik pada media cair yang ditempatkan di shaker
membuat agregat-agregat sel pecah menjadi bentuk klumyang lebih kecil sampai menjadi sel tunggal atau klum-klum kecil. Klum-klum ini kemudian yang terdis-tribusi secara merata pada media cair dan terus berproliferasi sampai salah satu faktor menjadi pembatas. Pertumbuhan sel kemudian akan melambat, umumnya ditandai dengan kondisi eksplan yang kecokelatan (Rahman & Bari 2012). Pada anggrek Cymbidium faberi Rolfe didapatkan bahwa proliferasi plb efisien pada media cair Tao et al. 2011. Media cair dinyatakan mampu menyediakan kondisi aerasi yang baik bagi plb, dan kondisi yang optimum untuk penyerapan nutrisi hara dari media oleh tanaman. Penambahan air kelapa juga dilakukan pada perco-baan tersebut dalam rangka menstimulasi pembelahan sel karena kandungan sitokinin di dalamnya.
21 Proliferasi Protocorm-like Bodies Dendrobium Klon 22/25
Ukuran eksplan memberikan pengaruh yang sangat nyata terhadap pertam-bahan luas cluster plb pada 4, 6, 8, 10 dan 12 MST. Konsentrasi NAA tidak memberikan pengaruh yang nyata terhadap pertambahan luas cluster plb pada 4, 6, 8, 10 dan 12 MST. Kombinasi antara ukuran eksplan dengan konsentrasi NAA tidak memberikan pengaruh yang nyata terhadap pertambahan luas cluster plb pada 4, 6, 8, 10 dan 12 MST. Nilai rataan pertambahan luas cluster Dendrobium
klon 22/25 pengaruh ukuran eksplan pada 4, 6, 8, 10 dan 12 MST tersaji pada Tabel 5.
Tabel 5 Nilai rataan pertambahan luas cluster plb Dendrobium klon 22/25 pengaruh ukuran eksplan pada 4, 6, 8, 10 dan 12 MST
Ukuran
Tabel 5 menunjukkan bahwa eksplan (cluster plb) berukuran 0.5 cm2 secara konsisten menghasilkan pertambahan luas yang berbeda nyata dengan perlakuan ukuran eksplan plb 1.5 cm2, akan tetapi tidak berbeda nyata dengan perlakuan ukuran eksplanplb 1.0 cm2 pada 4 sampai dengan 12 MST. Pada 12 MST, cluster
plb berukuran 0.5 cm2 menghasilkan pertambahan luas yang tertinggi diban-dingkan perlakuan yang lain yaitu 1.95 cm2, akan tetapi tidak berbeda nyata dengan plb berukuran 1.0 cm2. Cluster plb berukuran 1.0 cm2 menghasilkan pertambahan luas yang tidak berbeda nyata dengan cluster plb berukuran 0.5 cm2 dan cluster plb berukuran 1.5 cm2 pada 12 MST, yaitu 1.53 cm2. Cluster plb berukuran 1.5 cm2 secara konsisten menghasilkan rataan pertambahan luas cluster
22
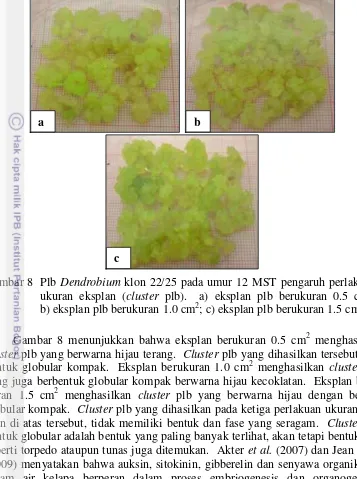
Gambar 8 Plb Dendrobium klon 22/25 pada umur 12 MST pengaruh perlakuan ukuran eksplan (cluster plb). a) eksplan plb berukuran 0.5 cm2; b) eksplanplb berukuran 1.0 cm2; c) eksplanplb berukuran 1.5 cm2
Gambar 8 menunjukkan bahwa eksplan berukuran 0.5 cm2 menghasilkan
cluster plb yang berwarna hijau terang. Cluster plb yang dihasilkan tersebut ber-bentuk globular kompak. Eksplan berukuran 1.0 cm2 menghasilkan cluster plb yang juga berbentuk globular kompak berwarna hijau kecoklatan. Eksplan beru-kuran 1.5 cm2 menghasilkan cluster plb yang berwarna hijau dengan bentuk globular kompak. Cluster plb yang dihasilkan pada ketiga perlakuan ukuran eks-plan di atas tersebut, tidak memiliki bentuk dan fase yang seragam. Cluster plb bentuk globular adalah bentuk yang paling banyak terlihat, akan tetapi bentuk lain seperti torpedo ataupun tunas juga ditemukan. Akter et al. (2007) dan Jean et al.
(2009) menyatakan bahwa auksin, sitokinin, gibberelin dan senyawa organik lain dalam air kelapa berperan dalam proses embriogenesis dan organogenesis tanaman anggrek. Media kultur dengan penambahan air kelapa tanpa tambahan auksin dan sitokinin sintetik (eksogen) dapat digunakan pada tahap proliferasi plb tanaman anggrek.
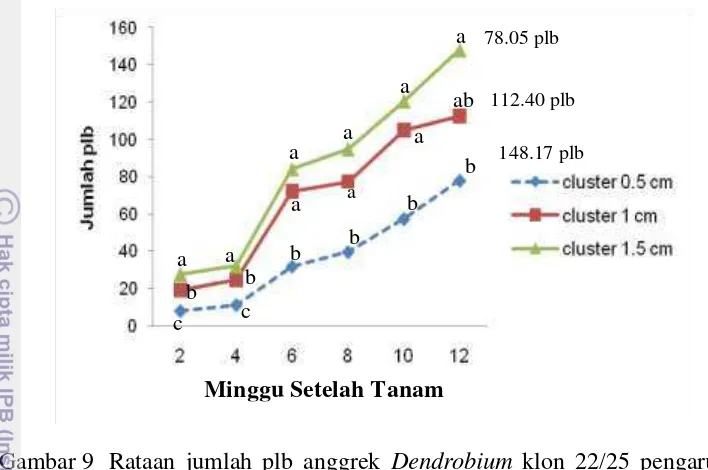
Konsentrasi NAA tidak memberikan pengaruh yang nyata terhadap jumlah plb pada 2, 4, 6, 8, 10 dan 12 MST. Kombinasi perlakuan ukuran eksplan dengan konsentrasi NAA menghasilkan jumlah plb yang tidak nyata pada 2, 4, 6, 8, 10 dan 12 MST. Rataan jumlah plb anggrek Dendrobium klon 22/25 pengaruh perla-kuan ukuran eksplan yang berbeda pada 2, 4, 6, 8, 10 dan 12 MST tersaji pada Gambar 9.
a b
23
Gambar 9 Rataan jumlah plb anggrek Dendrobium klon 22/25 pengaruh perla-kuan ukuran eksplan yang berbeda pada 2, 4, 6, 8, 10 dan 12 MST Gambar 9 menunjukkan bahwa semakin besar ukuran eksplan maka sema-kin banyak pula plb yang dihasilkan. Pada Gambar 9 terlihat pertambahan yang terbesar terjadi pada 6 MST pada semua perlakuan. Ukuran eksplan1.0 cm2 me-miliki jumlah plb yang tidak berbeda nyata dengan ukuran eksplan 1.5 cm2 pada 6-12 MST. Ukuran eksplan 0.5 cm2 menghasilkan rataan jumlah plb terendah pada 12 MST, yaitu sebanyak 78.05 plb. Ukuran eksplan 1.5 cm2 menghasilkan rataan jumlah plb tertinggi sebanyak 148.17 plb, yang tidak berbeda nyata dengan ukuran eksplan 1.0 cm2 yaitu 112.40 plb. Berdasarkan peubah jumlah plb dan persentase tunas yang terbentuk, ukuran eksplan plb 1.0 cm2 dapat digunakan sebagai sumber eksplan. Semua cluster plb yang terbentuk memiliki warna hijau dengan bentuk globular kompak.
Auksin berperan penting sebagai pemandu arah pada berbagai proses perkembangan tanaman yang melibatkan polaritas (Srivasta et al. 2012). Auksin merupakan inducer yang efektif untuk diferensiasi dan proliferasi sel (Abrash et al. 2009). Pengaruh dari konsentrasi yang berbeda pada jenis auksin yang sama bervariasi pada setiap spesies tanaman anggrek. Auksin sintetis secara umum lebih stabil dan memiliki kemampuan bertahan untuk tetap aktif lebih lama diban-dingkan dengan auksin alami (Arditti 2008). Fungsi auksin secara umum adalah untuk elongasi sel tanaman (Cleland 2004). Auksin juga berperan dalam proses embriogenesis somatik. Auksin mengaktivasi PIN1 dalam kalus embriogenik se-hingga terjadi polarisasi dalam sel yang kemudian menginduksi embrio somatik (Su et al. 2009).
Berbeda dengan pernyataan di atas tersebut, pada percobaan ini konsentrasi NAA tidak menghasilkan jumlah plb yang berbeda nyata pada semua minggu pengamatan, begitupun dengan kombinasi konsentrasi NAA dan ukuran cluster. Beberapa percobaan lain mendapatkan jumlah plb yang berbeda dengan penam-bahan auksin, sitokinin ataupun penampenam-bahan keduanya. Pada percobaan Martin et