EKSPLORASI CENDAWAN ENDOFIT SEBAGAI AGENS
PENGENDALI HAYATI Phytophthora capsici LEONIAN
PADA CABAI
EVAN PURNAMA RAMDAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Eksplorasi Cendawan Endofit sebagai Agens Pengendali Hayati Phytophthora capsici Leonian pada Cabai adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
EVAN PURNAMA RAMDAN. Eksplorasi Cendawan Endofit sebagai Agens Pengendali Hayati Phytophthora capsici Leonian pada Cabai. Dibimbing oleh WIDODO dan EFI TODING TONDOK.
Tanaman cabai merupakan salah satu komoditas hortikultura yang banyak ditanam di Indonesia. Produktivitas cabai di Indonesia masih di bawah potensi produksi semestinya. Salah satu penyebab produktivitas yang belum optimal adalah adanya penyakit busuk pangkal batang yang disebabkan oleh Phytophthora capsici. Pengendalian yang telah umum dengan penggunaan pestisida sintetis belum mampu mengatasi masalah sehingga pengendalian alternatif diperlukan.
Pengendalian hayati merupakan salah satu alternatif pengendalian yang dapat digunakan untuk mengendalikan penyakit tanaman. Agens hayati berupa cendawan endofit untuk mengendalikan Phytophthora capsici pada cabai belum dilaporkan di Indonesia. Oleh karena itu diperlukan penelitian untuk mengeksplorasi cendawan endofit yang memiliki potensi sebagai agens hayati pengendalian P. capsici. Penelitian ini terdiri dari 5 tahapan, yaitu 1) eksplorasi cendawan endofit dari tanaman cabai, 2) uji patogenesitas cendawan endofit, 3) uji penghambatan cendawan endofit terhadap pertumbuhan P. capsici, 4) uji kemampuan kolonisasi cendawan endofit pada bibit cabai, 5) uji penekanan penyakit busuk pangkal batang pada bibit cabai.
Cendawan endofit yang berhasil diisolasi sebanyak 138 isolat dengan 8 isolat yang digunakan pada uji in vitro dan in planta berdasarkan hasil uji patogenesitas dan potensinya sebagai plant growth promoting fungi (PGPF). Tiga isolat cendawan endofit menunjukkan daya hambat yang tinggi terhadap pertumbuhan P. capsici, masing-masing sebesar 57.0%, 56.8%, dan 52.6%. Dua isolat cendawan endofit yang diuji mempunyai mekanisme antibiosis ditunjukkan dengan adanya zona bening pada pertemuan miselium patogen dan endofit. Pada pengujian secara in vivo, aplikasi cendawan endofit mampu menekan kejadian penyakit busuk pangkal batang pada bibit cabai dengan tingkat penekanan penyakit sebesar 13.7-27.5%. Penekanan penyakit paling tinggi ditunjukkan oleh isolat PAB2 dan HAJ1 masing-masing sebesar 27.5%, diikuti oleh PBG7 dan MAGR1 masing-masing sebesar 25.5%. Inokulasi cendawan endofit pada bibit cabai menunjukkan respons yang berbeda terhadap pertumbuhan bibit cabai. Perlakuan isolat PBG 7 menunjukkan adanya pengaruh positif terhadap semua parameter pertumbuhan (tinggi tajuk, panjang akar, dan bobot biomassa) dibandingkan kontrol. Isolat HAJ1, HAJ2, PAB2, dan CGB5 merupakan isolat-isolat yang berpotensi sebagai plant growth promoting fungi (PGPF), sebab memiliki pengaruh nyata terhadap tinggi tajuk, panjang akar, dan bobot biomassa bibit cabai. Meskipun keempat isolat ini berdasarkan analisis ragam tidak memiliki pengaruh nyata terhadap bobot kering biomassa, tapi nilai bobot masih cenderung lebih tinggi dibandingkan kontrol. Isolat yang telah diuji teridentifikasi sebagai Penicillium sp.1, Penicillium sp.2, Aspergillus sp., Fusarium sp., hifa steril 1, hifa steril 2, hifa steril 3, dan cendawan belum teridentifikasi.
SUMMARY
EVAN PURNAMA RAMDAN. Exploration of Endophytic Fungi as Biocontrol Agenst of Phytophthora capsici Leonian on Chili Pepper. Supervised by WIDODO and EFI TODING TONDOK.
Chili pepper is one of the important horticultural commodities planted in Indonesia. The potencial productivity of those planted chilli pepper has not been achieved yet because of some constrains, including the present of stem rot disease caused by Phytophthora capisci. Conventionally control of this disease using synthetic pesticides has not been able to overcome the problem, so that alternative control is needed.
Biological control is one of the promising technique that can be applied to control plant diseases. Using biological agents such as endophytic fungi to control Phytophthora capsici has not been reported yet from Indonesia. Therefore, this research is aimed to explore the potential of endophytic fungi as biological agents to control P. capsici. The study was consisted of 5 steps, 1) exploration of endophytic fungi from chili pepper plants, 2) pathogenecity test of endophytic fungi to chili pepper seedlings in laboratory, 3) dual culture screening of endophytic fungi to P. capsici isolate, 4) Efficacy test of endophytic fungi on the development of stem rot disease caused by P. capsici at green house, and 5) the ability of endophytic fungi to colonize chili pepper seedlings at green house.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
EKSPLORASI CENDAWAN ENDOFIT SEBAGAI AGENS
PENGENDALI HAYATI Phytophthora capsici LEONIAN
PADA CABAI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Eksplorasi Cendawan Endofit sebagai Agens Pengendali Hayati Phytophthora capsici Leonian pada Cabai
Nama : Evan Purnama Ramdan NIM : A352110021
Disetujui oleh Komisi Pembimbing
Dr Ir Widodo, MS Ketua
Dr Efi Toding Tondok, SP MSc Anggota
Diketahui oleh
Ketua Program Studi Fitopatologi
Prof Dr Ir Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2012 ini ialah cendawan endofit, dengan judul Eksplorasi Cendawan Endofit sebagai Agens Pengendali Hayati Phytophthora capsici Leonian pada Cabai.
Terima kasih penulis ucapkan kepada Dr Ir Widodo, MS dan Dr Efi Toding Tondok, SP MSc selaku pembimbing yang telah memberika arahan, saran, dan motivasi bagi penulis baik dalam proses penelitian maupun penulisan karya ilmiah ini. Ucapan terima kasih juga penulis sampaikan kepada Direktorat Perguruan Tinggi, Kementerian Pendidikan dan Kebudayaan yang telah mendanai penelitian ini melalui Hibah Penelitian Unggulan Strategis Nasional, dan kepada Prof Dr Ir Sri Hendrastuti Hidayat MSc selaku ketua tim penelitian pada proyek Hibah Penelitian Unggulan Strategis Nasional yang telah memberikan saran dan masukan dalam penelitian ini serta kesempatan untuk publikasi di Seminar Nasional dan Kongres XXII Perhimpunan Fitopatologi Indonesia, Padang Sumatera Barat. Selain itu, penghargaan penulis sampaikan kepada Kepala UPTD Balai Benih Hortikultura Kabupaten Garut, yang telah memberi izin penggunaan Laboratorium Agroklinik pada proses isolasi cendawan endofit dari tanaman cabai asal Garut. Ungkapan terima kasih juga disampaikan kepada Ibunda Heni Nurjanah untuk kasih sayang, dorongan, dan doa yang dirapal dalam sujudnya, Dek Iqbal dan seluruh keluarga, atas segala doa dan dukungannya, serta kepada Almarhum Ayahanda Engkoh, yang selalu menjadi panutan dan teladan.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Serangan P. capsici pada Cabai 4
Patogenesis dan Siklus Hidup 5
Pengendalian P. capsici 6
Cendawan Endofit 7
Cendawan Endofit sebagai Agens Pengendali Hayati 8
3 METODE 9
Tempat dan Waktu Penelitan 9
Bahan 9
Pelaksanaan Penelitian 9
Isolasi Cendawan Endofit asal Tanaman Cabai 9
Seleksi Cendawan Endofit 10
Uji Penghambatan Cendawan Endofit terhadap Pertumbuhan
P. capsici 10
Uji Penghambatan Penyakit Busuk Pangkal Batang 10
Penyiapan Inokulum Cendawan Endofit 10
Penyiapan Inokulum P. capsici 11
Penyiapan Pembibitan Cabai 11
Inokulasi Cendawan Endofit 11
Inokulasi P. capsici 11
Uji Kemampuan Cendawan Endofit Mengoloni Bibit Cabai 11
Variabel dan Pengukuran 11
Analisis Data 13
4 HASIL DAN PEMBAHASAN 13
Keragaman Cendawan Endofit asal Cabai 13
Pengujian Cendawan Endofit terhadap Perkecambahan dan
Perkembangan Benih Cabai 15
Uji Penghambatan Cendawan Endofit terhadap Pertumbuhan P. capsici 17 Uji Kemampuan Cendawan Endofit Mengolonisasi Tanaman Cabai 19 Uji Penghambatan Penyakit Busuk Pangkal Batang pada Bibit Cabai 20 Pengaruh Cendawan Endofit terhadap Pertumbuhan Bibit Cabai 23
5 SIMPULAN DAN SARAN 29
Simpulan 29
Saran 30
DAFTAR PUSTAKA 30
LAMPIRAN 35
DAFTAR TABEL
1 Keragaman cendawan endofit yang diperoleh dari tanaman cabai sehat
di daerah Garut dan Bogor 14
2 Jumlah isolat dari masing-masing bagian tanaman dan pengaruhnya
terhadap perkecambahan benih cabai 15
3 Pengaruh cendawan endofit terhadap pertumbuhan P. casici in vitro 18 4 Pengaruh cendawan endofit terhadap kejadian penyakit busuk pangkal
batang 22
5 Pengaruh cendawan endofit terhadap respon pertumbuhan tanaman 26 6 Hasil identifikasi morfologi cendawan endofit yang diuji 28
DAFTAR GAMBAR
1 Jumlah isolat asal akar, batang, dan cabang terhadap pertumbuhan bibit
cabai 16
2 Pengaruh isolat cendawan endofit terhadap tinggi tajuk dan panjang
akar 16
3 Jumlah isolat dari lahan sampel tanaman dan pengaruhnya terhadap
pertumbuhan bibit cabai 17
4 Pertumbuhan P. capsici pada kondisi: A) tanpa perlakuan, B) tertekan oleh mekanisme antibiosis, C) tertekan oleh mekanisme kompetisi 18 5 Tingkat kolonisasi cendawan endofit dari bagian akar dan batang bibit
cabai 19
6 Pola sebaran hasil reisolasi cendawan endofit pada batang bibit cabai 20 7 Perkembangan kejadian penyakit selama 3 minggu setelah inokulasi 21 8 Tinggi tanaman selama 4 minggu setelah pindah tanam 24 9 Jumlah daun selama 4 minggu setelah pindah tanam 25 10 Bobot basah dan kering bibit cabai setelah pemberian perlakuan
cendawan endofit 26
DAFTAR LAMPIRAN
1 Daftar sidik ragam penghambatan pertumbuhan P. capsici oleh
cendawan endofit 35
2 Daftar sidik ragam kejadian penyakit busuk pangkal batang oleh P. capsici pada minggu ke-1 setelah inokulasi 35 3 Daftar sidik ragam kejadian penyakit busuk pangkal batang oleh
P. capsici pada minggu ke-2 setelah inokulasi 35 4 Daftar sidik ragam kejadian penyakit busuk pangkal batang oleh
P. capsici pada minggu ke-3 setelah inokulasi 35 5 Daftar sidik ragam tinggi bibit cabai setelah aplikasi cendawan endofit 35 6 Daftar sidik ragam jumlah daun setelah aplikasi cendawan endofit 36 7 Daftar sidik ragam panjang akar setelah aplikasi cendawan endofit 36 8 Daftar sidik ragam bobot segar biomassa setelah aplikasi cendawan
9 Daftar sidik ragam bobot kering biomassa setelah aplikasi cendawan endofit
10 Daftar sidik ragam nilai AUDPC 36
11 Lokasi pengambilan sampel tanaman cabai sehat di daerah A) Garut
dan B) Bogor 37
12 Beberapa isolat yang telah diisolasi 38
13 Respon benih pada biakan cendawan endofit: A) kontrol, B) berkecambah normal, C) berkecambah nekrotik, dan D) tidak
berkecambah 39
14 Kenampakan pertumbuhan P. capsici pada uji antagonisme: A) kontrol tanpa endofit, B), C), D), E), F), G), H) dan I) berturut-turut isolat cendawan endofit MAG1, HAJ2, HAG1, HAJ1, PBG7, CBG5,
MAGR1, dan PAB2 40
15 Gejala penyakit busuk pangkal batang pada bibit cabai: A) bibit layu,
B) lesio hitam mengelilingi pangkal batang 40
16 Pertumbuhan tinggi bibit cabai pada minggu keempat setelah pindah tanam: A) kontrol tanpa endofit, B), C), D), E), F), G), H) dan I) berturut-turut isolat cendawan endofit PAB2, PBG7, HAJ2, CBG5,
HAJ1. MAGR1, HAG1, dan MAG1. 40
17 Pertumbuhan tinggi bibit cabai pada minggu keempat setelah pindah tanam: A) kontrol tanpa endofit, B), C), D), E), F), G), H) dan I) berturut-turut isolat cendawan endofit PBG7, HAJ1, HAJ2, CBG5,
1
PENDAHULUAN
Latar Belakang
Tanaman cabai merupakan salah satu komoditas hortikultura yang banyak ditanam di Indonesia. Produksi nasional cabai besar dan cabai rawit tahun 2012 mengalami peningkatan dibandingkan tahun 2011, masing-masing terjadi peningkatan sebanyak 65.5 ribu ton (7.2%) dan 108.0 ton (18.2%). Sementara itu, di daerah Jawa Barat tahun 2012 produksi cabai besar meningkat 6.000 ton (3.1%), sedangkan produksi cabai rawit menurun sebanyak 14.713 ton (-14.0%) dibandingkan tahun 2011 (BPS 2013). Sentra produksi cabai di Jawa Barat meliputi daerah Garut, Bandung, Cianjur, Majalengka, dan Tasikmalaya dengan luas tanam masing-masing 3.921, 2.408, 1.349, 839, dan 809 hektar (Dispertan Jabar 2013).
Kendala dalam budidaya cabai adalah adanya gangguan organisme pengganggu tanaman (OPT). Saat meningkatnya curah hujan, pembusukan pada tanaman akan meningkat sehingga produksi berkurang. Salah satu penyakit busuk pada tanaman cabai adalah busuk Phytophthora yang disebabkan oleh Phytophthora capsici Leonian. Patogen ini dapat menyerang semua bagian tanaman cabai, termasuk akar, batang, cabang, dan buah (Linderman 2003; Babadoost 2004). Selain itu, patogen ini juga mampu menyerang pada tiap tahap perkembangan tanaman. Pada fase pembibitan tanaman akan mengalami rebah semai, hawar bibit, hawar daun, dan kelayuan yang diikuti kematian. Sementara pada tanaman tua akan terjadi pembusukan pada bagian tanaman yang diserang (Baysal et al. 2005).
Busuk Phytophthora termasuk salah satu penyakit yang mengakibatkan kehilangan hasil cabai di seluruh dunia. Kehilangan hasil cabai akibat serangan P. capsici di Illionis sebesar 100% (RDP 2001, Babadoots 2004), sedangkan hasil penelitian AVRDC tahun 2007 serangan P. capsici pada tanaman cabai di Kabupaten Brebes Jawa Tengah mencapai 50% (AVRDC 2007). Pada kondisi lembab di bawah 25-30 oC akar dan pangkal batang akan terinfeksi yang menyebabkan layu permanen dan mati. Pada kondisi hujan, percikan air akan membawa P. capsici yang terinfestasi di tanah ke bagian atas tanaman, kemudian menginfeksi tanaman (Hausbeck dan Lamour 2004). P. capsici bersifat polisiklik dan patogen tular-tanah yang menyebabkan siklus penyakit dapat berjalan cepat (Restaino dan Johnston 1999). Fase dormansi berupa oospora yang berdinding tebal, dibentuk ketika dua miselium berlawanan jenis tumbuh bersama. Oospora tahan terhadap desikasi, suhu rendah, dan kondisi lingkungan yang esktrim, serta dapat bertahan hidup dalam tanah bertahun-tahun dalam keadaan tidak ada tanaman inang (Roberts et al. 2000; RDP 2001). Begitu juga di daerah tropis, seperti Indonesia, oospora dapat terbentuk sebagai spora tahan pada saat suhu mencapai 20 oC. Suhu tersebut merupakan suhu optimum untuk pembentukan oospora di Indonesia, sebab oospora juga dapat terbentuk pada suhu dengan kisaran 16-32 oC (Wahyono dan Manohara 1995; Manohara 2007).
2
pengendalian alternatif diperlukan. Salah satu alternatif pengendalian yang telah banyak diteliti adalah pengendalian hayati. Konsep pengendalian hayati adalah mengurangi jumlah inokulum atau perkembangan penyakit dengan cara alami ataupun manipulasi lingkungan, inang, dan penggunaan antagonis (Baker dan Cook 1994). Pengendalian hayati terhadap busuk Phytophthora telah dilaporkan dengan cendawan mikoriza arbuskular Glomus intraradices, Trichoderma spp., Muscodor albus, Streptomyces violaceoniger, Pseudomonas cepacia, Pseudomonas aeruginosa telah dilaporkan mampu menekan penyakit busuk Phytophthora (Sir Ahmed et al. 1999; Strobel et al. 2001; Ozogen dan Erkilic 2007). Sementara itu, belum ada laporan mengenai pemanfaatan cendawan endofit untuk mengendalikan P. capsici.
Cendawan endofit adalah cendawan yang hidup pada bagian di dalam jaringan tanaman sehat tanpa menimbulkan gejala penyakit pada inang (Schulz dan Boyle 2005). Cendawan endofit yang berasosiasi dengan tanaman telah dilaporkan dapat meningkatkan 33.1% tinggi tajuk dan 47.8% panjang akar pada bibit padi dibandingkan dengan kontrol (Vasudevan et al. 2002), sedangkan pada tanaman cabai telah dilaporkan meningkatkan 28.6% tinggi tanaman, 34.6% panjang akar, dan 22.2% bobot buah per tanaman dibandingkan dengan kontrol (Istikorini 2008).
Laporan aplikasi cendawan endofit dalam menekan perkembangan penyakit telah banyak diteliti. Cendawan endofit asal cabai telah dilaporkan dapat menekan kejadian penyakit antraknosa sebesar 33.3 sampai 43.3% (Istikorini 2008). Mekanisme penekanan penyakit oleh cendawan endofit diantaranya deposisi liginin yang tinggi, aktivitas peroksidase dan aktivitas fenilalanin amoniliase oleh cendawan endofit Colletotrichum magna (Redman et al. 1999), produksi antibiotik, seperti antibiotik pyrrocidines yang diproduksi oleh cendawan endofit Verticillium sp. (You et al. 2009) dan antibiotik tetra hydrofuran,2-methyl furan, 2-butanone, aciphyllene yang diproduksi oleh cendawan endofit Muscodor albus (Atmosukarto et al. 2005).
Keuntungan lain dari inokulasi cendawan endofit pada tanaman adalah adanya promosi pertumbuhan tanaman dan ketahanan tanaman terhadap patogen (Arnold et al. 2003; Kavroulakis et al. 2007; Ganley et al. 2008). Cendawan endofit menginduksi ketahanan tanaman terhadap patogen telah diteliti dengan baik pada pertanaman pertanian, rerumputan (Terry dan Joyce 2004) dan tanaman hutan (Ganley et al. 2008). Cendawan endofit juga mempunyai kemampuan adapatasi baik di lingkungan dengan cekaman kekeringan sehingga dapat berperan pula dalam promosi pertumbuhan tanaman pada kondisi cekaman abiotik, seperti cendawan endofit Trichoderma harzianum, T. ovalisporum, T. hamatum, dan T. koningiopsis pada tanaman kakao (Bailey et al. 2009; Bae et al. 2009), dan T. harzianum pada tanaman padi (Shukla et al. 2012).
3 Tujuan Penelitian
Tujuan dari penelitian ini adalah
1. Mengeksplorasi, menyeleksi, dan mengidentifikasi cendawan endofit dari tanaman cabai.
2. Menguji cendawan endofit yang berpotensi menekan pertumbuhan P. capsici secara in vitro.
3. Menguji potensi cendawan endofit dalam menekan penyakit busuk pangkal batang bibit cabai secara in vivo.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai keragaman cendawan endofit pada tanaman cabai dan cendawan endofit yang paling baik dalam memacu pertumbuhan tanaman. Selain itu, diharapkan pula diperoleh cendawan endofit yang dapat menginduksi ketahanan tanaman cabai sebagai salah satu alternatif pengendalian penyakit busuk pangkal batang yang disebabkan oleh P. capsici.
Hipotesis
1. Cendawan endofit memiliki hubungan sebagai mutualisme, netral, dan komensalisme dengan inangnya.
2. Cendawan endofit mampu menekan penyakit busuk pangkal batang pada tanaman cabai.
3. Cendawan endofit mempunyai peran dalam pertumbuhan tanaman inangnya.
2
TINJAUAN PUSTAKA
Bioekologi Phytophthora capsici
Nama genus Phytophthora berasal dari bahasa Yunani yang berarti phyto atau tanaman dan phthora atau perusak (Erwin dan Ribeiro 1996). Phytophtora capisi termasuk famili Phytiaceae ordo Peronosporales, kelas Oomycetes (Alexopoulus dan Mims 1996). Cendawan kelas Oomycetes memiliki dinding sel
yang mengandung selulosa yang disimpan dalam bentuk β-glucan, yaitu
4
zoospora. Spora kebanyakan papillate, tetapi pada beberapa kasus tampak semipapillate dengan penebalan apikal antara 1.4-1.9 µm. Bentuk sporangia dipengaruhi oleh cahaya dan kondisi lainnya, bentuk sporangia dapat berupa subsperikal, ovoid, obovoid, elipsoid, fusiform, dan piriform (Erwin dan Ribeiro 1996).
Sporangia akan berkecambah pada kondisi basah (berair) atau pada media agar dengan membentuk tabung kecambah, tapi saat temperatur turun sporangia dapat langsung berkecambah. Zoospora berbentuk seperti ginjal dengan 2 flagela yang muncul pada sisi cekung. Zoospora akan berenang selama berjam-jam, kemudian berhenti, mengumpul, dan dalam beberapa menit membentuk dinding sel. Pada tahap ini spora disebut cyst. Cyst akan berkecambah dengan memproduksi tabung kecambah dan miselia. Kadang-kadang zoospore di dalam cyst dapat keluar dan menginfeksi tanaman. Struktur seksual dari Phytophthora terdiri dari antheridium dan oogonium. Oogonia selalu berbentuk globose atau subglobos, kadang-kadang pyriform. Seluruhnya hampir hialin, tapi beberapa kasus dinding berpigmen dengan warna kuning kecoklatan. Oogonium dibatasi oleh septa dari hifa. Sementara itu, antheridium dibatasi oleh septa dan menempel pada oogonium. Antheridium dibedakan menjadi amphigynous (disekeliling oogonia) dan paragynous (disamping oogonia). P. capsici tumbuh optimum pada suhu antara 25 oC dan 28oC dengan kelembapan relatif 60% dan 80%. Pada kondisi tersebut P. capsici dapat menghasilkan spora dalam jumlah berlebih pada permukaan jaringan yang terinfeksi (Hausbeck dan Lamour 2004).
Serangan P. capsici pada Cabai
Phytophthora dapat menyebabkan penyakit pada seluruh bagian tanaman temasuk akar, batang, cabang, daun, bunga, serta buah (Zitter 1989; Roberts et al. 2000). Beberapa spesies Phytophthora dapat menginfeksi daerah di bawah dan atau di atas permukaan tanah, maupun menginfeksi keduanya. Meskipun genus Phytophthora dapat menginfeksi bagian atas permukaan tanaman, tapi siklus hidupnya dapat terjadi melalui tular tanah dan tular benih, seperti P. capsici yang menyebabakan kematian tanaman akibat dari pembentukan kanker pada batang yang menyebabkan mati pucuk, dan bercak pada daun (Erwin dan Ribeiro 1996; Babadoost 2004). Menurut Zitter (1989) proses serangan P. capsici tergantung dari fase tanaman yang diinfeksi. Infeksi lebih awal pada tanaman akan menyebabkan kematian tanaman, sedangkan infeksi pada fase pertumbuhan lebih lanjut akan menyebabkan kerusakan parah meski tidak menyebabkan kematian. Sementara itu, pada fase bibit dapat menyebabkan rebah semai, namun jumlah kematiannya relatif rendah jika kondisi lingkungan tidak terlalu lembab (RDP 2001, Babadoots 2004).
5 dan cabang mengalami pembusukan, berwarna hitam, serta daun menjadi layu (Zitter 1989; Roberts et al. 2000; Louws et al. 2002).
Gejala pada daun diawali dengan bercak kecil berwarna hijau kehitaman kemudian meluas dan menjadi putih seperti terbakar dalam waktu setengah bulan membentuk warna coklat pada pinggirnya (Roberts et al. 2000; RDP 2001). Pada buah, gejala serangan diawali dengan bercak berwarna gelap ditutupi oleh spora dan miselium cendawan tersebut. Buah yang terinfeksi akan mengakibatkan benih dari cabai akan terinfeksi juga oleh patogen ini (Zitter 1989). Infeksi patogen yang terjadi pada tanaman dapat menimbulkan intensitas serangan yang berbeda, tergantung pada jenis tanaman atau jaringan yang terserang pada satu tanaman. Masa inkubasi bervariasi waktunya dan dipengaruhi oleh interaksi antara inang dan patogen, stadium perkembangan inang, serta keadaan lingkungan (Agrios 2005). Zoospora akan berhenti aktif pada tanaman antara 17-59 hari, ekspresi gejala berkurang dengan semakin bertambahnya umur tanaman. Sementara itu, rebah kecambah dapat menyebabkan kematian dalam waktu 5 hari setelah infeksi (Erwin dan Ribeiro 1996).
Patogenesis dan Siklus Hidup
6
Selain itu, proses infeksi P. capsici juga melibatkan enzim degradasi dinding sel inang. Setelah zoospora berkecambah, secara langsung melakukan penetrasi jaringan tanaman dengan bantuan enzim yang dihasilkan patogen pada saat kontak dengan inang (Munoz dan Bailey 1998). P. capsici dapat ditularkan pada saat pemindahan tanaman yang terinfeksi ke lapangan serta melalui kontaminasi tanah dan alat (Roberts et al. 2000). Cendawan dalam sel inang akan membentuk struktur hifa primer yang menyebar melalui ruang interseluler, kemudian membentuk hifa sekunder (haustorium) yang menembus ke dalam sel, selanjutnya membentuk sporangiofor. Struktur tersebut muncul dari stomata inang dan membentuk cabang-cabang pendek, tempat terbentuknya sporangium. Zoospora akan dibentuk dan dilepas dari sporangium melalui papila setelah dinding sporangium pecah (Coffey dan Gees 1991; Agrios 2005).
Umumnya hampir semua spesies Phytophthora dapat berkembang baik pada kondisi air bebas, di mana spora dapat berkecambah dan memproduksi sporangia yang menghasilkan zoospora motil yang berenang dan bergerak secara pasif melalui air mengalir ke lokasi infeksi baru. Hujan, tanah basah, dan suhu diantara 24-29 oC merupakan lingkungan yang baik untuk perkembangan penyakit hawar Phytophthora (Roberts et al. 2000). Pada kondisi yang ideal, peningkatan penyakit terjadi dengan sangat cepat dan gejala dapat terjadi setelah 3-4 hari setelah infeksi. P. capisci secara cepat dapat merusak seluruh lapangan, yang akhirnya tanaman akan mati dan oospora dibentuk di tempat terjadi luka kemudian dilepaskan ke dalam tanah. Oospora akan tetap berada dalam tanah hingga tanaman lain rentan yang ditanam.
Pengendalian P. capsici
Pengendalian P. capsici yang telah dilaporkan yaitu penggunaan pestisida, gen resisten, agens biokontrol, dan cara budidaya. Hwang dan Kim (1995) melaporkan bahwa pengendalian efektif hawar Phytophthora tergantung pada aplikasi fungsida. Beberapa fungisida seperti metalaxyl, oxadixyl, propamocarb, copper oxychloride, chlorothalonil, dan dithianon telah dilaporkan untuk pengendalian hawar Phytophthora di Korea. Anjuran pemakaian fungisida yang efektif untuk mengendalikan hawar Phytophthora dengan 6 kali menyemprot daun dengan interval 10 hari. Meskipun aplikasi fungisida sering tidak efektif untuk mengendalikan penyakit, tapi fungisida umumnya sering digunakan dalam pengendalian.
Agens biokontrol untuk pengendalian P. capisci seperti Streptomyces violaceoniger, Pseudomonas cepacia, Pseudomonas aeruginosa, dan Trichoderma harzianum sangat efektif terhadap hawar Phytophthora pada
tanaman lada baik di bawah kondisi laboratorium maupun rumah kaca. S. violaceoniger strain A50 memproduksi antibiotik nukleosid tubericidin yang
kuat menghambat pertumbuhan miselium P. capsici. Beberapa senyawa antibiotik yang efektif terhadap P. capsici juga diproduksi oleh Pseudomonas aeruginosa. Antagonis Pseudomonas cepacia dan T. harzianum dapat diformulasikan dalam bentuk bulir untuk aplikasi lapang.
7 patogen tersebut. Selain itu, tumpang sari cabai dengan wijen (Sesamum indicum) atau kacang tanah (Arachis hypogea) menunjukkan sangat efektif menekan hawar Phytophthora, masing-masing sebesar 39 dan 11%. Pada pola tanam tumpang sari cabai dan kacang tanah, sejumlah cendawan dan actinomycetes meningkat dibandingkan dengan pertanaman cabai monokultur. Sementara itu ekstrak dari tanah pertanaman wijen dan kacang tanah serta eksudat akarnya mampu menghambat pertumbuhan miselia, pembentukan sporangium, dan pelepasan zoospore P. capsici. Tanaman lain seperti bawang merah (Allium cepa), jahe (Zingiber officinale), dan kacang hijau (Pisum sativum) memiliki pengaruh penghambatan tarhadap P. capsici (Hwang dan Kim 1995).
Cendawan Endofit
Cendawan endofit adalah cendawan yang menginfeksi jaringan tanaman tanpa menyebabkan penyakit. Secara harfiah endofit berarti suatu organisme yang hidup dalam tubuh organisme lain (Doss et al. 1995). Beberapa cendawan yang tergolong cendawan endofit adalah Cylindrocarpon sp., Neonectria sp., Fusarium oxysporum, Hypocrea lixii, Trichoderma hamatum, Fusarium sp., Botryosphaeria parva, Pyronema domesticum, Glomerella sp., Cladosporium sp., Lasiodiplodia sp., Fusarium solani, Neonectria macrodydima, Glionectria tenuis, Diaporthe sp., Penicillium sp., Penicillium crustosum, Pestalothiopsis sp., Penicillium commune, Alternaria sp. (Hakizimana et al. 2011).
Cendawan endofit masuk ke dalam jaringan tanaman melalui 2 cara yaitu secara vertikal dan horizontal. Cendawan endofit yang masuk secara transmisi vertikal masuk dari generasi ke genarasi tanaman melalui benih (Doss et al. 1995). Penyebaran cendawan endofit dapat secara vertikal melalui biji, yaitu cendawan endofit ditularkan secara maternal melalui biji tanaman inang, kemudian tumbuh dan berkembang dalam ovul dan biji. Selain itu, penyebaran cendawan endofit dapat terjadi secara horizontal melalui spora secara eksternal (Clay et al. 1993). Cendawan endofit berdasarkan asalnya dibagi dalam dua kelompok yaitu cendawan endofit yang terdapat di tanaman tidak berkayu (rumput) dan cendawan endofit yang hidup pada tanaman berkayu. Pada umumnya rumput-rumputan dapat terinfeksi cendawan endofit (Clay 1990).
Rodriguez et al. (2009) membagi cendawan endofit ke dalam empat kelas berdasarkan kriteria simbiotiknya. Kelas 1 yaitu cendawan endofit Claviceptales, yang diduga berasal dari patogen serangga, sebab banyak mengandung toksin antiserangga. Cendawan kelas 1 mengolonisasi inangnya secara interseluler, sistemik, dan ditularkan secara vertikal. Fungsi ekologi bagi tanaman dari endofit ini tidak mampu meningkatkan pertumbuhan inang, tapi mampu berperan sebagai agens yang toleran terhadap cekaman abiotik, namun harga yang harus dibayar tanaman dengan keberadaan cendawan ini adalah rentan penyakit dan biomassanya lebih kecil. Cendawan endofit yang termasuk kelas 1 diantaranya Epichloe sp., Neotypodium, Balansia, Myriogenospora, Clavicipetales, dan Acremonium.
8
vertikal maupun horizontal. Fungsi ekologi bagi tanaman yaitu dapat meningkatkan pertumbuhan dan adaptasi tanaman. Cendawan kelas 2 yaitu Phoma, Fusarium culmorum, Curvularia, Arthrobotrys, Colletotrichum, basidiomycota dan ascomycota. Cendawan kelas 3 hanya terdapat pada tajuk tanaman dengan spesies yang beragam. Kolonisasi cendawan terjadi secara lokal dengan penularan secara horizontal melalui air, udara, serangga, dan seresah. Fungsi ekologi bagi tanaman adalah resistensi terhadap penyakit tapi tidak berpengaruh terhadap pertumbuhan inang. Cendawan yang termasuk kelas ini diantaranya Phoma, Phyllosticta, dan Colletotricum. Cendawan kelas 4 hanya mengolonisasi akar tanaman pada interseluler dan intraseluler, tidak membentuk struktur di dalam sel seperti mikoriza. Penularan secara horizontal dengan konidia atau fragmen hifa. Fungsi ekologi bagi tanaman adalah pertahanan terhadap penyakit.
Cendawan Endofit sebagai Agens Pengendali Hayati
Penelitian pada beberapa rumput-rumputan menunjukkan bahwa tanaman yang terinfeksi cendawan endofit lebih vigor dan toksik terhadap herbivora (termasuk serangga dan mamalia) dibandingkan tanaman yang tidak terinfeksi. Endofit ini sangat penting untuk meningkatkan ketahanan tanaman dengan mempengaruhi kebugaran inang secara keseluruhan (Clay 1998; Clay et al. 1993). Penelitian lainnya menemukan bahwa cendawan endofit mempunyai kemampuan untuk melindungi tanaman dari penyakit dan mengurangi kerusakan yang disebabkan oleh patogen. Mekanisme perlindungan cendawan endofit dapat secara langsung melalui produksi antibiotik dan sekresi enzim litik. Sementara itu, pada mekanisme perlindungan tanaman secara tidak langsung melalui peningkatan pertahanan tanaman (Arnold et al. 2003). Pada uji in vitro, isolat cendawan endofit dari Artemisia annua dapat memproduksi senyawa yang menghambat pertumbuhan beberapa patogen tanaman dengan kandungan anti fungi seperti EtOAc dan n-butanol (Liu et al. 2001). Cendawan endofit dari spesies pohon tropik, Muscodor albus, dapat memproduksi senyawa volatile organik termasuk tetrohidrofuran, 2-dimetil furan, 2-butanon dan acipelin yang mempunyai aktivitas antibiotik (Atmosukarto et al. 2005).
9 cendawan endofit Muscodor albus memproduksi antibiotik tetra hydrofuran,2-methyl furan, 2-butanone, aciphyllene (Atmosukarto et al. 2005).
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian dan Rumah Kaca, Cikabayan, University Farm, Institut Pertanian Bogor. Penelitian dilaksanakan pada bulan Maret 2012 sampai Maret 2014.
Bahan
Bahan yang digunakan dalam penelitian ini adalah tanaman cabai sehat yang diambil dari dua lokasi di daerah Garut, yaitu Desa Rancabango dan Desa Panjiwangi, serta dua lokasi di daerah Bogor, yaitu Desa Situ Gede dan Desa Gunung Bunder, masing-masing sebanyak 20 sampel tanaman, isolat Phytophthora capsici koleksi Klinik Tanaman, dan benih cabai varietas Gelora, dan Malt Extract Agar (MEA) 10%.
Pelaksanaan Penelitian Isolasi Cendawan Endofit asal Tanaman Cabai
Isolasi cendawan endofit dilakukan pada bagian akar, batang, dan cabang tanaman cabai. Metode isolasi mengikuti metode yang dikemukakan Rodrigues (1994) yang telah dimodifikasi. Bagian tanaman dicuci bersih dengan air mengalir untuk menghilangkan partikel tanah yang melekat. Kemudian dilakukan sterilisasi permukaan secara bertahap melalui perendaman dalam etanol 70% selama 1 menit, NaOCl 1% (akar) dan 3% (batang dan cabang) selama 2 menit, serta etanol 70% selama 30 detik. Selanjutnya masing-masing bagian tanaman dibilas sebanyak 3 kali dengan akuades steril dan dikeringanginkan, kemudian dipotong kecil dan diletakkan pada cawan Petri yang telah berisi MEA 10% (Malt extract 2 g, agar 15 g, aquades 1000 ml). Setelah itu diinkubasi dalam keadaan gelap. Uji kesterilan bagian tanaman yang diisolasi dilakukan dengan cara menggoreskan bilasan terakhir akuades steril ke media MEA 10% dan selanjutnya diinkubasi selama 3-5 hari. Hasil isolasi cendawan endofit tidak dapat digunakan apabila ditemukan kontaminan pada media uji kesterilan.
10
Seleksi Cendawan Endofit pada Benih Cabai
Benih cabai disterilisasi permukaan menggunakan NaOCl 1% selama 2 menit, kemudian dibilas air steril 2 kali. Setelah itu dikecambahkan pada biakan murni cendawan endofit umur 3-7 hari, masing-masing 10 benih. Pengamatan dilakukan dengan menghitung persentase perkecambahan dan mengukur tinggi tajuk dan panjang akar dari hari pertama hingga 14 hari setelah tanam. Jika benih tidak mampu berkecambah atau timbul nekrotik pada kecambah maka cendawan bersifat patogen dan tidak dapat digunakan pada uji berikutnya.
Uji Penghambatan Cendawan Endofit terhadap Pertumbuhan P. capsici Pengujian dilakukan mengikuti metode Li et al. (2007), plak cendawan endofit dengan diameter 5 mm diambil dari biakan cendawan endofit yang telah berumur 7 hari kemudian dipindah ke media PDA tepat di tengah cawan petri diameter 85 mm. Selanjutnya diinkubasi di tempat gelap pada suhu ruang selama 3-4 hari. Empat plak P. capisci dengan diameter 5 mm diambil dari biakan yang telah berumur 7 hari dan diinokulasi pada media PDA yang telah ditumbuhi cendawan endofit, sebagai kontrol pada saat yang bersamaan 4 plak patogen ditanam pada media PDA tanpa ada cendawan endofit.
Uji Penghambatan Penyakit Busuk Pangkal Batang Penyiapan Inokulum Cendawan Endofit
Inokulum yang digunakan untuk aplikasi pada bibit cabai adalah suspensi cendawan endofit. Pada cendawan endofit yang membentuk konidia, dilakukan panen konidia dengan menambahkan air steril 10 ml, kemudian menggosok permukaan koloni dengan jarum ose untuk memisahkan konidia dari media. Sementara itu, cendawan endofit yang berupa hifa steril disiapkan dengan menumbuhkan cendawan endofit pada media Potato Dextrosa Borth (PDB), kemudian di shaker selama 7 hari pada kecepatan 130 rpm. Kumpulan miselium yang telah tumbuh kemudian dipisahkan dari PDB dan dibilas tiga kali menggunakan aquades steril. Kumpulan miselium yang telah dipisahkan dimasukkan ke dalam aquades steril 100 ml kemudian dihancurkan menggunakan IKA ULTRA-TURRAX T18 Basic dengan kecepatan 3.500–24.000 rpm selama 5 menit atau hingga didapatkan suspensi yang relatif homogen. Kerapatan cendawan endofit yang dipakai adalah 2.8 x 106 koloni/ml.
Penyiapan Inokulum P. capisci
11 zoospora. Setelah terjadi pelepasan zoospora dilakukan penghitungan zoospora dengan haemocytometer. Suspensi zoospora yang dipakai untuk perlakuan sebanyak 5 ml dengan kerapatan 5 x 105 zoospora.
Penyiapan Pembibitan Cabai
Benih cabai yang telah disterilisasi permukaan disemai pada baki semai yang mempunyai 50 lubang dengan media tanam berupa media semai komersil. Pada umur 4 minggu setelah semai benih cabai dipindah tanam ke polibag yang berisi media tanah dengan pupuk kandang dengan perbandingan 1:1. Pemeliharaan tanaman dilakukan dengan penyiraman tanaman secara berkala. Inokulasi Cendawan Endofit
Inokulasi cendawan endofit dilakukan 2 kali, pertama dengan perendaman benih yang telah disterilisasi permukaan pada suspensi cendawan endofit semalaman, dan kedua, dengan penyiraman suspensi cendawan endofit pada bibit cabai berumur 3 minggu setelah semai. Kontrol pada masing-masih inokulasi menggunakan aquades steril untuk perendaman dan penyiraman.
Inokulasi P. capsici
Inokulasi cendawan endofit dilakukan pada bibit cabai umur 28 hari setelah semai dengan cara menyiram suspensi zoospora P. capisci pada daerah sekitar pangkal batang bibit cabai. Bibit tanaman cabai yang telah diinokulasi cendawan endofit dan P. capsici dipelihara, diamati, dan dihitung kejadian penyakit yang muncul.
Uji Kemampuan Cendawan Endofit Mengolonisasi Tanaman Cabai
Bibit cabai umur 4 minggu setelah semai yang telah diinokulasi cendawan endofit diambil sebanyak 5 tanaman. Setelah itu direisolasi pada bagian akar dan pangkal batang dengan cara yang sama seperti isolasi awal, kemudian dihitung bagian tanaman yang terinfeksi cendawan endofit. Isolasi pada akar dilakukan secara acak pada bagian akar primer, akar lateral, rambut akar, dan ujung akar sebanyak 5 potongan, sedangkan isolasi pada batang diambil 5 cm dari pangkal batang untuk mengamati pola sebaran cendawan endofit pada batang.
Variabel dan Pengukuran
Variabel yang diamati dalam penelitian ini adalah: 1. Kejadian penyakit
Perkembangan kejadian penyakit diamati tiap minggu sejak munculnya gejala. Pengamatan dilakukan terhadap 20 bibit cabai per perlakuan yang diulang empat kali. Kejadian penyakit busuk pangkal batang dihitung dengan menggunakan rumus berikut:
KP = n
12
Keterangan:
KP = Kejadian penyakit
n = Jumlah tanaman yang terinfeksi N = Jumlah tanaman yang diamati
2. Persentasi kolonisasi cendawan endofit yang menginfeksi bagian tanaman cabai
Penghitungan kolonisasi cendawan endofit dilakukan dengan menggunakan rumus:
3. Persentase penghambatan pertumbuhan P. capsici oleh cendawan endofit Pengamatan penghambatan pertumbuhan P. capisci dilakukan dengan menghitung diameter koloni P. capsici pada kontrol dan perlakuan, kemudian dihitung menggunakan rumus:
P = (r1 – r2) / r1 x 100% Keterangan:
P = persentasi penghambatan
r1 = diameter koloni cendawan patogen pada kontrol r2 = diameter koloni cendawan patogen pada perlakuan 4. Total luas area di bawah kurva perkembangan penyakit (AUDPC)
Untuk menggambarkan besarnya kejadian penyakit selama periode pengamatan, nilai total luas area di bawah kurva perkembangan penyakit (AUDPC) dihitung berdasarkan kejadian penyakit menggunakan formula Van der Plank (1963):
13 Sementara panjang akar, bobot basah biomassa dan bobot kering biomassa diukur pada akhir pengamatan pada tanaman berumur empat minggu setelah pindah tanaman. Panjang akar diukur dari pangkal batang sampai pada ujung akar, sedangkan bobot kering diukur setelah tanaman dikeringkan pada oven selama tiga hari dengan suhu 60 oC.
Analisis Data
Percobaan penghambatan pertumbuhan P. capsici secara in vitro dan pengujian kolonisasi cendawan endofit pada bibit cabai menggunakan rancangan acak lengkap (RAL) dengan ulangan berturut-turut sebanyak 3 kali dan 5 kali. Data yang diperoleh kemudian diolah menggunakan program SAS versi 9.1. Perlakuan yang menunjukkan beda nyata diuji lanjut dengan uji Tukey pada taraf 5%.
Sementara pada percobaan pengujian penekanan penyakit busuk pangkal batang pada bibit cabai dan pengaruh terhadap pertumbuhan tanaman oleh cendawan endofit menggunakan rancangan acak kelompok (RAK) dengan masing-masing ulangan sebanyak 3 kali. Data yang diperoleh kemudian diolah menggunakan program SAS versi 9.1. Perlakuan yang menunjukkan beda nyata diuji lanjut dengan uji selang berganda Duncan pada taraf 5%.
4
HASIL DAN PEMBAHASAN
Keragaman Cendawan Endofit asal Tanaman Cabai
Total 138 isolat cendawan endofit berhasil diisolasi dari bagian akar, batang, dan cabang tanaman cabai sehat dari Garut dan Bogor, masing-masing sebanyak 40 sampel tanaman. Sampel asal Garut menunjukkan kelimpahan isolat yang lebih tinggi dibandingkan dengan sampel asal Bogor, berturut-turut sebanyak 104 dan 34 isolat (Tabel 1).
Kelimpahan cendawan endofit asal akar, batang, dan cabang tanaman cabai bervariasi. Pada ketiga bagian tanaman tersebut, cendawan endofit paling banyak ditemukan pada akar yaitu sebanyak 101 isolat dibandingkan dengan bagian batang dan cabang. Hal ini sesuai dengan penelitian Paul et al. (2012) yang melaporkan bahwa frekuensi isolasi tertinggi didapatkan dari akar dibandingkan batang dan daun, berturut-turut sebesar 41.0, 23.0, dan 36.0%.
15 Berdasarkan morfologi warna koloni dan bentuk miselium, diperoleh 9 jenis morfospesies yang berbeda, yaitu koloni cendawan berwarna putih dengan miselium yang tumbuh ke atas atau aerial (PA), koloni putih dengan miselium tumbuh mendatar atau non-aerial (PN), koloni merah dengan miselium aerial (MA) dan non-aerial (MN), koloni kuning dengan miselium aerial (KA), koloni hijau dengan miselium aerial (HA) dan non-aerial (HN), serta koloni cokelat dengan miselium aerial (CA) dan non-aerial (CN). Hasil isolasi menunjukkan bahwa cendawan endofit yang memiliki warna koloni putih dengan bentuk miselium aerial (PA) dan non-aerial (PN) merupakan cendawan yang dominan ditemukan dengan masing-masing rerata persentasi frekuensi sebesar 29.5% dan 37.8%, sedangkan persentase frekuensi yang paling rendah ditunjukkan oleh cendawan endofit yang memiliki warna koloni cokelat dengan bentuk miselium aerial (CA) diikuti oleh cendawan endofit yang memiliki warna koloni hijau dengan bentuk miselium aerial (HA), dan cendawan endofit yang memiliki warna koloni kuning dengan bentuk miselium aerial (KA), berturut-turut sebesar 1.4; 2.8; dan 2.8%.
Pengujian Cendawan Endofit terhadap Perkecambahan dan Perkembangan Benih Cabai
Pengujian pada benih cabai menunjukkan bahwa cendawan endofit menyebabkan benih tidak dapat berkecambah sebesar 49.2%, berkecambah normal sebesar 26.3%, dan timbul gejala penyakit pada benih berupa nekrosis yang menghambat perkecambahan benih sebesar 24.5% (Tabel 2).
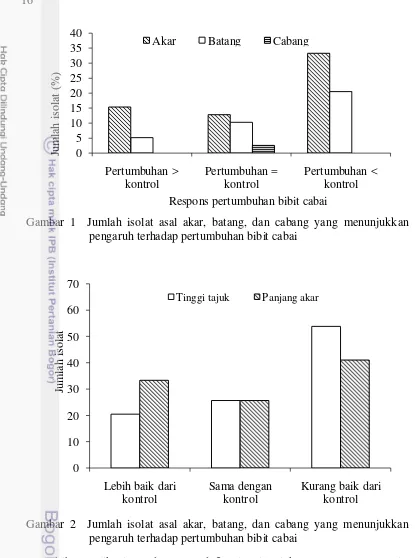
Cendawan endofit yang diuji mengindikasikan adanya pengaruh yang bersifat netral terhadap pertumbuhan bibit, memacu pertumbuhan bibit, atau menghambat pertumbuhan bibit cabai, sehingga cendawan endofit yang diuji dapat diklasifikasikan sebagai cendawan patogen, berpeluang patogen, dan non-patogen, berturut-turut sebanyak 99, 21, dan 18 isolat. Sementara respons pertumbuhan benih yang berkecambah normal menunjukkan adanya pertumbuhan yang lebih baik dari kontrol, sama dengan kontrol, dan kurang baik dari kontrol Sementara respons pertumbuhan benih yang berkecambah normal menunjukkan adanya pertumbuhan yang lebih baik dari kontrol, sama dengan kontrol, dan kurang baik dari kontrol (Gambar 1). Pada bibit cabai yang mampu berkecambah normal, semua cendawan endofit non-patogen berpengaruh pada tinggi bibit dan panjang akar (Gambar 2).
Tabel 2 Jumlah isolat dari masing-masing bagian tanaman dan pengaruhnya terhadap perkecambahan benih cabai
16
Akibat aplikasi cendawan endofit tinggi tajuk tanaman (persemaian) meningkat lebih tinggi bila dibandingkan kontrol sebesar 20.5%. Selain itu aplikasi cendawan endofit juga memberikan pengaruh tinggi tajuk yang sama dengan kontrol sebesar 25.6% dan tinggi tajuk yang lebih rendah dibandingkan kontrol sebesar 53.8%. Sementara panjang akar meningkat lebih panjang bila dibandingkan dengan kontrol, sebesar 33.3%. Selain itu memberikan pengaruh panjang akar yang sama dengan kontrol sebesar 25.6% dan panjang akar lebih rendah dibandingkan dengan kontrol sebesar 41.0%.
17
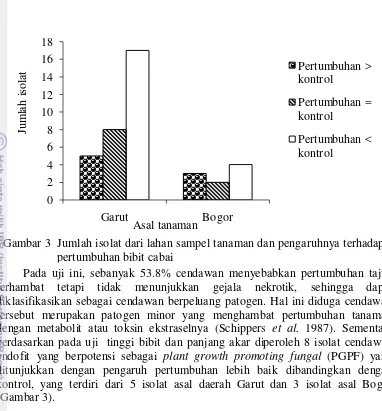
Pada uji ini, sebanyak 53.8% cendawan menyebabkan pertumbuhan tajuk terhambat tetapi tidak menunjukkan gejala nekrotik, sehingga dapat diklasifikasikan sebagai cendawan berpeluang patogen. Hal ini diduga cendawan tersebut merupakan patogen minor yang menghambat pertumbuhan tanaman dengan metabolit atau toksin ekstraselnya (Schippers et al. 1987). Sementara berdasarkan pada uji tinggi bibit dan panjang akar diperoleh 8 isolat cendawan endofit yang berpotensi sebagai plant growth promoting fungal (PGPF) yang ditunjukkan dengan pengaruh pertumbuhan lebih baik dibandingkan dengan kontrol, yang terdiri dari 5 isolat asal daerah Garut dan 3 isolat asal Bogor (Gambar 3).
Uji Penghambatan Cendawan Endofit terhadap Pertumbuhan P. capisci in vitro
Delapan cendawan endofit terpilih menunjukkan adanya pengaruh berbeda nyata terhadap penghambatan pertumbuhan P. capsici dibandingkan dengan kontrol pada penelitian in vitro (Tabel 3). Menurut hasil analisis ragam, daya hambat yang paling tinggi ditunjukkan oleh isolat HAJ2, yaitu sebesar 57.0%, kemudian diikuti oleh isolat HAJ1, PAB 2, MAGR1, PBG7, MAG1, dan CBG5, berturut-turut sebesar 56.8, 52.6, 48.8, 48.1, 46.8, dan 40.9%. Sementara isolat HAG1 merupakan isolat yang paling rendah daya hambatnya terhadap pertumbuhan P. capsici yaitu sebesar 32.9%. Pada percobaan ini dapat dilihat bahwa terjadi mekanisme penghambatan yang berbeda diantara isolat cendawan endofit yang diuji (Gambar 4). Kompetisi diantara patogen dan cendawan endofit merupakan mekanisme yang paling banyak terjadi. Isolat HAJ2 dan HAJ1 adalah isolat yang memiliki kompetisi paling tinggi dalam memperebutkan ruang dan nutrisi, hal ini ditunjukkan oleh pertumbuhan miselium yang dominan dan menekan pertumbuhan patogen. Mekanisme lainnya yang ditunjukkan pada percobaan ini adalah mekanisme antibiosis oleh isolat MAG1 dan PAB2. Gambar 3 Jumlah isolat dari lahan sampel tanaman dan pengaruhnya terhadap
18
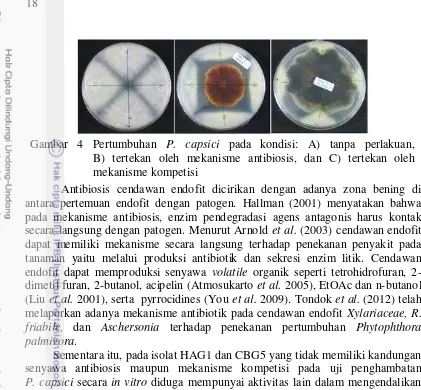
Antibiosis cendawan endofit dicirikan dengan adanya zona bening di antara pertemuan endofit dengan patogen. Hallman (2001) menyatakan bahwa pada mekanisme antibiosis, enzim pendegradasi agens antagonis harus kontak secara langsung dengan patogen. Menurut Arnold et al. (2003) cendawan endofit dapat memiliki mekanisme secara langsung terhadap penekanan penyakit pada tanaman yaitu melalui produksi antibiotik dan sekresi enzim litik. Cendawan endofit dapat memproduksi senyawa volatile organik seperti tetrohidrofuran, 2-dimetil furan, 2-butanol, acipelin (Atmosukarto et al. 2005), EtOAc dan n-butanol (Liu et al. 2001), serta pyrrocidines (You et al. 2009). Tondok et al. (2012) telah melaporkan adanya mekanisme antibiotik pada cendawan endofit Xylariaceae, R. friabile, dan Aschersonia terhadap penekanan pertumbuhan Phytophthora palmivora.
Sementara itu, pada isolat HAG1 dan CBG5 yang tidak memiliki kandungan senyawa antibiosis maupun mekanisme kompetisi pada uji penghambatan P. capsici secara in vitro diduga mempunyai aktivitas lain dalam mengendalikan penyakit tanaman, seperti kemampuan menginduksi ketahanan tanaman. Ketahanan terinduksi oleh cendawan endofit menjadikan tanaman sebagai bukan Gambar 4 Pertumbuhan P. capsici pada kondisi: A) tanpa perlakuan, B) tertekan oleh mekanisme antibiosis, dan C) tertekan oleh mekanisme kompetisi
Tabel 3 Pengaruh cendawan endofit terhadap pertumbuhan P.capsici in vitro
19 target patogen secara langsung, melalui perubahan fisiologis dan metabolik yang memungkinkan tanaman untuk lebih mengefektifkan ketahanannnya terhadap penyakit (Slusarenko et al. 2000).
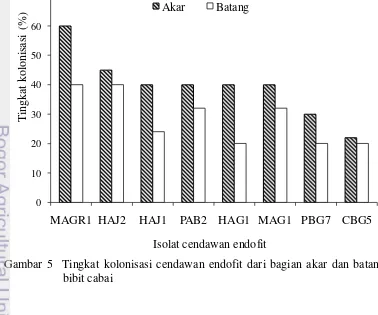
Uji Kemampuan Cendawan Endofit Mengolonisasi Tanaman Cabai Kolonisasi cendawan endofit pada akar bibit cabai berkisar antara 26-60%, sedangkan pada pangkal batang 20–40% (Gambar 5). Hal ini diduga dipengaruhi oleh metode inokulasi dengan perendaman dan penyiraman bibit cabai. Cendawan endofit yang diinokulasi diduga masuk melalui akar terlebih dahulu kemudian menyebar mengoloni bagian batang tanaman. Oleh karena itu, pada hasil pengujian kolonisasi ini, akar merupakan bagian yang paling banyak dikolonisasi cendawan endofit dibandingkan dengan bagian batang.
Isolat MAGR1 merupakan isolat yang paling tinggi persentase kolonisasi di bagian akar jika dibandingkan dengan perlakuan lain, yaitu sebesar 60%, diikuti oleh isolat HAJ2 sebesar 45% serta isolat HAJ1, PAB2, HAG1, dan MAG1, masing-masing sebesar 40%. Sementara pada bagian batang, isolat MAGR1 dan HAJ2 merupakan isolat yang lebih tinggi kolonisasinya, yaitu sebesar 40%. Kemudian diikuti oleh isolat PAB2 dan MAG2, sebesar 32%. Kemampuan cendawan endofit mengolonisasi jaringan tanaman merupakan faktor penting keberhasilan cendawan endofit establish di dalam jaringan tanaman. Keberadaan cendawan endofit di dalam jaringan tanaman juga dapat menjadi kompetitor patogen baik dalam ruang dan nutrisi untuk hidup, serta menginduksi ketahanan tanaman terhadap patogen.
MAGR1 HAJ2 HAJ1 PAB2 HAG1 MAG1 PBG7 CBG5
20
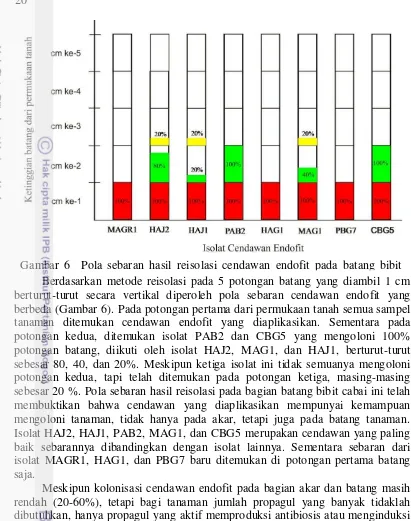
Berdasarkan metode reisolasi pada 5 potongan batang yang diambil 1 cm berturut-turut secara vertikal diperoleh pola sebaran cendawan endofit yang berbeda (Gambar 6). Pada potongan pertama dari permukaan tanah semua sampel tanaman ditemukan cendawan endofit yang diaplikasikan. Sementara pada potongan kedua, ditemukan isolat PAB2 dan CBG5 yang mengoloni 100% potongan batang, diikuti oleh isolat HAJ2, MAG1, dan HAJ1, berturut-turut sebesar 80, 40, dan 20%. Meskipun ketiga isolat ini tidak semuanya mengoloni potongan kedua, tapi telah ditemukan pada potongan ketiga, masing-masing sebesar 20 %. Pola sebaran hasil reisolasi pada bagian batang bibit cabai ini telah membuktikan bahwa cendawan yang diaplikasikan mempunyai kemampuan mengoloni tanaman, tidak hanya pada akar, tetapi juga pada batang tanaman. Isolat HAJ2, HAJ1, PAB2, MAG1, dan CBG5 merupakan cendawan yang paling baik sebarannya dibandingkan dengan isolat lainnya. Sementara sebaran dari isolat MAGR1, HAG1, dan PBG7 baru ditemukan di potongan pertama batang saja.
Meskipun kolonisasi cendawan endofit pada bagian akar dan batang masih rendah (20-60%), tetapi bagi tanaman jumlah propagul yang banyak tidaklah dibutuhkan, hanya propagul yang aktif memproduksi antibiosis atau menginduksi ketahanan yang dibutuhkan. Tondok (2012) menyebutkan bahwa kelimpahan atau frekuensi kemunculan cendawan endofit di lapangan tidak berkorelasi dengan kemampuannya dalam menekan penyakit busuk buah, seperti endofit Fusarium QJX 1403 dan Pestalotiopsis terhadap penyakit busuk buah.
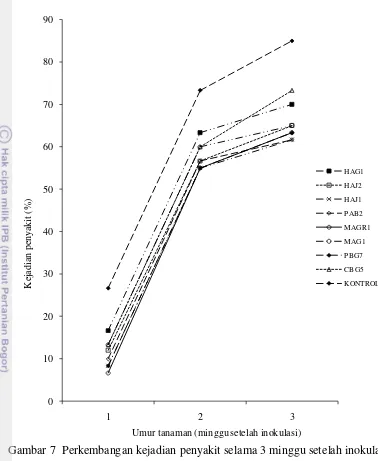
Uji Penghambatan Penyakit Busuk Pangkal Batang pada Bibit Cabai Pada pengujian in vivo, aplikasi isolat cendawan endofit mampu menekan kejadian penyakit busuk pangkal batang bibit cabai dibandingkan dengan kontrol. Kejadian penyakit pada periode pengamatan menunjukkan nilai yang lebih rendah dan berbeda nyata dibandingkan dengan kontrol di minggu pertama dan kedua (Gambar 7).
21
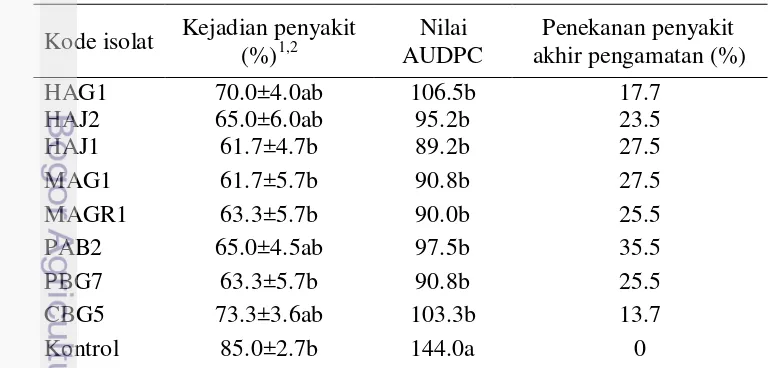
Pada akhir pengamatan kejadian penyakit berbeda nyata pada perlakuan isolat HAJ1, PAB2, MAGR1, dan PBG7 dibandingkan dengan kontrol, dengan kejadian penyakit 61.7-63.3%. Kemudian diikuti oleh isolat HAJ2 dan MAG1 dengan kejadian penyakit 65.0%, sedangkan kontrol menunjukkan kejadian penyakit paling besar yaitu 85.0%. Rendahnya kejadian penyakit pada aplikasi cendawan endofit berkorelasi dengan nilai AUDPC selama periode pengamatan dari masing-masing perlakuan yang rendah dan berbeda nyata berdasarkan analisis ragam.
Nilai AUDPC pada isolat-isolat HAJ1, PAB2, MAGR1, PBG7, HAJ2, dan MAG sebesar 89.2-97.5 unit, sedangkan pada kontrol nilai AUDPC mencapai 144.0 unit (Tabel 4). Sesuai dengan percobaan sebelumnya pada uji penghambatan in vitro terhadap pertumbuhan P. capsici, bahwa isolat-isolat PAB2, HAJ1, PBG7, MAGR1, HAJ2, dan MAG1 memiliki daya hambat yang tinggi (48.1–567.0%), baik dengan mekanisme antibiosis maupun kompetisi. Penekanan penyakit pada uji in vivo diduga ada juga peran cendawan endofit
Gambar 7 Perkembangan kejadian penyakit selama 3 minggu setelah inokulasi
22
dalam menginduksi ketahanan tanaman. Tondok et al. (2012) telah melaporkan bahwa cendawan endofit Xylariaceae, C.gambosa, R. friablile, Aschersonia sp. mampu meningkatkan produksi asam salisilat dan peroksidase sebagai mekanisme pertahanan inang terhadap penyakit busuk buah pada kakao. Menurut Hallman (2001) enzim peroksidase diperlukan tanaman untuk menghasilkan senyawa pertahanan tanaman, seperti lignin, kitin, dan senyawa penyusun dinding sel, sedangkan asam salisilat merupakan molekul sinyal pada ketahanan lokal dan sistemik, sebagai respons ketahanan inang karena adanya infeksi patogen atau luka (Shah 2003). Selain itu, adanya proteksi silang dengan adanya cendawan endofit Fusarium telah dilaporkan Kuldau dan Yates (2000). Fusarium yang mengoloni tomat mampu mengurangi penyakit oleh cendawan patogen (Benhamou dan Garand 2001). Kemampuan kolonisasi cendawan endofit yang baik (20-60%) pada bagian akar dan batang bibit cabai ikut berperan dalam membantu proses transportasi nutrisi dan unsur hara menjadi lebih optimal, sehingga vigor tanaman lebih baik dan tahan terhadap patogen.
Pada penelitian ini, penekanan penyakit (efikasi) busuk pangkal batang masih rendah, yaitu sebesar 25.5-27.5%. Meskipun dari analsis ragam menunjukkan perbedaan nyata dengan kontrol. Rendahnya penekanan penyakit disebabkan karena daya tahan hidup saprofitik Phytophhtora dan kolonisasinya pada bahan organik tinggi di dalam tanah. Situmorang (1983) melaporkan bahwa Phytophthora palmivora dapat bertahan hidup selama 4-8 minggu di dalam tanah. Selain itu, kemampuan kolonisasinya mencapai 100% pada potongan-potongan daun, tangkai daun, dan buah kakao di dalam tanah steril, di mana potensi kolonisasi P. palmivora meningkat seiring lamanya masa inkubasi. Berdasarkan laporan tersebut diduga bahwa terjadi kompetisi antara cendawan endofit dan P. capsici di dalam tanah setelah inokulasi, dengan kemampuan saprofitik P. capsici yang tinggi dalam tanah dapat menyebabkan ketersediaan nutrisi bagi cendawan endofit lebih rendah.
23 Selain itu cendawan endofit akan akfit melindungi tananaman saat berada di dalam tanaman. Pada jaringan tanaman, endofit akan aktif melindungi tanaman secara langsung maupun tidak langsung. Secara langsung melalui aktivitas kimiawi yang diproduksi terhadap patogen, sedangkan secara tidak langsung dengan menghasilkan beberapa regulasi gen ketahanan tanaman terhadap patogen serta meningkatkan vigor tanaman (Herre et al. 2007).
Meskipun pada penelitian ini efikasi busuk pangkal batang masih rendah, tapi masih berpotensi digunakan sebagai agens biokontrol. Apalagi jika diteliti lebih lanjut dengan perlakuan kombinasi antar isolat, sebab mikroba bermanfaat seperti cendawan endofit tidak bekerja sendiri di alam dalam mengendalikan penyakit busuk pangkal batang. Menurut Malinowski dan Belesky (2000) kerja dari cendawan endofit di alam tidaklah tunggal tetapi dalam komunitas untuk menghasilkan multi mekanisme yang melindungi inangnya dari lingkungan biotik dan abiotik yang tidak mendukung. Oleh karena itu untuk memaksimalkan efikasi dari tiap isolat hasil penelitian ini sangat memungkinkan untuk dilakukan kombinasi perlakuan, ditambah cara aplikasi yang tepat (siram dan semprot), formulasinya dan sebagainya.
Upaya lain yang bisa dilakukan untuk menjaga kejadian penyakit busuk pangkal batang supaya rendah adalah dengan mengkonservasi cendawan endofit yang telah ada atau diinokulasikan dengan mengurangi ekologi alami pertanaman cabai seperti penyiangan gulma yang lebih jarang dan penggunaan Legum Cover Crops (LCCs) untuk menjaga mikroba bermanfaat di permukaan tanah (Wilberforce et al. 2003; Seghers et al. 2007).
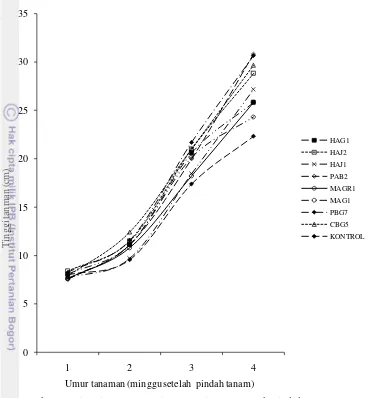
Pengaruh Cendawan Endofit terhadap Pertumbuhan Bibit Cabai Inokulasi cendawan endofit pada bibit cabai menunjukkan respons yang berbeda terhadap pertumbuhan bibit cabai (Tabel 5). Pengamatan tinggi tanaman tiap minggu menunjukkan bahwa penambahan tinggi tanaman yang berbeda dimulai pada minggu ketiga, sedangkan pada minggu pertama dan kedua penambahan tinggi tanaman masih belum menunjukkan perbedaan yang signifikan.
24
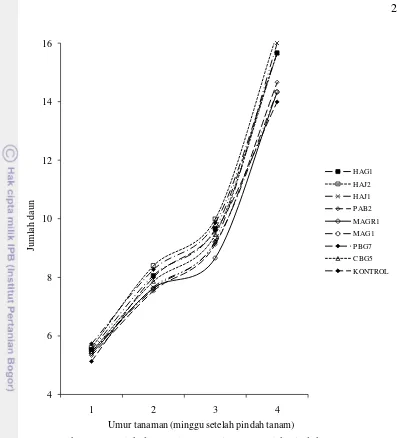
Jumlah daun cukup beragam, meskipun secara statistik setiap perlakuan cendawan endofit menunjukkan tidak berbeda nyata dibandingkan dengan kontrol. Hal ini diduga karena umur bibit cabai pada saat pengamatan berlangsung masih muda yang pertumbuhan dan perkembangan sel daunnya belum tumbuh dengan sempurna, sehingga jumlah daun dari bibit cabai tidak memperlihatkan perbedaan nyata, tetapi hasil pengamatan jumlah daun bibit cabai yang diberi perlakuan endofit cenderung lebih besar dibandingkan dengan kontrol (Gambar 9). Jumlah daun paling besar ditunjukkan oleh bibit cabai yang diberi perlakuan isolat HAJ2 yaitu sebesar 16.3 buah, lalu diikut oleh bibit yang diberi perlakuan HAJ1 sebesar 16.0 buah. Sementara jumlah daun yang lebih rendah ditunjukkan oleh bibit cabai yang tidak diberi perlakuan (kontrol) sebesar 14.0 buah.
Hasil pengukuran bobot basah dan bobot kering biomassa menunjukkan bahwa cendawan endofit memberikan pengaruh terhadap bobot dari bibit cabai (Gambar 10). Perlakuan cendawan endofit menunjukkan bertambahnya bobot basah dari bibit cabai sebesar 4.7-5.7 g dibandingkan dengan kontrol yang memiliki bobot basah 3.4 g. Bobot basah yang paling tinggi ditunjukkan oleh
Gambar 8 Tinggi tanaman selama 4 minggu setelah pindah tanam
0
Umur tanaman (minggu setelah pindah tanam)
25
isolat PBG7 sebesar 5.7 g, kemudian diikuti oleh isolat CBG5, MAG1, dan HAJ2, berturut-turut sebesar 5.3, 5.2, 5.2 g.
Seiring dengan penambahan bobot basah bibit, bobot kering bibit akar juga mengalami peningkatan bobot sebesar 2.0-2.6 g dibandingkan dengan kontrol sebesar 1.5 g. Bobot basah yang paling tinggi ditunjukkan oleh isolat PBG7 sebesar 2.6 g, kemudian diikuti oleh isolat MAGR1 dan HAJ2, masing-masing sebesar 2.2 g. Mucciarelli et al. (2003) menemukan bahwa kolonisasi cendawan endofit non-sporulasi mampu meningkatkan biomassa akar peppermint, sejalan dengan laporan Varma et al. (2000) bobot tajuk jagung meningkat tidak hanya adanya karena kolonisasi endofit Piriformosa indica, tapi juga karena perlakuan ekstrak kulutur miselia P. indica.
Sementara itu panjang akar bibit cabai berdasarkan analisis ragam menunjukkan adanya perbedaan nyata antara perlakuan dengan kontrol, kecuali pada isolat MAG1. Akar yang paling panjang ditunjukkan oleh bibit cabai yang diberi perlakuan isolat HAJ1 yaitu sebesar 18.8 cm, kemudian diikuti oleh isolat HAJ2 dan PABG7 masing-masing sebesar 18.0 cm. Sementara panjang akar paling rendah ditunjukkan oleh isolat MAG1, sebesar 16.7 cm. Vasudevan et al.
Gambar 9 Jumlah daun selama 4 minggu setelah pindah tanam
26
(2002) melaporkan bahwa pada varietas padi IR 24, IR 50, dan Joythi terjadi peningkatan panjang akar setelah pemberian endofit, masing-masing sebesar 47.8; 46.9; dan 44.0%. Sesuai dengan laporan Schulz (2006) kolonisasi akar bibit Larix deciduas oleh cendawan endofit P. fortinii dan Cryiptosporiopsis sp. signifkan dalam meningkatkan tinggi tajuk, panjang akar, serta bobot kering akar dan tajuk.
Tabel 5 Pengaruh cendawan endofit terhadap respon pertumbuhan tanaman Kode isolat Tinggi tajuk
(cm)1,2 Jumlah daun Panjang akar (cm)
HAG1 29.8±3.7ab 15.7±2.9a 17.7±1.8a
HAJ2 32.8±3.5a 16.3±2.1a 18.0±2.6a
HAJ1 31.2±4.5a 16.0±2.6a 18.8±0.8a
MAG1 29.3±2.2ab 14.3±1.5a 16.7±1.3ab
MAGR1 30.8±6.7ab 14.3±0.6a 17.2±1.9a
PAB2 34.8±4.3a 14.7±0.6a 17.7±1.6a
PBG7 34.7±3.7a 15.7±1.1a 18.0±1.7a
CBG5 32.7±4.0a 15.7±0.6a 17.5±0.9a
Kontrol 22.3±7.0 14.0±0.0a 14.1±1.5b
1
rataan±standar deviasi, 2Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang Duncan).
27 Identifikasi Cendawan Endofit
Identifikasi cendawan endofit dilakukan dengan mengamati morfologi cendawan secara mikroskopis. Hasil identifikasi berupa ciri morfologi secara mikroskopis dan koloni cendawan pada media agar (Tabel 6.)
Penicillium sp.
Penicillium sp. memiliki miselium berwarna putih, kompak, dan menyerupai kapas padat dengan belakang koloni berwarna kuning kecoklatan dan tekstur halus. Struktur hifa bersepta dan hialin, fialid yang terbentuk bercabang dari ujung konidiofor dan melekat kondia yang berantai,dengan bentuk konida bulat. Isolat yang menunjukkan ciri morfologi seperti ini ditujukkan oleh isolat MAG1 dan PAB2.
Aspergillus sp.
Aspergillus sp. memiliki koloni berwarna putih kemudian lama kelamaan menjadi hijau, di atas koloni ada butiran seperti serbuk yang merupakan kepala konida. Struktur hifa yang terbentuk bersepta, hialin, dengan konidia berlimpah berwarna hitam. Ciri morfologi seperti ini ditujukkan oleh isolat HAG1.
Fusarium sp.
Fusarium sp. memiliki koloni berbentuk seperti kapas berwarna putih keunguan (Gambar 12). Struktur hifa yang terbentuk bersepta dan hialin, dengan konidia berupa makrokonidia. Isolat yang menunjukkan ciri morfologi seperti ini ditujukkan oleh isolat MAGR1.
Hifa Steril 1
Koloni pada cendawan hifa steril berwarna hijau kecoklatan dengan miselium aerial. Sruktur hifa yang terbentuk bersepta dan hialin serta tidak ditemukan konidia. Isolat yang menunjukkan ciri morfologi seperti ini ditunjukkan oleh isolat HAJ1.
Hifa Steril 2
Koloni pada cendawan hifa steril berwarna hijau kecoklatan dengan miselium aerial yang kurang merata, pada bagian tengah terdapat kumpulan miselium yang berwarna putih. Sruktur hifa yang terbentuk bersepta dan hialin serta tidak ditemukan konidia. Isolat yang menunjukkan ciri morfologi seperti ini ditunjukkan oleh isolat HAJ2.
Hifa Steril 3
28
Tabel 6 Hasil identifikasi morfologi cendawan endofit yang diuji Kode
isolat Hasil identifikasi Koloni cendawan
Pengamatan mikroskopis
MAG1 Penicillium sp. 1
PAB2 Penicillium sp.2
HAG1 Aspergillus sp.
MAGR1 Fusarium sp.
HAJ1 Hifa steril 1
konidia
konidiofor fialid
hifa
hifa fialid konidiofor
konidia
visikel, falid
konidiofor
konidia
hifa makrokonidia
29
Isolat CBG5 (belum teridentifikasi)
Isolat CBG5 memiliki koloni berwarna putih dengan miselium aerial yang tidak merata. Pada tengah koloni warna koloni berubah menjadi hijau kecoklatan. Struktur hifa yang terbentuk bersepta dan hialin, serta memiliki konidia berupa kepala konidia yang menempel pada konidiofor. Isolat ini belum dapat diidentifikasi.
5
SIMPULAN DAN SARAN
Simpulan
Cendawan endofit yang berhasil diisolasi sebanyak 138 isolat, terdiri dari 13% isolat non patogenik, 72% isolat patogenik, dan 15% isolat berpotensi patogenik. Lima Isolat dari 8 cendawan endofit yang diuji menunjukkan penghambatan terhadap pertumbuhan P. capsici secara in vitro dan 2 diantaranya mekanismenya secara antibiosis. Cendawan endofit juga mampu meningkatkan
Tabel 6 (Lanjutan) Kode
isolat Hasil identifikasi Koloni cendawan
Pengamatan mikroskopis
HAJ2 Hifa steril 2
PBG7 Hifa steril 3
CBG5 Belum
teridentifikasi
hifa
hifa
hifa konidiofor
30
pertumbuhan bibit cabai baik pada pertambahan tinggi tanaman, panjang akar, dan bobot biomassa. Hasil seleksi cendawan endofit yang diuji in vivo diperoleh 5 isolat yang berpotensi mengendalikan penyakit busuk pangkal batang yaitu MAGR1, PBG7, HAJ1, PAB2, dan HAJ2, dengan tingkat penekanan kejadian penyakit sebesar 25.49 sampai 27.45%. Cendawan endofit yang telah diuji teridentifikasi sebagai Penicillium sp.1, Penicillium sp.2, Aspergillus sp.,
Fusarium sp., hifa steril 1, hifa steril 2, hifa steril 3 dan isolat CBG5 yang belum teridentifikasi.
Saran
Perlu dilakukan penelitian lanjutan dengan metode inokulasi cendawan endofit yang berbeda seperti penyemprotan pada bibit cabai. Selain itu perlu pula diteliti aplikasi endofit secara campuran untuk mendapatkan formulasi dan kefektifan yang baik dalam mengendalikan P. capsici pada cabai. Penelitian perlu pula dilanjutkan sampai tanaman cabai dewasa, sebab P. capsici tidak hanya menyerang pembibitan tapi juga menyerang cabang dan buah pada tanaman dewasa.
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology, 5th ed. New York (US): Academic Press. Alexopoulos CJ, Mims CW. 1996. Introductory Mycology, 4th Ed. New York characterization of Muscodor albus I-4.3s, a volatile antibiotic producing fungus. Plant Sci. 169:854-861.
[AVRDC] Asian Vegetable Research and Development Center. 2007. Chilli (Capsicum spp.) food chain analysis: setting research prorities in asia. Tech Bull. 38:1-260.
Bae H, Sicher RC, Kim MS, Kim SH, Strem MD, Melnick RL, Bailey BA. 2009. The beneficial endophyte Trichoderma hamatum Isolate DIS 219b promotes growth and delay the onset of the drought response in Theobroma cacao. J Exp Bot. 60:3279-3295.