MIKROB RIZOSFER DAN ENDOFIT JARINGAN AKAR
TANAMAN KARET SEBAGAI AGENS HAYATI PENYAKIT
AKAR PUTIH (
Rigidoporus lignosus
(Klotzsch) Imazeki)
SITI HARDIYANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Mikrob Rizosfer dan Endofit Jaringan Akar Tanaman Karet sebagai Agens Hayati Penyakit Akar Putih (Rigidoporus lignosus (Klotzsch) Imazeki) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SITI HARDIYANTI. Mikrob Rizosfer dan Endofit Jaringan Akar Tanaman Karet sebagai Agens Hayati Penyakit Akar Putih (Rigidoporus lignosus (Klotzsch) Imazeki). Dibimbing oleh BONNY POERNOMO WAHYU SOEKARNO dan TITIEK SITI YULIANI.
Karet merupakan salah satu komoditas ekspor yang memegang peranan penting bagi perekonomian Indonesia. Penyakit akar putih yang disebabkan oleh Rigidoporus lignosus merupakan salah satu faktor pembatas dalam budidaya tanaman karet. Infeksi patogen ini dapat mengakibatkan kematian tanaman sehingga jumlah tanaman produktif berkurang. Pengendalian penyakit sulit dilakukan karena patogen bersifat tular tanah dan dapat bertahan pada tunggul dan sisa-sisa tanaman yang terinfeksi. Teknik pengendalian yang saat ini banyak digunakan adalah dengan penggunaan agens hayati. Pengendalian ini memiliki nilai lebih karena selain bersifat efektif mengendalikan patogen juga bersifat ramah lingkungan. Penelitian ini bertujuan untuk mendapatkan agens hayati dari jaringan akar dan rizosfer tanaman karet yang memiliki potensi mengendalikan R. lignosus penyebab penyakit akar putih pada tanaman karet.
Penelitian dilakukan di Laboratorium Mikologi dan Bakteriologi Departemen Proteksi Tanaman, Institut Pertanian Bogor. Metode penelitian meliputi 4 tahapan, yaitu: 1) isolasi bakteri dan cendawan dari rizosfer dan jaringan akar tanaman karet, 2) seleksi bakteri dan cendawan dengan uji patogenisitas, 3) seleksi bakteri dan cendawan secara in vitro dan in vivo, 4) karakterisasi bakteri antagonis, dan 5) identifikasi bakteri dan cendawan antagonis.
Hasil isolasi mikrob dari rizosfer dan jaringan tanaman karet diperoleh 131 isolat bakteri dan 28 isolat cendawan, masing-masing terdiri atas 76 isolat bakteri rizosfer, 55 isolat bakteri dari jaringan akar, 13 isolat cendawan dari rizosfer, dan 15 isolat cendawan jaringan akar. Berdasarkan pengujian patogenisitas, sebanyak 99 isolat bakteri dan 18 isolat cendawan bersifat non patogen. Hasil pengujian secara in vitro dan in vivo diperoleh 2 isolat bakteri dan 3 isolat cendawan terbaik yang memiliki tingkat hambatan relatif lebih dari 50%. Isolat tersebut yaitu isolat bakteri rizosfer MR3, isolat bakteri endofit ME8, isolat cendawan endofit CB6, CB8, dan CL3.
Hasil pengujian secara in vitro menunjukkan bahwa isolat bakteri MR3, isolat cendawan CB6, dan CB8 memiliki sifat antibiosis dengan menghasilkan senyawa antifungal. Karakterisasi bakteri antagonis menunjukkan bahwa bakteri isolat MR3 memiliki kemampuan dalam memfiksasi nitrogen dan bakteri isolat ME8 mampu melarutkan fosfat dan memfiksasi nitrogen. Isolat cendawan CB8 mampu menghasilkan senyawa volatil dengan daya hambat sebesar 13%. Kemampuan hiperparasitisme juga ditunjukkan oleh isolat cendawan CL3 dan CB8 dengan ditandai aktivitas pelilitan hifa pada pengamatan mikroskopik.
ini dilakukan dengan cara membantu penyediaan nutrisi bagi tanaman seperti unsur P dan N.
Hasil identifikasi bakteri antagonis bedasarkan runutan sebagian gen 16S rRNA menunjukkan bahwa bakteri isolat MR3 memiliki kemiripan dengan Bacillus amyloliquefaciens, sedangkan isolat ME3 memiliki kemiripan dengan B. siamensis. Hasil identifikasi cendawan berdasarkan karakter morfologi untuk isolat CB8, CB6, dan CL3 secara berurutan yaitu hifa steril CB8, Chaetomium sp., dan Penicillium sp.
Informasi mengenai pengendalian efektif penyakit akar putih yang disebabkan oleh R. lignosus masih terbatas. Diharapkan penelitian yang telah dilakukan dapat melengkapi dan memberikan informasi ilmiah alternatif cara pengendalian penyakit akar putih karet dengan memanfaatkan mikrob yang bersifat agens antagonis, sehingga pengendalian secara berkelanjutan dapat diterapkan pada budi daya tanaman karet.
SUMMARY
SITI HARDIYANTI. Rhizospheric Microbes and Edophytic of Roots Tissues as Biocontrol of White Root Disease (Rigidoporus lignosus (Klotzsch) Imazeki). Supervised by BONNY POERNOMO WAHYU SOEKARNO and TITIEK SITI YULIANI.
Rubber is export comodities which plays an important role for the economy of Indonesia. The limiting factors in the cultivation of rubber tree is white root disease that caused by Rigidoporus lignosus. The symptom is the death of the plants so the productive trees are reduce. The controling of disease are difficult because the pathogen is soil borne disease and can survive in stumps and remains of infected plants. The controls techniques are currently widely used is the biological control. These controls have more value because effective in controlling the pathogen are also more environmentally friendly. This study aimed to abtain biological agents from the rhizosphere and endophytic of rubber tree that potential to control R. lignosus caused white root disease in rubber.
Research was conducted at The Mycology and Bacteriology Laboratory, Plant Protection Department, Bogor Agricultural University. Research methode include 5 stage, there were: 1) isolation of bacteria and fungi from root tisuues and rhizosphere of rubber tree, 2) selection of bacteria and fungi with pathogenicity test, 3) selection of bacteria and fungi based in vitro and in vivo assays, 4) characterization of antagonist bacteria and 5) identification of antagonist bacteria and fungi.
The isolation of rhizosphere microbes and endophytic of roots tissues of rubber tree results 131 bacterial isolates and 28 fungi isolates, each consisting of 55 bacterial isolates from roots tissue, 76 bacterial isolates from rhizosphere, 13 fungi isolates from rhizosphere and 15 fungi isolates from roots tissue. Based on pathogenicity testing results that 99 bacterial isolates and 18 fungi isolates were non pathogenic for plants. The result of in vitro and in vivo assays results that 2 bacteria and 3 fungi inhibit the growth of R. lignosus more than 50%. These isolates were rhizospheric bacterial MR3, endophytic bacteria of ME8, and endophytic fungi CB6, CB8, and CL3.
Based on in vitro assays, we knowed thats MR3, CB6, and CB8 isolates had antibiosis mecanism and produced antifungal to inhibit the growth of pathogen. Characterization of antagonistic bacteria showed that bacterial ME8 isolates were phosphate solubilizing and both MR3 and ME8 isolates were nitrogen fixing bacteria. Fungal isolate CB8 is able to produce volatile organic compound and inhibit the growth of R. lignosus about 13%. Hiperparasitsm activity shown by fungal isolates CL3 and CB8 with winding of hyphae on microscopic examination.
The identification of bacterial based on sequences 16S rRNA showed that the bacterial isolate MR3 has similarities with Bacillus amylolyquefaciens, and bacteria isolate ME8 has similarities with Bacillus sp. The identification of fungi based on morphological structure to isolates CB6, CL3, and CB8 were
Chaetomium sp., Penicillium sp., and sterile hyphae CB8.
Informasi mengenai pengendalian efektif penyakit akar putih yang disebabkan oleh R. lignosus masih terbatas. Diharapkan penelitian yang telah dilakukan dapat melengkapi dan memberikan informasi ilmiah cara pengendalian alternatif penyakit akar putih karet dengan memanfaatkan mikrob yang bersifat agens antagonis, sehingga pengendalian secara berkelanjutan dapat diterapkan pada budi daya tanaman karet.
The information about controling of white root rot disease efectively is fewer than other. Therefore, this research expected to increase the scientific information about the alternate controling of white root rot disease, which use antagonistic microbes, so that sustainable management of plant disease is applied well on rubber trees cultivation.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Fitopatologi
MIKROB RIZOSFER DAN ENDOFIT JARINGAN AKAR
TANAMAN KARET SEBAGAI AGENS HAYATI PENYAKIT
AKAR PUTIH (
Rigidoporus lignosus
(Klotzsch) Imazeki)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah pengendalian hayati, dengan judul Mikrob Rizosfer dan Endofit Jaringan Akar Tanaman Karet sebagai Agens Hayati Penyakit Akar Putih (Rigidoporus lignosus (Klotzsch) Imazeki).
Terima kasih penulis ucapkan kepada Dr. Ir. Bonny Poernomo Wahyu Soekarno, MS dan Dr. Ir. Titiek Siti Yuliani, SU selaku pembimbing, yang telah banyak memberi saran. Terima kasih kepada Dr. Ir. Elis Nina Heriyana, M.Si selaku Dosen Penguji di luar komisi yang telah memberikan masukan dan saran. Terima kasih kepada Prof. Dr. Ir. Sri Hedrastuti Hidayat, M.Sc selaku Ketua Prodi Fitopatologi yang telah memberikan saran selama menempuh pendidikan di Pascasarjana Fitopatologi IPB. Ungkapan terima kasih disampaikan kepada kedua orang tua, Bapak Samujiono dan Ibu Tarwiyani dan adik Siti Mustika Ningsih atas dukungan, doa, dan kasih sayangnya. Terima kasih kepada Pranata Laboratorium Mikologi dan Bakteriologi. Terima kasih kepada rekan-rekan Fitopatologi 2014, sahabat mikologi, dan teman-teman wisma queen 1 atas dukungan dan kerjasamanya selama ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Penyakit Akar Putih pada Tanaman Karet 3
Mikrob Antagonis sebagai Agens Hayati 4
Uji In Vivo Mikrob Antagonis terhadap R. lignosus 9
Karakterisasi Fisiologis Bakteri Antagonis 9
Identifikasi Mikrob Antagonis 10
Analisis Data 11
4 HASIL DAN PEMBAHASAN 12
Isolat Cendawan Patogen 12
Isolasi Mikrob dari Rizosfer dan Jaringan Akar Tanaman Karet 12 Potensi Bakteri Antagonis dalam Menghambat Pertumbuhan R. lignosus 13 Potensi Cendawan Antagonis dalam Menghambat Pertumbuhan R.
DAFTAR TABEL
1 Jumlah isolat mikrob asal rizosfer dan endofit jaringan akar tanaman
karet 12
2 Daya hambat bakteri potensial pada percobaan in vitro dan in vivo 13 3 Daya hambat cendawan antagonis pada percobaan in vitro dan in vivo 15
4 Karakter fisiologis bakteri antagonis 18
5 Identifikasi bakteri antagonis berdasarkan perunutan sebagian gen 16S
rRNA 21
DAFTAR GAMBAR
1 Skema uji antibiosis mikrob rizosfer dan endofit jaringan akar tanaman karet untuk isolat bakteri (A) dan cendawan (B). M merupakan mikrob rizosfer dan endofit jaringan akar. P merupakan patogen R. lignosus. 8 2 Perkembangan R. lignosus pada akar tanaman karet tanpa perlakuan
bakteri antagonis (A) dan pengaruh perlakuan bakteri antagonis MR3 terhadap penghambatan pertumbuhan R. lignosus pada akar tanaman
secara in vivo (B) 13
3 Kemampuan isolat bakteri antagonis dalam menekan pertumbuhan R. lignosus secara in vitro: kontrol (A); isolat bakteri MR3 (B); dan isolat
bakteri ME8 (C) 14
4 Kemampuan cendawan antagonis dalam menekan pertumbuhan R. lignosus secara in vitro: kontrol (A); isolat hifa steril CB8 (B); isolat Chaetomium sp. CB6 (C); dan isolat Penicillium sp. CL3 (D) 16 5 Diameter koloni R. lignosus yang dipengaruhi oleh senyawa volatil
yang dihasilkan oleh cendawan antagonis: kontrol (A); dan isolat hifa
steril CB8; 17
6 Aktivitas hiperparasitisme isolat cendawan antagonis terhadap R. lignosus pada perbesaran 400x: Hifa normal R. lignosus (A), pelilitan pada hifa R. lignosus oleh cendawan hifa steril CB8(B) dan Penicillium sp. CL3 (C), ukuran hifa mengecil akibat parasitisme cendawan
Chaetomium sp. CB6 (D) 17
7 Kemampuan bakteri antagonis dalam menambat fosfat pada kontrol (A)
dan isolat ME8 (B) 18
8 Kemampuan bakteri antagonis dalam memfiksasi nitrogen pada kontrol (A); isolat bakteri MR3 (B); dan isolat bakteri ME8 (C) 19 9 Koloni cendawan antagonis umur 5 hari pada media PDA: isolat CB8
(A); isolat CB6 (B); dan isolat CL3 (C) 20
10 Morfologi cendawan antagonis pada perbesaran 400x: hifa steril CB8 (A); peritesium Chaetomium sp. CB6 (B); dan Penicillium sp. CL3 (C) 20 11 Koloni bakteri rizosfer MR3 (A) dan bakteri endofit ME8 (B) 21 12 Klasifikasi filogenetik bakteri antagonis berdasarkan perunutan
MR3_IDN merupakan isolat bakteri rizosfer; BS_CHN_KY129717 merupakan isolat B. siamensis asal Cina dengan No. Aksesi Genbank KY129717; BSP_DE_KU644287 merupakan isolat bakteri B. subtillis asal Jerman dengan No. Aksesi Genbank KU644287; dan ME8_IDN
merupakan isolat bakteri endofit. 22
DAFTAR LAMPIRAN
1 Hasil uji patogenisitas isolat bakteri dari rizosfer dan endofit jaringan
akar tanaman karet 30
2 Hasil uji patogenisitas isolat cendawan dari rizosfer dan endofit
jaringan akar tanaman karet 33
1
PENDAHULUAN
Latar Belakang
Karet merupakan salah satu komoditas perkebunan yang memegang peranan penting bagi perekonomian Indonesia. Karet memiliki peran sebagai sumber pendapatan domestik negara, sumber pendapatan bagi masyarakat, membuka kesempatan kerja, dan berperan dalam pelestarian lingkungan dan sumber daya hayati. Secara umum luas perkebunan dan produksi karet di Indonesia mengalami peningkatan hingga tahun 2014. Pada tahun 2000 produktivitas karet sebesar 369 kg/ha dan meningkat pada tahun 2014 menjadi 834 kg/ha (BPS 2015). Meskipun demikian produktivitas ini lebih rendah jika dibandingkan dengan negara-negara penghasil karet lainnya, misalnya di Thailand yang mencapai 1 624 kg/ha (KEMENTAN 2015)
Secara umum rendahnya produktivitas karet di Indonesia disebabkan oleh umur tanaman karet yang telah tua dan adanya organisme pengganggu tanaman (OPT). Penyakit akar merupakan penyakit yang dapat menyebabkan kematian tanaman dan dapat menimbulkan kerusakan parah. Penyakit akar pada tanaman karet dapat disebabkan oleh Rigidoporus lignosus, Ganoderma pseudoferreum, dan Phellinus noxius. Menurut Lim et al. (1990) penyakit akar putih yang disebabkan oleh R. lignosus merupakan penyakit paling merusak, diikuti penyakit akar merah yang disebabkan oleh G. pseudoferreum dan P. noxius. Kehilangan hasil yang disebabkan penyakit akar putih lebih besar dibandingkan dengan hama dan penyakit lain di berbagai negara penghasil karet seperti India, Indonesia, Malaysia, Sri Lanka, Thailand, Afrika Barat, dan Tengah (Kaewchai et al. 2010). Di Nigeria penyakit akar putih menyebabkan kematian tanaman hingga setengah dari perkebunan karet (Omorusi 2012). Pada tahun 2015, luas serangan R. lignosus di Indonesia mencapai 26 ribu ha dan menyebabkan kerugian hasil sebesar 75.67 miliar rupiah (Isnaini 2016).
Tanaman yang terinfeksi R. lignosus menunjukkan gejala menguning pada daun dan diikuti dengan gugur daun. Pangkal batang membusuk dan mengakibatkan pohon mudah tumbang. Infeksi patogen pada stadia lanjut dapat menyebabkan kematian tanaman sehingga jumlah tanaman produktif menjadi berkurang dan produktivitas kebun menurun. Tanda yang dapat dikenali yaitu adanya tubuh buah (basidiokarp) di sekitar bagian bawah batang tanaman karet dan rizomorf menyebar melalui tanah dan menginfeksi tanaman karet di sekitarnya (Omo-Ikerodah et al. 2012).
2
biofertilizer yang berpotensi dalam meningkatkan produktivitas karet (Tistama dan Nugroho 2007).
Mikrob antagonis yang banyak dimanfaatkan dalam pengendalian R. lignosus sebagian besar merupakan kelompok cendawan antagonis. Beberapa genus cendawan antagonis yang diketahui menghambat perkembangan R. lignosus antara lain: Trichoderma, Penicillium, Eupenicillium, Paecilomyces, dan Aspergillus (Amaria et al. 2015). Muharni dan Widjajanti (2011) melaporkan bahwa bakteri rizosfer Bacillus sp. dan Bacillus apiarius bersifat antagonis dan mampu menghambat pertumbuahn R. lignosus secara in vitro. Oleh karena itu dilakukan penelitian ini guna menunjang keanekaragaman agens hayati dalam mengendalikan penyakit akar putih.
Perumusan Masalah
Penyakit akar putih pada tanaman karet yang disebabkan oleh cendawan R. lignosus sangat berpotensi menurunkan produktivitas tanaman karet. Penyakit akar putih yang disebabkan oleh R. lignosus telah dilaporkan menginfeksi tanaman karet di sentra-sentra tanaman karet di Indonesia, sehingga perlu dilakukan upaya pengendalian yang efektif dan efisien. Isolasi dan seleksi agens antagonis perlu dilakukan untuk mendapatkan isolat-isolat sebagai kandidat agens hayati yang dapat mengendalikan patogen R. lignosus.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan agens hayati dari rizosfer dan jaringan tanaman karet yang mempunyai potensi mengendalikan R. lignosus penyebab penyakit akar putih pada tanaman karet.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Syarat Tumbuh Tanaman Karet
Tanaman karet (Hevea brasiliensis Muell- Arg.) merupakan salah satu jenis tanaman yang memiliki nilai ekonomi di Indonesia dalam menghasilkan produk ekspor dan menambah devisa negara. Saat ini tanaman karet banyak dibudidayakan oleh perusahaan swasta, perusahaan negara, dan masyarakat. Tanaman karet merupakan tanaman tropis yang dapat cepat tumbuh dengan tinggi tanaman mencapai 25 m, dan mencapai 40 m pada tanaman liar. Genus Hevea berasal dari Amerika Selatan yang tumbuh liar di lembah Amazon dan Orinoco. Tanaman karet temasuk dalam famili Euphorbiaceae yang memiliki 280 genus dan 8000 spesies, hingga saat ini telah ditemukan 9 spesies yang telah dimanfaatkan.
Tanaman karet telah banyak dibudiyakan pada daerah dataran rendah pada daerah tropis dengan ketinggian 300-500 di atas permukaan air laut, dengan suhu berkisar 23-35 oC dan curah hujan rata-rata 1500-4000 mm. Tanaman karet toleran terhadap pH tanah yang tinggi, tetapi dapat tumbuh dengan baik pada kisaran pH antara 4.5 dan 6 (Verheye 2010).
Penyakit-penyakit Penting Tanaman Karet
Budi daya tanaman karet tidak lepas dari adanya infeksi patogen dan mengakibatkan penyakit pada tanaman. Penyakit tanaman karet dapat terjadi pada daerah perakaran, daerah bidang sadap, dan pada daun tanaman. Penyakit yang terjadi pada daun antara lain south american leaf blight (SALB) yang disebabkan oleh Microcyclus ulei (Lieberei 2007), penyakit gugur daun yang disebabkan oleh Corynespora cassiicola (Evueh et al. 2011), penyakit hawar daun yang disebabkan oleh Neofusicoccum ribis (Ngobisa et al. 2013), dan penyakit bercak daun yang disebabkan oleh Colletotricum sp. (Hashim et al. 2014). Penyakit pada bidang sadap yang banyak menimbulkan kerugian yaitu penyakit mouldy rot yang disebabkan oleh Ceratocystis fimbriata (Valdetaro et al. 2015). Penyakit yang terjadi pada akar tanaman karet antara lain penyakit akar coklat yang disebabkan oleh Phellinus noxius dan penyakit akar putih yang disebabkan oleh R. lignosus. Penyakit pada akar tanaman karet merupakan penyakit paling penting dan menimbulkan kerusakan yang serius diantara penyakit lainnya.
Penyakit Akar Putih pada Tanaman Karet
Penyebab Penyakit
Cendawan patogen penyebab penyakit akar putih adalah R. lignosus (Klotzsch) Imazeki (Omurusi 2012). Koloni cendawan ini terlihat berwarna putih dan datar pada media PDA. Hifa cendawan bersifat monomitic, hialin, berdinding tebal dengan septa tanpa koneksi penjepit, terdapat clamp connection dan memiliki banyak cabang (Kwaechai et al. 2010). Rizomorf tumbuh dengan cepat pada tanah dan dapat menginfeksi akar tanaman sehat.
4
permukaannya halus dan permukaan bawah tubuh buah berwarna jingga kecoklatan, halus dan memiliki pori-pori. Basidiospora berbentuk bulat, berdinding tipis, tidak berwarna, dan halus. Ukuran spora adalah 3.6-4.1 µm (Kwaechai et al. 2010). Hood (2006) melaporkan bahwa pori-pori pada permukaan bawah tubuh buah berukuran 6-9 mm.
Identifikasi ITS yang dilakukan oleh Kwaechai et al. (2010) menunjukkan bahwa R. lignosus berkerabat dekat dengan R. ulmaroius. Ryvarden (1991) melaporkan bahwa R. lignosus berkerabat dengan Melanoporia, Nigrofomes, Heterobasidion, Oxyporus, Leucophellinus, Laetiporus, Flavodon dan Irpex serta menegaskan bahwa R. lignosus berbeda dari R. ulmarius.
Gejala Penyakit
Gejala penyakit akar putih biasanya terlihat pada fase akhir perkembangan penyakit. Nama penyakit akar putih ini diambil dari warna cendawan pada miselium epifitotik yang menginfeksi akar tanaman. Menurut Omo-Ikerodah et al. (2012) gejala awal penyakit ditandai dengan daun tanaman menguning, kemudian seluruh kanopi akan hancur dan pohon akan tumbang diakibatkan oleh pembusukan akar lateral. Pada stadium lanjut akan muncul tubuh buah disekitar pangkal batang.
Daur Penyakit
Infeksi R. lignosus terjadi melewati 3 tahap yaitu penetrasi, kolonisasi dan degradasi. Patogen memenetrasi akar dan mengolonisasi jaringan, aktivitas patogenesis patogen melibatkan aktivitas enzimatik, struktur khusus atau dengan penetrasi melaui lubang alami atau luka (Kwaechai et al. 2010).
Pengamatan interaksi cendawan pada inang mengungkapkan beberapa interaksi yaitu distorsi dan rusaknya lamella tengah dinding sel yang diakibatkan dari aktivitas enzimatik. Pada jaringan yang terinfeksi terdapat tiga enzim yaitu CM-selulosa, pektinase dan laktase yang terlibat dalam aktivitas patogen terhadap inang (Geiger et al. 1986).
Faktor yang Memengaruhi Perkembangan Penyakit
Penyakit akar putih dapat menginfeksi tanaman karet sejak di pembibitan hingga pada perkebunan tua. Kebun karet dari bekas hutan dan kebun tua yang pembukaannya tidak dilakukan dengan baik akan banyak terinfeksi dengan R. lignosus. Cendawan akar putih memiliki pertumbuhan dan biomassa lebih tinggi pada pH 6-7 dibandingkan pada pH 3-4 (Dede et al. 2011).
Mikrob Antagonis sebagai Agens Hayati
5 yang kompetitif atau yang bersifat antagonis terhadap patogen tanaman yang interaksinya di alam dapat menurunkan atau mencegah terjadinya penyakit tanaman (Baker dan Cook 1974).
Mikrob Rizosfer
Tanaman selalu berasosiasi dengan mikrob sepanjang waktu, mikrob ini merupakan komponen ekosistem yang berperan dalam pertumbuhan tanaman. Mikrob tanah memiliki peran penting pada ekosistem tanah. Mikrob dapat digunakan sebagai indikator selektif pada tanah dan juga sebagai indeks untuk mengevaluasi kualitas tanah (Zhang et al. 2013). Mikrob yang berasal dari tanah memungkinkan untuk digunakan sebagai komponen fundamental yang dapat dipertimbangkan sebagai salah satu strategi manajemen untuk tercapainya pertanian berkelanjutan. Beberapa penelitian menunjukkan bahwa keberadaan mikrob rizosfer dipengaruhi oleh beberapa aspek seperti tipe tanah, stadia pertumbuhan tanaman, kultivar, dan genotipe inang (Hidayati et al. 2014).
Pemanfaatan mikrob rizosfer telah banyak dilakukan dalam bidang pertanian. Pemberian bakteri rizosfer pada tanaman jagung dapat mempercepat perkecambahan benih dan meningkatkan pertumbuhan tanaman jagung (Karakaya dan Martison 1995). Inokulasi bakteri rhizozfer pada tanaman gandum dapat meningkatkan pertumbuhan akar dan tajuk tanaman (Egamberdieva 2008). Mu’minah et al. (2015) mengemukakan bahwa bakteri yang berasal dari rizosfer dapat memproduksi senyawa pemicu pertumbuhan tanamanan (IAA) antara 0.4 dan 21.14 mg/L. Mekanisme mikrob rizosfer dalam pertumbuhan dan perlindungan tanaman antara lain memiliki kemampuan dalam memfiksasi nitrogen, melarutkan fosfat, menghasilkan senyawa perangsang pertumbuhan tanaman dan memproduksi enzim selulase (Susilowati et al. 2015).
Mikrob Endofit
Mikrob endofit secara umum merupakan organisme yang hidup di dalam jaringan tanaman baik berupa bakteri (Kobayashi dan Palumbo 2000), cendawan (Syamsia et al. 2015) maupun alga (Peters 1991). Mikrob endofit bersifat tidak menyebabkan penyakit pada tanaman inangnya. Eksplorasi mikrob endofit yang bersifat mutualisme telah banyak dilakukan. Mikrob diseleksi dan dimanfaatkan sebagai agens hayati dalam perlindungan tanaman. Beberapa mikrob endofit telah diisolasi dari berbagai jenis tanaman di Indonesia seperti tanaman hutan, gulma, dan tanaman yang dibudidayakan.
Bakteri endofit dapat diisolasi dari bunga, buah, daun, batang, akar, dan biji dari bermacam-macam spesies tanaman. Bakteri endofit mengendalikan patogen tanaman melalui mengolonisasi jaringan, antagonisme langsung dengan menghasilkan senyawa metabolit dan induced systemic resistance (ISR). Selain itu bakteri endofit mampu memberikan keuntungan tambahan seperti agen pemacu pertumbuhan. Pada umumnya pemacu pertumbuhan pada tanaman difasilitasi oleh mikrob pengolah seperti pelarut nutrisi, fiksasi N dari atmosfer dan memproduksi hormon pertumbuhan tanaman (Hallmann 2001). Sementara menurut Munif et al.
6
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Januari sampai Oktober 2016 di Laboratorium Mikologi dan Bakteriologi, Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Penyiapan Isolat Cendawan Patogen
Isolat R. lignosus diperoleh dari Balai Penelitian Karet Sembawa, Sumatra Selatan. Isolat dari culture stock diremajakan pada media potato dextrosa agar (PDA) untuk digunakan pada pengujian-pengujian selanjutnya.
Isolasi Mikrob pada Tanaman Karet
Isolasi Mikrob dari Rizosfer Tanaman Karet
Isolasi mikrob rizosfer dilakukan dengan metode pengenceran berseri (Chang dan Yang 2009). Tanah rizosfer tanaman karet diperoleh dari perkebunan karet rakyat di Kabupaten Sarolangun dan Kabupaten Muaro Jambi, Provinsi Jambi. Tanah sebanyak 1 g dicampurkan dengan 9 mL akuades steril (perbandingan 10:1) kemudian dihomogenisasi menggunakan shaker dengan kecepatan 100 rpm selama 15 menit kemudian suspensi diencerkan hingga 10-6. Isolasi cendawan rizosfer dilakukan dengan menumbuhkan sebanyak 0.1 mL suspensi dalam cawan petri yang telah berisi media PDA. Isolasi bakteri rizosfer dilakukan dengan menumbuhkan sebanyak 0.1 mL suspensi pada media trypticase soya agar (TSA) 10%. Hasil isolasi diinkubasi selama 2 hari untuk isolasi bakteri rizosfer dan 7 hari untuk isolasi cendawan rizosfer. Masing-masing isolat cendawan dan bakteri yang memiliki morfologi berbeda dipindahkan pada media PDA dan TSA 100% untuk mendapatkan isolat murni.
Isolasi Mikrob dari Jaringan Akar
7 mendapatkan biakan murni dari masing-masing bakteri. Isolasi cendawan dari jaringan tanaman dilakukan dengan metode sterilisasi permukaan seperti isolasi bakteri. Tingkat keberhasilan sterilisasi permukaan dilakukan dengan mengoleskan potongan akar pada media PDA. Potongan akar tanaman karet yang telah disterilisasi permukaannya kemudian ditumbuhkan pada media PDA. Pemurnian isolat yang tumbuh dilakukan setelah diinkubasi selama 7 hari dengan memindahkan isolat cendawan yang memiliki morfologi berbeda pada media PDA baru.
Uji Patogenisitas
Uji Patogenisitas Isolat Bakteri. Pengujian ini bertujuan untuk mengetahui sifat patogenik isolat bakteri yang telah diperoleh. Uji patogenisitas isolat bakteri dilakukan dengan pengujian reaksi hipersensitif pada tanaman tembakau. Isolat bakteri ditumbuhkan pada media trypticase soya broth (TSB) dan digoyang menggunakan shaker selama 24 jam dengan kecepatan 100 rpm. Isolat bakteri sebanyak 1 mL dengan kerapatan 108 cfu/mL diinfiltrasikan pada daun tembakau dan diinkubasi selama 24−48 jam. Apabila terjadi nekrotik pada daun tembakau, maka isolat tersebut berpotensi patogen dan tidak dapat digunakan pada tahap seleksi selanjutnya.
Uji Patogenisitas Isolat Cendawan. Uji patogenisitas isolat cendawan dilakukan dengan pengujian gejala pada benih padi. Benih padi yang digunakan pada pengujian ini ialah benih padi varietas Ciherang. Benih padi disterilisasi permukaannnya terlebih dahulu dengan merendam benih dalam larutan sodium hypochlorite 2% selama 2 menit kemudian dibilas dengan akuades steril sebanyak 3 kali. Benih padi ditumbuhkan di atas isolat cendawan endofit dan rizosfer yang telah berumur 7 hari. Pengamatan dilakukan setelah 14 hari dengan melihat gejala yang terjadi pada tanaman padi. Apabila terjadi bercak nekrotik dan benih tidak tumbuh sempurna, maka isolat cendawan yang diperoleh berpotensi patogen terhadap tanaman.
Uji In Vitro terhadap R. lignosus
Uji Antibiosis
8
Gambar 1 Skema uji antibiosis mikrob rizosfer dan endofit jaringan akar tanaman karet untuk isolat bakteri (A) dan cendawan (B). M merupakan mikrob rizosfer dan endofit jaringan akar; P merupakan patogen R. lignosus.
Persentase penghambatan pertumbuhan R. lignosus oleh aktivitas antibiosis dihitung dengan menggunakan rumus berikut:
Keterangan:
H : Persentase penghambatan pertumbuhan (%)
R1 : Jari-jari koloni patogen yang tidak terhambat pertumbuhannya (mm) R2 : Jari-jari koloni patogen yang terhamat pertumbuhannya (mm)
Uji Produksi Senyawa Volatil
Pengujian produksi senyawa volatil bertujuan untuk melihat aktivitas mikrob rizosfer dan endofit jaringan akar tanaman karet dalam menghasilkan senyawa volatil. Pengujian ini dilakukan terhadap isolat bakteri dan cendawan antagonis yang memiliki daya hambat tertinggi pada pengujian antibiosis. Uji produksi senyawa volatil dilakukan dengan menggunakan dua cawan petri dengan ukuran diameter seragam (Raza et al. 2015). Isolat mikrob rizosfer dan endofit dikulturkan pada media PDA untuk cendawan dan pada media TSA untuk isolat bakteri. Isolat mikrob rizosfer dan endofit dikulturkan pada bagian bawah cawan petri kemudian ditutup dengan cawan petri yang telah dikulturkan dengan R. lignosus. Cawan petri direkatkan dengan menggunakan plastic wrap dan diinkubasi selama 7 hari pada suhu ruang. Produksi senyawa volatil mikrob rizosfer dan endofit dilakukan dengan membandingkan diameter cendawan R. lignosus pada perlakuan uji dan pada kontrol. Persentase penghambatan dihitung menggunakan rumus:
9
Keterangan:
ɸK = diameter R. lignosus pada perlakuan kontrol
ɸP = diameter R. lignosus pada perlakuan mikrob antagonis.
Uji Hiperparasitisme Cendawan Antagonis
Pengujian hiperparasitisme bertujuan untuk melihat aktivitas hiperparasitisme cendawan antagonis dari rizosfer dan endofit tanaman karet dalam menghambat pertumbuhan R. lignosus. Pengujian ini dilakukan terhadap 3 isolat cendawan antagonis yang memiliki daya hambat tertinggi pada pengujian antibiosis. Pengujian dilakukan dengan mengikuti metode Amaria et al. (2015). Isolat cendawan antagonis umur 7 hari dikulturkan pada media PDA kemudian R. lignosus diinokulasikan pada jarak 3 cm dari koloni cendawan antagonis. Inkubasi dan pengamatan dilakukan pada saat terjadi tumpang tindih antara kedua koloni. Pertemuan antara kedua koloni ini diamati dengan menggunakan mikroskop untuk melihat aktivitas hiperparasitisme cendawan antagonis. Indikator mekanisme hiperparasitisme dilihat dari pelilitan dan lisis pada hifa R. lignosus. Perlakuan pada percobaan ini diulang sebanyak 3 kali
Uji In Vivo Mikrob Antagonis terhadap R. lignosus
Seleksi in vivo dilakukan dengan menggunakan potongan akar tanaman karet (Jayasuriya dan Thenaakoon 2007) yang telah dimodifikasi. Isolat mikrob antagonis yang digunakan ialah isolat yang memiliki daya hambat lebih dari 50% pada seleksi in vitro. Pengujian dilakukan dengan menggunakan kotakplastik dan diisi dengan tanah steril hingga 1/2 bagian. Potongan akar karet (panjang 8-10 cm, lebar 2-3 cm) direndam pada suspensi agens antagonis dengan kerapatan 108 cfu mL-1 selama 6 jam, sebagai kontrol perendaman akar dilakukan dengan menggunakan akuades steril. Akar tanaman selanjutnya diletakkan di atas permukaan tanah. Sisa suspensi isolat mikrob antagonis disiramkan di atas permukaan akar. Inokulasi cendawan R. lignosus dilakukan pada jarak 1 cm dari ujung akar. Setelah diinkubasi selama 10 hari dilakukan perhitungan persentase penghambatan dengan mengukur pertumbuhan rizomorf.
Karakterisasi Fisiologis Bakteri Antagonis
Uji Pelarut Fosfat
10
Uji Penambat Nitrogen
Pengujian ini dilakukan untuk mengetahui kemampuan isolat agens antagonis dalam menyediakan nitrogen untuk tanaman. Uji sifat bakteri dalam menambat nitrogen dilakukan dengan mengkulturkan bakteri pada media semi padat JNFb (malic acid 5 g, kalium hidroksida 4 g, ferrous sulfat 0.05 g, manganese sulfat 0.01 g, magnesium sulfat 0.1 g, natrium klorida 0.02 g, kalsium klorida 0.01 g, natrium molibat 0.002 g, bromothymol blue 2 mL, agar 1.75 g, dan akuades 1 L). Inkubasi dilakukan selama 48 jam, apabila media berubah warna menjadi biru atau biru tua serta pada bakteri akan terdapat lapisan lendir maka isolat bakteri uji tersebut memiliki kemampuan dalam penambat nitrogen (Hongrittipun et al. 2014).
Identifikasi Mikrob Antagonis
Identifikasi Cendawan Antagonis
Isolat cendawan antagonis yang berpotensi sebagai agens biokontrol diidentifikasi berdasarkan karakter morfologi dengan menumbuhkan cendawan endofit pada medium water agar (WA) kemudian diamati di bawah mikroskop dan diidentifikasi berdasarkan karakter morfologi dengan buku identifikasi cendawan menurut Watanabe (2002), dan Barnet dan Hunter (2006).
Identifikasi Bakteri Antagonis
Identifikasi bakteri antagonis bertujuan untuk melihat klasifikasi bakteri antagonis yang diperoleh berdasarkan perunutan sebagian gen 16S rRNA. Identifikasi dilakukan menggunakan polymerase chain reaction (PCR) melalui tahapan ektraksi DNA, Amplifikasi DNA, dan perunutan gen bakteri.
Ektraksi DNA. Isolasi DNA dilakukan dengan menyiapkan kultur bakteri sebanyak 1.5 mL umur 24 jam kemudian disentrifugasi dengan kecepatan 10 000 rpm selama 5 menit pada suhu ruang. Pelet yang terbentuk ditambahkan dengan 250 µL bufer TE dan 5 mg/mL lisozym dan digoyang pada suhu 37 °C selama 30 menit. Setelah diinkubasi ditambahkan dengan SDS 10% sebanyak 50 µL dan digoyang pada suhu 37 °C selama 60 menit, kemudian ditambahkan dengan 65 µL 5M NaCl dan 80 µL CTAB-NaCl diinkubasi pada suhu 65 °C selama 20 menit pada shaker water bath. Setelah diinkubasi ditambahkan dengan 450 µL CI (Chlroform:Isoamil alkohol) dan dikocok selama 30 menit. Kemudian disentrifugasi selama 20 menit dengan kecepatan 11 000 rpm. DNA yang diperoleh kemudian dipresipitasi dengan menambahkan 400 µL isopropanol dengan suhu -20 °C dan diinkubasi selama 30 menit pada suhu -20 °C. DNA diendapkan dengan disentrifugasi pada kecepatan 12 000 rpm selama 20 menit pada suhu 4 °C. Pelet yang terbentuk dicuci dengan menambahkan etanol 70% (suhu -20 °C) sebanyak 800 µL lalu disentrifugasi kembali selama 2 menit dengan kecepatan 12 000 rpm pada suhu 4 °C. Supernatan dibuang dan pelet DNA dikeringanginkan selama 12 jam pada suhu ruang. Pelet DNA yang dihasilkan kemudian dilarutkan dengan bufer TE. Selanjutnya, suspensi DNA disimpan pada freezer dengan suhu -20 °C.
11 yang digunakan DNA template 1 µL, KAPA taq Ready Mix (KAPA Biosystem) 12.5 µL, forward primer 1 µL, reverse primer 1 µL dan ddH2O 9.5 µL. Proses PCR
dilakukan sebanyak 30 siklus dengan kondisi pra PCR 95 °C selama 5 menit, denaturasi 95 °C selama 1 menit, annealing 55 °C selama 5 menit, elongation 72 °C selama 1.5 menit, dan post-PCR 72 °C selama 5 menit. Hasil amplifikasi DNA selanjutnya dilakukan perunutan gen di laboratorium 1st BASE. Data hasil perunutan gen kemudian dicocokkan dengan data GeneBank NCBI (national center for biotechnology information) menggunakan BLAST pada situs http://www.ncbi.nlm.nih.org.
Analisis Data
12
4 HASIL DAN PEMBAHASAN
Isolat Cendawan Patogen
Isolat cendawan patogen yang digunakan diperoleh dari Balai Penelitian Karet Sembawa yang diisolasi dari tanaman terinfeksi R. lignosus di Provinsi Jambi. Cendawan yang digunakan dalam setiap perlakuan ialah cendawan berumur 7 hariyang diinkubasi pada suhu kamar.
Isolasi Mikrob dari Rizosfer dan Jaringan Akar Tanaman Karet
Hasil isolasi mikrob dari rizosfer dan jaringan akar tanaman karet diperoleh 131 isolat bakteri dan 28 isolat cendawan, masing-masing terdiri atas 76 isolat bakteri rizosfer, 55 isolat bakteri dari jaringan akar, 13 isolat cendawan dari rizosfer, dan 15 isolat cendawan dari jaringan akar. Berdasarkan pengujian patogenisitas, sebanyak 99 isolat bakteri dan 18 isolat cendawan bersifat non patogen, masing-masing terdiri atas 57 isolat bakteri dari rizosfer, 42 isolat bakteri dari jaringan akar, 8 isolat cendawan dari rizosfer, dan 10 isolat cendawan dari jaringan akar (Tabel 1, Tabel Lampiran 1, dan Tabel Lampiran 2).
Tabel 1 Jumlah isolat mikrob asal rizosfer dan endofit dari jaringan akar
Asal mikrob Mikrob Mikrob non patogen
Bakteri Cendawan Bakteri Cendawan
Rizosfer 76 13 57 8
Jaringan Akar 55 15 42 10
Total 131 28 99 18
Kelimpahan populasi bakteri pada rizosfer maupun pada jaringan akar tanaman menunjukkan populasi yang lebih dominan dibandingkan dengan populasi cendawan. Penelitian sebelumnya menyatakan bahwa pada permukaan daun, populasi bakteri diketahui lebih dominan dibandingkan dengan populasi cendawan dan khamir (Lindow dan Leveau 2002; Lindow dan Brandi 2003). Sementara itu populasi mikrob pada rizosfer lebih melimpah dibandingkan dengan populasi mikrob pada jaringan akar tanaman. Hal ini berkaitan dengan keberadaan nutrisi yang lebih melimpah pada daerah rizosfer karena dipengaruhi oleh adanya eksudat akar. Kolonisasi mikrob pada akar tanaman dipengaruhi oleh adanya senyawa atraktan antara lain berupa asam amino. Oku et al. (2012) menyatakan bahwa kolonisasi Pseudomonas fluorescens Pf0-1 pada akar tanaman tomat dipengaruhi oleh peran asam amino yang dihasilkan oleh akar tanaman yaitu: sisteina, glutamina, isoleusina, lisina, metionina, fenilalanina, prolina, dan serina.
13 tanaman tembakau sebagai tanaman indikator. Gejala nekrotik pada daun tembakau menunjukkan bahwa isolat bakteri yang diuji berpotensi menimbulkan penyakit pada tanaman. Tanaman tembakau menghasilkan respons hipersensitif berkorelasi dengan kemampuan bakteri tersebut menyebabkan penyakit pada tanaman inang yang rentan. Uji patogenisitas isolat cendawan dilakukan dengan menggunakan benih padi karena benih padi memberikan respon yang cepat terhadap infeksi patogen yang ditandai dengan gejala nekrotik atau benih tidak berkecambah sempurna.
Potensi Bakteri Antagonis dalam Menghambat Pertumbuhan R. lignosus
Hasil pengujian secara in vitro terhadap 99 isolat bakteri rizosfer dan endofit jaringan akar dipilih 2 isolat bakteri yang mampu menghambat pertumbuhan R. lignosus lebih dari 50%. Kedua isolat bakteri tersebut ialah bakteri rizosfer MR3 dan bakteri endofit ME8, masing-masing mampu menghambat R. lignosus sebesar 70.0% dan 62.5%. Pengujian in vivo pada akar tanaman karet isolat MR3 dan ME8 mampu menekan pertumbuhan R. lignosus masing-masing 100% (Tabel 2 dan Tabel Lampiran 1). Bakteri antagonis yang diperoleh berpotensi dalam mengendalikan R. lignosus pada kondisi in vivo dengan menghambat pertumbuhan miselium pada akar tanaman (Gambar 2).
Tabel 2 Daya hambat bakteri potensial pada percobaan in vitro dan in vivo
Kode isolat Daya hambat (%)
Uji antibiosis (in vitro) Akar tanaman (in vivo)
MR3 62.5 100
ME8 70.0 100
Gambar 2 Perkembangan R. lignosus pada akar tanaman karet tanpa perlakuan bakteri antagonis (A) dan pengaruh perlakuan bakteri antagonis MR3 terhadap penghambatan pertumbuhan R. lignosus pada akar tanaman secara in vivo (B)
Hasil pengujian secara in vivo menunjukkan bahwa kedua isolat bakteri antagonis mampu menekan perkembangan miselium pada akar tanaman. Pada akar tanaman yang telah diinokulasi dengan bakteri antagonis, miselium tidak dapat tumbuh pada permukaan akar. Hal ini mengindikasikan bahwa bakteri antagonis yang diperoleh mampu mengolonisasi jaringan akar dan memiliki
14
kemampuan beradaptasi pada lingkungan dengan baik sehingga R. lignosus tidak mampu mengolonisasi akar tanaman.
Uji Antibiosis
Pada pengujian antibiosis dapat dilihat 2 mekanisme pengendalian patogen yaitu mekanisme kompetisi dan produksi senyawa allelokimia. Pada pengujian ini dapat dilihat bahwa isolat bakteri MR3 memiliki zona bening yang terdapat diantara kedua koloni. Hal ini mengindikasikan bahwa isolat bakteri MR3 menghasilkan senyawa allelokimia dalam menekan pertumbuhan R. lignosus. Isolat bakteri ME8 memiliki kecepatan tumbuh lebih besar dibandingkan dengan R. lignosus sehingga pertumbuhan R. lignosus terhambat. Mekanisme kompetisi ruang dan nutrisi pada isolat ME8 lebih berperan dibandingkan dengan mekanisme produksi senyawa allelokimia (Gambar 3).
Gambar 3 Kemampuan isolat bakteri antagonis dalam menekan pertumbuhan R. lignosus secara in vitro: kontrol (A); isolat bakteri MR3 (B); dan isolat bakteri ME8 (C)
Secara umum, mekanisme agens antagonis dalam menghambat pertumbuhan patogen meliputi kompetisi ruang dan nutrisi, memproduksi senyawa allelokimia yang bersifat menghambat patogen, dan menginduksi ketahanan sistemik (ISR) tanaman inang (Compant et al. 2005). Mekanisme bakteri antagonis dalam mengendalikan patogen tanaman telah diteliti sebelumnya. Bakteri B. amyloliquefaciens diketahui menghasilkan senyawa surfactin, iturin, bacilomycine, azalomycin, acivicin, arthrobactin, rhodutorola acid, valinomycin, stenothricin, enterochelin, dan nocardamin (Wulff et al. 2002). Menurut Soares et al. (2015) selain menghasilkan senyawa antifungal bakteri B. amyloliquefaciens juga diketahui memproduksi hormon pertumbuhan tanaman dan mampu memfiksasi nitrogen di udara. Ribeiro dan Cardoso (2012) menyatakan bahwa isolat B. amyloliquefaciens yang diisolasi dari rizosfer pada tanaman hutan, selain bersifat antagonis juga menunjukkan kemampuan dalam produksi enzim fosfatase, produksi siderofor, dan memfiksasi nitrogen.
Senyawa antifungal yang dihasilkan oleh Bacillus subtilis strain E1R-j dapat mengakibatkan hifa cendawan terselimuti eksudat kemudian membengkak, pecah (lisis), membengkok, keriput dan akhirnya mati (Liu et al. 2009). Hasil penelitian Muharni dan Widjajanti (2011) menunjukkan bakteri Bacillus sp dan B. apiarus yang diisolasi dari rizosfer tanaman karet bersifat antagonis terhadap R. lignosus dengan menghasilkan enzim kitinolitik. Sebagian besar isolat B. subtilis yang
15 diisolasi dari rizosfer di hutan juga memiliki kemampuan dalam produksi siderofor dan enzim fosfatase (Ribeiro dan Cardoso 2012).
Potensi Cendawan Antagonis dalam Menghambat Pertumbuhan R. lignosus
Hasil pengujian in vitro terhadap 18 isolat cendawan rizosfer dan endofit dari jaringan akar tanaman karet diperoleh 3 isolat cendawan endofit yang memiliki daya hambat tertinggi yaitu isolat CB8, CB6, dan CL3 dengan daya hambat berturut-turut sebesar 65.3%, 57.8%, dan 57.3%. Isolat ini juga memiliki daya hambat lebih dari 50% pada pengujian in vivo. Isolat CB8 diketahui menghasilkan senyawa volatil yang mampu menghambat pertumbuhan R. lignosus (Tabel 3 dan Tabel Lampiran 2).
Tabel 3 Daya hambat cendawan antagonis pada percobaan in vitro dan in vivo
Kode isolat Cendawan
Cendawan antagonis memiliki kemampuan menghambat R. lignosus yang berbeda pada kondisi in vitro dan in vivo. Isolat cendawan CL3 pada kondisi in vivo memiliki daya hambat yang lebih tinggi jika dibandingkan dengan kondisi in vitro. Hal ini diduga cendawan isolat CL3 lebih mampu beradaptasi pada lingkungan. Selain itu, cendawan antagonis akan lebih banyak memproduksi senyawa antibiosis pada kondisi lingkungan yang miskin nutrisi. Cendawan antagonis isolat CB8 dan isolat CB6 memiliki kemampuan daya hambat yang tidak jauh berbeda pada kondisi in vitro dan in vivo. Hal ini diduga karena kedua isolat ini mampu beradaptasi pada lingkungan yang baru.
Pemanfaatan cendawan antagonis khususnya cendawan rizosfer untuk mengendalikan R. lignosus telah banyak dilakukan. Cendawan yang banyak digunakan sebagian besar merupakan cendawan dari Genus Trichoderma. Jayasuriya dan Thennakoon (2007) menyatakan bahwa T. harzianum memiliki sifat antagonis pada R. lignosus dan mampu mempertahankan sporanya pada kerapatan spora sebesar 50% selama 4 bulan pada kondisi kering. Ogebor et al. (2015) menyatakan bahwa Hypocrea jecorena mampu meningkatkan pertumbuhan bibit tanaman karet dan menurunkan kematian tanaman akibat R. lignosus setelah 150 hari inokulasi.
16
antagonis memiliki kemampuan daya hambat yang berbeda walaupun cendawan tersebut berada pada genus yang sama.
Uji Antibiosis
Hasil pengujian antibiosis menunjukkan bahwa isolat cendawan antagonis yang diisolasi dari rizosfer dan jaringan akar tanaman karet memiliki potensi dalam mengendalikan R. lignosus. Berdasarkan pengujian secara in vitro dapat dilihat mekanisme cendawan antagonis dalam menekan pertumbuhan R. lignosus, yaitu mekanisme kompetisi dan antibiosis. Mekanisme kompetisi dapat dilihat jika cendawan antagonis dapat tumbuh lebih cepat dibandingkan dengan R. lignosus sehingga cendawan tersebut mengalami penekanan pertumbuhan. Mekanisme antibiosis dapat dilihat dengan terbentuknya zona bening di antara kedua koloni cendawan. Zona bening ini menandakan bahwa isolat cendawan antagonis menghasilkan senyawa antifungal yang menghambat pertumbuhan R. lignosus (Gambar 4).
Gambar 4 Kemampuan cendawan antagonis dalam menekan pertumbuhan R. lignosus secara in vitro: kontrol (A); isolat hifa steril CB8 (B); isolat Chaetomium sp. CB6 (C); dan isolat Penicillium sp. CL3 (D)
Cendawan endofit hifa steril CB8 diketahui memiliki mekanisme kompetisi dalam menekan pertumbuhan R. lignosus. Pada pertemuan kedua koloni cendawan juga terdapat zona bening yang menandakan terbentuknya senyawa antifungal. Cendawan Chaetomium sp. CB6 diketahui membentuk senyawa antifungal dalam menekan perkembangan R. lignosus. Soytong et al. (2001) menyatakan bahwa C. globosum diketahui menghasilkan senyawa chaetoglobosin dan chaetoviridins yang berperan dalam mekanisme penekanan patogen. Cendawan Penicillium sp. CL3 yang ditemukan pada penelitian ini diketahui tidak membentuk zona bening pada uji antibiosis. Hal ini diduga mekanisme kompetisi lebih berperan dalam menghambat pertumbuhan R. lignosus. Sementara itu, Penicillium spp. diketahui mampu menghasilkan senyawa metabolit sekunder berupa 3-Omethylfunicone, mycophenolic acid, dan patulin yang diekstraksi dari kultur filtrat cendawan (Nicoletti et al. 2004).
Uji Produksi Senyawa volatil
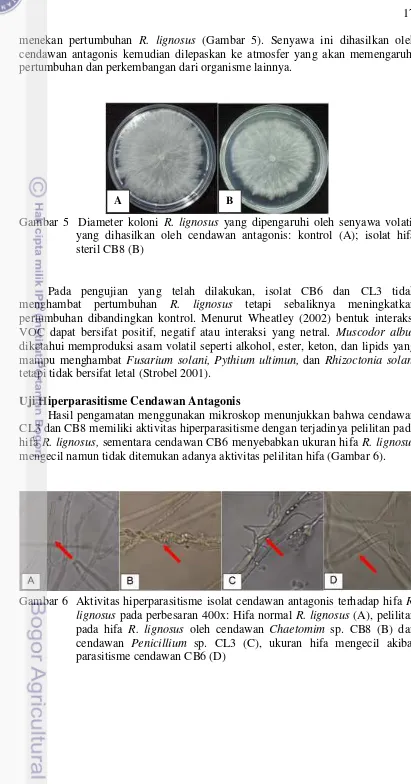
Selain bersifat antibiosis cendawan antagonis yang diisolasi juga dapat menghasilkan volatile organic compound (VOC). VOC merupakan molekul rendah karbon yang dapat menguap dengan mudah pada suhu dan tekanan normal. Senyawa volatil yang dihasilkan oleh cendawan antagonis hifa steril CB8 mampu
17 menekan pertumbuhan R. lignosus (Gambar 5). Senyawa ini dihasilkan oleh cendawan antagonis kemudian dilepaskan ke atmosfer yang akan memengaruhi pertumbuhan dan perkembangan dari organisme lainnya.
Gambar 5 Diameter koloni R. lignosus yang dipengaruhi oleh senyawa volatil yang dihasilkan oleh cendawan antagonis: kontrol (A); isolat hifa steril CB8 (B)
Pada pengujian yang telah dilakukan, isolat CB6 dan CL3 tidak menghambat pertumbuhan R. lignosus tetapi sebaliknya meningkatkan pertumbuhan dibandingkan kontrol. Menurut Wheatley (2002) bentuk interaksi VOC dapat bersifat positif, negatif atau interaksi yang netral. Muscodor albus diketahui memproduksi asam volatil seperti alkohol, ester, keton, dan lipids yang mampu menghambat Fusarium solani, Pythium ultimun, dan Rhizoctonia solani tetapi tidak bersifat letal (Strobel 2001).
Uji Hiperparasitisme Cendawan Antagonis
Hasil pengamatan menggunakan mikroskop menunjukkan bahwa cendawan CL3 dan CB8 memiliki aktivitas hiperparasitisme dengan terjadinya pelilitan pada hifa R. lignosus, sementara cendawan CB6 menyebabkan ukuran hifa R. lignosus mengecil namun tidak ditemukan adanya aktivitas pelilitan hifa (Gambar 6).
Gambar 6 Aktivitas hiperparasitisme isolat cendawan antagonis terhadap hifa R. lignosus pada perbesaran 400x: Hifa normal R. lignosus (A), pelilitan pada hifa R. lignosus oleh cendawan Chaetomim sp. CB8 (B) dan cendawan Penicillium sp. CL3 (C), ukuran hifa mengecil akibat parasitisme cendawan CB6 (D)
18
Berdasarkan pengamatan, aktivitas hiperparasitisme cendawan antagonis dapat menyebabkan sel-sel patogen menjadi lisis, mengecil, keriput, dan membengkak. Zhan et al. (2014) mengemukakan bahwa aktivitas hiperparasit Cladosporium idahoensis dapat menyebabkan penurunan produksi dan viabilitas uredospora Puccinia striiformis f. sp. tritici. Selain itu interaksi cendawan antagonis Pythium radiosum dan Brotrytis cinerea mengakibatkan hifa P. radiosum masuk ke dalam miselium B. cinerea menyebabkan koagulasi protoplasma, hifa menjadi kosong, dan kerusakan hifa ini dapat menyebabkan percabangan dan produksi struktur sexual (Paul 1999). Menurut Amaria et al. (2015) akitifitas parasitisme T. virens dan H. atrovorodis ditandai dengan terjadinya pelilitan hifa cendawan antagonis pada cendawan patogen.
Karakterisasi Bakteri Antagonis
Pengujian karakterisasi bakteri antagonis menunjukkan bahwa isolat MR3 mampu memfiksasi nitrogen. Hasil pengujian tersebut juga menunjukkan isolat ME8 termasuk dalam kelompok bakteri penambat fosfat dan memfiksasi nitrogen (Tabel 4).
Tabel 4 Karakter fisiologis bakteri antagonis Karakter fisiologis Kode isolat mikrob antagonis
a
MR3 ME8
Pelarut fosfat - +
Penambat nitrogen + +
a
Isolat bakteri dengan kode positif (+) menunjukkan bahwa bakteri tersebut positif pada uji-uji fisiologis, isolat bakteri dengan kode negatif (-) menunjukkan bahwa bakteri tersebut negatif pada uji-uji fisiologis
Kemampuan bakteri antagonis dalam menambat fosfat dapat dilihat dengan terbentuknya zona bening di sekitar koloni bakteri antagonis (Gambar 7). Bakteri antagonis juga memiliki kemampuan dalam fiksasi nitrogen yang ditandai dengan pembentukan pelikel pada media kultur (Gambar 8).
Gambar 7 Kemampuan bakteri antagonis dalam menambat fosfat pada kontrol (A) dan isolat bakteri ME8 (B)
19 Bakteri antagonis sebagai pemacu pertumbuhan karena dapat menghasilkan hormon pertumbuhan seperti indole acetic acid, sitokinin, dan giberalin, mampu menambat fosfat, memfiksasi nitrogen maupun bersifat siderofor. Bakteri endofit ME8 selain memiliki antibiosis yang tinggi juga memiliki kemampuan dalam menambat fosfat. Fosfat merupakan unsur esensial dalam perkembangan tanaman dalam proses fotosintesis, glikolisis, fiksasi nitrogen, pembungaan, dan produksi biji (Mehrvarz et al. 2008). Zona bening yang terbentuk di sekitar koloni bakteri menunjukkan bahwa bakteri tersebut mampu melarutkan unsur fosfat dari senyawa Ca3(PO4)2 (Widawati dan Suliasih 2006). Menurut Rahayu et al. (2014) aktivitas pelarutan fosfat berkorelasi dengan produksi enzim fosfomonoesterase (PME-ase).
Gambar 8 Kemampuan bakteri antagonis dalam memfiksasi nitrogen pada kontrol (A); isolat bakteri MR3 (B); dan isolat bakteri ME8 (C)
Kemampuan bakteri antagonis dalam memfiksasi nitrogen ditunjukan dengan terbentuknya pelikel pada medium. Unsur nitrogen diperlukan oleh tanaman untuk membentuk asam amino dan protein. Nitrogen yang tersedia di alam merupakan nitrogen dalam bentuk organik sedangkan tanaman mampu menyerap nitrogen dalam bentuk anorganik (NO3- dan NH4+). Asimilasi amonia oleh bakteri fiksasi nitrogen dipengaruhi oleh enzim glutamate dehydrogenase (Nagatani et al. 1997).
Bakteri antagonis dapat berperan sebagai agens biokontrol dalam menekan perkembangan penyakit dan sebagai agens pemacu pertumbuhan. Isolat bakteri MR3 dan ME8 merupakan isolat bakteri antagonis yang potensial sebagai agens biokontrol terhadap R. lignosus pada pengujian in vitro maupun in vivo. Selain itu potensi lain yang dimiliki oleh bakteri antagonis adalah dalam menambat fosfat dan memfiksasi nitrogen. Kemampuan bakteri antagonis dalam menyediakan unsur hara bagi tanaman dapat memacu pertumbuhan tanaman dan meningkatkan vigor tanaman.
20
Identifikasi Mikrob Antagonis
Identifikasi Cendawan Antagonis
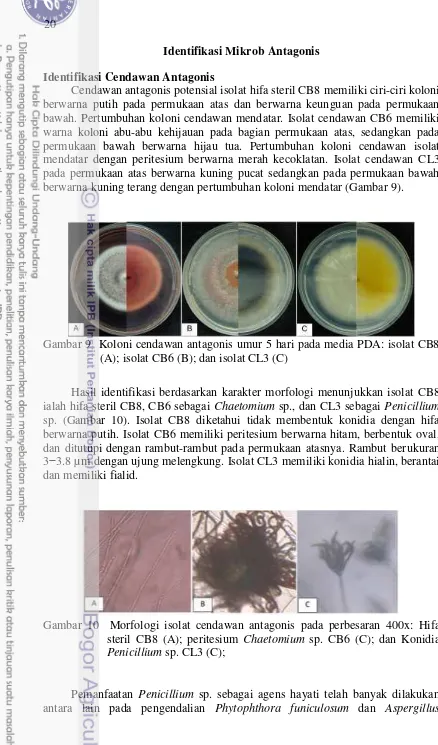
Cendawan antagonis potensial isolat hifa steril CB8 memiliki ciri-ciri koloni berwarna putih pada permukaan atas dan berwarna keunguan pada permukaan bawah. Pertumbuhan koloni cendawan mendatar. Isolat cendawan CB6 memiliki warna koloni abu-abu kehijauan pada bagian permukaan atas, sedangkan pada permukaan bawah berwarna hijau tua. Pertumbuhan koloni cendawan isolat mendatar dengan peritesium berwarna merah kecoklatan. Isolat cendawan CL3 pada permukaan atas berwarna kuning pucat sedangkan pada permukaan bawah berwarna kuning terang dengan pertumbuhan koloni mendatar (Gambar 9).
Gambar 9 Koloni cendawan antagonis umur 5 hari pada media PDA: isolat CB8 (A); isolat CB6 (B); dan isolat CL3 (C)
Hasil identifikasi berdasarkan karakter morfologi menunjukkan isolat CB8 ialah hifa steril CB8, CB6 sebagai Chaetomium sp., dan CL3 sebagai Penicillium sp. (Gambar 10). Isolat CB8 diketahui tidak membentuk konidia dengan hifa berwarna putih. Isolat CB6 memiliki peritesium berwarna hitam, berbentuk oval, dan ditutupi dengan rambut-rambut pada permukaan atasnya. Rambut berukuran 3−3.8 µm dengan ujung melengkung. Isolat CL3 memiliki konidia hialin, berantai, dan memiliki fialid.
Gambar 10 Morfologi isolat cendawan antagonis pada perbesaran 400x: Hifa steril CB8 (A); peritesium Chaetomium sp. CB6 (C); dan Konidia Penicillium sp. CL3(C);
21 carbonarius (Fang dan Tsao 1995; Ahmed et al. 2015). Pemanfaatan cendawan antagonis Chaetomium sp. dalam pengendalian penyakit juga telah dilaporkan, terutama pada penyakit akar putih. Beberapa spesies Chaetomium juga telah dimanfaatkan menjadi produk fungisida dalam mengendalikan R. lignosus (Soytong et al. 2001).
Identifikasi Bakteri Antagonis
Berdasarkan pengamatan morfologi isolat bakteri MR3 memiliki warna koloni putih dengan tepian koloni bergelombang, elevasi permukaan datar, dan memiliki tekstur koloni yang halus. Isolat bakteri ME8 memiliki koloni berwarna putih kekuningan dengan tepian permukaan rata, elevasi permukaan cembung, dan tekstur koloni yang licin (Gambar 11).
Gambar 11 Koloni bakteri rizosfer MR3 (A) dan bakteri endofit ME8 (B)
Hasil identifikasi bakteri antagonis berdasarkan perunutan sebagian gen 16S rRNA diperoleh hasil bahwa bakteri rizosfer MR3 memiliki ukuran basa 1487 pasang basa dan bakteri endofit ME8 memiliki ukuran basa 699 pasang basa. Hasil pencarian BLAST menunjukkan bahwa bakteri MR3 memiliki hubungan kekerabatan yang dekat dengan Bacillus amyloliquefaciens dengan homologi sebesar 98% sedangkan isolat bakteri endofit ME3 memiliki kekerabatan yang dekat dengan bakteri B. siamensis dengan homologi sebesar 95% (Tabel 5).
Tabel 5 Identifikasi bakteri antagonis berdasarkan perunutan sebagian gen 16S rRNA
Isolat NCBIa Nomor aksesi genbank Hb (%)
MR3 B. amyloliquefaciens KY271752 98
ME8 B. siamensis KY129717 95
Ket: a= National Center for Biotechnology Information b= Homologi:1-100%
22
kekerabatan bakteri isolat ME8 dengan spesies lain belum diketahui secara spesifik.
Gambar 12 Klasifikasi filogenetik bakteri antagonis berdasarkan perunutan sebagian gen 16S rRNA. BA_CHN_KY271752 merupakan isolat B. amyloliquefaciens asal Cina dengan No. Aksesi Genbank KY271752; MR3_IDN merupakan isolat bakteri rizosfer; BS_CHN_KY129717 merupakan isolat B. siamensis asal Cina dengan No. Aksesi Genbank KY129717; BSP_DE_KU644287 merupakan isolat bakteri B. subtillis asal Jerman dengan No. Aksesi Genbank KU644287; dan ME8_IDN merupakan isolat bakteri endofit.
23
5 SIMPULAN DAN SARAN
Simpulan
Mikrob dari rizosfer dan jaringan akar tanaman karet yang memiliki potensi sebagai agens hayati untuk mengendalikan R. lignosus penyebab penyakit akar putih dari kelompok bakteri yaitu B. amyloliquefaciens (isolat MR3) dan B. siamensis (isolat ME8), sedangkan dari kelompok cendawan yaitu cendawan hifa steril (isolat CB8), Chaetomium sp. (CB6), dan Penicillium sp. (isolat CL3), masing-masing dengan daya hambat terhadap R. lignosus yaitu 62.5%, 70%, 65.3%, 57.8%, dan 57.3%.
Saran
24
DAFTAR PUSTAKA
Ahmed H, Strub C, Hilaire F, Schorr-Galindo S. 2015. First report: Penicillium adametzioide, a potential biocontrol agent for ochratoxin-producing fungus in grapes, resulting from natural product pre-harvest treatment. Food Cont. 51:23-30. doi:10.1016/j.foodcont.2014.10.034.
Amaria W, Harni R, Samsudin. 2015. Evaluation of antagonistic fungi in inhibiting the growth of Rigidoporus microporus causing white root disease in rubber plants. JTIDP. 29(1):51-60.
Amaria W, Taufiq E, Harni R. 2013. Seleksi dan identifikasi jamur antagonis sebagai agens hayati jamur akar putih (Rigidoporus lignosus) pada tanaman karet. Buletin RISTRI. 4(1):1-8.
Ambawade MS, Pathade GR. 2013. Production of Gibberellic acid by Bacillus siamensis BE76 isolated from banana plant (Musa spp). IJSR. 4(7):394-398. Baker KP, Cook RJ. 1974. Biological Control of Plant Pathogens. San Fransisco
(US): WH Freeman & Company.
Barnet HL, Hunter BB. 2006. Illustrated Genera of Imperfect Fungi. Ed ke-4. Amerika (US): APS Press.
[BPS] Badan Pusat Statistik. 2015. Produksi tanaman perkebunan [Internet]. [diunduh 2015 Apr 28] tersedia pada www.bps.go.id.
Chang CH, Yang SS. 2009. Thermo-tolerant phosphat-solubilizing microbes for multi-functional biofertilizer preparation. Bioresour Tech. 100:1648-1658. doi: 10.1016/j.biortech.2008.09.009.
Compant S, Duffy B, Nowak J, Clement C, Barkal EA. 2005. Use of plant growth-promoting bacteria for biocontrol of plant disease: principle, mechanisms of action, and future prospects. Appl Environ Microbiol. 71:4951-4959.
Dede APO, Akpaja EO, Galille JE. 2011. Effect of pH on the growth of the white root rot pathogen, Rigidoporus lignosus (Klotzsch) Imazeki, on selested para rubber susteaining soils in Nigeria. African Sci. 12(3):175-179.
Egamberdieva D. 2008. Plant growth promoting properties of rhizobacteria isolated from wheat and pea grown in loamy sand soil. Turk J Biol. 32:9-15. Evueh AG, Okhuoya JA, Attitalla IH, Ogbebor ON. 2011. Evaluation of
phylloplane fungi as biocontrol agent of Corynespora leaf fall disease of rubber (Hevea brasiliensis Muell. Arg.). World J Fungal Plant Bio. 2(1):1-5.
Fang JG, Tsao PH.1995. Efficacy of Penicillium funiculosum as a biocontrol agent against Phytophthora root rots of Azalea and Citrus. Bio Cont. 85(8):871-878.
Gazis R, Chaverri P. 2010. Diversity of fungal endophytes in leaves and stems of wild rubber trees (Hevea brasiliensis) in Peru. Fungal Ecology. 3:240-254. doi:10.1026/j.funeco.2009.12.001.
Geiger JP, Huguenin B, Nicole M, Nandris D. 1986. Laccases of Rigidoporus lignosus and Phellinus noxius. App Biochem Biotech. 13:97-110.
25 Hashim H, Abdullah NE, Sulaiman S, Ismail M. 2014. Classification of Hevea Brasiliensis leaf diseases through imaging technique and neural network. J. Appl Sci Agric. 9(11): 358-365.
Hidayati E, Wahyudi AT, Suwanto A, Widyastuti R. 2014. Abundance of culturable bacteria isolated from maize rhizosphere using four different culture media.
Microbiol Indones. 8(1):33-40.
Hongrittipun P, Youpensuk S, Rerkansem B. 2014. Screening of nitrogen fixing endophytic bacteria in Oryza sativa L. J Agr Sci. 6(6):66-74 doi:10.5539/jas/v6n6p66.
Hood AI. 2006. The Mycology of the Basidiomycetes. Di dalam: Potter K, Rimbawanto A, Beadle C, editor. Heart Rot and Root Rot in Tropical Acacia Plantation [internet]. [2017 Feb 7-9] Yogyakarta (ID):ACIAR. hlm 46-49;
Jayasuriya KE, Thenaakoon BI. 2007. Biological control of Rigidoporus lignosus the cause of white root disease in rubber. J Bio Sci. 36(1):9-16.
Karakaya A, Martinson CA. 1995. The effect of some rizosfere bacteria on development of maize. Tarla Bukilen Merkez Arasturma Enstitusii Dergisi. 4(1):7-10.
Kwaechai S, Lin FC, Wang HK, Soytong K. 2010. Characterization of Rigidoporus lignosus isolated from rubber trees based on morphology and ITS sequencing. J Agric Tech. 6(2):289-298.
[KEMENTAN] Kementerian Pertanian. 2015. Outlook Karet Komoditas Pertanian Subsektor Perkebunan. Jakarta (ID): Pusat Data dan Sistem Informasi Pertanian.
Kobayashi DY, Palumbo JD. 2000. Bacterial Endophytes and Their Effects on Plants and uses in Agriculture. Dalam: Bacon CW, White JF, editor. Microbial Endophytes. New York [US]: Marcel Dekker Inc. Hlm. 199-233.
Lieberei R. 2007. South american leaf blight of the rubber tree (Hevea spp.): new steps in plant domestication using physiological features and molecular markers. Annals of Botany. 100:1125-1142 doi:10.1093/aob/mcm133.
Lim TK, Hamm RT, Mohamad RB. 1990. Persistency and volatile behaviour of selected chemicals in treated soil against three basidiomycetous root disease pathogens. Trop. Pest. Manag. 36(1):23-26 doi:10.1080/09670879009371430. Lindow SE, Leveau JH. 2002. Phylosphere microbiology. JCurr Opin Biotechnol.
13:238–243. doi:10.1016/S0958-1669(02)00313-0.
Lindow SE, Brandi MT. 2003. Microbiology of the phyllosphere. Appl Environ Microbiol. 69:1875–1883. doi:10.1128/AEM.69.4.1875-1883.2003.
26
Mehrvarz S, Chaichi MR, Alikhani HA. 2008. Effects of phosphate solubilizing microorganisms and phos-phorus chemical fertilizer on yield components of Barley (Hordeum vulgare L.) Am-Euras. J Agric Environ Sci. 32:822-828. Mu’minah, Baharuddin, Subair H, Fahrudin. 2015. Isolation and screening
bacterial exopolysaccharide (EPS) from potato rhizosphere in highland and the potential as a producer Indole Acetic Acid (IAA). Procedia Food Sci. 3:74-81. Muharni, Widjajanti H. 2011. Skrining bakteri kitinolitik antagonis terhadap
pertumbuhan jamur akar putih (Rigidoporus lignosus) dari rizosfir tanaman karet. J Penel Sains. 14: 14112-14151.
Munif A, Hallmann J, Sikora RA. 2012. Isolation of endophytic bacteria from tomato and their biocontrol activities against fungal disease. Microbiol Indones. 6(3):148-156. doi:10.5454/mi.6.4.2.
Munif A, Wiyono S, Suwarno. 2012. Isolasi bakteri endofit asal padi gogo dan potensinya sebagai agens biokontrol dan pemacu pertumbuhan. J Fitopatol Indones. 8(3): 57-64.
Nagatani H, Shimizu M, Valentine RC. 1971. The mechanism of amonia assimilation in Nitrogen fixing bacteria. Arch Mikrobiol. 79: 164-175.
Ngobisa AICN, Abidin MAZ, Wong MY, Noordin MWDW. 2013. Neofusicoccum ribis associated with leaf blight on rubber (Hevea brasiliensis) in Peninsular Malaysia. J Plant Pathol. 29(1): 10-16 doi: 10.5423/PPJ.OA.07.2012.0110.
Nicoletti R. De Stefano M, De Stefano S, Trincone A, Marziano F. 2004. Antagonism against Rhizoctonia solani and fungitoxic metabolite production by some Penicillium isolates. Mycopathol. 158:465-474.
Noran AS, Maiden NA, Fauzi MAFA. 2015. Rhizospheric microorganisms from Hevea brasiliensis and their antagonism on Rigidiporus miroporus. IJ Agric Forest Plan. 1:59-65.
Ogbebor NO, Adekunle AT, Eghafona ON, Agboghodo AI. 2015. Incidence of Rigidoporus lignosus (Klotzsch) Imaz on para rubber in Nigeria. Res. 5(12):181-184.
Oku S, Komatsu A, Tajima T, Nakashimada Y, Kato J. 2012. Identification of chemotaxis sensory proteins for amino acids in Pseudomonas fluorescens Pf0-1 and their involvement in chemotaxis to tomato root exudate and root colonization. Microbes Environ. 27(4): 462-469 doi:10.1264/jsme2.MEI12005. Omo-Ikerodah EE, Omorusi VI, Mokwunye MUB. 2012. Challenges and progress
in the control of white root rot disease of Hevea brasiliensis in Africa. World Rural Observations. 4(1):1-2.
Omorusi VI. 2012. Effects of white root rot disease on Havea brasiliensis (Muell. Arg)- Challenges and control approach. Di dalam: Dhal NK, Sahu SC, editor. Plant Science. Croatia (HR): hlm: 139-152 doi:10.5772/54024.
Paul B. 1999. Suppression of Botrytis cinera causing the grey mould disease of grape-vine by an sggressive mycoparasite, Phytium radiosum. FEMS Microbiol. 176:25-30.