UJI EFEKTIVITAS TRICHODERMIN DAN FUNGISIDA TRIADIMEFON DALAM MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH
Rigidoporus lignosus Klotzsch PADA TANAMAN KARET DI LABORATORIUM
SKRIPSI
OLEH :
JUNITA HOTNALIANI SILANGIT 100301007
AGROEKOTEKNOLOGI- HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UJI EFEKTIVITAS TRICHODERMIN DAN FUNGISIDA TRIADIMEFON DALAM MENGHAMBAT PERTUMBUHAN JAMUR AKAR PUTIH
Rigidoporus lignosus Klotzsch PADA TANAMAN KARET DI LABORATORIUM
SKRIPSI
OLEH :
JUNITA HOTNALIANI SILANGIT 100301007
AGROEKOTEKNOLOGI- HPT
Skripsi Merupakan Salah Satu Syarat Untuk Dapat Meraih Gelar Sarjana Di Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Uji Efektivitas Trichodermin dan Fungisida Triadimefon dalam Menghambat Pertumbuhan Jamur Akar Putih Rigidoporus
lignosus
Klotzsch Pada Tanaman Karet di Laboratorium Nama : Junita Hotnaliani Silangit
NIM : 100301007 Program Studi : Agroekoteknologi
Jurusan : Hama dan Penyakit Tumbuhan
Disetujui Oleh : Komisi Pembimbing
(Dr. Ir. Hasanuddin, MS) (Ir. Suzanna Fitriany Sitepu, M.Si) Ketua Anggota
Mengetahui
ABSTRAK
JUNITA HOTNALIANI SILANGIT: Uji Efektivitas Trichodermin dan Fungisida Triadimefon dalam Menghambat Pertumbuhan Rigidoporus lignosus
Klotzsch Penyebab Penyakit Jamur Akar Putih Pada Tanaman Karet di Laboratorium, dibimbing oleh HASANUDDIN dan SUZANNA FITRIANY
SITEPU.
Penggunaan toksin trichodermin untuk menghambat pertumbuhan Rigidoporus lignosus penyebab penyakit Jamur Akar Putih (JAP) pada tanaman
karet belum banyak diteliti. Untuk itu suatu penelitian telah dilakukan di laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara (±25 m dpl) mulai Desember 2014 sampai Pebruari 2015 menggunakan rancangan acak lengkap (RAL) non faktorial dengan 5 perlakuan dan empat ulangan, cawan petri diisi 1 ml trichodermin dan larutan fungisida sesuai perlakuan + 9 ml media PDA, teknik one point, pada suhu kamar. Parameter yang diamati adalah luas pertumbuhan koloni jamur, persentase percepatan tumbuh, persentase penghambatan dan perbandingan percepatan tumbuh.
Hasil penelitian menunjukkan bahwa trichodermin berpengaruh sangat nyata terhadap semua parameter yang diamati. Luas pertumbuhan koloni tertinggi
terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sebesar 50,18 cm2 sedangkan luas pertumbuhan koloni terendah terdapat pada
trichodermin 10-1 sebesar 11,39 cm2. Persentase percepatan tumbuh tertinggi terdapat pada trichodermin 10-3 yaitu sebesar 84,15 % sedangkan persentase
percepatan tumbuh terendah terdapat pada trichodermin 10-1 yaitu sebesar 53,75 %. Persentase penghambatan tertinggi terdapat pada Trichodermin 10-1
yaitu sebesar 46,25 % sedangkan persentase penghambatan terendah terdapat pada trichodermin 10-3 yaitu sebesar 15,85 %. Perbandingan percepatan tumbuh tertinggi terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sebesar 1 cm sedangkan perbandingan percepatan tumbuh terendah terdapat pada trichodermin 10-1) sebesar 0,40 cm.
ABSTRACT
JUNITA HOTNALIANI SILANGIT: Efectivity Test of Trichodermin and Triadimefon Fungicide to inhibit Rigidoporus lignosus Klotzsch growth causal white root fungus disease of Rubber Plant in Laboratory, supervised by HASANUDDIN and SUZANNA FITRIANY SITEPU.
The use of trichodermin to inhibit Rigidoporus lignosus growth causal white root fungus disease of Rubber Plant have not been researched. Therefore, a research had been conducted at Plant Pathology Laboratory, Faculty of Agriculture, University of Sumatera Utara (± 25 m asl) from December 2014 until February 2015 using non- factorial completely randomized design with five treatments and four replications, petridish contained 1 ml trichodermin and fungicide + 9 ml PDA medium, used one point technic, incubated at room temperature. Parameters measured were fungal colony extensive, percentage of acceleration grow, percentage of inhibition and comparison of accelaration grow.
The result showed that trichodermin gave highly significantly effect for all parameters observed. Highest fungal colony extensive was on control (without toxin and without fungicide) which reached 50,18 cm2 meanwhile the lowest fungal colony extensive was on trichodermin 10-1 which reached 11,39 cm2. Highest percentage of acceleration grow was on trichodermin 10-3 which reached 84,15 % meanwhile the lowest percentage of acceleration grow was on trichodermin 10-1 which reached 53,75 %. Highest percentage of inhibition was on trichodermin 10-1 which reached 46,25 % meanwhile the lowest percentage of inhibition was on trichodermin 10-3 which reached 15,85 %. Highest comparison of accelaration grow was on control (without toxin and without fungicide) which reached 1cm meanwhile the lowest comparison of accelaration grow was on trichodermin 10-1 which reached 0,40 cm.
RIWAYAT HIDUP
Junita Hotnaliani Silangit lahir pada tanggal 15 Juni 1992 di Petumbukan. Merupakan anak pertama dari empat bersaudara dari pasangan
Jonniaman Silangit dan Lamria Tambunan.
Tahun 2010 penulis lulus dari SMA Negeri I Bangun Purba dan pada tahun yang
sama masuk ke Fakultas Pertanian Universitas Sumatera Utara melalui jalur Pemanduan
Minat dan Prestasi (PMP). Penulis memilih minat Hama dan Penyakit Tanaman,
Departemen Agroekoteknologi.
Selama mengikuti perkuliahan, penulis aktif sebagai anggota HIMAGROTEK
(Himpunan Mahasiswa Agroekoteknologi), anggota IMAPTAN (Ikatan Mahasiswa
Perlindungan Tanaman), anggota IMKA (Ikatan Mahasiswa Karo) tahun 2010- 2012,
sebagai asisten Laboratorium Dasar Perlindungan Tanaman sub- Hama pada 2014-2015,
asisten Laboratorium Entomologi pada tahun 2014, dan asisten Laboratorium
Pengendalian Hayati pada tahun 2014. Selain itu penulis mengikuti seminar “Optimalisasi
Sistem Pertanian untuk Menekan Dampak Perubahan Iklim Guna Terwujudnya Pertanian
Berkelanjutan” di Fakultas Pertanian Universitas Sumatera Utara
pada Mei 2012, dan mengikuti seminar “Implementasi Bioteknologi Perlindungan
Tanaman dalam Menunjang Ketahanan Pangan” di Fakultas Pertanian Universitas
Padjajaran Bandung pada November 2013.
Penulis melaksanakan Praktek Kerja Lapangan (PKL) di PTPN IV Kebun Air
Batu pada Juli sampai Agustus 2013.
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa, karena kasih karunia-Nya penulis dapat menyelesaikan skripsi ini tepat pada
waktunya.
Skripsi ini berjudul “Uji Efektivitas Trichodermin dan Fungisida
Triadimefon Dalam Menghambat Pertumbuhan Jamur Akar Putih Rigidoporus lignosus Klotzsch Pada Tanaman Karet di Laboratorium” merupakan salah satu syarat untuk dapat meraih gelar Sarjana di Program Studi
Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis menyampaikan ucapan terimakasih
kepada Komisi Pembimbing Dr. Ir. Hasanuddin, MS sebagai Ketua dan Ir. Suzanna Fitriany Sitepu, M.Si sebagai Anggota yang telah membimbing
penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun
demi kesempurnaan skripsi ini.
Akhir kata penulis ucapkan terimakasih dan semoga skripsi ini dapat berguna bagi kita semua.
Medan, September 2015
Penulis
DAFTAR TABEL
No Judul Hal
1. Luas pertumbuhan koloni jamur (cm2) 21
DAFTAR GAMBAR
No Judul Hal
5. R. lignosus Klotzsch ... 5
6. Gejala serangan R. lignosus ... 6
7. Trichoderma sp. ... 11
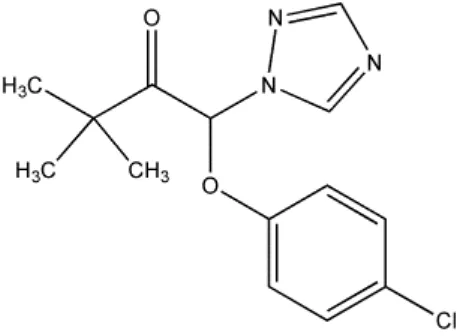
8. Rumus molekul Triadimefon ... 14
9. Grafik rata-rata luas pertumbuhan koloni R. lignosus pada 1 -10hsi ... 21
DAFTAR LAMPIRAN
No Judul Hal
11. Bagan Penelitian ... 33
12. Luas pertumbuhan koloni jamur data pengamatan 1 hsi ... 34
13. Luas pertumbuhan koloni jamur data pengamatan 2 hsi ... 35
14. Luas pertumbuhan koloni jamur data pengamatan 3 hsi ... 36
15. Luas pertumbuhan koloni jamur data pengamatan 4 hsi ... 37
16. Luas pertumbuhan koloni jamur data pengamatan 5 hsi ... 38
17. Luas pertumbuhan koloni jamur data pengamatan 6 hsi ... 39
18. Luas pertumbuhan koloni jamur data pengamatan 7 hsi ... 40
19. Luas pertumbuhan koloni jamur data pengamatan 8 hsi ... 41
20. Luas pertumbuhan koloni jamur data pengamatan 9 hsi ... 42
21. Luas pertumbuhan koloni jamur data pengamatan 10 hsi ... 43
22. Persentase percepatan tumbuh data pengamatan 2 hsi ... 44
23. Persentase percepatan tumbuh data pengamatan 3 hsi ... 45
24. Persentase percepatan tumbuh data pengamatan 4 hsi ... 46
25. Persentase percepatan tumbuh data pengamatan 5 hsi ... 47
26. Persentase percepatan tumbuh data pengamatan 6 hsi ... 48
27. Persentase percepatan tumbuh data pengamatan 7 hsi ... 49
28. Persentase percepatan tumbuh data pengamatan 8 hsi ... 50
29. Persentase percepatan tumbuh data pengamatan 9 hsi ... 51
30. Persentase percepatan tumbuh data pengamatan 10 hsi ... 52
31. Persentase penghambatan data pengamatan 2 hsi ... 53
32. Persentase penghambatan data pengamatan 3 hsi ... 54
33. Persentase penghambatan data pengamatan 4 hsi ... 55
34. Persentase penghambatan data pengamatan 5 hsi ... 56
35. Persentase penghambatan data pengamatan 6 hsi ... 57
36. Persentase penghambatan data pengamatan 7 hsi ... 58
37. Persentase penghambatan data pengamatan 8 hsi ... 59
38. Persentase penghambatan data pengamatan 9 hsi ... 60
39. Persentase penghambatan data pengamatan 10 hsi ... 61
40. Perbandingan percepatan tumbuh ... 62
DAFTAR ISI
Hal.
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
DAFTAR ISI ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 4
Hipotesis Penelitian ... 4
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA Penyakit Jamur Akar Putih (Rigidoporus lignosus Klotzsch) ... 5
Biologi Penyakit ... 5
Gejala Serangan ... 6
Faktor Yang Mempengaruhi Perkembangan Penyakit ... 7
Pengendalian ... 8
Trichoderma sp. ... 9
Biologi Trichoderma sp. ... 9
Mekanisme Antagonis Trichoderma sp. ... 11
Trichodermin ... 12
Triadimefon ... 13
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 15
Bahan dan Alat ... 15
Metode Penelitian ... 15
Pelaksanaan Penelitian ... 17
Pembuatan PDA ... 17
Isolasi R. lignosus ... 17
Isolasi Trichoderma sp. ... 18
Ekstraksi Pigmen Trichodermin ... 18
Perbanyakan Isolat Trichoderma sp.. ... 18
Pigmen Trichoderma ... 18
Uji Aktivitas Fungistatik Trichodermin dan Triadimefon Terhadap R. lignosus secara In vitro ... 18
Peubah Amatan ... 19
Luas Koloni Jamur ... 19
Persentase Percepatan Tumbuh Jamur ... 19
Persentase Pengahambatan ... 19
Perbandingan Percepatan Tumbuh ... 19
HASIL DAN PEMBAHASAN Luas Pertumbuhan Koloni R. lignosus ... 20
Persentase Percepatan Tumbuh ... 23
Persentase Penghambatan ... 24
Perbandingan Percepatan Tumbuh ... 27
KESIMPULAN DAN SARAN Kesimpulan ... 29
Saran ... 29
DAFTAR PUSTAKA LAMPIRAN
ABSTRAK
JUNITA HOTNALIANI SILANGIT: Uji Efektivitas Trichodermin dan Fungisida Triadimefon dalam Menghambat Pertumbuhan Rigidoporus lignosus
Klotzsch Penyebab Penyakit Jamur Akar Putih Pada Tanaman Karet di Laboratorium, dibimbing oleh HASANUDDIN dan SUZANNA FITRIANY
SITEPU.
Penggunaan toksin trichodermin untuk menghambat pertumbuhan Rigidoporus lignosus penyebab penyakit Jamur Akar Putih (JAP) pada tanaman
karet belum banyak diteliti. Untuk itu suatu penelitian telah dilakukan di laboratorium Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara (±25 m dpl) mulai Desember 2014 sampai Pebruari 2015 menggunakan rancangan acak lengkap (RAL) non faktorial dengan 5 perlakuan dan empat ulangan, cawan petri diisi 1 ml trichodermin dan larutan fungisida sesuai perlakuan + 9 ml media PDA, teknik one point, pada suhu kamar. Parameter yang diamati adalah luas pertumbuhan koloni jamur, persentase percepatan tumbuh, persentase penghambatan dan perbandingan percepatan tumbuh.
Hasil penelitian menunjukkan bahwa trichodermin berpengaruh sangat nyata terhadap semua parameter yang diamati. Luas pertumbuhan koloni tertinggi
terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sebesar 50,18 cm2 sedangkan luas pertumbuhan koloni terendah terdapat pada
trichodermin 10-1 sebesar 11,39 cm2. Persentase percepatan tumbuh tertinggi terdapat pada trichodermin 10-3 yaitu sebesar 84,15 % sedangkan persentase
percepatan tumbuh terendah terdapat pada trichodermin 10-1 yaitu sebesar 53,75 %. Persentase penghambatan tertinggi terdapat pada Trichodermin 10-1
yaitu sebesar 46,25 % sedangkan persentase penghambatan terendah terdapat pada trichodermin 10-3 yaitu sebesar 15,85 %. Perbandingan percepatan tumbuh tertinggi terdapat pada kontrol (tanpa toksin dan tanpa fungisida) sebesar 1 cm sedangkan perbandingan percepatan tumbuh terendah terdapat pada trichodermin 10-1) sebesar 0,40 cm.
ABSTRACT
JUNITA HOTNALIANI SILANGIT: Efectivity Test of Trichodermin and Triadimefon Fungicide to inhibit Rigidoporus lignosus Klotzsch growth causal white root fungus disease of Rubber Plant in Laboratory, supervised by HASANUDDIN and SUZANNA FITRIANY SITEPU.
The use of trichodermin to inhibit Rigidoporus lignosus growth causal white root fungus disease of Rubber Plant have not been researched. Therefore, a research had been conducted at Plant Pathology Laboratory, Faculty of Agriculture, University of Sumatera Utara (± 25 m asl) from December 2014 until February 2015 using non- factorial completely randomized design with five treatments and four replications, petridish contained 1 ml trichodermin and fungicide + 9 ml PDA medium, used one point technic, incubated at room temperature. Parameters measured were fungal colony extensive, percentage of acceleration grow, percentage of inhibition and comparison of accelaration grow.
The result showed that trichodermin gave highly significantly effect for all parameters observed. Highest fungal colony extensive was on control (without toxin and without fungicide) which reached 50,18 cm2 meanwhile the lowest fungal colony extensive was on trichodermin 10-1 which reached 11,39 cm2. Highest percentage of acceleration grow was on trichodermin 10-3 which reached 84,15 % meanwhile the lowest percentage of acceleration grow was on trichodermin 10-1 which reached 53,75 %. Highest percentage of inhibition was on trichodermin 10-1 which reached 46,25 % meanwhile the lowest percentage of inhibition was on trichodermin 10-3 which reached 15,85 %. Highest comparison of accelaration grow was on control (without toxin and without fungicide) which reached 1cm meanwhile the lowest comparison of accelaration grow was on trichodermin 10-1 which reached 0,40 cm.
PENDAHULUAN Latar Belakang
Karet (Hevea brasiliensis) berasal dari benua Amerika dan saat ini menyebar luas ke seluruh dunia. Karet dikenal di Indonesia sejak masa kolonial
Belanda, dan merupakan salah satu komoditas perkebunan yang memberikan sumbangan besar bagi perekonomian Indonesia. Diperkirakan ada lebih dari 3,4 juta hektar perkebunan karet di Indonesia, 85% di antaranya 2,9 juta hektar
merupakan perkebunan karet yang dikelola oleh rakyat atau petani skala kecil, dan
sisanya dikelola oleh perkebunan besar milik negara atau swasta
(Prahmono, 2013).
Indonesia merupakan negara kedua penghasil karet alam di dunia (sekitar 28 persen dari produksi karet dunia di tahun 2010), sedikit di belakang Thailand
(sekitar 30 persen). Pengembangan karet Indonesia dalam kurun waktu 3 dekade mengalami pertumbuhan yang sangat pesat. Dalam kurun waktu lima tahun
terakhir, peningkatan ekspor karet cukup signifikan, dari volume ekspor tahun 2002 sebesar 1.496 ribu ton senilai US$ 1.038 juta meningkat menjadi 2.100 ribu ton pada tahun 2009 (Nasir, 2012).
Dalam upaya meningkatkan pendapatan petani karet dan ekspor non migas, mulai tahun 1980-an pemerintah telah mengembangkan pertanaman karet
dengan pola intensifikasi, rehabilitasi, perluasan areal dan penanaman ulang. Sebagai konsekuensinya, berbagai masalah telah timbul, diantaranya adalah hama dan penyakit. Hama dan penyakit merupakan salah satu faktor pengganggu yang
menimbulkan kerugian pada tanaman karet adalah rayap, jamur akar putih (JAP), jamur upas dan Mouldy-rot (Muklasin dan Matondang, 2010).
Penyakit tanaman karet telah menyebabkan kerugian ekonomi, tidak hanya disebabkan kehilangan produksi akibat kerusakan tanaman tetapi juga mahalnya
biaya yang diperlukan dalam pengendaliannya. Diperkirakan kehilangan produksi setiap tahunnya akibat kerusakan oleh penyakit karet mencapai 5-15%. Penyakit
tanaman karet yang umum ditemukan pada perkebunan diantaranya adalah
JAP. Penyakit JAP disebabkan oleh jamur Rigidoporus lignosus. Serangan JAP telah menyebabkan kerusakan pada akar tanaman (Muharni dan Widjajanti, 2011).
Penyakit JAP disebabkan oleh R. lignosus yang menyerang akar tunggang maupun akar lateral. Penyakit ini dapat mengakibatkan kematian tanaman dengan intensitas yang sangat tinggi terutama pada tanaman karet yang berumur 2-4
tahun. Serangan dapat terjadi mulai pada pembibitan, tanaman belum menghasilkan (TBM) sampai tanaman menghasikan (TM) (Yulfahri et al., 2012).
Pengendalian biologi (hayati) menunjukkan alternatif pengendalian yang dapat dilakukan tanpa harus memberikan pengaruh negatif terhadap lingkungan dan sekitarnya, salah satunya adalah dengan pemanfaatan agens hayati seperti
virus, jamur atau cendawan, dan bakteri. Jamur atau cendawan mempunyai potensi sebagai agens hayati dari jamur patogenik diantaranya adalah
Trichoderma sp. (Ismail dan Tenrirawe, 2010).
Trichoderma sp. adalah suatu jenis jamur yang memiliki kemampuan tumbuh yang sangat cepat dibandingkan jenis lain. Selain itu jamur ini juga
tetapi populasinya sering menurun akibat kondisi lingkungan yang tidak sesuai (Hutagaol dan Melin, 2000).
Jamur Trichoderma sp. dalam menekan pertumbuhan patogen mampu
memproduksi senyawa racun (antibiotik) berupa trichodermin, trichodermol
dan chrysophanol yang dapat menyebabkan lisis pada hifa jamur lain. Keberhasilan penggunaan agen hayati ini telah banyak dilaporkan di berbagai
penelitian diantaranya untuk mengendalikan penyakit akar putih R. microporus
di perkebunan karet dan teh. Mengendalikan patogen penyebab rebah kecambah Rhizoctania solani, busuk batang Fusarium sp., akar gada Plasmodiophora brassicae, dan patogen Pythium yang merupakan patogen tular tanah yang dapat menyebabkan penyakit rebah kecambah (dumping off) pada kacang-kacangan (Wahyudi, 2011).
Berdasarkan uraian di atas, maka perlu dilakukan penelitian tentang uji efektivitas trichodermin dan fungisida triadimefon dalam menghambat
pertumbuhan JAP (R. lignosus) pada tanaman karet di laboratorium.
Tujuan Penelitian
Untuk menguji efektivitas trichodermin dan fungisida triadimefon
dalam menghambat pertumbuhan JAP (R.lignosus) pada tanaman karet di laboratorium.
Hipotesis Penelitian
Kegunaan Penelitian
Penelitian ini berguna sebagai informasi pengendalian JAP (R. lignosus)
TINJAUAN PUSTAKA
Penyakit Jamur Akar Putih (Rigidoporus lignosus Klotzsch) Biologi Penyakit
Menurut Alexopoulus dan Mims (1979) penyakit Jamur Akar Putih (JAP)
R. lignosus dapat diklasifikasikan sebagai berikut: Kingdom : Fungi
Divisio : Basidiomycota
Kelas : Basidiomycetes Ordo : Polyporales
Famili : Polyporaceae Genus : Rigidoporus
Spesies : Rigidoporus lignosus
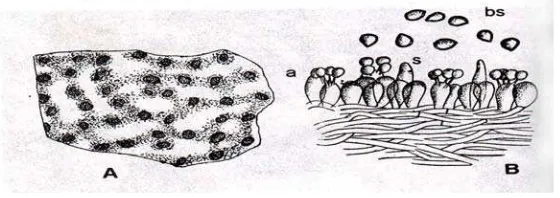
R. lignosus mamiliki basidiospora bulat, tidak berwarna, dengan garis tengah 2,8-5,0 µm, banyak dibentuk pada tubuh buah yang masih muda. Basidium
pendek (buntak), lebih kurang 16 x 4,5-5,0 µm, tidak berwarna, mempunyai empat sterigma (tangkai basidiospora). Diantara basidium-basidium terdapat banyak sistidium yang berbentuk gada, berdinding tipis dan tidak berwarna
(Gambar 1) (Semangun, 2008).
Gejala Serangan
Jamur kadang-kadang membentuk badan buah mirip topi berwarna jingga
kekuning-kuningan pada pangkal akar tanaman (Gambar 2). Pada serangan berat akar tanaman membusuk, sehingga tanaman mudah tumbang dan mati. Penyakit
ini sering dijumpai pada tanaman karet umur 1-5 tahun terutama pada pertanaman yang bersemak, banyak tunggul atau sisa akar tanaman dan pada tanah gembur dan berpasir (Rahayu dan Dina, 2010).
Gambar 2. Tubuh Buah R. lignosus
Sumber:www.google.com
Penyakit JAP dapat menyerang di pembibitan sampai tanaman dewasa.
Serangan menyebabkan akar menjadi busuk dan biasanya pada permukaan akar ditumbuhi miselium jamur menyerupai akar rambut tanaman
berwarna putih kemudian kuning gading. Gejala ini baru terlihat apabila daerah perakaran dibuka. Gejala luar yang nampak pada pohon terserang, daun
sehingga tajuk pohon menipis akhirnya pohon menjadi gundul dan mati (DirPerTan, 2001).
Gejala pada daun terlihat pucat kuning dan tepi atau ujung daun terlipat ke dalam, kemudian daun gugur dan ujung ranting menjadi mati. Ada kalanya
terbentuk daun muda, atau bunga dan buah lebih awal. Pada perakaran tanaman sakit tampak benang-benang jamur berwarna putih dan agak tebal (rizomorf). Penyakit ini dapat mengakibatkan penurunan produksi 20-60% dan menimbulkan
kematian pada tanaman karet, sehingga serangan penyakit ini akan berpengaruh negatif pada produksi kebun (Hutagaol dan Meilin, 2000).
Faktor Yang Mempengaruhi Perkembangan Penyakit
Faktor-faktor yang mendorong perkembangan JAP yaitu tunggul dan sisa-sisa akar yang tertinggal di area kebun merupakan sumber infeksi, iklim
basah dan tanah yang gembur sangat membantu perkembangan JAP. Penyebaran penyakit paling dominan adalah melalui kontak akar yaitu apabila akar sakit
bersinggungan dengan akar sehat tersebut akan segera terinfeksi (BPSP, 2008). Tunggul atau sisa akar tanaman karet dan kayu hutan primer merupakan sumber infeksi jamur akar putih yang paling penting pada pertanaman. Di antara
tunggul ini terdapat beberapa tunggul yang telah terinfeksi jamur akar putih dan menjadi sumber penularan sangat efektif. Dari tunggul ini jamur akar putih
melalui kontak akar menular ke tunggul lain dekatnya dan menjadi sumber infeksi baru. Pada tunggul tersebut jamur membentuk badan buah yang membebaskan
banyak spora ke udara dan mendarat ke permukaan tunggul lain
Setelah patogen menginfeksi tanaman, perkembangan JAP selanjutnya bergantung pada pH, kandungan bahan-bahan organik, kelembaban dan aerase
tanah. R. lignosus dapat tumbuh baik pada kelembaban di atas 90%, kandungan bahan organik tinggi serta aerase yang baik. Apabila kondisi ini sesuai, patogen
dapat menjalar sejauh 30 cm dalam waktu 2 minggu (Sinulingga dan Eddy, 1989).
Pengendalian
Cara pencegahan penyakit jamur akar putih adalah sebagai berikut :
• Satu meter di sekitar tanaman karet harus bersih dari sisa - sisa akar dan
tunggul tanaman lainnya. Sisa akar dan tunggul ini harus dibongkar dan
dibakar supaya tidak menjadi sumber penyakit
• Menanam tanaman penutup tanah minimal satu tahun lebih awal dari
penanaman karet. Tanaman yang dianjurkan adalah jenis kacang- kacangan seperti Calopogonium muconoides atau C. caeruleum, Centrosema pubescens, Pueraria javanica. Jenis tanaman ini dapat membantu aktivitas mikroba untuk mempercepat pembusukan sisa-sisa akar dan tunggul tanaman sehingga dapat menekan perkembangan jamur penyebab penyakit
• Sebelum penanaman, lubang tanam ditaburi biakan jamur Trichoderma
harzianum yang telah dicampur dengan kompos sebanyak 200 gram perlubang tanam (1 kg T. harzianum dicampur dengan 50 kg kompos/ pupuk kandang)
(Yulfahri et al., 2012).
Langkah pengendalian yang dilakukan untuk pencegahan dan pengobatan
JAP pada tanaman karet adalah:
• Lakukan pembongkaran dan pemusnahan tunggul sisa akar tanaman pada saat
• Gunakan bibit karet yang sehat dan bebas dari JAP
• Lakukan perlindungan tanaman di kebun dengan menaburkan belerang (cara
kimiawi) di sekitar perakaran tanaman sebanyak 100–200 g/pohon dengan jarak 10 cm dari batang tanaman atau Trichoderma (cara biologis) dengan
dosis 100 g/pohon yang dilakukan setiap enam bulan
• Lakukan pemeliharaan tanaman secara teratur dan rutin agar pertumbuhan karet sehat dan optimum
• Tidak menanam tanaman yang menjadi inang jamur akar di kebun karet, seperti ubi kayu atau ubi jalar
• Bila tanaman karet telah terserang JAP, maka pengobatan JAP dapat dilakukan dengan menggunakan obat-obatan kimia yang mengandung bahan aktif
triadimefon dengan dosis sesuai anjurannya. Lakukan proses pengobatan ini secara berkala hingga tanaman kembali sehat (Prahmono, 2013).
Trichoderma sp. Biologi Trichoderma sp.
Menurut Alexopoulus dan Mims (1979) Trichoderma sp. diklasifikasikan dalam :
Kingdom : Fungi
Divisio : Deuteromycota
Class : Deuteromycetes Ordo : Moniliales Famili : Moniliaceae
Beberapa spesies Trichoderma telah dilaporkan sebagai agensia hayati seperti T. harzianum, T. viridae, dan T. koningii yang berspektrum luas pada berbagai tanaman pertanian. Suhu optimum untuk tumbuhnya Trichoderma berbeda-beda setiap spesiesnya. Kisarannya sekitar 7– 41°C. Trichoderma yang dikultur dapat bertumbuh cepat pada suhu 25-30°C, namun pada suhu 35°C cendawan ini tidak dapat tumbuh. pH optimum bagi Trichoderma berkisar antara 3-7. Faktor lain yang mempengaruhi pertumbuhan Trichoderma adalah
kelembaban (Wahyudi, 2011).
Trichoderma sp. merupakan jamur saprofitik yang dapat hidup dalam tanah, dan serasah kayu mati. Jamur hidup di berbagai tempat, mudah ditemukan, berkembang dengan cepat dan diantaranya mampu membunuh jamur lain.
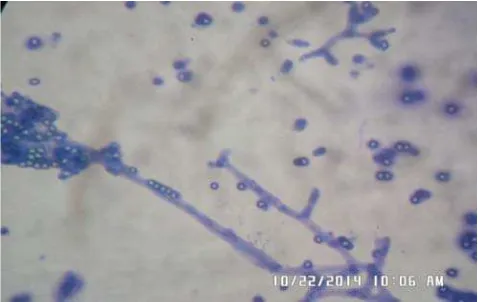
Trichoderma dikenal dengan konidianya yang berwarna hijau dan mengelompok konidiopornya hialin, banyak cabang yang pialid, konidianya bersel satu, bulat telur dan terdapat pada ujung pialid (Basuki dan Aron, 1994).
Ciri- ciri spesifik jamur Trichoderma sp. adalah miselium memiliki septat, konidia bercabang banyak, dan ujung percabangannya merupakan sterigma, membentuk konidia bulat atau oval, bewarna hijau terang, berbentuk bola- bola
berlendir (Gambar 3) (Fardiaz, 1989).
Mekanisme Antagonis Trichoderma sp.
Trichoderma sp. adalah jamur saprofit tanah yang secara alami merupakan parasit yang menyerang banyak jenis jamur penyebab penyakit tanaman (spektrum pengendalian luas). Jamur Trichoderma sp. dapat menjadi hiperparasit
pada beberapa jenis jamur penyebab penyakit tanaman, pertumbuhannya sangat cepat dan tidak menjadi penyakit untuk tanaman tingkat tinggi. Trichoderma sp. yang bersifat spesifik target, mengkoloni rhizosfer dengan cepat dan melindungi
akar dari serangan jamur patogen, mempercepat pertumbuhan tanaman dan meningkatkan hasil produksi tanaman, menjadi keunggulan lain sebagai agens
hayati (Purwantisari dan Hastuti, 2009).
Trichoderma sp. bertindak sebagai mikoparasit bagi cendawan lain dengan tumbuh mengelilingi miselium patogen. Mikoparasitisme dari Trichoderma sp.
merupakan suatu proses yang kompleks dan terdiri dari beberapa tahap dalam menyerang inangnya. Interaksi awal dari Trichoderma sp. yaitu dengan
cara hifanya membelok ke arah cendawan inang yang diserangnya (Alfizar et al., 2013).
Mekanisme antagonis Trichoderma sp. dapat terjadi melalui 3 cara yaitu
persaingan baik ruang maupun nutrisi, antibiosis dengan menghasilkan toksin antara lain Trichodermin dan asam sitrat serta menghasilkan enzim glukanase,
dan kitinase yang dapat menghancurkan hifa patogen dan sebagai mikoparasit
Trichodermin
Trichodermin adalah suatu anggota dari famili metabolit jamur yang
mendapat suatu ikatan kelompok ditandai dengan 12, 13-epoxytrichothecenes. Biasanya sangat beracun untuk hewan dan tumbuhan dan telah dikenal sebagai
agen beracun penting secara medis. Trichodermin merupakan suatu penghambat spesifik sintesa protein. Efek trichodermin pada sintesa protein secara in vitro telah diselidiki dalam suatu rangkaian sistem in vitro didasarkan pada retikulum
kelinci (Wei et al., 1974).
Jamur T. harzianum dalam menekan pertumbuhan patogen mampu memproduksi senyawa racun (antibiotik) berupa trichodermin, trichodermol dan chrysophanol yang dapat menyebabkan lisis pada hifa jamur lain. Trichoderma juga menghasilkan antibiotik yang termasuk kelompok furanon yang dapat
menghambat pertumbuhan spora dan hifa mikroba patogen, diidentifikasikan dengan rumus kimia 3-2-hydoxyprophyl- 4-2-hexadienyl)-2-5(5H)-furanon. Trichoderma sp menghasilkan toksin trichodermin. Toksin tersebut dapat menyerang dan menghancurkan propagul yang berisi spora-spora patogen disekitarnya. Jenis Trichoderma viridae menghasilkan antibiotik gliotoksin dan
viridin yang dapat melindungi bibit tanaman dari serangan penyakit rebah kecambah (Wahyudi, 2011).
terang. Pengamatan dan pengukuran mikroskopik dibuat dari kaca mikroskop. Untuk menghasilkan metabolit, strain diinokulasi pada media PDA dan diinkubasi
selama 10 hari pada suhu 200 C di tempat gelap (Chen et al., 2008). Triadimefon
Triadimefon disediakan dalam bentuk wettable powder, emulsifiable
concentrate, suspensi concentrate yang digunakan pada buah, sayuran, gandum,
kopi , tebu, dan gulma. Triadimefon menghasilkan racun mulut akut di laboratorium hewan, tetapi racun kulitnya rendah. Itulah yang menyebabkan
iritasi jika mata terkontaminasi. Triadimefon diserap melewati kulit (EPA, 2004). Bahan kimia triadimefon memiliki potensi efek toksik kumulatif yang
rendah terhadap tanaman tetapi memiliki efek toksik yang cukup tinggi terhadap manusia sehingga berpengaruh pada kesehatan manusia. Triadimefon termasuk dalam kelompok pestisida yang disebut triazoles (conazoles) dan juga mencakup
fungisida propiconazole. Triadimenol merupakan metabolit dari triadimefon yang bersifat toleran terhadap tanaman (Edwards, 2006).
Fotodegradasi pestisida sistemik ini memiliki kepentingan besar di bidang pertanian, ekonomi dan lingkungan. Triadimefon dan triadimenol adalah dua fungisida sistemik kuat terhadap penyakit embun tepung dan karat jamur.
Triadimenol bersifat metabolit utama pada tanaman dan jamur. Triadimefon dianggap sebagai sebuah molekul bichromophorik yang terdiri dari karbonil non konjugasi dan tergabung dalam kelompok chlorophenoxy. Kelompok
chlorophenoxy mampu mentransfer energi dengan cepat. Triadimenol bersifat stabil pada fotodegradasi langsung secara alamiah. Triadimefon dapat
Fungisida triazole memiliki unsur senyawa 1,2,4 - triazole, alanin triazole, dan asam asetat triazole. Untuk informasi mengenai mekanisme umum dari
toksisitas triazole dan upaya menentukan dosis bahan kimia triazole biasanya dilihat dari kebijakan program pestisida (Edwards, 2006).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Program Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan
dengan ketinggian tempat ±25m dpl pada bulan Desember 2014 sampai dengan Februari 2015.
Bahan dan Alat
Bahan yang digunakan yaitu media PDA, clorox, fungisida triadimefon (Bayleton 250 EC), tanah di sekitar perakaran tanaman karet yang sehat, akar
tanaman karet yang terserang jamur akar putih, alkohol 96%, kertas saring whatman 041, air steril, aluminium foil, kapas, aquades, dan cling wrap.
Alat yang digunakan yaitu laminar air flow (LAF), cawan petri, mikroskop
kampaun, timbangan analitik, cool box, erlenmeyer, cotton bud, tabung reaksi, mikropipet, oven, bunsen, autoklaf, beaker glass, hot plate, lemari es, cork borer,
jarum inokulum, pisau, batang pengaduk, dan alat tulis lainnya.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Lengkap
(RAL) non faktorial yaitu sebagai berikut :
T01 : Kontrol - (tanpa toksin dan fungisida)
T02 : Kontrol + (fungisida triadimefon 250 EC sebanyak 2000 ppm) TX-1 : Trichodermin 10-1
Perlakuan diulang sebanyak 4 kali sehingga diperoleh 20 unit percobaan. Jumlah ulangan diperoleh dengan rumus :
t (r-1) ≥ 15 5 (r-1) ≥ 15
5 r – 5 ≥ 15 5 r ≥ 20 r ≥ 4
Metode linear yang digunakan yaitu sebagai berikut : Yij = µ + + αi + ∑ij
Dimana :
Yij = respon atau nilai pengamatan pada perlakuan ke-i µ = efek nilai tengah
αi = efek dari perlakuan taraf ke-i
∑ij = efek error
(Sastrosupadi, 2000).
Pelaksanaan Penelitian Pembuatan PDA
Kentang dikupas dan dicuci bersih kemudian ditimbang 250 g, selanjutnya dipotong dadu kecil. Kemudian kentang dimasak dengan aquades steril 500 ml
selama 30 menit hingga kentang lunak. Kemudian disaring ekstraknya dengan kain muslin sampai volume 500 ml. Pada waktu air steril dididihkan sebanyak
500 ml bersama dengan agar-agar sebanyak 20 g, ditambahkan lagi kedalamnya dextrose 20 g. Ekstrak kentang dan agar keduanya dicampurkan sambil diaduk
200 ml dan ditutup dengan kapas steril dan dibalut dengan kertas alumunium foil lalu dimasukkan kedalam autoklaf untuk disterilkan selama 15 menit dengan suhu
121°C pada tekanan 1,25 atm. PDA dibiarkan terlebih dahulu dalam udara terbuka hingga panasnya menjadi hangat kuku, lalu dituang kedalam cawan petri. PDA
dapat disimpan di dalam lemari es dengan suhu 6-10°C.
Isolasi R. lignosus
Diambil akar tanaman karet yang terinfeksi jamur R. lignosus dari
perkebunan rakyat di desa Bangun Purba kemudian dibawa ke laboratorium. Setelah itu, dibersihkan dengan air kemudian dipotong menjadi ukuran ± 5cm
serta disterilisasi permukaan dengan klorox 0,1% selama 2-3 menit kemudian dikering anginkan. Selanjutnya dibiakkan dalam media PDA dan dibiarkan sampai tumbuh miselium jamurnya. Inokulum jamur yang tumbuh diisolasi
kembali untuk mendapatkan biakan murninya.
Isolasi Trichoderma sp.
Sebanyak 1g tanah di sekitar perakaran tanaman karet yang sehat ditimbang, dimasukkan ke dalam tabung ukur yang berisi 9 ml air steril. Tanah yang sudah dicampur dalam air steril tersebut kemudian diguncang selama 5
menit. Suspensi tanah yang telah diguncang diambil 0,1 ml menggunakan mikropipet dan ditumbuhkan di dalam cawan petri yang berisi media PDA dan
diinkubasi pada suhu ruang, kemudian dimurnikan.
Ekstraksi Pigmen Trichodermin
Perbanyakan Isolat Trichoderma sp.
cotton bud basah dan steril, cotton bud dioleskan di atas koloni biakan murni kemudian disebarkan merata di atas medium PDA. Kultur spora diinkubasi
selama 4-5 hari sampai terlihat perubahan warna PDA di dasar cawan petri yang menandakan adanya keluaran pigmen dari isolat Trichoderma.
Pigmen Trichodermin
Pigmen yang dihasilkan kultur Trichoderma sp. dipanen dengan cara
memotong medium PDA sehingga menjadi bagian- bagian kecil ukuran
± 1 x 1 cm dan merendamnya dengan pelarut alkohol dalam beaker glass dengan perbandingan volume pelarut dan volume medium 1 : 1. Campuran pelarut
disaring dengan kertas whatman nomor 041 untuk memisahkan sisa PDA. Suspensi pelarut dan pigmen trichodermin dikeringkan di udara terbuka sampai diperoleh endapan pigmen trichodermin setengah murni.
Uji Aktivitas Fungistatik Trichodermin dan Triadimefon Terhadap R. lignosus secara In vitro
Ekstrak trichodermin yang telah didapat diencerkan terlebih dahulu dengan air steril sesuai dengan perlakuan sebagai berikut : ekstrak trichodermin dicampur dengan air suling steril untuk mendapatkan pengenceran 10 -1, 10 -2, dan 10-3. Setelah trichodermin diencerkan, trichodermin dicampur dengan media PDA. Pengujian fungisida dilakukan dengan mencampur fungisida dengan dosis
Peubah Amatan
1. Luas Pertumbuhan Koloni Jamur R. lignosus
Pengamatan luas pertumbuhan koloni jamur dilakukan setiap hari dengan cara menggambar bentuk koloni pada plastik transparan dan kemudian ditimbang
beratnya, selanjutnya nilai berat timbangan koloni tersebut ditransformasikan ke dalam cm, yaitu dengan menimbang plastik transparan yang lain.
2. Persentase Percepatan Tumbuh R. lignosus
Pengamatan persentase percepatan tumbuh dilakukan setiap hari dengan menggunakan rumus :
Persentase Percepatan Tumbuh = x 100%
3. Persentase Penghambatan R. lignosus
Pengamatan persentase penghambatan dilakukan setiap hari dengan
menggunakan rumus :
Persentase Penghambatan = 100 % - Persentase Percepatan tumbuh
4. Perbandingan Percepatan Tumbuh R. lignosus
Perbandingan percepatan tumbuh dihitung pada pengamatan terakhir pada saat diemeter koloni kontrol telah memenuhi cawan petri lalu dibandingkan
dengan masing- masing perlakuan.
HASIL DAN PEMBAHASAN Hasil
1. Luas Pertumbuhan Koloni R. lignosus
Pengamatan dilakukan dari 1 hari setelah inokulasi sampai 10 hari setelah inokulasi. Analisis sidik ragam menunjukkan bahwa toksin trichodermin
berpengaruh sangat nyata terhadap luas pertumbuhan koloni R. lignosus. Hal ini menunjukkan jika pengaruh fungisida dan tingkat kepekatan toksin trichodermin tersebut berpengaruh terhadap rataan luas pertumbuhan. Hasil selengkapnya dapat
dilihat pada Tabel 1 dan lampiran 2-11.
Tabel 1 menunjukkan bahwa luas pertumbuhan koloni
R. lignosus tertinggi pada 10 hsi terdapat pada perlakuan T01 (tanpa toksin dan tanpa fungisida) yaitu sebesar 50,18 cm2. Sedangkan luas pertumbuhan
koloni R. lignosus terendah terdapat pada TX-1 (trichodermin 10-1) yaitu sebesar
11,39 cm2. Kemampuan trichodermin menghambat pertumbuhan R. lignosus dapat dilihat dari terhambatnya luas pertumbuhan R. lignosus secara
in vitro, ini membuktikan bahwa trichodermin merupakan toksin atau antibiotik yang dihasilkan oleh agen antagonis yang dapat menekan pertumbuhan patogen. Hal ini sesuai dengan literatur Wahyudi (2011) yang menyatakan bahwa
Trichoderma menghasilkan antibiotik yang dapat menghambat pertumbuhan spora dan hifa mikroba patogen, sehingga dapat mengakibatkan hambatan
terhadap luas pertumbuhan patogen.
Berdasarkan hasil uji beda rataan pada 10 hsi diketahui bahwa luas pertumbuhan pada perlakuan T02 (diberi fungisida triadimefon 2000 ppm) berbeda
fungisida). Ini menunjukkan bahwa triadimefon dapat menghambat pertumbuhan R. lignosus. Hal ini disebabkan triadimefon sebagai fungisida sistemik
menghasilkan racun yang dapat mengganggu metabolisme di dalam sel jamur R. lignosus. Sesuai dengan literatur Edwards (2006) menyatakan bahwa bahan
kimia triadimefon memiliki potensi efek toksik, Vyas (1984) juga menyatakan bahwa fungisida sistemik mengendalikan jamur patogen dengan membentuk berbagai penghambat kimia yang menyebar sebagai racun jamur dan menghambat
pertumbuhan jamur.
Gambar 5. Grafik rata- rata luas pertumbuhan koloni R. lignosus pada 1- 10hsi (cm2) akibat pengaruh trichodermin dan triadimefon terhadap berbagai tingkat konsentrasi toksin dan fungisida
Gambar 5 menunjukkan rata- rata pengamatan luas pertumbuhan koloni R. lignosus pada 1hsi perlakuan toksin trichodermin dan fungisida triadimefon tidak berpengaruh nyata terhadap luas pertumbuhan koloni R. lignosus, hal ini
disebabkan toksin dan fungisida yang diberikan belum menunjukkan reaksinya sehingga belum terlihat adanya hambatan pertumbuhan patogen. Perlakuan
berpengaruh nyata pada 2hsi sampai 10hsi, kemampuan toksin trichodermin dan fungisida triadimefon menghambat luas pertumbuhan koloni R. lignosus
menunjukkan dengan racun yang dimiliki menyebabkan lisi pada hifa.
2. Persentase Percepatan Tumbuh
Analisis sidik ragam menunjukkan bahwa trichodermin berpengaruh nyata
terhadap rataan persentase percepatan tumbuh R. lignosus. Hasil selengkapnya dapat dilihat pada tabel 2 dan lampiran 12-20.
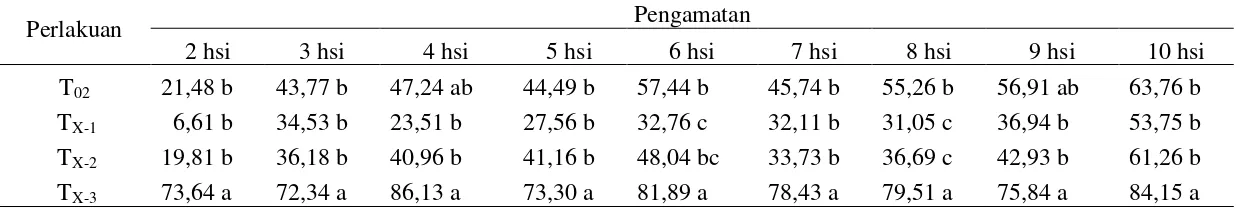
Dari hasil pengamatan pada tabel 2 terlihat perbedaan persentase percepatan tumbuh antara perlakuan T02 (diberi fungisida triadimefon 2000 ppm), TX-1 (trichodermin 10-1), TX-2 (trichodermin 10-2), dan TX-3(trichodermin 10-3). Tidak terlihat perbedaan nyata akibat perbedaan konsentrasi pada perlakuan TX-1 (trichodermin 10-1), TX-2 (trichodermin 10-2) dengan T02 (diberi fungisida triadimefon 2000 ppm), tetapi berbeda nyata pada TX-3 (trichodermin 10-3).
Dari data pengamatan 10 hsi menunjukkan bahwa perlakuan T02
(diberi fungisida triadimefon 2000 ppm), TX-1 (trichodermin 10-1), TX-2 (trichodermin 10-2) memperkecil percepatan tumbuh R. lignosus. Hal ini
disebabkan trichodermin dan fungisida sama-sama senyawa yang mempunyai
efek toksik terhadap jamur patogen. Sesuai dengan literatur Chen et al., (2008) menyatakan bahwa jamur endofit Trichoderma dapat menghasilkan suatu campuran sebagai aktivitas fungisida. Edwards (2006) menyatakan bahwa bahan
Tabel 1. Rataan luas pertumbuhan koloni R. lignosus pada 1- 10hsi (cm2
) akibat pengaruh trichodermin dan triadimefon pada berbagai tingkat konsentrasi toksin dan fungisida
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%. hsi = hari setelah inokulasi
Tabel 2. Rataan persentase percepatan tumbuh R. lignosus pada 1 – 10hsi (%) akibat pengaruh trichodermin dan triadimefon pada berbagai tingkat konsentrasi toksin dan fungisida
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%. hsi = hari setelah inokulasi
Perlakuan Pengamatan
1 hsi 2 hsi 3 hsi 4 hsi 5 hsi 6 hsi 7 hsi 8 hsi 9 hsi 10 hsi
T01 0,37 4,59 a 8,03 a 11,42 a 17,53 a 23,04 a 30,01 a 37,21 a 43,70 a 50,18 a T02 0,26 1,03 bc 1,95 c 4,59 bc 9,03 bc 10,58 bc 11,53 bc 12,05 c 14,37 c 14,83 c TX-1 0,14 0,37 c 0,86 c 1,14 c 1,66 d 2,49 d 4,13 d 6,57 c 8,89 c 11,39 c TX-2 0,14 0,54 c 1,41 c 2,86 c 3,70 cd 5,25 cd 5,91 cd 8,63 c 10,32 c 12,42 c TX-3 0,29 3,01 ab 4,71 b 7,43 b 10,53 b 13,77 b 15,69 b 21,17 b 23,73 b 29,21 b
Perlakuan Pengamatan
2 hsi 3 hsi 4 hsi 5 hsi 6 hsi 7 hsi 8 hsi 9 hsi 10 hsi
T02 21,48 b 43,77 b 47,24 ab 44,49 b 57,44 b 45,74 b 55,26 b 56,91 ab 63,76 b TX-1 6,61 b 34,53 b 23,51 b 27,56 b 32,76 c 32,11 b 31,05 c 36,94 b 53,75 b TX-2 19,81 b 36,18 b 40,96 b 41,16 b 48,04 bc 33,73 b 36,69 c 42,93 b 61,26 b TX-3 73,64 a 72,34 a 86,13 a 73,30 a 81,89 a 78,43 a 79,51 a 75,84 a 84,15 a
Berdasarkan hasil uji beda rataan diketahui bahwa persentase percepatan tumbuh pada perlakuan TX-1 (trichodermin 10-1) dan TX-2 (trichodermin 10-2) berbeda nyata dengan persentase percepatan tumbuh pada perlakuan TX-3 (trichodermin 10-3). Hal ini disebabkan adanya perbedaan kepekatan toksin. Permberian toksin trichodermin yang tepat dapat mempengaruhi percepatan tumbuh R. lignosus. Semakin pekat toksin maka percepatan tumbuh jamur patogen semakin kecil. Semakin encer toksin maka percepatan tumbuh patogen
semakin besar.
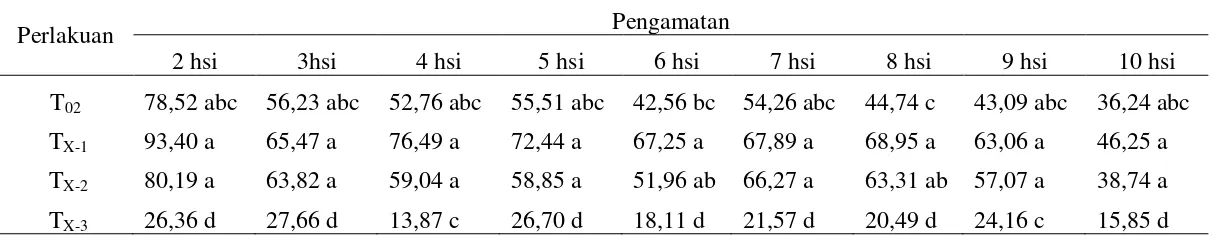
3. Persentase Penghambatan
Analisis sidik ragam bahwa trichodermin berpengaruh nyata terhadap rataan persentase penghambatan tumbuh R. lignosus. Dapat dilihat bahwa persentase penghambatan yang ditimbulkan oleh trichodermin terhadap R.
lignosus terdapat perbedaan pada tingkat konsentrasi yang berbeda. Hasil uji beda rataan persentase penghambatan dapat dilihat pada tabel 3 dan lampiran 21-29.
Persentase penghambatan pertumbuhan R. lignosus pada TX-1 (trichodermin 10-1), TX-2 (trichodermin 10-2), dan TX-3 (trichodermin 10-3) menunjukkan perbedaan dengan T02 (diberi fungisida triadimefon 2000 ppm).
Disebabkan trichodermin merupakan senyawa racun yang dapat menyerang dan menghancurkan propagul yang berisi spora-spora patogen sehingga dapat
menghambat pertumbuhan spora dan hifa mikroba patogen. Hal ini sesuai dengan literatur Hartal et al., (2011) yang menyatakan bahwa toksin yaitu T. viride memproduksi trichodermin merupakan antagonis yang menyebabkan spora
patogen mengalami lesio dan tidak berkembang, dengan mekanisme penghambatan kompetisi ruang tumbuh dan nutrisi, hiperparasit serta lisis.
Hasil pengamatan diketahui bahwa terdapat perbedaan yang nyata antara perlakuan T02 (diberi fungisida triadimefon 2000 ppm) dengan perlakuan TX-3
(trichodermin 10-3). Ini menunjukkan bahwa triadimefon sebagai fungisida sistemik mampu mentransfer energi dengan cepat sehingga dapat mengganggu sistem kerja enzim jamur. Hal ini sesuai dengan literatur Djunaedy (2008) yang
menyatakan bahwa mekanisme kerja fungisida sistemik salahsatunya dengan penghambatan sistem enzim jamur, sehingga mengganggu terbentuknya buluh
kecambah.
4. Perbandingan Percepatan Tumbuh
Analisis sidik ragam menunjukkan bahwa toksin trichodermin
berpengaruh sangat nyata terhadap perbandingan percepatan tumbuh R. lignosus. Hasil selengkapnya dapat dilihat pada tabel 4 dan lampiran 30.
Tabel 4 menunjukkan bahwa perbandingan percepatan tumbuh
R. lignosus tertinggi terdapat pada perlakuan T01 (tanpa toksin dan tanpa
fungisida) yaitu sebesar 1. Sedangkan perbandingan percepatan
tumbuh R. lignosus terendah terdapat pada TX-1 (trichodermin 10-1) yaitu sebesar 0,40. Kemampuan trichodermin memperkecil percepatan tumbuh jamur patogen
menunjukkan bahwa R. lignosus tertekan pertumbuhannya, karena trichodermin menghasilkan enzim yang dapat mengakibatkan terjadinya lisis pada dinding sel jamur. Hal ini sesuai dengan literatur Herliyana et al., (2013) menyatakan bahwa
cendawan patogen pada media padat. Harman et al., (2008) melaporkan juga bahwa Trichoderma sp. dapat menghasilkan antibiotik yang dapat menghancurkan
sel cendawan melalui pengrusakan terhadap permeabilitas membran sel, serta menghasilkan enzim khitinase yang dapat menyebabkan lisis dinding sel serta
dapat melakukan interfensi hifa.
Penghambatan pertumbuhan R. lignosus oleh fungisida triadimefon dikarenakan fungisida ini menghasilkan senyawa kimia yang bersifat toksik
terhadap jamur patogen. Fungisida triadimefon mampu mentransfer energi dengan cepat sehingga dapat mengganggu kerja enzim dan menurunkan fungsi haustoria.
Hal ini sesuai dengan literatur Djunaedy (2008) yang menyatakan bahwa mekanisme kerja fungisida sistemik salah satunya dengan penghambatan sistem enzim jamur, sehingga mengganggu terbentuknya buluh kecambah, apresorium
dan haostorium.
Tabel 3. Rataan persentase penghambatan R. lignosus pada 1 – 10hsi (%) akibat pengaruh trichodermin dan triadimefon pada berbagai tingkat konsentrasi toksin dan fungisida
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%. hsi = hari setelah inokulasi
Tabel 4. Rataan perbandingan percepatan tumbuh R. lignosus pada 10 hsi akibat pengaruh trichodermin dan triadimefon pada berbagai tingkat konsentrasi toksin dan fungisida
Perlakuan Pengamatan 10 hsi
T01 1,00 a
T02 0,50 c
TX-1 0,40 c
TX-2 0,49 c
TX-3 0,73 b
Keterangan: angka yang diikuti notasi huruf yang sama pada kolom menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%. hsi = hari setelah inokulasi
Perlakuan Pengamatan
2 hsi 3hsi 4 hsi 5 hsi 6 hsi 7 hsi 8 hsi 9 hsi 10 hsi
T02 78,52 abc 56,23 abc 52,76 abc 55,51 abc 42,56 bc 54,26 abc 44,74 c 43,09 abc 36,24 abc TX-1 93,40 a 65,47 a 76,49 a 72,44 a 67,25 a 67,89 a 68,95 a 63,06 a 46,25 a TX-2 80,19 a 63,82 a 59,04 a 58,85 a 51,96 ab 66,27 a 63,31 ab 57,07 a 38,74 a TX-3 26,36 d 27,66 d 13,87 c 26,70 d 18,11 d 21,57 d 20,49 d 24,16 c 15,85 d
DAFTAR PUSTAKA
Alexopoulus, JC dan CW Mims. 1979. Introductory Mycology Third Edition. John Wiley and Sons Inc. New York.
Alfizar, Marlina, dan Fitri Susanti. 2013. Kemampuan Antagonis Trichoderma sp. Terhadap Beberapa Jamur Patogen In Vitro. J. Floratek 8: 45 - 51.
Basuki dan Aron. 1994. Trichoderma koningii Dan Pemanfaatannya Dalam Pengendalian Penyakit Jamur Akar Putih (Rigidoporus microporus) Pada Tanaman Karet. Pusat Penelitian Sei Putih, Galang. Hal 3-4.
BPSP. 2008. Pengendalian Jamur Akar Putih. Balai Penelitian Sungei Putih, Galang.
Chen, SY., CL. Zhang., YZ. Chen., and FC. Lin. 2008. Trichodermin (4
-acetoxy-12,13-epoxytrichothec-9-ene). http://www. Acta Cryst.Trichodermin [20 Maret 2014].
Djunaedy, A. 2008. Aplikasi Fungisida Sistemik dan Pemanfaatan Mikoriza dalam Rangka Pengendalian Patogen Tular Tanah Pada Tanaman Kedelai (Glycine max L.). EMBRYO 5 (2): 149 - 157.
Direktorat Perlindungan Perkebunan. 2001. Musuh Alami, Hama dan Penyakit Tanaman Jambu Mete. Departemen Pertanian, Jakarta.
Edwards, D. 2006. Triadimefon And Tolerance Reassessment For Triadimenol. United States Environmental Protection Agency.
Environmental Protection Agency. 2004. Fungicides. http://www. Environmental Protection Agency. [20 Maret 2014].
Fardiaz, S. 1989. Mikrobiologi Pangan. Departemen Pendidikan dan Kebudayaan Direktorat Jenderal Antar Universitas Pangan dan Gizi. Institut Pertanian Bogor, Bogor.
Harman GE, Björkman T, Ondik K, Shoresh M. 2008. Trichoderma spp. for Biocontrol. Changing paradigms on the mode of action and uses of Trichoderma spp. for biocontrol. Research Information. Cornell University, USA.
Hartal., Misnawaty dan F. Bardo. 2011. Pengendalian Penyakit Layu Fusarium di Pembibitan Jarak Pagar (Jatropha curcaslinn.) dengan Gliocladium virens dan Trichoderma viride. J. Manggaro, 12(1): 29 - 34.
Hutagaol, J. A dan A. Melin. 2000. Pengendalian Jamur Akar Putih (JAP) Pada Tanaman Karet Rakyat Menggunakan Trichoderma koningii Oud. Balai Pengkajian Teknologi Pertanian (BPTP), Jambi.
Ismail, N. dan Tenrirawe. 2010. Potensi Agens Hayati Trichoderma spp. Sebagai Agens Pengendali Hayati. Balai Pengkajian Teknologi Pertanian (BPTP), Sulawesi Utara.
Muharni dan Widjajanti. 2011. Skrining Bakteri Kitinolitik Antagonis Terhadap Pertumbuhan Jamur Akar Putih (Rigidoporus lignosus) dari Rizosfir Tanaman Karet. J. Penelitian Sains 14 (1): 51-58.
Muklasin dan Matondang, CO. 2010. Trend Perkembangan Serangan Hama dan PenyakitTanaman Karet di Provinsi Sumatera Utara. Balai Besar Perbenihan Dan Proteksi Tanaman Perkebunan, Medan.
Nasir, G. 2012. Pedoman Teknis Pengembangan Tanaman Karet. Direktorat Jenderal Perkebunan, Jakarta.
Person Ex Grey. 1801. Fungi [20 Maret 2014].
Prahmono. 2013. Panduan Budidaya Karet Untuk Petani Skala Kecil. Agroforestry dan Forestry, Sulawesi.
Purwantisari, S. dan Hastuti, RB. 2009. Uji Antagonisme Jamur Patogen Phytophthora infestans Penyebab Penyakit Busuk Daun dan Umbi Tanaman Kentang Dengan Menggunakan Trichoderma sp. Isolat Lokal. BIOMA 11 (1): 24-32.
Rahayu, AK dan Dina, E. 2010. Tingkat Serangan Penyakit Jamur Akar Putih (JAP) Rigidoporus lignosus Pada Tanaman Karet Triwulan 2 Tahun 2013 Wilayah Kerja. BBPPTP, Surabaya.
Semangun, H. 2008. Penyakit-Penyakit Tanaman Perkebunan. Gadjah Mada University Press, Yogyakarta.
Silva, J. P. D., A.M. D. Silva., I.V. Khmelinskii., J.M.G. Martinho and L.F. V. Ferreira. 2001. Photophysics and Photochemistry of Azole Fungicides:
Triadimefon and Triadimenol. J. Photochemistry and Photobiology 142 (2001): 31–37.
Sinulingga, W., dan Eddy, S. 1989. Pengendalian Penyakit Jamur Akar Putih Pada Tanaman Karet. Pusat Penelitian Karet, Sungei Putih, hal: 8-13.
Situmorang, A. 2004. Strategi dan manajemen pengendalian penyakit akar putih di perkebunan karet pp 66-86. Dalam Prosiding Pertemuan Teknis Strategi Pengelolaan Penyakit Tanaman Karet Untuk Mempertahankan
Potensi Produksi Mendatang Industri Perkaretan Indonesia Tahun 2020 Palembang 6-7 Mei 2004. Pusat Penelitian Tanaman Karet, Sumbawa. Susanna., T. Chamzurni., and A. Pratama. 2010. Dosage and Frequency of
Kascing To Control Fusarium Wilt Disease on Tomato Plants. J. Floratek 5: 152 – 163.
Vyas, SC. 1984. Systemic Fungicides. Tata Mc-Graw Hill Publishing Company Limited. New Delhi.
Wahyudi, A. 2011. Pendampingan Pengembangan Lada di Kabupaten Belitung. Pusat Penelitian dan Pengembangan Tanaman Perkebunan, Suka Bumi. Wei, CM., BS. Hansen., MC. Vaughan., and CS. McLaughlin. 1974. Mechanism
of Action of the Mycotoxin Trichodermin, 12,13-Epoxytrichothecene. Department of Molecular Biology and Biochemistry, University of California.
Yulfahri., N. Joni., dan A. Jalil. 2011. Pengendalian Jamur Akar Putih Pada Budidaya Karet. Balai Pengkajian Teknologi Pengembangan, Riau.
Zhao, JH., Y. Zhou., JG. Zhang., J. LiCheng., and F. ChengLin. 2009. Dihalogenated trichodermin (4bacetoxy-9,10-dibromo-12,13-epoxytrichothec) [20 Maret 2014].
Lampiran 1:
Bagan Penelitian
T01
TX-2
TX-1
TX-2
TX-3
T02
TX-1
TX-3
T01
T02
TX-2
TX-3
T02
TX-3
TX-1
T01
T02
TX-2
T01
Lampiran 2:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 1 HSI
Perlakuan Ulangan Total Rata-rata
I II III IV
T01 0,11 0,46 0,69 0,23 1,49 0,37
T02 0,11 0,34 0,46 0,11 1,03 0,26
TX-1 0,11 0,11 0,23 0,11 0,57 0,14
TX-2 0,23 0,11 0,11 0,11 0,57 0,14
TX-3 0,11 0,23 0,57 0,23 1,15 0,29
Total 0,69 1,26 2,06 0,80 4,81
Rata-rata 0,14 0,25 0,41 0,16 0,24
Daftar Sidik Ragam
SK db JK KT F hit F 0.05 F 0.01 Ket
Perlakuan 4,00 0,16 0,04 1,38 3,06 4,89 tn Galat 15,00 0,42 0,03
Total 19,00 0,58
FK = 1,16 Ket: *=nyata
KK = 0,70 % **=sangat nyata
Lampiran 3:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 4:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total
Lampiran 5:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 6:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 5 HSI
Perlakuan Ulangan Total
Lampiran 7:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 6 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 8:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 7 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 9:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 8 HSI
Perlakuan Ulangan Total
Lampiran 10:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 9 HSI
Perlakuan Ulangan Total
Lampiran 11:
LUAS PERTUMBUHAN KOLONI JAMUR (cm2) DATA PENGAMATAN 10 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 12:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total
Lampiran 13:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total
Lampiran 14:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 15:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 5 HSI
Perlakuan Ulangan Total
Lampiran 16:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 6 HSI
Perlakuan Ulangan Total
Lampiran 17:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 7 HSI
Perlakuan Ulangan Total
Lampiran 18:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 8 HSI
Perlakuan Ulangan Total
Lampiran 19:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 9 HSI
Perlakuan Ulangan Total
Lampiran 20:
PERSENTASE PERCEPATAN TUMBUH (%) DATA PENGAMATAN 10 HSI
Perlakuan Ulangan Total
Lampiran 21:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 2 HSI
Perlakuan Ulangan Total
Lampiran 22:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 3 HSI
Perlakuan Ulangan Total
Lampiran 23:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 4 HSI
Perlakuan Ulangan Total
Lampiran 24:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 5 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 25:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 6 HSI
Perlakuan Ulangan Total
Lampiran 26:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 7 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 27:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 8 HSI
Perlakuan Ulangan Total
Lampiran 28:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 9 HSI
Perlakuan Ulangan Total
Lampiran 29:
PERSENTASE PENGHAMBATAN (%) DATA PENGAMATAN 10 HSI
Perlakuan Ulangan Total Rata-rata
Lampiran 30:
PERBANDINGAN PERCEPATAN TUMBUH DATA PENGAMATAN 10 HSI
Perlakuan Ulangan Total