PRODUKSI BIOETANOL DARI RUMPUT LAUT
Eucheuma cottonii
MELALUI PROSES DETOKSIFIKASI DAN
DESALINASI HIDROLISAT
JAINI FAKHRUDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Produksi Bioetanol dari Rumput Laut Eucheuma cottonii melalui Proses Detoksifikasi dan Desalinasi Hidrolisat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 20 Agustus 2014
Jaini Fakhrudin
RINGKASAN
JAINI FAKHRUDIN. Produksi Bioetanol dari Rumput Laut Eucheuma cottonii
melalui Proses Detoksifikasi dan Desalinasi Hidrolisat. Dibimbing oleh DWI SETYANINGSIH dan MULYORINI RAHAYUNINGSIH.
Senyawa-senyawa toksik yang terbentuk karena proses hidrolisis asam pada E. cottonii seperti HMF mengganggu pertumbuhan S. cerevisiae pada proses fermentasi etanol. Faktor lain yang bisa menjadi penghambat adalah garam-garam terlarut pada substrat. Upaya yang dilakukan untuk mengurangi toksik adalah dengan detoksifikasi overliming dan adsorpsi arang aktif, sementara penurunan kadar garam dilakukan dengan teknik elektrodialisis. Tujuan penelitian ini adalah untuk menghilangkan senyawa-senyawa toksik dan garam-garam terlarut pada hidrolisat rumput laut sehingga proses fermentasi berjalan dengan baik dan produksi etanol meningkat.
Bahan utama yang digunakan dalam penelitian ini adalah rumput laut E. cottonii dan mikroorganisme yang digunakan untuk proses fermentasi adalah khamir Saccharomyces cerevisiae yang sudah diadaptasi. Media tumbuh yang digunakan sebagai stok adalah PDA (Potato Dextrose Agar). S. cerevisiae
ditumbuhkan pada media PDA yang telah disterilisasi, selanjutnya diinkubasi pada suhu 30 oC selama 3 hari. Biakan murni dari media PDA diambil sebanyak 2 ose diremajakan pada media YMGP (Yeast Extract Maltose Glucose Pepton)
sebanyak 10 ml dan diinkubasi pada suhu 30 oC selama 48 jam.
Bahan rumput laut direndam selama 3 hari dengan dilakukan penggantian air selama proses perendaman. Rumput laut kemudian ditiriskan dan dipotong dengan mesin pemotong hingga berukuran 1-2 cm. Rumput laut kemudian dikeringkan dengan dijemur di bawah sinar matahari sampai kering selama 5-7 hari.
Hidrolisis dilakukan melalui dua tahap. Tahap pertama dan kedua masing-masing selama 30 menit. Pada tahap pertama menggunakan total padatan rumput laut 15 % selama 30 menit, kemudian dilanjutkan dengan tahap kedua dengan pencampuran kembali rumput laut sebanyak 15 g. Proses detoksifikasi dilakukan melalui dua cara. Pertama, overliming dilakukan dengan menambahkan Ca(OH)2
atau NH4OH padahidrolisat sesuai dengan perlakuan penelitian hingga pH 10.
Hidrolisat ini kemudian diturunkan pH nya hingga 5,5-6,0 dengan penambahan H2SO4 10 %. Kedua, penambahan arang aktif. Arang aktif digunakan dengan
konsentrasi 2,5%, 5% dan 7,5% (b/v) dengan cara ditambahkan pada hidrolisat dan dilakukan pengadukan dengan kecepatan 150 rpm selama 15, 30, dan 45 menit pada suhu 400 C dan dilanjutkan dengan penyaringan menggunakan kertas saring. Selanjutnya, sebagai kontrol adalah netralisasi hidrolisat dengan Ca(OH)2
dan NH4OH hingga pH 6,4-6,8. Larutan diaduk selama 30 menit dan dilanjutkan
dengan adsorpsi arang aktif 2,5%, 5 % dan 7,5% (b/v) selama 15, 30, dan 45 menit pada suhu 40 oC.
dihubungkan dengan DC power supply. Proses elektrodialisis ini menggunakan tegangan 5, 9, dan 12 V dengan waktu 15, 30, dan 45 menit.
Proses fermentasi pada penelitian ini dilakukan selama 6 hari pada suhu ruang. Hidrolisat yang sudah siap ditambahkan urea 0,5% dan NPK 0,06% dari kandungan gula pereduksi untuk memperkaya substrat. Mikroba fermentasi yang digunakan adalah Saccharomyces cerevisiae yang sudah diadaptasi.
Hasil penelitian menunjukan bahwa kandungan gula pereduksi tertinggi diperoleh pada perlakuan netralisasi dengan Ca(OH)2 yaitu sebesar 11,34% (b/v)
dan kadar gula pereduksi terendah sebesar 8,85% (b/v hidrolisat) pada perlakuan netralisasi dengan NH4OH. Salinitas tertinggi sebesar 1600/00 pada proses
netralisasi dengan NH4OH, sementara pada detoksifikasi overliming tingkat
salinitas lebih rendah. Kandungan HMF terendah pada perlakuan overliming dengan Ca(OH)2 yaitu 1,39 g/l. Perlakuan overliming dengan Ca(OH)2 mampu
menurunkan kadar HMF hingga 16,77%, sementara perlakuan overliming dengan NH4OH sebesar 1,06%.
Etanol tertinggi yang dihasilkan pada perlakuan netralisasi dengan Ca(OH)2 sebesar 2,56% (v/v) dan efisiensi fermentasi 46,07%, sementara
detoksifikasi overliming menghasilkan etanol yang lebih rendah. Perlakuan hidrolisat dengan arang aktif mampu menurunkan HMF sebesar 65,18%, namun menyebabkan penurunan gula pereduksi sebesar 25,34%. Daya serap karbon aktif semakin kuat dengan semakin tingginya konsentrasi arang aktif yang ditambahkan. Penurunan HMF tertinggi sebesar 65,18% pada penambahan arang aktif 7,5% selama 45 menit. Adsorpsi arang aktif juga mampu menurunkan tingkat salinitas. Penurunan tertinggi terjadi pada perlakuan pada konsentrasi 7,50% dan waktu kontak selama 30 menit, yaitu sebesar 22%. Etanol tertinggi diperoleh melalui perlakuan adsorpsi arang aktif konsentrasi 7,5% selama 45 menit, yaitu sebesar 2,33% (v/v).
Proses desalinasi dengan elektrodialisis mampu menurunkan salinitas sebesar 20% pada perlakuan tegangan 5 V dan waktu 30 menit, tegangan 9 V dan waktu 15 menit, tegangan 12 V dan waktu 30 menit. Penurunan SO42- tertinggi
yaitu pada tegangan 12 V selama 45 menit. Kandungan sulfat pada perlakuan tersebut turun menjadi 2,97 g/l atau sebesar 46,22%. Perlakuan desalinasi pada tegangan 5 V selama 30 menit merupakan perlakuan terbaik karena menghasilkan etanol tertinggi, yaitu sebesar 2,06%. Semua perlakuan tegangan dan lama waktu pada proses elektrodialisis memberikan pengaruh yang signifikan terhadap kadar etanol yang dihasilkan.
Proses netralisasi hidrolisat E. cottonii menggunakan Ca(OH)2
menghasilkan kandungan etanol yang lebih tinggi dan kadar HMF yang lebih rendah dibandingkan dengan menggunakan NH4OH. Perlakuan netralisasi dengan
Ca(OH)2 merupakan perlakuan terbaik karena menghasilkan gula pereduksi dan
kadar etanol tertinggi. Adsorpsi arang aktif mampu meningkatkan etanol pada proses fermentasi. Proses desalinasi dengan elektrodialisis mampu menurunkan kadar garam terlarut dan mempunyai pengaruh yang signifikan terhadap etanol yang dihasilkan.
SUMMARY
JAINI FAKHRUDIN. Bioethanol Production From Seaweed Eucheuma cottonii
by Detoxification and Desalination of Acidic Catalyzed Hydrolysate. Supervised by DWI SETYANINGSIH and MULYORINI RAHAYUNINGSIH.
The toxic compounds in which resulted from acid hydrolysis process on E. cottonii such as HMF interfere the growth of S. cerevisiae in the fermentation. In addition, the other factors such as the dissolved salts in the substrate are considered as inhibitors. The efforts had been made to reduce toxic through detoxification and activated charcoal adsorption, while salinity level was reduced by electrodialysis. The objective of this study was to eliminate toxic compounds and dissolved salts in the hydrolysate in order to make the process of fermentation run well and increase ethanol yield.
The main material used in this study was E. cottonii. Microorganisms used for fermentation was adapted Saccharomyces cerevisiae. Growth medium was Potato Dextrose Agar (PDA) as a culture stock. S. cerevisiae had been grown on sterilized PDA, then incubated at 30°C for 3 days. Pure cultures of PDA were taken by 2 ose then rejuvenated on YMGP media of 10 ml and incubated at 30°C for 48 hours.
Seaweed was soaked for 2 days with replacement of water during the immersion process. Seaweed was crushed by drilling machine with 1-2 cm length. Then seaweed was dried under the sun for 5-7 days.
Hydrolysis was conducted in two stages. The first and second stages were conducted for 30 minutes respectively. In the first stage using a total of 15% solids seaweed for 30 minutes, followed by a second stage with mixing seaweed as much as 15 g. The detoxification process was conducted in two ways. First, overliming was done by adding Ca(OH)2 and NH4OH in the hydrolyzate to a pH
of 10. The hydrolysate was then lowered to pH 5,5-6,0 by the addition of 10%
solution was stirred for 30 minutes and followed by activated charcoal adsorption of 2,5%, 5% and 7,5% (w/v) for 15, 30, and 45 minutes at a temperature of 40oC.
Desalination process was conducted by electrodialysis. Cell consisted of three chambers, namely the anode chamber, the feed chamber and the cathode chamber, wherein each chamber limited by the filter to separate salt deposits attached to the electrodes. Hydrolysate put into the feed chamber and the anode-cathode were connected to a DC power supply. The electrodialysis process used voltage of 5, 9, and 12 V with a time of 15, 30, and 45 minutes.
The process of fermentation in this study was carried out for 6 days at room temperature. Hydrolysates were added urea of 0,5% and the compound fertilizer (NPK) of 0,06% of reducing sugar to enrich the substrate. Microbial used in fermentation was adapted Saccharomyces cerevisiae.
of reducing sugar was 8,85% (w/v hydrolysate) on the neutralization treatment with NH4OH . Analysis of variance showed that the detoxification by overliming
and the type of base used did not give effect to reducing sugar produced. The highest salinity was 1600/00 in the process of neutralization with NH4OH, while in
detoxification by overliming, salinity level was lower. The lowest content of HMF in overliming treatment with Ca(OH)2 was 1,39 g/l. Overliming treatment with
Ca(OH)2 was able to reduce level of HMF up to 16,77%, while overliming
treatment with NH4OH of 1,06%.
The highest ethanol produced in the neutralization treatment with Ca(OH)2 was 2,56% (v/v) and fermentation efficiency of 46,07%, while
overliming detoxification produced lower ethanol yield. Hydrolysate treatment with activated charcoal was able to reduce HMF of 65,18% and led to a decrease of reducing sugar of 25,34%. Adsorptive capacity of the activated carbon was getting stronger with the increasing concentration of activated charcoal. The highest decrease of HMF was 65.18% on concentration of activated charcoal 7.5% for 45 minutes. Activated charcoal adsorption was also able to reduce the level of salinity. Highest decline occurred in treatment at concentrations of 7.50% and a contact time of 30 minutes, at 22%. The highest ethanol obtained through activated charcoal adsorption treatment concentration of 7.5% for 45 minutes, amounting to 2.33% (v / v).
The process of desalination by electrodialysis was able to reduce the salinity of 20% on the voltage of 5 V and time of 30 minutes, the voltage 9 V and 15 minutes, the voltage 12 V and 30 minutes. The lowest decrease of SO4
2-occured at treatment of 12 V for 45 minutes. The content of sulfate in the treatment decreased to 2,97 g/l or 46,22%. Desalination treatment at a voltage of 5 V for 30 minutes was the best treatment because it produced the highest ethanol yield of 2,06%. All the voltage treatments and the length of time on the electrodialysis process had a significant influence on levels of ethanol yield.
The process of neutralization E. cottonii hydrolysate using Ca(OH)2
resulted in higher ethanol content and lower levels of HMF compared to using NH4OH. Neutralization treatment with Ca(OH)2 is the best treatment for reducing
sugar yield and the highest ethanol content. The adsorption of activated charcoal was able to increase ethanol yield in fermentation process. The process of desalination by electrodialysis was able to reduce levels of dissolved salts and have a significant effect on ethanol yield.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
PRODUKSI BIOETANOL DARI RUMPUT LAUT
Eucheuma cottonii
MELALUI PROSES DETOKSIFIKASI DAN
DESALINASI HIDROLISAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Produksi Bioetanol dari Rumput Laut Eucheuma cottonii melalui Proses Detoksifikasi dan Desalinasi Hidrolisat
Nama : Jaini Fakhrudin NIM : F351110021
Disetujui oleh Komisi Pembimbing
Dr Dwi Setyaningsih, STP MSi Ketua
Dr Ir Mulyorini Rahayuningsih, MSi Anggota
Diketahui oleh
Ketua Program Studi Teknologi Industri Pertanian
Prof Dr Ir Machfud, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 ini ialah Bioenergi, dengan judul Produksi Bioetanol dari Rumput Laut Eucheuma cottonii
melalui Proses Detoksifikasi dan Desalinasi Hidrolisat.
Terima kasih penulis ucapkan kepada Ibu Dr. Dwi Setyaningsih, STP MSi dan Ibu Dr. Ir. Mulyorini Rahayuningsih, MSi selaku pembimbing, serta Ibu Dr. Ir. Liesbetini Haditjaroko, MS sebagai penguji yang telah banyak memberi saran. Terima kasih yang sebesar-besarnya juga penulis sampaikan kepada orang tua, istri dan anak yang telah memberikan dukungan dan doanya. Di samping itu, penghargaan penulis sampaikan kepada staf SBRC Indah dan Nely yang telah membantu selama pengumpulan data, serta mahasiswa-mahasiswa di asrama Kalbar rahadi oesman yang memberikan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
Polisakarida Eucheuma cottonii 2
Bioetanol 4
Hidrolisis Asam 4
Detoksifikasi 5
Desalinasi dengan Elektrodialisis 5
Fermentasi 6
3 METODOLOGI PENELITIAN 7
Waktu dan Tempat 7
Bahan dan Alat 7
Metode Penelitian 7
4 HASIL DAN PEMBAHASAN 12
Karakteristik Rumput Laut E. cottonii 12
Detoksifikasi 13
Proses Desalinasi 24
5 SIMPULAN DAN SARAN 28
Simpulan 28
Saran 29
DAFTAR PUSTAKA 29
LAMPIRAN 33
DAFTAR TABEL
1 Karakteristik E. cottonii kering 13
2 Karakteristik hidrolisat pada detoksifikasi 14
3 Kadar HMF (g/l) pada proses netralisasi dan overliming 16
4 Pengaruh overliming terhadap fermentasi 17
5 Kadar Gula Pereduksi pada lama waktu adsorpsi dan konsentrasi arang
aktif yang berbeda 20
6 Kandungan HMF pada lama waktu adsorpsi dan konsentrasi arang aktif
yang berbeda 21
7 Tingkat salinitas pada lama waktu adsorpsi dan konsentrasi arang aktif
yang berbeda 22
8 Total padatan terlarut pada lama waktu adsorpsi dan konsentrasi arang
aktif yang berbeda 22
9 Pengaruh adsorpsi arang aktif terhadap fermentasi 23 10 Tingkat salinitas pada lama waktu dan tegangan yang berbeda pada
proses desalinasi 24
11 Pengaruh desalinasi terhadap proses fermentasi 28
DAFTAR GAMBAR
1 Struktur dasar karaginan 3
2 Strukturkappa karaginan 4
3 Skema elektrodialisator 9
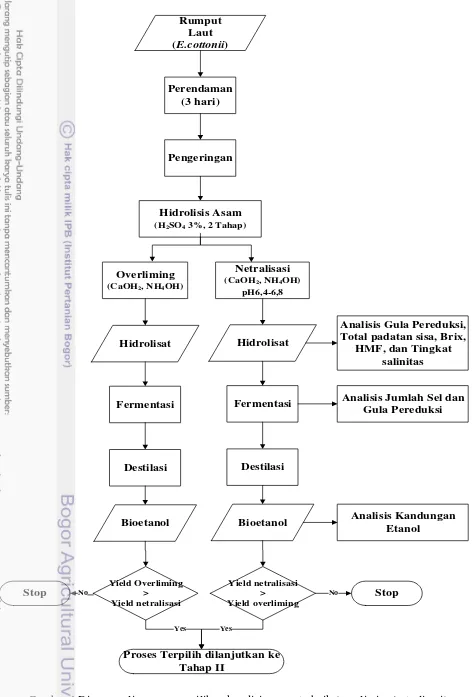
4 Diagram alir proses pemilihan kondisi proses terbaik berdasarkan yield
etanol tertinggi 10
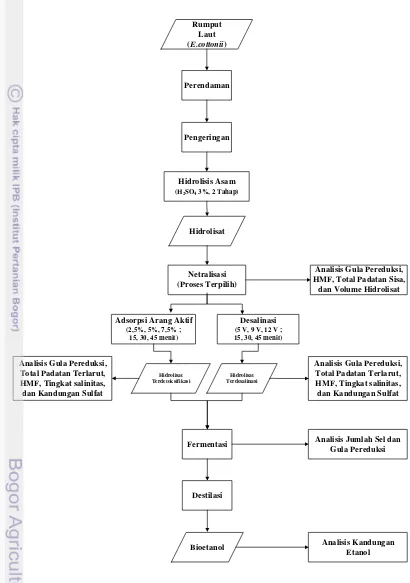
5 Diagram alir proses produksi etanol 11
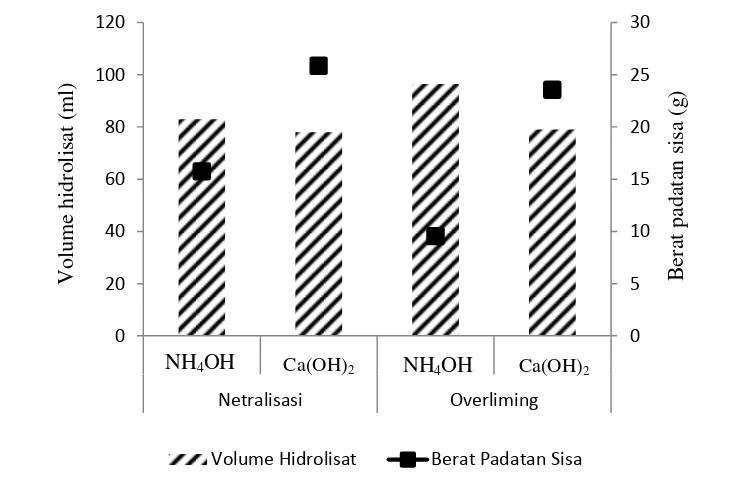
6 Volume hidrolisat dan berat padatan sisa pada detoksifikasi 15 7 Jumlah sel khamir sebelum dan setelah fermentasi pada overliming 19 8 Pengaruh lama waktu kontak dan konsentrasi arang aktif terhadap
volume hidrolisat 20
9 Pengaruh variasi tegangan dan lama waktu kontak terhadap kandungan
SO42- pada proses desalinasi 25
10 Pengaruh variasi tegangan dan lama waktu kontak terhadap kadar gula
pereduksi pada proses desalinasi 26
11 Pengaruh lama elektrodialisis dan tegangan listrik yang berbeda
terhadap volume hidrolisat pada desalinasi 26
12 Pengaruh variasi tegangan dan lama waktu kontak terhadap total
padatan terlarut pada proses desalinasi 27
DAFTAR LAMPIRAN
1 Prosedur pengujian 33
2 Analisis Ragam 37
Latar Belakang
Cadangan minyak bumi dunia semakin menipis. Hal ini terjadi karena adanya peningkatan kebutuhan sejalan dengan semakin bertambahnya jumlah penduduk dan sifatnya yang tidak dapat diperbaharui. Keadaan ini mendorong berbagai negara untuk mencari sumber energi alternatif yang terbaharukan dan berkelanjutan. Indonesia sebagai negara dengan jumlah penduduk terbesar ke empat di dunia harus mempunyai ketahanan energi yang baik. Upaya yang bisa dilakukan adalah dengan memberdayakan potensi sumber daya alam yang melimpah sebagai bahan baku pengembangan bioenergi dan sebagai langkah untuk mengurangi kebergantungan pada energi fosil seperti yang terjadi selama ini.
Potensi sumber daya alam yang potensial untuk dikembangkan sebagai bahan baku bioenergi khususnya bioetanol adalah rumput laut. Rumput laut sekarang sudah banyak dikembangkan untuk berbagai keperluan dan sangat mudah dikembangkan. Dari aspek budidaya tanaman ini mempunyai produktivitas yang sangat tinggi. Selain itu, Indonesia mempunyai perairan yang sangat luas, sehingga rumput laut merupakan sumber biomassa yang potensial untuk dikembangkan menjadi alternatif sumber energi terbarukan di Indonesia. Menurut Goh et al. (2010) dari 1 kg rumput laut Eucheuma spp. bisa menghasilkan 0,3934 kg galaktosa, yang berarti 1,18 kg dari 1 m2 area budidaya tiap musimnya. Salah satu paradigma yang mulai dikembangkan untuk menjadi solusi adalah menggali lebih banyak potensi sumber daya untuk produksi biomassa yang terbarukan dan berkelanjutan. Data produksi rumput laut pada tahun 2010 mencapai 2,828 juta ton (Dirjen Perikanan Budidaya 2010). Mengingat besarnya manfaat dari senyawa alkohol serta tersedianya bahan baku yang banyak dan mudah didapatkan maka perlu pengkajian dan pengembangan rumput laut E. cottonii sebagai bahan alternatif penghasil etanol.
Teknik fermentasi dalam produksi bioetanol dari rumput laut sampai saat ini masih belum efisien dengan produktivitas yang masih rendah. Rendahnya produktivitas diantaranya disebabkan oleh adanya penghambat pada substrat berupa senyawa toksik dan garam terlarut. Usaha untuk detoksifikasi dan desalinasi untuk mengurangi faktor penghambat tersebut menjadi sangat penting agar rendemen bioetanol yang dihasilkan pada proses fermentasi maksimal.
Konsentrasi inhibitor dan kandungan gula pada hidrolisat tergantung pada kondisi hidrolisis. Hidrolisat dengan kadar gula yang tinggi tidak selalu memberikan hasil etanol yang lebih tinggi daripada hidrolisat dengan kadar gula rendah karena bisa terdapat sejumlah penghambat terhadap pertumbuhan mikroorganisme fermentasi (Alriksson 2006).
Salah satu metode detoksifikasi yang umum digunakan adalah dengan menambahkan senyawa alkali pada hidrolisat asam hingga pH mencapai 10, setelah itu pH diturunkan hingga 5,5 dengan menambahkan H2SO4. Senyawa
alkali yang bisa digunakan antara lain Ca(OH)2 dan NH4OH. Penambahan alkali
ini dapat mengurangi furan dan HMF yang terdapat pada hidrolisat, sehingga terjadi peningkatan produktivitas etanol dari proses fermentasi (Palmqvist dan Hahn-Hagerdal 2000).
Faktor lain yang bisa menjadi penghambat pertumbuhan S. cerevisiae
adalah garam-garam pada substrat. Kelemahan dari penggunaan Ca(OH)2 sebagai
detoksifikasi alkali adalah terbentuknya CaSO4 (Alriksson 2006). Keberadaan
CaSO4 bisa menjadi penghambat pertumbuhan mikroba. Konsentrasi garam yang
tinggi dapat menghambat proses fermentasi sehingga penting untuk mengurangi konsentrasi garam tersebut. Upaya yang dilakukan untuk mengurangi kadar garam tersebut adalah dengan teknik elektrodialisis. Teknik ini mampu mengurangi kadar garam hingga 91,5 % dan relatif tidak mempengaruhi kadar gula pereduksi pada hidrolisat (Khambhaty et al. 2012).
Tujuan Penelitian
Tujuan penelitian ini secara umum adalah menghilangkan senyawa-senyawa toksik dan garam-garam terlarut pada hidrolisat asam E. cottonii sehingga proses fermentasi berjalan dengan baik dan produksi bioetanol meningkat.
Adapun tujuan khusus dari penelitian ini adalah :
1. Menganalisis pengaruh detoksifikasi dengan metode overliming dan dilanjutkan dengan adsorpsi arang aktif untuk menghilangkan senyawa-senyawa toksik pada hidrolisat asam E. cottonii.
2. Menganalisis pengaruh desalinasi dengan metode elektrodialisis untuk menghilangkan garam terlarut pada hidrolisat asam E. cottonii.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah memberikan alternatif solusi penghilangan senyawa toksik dan garam terlarut pada proses produksi bioetanol dari E. cottonii.
2 TINJAUAN PUSTAKA
Polisakarida E. cottonii
tanaman alga merah. Struktur dasar karaginan adalah ester sulfat kalium, natrium, kalsium, magnesium, atau amonium dari polimer D-galaktosa dengan ikatan α-1,3 dan β-1,4.
Karagenan merupakan poligalaktan sulfat dengan 15 sampai 40 % kandungan estersulfat dan berat molekul relatif rata-rata di atas 100 kDa . Hal ini dibentuk oleh unit alternatif D–galaktosa dan 3,6-anhydro–galaktosa ( 3,6-AG )
bergabung dengan α-1,3 dan β-1,4-glikosidik. Karagenan diklasifikasikan menjadi beberapa jenis seperti , , , , dan . semuanya mengandung 22-35% gugus sulfat. Klasifikasi ini dibuat berdasarkan kelarutannya dalam kalium klorida. Perbedaan utama yang mempengaruhi sifat jenis karagenan adalah jumlah dan posisi ester sulfat serta kandungan dari 3,6-AG. Tingginya tingkat ester sulfat berarti lebih rendah suhu kelarutan dan kekuatan gel. Jenis Kappa karagenan memiliki kandungan sulfat ester dari sekitar 25-30% dan kandungan 3,6-AG dari sekitar 28-35% (Necas dan Bartosikova 2013).
Polisakarida yang terdapat pada Eucheuma spp. sebagian besar dalam bentuk karagenan sebagai komponen dinding sel. Karagenan merupakan polisakarida, linear sulfat, struktur utama yang terdiri dari α (1-3)-D-galaktosa-4-sulfat dan β (1,4) -3,6-anhydro-D-galaktosa (Ellis et al. 2009). Selain karagenan, juga terdapat sejumlah kecil selulosa pada biomassa. Kandungan karbohidrat pada
Eucheuma spp. sebesar 56,2% D-galaktosa dan 43,8% 3,6-anhydro-galaktosa (Lin et al. 2000). Struktur dasar seperti terlihat pada Gambar 1 (cPKelco ApS, 2004):
Gambar 1 Struktur dasar karaginan (cPKelco ApS, 2004)
E. cottonii merupakan penghasil kappa karagenan. Kappa (k) Karaginan merupakan kopolimer linier yang disusun oleh residu D galaktosa-4-sulfat dengan ikatan α pada posisi 1,3 dan residu 3,6-anhidro-D galaktosa dengan ikatan β pada posisi 1,4. Beberapa satuan yang berikatan pada posisi 1,4 kadang-kadang sebagai 3,6-anhidro-D-galaktosa-2-sulfat, D-galaktosa- 2,6-disulfat atau D -galaktosa-6-sulfat. -Karaginan disusun oleh 38,1% Dgalaktosa, 28,1% 3,6-anhidro-D -galaktosa dan 25-28% sulfat sebagai OSO3Na. Struktur -Karaginan ditunjukkan
Gambar 2 Struktur -karaginan (Necas dan Bartosikova 2013)
Bioetanol
Bioetanol diproduksi dengan cara fermentasi menggunakan bahan baku hayati, sedangkan etanol dapat dibuat dengan cara sintesis melalui hidrasi katalitik dari etilen. Sifat fisika dari etanol adalah polar yang disebabkan karena gugus
hidroksilnya (R-OH). Seperti air, etanol dapat membentuk ikatan hidrogen. Karena adanya ikatan hidrogen ini maka etanol mempunyai titikdidih yang lebih tinggi dari senyawa lain yang mempunyai berat formula yang sama. Etanol juga mempunyai nilai pH sebagai asam lemah, mudah menguap, mudah terbakar dan mendidih pada suhu 78 oC.
Hidrolisis asam
Hidrolisis merupakan reaksi kimia menggunakan air yang memutus rantai panjang polisakarida. Pada dasarnya proses hidrolisis karbohidrat bisa dengan menggunakan katalist enzim atau asam. Perbedaan dari kedua cara tersebut adalah cara kerja enzim lebih spesifik dalam pemutusan ikatan rantai polisakarida dan menghasilkan jenis gula yang relatif seragam, sementara pada katalis asam pemutusan dilakukan secara acak.
Hidrolisis asam dapat dilakukan dengan menggunakan asam pekat H2SO4
72 % dan HCl 42 % pada suhu ruang. Selain itu, hidrolisis juga dapat dilakukan dengan larutan asam H2SO4 1 % pada suhu 100-1200 C selama 3 jam. Karbohidrat
dapat dihidrolisis dalam suasana asam menjadi gula sederhana yang akan dijadikan sumber makanan bagi khamir, selanjutnya gula ini difermentasi (Grethlein 1978). Menurut Meinita et al. (2012b) kondisi optimal untuk hidrolisis
menggunakan konsentrasi asam sulfat, suhu, dan waktu reaksi masing-masing adalah 0,2 M, 130 ° C dan 15 menit dan penelitian yang dilakukan Setyaningsih et al. (2012) menggunakan H2SO4 2 % selama 45 menit mendapatkan kandungan
Detoksifikasi
Detoksifikasi merupakan usaha yang dilakukan untuk menghilangkan racun atau toksik yang terkandung pada hidrolisat agar proses fermentasi bisa berjalan dengan baik. Penggunaan Ca(OH)2 sebagai katalis detoksifikasi mengakibatkan
kadar gula hidrolisat asam menurun dari 13% menjadi 10%, sedangkan penggunaan NH4OH tidak menurunkan kadar gula hidrolisat, bahkan dapat
menaikkan kadar gula seperti yang terlihat pada pengadukan selama 15 dan 45 menit. Penurunan kadar gula disebabkan oleh terjadinya konversi total gula menjadi gula pereduksi oleh senyawa alkali (Ca) dan terbentuknya gypsum diakhir proses. Gypsum yang terbentuk tersebut mengikat sebagian gula yang ada dalam hidrolisat (Susmiati 2011). Proses detoksifikasi pada hidrolisat ubi kayu dengan overliming dilanjutkan adsorpsi arang aktif dengan konsentrasi 5 % dan lama waktu kontak 30 menit merupakan perlakuan terbaik (Juara 2011).
Salah satu upaya yang bisa dilakukan adalah dengan memanfaatkan arang aktif. Arang aktif ini lebih efektif daripada kalsium hidroksida untuk menghilangkan inhibitor pada hidrolisat. Detoksifikasi dengan arang aktif mampu meningkatkan kemampuan fermentasi Saccharomyces cerevisiae dari hidrolisat asam encer E. cottonii. Kondisi detoksifikasi yang optimal dengan konsentrasi arang aktif adalah 5% (Meinita et al. 2012a).
Desalinasi dengan Elektrodialisis
Efisiensi penggunaan gula dalam proses fermentasi masih rendah dikarenakan adanya garam terlarut yang dihasilkan dari hidrolisis asam dan dilanjutkan netralisasi Ca(OH)2 pada hidrolisat yang mengganggu proses
fermentasi tersebut. Desalinasi merupakan proses pemisahan yang dilakukan untuk mengurangi kadar garam terlarut dari suatu substrat. Garam merupakan senyawa ionik yang terbentuk oleh reaksi antara asam dan basa seperti reaksi berikut :
H2SO4(aq) + Ca(OH)2(aq) --> CaSO4(aq) + 2 H2O(l)
Dengan persamaan ionik adalah sebagai berikut :
2 H+ SO42- + Ca2+ 2 OH-→ Ca2+ SO42- + 2H+ 2 OH
Fermentasi
Teknik fermentasi dalam produksi bioetanol rumput laut sampai saat ini masih belum efisien dengan produktivitas yang masih rendah dan membutuhkan modal yang besar. Penelitian yang dilakukan oleh Putra et al. (2011) pada limbah
E. cottonii, kadar alkohol bioetanol tertinggi diperoleh sebesar 14% per kilogram limbah yaitu melalui proses delignifikasi dan perlakuan fisik. Hasil kajian pada fermentasi hidrolisat yang didesalinasi skala laboratorium menunjukkan 80% dari gula pereduksi dikonsumsi dalam waktu 48 jam dan menghasilkan etanol 2,18% (Khambhaty et al. 2012).
Untuk meningkatkan produktivitas etanol, perlu dilakukan optimasi kondisi yang dapat mengarahkan penggunaan piruvat menjadi etanol. Pendekatan yang dapat dilakukan antara lain pemilihan substrat dan kondisi fermentasi yang optimum. Secara teoritis, hidrolisis glukosa akan menghasilkan etanol dan karbondioksida. Perbandingan mol antara glukosa dan etanol dapat dilihat pada diagram reaksi berikut :
C6H12O6→ 2 C2H5OH + 2 CO2
Satu mol glukosa menghasilkan 2 mol etanol dan 2 mol karbondioksida. Dengan melihat kondisi tersebut, perlu diupayakan penggunaan substrat yang murah untuk dapat menekan biaya produksi etanol sehingga harga produknya bisa lebih murah. Ragi tapai tidak cocok digunakan untuk fermentasi hidrolisat rumput laut E. cottonii, sementara Saccharomyces cereviceae mampu menghasilkan kandungan alkohol sebesar 4,6% setelah 5-6 hari proses fermentasi pada suhu kamar( Candra et al. 2011).
Eucheuma spp. mengandung 70% karbohidrat dan sebesar 56,2%
galaktosa dapat diekstrak dari karbohidrat tersebut. Oleh karena itu bisa dihitung bahwa 0,3934 kg galaktosa didapat dari 1 kg rumput laut (Goh et al. 2010). Sementara menurut Meinita et al. (2011), hasil etanol dari hidrolisat K. Alvarezii
(cottonii) adalah 0,21 gr per gram galaktosa, dengan efisiensi fermentasi 41%.
3 METODOLOGI PENELITIAN
Waktu dan Tempat
Penelitian ini dilakukan di Laboratorium Surfactant and Bioenergy Research Center (SBRC) IPB. Penelitian berlangsung selama 8 bulan dari bulan April sampai November 2013.
Bahan dan Alat
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah rumput laut E. cottonii dan mikroorganisme yang digunakan untuk proses fermentasi adalah khamir yang sudah diadaptasi Saccharomyces cerevisiae. Bahan kimia yang digunakan terdiri dari arang aktif, H2SO4, Ca(OH)2, NH4OH, media PDA (Potato Dextrose Agar), YMGP (Yeast Extract Maltose Glucose Peptone), urea, pupuk majemuk NPK, etanol dan bahan kimia untuk analisa.
Alat
Peralatan yang digunakan dalam penelitian ini adalah fermentor, cawan petri, tabung reaksi, laminary air flow, autoclave, satu unit sel elektrodialisis tiga bilik, DC power supply, inkubator, stiring hot plate, sentrifugal, spektrofotometer, Density Meter, peralatan destilasi dan peralatan tambahan lainnya yang lazim digunakan dalam laboratorium kimia.
Metode Penelitian
Regenerasi Khamir
Media tumbuh yang digunakan sebagai stok adalah PDA. Khamir yang digunakan adalah S. cerevisiae yang sudah diadaptasi mengacu pada penelitian yang dilakukan oleh Sarfat (2013) yaitu khamir diadaptasi pada media yang mengandung galaktosa. S.cerevisiae ditumbuhkan pada media PDA yang telah disterilisasi pada suhu 121oC dan tekanan 1 atm selama 15 menit, selanjutnya diinkubasi pada suhu 30 oC selama 3 hari. Biakan murni dari media PDA diambil sebanyak 2 ose diremajakan pada media YMGP sebanyak 10 ml dan diinkubasi pada suhu 30 oC selama 48 jam. Komposisi media YMGP yang dibuat yaitu yeast extract 5 g/l, Maltose 5 g/l, Glucose 40 g/l, Peptone 5 g/l, selanjutnya disterilisasi pada suhu 121oC dan tekanan 1 atm selama 15 menit.
Persiapan Bahan Baku
penggiling hingga berukuran 1-2 cm. Rumput laut kemudian dikeringkan dengan dijemur di bawah sinar matahari sampai kering 5-7 hari. Rumput laut tersebut kemudian dikarakterisasi meliputi analisis terhadap kadar karbohidrat (SNI 01-2891-1992), protein (AOAC, 1995), serat kasar (AOAC, 1995), abu (AOAC, 1995), dan kadar air (AOAC, 1995). Prosedur analisis tersedia pada Lampiran 1.
Proses Hidrolisis
Hidrolisis asam dilakukan dengan tujuan menguraikan polisakarida yang ada pada rumput laut sehingga menjadi struktur yang lebih sederhana. Berdasarkan penelitian yang dilakukan oleh Astari (2012) perlakuan terbaik untuk hidrolisis E. cottonii dengan asam sulfat (H2SO4) adalah konsentrasi 3% melalui
dua tahap hidrolisis. Tahap pertama dan kedua masing-masing selama 30 menit. Pada tahap pertama menggunakan larutan asam sebanyak 100 ml dan total padatan rumput laut 15% selama 30 menit, kemudian dilanjutkan dengan tahap kedua dengan penambahan kembali rumput laut sebanyak 15 g. Hidrolisis dilakukan dengan menggunakan autoclave pada suhu 1210 C, tekanan 1 atm. Hidrolisat kemudian dinetralkan pada pH 5,5-6,0 dan dianalisa total padatan sisa setelah dilakukan pemisahan padatan dengan penyaringan metode vakum. Gula pereduksi diuji dengan metode DNS (3,5-dinitrosalicylic Acid) (Miller 1959). Prosedur analisis tersedia pada Lampiran 1.
Detoksifikasi
Proses detoksifikasi dilakukan melalui dua cara. Pertama, overliming
dilakukan dengan menambahkan Ca(OH)2 dan NH4OH padahidrolisat hingga pH
10. Pada overliming dengan Ca(OH)2, kalsium yang tidak larut dipisahkan dengan
filtrasi. Larutan kapur yang digunakan dibuat dengan menambahkan kapur tohor (CaO) dengan air ( perbandingan 1:3). Larutan diaduk selama 30 menit dan dilakukan penyaringan untuk menghilangkan kandungan kapur dan senyawa lain yang mengendap. Hidrolisat ini kemudian diturunkan pH nya hingga 5,5-6,0 dengan penambahan H2SO4 10 %. Kedua, penambahan arang aktif. Arang aktif
yang digunakan dengan konsentrasi 2,5%, 5% dan 7,5% (b/v) dengan cara ditambahkan pada hidrolisat dan dilakukan pengadukan dengan kecepatan 150 rpm selama 15, 30, dan 45 menit pada suhu 400 C dan dilanjutkan dengan penyaringan menggunakan kertas saring. Pada detoksifikasi dengan NH4OH,
proses dilakukan dengan cara yang sama tetapi tidak ada penyaringan. Selanjutnya, sebagai kontrol adalah netralisasi hidrolisat dengan Ca(OH)2
(Khambhathy et al. 2012) dan NH4OH hingga pH 6,4-6,8. Larutan diaduk selama
30 menit dan dilanjutkan dengan adsorpsi arang aktif 2,5%, 5 % dan 7,5% (b/v) selama 15, 30, dan 45 menit pada suhu 40 oC. Perlakuan tersebut dilakukan 2 (dua) ulangan. Perlakuan terbaik dilanjutkan pada tahap desalinasi.
Desalinasi
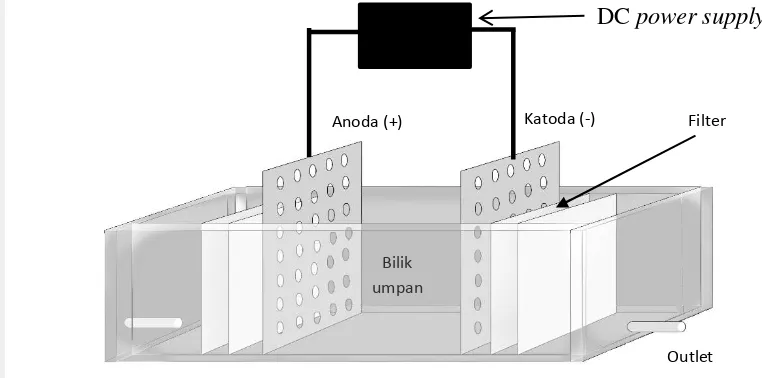
Proses desalinasi bertujuan untuk menghilangkan kandungan garam pada hidrolisat yang berperan sebagai inhibitor dalam proses fermentasi. Pemisahan garam yang tidak terlarut dilakukan dengan cara filtrasi atau sentrifugasi dan desalinasi hidrolisat untuk menghilangkan garam terlarut dengan cara elektrodialisis (Mody et al. 2011). Sel terdiri dari tiga bilik, yaitu bilik anode, bilik umpan dan bilik katode, dimana masing-masing bilik dibatasi dengan filter/kertas saring whatman untuk menyaring endapan garam yang melekat pada elektroda. Kapasitas bilik umpan 150 ml.Hidrolisatdimasukkan pada bilik umpan dan pada anoda-katoda dihubungkan dengan DC power supply (Sigit et al. 2010). Proses dilakukan pada suhu ruang (Banasiak et al. 2007). Proses elektrodialisis ini menggunakan listrik dengan tegangan 5, 9, dan 12 V dengan waktu 15, 30, dan 45 menit. Skema elektrodialisator yang digunakan pada penelitian ini seperti ditunjukkan pada Gambar 3. Pengujian yang dilakukan setelah proses ini meliputi total padatan terlarut (TDS) dengan TDS meter, tingkat salinitas dengan Refraktometer salinitas, garam sulfat SO4 2- dengan metode turbidimetri (SNI
06-6989.20-2004)dan gula pereduksi (Miller 1959).
Gambar 3 Skema elektrodialisator
Fermentasi
Proses fermentasi pada penelitian ini dilakukan selama 6 hari pada suhu ruang. Sebelum difermentasi, hidrolisat sebanyak 90 ml dipasteurisasi pada suhu 70 oC selama 15 menit untuk membunuh mikroba-mikroba yang mengganggu proses fermentasi. Hidrolisat yang sudah siap ditambahkan urea 0,5 % dan NPK 0,06 % dari kandungan gula untuk memperkaya substrat. Mikroba fermentasi yang digunakan adalah S. cerevisiae yang sudah diadaptasi. Biakan murni dari media PDA diambil sebanyak 2 ose diremajakan pada media YMGP sebanyak 10 ml, kemudian dicampurkan dengan hidrolisat yang sudah disiapkan sebelumnya, sehingga volume total adalah 100 ml. Proses fermentasi masing-masing dilakukan setelah proses netralisasi, overliming, adsorpsi arang aktif, dan desalinasi. Analisis yang dilakukan adalah pengukuran gula pereduksi (Miller 1959), jumlah sel dengan hemasitometer, dan kadar etanol dengan Density Meter DMA 4500 M.
Bilik umpan
Anoda (+) Katoda (-) Filter
Outlet
Perendaman
Tahap II
Perendaman Rumput
Laut (E.cottonii)
Pengeringan
Hidrolisis Asam
(H2SO4 3%, 2 Tahap)
Fermentasi
Destilasi Netralisasi (Proses Terpilih)
Adsorpsi Arang Aktif
(2,5%, 5%, 7,5% ; 15, 30, 45 menit)
Desalinasi
(5 V, 9 V, 12 V ; 15, 30, 45 menit)
Hidrolisat Terdetoksifikasi
Hidrolisat Terdesalinasi
Bioetanol Hidrolisat
Analisis Gula Pereduksi, HMF, Total Padatan Sisa,
dan Volume Hidrolisat
Analisis Gula Pereduksi, Total Padatan Terlarut, HMF, Tingkat salinitas, dan Kandungan Sulfat Analisis Gula Pereduksi,
Total Padatan Terlarut, HMF, Tingkat salinitas, dan Kandungan Sulfat
Analisis Jumlah Sel dan Gula Pereduksi
Analisis Kandungan Etanol
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dua faktorial dengan dua ulangan. Berdasarkan ANOVA, jika perlakuan memberikan pengaruh maka dilanjutkan dengan uji BNJ.
Pada detoksifikasi, faktor pertama yaitu metode detoksifikasi terdiri atas dua taraf yaitu overliming (A1) dan netralisasi (A2). Faktor kedua yaitu Jenis basa terdiri atas dua taraf yaitu Ca(OH)2 (B1) dan NH4OH (B2). Parameter yang
diamati adalah gula pereduksi, brix, berat padatan sisa, volume hidrolisat, kandungan HMF, tingkat salinitas dan kandungan etanol.
Pada adsorpsi arang aktif, faktor pertama yaitu konsentrasi terdiri atas tiga taraf yaitu 2,5% (b/v) (C1), 5 % (b/v) (C2), dan 7,5% (b/v) (C3). Faktor kedua yaitu waktu terdiri atas tiga taraf yaitu 15 menit (D1), 30 menit (D2), dan 45 menit (D3). Parameter yang diamati adalah gula pereduksi, kandungan HMF, total padatan terlarut, tingkat salinitas dan kandungan etanol.
Pada desalinasi, faktor pertama yaitu voltase terdiri atas tiga taraf yaitu 5 V (E1), 9 V (E2), dan 12 V (E3). Faktor kedua yaitu waktu terdiri dari tiga taraf yaitu 15 menit (F1), 30 menit (F2), 45 menit (F3). Parameter yang diamati adalah gula pereduksi, total padatan terlarut, volume hidrolisat, kandungan sulfat, tingkat salinitas dan kandungan etanol
Model linier untuk percobaan faktorial yang terdiri dari 2 faktor secara umum adalah :
Yi j k = μ + αi + βj + (αβ) i j + εi j k
Dimana:
Y ijk = Nilai pengamatan pada faktor pertama taraf ke-i faktor kedua
taraf ke-j dan ulangan ke-k
( , i , j ) = Komponen rataan, pengaruh utama faktor pertama dan
pengaruh utama faktor kedua
( )ij = Merupakan komponen interaksi dari faktor pertama dan faktor
kedua
ijk = Komponen galat oleh faktor pertama taraf taraf ke-i, faktor kedua
taraf ke-j dan ulangan ke-k
4 HASIL DAN PEMBAHASAN
Karakteristik Rumput Laut E. cottonii
Tabel 1 Karakteristik E. cottonii kering
Kadar karbohidrat pada rumput laut yang digunakan sebesar 48,93%. Kadar karbohidrat ini lebih tinggi dibandingkan dengan hasil penelitian Widyastuti (2010) yang menyatakan kandungan karbohidrat pada E. cottoni
sebesar 37,15%, sementara menurut Goh et al (2010) menyatakan kandungan karbohidrat Eucheuma spp. sebesar 70%. Karbohidrat berupa galaktan merupakan komponen utama yang digunakan dalam proses konversi menjadi gula sederhana yaitu berupa galaktosa pada proses hidrolisis, yang selanjutnya digunakan oleh khamir pada proses fermentasi. Semakin tinggi kadar karbohidrat diharapkan semakin banyak gula yang dihasilkan, sehingga potensi etanol yang dihasilkan akan semakin baik.
Kadar air pada bahan baku adalah 8,01%. Kadar air akan mempengaruhi daya simpan bahan baku sebelum digunakan. Bahan baku dengan kadar air tinggi atau pengeringan yang tidak sempurna akan mudah rusak. Selain itu, kadar air akan mempengaruhi jumlah padatan E. cottonii yang digunakan pada saat hidrolisis. Kadar air yang tinggi pada bahan baku berarti jumlah padatan yang digunakan semakin kecil dan akan mempengaruhi kekentalan hidrolisat.
Kadar abu merupakan komponen-komponen anorganik pada suatu bahan. Kadar abu pada bahan baku sebesar 13,79%. Kadar abu terkait dengan kandungan mineral bahan baku. Mineral tersebut bisa berupa garam organik maupun garam non organik. Kadar protein pada bahan baku adalah 3,59%. Kadar protein mempengaruhi tingkat kelarutan hidrolisat setelah proses hidrolisis. Pada saat hidrolisis terjadi pemutusan ikatan peptida menjadi molekul sederhana.
Hasil karakterisasi bahan baku, serat sebesar 19,66%. Serat kasar terdiri dari selulosa, hemiselulosa, dan lignin. Hemiselulosa merupakan salah satu penyusun dinding sel tanaman yang terdiri dari beberapa unit gula. Hemiselulosa terikat dengan polisakarida, protein dan lignin dan lebih mudah larut dibandingkan dengan selulosa. Komponen lain yang cukup penting pada bahan baku adalah kandungan selulosa. Selulosa merupakan komponen utama dinding sel tanaman. Selulosa terdiri dari unit monomer D-glukosa yang terikat pada ikatan 1,4-glikosidik. Selulosa bisa dihidrolisis menjadi glukosa, yang kemudian bisa digunakan pada proses fermentasi.
Detoksifikasi
Overliming
yang dirombak adalah polisakarida berupa galaktan menjadi galaktosa dengan melibatkan air dan katalis asam. Hasil hidrolisis yaitu berupa hidrolisat yang membutuhkan proses detoksifikasi untuk mengurangi kandungan toksik pada hidrolisat tersebut. Hidrolisis asam pada penelitian ini dilakukan dengan menggunakan asam H2SO4 3%, kemudian dilakukan overliming dengan dua jenis
basa NH4OH dan Ca(OH)2.
Tabel 2 Karakteristik hidrolisat pada proses detoksifikasi
Metode Jenis
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Tabel 2 menunjukkan kadar gula pereduksi tertinggi yang dihasilkan yaitu 11,34% (b/v hidrolisat) melalui proses netralisasi dengan Ca(OH)2 dan kadar gula
pereduksi terendah sebesar 8,85% (b/v hidrolisat) pada perlakuan netralisasi dengan NH4OH. Gula pereduksi yang diperoleh pada proses hidrolisis
menyatakan tingkat konversi dari polisakarida menjadi gula sederhana akibat adanya perombakan. Kondisi ini dipengaruhi oleh jenis dan konsentrasi asam yang digunakan, suhu dan tekanan, dan lama proses hidrolisis.
Analisis ragam menunjukkan bahwa detoksifikasi overliming dan jenis basa yang digunakan tidak memberikan pengaruh terhadap gula pereduksi yang dihasilkan (Lampiran 3). Hidrolisis asam dan dilanjutkan netralisasi dengan Ca(OH)2 menghasilkan gula pereduksi tertinggi pada hidrolisat. Semakin tinggi
gula yang dihasilkan dari proses hidrolisis maka semakin besar potensi etanol yang diperoleh pada saat proses fermentasi. Secara teoritis etanol yang dihasilkan sebesar 0,51 g/g glukosa, sesuai dengan persamaan berikut :
C6H12O6 → 2 C2H5OH + 2 CO2
Nilai Brix yang tinggi tidak berbanding lurus terhadap gula pereduksi yang dihasilkan. Tingginya nilai brix terutama pada detoksifikasi dengan NH4OH. Nilai
brix tertinggi sebesar 16,75oBx. Nilai brix merupakan jumlah zat padat yang larut dalam suatu larutan. Pengukuran brix dengan refraktometer ini menggunakan prinsip pembiasan cahaya ketika melalui suatu larutan. Tingginya nilai tersebut diduga karena selain gula, juga adanya kandungan garam dan zat terlarut lainnya yang terukur. Selain itu, NH4OH bersifat lebih larut dibandingkan dengan
Ca(OH)2, sehingga nilai brixnya lebih tinggi.
adanya garam yang terbentuk dari proses tersebut. Salinitas tertinggi sebesar 1600/00 pada proses netralisasi dengan NH4OH, sementara pada detoksifikasi overliming tingkat salinitas lebih rendah. Terjadinya penurunan salinitas pada
overliming disebabkan terjadinya pengendapan.
Detoksifikasi dengan overliming mampu menurunkan tingkat salinitas. Analisis ragam menunjukkan bahwa overliming dan jenis basa mempunyai pengaruh terhadap tingkat salinitas. Semakin tinggi kandungan garam pada hidrolisat maka akan mengganggu pertumbuhan mikroorganisme pada proses fermentasi. Ini akan menyebabkan rendahnya yield ethanol yang dihasilkan. Alriksson 2006 menyebutkan salah satu faktor yang menjadi hambatan pertumbuhan S. cerevisiae adalah kandungan garam pada substrat. Garam yang terbentuk berupa CaSO4, sebagai efek dari detoksifikasi dengan basa Ca(OH)2.
Penambahan 1 M NaCl pada media akan menurunkan tingkat pertumbuhan S. cerevisiae sebesar 70% (Garcia et al. 1997). Na+ and Cl- dapat menghambat pertumbuhan Z. mobilis, konsumsi glukosa, dan produksi etanol, tetapi penghambatan Na+ lebih besar (Vriesekoop et al. 2002).
Pada proses hidrolisis, pemisahan dilakukan dengan penyaringan vakum untuk memisahkan hidrolisat dan padatan sisa. Perlakuan netralisasi dan
overliming dengan Ca(OH)2 menghasilkan berat padatan sisa yang lebih tinggi.
Padatan sisa tertinggi sebesar 25,85 g yaitu pada perlakuan overliming dengan Ca(OH)2. Beratnya padatan sisa pada perlakuan dengan Ca(OH)2 dikarenakan
terbentuknya endapan kalsium sulfat. Padatan sisa terdiri dari ampas, kalsium sulfat dan senyawa-senyawa toksik yang terikat.Semakin berat padatan sisa yang dihasilkan, maka volume hidrolisat yang diperoleh juga semakin sedikit. Penggunaan Ca(OH)2 menghasilkan volume hidrolisat relatif lebih rendah
dibandingkan NH4OH, seperti ditunjukkan pada Gambar 6.
Overliming dalam penelitian ini merupakan upaya untuk menghilangkan
dibandingkan dengan menggunakan NH4OH.
Tabel 3 Kadar HMF (g/l) pada proses netralisasi dan
overliming
HMF mempunyai daya hambat terhadap pertumbuhan mikroba (Modig et al. 2002). Tingginya HMF akan mengganggu proses metabolisme khamir, sehingga kadar etanol yang dihasilkan pada proses fermentasi tidak maksimal. Kandungan HMF tertinggi adalah pada perlakuan netralisasi dengan NH4OH yaitu
sebesar 1,89 g/l. Terbentuknya HMF merupakan hasil dehidrasi heksosa pada suasana asam dan suhu yang tinggi. Perlakuan awal pada bahan baku menyebabkan terjadinya pembentukan produk seperti gula pentosa, heksosa, asam-asam gula, asam-asam alifatik (asam asetat, asam format, asam levulinat), HMF dan furfural (Jonsson et al. 2013). Liu et al. (2009) menyebutkan hydroxy methylfurfural (HMF) merupakan penghambat utama terhadap pertumbuhan mikroba yang terbentuk dari dehidrasi heksosa. Menurut Wikandari et al. (2010) kandungan HMF dan furfural 1 g L-1 pada medium dapat menurunkan produktivitas etanol yang dihasilkan masing-masing sebesar 71,42% dan 73%. Analisis ragam menunjukkan hanya jenis basa yang memberikan pengaruh nyata terhadap kandungan HMF. Uji lanjut BNJ (α=0,05), penggunaan Ca(OH)2 berbeda
nyata terhadap NH4OH, sementara overliming tidak berbeda nyata terhadap
netralisasi (Lampiran 7).
Hidrolisis menggunakan asam sulfat dan detoksifikasi overliming
menggunakan Ca(OH)2 menyebabkan terbentuknya endapan kalsium sulfat
(gipsum) (Martinez et al. 2001). Mekanisme munculnya kemampuan untuk mendetoksifikasi terjadi karena adanya pengendapan senyawa-senyawa toksik yang terjadi akibat penggunaan Ca(OH)2.
Proses Fermentasi
yang toksisitasnya relatif lebih rendah seperti 2,5-bis-hydroxymethylfuran. Larsson et al. (2000) menyebutkan S. cerevisiae mampu memetabolisme beberapa senyawa fenol.
Tabel 4 menunjukkan etanol tertinggi yang dihasilkan pada perlakuan netralisasi dengan Ca(OH)2 sebesar 2,56% (v/v) dan efisiensi fermentasi 46,07%,
sementara detoksifikasi overliming menghasilkan etanol yang lebih rendah. Uji lanjut BNJ terhadap kandungan etanol (% v/v hidrolisat) pada perlakuan netralisasi dengan Ca(OH)2 menunjukkan perbedaan yang nyata terhadap semua
perlakuan, sehingga netralisasi dengan Ca(OH)2 merupakan perlakuan terbaik
(Lampiran 8).
Tabel 4 Pengaruh overliming terhadap fermentasi
Metode
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Konsentrasi gula pada hidrolisat relatif sesuai bagi pertumbuhan mikroba dan tidak menjadi faktor penghambat. Konsentrasi gula pereduksi yang paling sesuai bagi pertumbuhan S. cerevisiae adalah 10% (Wignyanto et al. 2001) dan menurut Maharjan et al. (2012) konsentrasi glukosa maksimum untuk pertumbuhan mikroba sebesar 20%. Konsentrasi etanol juga bukan menjadi faktor penghambat, karena masih pada batas toleran. Menurut Lin and Tanaka (2006) S. cerevisiae tahan terhadap konsentrasi etanol hingga 18%.
Konversi etanol tertinggi yang diperoleh dari penelitian ini adalah 0,20 g/g gula, yaitu pada perlakuan overliming Ca(OH)2, sementara pada netralisasi
Ca(OH)2 sebesar 0,12 g/g gula. Menurut Goh et al. (2010), Eucheuma spp.
mengandung 70% karbohidrat dan sebesar 56,2% galaktosa dapat diekstrak dari karbohidrat tersebut. Oleh karena itu bisa dihitung bahwa 0,3934 kg galaktosa didapat dari 1 kg rumput laut. Sementara menurut Meinita et al. (2011), hasil etanol dari hidrolisat K. alvarezii (cottonii) adalah 0,21 g/g galaktosa, dengan efisiensi fermentasi 41%.
mutarotase, galaktokinase, galaktose 1-phosphate uridyltransferase, UDPgalaktose 4-epimerase dan phosphoglucomutase (Timson 2007).
Penggunaan NH4OH untuk proses netralisasi dan overliming pada
hidrolisat menghasilkan kandungan etanol yang lebih rendah dibandingkan dengan penggunaan Ca(OH)2. Etanol yang dihasilkan masing-masing sebesar
0,56 % (v/v) dan 0,36% (v/v). Rendahnya etanol yang dihasilkan disebabkan karena kandungan HMF dan salinitas yang lebih tinggi dibandingkan dengan menggunakan Ca(OH)2.
Kandungan HMF pada netralisasi dan overliming dengan NH4OH
masing-masing sebesar 1,89 dan 1,87 g/l. HMF pada konsentrasi 1 g/l sudah mampu menghambat proses fermentasi dengan S. cerevisiae (Alves et al. 1998). Penggunaan S.cerevisiae untuk fermentasi relatif menguntungkan karena lebih adaptif dan mempunyai mekanisme tertentu untuk bertahan pada suasana toksik. Menurut Taherzadeh et al (2000) S. cerevisiae mampu mengubah HMF menjadi 5-hydroxymethylfurfuryl alkohol.
Tingginya salinitas berpengaruh terhadap pertumbuhan khamir. Adanya garam terlarut mengakibatkan meningkatnya tekanan osmotik dan ion-ion bisa memberikan pengaruh hambatan jika konsentrasinya cukup tinggi (Helle et al. 2003). Reaksi pembentukan garam pada penggunaan NH4OH adalah sebagai
berikut :
2NH4OH (aq) + H2SO4(aq) → (NH4)2SO4(aq) + 2H2O (l)
Persamaan ioniknya adalah sebagai berikut :
2NH4+(aq) + 2OH- (aq) + 2H+(aq) + SO4 2-(aq) → 2NH4+(aq) + SO4 2-(aq) +
2H2O(l)
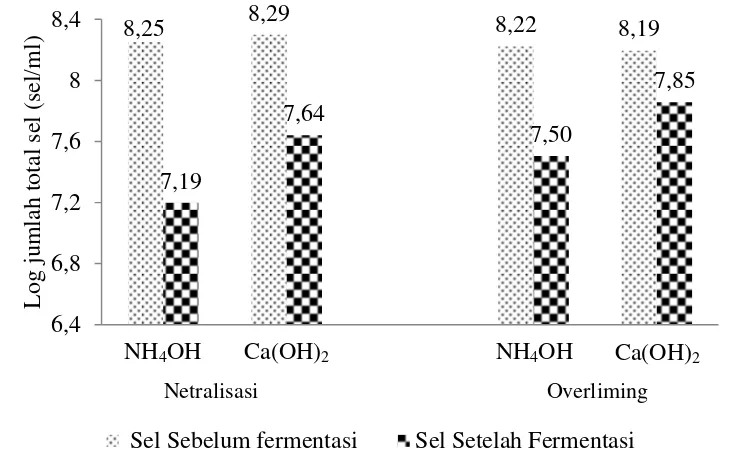
Berdasarkan Gambar 7, jumlah sel mengalami penurunan setelah proses fermentasi berlangsung. Penurunan jumlah sel pada netralisasi dan overliming
dengan NH4OH lebih tinggi dibandingkan dengan Ca(OH)2. Penurunan tersebut
diduga terjadi karena sel-sel mengalami kematian akibat beberapa penghambatan baik berupa toksik dan garam-garam terlarut maupun hambatan produk seperti etanol, walaupun hambatan produk tidak terlalu memberikan pengaruh karena konsentrasinya rendah. Berdasarkan analisis juga menunjukkan tingkat salinitas dan HMF pada penggunaan NH4OH lebih tinggi dibandingkan dengan
penggunaan Ca(OH)2. Penghitungan jumlah sel dilakukan dengan menggunakan
Gambar 7 Jumlah sel khamir sebelum dan setelah fermentasi pada detoksifikasi overliming
Adsorpsi Arang Aktif
Hidrolisat yang diadsorpsi arang aktif merupakan hidrolisat yang sudah dinetralisasi dengan Ca(OH)2. Penggunaan hidrolisat yang dinetralisasi dengan
Ca(OH)2 karena etanol yang dihasilkan lebih tinggi dibandingkan dengan
perlakuan yang lainnya, selain itu juga lebih menghemat biaya dibandingkan dengan NH4OH yang relatif lebih mahal. Tujuan Adsorpsi arang aktif utamanya
adalah menyerap HMF. Proses adsorpsi ini dipengaruhi oleh jenis adsorban, suhu lingkungan, dan jenis adsorbat. Semakin luas permukaan kontaknya makin tinggi potensi penyerapan HMF.
Pada Gambar 8 terlihat bahwa volume hidrolisat mengalami penurunan hingga menit ke 30 tetapi meningkat kembali pada menit ke 45. Penurunan hidrolisat karena teradsorpsi oleh arang aktif, sementara terjadinya peningkatan hidrolisat pada menit ke 45 diduga karena hidrolisat yang teradsorpsi terlepas kembali setelah berada pada titik jenuh. Selain itu, pada menit ke 45 arang aktif hancur menjadi ukuran partikel yang lebih kecil, ini terlihat dari hidrolisat yang tampak keruh setelah penyaringan. Walaupun volume hidrolisat kembali meningkat pada menit ke 45, tetapi kandungan gula menurun pada menit tersebut karena teradsorpsi seperti ditunjukkan pada Tabel 5. Semakin tinggi persentase arang aktif yang digunakan maka semakin besar potensi penurunan volume hidrolisat, sehingga konsentrasi arang aktif perlu dipertimbangkan dalam menyiapkan hidrolisat yang digunakan untuk fermentasi. Hasil analisis ragam menunjukkan bahwa konsentrasi arang aktif dan waktu kontak memberikan pengaruh terhadap volume hidrolisat. Pada uji lanjut BNJ, konsentrasi 2,5%, 5%, dan 7,5% berbeda nyata terhadap volume hidrolisat (Lampiran 15).
8,25 8,29 8,22 8,19
Sel Sebelum fermentasi Sel Setelah Fermentasi
Overliming
Ca(OH)2 Ca(OH)2
Gambar 8 Pengaruh lama waktu kontak dan konsentrasi arang aktif terhadap volume hidrolisat
Tabel 5 Kadar Gula Pereduksi (% b/v hidrolisat) pada lama waktu adsorpsi dan konsentrasi arang aktif yang berbeda
Konsentrasi
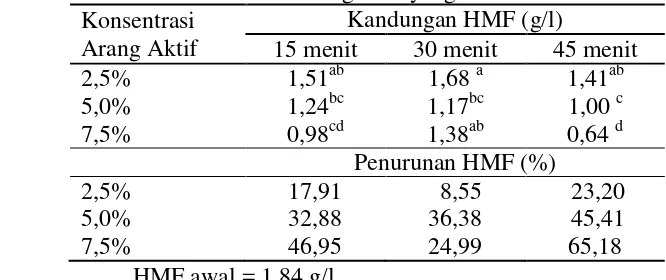
Penggunaan arang aktif untuk detoksifikasi tidak hanya mengurangi senyawa toksik seperti HMF tetapi juga gula pereduksi, karena arang aktif bersifat tidak selektif. Perlakuan hidrolisat dengan arang aktif mampu menurunkan HMF sebesar 65,18% serta menyebabkan penurunan gula pereduksi sebesar 25,34% (Tabel 5). Hasil analisis ragam menunjukkan bahwa hanya lama waktu adsorpsi arang aktif yang memberikan pengaruh terhadap kandungan gula pereduksi. (Lampiran 16).
menunjukkan bahwa waktu, konsentrasi adsorpsi arang aktif dan interaksinya memberikan pengaruh terhadap kandungan HMF (Lampiran 17).
Tabel 6 Kandungan HMF (g/l) pada pada lama waktu adsorpsi dan konsentrasi arang aktif yang berbeda
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Arang aktif bersifat sangat aktif dan akan menyerap apa saja yang kontak dengan arang aktif tersebut termasuk gula. Arang aktif merupakan karbon yang mempunyai luas permukaan yang sangat besar yaitu dengan cara mengaktifkan arang tersebut sehingga mempunyai daya adsorpsi yang sangat tinggi. Kemampuan mengadsorpsi ini akan mengikat dan menurunkan konsentrasi senyawa-senyawa toksik seperti HMF dan furfural pada hidrolisat.
Proses adsorpsi ini berhubungan dengan gaya Van der Waals dan merupakan suatu proses bolak – balik karena adanya daya tarik menarik antara zat terlarut dan adsorben. Kelemahan dari penggunaan arang aktif ini adalah mengadsorpsi gula, sehingga kandungan gula pada hidrolisat mengalami penurunan. Hasil analisis ragam menunjukkan hanya waktu yang memberikan pengaruh terhadap penurunan gula pereduksi, yaitu pada menit ke 45, sementara pada menit ke 15 dan 30 tidak berbeda nyata (Lampiran 16).
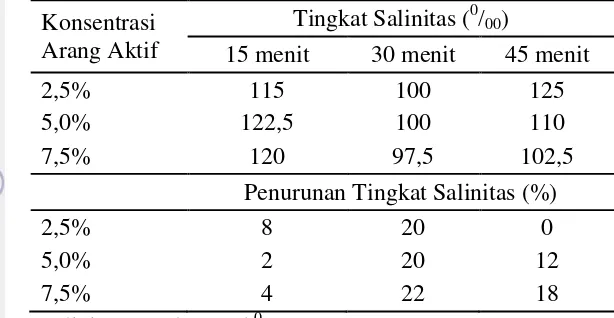
Pada Tabel 7 ditunjukkan tingginya tingkat salinitas pada hidrolisat yaitu mencapai 1250/00 . Tingkat salinitas tersebut menurun setelah dilakukan proses
Tabel 7 Tingkat salinitas pada pada lama waktu adsorpsi dan konsentrasi arang aktif yang berbeda
Konsentrasi Arang Aktif
Tingkat Salinitas (0/00)
15 menit 30 menit 45 menit
2,5% 115 100 125
5,0% 122,5 100 110
7,5% 120 97,5 102,5
Penurunan Tingkat Salinitas (%)
2,5% 8 20 0
5,0% 2 20 12
7,5% 4 22 18
Salinitas Awal = 125 0/00
Tabel 8 Total padatan terlarut (TDS) pada pada lama waktu adsorpsi dan konsentrasi arang aktif yang berbeda
Konsentrasi Arang Aktif
Total Padatan Terlarut (ppm) 15 menit 30 menit 45 menit
2,5% 20.700 22.360 21.560
5,0% 21.380 22.000 21.580
7,5% 20.280 20.890 19.700
% Penurunan TDS
2,5% 8,65 1,32 4,85
5,0% 5,65 2,91 4,77
7,5% 10,5 7,86 13,06
Total Padatan terlarut awal = 22.660 ppm
Tabel 8, kandungan total padatan terlarut awal (TDS) pada hidrolisat sebelum adsorpsi arang aktif sebesar 22.660 ppm. Setelah proses adsorpsi dilakukan terjadi penurunan TDS. Penurunan tersebut terjadi karena teradsorpsi oleh arang aktif. Pada Tabel 8, Konsentrasi arang aktif sebesar 7,5% dan lama kontak 45 menit menunjukkan penurunan terbesar yaitu 13,06%. Pada menit ke-15 terjadi penurunan TDS kemudian mengalami peningkatan kembali pada menit ke-30. Ini terjadi padatan-padatan terlarut yang sudah teradsorpsi, terlepas dari pori-pori arang aktif. Analisis ragam menunjukkan tidak ada pengaruh konsentrasi arang aktif maupun lama waktu kontak terhadap kandungan TDS (Lampiran 19).
Fermentasi
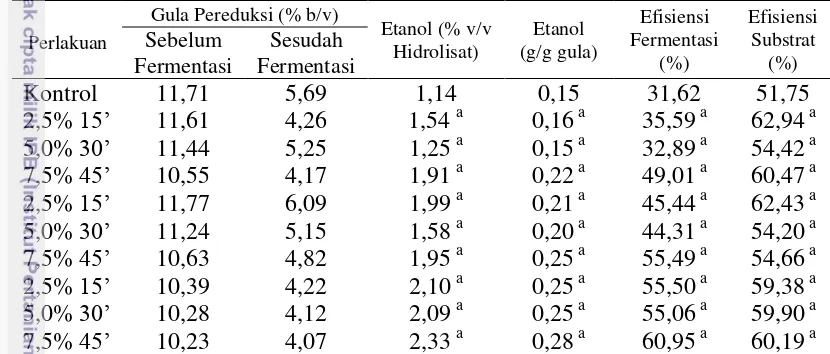
mampu menurunkan kandungan toksik pada hidrolisat melalui proses adsorpsi. Etanol tertinggi diperoleh melalui perlakuan adsorpsi arang aktif konsentrasi 7,5% selama 45 menit, yaitu sebesar 2,33% (v/v) atau peningkatan sebesar 104,34% dibandingkan kontrol. Semua perlakuan menunjukkan peningkatan etanol yang diperoleh jika dibandingkan dengan kontrol sebesar 1,14% (v/v). Hasil analisis ragam menunjukkan bahwa interaksi arang aktif dan lama waktu kontak tidak memberikan pengaruh terhadap kandungan etanol (%v/v), etanol (g/g gula), efisiensi fermentasi dan efisiensi substrat.
Tabel 9 Pengaruh Adsorpsi Arang Aktif terhadap Proses Fermentasi
Perlakuan
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Faktor yang menentukan keefektifan penggunaan arang aktif adalah luas permukaan yang tinggi dan struktur mikroporinya. Semakin kecil pori-pori arang aktif maka semakin tinggi luas permukaannya. Beberapa tahap proses adsorpsi yang terjadi seperti (1) makrotransport yaitu perpindahan adsorbat yang berupa garam-garam, senyawa toksik, dan padatan terlarut di dalam hidrolisat menuju permukaan arang aktif; (2) mikrotransport yaitu perpindahan adsorbat menuju pori-pori di dalam arang aktif; (3) sorpsi yaitu pelekatan zat adsorbat ke dinding pori-pori.
Penelitian yang dilakukan oleh Kamal et al. (2011) menunjukkan bahwa penggunaan arang aktif pada detoksifikasi hidrolisat sagu mampu menurunkan 58% furfural dan senyawa fenol total 78%. Detoksifikasi arang aktif menyebabkan peningkatan pertumbuhan spesifik Candida tropicalis pada hidrolisat batang sagu.
Proses Desalinasi
Desalinasi dilakukan dengan metode elektrodialisis. Proses elektrodialisis merupakan pengembangan dari proses elektrolisis menggunakan elektroda yang dihubungkan dengan arus listrik searah. Elektroda yang digunakan yaitu berupa katoda dan anoda. Katoda bertindak sebagai kutub negatif, sehingga ion-ion positif (kation) akan bergerak menuju katoda dan sebaliknya ion negatif (anion) bergerak menuju anoda. Sebagian ion-ion ini akan menempel pada elektroda dan tersaring pada bilik elektrodialisator yang dilengkapi dengan filter. Mekanisme seperti ini akan menyebabkan penurunan tingkat salinitas dan garam terlarut pada hidrolisat.
Berdasarkan Tabel 10, tingkat salinitas terendah yaitu sebesar 1000/00 atau
penurunan salinitas sebesar 20% pada perlakuan tegangan 5 V dan waktu 30 menit, tegangan 9 V dan waktu 15 menit, tegangan 12 V dan waktu 30 menit. Pada menit ke-45 tingkat salinitas mengalami peningkatan. Peningkatan salinitas terjadi karena karena reaksi bersifat reversibel.
Tabel 10 Tingkat salinitas pada lama waktu dan tegangan yang berbeda pada proses desalinasi (0/00)
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Hasil analisis ragam menunjukkan tidak ada pengaruh untuk perlakuan tegangan, sementara pada lama waktu elektrodialisis dan interaksi keduanya menunjukkan adanya pengaruh terhadap tingkat salinitas. Pada uji lanjut BNJ, waktu kontak selama 15 menit dan 30 menit menunjukkan tidak berbeda nyata terhadap tingkat salinitas, tetapi berbeda nyata pada menit ke- 45. Kombinasi tegangan 5 V dan waktu kontak 30 menit, tegangan 9 V dan waktu kontak 15 menit, tegangan 12 V dan waktu kontak 30 menit merupakan kombinasi terbaik yang memberikan pengaruh terhadap penurunan tingkat salinitas yang tinggi (lampiran 25).
Garam-garam yang terlarut pada hidrolisat bisa menjadi penghambat pertumbuhan S. cerevisiae. Garam-garam tersebut bersumber dari biomassa maupun terbentuk dari bahan-bahan kimia yang digunakan untuk proses hidrolisis seperti H2SO4, CaOH2, dan NH4OH. Ion dan kation dari garam yang berpotensi
Pada Gambar 9, Kandungan sulfat awal sebesar 5,52 g/l. semua perlakuan menunjukkan terjadinya penurunan sulfat dibandingkan dengan kandungan sulfat awal (kontrol). Penurunan sulfat tertinggi yaitu pada tegangan 12 V selama 45 menit. Kandungan sulfat pada perlakuan tersebut turun menjadi 2,97 g/l atau sebesar 46,22%. Semakin tinggi penurunan sulfat melalui proses elektrodialisis maka diharapkan semakin baik proses fermentasi yang dilakukan. Hasil analisis ragam menunjukkan adanya pengaruh tegangan, lama waktu elektrodialisis dan interaksinya terhadap kandungan sulfat (Lampiran 26).
Gambar 9 Pengaruh variasi tegangan dan lama waktu kontak terhadap kandungan SO42- pada proses desalinasi
Menurut Franden et al. (2013) tingkat penghambatan beberapa jenis kation terhadap pertumbuhan Zymomonas mobilis adalah sebagai berikut : Ca2+ >>Na+>NH4+ > K+. Almagro et al. (2000) menyatakan Na+ konsentrasi 0,5 M mampu menghambat pertumbuhan S. cerevisiae. Pada penelitian yang dilakukan oleh Casey et al. (2013) menguji pengaruh hambatan beberapa jenis garam terhadap pertumbuhan S. cerevisiae menunjukkan bahwa hanya NaCl yang mempunyai pengaruh hambatan pada konsentrasi garam yang rendah (dibawah 0,2 M). Sementara pada konsentrasi yang lebih tinggi (1 M), penambahan garam K2SO4 dan Na2SO4 menyebabkan penurunan konsumsi gula masing-masing
sebesar 12% dan 33% dibandingkan dengan kontrol.
Gambar 10 Pengaruh variasi tegangan dan lama waktu kontak terhadap kadar gula pereduksi pada proses desalinasi
Hidrolisat yang digunakan pada elektrodialisis sebanyak 100 ml. Setelah proses berlangsung terjadi penurunan volume hidrolisat. Hasil analisis ragam menunjukkan adanya pengaruh tegangan, lama elektrodialisis, dan interaksinya terhadap volume hidrolisat. Berdasarkan Gambar 11, pada voltase 5 dan 9 V penurunan terjadi relatif kecil. Penurunan tertinggi terjadi pada proses tegangan 12 V selama 45 menit. Volume hidrolisat turun menjadi 66,5 ml. Penurunan terjadi karena pada proses yang menggunakan tegangan tinggi akan menyebabkan terbentuknya busa atau gelembung pada hidrolisat, karena terjadi elektrolisis pada air.
Pada Gambar 12, TDS awal sebesar 22.900 ppm. Setelah dilakukan proses desalinasi dengan elektrodialisis, terjadi penurunan TDS. TDS pada perlakuan tegangan 5 V, 9 V, dan 12 V pada menit ke-15 masing-masing sebesar 21.940 ppm, 22.040 ppm, dan 21.720 ppm. Penurunan terbesar terjadi pada menit ke-45, yaitu menjadi 19.640 ppm. Hasil analisis ragam menunjukkan perlakuan tegangan memberikan pengaruh terhadap total padatan terlarut (TDS). Pada uji lanjut BNJ, tegangan 5 V dan 9 V tidak berbeda nyata. Kedua tegangan tersebut (5V dan 9V) berbeda nyata terhadap tegangan 12 V (Lampiran 28).
Gambar 12 Pengaruh variasi tegangan dan lama waktu kontak terhadap total padatan terlarut pada proses desalinasi
Fermentasi
Proses fermentasi pada tahap ini menggunakan hidrolisat yang dinetralisasi dengan Ca(OH)2 dan dilanjutkan dengan proses desalinasi dengan
elektrodialisis. Melalui proses ini, terjadi penurunan tingkat salinitas dan kandungan sulfat, sehingga diharapkan proses fermentasi berjalan dengan baik dan menghasilkan kadar etanol optimum.
Tabel 11 Pengaruh Desalinasi terhadap Proses Fermentasi
Angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Adanya garam mengakibatkan tekanan osmotik meningkat dan ion-ion bisa memberikan pengaruh hambatan jika konsentrasinya cukup tinggi (Helle et al.
2003). Penambahan 1 M NaCl pada media akan menurunkan tingkat pertumbuhan S. cerevisiae sebesar 70% (Garcia et al. 1997). Na+ and Cl- dapat menghambat pertumbuhan Z. mobilis, konsumsi glukosa, dan produksi etanol, tetapi daya hambat Na+ lebih tinggi (Vriesekoop et al. 2002). Pada media berbasis gula, S. cerevisiae dapat tumbuh pada larutan NaCl 1,5 M(Jonsson et al. 2013).
Penelitian yang dilakukan oleh Maiorella et al. (1984), menunjukkan bahwa tingkat penghambatan jenis-jenis garam terhadap mikroba adalah sebagai berikut CaCl2, (NH4)2SO4 > NaCl, NH4Cl > KH2PO4 > MgCl2 > MgSO4 > KCl.
Senyawa-senyawa lain yang berperan sebagai inhibitor yaitu senyawa fenol dan senyawa aromatik lainnya, asam alifatik, aldehid, ion-ion anorganik, dan bioalkohol (Jonsson et al. 2013).
5 SIMPULAN DAN SARAN
Simpulan
Proses detoksifikasi dengan overliming mampu menurunkan senyawa toksik pada hidrolisat. Analisis ragam menunjukkan hanya jenis basa yang memberikan pengaruh nyata terhadap penurunan kandungan HMF. Penggunaan Ca(OH)2 memberikan hasil penurunan HMF yang lebih tinggi dibandingkan
dengan NH4OH. Perlakuan overliming dengan Ca(OH)2 mampu menurunkan
kandungan HMF sebesar 16,77%. Meskipun overliming dengan Ca(OH)2
menghasilkan penurunan HMF tertinggi, namun kandungan etanol tertinggi dihasilkan dengan netralisasi Ca(OH)2. Kadar etanol yang dihasilkan dari
netralisasi dan overliming dengan Ca(OH)2 masing-masing sebesar 2,56% dan