INDUKSI OVULASI DAN PEMIJAHAN SEMI ALAMI
PADA IKAN PATIN (
Pangasianodon
hypopthalmus)
MENGGUNAKAN KOMBINASI HORMON
AROMATASE
INHIBITOR
DAN OKSITOSIN
MAHDALIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Ovulasi dan Pemijahan Semi Alami pada Ikan Patin (Pangasianodon hypopthalmus)
Menggunakan Kombinasi Hormon Aromatase inhibitor dan Oksitosin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
Mahdaliana
RINGKASAN
MAHDALIANA. Induksi Ovulasi dan Pemijahan Semi Alami pada Ikan Patin (Pangasianodon hypopthalmus) Menggunakan Kombinasi Hormon Aromatase inhibitor dan Oksitosin. Dibimbing oleh AGUS OMAN SUDRAJAT dan DINAR TRI SOELISTYOWATI.
Ikan patin (Pangasianodon hypopthalmus) merupakan ikan potensial bernilai ekonomis tinggi. Perkembangan produksi ikan patin mengalami peningkatan yang cukup tinggi namun hasil pemijahannya masih rendah. Pemijahan buatan pada ikan patin dilakukan dengan cara stripping karena tidak memiliki refleks spawning. Teknik stripping berdampak stress pada induk, kualitas gamet menurun dan gonad menjadi rusak. Proses pematangan gonad dan pemijahan tanpa stripping dapat diinduksi secara hormonal untuk membantu ovulasi ikan yang sulit memijah diluar habitatnya.
Penelitian ini bertujuan mengevaluasi penggunaan hormon aromatase
inhibitor (AI) dan oksitosin serta kombinasi hormon untuk merangsang ovulasi dan pemijahan pada ikan patin tanpa stripping (semi alami).
Perlakuan kombinasi hormon terdiri dari P1(AI+Oksitosin), P2 (AI+Oksitosin+Ovaprim), P3 (AI + Oksitosin + Ovaprim + PGF2α), P4 (ovaprim)
sebagai kontrol positif, dan P5 (NaCl) sebagai kontrol negatif. Setiap perlakuan digunakan lima induk ikan patin jantan dan lima induk ikan patin betina sebagai ulangan individu dengan bobot berkisar 2-5 kg. Perlakuan diberikan satu kali dengan cara penyuntikan secara instramuscular pada bagian otot dibawah sirip punggung.
Hasil penelitian menunjukkan perlakuan kombinasi hormon menggunakan AI dan oksitosin (P1, P2, P3) berhasil menginduksi ikan untuk ovulasi dan memijah tanpa stripping, sedangkan pada perlakuan ovaprim (P4) ikan memijah dengan distripping dan pada kontrol NaCl (P5) ikan tidak ovulasi dan tidak memijah. Perlakuan kombinasi hormon menyebabkan konsentrasi estradiol-17β dan testosteron dalam darah menurun yang menunjukkan tahap pematangan akhir. Lama waktu ovulasi tidak berbeda nyata yaitu berkisar antara 12,35±4,05 sampai 15,20±2,25 jam, sedangkan jumlah telur yang diovulasikan tertinggi adalah 145865 butir pada perlakuan kombinasi hormon P3 (AI + Oksitosin + Ovaprim + PGF2α), dengan diameter telur 1,08±0,007 mm, derajat pembuahan 99,60±0,55
%, derajat penetasan 98,60±0,54 % dan kelangsungan hidup larva 99,39 %. Kualitas air selama penelitian menunjukkan kisaran yang masih bisa ditoleransi ikan. Kandungan oksigen terlarut berkisar 5,4-6,5 mg/L, temperatur air 27-30 oC dan pH 7-7.5.
SUMMARY
MAHDALIANA. Hormonal Induction on Artificial Ovulation and Spawning of Catfish (Pangasianodon hypopthalmus) using Combined Hormon Aromatase inhibitor and Oxytocin. Supervised by AGUS OMAN SUDRAJAT dan DINAR TRI SOELISTYOWATI.
Catfish (Pangasianodon hypopthalmus) is a potential fish which has high economic value. The development of catfish production has increased high but the results nurseries are still low. Artificial spawning on catfish has carried out by stripping because of the absence in reflex of spawning. Mechanical stripping usually caused damage on the gonad, stress, and decreased of gametes and seeds. The process of gonadal maturation and spawning without stripping can be induced hormonal to help ovulation difficult fish spawning outside habitat.
This research proposed to evaluate the use of aromatase inhibitor (AI) and oxytocin with the combined of hormones to stimulate ovulation and spawning on catfish without stripping (semi-natural).
Treatment consists of a combination of hormones P1 (AI + oxytocin), P2 (AI +oxytocin + ovaprim), P3 (AI + oxytocin + ovaprim + PGF2α), P4 (ovaprim)
as a positive control, and P5 (NaCl) as a negative control. Each treatment was performed by using five pair of male parent and female parent as individual replicates an average ranging from 2-5 kg weight. The treatment is given once instramuscular injection by means of the muscle below the dorsal fin.
The results showed that the combined hormone using AI and oxytocin (P1, P2, P3) managed to induce ovulation and spawning catfish without stripping, while on treatment ovaprim (P4) spawning with stripping and the control NaCl (P5) fish do not ovulate and do not spawn. The treatment combined led to a concentration of hormones estradiol-17β and testosterone in the blood decreases which shows the final stages of maturation. The length of time ovulation was not significantly different ranging from 12,35 ± 4,05 to 15,20 ± 2,25 hours, while the highest number of eggs in a spawning is 145865 grains in the treatment of combined hormone P3 (AI + oxytocin + ovaprim + PGF2α), with a diameter of egg 1,08 ± 0,007 mm,the fertilization rate 99,60±0,55 %, the hatching rate 98,60 ± 0,54 %, and the survival rate 99,39 %. Water quality during the study showed that the range can be tolerated fish. Dissolved oxygen content ranged from 5,4 to 6,5 mg /L, water temperature 27-30 °C and pH 7-7,5.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
INDUKSI OVULASI DAN PEMIJAHAN SEMI ALAMI
PADA IKAN PATIN (
Pangasianodon
hypopthalmus)
MENGGUNAKAN KOMBINASI HORMON
AROMATASE
INHIBITOR
DAN OKSITOSIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Induksi Ovulasi dan Pemijahan Semi Alami pada Ikan Patin (Pangasianodon hypopthalmus) Menggunakan Kombinasi Hormon
Aromataseinhibitor dan Oksitosin Nama : Mahdaliana
NRP : C151120231
Disetujui oleh Komisi Pembimbing
Dr Ir Agus Oman Sudrajat, MSc Ketua
Dr Ir Dinar Tri Soelistyowati, DEA Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Yang Maha Rahman dan Rahim Allah Subhanahu wa ta’ala, karena hanya dengan ridha dan karunia-Nya penulis dapat menyelesaikan studi, penelitian serta penulisan tesis yang berjudul Induksi Ovulasi dan Pemijahan Semi Alami pada Ikan Patin (Pangasianodon hypopthalmus) Menggunakan Kombinasi Hormon Aromatase inhibitor dan Oksitosin.
Ucapan terimakasih yang tak terhingga penulis sampaikan secara khusus kepada bapak Dr Ir Agus Oman Sudrajat, M.Sc dan ibu Dr Ir Dinar Tri Soelistyowati, DEA selaku dosen pembimbing atas waktu, kebijaksanaan, tuntunan, kesabaran, memberikan semangat dan keteladanan untuk bekerja keras serta masukan hingga tesis ini dapat diselesaikan.
Penulis juga mengucapkan terima kasih yang sedalam-dalamnya kepada kedua orang tua penulis Ayahanda Muchtar Jalil, S.Sos dan Ibunda Saudah, S.Ag atas keteladanan, semangat untuk selalu pantang menyerah, kelembutan hati keduanya, kesederhanaan hidup yang diajarkannya, serta dorongannya untuk terus mencari ilmu dan menyampaikan pada sesama. Kakakku (Ners.Fitriana, S.Kep., Muchbir, SH.), adikku (Muchlizar Saputra, S.kom., Intan, Dinda) dan kepada Samsul Hadi, SH. Terima kasih untuk do’a, dukungan, pengertian dan kasih sayang yang tulus selama ini.
Terima kasih juga kepada Direktorat Perguruan Tinggi atas atas bantuan beasiswa selama menempuh pendidikan, Dodi Suhenda, SP.MM selaku Kepala BPBAT Cijengkol Subang yang telah memfasilitasi penelitian. Rekan-rekan yang telah membantu selama penelitian , Pak Sariya, Ade Hasanudin, S.Pi. Yudha Lestira, M.Si, adik-adik SMK Cibadak, adik-adik IPB (Arman, Linly, Ovie, Adri). Teman seperjuangan Nita, Hadra, Aprillia, Ega dan semua teman-teman Pascasarjana Ilmu Akuakultur IPB 2012 yang telah memberi motivasi, semangat serta masukan dalam penyelesaian tesis ini.s
Semoga tesis ini bermanfaat dan dapat memberikan tambahan informasi. Saran dan kritik untuk penyempurnaan dari semua pihak sangat diharapkan.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Kerangka Pemikiran 3
Tujuan Penelitian 4
Manfaat Penelitian 4
Hipotesis 4
3 METODE 5
Waktu dan Tempat Penelitian 5
Materi Uji 5
Rancangan Penelitian 5
Prosedur Penelitian 5
Parameter Uji 6
Analisis Data 7
4 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 15
5 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 26
DAFTAR TABEL
1 Perlakuan induksi ovulasi dan pemijahan secara hormonal pada ikan
Patin 5
2 Tingkat ovulasi ikan patin siam (Pangasianodon hypopthalmus) betina pada induksi ovulasi dan pemijahan semi alami secara hormonal 9 3 Kisaran kualitas air pada kolam pemijahan dan pemeliharaan ikan patin
selama penelitian 15
DAFTAR GAMBAR
1 Mekanisme hormonal dan kerja Aromatase inhibitor pada ovulasi dan
pemijahan ikan 4
2 Konsentrasi estradiol-17ß plasma darah ikan patin betina sebelum
induksi hormon dan 12 jam pasca penyuntikan 8
3 Konsentrasi testosteron plasma darah ikan patin jantan sebelum induksi
hormon dan 12 jam pasca penyuntikan 9
4 Rata-rata lama waktu laten ikan Patin siam (P. hypopthalamus) yang diberi perlakuan induksi hormonal menggunakan aromatase inhibitor
dan oksitosin 10
5 Pemijahan semi alami pada ikan Patin yang diberi perlakuan kombinasi
hormon AI, oksitosin, ovaprim dan PGF2α 10
6 Diameter telur ikan patin siam (P. hypopthalamus) sebelum induksi
hormone dan sesudah pemijahan semi alami 11
7 Diameter contoh telur ikan patin pada perlakuan 11 8 Rata-rata jumlah telur ikan patin siam (P. hypopthalamus) yang
dihasilkan pada induksi pemijahan semi alami secara hormonal 12 9 Rata-rata derajat pembuahan telur ikan patin siam (P. hypopthalamus)
pada induksi ovulasi dan pemijahan semi alami secara hormonal 13
10 Rata-rata derajat penetasan telur ikan patin siam (P. hypopthalamus) pada induksi ovulasi dan pemijahan semi alami secara hormonal 13 11 Rata-rata kelangsungan hidup larva ikan patin siam (P. hypopthalamus)
yang dihasilkan pada perlakuan induksi secara hormonal 14
DAFTAR LAMPIRAN
1 Analisis statistik terhadap kombinasi hormon dengan waktu masa laten
ovulasi pada ikan Patin 26
2 Analisis statistik terhadap kombinasi hormon dengan jumlah telur pada
pemijahan ikan Patin 27
3 Analisis statistik terhadap kombinasi hormon dengan derajat
4 Analisis statistik terhadap kombinasi hormon dengan derajat penetasan
pada pemijahan ikan Patin 28
5 Analisis statistik terhadap kombinasi hormon dengan tingkat kelangsungan hidup larva pada pemijahan ikan Patin 29 6 Analisis konsentrasi estradiol-17ß dan testoteron dalam plasma darah
PENDAHULUAN
Latar Belakang
Ikan patin (Pangasianodon hypopthalmus) merupakan ikan potensial bernilai ekonomis tinggi. Perkembangan produksi ikan patin mengalami peningkatan yang signifikan namun frekuensi pemijahannya masih rendah. Ikan patin siam diintroduksi dari Thailand dan memiliki tampilan mirip dengan ikan patin (Pangasius pangasius). Legendre et al. (1998) menyatakan bahwa ikan patin siam toleran terhadap kualitas air yang rendah, memiliki fekunditas tinggi, dan sudah dibudidayakan secara meluas di Lampung, Sumatera Selatan, Jawa Barat, dan Kalimantan (Prihatman 2000).
Produksi ikan patin pada tahun 2011 sebesar 478 juta ton baru terpenuhi sebesar 55% yaitu sekitar 263 juta ton. Sementara, kebutuhan ikan patin terus meningkat 70% per tahun atau 1.883.000 ton pada tahun 2014 (KKP 2012). Hingga saat ini masalah yang ditemui dalam pembenihan ikan patin adalah rendahnya frekuensi pemijahan.Waktu yang dibutuhkan untuk pematangan kembali gonad ikan patin berkisar 6-8 bulan dan masa pemijahannya berlangsung hanya pada musim penghujan (Samara 2010). Pemijahan buatan pada ikan patin budidaya umumnya dilakukan dengan cara stripping karena tidak memiliki refleks
spawning. Teknik stripping yang biasa dilakukan bisa menyebabkan ikan mengalami stress, menurunkan kualitas gamet dan merusak gonad, sehingga produksi benih tidak optimal. Teknologi reproduksi buatan untuk mempercepat proses ovulasi serta pemijahan buatan tanpa stripping dapat dilakukan dengan perangsangan hormonal pada fase kematangan gonad akhir.
Rekayasa hormonal pada umumnya mempengaruhi proses vitelogenesis sehingga mempercepat pematangan dan pemijahan pada ikan yang sulit memijah di luar habitatnya (Sadili 1996). Menurut Mylonas dan Zohar (2001), manipulasi hormonal memiliki aplikasi penting dalam pengembangan budidaya ikan komersial. Sejauh ini riset dan usaha pengembangbiakan menggunakan hormon untuk mengontrol siklus reproduksi ikan budidaya terfokus pada perangsangan
final oocyte maturation (FOM), ovulasi, spermiasi dan pemijahan. Tingkat pematangan gonad, ovulasi dan pemijahan pada siklus reproduksi ikan jantan dan betina seringkali tidak sinkron atau tidak seragam baik pada ikan di perairan umum maupun yang dipelihara dalam lingkungan budidaya (Rideout et al. 2003). Hormon dan lingkungan saling bekerjasama didalam memacu proses vitelogenesis, ovulasi dan pemijahan pada ikan. Tahapan reproduksi dikendalikan oleh kelenjar hypofisa dan estrogen yang dapat dipercepat prosesnya dengan penambahan hormon-hormon reproduksi (Lam 1995; Fujaya 2004). Faktor lingkungan yang mempengaruhi ovulasi antara lain foto periode, kualitas air (suhu, oksigen, pH, kesadahan, dan alkalinitas, salinitas) , siklus bulan (musim) substrat, kecukupan nutrisi, dan penyakit (Rothmans et al. 1991). Barnier et al.
(2009) menambahkan bahwa sinyal lingkungan akan diterima oleh otak dan disampaikan ke syaraf pusat untuk diteruskan ke hipotalamus. Hipotalamus akan merespon dengan melepaskan Gonadatropin releasing hormon (GnRH).
2
beberapa keuntungan (Ernawati 1990), yaitu selalu tersedia dan tersimpan dalam kemasan yang baik dan aman, mencegah pembunuhan ikan sebagai donor serta biaya, waktu dan tempat dapat lebih hemat.
Aromataseinhibitor dan oksitosin merupakan hormon yang secara fisiologis dalam proses reproduksi ikan saling bekerjasama memacu terjadinya ovulasi dan pemijahan. Aromatase inhibitor akan menyebabkan penurunan kadar estrogen, yang akan membebaskan hipotalamus dari efek umpan balik negatif estrogen. Kondisi ini akan menyebabkan pelepasan gonadotropin di hipofisa, terutama FSH dan selanjutnya akan menstimulasi perkembangan folikel di ovarium (Casper 2006; Polyzoz 2008). Sumantri (2006) mengatakan Aromatase inhibitor mampu menghambat atau menghentikan kerja enzim aromatase sehingga menghambat produksi hormon esterogen yang ada di otak maupun gonad. enzim aromatase pada otak ikan maupun gonad berfungsi mengkonversi hormon androgen menjadi esterogen. Oksitosin adalah hormon peptide yang disekresi olah pituitary posterior yang menyebabkan ejeksi air susu pada wanita dalam masa laktasi (Hopfer et al. 2004). Oxytocin berperan pada pemijahan. Oksitosin merangsang otot polos uterus pada proses pengeluaran telur. Fungsi perangsangan ini bersifat selektif dan cukup kuat. Pada konsentrasi esterogen yang rendah, efek oksitosin terhadap uterus juga berkurang, otot polos yang sensitif terhadap oksitosin hanyalah uterus, pembuluh darah dan mioepitel kelenjar (Tjay dan Rahardja 2008). Oksitosin bekerja pada reseptor oksitosik untuk menyebabkan kontraksi uterus pada kehamilan aterm yang terjadi lewat kerja langsung pada otot polos maupun lewat peningkatan produksi prostaglandin.
Menurut Haraldsen et al. (2001) aktivitas hormon oksitosin meningkat pada saat ovulasi dan berperan penting dalam proses pemijahan. Penelitian mengenai penggunaan aromatase inhibitor 0.1 mg dan oksitosin 0.3 IU pada ikan patin dilaporkan mampu memicu pemijahan semi alami 8 jam 19 menit pasca penyuntikan, dengan derajat pembuahan 92,27%, derajat penetasan 86,29% dan
survival rate (SR) larva 4 hari 84,75 % (Dewanthara 2013). Perlakuan AI+Oxytocin dapat memberikan rangsangan pada induk ikan Torsoro dalam melakukan pemijahan semi alami(Farastuti 2014).
Prostaglandin F2α (PGF2α) merupakan derivat dari struktur asam prostanoat
dan berasal dari asam lemak esensial melalui seleksi dan oksidasi (Tunner dan Bagnara 1998), PGF2α pada ikan berperan untuk merangsang terjadinya
pengeluaran oosite yang telah matang dari saluran reproduksi (ovulasi). Dalam hal ini, mekanisme kerja hormon PGF2α dalam proses ovulasi bekerjasama dengan
Luteinizing Hormone (LH) yaitu meningkatkan aktivitas enzim proteolitik di folikel sehingga menstimulasi inti sel telur bergerak dari tengah ke tepi sel dan selanjutnya melebur menuju kutub anima hingga telur siap diovulasikan (Broach 2009).
3 melepaskan gonadotropin (Lam 1995). Mengingat ovaprim dengan tingkat harga yang tinggi dan bukan merupakan produk dalam negeri, maka perlu dicari bahan alternatif yang dapat mengurangi ketergantungan pada ovaprim.
Berdasarkan pentingnya peranan Aromatase inhibitor dan oksitosin dalam proses vitelogenesis, ovulasi dan pemijahan, maka gabungan hormon tersebut serta dikombinasikan dengan ovaprim dan PGF2α diharapkan dapat menjadi
alternatif dalam pemijahan semi alami tanpa stripping pada ikan yang tidak memiliki refleks spawning alami di luar habitatnya. Respons ovulasi dan pemijahan ikan Patin tanpa stripping terhadap induksi hormon Aromatase inhibitor dan oksitosin serta dikombinasikan ovaprim dan PGF2α akan dievaluasi
berdasarkan mekanisme hormon plasma darah estradiol dan testosteron.
Perumusan Masalah
Reproduksi pada ikan, seperti pada vertebrata tingkat tinggi diatur oleh sistem endokrin reproduksi yang terdiri dari otak (hypothalamus), kelenjar pituitari dan gonad. Pada ikan, gonadotropin adalah hormon pituitari utama yang bertanggung jawab mengatur pematangan seksual dan perkembangan gamet (Swanson 2008). Sinyal dari lingkungan diluar musim pemijahan terkadang kurang mampu mengaktivasi hormon yang ada sehingga pemijahan belum bisa terlaksana secara alami. Penyuntikan kombinasi hormon Aromatase inhibitor dan oksitosin pada ikan patin ini diharapkan akan mampu menghambat kerja enzim aromatase yang dapat menghentikan produksi estradiol-17β. Sehingga kadarnya menurun dalam darah dan hati berhenti melepaskan vitelogenin. Pada saat proses vitelogenesis berhenti merupakan sinyal balik bagi hipofisis untuk segera memproduksi luteinizing hormone (LH) yang berperan dalam proses pematangan, selanjutnya pemberian oksitosin dapat membantu pelepasan sel telur sehingga terjadi pemijahan secara semi alami.
Kerangka Pemikiran
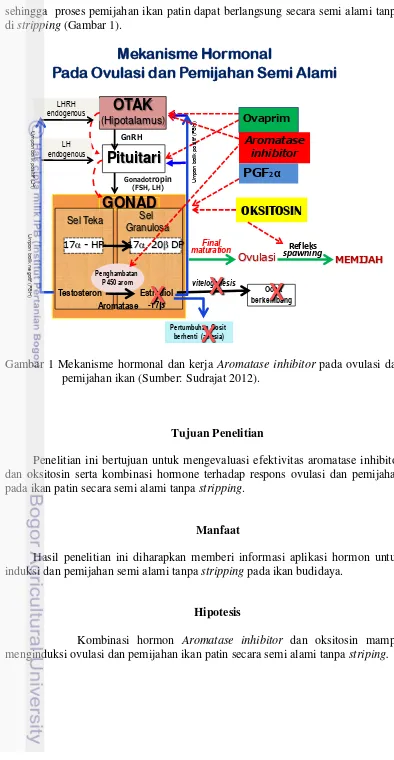
Mekanisme hormonal untuk vitelogenesis, pematangan serta ovulasi dan pemijahan melibatkan gonadothropin releasing hormone (Gn-RH), gonadotropin, estradiol-17β testosterone, 17α-20β dihidroksi progesteron, dan aromatase
inhibitor. Pemberian Aromatase inhibitor, ovaprim dan PGF2α pada induk matang
4
sehingga proses pemijahan ikan patin dapat berlangsung secara semi alami tanpa di stripping (Gambar 1).
Gambar 1 Mekanisme hormonal dan kerja Aromatase inhibitor pada ovulasi dan pemijahan ikan (Sumber: Sudrajat 2012).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi efektivitas aromatase inhibitor dan oksitosin serta kombinasi hormone terhadap respons ovulasi dan pemijahan pada ikan patin secara semi alami tanpa stripping.
Manfaat
Hasil penelitian ini diharapkan memberi informasi aplikasi hormon untuk induksi dan pemijahan semi alami tanpa stripping pada ikan budidaya.
Hipotesis
5 2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari sampai Mei 2014. Penelitian ini dilakukan di Balai Pengembangan Budidaya Air Tawar (BPBAT) Cijengkol, Sukamandi, Subang. Dan di Laboratorium Hormon Unit Rehabilitasi dan Reproduksi Departemen Klinik, Reproduksi dan Patologi Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Materi Uji
Ikan uji yang digunakan adalah ikan patin (Pangasianodon hypopthalmus) jantan dan betina yang siap memijah kira-kira berumur 1-2 tahun dengan bobot berkisar 2-5 kg/ekor. Setiap perlakuan terdiri dari 5 ekor jantan dan 5 ekor betina sebagai ulangan individu. Bahan hormonal sintetis yang digunakan berupa
Aromataseinhibitor, oksitosin, PGF2α, ovaprim dan NaCl.
Rancangan Penelitian
Induksi ovulasi dan pemijahan secara hormonal diberikan melalui penyuntikan kombinasi hormon yang terdiri dari Aromatase inhibitor, oksitosin serta penambahan ovaprim dan PGF2α. Sedangkan pada perlakuan kontrol terdiri
dari kontrol positif yaitu ovaprim dan kontrol negatif yaitu NaCl (Tabel 1). Tabel 1 Perlakuan induksi ovulasi dan pemijahan secara hormonal pada ikan Patin
Perlakuan Dosis Hormon per Kg berat badan ikan
P1 AI 50 ppm + Oksitosin 1 IU
P2 AI 50 ppm + Oksitosin 1 IU + Ovaprim 0.3 ml
P3 AI 50 ppm + Oksitosin 1 IU + Ovaprim 0.3 ml + PGF2α 500 μg
P4 (kontrol positif) Ovaprim 0.6 ml
P5 (kontrol negatif) NaCl 0.09 %
Prosedur Penelitian
Induksi ovulasi dan pemijahan semi alami
6
membesar dan warna daerah genital cenderung berwarna kuning bening. Pengamatan adanya telur dilakukan menggunakan kateter. Ikan betina yang sudah matang gonad ditandai dengan bagian perut atas (dibawah linea lateralis) yang membesar dan cenderung lembek, warna tubuh cendurung memudar.
Induk yang telah matang gonad segera dipindahkan kedalam bak fiber bulat dengan kapasitas volume air sebanyak 3000 L untuk persiapan pelaksanaan pemijahan semi alami. Induksi pemijahan semi alami dilakukan melalui penyuntikan secara intramuscular pada ikan uji jantan dan betina yang sudah matang gonad sesuai dengan rancangan sebelum percobaan dipasangkan selanjutnya ikan jantan dan betina dipasangkan dengan perbandingan 1:1 (1 ekor jantan dan 1 ekor betina). Sekitar 6-12 jam setelah pemasangan, dilakukan pengamatan kesiapan induk memijah. Ikan yang ovulasi dicatat waktunya sejak ikan tersebut disuntik hormon. Dalam wadah pemijahan diletakkan kaca untuk menampung telur-telur hasil pemijahan. Pengamatan adanya telur dilakukan pada dasar wadah pemeliharaan setelah 6 jam penyuntikan. Pengamatan dilanjutkan setiap 30 menit. Pengukuran diameter telur dilakukan sebelum penyuntikan dan saat ovulasi. Telur yang akan diamati ditambahkan larutan sierra untuk mempertahankan bentuk inti telur.
Pengukuran diameter telur menggunakan mikroskop yang dilengkapi dengan mikrometer (0,01 mm) merk UYCP-12. Sampel telur diambil dengan menggunakan kateter sebanyak 100 butir dalam setiap gonad yang diamati. Selanjutnya telur dipindahkan ke dalam akuarium inkubasi untuk diamati derajat pembuahan, derajat penetasan dan kelangsungan hidup larva selama 3 hari. Parameter kualitas air yang diamati terdiri dari disolved oxygen (DO), pH, dan suhu yang diukur setiap hari selama penelitian.
Analisis hormon estradiol dan testosterone plasma darah
Konsentrasi estradiol 17-β dan testosteron dalam darah diukur sebelum dilakukan penyuntikan hormon dan setelah pemijahan pada setiap perlakuan menggunakan 2 sampel ikan uji. Sampel darah diambil dari pangkal batang ekor sebanyak 3 mL dengan menggunakan jarum suntik yang telah diberi antikoagulan (natrium sitrat 3,8%). Sebelum dilakukan pengambilan darah, ikan percobaan terlebih dahulu dibius menggunakan anasthesi MS222, selanjutnya darah disentrifugasi dengan kecepatan 5000 rpm selama 15 menit, plasma darah diambil dan disimpan pada freezer bersuhu -20 0 C selama 24 jam selanjutnya dilakukan pengukuran konsentrasi hormon dalam plasma darah menggunakan metode Vidas ELISA kit untuk 17-estradiol (REF 30 330) dan testoteron.
Parameter Uji
1. Keberhasilan dan Lama Waktu Ovulasi
7 waktu ovulasi dimulai dari setelah dilakukan penyuntikan hormon hingga terjadinya ovulasi.
2. Tingkah laku Pemijahan Semi Alami
Pengamatan tingkah laku pemijahan semi alami dilakukan secara visual dengan mengamati secara langsung dan merekam proses pemijahan ikan Patin menggunakan kamera underwater.
3. Jumlah Telur yang di Ovulasikan (Spawned Eggs)
Pengamatan telur dilakukan pada dasar bak fiber setelah 6 jam penyuntikan. Pengamatan dilanjutkan setiap 30 menit. Selanjutnya, dilakukan pemijahan buatan atau dengan cara stripping, kemudian menghitung seluruh telur yang dikeluarkan (spawned eggs).
4. Derajat Pembuahan (FR)
Derajat pembuahan dihitung dengan membandingkan jumlah telur yang dibuahi dengan jumlah telur yang diovulasikan (dalam persen).
Jumlah telur yang dibuahi X 100% FR = Jumlah telur yang diovulasi
5. Derajat Penetasan (HR)
Derajat penetasan dihitung berdasarkan jumlah telur yang menetas dibandingkan dengan jumlah telur yang dibuahi (dalam persen).
Jumlah telur yang menetas X 100% HR = Jumlah telur yang dibuahi
6. Tingkat Kelangsungan Hidup Larva (SR)
Kelangsungan hidup larva dhitung berdasarkan jumlah larva hidup umur 3 hari dibandingkan dengan jumlah telur yang menetas (dalam persen).
Jumlah larva setelah 3 hari X 100% SR = Jumlah telur yang menetas
Analisis Data
8
3 HASIL DAN PEMBAHASAN
HASIL
Konsentrasi estradiol-17ß
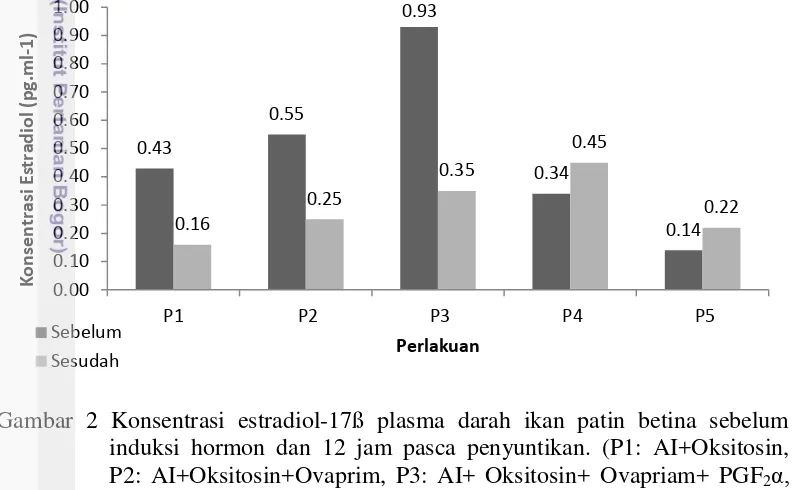
Konsentrasi hormon estradiol-17β plasma darah ikan patin betina pada perlakuan kombinasi hormon yang mengandung AI dan oksitosin (P1, P2 dan P3) sebelum penyuntikan dan sesudah ovulasi mengalami penurunan, sebaliknya pada perlakuan kontrol ovaprim dan NaCl (P4, P5) menunjukkan peningkatan (Gambar 2). Penurunan konsentrasi estradiol sesudah ovulasi menunjukkan fase final oosit maturation (FOM) yang akan segera diikuti dengan pemijahan. Pada perlakuan kombinasi empat hormon AI, oksitosin, ovaprim dan PGF2α (P3) menunjukkan
selisih konsentrasi estradiol sebelum dan sesudah ovulasi yang paling tinggi yaitu penurunan dari 0,93 ngmL-1 menjadi 0,35 ng/mL.
Gambar 2 Konsentrasi estradiol-17ß plasma darah ikan patin betina sebelum induksi hormon dan 12 jam pasca penyuntikan. (P1: AI+Oksitosin, P2: AI+Oksitosin+Ovaprim, P3: AI+ Oksitosin+ Ovapriam+ PGF2α,
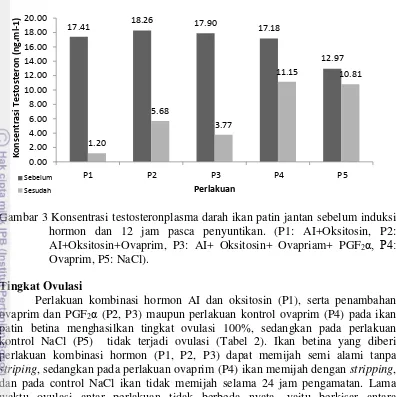
P4: Ovaprim, P5: NaCl) Konsentrasi testosteron
Konsentrasi hormon testosteron plasma darah ikan patin jantan yang diinduksi kombinasi hormon mengalami penurunan sebelum perlakuan dan sesudah ovulasi (Gambar 3). Pada perlakuan kombinasi hormon AI dan oksitosin (P1), serta kombinasi dengan ovaprim dan PGF2α (P2, P3) menunjukkan
9
Gambar 3 Konsentrasi testosteronplasma darah ikan patin jantan sebelum induksi hormon dan 12 jam pasca penyuntikan. (P1: AI+Oksitosin, P2:
patin betina menghasilkan tingkat ovulasi 100%, sedangkan pada perlakuan kontrol NaCl (P5) tidak terjadi ovulasi (Tabel 2). Ikan betina yang diberi perlakuan kombinasi hormon (P1, P2, P3) dapat memijah semi alami tanpa
striping, sedangkan pada perlakuan ovaprim (P4) ikan memijah dengan stripping, dan pada control NaCl ikan tidak memijah selama 24 jam pengamatan. Lama waktu ovulasi antar perlakuan tidak berbeda nyata, yaitu berkisar antara 12,35±4,05 jam sampai 15,20±2,25 jam.
Tabel 2. Tingkat ovulasi ikan patin siam (P. hypopthalamus) betina pada induksi ovulasi dan pemijahan semi alami secara hormonal
Perlakuan P5 4,04±0,93 0 Tidak ovulasi* Tidak ovulasi* Tidak memijah
Keterangan: P1: AI+Oksitosin, P2: AI+Oksitosin+Ovaprim, P3: AI+ Oksitosin+ Ovapriam+ PGF2α, P4: Ovaprim, P5: NaCl; (*Pengamatan dilakuan 24 jam, n= jumlah ikan)
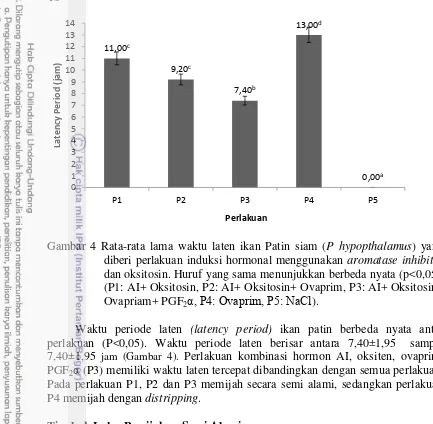
Waktu Laten (Latency Period)
Perhitungan waktu laten pada penelitian ini yaitu jarak waktu dari dilakukannya induksi kombinasi hormone perlakuan hingga terjadinya ovulasi yang dideteksi dengan adanya keberhasilan telur.
10
Gambar 4 Rata-rata lama waktu laten ikan Patin siam (P hypopthalamus) yang diberi perlakuan induksi hormonal menggunakan aromatase inhibitor
dan oksitosin. Huruf yang sama menunjukkan berbeda nyata (p<0,05). (P1: AI+ Oksitosin, P2: AI+ Oksitosin+ Ovaprim, P3: AI+ Oksitosin+ Ovapriam+ PGF2α, P4: Ovaprim, P5: NaCl).
Waktu periode laten (latency period) ikan patin berbeda nyata antar perlakuan (P<0,05). Waktu periode laten berisar antara 7,40±1,95 sampai 7,40±1,95 jam (Gambar 4). Perlakuan kombinasi hormon AI, oksiten, ovaprim, PGF2α (P3) memiliki waktu laten tercepat dibandingkan dengan semua perlakuan.
Pada perlakuan P1, P2 dan P3 memijah secara semi alami, sedangkan perlakuan P4 memijah dengan distripping.
Tingkah Laku Pemijahan Semi Alami
Pengamatan tingkah laku pemijahan semi alami yang dilakukan secara visual memperlihatkan tingkah laku ikan saat pemijahan semi alami. Ikan jantan bergerak aktif disekitar ikan betina sambil menggetarkan seluruh bagian tubuh dan mengeluarkan bunyi-bunyian tertentu. Ikan betina dan ikan jantan akan sama-sama melepaskan sperma dan telur. Telur akan menempel pada subtrat di dasar wadah pemijahan (Gambar 5).
Gambar 5 Pemijahan semi alami pada ikan Patin yang diberi perlakuan kombinasi hormon AI, oksitosin, ovaprim dan PGF2α. Anak panah menunjukkan
11 Diameter Telur
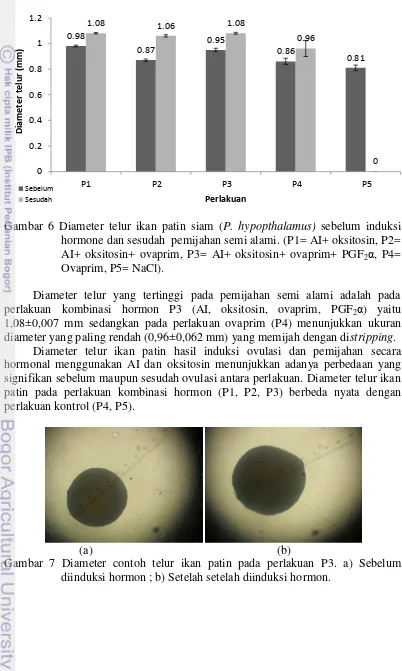
Rata-rata diameter telur sebelum diberi perlakuan induksi hormon dan setelah pemijahan mengalami peningkatan pada semua perlakuan. Pada perlakuan kontrol NaCl (P5) tidak memijah, diameter telur sebelum penyuntikan 0,81±0,022 mm (Gambar 6).
Gambar 6 Diameter telur ikan patin siam (P. hypopthalamus) sebelum induksi hormone dan sesudah pemijahan semi alami. (P1= AI+ oksitosin, P2= AI+ oksitosin+ ovaprim, P3= AI+ oksitosin+ ovaprim+ PGF2α, P4=
Ovaprim, P5= NaCl).
Diameter telur yang tertinggi pada pemijahan semi alami adalah pada perlakuan kombinasi hormon P3 (AI, oksitosin, ovaprim, PGF2α) yaitu
1,08±0,007 mm sedangkan pada perlakuan ovaprim (P4) menunjukkan ukuran diameter yang paling rendah (0,96±0,062 mm) yang memijah dengan distripping.
Diameter telur ikan patin hasil induksi ovulasi dan pemijahan secara hormonal menggunakan AI dan oksitosin menunjukkan adanya perbedaan yang signifikan sebelum maupun sesudah ovulasi antara perlakuan. Diameter telur ikan patin pada perlakuan kombinasi hormon (P1, P2, P3) berbeda nyata dengan perlakuan kontrol (P4, P5).
(a) (b)
Gambar 7 Diameter contoh telur ikan patin pada perlakuan P3. a) Sebelum diinduksi hormon ; b) Setelah setelah diinduksi hormon.
12
Diameter contoh telur ikan patin dari perlakuan kombinasi hormon P3 menunjukkan adanya perkembangan sebelum penyuntikan (Gambar 7a) dengan setelah ovulasi (Gambar 7b).
Jumlah Telur yang di Ovulasikan (Spawned Eggs)
Rata-rata jumlah telur yang berhasil dipijahkan induk betina ikan patin antar perlakuan induksi hormon berbeda nyata (p<0.05). Pada perlakuan P3 yang diinduksi dengan kombinasi hormon (AI, oksitosin, ovaprim, PGF2α) dan
memijah semi alami (tanpa stripping) menghasilkan jumlah telur yang tertinggi (145865±10059 butir) dibandingkan dengan perlakuan P1 (aromatase inhibitor dan oksitosin) dan P4 (ovaprim) yang memijah dengan stripping. Sedangkan pada perlakuan P2 (AI, oksitosin, ovaprim) ikan memijah semi alami menghasilkan telur yang paling rendah (108421±28548 butir), dan pada kontrol NaCl (P5) tidak terjadi pemijahan (Gambar 8).
Gambar 8 Rata-rata jumlah telur ikan patin siam (P. hypopthalamus) yang dihasilkan pada induksi pemijahan semi alami secara hormonal. (Huruf superskrip yang berbeda menunjukkan perbedaan nyata (p<0,05);
Derajat Pembuahan
Perlakuan induksi hormon memberikan pengaruh yang berbeda nyata antar perlakuan terhadap derajat pembuahan telur (p<0.05). Derajat pembuahan telur ikan patin pada perlakuan kombinasi hormon P2 (AI, oksitosin, ovaprim) dan P3 (AI, oksitosin, ovaprim, PGF2α) lebih tinggi dibandingkan perlakuan P1 (AI,
13
Gambar 9 Rata-rata derajat pembuahan telur ikan patin siam (P. hypopthalamus) pada induksi ovulasi dan pemijahan semi alami secara hormonal. Huruf superskrip yang berbeda menunjukkan perbedaan nyata (p<0.05). (P1=AI+ oksitosin, P2= AI+ oksitosin+ ovaprim, P3=AI+ oksitosin+ ovaprim+ PGF2α, P4= Ovaprim, P5= NaCl)
Derajat Penetasan
Induksi pemijahan semi alami secara hormonal memberikan pengaruh yang nyata terhadap derajat penetasan telur (p<0.05), kecuali pada perlakuan kombinasi hormon yang mengandung AI dan oksitosin (P1) dan kombinasi AI, oksitosin, ovaprim (P2). Pada perlakuan P3 dengan kombinasi 4 hormon (AI, oksitosin, ovaprim, PGF2α) menunjukkan tingkat penetasan yang tertinggi yaitu
98,60±0,54% dan yang terendah adalah pada perlakuan ovaprim (P4) yaitu 93,60±207% (Gambar 10).
14
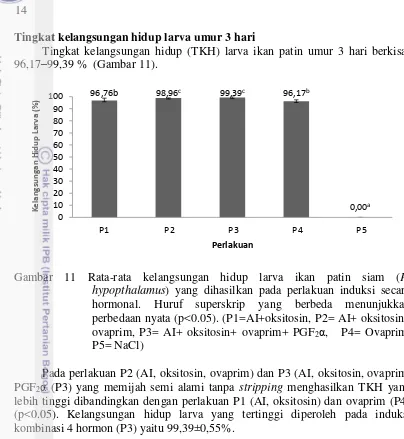
Tingkat kelangsungan hidup larva umur 3 hari
Tingkat kelangsungan hidup (TKH) larva ikan patin umur 3 hari berkisar 96,17–99,39 % (Gambar 11).
Gambar 11 Rata-rata kelangsungan hidup larva ikan patin siam (P. hypopthalamus) yang dihasilkan pada perlakuan induksi secara hormonal. Huruf superskrip yang berbeda menunjukkan perbedaan nyata (p<0.05). (P1=AI+oksitosin, P2= AI+ oksitosin+ ovaprim, P3= AI+ oksitosin+ ovaprim+ PGF2α, P4= Ovaprim,
P5= NaCl)
Pada perlakuan P2 (AI, oksitosin, ovaprim) dan P3 (AI, oksitosin, ovaprim, PGF2α (P3) yang memijah semi alami tanpa stripping menghasilkan TKH yang
lebih tinggi dibandingkan dengan perlakuan P1 (AI, oksitosin) dan ovaprim (P4) (p<0.05). Kelangsungan hidup larva yang tertinggi diperoleh pada induksi kombinasi 4 hormon (P3) yaitu 99,39±0,55%.
Kualitas Air
Kualitas air diamati pada saat sebelum dan sesudah pemijahan serta pada saat pemeliharaan larva. Parameter kualitas air yang diamati diantaranya: kandungan oksigen terlarut (DO meter mg/L), temperatur air (termometer (oC)) dan nilai pH (pH meter). Kualitas air yang diamati selama penelitian diperoleh hasil sebagaimana di sajikan pada Tabel 3.
15 PEMBAHASAN
Pemijahan merupakan bagian dari reproduksi ikan yang menjadi mata rantai daur hidup kelangsungan hidup spesies. Penambahan populasi ikan bergantung kepada berhasilnya pemijahan. Pada ikan betina, induksi pemijahan dilakukan pada akhir vitelogenesis untuk menginduksi germinal vesicle breakdown (GVBD) yang merupakan akhir pematangan sel telur dan ovulasi serta pemijahan. Induksi pemijahan banyak dilakukan dengan menciptakan kondisi lingkungan sesuai dengan kondisi di alam sebagai persyaratan untuk pemijahan. Sedangkan untuk merangsang pemijahan walaupun dalam kondisi yang kurang tepat maka dilakukan dengan pendekatan hormonal. Kadar hormon gonadotropin yang relatif stabil bahkan cenderung menurun sepanjang siklus pemijahan juga merupakan fenomena yang menarik karena keberhasilan pemijahan secara tidak langsung memerlukan induksi dari hormon gonadotropin (Yaron, 1995 ; Barnier et al.
2009). Proses pematangan gonad diprediksi melalui kadar testosteron dan estradiol-17β plasma terhadap perkembangan oosit (Mackenzie et al. 1989). Oleh karena itu kadar steroid plasma dapat digunakan sebagai indikator dari pematangan gonad (Zairin et al. 1992).
Estradiol adalah steroid yang sangat penting terutama untuk ikan betina yang sedang mengalami proses vitelogenesis. Konsentrasi estradiol merupakan jumlah kandungan hormon estradiol pada ikan betina pada plasma darah untuk merangsang hati mensintesis vitelogenin. Pada perlakuan kombinasi hormon AI, oksitosin, ovaprim dan PGF2α (P1, P2, P3) terjadi penurunan nilai konsentrasi
estradiol dari sebelum dan pada saat sesudah ovulasi. Penurunan konsentrasi estradiol-17β menunjukkan ikan siap untuk ovulasi dan menandakan ikan siap memijah. Estradiol-17ß merangsang vitelogenesis di hati, dan dapat memberikan rangsangan balik terhadap hipofisa serta hipotalamus ikan untuk menghasilkan gonadotropin. Ransangan terhadap hipotalamus adalah memacu produksi GnRH. GnRH yang dihasilkan ini bekerja untuk merangsang hipofisa untuk melepaskan gonadotropin dan selanjutnya berperan dalam proses biosintesis estradiol-17ß pada lapisan granulose. Menurut Lee dan Young (2002), perubahan konsentrasi estradiol-17β dalam darah ikan betina berhubungan dengan perkembangan oosit dan peningkatan gonadosomatik indeks. Hormon estradiol pada ikan betina berperan merangsang hati untuk mensintesis vitelogenin yang selanjutnya melalui aliran darah menuju gonad dan diserap oleh lapisan folikel oosit sehingga tumbuh membesar kemudian berhenti perkembangannya apabila oosit telah mencapai ukuran maksimum. Pada umumnya konsentrasi estradiol-17β menurun pada saat ikan betina siap ovulasi dan pemijahan (Martin 2004).
16
Pada perlakuan kombinasi hormon AI, oxytocin, ovaprim dan PGF2α (P1,
P2, P3) menunjukkan bahwa induk ikan Patin betina yang di induksi dengan perlakuan ini dapat terjadi ovulasi dan pemijahan semi alami (tanpa stripping) sedangkan induk ikan patin betina yang hanya diinduksi dengan hormon tunggal ovaprim harus dipijahkan dengan melakukan stripping.
Testosteron dibutuhkan untuk melengkapi proses spermatosit bersama dengan sekresi pituitary dari ICSH (Intestill Cell stimulating Hormone) 1 fase dan sangat berperan dalam proses pematangan oosit menuju fase Germinal Vesicle Breakdown (GVBD). Fase ini merupakan tahapan menjelang ovulasi dimana inti sel terlihat berada 1 tahap lebih dekat ke korion telur. Testosteron merupakan steroid C19 yang dapat merangsang terjadinya GVBD pada konsentrasi yang tinggi (Basuki 2007).
Pada perlakuan kombinasi hormon AI, oksitosin, ovaprim dan PGF2α (P1,
P2, P3, P4, P5) terlihat adanya penurunan nilai testosteron. Pada perlakuan AI dan oksitosin (P1), serta kombinasi dengan ovaprim dan PGF2α (P2, P3) menunjukkan
penurunan konsentrasi testosteron yang lebih besar dibandingkan kontrol ovaprim dan NaCl (P4, P5). Menurut Evans (2000) testosteron plasma darah meningkat saat pematangan gonad lalu menurun saat pemijahan. Demikian pula disampaikan oleh Rottmann et al. (2001) dan Yank (2007) bahwa konsentrasi estradiol dan testosteron pada ikan secara alami mengalami penurunan setelah matang gonad. Denning dan Wathes (1994) juga menyampaikan bahwa testosteron plasma darah mulai meningkat mulai matang dan berkembang lalu menurun lagi selama dewasa, pemijahan dan tahapan menghabiskan.
Nagahama et al. (1991) menyampaikan bahwa kadar konsentrasi testosteron relatif lebih rendah selama spermatogenesis kemudian meningkat tajam pada waktu spermiation dan menjadi lemah setelah pemijahan dan selama periode dewasa. Ismail et al. (2011) mengungkapkan bahwa konsentrasi estradiol dan testosteron hormon lainnya pada ikan mengalami penurunan setelah matang gonad. Perangsangan perkembangan sperma tidak terlepas dari peran serta hormon androgen, yakni testosteron. Sedangkan, testosteron memegang peranan utama pada spermatogenesis dan spermiasi adalah 11-Ketostestosteron (11-KT). Nilai konsentrasi testosteron dipengaruhi oleh umur dan kematangan spermatozoa, temperatur dan faktor-faktor lingkungan lain sperti ion-ion, pH dan osmolalitas. Sedangkan kecepatan geraknya tergantung spesies (Glasser 2004).
Penambahan AI sebagai inhibitor enzim aromatase dapat membantu meningkatkan jumlah testosteron dalam gonad sehingga terjadi percepatan GVBD pada oosit. Mekanisme yang terjadi pada ikan betina maupun jantan yang diberi perlakuan Aromatase inhibitor menunjukkan terjadi penurunan plasma estradiol dan kosentrasi vitelogenin pada ikan betina (Casperdan Mitwally 2006).
Dari hasil penelitian menunjukkan bahwa perlakuan kombinasi hormon AI, oksitosin, ovaprim dan PGF2α (P1, P2, P3) dan perlakuan kontrol ovaprim (P4)
mampu memberikan rangsangan sehingga terjadi ovulai pada ikan patin dengan tingkat keberhasilan hingga 100% namun pada perlakuan kontrol NaCl (P5) tidak terjadi ovulasi dan pemijahan.
17 laten dapat dilihat pada Tabel 2. Masa laten tercepat diperoleh pada perlakuan AI, oksitosin, ovaprim dan PGF2α (P3) yaitu 7,40 ± 1,95 jam. Pada perlakuan P1, P2
dan P3 induk betina dan jantan yang diinduksi dengan perlakuan kombinasi hormon AI, oksitosin, ovaprim dan Pgf2α berhasil memijah secara semi alami (tanpa stripping) sedangkan pada perlakuan ovaprim (P4) ikan memijah dengan cara distripping. Berdasarkan hasil uji lanjut diketahui bahwa perlakuan P3 berbeda nyata (p<0,05) dibandingkan dengan semua perlakuan .
Proses pematangan oosit terjadi karena rangsangan Leutinizing Hormone (LH) pada folikel, kemudian terjadi proses pembentukan hormon steroid, pada sel teka membentuk 17α-hidroksiprogesteron dan pada sel granulose terbentuk 17α, 20β dihidroksi dan hormon steroid yang terakhir inilah yang mempunyai peranan sebagai mediator kematangan oosit lebih lanjut (Chen dan Fernald 2008). FSH merangsang sekresi estrogen dari folikel sehingga menyebabkan folikel berkembang dan membesar dalam ovari. Bila kadar estrogen meningkat optimum, produksi FSH akan menurun , dan produksi LH meningkat yang menyebabkan folikel anti klimaks dan terjadilah ovulasi (Nagahama 1995). Aktivitas hormon oksitosin meningkat pada saat ovulasi dan berperan penting dalam proses pemijahan (Haraldsen et al. 2001).
Aromatase inhibitor (AI) mampu menghambat produksi estrogen dengan menghambat proses aromatase pada hipothalamus-hipophisis-gonad axis dari umpan balik negatif estrogen, sehingga menyebabkan sekresi FSH meningkat dan menyebabkan rangsangan yang menghasilkan perkembangan ovari hingga terjadinya ovulasi (Casper dan Mitwally 2006), Menurut Basuki (2007), penambahan aromatase inhibitor (AI) juga memungkinkan kerja LH dalam menurunkan enzim aromatase tadi akan diperkuat oleh AI, sehingga peranan LH dalam proses ovulasi akan lebih efisien, dan AI terbukti dapat digunakan sebagai induksi ovulasi. Sedangkan penambahan oxytocin dapat menyebabkan induk ikan patin melakukan pemijahan secara semi alami karena oksitosin berperan dalam merangsang otot polos sehingga menyebabkan kontraksi dan ikan mampu memijah secara alami.
Ovulasi merupakan proses keluarnya sel telur folikel ke dalam lumen ovarium atau rongga perut. Nagahama (1987) menyatakan bahwa proses ovulasi terdiri dari beberapa tahapan. Pada tahap awal lapisan folikel melepaskan diri dari oosit, pada saat akan terjadi ovulasi, mikrofili pada kedua permukaan tersebut sedikit demi sedikit terpisah, hal tersebut dimungkinkan dilakukan oleh enzim proteolitik. Dalam setiap perkembangan secara biologi termasuk oosit ikan, perkembangan antara satu fase ke fase yang berikutnya membutuhkan waktu tertentu. Brooks et al. (1997) menjelaskan bahwa pada oosit yang telah matang, sitoplasma akan menjadi bening, oil droplet bergabung menjadi satu dan berukuran besar serta terjadi breakdown germinal vesikel.
Dari hasil pengamatan pada pemijahan induksi kombinasi hormon AI, oksitosin, ovaprim, PGF2α (P1, P2, P3) dan dan perlakuan kontrol (P4) rata-rata
18
oksitosin, ovaprim) ikan memijah semi alami menghasilkan telur yang paling rendah (108421±28548 butir), dan pada kontrol NaCl (P5) tidak terjadi pemijahan. Berdasarkan hasil uji lanjut diketahui bahwa perlakuan P3 dan P4 berbeda nyata (p<0,05) dibandingkan dengan perlakuan P1, P2 dan P5.
Pemberian AI dapat mempercepat dan memicu terjadinya ovulasi. Hal ini dikarenakan, AI berperan dalam menurunkan aktivitas aromatase dalam gonad akibatnya produksi estrogen-17β turun dan meningkatkan produksi testosteron, hal tersebut merupakan awal sinyal balik positif terhadap LH sehingga proses pematangan oosit akan berlangsung lebih cepat. Dari hasil penelitian dapat dilihat pengaruh induksi kombinasi hormon dalam proses akhir ovulasi sangat berperan. Kombinasi yang diberikan merangsang hipofisa untuk mensekresikan gonadotropin LH membantu memperlancar sekresi gonadotropin untuk permatangan oosit. Pemberian AI juga mengakibatkan kerja enzim aromatase terhambat, akibatnya sintesis estrogen dalam pengembangan oosit semakin menurun. Dengan turunnya produksi estrogen maka diikuti dengan meningkatnya produksi testosteron sehingga terjadilah umpan balik positif terhadap gonadotropin terutama LH. Sehingga kerja LH dari pituitari ditambah dengan adanya efek Aromatase inhibitor pada gonad yang juga menyebabkan terjadinya umpan positif pada LH akan semakin mempercepat pematangan oosit hingga nanti berakhir pada ovulasi.
Pembuahan atau fertilisasi adalah bersatunya oosit (telur) dengan sperma berbentuk zigot, dimana asosiasi ini merupakan mata rantai awal dan sangat penting pada proses fertilisasi. Pada pembuahan ini terjadi percampuran inti sel telur dan inti sperma. Kedua inti ini masing-masing mengandung gen (pembawa sifat keturunan) sebanyak satu set (haploid). Hanya satu sperma yang dibutuhkan untuk membuahi satu sel telur (monospermi).
Ada beberapa hal yang mendukung berlangsungnya pembuahan, yakni spermatozoa yang tadinya tidak bergerak dalam cairan plasmanya, akan bergerak setelah bersentuhan dengan air dan dengan bantuan ekornya, bergerak ke arah telur. Derajat pembuahan sering digunakan sebagai parameter untuk mendeteksi kualitas telur. Fertilisasi dan proses aktivasi pada telur ikan menjadi penting untuk beberapa perkembangan embrio. Selama fertilisasi dan aktivasi, pada telur-telur ikan teleost terjadi reaksi kortikal. Alveoli kortikal melebur dan melepaskan kandungannya (koloids) dari lapisan kortikal, dan selanjutnya memulai pembentukan ruang perivitelin. Kortikal alveoli muncul setelah terjadinya fertilisasi dan reaksi kortikal yang tidak lengkap menunjukkan kualitas telur yang jelek. Tidak lengkapnya proses aktivasi ini menyebabkan ruang perivitelin sempit sehingga diameter telur tidak berkembang (Kjorsvik et al. 1990).
Berdasarkan hasil penelitian diketahui hasil derajat pembuahan telur ikan Patin tertinggi terdapat pada induk ikan patin yang diinduksi dengan perlakuan P3 yaitu sebesar 99,60±0,55 % dan derajat pembuahan terendah terjadi pada ikan yang diinduksi perlakuan P4 yaitu 94,48±2,71%. Selanjutnya P1 91,08±1,13% dan P2 98,97±0,72%. Dalam hal ini diduga karena adanya pengaruh efektivitas hormon yang diberikan pada perlakuan induksi kombinasi hormon Aromatase inhibitor, oksitosin, ovaprim dan juga PGF2α saling bekerjasama dalam proses
fertilisasi. Tunner dan Bagnara (1998) menyatakan bahwa mekanisme kerja hormon Pgf2α dalam proses ovulasi bekerjasama dengan Luteinizing Hormone
19 menstimulasi inti sel telur bergerak dari tengah ke tepi sel dan selanjutnya melebur menuju kutub anima hingga telur siap diovulasikan.
Fase pembentukan kuning telur dimulai sejak terjadinya penumpukan bahan-bahan kuning telur dalam sel telur dan berakhir setelah sel telur mencapai ukuran tertentu atau nukleolus tertarik ke tengah nukleus. Setelah fase pembentukan kuning telur berakhir, sel telur tidak mengalami perubahan bentuk selama beberapa saat, tahap ini disebut fase istirahat (dorman).
Pada saat menjelang ovulasi akan terjadi peningkatan diameter oosit karena diisi oleh massa kuning telur yang homogen akibat adanya peningkatan kadar estrogen dan vitelogenin. Lee dan Young (2002) menyatakan ukuran telur juga berperan dalam kelangsungan hidup ikan. Induk yang pantas dipijahkan adalah induk yang telah melewati fase pembentukan kuning telur (fase vitellogenesis) dan masuk ke fase dorman. Apabila rangsangan diberikan pada saat ini, maka akan menyebabkan terjadinya migrasi inti ke perifer, kemudian inti pecah atau melebur pada saat pematangan oosit, ovulasi (pecahnya folikel), dan oviposisi (Lam 1995). Namun apabila kondisi lingkungan tidak cocok dan rangsangan tidak tersedia maka telur dorman tersebut akan mengalami degenerasi (rusak) lalu diserap kembali oleh lapisan folikel melalui atresia (Mylonas dan Zohar 2001).
Perkembangan telur ikan secara umum meliputi empat tahap, yakni ; awal pertumbuhan, tahap pembentukan kantung kuning telur, tahap vitolegenesis dan tahap pematangan. Vitolegenesis dicirikan oleh bertambah banyaknya volume sitoplasma yang berasal dari luar sel, yakni kuning telur atau disebut juga vitolegenin. Vitelogenin disintesis oleh hati dalam bentuk lipophosphoprotein-calsium komplek dan hasil mobilisasi lipid dari lemak visceral. Selanjutnya kuning telur dibawa oleh darah dan ditransfer ke dalam sel telur secara endositosis (Lubzens et al. 2010). Dalam vitelogenesis yang sedang berkembang, sitoplasma telur yang matang ruangannya diisi oleh bola-bola kecil kuning telur saling bersatu dengan yang lainnya membentuk menjadi massa kuning telur. Tahap akhir dari perkembangan telur adalah tahap pematangan, yakni tahap pergerakan germinal vesikel ke tepi dan akhirnya melebur (germinal vesicle break down) selanjutnya membentuk pronuklei dan polar bodi II (Patino dan Sullivan 2003).
Ukuran telur berkorelasi dengan ukuran larva. Larva yang besar lebih tahan tanpa pakan dibandingkan dengan larva yang kecil yang ditetaskan dari telur yang kecil (Kamler 1992). Hubungan positif antara ukuran larva dan ukuran telur telah dilaporkan untuk Salmon salar, Onchorhynchus mykiss, dan turbot
(Scopththalmus maximus. L) (Kjorsvik et al. 1990).
Beberapa peneliti menunjukkan bahwa telur yang berukuran besar menghasilkan kelangsungan hidup yang lebih tinggi. Kamler (1992) mengajukan sebuah persamaan kelangsungan hidup untuk ikan pelagis laut, laju mortalitas telur dan larva berbanding terbalik dengan ukuran telur. Bila tidak ada makanan eksternal, larva yang lebih besar yang berasal dari telur yang besar dapat bertahan hidup lebih lama dibanding larva yang berasal dari telur yang kecil. Pada kondisi yang baik seperti di pembenihan, ukuran telur tidak memberikan dampak secara langsung pada kelangsungan hidup dan pertumbuhan pada ikan Rainbow trout Salmo salar catfish Clariasmacrocepalus dan carp (Kjorsvik et al. 1990).
20
terhenti pada waktu oosit mencapai ukuran maksimal atau telur mencapai kematangan. Selanjutnya telur memasuki masa dorman menunggu sinyal lingkungan untuk ovulasi dan pemijahan (Lubzens et al. 2010).
Menurut Zairin (2003) umumnya ikan akan terus menerus memijah setelah pertama kali matang gonad, namun bergantung kepada daur pemijahannya, ada yang satu tahun sekali, beberapa kali dalam satu tahun, dan sebagainya. Beberapa faktor yang mempengaruhi dan menentukan daur reproduksi antara lain adalah suhu, oksigen terlarut dalam perairan dan hormon yang berperan dalam reproduksi yang dapat memacu organ-organ reproduksi berfungsi. Umur pada awal reproduksi bervariasi terhadap jenis kelamin. Bagi ikan jantan maupun betina, umur pertama kali memijah bergantung kepada kondisi lingkungan yang sesuai. Adashi (1996) menambahkan pituitari (hipofisis) anterior dari ikan teleostei berisi bermacam-macam sel endokrin di bawah kendali hipotalamus, hormon release trophic dan memainkan peran utama dalam reproduksi ikan, tingkah laku sosial ikan dan pertumbuhan ikan.
Tingkah laku pemijahan dapat memberikan pesan-pesan tertentu, antara lain adalah memberi tanda-tanda pada betina bahwa jantan tersebut telah siap untuk kawin. Masa reproduksi steroid yang dihasilkan gonad memegang peranan penting dalam sifat seksual sekunder. Semua tingkah laku ikan itu merupakan hasil sejumlah rangsangan motoris yaitu rangsangan eksternal dan rangsangan internal yang berasal dari sekresi hormon. Rangsangan luar berasal dari berbagai macam sumber seperti faktor lingkungan, zat kimia dan lain-lain yang dimediasikan melalui organ-organ sensori dan visual (Jones 1997). Ikan memperlihatkan suatu tindakan yang fenomenal yang dinamik setiap jenis. Ikan mempunyai cara yang berbeda-beda dalam tingkah laku pemijahan. Dalam tingkah laku pemijahan ikan Patin jantan dan betina dewasa sama-sama melepaskan sperma dan telur melalui bermacam cara agar terjadi pembuahan dengan tingkat keberhasilan yang tinggi. Ketepatan waktu dalam proses pelepasan sperma dan telur agar pembuahan dapat berhasil dengan baik. Individu jantan dari setiap jenis ikan mempunyai tanda-tanda atau sinyal tersendiri yang hanya dimengerti oleh betina dari jenisnya. Begitu pula ikan betina mempunyai sinyal-sinyal khusus yang hanya dimengerti oleh individu jantannya (Patent 1976).
Kualitas air selama proses pemijahan induk dan pemeliharaan larva ikan patin menunjukkan kisaran yang masih bisa di toleransi ikan. Kandungan oksigen terlarut berkisar 5,4-6,5 mg/L, temperatur air 27-30 oC dan pH 7-7,5. Menurut Boyd (1990), pH yang sesuai untuk kelayakan hidup ikan budidaya berkisar antara 6,5-9,0, DO 5,6-9 mg/L, suhu 25-30°C.
4 SIMPULAN DAN SARAN
Simpulan
Induksi kombinasi hormon menggunakan Aromatase inhibitor dan
21 dan pemijahan semi alami pada ikan patin (Pangasianodon hypopthalmus) tanpa
stripping
Saran
1. Kombinasi hormon aromatase inhibitor (AI) dan oksitosin dapat menjadi alternatif menggantikan ovaprim untuk induksi ovulasi dan pemijahan tanpa striping.
2. Kombinasi hormon aromatase inhibitor (AI), oksitosin, oksitosin, ovaprim dan PGF2αdapatdigunakan untuk mempercepat proses induksi ovulasi.
DAFTAR PUSTAKA
Adashi EY, 1996. Ovulation induction: Clomiphene Citrate. In: Reproductive endocrinology, surgery and teknology. Philadelphia: Lippincott-Raven. Pp1181-1206.
Afonso LOB, Iwama GK, Smith J, Donaldson EM. 1999. Effect Of Aromatase Inhibitor Fadrozol On Plasma On Plasma Sex Steroid Secretion and Ovulation Rate In Female Coho Salmon, Onchorhynchus kisutch Close To Final Maruration. Gen Comp Endocrinol 133: 221-229.
Basuki F. 2007. Optimalisasi Pematangan Oosit dan Ovulasi pada Ikan Mas Koki (Carassius auratus) melalui Penggunaan Inhibitor Aromatase. Disertasi. Sekolah Pascasarjana. Institut Pertanian Bogor.
Barnier NJ, Kraak GV, Farrel, Brauner CJ. 2009. Fish Neuroendocrinology. In : Fish hysilogy Vol 28. By : Farrel AP and Brauner CJ. First Edition Academic Press. London.
Broach J. 2009. Effects of steroid and prostaglandin injections on hybridization success between female channel catfish and male blue catfish. [Thesis]. The Graduate Faculty of Auburn University, Auburn, Alabama.
Boyd CE. 1990. Water Quality Management In Pond Fish. Research and Development Series No. 22. International for Aquaculture. Agriculture Experiment Station, Auburn Alabama
Brooks S, Tyler CR, Sumpter JP. 1997. Egg quality in fish: what makes a good eggs. Rev in Fish Biology and Fisheries 7: 387-416.
Casper R, Mitwally MFM. 2006. Aromatase Inhibitor for Ovulation Induction. Clinic Endocrinol Metabol. 91. 3: 760-771
Chen CC, Fernald D. 2008. GnRH and RnRH reseptors: distribotion, function and evolution. Jurnal of fish biology. 73, 1099.1120.
Denning-Kendall PA, Wathes DC, 1994. Acute effects of prostaglandin F2α,
luteinizing hormone, and estradiol on second messenger systems and on the secretion of oxytocin and progesterone from granulosa and earlyluteal cells of the ewe. Biol. Reprod. 50, 765–773
Dhewantara L. 2013. Induksi Ovulasi dan Pemijahan pada Ikan Patin Siam (Pangasianodon hypothalmus) dengan Manipulasi Hormonal. [Tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor
22
Ernawati Y. 1990. Penggunaan Prostaglandin sebagai Induksi Ovulasi Ikan Lele Dumbo (Clarias gariepinus). Lembaga Penelitian Universitas Riau. Pekanbaru.46 hal.
Evans DH. 2000. The Physiology of Fishes. New York. CRC Press. Inc
Farastuti ER. 2014. Induksi Maturasi, Ovulasi Dan Pemijahan Pada Ikan Torsoro (Torsoro) Menggunakan Kombinasi Hormon. [Tesis]. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor
Fujaya Y. 2004. Fisiologi ikan: Dasar pengembangan teknik perikanan. PenerbitRineka Jaya, Jakarta.
Glasser F, Mikolajczyk T, Jalabert B, Baroiller JF, Breton F. 2004. Temperature effects along the reproductive axis during spawning induction of grass carp (Ctenopharyngodon idella). General and Comparative Endocrinology, 136:171-179
Haraldsen L, Veronica SL, Goran E. 2001. Oxytocin stimulates cerebral blood flow in rainbow trout (Oncorhynchus mykiss) through a nitric oxide dependent mecha nism. Nilsson Division of General Physiology, Department of Biology, University of Oslo. Norway. Brain Research 929 (2002) 10–14
Harker K. 1992. Pembiakan Kap dengan menggunakan ovaprim di India. Warta Akualulture. Volume 2, No. 3.
Hopfer, Pharmd JD. Hazand, Vallerand A, 2004. Pedoman Obat untuk Perawat Edisi 4. Jakarta: Penerbit EGC.
Ismail MFS, Siraj SS, Daud SK, Harmin SA. 2011. Association of annual hormone profile with gonad maturity of mahseer (Tor tambroides) in captivity. General and Comparative Endocrinology,170: 125-130.
Jones RE. 1997. Ovulation: Insights about the mechanisms based on a comparative approach, in: Norris, D.O., Jones, R.E. (Eds.), Hormones and reproduction in fishes, amphibians, and reptiles. Plenum Press, New York, pp. 203-240.
Kamler E. 1992. Early life history of fish. An energetic approach. Chapman and Hill. London. 267p.
Kjorsvik E, Mangor-Jensen A, Holmfjord I. 1990. Egg quality in fishes. Advances in Marine Biology, 26: 71-113.
KKP (Kementrian Kelautan dan Perikanan). 2012. Produktivitas budidaya ikan di Indonesia. www.dkp.go.id
Lam TJ. 1995. Induced Spawning in Fish. Proceedings for Workshop held in Tungkang Marine Laboratory. Taiwan. April 22–24 1995. Reproduction in Culture of Milkfish, 14- 65.
Lee WK , Young SW. 2002. Relationship between ovarian development and serum levels of gonadal steroid hormones, and induction of oocyte maturation and ovulation in the cultured female Korean spotted sea bass
Lateolabrax moculatus (Jeom-nong-eo). Aquaculture, 207: 169-183. Legendre M, Slembrouck J, Subagja J. 1998. First Results on growth and artifial
23 Lubzens E, Young G, Bobe J, Cerdá J. 2010. Oogenesis in teleosts: How fish eggs
are formed. General and Comparative Endocrnology, 165: 367-389. MacKenzie DS, Thomas P, Farrar SM. 1989. Seasonal Changes In Thyroid and
Reproduction Steroid Hormones In Female Channel Catfish (Ichtalurus punctatus) In Pond Culture. Aquaculture, 78: 63 – 80.
Martin J. 2004. Hormonal and physiological profiles of female Haplochromis burtoni as it relate to affiliative behavior. SURJ: 55-61.
Mylonas CC, Zohar Y. 2001. Endocrine regulation and artificial induction of oocyte maturation and spermiation in basses of the genus morone. Aquaculture 2002-205-220.
Nagahama Y. 1987. 17α, 20β-dyhidroxy-4-pregnen-3-one: a teleost maturation inducing hormone. Develop. Growth and Differ. 29(1):1-12.
Nagahama Y, Matsuhisa A, Iwamatsu T, Sakai N, Fukada S. 1991. A mechanism for the action of pregnant mare serum gonadotropin on aromatase activity in the ovarian follicle of the medaka, Oryzias latipes. Journal of Experimental Zoology 259: 53-58.
Nagahama Y. 1995. Regulation of oocyte growth and maturation in fish. Dev boil 30: 103-145.
Partodihardjo S. 1987. Ilmu Reproduksi Hewan. Mutiara Sumberdaya. Jakarta. 76 hal.
Patino R, Sullivan CV. 2003. Ovarian follicle growth, maturation and ovulation in teleost fish. Fish Physiology and Biochemistry, 26:57-70.
Patent DH. 1976. Fish and how they reproduce. Holiday House. New York :128 pp
Prihatman K. 2000. Budidaya Ikan Patin (Pangasius pangasius) : Proyek Pengembangan Ekonomi Masyarakat Pedesaan
Polyzons NP, Tsappi M, Mauri D Atay V, Cortinovis I, Casazza G. 2008. Aromatase inhibitor for infertilityin polycystic ovary syndrome : The beginning or the of a new era. Fertil Steril 89: 278-80.
Rottmann RW, Shireman JV, Chapman FA. 1991. Hormonal control of reproduction in fish for Induced spawning. SRAC Publication No. 424. United States Departemen of Agriculture.
Rideout RM, Litvak MK, Trippel EA. 2003. The Development of A Sperm Cryopreservation Protocol For Winter Flounder Pseudopleuronectes americanus (Walbaum) : Evalution of Cryopreservation and Diluents.
Aquaculture Research 34 : 653-659.
Sadili D. 1996. Studi Penggunaan Ekstrak Kelenjar Hypofisa dalam Budidaya Ikan Air Tawar. Prosiding Lokakarya Nasional Teknologi tepat Guna Samara HS. 2010. Rekayasa rematurasi ikan Patin Siam (Pangasianodon
24
Scheele D, Nadine S. 2012. Oxytocin Modulates Social Distance between Males and Females. Department of Psychiatry, University of Bonn. Department of Biopsychology, Ruhr University. Laboratory for Neuroinformation, School of Life Science and Technology, University of Electronic Science and Technology of China, Center for Neurodegenerative Diseases. Germany.
Sudrajat AO. 2012. Pengantar Endokrinologi. Materi mata kuliah Endokrinologi. Institut pertanian Bogor
Sumantri. 2006. Efektivitas ovaprim dan aromatase inhibitor dalam mempercepat pemijahan pada ikan lele dumbo Clarias sp. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Bogor.
Swanson P. 2008. Endocrine Regulation of Reproduction. http://www.north west fisherysciensecenter.noaa.gov/research/divisions/reutd/phys_endo/endocri ne . cfm [15 Desember 2013].
Tjay TH, Rahardja K. 2008. Obat-obat penting khasiat, penggunaan, dan efek sampingnya edisi ke 6. Jakarta : Gramedia.
Turner CD, Bagnara JT. 1998. Endokrinologi umum. Airlangga University Press , Surabaya.
Yayou K, Sayuki K, Shuichi I. 2011. Effect of Oxytocin, Prolactin-Releasing Peptide, or Corticotropin-Releasing Hormone on Feeding Behavior in Steers. Laboratory of Neurobiology, National Institute of Agrobiological Sciences. Japan. General and Comparative Endocrinology 174. 287–291. Yang JX, Chen XY, Chen YR. 2007. On the population status of Pangasiid
catfishes in Lancangjiang River Basin, China. Zoological Research 28(1): 63-67.
Yaron. 1995. Endocrine control of gametogenesis and spawning induction in the carp. Aquaculture, 129:49-73.
Zairin MJr, Furukawa, Aida K. 1992. Induction of Ovulation by HCG Injection in Tropical Walking Catfish, Clarias bsatrachus Reared Under 23-250C. Nippon Suisan Gakkaishi, 58(a): 1681 – 1685.
25
26
Lampiran 1. Analisis statistik terhadap kombinasi hormon dengan waktu masa laten ovulasi pada ikan Patin
Corrected Total 524.960 24
a. R Squared = ,929 (Adjusted R Squared = ,915)
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 1,860.
Lampiran 2. Analisis statistik terhadap kombinasi hormon dengan jumlah telur pada pemijahan ikan Patin
Corrected Total 7.594E10 24
a. R Squared = ,922 (Adjusted R Squared = ,907)
Means for groups in homogeneous subsets are displayed. Based on observed means.
27 Lampiran 3. Analisis statistik terhadap kombinasi hormon dengan derajat
pembuahan pada pemijahan ikan Patin
Corrected Total 38166.438 24
a. R Squared = ,999 (Adjusted R Squared = ,999)
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 1,898.
Lampiran 4. Analisis statistik terhadap kombinasi hormon dengan derajat penetasan pada pemijahan ikan Patin
ANOVA
Source
Type III Sum of
Squares df Mean Square F Sig.
Model 185154.000a 5 37030.800 2.64
5E4 .000
Perlakuan
185154.000 5 37030.800 2.64
5E4 .000
Error 28.000 20 1.400
Total 185182.000 25
28
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 1,400.
Lampiran 5. Analisis statistik terhadap kombinasi hormon dengan tingkat kelangsungan hidup larva pada pemijahan ikan Patin
ANOVA Source
Type III Sum of
Squares df Mean Square F Sig.
Model 191407.223a 5 38281.445 3.187E4 .000
Perlakuan 191407.223 5 38281.445 3.187E4 .000
Error 24.022 20 1.201
Total 191431.245 25
a. R Squared = 1,000 (Adjusted R Squared = 1,000)
DUNCAN
Means for groups in homogeneous subsets are displayed. Based on observed means.
The error term is Mean Square(Error) = 1,201.
Lampiran 6 Analisis konsentrasi estradiol-17ß dan testoteron dalam plasma darah ikan Patin
Konsentrasi Estradiol dan Testosteron dalam Darah