PENAMBAHAN TEPUNG DAUN MENGKUDU
Morinda citrifolia
L.
PADA PAKAN IKAN PATIN
Pangasianodon hypophthalmus
UNTUK
PENCEGAHAN INFEKSI
Aeromonas hydrophila
ERMIANUS SAMALEI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Penambahan Tepung Daun Mengkudu Morinda citrifolia L. pada Pakan Ikan Patin Pangasianodon hypophthalmus untuk Pencegahan Infeksi Aeromonas hydrophila” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ERMIANUS SAMALEI. Penambahan Tepung Daun Mengkudu Morinda citrifolia L. pada Pakan Ikan Patin Pangasianodon hypophthalmus untuk Pencegahan Infeksi Aeromonas hydrophila. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan TATAG BUDIARDI.
Aeromonas hydrophila merupakan bakteri penyebab penyakit motile aeromonads septicaemia (MAS) yang menyerang ikan patin Pangasianodon hypophthalmus. Tepung daun mengkudu Morinda citrifolia L. merupakan bahan alami yang mengandung flavonoid, terpenoid, antrakuinon, alkaloid, dan saponin yang berpotensi sebagai antibakteri dan imunostimulan. Tujuan penelitian ini adalah untuk menentukan dosis yang tepat untuk pencegahan infeksi Aeromonas hydrophila pada ikan patin. Ikan patin yang digunakan dalam penelitian ini memiliki panjang rata-rata 11,26±0,10 cm/ekor dan bobot 12,39±0,49 g/ekor yang diberi pakan dengan campuran tepung daun mengkudu dengan dosis 0%, 0,5%, 1%, dan 2% selama 14 hari. Uji tantang dilakukan dengan menyuntikkan secara intramuskuler 0,1 mL Aeromonas hydrophila (107 CFU/mL) ke ikan patin pada hari ke-15 dan diberi pakan komersial sampai hari ke-28. Perlakuan 0,5% memberikan kelangsungan hidup sebesar 83,33±2,88% yang lebih tinggi dibandingkan perlakuan kontrol positif yang memiliki kelangsungan hidup sebesar 40±10,00%.
Kata kunci: Aeromonas hydrophila, Morinda citrifolia L., Ikan patin
ABSTRACT
ERMIANUS SAMALEI. Addition of Flour of Noni Morinda citrifolia L. Leaves for Stripped Catfish Pangasianodon hypophthalmus Feed for the Prevention of Aeromonas hydrophila Infection. Supervised by DINAMELLA WAHJUNINGRUM and TATAG BUDIARDI.
Aeromonas hydrophila is a bacterial causing motile aeromonads septicaemia (MAS) that groaning of stripped catfish Pangasianodon hypophthalmus. Flour of noni Morinda citrifolia L. leaves is a natural substance that contains flavonoids, anthraquinones, terpenoids, alkaloids, and saponins that have the potential as an antibacterial and immunostimulant. This research was aimed to determine the optimal dosage of flour of noni leaves for the prevention of Aeromonas hydrophila infection in stripped catfish. Stripped catfish was used in this research have the average body length 11.26±0.10 cm/fish and weight 12.39±0.49 g/fish which was fed with the mixture of flour of noni leaves at dosage 0%, 0.5%, 1%, and 2% during 14 days. Challenging test was carried out by intramuscularly injection of 0.1 mL Aeromonas hydrophila (107 CFU/mL) into the fish on 15th day and gave commercial feed until on 28th day. The treatment with dosage 0.5% gave survival 83.33±2.88 % which is higher than the positive control treatment had survival only 40±10.00%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
PENAMBAHAN TEPUNG DAUN MENGKUDU
Morinda citrifolia
L.
PADA PAKAN IKAN PATIN
Pangasianodon hypophthalmus
UNTUK
PENCEGAHAN INFEKSI
Aeromonas hydrophila
ERMIANUS SAMALEI
DEPARTEMEN BUDIDAYA PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi :Penambahan Tepung Daun Mengkudu Morinda citrifolia L. pada Pakan Ikan Patin Pangasianodon hypophthalmus untuk Pencegahan Infeksi Aeromonas hydrophila
Nama :Ermianus Samalei NIM :C14110086
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr. Dinamella Wahjuningrum, S.Si., M.Si. Pembimbing I
Dr.Ir. Tatag Budiardi, M.Si. Pembimbing II
Diketahui oleh
Dr.Ir. Sukenda, M.Sc. Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segenap rahmat dan karunia-Nya sehingga penyusunan skripsi yang berjudul ‘Penambahan Tepung Daun Mengkudu Morinda citrifolia L. pada Pakan Ikan Patin Pangasianodon hypophthalmus untuk Pencegahan Infeksi Aeromonas hydrophila’ berhasil diselesaikan. Penelitian ini dilaksanakan pada bulan Oktober sampai Desember 2014 bertempat di Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini, penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada:
1. Ayah Markus Br. dan Ibu Martha Takaronan, serta Abang Hyeronimus Samalei, dan Adik Seprianus S, Leonardus Bermans atas doa, nasehat, harapan dan dukungan tanpa batas yang selalu diberikan;
2. Dr Dinamella Wahjuningrum, SSi, MSi dan Dr Ir Tatag Budiardi, MSi selaku Dosen Pembimbing yang telah memberikan bimbingan, saran, serta nasehatnya;
3. Dr Julie Ekasari, SPi, MSc selaku Dosen Penguji Tamu;
4. Dr Alimuddin, SPi, MSc selaku Ketua Program Studi Departemen Budidaya Perairan;
5. Dr Ir Sukenda, MSc selaku Ketua Departemen Budidaya Perairan
6. Teman-teman LKI (Adel, Iqbal, May, Mita, Kiki, Mul, Yuri, Fenti, Risma, Syifa, Zani, Adhiet, Fadhilatun, Ridhana, Dinda, Hana, Dian, dan Hesti) yang telah memberikan doa dan bantuannya selama penelitian;
7. Pak Ranta, Kang Abe, Kang Yosi, Pak Endang, Pak Jajang atas bantuannya selama penelitian berlangsung;
8. Teman seperjuangan keluarga besar BDP 48 atas kebersamaan dan dukungannya serta motivasinya selama penyusunan skripsi ini;
9. Keluarga Besar Omda Mentawai (Jhon, Eta, Welly, Sagulu, Desni, Yudika, Lira, Fitri, Rehu, Rey, Maria, Melani, Iss, Adel, Rika, Fajar, Josen, Rudi, Eigel, Cia, Desi, Dion, Dono, Erik, Jufri, Safni, dan Winda) atas kebersamaannya serta doanya;
10.Veronika EF, atas kebersamaan, bantuan, doa dan nasehatnya selama ini; 11.Pak Mar, Bu Yuli, semua pegawai dan staf TU BDP, atas doa dan bantuannya
serta sarannya;
12.Keluarga besar angkatan 50, 49 dan 47 yang tidak bisa saya sebutkan satu persatu;
Semoga karya ilmiah ini bermanfaat bagi yang memerlukan.
DAFTAR ISI
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
METODE ... 3
Prosedur Penelitian ... 3
Parameter Penelitian dan Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 9
Hasil ... 9
Pembahasan ... 16
KESIMPULAN DAN SARAN ... 21
Kesimpulan ... 21
Saran ... 21
DAFTAR PUSTAKA ... 21
LAMPIRAN ... 25
DAFTAR TABEL
1 Hasil identifikasi bakteri Aeromonas hydrophila ... 3
2 Diameter zona bening disekitar kertas cakram yang diberi ekstrak tepung daun mengkudu ... 5
3 Nilai kelainan klinis pada ikan patin ... 8
4 Parameter, satuan dan alat ukur kualitas air ... 8
5 Kisaran nilai kualitas air selama penelitian ... 8
6 Warna dan morfologi organ dalam ikan patin pada akhir pemeliharaan ... 11
DAFTAR GAMBAR
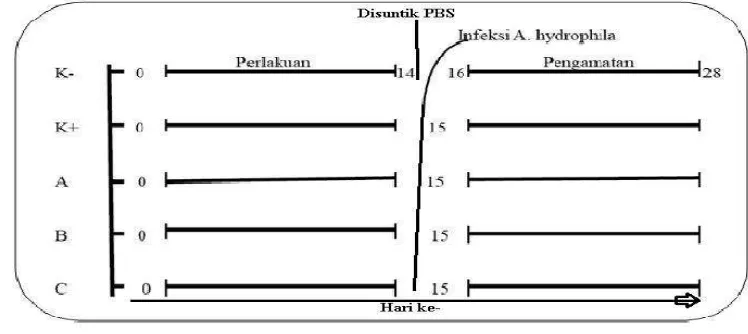
1 Skema uji in vivo pada ikan patin ... 62 Kelangsungan hidup ikan patin tiap perlakuan sebelum dan sesudah uji tantang ... 9
3 Nafsu makan ikan patin tiap perlakuan sebelum dan sesudah uji tantang ... 10
4 Konversi pakan ikan patin tiap perlakuan sebelum dan sesudah uji tantang ... 11
5 Pengamatan organ dalam ikan patin tiap perlakuan pada akhir pemeliharaan ... 12
6 Ikan patin kontrol negatif tidak mengalami kelainan klinis sampai akhir pemeliharaan ... 12
7 Pengamatan gejala klinis ikan patin pascauji tantang pada hari ke-1 ... 13
8 Pengamatan gejala klinis ikan patin pascauji tantang pada hari ke-7 ... 13
9 Pengamatan gejala klinis ikan patin pascauji tantang pada hari ke-14 ... 14
10 Skoring gejala klinis ikan patin tiap perlakuan pascauji tantang ... 14
11 Perubahan rata-rata diameter luka ikan patin tiap perlakuan selama 14 hari pascauji tantang ... 15
12 Jumlah kematian kumulatif ikan patin yang terjadi pascauji tantang ... 15
DAFTAR LAMPIRAN
1 Perhitungan nilai LD50 ... 252 Gambar hasil zona bening (hambat) disekitar kertas cakram yang diberi ekstrak tepung daun mengkudu ... 25
3 Analisis statistik kelangsungan hidup ikan patin ... 26
4 Analisis statistik nafsu makan ikan patin sebelum uji tantang... 26
5 Analisis statistik nafsu makan ikan patin setelah uji tantang ... 27
6 Analisis statistik konversi pakan ikan patin sebelum uji tantang ... 27
1
PENDAHULUAN
Latar Belakang
Ikan patin (Pangasianodon hypophthalmus) merupakan salah satu jenis ikan konsumsi yang sudah banyak dibudidayakan karena memiliki prospek bisnis yang besar dan nilai ekonomis yang tinggi, baik tahap pembenihan maupun pembesaran. Kegiatan budidaya ikan patin dinilai cukup prospektif di Indonesia karena tingginya permintaan konsumen. Ikan ini merupakan salah satu komoditas air tawar unggulan Kementerian Kelautan dan Perikanan (KKP) yang sedang ditingkatkan produksinya. Menurut data Direktorat Jenderal Perikanan Budidaya (DJPB 2013) produksi ikan patin Indonesia pada tahun 2012 mencapai 347.000 ton dan pada tahun 2013 mencapai 410.684 ton. Kemudian produksi budidaya ikan patin yang ditargetkan meningkat menjadi sekitar 1.883 juta ton pada tahun 2014. Namun demikian, selama proses budidaya ikan patin terkadang mengalami beberapa kendala. Salah satu kendala yang sering dihadapi adalah penyakit yang disebabkan oleh bakteri Aeromonas hydrophila. Tingkat kematian larva ikan patin akibat serangan penyakit A. hydrophila mencapai 40%-80% (Hadie 2010). Selanjutnya ditambahkan oleh Cipriano (2001), serangan penyakit ini dapat mematikan benih ikan dengan tingkat kematian mencapai 80%-100% dalam waktu 1-2 minggu. Bakteri A. hydrophila merupakan bakteri Gram negatif berbentuk batang yang ada dimana-mana (ubiquitous) yang bersifat sewaktu-waktu dapat menyerang ikan (Swann & White 1989). Gejala yang ditimbulkan berupa gejala eksternal yaitu pendarahan lokal di insang dan daerah anal, abses, exophthalmia, geripis pada ekor dan sirip, dan dropsy, serta gejala internal berupa anemia, akumulasi cairan pada rongga perut, kerusakan organ ginjal dan hati (Rahman et al. 2004). Dengan demikian, perlu dilakukan pencegahan sebelum ikan positif terinfeksi.
Beberapa upaya pencegahan penyakit yang umum dilakukan adalah penggunaan probiotik, ganti air (pengenceran), rekayasa genetika, dan vaksin. Salah satu upaya pencegahan infeksi A. hydrophila dapat dilakukan dengan menggunakan vaksin. Menurut penelitian Olga et al. (2007), pemberian vaksin A. hydrophila pada ikan patin yang diinfeksi oleh bakteri A. hydrophila memberikan tingkat kelangsungan hidup sebesar 80,77%. Penggunaan vaksin A. hydrophila telah dicobakan pula oleh beberapa instansi terkait pencegahan penyakit A. hydrophila pada ikan patin. Namun, pemakaian vaksin tersebut belum memasyarakat di kalangan pembudidaya ikan (Sundana 2002). Hal ini disebabkan oleh penggunaan vaksin yang tidak praktis dan hanya spesifik pada satu jenis penyakit, sehingga tidak efisien dalam penggunaannya.
2
pencegahan infeksi A. hydrophila pada ikan patin adalah ekstrak daun sirih (Mulia & Arif 2012), ekstrak bawang putih (Yuhana 2008), ekstrak buah mahkota dewa (Wahjuningrum et al. 2007) dan ekstrak daun ketapang (Wahjuningrum et al. 2008).
Jenis fitofarmaka lain yang memiliki potensi untuk pencegahan penyakit ini adalah daun mengkudu (Morinda citrifolia L.). Tanaman mengkudu merupakan tanaman liar yang banyak dijumpai di dataran rendah sampai dataran tinggi 1500 dpl, dan tanaman daerah tropis yang disebut juga sebagai tanaman evergreen karena terus berdaun hijau sepanjang tahun dan berbuah tidak mengenal musim (Waha 2002). Tanaman mengkudu merupakan salah satu tanaman obat yang tersebar hampir di seluruh Indonesia, juga ditemukan di Malaysia, Kepulauan Pasifik, Australia dan Afika Timur (Heyne 1987). Menurut Deshmukh et al. (2011) dan Zoleta et al. (2014), daun mengkudu mengandung flavonoid, terpenoid, antrakuinon, alkaloid, dan saponin.
Beberapa penelitian terdahulu telah membuktikan bahwa buah dan daun mengkudu memiliki aktivitas antelmintik, antara lain terhadap cacing pita ayam Raillietina spp (Fathurrahmah 1992), dan Ascaris suum (nematode) (Soemardji et al. 1994), cacing Haemonchus contortus secara in vitro (Hildasari 1998), dan secara in vivo (Satrija 1998), Haemonchus contortus pada domba (Herissuparman 2000), cacing Hymenolepsi nana pada mencit putih (Widdhiasmoro 2000), dan terhadap parasit Eimeria tenella pada ayam (Hendi 2006). Sebagai antibakteri, daun mengkudu juga dipakai untuk pengendalian Salmonella typhimurium pada ayam broiler (Wati 2009), serta peningkatan tanggap kebal (imun) terhadap serangan Newcastle disease oleh virus jenis Paramyxovirus pada ayam pedaging (Wiryanti 2004).
Penelitian mengenai penggunaan daun mengkudu pada ikan yang diinfeksi bakteri belum ada, sehingga perlu dilakukan penelitian untuk menentukan dosis yang tepat terhadap pencegahan infeksi A. hydrophila pada ikan patin Pangasianodon hypophthalmus. Metode yang digunakan dalam aplikasi fitofarmaka ini adalah pencampuran tepung daun mengkudu dengan pakan komersial yang dicetak ulang (repelleting). Pencampuran tepung daun mengkudu ini diharapkan dapat meningkatkan kekebalan tubuh ikan patin dalam melawan infeksi bakteri. Dasar penggunaan metode ini adalah agar mudah diaplikasikan oleh para pembudidaya ikan dan efisiensi waktu dalam produksi pakan tepung fitofarmaka.
Tujuan Penelitian
3
METODE
Prosedur Penelitian
Penyediaan Bakteri Uji
Isolat bakteri Aeromonas hydrophila diperoleh dari Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Bakteri tersebut disuntikkan ke ikan patin secara intramuskuler untuk menguji virulensinya. Setelah muncul tanda-tanda penyakit MAS pada ikan patin, kemudian dilakukan reisolasi bakteri A. hydrophila dengan cara menggoreskan jarum ose ke bagian ginjal. Selanjutnya goresan tersebut dibiakkan menggunakan media trypticase soy agar (TSA) dan diinkubasi selama 24 jam pada suhu kamar dalam inkubator. Koloni bakterihasil reisolasi dilakukan pengamatan terhadap morfologinya. Untuk mendapatkan biakan murni, maka setiap koloni bakteri yang tumbuh terpisah dan berlainan morfologinya dimurnikan kembali dengan cara diisolasi ke dalam media TSA miring serta diinkubasi selama 24 jam dalam inkubator pada suhu 28ºC.
Kemudian hasil reisolasi ini dikarakterisasi melalui uji sifat fisiologis dan biokimianya.Uji fisiologis dilakukan melalui pengamatan morfologi secara visual yaitu warna, elevasi, dan tepian. Pengamatan secara biokimia dilakukan melalui pewarnaan Gram, uji motilitas, uji oksidasi/fermentasi, uji katalase, uji oksidase, dan uji gelatin. Identifikasi yang digunakan berdasarkan Bergey’s Mannual of Determinative Bacteriology (Holt et al. 1998). Hasil uji biokimia bakteri uji maupun bakteri reisolasi menunjukkan bahwa bakteri tersebut adalah bakteri A. hydrphila (Tabel 1).
Tabel 1 Hasil identifikasi bakteri Aeromonas hydrophila
Parameter Isolat murni Isolat reisolasi
Morfologi
Bakteri yang diuji diregenerasi terlebih dahulu sebelum digunakan. Bakteri stok dari kultur primer diambil sebanyak satu ose untuk dibiakkan dalam agar miring dan diinkubasi selama 24 jam pada suhu 27ºC dalam inkubator. Bakteri
yang berumur 24 jam diambil sebanyak satu ose dan diinokulasikan ke dalam Erlenmeyer yang berisi 25 mL media trypticase soy broth (TSB) dan diinkubasi selama 24 jam dalam inkubator bergoyang (water bath shaker) pada suhu 28ºC.
4
menggunakan pipet mikro, kemudian disentrifus 3000 rpm sekitar 5 menit dan dibuang supernatannya. Endapan yang diperoleh dicuci dengan phosphate buffer saline (PBS) sebanyak 2 kali. Kemudian ke dalam endapan ditambahkan 1 mL PBS dan dihomogenkan dengan Vortex sampai tercampur rata, setelah itu diambil 0,1 mL dan dimasukkan ke dalam tabung mikro yang berisi 0,9 mL PBS (pengenceran 10-1) (Hadioetomo 1990). Larutan tersebut dihomogenkan kembali hingga mendapatkan kepadatan bakteri yang digunakan untuk uji tantang berdasarkan pada nilai uji LD50.
Penentuan Nilai LD50
Uji LD50 merupakan penentuan tingkat virulensi bakteri dengan melihat
konsentrasi bakteri yang dapat mematikan sekitar 50% populasi dalam suatu media. Hal ini penting dilakukan untuk menentukan konsentrasi bakteri yang digunakan untuk uji tantang (in vivo). Uji LD50 dilaksanakan pada akuarium
berukuran 60 cm x 30 cm x 30 cm. Bakteri A. hydrophila yang akan digunakan dikultur pada media TSB, kemudian dicuci dengan menggunakan PBS sebanyak 2 kali. Penyuntikan bakteri dilakukan secara intramuskuler sebanyak 0,1 mL/ekor dengan kepadatan 105 sampai 107 CFU/mLpada 10 ekor ikan patin. Pengamatan dilakukan dengan menghitung jumlah ikan yang masih hidup dan yang mati sampai hari ke empat. Kemudian dilakukan penghitungan untuk mengetahui LD50
yaitu konsentrasi yang dapat menyebabkan ikan mati sebanyak 50% dari populasi ikan uji (Reed & Muench 1938) yang dapat dilihat pada Lampiran 1.
Pembuatan Tepung Daun Mengkudu
Tanaman mengkudu (Morinda citrifolia L.) diperoleh darilingkungan kampus Institut Pertanian Bogor. Bagian tanaman yang diambil adalah bagian daun yang masih segar. Daun dicuci terlebih dahulu dengan air mengalir dan dikering-udarakan tanpa terkena sinar matahari secara langsung selama 7 hari. Kemudian daun dipotong kecil-kecil dan diblender sampai menjadi tepung. Selanjutnya tepung yang dihasilkan disaring dengan saringan halus (mesh size 0,5-1,0 mm). Bubuk tersebut disimpan dalam wadah yang kedap udara hingga saatnya dicampur dengan bahan pakan (Wahjuningrum et al. 2012a).
Uji In Vitro
Uji in vitro dilakukan untuk melihat aktivitas antibakteri dari ekstrak tepung daun mengkudu terhadap bakteri A. hydrophila dengan menggunakan metode Kirby Bauer (Lay 1994). Uji ini menghasilkan dosis optimum ekstrak daun mengkudu yang efektif untuk menghambat atau membunuh bakteri A. hydrophila. Hasil uji aktivitas antibakteri dengan metode kertas cakram ditunjukkan dengan adanya zona bening di sekitar kertas cakram.
Uji daya hambat dilakukan dengan terlebih dahulu menyiapkan stok ekstrak tepung daun mengkudu dengan dosis 50 g/L yaitu 50 g tepung daun mengkudu yang dipanaskan ke dalam 1 L air selama 30 menit pada suhu 60ºC. Kemudian
dibuat konsentrasi 5 g/L, 10 g/L, dan 20 g/L dengan 3 kali ulangan untuk uji in vitro. Media TSA yang telah disterilkan dituang ke dalam cawan petri pada suhu 40ºC-45ºC. Selanjutnya setelah media memadat maka bakteri A. hydrophila
5
dalam larutan ekstrak daun mengkudu pada berbagai dosis selama 5 menit. Selanjutnya kertas cakram diambil dengan menggunakan pinset dan diletakkan di atas media TSA yang sudah disebar bakteri kemudian diinkubasi pada suhu ruang selama 24 jam. Diameter zona bening yang terbentuk diukur menggunakan penggaris (cm), dengan ketentuan semakin lebar zona bening maka makin besar pula daya antibakterinya (Ayuningtyas 2008). Gambar hasil zona bening yang diberi ekstrak daun mengkudu dapat dilihat pada Lampiran 2. Pengukuran diameter zona bening yang diberi ekstrak daun mengkudu terdapat pada Tabel 2. Tabel 2 Diameter zona bening di sekitar kertas cakram yang diberi ekstrak tepung
daun mengkudu.
Perlakuan Diameter zona bening (cm) Rata-rata (cm)
1 2 3 4
5 g/L 1,3 1,7 1,7 1,8 1,63
10 g/L 1,7 1,7 1,7 1,9 1,75
20 g/L 1,8 1,7 2,1 1,8 1,85
Pembuatan Pakan Uji Dengan Cetak Ulang (Repelleting)
Pakan komersial berprotein 30% ditepungkan dan kemudian dicampurkan dengan tepung daun mengkudu sesuai dengan dosis perlakuan yaitu 0%, 0,5%, 1% dan 2%. Selanjutnya pada campuran tersebut ditambahkan air sebanyak 300 ml lalu dicetak, kemudian dikeringkan dalam oven pada suhu 60ºC sekitar 2 jam.
Pakan disimpan dalam wadah kedap udara (Wahjuningrum et al. 2012a).
Persiapan Wadah dan Ikan Uji
Wadah yang digunakan dalam penelitian ini adalah 15 akuarium yang berukuran 60 cm x 30 cm x 30 cm. Persiapan wadah meliputi pencucian akuarium dan tandon, penyusunan akuarium dan penataan aerasi. Akuarium terlebih dahulu dicuci dengan menggunakan sabun lalu dibilas dengan air hingga bersih dan dikeringkan. Kemudian didesinfeksi dengan klorin dengan konsentrasi 30 mg/L untuk wadah selama 24 jam. Setelah itu diisi air setinggi 20 cm, kemudian didesinfeksi dengan klorin dengan konsentrasi 30 mg/L untuk air selama 24 jam, selanjutnya dinetralisir dengan Na-thiosulfate (Na2S2O3.5H2O) 15 mg/L dan
diaerasi kuat. Air tandon juga diklorin dan diberi Na-thiosulfate dengan dosis masing-masing 30 mg/L dan 15 mg/L. Seluruh sisi akuarium ditutup plastik berwarna hitam untuk menghindari stres pada ikan patin dan menghindari gangguan lainnya.
Pemasangan sistem aerasi menggunakan blower, selang aerasi dan batu aerasi. Aerasi yang digunakan sebanyak 15 titik sesuai dengan kebutuhan akuarium yang tersedia. Air yang dimasukkan ke dalam akuarium dibiarkan sambil diaerasi kuat selama 24 jam sebelum ikan uji dimasukkan ke dalam akuarium.
6
tiga kali sehari secara at satiation. Setelah diadaptasi ikan dipindahkan ke dalam akuarium perlakuan dengan kepadatan 20 ekor/akuarium atau 500 ekor/m3.
Uji In Vivo
Penelitian ini menggunakan rancangan acak lengkap (RAL) yang terdiri dari lima perlakuan dan tiga ulangan, yaitu:
1. Kontrol Negatif (K-)
Ikan diberi pakan komersial yang dicetak ulang tanpa pemberian tepung daun mengkudu dan disuntik dengan larutan PBS sebanyak 0,1 mL.
2. Kontrol Positif (K+)
Ikan diberi pakan komersial yang dicetak ulang tanpa pemberian tepung daun mengkudu dan disuntik dengan bakteri A. hydrophila dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL.
3. Pakan komersial yang ditambah tepung daun mengkudu 0,5%
Ikan diberi pakan komersial yang dicampur dengan tepung daun mengkudu 0,5% dan diuji tantang dengan bakteri A. hydrophila dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL.
4. Pakan komersial yang ditambah tepung daun mengkudu 1%
Ikan diberi pakan komersial yang dicampur dengan tepung daun mengkudu 1% dan diuji tantang dengan bakteri A. hydrophila dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL.
5. Pakan komersial yang ditambahkan tepung daun mengkudu 2%
Ikan diberi pakan komersial yang dicampur dengan tepung daun mengkudu 2% dan diuji tantang dengan bakteri A. hydrophila dengan konsentrasi 107 CFU/mL sebanyak 0,1 mL.
Ikan patin yang digunakan memiliki panjang rata-rata 11,26±0,10 cm/ekor dan bobot 12,39±0,49 g/ekor. Ikan patin tersebut diinfeksi A. hydrophila dengan dosis 107 CFU/mL (hasil LD50) sebanyak 0,1 mL/ikan secara intramuskuler.
Penginfeksian A. hydrophila dilakukan setelah pakan perlakuan diberikan selama 14 hari. Selanjutnya dilakukan pemeliharaan dengan pemberian pakan komersial sampai hari ke-28. Pemberian pakan dilakukan secara at satiation dengan frekuensi pemberian pakan sebanyak 3 kali yaitu pagi hari (08.00 WIB), siang hari (12.00 WIB) dan sore hari (16.00 WIB). Skema bagan penelitian yang lebih ringkas dapat dilihat pada Gambar 1.
7
Parameter Penelitian dan Analisis Data
Kelangsungan Hidup
Kelangsungan hidup ikan uji diperoleh dari persentase antara ikan hidup pada akhir pemeliharaan dengan jumlah ikan pada awal pemeliharaan. Kelangsungan hidup dihitung dengan menggunakan rumus:
100
Nafsu makan ikan adalah bobot pakan yang dimakan oleh tiap bobot ikan. Nafsu makan ikan ini, dihitung dengan menggunakan rumus:
Nafsu Makan Ikan % =ƩPB x
Konversi pakan dihitung berdasarkan rumus Zonneveld (1991): Konversi pakan = [ �� + �� − ��]�
Keterangan:
Bt = biomassa ikan pada akhir pemeliharaan
Bm = biomassa ikan mati selama pemeliharaan
B0 = biomassa ikan pada awal pemeliharaan
F = jumlah pakan yang dimakan selama pemeliharaan
Pengamatan Organ Dalam
Pengamatan organ dalam dilakukan pada akhir perlakuan bertujuan untuk mengetahui kelainan yang terjadi antar perlakuan. Pengamatan meliputi warna dan morfologi organ dalam ikan patin dari setiap perlakuan (Wahjuningrum et al. 2012b).
Gejala Klinis
8
dilakukan dengan metode sampling sebanyak 3 ekor per akuarium. Pengukuran kelainan klinis dilakukan dengan metode skoring (Angka 2005), sehingga semakin tinggi nilai maka semakin buruk kondisi tubuh ikan. Nilai kelainan klinis dapat dilihat pada Tabel 3.
Tabel 3 Nilai kelainan klinis pada ikan patin
Kondisi ikan Diamater kelainan klinis Nilai
Ikan sembuh (Sm) 0 cm 0
Ikan hampir sembuh (Hs) 0,1-0,2 cm 1
Ikan radang (R) 0,3-0,6 cm 2
Ikan hemoragi (H) 0,7-1,0 cm 3
Ikan nekrosis (Nk) 1,1-1,4 cm 4
Ikan tukak (T) 1,5-1,8 cm 5
Ikan tukak para tapi ikan hidup (Th)
1,9-2,2 cm 6
Kriteria berdasarkan Angka (2005)
Kualitas Air
Parameter kualitas air yang diamati yaitu suhu, pH, oksigen terlarut (dissolved oxygen, DO) dan amonium total (total ammonical nitrogen, TAN) (Tabel 4). Pengukuran kualitas air selama pemeliharaan dapat dilihat pada Tabel 5. Selama penelitian parameter kualitas air selalu dijaga, sehingga selama pemeliharaan parameter kualitas air berada pada batas toleransi ikan uji.
Tabel 4 Parameter, satuan dan alat ukur kualitas air
Paremeter Satuan Alat ukur Waktu pengukuran
Suhu ºC Termometer Setiap hari
pH - pH universal Setap hari
DO mg/l DO meter Setiap minggu
TAN mg/l Spektrofotometer Setiap minggu
Tabel 5 Kisaran nilai kualitas air selama penelitian
Parameter Kisaran Nilai optimum
DO 3,30 mg/L-5,10 mg/L ≥3,0 mg/L (SNI 2002) Amonia 0,01 mg/L-0,02 mg/L ≤0,02 mg/L (SNI 2002)
pH 7,0-7,5 6,5-9,0 Boyd (1982)
Suhu 28ºC -31ºC 28ºC-31ºC Boyd (1982)
Nilai amonia (NH3) didapatkan dari hasil konversi nilai TAN berdasarkan
nilai suhu dan pH pada saat pengukuran. Nilai amonia pada media pemeliharaan dihitung dengan rumus nilai pKa (Emerson et al. 1975) dan nilai amonia (Albert 1973):
Nilai pKa = , Suhu + + ,
9
Analisis Data
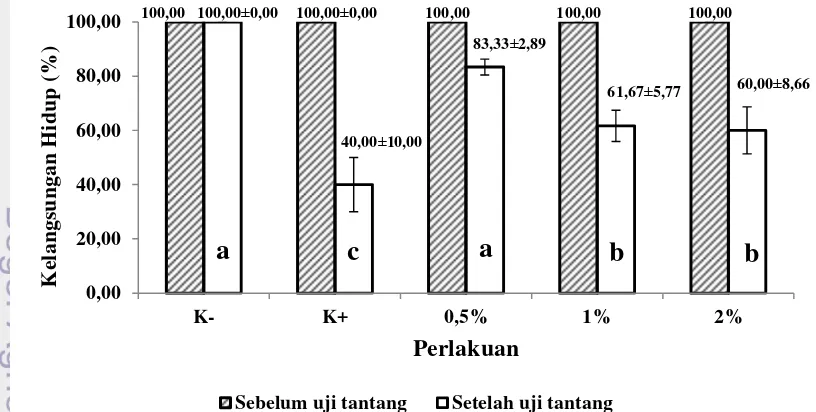
Data yang telah diperoleh ditabulasi dan dianalisis menggunakan program Ms.Excel2010 dan SPSS versi 22. Analisis ragam (ANOVA) dilakukan terhadap parameter kelangsungan hidup, konversi pakan dan nafsu makan ikan, untuk menguji apakah perlakuan berpengaruh terhadap parameter uji. Jika terdapat perbedaan nyata maka dilanjutkan dengan uji Tukey pada taraf uji 5%. Analisis ragam dilakukan setelah memenuhi persyaratan, yaitu data homogen dan terdistribusi normal. Analisis deskriptif dengan penyajian gambar atau tabel dilakukan pada parameter pengamatan organ dalam, gejala klinis, dan kualitas air untuk memperjelas pembahasan. sampai hari ke-28) kelangsungan hidup tertinggi terdapat pada perlakuan 0,5% yaitu sebesar 83,33±10,00% dan terendah terdapat pada perlakuan kontrol positif yaitu sebesar 40±8,66%. Berdasarkan uji lanjut, perlakuan 0,5% berbeda nyata (P<0,05) dengan perlakuan1%, 2% dan kontrol positif, namun antar perlakuan 1% dan 2% tidak berbeda nyata (P>0,05) (Lampiran 3). Kelangsungan hidup ikan patin sebelum dan sesudah uji tantang dapat dilihat pada Gambar 2.
Keterangan: huruf yang sama pada diagram batang ( ) menunjukkan tidak berbeda nyata (P>0,05)
Gambar 2 Kelangsungan hidup ikan patin tiap perlakuan sebelum dan sesudah uji tantang
100,00 100,00±0,00 100,00±0,00 100,00 100,00 100,00
10
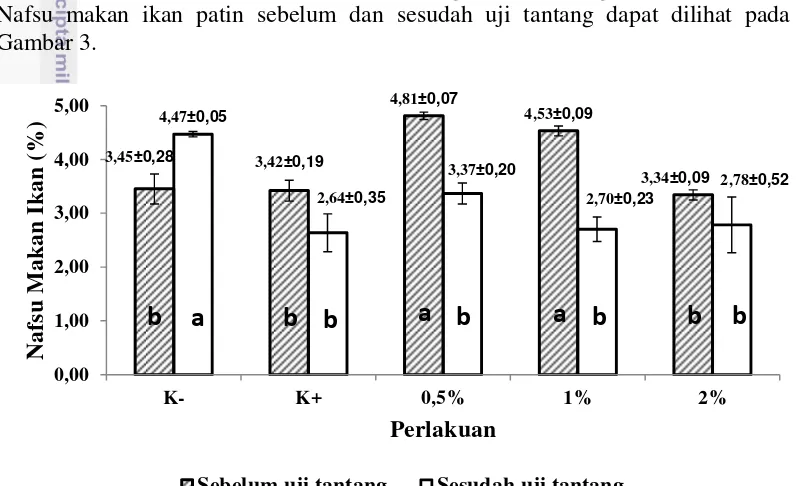
Nafsu Makan Ikan
Nafsu makan ikan tertinggi sebelum uji tantang (hari 1 sampai hari ke-14) dari perlakuan dosis terdapat pada perlakuan 0,5% yaitu sebesar 4,81±0,07% dan terendah terdapat pada perlakuan 2% yaitu sebesar 3,34±0,09%. Berdasarkan uji lanjut, perlakuan 0,5% dan 1% berbeda nyata (P<0,05) dengan semua perlakuan, namun antar perlakuan kontrol positif, kontrol negatif dan 2% tidak berbeda nyata (P>0,05) (Lampiran 4).
Nafsu makan ikan patin tertinggi setelah uji tantang (hari ke-15 sampai hari ke-28) dari perlakuan dosis terdapat pada perlakuan 0,5% yaitu sebesar 3,37±0,20% dan terendah terdapat pada perlakuan kontrol positif yaitu sebesar 2,64±0,35%. Berdasarkan uji lanjut, semua perlakuan tidak berbeda nyata (P>0,05), namun berbeda nyata (P<0,05) dengan kontrol negatif (Lampiran 5). Nafsu makan ikan patin sebelum dan sesudah uji tantang dapat dilihat pada Gambar 3.
Keterangan: huruf yang sama pada diagram batang ( ) menunjukkan tidak berbeda nyata (P>0,05) huruf yang sama pada diagram batang ( ) menunjukkan tidak berbeda nyata (P>0,05)
Gambar 3 Nafsu makan ikan patin tiap perlakuan sebelum dan sesudah uji tantang
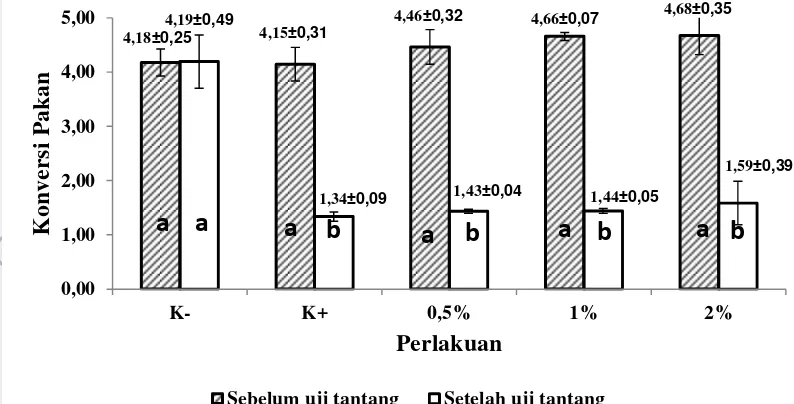
Konversi Pakan
Konversi pakan tertinggi sebelum uji tantang(hari ke-1 sampai hari ke-14) terdapat pada perlakuan 2% yaitu sebesar 4,68±0,35 dan terendah terdapat pada perlakuan kontrol positif yaitu sebesar 4,15±0,31. Berdasarkan uji lanjut, semua perlakuan tidak berbeda nyata (P>0,05) (Lampiran 6).
Konversi pakan tertinggi setelah uji tantang (hari ke-15 sampai hari ke-28) dari perlakuan dosis terdapat pada perlakuan 2% yaitu sebesar 1,59±0,39 dan terendah terdapat pada perlakuan kontrol positif yaitu sebesar 1,34±0,09.
11
Keterangan: huruf yang sama pada diagram batang ( ) menunjukkan tidak berbeda nyata (P>0,05) huruf yang sama pada diagram batang ( ) menunjukkan tidak berbeda nyata (P>0,05)
Gambar 4 Konversi pakan ikan patin tiap perlakuan sebelum dan sesudah uji tantang
Pengamatan Organ Dalam
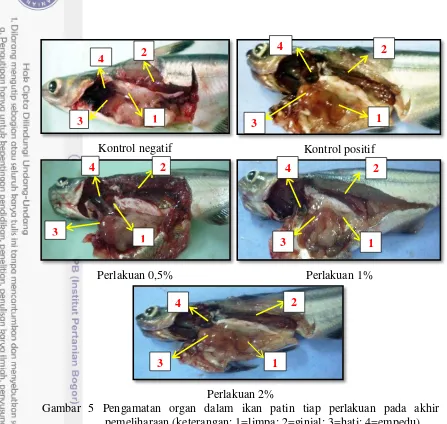
Pengamatan organ dalam bertujuan untuk mengetahui adanya kelainan yang terjadi setelah uji tantang pada ikan patin. Organ dalam yang diamati meliputi; hati, ginjal, empedu, dan limpa. Parameter yang diamati berupa warna dan morfologinya. Perbedaan morfologi dan warna masing-masing perlakuan disajikan pada Tabel 6 dan Gambar 5.
Tabel 6 Warna dan morfologi organ dalam ikan patin pada akhir pemeliharaan Organ
membengkak Merah tua Kekuningan
Kekuningan dan bengkak
Empedu
Hijau
kebiruan Hijau kekuningan Hijau kebiruan
12
Kontrol negatif Kontrol positif
Perlakuan 0,5% Perlakuan 1%
Perlakuan 2%
Gambar 5 Pengamatan organ dalam ikan patin tiap perlakuan pada akhir pemeliharaan (keterangan: 1=limpa; 2=ginjal; 3=hati; 4=empedu)
Gejala Klinis dan Penyembuhan Luka
Pengamatan gejala klinis dilakukan dengan metode skoring, yaitu nilainya didapat melalui pengukuran diameter luka pada ikan uji dengan penyamplingan 3 ekor tiap akuarium. Semakin tinggi nilainya semakin buruk keadaan ikannya. Pengamatan gejala klinis dilakukan sampai hari ke-14 setelah uji tantang A. hydrophila. Proses penyembuhan luka dapat terlihat dari mengecilnya diameter luka. Perubahan diameter luka yang terjadi tiap perlakuan berbeda-beda, serta lama waktu penutupan yang bervariasi. Pada perlakuan kontrol negatif setelah dilakukan penyuntikan dengan PBS (0,1 mL/ekor) tidak menunjukkan adanya kelainan klinis sampai akhir pemeliharaan (Gambar 6).
Gambar 6 Ikan patin kontrol negatif tidak mengalami kelainan klinis sampai akhir pemeliharaan
1 2
3 4
1 3
2
1 4
3
4
3 1
2
3 4
1
4 2
13
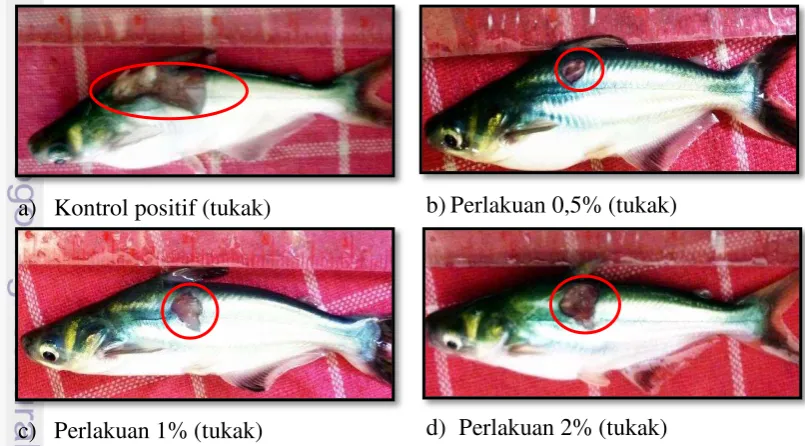
Gejala klinis yang terjadi pada hari ke-1 pascauji tantang pada perlakuan kontrol positif berupa radang, nekrosis, dan adanya kematian. Perlakuan 0,5%, gejala klinis yang terjadi berupa hemoragi, nekrosis, dan adanya kematian. Perlakuan 1%, gejala klinis yang terjadi berupa hemoragi, nekrosis, dan kematian. Pada perlakuan 2%, gejala klinis yang terjadi berupa nekrosis, tukak dan adanya kematian. Perbedaan gejala klinis yang terjadi pada semua perlakuan (K+, 0,5%, 1%, 2% ) pada hari ke-1 pascauji tantang dapat dilihat pada Gambar 7.
a) Kontrol positif (radang & nekrosis) b)Perlakuan 0,5% (hemoragi & nekrosis)
c) Perlakuan 1% (nekrosis & tukak) d)Perlakuan 2% (nekrosis & tukak) Gambar 7 Pengamatan gejala klinis ikan patin pasacauji tantang pada hari ke-1
Gejala klinis yang terjadi pada hari ke-7 pascauji tantang pada semua perlakuan berupa tukak. Namun, yang membedakan antar perlakuan adalah besar kecilnya diameter luka yang terjadi. Perbedaan gejala klinis yang terjadi pada semua perlakuan (K+, 0,5%, 1%, 2% ) pada hari ke-7 pascauji tantang dapat dilihat pada Gambar 8.
a) Kontrol positif (tukak) b)Perlakuan 0,5% (tukak)
c) Perlakuan 1% (tukak) d) Perlakuan 2% (tukak)
14
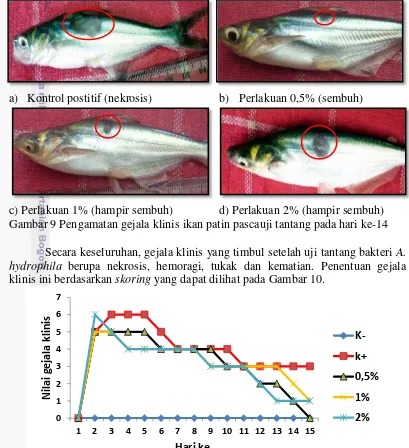
Gejala klinis yang terjadi pada hari ke-14 pascauji tantang pada perlakuan kontrol positif berupa nekrosis. Pada perlakuan 0,5%, luka mengalami penyembuhan setelah hari ke-14. Pada perlakuan 1% dan perlakuan 2%, luka yang terjadi hampir sembuh setelah hari ke-14. Perbedaan gejala klinis yang terjadi pada semua perlakuan (K+, 0,5%, 1%, 2% ) pada hari ke-14 pascauji tantang dapat dilihat pada Gambar 9.
a) Kontrol postitif (nekrosis) b) Perlakuan 0,5% (sembuh)
c) c) Perlakuan 1% (hampir sembuh) d) d) Perlakuan 2% (hampir sembuh) Gambar 9 Pengamatan gejala klinis ikan patin pascauji tantang pada hari ke-14
Secara keseluruhan, gejala klinis yang timbul setelah uji tantang bakteri A. hydrophila berupa nekrosis, hemoragi, tukak dan kematian. Penentuan gejala klinis ini berdasarkan skoring yang dapat dilihat pada Gambar 10.
Gambar 10 Skoring gejala klinis ikan patin tiap perlakuan pascauji tantang Proses penyembuhan yang ditandai dengan proses penyempitan luka yang terjadi pada masing-masing perlakuan dapat dilihat pada Gambar 11.
0 1 2 3 4 5 6 7
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
N
il
ai
g
ej
al
a
kl
in
is
Hari ke-
K-k+
0,5%
1%
15
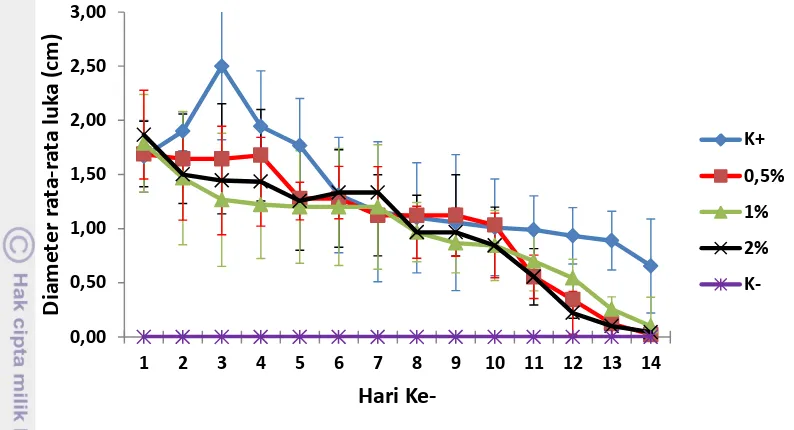
Gambar 11 Perubahan rata-rata diameter luka ikan patin tiap perlakuan selama 14 hari pascauji tantang
Pada perlakuan kontrol positif, diameter luka yang terjadi semakin membesar sampai hari ke-3, kemudian mengalami penyempitan dari hari ke-4 sampai hari ke-14. Namun, penyempitan luka ini tidak sampai sembuh total. Pada perlakuan 0,5%, diameter luka yang terjadi mengalami penyempitan mulai dari hari ke-2 sampai hari ke-14 yang terus-menerus hingga ikan uji mengalami penyembuhan total. Pada perlakuan 1% dan 2% diameter luka yang terjadi mengalami penyempitan dari hari ke hari hingga luka tersebut hampir sembuh.
Secara keseluruhan bahwa jumlah kematian terbanyak terjadi pada hari pertama pascauji tantang, dengan kematian tertinggi terdapat pada perlakuan kontrol positif dan kematian terjadi hingga hari ke-7. Jumlah kematian kumulatif yang terjadi pascauji tantang dapat dilihat pada Gambar 12.
16
Pembahasan
Berdasarkan hasil penelitian, kontrol negatif tidak terjadi kematian ikan uji sampai akhir pemeliharaan. Hal ini terjadi karena ikan uji hanya disuntik dengan PBS. Berdasarkan nilai kelangsungan hidup ikan uji, dapat diketahui, bahwa semakin tinggi konsentrasi pemberian tepung daun mengkudu semakin rendah kelangsungan hidupnya. Hal tersebut terjadi diduga karena toksisitas bahan yang semakin meningkat seiring dengan peningkatan dosis suatu bahan. Daun mengkudu mengandung bahan aktif berupa alkaloid. Senyawa alkaloid diduga memiliki efek negatif yaitu dapat bersifat racun bagi ikan. Namun demikian, alkaloid pada jumlah tertentu dapat bekerja secara sinergis dengan senyawa lainnya, sehingga tidak bersifat racun bagi ikan (Naim 2004). Peningkatan dosis setelah dosis tersebut tidak lagi memberikan efek positif tetapi justru sebaliknya. Bahan aktif seperti alkaloid yang telah terserap oleh tubuh dalam jumlah yang berlebihan akan dinetralkan kembali oleh tubuh. Implikasinya kerja organ hati ikan uji akan semakin berat atau bahkan terganggu. Menurut Cipriano et al. (2001), organ hati sangat berpengaruh pada proses metabolisme. Dengan demikian tubuh ikan akan menjadi lemas dan sangat mudah terserang oleh infeksi bakteri A. hydrophila.
Perlakuan 0,5% merupakan dosis yang baik sehingga dapat bekerja dengan sinergis dalam tubuh ikan uji yang ditunjukkan dengan kelangsungan hidup yang mencapai 83,33% lebih tinggi dibandingkan dengan perlakuan yang lainnya. Menurut Naim (2004), alkaloid dapat berfungsi sebagai antibakteri yang dapat menghambat pertumbuhan bakteri Gram positif dan Gram negatif serta efektif membunuh virus. Bahan aktif selain alkaloid menurut Deshmukh et al. (2011) dan Zoleta et al. (2014) adalah flavonoid, terpenoid. antrakuinon, dan saponin. Senyawa tersebut diduga sebagai bahan aktif yang berperan sebagai imunostimulan dan antibakteri.
Perlakuan kontrol positif tanpa diberi tepung daun mengkudu memiliki kelangsungan hidup yang rendah. Hal ini disebabkan oleh bakteri A. hydrophila menghasilkan enzim dan toksin yang dikenal dengan produk ekstraseluler (extra cellular product, ECP) yang mengandung sedikitnya aktivitas hemolisis dan protease yang merupakan penyebab patogenisitas pada ikan (Angka 2005). Dengan demikian, ECP menyebabkan kematian yang tinggi karena sistem imun ikan yang lemah.
Pada penelitian ini pemberian dosis 0,5% merupakan dosis yang paling baik yang ditunjukkan dengan nafsu makan yang lebih tinggi dibandingkan dengan perlakuan lain. Menurut Suprapto (2006), flavonoid dapat merangsang sistem imun dengan cara mengirimkan sinyal secara intraseluler pada reseptor sel sehingga sel bekerja lebih optimal. Peningkatan laju metabolisme akan meningkatkan pembentukkan sel makrofag yang berfungsi sebagai sel fagositik, sehingga sistem imun akan bekerja lebih baik.
17
terutama pada perlakuan 2%. Senyawa alkaloid yang bersifat racun yang masuk ke dalam tubuh akan dinetralkan oleh hati. Peningkatan senyawa alkaloid akan menyebabkan kerja hati semakin berat dan terganggu (Cipriano et al. 2001). Hal ini akan mengganggu fungsi fisiologis ikan yang akhirnya berdampak penurunan nafsu makan ikan.
Konversi pakan ikan uji sebelum dan sesudah uji tantang tidak berbeda nyata antar perlakuan (P>0,05). Hal ini menunjukkan bahwa pemberian tepung daun mengkudu dengan dosis 0,5%, 1% dan 2% tidak mempengaruhi kualitas pakan tiap perlakuan. Menurut NRC (1993), besar kecilnya rasio konversi pakan dipengaruhi oleh beberapa faktor tetapi yang terpenting adalah kualitas dan kuantitas pakan, spesies, ukuran dan kualitas air. Besar kecilnya rasio konversi pakan ini sangat menentukan efektivitas pakan tersebut.
Berdasarkan pengamatan kondisi organ dalam, terdapat perbedaan antara ikan yang disuntik dengan PBS dengan ikan uji yang disuntik A. hydrophila. Pada perlakuan kontrol negatif tidak menunjukkan adanya kelainan organ dalam. Pada perlakuan 0,5% terlihat bahwa hampir sama dengan perlakuan kontrol negatif, hanya saja ginjal berwarna merah kehitaman. Hal ini terjadi karena organ ginjal merupakan organ yang berperan sebagai penyaring (filter) beberapa bahan buangan sisa metabolisme yang terdapat dalam darah. Menurut Taufik (2001), patogen A. hydrophila selain memakan dan merusak jaringan organ tubuh juga mengeluarkan toksin yang disebarkan ke seluruh tubuh melalui aliran darah. Oleh karena itu, ginjal berwarna merah kehitaman karena telah menyaring buangan sisa metabolisme dalam darah yang tercemar oleh toksin bakteri A. hydrophila.
Pada perlakuan 1% dan 2% warna organ dalam hampir sama hanya saja limpa memgalami pembengkakkan pada perlakuan 2%. Limpa merupakan organ yang berperan dalam pemecahan eritrosit tua dan membentuk sel darah baru (Abdullah 2008). Perubahan organ limpa pada perlakuan ini disebabkan oleh meningkatnya jumlah pigmen dan hemosiderin pada limpa. Peningkatan tersebut disebabkan oleh aktivitas toksin bakteri yaitu adanya enzim hemolisin yang mampu melisiskan sel darah merah dan membebaskan hemoglobinnya (Angka 2005). Perlakuan 1% dan 2% memiliki empedu yang berwarna hijau kekuningan dan pembengkakkan pada perlakuan kontrol positif. Perubahan warna empedu menjadi kekuningan disebabkan oleh adanya gangguan pada organ hati, sehingga pembongkaran eritrosit menjadi hemin, Fe dan globin menjadi terhambat. Dengan demikian, produksi hemin sebagai zat asal warna empedu menjadi menurun (Hafsah 1994).
18
adanya infeksi bakteri A. hydrophila dapat mengakibatkan terganggunya proses metabolisme tubuh dan akhirnya ikan mengalami kematian.
Secara keseluruhan dari hasil pemeriksaan organ dalam, ikan uji perlakuan 0,5% memberikan hasil yang baik yaitu hampir sama dengan kontrol negatif. Hal ini menunjukkan bahwa pemberian tepung daun mengkudu pada pakan ikan uji mampu mempercepat regenerasi sel-sel yang rusak dan meningkatkan mekanisme respons imun ikan, baik seluler maupun humoral yang merupakan komponen penting dalam sistem pertahanan tubuh terhadap infeksi. Kondisi fisiologis homeostasis tubuh terkendali dan meningkatkan hemostasis saat terjadi luka.
Secara umum, gejala klinis yang terjadi pascauji tantang adalah radang, hemoragi, nekrosis, tukak dan adanya kematian. Pada perlakuan kontrol negatif setelah dilakukan penyuntikan dengan PBS (0,1 mL/ekor) tidak menunjukkan adanya kelainan klinis sampai akhir pemeliharaan. Pada perlakuan kontrol positif mengalami kelainan seperti radang, hemoragi, nekrosis, tukak dan kematian. Peradangan terjadi di daerah sekitar masuknya patogen. Kelainan ini terjadi karena adanya patogen yang masuk ke dalam tubuh inang dan menyebabkan infeksi. Pada dasarnya reaksi peradangan meliputi tiga tahap, yaitu terjadinya peningkatan suplai darah ke daerah sekitar luka atau infeksi, bertambahnya sifat permeabilitas pipa kapiler darah, serta terjadinya proses migrasi leukosit yang keluar dari kapiler dan masuk ke dalam jaringan secara merata (Suzuki 1992).
Pada penelitian ini setelah mengalami radang pascapenyuntikan A. hydrophila, kemudian berkembang menjadi hemoragi. Patogen A. hydrophila mendegradasi jaringan organ tubuh serta mengeluarkan toksik yang disebarkan ke seluruh tubuh melalui aliran darah sehingga menimbulkan warna kemerahan pada tubuh ikan. Infeksi A. hydrophila berkembang cepat dalam waktu 24 jam setelah infeksi, sehingga banyak ikan uji yang mengalami gejala tukak dan akhirnya mengalami kematian. Tingginya kematian pada perlakuan kontrol positif ini karena tidak diberi pakan yang mengandung bahan imunostimulan yang dapat merangsang sistem imunitasnya.
19
membrane) bakteri Gram negatif. Menurut Syamsir (2008), LPS dapat menyebabkan peradangan, demam, penurunan kadar besi dan pembekuan darah. Selanjutnya menurut Angka (2005), LPS dapat menyebabkan goncangan (shock) pada inang. Namun demikian, endotoksin ini akan dilepaskan ke lingkungan hanya apabila bakteri tersebut mati dan mengalami lisis.
Diameter luka yang terjadi mengalami sedikit penyempitan dengan waktu yang lebih lambat, terutama pada perlakuan kontrol positif. Hal ini terjadi, karena rusaknya jaringan limfomieloid sehingga ikan uji tidak mampu meningkatkan mekanisme respons imunitasnya, akibatnya banyak ikan uji yang mati pada perlakuan ini. Limfomieloid merupakan organ pembentuk respons imun dan darah pada ikan, yang terdiri dari jaringan limfoid (organ yang merespons antigen) dan mieloid (organ penghasil darah) bergabung menjadi satu (Affandi & Tang 2002).
Adanya penambahan tepung daun mengkudu dengan dosis 0,5% memberikan hasil yang lebih baik ditinjau dari diameter luka yang lebih sempit serta proses penyembuhannya yang relatif lebih cepat dibandingkan tanpa pemberian tepung daun mengkudu. Hal ini menunjukkan bahwa sistem imun pada ikan tersebut bekerja sebagai akibat adanya pemberian imunostimulan pada pakan yang termakan dan masuk ke dalam tubuh ikan. Pemberian dosis tersebut, diduga mampu meningkatkan produk jaringan limfomieloid untuk menghasilkan sel-sel darah dan meningkatkan respons imunitas ikan terhadap serangan patogen.
Peningkatan daya tahan tubuh ini diduga karena adanya senyawa alkaloid yang dibawa aliran darah menuju sel-sel tubuh. Akibatnya, sel-sel tersebut menjadi lebih aktif, sehat dan terjadi perbaikan struktur maupun fungsi serta bersifat detoksifikasi yang mampu menetralisir racun yang dihasilkan oleh bakteri A. hydrophila. Ditambahkan oleh Naim (2004), senyawa alkaloid bersifat toksik terhadap mikrob sehingga efektif membunuh bakteri dan virus. Mekanisme kerja dari alkaloid dihubungkan dengan kemampuan berinteraksi dengan DNA.
Selain itu, bahan imunostimulan yang terkandung dalam pakan adalah flavonoid yang merupakan golongan terbesar dari senyawa fenol. Senyawa fenol dari tanaman mengkudu memiliki kemampuan untuk membentuk kompleks dengan protein melalui ikatan hidrogen (Pleczar & Chan 1988), sehingga dapat merusak membran sel bakteri. Selain itu, flavonoid bersifat antibakteri dan antioksidan serta mampu meningkatkan kerja sistem imun karena leukosit sebagai pemakan antigen lebih cepat dihasilkan dan sistem limfoid lebih cepat diaktifkan (Rahman 2008). Flavonoid pada daun mengkudu menempel pada sel imun dan memberikan sinyal intraselular atau rangsangan untuk mengaktifkan kerja sel imun lebih baik. Selanjutnya ditambahkan oleh Suprapto (2006), bahwa adanya peningkatan sistem imun ikan akan mengakibatkan aktivitas limfosit dalam memfagosit bakteri, sehingga meningkatkan kesehatan ikan dan akibatnya dapat meningkatkan nafsu makan ikan. Menurut Angka et al. (2004), flavonoid bersifat antiinflamasi sehingga dapat mengurangi peradangan serta membantu mengurangi rasa sakit bila terjadi pendarahan atau pembengkakan pada luka, bersifat antibakteri dan antioksidan.
20
Menurut Nursal (1997), senyawa terpenoid yang mempunyai daya polaritas sama dengan golongan fenol. Mekanisme kerja dari senyawa terpenoid adalah mengganggu proses transportasi ion penting ke dalam sel bakteri. Terpenoid mampu berikatan dengan lemak dan karbohidrat yang akan menyebabkan permeabilitas dinding sel bakteri.
Senyawa saponin berfungsi sebagai antibakteri yaitu dapat menyebabkan kebocoran protein dan enzim dari dalam sel (Madduluri 2013). Saponin dapat menjadi anti bakteri karena zat aktif permukaannya mirip detergen, akibatnya saponin akan menurunkan tegangan permukaan dinding sel bakteri dan merusak permebialitas membran. Rusaknya membran sel ini sangat mengganggu kelangsungan hidup bakteri (Harborne 2006).
Patogen Aeromonas hydrophila selain mampu memproduksi eksotoksin dan endotoksin sebagai faktor virulensi, memiliki kemampuan untuk menempel pada sel tubuh ikan melalui aktivitas adhesins. Adhesins ini bersifat sangat selektif, hanya mampu mengenali rantai polimer D-mannosa dan L-sucosa yang terletak pada permukaan sel eukariot. Dengan menempelnya A. hydrophila pada permukaan sel inang, kemungkinan besar sel inang tersebut akan terinfeksi (Austin & Austin 1993). Namun demikian, dengan adanya senyawa saponin yang merupakan senyawa antibakteri maka akan menghambat fungsi membran sel sehingga merusak permeabilitas membran yang mengakibatkan dinding sel rusak atau hancur. Oleh karena itu, proses penyembuhan luka pada perlakuan yang diberi tepung daun mengkudu lebih cepat, karena kandungan bahan aktif telah tercampur pada pakan ini.
Ikan pada perlakuan 1% dan 2% memiliki nilai gejala klinis yang lebih rendah dibandingkan dengan perlakuan kontrol positif, dan perlakuan 0,5% memiliki nilai gejala klinis yang lebih rendah dari perlakuan 1% dan 2%. Selain itu, pemberian dosis 0,5% memiliki jumlah kematian kumulatif yang lebih rendah dari pada perlakuan lainnya. Hal ini diduga bahan aktif sebagai imunostimulan yang masuk ke dalam tubuh ikan lebih banyak dibandingkan dengan perlakuan lainnya. Hal ini dibuktikan dengan nafsu makan ikan yang lebih tinggi pada perlakuan 0,5%. Menurut Abdullah (2008), semakin besar konsumsi pakan (nafsu makan tinggi) maka semakin besar kesempatan ikan tersebut untuk memperoleh nutrien (karbohidrat, lemak, protein, vitamin dan mineral), serta bahan aktif lainnya yang dimasukkan ke dalam pakan, sehingga energi tersebut dapat dipergunakan untuk pemeliharaan (maintainance), proses metabolisme, aktivitas fisik, dan pertumbuhan.
21
KESIMPULAN DAN SARAN
Kesimpulan
Perlakuan pencegahan dengan penambahan tepung daun mengkudu dalam pakan komersial yang dicetak ulang (repelleting) dengan dosis 0,5% dapat memberikan kelangsungan hidup ikan patin pascauji tantang sebesar 83,33%, lebih tinggi dibandingkan dengan perlakuan lainnya.
Saran
Dalam pembuatan pakan untuk mencegah infeksi Aeromonas hydrophila pada ikan patin disarankan menggunakan tepung daun mengkudu dengan dosis 0,5%. Perlu dilakukan penelitian lanjutan mengenai penggunaan dosis yang lebih rendah dari 0,5% untuk pencegahan infeksi Aeromonas hydrophila.
DAFTAR PUSTAKA
Abdullah Y. 2008. Efektivitas ekstrak daun paci-paci Leucas lavandulaefolia untuk pencegahan dan pengobatan infeksi penyakit MAS Motile Aeromonad Septicaemia ditinjau dari patologi makro dan hematologi ikan lele dumbo Clarias sp.[skripsi]. Bogor (ID): Institut Pertanian Bogor. Affandi R, UM Tang. 2002. Fisiologi Hewan Air. Pekanbaru (ID): Unri Press. Albert A. 1973. Selective Toxicity.Chapman & Hall, London.
Angka SL, Priosoeryanto BP, Lay BW, Harris E. 2004. Penyakit motile aeromonad septicaemia pada ikan lele dumbo (Clarias sp.): upaya pencegahan dan pengobatannya dengan fitofarmaka. Forum Pascasarjana. 27(4): 339-350.
Angka SL. 2005. Kajian penyakit Motile Aeromonad Septicaemia (MAS) pada ikan lele dumbo (Clarias sp.): patologi, pencegahan, dan pengobatannya dengan fitofarmaka [disertasi]. Bogor (ID): Institut Pertanian Bogor. Austin B, Austin DA. 1993. Bacterial Fish Pathogens, Disease in Farm and Wild
Fish. Ed ke-2. London: Ellis Herwood.
Ayuningtyas AK. 2008. Efektivitas campuran meniran Phyllanthus niruri dan bawang putih Allium sativum untuk pengendalian infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo Clarias sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Boyd CE. 1982. Water Quality Management for Pond Fish Culture. Auburn University 4 th Printing, International Centre for Aquaculture Experiment Station. Auburn.
22
Cipriano RC. 2001. Aeromonas hydrophila and motile aeromonas septicemias of fish. Fish Disease Leaflet 68. Washington DC.
Deshmukh, Wadegaonkar, Bhagat RP, Wadegaonkar PA. 2011. Tissue specific expression of Anthraquinones, flavonoids and phenolics in leaf, fruit and root suspension cultures of Indian Mulberry (Morinda citrifola L.). Plant Omics Journal, 4(1):6-13.
DJPB [Direktorat Jenderal Perikanan Budidaya]. 2013. Statistik menakar target air tawar tahun 2013. http://www.djpb.kkp.go.id/berita.php?id=847[1 September 2014].
Dwidjoseputro D. 1994. Dasar-dasar Mikrobiologi. Jakarta (ID): Djambatan. Emerson KR, Russo RC, Lund RE, Thurston RV. 1975. Aqueous ammonia
equilibrium calculations: effect of pH and temperature. J. Fish. Res. Board Can, 32: 2377–2383.
Fathurrahmah. 1992. Efek anthelmintik beberapa tanaman obat terhadap cacing Raillentina spp secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hadie W, Emmawati L, Lusiastuti AM. 2010. Peningkatan produksi benih ikan patin di unit pembenihan rakyat (UPR) melalui penerapan kekebalan bawaan (Maternal Immunity). Prosiding Forum Inovasi Teknologi Akuakultur.
Hadioetomo RS. 1990. Dasar-dasar Mikrobiologi dalam Praktek. Jakarta (ID): PT Gramedia.
Hafsah S. 1994. Pengaruh penyuntikan Freud’s Complete Adjusvant dan bakteri Aeromonas hydrophila galur virulen L38 terhadap ikan lele dumbo (Clarias sp.) dewasa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Handfield M, Simartd P, Coullard M, Letarte R. 1996. Aeromonas hydrophila isolated from food and drinking water: hemaglutination, hemolysis and cytotoxity for a human intestinal cell line (Ht-29). Applied and Environmental Mikrobiology, 62: 3459-3461.
Harborne JB. 2006. Metode Fitokimia, Edisi ke-2. Bandung (ID): ITB.
Hendi. 2006. Diferensial leukosit ayam yang diinfeksi Eimeria tenella setelah pemberian sari buah mengkudu (Morinda citrifolia) dengan dosis bertingkat melalui air minum [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Herissuparman E. 2000. Studi aktivitas ekstrak chloroform buah mengkudu (Morinda citrifolia) sebagai anthelmintika pada domba yang diinfeksi Haemonchus contortus [tesis]. Bogor (ID): Institut Pertanian Bogor. Heyne K. 1987. Tumbuhan Berguna Indonesia. Jakarta (ID): Badan Litbang
Kehutanan.
Hildasari D. 1998. Penapisan kandungan kimia dan uji efek anthelmintic buah mengkudu (Morinda citrifolia L.) terhadap cacing lambung (Haemonchus contortus) secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor. Holt JG, Krieg NR, Sneath PHA, Staley JT, Williams ST. 1998. Bergey’s Manual
of Determinative Bacteriology. Williams & Wilkins. Baltimore.
Kabata Z. 1985. Parasites and Disease of Fish Cultured in the Tropics. Taylor and Francis Press, London and Philadelphia.
23
Madduluri S, Rao K, Babu, Sitaram B. 2013. In vitro evaluation of antibacterial activity of five indegenous plants extract against five bacterial pathogens of human. International Journal of Pharmacy and Pharmaceutical Sciences, 5(4): 679-684.
Mulia DS, Arif H. 2012. Efektivitas ekstrak daun sirih dalam menanggulangi ikan patin yang terinfeksi bakteri Aeromonas hydrophila. Jurnal Penelitian, 9(2).
Naim R. 2004. Senyawa antimikroba dari tanaman. http/www.kompas.com. [27 Januari 2015].
NRC. 1993. Nutrient Requirement of Fishes. National Academic of Sciences. Washington DC.
Nursal M, Nganro MR. 1997. Pengaruh ekstrak akar Achantus illicifolius terhadap pertumbuhan Vibrio parahaemolyticus. Jurnal Biosains, 2(1).
Olga, Rini RK, Akbar J, Isnansetyo, Sembiring L. 2007. Protein Aeromonas hydrophila sebagai vaksin untuk pengendalian MAS (Motile Aeromonas Septicaemia) pada jambal siam (Pangasius hypophthalmus). Jurnal Perikanan, IX (1): 17-25.
Pleczar MJ, ECS Chan. 1988. Dasar-dasar Mikrobiologi 2. Jakarta (ID): Universitas Indonesia.
Rahman MF. 2008. Potensi ekstrak daun pepaya pada ikan gurame yang diinfeksi bakteri Aeromonas hydrophila [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rahman MH, Somsiri T, Tajima K, Ezura Y. 2004. Distribution of Aeromonas sp. emphasizing on a newly identified species of Aeromonas sp. T8 isolated from fish and aquatic animals in Southeast Asia. J. Biol Sci, 7: 258–268. Reed LJ, Muench H. 1938. A simple method of estimating fifty percent endpoints.
Am. J. Hygiene, 27(3): 493-497.
Satrija F. 1998. Study on the use of Carica papaya L. Latex and Morinda citrifolia L. fruit against gastrointestinal nematodes of sheep. Final Report-Young Academic Program URGE Batch I.
SNI [Standar Nasional Indonesia]. 2002. Ikan patin siam (Pangasius hypophthalmus). Badan Standarisasi Nasional.
Soemardji AA, Soegiarto, Sigit. 1994. Dekok daun Morinda citrifolia L. sebagai obat cacing. Simposium Penelitian Bahan Obat Alami VIII dan Muktamar PERHIPBA VI di Bogor.
Sundana, Mariyono. 2002. Teknik pencegahan dan pengobatan penyakit bercak merah pada ikan air tawar yang disebabkan oleh bakteri Aeromonas hydrophila. Buletin Teknik Pertanian, 7(1).
Suprapto. 2006. Tubuh kebal dengan herbal. http://www.depkes.go.id [28 Januari 2014].
Suzuki Y, Iida T. 1992. Fish granulocytes in the process of imflamation. Annual Review of Fish disease, 2: 149-160.
Swann L, White RM. 1989. Diagnosis and treatment of Aeromonas hydrophila infection of fish. Aquaculture extension, Purdue University.
24
Taufik P. 1984. Faktor kualitas air dapat mempengaruhi timbulnya suatu penyakit pada ikan. Majalah Pertanian No.3, tahun ke-31. Jakarta (ID): Departemen Pertanian.
Taufik P. 2001. Ketahanan ikan baung Mystus nemurus terhadap patogen Aeromonas hydrophila. Jurnal Sains Akuatik, 4(2): 6-12.
Waha MG. 2002. Sehat dengan Mengkudu (Noni- Morinda citrifolia). Jakarta (ID): Mitra Sitta Falah Group.
Wahjuningrum D, Angka SL, Lesmanawati W, Sa’diyah, Yuhana M. 2007. Prospek mahkota dewa Phaleria macrocarpa untuk pencegahan penyakit motile Aeromonad septicaemia pada ikan patin Pangasionodon hypophthalmus. Jurnal Akuakultur Indonesia, 6(1): 109–117.
Wahjuningrum D, Ashry N, Nuryati S. 2008. Pemanfaatan ekstrak daun ketapang Terminalia cattapa untuk pencegahan dan pengobatan ikan patin Pangasionodon hypophthalmus yang terinfeksi Aeromonas hydrophila. Jurnal Akuakultur Indonesia, 7(1): 79-94.
Wahjuningrum D, Kurniawan D, Setyotomo K, Setiawati M. 2012a. Penggunaan campuran tepung meniran dan bawang putih dengan metode repeleting dalam pakan untuk pencegahan dan pengobatan Aeromonas hydrophila pada ikan lele dumbo Clarias sp. Jurnal Akuakultur Indonesia, 11(1):11-16.
Wahjuningrum D, Widiani I, Nuryati S. 2012b. Lama pemberian pakan mengandung tepung meniran phyllanthus niruri dan bawang putih allium sativum untuk pencegahan infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo Clarias sp. Jurnal Akuakultur Indonesia, 11(2):179-189. Wati RA. 2009. Efektivitas pemberian ekstrak daun mengkudu (Morinda citrifolia
Lignosae) sebagai pengganti antibiotik terhadap performa ayam broiler yang diinfeksi Salmonella typhimurium [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Widdhiasmoro NP. 2000. Kajian efektivitas anthelmintika ekstrak buah mengkudu (Morinda citrifolia) terhadap cacing Hymenolepsis nana pada mencit putih (Mus musculus albinus) [tesis]. Bogor (ID): Institut Pertanian Bogor. Wiryanti I. 2004. Tanggap kebal dan tampilan produksi ayam pedaging yang
diberi ekstrak buah mengkudu (Morinda citrifolia) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Yuhana M, Normalina, Sukenda. 2008. Pemanfaatan ekstrak bawang putih Allium sativum untuk pencegahan dan pengobatan pada ikan patin Pangasionodon hypophthalmus yang diinfeksi Aeromonas hydrophila. Jurnal Akuakultur Indonesia, 7(1): 95-107.
Zoleta JMR, Balito MBR, Caparaz MFM, Izon EC, Ponio JI, Termonio RMG, Uayan MB. 2014. Effect of crude extracts of Morinda citrifolia leaves to blood glucose level of allonxan-induced male mice. Peer Reviwed Journal, 1.
25
LAMPIRAN
Lampiran 1 Perhitungan nilai LD50
Kepadatan
bakteri Mati Hidup
Nilai akumulasi
Mati (ekor)
Hidup (ekor)
Rasio kematian
(%)
107 7 3 14 13 51,85
106 5 5 7 10 41,18
105 2 5 2 5 28,57
Selang proporsi = K %−
K %−K w %
= ,8 − , 8,8 −
= ,
Log negatif LD50 = Log negatif nilai di atas 5 % + selang proporsi
= -Log 107 + 0,17
= 6,82
Maka LD50= 106,82 CFU/mL ≈ 107 CFU/mL
Lampiran 2 Gambar hasil uji zona bening (hambat) di sekitar kertas cakram yang diberi ekstrak tepung daun mengkudu
A B C D
26
Lampiran 3 Analisis statistik kelangsungan hidup ikan patin
ANOVA
Sumber keragaman Jumlah kuadrat DB Kuadrat tengah F P
Perlakuan 6426,66 4 1606,67 37,07 0,00
Galat 433,33 10 43,33
Jumlah 6860,00 14
Uji Tukey
Perlakuan N
α = 0,05
1 2 3
Tukey BNJa
K+ 3 40,00
2% 3 60,00
1% 3 61,67
0,5% 3 83,33
K- 3 100,00
Sig. 1,00 1,00 0,07
Lampiran 4 Analisis statistik nafsu makan ikan patin sebelum uji tantang
ANOVA
Sumber keragaman Jumlah kuadrat DB Kuadrat tengah F P
Perlakuan 5,89 4 1,47 53,73 0,00
Galat 0,27 10 0,03
Total 6,17 14
Uji Tukey
Perlakuan N
α = 0,05
1 2
Tukey BNJa
2% 3 3,34
K+ 3 3,42
K- 3 3,45
1% 3 4,53
0,5% 3 4,81
27
Lampiran 5 Analisis statistik nafsu makan ikan patin setelah uji tantang
ANOVA
Sumber keragaman Jumlah kuadrat DB Kuadrat tengah F P
Perlakuan 7,11 4 1,78 18,37 0,00
Galat 0,97 10 0,10
Total 8,08 14
Uji Tukey
Perlakuan N
α = 0,05
1 2
Tukey BNJa
K+ 3 2,64
1% 3 2,70
2% 3 2,78
0,5% 3 3,37
K- 3 4,47
Sig. 0,10 1,00
Lampiran 6 Analisis statistik konversi pakan ikan patin sebelum uji tantang
ANOVA
Sumber keragaman Jumlah kuadrat DB Kuadrat tengah F P
Perlakuan 0,77 4 0,19 2,50 0,11
Galat 0,77 10 0,07
Total 1,55 14
Uji Tukey
Perlakuan N
α = 0,05 1 Tukey
BNJa
K+ 3 4,15
K- 3 4,18
0,5% 3 4,46
1% 3 4,66
2% 3 4,68
28
Lampiran 7 Analisis statistik konversi pakan ikan patin setelah uji tantang
ANOVA
Sumber keragaman Jumlah kuadrat DB Kuadrat tengah F P
Perlakuan 2,75 4 0,69 41,09 0,00
Galat 0,17 10 0,02
Total 2,92 14
Uji Tukey
Perlakuan N
α = 0,05
1 2
Tukey BNJa
K+ 3 0,29
2% 3 0,36
1% 3 0,36
0,5% 3 0,45
K- 3 1,43
29
RIWAYAT HIDUP
Penulis dilahirkan di Taileleu-Mentawai pada tanggal 26 April 1992, merupakan putra ke-2 dari 4 bersaudara dari keluarga Bapak Markus Beretci Samalei dan Ibu Martha Takaronan. Penulis menyelesaikan pendidikan akademik di SDN 14 Desa Pasakiat Taileleu, SMP Yos Sudarso II Siberut Selatan, SMA Negeri 1 Muara Siberut, dan diterima di IPB melalui jalur BUD (Beasiswa Utusan Daerah) Pemda Kabupaten Kepulauan Mentawai, Sumatera Barat tahun 2011 pada program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis pernah menjadi asisten praktikum Dasar-dasar Akuakultur pada tahun 2013/2014 dan tahun 2014/2015, Dasar-Dasar-dasar Mikrobiologi Akuatik pada tahun 2014/2015, kegiatan magang di Balai Besar Budidaya Laut Lampung pada tahun 2014 dan mengikuti praktik lapang akuakultur di PT. Surya Windu Kartika, Rogojampi-Jawa Timur pada tahun 2014. Selain itu, penulis juga aktif menjadi Pengurus Himpunan Mahasiswa Akuakultur (HIMAKUA) sebagai anggota devisi Riset tahun 2013/2014.