1.
JENIS TANIN, TOTAL TANIN DAN AKTIVITAS
PENGHAMBATAN
α
-GLUKOSIDASE DARI
EKSTRAK DAUN DAN KULIT BATANG SURIAN
(
Toona sinensis
Merr.)
FITRIANA SHOFIA MONISA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Jenis Tanin, Total Tanin dan Aktivitas Penghambatan α-Glukosidase dari Ekstrak Daun dan Kulit Batang Surian (Toona sinensis Merr.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2016
Fitriana Shofia Monisa
RINGKASAN
FITRIANA SHOFIA MONISA. Jenis Tanin, Total Tanin dan Aktivitas Penghambatan α-Glukosidase dari Ekstrak Daun dan Kulit Batang Surian (Toona sinensis Merr.) Dibimbing oleh MARIA BINTANG dan MEGA SAFITHRI.
Surian (Toona sinensis Merr.) merupakan tumbuhan kayu hasil hutan rakyat yang cepat dan mudah tumbuh. Surian termasuk dalam famili Meliaceae yang memiliki banyak manfaat dan aktivitas biologis seperti antioksidan, antikanker dan antidiabetes. Penelitian ini bertujuan mengetahui aktivitas penghambatan ekstrak daun dan kulit batang surian terhadap α-glukosidase secara in vitro dan mengidentifikasi jenis serta total tanin yang terkandung sehingga daun dan kulit batang tanaman surian dapat digunakan sebagai alternatif obat tradisional dalam pengobatan diabetes.
Serbuk daun dan kulit batang surian diekstraksi dengan air menggunakan metode perebusan dan etanol 70% dengan metode maserasi. Ekstrak air dan ekstrak etanol selanjutnya difraksinasi menggunakan dietil eter. Hasil penapisan fitokimia menunjukkan bahwa daun dan kulit batang surian mengandung flavonoid, triterpenoid, tanin dan saponin.
Identifikasi jenis tanin ditentukan dengan menggunakan pereaksi FeCl3 dan Stiasny. Hasil identifikasi menunjukkan bahwa ekstrak daun dan kulit batang surian memiliki jenis tanin yang berbeda. Ekstrak daun surian mengandung jenis tanin terhidrolisis sedangkan ekstrak kulit batang surian mengandung jenis tanin terkondensasi. Kandungan total tanin dianalisis menggunakan metode titrasi permanganometri. Kandungan total tanin yang paling tinggi ditunjukkan ekstrak tanin kulit batang etanol hasil fraksinasi sebesar 9.35 mg/g.
Aktivitas penghambatan α-glukosidase diukur dengan menggunakan metode spektrofotometri pada panjang gelombang 410 nm. Aktivitas penghambatan α-glukosidase yang paling tinggi ditunjukkan oleh ekstrak tanin daun etanol hasil fraksinasi dengan IC50 50.44 µg/mL. Hasil penelitian menunjukkan bahwa ekstrak daun dan kulit batang surian mempunyai aktivitas penghambatan α-glukosidase secara in vitro dan jenis tanin mempengaruhi aktivitas penghambatan α-glukosidase.
SUMMARY
FITRIANA SHOFIA MONISA. The type of tannin, total tannin content, and Inhibitory Activity of α-Glucosidase From Surian (Toona sinensis Merr.) Leaf and Bark Extracts. Supervised by MARIA BINTANG and MEGA SAFITHRI.
Surian (Toona sinensis Merr.) is a timber plant as people forest product, that can quick and easy to grow. Surian included in the family Meliaceae that has many benefits and biological activities such as antioxidant, anticancer and antidiabetic.
The aim of this study was to determine in vitro inhibitory activity of α-glucosidase, the type of tannin, and total tannin content from surian leaves and
bark extracts so that it can be used as an alternative traditional medicine in the treatment of diabetes.
The leaves and bark powder of surian were extracted by water using boiling method and by 70% ethanol using maceration method. Water and 70% ethanol extracts of surian leaf and bark were then fractionated using diethyl ether. Phytochemical screening showed the leaves and bark of surian contained flavonoids, triterpenoids, tannins dan saponin.
The type of tannin was determined using reagent ferric chloride and stiasny. The result showed that the type of tannin in surian leaf extract was hydrolyzable tannin, while surian bark extract was condensed tannin.
The total tannin content was analyzed by permanganate titration. The highest total tannin content was shown by tanin extract of ethanol surian bark
at 9.35 mg/g.
The α-glucosidase inhibitory activity was performed using spectrophotometric method at wavelength of 410 nm. The tanin extract of ethanol surian leaf showed highest inhibitory α-glucosidase activity with IC50 50.44 µg/mL. Therefore, these results showed that surian leaf and bark extracts had in vitro α-glucosidase inhibitory activity.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
JENIS TANIN, TOTAL TANIN DAN AKTIVITAS
PENGHAMBATAN
α
-GLUKOSIDASE DARI
EKSTRAK DAUN DAN KULIT BATANG SURIAN
(
Toona sinensis
Merr.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Jenis Tanin, Total Tanin dan Aktivitas Penghambatan α-Glukosidase dari Ekstrak Daun dan Kulit Batang Surian
(Toona sinensis Merr.) Nama : Fitriana Shofia Monisa
NIM : G851130331
Disetujui oleh Komisi Pembimbing
Prof Dr drh Maria Bintang, MS Ketua
Dr Mega Safithri, SSi MSi Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis haturkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Judul karya ilmiah dalam penelitian yang dilaksanakan sejak September 2015 sampai dengan Januari 2016 ini ialah Jenis Tanin, Total Tanin dan Aktivitas Penghambatan α-Glukosidase dari Ekstrak Daun dan Kulit Batang Surian (Toona sinensis Merr.)
Ucapan terima kasih kepada Prof Dr drh Maria Bintang, MS dan Dr Mega Safithri, SSi MSi selaku pembimbing atas ilmu, saran dan kesabaran yang telah diberikan. Terima kasih juga kepada keluarga besar Biokimia (Dosen, Staff TU, Laboran dan teman-teman Biokimia 2013) yang telah memberikan motivasi dan membantu penulis dalam menyelesaikan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) sebagai sponsor Beasiswa Pendidikan Pascasarjana Dalam Negeri 2013 dan Bapak Dr Syamsul Falah, SHut MSi atas dana penelitian unggulan sesuai mandat divisi (PUD) yang telah diberikan. Ucapan spesial kepada kedua orang tua, Saudara Kak Shera, Abang Reza, Adek Syifa, Suami dan ananda tercinta Faizah, Ayunda Evita, Bu Lilis, Sahabat Chea, Vida, Tiana, Asih, Bu Husna dan Shinta serta teman-teman penelitian Titi, Azra, Liya, Feny yang selalu memberikan do’a, semangat, dan dukungannya kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor,Mei 2016
DAFTAR ISI
Waktu dan Tempat Penelitian 3
Bahan 3
Alat 3
Prosedur Penelitian 4
Analisis Data 7
3 HASIL 7
Kadar Air Serbuk Daun dan Kulit Batang Surian 7
Ekstraksi dan Fraksinasi Sampel 7 Kadar Air Serbuk Daun dan Kulit Batang Surian 12
DAFTAR TABEL
1. Sistem reaksi penghambatan α-glukosidase 6
2. Rendemen ekstrak daun dan kulit batang 7
3. Rendemen ekstrak tanin daun dan kulit batang 8
4. Senyawa fitokimiaekstrak daun dan kulit batang 8 5. Uji identifikasi jenis tanin ekstrak daun dan kulit batang 9 6. Uji identifikasi jenis tanin ekstrak tanin daun dan kulit batang 9 7. Aktivitas penghambatan α-glukosidase ekstrak daun dan kulit
batang 11
8. Aktivitas penghambatan α-glukosidase ekstrak tanin daun dan
kulit batang 11
DAFTAR GAMBAR
1. Perbandingan kandungan total tanin ekstrak kasar 10 2. Perbandingan kandungan total tanin ekstrak tanin hasil fraksinasi 10
3. Reaksi senyawa tanin dengan FeCl3 14
4. Reaksi antara catechin dengan formaldehid 15
5. Reaksi hidrolisis substrat p-NPG oleh α-glukosidase 17
DAFTAR LAMPIRAN
1. Diagram alir penelitian 25
2. Hasil uji analisis statistik total tanin ekstrak daun dan kulit batang 26 3. Hasil uji analisis statistik total tanin ekstrak tanin daun dan kulit
batang hasil fraksinasi 27 4. Hasil uji analisis statistik nilai IC50 penghambatan α-glukosidase
ekstrak daun dan kulit batang 28
5. Hasil uji analisis statistik nilai IC50 penghambatan α-glukosidase
ekstrak tanin daun dan kulit batang hasil fraksinasi 29 6. Data persen penghambatan α-glukosidase ekstrak daun 30 7. Data persen penghambatan α-glukosidase ekstrak kulit batang 31 8. Data persen penghambatan α-glukosidase ekstrak tanin daun 32 9. Data persen penghambatan α-glukosidase ekstrak tanin kulit
batang 33
10. Data persen penghambatan α-glukosidase akarbose 34 11. Kurva persen penghambatan α-glukosidase vs konsentrasi dari
ekstrak etanol daun 35
12. Kurva persen penghambatan α-glukosidase vs konsentrasi dari
ekstrak tanin daun pelarut etanol 36
13. Data nilai IC50 aktivitas penghambatan α-glukosidase akarbose
dan ekstrak daun dan kulit batang 37
14. Data nilai IC50 aktivitas penghambatan α-glukosidase ekstrak
1 PENDAHULUAN
Latar Belakang
Pola hidup tidak sehat dari masyarakat menyebabkan terjadinya berbagai penyakit, salah satunya adalah diabetes mellitus. Data International Diabetes Federation (IDF) penderita diabetes di dunia pada tahun 2014 mencapai 387 juta jiwa dan diperkirakan akan meningkat pada tahun 2035 menjadi 592 juta jiwa. Prevalensi diabetes Indonesia juga sangat tinggi yaitu menempati urutan kelima di dunia setelah Brazil dan kedua setelah India di kawasan Asia Tenggara dengan perkiraan jumlah penderita pada tahun 2014 mencapai 9.1 juta jiwa dari 8.5 juta jiwa pada tahun 2013 (IDF 2014). Peningkatan ini dikarenakan penyakit diabetes mellitus merupakan penyakit keturunan yang dapat terjadi pada semua kelompok umur dan populasi bangsa manapun (Sutedjo 2010). Penatalaksanaan diabetes diperlukan untuk menurunkan morbiditas dan mortalitas penderita diabetes dengan terapi tanpa obat dan terapi obat. Terapi tanpa obat dapat dilakukan dengan cara pengaturan diet dan olah raga sedangkan terapi dengan obat dalam bentuk obat hipoglikemik oral, terapi insulin atau kombinasi keduanya (Depkes 2005).
Menurut Badan POM pengobatan penderita diabetes mellitus menggunakan obat-obatan sintetik membutuhkan biaya yang cukup tinggi dan menimbulkan efek samping seperti diare, kembung, peningkatan risiko infark miokardial dan kardiovaskular (BPOM 2010). Faktor biaya dan efek samping mendorong pengobatan diabetes beralih pada tanaman yang mempunyai khasiat obat antihiperglikemia dengan cara menghambat kerja α-glukosidase yang terletak pada dinding usus halus (Mataputun et al. 2013). α-glukosidase merupakan jenis enzim hidrolase yang berperan dalam proses pemecahan karbohidrat menjadi glukosa yang kemudian akan diserap tubuh sehingga akan meningkatkan kadar glukosa darah (Gao et al. 2008; Bosenberg 2008). Senyawa bioaktif pada tanaman yang diketahui memiliki potensi sebagai penghambat kerja α-glukosidase adalah flavonoid, alkaloid, terpen, dan tanin. (Zhao et al. 2009; Hagerman 2002).
Penelitian mengenai tanaman yang mengandung senyawa bioaktif khususnya tanin sebagai penghambat kerja α-glukosidase menjadi penting dikarenakan tanin mempunyai beberapa aktivitas biologis yang berkaitan dengan pengobatan antidiabetes. Berdasarkan hasil penelitian Safithri et al. (2016) daun
sirih merah yang mengandung tanin mempunyai aktivitas penghambatan α-glukosidase. Selain daun sirih merah, tanaman yang mengandung bioaktif tanin
tumbuhan hijau tingkat tinggi maupun tingkat rendah dengan kadar dan kualitas yang berbeda (Danarto et al. 2011).
Surian (Toona sinensis) merupakan tanaman kayu yang cepat dan mudah tumbuh (Djam’an 2002). Surian diklasifikasikan ke dalam kingdom Plantae, divisi Magnoliophyta, kelas Magnoliopsida, ordo Sapindales, keluarga Meliaceae, dan genus Toona (Kumar et al. 2012). Secara ilmiah, daun surian mengandung flavonoid, polifenol, lignan, tanin, alkaloid, saponin, steroid, terpenoid, minyak dan lemak (Chen et al. 2000). Kulit batang surian mengandung triterpenoid, flavonoid, alkaloid, tanin, dan saponin (Santoni et al. 2010; Kardono et al. 2002). Surian merupakan jenis pohon yang digunakan dalam gerakan nasional rehabilitasi hutan dan lahan, penghijauan kota dan pembangunan hutan rakyat di Indonesia sehingga mudah diperoleh (Dephut 2004; Sari et al. 2011). Peran surian (Toona sinensis) dalam menghambat aktivitas α-glukosidase telah diteliti sebelumnya oleh Zhao et al. (2009) dengan menggunakan batang sebagai sampelnya. Hasil penelitian menujukkan bahwa komponen dalam batang yang memberikan aktivitas inhibisi α-glukosidase adalah asam galat, katekin, epikatekin, prosianidin B3 dan prosianidin B4 dengan nilai IC50 secara berurutan sebesar 24.3 μM, 190.7 μM, 189 μM, 111 μM, dan 89 μM.
Berdasarkan hasil penelitian Zhao et al. (2009) belum ada yang meneliti mengenai faktor yang berperan seperti jenis tanin dan total tanin yang terkandung dalam meningkatkan aktivitas penghambatan α-glukosidase oleh surian. Oleh karena itu, penelitian ini bertujuan mengetahui aktivitas penghambatan ekstrak daun dan kulit batang surian terhadap α-glukosidase secara in vitro dan mengidentifikasi jenis serta total tanin yang terkandung sehingga dapat diketahui korelasi antara jenis tanin dan total tanin dalam memberikan pengaruh terhadap aktivitas penghambatan α-glukosidase.
Perumusan Masalah
Diabetes mellitus (DM) adalah penyakit gangguan metabolisme karbohidrat, lipid dan protein yang disebabkan oleh gangguan produksi, sekresi atau resistensi hormon insulin dari sel beta pankreas sehingga terjadi hiperglikemia. Pengobatan antidiabetes dengan obat-obatan sintetik membutuhkan biaya tinggi dan menimbulkan banyak efek samping. Oleh sebab itu, diharapkan tanaman obat seperti daun dan kulit batang surian yang mengandung salah satu senyawa fitokimia tanin menjadi obat alternatif diabetes mellitus melalui aktivitas penghambatan kerja α-glukosidase.
Tujuan Penelitian
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan tambahan informasi ilmiah tentang pemanfaatan bioaktif tanin dari ekstrak daun dan kulit batang surian sebagai penghambat α-glukosidase.
Ruang Lingkup Penelitian
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2015 sampai Januari 2016. Penelitian dikerjakan di laboratorium Biokimia IPB dan Pusat Studi Biofarmaka.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah daun dan kulit batang surian (Toona sinensis Merr.) yang diperoleh dari Kecamatan Tanjung Sari, Kabupaten Sumedang, Jawa Barat, Indonesia, etanol 70%, etanol 96%, dietil eter, enzim α-glukosidase yang berasal dari rekombinan Bacillus stearothermophilus (Sigma G3651-250UN, Jerman), substrat p-nitrofenil-α -D-glukopiranosida (pNPG) (Sigma Aldrich, USA), dimetil sulfoksida (DMSO) (Merck, Jerman), akarbose, indigokarmin, pereaksi stiasny dan KMnO4 0,1 N.
Alat
Peralatan yang digunakan dalam penelitian ini adalah oven, waterbath, corong pisah, rotary evaporator, pH meter (Eutech Instruments), vortex mixer (BI type 37600 mixer), microplate reader (Biotek Epoch), inkubator, buret (Pyrex) dan alat gelas yang biasa digunakan seperti tabung reaksi, cawan, gelas ukur.
Prosedur Penelitian
Preparasi Sampel (Hamidah 2006)
Daun dan kulit batang surian dikeringudarakan dan dihaluskan sampai berbentuk serbuk berukuran 40-60 mesh.
Penentuan Kadar Air Daun dan Kulit Batang Surian (SNI 01-3182-1992) Kadar air serbuk daun dan kulit batang surian ditentukan dengan cara pengeringan di dalam oven. Cawan porselin dikeringkan pada suhu 105°C selama 15 menit lalu didinginkan dalam desikator dan ditimbang dengan neraca analitik. Sebanyak 1 gram sampel dimasukkan ke dalam cawan dan dipanaskan pada suhu 105°C selama 3 jam lalu didinginkan dalam desikator selama 15 menit kemudian ditimbang. Pemanasan diulang sampai diperoleh bobot konstan. Kadar air dihitung dengan persamaan :
Ekstraksi Daun dan Kulit Batang Surian (BPOM 2004; Handa et al 2008)
Ekstraksi daun dan kulit batang surian dilakukan dengan metode perebusan dan maserasi. Perbandingan serbuk daun dan kulit batang surian dengan pelarut adalah 1:10 (b/v). Ekstraksi melalui perebusan dilakukan dengan cara merebus simplisia ke dalam pelarut air selama 2 jam pada suhu 80°C sedangkan maserasi dilakukan dengan cara merendam simplisia ke dalam pelarut etanol 70%. Maserasi dilakukan selama 72 jam dengan shaker pada kecepatan 150 rpm di suhu ruang. Campuran dipisahkan dan filtrat yang diperoleh dipekatkan menggunakan rotaryevaporator sehingga diperoleh ekstrak kering air dan ekstrak kering etanol 70%. Rendemen ekstrak dinyatakan dalam persen dihitung dengan menggunakan persamaan sebagai berikut :
Fraksinasi Tanin (Kim et al. 2008; Sulastri 2009; Moosophin 2010)
Ekstrak air dan ekstrak etanol 70% selajutnya difraksinasi secara ekstraksi cair-cair menggunakan pelarut dietil eter. Sebanyak 5 gram ekstrak air dan ekstrak etanol 70% dari daun dan kulit batang surian dilarutkan dalam air panas 50 mL, dilakukan pengadukan sampai homogen kemudian dimasukkan ke dalam corong pisah. Campuran ekstrak etanol 70% dan ekstrak air dari daun dan kulit batang surian masing-masing difraksinasi dengan pelarut dietil eter sebanyak 50 mL. Campuran dikocok setiap 10 menit sekali sebanyak 3 kali, lalu didiamkan lebih kurang 30 menit untuk mencapai kondisi jenuh, sehingga diperoleh lapisan dietil eter dan air. Lapisan dietil eter dipisahkan, kemudian lapisan air hasil fraksinasi dipekatkan dengan rotary evaporator. Lapisan air yang telah dipekatkan dilarutkan ke dalam 50 mL air panas untuk ekstrak air dan 50 mL etanol 96% untuk ekstrak etanol 70% yang kemudian dipekatkan kembali menggunakan
rotary evaporator sehingga diperoleh ekstrak tanin air dan ekstrak tanin etanol. Uji Fitokimia (Farnsworth 1966; Vinod et al. 2010; Fitrilia et al. 2015)
Penapisan fitokimia dari ekstrak air dan ekstrak etanol meliputi analisis kualitatif tanin, alkaloid, flavonoid, saponin dan triterpenoid.
Uji Tanin. Larutan uji dibuat dengan mereaksikan 10 mg sampel dengan 50 mL air panas, kemudian dipanaskan hingga mendidih selama 5 menit dan filtrat disaring. Sebanyak 5 mL larutan uji dimasukkan ke dalam tabung reaksi, kemudian ditambahkan beberapa tetes FeCL3. Terbentuknya warna biru tua atau hitam kehijauan menunjukkan adanya tanin.
Uji Alkaloid. Sebanyak 50 mg ekstrak ditambahkan dengan 1 mL
kloroform dan 3 tetes NH3, kemudian disaring dan filtratnya dimasukkan ke dalam tabung reaksi. Ekstrak kloroform dalam tabung reaksi dikocok dengan 10 tetes H2SO4 2 M dan lapisan asamnya dipisahkan ke dalam tabung reaksi yang lain. Lapisan asam ini diteteskan pada lempeng (spot) tetes dan ditambahkan pereaksi Meyer, Wagner, dan Dragendorf yang akan menimbulkan endapan warna berturut-turut putih, coklat, dan merah.
Uji Flavonoid. Sebanyak 10 mg sampel direaksikan dengan 10 mL air
HCl pekat dan 1 mL amil alkohol. Uji positif ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Saponin. Sebanyak 10 mg sampel dimasukkan ke dalam tabung reaksi,
kemudian ditambahkan 10 mL air panas lalu didinginkan. Larutan uji dikocok vertikal selama 10 detik, kemudian diamati selama 10 menit. Terbentuknya buih setinggi 1 – 10 cm menunjukkan adanya saponin dalam sampel. Pada penambahan 1 tetes HCl 2N buih tidak hilang.
Uji Triterpenoid. Sebanyak 10 mg sampel ditambahkan dengan 5 mL
larutan eter, kemudian diuapkan dalam cawan penguap. Larutan uji ditambahkan dengan asam asetat anhidrat dan asam sulfat pekat (2:1). Terbentuknya warna merah-hijau adanya triterpenoid.
Uji Identifikasi Jenis Tanin (Desinta 2015)
Sebanyak 80 mg ekstrak air dan ekstrak etanol 70% daun dan kulit batang surian masing-masing dilarutkan ke dalam 50 mL air panas. Campuran disaring dan filtrat diambil masing-masing 5 mL kemudian dimasukkan ke dalam tabung reaksi dan ditambahkan dengan pereaksi FeCl3 dan Stiasny. Filtrat ditambahkan FeCl3 10% pada filtrat akan terbentuk warna biru tinta atau hitam menunjukkan adanya tanin galat (tanin terhidrolisis), endapan biru hitam menunjukkan gallotanin/elagitanin (tanin terhidrolisis), endapan hitam kehijauan menunjukkan tanin terkondensasi.
Filtrat ditambahkan dengan pereaksi Stiasny L formaldehid 30% dan asam klorida 37% (2:1) kemudian dipanaskan selama 30 menit, bila terjadi endapan merah, menunjukkan adanya tanin katekol (tanin terkondensasi) dan bila tidak terjadi endapan merah menunjukkan adanya tanin terhidrolisis.
Uji Total Tanin (Depkes 1979)
Sebanyak 0.2 g ekstrak air dan ekstrak etanol kulit batang dan daun surian masing-masing dimasukkan dalam labu Erlenmeyer 250 mL yang sudah ditambahkan dengan air mendidih 5 mL. Setelah itu dipanaskan selama 30 menit di atas penangas air. Selanjutnya didiamkan selama 10 menit dan disaring dengan kapas ke dalam labu takar 25 mL. Residu yang tertinggal pada kapas ditambahkan dengan air mendidih yang kemudian disaring lagi dengan kapas sampai esktrak tanin habis. Setelah selesai, cairan didinginkan dan ditambahkan dengan air sampai tanda tera. Pipet sebanyak 2.5 mL larutan ke dalam labu takar 100 mL, kemudian ditambahkan dengan 2.5 mL indigokarmin dan air sampai tanda tera. Tahap akhir, titrasi dengan KMnO4 0.1 N hingga larutan berwarna kuning emas. Larutan blanko dibuat dengan prosedur yang sama tanpa ekstrak. Sebanyak 1 mL KMnO4 0.1 N setara dengan 0.004157 g tanin. Total tanin dihitung dengan persamaan:
Uji Aktivitas α-Glukosidase (Sancheti et al. 2009; Sugiwati et al. 2009)
Sebanyak 10 μL larutan standar, blanko dan sampel (konsentrasi 5, 10, 30, 50, 100, 200, 400 dan 500 µg/mL) dimasukkan ke dalam sumur microplate reader
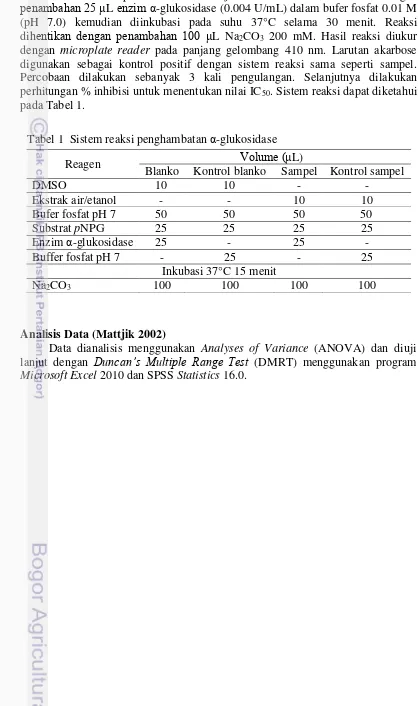
25 μL substrat berupa p-nitrofenil-α-D-glukopiranosida (pNPG) 10 mM ditambahkan beberapa saat sebelum uji dimulai. Reaksi diinisiasi dengan penambahan 25 μL enzim α-glukosidase (0.004 U/mL) dalam bufer fosfat 0.01 M (pH 7.0) kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan dengan penambahan 100 μL Na2CO3 200 mM. Hasil reaksi diukur dengan microplate reader pada panjang gelombang 410 nm. Larutan akarbose digunakan sebagai kontrol positif dengan sistem reaksi sama seperti sampel. Percobaan dilakukan sebanyak 3 kali pengulangan. Selanjutnya dilakukan perhitungan % inhibisi untuk menentukan nilai IC50. Sistem reaksi dapat diketahui pada Tabel 1.
Tabel 1 Sistem reaksi penghambatan α-glukosidase
Reagen Volume (μL)
Blanko Kontrol blanko Sampel Kontrol sampel
DMSO 10 10 - -
Ekstrak air/etanol - - 10 10
Bufer fosfat pH 7 50 50 50 50
Substrat pNPG 25 25 25 25
Enzim α-glukosidase 25 - 25 -
Buffer fosfat pH 7 - 25 - 25
Inkubasi 37°C 15 menit
Na2CO3 100 100 100 100
Analisis Data (Mattjik 2002)
Data dianalisis menggunakan Analyses of Variance (ANOVA) dan diuji lanjut dengan Duncan’s Multiple Range Test (DMRT) menggunakan program
3 HASIL
Kadar Air Serbuk Daun dan Kulit Batang Surian
Daun dan kulit surian yang telah dikeringkan dan berbentuk serbuk dilakukan pengujian terhadap kadar air dengan cara pemanasan fisik menggunakan oven pada suhu 105˚C. Penentuan kadar air bertujuan untuk mengetahui ketahanan serbuk simplisia dalam masa penyimpanan. Serbuk daun surian memiliki kadar air sebesar 8% sedangkan kulit batang memiliki kadar air sebesar 6%.
Ekstraksi dan Fraksinasi Sampel
Ekstrak daun dan kulit batang surian diperoleh dari hasil ekstraksi dengan metode perebusan menggunakan air pada suhu 80˚C dan maserasi menggunakan etanol 70% pada suhu ruang. Proses ekstraksi dilakukan dengan lima kali ulangan yang bertujuan menarik secara optimal senyawa bioaktif dalam serbuk simplisia. Filtrat hasil ekstraksi diuapkan pelarutnya menggunakan rotary evaporator
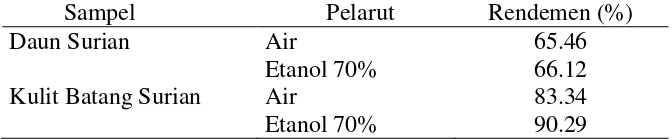
hingga diperoleh ekstrak kering air dan ekstrak kering etanol 70%. Hasil ekstraksi diperoleh dengan menghitung persentase rendemen. Hasilnya bahwa rendemen ekstrak menggunakan pelarut etanol 70% lebih besar dibandingkan pelarut air. Rendemen ekstrak daun surian lebih besar dibanding ekstrak kulit batang surian (Tabel 2). Rendemen ekstrak daun surian yang lebih besar dibandingkan ekstrak kulit batang surian juga ditunjukkan dari hasil penelitian Sari et al. (2011) menggunakan pelarut etanol yaitu sebesar 13.11% dan 7.06%. Hasil berbeda ditunjukkan dari penelitian Jiang et al. (2009) dan Santoni et al. (2010) bahwa ekstraksi daun surian menggunakan metanol menghasilkan rendemen yang lebih kecil sebesar 13.11% dibandingkan rendemen ekstrak kulit batang sebesar 14.98%.
Tabel 2 Rendemen ekstrak daun dan kulit batang surian pada pelarut air dan etanol 70%
Sampel Pelarut Rendemen (%)
Tabel 3 Rendemen ekstrak tanin daun dan kulit batang surian hasil fraksinasi
Sampel Pelarut Rendemen (%)
Daun Surian Air 65.46
Etanol 70% 66.12
Kulit Batang Surian Air 83.34
Etanol 70% 90.29
Tabel 4 Senyawa fitokimia ekstrak daun dan kulit batang surian Kandungan
kimia
Ekstrak air Ekstrak etanol 70% Daun Kulit Batang Daun Kulit Batang Alkaloid
Hasil penelitian uji fitokimia (Tabel 4) menunjukkan bahwa semua sampel yang diuji menunjukkan adanya kandungan flavonoid, triterpenoid, dan tanin namun tidak mengandung alkaloid sedangkan uji saponin negatif hanya untuk ekstrak etanol kulit batang. Hampir sama dengan hasil penelitian yang dilaporkan Sari et al. (2011), bahwa ekstrak etanol daun dan kulit tidak mengandung alkaloid dan saponin. Selain itu berbeda dengan penelitian yang dilaporkan oleh Yuhernita dan Juniarti (2011) bahwa ekstrak metanol daun surian positif mengandung alkaloid.
Identifikasi Jenis Tanin
Jenis tanin diidentifikasi menggunakan pereaksi FeCl3 10% dan pereaksi
Tabel 5 Uji identifikasi jenis tanin ekstrak daun dan kulit batang surian
Warna biru hitam Tidak ada endapan merah batang surian memiliki jenis tanin yang berbeda. Ekstrak daun surian mengandung jenis tanin terhidrolisis yaitu tanin galat dan turunannya sedangkan ekstrak kulit batang surian mengandung jenis tanin terkondensasi yaitu tanin katekol. Hasil yang sama juga diperoleh pada hasil identifikasi jenis tanin pada ekstrak tanin daun dan kulit batang surian (Tabel 6) hanya berbeda pada senyawa tanin yang terdapat pada ekstrak tanin pada daun menggunakan pelarut air kemungkinan mengandung galotanin/elagitanin.
Tabel 6 Uji identifikasi jenis tanin ekstrak tanin daun dan kulit batang surian Jenis Ekstrak
Gambar 1 Perbandingan kandungan total tanin ekstrak kasar. Angka di atas tiap balok menunjukkan kandungan total tanin sedangkan huruf
superscript (a dan b) menunjukkan hasil yang berbeda nyata (p<0.05).
Hasil uji Duncanpada alfa 0.05 total tanin ekstrak etanol 70% daun surian tidak berbeda nyata dengan ekstrak etanol kulit batang dan ekstrak air kulit batang namun berbeda nyata dengan ekstrak air daun surian (Lampiran 2). Hasil penelitian memperlihatkan bahwa kandungan tanin paling tinggi ditunjukkan oleh ektrak etanol dan paling rendah ekstrak air daun.
Kandungan total tanin yang berbeda ditunjukkan ekstrak tanin dari daun dan kulit batang surian hasil fraksinasi. Berdasarkan hasil pengukuran total tanin yang paling tinggi terdapat pada sampel kulit batang surian dengan pelarut etanol (Gambar 2).
Gambar 2 Perbandingan kandungan total tanin ekstrak tanin hasil fraksinasi. Angka di atas tiap balok menunjukkan kandungan total tanin sedangkan huruf superscript (a,b,c dan d) menunjukkan hasil yang berbeda nyata (p<0.05).
8.57a
7.53a 5.80b
7.87a
9.35a
7.61b
Hasil uji Duncan diperoleh bahwa semua sampel memiliki total tanin yang berbeda nyata (p<0,05). Total tanin ekstrak tanin kulit batang etanol berbeda nyata dengan total tanin ekstrak tanin kulit batang air, total tanin ekstrak tanin daun etanol dan total tanin ekstrak tanin daun air (Lampiran 3).
Aktivitas Penghambatan α-Glukosidase
Aktivitas inhibisi ekstrak daun dan kulit batang surian ditentukan dengan menggunakan enzim α-glukosidase yang berasal dari rekombinan Bacillus stearothermophilus dengan substrat berupa p-nitrofenil-α-D-glukopiranosida (pNPG). Aktivitas penghambatan enzim dari ekstrak diketahui berdasarkan nilai IC50 (Tabel 7). Hasil uji statistik memperlihatkan bahwa akarbose sebagai kontrol positif memiliki daya penghambatan α-glukosidase yang berbeda nyata (p<0.05) terhadap semua sampel sebesar 0.08 µg/mL (Lampiran 4). Ekstrak etanol daun memiliki aktivitas penghambatan yang berbeda nyata dengan ekstrak etanol kulit batang, ekstrak air kulit batang dan ekstrak air daun. Ekstrak etanol 70% daun surian memiliki aktivitas penghambatan paling besar dengan nilai IC50 sebesar 64.35 µg/mL sedangkan aktivitas penghambatan paling kecil ditunjukkan oleh ekstrak air daun dengan IC50 sebesar 323.27 µg/mL.
Tabel 7 Aktivitas penghambatan α-glukosidase ekstrak kasar daun dan kulit batang surian
Jenis sampel IC50 (μg/mL)
Ekstrak etanol daun 64.35b
Ekstrak air daun 323.27c
Ekstrak etanol kulit batang 277.54c Ekstrak air kulit batang 302.88c
Akarbose 0.08a
Keterangan : Huruf superscrift (a, b dan c) pada tabel menunjukkan hasil yang berbeda nyata (p<0.05)
Aktivitas yang berbeda ditunjukkan ekstrak tanin hasil fraksinasi dari daun
dan kulit batang surian (Tabel 8). Besarnya aktivitas penghambatan
α-glukosidase ditandai dengan semakin kecil nilai IC50 yang diperoleh. Hasil uji statistik ekstrak tanin memperlihatkan bahwa akarbose sebagai kontrol positif memiliki aktivitas penghambatan α-glukosidase yang berbeda nyata terhadap semua sampel (Lampiran 5). Ekstrak tanin etanol daun surian memiliki aktivitas penghambatan paling besar dengan nilai IC50 sebesar 50.44 μg/mL kemudian ekstrak tanin air kulit batang (165.75 μg/mL), ekstrak tanin etanol kulit batang (177.98 μg/mL) dan ekstrak tanin air daun (183.32 μg/mL).
Tabel 8 Aktivitas penghambatan α-glukosidase ekstrak tanin daun dan kulit batang surian
Jenis sampel IC50 (μg/mL)
Ekstrak tanin daun etanol 50.44b Ekstrak tanin daun air 183.32c Ekstrak tanin kulit batang etanol 177.98c Ekstrak tanin kulit batang air 165.75c
Akarbose 0.08a
4 PEMBAHASAN
Kadar Air Serbuk Daun dan Kulit Batang Surian
Peraturan BPOM (2014) masa simpan serbuk yang baik memiliki kadar air kurang dari 10% sehingga dari hasil uji kadar air menunjukkan bahwa serbuk daun dan kulit batang surian dapat disimpan dalam jangka waktu panjang dan kualitas terjaga dari cemaran mikroorganisme. Kadar air lebih dari 10% akan menyebabkan terjadinya kerusakan oleh mikroba dan proses enzimatik yang akan merubah kandungan kimia yang telah terbentuk menjadi produk lain yang mungkin tidak memiliki efek farmakologis lagi (Manoi 2006). Kadar air ditentukan dengan cara pemanasan menggunakan oven pada suhu 105˚C dikarenakan air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 100-105˚C (Harjadi 1993). Hasil uji kadar air menunjukkan bahwa kandungan air daun lebih banyak dibandingkan kulit batang dikarenakan pada daun terdapat jaringan epidermis atas yaitu lapisan kutikula yang berfungsi melindungi dan mencegah terjadinya penguapan kandungan air secara berlebihan pada daun (Sumarwan et al. 2004).
Ekstraksi dan Fraksinasi Sampel
Metode ekstraksi yang digunakan adalah perebusan pada suhu 80˚C dan maserasi pada suhu ruang. Perebusan menggunakan air merupakan cara tradisional masyarakat pada umumnya dalam mengolah tanaman yang berkhasiat obat. Pelarut air dan suhu 80˚C yang digunakan karena kaitan dengan sifat tanin yang mudah larut dalam air panas dan tanin yang tidak tahan terhadap pemanasan suhu tinggi, dimana suhu ekstraksi tanin yang baik adalah berkisar antara 60-80˚C (Oematan 2015). Maserasi digunakan karena merupakan metode ekstraksi dingin sehingga melindungi senyawa aktif yang tidak tahan pemanasan dalam simplisia, pengerjaannya murah dan mudah. Pelarut etanol 70% digunakan karena tidak toksik merupakan jenis alkohol yang dapat dikonsumsi, relatif murah, dan dapat melarutkan senyawa metabolit sekunder yang ada pada tanaman (Wiratmaja et al.
2011; Mailoa et al. 2013).
Proses ekstraksi menggunakan metode yang berbeda menghasilkan rendemen ekstrak yang berbeda dimana ekstraksi menggunakan pelarut etanol 70% memberikan rendemen yang lebih besar dibandingkan pelarut air (Tabel 2). Perbedaan hasil rendemen dapat disebabkan oleh sifat kepolaran pelarut, pemanasan (suhu) yang berbeda, dan pengadukan (Pambayun et al. 2007; Budiharti et al. 2014). Sifat kepolaran pelarut akan menentukan komponen metabolit sekunder yang terkandung dalam surian sedangkan pemanasan (suhu) dan pengadukan akan mempengaruhi kelarutan ekstrak. Hasil penelitian (Tabel 2) juga menunjukkan bahwa rendemen ekstrak etanol 70% daun lebih besar dibandingkan dengan ekstrak etanol 70% kulit batang. Hal ini disebabkan oleh senyawa klorofil yang ada pada daun ikut terekstraksi oleh etanol, dimana klorofil merupakan senyawa yang dapat larut dalam pelarut organik seperti etanol (Sari et al. 2011). Hasil rendemen menunjukkan bahwa gugus polar dari etanol 70% lebih banyak menarik komponen metabolit sekunder dari daun surian dibandingkan kulit batang surian.
pemanasan dan juga dapat mengoksidasi komponen metabolit sekunder yang tidak tahan terhadap pemanasan dan pengadukan seperti tanin yang merupakan senyawa fenolik yang terikat dengan gula sehingga mudah larut dalam air (Sari et al. 2013), namun bila diberi panas berlebih akan menyebabkan tanin teroksidasi (Hagerman 2002) dan rusak sehingga mengurangi persentase rendemen. Persentase rendemen ekstrak etanol 70% dari daun dan kulit batang surian yang dihasilkan tidak terlalu berbeda dengan persentase rendemen ekstrak air sehingga dapat dikatakan bahwa kandungan metabolit sekunder daun dan kulit batang surian adalah bersifat polar. Komponen metabolit sekunder yang bersifat polar akan memberikan aktivitas farmakologis yang lebih baik.
Ekstrak kering air dan etanol 70% kemudian difraksinasi dengan pelarut dietil eter untuk memisahkan senyawa tanin yang ada dalam ekstrak. Pelarut non polar yang tidak dapat melarutkan tanin salah satunya adalah dietil eter. Dietil eter dapat melarutkan pengotor berupa lemak, minyak, klorofil sehingga dapat diperoleh tanin yang lebih murni. Tanin merupakan senyawa polar dengan gugus hidroksi dan diperlukan pelarut polar seperti air, etanol dan aseton sebagai larutan penyarinya (Pramono 2013). Fraksi air ekstrak air dan etanol dievaporasi kemudian masing-masing dilarutkan dalam air panas kembali dan etanol 96% untuk menghasilkan ekstrak tanin terpurifikasi. Rendemen ekstrak tanin menggunakan pelarut etanol lebih besar dibandingkan pelarut air (Tabel 3). Semakin tinggi konsentrasi pelarut etanol yang digunakan semakin banyak pula gugus polar yang dapat menarik gugus polar tanin dalam jumlah banyak sehingga meningkatkan persentase rendemen ekstrak tanin yang dihasilkan. Hasil rendemen (Tabel 3) juga menunjukkan bahwa rendemen ekstrak tanin menggunakan pelarut etanol menghasilkan rendemen ekstrak tanin yang lebih besar pada kulit batang surian dibandingkan pada daun surian. Hal ini dapat dikatakan bahwa pelarut etanol lebih banyak mengestraksi tanin yang ada pada kulit batang surian dan komponen tanin pada ekstrak etanol lebih banyak bersifat semi polar bila dibandingkan dengan pelarut air. Hasil rendemen (Tabel 3) menunjukkan bahwa pelarut air dan pelarut etanol dapat mengestraksi tanin dalam persentase yang besar dikarenakan perbedaan rendemen yang dihasilkan kedua pelarut kecil. Hasil rendemen ekstrak tanin hasil fraksinasi juga menunjukkan bahwa kulit batang surian mengandung tanin yang lebih banyak dibanding daun surian.
Senyawa Fitokimia
Analisis senyawa fitokimia bertujuan untuk mengetahui secara kualitatif kandungan metabolit sekunder pada daun dan kulit batang surian yang mempunyai efek farmakologis seperti pada pengobatan diabetes mellitus. Hasil penelitian uji fitokimia (Tabel 4) menunjukkan bahwa daun surian dan kulit batang surian mengandung flavonoid, triterpenoid, tanin dan saponin namun tidak mengandung alkaloid. Perbedaan kandungan metabolit sekunder pada jenis tanaman yang sama dipengaruhi oleh variasi genetik, umur tanaman, kondisi geografis tempat tanaman tumbuh dan pelarut yang digunakan untuk ekstraksi (Kardono 2003).
2013). Kandungan tanin pada daun sirih merah juga diketahui dapat menurunkan kadar glukosa darah (Safithri dan Fahma 2008). Flavonoid dapat mencegah komplikasi diabetes mellitus melalui pembersihan radikal bebas yang berlebihan dan pemutusan rantai radikal bebas. Flavonoid juga mempunyai aktivitas penghambatan α-glukosidase melalui ikatan hidroksilasi dan substitusi pada cincin beta (Prameswari et al. 2014). Saponin mempunyai aktivitas hipolipidemik sehingga insulin dapat berfungsi normal (Doughari 2012). Triterpenoid merupakan komponen aktif obat antidiabetes yang memiliki efek dalam penyerapan glukosa dan sekresi insulin (Sunaryo et al. 2012; Rathore et al. 2014). Identifikasi Jenis Tanin
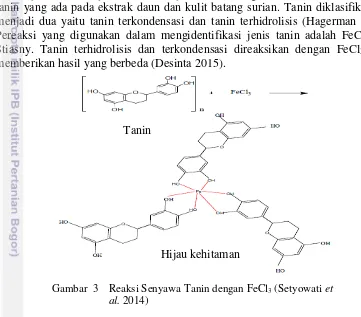
Uji identifikasi jenis tanin bertujuan untuk mengetahui secara kualitatif jenis tanin yang ada pada ekstrak daun dan kulit batang surian. Tanin diklasifikasikan menjadi dua yaitu tanin terkondensasi dan tanin terhidrolisis (Hagerman 2002). Pereaksi yang digunakan dalam mengidentifikasi jenis tanin adalah FeCl3 dan Stiasny. Tanin terhidrolisis dan terkondensasi direaksikan dengan FeCl3 akan memberikan hasil yang berbeda (Desinta 2015).
Gambar 3 Reaksi Senyawa Tanin dengan FeCl3 (Setyowati et al. 2014)
Tanin terhidrolisis memberikan endapan atau warna biru hitam dan tanin terkondensasi memberikan endapan warna hitam kehijauan (Desinta 2015). Tanin akan bereaksi dengan ion Fe3+ membentuk senyawa kompleks berwarna (Gambar 3) (Setyowati et al. 2014).
Identifikasi jenis tanin menggunakan pereaksi Stiasny L Formaldehyde
dikarenakan tanin mempunyai gugus fenol yang sangat reaktif terhadap formaldehid dan tidak terhidrolisis (Linggawati 2002). Ekstrak yang mengandung tanin terkondensasi ketika ditambahkan dengan asam klorida dan formaldehid akan membentuk endapan merah. Senyawa tanin terkondensasi yang mempunyai gugus hidroksil yang reaktif terhadap formaldehid adalah tanin katekol (catechin). Tanin terkondensasi terbentuk dari reaksi kondensasi tunggal katekin menghasilkan senyawa dimer dan kemudian polimer (Gambar 4) (Harborne 1987).
Tanin
Gambar 4 Reaksi antara catechin dengan formaldehid (Fechtal et al. 1993)
Hasil penelitian identifikasi jenis tanin (Tabel 5) menunjukkan bahwa ekstrak daun dan kulit batang surian memiliki jenis tanin yang berbeda. Ekstrak daun surian mengandung jenis tanin terhidrolisis yaitu galat dan turunannya sedangkan ekstrak kulit batang surian mengandung jenis tanin terkondensasi yaitu tanin katekol. Beberapa penelitian menunjukkan bahwa daun surian mengandung senyawa fenolik seperti asam galat dan turunannya, galotanin sedangkan tanin terkondensasi banyak terdapat pada jenis tumbuhan berkayu dan surian merupakan salah satu tumbuhan berkayu (Sari et al. 2013; Harborne 1987). Hasil penelitian Zhao et al. (2009) batang surian mengandung katekin, epikatekin, prosianidin B3 dan prosianidin B4. Jenis tanin yang sama juga ditunjukkan dari hasil identifikasi jenis tanin hasil fraksinasi (Tabel 6), perbedaan terjadi hanya pada kandungan senyawa tanin ekstrak etanol daun surian yang kemungkinan mengandung gallotanin/ellagitanin. Perbedaan ini dapat dikarenakan asam galat mengalami proses oksidasi silang menghasilkan tanin terhidrolisis yang lebih kompleks yaitu gallotanin/ellagitanin (Hagerman 2002). Perbedaan jenis tanin yang terdapat pada daun dan kulit batang dapat disebabkan oleh perbedaan
komponen jaringan penyusun daun dan kulit batang. Daun memiliki pori-pori yang disebut dengan stomata yang berperan sebagai tempat pertukaran gas dikarenakan sifat stomata yang dapat membuka atau menutup (Sumarwan et al. 2004). Kemampuan membuka atau menutup stomata dapat disebabkan oleh perubahan kandungan air dan bentuk sel penjaga sehingga senyawa bioaktif yang ada pada daun mudah terhidrolisis seperti tanin terhidrolisis. Kulit batang mengandung banyak lignin dibanding pada batang. Lignin merupakan komponen penyusun utama dinding sel tanaman. Lignin mempunyai struktur yang kompleks sehingga tidak mudah dihidrolisis. Struktur lignin pada kulit batang berikatan dengan struktur zat ekstraktif tanin sehingga tanin yang terdapat pada kulit batang tidak dapat terhidrolisis (Arryat 2006).
Kandungan Total Tanin
Total tanin diketahui berdasarkan pada jumlah gugus fenol pada tanin sehingga jumlah gugus fenol diasumsikan mewakili jumlah tanin secara keseluruhan yang terdapat pada ekstrak. Total tanin ditentukan dengan menggunakan metode titrasi permanganometri berdasarkan proses oksidasi dan reduksi diman gugus fenol pada tanin akan mengalami oksidasi. Jumlah gugus fenol berbanding lurus dengan jumlah kalium permanganat yang digunakan pada proses titrasi (Sudarmadji et al. 1997; Depkes 1979).
Hasil penelitian (Gambar 1) memperlihatkan bahwa kandungan tanin paling tinggi ditunjukkan oleh ektrak etanol dan paling rendah ekstrak air daun. Perbedaan total tanin ekstrak air daun dan ekstrak etanol dapat disebabkan oleh jenis tanin terhidrolisis yang terkandung dalam daun yang berbeda, yaitu asam galat pada ekstrak air daun dan galotanin/elagitanin pada ekstrak etanol daun sehingga mempengaruhi kelarutan tanin dalam pelarut. Tanin mempunyai karakter larut dalam air, namun beberapa jenis tanin yang mempunyai bobot molekul yang tinggi akan berkurang kelarutannya dalam air. Gallotanin dan ellagitanin merupakan jenis tanin terhidrolisis yang mempunyai bobot molekul yang tinggi yaitu sekitar 900-5000 g/mol (Cannas 2015). Asam galat mempunyai bobot molekul sekitar 170 g/mol sehingga lebih mudah larut dalam air (PubChem 2015a). Sama halnya dengan ekstrak daun, ekstrak etanol kulit batang
juga memiliki nilai total tanin yang lebih tinggi dibandingkan ekstrak air. Jenis tanin yang terdapat pada ekstrak kulit batang adalah tanin terkondensasi, salah satunya adalah katekol. Katekol sangat mudah larut dalam etanol dibandingkan dalam pelarut air (PubChem 2015b). Hal ini dapat diartikan bahwa komponen tanin pada ekstrak etanol 70% lebih banyak bersifat semi polar bila dibandingkan dengan pelarut air dan jenis tanin yang terkandung dalam ekstrak juga berpengaruh dalam menentukan nilai total tanin.
Kandungan total tanin yang berbeda ditunjukkan ekstrak tanin hasil fraksinasi (Gambar 2). Total tanin ekstrak daun mengalami penurunan sedangkan total tanin ekstrak kulit batang meningkat. Perbedaan ini dapat disebabkan oleh proses fraksinasi dari dietil eter yang melarutkan sebagian pengotor pada ekstrak tanin sehingga mempengaruhi kandungan total tanin. Tanin terhidrolisis biasanya ditemukan dalam jumlah yang lebih rendah dibandingkan dengan tanin terkondensasi pada tanaman. Tanin terkondensasi banyak terdapat pada tanaman berkayu dan surian merupakan jenis tanaman berkayu (Lisan 2015).
Aktivitas Penghambatan α-Glukosidase
Inhibitor α-glukosidase penting digunakan sebagai pengobatan oral pada diabetes tipe 2. Inhibitor α-glukosidase berperan secara kompetitif menghambat α-glukosidase dalam mencerna karbohidrat menjadi glukosa dan monosakarida lain di usus halus. Penghambatan α-glukosidase menyebabkan berkurangnya
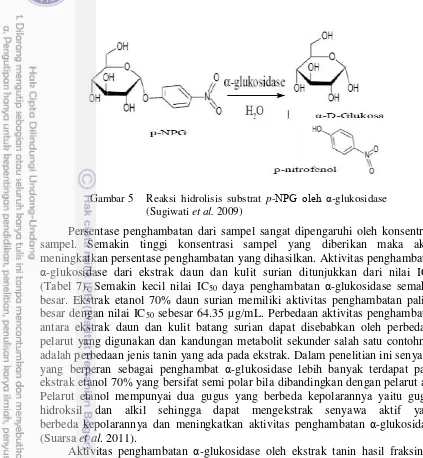
glukosa yang diserap tubuh (Balaji et al. 2015). Proses penghambatan α-glukosidase oleh ekstrak secara in vitro diketahui berdasarkan reaksi
Gambar 5 Reaksi hidrolisis substrat p-NPG oleh α-glukosidase (Sugiwati et al. 2009)
Persentase penghambatan dari sampel sangat dipengaruhi oleh konsentrasi sampel. Semakin tinggi konsentrasi sampel yang diberikan maka akan meningkatkan persentase penghambatan yang dihasilkan. Aktivitas penghambatan α-glukosidase dari ekstrak daun dan kulit surian ditunjukkan dari nilai IC50 (Tabel 7). Semakin kecil nilai IC50 daya penghambatan α-glukosidase semakin besar. Ekstrak etanol 70% daun surian memiliki aktivitas penghambatan paling besar dengan nilai IC50 sebesar 64.35 µg/mL. Perbedaan aktivitas penghambatan antara ekstrak daun dan kulit batang surian dapat disebabkan oleh perbedaan pelarut yang digunakan dan kandungan metabolit sekunder salah satu contohnya adalah perbedaan jenis tanin yang ada pada ekstrak. Dalam penelitian ini senyawa yang berperan sebagai penghambat α-glukosidase lebih banyak terdapat pada ekstrak etanol 70% yang bersifat semi polar bila dibandingkan dengan pelarut air. Pelarut etanol mempunyai dua gugus yang berbeda kepolarannya yaitu gugus
hidroksil dan alkil sehingga dapat mengekstrak senyawa aktif yang berbeda kepolarannya dan meningkatkan aktivitas penghambatan α-glukosidase
(Suarsa et al. 2011).
5 SIMPULAN DAN SARAN
Simpulan
Aktivitas penghambatan α-glukosidase yang terbaik ditunjukkan oleh ekstrak tanin daun etanol hasil fraksinasi dengan IC50 50.44 µg/mL. Total tanin yang tinggi ditunjukkan oleh ekstrak tanin kulit batang etanol hasil fraksinasi sebesar 9.35 mg/g. Jenis tanin yang teridentifikasi pada ekstrak daun surian merupakan tanin terhidrolisis sedangkan pada ekstrak kulit batang surian merupakan tanin terkondensasi.
Saran
Perlakuan variasi pelarut dalam ekstraksi daun dan kulit batang surian perlu
dilakukan untuk mengetahui pelarut yang memberikan aktivitas penghambatan α-glukosidase yang terbaik. Variasi suhu ekstraksi perlu dilakukan untuk
DAFTAR PUSTAKA
Arryat H. 2006. Analisis kimia kayu batang, cabang dan kulit kayu jenis kayu leda (Eucalyptus deglupa Blume). Jurnal Hutan Tropis Borneo. (18):81-84.
Auliawan R, Cahyono B. 2014. Efek hidrolisis ekstrak daun iler (Coleus scutellarioides) terhadap aktivitas inhibisi enzim α-glukosidase. JSM.
22(1): 15-19.
Badan Standarisasi Nasional. 1992. Standar Nasional Indonesia (SNI). SNI-01-3182-1992. Penentuan Kadar Air. Dewan Standarisasi Indonesia. Jakarta. Balaji RM, Jeyaram C, Sundaram KM, Ramasamy MS. 2015. Studies on
antidiabetic activity of indian medicinal plants using α-amylase and α-glukosidase inhibitory activity-a pathway to antidiabetic drugs. World
Journal of Medicinal Sciences. 12(3):207-212. ISSN 1817-3055.
Bӧsenberg LH. 2008. The mechanism of action of oral antidiabetic drug: A review of Recent Literature. The Journal of Endocrinology, Metabolism and
Diabetes of South Africa. 13(3):80-88.
[BPOM] Badan Pengawas Obat dan Makanan. 2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM RI.
[BPOM] Badan Pengawas Obat dan Makanan. 2010. Acuan Sediaan Herbal, 5(1). Jakarta: Direktorat OAI BPOMRI.
[BPOM] Badan Pengawas Obat dan Makanan. 2014. Persyaratan mutu obat tradisional.
Budiharti D, Yudha CS, Inayati. 2014. Ekstraksi tanin dari kulit kayu soga tingi untuk pewarna batik. Di dalam: Seminar Nasional Kimia dan Pendidikan Kimia VI-Pemantapan Riset Kimia dan Asesmen dalam Pembelajaran Berbasis Pendekatan Saintifik. ISBN 979363174-0.
Cannas A. 2015. Tannins: fascinating but sometimes dangerous molecules. [Internet]. [diunduh 2016 Feb 05]. Tersedia pada: http://poisonousplants.ansci.cornell.edu/toxicagents/tannin.html.
Chen T, Luo Z, Cui HA, Zeng XQ, Liu ZZ. 2000. Preliminary study of chemical constituents from leaves of Toona sinensis. Shanxi Forest Science and Technology. 2:1-2.
Dalimartha S. 2005. Ramuan tradisional untuk pengobatan Diabetes mellitus.
Bogor: Penebar Swadaya.
Danarto YC, Prihananto SA, Pamungkas ZA. 2011. Pemanfaatan tanin dari kulit kayu bakau sebagai pengganti gugus fenol pada resin fenol formaldehid. Di dalam: Prosiding Seminar Nasional Teknik Kimia Kejuangan Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam Indonesia. ISSN 1693-4393.
[Dephut] Departemen Kehutanan. 2004. Keputusan Menteri Kehutanan Nomor SK.456/Menhut-1I/2004 tentang 5 Kebijakan Prioritas Bidang Kehutanan Dalam Program Pembangunan Nasional. Jakarta: Dephut.
[Depkes] Departemen Kesehatan. 1979. Materia Medika Indonesia. Jakarta (ID): Depkes RI.
Desinta T. 2015. Penentuan jenis tanin secara kualitatif dan penetapan kadar tanin dari kulit buah rambutan (Nephelium lappaceum L.) secara permanganometri. Calyptra Jurnal Ilmiah Mahasiswa Universitas Surabaya..4(1). [Internet]. [diunduh 2015 Nov 17]. Tersedia pada: https://journal.ubaya.ac.id/index.php/jimus/article/download/987/956.
Djam’an D F. 2002. Informasi Singkat Benih Toona suriani. Bogor: Direktorat Perbenihan Tanaman Hutan.
Doughari JH. 2012. Phytochemicals: Extraction Methods, Basic Structures and Mode of Action as Potential Chemotherapeutic Agents, Phytochemicals-A Global Perspective of Their Role in Nutrition and Health. [Internet]. [diunduh 2016 Apr 16]. Tersedia pada: www.intechopen.com.
Farnsworth NR. 1966. Biological and phytochemical screening of plants. Journal of Pharmaceutical Sciences. 55(3).
Fechtal M, Riedl B, Calve L. 1993. Modeling of tannins as addhesives.
Holzforschung. 47(5):419-424.
Firdausi A, Siswoyo TA, Wiryadiputra S. 2013. Identifikasi tanaman potensial penghasil tanin-protein kompleks untuk penghambatan aktivitas α-amylase
kaitannya sebagai pestisida nabati. Pelita Perkebunan. 29(1):31-43.
Fitrilia T, Bintang M, Safithri M. 2015. Phytochemical screening and antioxidant activity of clove mistletoe leaf extracts (Dendrophthoe pentandra (L.) Miq).
IOSR Journal Of Pharmacy. 5(8):13-18.
Gao H, Huang Y, Gao B, Kawabata J. 2008. Chebulagic Acid Is a Potent α-Glucosidase Inhibitor. Biosci. Biotechnol. Biochem. 72(2):601-603.
Hagerman AE. 2002. Tannin Chemistry. [Internet]. [diunduh 2015 Jul 08]. Tersedia pada: www.users.muohio.edu/hagermae/tannin.pdf.
Hamidah S. 2006. Rendemen dan kadar tanin kulit kayu bakau (Rhizophora mucronata Lamck) dari daerah Takisung. Jurnal Hutan Tropis Borneo. (18).. Handa SS, Khanuja SPS, Longo G, Rakesh DD. 2008. Extraction technology for
medicinal and aromatic plants. Trieste: United nations industrial development organization and the international centre for science and high technology. Harborne JB. 1987. Metode fitokimia penuntun cara modern menganalisis
tumbuhan. Bandung: ITB.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hayashi T, Maruyama H, Kasai R, Hattori K, Takasuga S, Hazeki O, Yamasaki K, Tanaka T. 2002. Ellagitanins from Lagerstroemia speciosa as activators of glucose transport in fat cells. Planta Medica 68: 173-175.
[IDF] International Diabetes Federation. 2014. IDF Diabetes Atlas Sixth Edition 2104 update. [internet]. [diunduh 2015 Jul 14]. Tersedia pada: https://www.idf.org/sites/default/files/Atlas-poster-2014_EN.pdf.
Ismarani. 2012. Potensi senyawa tannin dalam menunjang produksi ramah lingkungan. CEFARS Jurnal Agribisnis dan Pengembangan Wilayah. 3(2). Jiang SH, Wang CL, Chen ZQ, Chen MH, Wang YR, Liu CJ, Zhou QL, Li ZJ.
2009. Antioxidant Properties of The Extract and Subfractions From Old Leaves of Toona sinensis Roem (Meliaceae). Journal of Food Biochemistry. 33:425-441. DOI 10.1111/j.1745-4514.2009.00226.x.
Mount Rinjani Forest. Di dalam: Sustainable Utilization of Tropical Forest Resources. Proceeding of the fourth International wood science symposium; 2-5 September 2002. Indonesia: LIPI and WRI, Kyoto Univ. hlm 522-526. Kardono LBS. 2003. Kajian kandungan kimia mahkota dewa (Phaleria
marcocarpa). Di dalam: Prosiding Pameran Produk Obat Tradisional dan Seminar Sehari Mahkota Dewa. Jakarta: Pusat Penelitian dan Pengembangan Farmasi dan Obat Tradisional Departemen Kesehatan, hlm 72-76.
Kim KY, Nam KA, Kurihara H, Kim SM. 2008. Potent α-Glucosidase inhibitors purified from the red alga Grateloupia elliptica. Phytochemistry. 69:2820-2825.
Kumar S, Rana M, Kumar D, Kashyap D, Rana M. 2012. A mini review on the phytochemistry and pharmacological activities of the plant Toona ciliate
(Meliaceae). Int J Phytothear Res. 2(1): 8-18.
Linggawati. A. 2002. Pemanfaatan tanin limbah kayu industri kayu lapis untuk modifikasi resin fenol formaldehid. Jurnal Natur Indonesia. 5(1): 84-94.
Lisan FR. 2015. Penentuan jenis tanin secara kualitatif dan penetapan kadar tanin dari serabut kelapa (Cocos nucifera L) secara permanganometri. Calyptra Jurnal Ilmiah Mahasiswa Universitas Surabaya.
4(1). [Internet]. [diunduh 2015 Nov 17]. Tersedia pada: https://journal.ubaya.ac.id/index.php/jimus/article/download/984/953.
Mailoa MN, Mahendradatta M, Laga A, Djide N. 2013. Tannin extract of guava leaves (Psidium guajava L) variation with concentration organic solvents.
International Journal of Scientific & Technology Research. 2(9). ISSN 2277-8616.
Manoi F. 2006. Pengaruh cara pengeringan terhadap mutu simplisia sambiloto.
Bul. Litro. XVII(6):1-5.
Mataputun SP, Rorong JA, Pontoh J. 2013. Aktivitas inhibitor α-glukosidase ekstrak kulit batang matoa (Pometia pinnata. Spp.) sebagai agen antihiperglikemik. Jurnal MIPA Unsrat Online. 2(2):119-123.
Mattjik AA. 2002. Rancangan Percobaan. Bogor: IPB Pr.
Moosophin K et al. 2010. Tannin extraction from Mangosteen Peel for protein precipitation in wine. KKU Res J 15 (5).
Oematan ZZB. 2015. Pengaruh perbedaan suhu dan waktu ekstraksi terhadap kandungan tanin pada ekstrak daun jambu mete (Anacardium occidentale L.). Calyptra Jurnal Ilmiah Mahasiswa Universitas
Surabaya. 4(2). [Internet]. [diunduh 2015 Nov 17]. Tersedia pada: https://journal.ubaya.ac.id/index.php/jimus/article/download/1126/1091.
Omar R, Li LY, Yuan T, Seeram NP. 2012. Alpha-glucosidase inhibitory hydrolyzable tannins from Eugenia jambolana seeds. J of Nat Prod. 75:1505-1509.
Pambayun R, Gardjito M, Sudarmadji S, Kuswanto KR. 2007. Kandungan fenol dan sifat antibakteri dari berbagai jenis ekstrak produk gambir (Uncaria gambir Roxb). Majalah Farmasi Indonesia. 3:141-146.
Pham AT. 2014. Chemical, biological and ethnopharmacological studies of two Malian medicinal plants Terminalia macroptera and Biophtum umbraculum
Prameswari OM, Widjanarko SB. 2014. Uji efek ekstrak air daun pandan wangi terhadap penurunan kadar glukosa darah dan hispatologi tikus diabetes mellitus. Jurnal Pangan dan Agroindustri. 2(2):16-27.
Pramono S. 2013. Jenis Pelarut dan Jenis Senyawa Terlarut, Bahan Kuliah Galenika. Yogyakarta: Fakultas Farmasi Universitas Gadjah Mada.
PubChem. 2015a. Gallic Acid. [Internet]. [diunduh 2016 Feb 05]. Tersedia pada: https://pubchem.ncbi.nlm.nih.gov.
PubChem. 2015b. Pyrocatechol. [Internet]. [diunduh 2016 Feb 05]. Tersedia pada: https://pubchem.ncbi.nlm.nih.gov.
Rathore K, Singh VK, Jain P, Rao SP, Ahmed Z, Singh VD. 2014. In-vitro and in-vivo antidiapogenic, hypolipidemic and antidiabetic activity of Diospyros melanoxylon (Roxb). Journal of Ethnopharmacology. 155: 1171-1176.
Safithri M, Fahma F. 2008. Potency of Piper crocatum decoction as an antihiperglycemia in rat strain Sprague dawley. Hayati J Biosci. 15(1):45-48. ISSN: 1978-3019.
Safithri M, Kurniawati A, Syaefudin. 2016. Formula of Piper crocatum, Cinnamomum burmanii, and Zingiber officinale extracts as a functional beverage for diabetics. IFRJ. 23(3):1123-1130.
Sancheti S, Sandesh S, Seo SY. 2009. Chaenomoles Sinensis : A Potent α- and β-glucosidase inhibitor. American J of Pharmacol and Toxicol. 4(1):8-11. Santoni A, Nurdin H, Manjang Y, Achmad SA. 2010. Isolasi dan elusidasi
struktur triterpenoid kulit batang surian Toona sinensis dan uji terhadap hama
Crosidolomia pavonana. J Ris Kim. 2(3). ISSN 1978-628X 103-111.
Sari RK, Syafii W, Achmadi SS, Hanafi M. 2011. Aktivitas antioksidan dan toksisitas ekstrak etanol surian (Toona sinensis). Jurnal Ilmu dan Teknologi Hasil Hutan. 4(2):46-52. ISSN 1979-5238.
Sari RK, Melianti D, Syafii W, Agungpriyono DR. 2013. Aktivitas antioksidan dan toksisitas akut zat ekstraktif dari residu penyulingan surian (Toona sinensis
Roemor). JITKT. 11(2):Juli.
Schofield P, Mbugua DM, Pell AN. 2001. Analysis of condensed tannins: a review. Animal Feed Science and Technology. 91:21-40. DOI:
10.1016/S0377-8401(01)00228-0.
Setyowati WAE, Ariani SRD, Ashadi, Mulyani B, Rahmawati CP. 2014. Skrining fitokimia dan identifikasi komponen utama ekstrak metanol kulit durian (Durio zibethinus Murr.) varietas pupuk. Seminar Nasional Kimia dan Pendidikan Kimia VI. ISBN: 979363174-0.
Suarsa IW, Suarya P, Kurniawati I. 2011. Optimasi jenis pelarut dalam ekstraksi zat warna alam dari batang pisang kepok (Musa paradiasiaca l. Cv kepok) dan batang pisang susu (Musa paradiasiaca L. cv susu). Jurnal Kimia. 5(1):72-80. Sudarmadji S, Harjono B, Suhardi. 1997. Prosedur Analisa untuk Bahan
Makanan dan Pertanian. Yogyakarta: Liberty.
Sugiwati S, Setiasih S, Afifah E. 2009. Antihyperglycemic activity of the
Mahkota Dewa [Phaleria macrocarpa (Scheff.) Boerl.] leaf extracts as an alpha-Glucosidase inhibitor. Makara, Kesehatan. 13(2):74-78.
Sulastri T. 2009. Analisis kadar tanin ekstrak air dan ekstrak etanol pada biji pinang sirih (Areca catechu L). Jurnal Chemica. 10(1):59-63.
Sunaryo H, Kusmardi, Trianingsih W. 2012. Uji aktivitas antidiabetes senyawa aktif dari fraksi kloroform herba ciplukan (Physalis angulata L.) terhadap penurunan kadar glukosa darah dan perbaikan sel langerhans pankreas pada mencit yang diinduksi aloksan. Farmasains. 1(5).
Sutedjo. 2010. 5 Strategi Penderita Diabetes Mellitus Berusia Panjang. Yogyakarta: Kanisius.
Toda M, Kawabata J, Kasai T. 2000. Alpha-glucosidase inhibitors from clove (Syzgium aromaticum). Biosci Biotechnol and Biochem. 64:294-298.
Vinod KS, Raghuveer I, Alok S, Himanshu G. 2010. Phytochemical investigation and chromatographic evaluation of the ethanolic extract of whole plant extract of Dendrophthoe falcata (L.F.) Ettingsh. Int J Pharm Sci Res 1:39-45.
Wiratmaja IG, Kusuma IGBW, Winaya INS. 2011. Pembuatan etanol generasi kedua dengan memanfaatkan limbah rumput laut Eucheuma Cottonii sebagai bahan baku. Jurnal Ilmiah Teknik Mesin Cakram. 5(1): 75-84.
Yuhernita, Juniarti. 2011. Analisis senyawa metabolit sekunder dari ekstrak metanol daun surian yang berpotensi sebagai antioksidan. Makara Sains.
15(1):48-52.
Lampiran 1 Diagram alir penelitian
Tanaman Surian
Ekstraksi simplisia dengan cara perebusan dan maserasi
Ekstrak etanol Ekstrak air
Fraksinasi tanin dengan pelarut dietil eter Kulit Batang Daun
Serbuk kering Penentuan
kadar air
Pengujian
Fitokimia Kualitatif dan kuantitatif tanin
Aktivitas penghambatan
α-glukosidase
Lampiran 2 Hasil uji analisis statistik total tanin ekstrak daun dan kulit batang surian
ANOVA Total Tanin
Sum of
Squares df
Mean
Square F Sig.
Between Groups 12.432 3 4.144 9.248 0.006
Within Groups 3.585 8 0.448
Total 16.016 11
Post Hoc Test
Homogeneous Subsets
Total Tanin Duncan
Jenis Sampel N Subset for alpha = 0.05
1 2
Ekstrak air daun 3 5.8067
Ekstrak air kulit batang 3 7.5333
Ekstrak etanol kulit batang 3 7.8767
Ekstrak etanol daun 3 8.5700
Sig. 1.000 0.106
Lampiran 3 Hasil uji analisis statistik total tanin ekstrak tanin daun dan kulit batang surian hasil fraksinasi
ANOVA Total Tanin
Sum of
Squares df
Mean
Square F Sig.
Between Groups 29.037 3 9.679 107.386 0.000
Within Groups 0.721 8 0.090
Total 29.758 11
Post Hoc Test
Homogeneous Subsets
Total Tanin Duncan
Jenis Sampel N Subset for alpha = 0.05
1 2 4 5
Ekstrak tanin daun air 3 5.2000
Ekstrak tanin daun etanol 3 6.2400
Ekstrak tanin kulit batang air 3 7.6167
Ekstrak tanin kulit batang etanol 3 9.3500
Sig. 1.000 1.000 1.000 1.000
Lampiran 4 Hasil uji analisis statistik nilai IC50 penghambatan α-glukosidase ekstrak daun dan kulit batang surian
ANOVA Rataan IC50
Sum of Squares df Mean
Square F Sig.
Between Groups 269880.167 4 67470.042 11.303 0.001 Within Groups 59690.246 10 5969.025
Total 329570.412 14
Post Hoc Test
Homogeneous Subsets
Rataan IC50
Duncan
Jenis Sampel N Subset for alpha = 0.05
1 2 3
Akarbose 3 0.0800
Ekstrak etanol daun 3 64.3533
Ekstrak etanol kulit batang 3 277.5433
Ekstrak air kulit batang 3 302.8833
Ekstrak air daun 3 323.2767
Sig. 1.000 1.000 0.505
Lampiran 5 Hasil uji analisis statistik nilai IC50 penghambatan α-glukosidase ekstrak tanin daun dan kulit batang surian hasil fraksinasi
ANOVA Rataan IC50
Sum of Squares df Mean
Square F Sig.
Between Groups 85750.843 4 21437.711 159.202 0.000 Within Groups 1346.577 10 134.658
Total 87097.420 14
Post Hoc Test
Homogeneous Subsets
Rataan IC50
Duncan
Jenis Sampel N Subset for alpha = 0.05
1 2 3
Akarbose 3 0.0800
Ekstrak tanin daun etanol 3 50.4400
Ekstrak tanin kulit batang air 3 165.7567
Ekstrak tanin kulit batang etanol 3 177.9800
Ekstrak tanin daun air 3 183.3200
Sig. 1.000 1.000 0.107
Lampiran 6 Data persen penghambatan α-glukosidase ekstrak daun surian menggunakan pelarut etanol 70% dan air
Ekstrak etanol daun Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
5 4.016 4.016 -9.236 -0.401
10 -0.401 -0.803 -0.401 -0.535
30 23.293 23.694 29.317 25.435
50 49.799 49.397 49.799 49.665
100 63.052 61.847 61.847 62.249
Contoh perhitungan % penghambatan dari ekstrak etanol daun surian: % penghambatan = [(C – S)/C] x 100
% penghambatan 1 pada konsentrasi 5 ppm = [(0,249 – 0,239) /0,249] x 100 = 4.016%
Ekstrak air daun Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
50 -20.161 -16.935 -16.935 -18.010
100 0 -1.612 -0.806 -0.806
200 36.290 32.258 33.064 33.870
400 59.677 51.612 61.290 57.526
Lampiran 7 Data persen penghambatan α-glukosidase ekstrak kulit batang surian menggunakan pelarut etanol 70% dan air
Ekstrak etanol kulit batang Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
50 18.451 20.428 22.899 20.593
100 27.841 29.818 30.313 29.324
200 39.209 54.530 40.691 44.810
400 54.036 53.542 56.013 54.530
500 62.438 62.932 63.426 62.932
Ekstrak air kulit batang Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
5 -28.992 -31.203 -25.061 -28.419
10 -21.375 -26.044 -23.341 -23.587
30 -2.457 -4.422 36.855 9.991
50 -1.965 6.879 22.113 9.009
Lampiran 8 Data persen penghambatan α-glukosidase ekstrak tanin daun surian menggunakan pelarut etanol dan air
Ekstrak tanin daun etanol Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
5 -32.197 -28.319 -21.974 -27.497
10 -3.290 -1.527 0.940 -1.292
30 31.962 28.437 39.365 33.254
50 49.588 52.408 52.761 51.586
100 71.092 68.272 72.150 70.505
Ekstrak tanin daun air Konsentrasi
(ppm)
Persen (%) penghambatan Rata-rata Persen (%) penghambatan Ulangan 1 Ulangan 2 Ulangan 3
50 29.639 35.824 31.572 32.345
100 37.757 28.866 31.572 32.731
200 50.515 50.515 52.061 51.030
400 67.525 66.366 62.500 65.463