UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIDIABETES
DARI EKSTRAK ETANOL 70%
TUMBUHAN PECAH BELING HUTAN (Ruellia tuberosa
L.)
MENGGUNAKAN METODE PENGHAMBATAN
ENZIM
α
-GLUKOSIDASE SECARA IN VITRO
SKRIPSI
ADAM DZUL FAQIH AMRI
(108102000015)
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
i
UIN SYARIF HIDAYATULLAH JAKARTA
UJI AKTIVITAS ANTIDIABETES
DARI EKSTRAK ETANOL 70%
TUMBUHAN PECAH BELING HUTAN (Ruellia tuberosa
L.)
MENGGUNAKAN METODE PENGHAMBATAN
ENZIM
α
-GLUKOSIDASE SECARA IN VITRO
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
ADAM DZUL FAQIH AMRI
(108102000015)
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
v
ABSTRAK
Nama : Adam Dzul Faqih Amri
Program Studi : Farmasi
Judul : Uji Aktivitas Antidiabetes dari Ekstrak Etanol 70% Tumbuhan Pecah Beling Hutan (Ruellia tuberosa L.) menggunakan Metode Penghambatan Enzim α -Glukosidase Secara In Vitro
Tumbuhan pecah beling hutan (Ruellia tuberosa L.) telah digunakan oleh masyarakat di Kabupaten Tojuuna-una, Sulawesi Tengah sebagai obat DM, dan diketahui dapat menurunkan glukosuria. Salah satu metode untuk menguji efek antidiabetes dari suatu ekstrak adalah uji penghambatan enzim α-glukosidase yang dilakukan secara in vitro. Penelitian dilakukan dengan menggunakan ekstrak etanol 70% tumbuhan pecah beling hutan (Ruellia tuberosa L.), akarbose sebagai pembanding inhibitor α-glukosidase, dan p-nitrofenil-α-D-glukopiranosida sebagai substrat. Variasi konsentrasi uji adalah 30 ppm, 90 ppm, 120 ppm, 150 ppm, 210 ppm dan 270 ppm. Enzim α-glukosidase menghidrolisis p-nitrofenil-D-glukopiranosida menjadi α-D-glukopiranosida dan p-nitrofenol yang berwarna kuning yang dapat diukur dengan spektrofotometri UV-Vis pada panjang gelombang 400 nm. Pada konsentrasi 270 ppm ektrak etanol 70% tumbuhan pecah beling hutan dan akarbose masing-masing menunjukkan persentase inhibisi sebesar 91,05% dan 95,42%, dan IC50 ektrak etanol 70% tumbuhan pecah beling
hutan dan akarbose masing-masing 83,23 ppm dan 134,94 ppm. Hal ini menunjukkan bahwa ekstrak etanol 70% tumbuhan pecah beling hutan memiliki aktivitas menghambat enzim α-glukosidase sehingga berkhasiat sebagai antidiabetes.
ABSTRACT
Name : Adam Dzul Faqih Amri Study Program : Pharmacy
Title : Antidiabetic Activity Test of 70% Ethanol Extract of
Pecah Beling Hutan Herbs Using Enzymes α -Glucosidase Inhibition Performed In Vitro
Pecah Beling Hutan (Ruellia tuberosa L.) plants has been used by people in the district Tojuuna-una, Central Sulawesi as antidiabetic drugs and also known to decrease glucosuria. The method to test the antidiabetic effect of the extract is inhibition ofα-glucosidase enzymes were performed in vitro. This research was carried out by using 70% ethanol extract of the Pecah Beling Hutan herbs (Ruellia tuberosa L.), acarbose as an α-glucosidase inhibitor comparator, and p-nitrophenyl-α-D-glukopiranoside as substrate. The variations of test concentration was 30 ppm, 90 ppm, 120 ppm, 150 ppm, 210 ppm and 270 ppm. α-glucosidase enzymes hydrolyze the p-nitrophenyl-α-D-glukopiranosida into α-D-glukopiranosida and p-nitrophenol which is yellow and it can be measured by UV Vis spectrophotometry at a wavelength of 400 nm. At concentration 270 ppm of 70% ethanol extracts of Pecah Beling Hutan herbs and acarbose respectively show the percentage inhibition was 91.05% and 95.42%, and 70% ethanol extracts IC50 Pecah Beling Hutan herbs and acarbose
respectively at 83.23 ppm and 134.94 ppm. This suggests that the 70% ethanol extract of Pecah Beling Hutan herbs inhibit the activity of α-glucosidase enzymes, so efficacious as an antidiabetic.
vii
KATA PENGANTAR
Segala puji bagi Allah SWT yang telah memberi nikmat yang tak terhitung
jumlahnya, atas izin dan hidayah-Nya pula penulis dapat melakukan penelitian
dan menyusun skripsi, tak lupa shalawat serta salam senantiasa penulis sampaikan
kepada Nabi Muhammad SAW. Penulisan skripsi dengan judul “Uji Aktivitas
Antidiabetes dari Ekstrak Etanol 70% Tumbuhan Pecah Beling Hutan (Ruellia
tuberosa L.) menggunakan Metode Penghambatan Enzim α-Glukosidase Secara
In Vitro” ini disusun untuk memenuhi salah satu syarat agar memperoleh gelar
Sarjana Farmasi pada Fakultas Kedokteran dan Ilmu Kesehatan (FKIK)
Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Tanpa bantuan dan bimbingan dari berbagai pihak, sejak masa perkuliahan dan
penyusunan skripsi ini, sangatlah sulit untuk penulis menyelesaikan perkuliahan
dan memperoleh gelar Sarjana Farmasi. Maka dari itu penulis mengucapkan
terima kasih kepada:
1. Drs. Ahmad Musir, M.Sc., Apt. selaku dosen pembimbing pertama dan
Drs. Umar Mansur, M.Sc., Apt. sebagai pembimbing kedua sekaligus
ketua Program Studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta,
yang telah meluangkan waktunya untuk memberikan petunjuk, bimbingan,
dan saran yang berharga selama penyusunan skripsi ini.
2. Bapak Prof. Dr. (hc) dr M.K Tadjudin, Sp. And., sebagai dekan FKIK UIN
Syarif Hidayatullah Jakarta.
3. Bapak dr. Djauhari sebagai wakil dekan, serta Bapak dan Ibu staf pengajar
dan karyawan yang telah memberikan bimbingan, saran dan bantuan
selama penulis menempuh pendidikan di Program Studi Farmasi FKIK
UIN Syarif Hidayatullah Jakarta.
4. Ayahanda Drs. Yayang Jamaludin, MM. dan Ibunda Dra. Roziah Hibshida
sebagai orang tua yang telah memberikan doa dan dukungan penuh baik
moril maupun materil demi kelancaran penulis menyelesaikan skripsi ini,
serta Luthfi Hilman Syah dan Yuni Fitria sebagai kakak dan seluruh
keluarga yang selalu mendoakan penulis.
5. Keluarga besar Farmasi UIN Syarif Hidayatullah Jakarta, terutama kepada
Sera Nur Agustin, Edrianyah Simanjuntak, St. Ratna Juminar, Lisna
Fauziah, Yopi Mulyana dan Nursitasari Pertiwi sebagai sahabat-sahabat
dan senior yang telah memberi doa dan bantuan yang lain yang tak ternilai
bagi penulis selama penulis menempuh jenjang S1 di Farmasi UIN Syarif
Hidayatullah Jakarta.
6. Semua pihak yang telah membantu penulis selama ini yang tidak dapat
disebutkan namanya satu persatu atau mungkin penulis lupa
mencantumkan nama Anda pada lembar ini, tapi Allah tidak pernah lupa
akan semua kebaikan Anda.
Akhir kata penulis berharap semoga Allah membalas kebaikan semua pihak
yang telah membantu. Semoga skripsi ini bermanfaat bagi pengemban ilmu
pengetahuan pada umumnya dan ilmu Farmasi pada khususnya. Aamiin.
DAFTAR ISI
HALAMAN JUDUL... i
HALAMAN ORISINALITAS... ii
HALAMAN PERSETUJUAN PEMBIMBING... iii
HALAMAN PENGESAHAN... iv 1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesa... 3
1.4 Tujuan Penelittian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA 2.1 Tinjauan Botani ... 5
2.2 Ekstraksi ... 6
2.3 Diabetes Melitus... 12
2.4 Enzimα-Glukosidase dan Akarbose ... 14
BAB III METODOLOGI PENELITIAN 3.1 Lokasi dan Waktu Penelitian... 16
3.2 Bahan... 16
3.3 Alat ... 16
3.4 Metode Penelitian... 16
3.5 Pengujian Parameter Spesifik... 17
3.6 Pengujian Parameter Non Spesifik... 17
3.7 Uji Penapisan Fitokimia ... 18
3.8 Penetapan Uji Aktivitas Penghambatan Enzimα-Glukosidase ... 19
BAB IV HASIL PENGAMATAN DAN PEMBAHASAN 4.1 Penyiapan bahan ... 24
4.2 Hasil Uji Parameter Spesifik dan Non Spesifik ... 24
4.3 Penapisan Fitokimia ... 25
4.4Uji Aktivitas Inhibisi α-Glukosidase ... 26
BAB V KESIMPULAN DAN SARAN... 28
DAFTAR PUSTAKA... 29
xi
DAFTAR TABEL
Tabel Halaman
Tabel 1. Hasil Uji Parameter Spesifik dan Non Spesifik Ekstrak... 24
Tabel 2. Hasil Penapisan Fitokimia Ekstrak ... 25
Tabel 3. Inhibisi Akarbose ... 26
Tabel 4. Inhibisi Ekstrak ... 26
DAFTAR GAMBAR
xiii
DAFTAR LAMPIRAN
Lampiran Halaman
Lampiran 1. Gambar Alat dan Bahan ... 31
Lampiran 2. Alur Penelitian... 32
Lampiran 3. Hasil Determinasi ... 33
Lampiran 4. Certificate of AnalysisAkarbose ... 34
Lampiran 5. Certificate of Analysisα-glukosidase ... 35
Lampiran 6. Certificate of Analysisp-nitrofenil-α-D-glukopiranosida ... 36
Lampiran 7. Kerangka Konsep Penelitian ... 37
A. Uji Antidiabetes Ekstrak ... 37
B. Blanko ... 38
C. Kontrol ... 39
Lampiran 8. Larutan Uji ... 40
Lampiran 9. Hasil Uji Akarbose ... 41
BAB I
PENDAHULUAN
1.1 Latar Belakang
Dalam Undang-undang No 23 Tahun 1992 tentang kesehatan disebutkan
bahwa obat tradisional adalah bahan atau ramuan bahan yang berupa bahan
tumbuhan, bahan hewan, bahan mineral, sediaan. Sarian (galenic) atau
campuran bahan tersebut yang secara turun temurun telah digunakan untuk
pengobatan berdasarkan pengalaman (Buku Kebijakan Obat Tradisional
Nasional Depkes, 2007).
Mengingat dalam penggunaan obat-obat modern dengan purifikasi bahan
aktif banyak menimbulkan efek samping terhadap kesehatan yang cukup
signifikan, maka sebagai akibatnya timbul kecenderungan pada masa kini
kebanyakan orang ingin kembali kepada alami (back to nature). Penggunaan
obat alami pada umumnya komponen berbeda memiliki efek saling mendukung
dan mengandung bahan lain yang terikat alamiah secara seimbang dalam
susunan dan pengaruh elemen obat alami terhadap jaringan tubuh.
Dilihat dari aspek ekonomi, pemakaian herbal mempunyai nilai ekonomis
tinggi, karena pada umumnya tanaman obat ini dibudidayakan dalam bentuk
industri rumah tangga. Penggunaan obat herbal untuk kepentingan peningkatan
kesehatan sangat mendukung program kesehatan primer, kemandirian
kesehatan masyarakat sehat dan tidak terikat pada import bahan baku obat
modern. Disamping itu ada beberapa jenis penyakit yang belum bisa
disembuhkan dengan obat kimia contohnya kanker, HIV, stroke dan lain-lain
(Harsini, 2008).
Diabetes adalah kondisi serius dengan potensi komplikasi merusak yang
dapat mempengaruhi semua kelompok umur di seluruh dunia. Pada tahun 1985,
sekitar 30 juta orang di seluruh dunia terdiagnosis diabetes, pada tahun 2000,
angka itu meningkat menjadi lebih dari 150 juta, dan diperhitungkan akan
2
UIN Syarif Hidayatullah Jakarta Federation menyatakan bahwa "setiap sepuluh detik, dua orang yang
terdiagnosis diabetes di suatu tempat di dunia ini” dan mengingat
kecenderungan saat ini lebih banyak orang akan menderita diabetes pada tahun
2025 dibandingkan dengan populasi Amerika Serikat, Kanada dan Australia
bila digabungkan. Dampak diabetes dirasakan di negara maju dan berkembang.
Untuk alasan ini, sesi ke-61 majelis umum PBB pada tahun 2007 menyatakan
bahwa tanggal 14 November adalah hari diabetes dunia, dan mendorong semua
negara anggota untuk mengembangkan strategi dan kebijakan untuk
pencegahan nasional, serta pengobatan dan perawatan penderita diabetes.
Dampak diabetes juga dirasakan di Kanada, di mana 1,8 juta orang dewasa
Kanada (5,5% dari populasi) telah didiagnosis diabetes pada tahun 2005. Hal
tersebut merupakan peningkatan dari tahun 1998, ketika prevalensi dokter
didiagnosis diabetes di Kanada adalah 4,8% (1054000 orang dewasa Kanada).
Diabetes didiagniosis telah tumbuh 70% sejak dipublikasikannya pedoman
praktek klinis pada tahun 1998 olehCanadian Diabetes Association (Canadian
Diabetes Association, 2008).
Sedangkan di Indonesia prevalensi diabetes yang terdiagnosis dokter
tertinggi terdapat di DI Yogyakarta (2,6%), DKI Jakarta (2,5%), Sulawesi Utara
(2,4%) dan Kalimantan Timur (2,3%). Prevalensi diabetes yang terdiagnosis
dokter atau gejala, tertinggi terdapat di Sulawesi Tengah (3,7%), Sulawesi
Utara (3,6%), Sulawesi Selatan (3,4%) dan Nusa Tenggara Timur (3,3%).
(Riskesdas, 2013).
Begitu banyak tumbuhan liar di Indonesia yang digunakan sebagai obat
tradisional, salah satunya adalah tumbuhan pecah beling hutan (Ruellia
tuberosa L.) yang berkhasiat sebagai antidiuretik, antidiabetes, antipyretic,
analgetik, antihipertensi danantidotal agent(Durre Shahwaret al., 2011). Daun
dari tumbuhan pecah beling hutan ini (Ruellia tuberosa L.) digunakan oleh
masyarakat di Kabupaten Tojuuna-una, Sulawesi Tengah sebagai obat DM, dan
3
Dari data empiris dan dari penelitian yang telah dilakukan oleh Lely Cintari
pada tahun 2009, daun dari tumbuhan pecah beling hutan (Ruellia tuberosaL.)
memang berkhasiat sebagai antidiabetes. Namun belum ada penelitian tentang
mekanisme kerja dari tumbuhan ini, yang mana mekanisme obat-obat
hipoglikemik oral ada yang meningkatkan sekresi insulin, meningkatkan
sensitifitas sel terhadap insulin, dan yang terakhir adalah inhibitor katabolisme
karbohidrat.
Hal tersebut yang menjadi alasan dilakukan uji antidibetes tumbuhan pecah
beling hutan (Ruellia tuberosa L.) secara in vitro dengan menggunakan enzim
α-glukosidase. Dalam penelitian ini teknik ekstraksi yang digunakan adalah
maserasi, dan acarbose sebagai pembanding inhibitorα-glukosidase.
1.2 Perumusan Masalah
1. Pecah beling hutan telah banyak digunakan sebagai obat antidiuretik,
antidiabetes,antipyretic, analgetik, antihipertensi danantidotal agent.
2. Di Sulawesi Tengah tepatnya di Kabupaten Tojuuna-una, daun pecah beling
hutan digunakan sebagai antidiabetes dan terbukti dapat menurunkan
glukosuria.
3. Belum pernah dilakukan penelitian uji antidiabetes dari ekstrak etanol 70%
tumbuhan pecah beling hutan (Ruellia tuberosa L.) dengan cara
menghambat kerja enzim α-glukosidase.
1.3 Hipotesa
Ekstrak etanol dari tumbuhan pecah beling hutan (Ruellia tuberosa L.)
dapatmenghambat kerja enzim α-glukosidase.
1.4 Tujuan Penelitian
Untuk mengetahui aktifitas ekstrak etanol 70% tumbuhan pecah beling
hutan (Ruellia tuberosa L.) sebagai antidiabetes dengan cara menghambat
4
UIN Syarif Hidayatullah Jakarta 1.5 Manfaat Penelitian
Manfaat penelitian dapat dilihat dari beberapa aspek, diantaranya:
1. Secara Teoritis
Hasil penelitian ini dapat menambah khazanah ilmu pengetahuan tentang
pengobatan DM dengan menggunakan tumbuhan pecah beling hutan dan
pemanfaatannya sebagai obat.
2. Secara Metodologi
Metode dalam penelitian ini dapat digunakan untuk uji aktifitas tumbuhan
lain yang memiliki mekanisme kerja sebagai penghambat enzim α
-glukosidase.
3. Secara Aplikatif
Hasil penelitian ini diharapkan dapat memberikan informasi dalam
meningkatkan upaya kesehatan dengan mengembangkan obat tradisional
sehingga dapat dimanfaatkan berdasarkan landasan ilmiah terutama dalam
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Botani
2.1.1 Klasifikasi Tanaman • Kingdom :Plantae
• Divisi :Spermatophyta • Sub divisi :Angiospermae • Kelas :Dicotyledoneae
• Bangsa :Solanales
• Familia :Acanthaceae
• Marga :Ruellia
• Jenis :Ruellia tuberosaL.
Gambar 1. Pecah Beling Hutan
2.1.2 Nama Daerah
Pecah beling hutan; Ceplikan, pletekan (Jawa).
2.1.3 Nama Asing
French Guiana: ipeca batard; Guyana: bluebell, menow weed, minnie
root; Surinam: waterkanon, watrakanoe, watra kanung, watra kanun;
Inggris:Cracker; Tamil:Pattaskai.
2.1.4 Uraian Tanaman
Ruellia tuberosa L. merupakan tumbuhan perennial (tumbuhan yang
hidup lebih dari dua tahun) dengan quadrangular stem (batang segi
6
UIN Syarif Hidayatullah Jakarta berlawanan dengan lebar sekitar 5 cm. Berbunga hanya pada awal musim
hujan. Bunganya biseksual berwarna ungu. Dalam kapsulnya terdapat 7-8
biji yang akan terbuka saat mendapatkan kelembaban yang cukup dan
biji hitam akan langsung terjatuh. Kapsul berbentuk baton dengan
panjang 3 cm dan lama-lama berubah menjadi hitam. Tanaman ini
memiliki jari-jari yang tebal seperti akar dan tumbuh dengan baik pada
daerah yang memiliki kondisi intensitas cahayanya rendah dan lembab
(Chaitanya B. Khrisnaet al., 2012).
2.1.5 Kandungan Kimia
Flavonoid diantaranya Cirismaritin, Cirsimarin, Cirsiriol 4’-glucoside,
Sorbifolin, Pedalitin, Betulin, Asam Vanilat, Indol-3-carboxaldehide (Lin
Chwan-Fwu et al., 2006). Selain itu terdapat tanin dan juga fenol. Pada
daun terdapat apigenin dan luteloin, didalam minyak biji miristatnya
terdapat asam kaprat dan laurat (Chaitanya B. Khrisnaet al., 2012).
2.1.6 Khasiat
Tumbuhan ini dapat digunakan untuk mengobati penyakit ginjal, bila
dicampurkan dengan Petivera alliacea memiliki efek membersihkan
(meluruhkan) saluran rahim (dilasi dan kuretasi) atau sebagai
abortifacientdan membersihkan saluran kemih, akarnya digunakan untuk
mengobati batuk rejan, bagian tanaman yang bernama tuber digunakan
sebagai teh untuk bersih darah, memiliki aktivitas antimikroba untuk
gram positif dan gram negatif (Chaitanya B. Khrisna et al., 2012). Selain
itu berkhasiat sebagai antidiuretik, antidiabetes, antipyretic, analgetik,
antihipertensi, thirst quensing danantidotal agent (Durre Shahwaret al.,
2011).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair.
7
menjadi kental atau pekat. Simplisia yang diekstrak dapat mengandung
senyawa yang dapat larut dan senyawa yang tidak larut seperti serat,
karbohidrat, dan protein (DepKes, 2000).
Ragam ekstraksi ini tergantung pada tekstur dan kandungan air bahan
yang diekstraksi dan jenis senyawa yang diisolasi. Ekstraksi dapat dilakukan
dengan pelarut organik terhadap bahan segar atau bahan kering. Pada
prinsipnya senyawa polar diekstraksi dengan pelarut polar, sedangkan non
polar diekstraksi dengan menggunakan pelarut non polar (Harborne, 1987).
Cairan pelarut dalam proses pembuatan ekstrak adalah pelarut yang baik
(optimal) untuk senyawa kandungan yang berkhasiat atau aktif dengan
demikian senyawa tersebut dapat dipisahkan. Dalam hal ekstrak total, maka
cairan pelarut dipilih yang dapat melarutkan hampir semua metabolit
sekunder yang terkandung.
Faktor utama untuk dipertimbangkan pada pemilihan cairan penyari
adalah sebagai berikut:
1. Selektifitas.
2. Kemudahan bekerjadan proses dengan cairan tersebut.
3. Ekonomis.
4. Ramah lingkungan.
5. Kemanan (DepKes, 2000).
Proses ekstraksi dengan menggunakan pelarut dapat digunakan dengan
dua cara, yaitu dengan cara dingin (suhu kamar) diantaranya perkolasi dan
maserasi, serta dengan cara panas diantaranya digesti, refluks dan soxhletasi
8
UIN Syarif Hidayatullah Jakarta Faktor-faktor yang berpengaruh pada mutu ekstrak adalah:
A. Faktor Biologi
Mutu ekstrak dipengaruhi oleh bahan asal yaitu tumbuhan obatnya dan
khusus dipandang dari segi biologi. Faktor biologi, baik untuk bahan dari
tumbuhan obat hasil budidaya (kultivar) ataupun dari tumbuhan liar (wild
crop) yang meliputi beberapa hal, yaitu :
1. Identitas jenis (species): Jenis tumbuhan dari sudut keragaman hayati
dapat dikonfirmasi sampai informasi genetik sebagai faktor internal
untuk validasi jenis (species).
2. Lokasi tumbuhan asal: Lokasi berarti faktor eksternal, yaitu
lingkungan (tanah dan atmosfer) dimana tumbuhan berinteraksi
berupa energi (cuaca, temperatur, cahaya) dan materi (air, senyawa
organik dan anorganik).
3. Periode pemanenan hasil tumbuhan: faktor ini merupakan dimensi
waktu dari proses kehidupan tumbuhan terutama metabolisme
sehingga menentukan senyawa kandungan. Kapan senyawa
kandungan mencapai kadar optimal dari proses biosintesis dan
sebaliknya kapan sebelum senyawa tersebut dikonversi /
dibiotranformasi / bidegradasi menjadi senyawa lain.
4. Penyimpanan bahan tumbuhan: merupakan faktor eksternal yang
dapat diatur karena dapat berpengaruh pada kestabilitas bahan serta
adanya kontaminasi (biotik dan abiotik).
5. Umur tumbuhan dan bagian yang digunakan.
Selain lima faktor tersebut, maka untuk bahan dari tumbuhan obat hasil
budidaya (kultivar) ada lagi faktor GAP (Good Agriculture Practice)
sedangkan untuk bahan dari tumbuhan liar (wild crop) ada faktor kondisi
proses pengeringan yang umumnya dilakukan di lapangan.
B. Faktor Kimia
Mutu ekstrak di pengaruhi oleh bahan asal yaitu tumbuan obatnya
9
untuk bahan dari tumbuhan obat hasil budidaya (kultivar) ataupun dari
tumbuhan liar (wild crop), meliputi beberapa hal yaitu :
1. Faktor internal
1) Jenis senyawa aktif dalam bahan.
2) Komposisi kualitatif senyawa aktif.
3) Komposisi kuantitatif senyawa aktif.
4) Kadar total rata-rata senyawa aktif.
2. Faktor eksternal
1) Metode ekstraksi.
2) Perbandingan ukuran alat ekstraksi (diameter dan tinggi alat).
3) Ukuran, kekerasan dan kekeringan bahan.
4) Pelarut yang digunakan dalam ekstraksi.
5) Kandungann logam berat.
6) Kandungan pestisida.
Mutu ekstrak ditinjau dan dipandang dari senyawa kimia yang dikandung
dalamnya seiring dengan paradigma ilmu kedokteran modern, bahwa
respons biologis yang diakibatkan oleh ekstrak pada manusia disebabkan
oleh senyawa kimia, bukannya dari unsur lain seperti bioenergi dan
spiritual.
Senyawa kimia dalam ekstrak ditinjau dari asalnya dapat di bedakan
menjadi empat kelompok, yaitu :
1) Senyawa kandungan asli dari tumbuhan asal.
Senyawa asli sebenarnya berarti senyawa yang memang sudah ada sejak
masa tumbuhan tersebut hidup. Jika proses preparasi simplisia dan ekstraksi
di jamin tidak menyebabkan perubahan kimia, maka hasil analisis kimia
terhadap ekstrak mencerminkan kompsisi senyawa kandungan asli.
2) Senyawa hasil perubahan dari senyawa asli.
Dari kajian dan riset memang sudah dapat diprediksi terjadi perubahan
kimia senyawa asli karena memang sifat fisikokimia senyawa asli dan
10
UIN Syarif Hidayatullah Jakarta 3) Senyawa kontaminasi, baik sebagai polutan atau aditif proses.
Senyawa kontaminasi merupakan senyawa eksogen yang tercampur pada
ekstrak, baik polusi yang terhindari atau sebagai sisa atau residu proses.
4) Senyawa hasil interaksi kontaminasi dengan senyawa asli atau senyawa
perubahan.
Pengertian dan kesadaran akan adanya empat kelompok senyawa
terkandung dalam ekstrak akan meningkatkan validasi standarisasi dan
parameter mutu ekstrak. Kelompok pertama dan kedua terkait dengan
parameter standar umum yang bersifat spesifik sedangkan kelompok ketiga
dan empat merupakan parameter standar umum non-spesifik (DepKes,
2000).
2.2.1 Macam-Macam Metode Ekstraksi (DepKes, 2000)
a. Ekstraksi dengan pemerasan, penekanan, atau pengahalusan mekanik.
b. Ekstraksi dengan menggunakan pelarut :
1. Cara Dingin
1) Maserasi
Maserasi adalah proses ekstraksi simplisia menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruangan.
2) Maserasi kocok
Maserasi yang dipercepat dengan menggunakan pengaduk
mekanik. Waktu yang diperlukan sekitar 10 - 30 menit.
3) Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru
sampai sempurna (exchaustive extraction) yang umumnya
dilakukan pada temperature ruangan. Proses terdiri dari tahapan
11
(penetesan, penampungan ekstrak) secara terus menerus sampai
diperoleh ekstrak.
2. Cara Panas
1) Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik
didihnya, selama waktu tertentu dan jumlah pelarut terbatas
yang relatif konstan dengan adanya pendinginan balik.
2) Soxhletasi
Soxhletasi adalah ekstraksi menggunakan pelarut yang selalu
baru. Umumnya dilakukan dengan alat khusus sehingga terjadi
ekstraksi berlanjut sampai jumlah pelarut relatif konstan dengan
adanya pendingin balik.
3) Digesti
Digesi adalah maserasi kinetik (dengan pengadukan
berlanjut) pada temperatur yang lebih tinggi dari temperatur
ruangan.
3. Destilasi Uap
Destilasi uap adalah ekstraksi kandungan senyawa mudah
menguap dari bahan segar atau simplisia dengan uap air. Cara ini
didasarkan pada peristiwa tekanan parsial senyawa kandungan
menguap dengan fase uap air dari ketel secara berlanjut sampai
sempurna dan diakhiri dengan kondensasi fase uap campuran
menjadi destilat air bersama senyawa kandungan yang memisah
12
UIN Syarif Hidayatullah Jakarta 2.3 Diabetes Mellitus
2.3.1 Definisi
Diabetes mellitus (DM) adalah gangguan metabolik ditandai dengan
adanya hiperglikemia karena kelainan dalam produksi insulin, gagal
memproduksi insulin atau keduanya. Para penderita hiperglikemia kronis
dalam jangka waktu panjang dapat mengalami gejala lainnya, seperti
kerusakan, disfungsi dan kegagalan berbagai organ terutama ginjal, mata,
saraf, jantung dan pembuluh darah. Dysglycemia adalah istilah yang
digunakan untuk menggambarkan kadar glukosa darah yang tidak normal.
Ada beberapa tipe diabetes, yaitu:
1) Diabetes tipe 1 meliputi diabetes yang terutama disebabkan oleh
kerusakan sel β-pankreas dan rentan ketoacidosis. Tipe ini termasuk
kasus diabetes yang disebabkan oleh autoimun.
2) Diabetes tipe 2 dapat menjangkit resistensi insulin pada penderita
dengan defisiensi insulin yang relatif terhadap penderita, kegagalan
sekretorik dengan resistensi insulin.
3) Diabetes mellitus gestasional mengacu pada intoleransi glukosa pada
masa hamil.
4) Tipe tertentu lainnya termasuk kondisi yang relatif jarang ditemui,
terutama kasus genetik yang secara spesifik didefinisikan sebagai
bentuk diabetes atau diabetes yang disebabkan oleh penyakit lainnya
atau karena penggunaan obat tertentu (Canadian Journal, 2008).
Diabetes mellitus dihubungkan dengan ketidaknormalan pada
karbohidrat, kegemukan, dan metabolisme protein dan komplikasi kronis
termasuk mikrovaskular, makrovaskular, dan kelainan neuropathic (Dipiro,
13
2.3.2 Gejala Klinik Diabetes
Diabetes sering kali muncul tanpa gejala. Namun ada beberapa gejala
yang harus diwaspadai sebagai tanda bahwa seseorang mengidap diabetes.
Gejala tipikal yang sering dirasakan penderita diabetes antara lain:
1. Poliuria (sering buang air kecil).
2. Polidipsia (sering haus).
3. Polifagia (banyak makan / mudah lapar).
Selain itu sering pula muncul :
1. Keluhan penglihatan kabur.
2. Koordinasi gerak anggota tubuh terganggu.
3. Kesemutan pada tangan atau kaki.
4. Timbul gatal-gatal yang sering kali sangat menggangu (pruritus).
5. Berat badan menurun tanpa sebab yang jelas (DepKes, 2006).
2.3.3 Terapi Pengobatan Diabetes Mellitus
1. Terapi insulin.
2. Terapi obat hipoglikemik oral.
Penggolongan obat hipoglikemik oral:
Berdasarkan mekanisme kerjanya, obat-obat hipogilkemik oral
dapat dibagi menjadi 3 golongan, yaitu:
a. Obat-obat yang meningkatkan sekresi insulin, meliputi obat
hipoglikemik oral golongan sulfonilurea dan glinida (meglitinida
dan turunan fenilalanin).
b. Sensitizer insulin (obat-obat yang dapat meningkatkan sensitifitas
sel terhadap insulin), meliputi obat-obat hipoglikemik oral
golongan biguanida dan tizolidindon, yang dapat membantu tubuh
untuk memanfaatkan insulin secara lebih efektif.
c. Inhibitor katabolisme karbohidrat, antara lain inhibitor α
14
UIN Syarif Hidayatullah Jakarta digunakan untuk mengendalikan hiperglikemia post-prandial,
disebut juga“starch-blocker”(DepKes, 2006).
3. Terapi Tanpa Obat
a. Pengaturan diet.
b. Olah raga.
2.4 Enzimα-Glukosidase dan Akarbose
2.4.1 Enzim α-Glukosidase
α-glukosidase adalah terminal ikatan hidrolisis exoenzim-exoenzim
glikosidik dan melepaskan α-glukosa dari ujung non-pereduksi sakarida.
Enzim ini merupakan enzim amilolitik yang terlibat pada langkah terakhir
dari degradasi pati dan yang paling penting kedua enzim selama tahap awal
dari hidrolisis pati mentah. α-glukosidase biasanya digunakan dalam
pengolahan makanan, fermentasi dan produksi alkohol di industri, di mana
enzim ini sangat penting dalam proses hidrolisis pati untuk menghasilkan
gula fermentasi. Termostabilitas dari α-glukosidase penting karena
merupakan sebagian besar dari proses industri, seperti konversi pati menjadi
gula fermentasi selama produksi industri etanol, biasanya berlangsung pada
suhu 65-73 °C. Sifat termolabil α-glukosidase tidak hanya mengurangi
efisiensi kerusakan pati pada suhu tinggi namun digunakan untuk
gelatinisasi pati (Zhou Chenget al., 2010).
Saat ini, terdapat dua inhibitor α-glukosidase yang tersedia di Amerika
Serikat yaitu akarbose dan miglitol. Inhibitor α-glukosidase secara
kompetitif menghambat enzim (maltase, isomaltase, sukrase, dan
glukoamilase) pada usus halus, menunda pemecahan sukrosa dan kompleks
karbohidrat. Keduanya tidak menyebabkan malabsorpsi nutrisi. Efek
utamanya adalah untuk mengurangi peningkatan glukosa darah
15
Mekanisme aksi inhibitor α-glukosidase terbatas di usus. Beberapa
metabolit dari akarbose secara sistemik diserap dan diekskresi oleh ginjal,
sedangkan mayoritas miglitol diserap dan diekskresikan ginjal tanpa
perubahan (Dipiro, 2008).
2.4.2 Akarbose
Akarbose merupakan salah satu inhibitor α-glukosidase, yang
meningkatkan kontrol glukosa pada DM tipe 2 secara kompetitif
menghambat enzim termasuk dalam pencernaan, meskipun memperlambat
penyerapan karbohidrat dan mengurangi glukosa darah setelah makan,
akarbose tidak menghambat laktase dan menunda absorpsi laktosa (Wolever
Thomas M.S.et al., 1998).
Pada penelitian Lely Cintari di tahun 2009, diketahui bahwa daun pecah
beling hutan dapat menurunkan kadar glukosa hewan uji coba, namun
belum diketahui mekanisme dari antihipoglikemiknya. Dengan penelitian
ini diharapkan ekstrak etanol 70% tumbuhan pecah beling hutan (Ruellia
tuberosaL.) memiliki efek antidiabetes yang lebih baik dan dapat diketahui
cara kerja dari ekstrak etanol 70% tumbuhan pecah beling hutan (Ruellia
tuberosa L.) sebagai antihipoglikemik dengan mekanisme menghambat
16 UIN Syarif Hidayatullah Jakarta
BAB III
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu Penelitian
Penelitian ini dilaksanakan di laboratorium PDR (Drug Development and
Research) Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif
Hidayatullah Jakarta pada 29 Januari 2013 hingga 18 Mei 2013.
3.2 Bahan
Simplisia dari tumbuhan pecah beling hutan (Ruellia tuberosa L.),
aquadest, etanol 70%, enzim α-glukosidase, buffer fosfat, bovine serum
albumin (BSA), p-nitrofenil α-D-glukopiranosida, dimetilsulfoksida
(DMSO), natrium karbonat (NaCO3), akarbose.
3.3 Alat
Alat yang digunakan : alat-alat gelas, rotary evaporator, penangas air,
spektrofotometer UV Vis, timbangan, krus porselein, lumpang dan alu,
desikator, oven, cawan penguap, tanur, penjepit kayu, penjepit besi, spatula,
mesin penghalus (blender), tabung reaksi, lemari pendingin, pH meter.
3.4 Metode Penelitian
3.4.1 Pengambilan Tanaman
Tanaman pecah beling hutan (Ruellia tuberosa L.) yang digunakan
merupakan tumbuhan liar yang yang tidak memiliki bunga diperoleh
dari daerah Petambran Semplak - Bogor yang dipanen dengan tinggi
minimal 10 cm. Setelah didapat, tanaman di cuci dan di sortir, dan
bagian tanaman yang di ambil adalah akar, batang, dan daun.
3.4.2 Determinasi Tanaman
Tanaman pecah beling hutan dideterminasi di Herbarium
17
3.4.3 Pembuatan Simplisia
Setelah dilakukan sortasi, tanaman di rajang untuk dikering
anginkan pada suhu ruangan dan tidak terkena sinar matahari
langsung. Setelah kering semua bagian dihaluskan dengan
menggunakan blender.
3.4.4 PembuatanEkstrak
Sejumlah 250 gram serbuk simplisia tanaman pecah beling hutan
(Ruellia tuberosa L.) di ekstraksi secara maserasi dengan pelarut
etanol 70%, lalu maserat disaring. Maserasi dilakukan hingga 7 kali,
dan filtrat yang terkumpul dipekatkan dengan rotary evaporator
kemudian diuapkan diatas penangas air hingga diperoleh ekstrak
kental.
3.5 Pengujian Parameter Spesifik (Depkes RI, 2000)
3.5.1 Parameter Identitas Ekstrak
1. Deskripsi tata nama :
a. Nama ekstrak (generik, dagang, paten).
b. Nama latin tumbuhan (sistematika botani).
c. Bagian tumbuhan yang digunakan (rimpang, daun, dsb).
d. Nama Indonesia tumbuhan.
2. Ekstrak dapat mempunyai senyawa identitas, artinya senyawa tertentu
yang menjadi petunjuk spesifik dengan metode tertentu.
3.5.2 Parameter Organoleptik Ekstrak
Penggunaan panca indera mendeskripsikan bentuk, warna, bau, dan
rasa.
3.6 Pengujian Parameter Non Spesifik Simplisia
3.6.1 Kadar Abu (Depkes RI, 2000)
Sebanyak lebih kurang 2-3 gram ekstrak yang telah di gerus dan
18
UIN Syarif Hidayatullah Jakarta silikat yang telah di pijarkan dan ditara. Serbuk simplisia diratakan
kemudian di pijarkan perlahan-lahan hingga arang habis, didinginkan,
dan ditimbang. Jika arang tidak dapat hilang, di tambahkan air panas,
disaring dengan menggunakan kertas saring bebas abu. Sisa abu dan
kertas saring lalu dipijarkan dalam krus yang sama. Filtrat di
masukkan ke dalam krus, diuapkan, di pijarkan hingga bobot tetap,
ditimbang. Kadar abu di hitung terhadap bahan yang telah di
keringkan di udara.
3.6.2 Susut Pengeringan (Depkes RI, 2000)
Kurang lebih 1–2 gram ekstrak dimasukkan dan ditimbang
seksama dalam wadah yang telah ditara. Ekstrak dikeringkan pada
suhu 105 oC selama 5 jam dan ditimbang. Sebelum ditimbang, ekstrak
diratakan dalam botol timbang, dengan menggoyangkan botol, hingga
merupakan lapisan setebal lebih kurang 5 mm sampai 10 mm.
Kemudian dimasukan ke dalam oven, dibuka tutupnya, dikeringkan
pada suhu 105ºC hingga bobot tetap. Botol dalam keadaan tertutup
dibiarkan dalam eksikator hingga suhu kamar.
3.7 Uji Penapisan Fitokimia (Tiwari et al., 2011)
3.7.1 Salkowski Test: Ekstrak ditetesi kloroform lalu disaring, dan
selanjutnya filtrate ditetesi dengan asam sulfat pekat. Adanya
kandungan triterpeniod ditandai dengan warna kuning keemasan.
3.7.2 Mayer Test: Filtrat ditetesi dengan reagen Mayer (Kalium Iodida
Merkuri). Pembentukan endapan berwarna kuning menunjukkan
adanya alkaloid.
3.7.3 Dragendroff Test: Filtrat ditetesi dengan reagen Dragendroff (larutan
Kalium Iodida Bismuth). Pembentukan endapan berwarna kuning
19
3.7.4 Alkaline Reagent Test: Ekstrak ditetesi beberapa tetes larutan
natrium hidroksida. Adanya flavonoid ditandai dengan terbentuknya
warna kuning yang intens, dan berubah menjadi tidak berwarna
dengan penambahan asam encer.
3.7.5 Foam Test: 0,5 gram ekstrak dilarutkan dalam 2 mL air, selanjutnya
larutan diguncangkan. Adanya buih yang bertahan selama 10 menit
menandakan adanya saponin.
3.7.6 Libermann Burchard Test: Ekstrak dilarutkan didalam kloroform dan
disaring. Filtrat ditetesi dengan beberapa tetes asetat anhidrat, larutan
dipanaskan lalu didinginkan selanjutnya ditambahkan dengan asam
sulfat pekat. Terbentuknya cincin cokelat pada permukaan
menunjukkan adanya pitosterol.
3.7.7 Ferri Chloride Test: Ekstrak ditetesi 3-4 tetes larutan klorida.
Terbentuknya warna hitam kebiruan menunjukkan adanya fenol.
3.8 Penetapan Uji Aktivitas Penghambatan Enzim α-Glukosidase
3.8.1 Pembuatan Larutan Dapar Fosfat pH 7,0
Sebanyak 27,22 gram kalium fosfat monobasa dilarutkan dalam air
dan diencerkan dengan air hingga 1000 mL. Dari larutan tersebut
dipipet 50 mL, dimasukkan ke dalam labu tentukur 200 mL, lalu
ditambahkan 29,1 mL natrium hidroksida 0,2 M kemudian
ditambahkan air hingga tanda dan pH ditetapkan dengan pH meter.
3.8.2 Pembuatan Larutan Natrium Karbonat 2 M
Sejumlah 2,12 gram natrium karbonat dilarutkan dalam aquadest
20
UIN Syarif Hidayatullah Jakarta 3.8.3 Pembuatan Larutan p-nitrofenol α-D-glukopiranosida
Sejumlah 15,1 mg p-nitrofenol α-D-glukopiranosida (Mr = 301,25)
dilarutkan dalam 25 mL dapar fosfat pH 7,0.
3.8.4 Pembuatan Larutan Enzim
Sejumlah 1 mg enzim α-glukosidase dilarutkan dalam 100 mL dapar fosfat pH 7,0 yang mengandung 200 mg bovine serum albumin,
kemudian 1 mL larutan dipipet dan dilarutkan dalam buffer fosfat 1 M
dengan pH 7,0 hingga 10 mL.
3.8.5 Pembuatan Larutan Uji
1) Larutan uji induk
Sampel ekstrak ditimbang sebanyak 500 mg dan dilarutkan dalam
dimetil sulfoksida (DMSO) hingga 5 mL.
2) Larutan uji seri
Seri larutan uji dibuat dalam lima konsentrasi berbeda. Dari larutan
induk uji dipipet sebanyak 10 µL, 30 µL, 50 µL, dan 70µL dan 90 µL,
kemudian ditambah dengan DMSO sebanyak 1000 µL. Sehingga
didapat konsentrasi seri larutan 1000 ppm, 3000 ppm, 5000 ppm, 7000
ppm dan 9000 ppm.
3) Larutan uji
a) Larutan uji dengan enzim
Masing-masing seri larutan uji dipipet 60 µL ditambahkan
dengan 440 µL dapar fosfat pH 7,0 dan ditambahkan 250 µL p-nitrofenol α-D-glukopiranosida, lalu campuran reaksi dipra-inkubasi selama 5 menit pada suhu ruangan. Kemudian
ditambahkan 250 µL larutan enzim, lalu diinkubasi selama 15
menit pada suhu ruangan. Reaksi dihentikan dengan penambahan
21
dibebaskan diukur dengan spektrofotometer UV-Vis dengan
panjang gelombang 400 nm.
b)Larutan uji tanpa enzim
Masing-masing seri larutan uji dipipet 60 µL ditambahkan
dengan 440 µL dapar fosfat pH 7,0 dan ditambahkan 250 µL p-nitrofenol α-D-glukopiranosida, lalu campuran reaksi dipra-inkubasi selama 5 menit pada suhu ruangan. Kemudian
ditambahkan 250 µL dapar fosfat pH 7,0. Selanjutnya diinkubasi
selama 15 menit pada suhu ruangan. Reaksi dihentikan dengan
penambahan 1000 µL larutan natrium karbonat 2 M. Jumlah
p-nitrofenol yang dibebaskan diukur dengan spektrofotometer
UV-Vis dengan panjang gelombang 400 nm.
3.8.6 Pembuatan Larutan Standar
1) Larutan induk standar
Akarbose ditimbang sebanyak 500 mg dan dilarutkan dalam
DMSO hingga 5 mL.
2) Larutan standar seri
Seri larutan standar dibuat dalam empat konsentrasi berbeda. Dari
larutan induk standar dipipet sebanyak 10 µL, 30 µL, 50 µL, dan
70µL dan 90 µL, kemudian ditambah dengan DMSO sebanyak 1000
µL. Sehingga didapat konsentrasi seri larutan 10 ppm, 30 ppm, 50
ppm, 70 ppm dan 90 ppm.
3) Larutan standar
a) Larutan standar dengan enzim
Masing-masing seri larutan uji dipipet sebanyak 60 µL
ditambahkan dengan 440 µL dapar fosfat pH 7,0 dan ditambahkan
p-nitrofenol α-D-glukopiranosida, lalu campuran tersebut
22
UIN Syarif Hidayatullah Jakarta ditambahkan 250 µL larutan enzim. Selanjutnya diinkubasi selama
15 menit pada suhu ruangan. Reaksi dihentikan dengan
penambahan 1000 µL larutan natrium karbonat 2 M. Jumlah
p-nitrofenol yang dibebaskan diukur dengan spektrofotometer
UV-Vis dengan panjang gelombang 400 nm.
b)Larutan standar tanpa enzim
Masing-masing seri larutan uji dipipet sebanyak 60 µL
ditambahkan dengan 440 µL dapar fosfat pH 7,0 dan ditambahkan
p-nitrofenol α-D-glukopiranosida, lalu campuran tersebut
dipra-inkubasi selama 5 menit pada suhu ruangan. Kemudian
ditambahkan 250 µL dapar fosfat pH 7,0. Selanjutnya diinkubasi
selama 15 menit pada suhu ruangan. Reaksi dihentikan dengan
penambahan 1000 µL larutan natrium karbonat 2 M. Jumlah
p-nitrofenol yang dibebaskan diukur dengan spektrofotometer
UV-Vis dengan panjang gelombang 400 nm.
3.8.7 Larutan Kontrol
Larutan DMSO dipipet sebanyak 60 µL ditambahkan dengan 440
µL dapar fosfat pH 7,0 dan ditambahkan250 µL p-nitrofenol α
-D-glukopiranosida, lalu campuran tersebut dipra-inkubasi selama 5
menit pada suhu ruangan. Kemudian ditambahkan 250 µL larutan
enzim. Selanjutnya diinkubasi selama 15 menit pada suhu ruangan.
Reaksi dihentikan dengan penambahan 1000 µL larutan natrium
karbonat 2 M. Jumlah p-nitrofenol yang dibebaskan diukur dengan
spektrofotometer UV-Vis dengan panjang gelombang 400 nm.
3.8.8 Larutan Blangko
Larutan DMSO dipipet sebanyak 60 µL ditambahkan dengan 440
µL dapar fosfat pH 7,0 dan ditambahkan250 µL p-nitrofenol α
-D-glukopiranosida, lalu campuran tersebut dipra-inkubasi selama 5
23
pH 7,0. Selanjutnya diinkubasi selama 15 menit pada suhu ruangan.
Reaksi dihentikan dengan penambahan 1000 µL larutan natrium
karbonat 2 M. Jumlah p-nitrofenol yang dibebaskan diukur dengan
spektrofotometer UV-Vis dengan panjang gelombang 400 nm.
Persen penghambatan dapat dihitung dari persamaan:
Keterangan:
S: absorbansi sampel (di peroleh dari S1 – So; S1 = absorbansi
sampel dengan penambahan enzim dan So = absorbansi sampel
tanpa penambahan enzim).
C: absorbansi kontrol (DMSO), tanpa sampel (kontrol-blanko).
Nilai IC50 di peroleh dari persamaan regresi linier y = a + bx. Dengan
nilai y = 50, kemudian di subtitusikan kepersamaan regresi linier menjadi:
24 UIN Syarif Hidayatullah Jakarta
BAB IV
HASIL DAN PEMBAHASAN
4.1 Penyiapan Bahan
1. Determinasi Tanaman
Dari hasil determinasi, diketahui nama tanaman yang digunakan untuk
penelitian adalah tanaman pecah beling hutan dengan nama spesies Ruellia
tuberosaL.
2. Ekstraksi
Dari sebanyak 500 mg serbuk simplisia, ekstrak yang didapat adalah
92,69 mg. Rendemen dari ekstrak yang dihasilkan dapat dihitung dengan
rumus:
% rendemen = bobot ekstrak yang didapat
bobot simplisia yang diekstraksi x 100%
Sehingga dapat di ketahui bahwa persen rendemen adalah 18.54%.
4.2 Hasil Uji Parameter Spesifik dan Non Spesifik Ekstrak
Dari uji parameter yang telah dilakukan, diperoleh data pada tabel
berikut:
Tabel 1. Hasil Uji Parameter Spesifik dan Non Spesifik Ekstrak.
25
4.3 Penapisan Fitokimia Ekstrak
Identifikasi golongan senyawa kimia atau penapisan fitokimia dari
ekstrak dilakukan dengan metode Mayer’s test dimana tidak terdapat
endapan putih dan dengan Dragendorff’s test tidak terbentuk endapan
merah, sehingga dapat disimpulkan bahwa ekstrak tidak mengandung
alkaloid. Pada deteksi flavonoid digunakan metode Alkaline reagent test
dimana terbentuk warna kuning yang menjadi tidak berwarna setelah
ditambahkan asam encer. Pada foam test terdapat busa yang konsisten
selama 10 menit menunjukkan adanya saponin pada ekstrak. Ekstrak tidak
mengandung triterpen karena tidak terdapat warna kuning keemasan setelah
di uji dengan Salkowski’s test. Pada Libermann Burchard’s test terdapat
cincin cokelat yang menunjukkan adanya fitosterol. Terbentuk warna hitam
kebiruan setelah ekstrak di tetesi oleh FeCl3 yang berarti terdapat fenol
dalam ekstrak. Hasil penetapan fitokimia ekstrak dapat dilihat pada tabel 2.
Tabel 2. Hasil penapisan fitokimia ekstrak.
No Penapisan Hasil
Keterangan ( + ) : Memberikan hasil positif. ( - ) : Memberikan hasil negatif.
Tujuan dari penapisan ini adalah untuk mengetahui kandungan metabolit
sekunder pada ekstrak yang mana dalam ekstrak etanol 70% tumbuhan
pecah beling hutan mengandung flavonoid, saponin, steroid dan fenol.
4.4 Uji Aktivitas Inhibisiα-Glukosidase
Pengujian penghambatan terhadap aktivitas enzim α-glukosidase secara
in vitrodenganp-nitrofenil-α-D-glukopiranosida sebagai substrat dilakukan
26
UIN Syarif Hidayatullah Jakarta akarbose sebagai kontrol positif masing-masing dengan konsentrasi yang
sama. Hasil inhibisi dapat dilihat pada tabel 3 dan tabel 4.
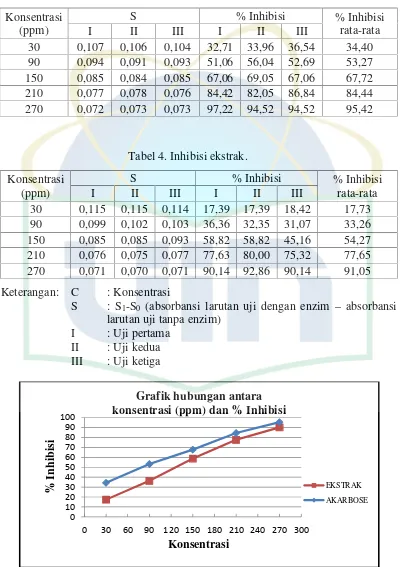
Tabel 3. Inhibisi akarbose.
Konsentrasi (ppm)
S % Inhibisi % Inhibisi
rata-rata
I II III I II III
30 0,107 0,106 0,104 32,71 33,96 36,54 34,40
90 0,094 0,091 0,093 51,06 56,04 52,69 53,27
150 0,085 0,084 0,085 67,06 69,05 67,06 67,72 210 0,077 0,078 0,076 84,42 82,05 86,84 84,44 270 0,072 0,073 0,073 97,22 94,52 94,52 95,42
Tabel 4. Inhibisi ekstrak.
Konsentrasi (ppm)
S % Inhibisi % Inhibisi
rata-rata
I II III I II III
30 0,115 0,115 0,114 17,39 17,39 18,42 17,73 90 0,099 0,102 0,103 36,36 32,35 31,07 33,26 150 0,085 0,085 0,093 58,82 58,82 45,16 54,27 210 0,076 0,075 0,077 77,63 80,00 75,32 77,65 270 0,071 0,070 0,071 90,14 92,86 90,14 91,05
Keterangan: C : Konsentrasi
Gambar 2. Grafik hubungan antara konsentrasi (ppm) dan persen inhibisi 0 konsentrasi (ppm) dan % Inhibisi
27
Uji inhibisi α-glukosidase mengindikasikan adanya aktivitas
antihiperglikemia dari ekstrak. Enzim α-glukosidase menghidrolisis
p-nitrofenil-α-D-glukopiranosida menjadi α-D-glukopiranosida dan
p-nitrofenol yang berwarna kuning yang dapat diukur dengan spektrofotometri
UV-Vis pada panjang gelombang 400 nm. Nilai IC50 merupakan bilangan
yang menunjukkan kemampuan penghambatan ekstrak terhadap aktivitas
enzim α-glukosidase sebanyak 50%. Dari data yang di dapat, ekstrak etanol
70% tumbuhan pecah beling hutan memiliki persentasi penghambatan
mendekati kemampuan penghambatan akarbose terhadap aktivitas enzim
α-glukosidase. Hasil perhitungan IC50dapat dilihat pada tabel 5.4.
Tabel 5. Perbandingan IC50.
No Inhibitor IC50(ppm)
1 Ekstrak etanol 70% tumbuhan pecah beling hutan 134,94
2 Akarbose 83,23
Hasil penetapan penghambatan ektrak etanol 70% tumbuhan pecah
beling hutan (Ruellia tuberosa L.) terhadap aktivitas enzim α-glukosidase
secara in vitro pada konsentrasi 270 ppm ektrak etanol 70% tumbuhan
pecah beling hutan dan akarbose masing-masing menunjukkan hasil persen
inhibisi sebesar 91,05% dan 95,42%. Dengan IC50 ektrak etanol 70%
tumbuhan pecah beling hutan dan akarbose masing-masing 83,23 ppm dan
134,94 ppm. Hal ini menunjukkan bahwa ekstrak etanol 70% tumbuhan
pecah beling hutan memiliki aktivitas menghambat enzim α-glukosidase
28 UIN Syarif Hidayatullah Jakarta
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa:
1. Penapisan fitokimia ekstrak
Hasil penapisan fitokimia ekstrak etanol 70% tumbuhan pecah beling hutan
menunjukkan adanya golongan senyawa flavonoid, fenol, steroid dan saponin.
2. Uji aktivitas penghambatan α-glukosidase
Dari hasil IC50 ekstrak etanol 70% tumbuhan pecah beling hutan (Ruellia
tuberosa L.) memiliki kemampuan dalam menghambat enzim α-glukosidase
sebanyak 0,6 kali dari akarbose, dan selisih daya hambat pada konsentrasi 270
ppm adalah 4,37%. Hal ini menunjukkan bahwa ekstrak etanol 70% tumbuhan
pecah beling hutan (Ruellia tuberosa L.) dapat menghambat enzim
α-glukosidase sehingga tidak terbentuk gula dalam darah yang berlebihan.
B. Saran
Perlu dilakukan penelitian lebih lanjut mengenai kadar flavonoid total
ekstrak etanol 70% tumbuhan pecah beling hutan (Ruellia tuberosa L.) dan
aktivitas antidiabetes dalam bentuk sediaan farmasi dan kestabilannya dengan
menggunakan bahan baku ekstrak etanol 70% tumbuhan pecah beling hutan
DAFTAR PUSTAKA
Canadian Diabetes Association. 2008. Canadian Journal of Diabetes. Canada:
Clinical Practice Guidlines Commitees. Hal: S1, S10.
Chaitanya, B. Khrisna., Atigari, Diana Vivian,. Babu, S. Ravindra., Ravella,
Alekhya., Vardhan, Jayasree. 2012. Hypolipidemic and Anti Oxidant
Activity of Ruellia tuberosa Linn. International Journal of Pharmacy an
Biological Sciences (e-ISSN: 2230-7605).
Cintari Lely. 2009. Swamedikasi Diabetes Mellitus (DM) dengan Daun Ceplikan
(Ruelllia tuberosa L.). Jurnal Skala Husada Volume 6 No. 1 2009: 65-74.
De Filipps, Robert A., Crepin, Julliette., Maina, Shirley L. 2004. Medicinal Plants
of the Guianas (Guyana, Surinam, French Guiana). Smithsonian
Institution: Departement of Botany, National Museum of Natural History.
Hal: 2.
Depatremen Kesehatan Republik Indonesia. 2000. Parameter Standar Ekstrak
Tumbuhan Obat. Jakarta: Direktorat Jendral Pengawasan Obat dan
Makanan. Hal: 13-21.
Depatremen Kesehatan Republik Indonesia. 2007. Buku Kebijakan Obat
Trasidional Tahun 2007 Keputusan Mentri Kesehatan Republik Indonesia
No. 381/Menkes/SK/III/2007. Jakarta: Direktur Jendral Bina Kefarmasian.
Dipiro, Joseph T., Posey, L Michael., Talbert, Robert L., Wells, Barbara G., Yee,
Gary C. 2008.Pharmacotherapy a Pathophysiologic Approach 7thedition.
US: The McGraw Hill Companies. Hal: 1226.
Fansworth, N.R. 1969. Metode Fitokimia Penuntun Cara Modern Menganalisis
Tumbuhan. Terjemahan: Kosasih P, Soediri Iwang, Bandung: ITB. Hal:
6-17.
Harsini, Widjijono. 2008. Penggunaan Herbal di Bidang Kedokteran Gigi.
Majalah Kedokteran Gigi (ISSN: 1978-0206); Juni 2008; 15 (1): 61-64.
Lin, Chwan-Fwu., Chen, Chien-Chih., Cheng, Lee-Ying., Huang, Yu-Ling.,Sheu,
Shuenn-Jyi. 2006. Bioactive Flavonoid from Ruellia tuberosa. Journal of
30
UIN Syarif Hidayatullah Jakarta Ma, Yanhe., Xue, Yanfen., Zhou, Cheng. 2010. Enhancing the Thermostability of
α-Glucosidase from Thermoanaerobacter tengcongenesis MB4 by Single
Proline Substitution.Japan: The Society for Biotechnology.
Riset Kesehatan Dasar (Riskesdas). 2013. Hasil Riset Kesehatan Dasar
(Riskesdas). Jakarta: Badan Litbangkes, Depkes RI, 2013. Hal: 88.
Shahwar, Durre., Ahmad, Naeem., Ahmad, Mobasher., Khan, Muhammad
Akmal., Ullah, Sami., Ullaha, Saif. 2011.Hypoglicemic Activity of Ruellia
tuberosa Linn (Achantaceae) in Normal and Alloxan-Induced Diabetic
Rabbit. Iranian Journal of Pharmaceutical Sciences: 7(2): 107-115.
Tiwari, P. et al. 2011. Phytochemical Screening and Extraction : A Review.
Internationale Pharmaceutica Sciencia. Department of Pharmaceutical
Sciences, Lovely School of Pharmaceutical Sciences, Phagwara, Punjab. 1
:1.
Wolever Thomas M.S., Chiasson, Jean-Louis., Hunt, John A., Josse, Robert G.,
Palmason, Carol., Rodger, N. Wilson., Ross, Stuart A., Ryan, Edmon A.,
Tan, Meng H. 1998. No Relationship Between Carbohydrate Intake an
Effect of Acarbose on HbA1C or Gastrointestinal Symptoms in Type 2
Diabetic Subjects Consuming 30-60% of Energy From Carbohydrate.
LAMPIRAN
Lampiran 1. Alat dan Bahan Penelitian
Timbangan analitik Rotary evaporator Destilator
Spektrofotometri UV Vis pH meter Botol Maserasi
32
UIN Syarif Hidayatullah Jakarta Serbuk simplisia
Penapisan
Lampiran 2. Alur Penelitian
Uji antidiabetes secara in Vitro menggunakan enzim α-glukosidase
Ekstraksi Dihaluskan
Dirajang dan dikeringkan Sortasi
Tanaman Liar
Determinasi
Diuapkan dengan vakum rotavapor
33
34
35
36
37
Diencerkan 25 kali dengan buffer fosfat pH 7,0
(larutan enzim) Diambil 1 mL
Lampiran 7. Kerangka Konsep Penelitian
A. Uji Antidiabetes Ekstrak
Uji dengan spektrofotometri UVVis pada λ = 400 nm
Ditambah NaCO31000 µL 2 M
Diinkubasi selama 15 menit, suhu 37oC
Ditambah 250 µ L larutan enzim Prainkubasi selama 5 menit,
suhu 37oC
250 µ Lp-nitrofenil α-D-glukopiranosida 0,2 M (substrat) +
440 µ L buffer fosfat pH 7,0 Dipipet 60 µ L
90 ppm 70 ppm
50 ppm 30 ppm
10 ppm
Ekstrak diencerkan dengan DMSO
38
UIN Syarif Hidayatullah Jakarta (lanjutan)
B. Blanko
Uji dengan spektrofotometri
UVVis pada λ = 400 nm
Ditambah NaCO31000 µL 2 M
Diinkubasi selama 15 menit, suhu 37oC
Ditambah 250 µ L larutan buffer fosfat pH 7 Prainkubasi selama 5 menit,
suhu 37oC
39
(lanjutan)
C. Kontrol
Uji dengan spektrofotometri UVVis pada λ = 400 nm
Ditambah NaCO31000 µL 2 M
Diinkubasi selama 15 menit, suhu 37oC
Ditambah 250 µ L larutan enzim Prainkubasi selama 5 menit,
suhu 37oC
40
UIN Syarif Hidayatullah Jakarta Lampiran 8. Larutan Uji
1. Pembuatan Larutan Induk
Konsentrasi larutan induk yang digunakan adalah 100.000 ppm,
ekstrak ditimbang sebanyak 500 mg, lalu ditambahkan DMSO hingga 5
mL.
2. Pembuatan Larutan Uji dan Kontrol Positif
Konsentrasi 1000 ppm
3. Pembuatan Larutan Uji
Pembuatan larutan uji dengan volume total 2 ml terdiri dari:
1) 60 µl diambil dari seri larutan uji.
Untuk konsentrasi 30 ppm diambil dari konsentrasi 1000 ppm. Untuk konsentrasi 90 ppm diambil dari konsentrasi 3000 ppm. Untuk konsentrasi 150 ppm diambil dari konsentrasi 5000 ppm. Untuk konsentrasi 210 ppm diambil dari konsentrasi 7000 ppm. Untuk konsentrasi 270 ppm diambil dari konsentrasi 9000 ppm.
2) 440 µL dapar fosfat pH 7,0.
41
(lanjutan)
4) 250 µL larutan enzim.
5) 1000 µL larutan natrium karbonat 2 M.
Lampiran 9. Hasil Uji Akarbose
C
S1 : Absorbansi larutan uji dengan enzim.
So : Absorbansi larutan uji tanpa enzim.
S : S1-S0 (absorbansi larutan uji dengan enzim – absorbansi
larutan uji tanpa enzim).
Dengan konsentrasi (ppm) sebagai sumbu x dan %Inhibisi sebagai sumbu y,
kemudian di masukkan ke dalam regresi linear didapat persamaan garis:
y= 28,748 + 0,255x. Sedangkan untuk menghitung IC50:
42
UIN Syarif Hidayatullah Jakarta Lampiran 10. Hasil Uji Ekstrak
C
S1 : Absorbansi larutan uji dengan enzim.
So : Absorbansi larutan uji tanpa enzim.
S : S1-S0(absorbansi larutan uji dengan enzim – absorbansi
larutan uji tanpa enzim).
Dengan konsentrasi (ppm) sebagai sumbu x dan % Inhibisi sebagai sumbu y,
kemudian di masukkan ke dalam regresi linear didapat persamaan garis:
y=7,039+ 0,318x. Sedangkan untuk menghitung IC50: