AKTIVITAS SITOTOKSIK DAN APOPTOSIS SEL KHAMIR
EKSTRAK KLOROFORM KAPANG ENDOFIT
Evodia suaveolens
AZMI AZHARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
AZMI AZHARI. Aktivitas Sitotoksik dan Apoptosis Sel Khamir Ekstrak
Kloroform Kapang Endofit
Evodia suaveolens
. Dibimbing oleh WARAS
NURCHOLIS dan DIMAS ANDRIANTO.
Kanker dapat terjadi apabila jumlah sel tidak dapat dipertahankan dalam
jumlah tetap. Sel yang mengalami gagal apoptosis akan mengalami pembelahan
terus menerus. Apoptosis adalah suatu kematian sel terprogram. Apoptosis pada
sel khamir dapat dijadikan sebagai model, karena siklus sel khamir mirip dengan
sel manusia.
Evodia suaveolens
dapat menghasilkan senyawa evodiamin yang
dapat memicu apoptosis. Kapang endofit dapat menghasilkan senyawa bioaktif
yang mirip inang tanamannya. Sebanyak 8 isolat kapang endofit telah diisolasi
dari batang
Evodia suaveolens
. Kapang endofit lalu difermentasi dan diekstraksi
metabolit sekundernya dengan kloroform. Ekstrak diujikan sitotoksitasnya dengan
menggunakan metode BSLT (
Brine Shrimp Lethality Test
). Nilai LC
50dari setiap
kapang endofit
Evodia suaveolens
adalah kapang 1 bernilai 315 ppm, kapang 3
bernilai 270 ppm, kapang 5 bernilai 400 ppm, kapang 7 bernilai 19.7 ppm dan
kapang 8 bernilai 403 ppm. Kapang 2, 4, dan 6 tidak toksik pada konsentrasi 500,
100, 50 dan 10 ppm. Konsentrasi LC
50masing-masing isolat dipakai untuk
ABSTRACT
AZMI AZHARI. Cytotoxic and Apoptosis Activities in Yeast of Chloroform
Extract from Endophytic Molds
Evodia suaveolens
. Supervised by WARAS
NURCHOLIS and DIMAS ANDRIANTO.
Cancer can occur if the cell cannot be sustained in the amount fixed. Cells that
have failed apoptosis, they will division continously. Apoptosis is the process of
programmed cell death. Apoptosis in yeast cell can be used as model because
yeast cell cycle similar to human cell.
Evodia suaveolens
produce evodiamine, it
trigger apoptosis. Endophytic mold produce bioactive compounds that similar to
its host plant. Eight isolates endophytic mold have been isolated from steam of
Evodia suaveaolens
. Endophytic mold then was fermented and secondary
metabolites was extracted with chloroform. Then the extracts was tested using
cytotoxic activity with BSLT (Brine Shrimp Lethality Test) method. Values of
LC
50from each endophytic mold of
Evodia suaveolens
are 315 ppm (mold 1), 270
ppm (mold 3), 400 ppm (mold 5), 19.7 ppm (mold 7), and 403 ppm (mold 8).
Mold 2,4, and 6 is not toxic in 500, 100, 50, and 10 concentration. Each
concentration of LC
50used for apoptosis induction in yeast cell. Percentation of
AKTIVITAS SITOTOKSIK DAN APOPTOSIS SEL KHAMIR
EKSTRAK KLOROFORM KAPANG ENDOFIT
Evodia suaveolens
AZMI AZHARI
G84080050
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Sitotoksik dan Apoptosis Sel Khamir Ekstrak
Kloroform Kapang Endofit
Evodia suaveolens
Nama
: Azmi Azhari
NIM
: G84080050
Disetujui,
Komisi Pembimbing
Diketahui,
Tanggal Lulus :
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Waras Nurcholis, M.Si
Ketua
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat,
berkah, dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan
penulisan skripsi ini dengan baik. Shalawat serta salam semoga selalu tercurah
kepada Nabi Muhammad SAW, keluarga, sahabat, dan para pengikutnya sampai
akhir zaman. Penelitian ini berjudul Aktivitas Sitotoksik dan Apoptosis Sel
Khamir Ekstrak Kloroform Kapang Endofit
Evodia suaveolens.
Kegiatan
penelitian yang merupakan salah satu syarat memperoleh gelar sarjana sains pada
Departemen Biokimia ini dilakukan dari bulan Februari hingga Juni 2012,
bertempat di Laboratorium Biokimia Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu
dalam penyelesaian penelitian ini baik secara langsung maupun tidak langsung.
Ucapan terima kasih kepada DIKTI selaku sumber pendanaan dari penelitian ini
yang merupakan PKM-P (Program Kreativitas Mahasiswa Penelitian) yang
berjudul Pemanfaatan Senyawa Metabolit Sekunder
Evodia suaveolens
sebagai
Antikanker yang disusun oleh Ridho Pratama, Affan Iqbal, dan Ayu Arthuria.
Ucapan terima kasih penulis sampaikan kepada Waras Nucholis, M.Si. sebagai
ketua pembimbing dan Dimas Andrianto, M.Si. sebagai anggota pembimbing
yang telah memberikan bimbingan, motivasi, saran, dan kritiknya. Terima kasih
kepada kedua orang tua tercinta, adik, Laita dan seluruh keluarga atas segala kasih
sayang, perhatian, doa, dan dukungan yang tak henti-hentinya diberikan kepada
penulis dan sangat berarti bagi penulis.
Penulis juga mengucapkan terima kasih kepada rekan-rekan selama penelitian
Affan, Ridho, Khoerotunnisa atas saran dan motivasi yang diberikan. Selain itu,
penulis ucapkan terima kasih kepada teman-teman seperjuangan Biokimia 45,
rekan penelitian satu lab, Ines, Mega, Didit, Dian, Aros, Anisa Utami, Daniel,
Elvita, Yoan, Rian, seluruh warga kosan Kingstone Perwira dan juga
sahabat-sahabat yang tidak dapat disebutkan satu persatu atas segala bantuan, saran, dan
motivasi yang diberikan. Penulis berharap semoga hasil penelitian dan karya
ilmiah ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Juni 2012
RIWAYAT HIDUP
Penulis dilahirkan di kabupaten Cirebon pada tanggal 6 Maret 1990 dari ayah
bernama Drs. Khudlori dan ibu bernama Dra. Rodliyah Zaenudin M.Ag. Penulis
merupakan anak pertama dari dua bersaudara.
Pendidikan penulis dimulai dari TK Khatulistiwa dan SDN II Pegagan,
kemudian dilanjutkan ke SMP Negeri 1 Kota Cirebon. Tahun 2008 penulis
menyelesaikan pendidikan di MAN Darussalam Ciamis dan pada tahun yang
sama lolos seleksi masuk dan melanjutkan studi di Institut Pertanian Bogor
melalui jalur Undangan Seleksi Masuk IPB (USMI). Di IPB penulis mengambil
mayor Biokimia di Departemen Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
Selama mengikuti perkuliahan penulis menjadi komti (ketua kelas) dari sejak
TPB (Tingkat Persiapan Bersama) hingga masuk departemen Biokimia. Penulis
juga aktif dalam kegiatan organisasi kemahasiswaan di IPB dan organisasi
mahasiswa daerah, diantaranya penulis pernah aktif sebagai Kordinator CIC
(
Communication and Information Center
)
Community Research and Education of
Biochemistry
periode 2009/2010, dan staf humas Ikatan Kekeluargaan Cirebon
2011/2012. Selain itu, penulis yang hobinya menulis ini menjadi ketua dan
tergabung komunitas FIKSI (Forum Imajinasi dan Kreativitas Sastra IPB) yang
baru dibentuknya untuk menampung bakat menulis sastra. Penulis juga sering
menulis di kompasiana.com dan mengikuti berbagai agendanya.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Kanker ... 1
Apoptosis ... 2
Sel khamir (
Saccharomyces cerevisiae)
... 2
Evodia suaveolens
... 3
Kapang endofit ... 3
Fermentasi ... 4
Ekstraksi ... 4
BSLT (
Brine Shrimp Lethality Test)
... 4
BAHAN DAN METODE ... 5
Alat dan Bahan ... 5
Metode ... 5
HASIL DAN PEMBAHASAN ... 6
Hasil Isolasi Kapang Endofit
Evodia suaveolens
... 6
Hasil Fermentasi dan Ekstrak Klorofom Kapang Endofit
Evodia suaveolens
.... 7
Hasil Uji Sitotoksik dengan BSLT (
Brine Shrimp Lethality Test)
... 8
Kurva Pertumbuhan Sel Khamir ... 9
Hasil Uji Induksi Apoptosis pada Sel Khamir ... 10
SIMPULAN DAN SARAN ... 11
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1.
Rendemen ekstrak kloroform hasil fermentasi kapang endofit
Evodia
suaveolens ...
8
2.
Hasil frekuensi sel khamir yang mengalami
petite
akibat induksi ekstrak
kloroform kapang endofit
Evodia suaveolens
... 10
DAFTAR GAMBAR
Halaman
1.
Sel khamir yang mengalami apoptosis ... 2
2.
Saccharomyces cerevisiae
pembesaran 10 x 40... 3
3.
Tanaman
Evodia suaveolens
... 3
4.
Kapang endofit A dan B
Evodia suaveolens
... 7
5.
Isolat kapang endofit
Evodia suaveolens
... 8
6.
Fase kloroform pada proses ekstraksi kapang endofit
Evodia suaveolens
... 8
7.
Nilai LC
50dari uji sitotoksik BSLT ekstrak kloroform kapang endofit
Evodia suaveolens
... 9
8.
Kurva pertumbuhan sel khamir berdasarkan nilai bobot sel ... 9
9.
Perbandingan ukuran sel normal (A) dan sel
petite
(B) ... 10
DAFTAR LAMPIRAN
Halaman
1.
Tabel kapang endofit
Evodia suaveolens ...
15
2.
Tabel khamir yang mengalami
petite
setelah perlakuan ekstrak ... 17
3.
Nilai LC
50... 19
4.
Strategi penelitian... 21
5.
Induksi apoptosis (pembuatan media) ... 22
1
PENDAHULUAN
Indonesia merupakan negara yang dikenal dengan keanekaragaman hayatinya yang tinggi. Salah satunya adalah tanaman yang berkhasiat sebagai antikanker seperti Zodia atau Evodia suaveolens. Tanaman ini berasal dari daerah Papua (Kardinan 2007), dan dapat digunakan untuk mengusir nyamuk. Studi terbaru mengatakan Evodia suaveolens dapat menghasilkan senyawa evodiamin (Humbert et al. 2012). Senyawa ini mempunyai aktivitas yang baik sebagai antikanker yang mana dapat menghambat proliferasi, metastasis dan mempercepat apoptosis beragam sel kanker (Jiang 2009). Namun, pengembangan obat yang berbahan dasar Zodia masih menghadapi kendala, senyawa aktif yang diperoleh dari tanaman ini tidaklah banyak sehingga diperlukan tanaman yang banyak untuk mendapatkan senyawa tersebut. Terbatasnya sumber daya alam, dan waktu tumbuh tanaman yang lama membuat efisiensi produksi obat ini menjadi turun.
Kanker merupakan penyakit degeneratif yang mematikan. WHO (World Health Organization) (2012) memprediksi kasus kanker dunia yang menyebabkan kematian akan mengalami 13.1 juta jiwa tahun 2030. Sebagian besar penyakit kanker disebabkan oleh lingkungan dan gaya hidup. Faktor lingkungan yang menyebabkan kanker antara lain polusi, asap rokok, radiasi, dan infeksi organisme. Faktor gaya hidup yaitu kebiasaan merokok, konsumsi alkohol, makanan yang mengandung bahan tambahan pangan yang karsinogenik, dan makanan berlemak trans serta obesitas (Jemal 2011). Teknologi untuk terapi kanker seperti pembedahan, radiasi, terapi hormon dan kemoterapi banyak dikembangkan saat ini, tapi pengobatan ini memerlukan biaya yang mahal dan memiliki efek samping yang tidak baik bagi tubuh. Oleh karena itu, perlu dikembangkan suatu pengobatan yang dapat mengobati kanker dengan kemampuan mengobati yang kuat dan tanpa efek samping.
Pengembangan teknologi produksi senyawa aktif dari tanaman obat merupakan teknologi yang memiliki prospek yang baik. Salah satu bioteknologi yang dapat digunakan untuk menghasilkan senyawa obat dalam skala besar adalah dengan menggunakan metabolit sekunder yang diekstrak dari kapang endofit. Penggunaan kapang endofit dapat meningkatkan efisiensi produksi senyawa antikanker, masa berkembang biak kapang endofit yang relatif singkat dengan laju
pertumbuhan yang tinggi memungkinkan produksi senyawa antikanker dan penginduksi apoptosis semakin efisien dalam jumlah besar. Senyawa bioaktif antikanker yang akan digunakan untuk produk antikanker harus diujikan terlebih dahulu dengan uji sitotoksik. Uji sitotoksik merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Studi eksperimental kanker dapat dilakukan terhadap sel khamir melalui induksi apoptosis sehingga akan memberikan informasi yang berkaitan efek modulator apoptosis tersebut terhadap sel (Sukardiman et al. 2006). Penelitian ini menggunakan ekstrak kloroform kapang endofit isolat dari batang Evodia suaveolens. Tujuan penelitian ini adalah untuk menguji aktivitas sitotoksik dan apoptosis sel khamir dari ekstrak tersebut. Hipotesis dari penelitian ini adalah ekstrak kloroform kapang endofit Evodia suaveolens memiliki aktivitas sitotoksik dan dapat menginduksi apoptosis pada sel khamir. Manfaat penelitian ini adalah untuk mengetahui aktivitas dari sitotoksik dan apoptosis pada sel khamir ekstrak kloroform kapang endofit Evodia suaveolens yang nantinya dapat dipakai sebagai antikanker.
TINJAUAN PUSTAKA
Kanker
Kanker dapat disebabkan oleh beberapa faktor yaitu penggunaan tembakau, infeksi, radiasi, kurangnya aktivitas fisik, makanan yang tidak sehat, obesitas, dan polusi lingkungan (Anand et al. 2008). Kanker merupakan penyakit kedua terbesar di dunia, dan 80 % kematian akibat kanker terjadi pada negara industri.
Penyakit kanker terus meningkat dalam skala global. Kanker dapat menyerang manusia pada segala usia yaitu dapat menyerang anak-anak dan dapat beresiko lebih tinggi dengan semakin bertambahnya usia. Pada tahun 2007 kanker menyebabkan 13 % kematian terhadap jumlah penduduk dunia (Mattias 2001).
2
tumor tidak padat yang disebabkan oleh produksi sel darah putih yang tidak normal. Lymphoma adalah kanker yang terjadi di pembuluh limfa, kanker ini dibagi menjadi 2 katagori yaitu hodkin’s dan non-hodgkins.
Myeloma merupakan tumor-tumor yang
terbentuk di dalam antibodi yang membentuk plasma sel pada beberapa jaringan.
Apoptosis
Apoptosis adalah suatu kematian sel secara alami dan terprogram. Apoptosis dapat terjadi jika sel mengalami suatu kerusakan yang tidak dapat diperbaiki lagi diakibatkan oleh terinfeksi virus, stress akibat kelaparan, kerusakan DNA, dan radikal bebas. Fungsi apoptosis adalah untuk melenyapkan sel-sel yang mengalami kerusakan dan tidak dapat lagi menjalankan fungsinya, serta mencegah penularan virus dan berperan penting dalam mencegah kanker. Sel yang mengalami kegagalan dalam apoptosis, akan mengalami pembelahan terus menerus dan berkembang menjadi tumor. Tumor dapat terjadi jika jumlah sel tidak dapat dipertahankan pada jumlah tetap. Pada apoptosis terjadi serangkaian transduksi sinyal akibat dari serangkaian reaksi biokimiawi yang dapat menyebabkan perubahan ciri morfologis yaitu pengkerutan sel, fragmentasi inti sel, kerusakan membran dan sel tersebut dapat pecah menjadi beberapa vesikel yang disebut badan apoptosis (Algiansyah 2009).
Apoptosis berbeda dengan nekrosis. Nekrosis adalah suatu kematian sel yang diakibatkan oleh infeksi. Pada nekrosis terjadi perubahan pada inti sel yang pada akhirnya menyebabkan inti menjadi lisis dan membran plasma menjadi pecah. Pada apoptosis terjadi kematian sel terprogram, membran sel tidak pecah, dan inti mengalami fragmentasi yang kemudian mengirimkan sinyal kepada sel yang berada didekatnya untuk difagosit. Proses apoptosis dikendalikan oleh berbagai sinyal tingkat sel yaitu dari ekstrinsik dan intrinsik. Sinyal ekstrinsik bisa berasal dari hormon, faktor pertumbuhan, nitrit oksida, dan sitokin. Sinyal tersebut harus bisa menembus membran plasma ataupun transduksi sinyal untuk mendapatkan respon. Sinyal intrinsik apoptosis merupakan suatu respon yang diinisiasi oleh sel sebagai respon terhadap stress dan akhirnya dapat mengakibatkan kematian sel. Pengikatan reseptor nuklear oleh glukokortikoid, panas, radiasi, kekurangan nutrisi, infeksi virus, dan hipoksia merupakan keadaan yang dapat menimbulkan pelepasan sinyal intrinsik
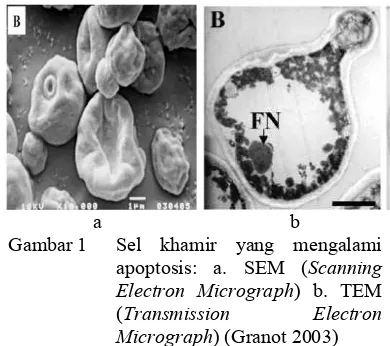
melalui kerusakan sel (Lumongga 2008). Koloni khamir yang mengalami apoptosis dapat dibedakan dari koloni normalnya. Koloni yang mengalami apoptosis berubah menjadi koloni petit akibat dari disfungsi mitokondria (kehilangan kemampuan respirasi pada mitokondria) sehingga laju pertumbuhan sel khamir menjadi jauh lebih lambat dari sel khamir normal (Gambar 1) (Madigan et al 2000). Sel khamir yang mengalami petite mendapatkan energi dari proses glikolisis dan tidak mampu menggunakan sumber karbon yang tidak dapat difermentasikan, sedangkan sel khamir normal tidak hanya memperoleh energi dari glikolisis, tetapi juga dari proses respirasi. Oleh sebab itu, koloni yang mengalami petit terlihat lebih kecil. Koloni khamir yang mengalami petit jarang terjadi secara alami, karena jumlah glukosa di alam melimpah sehingga bukan pembatas untuk pertumbuhan khamir, apalagi oksigen yang jumlahnya juga melimpah (Algiansyah 2009).
Sel khamir (Saccharomyces cerevisiae) Khamir adalah suatu organisme uniselular, eukariot yang bereproduksi secara aseksual melalui pertunasan, bisa juga dengan pembelahan biner dan memproduksi semacam spora haploid untuk bereproduksi secara seksual. Saccharomyces cervisiae adalah organisme yang biasa dipakai oleh masyarakat indonesia untuk dimanfaatkan pembuatan roti dan tape singkong. Selain itu, khamir jenis ini juga dipakai pada berbagai industri yaitu proses produksi minuman beralkohol (Ahmad 2005).
Saccharomyces cerevisiae merupakan
khamir sejati secara morfologi hanya membentuk blastospora berbentuk bulat lonjong, silindris, oval atau bulat telur yang dipengaruhi oleh strainnya (Gambar 2). Penampilan makroskopik mempunyai koloni
a b
3
berbentuk bulat, warna kuning muda, permukaan berkilau, licin, tekstur lunak dan memiliki sel bulat dengan askospora 1-8 buah (Ahmad 2005).
Taksonomi Saccharomyces cerevisiae menurut Sanger (2004) diklasifikasikan sebagai berikut super kingdom Eukaryota, phylum Fungi, subphylum Ascomycota, kelas Saccharomycetes, ordo Saccharomycetales, family Saccharomycetaceae, genus Saccharomyces, spesies Saccharomyces cerevisae.
Evodia suaveolens
Tanaman Zodia (Evodia suaveolens Scheff) merupakan tanaman asli Indonesia yang berasal dari Irian (Papua) yang pada umumnya ditanam di pekarangan rumah, tanaman yang mempunyai tinggi antara 50 cm hingga 200 cm (rata-rata 75 cm), dipercaya mampu mengusir nyamuk dan serangga lainnya dari sekitar tanaman. Oleh sebab itu, tanaman ini sering ditanam pada pekarangan rumah untuk menghalau nyamuk. Aroma yang dikeluarkan oleh tanaman Zodia cukup wangi. Tanaman ini dapat mengeluarkan aroma apabila tanaman tergoyang oleh tiupan angin sehingga diantara daunnya saling menggosok, maka keluarlah aroma yang wangi. Saat ini sebagian masyarakat menyimpan tanaman Zodia pada pot di dalam ruangan sehingga selain memberikan aroma yang khas, juga aromanya dapat menghalau nyamuk dari ruangan. Selain itu, manfaat yang lainnya adalah sebagai antikanker (Kardinan 2007).
Evodia suaveolens diklasifikasikan ke dalam kingdom Plantae (tumbuh-tumbuhan), subkingdom Tracheobionta (tumbuhan berpembuluh), super divisi Spermatophyta (menghasilkan biji), divisi Magnoliophyta (tumbuhan berbunga), kelas Magnoliopsida (berkeping dua), sub kelas Rosidae, ordo Sapindales, family Rutaceae (suku jeruk-jerukan), genus Evodia, spesies Evodia suaveolens Scheff.
Kapang endofit
Endofit secara bahasa berasal dari kata
endon yang berarti di dalam dan phyton yang
berarti tanaman (Schulz & Boyle 2005). Secara umum, endofit adalah makhluk hidup yang berada di dalam tanaman dapat bersifat parasitik atau simbiotik. Kapang endofit adalah fungi yang menginfeksi jaringan tanaman yang sehat tanpa menyebabkan sakit (Clay 2004).
Cendawan atau fungi adalah suatu organisme heterotrof, dan memerlukan senyawa organik untuk pertumbuhannya. Organisme ini tidak berklorofil dan mempunyai sel yang kaku. Cendawan dapat dibagi menjadi dua bagian yaitu khamir (yeast) yang berbentuk uniselular dan kapang (mold) yang berbentuk benang (filamen). Fase khamir timbul jika organisme itu hidup sebagai parasit (merugikan) dalam jaringan dan ada juga yang bersifat saprofit (menguntungkan) dalam jaringan. Fase kapang ini dapat tumbuh dalam organisme tersebut, jika hidup sebagai saprofit (Gandjar & Sjamsuridzal 2006).
Winarno (2006) menemukan bahwa hasil pemurniaan mikroba endofit dari batang kina Cinchona ledgeriana Moens diperoleh dua jenis kapang yang dapat menghasilkan senyawa alkaloid kinin dan sinkonin. Kedua senyawa tersebut biasanya terkandung dalam batang Kina yang memiliki aktivitas antimalaria. Hubungan antara mikroba endofit dan tanaman dalam menghasilkan metabolit sekunder sangat menarik dipelajari. Sejak tahun 1993 penelitian produksi taxol yang merupakan obat kanker oleh kapang endofitik Taxomyces andreanae dan Pestalotiopsis
microspora telah dilaporkan. Pada
perkembangan senyawa aktif yang dihasilkan oleh kapang endofit ternyata tidak selalu sama dengan senyawa yang dihasilkan oleh tanaman inangnya sehingga kapang endofit menjadi sumber senyawa aktif baru yang sangat menjanjikan. Disamping itu pencarian senyawa baru dari mikroba endofit diharapkan Gambar 2 Saccharomyces cerevisiae
pembesaran 10 x 40 (Ahmad 2005)
4
dapat mengurangi kerusakan lingkungan akibat pemanfaatan tanaman secara besar-besaran untuk mendapatkan senyawa aktif (Strobel et al. 2004).
Hasil penelitian terhadap kapang endofit menunjukkan bahwa bagian tanaman yang berbeda dari satu tanaman inang memperlihatkan isolat kapang endofit yang berbeda. Perbedaan habitat dan ekosistem tanaman inang ini juga menunjukkan perbedaan kapang endofit.
Fermentasi
Fermentasi adalah suatu proses perubahan biokimia yang terjadi di dalam substrat organik sebagai akibat kerja zat-zat katalis kimia (enzim) yang diproduksi oleh mikroba tertentu. Fermentasi secara teknik dapat didefinisikan sebagai suatu proses oksidasi anaerobik atau partial anaerobik karbohidrat yang menghasilkan alkohol serta beberapa asam, namun banyak proses fermentasi yang menggunakan substrat protein dan lemak (Muchtadi & Ayustaningwarno 2010).
Fermentasi terbagi menjadi dua, yaitu fermentasi spontan dan tidak spontan (membutuhkan starter). Fermentasi spontan adalah fermentasi yang biasa dilakukan menggunakan media penyeleksi, seperti garam, asam organik, asam mineral, dan pati. Media penyeleksi tersebut akan menyeleksi bakteri patogen dan menjadi media yang baik bagi tumbuh kembang bakteri selektif yang membantu jalannya fermentasi. Fermentasi tidak spontan adalah fermentasi yang dilakukan dengan penambahan kultur organisme bersama media penyeleksi sehingga proses fermentasi dapat berlangsung lebih cepat (Rejeki 2011).
Mikroba yang melakukan fermentasi membutuhkan energi yang umumnya diperoleh dari glukosa. Dalam keadaan aerob, mikroba mengubah glukosa menjadi air, CO2
dan energi (ATP). Beberapa mikroba hanya dapat melangsungkan metabolisme dalam keadaan anaerob dan hasilnya adalah substrat yang setengah terurai. Hasil penguraiannya adalah air, CO2, energi dan sejumlah asam
organik lainnya, seperti asam laktat, asam asetat, etanol serta bahan-bahan organik yang mudah menguap (Muchtadi & Ayustaningwarno 2010).
Kapang endofit menyimpan potensi ekonomi yang tidak terbatas dan belum banyak diaplikasikan dalam industri farmasi dan pertanian sumber bahan obat, enzim dan senyawa biologis pengendali hama di masa
depan. Proses fermentasi memegang peranan penting dalam produksi senyawa tersebut secara masal dalam skala industri. Produksi senyawa bioaktif melalui fermentasi jamur endofit ini berpotensi besar bagi industri karena reprodusibel, penyediaannya bisa tidak terbatas karena tidak dibatasi jumlah tanaman (Sugijanto 2008).
Ekstraksi
Ekstraksi adalah suatu proses pemisahan beberapa zat atau senyawa dengan pelarut tertentu. Pemisahan terjadi berdasarkan kemampuan yang berbeda dari komponen-komponen dalam campuran. Pelarut yang digunakan adalah pelarut dengan kemampuan menjerap bahan yang dibutuhkan (Purba 2011).
Proses ekstraksi terdiri dari beberapa tahapan yaitu pencampuran bahan dengan pelarut, pemisahan dan isolasi ekstrak. Pada pencampuran bahan ekstrak dengan pelarut dibiarkan saling berkontrak sehingga terjadi perpindahan masa. Setelah terjadi penjerapan, maka pemisahan dilakukan dengan alat pemisah. Pemisahan bertujuan untuk memisahkan larutan ekstrak dan pelarut. Setelah didapatkan fase ekstrak pelarut, maka pelarut lalu diuapkan dan didapatkan ekstrak murni. Ekstraksi dilakukan berulang sehingga zat yang dijerap lebih optimal (Dirjen POM 2000).
Ekstraksi dilakukan dengan menggunakan pelarut kloroform. Kloroform adalah suatu pelarut non polar yang dapat digunakan untuk ekstraksi alkaloid (Winarno 2006). Evodiamin adalah senyawa alkaloid yang dihasilkan oleh
Evodia suaveolens. Alkaloid dalam bentuk
bebas tidak dapat larut di dalam air, namun dapat larut di dalam kloroform (Jiang 2009).
BSLT (Brine Shrimp Lethality Test) Uji toksisitas adalah suatu uji pendahuluan untuk mengetahui aktivitas farmakologi suatu senyawa. Prinsipnya komponen bioaktif selalu bersifat toksik jika diberikan dengan dosis tinggi dan menjadi obat pada dosis rendah.
Brine Shrimp Lethality Test (BSLT)
merupakan salah satu uji untuk mengetahui toksisitas suatu senyawa (Zebua 2011).
Artemia salina Leach merupakan
5
Metode Brine Shrimp Lethality Test (BSLT) sering digunakan untuk praskrining terhadap senyawa aktif yang terkandung dalam ekstrak tumbuhan karena murah, cepat, mudah dan dapat dipercaya. Suatu metode yang menggunakan Artemia salina Leach telah diperkenalkan sebagai metode bioassay yang sederhana untuk penelitian produk alam. Sifat toksisitas suatu senyawa dapat dibandingkan dengan uji kultur sel sehingga dapat diasosiasikan dengan aktivitas antikanker (Baraja 2008).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah Laminar Air Flow (LAF), neraca analitik, autoklaf, oven, tabung reaksi, cawan petri, labu Erlenmeyer, lempeng pemanas, pengaduk magnetik, jarum ose, pembakar spirtus, pinset, lampu UV, inkubator bergoyang (shaker incubator), sumur BSLT, sentrifus, tabung sentrifus, homogenizer, lemari es, tabung Eppendorf, kaca sebar, mikro pipet, tip (biru, kuning, putih), kertas aluminium, colony counter, dan plastik penyegel.
Bahan yang digunakan dalam penelitian ini adalah tanaman Evodia suaveolens yang didapatkan dari toko tanaman hias di Baranangsiang Bogor, isolat kapang endofit dari batang tanaman Evodia suaveolens, ekstrak metabolit sekunder dari kapang endofit Evodia suaveolens, khamir
Saccharomyces cerevisiase, akuades, etanol,
glukosa, kloroform, natrium hipoklorit 5.3%, kloramfenikol, PDA (Potatos Dextrose Agar), PDB (Potatos Dextrose Broth), air laut, Artemia salina, YEPD (Yeast Extract, Dextrose, Pepton) padat, cair dan petit.
Metode
Penelitian ini terdiri beberapa tahapan yaitu isolasi dan pemurnian kapang endofit, peremajaan kapang endofit, fermentasi, ekstraksi senyawa metabolit sekunder, uji sitotoksik dengan BSLT (Brine Shrimp
Lethality Test) LC50 dan induksi apoptosis
pada sel khamir.
Isolasi dan pemurnian kapang endofit
Batang tanaman Evodia suaveolens dengan panjang 2 cm dan lebar 1 cm dicuci dengan air mengalir, lalu disterilkan dengan etanol 70% selama 1 menit, natrium hipoklorit 5,3% selama 5 menit, dan etanol 75% selama 0,5 menit. Bagian batang dibelah dua secara
longitudinal, lalu diletakkan di atas cawan petri berisi PDA yang telah dicampur dengan kloramfenikol 0,05 mg/mL (Theantana et al. 2007). Keduanya diinkubasi selama 3 hari pada suhu 25oC. Koloni dipindahkan ke PDA dalam cawan petri dan diinkubasi lagi pada suhu 25oC dan dilakukan pengecekan secara berkala untuk pemurnian lebih lanjut. Masing-masing endofit diisolasi melalui beberapa kali ditanam pada agar miring (PDA) dan diinkubasi dalam inkubator suhu 25oC dan diremajakan.
Peremajaan kapang endofit dari isolat
Inokulasi isolat kapang endofit dilakukan secara aseptis di dalam laminar. Laminar terlebih dahulu disterilkan dengan penyinaran sinar ultraviolet selama 1 jam, dan kemudian seluruh bagian dalam laminar dan bagian luar kaca disemprot dengan etanol 70%. Isolat kapang endofit dari agar miring diinokulasi ke dalam media PDA kemudian diinkubasi selama dua hari pada suhu kamar (Pelczar & Chan 1996).
Fermentasi kapang endofit
Isolat kapang yang telah diremajakan masing-masing diinokulasikan ke dalam tabung Erlenmeyer berisi 50 ml media PDB. Tiap tabung Erlenmeyer dilakukan fermentasi dengan metode statik pada suhu kamar selama 12 hari dan diuji juga dengan fermentasi dinamis dengan agitasi 171 rpm selama 5 hari. Perbedaan ini untuk mengetahui perbandingan fermentasi tersebut untuk menghasilkan ekstrak lebih banyak (Kumala dan Muhamad 2005).
Ekstraksi metabolit sekunder
Kapang endofit dalam Erlenmeyer diekstrak dengan pelarut kloroform masing-masing sebanyak tiga kali ekstrak dan pada tiap ekstraksi digunakan pelarut sebanyak 50 ml. Fase pelarut ditampung dalam botol yang telah diketahui bobot kosongnya. Hasil ekstraksi diuapkan dalam ruang asam hingga tertinggal residunya. Bobot ekstrak diperoleh dari selisih antara bobot botol berisi ekstrak dan bobot botol kosong. Ekstrak di dalam botol dipindahkan ke vial yang lebih kecil dengan dilarutkan terlebih dahulu dengan pelarutnya (Kumala dan Muhamad 2005).
Uji toksistas dengan BSLT (Brine Shrimp Lethality Test)
6
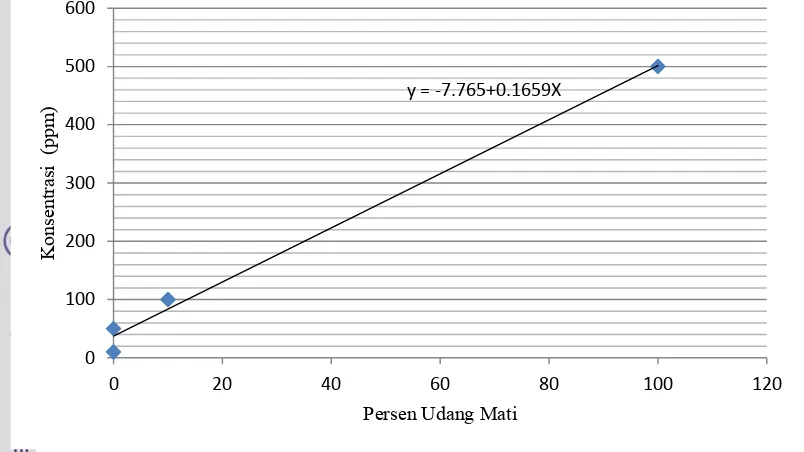
dimasukkan aerator, dan didiamkan selama 1x24 jam agar menjadi larva udang. Selanjutnya, disiapkan larutan sampel dengan konsentrasi masing-masing 500 ppm, 100 ppm, 50 ppm, dan 10 ppm setelah ditambah air laut dan Artemia salina. Perhitungan larva yang masih hidup dan yang mati dilakukan setelah 24 jam untuk menentukan nilai LC50 (Meyer et al. 1982).
Induksi apoptosis pada sel khamir
Induksi apoptosis pada sel khamir meliputi beberapa tahapan yaitu pembuatan media, peremajaan sel khamir, inkubasi dan pemanenan sel khamir, serta perlakuan induksi apoptosis pada sel khamir (Granot 2003).
Pembuatan Media (Campbell 1991).
Media yang digunakan untuk induksi apoptosis pada sel khamir meliputi media cair dan padat, serta media padat petit YEPD (Yeast Extract Peptone Dextrose). Media cair YEPD memiliki komposisi 1% yeast extract, 2 % pepton, 2% glukosa, 1.8% baktoagar, dan akuades hingga 100 ml, lalu disterilkan dengan autoklaf pada suhu 120°C selama 15 menit dengan tekanan 10 atm. Semua media yang dibutuhkan dalam penelitian ini memiliki komposisi dan cara pembuatan yang hampir sama. Perbedaannya terletak pada penambahan baktoagar di medium padat YEPD. Sementara pada media petit dilakukan pengurangan jumlah glukosa menjadi 0.1%, penambahan etanol 2%.
Peremajaan Sel Khamir (Campbell 1991). Sel-sel khamir diremajakan pada media YEPD padat dengan menggoreskan 2 ose khamir dan diinkubasi pada suhu 27°C selama 2 hari. Hasil peremajaan akan digunakan sebagai biakan perlakuan.
Inkubasi dan Pemanenan Sel Khamir (Campbell 1991). Proses inkubasi ini dilakukan untuk mengetahui kurva pertumbuhan dari sel khamir. Kurva ini didapatkan dengan menghitung bobot kering sel khamir. Pada awalnya, sel-sel khamir ditumbuhkan pada media padat YEPD, kemudian sebanyak 1 ose sel khamir dipindahkan ke medium cair YEPD dan dipindahkan sebanyak 200 µl ke masing-masing 5 tabung untuk diukur jumlah khamir selama 5 hari. Sel dipanen dengan proses sentrifugasi pada kecepatan 4000 rpm selama 10 menit dan peletnya dicuci 2 kali dengan akuades secukupnya. Pelet yang sudah dicuci kemudian diukur bobotnya dan dicatat, selanjutnya dilakukan metode gravimetri
untuk didapatkan bobot kering sel. Bobot akhir sel khamir kemudian didapatkan melalui perhitungan sebagai berikut:
Bobot Akhir Sel Khamir = Bobot Basah – Bobot Kering
Perlakuan Induksi Apoptosis (Granot 2003). Percobaan ini akan dilakukan pada beberapa perlakuan, yaitu ekstrak metabolit sekunder kapang endofit Evodia suaveolens yang telah diseleksi dari uji toksistas BSLT, glukosa 2% sebagai kontrol positif, dan akuades sebagai kontrol negatif. Konsentrasi yang dipakai untuk induksi adalah nilai konsentrasi LC50 dari masing-masing kapang
endofit. Ekstrak metabolit sekunder sebanyak 400 µl lalu dimasukan ke dalam Eppendorf yang berisi 100 µl kultur sel khamir dan ditambahkan 500 µl YEPD. Campuran itu dihomogenisasi terlebih dahulu, kemudian diinkubasi pada 37°C selama 24 jam. Sama halnya pada perlakuan ekstrak kapang endofit
Evodia suaveolens, perlakuan kontrol positif
ditambahkan glukosa 2% dan kontrol negatif akuades untuk mengganti ekstrak pada perlakuan.
Uji Frekuensi Petit (Granot 2003). Pada 24 jam dilakukan pengambilan sebanyak 15 µl sel dari biakan perlakuan yang telah diencerkan sebanyak 10-6 kali. Sel-sel khamir tersebut disebar merata ke cawan petri yang berisi media padat petit dan diinkubasi pada suhu 28°C selama 24 jam, kemudian dilakukan perhitungan koloni petit. Sel-sel khamir yang berubah menjadi koloni petit tampak berukuran lebih kecil dibandingkan sel-sel khamir normal. Sel-sel khamir yang berubah menjadi koloni petit dihitung frekuensi petitnya dengan rumus :
x 100 %
HASIL DAN PEMBAHASAN
Hasil Isolasi Kapang Endofit Evodia suaveolens
7
Tahapan pertama penelitian ini adalah isolasi dengan tujuan mengisolasi kapang yang terdapat di dalam batang dari Evodia
suaveolens. Batang yang dicuci, sebelum
proses pemotongan dan isolasi dilakukan bertujuan untuk menghilangkan kotoran yang berada diluar batang. Setelah itu dilakukan sterilisasi berurutan dengan menggunakan etanol, sodium hipoklorit (NaOCl), dan etanol. Hal ini dimaksudkan agar mikrob yang berada di luar batang, tidak ikut tumbuh pada media isolasi. Media PDA (Potatos Dextrose Agar) ditambahkan kloramfenikol sebagai antibakteri (Sukandar 2010). Beberapa perlakuan tersebut berguna pada proses isolasi kapang endofit yang berada pada batang Evodia suaveolens.
Isolat kapang endofit yang didapatkan dari Evodia suavelones beragam dan dibedakan dari penyebaran hifa, warna kapang, dan bentuk permukaan kapang tersebut. Pada saat kapang tersebut telah tumbuh, hifa diambil dan dipindahkan pada media PDA yang baru. Pada Gambar 4, kapang endofit A dan B dilakukan isolasi. Kedua kapang tersebut bentuk morfologinya berbeda sehingga dipindahkan pada media PDA baru. Setelah kapang tersebut tumbuh selama tiga hari, maka diamati lagi. Jika kapang endofit tumbuh lebih dari satu, maka dimurnikan lebih lanjut. Isolat kapang endofit dari Evodia suavelolens yang telah didapatkan, akan disamakan satu dengan yang lain sehingga isolat kapang endofit diyakini berbeda dari satu sama lain. Beberapa kapang yang terlihat sama, dicoba ditumbuhkan lebih lama untuk melihat warna pada saat umur tua. Jika warnanya sama, maka isolat satunya dieliminasi. Proses isolasi ini menghasilkan kapang endofit Evodia suaveolens yang beragam.
Banyaknya isolat yang akan dihasilkan bergantung pada media yang digunakan. Penggunaan media yang berbeda akan
menghasilkan kekayaan spesies yang berbeda (Nurhasanah 2008). Dari media PDA (Potatoes Dextrose Agar) terdapat 8 kapang endofit (Gambar 5). Media ini bersifat tidak selektif dan dapat digunakan untuk menumbuhkan atau mengidentifikasi kapang. Media ini mengandung sumber karbohidrat dalam jumlah cukup yaitu terdiri dari 20% ekstrak kentang dan 2% glukosa sehingga baik untuk pertumbuhan kapang tetapi kurang baik untuk pertumbuhan bakteri (Julianingsih 2012). Keterangan mengenai warna, bentuk permukaan dan pola setiap kapang disajikan pada Lampiran 1.
Hasil Fermentasi dan Ekstrak Klorofom Kapang Endofit Evodia suaveolens Fermentasi adalah suatu proses merubah substrat menjadi produk. Tujuannya untuk menumbuhkan dan menghasilkan produk senyawa aktif. Isolat kapang endofit Evodia
suaveolens ditumbuhkan pada media PDB
(Potato Dextrose Broth) yang telah disterilisasi sebelumnya pada autoklaf. Media PDB biasa dipakai untuk pertumbuhan, Gambar 4 Kapang Endofit A dan B Evodia
suaveolens
Kapang 1
Kapang 3
Kapang 2
Kapang 4
Kapang 5
Kapang 7
Kapang 6
Kapang 8 Gambar 5 Isolat Kapang Endofit dari
Evodia suaveolens A
8
pemanenan dan produksi kapang (Simanjuntak 2011). Fermentasi dilakukan secara statis dan dinamis. Tujuannya untuk mengetahui perbandingan ekstrak yang didapatkan antara keduanya. Fermentasi statis tanpa agitasi selama 12 hari dan fermentasi dinamis selama 5 hari dengan agitasi 171 rpm. Pada fermentasi substrat yang terdapat pada media PDB (Potato Dextrose Broth) dimanfaatkan kapang endofit tersebut untuk kebutuhan pertumbuhannya. Setiap kapang endofit, menghasilkan produk yang kemungkinan berbeda. Fermentasi ini diharapkan dapat memproduksi evodiamin dari salah satu isolat kapang endofit Evodia
suaveolens. Kapang endofit dapat
menghasilkan senyawa yang mirip dengan inangnya yaitu Evodia suaveolens sehingga diharapkan senyawa evodiamin yang didapatkan dapat menginduksi apoptosis pada sel khamir (Jiang 2009).
Ekstraksi dilakukan setelah fermentasi selesai dilakukan dengan tujuan mengekstrak senyawa yang diinginkan. Ekstraksi ini menggunakan kloroform karena dapat dipakai untuk mengekstrak alkaloid (Winarno 2006). Evodiamine adalah senyawa alkaloid yang dihasilkan dari Evodia suaveolens sehingga diekstraksi dengan kloroform. Pengocokan dilakukan pada ekstraksi dengan tujuan agar ekstrak terjerap secara menyeluruh. Pengocokan ini menghasilkan dua fase yaitu fase air dan fase kloroform. Fase kloroform berada pada bagian bawah (Gambar 6) dan dipisahkan dengan pipet. Ekstraksi dilakukan tiga kali untuk memperbanyak senyawa yang terjerap oleh kloroform. Kloroform diuapkan sampai tertinggal residunya. Bobot residu ini ditimbang dan didapatkan dari bobot botol yang berisi ekstrak dikurangi dengan bobot kosong.
Bobot ekstrak disajikan pada Tabel 1. Dari tabel tersebut, didapatkan residu terbesar dari ekstrak adalah kapang 1 untuk fermentasi
statis yaitu sebanyak 0.41 gram dan kapang 1, 2, 5, 6, dan 7 untuk fermentasi statis sebanyak 0.03 gram. Fermentasi statis menghasilkan senyawa yang lebih banyak dibandingkan fermentasi dinamis. Fermentasi secara dinamis menghasilkan residu ekstrak yang lebih sedikit, disebabkan oleh metabolit yang dihasilkan kemungkinan dimakan kembali oleh kapang tersebut (Simanjuntak 2002).
Ekstrak dilarutkan lagi dalam kloroform, dipindahkan pada botol vial dan diuapkan kembali untuk uji sitotoksik dengan BSLT dan senyawa yang memiliki bioaktif dari seleksi sitotoksik, diinduksi pada sel khamir untuk mengetahui daya apoptosisnya.
Hasil Uji Sitotoksik dengan BSLT (Brine Shrimp Lethality Test)
Senyawa bioaktif antikanker yang akan digunakan untuk produk antikanker harus diujikan terlebih dahulu dengan uji sitotoksik. Uji sitotoksik merupakan salah satu pengembangan metode untuk memprediksi keberadaan senyawa yang bersifat toksik pada sel (Kurnijasanti et al. 2008). Salah satu metode uji sitotosisitas adalah Brine Shrimp
Lethality Test (BSLT) yang digunakan untuk
praskrining terhadap senyawa yang diduga berkhasiat sebagai anti tumor (Widyastuti 2008). Uji BSLT merupakan uji pendahuluan di National Cancer Institute (NCI) Amerika. Hewan uji yang digunakan dalam BSLT adalah Artemia salina L.
Tujuan utama dari tahapan ini adalah untuk mengetahui ekstrak yang dihasilkan oleh kapang endofit dari Evodia suaveolens yang paling berpotensi. Selain itu, tujuannya adalah mengetahui konsentrasi yang dapat membunuh dari setengah populasi Artemia
salina. Nilai tersebut menggambarkan
bioaktivitas metabolit yang dihasilkan dari kapang endofit Evodia suaveolens. Semakin kecil nilai konsentrasi yang dapat membunuh setengah populasi larva maka akan semakin tinggi bioaktivitasnya, begitu pula sebaliknya. Gambar 6 Fase kloroform (A) pada proses ekstraksi kapang endofit Evodia suaveolens
Tabel 1 Rendemen ekstrak kloroform hasil fermentasi kapang endofit Evodia suaveolens
Nomor Kapang
Bobot Ekstrak (Gram) Fermentasi Dinamis
9
Pada uji ini akan dipilih ekstrak kapang endofit Evodia suaveolens yang memiliki bioaktivitas yang terbaik. Nilai LC50 (Gambar
7 dan lampiran 3) dari kapang endofit Evodia suavelolens telah dibandingkan. Dari Gambar 7, diperjelas bahwa kapang 1 memiliki nilai 315 ppm, kapang 3 memiliki nilai 270 ppm, kapang 5 memiliki nilai 400 ppm, kapang 7 memiliki nilai 19.7 ppm dan kapang 8 memiliki nilai 403 ppm. Nilai tersebut menunjukkan konsentrasi yang dapat membunuh dari setengah populasi Artemia salina. Berbeda pada kapang 2, 4, dan 6, ketiganya tidak memiliki daya toksik pada konsentrasi 500, 100, 50 dan 10 ppm. Ketiganya memiliki nilai toksik diatas 500 ppm
Kapang endofit tersebut memiliki nilai
Lethal Concentration (LC50) yang bervariasi.
Pada kapang 7 didapatkan 19.6 ppm. Konsentrasi ini sudah dapat membunuh setengah populasi Artemia salina. Beda halnya dengan kapang endofit lainnya, yang memiliki dosis konsentrasi kematian diatas
200 ppm. Kapang 7 paling berpotensi digunakan sebagai agen penginduksi apoptosis, karena memiliki bioaktivitas yang tinggi dan kapang 2, 4, dan 6 (warna hijau) memiliki bioaktivitas diatas 500 ppm sehingga ketiganya tidak diuji lebih lanjut karena sudah tidak berpotensial. Semakin kecil konsentrasi, berarti bioaktivitasnyapun tinggi (Zebua 2011).
Konsentrasi yang dipakai dari nilai LC50
lima kapang endofit (kapang 1, 3, 5, 7, 8) digunakan sebagai konsentrasi untuk induksi apoptosis pada sel khamir dan tiga kapang endofit yaitu kapang 2, 4, dan 6 tidak diuji karena sudah tidak potensial.
Kurva Pertumbuhan Sel Khamir
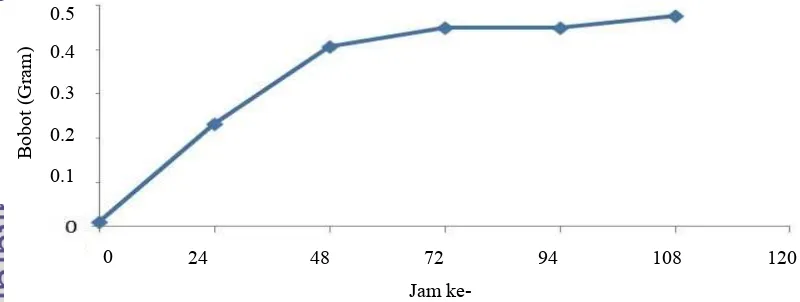
Tahapan ini bertujuan untuk mengetahui pertumbuhan pada sel khamir. Kurva pertumbuhan pada sel khamir didapatkan dari metode gravimetri dengan mengukur bobot sel dengan mengurangkan bobot basah sel dengan bobot kering. Laju pertumbuhan ini akan berguna untuk membuat kurva pertumbuhan dan akan dipakai untuk menentukan awal fase stasioner dari sel khamir. Pada tahapan ini sel khamir telah mencapai pertumbuhan dan aktivitas yang maksimum (Granot & Snyder 1991). Fase ini dipakai pada saat induksi metabolit sekunder pada sel khamir.
Sel khamir pada media YEPD (Yeast Extract Peptone Dextrose) dipindahkan pada media cair YEPD merupakan media starter dengan tujuan agar khamir mengalami proses adaptasi (Rizqiyanti 2012). Setelah adaptasi, sel mengalami pembelahan yang sangat rendah, karena baru selesai tahap penyesuaian diri. Fase ini adalah fase pertumbuhan awal.
Setelah mengalami proses adaptasi sel khamir akan memasuki fase log (fase eksponensial). Fase ini ditandai dengan pertumbuhan sel yang cepat. Hal ini terlihat pada peningkatan jumlah sel khamir pada 0 Nilai LC50
K=Kapang Endofit
Gambar 7 Nilai LC50 dari uji sitotoksik BSLT
ekstrak kloroform kapang endofit Evodia s. 315 270 400 19,6 403 0 100 200 300 400 500
K1 K2 K3 K4 K5 K6 K7 K8
Gambar 8 Kurva pertumbuhan sel khamir berdasarkan nilai bobot sel Jam ke-
24 48 72 94 108 120
B o b o t ( Gr am ) 0.5 55 0.4 0.3 0.2 = 0.1 5 0
10
jam sampai 48 jam. Pada fase ini sel khamir memproduksi zat-zat metabolit yang dibutuhkan untuk memenuhi nutrisinya.
Hasil penelitian menunjukkan fase stasioner terjadi setelah inkubasi 48 jam. Pada kurva tersebut (Gambar 8) laju pertumbuhan tidak lagi pesat karena sel khamir memasuki fase kematian. Hal ini sesuai dengan penelitian Granot & Snyder (1991) dan penelitian Rizqiyanti (2012) bahwa sel mengalami fase stasioner pada waktu setelah 48 jam. Oleh sebab itu, fase ini adalah fase yang tepat pada saat inkubasi dengan perlakuan ekstrak. Pada fase ini, khamir juga membutuhkan nutrisi untuk pertumbuhannya. Perlakuan ekstrak juga ditambahkan medium nutrisi baru sehingga sel khamir akan mengalami pertumbuhan yang baik (Granot & Snyder 1991). Hal ini ditunjukan juga pada penelitian Granot et al. (2003), induksi glukosa 2% menyebabkan apoptosis pada sel khamir.
Hasil Uji Induksi Apoptosis pada Sel Khamir
Sel khamir respirasi aerob dan anaerob. Sel khamir pada kondisi normal memperoleh energi dari glikolisis dan siklus krebs. Sel yang mengalami petite (Gambar 9B) berukuran lebih kecil dibandingkan dengan sel normal (Gambar 9A). Hal ini disebabkan sel telah kehilangan kemampuan untuk berespirasi akibat rusaknya mitokondria akibat mekanisme apoptosis sehingga laju pertumbuhan menjadi lebih lambat (Madigan et al. 2000). Sel khamir memiliki kemampuan
untuk tetap hidup meskipun dalam keadaan kekurangan nutrisi serta kerusakan organel mitokondria. Hal ini disebabkan karena sel khamir masih menjalankan proses glikolisis (respirasi anaerob) tanpa mitokondria dengan mengubah glukosa menjadi ATP melalui fermentasi etanol (Muray et al. 2006). Hal ini menjadikan mekanisme apoptosis khamir dapat dideteksi dengan visualisasi pada cawan sebar.
Ekstrak metabolit sekunder dari kapang endofit Evodia suaveolens yang diujikan adalah dari kapang 1, kapang 3, kapang 5, kapang 7 dan kapang 8 dengan konsentrasi berturut-turut 315 ppm, 270 ppm, 400 ppm, 19.7 ppm dan 403 ppm. Konsentrasi dari kelima kapang endofit tersebut berasal dari nilai LC50 uji toksisitas BSLT (Brine Shrimp
Lethality Test). Konsentrasi ini dipakai untuk
induksi apoptosis pada sel khamir dengan tujuan untuk mengetahui frekuensi jumlah sel yang mengalami petite akibat induksi senyawa aktif tersebut.
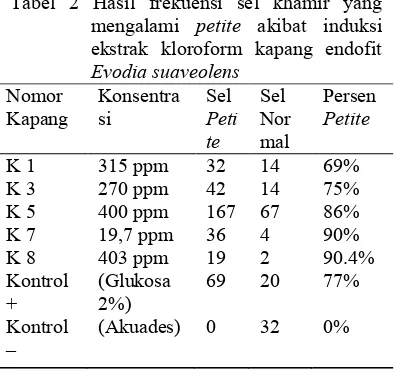
Berdasarkan Tabel 2, frekuensi sel khamir yang mengalami petite tertinggi adalah berasal dari senyawa aktif kapang 7 dan 8 yaitu 90%. Keduanya dapat menginduksi apoptosis 90% dengan konsentrasi 19.7 ppm dan 403 ppm. Frekuensi petite sel khamir terkecil berasal dari induksi senyawa kapang 1 yaitu 69% dengan konsentrasi 315 ppm. Pada penelitian Rizqianti (2012), ekstrak flavonoid murni dari daun salam dapat menginduksi apoptosis pada sel khamir sebesar 99.1%. Jumlah frekuensi petite sel khamir ini lebih besar, karena flavonoid yang diekstrak dari daun salam telah murni, berbeda dengan ekstrak alkaloid (evodiamin) yang belum murni sehingga ada senyawa lain yang dapat berpengaruh terhadap apoptosis sel khamir. Pada saat ekstraksi kloroform senyawa dari
A B
Gambar 9 Perbandingan ukuran sel normal (A) dan sel petite (B)
11
kapang endofit kemungkinan tidak hanya alkaloid, namun bisa juga senyawa lain terekstrak (Winarno 2006). Selain itu, flavonoid dan alkaloid kemungkinan berbeda khasiatnya dalam menyebabkan apoptosis.
Sel-sel khamir yang ditumbuhkan pada media petite padat (semua perlakuan) tidak semuanya menjadi menjadi koloni petite. Hal ini disebabkan oleh sel khamir yang dapat beradaptasi pada kadar glukosa yang terbatas, walaupun pada media petite sumber utama karbon pada media petit adalah etanol (sumber karbon yang tidak dapat difermentasikan). Sel-sel khamir yang berubah menjadi koloni petite hanya mampu menggunakan glukosa yang jumlahnya sangat terbatas (karena mengalami disfungsi mitokondria akibat proses apoptosis). Hal ini mengindikasikan bahwa glukosa sebagai sumber karbon utama pada media yang memiliki nutrien lain yang terbatas dapat menginduksi terjadinya apoptosis seperti yang dilaporkan Granot (2003). Pada kontrol positif dengan pemberian glukosa dapat memicu apoptosis lebih banyak disebabkan oleh khamir kurang mampu beradaptasi dengan sumber karbon yang terlalu banyak (Algiansyah 2009).
Pelarut yang digunakan untuk melarutkan ekstrak adalah akuades steril yang pada dasarnya tidak menginduksi apoptosis seperti diperlihatkan pada kontrol negatif. Penggunaan glukosa sebagai kontrol positif disebabkan karena glukosa 2% dapat menginduksi apoptosis yang ditunjukan dengan perubahan sel menjadi petit (Granot et al. 2003). Pada penelitian Granot (2003) bahwa pemberian glukosa dengan konsentrasi tinggi dapat memicu apoptosis dengan perubahan morfologi menjadi sel yang berukuran kecil (petit), fragmentasi DNA, tingginya produksi spesies oksigen reaktif dan membran blebbing (kerusakan membran).
Dari penelitian ini, ekstrak kapang endofit yang potensial adalah kapang endofit 7 dengan konsentrasi 19.7 ppm dapat memicu apoptosis dengan frekuensi 90%. Kapang 1, 3, 5, dan 8 juga mampu menginduksi apoptosis pada konsentrasi diatas 200 ppm. Kapang 2, kapang 4, dan kapang 6 tidak diujikan pada induksi apoptosis, sebab sebelumnya telah diujikan pada BSLT (Brine Shrimp Lethality Test) tidak memiliki daya toksik pada konsentrasi 500 ppm. Oleh sebab itu, kapang 2, 4 dan 6 tidak perlu lagi diujikan.
Pertumbuhan koloni yang mengalami petit yang disebabkan oleh induksi ekstrak metabolit sekunder dari kapang endofit Evodia suaveolens yaitu kapang 1, 3, 5, 7 dan
8 merupakan salah satu indikasi adanya mekanisme apoptosis. Hal ini menunjukkan metabolit sekunder tersebut memiliki suatu senyawa yang dapat memicu apoptosis pada sel khamir.
SIMPULAN DAN SARAN
Simpulan
Simpulan dari penelitian ini adalah isolasi terhadap kapang endofit dari Evodia suaveolens menghasilkan 8 isolat. Hasil aktivitas sitotoksik menunjukkan toksik tertinggi terdapat dari kapang 7 yaitu 19.7 ppm. Kapang ini juga mampu menginduksi apoptosis pada sel khamir dicirikan dengan frekuensi petite sebesar 90%. Nilai ini membukitkan ekstrak kloroform kapang endofit dari Evodia suaveolens memiliki daya toksiksitas yang cukup baik dan dapat menginduksi apoptosis pada model sel khamir.
Saran
Perlu dikaji lebih lanjut jenis kapang endofit yang diisolasi dari Evodia suaveolens, dan senyawa metabolit sekunder yang dihasilkan dari masing-masing kapang. Penelitian mengenai mekanisme induksi apoptosis perlu diujikan lebih lanjut dengan isolasi DNA dan elektroforesis untuk mengetahui fragmentasi DNA, visualisasi dengan mikroskop pemindai (SEM) untuk melihat kerusakan membran, dan uji aktivitas enzim caspase yang memiliki peran penting dalam peristiwa apoptosis.
DAFTAR PUSTAKA
Ahmad RZ. 2008. Pemanfaatan khamir Saccharomyces cerevisiae untuk ternak. Wartazoa 15 (1): 49-55
Algiansyah. 2009. Kemampuan ekstrak dedaunan berpotensi antioksidan untuk memodulasi apoptosis pada sel khamir [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Anand P, Sundaram C, Jhurani S, Kunnumakkara AB, Aggarwal BB. 2008. Curcumin and cancer an old-age disease with an age-old solution. Cancer Letters 267 : 133–164.
12
Baraja M. 2008. Uji toksistas ekstrak daun
Ficus elastica Nois ex Blume terhadap
Artemia salina Leach dan profil
kromatografi lapis tipis [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Campbell I, Duffus JH. 1991. Yeast a practical approach. Leeds : IRL Press. Clay K. 2004. Fungi and the food of the gods.
Nature 427: 401-402
Ditjen POM. 2000. Parameter Standar Umum
Ekstrak Tumbuhan Obat. Jakarta:
Departemen Kesehatan RI
Gandjar I, Sjamsuridzal W. 2006. Mikologi
Dasar dan Terapan. Ed 1.
Jakarta:Yayasan Obor Indonesia
Granot D, Levine A, Dor-Hefetz E. 2003. Sugar-induced apoptosis in yeast cells. FEMS Yeast Research 4:7-13.
Granot D, Snyder M. 1991. Glucose induces cAMP-independent growth related changes in stationery-phase cells of
Saccharomyces cerevisiae. Proc. Natl
Acad. Sci. 88:5724-5728
Humbert et al. penemu: United States Patent Application Publication. 19 Jan 2012. Extract of Evodia suaveolens scheff repellent compositions and use thereof. US 20120015054A1
Jemal A et al. 2011. Global cancer statistics.
CA Cancer J Clin 61 (2): 69–90.
Jiang J, Hu C. 2009. Evodiamine: A Novel Anti-Cancer alkaloid from Evodia rutaecarpa. Molecules 14: 1852-1859 Julianingsih D. 2012. Sterilisasi dan Media
Mikroba. [terhubung berkala] http://tekpan.unimus.ac.id/index.php?opt ion=com_content&view=article&id=105 :sterilisasi-dan-media-mikroba-olehdewi -julianingsih&catid=34:tugas mahasiswa &Itemid=55 [4 Juni 2012]
Kardinan A. 2007. Tanaman Pengusir dan Pembasmi Nyamuk. Jakarta: Agromedia Pustaka.
Kumala S, Muhammad G. 2005. Isolasi dan Penapisan Kapang Endofit Tanaman Secang (Caesalpinia sappan L.) sebagai Penghasil Senyawa Antibakteri. MEDICINUS (Scientific Journal of
Pharmaceutical Development and
Medical Application) 21 :15 [terhubung berkala] http://lib.atmajaya.ac.id/ default.aspx?tabID=61&id=129265&src =a [28 September 2011].
Kurnijasanti R, Hamid IS, Rahmawati K. 2008. Efek sitotoksis in vitro dari ekstrak buah mahkota dewa (Phaleria
macrocarpa) terhadap kultur sel kanker
mieloma. J. Penelit. Med. Eksakta 7 ( 1) : 48-54.
Lumongga F. 2008. Apoptosis. [terhubung berkala] repository.usu.ac.id/bitstream/1 23456789/2061/1/09E01457.pdf [10 Juni 2012]
Madigan MT, Martinko JM, Parker J. 2000. Brock Biology of Microorganisms. Edisi ke-9. New Jersey: Prentice Hall. Matthias R. 2001. Cancer. First edition. Sta
Clara: MR publishing
Mayer A, Gustafson K. 2008. Marine Pharmacology in 2005–2006: Antitumour and Cytotoxic Compounds.
European Journal of Cancer 44: 2357–
2387
Melliawati et al. 2006. Pengkajian bakteri endofit penghasil senyawa bioaktif untuk proteksi tanaman. Biodiversitas 7(3): 221-224.
Meyer BN et al. 1982. Brine shrimp: a convenient general bioassay for active plants constituent. J Medical Plant Res 45:31-34.
Michael L. 2003. Beating cancer with natural medicine. USA: Bloomington.
Muchtadi TR, Ayustaningwarno F. 2010. Teknologi Proses Pengolahan Pangan. Bandung: Alfabeta.
Murray et al. 2006. Harper’s Illustrated
Biochemistry 27th Edition. USA: The
McGraw-Hill Companies.
Nurhasanah. 2008. Isolasi mikroba endofitik penghasil senyawa antimikroba pada tanaman ciremai (Phyllanthus acidus) dan meniran (Phyllanthus niruri). Warta Akab 19:20-32
Pelczar JR, Chan ES. 1996. Dasar-dasar Mikrobiologi. Jakarta: UI Pr.
Purba CYC. 2011. Bioaktivitas ekstrak kayu teras suren (Toona sinensis Roemor) dan profil kromatografi lapis tipis fraksi aktifnya [Skripsi]. Bogor: Fakultas Kehutanan, Institut Pertanian Bogor Rejeki YS. 2011. Pengaruh kondisi kultivasi
13
[Skripsi]. Bogor: Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Rizqianti AA. 2012. Ekstrak flavonoid daun
salam (Syzygium polyanthum Wight.) Sebagai agen proapotosis sel khamir [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sanger 2004, diacu dalam Ahmad Riza Zainuddin. 2008. Pemanfaatan Khamir Saccharomyces cerevisiae untuk Ternak. Wartazoa 15 (1), 49-55
Schulz B, Boyle C. 2005. The endophytic continuum. Mycol 109 (6) : 661-686 Simanjuntak P. 2011. Indonesia Gudang
Mikroba Antikanker dan Antidiabetes. [terhubung berkala] http://www.biotek. lipi.go.id/index.php/news/biotek/755ind onesia-gudang-mikroba-antikanker-dan-antidiabetes-?PHPSESSID=275d90261d f7e82c864cb9992fb7a347 [4 Juni 2012] Simanjuntak P. et al. 2002. Produksi alkaloid
kuinina oleh beberapa mikroba endofit dengan penambahan zat induser (studi mikroba endofit tanaman Cinchona sp. (2)). Majalah Farmasi Indonesia 13(1): 1-6
Strobel G, Daisy, Castillo, Harper J. 2004. Natural product from endophytic microorganism. J. Nat. Prod. 67 : 257-268
Sugijanto NE, Indrayanto G, Zaini NC. 2008. Paradigma baru produksi antibiotika menggunakan jamur endofit dari tanaman Alyxia Reinwardtii [terhubung berkala] http://repo.unair.ac.id/data/ richfiles/abstrak%20EKSAK%200610% 20_upload_(81).pdf [19 Juli 2012]. Sukandar et al. 2010. Karakterisasi senyawa
aktif antibakteri ekstrak air bunga kecombrang (Etlingera elatior) sebagai bahan pangan fungsional. Valensi 2 (1):333-339
Sukardiman et al. 2006. Uji antikanker dan induksi apoptosis fraksi kloroform dari daun pepaya (Carica papaya) terhadap kultur sel kanker. Media Kedokteran Hewan 22 (2): 110-113
Theantana T, Hyde S, Lurnyong. 2007. Asparaginase production by endophytic fungi isolated from some thai medical plants. KMITL Science Technology· Journ 7 (1): 13-18
[WHO] World Health Organization. 2012.
Cancer [terhubung berkala].
http://www.who.int/mediacentre/factshe es/fs297/en/ [18 Juni 2012].
Widyastuti S. 2008. Uji toksisitas ekstrak daun iprih (Ficus glabella Blume) terhadap Artemia salina Leach dan profil kromatografi lapis tipis. Jurusan Farmasi Universitas Muhamadiyah Surakarta Winarno EK. 2006. Produksi alkaloid oleh
mikroba endofit yang diisolasi dari batang kina Cinchona ledgeriana Moens
dan Cinchona Pubescens Vahl
(Rubiaceae). Jurnal Kimia Indonesia. (2):8-15
14
15
Lampiran 1 Tabel Kapang Endofit
Evodia suaveolens
No
Kapang
Warna
Permukaan
Pola
Foto
Tengah
Samping Belakang
1
Putih
Putih
Putih
Tidak rata
Tumbuh
seperti kapas
dan
tersebar
tidak merata
2
Putih
Putih
Putih
Tidak rata
Kapas
tersebar
dengan
merata
3
Putih
Putih
Putih
Tidak rata
Kapas tumbuh
lebat
ditengah
4
Putih
Putih
Putih
Rata
Tumbuh
seperti kapas
dan tersebar.
5
Kehitaman Putih
Hitam
keabuan
Rata
Kapas tumbuh
acak
16
7
Hijau
Hijau
Hijau
Rata
Kapas
berwarna
hijau
yang
tersebar
17
Lampiran 2 Tabel Khamir yang mengalami
petite
setelah perlakuan
masing-masing ekstrak
No. Jenis
Perlakuan
Konsentrasi
Foto Khamir
1
Kapang 1
315 ppm
2
Kapang 3
270 ppm
3
Kapang 5
400 ppm
18
5
Kapang 8
403 ppm
6
Kontrol
positif
Glukosa 2%
7
Kontrol
negatif
19
Lampiran 3 Nilai LC
50Nomor Kapang Konsentrasi (ppm) Persen Udang Mati
Nilai LC
50(ppm)
Kapang 1
Kapang 2
Kapang 3
Kapang 4
Kapang 5
Kapang 6
Kapang 7
Kapang 8
500
100
50
10
500
100
50
10
500
100
50
10
500
100
50
10
500
400
300
200
100
50
10
500
100
50
10
500
100
50
10
8
6
4
2
500
100
50
10
80
20
0
0
0
0
0
0
100
10
0
0
20
10
0
0
100
20
20
0
0
0
0
20
0
0
0
100
100
100
80
20
20
10
0
60
20
10
10
315
-
270
-
400
-
19.7
403
Contoh perhitungan:
20
Gambar 10 Grafik LC
50Kapang 3
y = -7.765+0.1659X
0 100 200 300 400 500 600
0 20 40 60 80 100 120
Ko
n
sen
tr
asi
(
p
p
m
)
21
Lampiran 4 Strategi Penelitian
Isolasi dan Pemurnian Kapang Endofit
Peremajaan Kapang Endofit dari Isolat
Fermentasi Kapang Endofit
Ekstraksi Metabolit Sekunder
22
Lampiran 5 Induksi Apoptosis (Pembuatan Media)
Pembuatan
media
terdiri dari media cair
YEPD, media padat
YEPD
dan
media
padat petit
Media
cair
YEDP
dibuat dari 1% yeast
ekstrak, 2% pepton,
2%
glukosa,
dan
akuades hingga 100 ml
Media padat YEDP
dibuat dari 1% yeast
ekstrak, 2% pepton,
2%
glukosa,
1.8%
baktoagar,
dan
akuades hingga 100 ml
Sterilisasi
autoklaf
suhu
120
0C, 15 menit
10 atm.
23
Lampiran 6 Perlakuan Induksi Apoptosis
Ekstrak
dihomogenisasi
terlebih
dahulu,
kemudian diinkubasi
Ekstrak kapang endofit:
Tambahkan 400 µl ekstrak dengan
konsentrasi LC
50dari masing-masing
kapang endofit ke
eppendorf
seberisi
100 µl kultur sel khamir, 500 µl YEPD
cair
Perlakuan terdiri dari
ekstrak metabolit
sekunder kapang endofit,
glukosa 2% sebagai
kontrol positif dan
akuades sebagai kontrol
negatif
perlakuan kontrol positif:
ekstrak kapang endofit diganti dengan