MARISA PERMATASARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Tanaman Genjer (Limnocharis flava) Akibat Pengukusan. Dibimbing oleh NURJANAH dan AGOES M JACOEB.
Genjer merupakan jenis tanaman air yang tersebar di seluruh daratan Asia dan berasal dari Amerika. Genjer dimanfaatkan oleh masyarakat sebagai bahan pangan yang dapat menambah nafsu makan dan melancarkan pencernaan. Kajian ilmiah mengenai khasiat genjer penting dan perlu dilakukan, di antaranya ialah uji komponen bioaktif dan uji aktivitas antioksidan.
Tujuan dari penelitian ini adalah untuk menentukan rendemen genjer utuh, rendemen ekstrak, kandungan zat gizi (air, lemak, protein, karbohidrat, abu, abu tidak larut asam, serat kasar), komponen bioaktif dan aktivitas antioksidan yang terkandung dalam genjer segar, genjer yang mengalami pengukusan selama 3 dan 5 menit serta pengujian aktivitas antioksidan dengan metode DPPH.
Bahan baku berupa genjer yang digunakan pada penelitian ini berasal dari persawahan Desa Cikarawang, Kecamatan Darmaga, Kabupaten Bogor. Hasil analisis proksimat pada genjer segar adalah kandungan air sebesar 93,92%, lemak sebesar 0,20%, protein sebesar 2,38%, abu sebesar 0,70%, abu tidak larut asam sebesar 0,10%, serat sebesar 1,31% dan karbohidrat sebesar 2,70%. Proses pengukusan menyebabkan perubahan kandungan gizi. Hasil analisis proksimat pada genjer yang mengalami pengukusan selama 3 dan 5 menit berturut-turut adalah kandungan air sebesar 92,49% dan 91,18%, lemak sebesar 0,29% dan 0,39%, protein sebesar 2,81% dan 2,03%, abu sebesar 0,89% dan 0,99%, abu tidak larut asam sebesar 0,10%, serat sebesar 1,34% dan 1,53% dan karbohidrat sebesar 3,42% dan 5,31%.
Skripsi
Oleh:
MARISA PERMATASARI C34080084
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Departemen Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Nama : Marisa Permatasari
Nrp : C34080084
Program Studi : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Nurjanah, MS. Dr. Ir. Agoes M. Jacoeb, Dipl.- Biol. NIP.1959 1013 1986 01 2 002 NIP. 1959 1127 1986 01 1 005
Mengetahui,
Ketua Departemen Teknologi Hasil Periran
Dr. Ir. Ruddy Suwandi, MS, Mphil. NIP. 1958 0511 1985 03 1 002
Aktivitas Antioksidan Tanaman Genjer (Limnocharis flava) Akibat Pengukusan”adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip
dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2012
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat
dan rahmat-Nya, penulis dapat menyelesaikan penyusunan skripsi ini
dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar
Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi hasil penelitian ini berjudul “Perubahan Aktivitas Antioksidan Tanaman Genjer (Limnocharis flava) Akibat Pengukusan”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dan memberi dukungan kepada penulis selama penyusunan skripsi ini,
terutama kepada:
1. Dr. Ir. Nurjanah, MS. selaku dosen pembimbing, atas segala bimbingan,
pengarahan serta masukan yang telah diberikan kepada penulis.
2. Dr. Ir. Agoes Mardiono Jacoeb, Dipl.-Biol. selaku Ketua Program Studi
Departemen Teknologi Hasil Perairan dan pembimbing atas segala
bimbingan, pengarahan serta masukan yang telah diberikan kepada penulis.
3. Roni Nugraha, S.Si, M.Sc selaku dosen penguji yang telah memberikan saran
serta pengarahan kepada penulis.
4. Dr. Ir. Ruddy Suwandi, M.S, M.Phil. sebagai Ketua Departemen Teknologi
Hasil Perairan.
5. Keluarga terutama Bapak, Mama, dan kakak-kakakku tercinta (Mas Feri,
Mas Budi, Mas Ismet, Mbak Teti) yang telah memberikan semangat, materi
dan doa kepada penulis selama menyelesaikan penelitian dan skripsi ini.
6. Taufik Hidayat yang telah menemani dan memberikan semangat, motivasi
serta saran kepada penulis selama menyelesaikan penelitian dan penulisan
skripsi ini.
7. Teman-teman asisten m.k Pengetahuan Bahan Baku Industri Hasil Perairan
(Asni, Euis, Hilma, Ika, Ningrum, Silvia dan kak Sabri) atas kerja sama dan
Yulista, Desi dan Hani).
9. Teman-teman THP 44, 46, dan 47 yang telah memberikan
informasi-informasi kepada penulis.
10. Bu Emma, Mbak Lastri, Mbak Dini, Mas Zaky, Mbak Ina, Mas Endi dan
Mbak Wiwi yang telah membantu penulis selama melakukan penelitian di
Laboratorium.
11. Pak Ade, bang Mail, Seluruh dosen, pegawai, dan staf TU atas bantuannya
selama ini.
12. Semua pihak yang telah membantu dalam penulisan skripsi ini, yang tidak
dapat disebutkan satu persatu.
Penulis menyadari bahwa masih ada kekurangan dalam penulisan skripsi
ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun
dari berbagai pihak dalam proses penyempurnaan skripsi ini. Semoga tulisan ini
bermanfaat bagi pihak-pihak yang memerlukannya.
Bogor, Juli 2012
Penulis dilahirkan di Jakarta pada 29 Maret 1991.
Penulis merupakan anak kelima dari lima bersaudara
pasangan Suyatman dan Sri Rejeki.
Penulis memulai jenjang pendidikan formal di SDN
Cempaka Baru 02 PG pada tahun 1996 hingga tahun
2002. Penulis melanjutkan pendidikan di MTs
Al-Muddatsiriyah (Tahun 2002-2005). Pendidikan formal
selanjutnya di tempuh di SMAN 5 Jakarta (Tahun 2005-2008). Penulis diterima
sebagai Mahasiswi Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan
Ilmu Kelautan, Institut Pertanian Bogor melalui jalur SMNPTN (Seleksi Masuk
Perguruan Tinggi Negeri) pada tahun 2008.
Selama perkuliahan penulis pernah menjadi asisten praktikum m.k
Pengetahuan Bahan Baku Industri Hasil Perairan tahun ajaran 2011-2012. Selain
itu penulis pernah mengikuti kepanitiaan sanitasi (Tahun 2011) dan sensori
(Tahun 2012).
Sebagai salah satu syarat meraih gelar Sarjana Perikanan, penulis
Halaman
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
1 PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2 TINJAUAN PUSTAKA ... 3
2.1 Deskripsi dan Klasifikasi Tanaman Air Genjer (L. flava) ... 3
2.2 Komposisi Kimia Tanaman Genjer ... 4
2.3 Antioksidan ... 4
2.4 Mekanisme Antioksidan ... 5
2.5 Ekstraksi Senyawa Bioaktif ... 6
2.6 Uji Aktivitas Antioksidan ... 7
2.7 Komponen Bioaktif ... 8
2.7.1 Alkaloid... 8
2.7.2 Steroid ... 9
2.7.3 Flavonoid ... 9
2.7.4 Saponin ... 10
2.7.5 Fenol hidrokuinon ... 10
2.7.6 Karbohidrat ... 11
2.7.7 Gula pereduksi ... 12
2.7.8 Peptida... 12
2.7.9 Asam amino ... 13
2.8 Pengukusan ... 14
3 METODOLOGI ... 15
3.1 Waktu dan Tempat ... 15
3.2 Bahan dan Alat ... 15
3.3 Metode yang digunakan ... 16
3.3.1 Preparasi sampel ... 17
3.3.2 Pengukusan genjer ... 17
4 HASIL DAN PEMBAHASAN ... 24
4.1 Karakteristik Genjer (L. flava) ... 24
4.1.1 Rendemen ... 24
4.1.2 Komposisi kimia ... 26
4.2 Ekstraksi Komponen Bioaktif Genjer (L. flava) ... 30
4.2.1 Ekstrak kasar ... 31
4.2.2 Komponen bioaktif pada ekstrak kasar ... 32
4.3 Aktivitas Antioksidan Genjer dengan Metode DPPH ... 35
5 KESIMPULAN DAN SARAN ... 39
5.1 Kesimpulan ... 39
5.2 Saran ... 39
Nomor Halaman
1 Tanaman genjer (L. flava)... 3
2 Reaksi penghambatan antioksidan primer terhadap radikal bebas ... 6
3 Struktur diphenylpycrilhydrazil dan diphenylpycrilhydrazine ... 7
4 Diagram alir proses penelitian ... 16
5 Morfologi genjer (L. flava) ... 24
6 Rendemen genjer ... 25
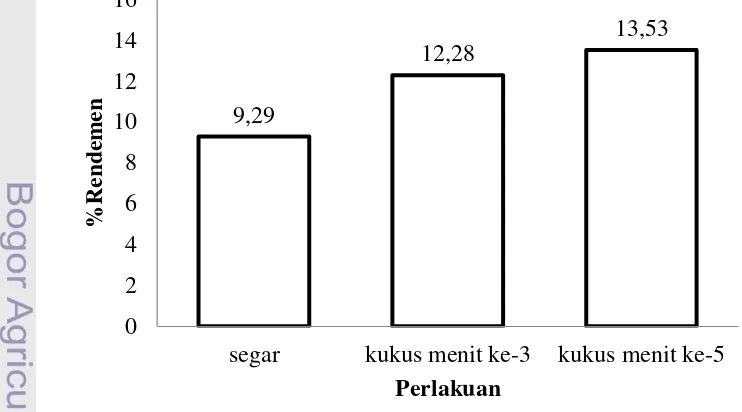
7 Diagram batang rendemen hasil ekstraksi ... 31
Nomor Halaman
1 Komposisis gizi tanaman genjer (L. flava) ... 4
2 Hasil uji proksimat genjer ... 26
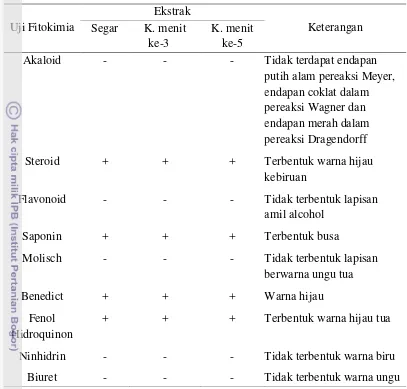
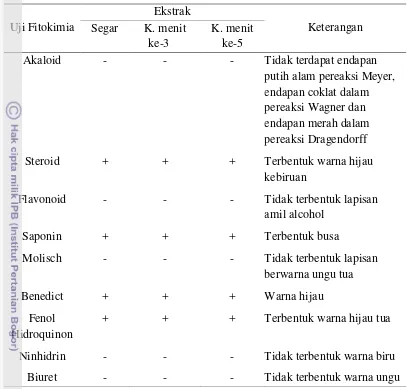
3 Hasil uji fitokimia ekstrak kasar genjer ... 33
DAFTAR LAMPIRAN
Lampiran Halaman
1 Perhitungan rendemen genjer ... 45
2 Perhitungan analisis proksimat ... 45
3 Data rendemen ekstrak kasar genjer ... 48
4 Gambar-gambar proses ekstraksi genjer (L. flava) ... 48
5 Gambar-gambar hasil uji fitokimia genjer (L. flava) ... 49
6 Perhitungan pengenceran DPPH, BHT dan ekstrak genjer ... 49
7 Perhitungan persen inhibisi dan penentuan IC50 ... 51
1 PENDAHULUAN
1.1 Latar Belakang
Kesibukan kerja di zaman sekarang menjadikan sebagian masyarakat lebih
menyukai pola makan yang serba instan. Konsumsi makanan instan secara terus
menerus dapat memberikan dampak negatif terhadap kesehatan. Makanan instan
kebanyakan mengandung pengawet, pewarna, tinggi lemak, namun rendah serat
yang berpotensi meninggalkan racun dalam tubuh serta sumber radikal bebas.
Radikal bebas adalah atom atau molekul yang tidakstabil dan sangat reaktif
karena mengandung satuatau lebih elektron tidak berpasangan pada
orbitalterluarnya. Radikal bebas akan bereaksi dengan molekul disekitarnya untuk
memperoleh pasangan elektron. Reaksi ini akan berlangsung terusmenerus dalam
tubuh dan bila tidak dihentikan akan menimbulkan berbagai penyakit
(Andayani et al. 2008)
Radikal bebas yang berlebihan di dalam tubuh dapat menyababkan penyakit
degeneratif antara lain kardiovaskuler, aterosklerosis, diabetes melitus dan kanker
(Winarsih 2007). Radikal bebas dapat dihasilkan dari metabolisme tubuh dan
faktor eksternal lainnya misalnya zat kimiawi dalam makanan sehingga
diperlukan senyawa yang dapat melindungi tubuh dari serangan radikal bebas,
yaitu antioksidan.
Antioksidan adalah senyawa yang mampu menangkal atau meredam
dampak negatif oksidan dalam tubuh. Antioksidan bekerja dengan cara
mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga
aktivitas senyawa oksidan tersebut bisa dihambat (Winarsih 2007). Berdasarkan
sumbernya antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik dan
alami.Antioksidan sintetik yang diijinkan untuk makanan, yaitu butil hidroksi
anisol (BHA), butil hidroksi toluen (BHT), propil galat, tert-butil hidroksi quinon
(TBHQ) dan tokoferol.Senyawa antioksidan yang diisolasi dari sumber alami
pada umumnya berasal dari tumbuhan yang berupa senyawa fenolik atau
polifenolik (Trilaksani 2003)
Salah satu tumbuhanair yang berpotensi sebagai alternatif antioksidan alami
wilayah tropis dan subtropis Amerika. Genjer merupakan tanaman air yang biasa
dikonsumsi oleh masyarakat. Pengolahan tanaman genjer di Indonesia dilakukan
dengan cara pengukusan, perebusan, maupun penumisan (Jacoeb et al. 2010). Komposisi kimia dalam setiap 100 g genjer mengandung energi 39 kkal,
protein 1,7 g, karbohidrat 7,7 g, kalsium 62 mg, fosfor 33 mg dan zat besi 2,1 mg.
Sayuran ini juga kaya akan serat yang baik untuk menjaga saluran sistem
pencernaan (Diantika 2011). Hasil penelitian Maisuthisakul et al. (2008) menunjukkan bahwa L. flava di wilayah Thailand mengandung total fenolik sebesar 5,4 mg GAE/g berat kering dan total flavonoid sebesar 3,7 mg RE/g berat
kering.
Tanaman genjer merupakan tanaman yang tumbuh di rawa atau kolam
berlumpur yang banyak airnya misalnya tepi sungai. Genjer juga mudah ditemui
pada lapisan tanah gembur dan lapisan lumpur yang tergenang air dangkal. Lahan
persawahan yang digenangi air setelah masa panen atau disela tanaman padi yang
masih muda juga merupakan habitat dari genjer.
Penelitian-penelitian sebelumya mengenai genjer telah dilakukan dan untuk
melengkapi data tentang aktivitas antioksidan perlu dilakukan penelitian lebih
lanjut. Penelitian ini diharapkan dapat memberikan informasi untuk
pemanfaatannya dalam bidang farmasi, pangan, industri, dan lain-lain. Penelitian
ini bersifat deskriftif, yaitu untuk menentukan pengaruh waktu pengukusan
terhadap aktivitas antioksidan pada genjer.
1.2Tujuan
Penelitian ini bertujuan untuk menentukan pengaruh waktu pengukusan
genjer (L. flava) terhadap kandungan zat gizi (air, lemak, protein, abu, abu tidak larut asam, karbohidrat dan serat kasar), komponen bioaktif dan aktivitas
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Tanaman Air Genjer (L. flava)
Genjer merupakan tanaman yang tumbuh di rawa atau kolam berlumpur
yang banyak airnya. Tanaman genjer merupakan tanaman asli wilayah tropis dan
subtropis Amerika (Jacoeb et al. 2010). Warna daunnya hijau dengan lapisan lilin sehingga terlihat mengkilat.Di berbagai daerah, genjer dikenal dengan sebutan
haleyo (Batak), eceng (Melayu), genjer, saber (Sunda) dan centongan (Jawa).
Klasifikasi dari tanaman genjer menurut Plantamor (2008) adalah sebagai berikut.
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Alismatales
Famili : Limnocharitaceae
Genus : Limnocharis
Spesies : L. flava (L.) Buch
Morfologi tanaman genjer (L. flava) dapat dilihat pada Gambar 1.
Gambar 1 Tanaman genjer (L. flava) Sumber: www.plantamor.com
Genjer mempunyai daun yang berbentuk membulat, ukurannya bisa
mencapai lebar telapak tangan orang dewasa dan ditopang batang bersegi tiga
yang berongga di dalamnya.Genjer merupakan tanaman air yang biasa dikonsumsi
oleh masyarakat. Di beberapa daerah di Indonesia daun genjer sudah lama diolah
menjadi beragam masakan, yaitu masyarakat Jawa Timur mengolah genjer
menjadi tumis atau urap, sedangkan di Klaten Jawa Tengah ditemui pecel dengan
2.2 Komposisi Kimia Tanaman Genjer
Pemanfaatan tanaman genjer dilakukan terhadap daun muda dan bunga yang
belum terbuka yang dimakan sebagai sayuran, di Indonesia terutama di Jawa
Barat, di Malaysia, dan di Thailand. Tanaman ini biasanya tidak dimakan mentah
tetapi dipanaskan di atas api atau dimasak untuk waktu yang singkat. Pengolahan
genjer sebagai penambah nafsu makan adalah dengan pengukusan genjer segar
hingga setengah matang yang dikonsumsi sebagai lalapan. Komposisi gizi
tanaman genjer disajikan pada Tabel 1.
Tabel 1 Komposisis gizi tanaman genjer (L. flava)
Komposisi gizi Jumlah (a)
Potasium 4202,50 ± 292,37 mg/100 g
Sodium 107,72 ± 17,15 mg/100 g
Kalsium 770,87 ± 105,2 mg/100 g
Magnesium 228,10 ± 15,26 mg/100 g
Tembaga 8,31 ± 1,83 mg/100 g
Zinc 0,66 ± 0,05 mg/100 g
(a)Saupi et al. (2009), jumlah dalam 100 gram berat basah
Daun dan bunga genjer berkhasiat sebagai penambah nafsu makan.Daun
dan bunga genjer mengandung kardenolin, flavonoid dan polifenol
(Plantamor 2008). Menurut Maisuthisakul et al. (2008) menunjukan bahwa
L. flava di wilayah Thailand mengandung total fenolik sebesar 5,4 mg GAE/g berat kering dan total flavonoid sebesar 3,7 mg RE/g berat kering. Genjer juga
dimanfaatkan sebagai pakan ternak, dengan cara batang genjer dicacah menjadi
bagian kecil-kecil, kemudian dicampur dengan bekatul atau dedak sebagai pakan
sapi dan kambing.
2.3 Antioksidan
Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau
lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat
disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit
degeneratif serta mampu menghambat peroksida lipid pada makanan (Kuncahyo
dan Sunardi 2007). Antioksidan sangat beragam jenisnya, berdasarkan
sumbernya antioksidan dibagi dalam dua kelompok, yaitu antioksidan sintetik
(antioksidan yang diperoleh dari hasil sintesis reaksi kimia) dan antioksidan alami
(antioksidan hasil ekstraksi bahan alami).
Antioksidan sintetik adalah antioksidan yang diperoleh dari hasil sintesis
reaksi kimia (Trilaksani 2003). Antioksidan sintetik yang banyak digunakan
adalah senyawa-senyawa fenol yang biasanya agak beracun. Penambahan
antioksidan ini harus memenuhi beberapa syarat, misalnya tidak berbahaya bagi
kesehatan, tidak menimbulkan warna yang tidak diinginkan, efektif pada
konsentrasi rendah, larut dalam lemak, mudah didapat, dan ekonomis. Empat
macam antioksidan sintetik yang sering digunakan adalah butylated hydroxyanisole (BHA), butylated hydroxytoluene (BHT), propylgallate (PG) dan
nordihidroquairetic acid (NDGA) (Winarno 2008).
Antioksidan alami adalah antioksidan yang diperoleh dari hasil ekstraksi
bahan alami (Trilaksani 2003). Antioksidan alami antara lain tokoferol, lesitin,
fosfatida, sesamol, gosipol, karoten dan asam askorbat yang banyak dihasilkan
oleh tumbuhan. Antioksidan alami yang paling banyak ditemukan dalam minyak
nabati adalah tokoferol yang mempunyai keaktifan vitamin E dan terdapat dalam bentuk α, , , δ-tokoferol (Winarno 2008).
2.4 Mekanisme Antioksidan
Mekanisme kerja antioksidan menurut Ong et al. (1995) dalam Hariyatmi (2004) ada lima, yaitu (1) Berinteraksi langsung dengan oksidan, radikal bebas
atau oksigen tunggal, (2) Mencegah pembentukkan jenis oksigen reaktif,
(3) Mengubah jenis oksigen reaktif menjadi kurang toksik, (4) Mencegah
kemampuan oksigen reaktif dan (5) Memperbaiki kerusakan yang timbul.
Penambahan antioksidan (AH) primer dengan konsentrasi rendah dapat
menghambat atau mencegah reaksi autooksidasi. Penambahan tersebut dapat
menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi (Gambar 2).
stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul
tertentu membentuk radikal bebas baru (Gordon 1990dalam Apriandi 2011). Reaksi penghambatan antioksidan primer terhadap radikal bebas pada Gambar 2.
Inisiasi : R* + AH ---RH + A*
Propagasi : ROO* + AH --- ROOH + A*
Gambar 2 Reaksi penghambatan antioksidan primer terhadap radikal bebas
Antioksidan sangat bermanfaat bagi kesehatan dan berperan penting untuk
mempertahankan mutu produk pangan. Antioksidan dapat berperan dalam
menekan prolifersi (perbanyakan) sel kanker, karena antioksidan berfungsi
menutup jalur pembentukan sel ganas (blocking agent). Dalam mempertahankan mutu pangan, antioksidan dapat menghambat berbagai kerusakan seperti
ketengikan, perubahan nilai gizi, perubahan warna dan aroma, serta kerusakan
fisik lain pada produk pangan karena oksidasi (Trilaksani 2003).
2.5 Ekstraksi Senyawa Bioaktif
Ekstraksi merupakan proses penarikan komponen zat aktif suatu bahan
dengan menggunakan pelarut tertentu. Tujuan dari proses ini adalah untuk
mendapatkan bagian-bagian tertentu dari bahan yang mengandung
komponen-komponen aktif (Harborne 1984).
Menurut Ansel (1989) dan Winarno et al. 1973, ekstraksi dapat dilakukan dengan dua cara yaitu fase cairdan fase organik. Cara fase cair dilakukan dengan
menggunakan air, sedangkan cara fase organik dilakukan dengan menggunakan
pelarut organik. Berdasarkan prinsipnya, proses ekstraksi dapat berlangsung bila
terdapat kesamaan dalam sifat kepolaran antara senyawa yang diekstrak dengan
senyawa pelarut. Suatu zat memiliki kemampuan terlarut yang berbeda dalam
pelarut yang berbeda. Hal ini menunjukkan adanya interaksi antara zat telarut
dengan pelarut. Senyawa polar akan larut pada pelarut polar juga, begitu juga
sebaliknya.
Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah
dan lain sebagainya). Hal ini yang perlu diperhatikan dalam pemilihan pelarut
adalah selektivitas, kemampuan untuk mengekstrak, toksisitas, kemudahan untuk
diuapkan, dan harga (Harborne 1984). Harborne (1984) mengelompokkan metode
ekstraksi menjadi dua, yaitu ekstraksi sederhana dan ekstraksi khusus. Ekstraksi
sederhana meliputi maserasi, perkolasi, reperkolasi, dan dialokasi sedangkan
ekstraksi khusus terdiri dari sokletasi, arus balik dan ultrasonik.
2.6 Uji Aktivitas Antioksidan
Kandungan senyawa antioksidan dalam suatu bahan dapat diketahui melalui
uji aktivitas antioksidan. Pengukuran aktivitas antioksidan dapat menggunakan
beberapa metode.Salah satu metode yang umum digunakan yaitu menggunakan
radikal bebas stabil diphenilpycrylhydrazil (DPPH). Prinsip metode-metode yang digunakan untuk mengetahui aktivitas antioksidan adalah mengevaluasi adanya
aktivitas penghambatan proses oksidasi oleh senyawa antioksidan yang terdapat
dalam bahan pangan atau contoh ekstrak bahan alam (Setyaningsih 2003).
Metode radikal bebas stabil diphenilpycrylhydrazil (DPPH) merupakan radikal sintetik yang larut dalam pelarut polar misalnyaetanol dan metanol. DPPH
merupakan radikal stabil yang dapat diukur intensitasnya pada panjang
gelombang 515 nm(Rohman dan Riyanto 2005). Menurut Molyneux (2004)
Meningkatnya jumlah diphenilpycrilhydrazine akan ditandai dengan berubahnya warna ungu pada larutan menjadi warna kuning pucat. Struktur
Diphenylpycrilhydrazil dan Diphenylpycrilhydrazine disajikan pada Gambar 3.
Gambar 3 Struktur Diphenylpycrilhydrazil dan Diphenylpycrilhydrazine
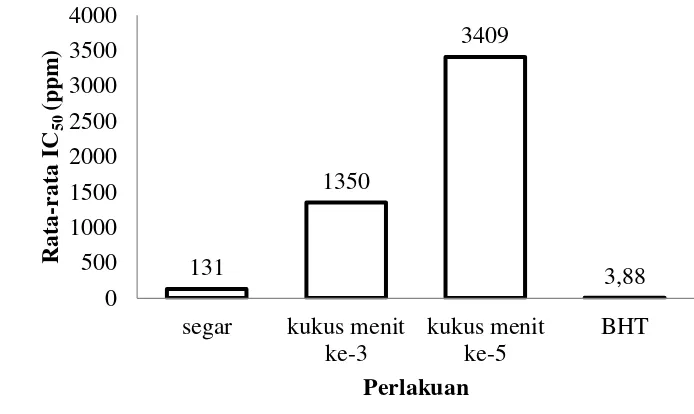
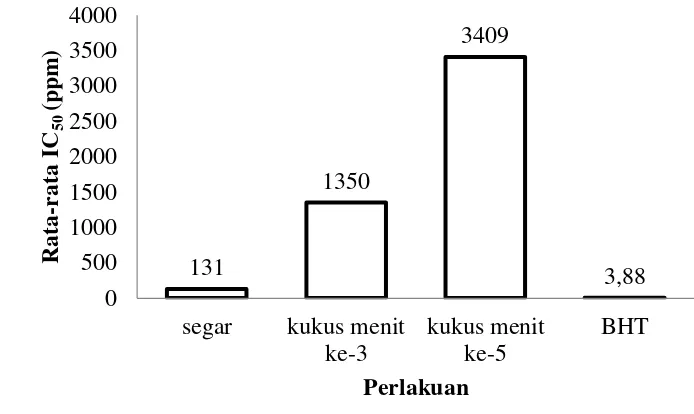
Hasil dari metode DPPH umumnya dalam bentuk IC50
substrat atau sampel yang akan menyebabkan tereduksi aktivitas DPPH sebesar
50%. Semakin besar aktivitas antioksidan maka nilai IC50 akan semakin kecil.
Suatu senyawa antioksidan dinyatakan baik jika nilai IC50-nya semakin kecil
(Molyneux 2004).
2.7 Komponen Bioaktif
Komponen bioaktif merupakan kelompok senyawa fungsional yang
terkandung dalam bahan pangan dan dapat memberikan pengaruh biologis.
Sebagian besar komponen bioaktif adalah kelompok alkohol aromatik misalnya
polifenol dan komponen asam (phenolic acid). Komponen bioaktif tidak terbatas pada hasil metabolisme sekunder saja, tetapi juga termasuk metabolit primer yang
memberikan aktivitas biologis fungsional, misalnya protein dan peptida (Kannan
et al. 2009). Pengujian terhadap komponen bioaktif ini dapat dilakukan dengan metode uji fitokimia.
2.7.1 Alkaloid
Alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang
terbentuk berdasarkan prinsip pembentukan campuran (Sirait 2007). Alkaloid
merupakan golongan zat tumbuhan sekunder yang terbesar. Umumnya, alkaloid
mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen,
biasanya dalam gabungan, sebagai bagian dari sistem siklik. Alkaloid biasanya
tanpa warna, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan
(misalnya nikotina) pada suhu kamar (Harborne 1984).
Beberapa contoh senyawa alkaloid yang telah umum dikenal dalam bidang
farmakologi, diantaranya adalah nikotin (stimulan pada syaraf otonom), morfin
(analgesik), kodein (analgesik dan obat batuk), atropin (obat tetes mata),
skopolamin (sedatif/obat penenang menjelang operasi), kokain (analgesik),
piperin (antifeedant), quinin (obat malaria), vinkristin (obat kanker), ergotamin (analgesik untuk migrain), reserpin (pengobatan simptomatis disfungsi ereksi),
mitraginin (analgesik dan antitusif), serta vinblastin (antineoplastik dan obat
2.7.2 Steroid
Triterpenoid adalah senyawa dengan kerangka karbon yang disusun dari 6
unit isoprena dan dibuat secara biosintesis dari skualen, suatu C30 hidrokarbon
asiklik. Senyawa tersebut mempunyai struktur siklik yang relatif kompleks,
terdiri atas alkohol, aldehid atau asam karboksilat. Senyawa tersebut tidak
berwarna, kristalin, sering mempunyai titik lebur tinggi, umumnya sulit untuk
dikarakterisasi karena secara kimia tidak reaktif, yang banyak digunakan untuk tes
adalah reaksi Liebermann-Burchard (asam asetat anhidrida-H2SO4 pekat), yang
membentuk warna biru hijau untuk sebagian besar triterpen dan sterol
(Sirait 2007).
Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana
perhidrofenantrena. Tiga senyawa yang biasa disebut fitosterol mungkin terdapat
pada setiap tumbuhan tingkat tinggi yaitu sitosterol, stigmasterol dan kampesterol.
Sterol tertentu hanya terdapat dalam tumbuhan tingkat rendah, contohnya
ergosterol yang terdapat dalam khamir dan sejumlah fungi. Sterol lain terutama
terdapat dalam tumbuhan tingkat rendah tetapi kadang-kadang terdapat juga
dalam tumbuhan tingkat tinggi, misalnya fukosterol, yaitu steroid utama pada alga
coklat dan juga terdeteksi pada kelapa (Harborne 1984).
2.7.3 Flavonoid
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan
gula bersenyawa pada satu atau lebih grup hidroksil fenolik. Flavonoid terdapat
pada seluruh bagian tanaman, termasuk pada buah, tepung sari dan akar.
Flavonoid diklasifikasikan menjadi flavon, flavonol, flavanon, flavanonol,
isoflavon, calkon, dihidrokalkon, auron, antosianidin, katekin dan flavan-3,4-diol
(Sirait 2007).
Flavonoid berupa senyawa fenol, karena itu warnanya berubah bila
ditambah basa atau ammonia sehingga mudah dideteksi pada kromatogram atau
dalam larutan. Flavonoid mengandung sistem aromatik yang terkonyugasi dan
karena itu menunjukkan pita serapan kuat pada daerah spektrum Ultra Violet
(UV) dan spektrum tampak (Harborne 1984).
Terbentuknya warna merah, kuning atau jingga di lapisan amil alkohol pada
manusia berfungsi sebagai stimulant pada jantung, hesperidin mempengaruhi
pembuluh darah kapiler.Flavon terhidrolisasi berkerja sebagai diuretik dan
antioksidan pada lemak (Sirait 2007).
2.7.4 Saponin
Saponin merupakan glikosida yang apabila dihidrolisis secara sempurna
akan menghasilkan gula dan satu fraksi non-gula yang disebut sapogenin atau
genin. Gula-gula yang terdapat dalam saponin jumlah dan jenisnya bervariasi,
diantaranya glukosa, galaktosa, arabinosa, ramnosa, serta asam galakturonat dan
glukoronat. Sapogenin sendiri dapat dibedakan menjadi dua jenis, yaitu
sapogenin triterpenik dan steroidik (Muchtadi 1989 dalam Permatasari 2011). Saponin merupakan senyawa aktif permukaan dan bersifat misalnya sabun.
Saponin dapat dideteksi berdasarkan kemampuannya membentuk busa dan
menghemolisis sel darah. Saponin terkadang dapat menimbulkan keracunan pada
ternak (misalnya saponin alfalfa, Medicago sativa) atau karena rasanya yang manis (misalnya glisirizin dari akar manis, Glycyrrhiza glabra) (Harborne 1984).
Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada epitel
hidung, bronkus, ginjal dan sebagainya. Stimulasi pada ginjal diperkirakan
menimbulkan efek diuretika. Saponin dapat mempertinggi resorpsi berbagai zat
oleh aktivitas permukaan. Saponin juga dapat meregangkan partikel tak larut dan
menjadikan partikel tersebut tersebar dan terbagi halus dalam larutan
(Sirait 2007).
Saponin merupakan senyawa metabolit sekunder yang dihasilkan spesies
tanaman yang berbeda, terutama tanaman dikotil dan berperan sebagai bagian dari
sistem pertahanan tanaman dan termasuk kedalam kelompok besar molekul
pelindung tanaman yang disebut phytoanticipins atau phytoprotectans. Saponin
diketahui mempunyai efek sebagai antimikroba, menghambat jamur dan
melindungi tanaman dari serangan serangga (Suparjo 2008).
2.7.5 Fenol hidrokuinon
Komponen fenolat merupakan struktur aromatik yang berikatan dengan satu
atau lebih gugus hidroksil, beberapa mungkin digantikan dengan gugus metil atau
glikosil. Komponen fenolat bersifat larut air selama komponen tersebut berikatan
Flavonoid merupakan kelompok yang terbesar di antara komponen
fenolatalami yang strukturnya telah diketahui, tetapi fenol monosiklik sederhana,
fenilpropanoid dan fenolat quinon terdapat dalam jumlah sedikit (Harborne 1984).
Pigmen kuinon alami berada pada kisaran warna kuning muda hingga hitam.
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar, misalnya
kromofor pada benzokuinon yang terdiri atas dua gugus karbonil yang
berkonjugasi dengan dua ikatan rangkap karbon-karbon (Ketaren 2008).
Kuinon dapat dibagi menjadi empat kelompok, yaitu benzokuinon,
naftakuinon, antrakuinon, dan isoprenoid kuinon. Tiga kelompok pertama
umumnya terhidrolisis dan memiliki sifat fenol, sedangkan isoprenoid kuinon
terdapat pada respirasi seluler (ubikuinon) dan fotosintesis (plastokuinon)
(Harborne 1984).
Antioksidan yang termasuk dalam golongan ini biasanya mempunyai
intensitas warna yang rendah atau kadang-kadang tidak bewarna dan banyak
digunakan karena tidak beracun. Antioksidan golongan fenol meliputi sebagian
besar antioksidan yang dihasilkan oleh alam dan sejumlah kecil antioksidan
sintesis, serta banyak digunakan dalam lemak atau bahan pangan berlemak.
Beberapa contoh yang termasuk golongan ini antara lain hidrokuinon gossypol, pyrogallol, catechol resorsinol dan eugenoli (Ketaren 2008).
2.7.6 Karbohidrat
Karbohidrat adalah polihidroksi aldehida atau keton atau senyawa-senyawa
yang menghasilkan senyawa-senyawa ini bila dihidrolisis. Nama karbohidrat
berasal dari kenyataan bahwa kebanyakan senyawa dari golongan ini mempunyai
rumus empiris, yang menunjukkan bahwa senyawa tersebut adalah karbon “hidrat” dan memiliki nisbah karbon terhadap hidrogen dan terhadap oksigen sebagai 1:2:1. Karbohidrat dalam bentuk gula dan pati melambangkan bagian
utama kalori total yang dikonsumsi manusia dan bagi kebanyakan kehidupan
Ahewan, misalnya juga bagi berbagai mikroorganisme. Karbohidrat juga
merupakan pusat metabolisme tanaman hijau dan organisme fotosintetik lainnya
yang menggunakan energi solar untuk melakukan sintesis karbohidrat dari CO2
Karbohidrat menurut Sirait (2007) dikelompokkan menjadi tiga, yaitu :
1) Monosakarida, merupakan suatu molekul yang dapat terdiri dari lima atau
enam atom C.
Contoh: glukosa, fruktosa, arabinosa
2) Oligosakarida, merupakan polimer dari dua sampai sepuluh monosakarida.
Contoh: sukrosa rafinosa
3) Polisakarida
Polisakarida merupakan rantai panjang yang terdiri dari monosakarida di mana
ikat satu dengan yang lainnya dapat berupa ikatan head to tail dan dapat bercabang-cabang.
Contoh: pati, selulosa, inulin.
2.7.7 Gula pereduksi
Gula pereduksi merupakan kelompok gula atau karbohidrat yang mampu
mereduksi senyawa pengoksidasi. Monosakarida akan segera mereduksi
senyawa-senyawa pengoksidasi misalnya ferisianida, hidrogen peroksida atau ion
kupri (Cu2+). Gula dioksidasi pada gugus karbonil dan senyawa pengoksidasi
menjadi tereduksi pada reaksi ini. Senyawa pereduksi adalah pemberi elektron
dan senyawa pengoksidasi adalah penerima elektron. Glukosa dan gula-gula lain
yang mampu mereduksi senyawa pengoksidasi disebut gula pereduksi. Sifat ini
berguna dalam analisis gula, dengan mengukur jumlah dari senyawa pengoksidasi
yang tereduksi oleh suatu larutan gula tertentu, dapat dilakukan pendugaan
konsentrasi gula. Prinsip tersebut berguna dalam menganalisa, kandungan gula
dalam darah dan air seni untuk diagnosis diabetes mellitus (Lehninger 1988).
Ada tidaknya sifat pereduksi dari suatu molekul gula ditentukan oleh ada
tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif
pada glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik),
sedangkan pada fruktosa (ketosa) hidroksil reaktifnya terletak pada karbon nomor
dua. Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya
sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor
1 pada gugus glukosanya. Akibatnya, laktosa bersifat pereduksi sedangkan
2.7.8 Peptida
Peptida merupakan ikatan kovalen antara dua atau lebih molekul asam
amino melalui suatu ikatan amida substitusi. Ikatan peptida dibentuk dengan
menarik unsur H2O dari gugus karboksil suatu asam amino dan gugus α-amino
dari molekul lain, dengan reaksi kondensasi yang kuat. Tiga asam amino dapat
disatukan oleh dua ikatan peptida dengan cara yang sama untuk membentuk suatu
tripeptida, tetrapeptida dan pentapeptida. Jika terdapat banyak asam amino yang
bergabung dengan cara demikian, struktur yang dihasilkan dinamakan polipeptida.
Peptida dengan panjang yang bermacam-macam dibentuk oleh hidrolisa sebagian
dari rantai polipeptida yang panjang dari protein, yang dapat mengandung ratusan
asam amino (Lehninger 1988).
Pengikatan asam amino dengan ikatan peptida berlangsung dalam
bermacam-macam urutan dengan perbandingan molekul dan struktur ruang yang
berbeda-beda (lipatan dari rantai, cincin makro, dll) (Sirait 2007). Pembentukan
ikatan peptida memerlukan banyak energi, sedangkan untuk hidrolisis praktis
tidak memerlukan energi. Reaksi keseimbangan ini cenderung untuk berjalan ke
arah hidrolisis daripada sintesis (Winarno 2008).
2.7.9 Asam amino
Asam amino merupakan unit struktural dasar dari protein. Asam amino
dapat diperoleh dengan menghidrolisis protein dalam asam, alkali, ataupun enzim.
Asam amino tumbuhan dapat dibagi menjadi dua golongan yaitu asam amino
protein dan asam amino bukan protein. Asam amino protein pada umumnya
diketahui berjumlah 20 dan ditemukan dalam hidrolisat asam dari protein
tumbuhan dan hewan. Hanya satu asam amino bukan protein yang selalu terdapat dalam tumbuhan, yaitu asam -amino-butirat. Perannya dalam tumbuhan tidak begitu nyata, meski ada (sering dalam konsentrasi tinggi) dalam biji dan dalam
metabolisme selanjutnya dalam perkecambahan yang memungkinkan sebagai
bahan penyimpan nitrogen (Harborne 1984).
Asam amino dalam kondisi netral (pH isolistrik) berada dalam bentuk ion
dipolar atau disebut juga ion zwitter.Pada asam amino yang dipolar, gugus amino mendapat tambahan sebuah proton dan gugus karboksil terdisosiasi.Derajat
terdisosiasi sedangkan gugus aminonya menjadi ion pada pH yang rendah
(misalnya pada pH 1,0). Gugus karboksilnya terdisosiasi sedangkan gugus
aminonya tidak pada pH yang tinggi (misalnya pada pH 11,0) (Winarno 2008).
2.8 Pengukusan
Penyiapan makanan dalam kehidupan sehari-hari umumnya menggunakan
proses pengolahan panas. Proses pengolahan makanan dapat meningkatkan daya
cerna dan penampakan, memperoleh flavor, dan merusak mikroorganisme dalam bahan pangan (Azizah et al. 2009). Pengolahan panas merupakan salah satu cara paling penting yang telah dikembangkan untuk memperpanjang umur simpan.
Salah satu proses pengolahan panas yang biasa digunakan untuk mengolah
sayuran adalah pengukusan. Pengukusan merupakan proses pemanasan yang
sering diterapkan pada sistem jaringan sebelum pembekuan, pengeringan, atau
pengalengan. Pengukusan tradisional menggunakan air panas atau uap panas
sebagai medium penghantar panas. Suhu air pengukusan harus lebih tinggi dari
66 oC, tetapi kurang dari 82 oC (Harris dan Karmas 1989).
Proses pengukusan menggunakan berupa dandang yang terdiri dari dua
bagian yaitu bagian bawah untuk air pengukus dan bagian berlubang di atasnya
untuk tempat sayuran. Sebelum sayuran dimasukkan sebaiknya air dididihkan
terlebih dahulu, setelah itu baru sayuran dimasukkan. Sayuran berwarna hijau
sebaiknya dandang jangan ditutup terlalu rapat. Metode pengukusan memberikan
beberapa keuntungan yaitu kandungan gizi tidak banyak berkurang, rasa sayur
lebih enak, renyah dan harum, serta kemungkinan sayur menjadi hangus hampir
tidak ada (Novary 1999).
Proses pengolahan akan memberikan perubahan karakteristik secara fisik
maupun komposisi kimia dalam sayuran. Pengukusan dapat menurunkan kadar
zat gizi makanan yang besarnya bergantung pada cara mengukus dan jenis
makanan yang dikukus. Proses pengolahan dapat mengakibatkan kandungan
fitokimia dan antioksidan dalam sayuran yang telah diolah lebih rendah daripada
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Februari 2012 sampai Mei 2012.
Sampel genjer (L. flava) diambil dari Desa Cikarawang, Kecamatan Darmaga, Kabupaten Bogor. Proses preparasi sampel dilakukan diLaboratorium
Karakteristik Bahan Baku dan Laboratorium Preservasi dan Pengolahan. Analisis
proksimat (Kadar air, abu, lemak, protein dan abu tidak larut asam) dilakukan di
Laboratorium Biokimia Hasil Perairan. Analisis total serat dilakukan di Balai
Besar Industri Agro (BBIA). Proses ekstrasi, uji fitokimia dan uji aktivitas
antioksidan di Laboratorium Pusat Studi Biofarmaka (LPSB), Institut Pertanian
Bogor.
3.2 Bahan dan Alat
Bahan utama yang digunakan untuk penelitian ini adalah genjer (L. flava) yang diambil di desa Cikarawang, Kecamatan Darmaga, Kabupaten Bogor.
Bahan-bahan yang dibutuhkan untuk analisis proksimat meliputi akuades, kjeltab
jenis selenium, H2SO4pekat, asam borat (H3BO3) 4% yang mengandung indikator
bromcherosol green-methyl red (1:2) berwarna merah muda, HCl 0,0947N, pelarut lemak (n-heksana), HCl 10% dan AgNO3 0,10 N. Bahan yang dibutuhkan
untuk proses ekstraksi dan evaporasi adalah etanol 96%. Bahan-bahan yang
dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner (uji alkaloid), pereaksi
Meyer (uji alkaloid), pereaksi Dragendroff (uji alkaloid), kloroform, anhidra
asetat, asam sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji
flavonoid), air panas, larutan HCl 2 N (uji saponin), etanol 70%, larutan FeCl3
5% (uji fenolhidrokuinon), peraksi Molisch, asam sulfat pekat (uji Molisch),
pereaksi Benedict (uji Benedict), pereaksi Biuret (uji Biuret) dan larutan
Ninhidrin 0,10% (uji Ninhidrin).Bahan-bahan yang dibutuhkan untuk uji aktivitas
antioksidan, yaitu ekstrak kasar genjer, kristal 1,1-difenil-2-pikrilhidrazil (DPPH), etanol dan BHT (butylated hydroxytoluena) sebagai pembanding.
Alat-alat yang digunakan dalam penelitian ini antara lain pisau, talenan,
desikator, oven, kompor listrik, tanur, kertas saring Whatman 42 bebas abu, kapas
bebas lemak, labu lemak, kondensator, tabung Soxhlet, penangas air, labu
Kjeldahl, destilator, blender, labu Erlenmeyer, buret, botol kaca kecil, pipet,
tabung reaksi, pipet volumetrik, pipet mikro, pipet tetes, gelas ukur, grindmill,
orbitalshaker, rotaryvacuumevaporator, corong kaca, botolgelas, gelas piala, tabung reaksi, ELISA reader, microplate, multipipette, dan labu takar.
3.3 Metode yang Digunakan
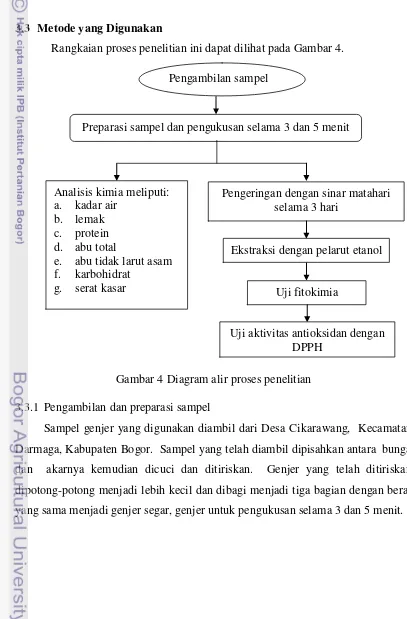
Rangkaian proses penelitian ini dapat dilihat pada Gambar 4.
Gambar 4 Diagram alir proses penelitian
3.3.1 Pengambilan dan preparasi sampel
Sampel genjer yang digunakan diambil dari Desa Cikarawang, Kecamatan
Darmaga, Kabupaten Bogor. Sampel yang telah diambil dipisahkan antara bunga
dan akarnya kemudian dicuci dan ditiriskan. Genjer yang telah ditiriskan
dipotong-potong menjadi lebih kecil dan dibagi menjadi tiga bagian dengan berat
yang sama menjadi genjer segar, genjer untuk pengukusan selama 3 dan 5 menit. Pengambilan sampel
Preparasi sampel dan pengukusan selama 3 dan 5 menit
Pengeringan dengan sinar matahari selama 3 hari
Analisis kimia meliputi: a. kadar air
b. lemak c. protein d. abu total
e. abu tidak larut asam f. karbohidrat
g. serat kasar
Ekstraksi dengan pelarut etanol
Uji fitokimia
3.3.2 Pengukusan tanaman genjer
Proses pengukusan genjer dilakukan terhadap bagian daun dan batang.
Proses pengukusan bertujuan untuk mengetahui pengaruh proses pengukusan
terhadap analisis proksimat, fitokimia dan aktivitas antioksidan genjer.
pengukusan akan dilakukan selama menit 3 dan 5 menit hingga daun terlihat agak
layu tetapi warna genjer tetap hijau.
Setelah proses pengukusan dilakukan analisis proksimat (kadar air, kadar
abu, kadar protein, kadar lemak, dan kadar abu tidak larut asam) dan pengeringan
genjer selama 3 hari dibawah sinar matahari kemudian genjer dihaluskan dengan
blender.
3.3.3 Analisis proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk
memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar
air, abu, lemak, protein, abu larut asam dan serat.
1) Analisis kadar air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah cawan
porselen dikeringkan dalam oven pada suhu 105 oC selama 1 jam.Cawan tersebut
diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai
dingin kemudian ditimbang.Sebanyak 5 gram contoh dimasukkan ke dalam cawan
tersebut dan dikeringkan dengan oven pada suhu 105oC selama 5 atau hingga
beratnya konstan.Setelah selesai proses pengeringan, cawan tersebut didinginkan
dalam desikator ±30 menit dan dibiarkan sampai dingin kemudian ditimbang
kembali.
Perhitungan kadar air :
% Kadar air = B - C x 100% B - A
Keterangan : A = Berat cawan kosong (gram)
B = Berat cawan yang diisi dengan sampel (gram)
C = Berat cawan dengan sampel yang sudah dikeringkan (gram)
2) Analisis kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu
105oC, kemudian didinginkan di dalam desikator dan ditimbang hingga
cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap
lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC
sampai pengabuan sempurna, kemudian ditimbang hingga didapatkan berat yang
konstan.
Kadar abu ditentukan dengan rumus:
% Kadar abu = C - A x 100% B - A
Keterangan : A = Berat cawan porselen kosong (gram) B = Berat cawan dengan sampel (gram)
C = Berat cawan dengan sampel setelah dikeringkan (gram)
3) Analisis kadar protein (AOAC 2005)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap
yaitu destruksi, destilasi, dan titrasi.Sampel ditimbang sebanyak 0,25 gram,
kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambah0,25 gram
selenium dan 3 ml H2SO4 pekat. Sampel didestruksi pada suhu 410oC sampai
larutan jernih lalu didinginkan, kemudian ditambah 50 ml akuades dan 20 ml
NaOH 40%, kemudian dilakukan proses destilasi. Hasil destilasi ditampung
dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3)
2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 200 ml maka proses destilasi dihentikan.
Lalu destilat dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah
muda kemudian volume titran dibaca dan dicatat.
Kadar protein dihitung dengan rumus sebagai berikut :
% N = (ml HCl – ml blanko) x N HCl x 14,007 x 100% Mg contoh x faktor koreksi alat *
% kadar protein = %N x faktor konversi* *) Faktor konversi = 6,25
4) Analisis kadar lemak (AOAC 2005)
Sampel seberat 5 gram (W1) dimasukkan ke dalam kertas saring dan
selanjutnya dimasukkan ke dalam selongsong lemak.Sampel yang telah dibungkus
dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan
disambungkan dengan tabung soxhlet.Selongsong lemak dimasukkan ke dalam
Tabung ekstraksi dipasang pada alat destilasi soxhlet, lalu dipanaskan pada suhu
40 ºC menggunakan pemanas listrik selama 6 jam.Pelarut lemak yang ada dalam
labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi
pelarut akan ditampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak
kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven
5) Analisis kadar abu tidak larut asam menurut SNI-2354.1-2010 (BSN 2010)
Abu hasil pengukurankadar abu total dilarutkan dalam 25 ml HCl 10% dan
didihkan selama 5 menit. Larutan kemudian disaring dengan kertas saring
Whatman bebas abu dan dicuci dengan air suling sampai bebas klorida (dengan
pereaksi AgNO3). Kertas saring kemudian dikeringkan dalam oven. Kertas
saring yang sudah dioven kemudian dilipat dengan menggunakan sudip dan
diletakkan di dalam cawan porselen yang telah ditimbang bobotnya.Cawan
tersebut dibakar di ruang asam sampai tidak berasap.Cawan kemudian
dimasukkan dalam pada suhu 600 ºC.Setelah dilakukan pengabuan, cawan lalu
didinginkan dalam desikator dan ditimbang. Kadar abu tak larut asam dapat
ditentukan dengan rumus:
x 100%
6) Analisis kadar serat kasar menurut SNI 01-2891-1992
Metode analisis kadar serat kasar yaitu sebanyak 2-4 gram sampel
dilarutkan dengan 100 ml H2SO4 1,25% dan dipanaskan hingga mendidih
kemudian didestruksi selama 30 menit dan ditambahkan 50 ml NaOH 1,25%,
kemudian didihkan kembali. Tahap selanjutnya adalah disaring menggunakan kertas saring Whatman (ф:10 cm) dan dengan bantuan corong Buchner. Residu hasil saringan dibilas dengan 20-30 ml air mendidih sebanyak 3 kali. Residu
Setelah itu disaring dengan cara seperti diatas dan dibilas berturut-turut dengan
25 ml H2SO4 1,25%; 2,5 ml air sebanyak 3 kali; dan 25 ml alkohol. Residu beserta
kertas saring dipindahkan ke cawan porselin yang telah diketahui bobotnya dan
dikeringkan dalam oven 130 oC selama 2 jam. Setelah dingin residu beserta
cawanporselin ditimbang (A), dan dimasukkan dalam tanur 600 oC selama 30
menit, lalu didinginkan dan ditimbang kembali (B).
3.3.4 Ekstraksi bahan aktif
Tahap ini terdiri dari beberapa langkah, yaitu persiapan sampel dan
ekstraksi bahan aktif. Pada tahap persiapan sampel, genjer yang telah diambil dari
desa Cikarawang, Dramaga, Bogor dipreparasi kemudian dilakukan pengukusan.
Genjer segar dan genjer yang telah mengalami pengukusan dikeringkan dengan
panas matahari. Genjer yang telah dikeringkan tersebut kemudian dihancurkan
dengan blender sehingga didapat tekstur yang halus. Tahap selanjutnya adalah ekstraksi bahan aktif. Metode ekstraksi yang digunakan adalah metode ekstraksi
tunggal (Quinn 1988). Pelarut yang digunakan dalam penelitian ini yaitu etanol
96%.
Sampel genjer yang telah dihancurkan ditimbang sebanyak 20 gram dan
dimaserasi dengan pelarut etanol 96% sebanyak 100 ml selama 24 jam.Hasil
maserasi yang berupa larutan kemudian disaring dengan kertas saring Whattman
42 sehingga didapat filtrat dan residu.Filtrat yang diperoleh dievaporasi hingga
pelarut memisah dengan ekstrak menggunakan rotary vacuum evaporator pada suhu 50 ºC. Berdasarkan proses ini maka akan diperoleh ekstrak etanol genjer
segar, genjer yang mengalami pengukusan selama 3 dan 5 menit.
3.3.5 Uji fitokimia (Harborne 1984)
Uji fitokimia dilakukan untuk mengetahui ada tidaknya
komponen-komponen bioaktif yang terdapat pada ekstrak kasar genjer yang memiliki
aktivitas antioksidan.Uji fitokimia meliputi uji alkaloid, uji steroid/triterpenoid,
flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict, Biuret dan
a) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2N kemudian
diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer,
dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer
terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan
endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 HgCl2 dengan
0,5 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml
dengan labu takar. Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat dengan
cara 10 ml akuades dipipet kemudian ditambah 2,5 gram iodin dan 2 gram kalium
iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu
takar. Pereaksi ini berwarna coklat. Pereaksi Dragendorff dibuat dengan cara 0,8
gram bismut subnitrat ditambah dengan 10 ml asam asetat dan 40 ml air. Larutan
ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml
air. Sebelum digunakan, satu volume campuran ini diencerkan dengan 2,3
volume campuran 20 ml asam asetat glasial dan 100 ml air. Pereaksi ini berwarna
jingga.
b) Steroid/ triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi
yang kering. Lalu, ke dalamnya ditambah 10 tetes anhidrat asetat dan 3 tetes
asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali
kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
c) Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil
alkohol (campuran asam klorida 37% dan metanol 95% dengan volume yang
sama) dan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna
merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya
flavonoid.
d) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil
selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan
e) Fenol Hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 mlmetanol 70%. Larutan
yang dihasilkan diambil sebanyak 1 ml kemudian ditambah 2 tetes larutan FeCl3
5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa
fenol dalam bahan.
f)Uji Molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi Molish dan 1 ml asam
sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya
karbohidrat ditandai terbentuknya kompleks berwarna ungu diantara 2 lapisan
cairan.
g) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi
Benedict. Campuran dikocok dan dididihkan selama 5 menit. Terbentuknya
warna hijau, kuning, atau endapan merah bata menunjukkan adanya gula
pereduksi.
3.3.6 Analisis antioksidan dengan metode DPPH (Salazar et al. 2009)
Analisis aktivitas uji aktioksidan dilakukan dengan menggunakan metode
DPPH (1,1-difenil-2-pikrilhidrazil). Ekstrak kasar genjer dari hasil ekstraksi tunggal menggunakan pelarut etanol dilarutkan dalam etanol.Uji aktivitas
antioksidan dilakukan berdasarkan kemampuan sampel dalam mereduksi radikal
bebas stabil DPPH. Larutan DPPH yang digunakan, dibuat dengan melarutkan
kristal DPPH dalam pelarut etanol 1 mM. Pembanding yang digunakan adalah
BHT.Sampel dan pembanding dipindahkan dalam microplate sebanyak 100 µl menggunakan pipet mikro dan ditambah 100 µl DPPH.Campuran diinkubasi pada
suhu 37 ºC selama 30 menit dan diukur absorbansinya dengan menggunakan
ELISA Reader. Aktivitas antioksidan dari masing-masing sampel dinyatakan dengan persen inhibisi, yang dihitung dengan rumus sebagai berikut:
% inhibisi = (A blanko – A sampel) x 100% A blanko
Nilai konsentrasi sampel (ekstrak ataupun antioksidan pembanding) dan
persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan
y = a + bx, digunakan untuk mencari nilai IC50 (inhibitor concentration 50%) dari masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang
akan diperoleh sebagai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan
sampel (ekstrak ataupun antioksidan pembanding) yang dibutuhkan untuk
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Genjer (L. flava)
Morfologi genjer yang digunakan dalam penelitian ini diambil dari areal
kolam di daerah Desa Cikarawang, Kecamatan Darmaga, Kabupaten Bogor dapat
dilihat pada Gambar 5.
Gambar 5 Morfologi genjer (L. flava)
Genjer mempunyai daun yang berbentuk membulat dan terdapat lapisan lilin
pada bagian daun. Tumbuhan genjer yang subur ukurannya bisa mencapai lebar
telapak tangan orang dewasa yang ditopang batang bersegi tiga yang berongga di
dalamnya. Batangnya berwarna hijau muda dan tebal dengan diameter sekitar
7,4 cm.
Genjer yang diperoleh dalam penelitian ini hidup di lingkungan dengan air
yang jernih, kedalaman air 3 sampai 4 cm dan suhu perairan 27 ºC. Proses
karakterisasi dilakukan untuk mengetahui sifat dari bahan baku yang akan
digunakan. Sifat bahan baku tidak terbatas pada sifat fisik saja seperti pengukuran
rendemen, tetapi juga sifat kimia sehingga perlu dilakukan analisis kandungan
gizi genjer dengan uji proksimat.
4.1.1 Rendemen
Rendemen adalah persentase perbandingan antara berat bagian bahan yang
dapat dimanfaatkan dengan berat total bahan.Rendeman digunakan untuk
mengetahui nilai ekonomis suatu produk atau bahan. Semakin tinggi nilai
rendemennya, maka semakin tinggi pula nilai ekonomisnya sehingga
Rendemen genjersegarbagian daun, batang dan akar dapat dilihat pada
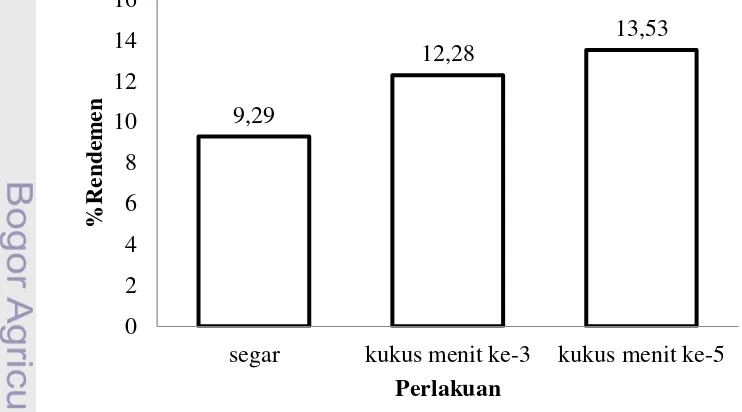
Lampiran 1. Nilai rendemen genjer disajikan pada Gambar 6.
Gambar 6 Rendemen genjer (L. flava)
Rendemen batang genjer lebih besar dibandingkan dengan rendemen daun
dan akar, yaitu sebesar 61,76%. Hal ini disebabkan karena bagian batang genjer
lebih besar dibandingkan bagian lain, yaitu daun dan akar sehingga menyebabkan
rendemen batang genjer lebih besar.
Genjer biasanya dimanfaatkan sebagai sayuran, di wilayah Indonesia,
Malaysia dan Thailand.Tanaman ini biasanya tidak dimakan mentah tetapi
dipanaskan di atas api atau dimasak untuk waktu yang singkat. Genjer berkhasiat
sebagai penambah nafsu makan dan menjaga kesehatan saluran pencernaan karena
kaya akan serat. Menurut Susmiati (2007) peran utama serat dalam makanan
adalahmampu mengikat air, selulosa dan pektin.Serat membantu mempercepat
keluarnya sisa-sisa makanan melalui saluran pencernaan. Tanpa bantuan serat,
feses dengan kandungan air rendah akan lebih lama tinggal dalam saluran usus
dan mengalami kesukaran melalui usus untuk dapat diekskresikan keluar karena
gerakan-gerakan peristaltik usus besar menjadi lebih lamban.
Hasil perhitungan rendemen pada Lampiran 1 menunjukkan bahwa
rendemen daun, batang dan akar genjer berturut-turut adalah 9,84%, 68,65% dan
20,49%. Perhitungan rendemen apabila dijumlahkan tidak mencapai 100%.Hal
ini disebabkan adanya bagian yang tidak dapat dimanfaatkan pada penelitian ini. Batang
68,85% Akar
20,49%
4.1.2 Komposisi kimia
Komposisi kimia genjer dapat diketahui melalui analisis proksimat.
Analisis proksimat merupakan salah satu metode yang digunakan untuk
mengetahui komposisi kimia suatu bahan yang meliputi kadar air, lemak, protein,
abu, abu tidak larut asam, karbohidrat dan serat kasar. Kadar karbohidrat genjer
diperoleh melalui perhitungan by difference.Cara perhitungan analisis proksimat genjer dapat dilihat pada Lampiran 2 dan hasil analisis proksimat disajikan pada
Tabel 2.
Tabel 2 Hasil uji proksimat genjer (n=2)
Komponen Kandungan (% bb)
Segar Kukus menit ke-3 Kukus menit ke-5
Kadar air 93,92 ± 0,13 92,49 ± 0,04 91,18 ± 0,07
Air merupakan komponen dasar dari bahan makanan terutama hasil
perikanan.Kandungan air pada tumbuhan dapat mencapai 85-98% (Utama et al.
2007).Kandungan air dalam bahan makanan ikut menentukan daya terima,
kesegaran dan daya simpan bahan tersebut (Winarno 1997).Buah dan sayuran
merupakan bahan pangan yang kandungan airnya cukup tinggi.Hal ini membuat
buah dan sayuran memberikan efek rasa segar ketika dikonsumsi. Air dalam tubuh
berfungsi sebagai pelarut dan alat angkut zat-zat gizi, terutama vitamin larut air
dan mineral.
Air juga berfungsi sebagai katalisator, pelumas, fasilitator pertumbuhan,
pengatur suhu, dan peredam benturan.Kandungan air yang tinggi menyebabkan
buah dan sayuran mudah mengalami kerusakan (perishable).Kadar air rata-rata genjer segar, kukus 3 menit dan kukus 5 menit secara berurut adalah 93,92%,
dibandingkan semanggi air yang memiliki kadar air rata-rata sebesar 89,02%
untuk semanggi air segar dan 87,92% untuk semanggi air kukus (Kristiono 2009).
Proses pengolahan pada sayuran dapat menyebabkan perubahan kadar
air.Kadar air genjer segar mengalami perubahan setelah proses pengukusan dari
93,92 % menjadi 92,49% pada pengukusan 3 menit dan 91,18 % pada pengukusan
5 menit. Perubahan kadar air ini dapat disebabkan oleh mudahnya air menguap
ketika mengalami proses pemanasan. Transfer panas dan pergerakan aliran air
maupun udara menyebabkan proses penguapan dan pengeringan pada bahan
makanan. Menurunnya kadar air pada sayuran akan mengakibatkan perubahan
tekstur pada sayuran tersebut. Sayuran setelah dikukus akan menjadi renyah dan
lebih mudah dikonsumsi (Novary 1999).
2) Kadar lemak
Lemak merupakan zat yang penting dan merupakan sumber energi yang
lebih efektif bagi tubuh dibandingkan karbohidrat dan protein.Lemak memberi
cita rasa dan memperbaiki tekstur pada makanan juga sebagai sumber pelarut bagi
vitamin A, D, E dan K (Winarno 1997).Kandungan lemak pada buah dan sayuran
umumnya sedikit, lemak yang terkandung dalam pangan nabati biasanya berupa
asam lemak tidak jenuh (Wirakusumah 2007).Kadar lemak (basis basah) pada
tanaman genjer segar, genjer yang mengalami pengukusan selama 3 dan 5 menit
secara berturut-turut sebesar 0,20%, 0,29% dan 0,39%. Hal ini lebih tinggi
dibandingkan hasil penelitian Kristiono (2009) yang menunjukkan kadar
lemaksemanggi air segar (0,27%) dan lebih tinggi pada kadar lemak semanggi
kukus (0,3%).
Perubahan kadar lemak secara proporsional terjadi pada genjer setelah
proses pengukusan. Kadar lemak genjer segar sebesar 0,20% berubah menjadi
0,39% setelah mengalami pengukusan selama 5 menit. Hal ini disebabkan oleh
sifat lemak yang volatil.Lemak yang terdapat pada daun dan tangkai dapat
mencair dan menguap karena proses pemanasan sehingga kandungan di dalam
bahan berkurang (Kristiono 2009). Proses pengolahan akan memberikan
perubahan karakteristik secara fisik maupun komposisi kimia dalam sayuran.
makanan yang besarnya bergantung pada cara mengukus dan jenis makanan yang
dikukus (Harris dan Karmas 1989).
3) Kadar protein
Protein merupakan suatu zat makanan yang penting bagi tubuh, karena zat
ini disamping berfungsi sebagai bahan bakar dalam tubuh juga berfungsi sebagai
zat pembangun dan zat pengatur. Protein adalah sumber asam-asam amino yang
mengandung unsur C, H, O, dan N yang tidak dimiliki oleh lemak dan karbohidrat
(Lehninger 1990). Tubuh kita membutuhkan asam amino essensial yang tidak
dapat diproduksi oleh tubuh dan hanya bisa didapatkan melalui makanan yang
kita konsumsi sehari-hari.
Kadar protein genjer segar pada penelitian ini sebesar2,38%. Nilai kadar
protein ini lebih tinggi dibandingkan dengan kadar protein hasil penelitian Saupi
et al. (2009) sebesar 0,28%. Hal ini diduga karena perbedaan habitat dan kondisi genjer yang digunakan.
Pengukusan menyebabkan penurunan kadar protein genjer. Kadar protein
genjer mengalami peningkatan setelah mengalami pengukusan selama 3 menit
dari 2,38% menjadi 2,81%, kemudian mengalami penurunan setelah pengukusan
selama 5 menit menjadi 2,03%. Menurut Jacoeb et al. (2010) peningkatan presentasi kadar protein pada genjer setelah pengukusan diduga karena adanya
penguraian tanin pada daun dan batang genjer. Protein tersebut tidak terlarut
bersama air yang keluar dari bahan pangan.Hal ini diduga menyebakan perubahan
kandungan protein pada daun genjer.
4) Kadar abu
Kadar abu dapat digunakan sebagai petunjuk adanya keberadaan mineral
suatu bahan.Sebagian besar bahan makanan, sekitar 96% terdiri dari bahan
organik dan air.Sisanya terdiri dari unsur-unsur mineral yang juga dikenal sebagai
zat anorganik (kadar abu). Dalam proses pembakaran, bahan-bahan organik
terbakar tetapi zat anorganiknya tidak (Winarno 1997). Kandungan abu dan
komponennya tergantung pada macam bahan dan cara pengabuannya. Genjer
memiliki kadar abu (basis basah) sebesar 0,7% yang nilainya lebih rendah apabila
dibandingkan dengan kadar abu selada air (1,14%) hasil penelitian Permatasari
Kadar abu genjer sebesar 0,70% berubah menjadi 0,85% dan 0,99% akibat
proses pengukusan selama 3 dan 5 menit. Kadar abu mengalami perubahan karena
adanya air yang keluar akibat proses pengukusan. Mineral-mineral yang
terkandung dalam tanaman genjer seperti kalsium, fosfor, besi, natrium, kalium,
tembaga, dan seng ikut keluar bersama dengan keluarnya air akibat proses
pengukusan.
5) Kadar abu tidak larut asam
Kadar abu tidak larut asam merupakan salah satu kriteria dalam menentukan
tingkat kebersihan dalam proses pengolahan suatu produk. Abu tidak larut asam
dicerminkan oleh adanya kontaminasi mineral atau logam yang tidak larut asam
dalam suatu produk (Basmal et al. 2003).
Hasil pengujian kadar abu tidak larut asam menunjukkan bahwa genjer
mengandung residu abu tak larut asam sebesar 0,10% dari ketiga sampel. Nilai
kadar abu yang diperoleh pada penelitian ini lebih rendah dibandingkan dengan
hasil penelitian Pernatasari (2011) yang menunjukkan nilai kadar abu tidak larut
asam selada air sebesar 0,29%. Kadar abu tidak larut asam ini diduga berasal dari
material-material abu yang tidak larut asam yang terdapat pada substrat perairan
tempat genjer tumbuh.
6) Kadar karbohidrat
Hasil perhitungan by difference memberikan nilai karbohidrat sebesar 2,70% pada genjer segar 3,42% pada pengukusan selama 3 menit dan 5,31% pada
proses pengukusan selama 5 menit. Kadar karbohidrat pada genjer segar ini lebih
rendah dibandingkan dengan hasil penelitian Saupi et al. (2009) sebesar 14,56%. Nilai karbohidrat pada genjer yang mengalami pengukusan terjadi peningkatan,
hal ini diduga karena pada kloroplas terkandung amilum yang tinggi.
Karbohidrat utama yang disimpan pada sebagian besar tumbuhan adalah pati dan
selulosa (Almatsier 2006).
Karbohidrat memegang peranan penting dalam alam, karena karbohidrat
merupakan sumber energi utama bagi hewan dan manusia. Terbentuknya
karbohidrat dalam tanaman melalui proses asimilasi atau fotosintesa, yang terjadi
melalui permukaan daun yang menghisap udara (CO2), bersamaan dengan air
hijau daun, CO2 dan air dalam daun dengan bantuan sinar matahari diubah
menjadi zat tepung atau pati (Muchtadi dan Ayustaningwarno 2010 dalam
Permatasari 2011).
7) Kadar serat kasar
Sayuran merupakan sumber serat yang paling baik dibandingkan dengan
bahan pangan lainnya.Serat pada tumbuhan umumnya terdiri dari selulosa,
hemiselulosa dan lignin.Genjer segar memiliki kandungan serat (basis basah) sebesar 1,31% sedangkan genjer yang telah mengalami proses pengukusan selama
3 dan 5 menit memiliki kandungan serat sebesar 1,34% dan 1,53%. Kandungan
serat ini lebih rendah apabila dibandingkan dengan kadar serat pada semanggi air
segar dan lebih tinggi kandungan serat genjer kukus dibandingkan dengan
semanggi air kukus.
Proses pengukusan menyebabkan perubahan kandungan serat pada genjer.
Kadar serat dalam makanan dapat mengalami perubahan akibat pengolahan yang
dilakukan terhadap bahan asalnya.Pada umumnya kadar serat dalam tanaman akan
mengalami proses penurunan akibat pengolahan panas (Muchtadi et al. 1993). Serat pada tumbuhan yang sebagian besar berupa selulosa akan terhidrolisis
menjadi senyawa-senyawa yang lebih sederhana. Serat yang berupa selulosa,
hemiselulosa, dan lignin ini merupakan polisakarida yang banyak terdapat pada
dinding sel tumbuhan.Selulosa yang terhidrolisis akan menjadi senyawa yang
lebih sederhana seperti selodekstrin yang terdiri dari satuan glukosa atau lebih
sedikit, kemudian selobiosa dan akhirnya glukosa (Robinson 1995).
4.2 Ekstraksi Komponen Bioaktif Genjer (L. flava)
Ekstraksi merupakan proses penarikan komponen zat aktif suatu bahan
dengan menggunakan pelarut tertentu. Tujuan dari proses ini adalah untuk
mendapatkan bagian-bagian tertentu dari bahan yang mengandung
komponen-komponen aktif (Harborne 1984). Ekstrak kasar genjer diperoleh dari proses
ekstraksi yang meliputi pengeringan genjer, penghancuran genjer hingga menjadi