SITI ANWARIYAH
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa skripsi dengan judul “Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Cymodocea rotundata” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal
atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Siti Anwariyah
SITI ANWARIYAH. Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Cymodocea rotundata. Dibimbing oleh JOKO SANTOSO dan PIPIH SUPTIJAH.
Lamun Cymodocea rotundata merupakan salah satu jenis lamun yang pemanfaatannya belum begitu banyak. Sejauh ini, lamun C. rotundata
dimanfaatkan sebagai pakan penyu hijau dan dugong. Masih terbatasnya data-data ilmiah yang mendukung pemanfaatan jenis lamun ini mendorong perlunya dilakukan penelitian mengenai metabolit sekunder dalam lamun C. rotundata. Metabolit sekunder ini dimungkinkan memiliki aktivitas sebagai antioksidan sehingga penelitian ini dapat bermanfaat untuk mengetahui pemanfaatan lamun
C. rotundata di masa mendatang.
Penelitian ini bertujuan untuk mengetahui komposisi proksimat (air, abu, protein, dan lemak), abu tidak larut asam dan kadar serat pangan, serta untuk mengetahui pengaruh perbedaan pelarut terhadap rendemen ekstrak, nilai total fenol, senyawa fitokimia, dan aktivitas antioksidan dalam lamun C. rotundata.
Lamun C. rotundata dalam penelitian ini berasal dari perairan Pulau Pramuka, Taman Nasional Kepulauan Seribu, Jakarta. Lamun yang masih segar digunakan dalam pengujian proksimat, abu tak larut asam dan serat pangan. Lamun yang telah dikeringkan diekstrak dengan metode maserasi dalam tiga pelarut berbeda, yaitu metanol (polar), etil asetat (semipolar) dan n-heksana (nonpolar). Pengujian dilakukan terhadap masing-masing ekstrak yang diperoleh meliputi uji total fenol menggunakan reagen Folin-Ciocalteau, uji kualitatif fitokimia, dan aktivitas antioksidan dengan metode diphenylpycrilhydrazil (DPPH).
Komposisi proksimat (%bb) lamun ini meliputi 90,67% air; 2,35% abu; 1,13% protein; 0,79% lemak; dan 5,06% karbohidrat (by difference). Lamun
C. rotundata tidak mengandung abu tak larut asam. Kandungan serat pangan (%bb) yang diperoleh dari lamun ini meliputi insoluble dietary fibre (IDF) sebesar 5,39 g/100 g sampel; soluble dietary fibre (SDF) sebesar 8,93 g/100 g sampel; dan
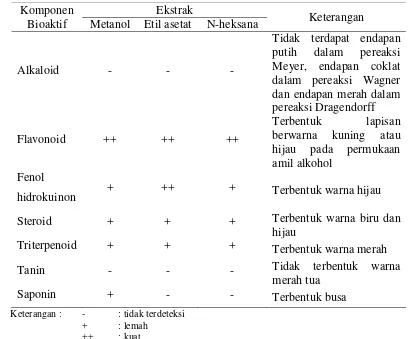
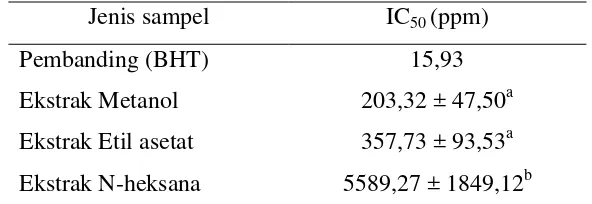
total dietary fiibre (TDF) sebesar 14,32 g/100 g sampel. Rendemen ekstrak lamun tertinggi terdapat pada ekstrak dengan pelarut metanol (9,76%) diikuti oleh etil asetat (0,57%) dan n-heksana (0,15%). Total fenol tertinggi terdapat pada ekstrak metanol (335,58 mg GAE/1000 g sampel) diikuti oleh etil asetat (37,24 mg GAE/1000 g sampel), dan n-heksana (2,63 mg GAE/1000 g sampel). Ekstrak metanol lamun C. rotundata memiliki 5 senyawa fitokimia, yaitu flavonoid, steroid, triterpenoid, fenol hidrokuinon, dan saponin. Aktivitas antioksidan dalam lamun ini ditunjukkan oleh nilai IC50. Aktivitas antioksidan
tertinggi terdapat pada ekstrak dengan pelarut metanol, diikuti oleh etil asetat dan n-heksana dengan nilai IC50 berturut-turut 203,32 ppm; 357,77 ppm; dan
SITI ANWARIYAH
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ii
Nama : Siti Anwariyah
NRP : C34070054
Departemen : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Joko Santoso, M.Si Dra. Pipih Suptijah, MBA NIP. 19670922 199203 1 003 NIP. 19531020 198503 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS., MPhil. NIP. 19580511 198503 1 002
iii
Puji dan syukur penulis panjatkan kepada Allah SWT atas nikmat, rahmat
dan hidayah-Nya, sehingga penulis dapat menyelesaikan penyusunan skripsi ini
dengan baik.
Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan gelar
Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi
hasil penelitian ini berjudul “Kandungan Fenol, Komponen Fitokimia dan Aktivitas
Antioksidan Lamun Cymodocea rotundata”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu penulis selama penyusunan skripsi ini , terutama kepada:
1 Dr. Ir. Joko Santoso, M.Si dan Dra. Pipih Suptijah, MBA selaku dosen
pembimbing, atas segala bimbingan, pengarahan serta masukan yang telah
diberikan kepada penulis.
2 Dr. Ir. Sri Purwaningsih, M.Si selaku dosen penguji yang telah memberikan
banyak saran.
3 Dr. Ir. Ruddy Suwandi, MS, M.Phil. selaku Ketua Departemen Teknologi
Hasil Perairan.
4 Dr. Ir. Agoes Mardiono Jacoeb, Dipl. Biol selaku Ketua Program Studi
Departemen Teknologi Hasil Perairan, yang telah banyak membantu penulis
selama proses penelitian.
5 Ir. Sri Andajani, M.Si selaku Kepala Balai Taman Nasional Kepulauan
Seribu, yang telah memberikan izin kepada penulis untuk mengambil
sampel di Pulau Pramuka.
6 Keluarga terutama Bapak, ibu, kakak dan adik yang telah memberikan
semangat, materil dan doa, serta membantu penulis dalam menyelesaikan
skripsi ini.
7 Chandra Serisa Rasi Kanya yang telah memberi semangat dan motivasi
kepada penulis selama menyelesaikan penelitian dan skripsi ini.
8 Ria, Dita, Fipo, dan Nabila atas kerja sama, persahabatan, dan bantuan
iv Laboratorium.
10 Zia, Ratna dan Elsa (Almh), atas persahabatan yang terjalin dan motivasi
yang selalu diberikan kepada penulis.
11 Anggun, Indri, Kanov, Wari, Hana, Putri, Ici, Ade, Widya, Junda, Depi, dan
Santi, atas motivasi dan keceriaan yang telah diberikan kepada penulis
selama di Aisyah.
12 Teman-teman THP 44 yang telah banyak memberikan informasi, pendapat
dan motivasi sehingga penelitian dan skripsi ini dapat terselesaikan.
13 Semua pihak yang telah membantu dalam penulisan skripsi ini, yang tidak
dapat disebutkan satu persatu.
Penulis menyadari bahwa masih ada kekurangan dalam penulisan skripsi
ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dari
berbagai pihak dalam proses penyempurnaan skripsi ini. Semoga tulisan ini
bermanfaat bagi pihak-pihak yang memerlukannya.
Bogor, Juli 2011
Siti Anwariyah
v
Penulis dilahirkan di Serang, Banten pada 10 Januari
1990. Penulis merupakan putri kedua dari pasangan Marin
dan Sarimah. Penulis memulai jenjang pendidikan formal di
SD Negeri Drangong I (tahun 1995-2001), selanjutnya
penulis melanjutkan pendidikannya di SMP Negeri 2 Serang
(tahun 2001-2004). Pendidikan menengah atas ditempuh
penulis di SMA Negeri 1 Serang (tahun 2004-2007). Pada
tahun 2007, penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas
Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI
(Undangan Seleksi Masuk IPB).
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi
kemahasiswaan seperti Forum for Scientific Studies (FORCES) sebagai anggota
divisi kewirausahaan periode 2007-2008, Himpunan Mahasiswa Teknologi Hasil
Perikanan (HIMASILKAN) sebagai anggota divisi pengembangan sumber daya
manusia periode 2009-2010 dan sebagai sekretaris umum periode 2010-2011, dan
Koperasi Mahasiswa (KOPMA) sebagai anggota entrepreneurship periode
2008-2009. Penulis juga aktif sebagai asisten m.k. Teknologi Industri Tumbuhan Laut
dan Teknologi Pengolahan Hasil Perairan tahun 2010-2011. Selain itu, penulis juga
aktif dalam kepanitiaan berbagai kegiatan kemahasiswaan di Institut Pertanian
Bogor.
Sebagai salah satu syarat untuk meraih gelar sarjana, penulis melakukan
penelitian yang berjudul “Kandungan Fenol, Komponen Fitokimia dan
vi
2.1 Deskripsi dan Klasifikasi Lamun Cymodocea rotundata ... 4
2.2 Antioksidan ... 5
2.3 Uji Aktivitas Antioksidan ... 7
2.4 Ekstraksi Bahan Aktif ... 8
2.5 Analisis Fitokimia ... 9
2.5.1 Alkaloid ... 10
2.5.2 Triterpenoid dan steroid ... 10
2.5.3 Flavonoid ... 11
3.3.6 Uji aktivitas antioksidan dengan metode DPPH ... 23
3.3.7 Uji fitokimia ... 23
3.4 Rancangan Percobaan dan Analisis Data ... 24
vii
4.2 Kandungan Serat Pangan Lamun Cymodocea rotundata ... 29
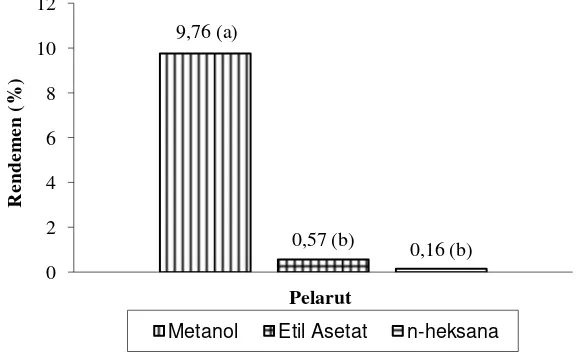
4.3 Rendemen Ekstrak Lamun Cymodocea rotundata ... 31
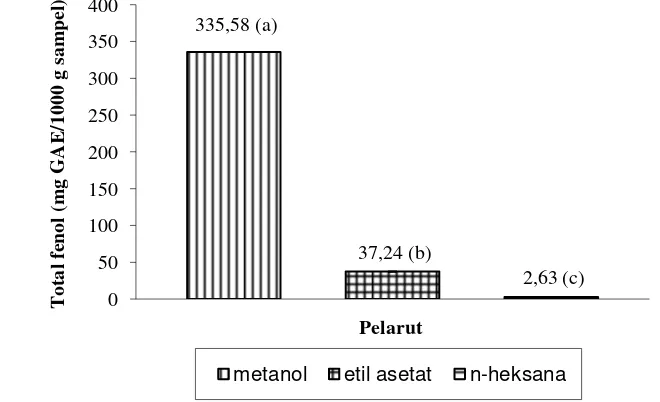
4.4 Total Fenol Lamun Cymodocea rotundata ... 32
4.5 Senyawa Fitokimia Lamun Cymodocea rotundata ... 34
4.6 Aktivitas Antioksidan Lamun Cymodocea rotundata ... 38
5 KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
viii
Halaman
1 Komposisi proksimat dan abu tak larut asam lamun C. rotundata .. 26
2 Kandungan serat pangan lamun C. rotundata ... 29
3 Senyawa fitokimia dalam ekstrak lamun C. rotundata pada
berbagai pelarut ... 35
4 Nilai IC50 larutan BHT dan ekstrak lamun C. rotundata ... 38
ix
Halaman
1 Cymodocea rotundata ... 5
2 Reaksi penghambatan antioksidan primer terhadap radikal bebas 7 3 Struktur Diphenylpycrilhydrazil dan Diphenylpycrilhydrazine ... 8
4 Diagram alir penelitian ... 17
5 Hasil rendemen ekstrak lamun C. rotundata ... 31
6 Total fenol ekstrak lamun C. rotundata dalam berbagai pelarut ... 32
x
Halaman
1 Dokumentasi penelitian ... 48
2 Perhitungan analisis proksimat ... 51
3 Perhitungan rendemen ekstrak kasar ... 53
4 Perhitungan kadar serat pangan ... 54
5 Perhitungan total fenol ekstrak lamun C. rotundata ... 56
6 Perhitungan pengenceran DPPH, BHT dan ekstrak kasar ... 59
7 Perhitungan persen inhibisi dan penentuan IC50 ... 60
8a Analisis ragam rendemen ekstrak lamun C. rotundata ... 65
8b Uji lanjut Duncan rendemen ekstrak ... 66
9a Analisis ragam aktivitas antioksidan lamun C. rotundata ... 66
9b Uji lanjut Duncan aktivitas antioksidan... 66
10a Analisis ragam total fenol lamun C. rotundata ... 66
1
PENDAHULUAN
1.1 Latar Belakang
Perubahan pola hidup manusia saat ini ternyata menjadi salah satu sumber
radikal bebas yang berperan dalam timbulnya berbagai penyakit. Sofia (2005)
menyatakan bahwa radikal bebas merupakan spesies kimia yang memiliki
elektron bebas di kulit terluar sehingga sangat reaktif. Badarinath et al. (2010)
menyatakan bahwa radikal bebas tipe turunan oksigen reaktif sangat signifikan
dalam tubuh. Oksigen reaktif ini mencakup superoksida (O·2), hidroksil (·OH),
peroksil (ROO·), hidrogen peroksida (H2O2), singlet oksigen (O2), oksida nitrit
(NO·), peroksinitrit (ONOO·) dan asam hipoklorit (HOCl).
Lim et al. (2002) menyatakan bahwa radikal bebas mampu bereaksi
dengan protein, lipida, karbohidrat, maupun deoxyribose nucleic acid (DNA).
Reaksi antara radikal bebas dan molekul tersebut berujung pada timbulnya suatu
penyakit seperti peradangan, penuaan dini, kanker, jantung koroner, dan penyakit
degeneratif lainnya. Salah satu pencegahan yang perlu dilakukan untuk
menghindari timbulnya penyakit-penyakit tersebut adalah pemberian atau
konsumsi antioksidan. Menurut Kuncahyo dan Sunardi (2007), antioksidan adalah
senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada
radikal bebas, sehingga radikal bebas tersebut dapat diredam.
Meenakshi et al. (2009) menggolongkan antioksidan menjadi dua jenis
berdasarkan sumbernya, yaitu antioksidan buatan (sintetik) dan antioksidan alami.
Antioksidan sintetik yang secara umum lebih sering digunakan adalah butylated
hydroxyl anysol (BHA), butylated hydroxyl toluene (BHT), Propyl gallate (PG),
dan butylated hydroxyl quione (BHQ). Adanya kekhawatiran akan kemungkinan
efek samping dari antioksidan sintetik menjadikan antioksidan alami menjadi
alternatif yang sangat dibutuhkan. Beberapa penelitian telah dilakukan terhadap
aktivitas antioksidan alami yang diperoleh dari bahan pangan seperti sayuran,
buah, rumput laut, dan hewan.
Lamun merupakan tumbuhan berbunga (Angiospermae) yang dapat
menyesuaikan dirinya untuk hidup di dalam air laut. Menurut Kurniawan (2010),
tersebut, tujuh genus diantaranya hidup di perairan tropis, yaitu Enhallus,
Thalassia, Thalassodendron, Halophila, Halodule, Cymodocea dan Syringodium.
Penelitian terhadap aktivitas antioksidan pada lamun sudah mulai dilakukan pada
beberapa spesis lamun, diantaranya Posidonia oceanic oleh Sureda et al. (2008)
dan Enhalus acoroides oleh Kannan et al. (2010)
Lamun Cymodocea rotundata merupakan salah satu jenis lamun yang
pemanfaatannya belum begitu banyak. Sejauh ini, lamun C. rotundata
dimanfaatkan sebagai pakan penyu hijau dan dugong. Lamun C. rotundata
yang terdapat di daerah tropis seperti di perairan Pulau Pramuka-Jakarta
mendapatkan paparan sinar ultra violet (UV) yang kuat sepanjang tahun. Lamun
ini diduga memproduksi metabolit sekunder untuk mempertahankan
hidupnya dari radiasi sinar UV yang dapat memicu terjadinya oksidasi.
Burkholder et al. (2007) menyatakan bahwa lamun C. rotundata mengandung
unsur nitrogen dan fosfor yang berasal dari sedimen habitatnya. Masih terbatasnya
data-data ilmiah yang mendukung pemanfaatan jenis lamun ini mendorong
perlunya dilakukan penelitian mengenai metabolit sekunder dalam lamun
C. rotundata.
Metabolit sekunder dalam suatu bahan dapat diperoleh dengan proses
ekstraksi. Lamun C. rotundata yang digunakan dalam penelitian ini diekstraksi
dengan menggunakan tiga jenis pelarut yang berbeda kepolarannya, yaitu metanol
(polar), etil asetat (semipolar) dan n-heksana (nonpolar). Perbedaan jenis pelarut
ini akan mempengaruhi karakteristik dari metabolit sekunder yang terdapat pada
lamun C. rotundata yang dimungkinkan memiliki aktivitas sebagai antioksidan.
Ekstraksi menggunakan pelarut dengan tingkat kepolaran berbeda
biasanya menggunakan sampel yang telah dikeringkan karena adanya resapan
membran sel sampel membuat ekstrak metabolit endoseluler yang dihasilkan lebih
banyak (Colegate dan Molyneux 2008). Menurut Gupta et al. (2011), proses
pengeringan dapat menurunkan aktivitas air yang dapat menghambat
pertumbuhan mikroba. Pengeringan juga dapat mengurangi volume penyimpanan
dan mengurangi reaksi-reaksi yang dapat merusak bahan seperti hidrolisis dan
oksidasi lemak (Winarno 2008). Penelitian mengenai aktivitas antioksidan juga
Sudirman (2011) dan Permatasari (2011), buah oleh Kuncahyo dan Sunardi
(2007), rumput laut oleh Meenakshi et al. (2009) dan Hwang et al. (2010),
maupun hewan seperti spons oleh Hanani et al. (2005) dan keong ipong-ipong
oleh Apriandi (2011). Penelitian ini diharapkan dapat memberikan informasi
yang dapat meningkatkan pemanfaatan lamun C. rotundata di masa mendatang.
1.2 Tujuan
Penelitian ini bertujuan untuk:
a. mengetahui komposisi proksimat (air, abu, lemak, dan protein), abu tak
larut asam dan serat pangan lamun Cymodocea rotundata;
b. mengetahui pengaruh perbedaan jenis pelarut terhadap nilai total fenol,
senyawa fitokimia dan aktivitas antioksidan ekstrak lamun
2
TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Lamun Cymodocea rotundata
Cymodoceae rotundata merupakan salah satu jenis lamun yang terdapat di
Indonesia. Lamun jenis ini disebut juga sebagai round tiped grass. Lamun adalah
tumbuhan berbunga (Angiospermae) yang sudah sepenuhnya menyesuaikan
diri hidup terbenam di dalam laut. Lamun memiliki beberapa sifat yang dapat
membuatnya mampu hidup di lingkungan laut, yaitu mampu hidup di media
air bersalinitas tinggi, mampu berfungsi normal dalam keadaan terbenam,
mempunyai sistem perakaran jangkar yang berkembang baik, serta mampu
melaksanakan penyerbukan dan daur generatif dalam keadaan terbenam
(Dahuri 2003).
Klasifikasi C. rotundata menurut Les dan Waycott (2004) adalah sebagai
berikut:
Kingdom : Plantae
Divisi : Magnoliophyta (Angiosperms) Kelas : Liliopsida
Subkelas : Alismatidae
Ordo : Potamogetonales Famili : Cymodoceaceae Genus : Cymodocea
Spesies : Cymodocea rotundata
C. rotundata memiliki ciri tanaman ramping, mirip dengan C. serrulata,
daun seperti garis lurus dan lengkap dengan panjang 6-15 cm dan lebar 2-4 mm,
lurus sampai agak bulat, tidak menyempit sampai ujung daun, ujung daun bulat
dan seludang daun keras. C. rotundata juga memiliki rimpang yang ramping
(diameter 1-2 mm, panjang antar ruas 1-4 cm) dengan tunas pendek yang tegak
dan setiap ruas terdiri atas 2-5 daun. Buah C. rotundata berbulu tanpa tangkai,
berada dalam seludang daun, berbentuk setengah lingkaran dan agak keras serta
bagian bawah berlekuk dengan 3-4 geligi runcing (COREMAP 2007). Morfologi
Gambar 1 Cymodocea rotundata Sumber : Les dan Waycott (2004)
Lamun merupakan tumbuhan autotrof yang dapat melakukan fotosintesis.
Lamun dapat memfiksasi sejumlah karbon organik dan sebagian besar memasuki
rantai pakan baik melalui pemangsaan langsung oleh herbivora maupun melalui
proses dekomposisi. Serasah yang diproduksi oleh lamun diduga membantu
meningkatkan kelimpahan fito dan zooplankton di permukaan terumbu karang
sehingga lamun berperan sebagai produsen primer. Lamun juga memiliki
peran penting bagi kehidupan penyu hijau (Chelonia mydas) dan dugong
(Dugong dugong). Jenis-jenis lamun yang dikonsumsi penyu hijau diantaranya
adalah Cymodocea, Thalassia, dan Halophila, sedangkan jenis lamun yang
dikonsumsi oleh dugong diantaranya adalah Posidonia dan Halophila. Daun dan
rhizoma lamun memiliki kandungan nitrogen yang tinggi sehingga disukai oleh
hewan-hewan tersebut (Dahuri 2003).
2.2 Antioksidan
Antioksidan menurut Kuncahyo dan Sunardi (2007) adalah senyawa kimia
yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas,
sehingga radikal bebas tersebut dapat diredam. Sofia (2005) mendefinisikan
antioksidan sebagai inhibitor yang bekerja menghambat oksidasi dengan cara
bereaksi dengan radikal bebas reaktif membentuk radikal bebas tak reaktif yang
relatif stabil.
Berdasarkan sumber perolehannya, antioksidan dibedakan menjadi dua
macam yaitu antioksidan buatan (sintetik) dan antioksidan alami. Tubuh manusia
tidak mempunyai cadangan antioksidan dalam berjumlah berlebih, sehingga jika
Beberapa contoh antioksidan sintetik yang diizinkan penggunaannya untuk
pangan yaitu butil hidroksi anisol (BHA), butil hidroksi toluen (BHT), propil
galat, tert-butil hidroksi quinon (TBHQ) dan tokoferol. Antioksidan alami di
dalam makanan dapat berasal dari senyawa antioksidan yang sudah ada dari satu
atau dua komponen makanan, senyawa antioksidan yang terbentuk dari
reaksi-reaksi selama proses pengolahan, senyawa antioksidan yang diisolasi dari sumber
alami dan ditambahkan ke makanan sebagai bahan tambahan pangan (Pratt 1992).
Menurut Sofia (2005), antioksidan terbagi menjadi antioksidan enzim dan
vitamin. Antioksidan enzim meliputi superoksida dismutase (SOD), katalase dan
glutation peroksidase (GSH.Prx). Superoksida dismutase berperan dalam
melawan radikal bebas pada mitokondria, sitoplasma dan bakteri aerob dengan
mengurangi bentuk radikal bebas superoksida. Katalase merupakan enzim yang
mengubah hidrogen peroksida menjadi air dan oksigen. Fungsinya menetralkan
hidrogen peroksida beracun dan mencegah formasi gelembung CO2 dalam darah.
GSH.Prx mengandung Se dan bekerja dengan cara menggerakkan H2O2 dan lipid
peroksida dibantu dengan ion logam-logam transisi. Antioksidan vitamin lebih
populer sebagai antioksidan dibandingkan enzim. Antioksidan vitamin mencakup
alfa tokoferol (vitamin E), beta karoten dan asam askorbat (vitamin C) yang
banyak didapatkan dari tanaman dan hewan.
Kuncahyo dan Sunardi (2007) menyatakan bahwa fungsi utama
antioksidan adalah sebagai upaya untuk memperkecil terjadinya proses oksidasi
dari lemak dan minyak, memperkecil terjadinya proses kerusakan dalam
makanan, memperpanjang masa pemakaian dalam industri makanan,
meningkatkan stabilitas lemak yang terkandung dalam makanan serta mencegah
hilangnya kualitas sensori dan nutrisi. Antioksidan juga dapat menetralkan radikal
bebas, seperti enzim SOD, glutation peroksidase, dan katalase. Antioksidan dapat
diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E
dan berkaroten serta senyawa fenolik. Lawrence et al. (2000) menambahkan
bahwa antioksidan juga pada akhirnya berfungsi untuk menetralisir atau meredam
dampak negatif dari radikal bebas.
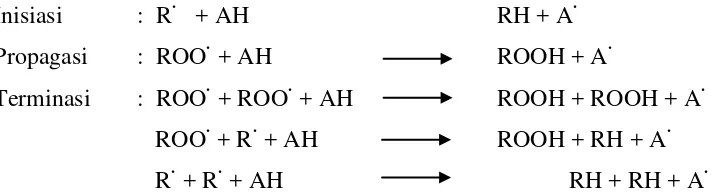
Barus (2009) mengelompokkan fungsi antioksidan berdasarkan
antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan (AH) yang
mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer.
Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R·,
ROO·) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal
antioksidan (A·) tersebut memiliki keadaan lebih stabil dibanding radikal bebas.
Fungsi sekunder merupakan fungsi memperlambat laju autooksidasi dengan
berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan
pengubahan radikal bebas kebentuk lebih stabil. Reaksi penghambatan
antioksidan terhadap radikal bebas dapat dilihat pada Gambar 2.
Gambar 2 Reaksi penghambatan antioksidan primer terhadap radikal bebas
(Sumber: Barus 2009)
2.3 Uji Aktivitas Antioksidan
Badarinath et al. (2010) mengelompokkan metode pengujian aktivitas
antioksidan kedalam tiga golongan. Golongan pertama adalah Hydrogen atom
Transfer methods (HAT) misalnya oxygen radical absorbance capacity (ORAC)
method dan lipidperoxidation inhibition capacity (LPIC) assay. Golongan kedua
adalah Electron Transfer methods (ET) misalnya ferric reducing antioxidant
power dan diphenylpicrylhydrazil (DPPH) free radical scavenging assay.
Golongan ketiga adalah metode lain seperti total oxidant scavenging capacity
(TOSC) dan chemiluminescence.
Molyneux (2004) menyatakan bahwa metode yang umum digunakan
dalam pengujian aktivitas antioksidan adalah diphenylpicrylhydrazil (DPPH) free
radical scavenging assay. Pada metode ini, larutan DPPH yang berperan sebagai
radikal bebas akan bereaksi dengan senyawa antioksidan sehingga DPPH akan
berubah menjadi diphenilpycrilhydrazine yang bersifat non-radikal. Peningkatan
jumlah diphenilpycrilhydrazine akan ditandai dengan berubahnya warna ungu
Inisiasi : R· + AH RH + A·
Propagasi : ROO· + AH ROOH + A·
Terminasi : ROO· + ROO· + AH ROOH + ROOH + A·
ROO· + R· + AH ROOH + RH + A·
menjadi warna kuning pucat. Struktur diphenylpicrylhydrazil dan
diphenilpycrilhydrazine dapat dilihat pada Gambar 3.
Gambar 3. Struktur Diphenylpycrilhydrazil dan Diphenylpycrilhydrazine Sumber : Molyneux (2004)
Molyneux (2004) menyatakan bahwa secara umum hasil dari metode
DPPH diinterpretasikan dalam parameter IC50 (Inhibition Concentration) atau
EC50 (Efficient Concentration 50). IC50 atau EC50 didefinisikan sebagai
konsentrasi larutan substrat atau sampel yang akan menyebabkan tereduksi
aktivitas DPPH sebesar 50%. Semakin besar aktivitas antioksidan maka nilai IC50
atau EC50 akan semakin kecil.
2.4 Ekstraksi Bahan Aktif
Ekstraksi menurut Rahayu (2009) merupakan pemisahan suatu zat dari
campurannya dengan pembagian sebuah zat terlarut antara dua pelarut yang tidak
dapat tercampur untuk mengambil zat terlarut tersebut dari satu pelarut ke pelarut
yang lain. Beberapa hal yang harus diperhatikan dalam penyiapan pelarut dan
bahan yang akan diekstrak diantaranya adalah selektivitas, kelarutan, kemampuan
tidak saling bercampur, kerapatan, reaktivitas, dan titik didih.
Jenis ekstraksi meliputi ekstraksi secara dingin dan ekstraksi secara panas.
Ekstraksi secara dingin terdiri atas metode maserasi, metode sokhletasi dan
metode perkolasi, sedangkan ekstraksi secara panas terdiri atas metode refluks dan
metode destilasi uap. Maserasi merupakan ekstraksi sederhana yang dilakukan
dengan cara merendam sampel dalam suatu pelarut selama beberapa hari pada
temperatur kamar dan terlindung dari cahaya. Metode maserasi bertujuan untuk
mengekstrak sampel yang mengandung komponen kimia yang mudah larut dalam
Sokhletasi merupakan ekstraksi yang dilakukan secara berkesinambungan.
Pelarut dipanaskan sehingga menguap kemudian uap pelarut terkondensasi
menjadi molekul-molekul air. Keuntungan metode ini adalah dapat digunakan
untuk sampel dengan tekstur yang lunak dan tidak tahan terhadap pemanasan
secara langsung. Perkolasi merupakan metode ekstraksi dengan mengalirkan
pelarut melalui sampel yang telah dibasahi. Keuntungan metode ini adalah
tidak memerlukan langkah tambahan yaitu sampel padat telah terpisah dari
ekstrak. Kerugiannya adalah kontak antara sampel padat tidak merata atau
terbatas dibandingkan dengan metode refluks dan pelarut menjadi dingin selama
proses perkolasi sehingga tidak melarutkan komponen secara efisien
(Suradikusumah 1989).
Metode refluks digunakan untuk mengekstraksi sampel-sampel yang
mempunyai tekstur kasar dan tahan pemanasan langsung. Kerugian metode ini
adalah membutuhkan volume total pelarut yang besar dari sejumlah manipulasi
dari operator. Destilasi uap adalah metode yang populer untuk ekstraksi
minyak-minyak esensial dari sampel tanaman. Metode ini diperuntukkan untuk mencari
bahan yang mengandung komponen kimia yang mempunyai titik didih tinggi pada
tekanan udara normal (Sudjadi 1986).
2.5 Senyawa Fitokimia
Fitokimia merupakan bagian ilmu pengetahuan alam yang menguraikan
aspek kimia suatu tanaman. Kajian fitokimia meliputi uraian tentang isolasi dan
konstitusi senyawa kimia dalam tanaman, perbandingan struktur senyawa kimia
tanaman dan perbandingan komposisi senyawa kimia dari bermacam-macam jenis
tanaman atau penelitian untuk pengembangan senyawa kimia dalam tanaman
(Sirait 2007).
Analisis fitokimia adalah analisis yang mencangkup aneka ragam senyawa
organik yang dibentuk dan ditimbun oleh makhluk hidup, yaitu mengenai struktur
kimianya, biosintesisnya, perubahan serta metabolismenya, penyebarannya secara
alamiah dan fungsi biologisnya. Analisis fitokimia dilakukan untuk menentukan
ciri senyawa aktif penyebab efek racun atau efek bermanfaat, yang ditunjukkan
2.5.1 Alkaloid
Alkaloid merupakan senyawa kimia tanaman hasil metabolit sekunder
yang terbentuk berdasarkan prinsip pembentukan campuran. Alkaloid terbagi
menjadi tiga bagian, yaitu elemen yang mengandung N terlibat pada pembentukan
alkaloid, elemen tanpa N yang ditemukan dalam molekul alkaloid dan reaksi yang
terjadi untuk pengikatan khas elemen-elemen pada alkaloid (Sirait 2007).
Hampir semua alkaloid yang ditemukan di alam mempunyai keaktifan
biologis tertentu, ada yang sangat beracun tetapi ada pula yang sangat berguna
dalam pengobatan. Misalnya kuinin, morfin dan stiknin adalah alkaloid yang
terkenal dan mempunyai efek fisiologis dan psikologis. Alkaloid tidak
mempunyai tata nama sistematik, oleh karena itu, suatu alkaloid dinyatakan
dengan nama trivial yang beakhiran -in (Lenny 2006).
2.5.2 Triterpenoid dan steroid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Triterpenoid merupakan senyawa tanpa warna, berbentuk kristal,
sering kali bertitik leleh tinggi dan aktif optik yang umumnya sukar dicirikan
karena tak ada kereaktifan kimianya. Triterpenoid digolongkan menjadi empat
golongan, yaitu triterpena sebenarnya, steroid, saponin, dan glikosida jantung
(Harborne 1987).
Steroid adalah molekul kompleks yang larut di dalam lemak dengan empat
cincin yang saling bergabung. Steroid yang paling banyak adalah sterol yang
merupakan steroid alkohol. Kolesterol merupakan sterol utama pada jaringan
hewan. Kolesterol dan senyawa turunan esternya, dengan lemaknya yang berantai
panjang adalah komponen penting dari plasma lipoprotein dan dari membran sel
sebelah luar. Membran sel tumbuhan mengandung jenis sterol lain terutama
stigmasterol yang berbeda dari kolesterol hanya dalam ikatan ganda di antara
karbon 22 dan 23 (Lehninger 1982).
2.5.3 Flavonoid
Flavonoid merupakan senyawa yang terdiri dari C6-C3-C6. Flavonoid
pada satu atau lebih grup hidroksil fenolik. Kegunaan flavonoid bagi tumbuhan
adalah untuk menarik serangga yang membantu proses penyerbukan dan untuk
menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia,
flavonoid dalam dosis kecil bekerja sebagai stimulan pada jantung dan pembuluh
darah kapiler (Sirait 2007).
Penggolongan jenis flavonoid dalam jaringan tumbuhan mula-mula
didasarkan pada telaah sifat kelarutan dan reaksi warna. Terdapat sekitar sepuluh
kelas flavonoid yaitu antosianin, proantosianidin, flavonol, flavon, glikoflavon,
biflavonil, khalkon, auron, flavanon, dan isoflavon. Senyawa flavonoid dapat
diekstraksi dengan etanol 70% dan tetap ada dalam lapisan air setelah ekstrak ini
dikocok dengan eter minyak bumi. Flavonoid berupa senyawa fenol, oleh karena
itu warnanya berubah bila ditambah basa atau amoniak (Harborne 1987).
2.5.4 Saponin
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam
lebih dari 90 suku tumbuhan. Glikosida adalah suatu kompleks antara gula
pereduksi (glikon) dan bukan gula (aglikon). Glikon bersifat mudah larut dalam
air dan glikosida-glikosida mempunyai tegangan permukaan yang kuat. Banyak
saponin yang mempunyai satuan gula sampai lima dan komponen yang umum
ialah asam glukuronat. Adanya saponin dalam tumbuhan ditunjukkan dengan
pembentukan busa yang mantap sewaktu mengekstraksi tumbuhan atau
memekatkan ekstrak (Harborne 1987).
Saponin dapat menyebabkan hidrolisis pada sel darah. Saponin yang
paling penting adalah hesogenin. Hesogenin mempunyai gugus keton pada C12
yang dapat ditransportasikan ke C11 membentuk 11-keto tigogenin yang dapat
diubah menjadi kortison. Saponin jauh lebih polar daripada sapogenin karena
ikatan glikosidanya dan lebih mudah dipisahkan dengan kromatografi kertas atau
kromatografi lapis tipis selulosa (Suradikusumah 1989).
2.5.5 Fenol hidrokuinon
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar.
Kuinon untuk tujuan identifikasi dibagi menjadi empat kelompok, yaitu
berkonjugasi dengan dua ikatan rangkap karbon-karbon), naftokuinon,
antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama biasanya
terhidroksilasi dan bersifat senyawa fenol serta mungkin terdapat in vivo dalam
bentuk gabungan dengan gula sebagai glikosida atau dalam bentuk kuinol tanpa
warna, kadang-kadang juga bentuk dimer. Dengan demikian diperlukan hidrolisis
asam untuk melepaskan kuinon bebasnya (Harborne 1987).
Kuinon disintesis tumbuhan dari berbagai prekursor dan berbagai jalur
seperti jalur asetat-polimalonat, jalur asam amino, jalur sikimat, dan melanovat.
Jalur asetat-polimalonat merupakan jalur yang paling umum. Suatu senyawa
poliketometilen dianggap sebagai intermediet antara ester CoA dengan fenol atau
kuinon (Suradikusumah 1989). Senyawa kuinon yang terdapat sebagai glikosida
mungkin larut sedikit dalam air, tetapi umumnya kuinon lebih mudah larut dalam
lemak dan akan terdeteksi dari tumbuhan bersama-sama dengan karotenoid dan
klorofil. Reaksi yang khas adalah reduksi bolak-balik yang mengubah kuinon
menjadi senyawa tanpa warna, kemudian warna kembali lagi bila terjadi oksidasi
oleh udara. Reduksi dapat dilakukan menggunakan natrium borohidrida dan
oksidasi ulang dapat terjadi hanya dengan mengocok larutan tersebut di udara
(Harborne 1987).
2.6 Serat Pangan (Dietary Fibre)
Serat pangan (Dietary fibre) merupakan salah satu bagian yang dapat
dikonsumsi dari tumbuhan atau dapat disebut karbohidrat yang tidak dapat dicerna
dan diserap oleh usus halus manusia namun akan difermentasikan secara
sempurna maupun parsial dalam usus besar (Kamp et al. 2004). Serat tergolong
zat non-gizi yang berguna untuk diet. Para ahli mengelompokkan serat pangan
sebagai salah satu jenis polisakarida yang disebut karbohidrat kompleks.
Karbohidrat ini terbentuk dari beberapa gugusan gula sederhana yang bergabung
menjadi satu membentuk rantai kimia panjang yang sulit dicerna oleh enzim
pencernaan. Berdasarkan jenis kelarutannya, serat pangan digolongkan menjadi
dua, yaitu serat pangan tidak larut air (insoluble dietary fibre) dan serat pangan
larut air (soluble dietary fibre) (Sulistijani 2002).
Serat pangan larut air lebih efektif dalam mereduksi plasma kolesterol
lipoprotein (HDL). Soluble dietary fibre (SDF) juga bermanfaat bagi penderita
diabetes melitus karena SDF dapat mereduksi absorpsi glukosa dalam usus.
Manfaat lain SDF menurut Muchtadi (2001) adalah membuat perut merasa cepat
kenyang sehingga bermanfaat untuk mempertahankan berat badan normal. SDF
terdiri atas komponen-komponen sebagai berikut (Sulistijani 2002):
1) Pektin
Pektin merupakan polimer dari glukosa dan asam galakturonat dengan
jumlah asam galakturonat yang lebih banyak. Pektin terdapat dalam sel primer
tanaman dan berfungsi sebagai perekat antara dinding sel tanaman. Sifatnya yang
membentuk gel dapat mempengaruhi metabolisme zat gizi.
2) Musilase
Musilase ditemukan dalam lapisan endosperm biji tanaman. Strukturnya
menyerupai hemiselulosa tetapi tidak termasuk dalam golongan tersebut karena
letak dan fungsinya berbeda. Musilase mampu mengikat air sehingga kadar air
dalam biji tanaman tetap bertahan dan mampu membentuk gel yang
mempengaruhi metabolisme dalam tubuh.
3) Gum
Gum terdapat pada bagian lamella tengah atau di antara dinding sel
tanaman. Gum berguna sebagai penutup dan pelindung bagian tanaman yang
terbuka. Gum mampu membentuk gel karena memiliki molekul hidrofilik yang
berkombinasi dengan air.
Insoluble dietary fibre (IDF) menurut Muchtadi (2001) tidak terlalu
signifikan sebagai agen hipokolesterolemik, tetapi peranannya sangat penting
dalam pencegahan disfungsi alat pencernaan seperti konstipasi (sulit buang air
besar), haemoroid (ambeien), kanker usus besar, dan infeksi usus buntu. IDF
terdiri atas komponen-komponen sebagai berikut (Sulistijani 2002):
1) Selulosa
Selulosa merupakan serat-serat panjang yang terbentuk dari homopolimer
glukosa rantai linier. Fungsi selulosa dalam tanaman adalah untuk memperkuat
dinding sel tanaman, sedangkan di dalam pencernaan, selulosa berperan sebagai
2) Hemiselulosa
Hemiselulosa memiliki rantai molekul lebih pendek dibanding selulosa.
Unit monomer pembentuk hemiselulosa terdiri dari heksosa dan pentosa.
Hemiselulosa berfungsi memperkuat dinding sel tanaman dan sebagai cadangan
pangan bagi tanaman.
3) Lignin
Lignin termasuk senyawa aromatik yang tersusun dari polimer fenil
propan. Lignin bersama hemiselulosa berfungsi membentuk jaringan tanaman dan
memperkuat sel kayu. Serealia dan kacang-kacangan merupakan bahan makanan
3
METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari sampai dengan bulan Mei
2011. Pengambilan sampel dilakukan di Pulau Pramuka, Taman Nasional
Kepulauan Seribu, Jakarta. Preparasi sampel dilakukan di Laboratorium
Karakteristik Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan
IPB. Uji proksimat dilakukan di Laboratorium Biokimia Hasil Perairan dan
Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan IPB.
Pengujian serat pangan dilakukan di Laboratorium Biokimia Pangan, Departemen
Ilmu dan Teknologi Pangan IPB. Ekstraksi sampel dilakukan di Laboratorium
Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan IPB.
Evaporasi dan pengujian aktivitas antioksidan dilakukan di Laboratorium Uji
Biofarmaka, Pusat Studi Biofarmaka IPB. Pengujian total fenol dan fitokimia
dilakukan di Laboratorium Kimia Analitik, Departemen Kimia IPB.
3.2 Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah lamun
C. rotundata dari Pulau Pramuka, Taman Nasional Kepulauan Seribu, Jakarta.
Bahan-bahan yang digunakan untuk analisis proksimat adalah dietil eter, K2SO4,
HgO, H2SO4, H2O2, H3BO3, bromcherosol green, methyl red, NaOH-Na2S2O3,
AgNO3, dan HCl. Bahan-bahan untuk uji serat pangan (dietary fibre) adalah
etanol, akuades, aseton, buffer phospat, NaH2PO4 anhidrat, enzim thermamyl,
HCl, pepsin, NaOH, dan pankreatin. Bahan-bahan yang digunakan untuk ekstraksi
adalah metanol, etil asetat dan n-heksana. Bahan-bahan untuk uji total fenol
adalah etanol, akuades, Na2CO3 5%, reagen Folin-Ciocalteau 50%, dan asam
galat. Bahan-bahan untuk uji aktivitas antioksidan adalah ekstrak C. rotundata,
diphenil- picrylhydrazil (DPPH), etanol, dan butylated hydroxytoluene (BHT)
sebagai standar. Bahan-bahan untuk uji fitokimia adalah asam sulfat, pereaksi
dragendorff, meyer, wagner, molisch, kloroform, anhidra asetat, asam sulfat, amil
alkohol, dan FeCl3.
Alat-alat yang diperlukan dalam penelitian ini meliputi timbangan analitik,
inkubator, spektrofotometer UV-Visible, plate microwell, sudip, alumunium foil,
tabung reaksi, gelas ukur, pipet volumetrik, pipet mikro, gegep, tissue, kapas
bebas lemak, kompor listrik, kantung plastik, tanur, cawan porselen, elisa reader
dan vorteks.
3.3 Tahapan Penelitian
Penelitian ini terdiri dari beberapa tahapan, yaitu tahap pengambilan dan
preparasi sampel, tahap analisis kimia berupa analisis proksimat (kadar air, lemak,
protein, karbohidrat, dan abu), abu tidak larut asam dan serat pangan, tahap
pembuatan ekstrak kasar sampel, uji total fenol, aktivitas antioksidan, dan uji
fitokimia. Tahapan penelitian ini dapat dilihat pada Gambar 4.
3.3.1 Pengambilan dan preparasi lamun C. rotundata
Pengambilan lamun C. rotundata dilakukan di Pulau Pramuka, Taman
Nasional Kepulauan Seribu, Jakarta. Lamun yang telah dikumpulkan segera
dibersihkan dengan air laut untuk menghilangkan kotoran-kotoran dan
dibersihkan kembali dengan air tawar untuk menghilangkan garam-garam yang
masih menempel. Sampel segar dimasukkan dalam kantung plastik kemudian
disimpan dalam cool-box. Pengeringan dilakukan dengan menjemur lamun
C. rotundata segar dibawah sinar matahari selama 3 hari kemudian diblender
hingga halus.
3.3.2 Analisis proksimat dan abu tak larut asam
Analisis proksimat merupakan suatu analisis yang dilakukan untuk
memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar
air, abu, lemak, dan protein.
1) Analisis kadar air (BSN 2006)
Analisis kadar air dilakukan mengacu pada SNI 01-2354.2-2006 yang
dimodifikasi. Cawan porselen kosong dikeringkan dalam oven selama 15 menit
lalu didinginkan dalam desikator selama 20 menit dan ditimbang. 5 gram sampel
disimpan dalam cawan kemudian dikeringkan dalam oven pada suhu 100 oC dan
Gambar 4 Diagram alir penelitian Analisis:
a. Proksimat
b. Abu tak larut asam c. Serat pangan
Pengeringan dengan sinar matahari Lamun
Cymodocea rotundata
Lamunkering Lamun segar
Ekstrak kasar metanol
Ekstrak kasar n-heksana Ekstrak kasar
etil asetat
Analisis: a. Rendemen b. Total fenol c. Fitokimia
d. Aktivitas antioksidan Evaporasi
Sampel + metanol Sampel + etil asetat Sampel + n-heksana
Maserasi
Penyaringan
Selanjutnya cawan dan isinya didinginkan dalam desikator dan ditimbang.
Perhitungan kadar air menggunakan rumus berikut ini.
Kadar air (%) = B−C
B−Ax 100%
Keterangan : A = berat cawan kosong (g)
B = berat cawan + sampel awal (g) C = berat cawan + sampel kering (g)
2) Analisis kadar abu (AOAC 1995)
Cawan pengabuan dikeringkan di dalam oven selama satu jam pada suhu
105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang
hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke
dalam cawan pengabuan dan dipijarkan di atas nyala api kompor listrik hingga
tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan
suhu 400 oC selama satu jam, kemudian ditimbang hingga didapatkan berat yang
konstan. Penentuan kadar abu dihitung dengan menggunakan rumus berikut.
Berat abu (g) = berat sampel dan cawan akhir (g) – berat cawan kosong (g)
Kadar abu (%) = berat abu (g)
berat sampel (g) x 100%
3) Analisis kadar lemak (AOAC 1995)
Analisis kadar lemak dilakukan dengan metode soxhlet. Abu lemak
dikeringkan dalam oven lalu didinginkan dalam desikator dan ditimbang. 1 gram
sampel dalam bentuk tepung ditimbang langsung dalam saringan timbel yang
sesuai ukurannya kemudian ditutup dengan kapas wool yang bebas lemak.
Timbel yang berisi sampel diletakkan dalam alat ekstraksi soxhlet kemudian alat
kondensor dipasang di atasnya dan labu lemak dibawahnya. Pelarut dietil eter
atau n-heksana dituangkan ke dalam labu lemak secukupnya dan refluks
dilakukan selama 6 jam sampai pelarut yang turun ke labu lemak berwarna jernih.
Pelarut hasil destilasi ditampung kemudian labu lemak yang berisi lemak hasil
ekstraksi dipanaskan dalam oven pada suhu 105 oC. Setelah dikeringkan
sampai berat tetap dan didinginkan dalam desikator, labu beserta lemaknya
ditimbang sehingga berat lemak dapat dihitung. Kadar lemak dihitung dengan
Kadar lemak % = W1−W2
4) Analisis kadar protein (AOAC 1995)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap,
yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan
metode kjeldahl. Sampel ditimbang sebanyak 1 gram, kemudian dimasukkan ke
dalam labu kjeldahl 50 ml lalu ditambahkan 7 gram K2SO4, kjeltab 0,005 g jenis
HgO, 15 ml H2SO4 pekat dan 10 ml H2O2 ditambahkan secara perlahan ke dalam
green 0,1 % dan methyl red 0,1 % dengan perbandingan 2:1. Destilasi dilakukan
dengan menambahkan 50 ml larutan NaOH-Na2S2O3 ke dalam alat destilasi
hingga tertampung 100-150 ml destilat di dalam erlenmeyer dengan hasil destilat
berwarna hijau. Lalu destilat dititrasi dengan HCl 0,2 N sampai terjadi perubahan
warna merah muda yang pertama kalinya. Volume titran dibaca dan dicatat.
Kadar protein dihitung dengan rumus sebagai berikut :
N (%) = ml HCl−ml blanko x N HCl x FP x 14,007 x 100%
mg contoh
Keterangan: Protein (%) = N (%) x 6,25
5) Analisis kadar abu tidak larut asam (BSN 2000)
Analisis kadar abu tidak larut asam dilakukan berdasarkan
SNI 01-3836-2000. Abu yang diperoleh pada penetapan kadar abu, dididihkan
dengan 25 ml HCl encer selama 5 menit, dikumpulkan bagian yang tidak larut
asam, disaring melalui krus kaca masir atau kertas saring bebas abu. Selanjutnya
dilakukan pencucian dengan air panas, dipijarkan dan ditanur hingga bobot tetap
lalu ditimbang. Perhitungan kadar abu tidak larut asam dilakukan menggunakan
Kadar abu tidak larut asam (%) = berat abu (g)
berat sampel (g) x 100%
3.3.3 Analisis serat pangan (dietary fibre) (Asp et al. 1983)
Analisis serat pangan dilakukan mengacu pada metode multi enzim
(Asp et al. 1983). Serat pangan terdiri atas serat pangan larut dan serat pangan tak
larut. Analisis serat pangan diawali dengan menghaluskan sampel kemudian
dihomogenkan dan diliofilisasi. Sampel yang akan digunakan adalah sampel
dalam keadaan tanpa lemak dan air. Oleh karena itu, dilakukan ekstraksi lemak
dan pengeringan. Sampel tanpa lemak dan air ditimbang sebanyak 1 gram lalu
ditambahkan 25 ml buffer phospat dan 0,1 ml enzim thermamil. Selanjutnya
sampel dipanaskan pada suhu 80 0C selama 15 menit. Setelah dipanaskan, sampel
didinginkan dan dilakukan pengaturan pH menjadi 1,5 dengan menggunakan
HCl 4N lalu dilakukan penambahan 1 ml suspensi pepsin dan sampel diinkubasi
dalam suhu 37 0C selama 2 jam. Selanjutnya dilakukan pengaturan pH menjadi
6,8 dengan menggunakan NaOH 4N. Setelah dilakukan pengaturan pH, sampel
ditambahkan suspensi pankreatin dan diinkubasi dalam suhu 37 0C selama 2 jam
kemudian dilakukan pengaturan pH kembali dengan menggunakan HCl 4N
hingga diperoleh larutan sampel dengan pH 4,5.
1) Analisis serat pangan tak larut air (IDF)
Analisis serat pangan tak larut air dilakukan dengan menyaring larutan
sampel pH 4,5 dengan kertas saring Whatman 40 hingga diperoleh filtrat dan
residu. Residu yang diperoleh dibilas dengan akuades dan dicuci dengan 50 ml
etanol 78%. Selanjutnya dilakukan pencucian kembali dengan menggunakan
aseton lalu dipanaskan dalam oven dengan suhu 105 0C selama 3 jam. Setelah
dioven, sampel didinginkan dan ditimbang kemudian diarangkan dan ditanur
dalam suhu 550 0C. Selanjutnya sampel didinginkan dan ditimbang lalu dilakukan
perhitungan dengan rumus berikut. Serat pangan tak larut air dinyatakan dalam
C = Berat kertas saring + residu setelah dioven D = Berat cawan porselen kosong
E = Cawan porselen + abu setelah ditanur
2) Analisis serat pangan larut air (SDF)
Analisis serat pangan larut air dilakukan dengan penambahan 400-500 ml
etanol 95% pada filtrat yang diperoleh dari analisis serat pangan tak larut.
Selanjutnya sampel dipanaskan hingga 60 0C dalam waterbath kemudian
didiamkan selama 1 jam. Sampel disaring dengan kertas saring Whatman 40
hingga diperoleh residu dan filtrat. Residu yang diperoleh kemudian dibilas
dengan akuades dan dicuci dengan 50 ml etanol 78% lalu dicuci kembali
dengan aseton. Selanjutnya sampel dipanaskan dalam oven dengan suhu 105 0C
selama 3 jam. Sampel didinginkan dan ditimbang kemudian diarangkan dan
ditanur dalam suhu 550 0C. Sampel yang telah dingin selanjutnya ditimbang dan
dilakukan perhitungan dengan rumus berikut. Serat pangan larut air dinyatakan
dalam g/100 g sampel.
F = Berat kertas saring kosong
G = Berat kertas saring + residu setelah dioven H = Berat cawan porselen kosong
I = Cawan porselen + abu setelah ditanur
3.3.4 Ekstraksi bahan aktif (Andayani et al. 2008)
Ekstraksi bahan aktif dilakukan dengan mengacu pada penelitian
Andayani et al. (2008) yang dimodifikasi. Proses ini menggunakan tiga jenis
pelarut yaitu metanol (polar), etil asetat (semipolar) dan n-heksana (non-polar).
Lamun yang telah dikeringkan dan dihaluskan kemudian ditimbang sebanyak
20 gram lalu dimasukkan ke dalam erlenmeyer dan ditambahkan 160 ml pelarut
(1:8). Sampel dimaserasi selama 48 jam dengan menggunakan automatic shaker
pada suhu kamar. Sampel disaring dengan menggunakan kertas saring
Whatman 42 sehingga diperoleh filtrat dan residu. Filtrat yang diperoleh
kemudian dikeringkan dengan vacuum rotary evaporator pada suhu 40 oC hingga
3.3.5 Uji kandungan total fenol (Yangthong et al. 2009)
Uji kandungan total fenol dilakukan untuk mengetahui jumlah fenol yang
terdapat pada sampel. Metode yang dipakai mengacu pada metode penelitian
Yangthong et al. (2009). Ekstrak kasar dengan berat sekitar 5 - 10 mg ditimbang
lalu diilarutkan dengan 2 ml etanol 95%. Kemudian larutan ditambahkan 5 ml
akuades dan 0,5 ml reagen Folin-Ciocalteau 50% (v/v). Campuran didiamkan
selama 5 menit kemudian ditambahkan 1 ml Na2CO3 5% (b/v). Campuran
dihomogenkan lalu diinkubasi dalam kondisi gelap selama satu jam. Serapan yang
dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang
725 nm. Asam galat digunakan sebagai standar dengan konsentrasi 0, 10, 20, 30,
40, 50, 60, dan 70 mg/l. Nilai total fenol lamun C. rotundata dinyatakan dalam
mg Galic Acid Equivalent (GAE)/1000 g sampel.
3.3.6 Uji aktivitas antioksidan dengan metode DPPH (Aranda et al. 2009)
Uji aktivitas antioksidan dilakukan berdasarkan kemampuan sampel yang
digunakan dalam mereduksi radikal bebas stabil DPPH. 1 mg ekstrak kasar dan
BHT sebagai kontrol positif ditimbang lalu ditambahkan etanol dengan
perbandingan 1:1000. Selanjutnya 1,3 mg DPPH diencerkan dengan 25 ml etanol.
1 µl etanol diisikan ke dalam microwell plate yang telah disiapkan. Setelah itu,
dilakukan pengisian ekstrak dengan beberapa konsentrasi dan penambahan larutan
DPPH. Campuran dihomogenkan dan diinkubasi pada suhu 37 oC dalam waktu
30 menit. Serapan yang dihasilkan diukur dengan elisa reader.
Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai
absorbansi sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi
sampel dan presentase penghambatan aktivitas radikal bebas. Nilai konsentrasi
penghambatan aktivitas radikal bebas sebanyak 50% (IC50) dihitung dengan
menggunakan persamaan regresi. Nilai IC50 diperoleh dengan memasukkan y=50
serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50 dapat dihitung
dengan persamaan :
y = A + B Ln(x)
Keterangan : y = persen inhibisi
A = slope
B = intercept
3.3.5 Uji fitokimia (Harborne 1987)
Uji fitokimia yang dilakukan meliputi uji alkaloid, steroid/triterpenoid,
flavonoid, saponin, fenol hidrokuinon, dan tanin. Uji ini dilakukan untuk
mengetahui ada tidaknya komponen bioaktif yang terdapat pada lamun
C. rotundata.
1) Alkaloid
Uji alkaloid dilakukan dengan melarutkan dalam beberapa tetes asam
sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi
dragendorff, pereaksi meyer, dan pereaksi wagner. Hasil uji positif diperoleh bila
terbentuk endapan putih kekuningan dengan pereaksi meyer, endapan coklat
dengan pereaksi wagner dan endapan merah hingga jingga dengan pereaksi
dragendorff.
Pereaksi meyer dibuat dengan menambahkan 1,36 HgCl2 dengan 0,5 g KI
lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml dengan labu takar.
Pereaksi ini tidak berwarna. Pereaksi wagner berwarna coklat dibuat dengan cara
10 ml akuades dipipet kemudian ditambahkan 2,5 gram iodin dan 2 gram KI lalu
dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar.
Pereaksi dragendorff berwarna jingga dibuat dengan cara 0,8 g bismut subnitrat
ditambahkan dengan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur
dengan larutan yang dibuat dari 8 gram KI dalam 20 ml air. Sebelum digunakan,
1 volume campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam
asetat glasial dan 100 ml air.
2) Triterpenoid/steroid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi
yang kering lalu ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat.
Reaksi positif ditunjukkan dengan terbentuknya larutan berwarna merah untuk
pertama kali kemudian berubah menjadi biru dan hijau.
3) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang
stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N
4) Fenol Hidrokuinon
1 gram sampel diekstrak dengan 20 ml etanol 70%. Larutan yang
dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3
5%. Reaksi positif ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
5) Flavonoid
Sejumlah sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 ml amil
alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama)
dan 4 ml alkohol kemudian campuran dikocok. Reaksi positif ditunjukkan dengan
terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
6) Tanin
Sejumlah sampel ditambahkan FeCl3 kemudian campuran dihomogenkan.
Reaksi positif ditunjukkan dengan terbentuknya warna merah pada campuran.
3.4 Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan dalam penelitian ini adalah
Rancangan Acak Lengkap (RAL) satu faktor. Data hasil pengujian yang diolah
menggunakan RAL adalah rendemen ekstrak, total fenol dan aktivitas antioksidan.
Semua perlakuan dilakukan sebanyak dua kali ulangan.
Hipotesis yang digunakan adalah:
H0 : Perbedaan jenis pelarut tidak memberikan pengaruh nyata terhadap
rendemen ekstrak, total fenol dan aktivitas antioksidan pada lamun
C. rotundata
H1 : Perbedaan jenis pelarut memberikan pengaruh nyata terhadap rendemen
ekstrak, total fenol dan aktivitas antioksidan pada lamun C. rotundata
Faktor yang digunakan sebagai perlakuan adalah jenis pelarut yang
digunakan yang terdiri dari 3 taraf, yaitu metanol, etil asetat dan n-heksana. Model
rancangan yang digunakan adalah :
Uji lanjut Duncan digunakan jika analisis ragam menunjukkan hasil
berbeda nyata pada selang 95% (α=0,05). Rumus yang digunakan dalam uji
lanjut Duncan adalah:
Sy = KTS r
Rp = qa′x Sy
Keterangan :
Sy = Significant range
KTS = kuadran tengah sisa
r = ulangan
qa’ = significant studentized range
4 HASIL DAN PEMBAHASAN
4.1 Komposisi Proksimat dan Abu Tak Larut Asam Lamun Cymodocea rotundata
Analisis proksimat dilakukan untuk mengetahui komposisi kimia atau
kandungan gizi dalam lamun C. rotundata. Komposisi kimia tersebut meliputi
air, protein, lemak, abu, dan karbohidrat. Kadar karbohidrat lamun C. rotundata
diketahui dengan perhitungan secara by difference. Pengujian lain yang dilakukan
adalah pengujian terhadap kadar abu tidak larut asam. Pengujian ini berkaitan
dengan kebersihan dalam proses preparasi lamun C. rotundata yang digunakan.
Perhitungan analisis proksimat dan abu tak larut asam dapat dilihat pada Lampiran
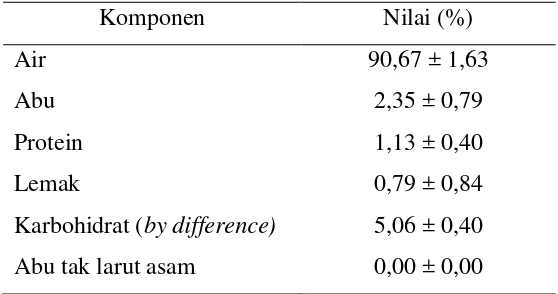
2 dan hasilnyadapat dilihat pada Tabel 1.
Tabel 1 Kandungan proksimat dan abu tak larut asam lamun C. rotundata
Komponen Nilai (%)
Air 90,67 ± 1,63
Abu 2,35 ± 0,79
Protein 1,13 ± 0,40
Lemak 0,79 ± 0,84
Karbohidrat (by difference) 5,06 ± 0,40
Abu tak larut asam 0,00 ± 0,00
Air merupakan senyawa yang paling berlimpah di dalam sistem hidup dan
mencakup 70% atau lebih dari bobot hampir semua bentuk kehidupan. Air
mengisi semua bagian dari tiap sel sehingga air merupakan medium tempat
berlangsungnya transportasi nutrien, reaksi-reaksi enzimatis metabolisme dan
transfer energi kimia (Lehninger 1982).
Menurut derajat keterikatan air, air terikat dibagi menjadi empat tipe. Air
tipe III atau air bebas merupakan air yang secara fisik terikat dalam jaringan
matriks bahan seperti membran, kapiler dan serat. Air tipe ini memiliki sifat
mudah diuapkan sehingga sifat ini dijadikan prinsip dalam pengujian kadar air
(Winarno 2008). Lamun C. rotundata memiliki kadar air yang tergolong tinggi,
Kandungan air dalam suatu bahan ikut menentukan acceptability, kesegaran dan
daya tahan bahan tersebut.
Sekitar 96% bahan pangan terdiri atas bahan organik dan air, sisanya
terdiri dari unsur-unsur mineral. Ketika proses pembakaran, bahan-bahan organik
terbakar sedangkan mineral tidak, oleh karena itu disebut sebagai abu. Mineral
dalam tubuh berfungsi sebagai zat pembangun dan pengatur. Setiap organisme
memiliki kemampuan yang berbeda-beda dalam meregulasi dan mengabsorbsi
mineral, sehingga akan berpengaruh terhadap nilai kadar abu pada masing-masing
bahan (Winarno 2008).
Analisis kadar abu dilakukan untuk mengetahui kandungan mineral dalam
lamun C. rotundata. Hasil penelitian menunjukkan bahwa kadar abu dalam lamun
C. rotundata adalah sebesar 24,86% bk. Nilai ini jauh lebih rendah jika
dibandingkan dengan hasil penelitian Setyati et al. (2003) pada lamun
C. serrulata yang mengandung abu sebesar 67,09% bk. Tinggi rendahnya kadar
abu ini dapat dipengaruhi oleh perbedaan habitat atau lingkungan hidup. Setiap
lingkungan perairan dapat menyediakan asupan mineral yang berbeda-beda bagi
organisme akuatik yang hidup di dalamnya.
Protein merupakan sumber asam amino yang mengandung unsur C, H,
O, dan N yang tidak dimiliki oleh lemak atau karbohidrat (Lehninger 1982).
Pengukuran kadar protein dilakukan untuk mengetahui besar atau kecilnya
kandungan protein di dalam lamun C. rotundata. Hasil pengujian kadar protein
menunjukkan bahwa lamun C. rotundata mengandung protein sebesar
12,67% bk. Jumlah ini lebih tinggi jika dibandingkan dengan kandungan protein
lamun C. serrulata yang diteliti oleh Setyati et al. (2003) yaitu sebesar 9,39% bk.
Kadar protein dalam tumbuhan secara umum memiliki mutu yang lebih
rendah daripada kadar protein hewani karena protein hewani lebih banyak
menyediakan asam amino-asam amino esensial. Protein dalam tubuh berfungsi
sebagai zat pengatur dan pembangun serta sebagai bahan bakar apabila keperluan
energi tubuh tidak terpenuhi oleh karbohidrat dan lemak (Winarno 2008).
Lemak merupakan senyawa organik yang tidak larut di dalam air dan
dapat diekstrak dari suatu bahan dengan menggunakan pelarut nonpolar, seperti
organisme (Lehninger 1982). Satu gram lemak mampu menghasilkan energi
sebesar 9 kkal. Lemak nabati mengandung asam-asam lemak esesial seperti asam
linoleat, linolenat dan arakidonat yang dapat mencegah penyempitan pembuluh
darah akibat penumpukan kolesterol dan juga berfungsi sebagai pelarut bagi
vitamin A, D, E, dan K (Winarno 2008).
Hasil pengujian kadar lemak menunjukkan bahwa lamun C. rotundata
mengandung lemak sebesar 7,81% bk. Kandungan lemak pada C. rotundata
ternyata memiliki jumlah yang sama dengan hasil penelitian Setyati et al. (2003)
yang menyatakan bahwa kadar lemak pada lamun C. serrulata adalah sebesar
7,81% bk. Yunizal et al. (1998) menyatakan bahwa kadar air umumnya memiliki
hubungan yang berbanding terbalik dengan kadar lemak. Lamun C. rotundata
memiliki kandungan air yang cukup tinggi sehingga secara proporsional kadar
lemak menjadi turun.
Karbohidrat merupakan polihidroksi aldehida (keton) atau senyawa yang
menghasilkan senyawa ini bila dihidrolisis. Karbohidrat terbagi atas tiga
golongan utama, yaitu monosakarida, oligosakarida dan polisakarida.
Polisakarida yang umumnya dijumpai pada tanaman adalah pati dan selulosa yang
mempunyai ratusan atau ribuan unit monosakarida (Lehninger 1982). Kadar
karbohidrat (by difference) lamun C. rotundata yang diperoleh dari hasil
penelitian ini adalah sebesar 5,06%.
Pada tanaman, karbohidrat (C6H12O6) dibentuk dari reaksi CO2 dan H2O
dengan bantuan sinar matahari melalui proses fotosintesis dalam sel tanaman yang
berklorofil. Walaupun jumlah kalori yang terdapat dalam satu gram karbohidrat
hanya 4 kkal, namun karbohidrat merupakan sumber kalori utama bagi hampir
seluruh penduduk dunia (Winarno 2008). Karbohidrat berguna sebagai storing
energy seperti pati dan sebagai penyusun dinding sel seperti selulosa. Banyak
senyawa kimia dalam tanaman seperti asam nukleat dan glikosida yang
mengandung karbohidrat dimana karbohidrat tersebut merupakan bagian esensial
pada strukturnya. Kegunaan gula pada tanaman antara lain untuk membantu
penyerbukan, melindungi luka dan mencegah terjadinya infeksi serta detoksifikasi
Abu tidak larut asam merupakan garam-garam klorida yang tidak larut
asam, yang sebagian merupakan garam-garam logam berat dan silika. Kadar abu
tidak larut asam menunjukkan adanya kontaminasi residu mineral atau logam
yang tidak dapat larut asam pada suatu bahan. Kadar abu tidak larut asam
juga menunjukkan kebersihan dalam suatu proses pengolahan suatu produk
(Basmal et al. 2003).
Lamun C. rotundata yang digunakan dalam penelitian ini memiliki kadar
abu tidak larut asam sebesar 0%. Nilai kadar abu tidak larut asam yang diperoleh
dalam penelitian ini masih berada dibawah 1%, yaitu nilai yang dipersyaratkan
dalam Food Chemical Codex (1992) untuk produk kappa-karaginan food grade.
Ada tidaknya kadar abu tidak larut asam ini diduga berasal dari bahan-bahan abu
yang tidak dapat larut asam yang terdapat di perairan tempat lamun C. rotundata
hidup yang terbawa saat proses preparasi seperti pasir, silika, lumpur, dan karang.
4.2 Kandungan Serat Pangan Lamun Cymodocea rotundata
Serat pangan (Dietary fibre) merupakan salah satu bagian yang dapat
dikonsumsi dari tumbuhan atau dapat disebut karbohidrat yang tidak dapat dicerna
dan diserap oleh usus halus manusia namun akan difermentasikan secara
sempurna maupun parsial dalam usus besar (Kamp et al. 2004). Para ahli
mengelompokkan serat pangan sebagai salah satu jenis polisakarida yang disebut
karbohidrat kompleks. Karbohidrat ini terbentuk dari beberapa gugusan gula
sederhana yang bergabung menjadi satu membentuk rantai kimia panjang yang
sulit dicerna oleh enzim pencernaan (Sulistijani 2002).
Pengujian serat pangan pada lamun C. rotundata dalam penelitian ini
menggunakan metode multi enzim. Serat pangan yang diuji meliputi serat pangan
larut air (Soluble Dietary Fibre) dan serat pangan tak larut air (Insoluble Dietary
Fibre). Kandungan serat pangan lamun C. rotundata dapat dilihat pada Tabel 2.
Tabel 2 Kandungan serat pangan lamun C. rotundata
Jenis serat pangan Nilai (g/100 g sampel)
Insoluble Dietary Fibre (IDF) 5,39 ± 0,08
Soluble Dietary Fibre (SDF) 8,93 ± 0,05