KANDUNGAN ZAT GIZI DAN NILAI GIZI PROTEIN
TEPUNG TEMPE KEDELAI LOKAL DAN IMPOR
SERTA AKTIVITAS ANTIOKSIDANNYA
MURSYID
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Dengan ini saya menyatakan bahwa tesis berjudul Kandungan Zat Gizi dan Nilai Gizi Protein Tepung Tempe Kedelai Lokal dan Impor serta Aktivitas Antioksidannya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Mursyid NIM F251110361
MURSYID. Kandungan Zat Gizi dan Nilai Gizi Protein Tepung Tempe Kedelai Lokal dan Impor serta Aktivitas Antioksidannya. Dibimbing oleh MADE ASTAWAN dan DEDDY MUCHTADI.
Laju pertumbuhan penduduk Indonesia sekarang ini meningkat dengan pesat, akan tetapi kemampuan petani dalam menghasilkan bahan pangan semakin menurun, termasuk juga produksi kedelai lokal. Badan Pusat Statistik (2013) mencatat bahwa produksi kedelai pada tahun 2012 hanya sebesar 843.15 ribu ton, sementara itu kebutuhan secara nasional sebesar 2.3 juta ton. Menyiasati permasalahan kekurangan ini, pemerintah melakukan proses impor kedelai dari negara penghasil kedelai lain. Ada banyak produk olahan kedelai, seperti tempe, tahu, tauco, kecap, susu kedelai, kembang tahu, dan lain sebagainya. Tempe merupakan produk olahan fermentasi kedelai yang berasal dari Indonesia. Masalah utama yang dihadapi tempe adalah umur simpannya yang relatif singkat. Salah satu alternatif untuk mengatasi permasalahan tersebut adalah membuat tempe menjadi tepung.
Tujuan dari penelitian ini adalah (1) membandingkan kandungan zat gizi dan non gizi tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG), (2) mengevaluasi nilai gizi protein tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG), dan (3) mengukur aktivitas antioksidan terhadap radikal DPPH dan kadar malonaldehid (MDA) pada hati tikus. Bahan penelitian yang digunakan : tepung tempe kedelai lokal grobogan dan impor PRG (Roundup Ready) dan non PRG. Penelitian ini terdiri dari dua tahap, analisis in vitro dan in vivo. Analisis in vitro terdiri dari analisis proksimat, asam amino, asam lemak, serat pangan, isoflavon total, dan vitamin E. Uji biologis dilakukan pada tikus putih Sprague-Dawley jantan sebanyak 25 ekor sebagai hewan coba, dibagi menjadi lima kelompok, diberi makan dengan tepung tempe kedelai lokal grobogan, impor PRG dan non PRG, serta kasein sebagai kontrol. Parameter yang digunakan pada evaluasi nilai gizi protein adalah nilai protein efficiency ratio (PER), feed conversion efficiency (FCE), net protein ratio (NPR), true protein digestibility (TPD), biological value (BV), net protein utilization (NPU), dan protein digestibility-corrected amino acid score (PDCAAS). Pengukuran aktivitas antioksidan terdiri dari analisis antioksidan metode DPPH dan pengukuran kadar MDA di hati tikus.
Hasil yang diperoleh menunjukkan bahwa kandungan zat gizi (proksimat, asam amino, asam lemak, dan vitamin E) dan non gizi (serat pangan dan isoflavon total) tepung tempe kedelai lokal grobogan tidak berbeda dengan tepung tempe kedelai impor PRG dan non PRG. Evaluasi nilai gizi protein menunjukkan bahwa tidak terdapat perbedaan yang nyata pada nilai FCE rata 20.45%), PER (rata-rata 2.04) dan NPR ((rata-rata-(rata-rata 2.80) dari semua jenis tepung tempe, tetapi nyata lebih rendah dibandingkan kasien. Nilai TPD tepung tempe kedelai grobogan dan non PRG tidak berbeda nyata (rata-rata 82.62%), sangat nyata lebih tinggi dibandingkan tepung tempe kedelai PRG (80.27), dan sangat nyata lebih rendah dibandingkan kasein (87.33%). Tidak terdapat perbedaan yang nyata nilai BV (rata-rata 89.59%) dan NPU (rata-rata 74.55%) dari semua sampel. Nilai
Aktivitas penangkapan radikal DPPH (IC50) tepung tempe kedelai lokal grobogan sebesar 2524.7 ppm, PRG sebesar 3349.3 ppm, dan non PRG sebesar 4049.6 ppm, sedangkan vitamin C sebesar 5.03 ppm. Pembentukan kadar MDA di hati menunjukkan tidak terdapat perbedaan yang nyata (p>0.05) antara kelompok tepung tempe kedelai grobogan (0.290 µg g-1 sampel), PRG (0.268 µg g-1 sampel), non PRG (0.353 µg g-1 sampel) dan kasein (0.238 µg g-1 sampel) sebagai kontrol. Kata kunci : Aktivitas antioksidan, kedelai lokal, kedelai impor, kandungan zat
Imported Soybean Tempe Flours and Their Antioxidant Activities. Supervised by MADE ASTAWAN and DEDDY MUCHTADI.
The rate of population growth in Indonesia has increased rapidly, but the ability of farmers to produce foodstuffs has declined, including soybean production. Central Agency on Statistics (2013) noted that national soybean production in 2012, only amounted to 843.15 thousand tons, while the national total requirement was 2.3 million tons. To fulfill this shortage, the government should import soybean from other countries. There are many kinds of soybean products, such as tempe, tofu, tauco, soy sauce, soy milk, yuba, etc. Tempe is Indonesian traditional fermented soybean. The main problem of tempe product is its short shelf life. An alternative way to solve this problem is making tempe into flour.
The objectives of this research were (1) to compare the nutritional and non-nutritional contents of local (grobogan) and imported (GMO and non-GMO) soybean tempe flours, (2) to evaluate the protein nutritional value of local (grobogan) and imported (GMO and non-GMO) soybean tempe flours, and (3) to measure antioxidant activities to DPPH radical and malonaldehyde (MDA) content in rat liver. Experimental material : local grobogan, imported GMO (Roundup Ready) and non-GMO soybean tempe flours. The research was conducted in two stages, in vitro and in vivo analysis. In vitro analysis was consists of proximate, amino acid, fatty acid, dietary fiber, total isoflavones, and vitamin E analysis. The biological assay was conducted on 25 male albino rats Sprague-Dawley as an animal model, divided into five groups, fed with imported GMO and non-GMO soybean tempe flours, local grobogan soybean tempe flours and casein as control. Parameters that used in the evaluation of protein nutritional value were protein efficiency ratio (PER), feed conversion efficiency (FCE), net protein ratio (NPR), true protein digestibility (TPD), biological value (BV), net protein utilization (NPU) and protein digestibility corrected amino acid score (PDCAAS) value. The measurement of antioxidant activity consist of DPPH antioxidant analysis and measure the MDA content in rat liver.
The results showed that the nutritionals (proximate, amino acid, fatty acid, and vitamin E) and non nutritionals (dietary fiber and total isoflavones) compound of local grobogan soybean tempe flour were not much different from imported GMO and non-GMO soybean tempe flours. The evaluations of protein nutritional value showed that there were no significantly different of FCE (average 20.45%), PER (average 2.04) and NPR (average 2.80) values from all of tempe flours but lower than casein. TPD value of grobogan soybean tempe flour and non-GMO were not statistically different (average 82.62%), significantly higher than GMO soybean tempe flour (80.27%), but lower than casein (87.33%). There were no significantly different of BV (average 89.59%) and NPU (average 74.55%) values from all of samples. The PDCAAS value from local grobogan soybean
tempe flour was 2524.7 ppm, imported GMO was 3349.3 ppm, imported non GMO was 4049.6 ppm, while vitamin C was 5.03 ppm. MDA forming in liver showed that there was not difference (p>0.05) between grobogan (0.290 µg/g sampel), GMO (0.268 µg/g sampel), non-GMO (0.353 µg/g sampel) soybean tempe flours and casein (0.238 µg/g sampel) as control.
Keyword : Antioxidant activity, local soybean, imported soybean, nutritional value, tempe flour.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
KANDUNGAN ZAT GIZI DAN NILAI GIZI PROTEIN
TEPUNG TEMPE KEDELAI LOKAL DAN IMPOR
SERTA AKTIVITAS ANTIOKSIDANNYA
MURSYID
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
NIM : F251110361
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Made Astawan, MS Prof Dr Ir Deddy Muchtadi, MS Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Ilmu Pangan
Prof Dr Ir Ratih Dewanti-Hariyadi, M.Sc Dr Ir Dahrul Syah, MScAgr
Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis diberi kemudahan dalam menyelesaikan tesis ini. Tema yang dipilih dalam penelitian yang telah dilaksanakan dari bulan April 2013 sampai November 2013 ini ialah tempe, dengan judul Kandungan Zat Gizi dan Nilai Gizi Protein Tepung Tempe Kedelai Lokal dan Impor serta Aktivitas Antioksidannya.
Selama penelitian, penulisan tesis, dan masa studi, penulis banyak dibantu oleh berbagai pihak. Oleh karena itu, penulis mengucapkan terima kasih yang sedalam-dalamnya kepada :
1. Bapak Prof Dr Ir Made Astawan,MS dan Bapak Prof Dr Ir Deddy Muchtadi, MS selaku dosen pembimbing yang telah memberi banyak saran, arahan, bimbingan, evaluasi, perhatian, dan motivasi selama perkulihan, penelitian, hingga penyusunan tesis.
2. Ibu Prof (R) Dr Ir Sri Widowati, M.APP.Sc dan Ibu Dr Ir Endang Prangdimurti, MSi selaku dosen penguji pada sidang akhir tesis atas kesediannya menjadi dosen penguji dan evaluasi serta saran yang diberikan kepada penulis.
3. Pemberi dana penelitian yaitu Badan Penelitian dan Pengembangan Pertanian Kantor Pusat Jakarta melalui Kerjasama Kemitraan Penelitian dan Pengembangan Pertanian Nasional (KKP3N) dengan surat perjanjian pelaksanaan kegiatan No : 709/LB.620/I.I/2/2013 tanggal 25 Februari 2013 an.Made Astawan.
4. Pemberi dana pendidikan yaitu Sekolah Tinggi Ilmu Kesehatan (STIKES) Baiturrahim Jambi yang telah membantu membiayai pendidikan melalui Beasiswa Pendidikan.
5. KOPTI Kabupaten Bogor dan Rumah Tempe Indonesia, Pak Heri, Pak Yanto, Mas Abdi, Pak Rikamto, dan Bu Lis, yang telah mengizinkan dan membantu produksi tempe di Rumah Tempe Indonesia selama penelitian berlangsung.
6. Keluarga tercinta, Bapak Zulyadaini, Ibu Rusnah, dan Kedua Abangku, Muhammad Hidayat dan Ahmad Syafiq atas doa, motivasi, dan kasih sayang yang diberikan hingga kini.
7. Semua laboran di laboratorium SEAFAST dan ITP, atas bantuan dan kerjasamanya selama penelitian.
8. Segenap rekan-rekan Ilmu Pangan angkatan 2011 dan semua pihak yang tidak dapat disebutkan satu persatu, atas dukungan, doa dan kerjasamanya yan diberikan kepada penulis.
Semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu pengetahuan, khusunya di bidang ilmu dan teknologi pangan. Terima kasih.
Bogor, Januari 2014 Mursyid
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xiv
1 PENDAHULUAN
Latar Belakang 1
Perumusan dan Pendekatan Masalah 3
Tujuan Penelitian 3
Hipotesis 3
2 TINJAUAN PUSTAKA
Kedelai 3
Tempe 6
Radikal Bebas dan Spesies Oksigen Reaktif 9
Isoflavon 9
Vitamin E 10
Teknik Evaluasi Nilai Biologis Protein 11
3 METODE PENELITIAN
Waktu dan Tempat 12
Bahan dan Alat 12
Metode Penelitian 12
Tahap Uji In Vitro 13
Proses Pembuatan Tempe 13
Proses Pembuatan Tepung Tempe 13
Analisis Proksimat 13
Analisis Komposisi Asam Amino 15
Analisis Asam Lemak 16
Analisis Serat Pangan 17
Analisis Vitamin E 18
Analisis Isoflavon 19
Analisis Aktivitas Antioksidan metode DPPH 20
Tahap Uji In Vivo 20
Perancangan Ransum 20
Tikus Percobaan 21
Masa Adaptasi 21
Seleksi dan Pengelompokan Tikus 21
Masa Pemeliharaan 22
Analisis Nitrogen Feses danUrin 22
Pengukuran Nilai Gizi Protein 23
Pengukuran Kadar MDA Hati 23
Komposisi Asam Amino 26
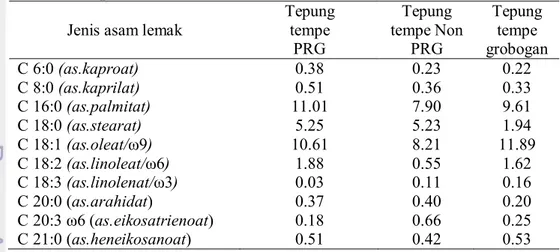
Komposisi Asam Lemak 28
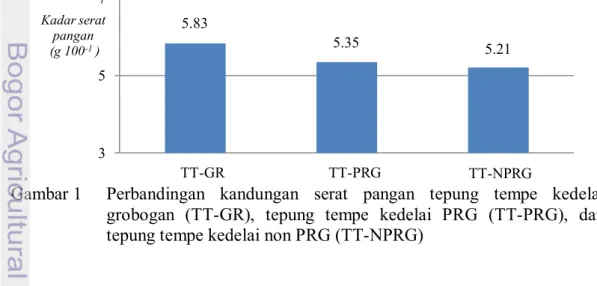
Kadar Serat Pangan 29
Kadar Vitamin E 30
Kadar Isoflavon Total 31
Evaluasi Nilai Gizi Protein Tepung Tempe Secara In Vivo 32
Konsumsi Ransum Total dan Kenaikan Berat Badan 33
Nilai Gizi Protein Berdasarkan Metode Pertumbuhan 35 Nilai Gizi Protein Berdasarkan Metode Keseimbangan Nitrogen 36
Aktivitas Antioksidan Secara In Vitro dan In Vivo 38
5 KESIMPULAN DAN SARAN
Kesimpulan 41
Saran 41
DAFTAR PUSTAKA 42
LAMPIRAN 47
DAFTAR RIWAYAT HIDUP 59
2 Komposisi kimia tempe (per 100 g) 7 3 Jumlah asam amino bebas (mg/100 g) pada proses fermentasi
kedelai menggunakan R.oligosporus 8
4. Rancangan komposisi ransum percobaan 21
5 Pengelompokan dan perlakuan tikus percobaan 22
6 Analisis proksimat kasein dan tepung tempe dari tiga jenis
varietas kedelai (bk) 25
7 Komposisi asam amino esensial tiga jenis tepung tempe 26
8 Skor kimia tiga jenis tepung tempe 27
9 Komposisi asam amino non-esensial tiga jenis tepung tempe 27 10 Komposisi asam lemak tiga jenis tepung tempe
(% lemak dalam sampel) 28
11 Komposisi ransum masing-masing perlakuan 33
12 Konsumsi ransum total dan kenaikan berat badan berdasarkan
kelompok perlakuan 34
13 Perbandingan nilai FCE, PER, dan NPR tepung tempe dan
kasein 35
14 Perbandingan nilai TPD, BV, NPU, dan PDCAAS tepung tempe
dan kasein 37
15 Aktivitas antioksidan tiga jenis tepung tempe dan vitamin C 39
DAFTAR GAMBAR
1 Perbandingan kandungan serat pangan tepung tempe kedelai grobogan (TT-GR), tepung tempe kedelai PRG (TT-PRG), dan
tepung tempe kedelai non PRG (TT-NPRG) 29
2 Perbandingan kandungan vitamin E tepung tempe kedelai grobogan (TT-GR), tepung tempe kedelai PRG (TT-PRG), dan
tepung tempe kedelai non PRG (TT-NPRG) 30
3 Perbandingan kandungan isoflavon total tepung tempe kedelai grobogan (TT-GR), tepung tempe kedelai PRG (TT-PRG), dan
tepung tempe kedelai non PRG (TT-NPRG) 31
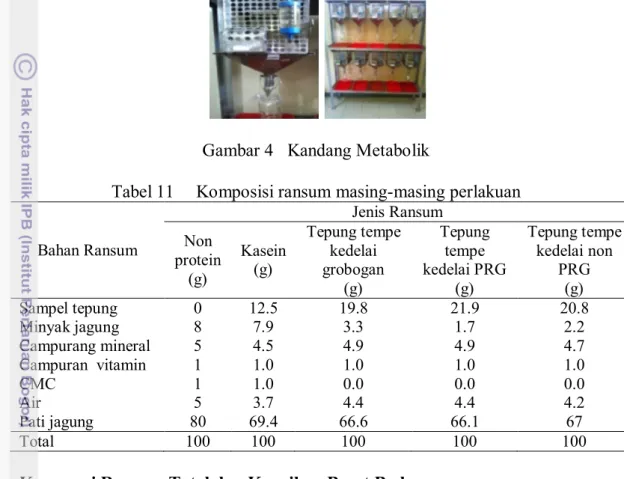
4 Kandang metabolik 33
5 Perubahan berat badan tikus percobaan selama 28 hari perlakuan 34
6 Struktur DPPH dan DPPH-H (Molyneux 2004) 39
7 Hasil pengukuran kadar MDA hati kelompok kasein (KAS), tepung tempe kedelai grobogan (TT-GR), tepung tempe kedelai PRG PRG), dan tepung tempe kedelai non PRG
2 Hasil analisis sidik ragam proksimat menggunakan SPSS versi
16.0. 47
3 Hasil analisis sidik ragam total konsumsi tikus percobaan selama
28 hari perlakuan menggunakan SPSS versi 16.0. 48
4 Hasil analisis sidik ragam kenaikan berat badan tikus percobaan selama 28 hari perlakuan menggunakan SPSS versi 16.0. 49 5 Rekapitulasi data hasil analisis kenaikan berat badan, total
konsumsi, FCE, PER dan NPR kelompok ransum kasein, tepung
tempe kedelai PRG, non PRG, dan grobogan. 50
6 Rekapitulasi data hasil analisis TPD, BV, NPU dan PDCAAS kelompok ransum kasein, tepung tempe kedelai PRG, non PRG,
dan grobogan. 51
7 Hasil analisis sidik ragam FCE, PER, NPR, TPD, BV dan NPU
menggunakan SPSS versi 16.0. 52
8 Hasil analisis sidik ragam nilai PDCAAS menggunakan SPSS
versi 16.0. 53
9 Rekapitulasi pengukuran aktivitas antioksidan metode DPPH 54
10 Rekapitulasi hasil pengukuran kadar MDA hati 56
11 Hasil analisis sidik ragam pengukuran kadar MDA hati
1
PENDAHULUAN
Latar Belakang
Tanaman kedelai merupakan tanaman asli dari Asia Timur dan telah dibudidayakan di Cina sejak 5000 tahun yang lalu. Pada awalnya kedelai ditanam untuk memberikan hara nitrogen pada tanah, sebagai rotasi tanaman. Di Indonesia, kedelai merupakan salah satu komoditi pangan utama setelah padi dan jagung. Kedelai merupakan bahan pangan sumber protein nabati utama bagi masyarakat (Muchtadi 2010a).
Laju pertumbuhan penduduk Indonesia sekarang ini meningkat dengan pesat sehingga kebutuhan akan bahan pangan meningkat pula. Akan tetapi, kemampuan petani dalam menghasilkan bahan pangan semakin lama semakin menurun, termasuk juga produksi kedelai lokal. Menurut Badan Pusat Statistik (2013), produksi kedelai di Indonesia semakin menurun dari tahun ke tahun. Produksi kedelai nasional pada tahun 2010 sebesar 907.03 ribu ton mengalami penurunan menjadi 843.15 ribu ton biji kering pada tahun 2012. Kebutuhan akan kedelai secara nasional selama lima tahun ini (tahun 2010-2014) sebesar 2.3 juta ton biji kering (Kementerian Pertanian 2013). Menyiasati permasalah tersebut, pengrajin olahan kedelai banyak yang menggantungkan usahanya dari bahan impor, sehingga minat akan bahan lokal lama-kelamaan menjadi menurun.
Permasalahan tingginya angka pertumbuhan penduduk tidak hanya dialami oleh Indonesia, laju pertumbuhan penduduk di dunia pun sekarang ini meningkat cukup tajam. Berbagai langkah ditempuh oleh negara-negara di dunia dalam mencukupi kebutuhan pangan akibat lonjakan populasi tersebut, salah satunya adalah dengan rekayasa genetik di bidang pertanian yang menghasilkan produk tanaman transgenik atau genetically modified organism (GMO). Tanaman transgenik adalah tanaman hasil rekayasa genetika dimana gen asing dimasukkan ke dalam suatu organisme dengan memanfaatkan teknik DNA rekombinan (rDNA).
Tujuan dari penyisipan gen asing dari spesies yang berbeda ini agar mendapatkan tanaman dengan sifat-sifat yang diinginkan, seperti membuat tanaman menjadi tahan terhadap suhu tinggi, suhu rendah, kekeringan, kebal terhadap organisme pengganggu tanaman, serta mengharapkan kualitas dan kuantitas yang lebih tinggi dari tanaman alaminya. Celec et al. (2005) menyatakan bahwa sekarang ini teknologi transgenik telah diaplikasikan pada berbagai bidang kehidupan seperti kedokteran, pertanian, serta pangan.
Terdapat banyak jenis tanaman pangan produk rekayasa genetika (PRG) yang tersebar di dunia sekarang ini, salah satunya adalah tanaman kedelai. Jenis kedelai transgenik saat ini yang paling banyak ditanam dan dipasarkan adalah jenis kedelai Roundup Ready (RR). Jenis kedelai ini banyak ditanam karena kemampuan toleran terhadap herbisida Roundup (Hagedorn 2000). Herbisida Roundup mengandung gliposat yang bekerja dengan cara menghambat biosintesis asam amino aromatik (fenilalanin, triptofan, dan tirosin) yang penting bagi pertumbuhan tanaman, sehingga menyebabkan gangguan pada beberapa sistem metabolik termasuk juga penghambatan biosintesis protein dan biosintesis produk sekunder sehingga menyebabkan tanaman tersebut mati (Nandula et al. 2005).
Akibat dari berhasilnya teknik rekayasa genetika tersebut menyebabkan produksi kedelai dunia melimpah dan harga yang ditawarkan juga cukup murah dibandingkan kedelai non transgenik dan kedelai lokal, sehingga pemerintah Indonesia tertarik untuk membeli kedelai tersebut guna memenuhi kebutuhan kedelai nasional. Secara tidak langsung, akibat melimpah dan mudah didapatnya kedelai impor tersebut, pengrajin olahan kedelai lebih menyukai jenis kedelai impor daripada jenis kedelai lokal.
Di Indonesia sendiri, kedelai telah dikenal sebagai bahan pangan yang biasa diolah menjadi tempe, tahu, tauco, kecap, kembang tahu dan susu kedelai. Dari berbagai jenis olahan kedelai tersebut, tempe merupakan jenis olahan kedelai asli dari Indonesia. Kandungan zat gizi yang terdapat pada tempe yang lebih baik dibandingkan kedelai mentah membuat tempe sekarang semakin banyak disukai oleh konsumen.
Muchtadi (2010a) menjelaskan bahwa proses fermentasi dalam pembuatan tempe dapat mempertahankan sebagian besar zat-zat gizi yang terkandung dalam kedelai, meningkatkan daya cerna proteinnya, serta meningkatkan kadar beberapa macam vitamin B. Penelitian mengenai nilai gizinya menunjukkan bahwa tempe dapat digunakan sebagai sumber protein yang murah untuk bahan pangan anak-anak di negara berkembang. Hal yang senada diutarakan oleh Astawan (2008), dari berbagai produk olahan kedelai, tempe merupakan produk olahan kedelai yang sangat terkenal di Indonesia. Kapang yang tumbuh pada tempe mampu menghasilkan beberapa enzim seperti enzim protease untuk mengurai protein menjadi peptida yang lebih pendek dan asam amino bebas, enzim lipase untuk mengurai lemak menjadi asam-asam lemak, dan enzim amilase untuk mengurai karbohidrat kompleks menjadi senyawa yang lebih sederhana. Oleh karena itu tempe sangat baik untuk dikonsumsi oleh berbagai umur (dari bayi hingga lanjut usia).
Selain kandungan gizi, tempe juga sering mendapat perhatian khusus bagi para peneliti yang disebabkan aktivitas antioksidan senyawa isoflavon yang ditemukan pada tempe. Telah diketahui bahwa isoflavon tersebut dapat berperan sebagai antioksidan dalam tubuh sehingga dapat mencegah kerusakan oleh radikal bebas dan juga pembentukan senyawa spesies oksigen reaktif (Reactive Oxygen Species, ROS) secara berlebihan.
Pengukuran radikal bebas secara langsung sulit dilakukan, hal ini disebabkan radikal bebas tidak menetap lama, mempunyai waktu paruh yang pendek dan menghilang dalam hitungan detik. Berbagai substansi biologis dikembangkan sebagai penanda biologis (biomarker) stres oksidatif. Lipid merupakan biomolekuler yang paling rentan terhadap serangan ROS dan akibat proses lipoperoksidasi akan dihasilkan pembentukan malonaldehida (MDA).
Masalah utama pada produk tempe adalah umur simpannya yang rendah akibat kadar airnya yang cukup tinggi (55-65%), serta adanya kapang yang terus tumbuh dan berkembang biak menyebabkan degradasi protein lebih lanjut membentuk amoniak. Amoniak yang terbentuk menyebabkan munculnya aroma busuk (Astawan, 2008; Bastian, et al., 2013). Oleh karena itu, pembuatan tepung merupakan alternatif pengolahan untuk memperpanjang masa simpan dan daya guna tempe. Adanya berbagai jenis kedelai yang digunakan pengrajin tempe di Indonesia juga merupakan hal yang menarik untuk diteliti lebih lanjut, baik terhadap kandungan gizi maupun terhadap kandungan antioksidannya.
Perumusan dan Pendekatan Masalah
Berdasarkan permasalahan yang telah diuraikan di atas, terlihat bahwa ada berbagai jenis kedelai yang digunakan dalam pembuatan tempe di Indonesia. Akan tetapi, data tentang keseragaman kandungan gizi dari berbagai tepung tempe sampai sekarang masih belum ada. Oleh karena itu, peneliti tertarik untuk melakukan penelitian tentang analisis kandungan zat gizi dan non gizi, nilai gizi protein tepung tempe dari kedelai lokal (grobogan) dan impor (PRG dan non PRG), serta aktivitas antioksidan yang dimiliki oleh tepung tempe tersebut terhadap radikal DPPH dan pengukuran kadar malonaldehida (MDA) hati tikus percobaan.
Tujuan Penelitian
Tujuan penelitian ini adalah mengevaluasi kesepadanan tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG). Tujuan khusus dari penelitian ini adalah :
a. Membandingkan kandungan zat gizi dan non gizi tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG).
b. Mengukur nilai gizi protein tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG).
c. Mengukur aktivitas antioksidan tepung tempe terhadap radikal DPPH dan pengukuran kadar MDA hati tikus percobaan.
Hipotesis Hipotesis yang diajukan adalah :
a. Tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG) memiliki kesamaan dalam hal kandungan zat gizi dan non gizi, maupun nilai gizi protein.
b. Ketiga jenis tepung tempe memiliki aktivitas antioksidan yang sepadan, ditinjau dari aktivitas antioksidan metode DPPH maupun pengukuran kadar MDA hati.
2
TINJAUAN PUSTAKA
Kedelai
Kedelai merupakan tanaman pangan berupa semak yang tumbuh tegak. Kedelai berasal dari daerah Manshukuo (Cina Utara). Di Indonesia, kedelai mulai dibudidayakan pada abad ke-17 sebagai tanaman pangan dan pupuk hijau (Menegristek 2000). Tanaman kedelai termasuk phylum Magnoliophyta, kelas Magnoliopsida, ordo Fabales, famili Fabaceae, subfamili Faboideae, genus Glycine dan spesies G. max.
Di Indonesia, beberapa sebutan lokal untuk kedelai adalah : kacang bulu, gadela, kacang jepung, atau kedele. Kedelai dibedakan atas dasar umur panen dan
warna biji. Berdasarkan umur panen, kedelai dibedakan atas tiga jenis golongan, yaitu kedelai genjah (umur 78-85 hari), kedelai tengahan (umur 85-95 hari), serta kedelai dalam (umur lebih dari 95 hari). Berdasarkan warna kulit biji, kedelai dibedakan atas kedelai kuning, hitam dan hijau. Secara kimia, umumnya tidak ada perbedaan di antara ke tiga jenis kedelai tersebut (Astawan 2008).
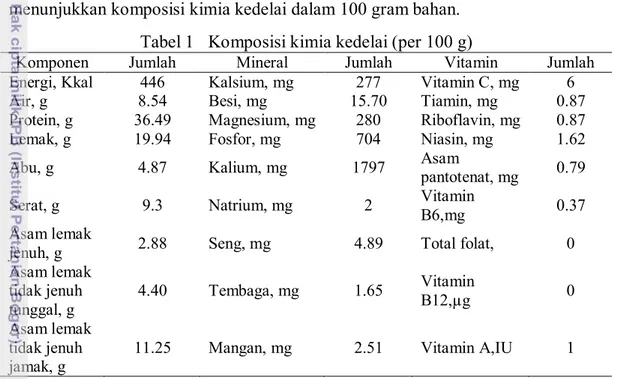
Komposisi kimia kedelai bervariasi tergatung pada varietas dan kondisi pertumbuhannya. Muchtadi (2010a) menjelaskan bahwa melalui pemuliaan tanaman, sangat mungkin akan diperoleh biji kedelai dengan kadar protein sekitar 40-45 % dan kadar lemak sekitar 18-20 %. Umumnya untuk setiap 1 % kenaikan kadar protein, akan diikuti dengan penurunan sekitar 0.5 % kadar lemak. Tabel 1 menunjukkan komposisi kimia kedelai dalam 100 gram bahan.
Tabel 1 Komposisi kimia kedelai (per 100 g)
Komponen Jumlah Mineral Jumlah Vitamin Jumlah
Energi, Kkal 446 Kalsium, mg 277 Vitamin C, mg 6
Air, g 8.54 Besi, mg 15.70 Tiamin, mg 0.87
Protein, g 36.49 Magnesium, mg 280 Riboflavin, mg 0.87
Lemak, g 19.94 Fosfor, mg 704 Niasin, mg 1.62
Abu, g 4.87 Kalium, mg 1797 Asam
pantotenat, mg 0.79
Serat, g 9.3 Natrium, mg 2 Vitamin
B6,mg 0.37
Asam lemak
jenuh, g 2.88 Seng, mg 4.89 Total folat, 0
Asam lemak tidak jenuh tunggal, g 4.40 Tembaga, mg 1.65 Vitamin B12,µg 0 Asam lemak tidak jenuh jamak, g
11.25 Mangan, mg 2.51 Vitamin A,IU 1
Sumber : USDA Nutrient Database for Standard Reference.
Muchtadi (2010a) menyatakan bahwa kedelai merupakan salah satu komoditi pangan utama setelah padi dan jagung. Kedelai merupakan bahan pangan sumber protein nabati utama bagi masyarakat. Sejalan dengan bertambahnya jumlah penduduk, maka permintaan akan kedelai juga semakin meningkat. Menurut Badan Pusat Statistik (2013), produksi kedelai pada tahun 2012 sebesar 843.15 ribu ton biji kering atau mengalami penurunan sebesar 8.13 ribu ton (0.96 persen) dibandingkan tahun 2011 yaitu sebesar 851.29 ribu ton biji kering. Kebutuhan akan kedelai secara nasional selama lima tahun ini (tahun 2010-2014) sebesar 2.3 juta ton biji kering (Kementerian Pertanian 2013).
Masalah kekurangan bahan pangan tidak hanya dialami oleh Indonesia, akan tetapi juga merupakan masalah bagi seluruh negara di dunia. Hal ini disebabkan laju pertumbuhan manusia di dunia meningkat dengan tajam. Akan tetapi, kemampuan petani dalam menghasilkan bahan pangan semakin lama semakin menurun. Salah satu upaya untuk mengatasi permasalahan pangan tersebut adalah dengan menerapkan bioteknologi pertanian (Karmana 2009).
Teknik bioteknologi pertanian yang sedang berkembang saat ini adalah teknologi rekayasa genetik atau dikenal dengan istilah Genetically Modified Organism (GMO). Menurut WHO, Genetically Modified Organism (GMO)
adalah organisme dimana materi genetiknya (DNA) telah mengalami perubahan yang tidak terjadi secara alami. Celec et al. (2005) menyatakan bahwa jenis organisme yang bisa dimodifikasi genetiknya dapat berupa mikroorganisme, tanaman, maupun hewan. Isu tentang transgenik dewasa ini sedang menarik perhatian banyak pihak di dunia, dimana transgenik diyakini dapat memecahkan masalah gizi. Halford dan Shewry, (2000) menyatakan modifikasi tanaman bertujuan untuk membuat tanaman tahan terhadap hama atau pestisida sehingga mengurangi kerugian panen.
Klasifikasi pangan transgenik menurut Celec et al. (2005) dibagi menjadi dua generasi, yaitu pertama berorientasi pada produser (Producer Oriented) yang menawarkan keuntungan bagi petani seperti dapat menurunkan penggunaan bahan kimia sehingga dapat menurunkan biaya produksi. Selain bermanfaat bagi tanaman, hasil dari tanaman transgenik ini juga bermanfaat bagi lingkungan karena dipercaya dapat mengurangi penggunaan pestisida. Generasi kedua, dibuat berorietasi pada konsumen (Consumer Oriented). Generasi kedua lebih bertujuan agar bahan pangan transgenik dapat bermanfaat bagi konsumen, seperti dapat meningkatkan kadar protein, memodifikasi lemak menjadi lebih sehat, modifikasi karbohidrat, meningkatkan karakteristik flavor, dan meningkatkan kadar fitokimia yang diinginkan.
Azeez dan Nunan (2008) menjelaskan bahwa teknik modifikasi genetik biasanya dilakukan dengan cara memasukkan DNA asing ke dalam DNA tanaman, baik dengan cara proses infeksi bakteri atau dengan cara pengikatan dengan DNA asing. Teknik penyisipan DNA buatan ini dapat menggangu mekanisme biologis alami tanaman tersebut. Gen yang biasanya dimasukkan dari organisme lain seperti bakteri atau produk sintetik, akan menghasilkan protein jenis baru bagi manusia atau hewan. Produksi protein baru tersebut dapat juga menyebabkan jalur biokimia baru pada tanaman itu sendiri.
Proses modifikasi genetik pada kedelai yaitu dengan memasukkan gen Agrobacterium sp strain CP4 ke dalam kedelai yang berikatan dengan 5-enol pyruvylshikimate-3-phosphate synthase (EPSPS) membentuk gen CP4-EPSPS (Chang et al. 2002 dan Wu et al. 2012). Enzim EPSPS merupakan enzim yang terdapat pada tanaman, alga, bakteri, dan fungi yang berfungsi mensintesis asam amino aromatik (Schonbrunn et al. 2001). Nandula et al. (2005) menyatakan bahwa asam amino aromatik merupakan jenis asam amino yang penting untuk pertumbuhan tanaman.
Gliposat merupakan jenis bahan aktif yang terdapat pada herbisida roundup (Schonbrunn et al. 2001). Kemampuan gliposat dalam menghambat sintesis enzim EPSPS sehingga proses pembentukan asam amino aromatik menjadi terhambat telah dimanfaatkan pada proses modifikasi genetik. Nandula et al. (2005) menyatakan bahwa ketika metabolisme asam amino aromatik dihambat, akan menyebabkan gangguan pada beberapa sistem metabolik termasuk juga penghambatan biosintesis protein dan biosintesis produk sekunder sehingga menyebabkan tanaman tersebut mati. Modifikasi genetik pada kedelai membentuk CP4-EPSPS menyebabkan kedelai menjadi resisten terhadap gliposat sehingga ketika terpapar oleh herbisida roundup, tanaman kedelai tersebut tetap mampu menghasilkan asam amino aromatik yang penting untuk pertumbuhan tanaman kedelai, sedangkan gulma yang berada disekitar tanaman kedelai tersebut akan mati.
Berdasarkan hasil penelitian yang dilakukan oleh Padgette et al. (1996) yang melakukan penelitian tentang uji kesepadanan kandungan gizi kedelai transgenik dengan kedelai non transgenik memperlihatkan bahwa secara umum kandungan gizi yang terkandung dalam kedelai transgenik tersebut tidak berbeda secara signifikan dibandingkan kedelai non transgenik. Kedelai transgenik yang digunakan adalah kedelai transgenik lines 40-3-2 dan lines 61-67-1. Kedelai transgenik lines 61-67-1 mendapat tambahan gen pengkodean dari protein β-glucuroni-dase yang berasal dari Escherichia coli, sedangkan kedelai transgenik lines 40-4-2 tidak mendapat tambahan gen pengkodean tersebut. Hasil penelitian tersebut memperlihatkan bahwa berdasarkan hasil analisis proksimat diketahui bahwa terdapat perbedaan yang nyata dari kedelai yang ditanam secara tradisional dibandingkan kedelai transgenik. Kedelai transgenik lines 40-3-2 mengandung kadar abu 5.24 g/100 g, sedangkan kontrol 5.04 g/100 g, kadar lemak 16.28 g/100 g, sedangkan kontrol yaitu 15.52 g/100g dan karbohidrat 37.1 g/100 g, sedangkan kontrol 38.1 g/100g. Analisis proksimat pada kedelai transgenik lines 61-67-1 menunjukkan perbedaan secara nyata hanyalah pada kadar abu yaitu 5.17 g/100 g, sedangkan kontrol 5.04 g /100g.
Hasil pengukuran kadar asam amino dari kedua sampel tersebut menunjukkan bahwa tidak terdapat perbedaan yang nyata dibandingkan kontrol. Hasil pengukuran kadar asam lemak pada kedua jenis kedelai tersebut menunjukkan bahwa kadar asam lemak kedelai transgenik lines 40-3-2 yaitu asam lemak 22:0 (0.53 %) berbeda nyata dibandingkan kontrol (0.50%). Hasil pengukuran kandungan tripsin inhibitor, aktivitas urease, dan kadar isoflavon memperlihatkan tidak terdapat perbedaan yang nyata antar kedelai transgenik tersebut dibandingkan kedelai non transgenik. Dari hasil penelitian tersebut disimpulkan bahwa kandungan gizi kedelai transgenik memiliki kesepadanan dibandingkan kedelai non transgenik.
Tempe
Di Indonesia, kedelai biasanya diolah menjadi tempe, tauco, tahu, kecap, kembang tahu, dan susu kedelai. Dari semua jenis pangan olahan tersebut, tempe merupakan jenis pangan fermentasi kedelai yang berasal dari Indonesia. Secara umum, tempe diartikan sebagai bahan pangan yang dihasilkan melalui proses fermentasi kedelai rebus, dalam waktu tertentu menggunakan kapang (jamur) Rhizopus sp. Pada proses pertumbuhannya, kapang tersebut menghasilkan beberapa enzim yang mampu menghidrolisis senyawa-senyawa kompleks menjadi senyawa yang lebih sederhana, sehingga lebih mudah dicerna dan diserap tubuh. Proses hidrolisis tersebut juga menghasilkan senyawa-senyawa tertentu, penimbul cita rasa tempe yang sangat enak (Astawan 2008).
Selama proses fermentasi, kapang akan tumbuh membentuk miselium berwarna putih yang menutupi permukaan kedelai. Miselium tersebut menghubungkan antar biji kedelai, membentuk massa yang padat, kompak, dan bertekstur lembut. Kondisi lingkungan Indonesia dengan suhu rata-rata 30oC dan kelembaban relatif sekitar 75 persen sepanjang tahun, memungkinkan untuk pembuatan tempe setiap saat tanpa membutuhkan ruang dan peralatan khusus (Astawan 2008).
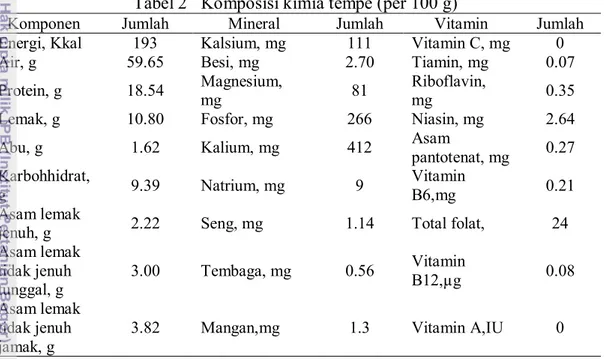
Telah diketahui bahwa nilai gizi protein kedelai mentah sangat rendah yang disebabkan adanya antitripsin, antikimotripsin dan hemaglutinin. Hasil penelitian menunjukkan bahwa kedelai yang diolah dengan cara fermentasi menjadi lebih tinggi nilai gizinya karena daya cerna protein dan ketersediaan dari semua zat gizi dalam kedelai menjadi lebih baik. Selama proses fermentasi, sebagian dari karbohidrat dan protein dipecah menjadi fragmen-fragmen yang lebih mudah dicerna dan diserap oleh usus, sedangkan faktor antitripsin aktivitasnya menjadi hilang (Muchtadi 2010a). Tabel 2 menunjukkan komposisi kimia tempe dalam 100 gram bahan.
Tabel 2 Komposisi kimia tempe (per 100 g)
Komponen Jumlah Mineral Jumlah Vitamin Jumlah
Energi, Kkal 193 Kalsium, mg 111 Vitamin C, mg 0
Air, g 59.65 Besi, mg 2.70 Tiamin, mg 0.07
Protein, g 18.54 Magnesium,
mg 81
Riboflavin,
mg 0.35
Lemak, g 10.80 Fosfor, mg 266 Niasin, mg 2.64
Abu, g 1.62 Kalium, mg 412 Asam
pantotenat, mg 0.27 Karbohhidrat, g 9.39 Natrium, mg 9 Vitamin B6,mg 0.21 Asam lemak
jenuh, g 2.22 Seng, mg 1.14 Total folat, 24
Asam lemak tidak jenuh tunggal, g 3.00 Tembaga, mg 0.56 Vitamin B12,µg 0.08 Asam lemak tidak jenuh jamak, g
3.82 Mangan,mg 1.3 Vitamin A,IU 0
Sumber : USDA Nutrient Database for Standard Reference.
Nout dan Kiers (2005) juga menjelaskan bahwa keberadaan asam lemak dalam gliserida menurun selama proses fermentasi. Produksi asam lemak bebas terjadi dari awal proses fermentasi. Jika produksi gliserol bebas hanya sedikit, ini mengindikasikan bahwa trigliserida telah terhidrolisis secara parsial menjadi gliserida. Selain itu pula, selama proses fermentasi, jumlah kandungan vitamin E tetap konstan, namun kandungan tokoferol bebas mengalami penurunan. Kandungan vitamin K pada kedelai tidak mengalami perubahan selama proses fermentasi tempe oleh Rhizopus sp.
Handoyo dan Morita (2006) menjelaskan bahwa lamanya waktu fermentasi akan menyebabkan terjadinya peningkatan kadar asam amino bebas yang terdapat pada tempe. Peningkatan kadar asam amino bebas tersebut disebabkan aktivitas kapang yang terus menghidrolisis protein hingga membentuk asam amino dan peptida-peptida kecil. Tabel 3 menunjukkan pengaruh lamanya proses fermentasi terhadap kadar asam amino yang terdapat pada tempe dalam 100 gram bahan.
Tabel 3 Jumlah asam amino bebas (mg/100 g) pada proses fermentasi kedelai menggunakan R.oligosporus
Asam amino Waktu Fermentasi (Jam)
0 24 48 72 Isoleusin 4.6 5.2 9.5 55 Leusin 4.2 6.6 10.1 81.7 Lisin 5.1 52.6 3.3 194.9 Metionin 2.1 0.7 1.3 6.3 Fenilalanin 1.4 5.6 6.2 63.4 Treonin 0.2 0.2 0.4 0.1 Valin 3.8 2.8 6.1 59.7 Arginin 26.7 32.4 7.6 21.5 Glisin 2.7 5.2 21.4 61.3 Histidin 1.7 26.4 2.0 50.6 Tirosin 1.3 13.1 4.6 38.1 Alanin 11.2 104.2 229.7 229.8 Asparagin 1.5 22.5 20.1 54.6 Aspartat 3.6 5.4 17.1 28.9 Sistein 0.9 4.5 6.4 15 Glutamat 42.1 16.7 140 147 Prolin 1.0 6.8 20.7 63 Serin 0.1 1.5 3.6 11.2 Ornitin 1.4 5.1 0.0 8.9
Handoyo dan Morita (2006)
Menurut Cahyadi (2007), kandungan vitamin pada tempe khususnya vitamin B komplek seperti riboflavin, niasin, biotin, asam pantotenat, dan vitamin B6 meningkat jumlahnya selama fermentasi, kecuali vitamin B1 karena digunakan oleh kapang tempe sebagai sumber nutrisi pertumbuhan. Kandungan vitamin B12 di dalam tempe berkisar antara 1.5-6.3 mikrogram per 100 gram tempe kering yang dapat mencukupi kebutuhan harian seseorang. Dibandingkan kedelai mentah, nilai gizi tempe lebih baik karena pada kedelai mentah, nilai gizi tempe lebih baik karena pada kedelai mentah terdapat zat-zat antinutrisi seperti antitripsin dan oligosakarida penyebab kelebihan gas dalam lambung (flatulensi). Fermentasi kapang menghilangkan kedua senyawa tersebut dan meningkatkan daya cerna kedelai. Di samping itu, terjadi pula perbaikan tekstur dan flavor sehingga menjadi lebih disukai.
Selain meningkatkan nilai gizi, proses fermentasi kedelai menjadi tempe juga mengubah aroma kedelai yang berbau langu menjadi beraroma khas tempe. Tempe segar memiliki aroma lembut seperti jamur. Aroma ini berasal dari aroma miselium kapang yang bercampur dengan aroma lezat dari asam amino bebas, serta aroma yang timbul akibat penguraian lemak. Semakin lama proses fermentasinya, maka aroma lembut akan berubah jadi tajam karena terjadi pelepasan amoniak (Astawan 2008). Hal senada juga diutarakan oleh Nout dan Kiers (2005) yang menyatakan bahwa manfaat utama dari proses fermentasi kedelai adalah meningkatnya kualitas organoleptik dan kandungan gizi dibandingkan bahan mentah.
Radikal Bebas dan Spesies Oksigen Reaktif
Radikal bebas didefinisikan sebagai suatu molekul, atom atau beberapa grup atom yang mempunyai satu atau lebih elektron tidak berpasangan pada orbital terluarnya. Molekul atau atom tersebut sangat labil dan mudah membentuk senyawa baru. Radikal bebas yang terdapat dalam tubuh dapat berasal dari dalam (endogen) atau dari luar tubuh (eksogen). Secara endogen, radikal bebas terbentuk sebagai respon normal dari rantai peristiwa biokimia dalam tubuh (Muchtadi 2013).
Zadak et al. (2009) menyatakan bahwa target utama serangan radikal di dalam tubuh dapat berupa lipid, protein, karbohidrat, dan DNA sehingga dapat menyebabkan gangguan pada berbagai bagian tubuh. Selain radikal bebas, dikenal juga dengan istilah spesies oksigen reaktif (Reactive Oxygen Species, ROS). Muchtadi (2013) menyatakan bahwa ROS adalah sebutan bagi bermacam-macam molekul dan radikal bebas yang berasal dari molekul oksigen. Lee et al. (2004) menyatakan bahwa baik radikal bebas maupun senyawa ROS di dalam tubuh dapat menyebabkan oksidasi lipid, oksidasi protein, DNA strand break, modifikasi basa DNA, dan modulasi ekspresi genetik.
Devasagayam et al. (2004) menjelaskan bahwa aktivitas antioksidan dalam menetralkan radikal bebas dalam tubuh dapat berupa pencegahan terbentuknya ROS, penangkapan radikal bebas yang masuk ke dalam tubuh, serta perbaikan akibat kerusakan tersebut. Mekanisme pencegahan ini melibatkan enzim superoksida dismutase (SOD) yang dapat mengkatalisis dismutasi (proses oksidasi sekaligus reduksi) superoksida menjadi H2O2 serta dapat mengkatalisis dan juga dapat melarutkannya ke dalam air sehingga dapat dikeluarkan dari tubuh.
Siswonoto (2008) dan Asni et al. (2009) menyatakan bahwa pengukuran radikal bebas secara langsung sangat sulit dilakukan, oleh karena radikal bebas tidak menetap lama, mempunyai waktu paruh yang pendek dan menghilang dalam hitungan detik. Berbagai substansi biologis dikembangkan sebagai penanda biologis (biomarker) stres oksidatif. Substansi yang sudah dikenal dan banyak dipakai sebagai penanda biologis peroksidasi lipid dan stres oksidatif adalah malonaldehid (MDA).
Malonaldehid (MDA) merupakan salah satu produk akhir peroksidasi lipid yang terbentuk setelah aksi senyawa radikal, sehingga digunakan sebagai indikator keberadaan radikal bebas dalam tubuh dan juga indikator kerusakan oksidatif membran sel (Astuti 2009). MDA banyak didapatkan dalam sirkulasi dan merupakan produk utama hasil reaksi radikal bebas dengan fosfolipid, diproduksi secara konstan sesuai dengan proporsi peroksidasi lipid yang terjadi, sehingga merupakan indikator yang baik untuk melihat kecepatan (rate) peroksidasi lipid in vivo (Asni, et al 2009). Vizuet et al. (2009) menyatakan bahwa lipid merupakan biomolekuler yang paling rentan terhadap serangan ROS dan akibat proses lipoperoksidasi akan dihasilkan pembentukan melonaldehida (MDA).
Isoflavon
Flavonoid adalah suatu golongan metabolit sekunder yang dihasilkan oleh tanaman. Isoflavon termasuk dalam golongan flavonoid dan merupakan bagian
dari kelompok terbesar dalam golongan tersebut. Muchtadi (2012) menyatakan bahwa isoflavon merupakan senyawa polifenol yang dapat memperlihatkan peranan seperti estrogen, sehingga seringkali disebut sebagai “fitoestrogen”, yaitu senyawa yang mempunyai aktivitas estrogenik tetapi berasal dari tanaman. Isoflavon juga mempunyai kemampuan sebagai antioksidan. Kacang-kacangan, khususnya kedelai, merupakan sumber utama isoflavon bagi manusia. Kedelai mengandung 12 macam isoflavon, yang terdapat dalam bentuk glukosida (terikat pada molekul gula) dan bentuk aglikon (tidak mengikat gula). Proses pencernaan atau fermentasi kedelai atau hidrolisis enzimatis akan melepaskan molekul gula dari isoflavon glukosida, menghasilkan isoflavon aglikon.
Muchtadi (2012) menjelaskan bahwa kedelai mengandung dua jenis isoflavon utama yaitu genistein dan daidzein, ditambah satu jenis isoflavon minor yaitu glisitein. Kandungan isoflavon produk olahan kedelai bervariasi dan dipengaruhi bukan saja oleh jenis (kultivar) kedelai yang digunakan, tetapi juga oleh proses pengolahannya. Kemungkinan selama pengolahan kedelai ada beberapa bagian isoflavon yang hilang (terbuang) atau rusak akibat proses pemanasan.
Astawan (2008) menyatakan bahwa pada tempe, selain terdapat ketiga jenis isoflavon tersebut, terdapat juga antioksidan faktor II (6,7,4-trihidroksi isoflavon) yang mempunyai aktivitas antioksidan yang kuat dibandingkan isoflavon lain dalam kedelai. Antioksidan ini disintesis pada saat terjadinya proses fermentasi kedelai menjadi tempe oleh bakteri Micrococcus luteus dan Coreyne bacterium. Isoflavon pada olahan kedelai non fermentasi umumnya berada dalam bentuk glikosida, yaitu 64 persen genistin, 23 persen daidzin, dan 13 persen glisetin. Pada produk fermentasi kedelai, seperti tempe dan miso, isoflavon umumnya berbentuk bebas (aglikon), yaitu genistein, daidzein, dan glisetein.
Berdasarkan hasil penelitian yang dilakukan oleh Astuti (1999) dan Unitly (2008), kandungan isoflavon tepung tempe lebih tinggi dibandingkan tepung kedelai. Isoflavon yang dominan yang terdapat pada tepung kedelai dan tepung tempe adalah jenis daidzein dan genistein. Terjadinya proses hidrolisis enzimatis pada saat perendaman kedelai dan hidrolisis enzimatik pada saat perendaman dan fermentasi kedelai dalam proses pembuatan tempe diduga mengubah distribusi isomer aglikon daidzein dan genistein, sehingga menyebabkan perbedaan kandungan isoflavon aglikon yang terdapat di dalamnya.
Astawan (2008) menyatakan bahwa berdasarkan data penelitian pada hewan coba menunjukkan bahwa konsumsi isoflavon yang berlebihan juga tidak disarankan pada manusia, karena berpengaruh negatif terhadap kesuburan. Kelebihan konsumsi umumnya akan terjadi ketika mengonsumsi isolat isoflavon murni. Jika konsumsi isoflavon dilakukan secara alami, maka kecil kemungkinan untuk terjadi kelebihan konsumsi. Oleh karena itu tidak ada yang perlu dikhawatirkan dari konsumsi kedelai dan produk olahannya. Data konsumsi isoflavon untuk penduduk indonesia belum pernah dipublikasi. Beberapa ahli menyarankan agar konsumsi isoflavon per hari adalah 30 – 40 mg/hari.
Vitamin E
Vitamin E adalah salah satu vitamin larut lemak yang memiliki kemampuan sebagai antioksidan. Devasagayam et al. (2004) menyatakan bahwa peranan
antioksidan vitamin E dalam tubuh dapat bertindak sebagai pencegah reaksi pembentukan radikal bebas pada semua membran sel pada tubuh manusia. Vizuet et al. (2009) menyatakan peranan utama antioksidan vitamin E pada membran yaitu sebagai antioksidan larut lemak yang dapat mencegah kerusakan ROS pada asam lemak tidak jenuh ganda (PUFA), dan juga sebagai agen penstabil membran yang berperan dalam pencegahan kerusakan yang disebabkan oleh fosfolipid.
Keberadaan radikal bebas di dalam tubuh dapat dinetralkan oleh berbagai sistem. Zadak et al. (2009) menjelaskan bahwa ada berbagai jenis enzim yang dapat menurunkan konsentrasi oksidan yang berbahaya pada jaringan tubuh seperti glutathione peroxidase, superoxide dismutases dan catalase. Ada pula beberapa jenis mineral esensial seperti selenium, tembaga, mangan dan zinc dibutuhkan untuk pembentukan atau aktivitas enzim tersebut. Selain itu pula, ada beberapa unsur dari sistem pertahanan yang merupakan antioksidan seperti glutation, ubiquinon dan asam urat yang diproduksi selama proses metabolisme normal dalam tubuh. Ada juga antioksidan yang terdapat dari bahan makanan.
Vitamin E bukan merupakan senyawa tunggal, melainkan campuran dari sediktinya delapan macam tokoferol dan tokotrienol. Terdapat empat jenis tokoferol, yaitu α-, β-, γ-, dan δ tokoferol, tetapi yang paling aktif secara biologis adalah alfa-tokoferol. Demikian juga dengan empat macam tokotrienol, dan seperti halnya tokoferol, yang paling aktif secara biologis adalah alfa-tokotrienol (Muchtadi 2013). Devasagayam et al. (2004) menyatakan bahwa asupan harian vitamin E yang dianjurkan adalah sekitar 400-800 IU.
Teknik Evaluasi Nilai Biologis Protein
Nilai gizi protein ditentukan oleh jenis dan proporsi asam amino yang dikandungnya. Almatsier (2004) menjelaskan bahwa protein dengan nilai biologis tinggi atau bermutu tinggi adalah protein yang mengandung semua jenis asam amino esensial dalam proporsi yang sesuai untuk keperluan pertumbuhan. Ada beberapa jenis protein mengandung semua jenis asam amino esensial, tetapi dalam jumlah terbatas yang hanya cukup untuk perbaikan jaringan tubuh, akan tetapi tidak cukup untuk pertumbuhan.
Winarno (2002) menyatakan bahwa asam-asam amino yang biasanya sangat kurang dalam bahan makanan disebut dengan asam amino pembatas. Kalau protein dengan mutu rendah terlalu banyak dikonsumsi dan menunya tidak beraneka ragam, akan berakibat kurangnya asam amino pembatas dan orang akan menderita gejala-gejala yang tidak dikehendaki. Ada banyak sekali cara yang dapat digunakan untuk mengukur mutu protein secara kualitatif, tetapi nampaknya tidak satupun sepenuhnya yang memuaskan. Cara analisis ini dapat dilakukan secara biologis maupun secara kimia.
Suatu cara penilaian untuk mengetahui ketersediaan protein dalam tubuh disebut teknik evaluasi protein. Secara garis besar, metode evaluasi nilai gizi protein digolongkan menjadi dua macam, yaitu metode in vitro (secara kimia, mikrobiologis, atau enzimatis) dan in vivo (secara biologis menggunakan hewan percobaan secara utuh, termasuk manusia) (Muchtadi 2010b). Teknik evaluasi yang mendekati pada keadaan yang sebenarnya dilakukan secara in vivo dengan menggunakan hewan percobaan, yang pada penelitian ini menggunakan tikus putih. Metode yang digunakan tentu harus dapat mengevaluasi kemampuan
metabolisme suatu protein sebagaimana fungsinya, yaitu dapat meningkatkan sintesis jaringan tubuh serta memelihara jaringan dan fungsi tubuh. Nilai gizi protein dapat diukur dengan berbagai cara, protein efficiency ratio (PER), net protein ratio (NPR), true digestibility (TD), biological value (BV), dan net protein utilizaton (NPU).
3
METODE PENELITIAN
Waktu dan Tempat
Penelitian dilaksanakan selama delapan bulan (April s.d. November 2013). Penelitian dilaksanakan di beberapa tempat yaitu di Rumah Tempe Indonesia (RTI) Bogor, Laboratorium Pilot Plant Laboratorium Southeast Asean Food Agricultural Science Technology Center (SEAFAST Center), Laboratorium Hewan, dan Laboratorium Biokimia Pangan Institut Pertanian Bogor.
Bahan dan Alat
Penelitian ini menggunakan tikus putih galur Sprague Dawley (sebagai hewan percobaan) dan tepung tempe sebagai bahan penelitian. Komposisi penyusun ransum tikus terdiri atas pati jagung, campuran mineral, campuran vitamin (merk ‘Fitkom’), minyak jagung, carboximethylcelulose (CMC), kasein, dan beberapa sampel protein uji yaitu tepung tempe kedelai lokal (grobogan) dan impor (PRG dan non PRG). Bahan-bahan untuk keperluan analisis proksimat, analisis kandungan asam amino, analisis kandungan serat pangan, analisis kandungan asam lemak, analisis kandungan isoflavon, analisis vitamin E, analisis antioksidan metode DPPH, serta analisis MDA.
Alat utama yang digunakan dalam penelitian adalah alat pembuatan tepung tempe, seperangkat kandang metabolik, timbangan bahan, timbangan tikus, seperangkat peralatan untuk analisis proksimat, HPLC dan spektrophotometer. Proses pengambilan organ dari hewan hidup memerlukan peralatan yaitu perangkat bedah.
Metode Penelitian
Penelitian ini dibagi menjadi dua tahap, yaitu : (1) tahap uji in vitro meliputi proses pembuatan tempe, proses pembuatan tepung tempe, analisis proksimat tepung tempe, analisis komposisi asam amino, analisis komposisi asam lemak, analisis kandungan serat pangan, analisis vitamin E, analisis isoflavon, serta kapasitas antioksidan secara in vitro metode DPPH, (2) tahap uji in vivo meliputi proses perancangan ransum, masa adaptasi, seleksi dan pengelompokan, masa percobaan (penimbangan berat badan, pengumpulan urin dan feses tikus percobaan), analisis nitrogen urin dan feses tikus percobaan, penentuan nilai gizi protein, pengambilan organ sampel berupa hati serta pengukuran MDA hati.
Tahap Uji In Vitro Proses Pembuatan Tempe (Rumah Tempe Indonesia)
Proses pembuatan tempe dilakukan berdasarkan cara pembuatan yang dilakukan di Rumah Tempe Indonesia (RTI), kedelai pertama kali dibersihkan dalam kondisi masih kering. Setelah itu kedelai dicuci dengan air hingga bersih dari semua partikel debu dan kotoran lain. Kedelai direbus dalam air mendidih bersuhu 1000C selama 30 menit agar kedelai menjadi lunak dan kulitnya mudah lepas. Setelah direbus, kedelai direndam dengan cara membiarkan kedelai rebus beserta air perebusnya mendingin, kemudian dibiarkan pada suhu ruang selama 20-22 jam. Untuk memastikan proses berlangsung dengan baik, pH-nya diukur (pH yang baik 3-5). Tahap selanjutnya adalah proses pelepasan kulit kedelai dengan menggunakan mesin pengupas. Kedelai tanpa kulit direbus kembali selama 30-45 menit. Proses ini bertujuan untuk menghilangkan zat anti gizi pada kedelai, meningkatkan daya cerna, dan membunuh mikroba yang tidak dikehendaki. Butir-butir kedelai ditiriskan dan didinginkan hingga mencapai suhu kamar (25-27 0C). Biji kedelai dicampur dengan ragi tempe (inokulum). Penambahan inokulum ke dalam kedelai masak sebaiknya dilakukan pada kondisi keasaman antara pH 4.8-5.0, kadar air 45-55 persen dan telah mencapai suhu kamar. Kedelai yang telah dicampur dengan inokulum dibungkus dengan kantong plastik PE (polietilen) yang telah diberi lubang. Pemeraman (inkubasi) pada suhu sekitar 30-37 0C dan kelembaban relatif (RH) 70-85 %, selama 46-48 jam hingga seluruh permukaan tempe tertutupi oleh miselium berwarna putih.
Proses Pembuatan Tepung Tempe (Inayati 1991)
Proses pembuatan tepung tempe secara umum melalui tahap-tahap pemotongan tempe segar, pengukusan dengan uap, pengeringan dengan oven, penggilingan dan pengayakkan. Tempe dipotong dengan ketebalan 0.5 cm. Berdasarkan hasil penelitian bahwa pengukusan selama 10 menit pada suhu 80oC menggunakan pengukus serta dengan pengeringan selama 6 jam pada suhu 60oC akan menghasilkan tepung tempe dengan derajat putih yang baik. Penggilingan menggunakan pin disc mill serta pengayakan menggunakan vibrating screen dengan ukuran 60 mesh.
Analisis Proksimat (AOAC 1995) a. Kadar air
Kadar air ditentukan secara langsung dengan menggunakan oven bersuhu 100 oC. Cawan aluminium dikeringkan dalam oven selama 15 menit, didinginkan dalam desikator selama 10 menit, dan selanjutnya ditimbang. Sejumlah sampel disimpan pada cawan tersebut, kemudian dimasukkan ke dalam oven selama 6 jam. Pengeringan dilakukan kembali sampai diperoleh bobot yang konstan. Berikut rumus menghitung kadar air :
dimana: a = berat cawan dan sampel awal (g) b = berat cawan dan sampel kering (g)
c = berat sampel awal (g)
b. Kadar abu
Cawan yang dipersiapkan untuk pengabuan contoh dikeringkan dalam oven selama 15 menit, lalu didinginkan dalam desikator dan ditimbang. Sejumlah sampel dengan bobot tertentu dimasukkan ke dalam cawan, kemudian dibakar dalam ruang asap sampai tidak mengeluarkan asap lagi. Selanjutnya, dilakukan pengabuan di dalam tanur listrik pada suhu 400-600 oC selama 4-6 jam sampai terbentuk abu berwarna putih dan memiliki bobot yang tetap. Abu beserta cawan didinginkan dalam desikator, kemudian ditimbang. Kadar abu contoh dapat dihitung dengan persamaan berikut :
Kadar abu (%) = berat abu
berat sampel x 100 %
c. Kadar lemak
Semua sampel yang digunakan pada penelitian ini merupakan bahan yang tidak banyak mengandung air, sehingga sampel dapat langsung dianalisis. Labu lemak disediakan sesuai dengan ukuran alat ekstraksi soxhlet yang digunakan. Labu dikeringkan dalam oven dengan suhu 105-110 oC selama 15 menit, kemudian didinginkan dalam desikator lalu ditimbang. Sejumlah sampel dengan bobot tertentu dalam kertas saring dan kemudian ditutup dengan kapas bebas lemak. Kertas saring beserta isinya dimasukkan ke dalam ekstraksi soxhlet dan dipasang pada alat kondensor. Pelarut heksana dituangkan ke dalam labu lemak secukupnya dan dilakukan refluks selama 5 jam sampai pelarut yang turun kembali menjadi bening. Pelarut yang tersisa dalam labu lemak didestilasi dan kemudian labu dipanaskan dalam oven pada suhu 105oC. Setelah dikeringkan sampai mencapai bobot tetap, didinginkan dalam desikator, labu beserta lemak ditimbang. Kadar lemak contoh dapat dihitung dengan persamaan berikut :
Kadar lemak (%) = berat lemak
berat sampel x 100 %
d. Kadar protein
Sampel sebanyak 100-250 mg dimasukkan kedalam labu Kjeldahl, ditambah dengan 1.9±0.1 g K2SO4, 40±10 mg HgO dan 3.8±0.1 ml H2SO4 pekat serta tambahkan batu didih. Sampel didestruksi hingga cairan menjadi jernih. Setelah dingin, isi labu dipindahkan ke dalam alat destilasi dan dibilas 5-6 kali dengan air destilata sebanyak 1-2 ml, kemudian ditambahkan 8-10 ml campuran larutan 60% NaOH-5% Na2S2O3. Labu tersebut disambungkan dengan alat destilasi dan kondensor yang telah dilengkapi dengan penampung yaitu labu erlemeyer 125 ml yang berisi larutan 5 ml H3BO3. Destilasi dilakukan sampai diperoleh volume destilat sebanyak 15 ml. Destilat dalam erlenmeyer dititrasi dengan HCl 0.02N sampai larutan berubah warna dari hijau menjadi biru. Indikator yang digunakan dalam titrasi ini adalah campuran dua bagian 0.2% metil merah dalam etanol dan satu bagian 0.2% metilen biru dalam etanol. Sebelum digunakan, HCl terlebih dahulu distandardisasi menggunakan NaOH dengan indikator fenolftalein. NaOH sebelumnya distandardisasi menggunakan
larutan kaliumhidrogenftalat (KHP) dengan indikator fenolftalein. Kadar protein contoh dapat dihitung dengan persamaan :
Kadar N (%) = ml HCL contoh-ml HCL blanko x [HCl]x 0.014
gram sampel x 100 %
Kadar protein (%) = Total nitrogen (%) x faktor konversi Keterangan : Faktor konversi = 6.25
e. Kadar serat kasar
Sampel yang telah bebas lemak dengan metode soxhlet sebanyak ± 2 gram ditempatkan dalam erlenmeyer 600 ml lalu ditambahkan 0.5 g asbes yang telah dipijarkan dan 2 tetes zat anti buih. Selanjutnya ditambahkan 200 ml larutan H2SO4 mendidih kemudian direfluks selama 30 menit. Suspensi yang diperoleh disaring dengan menggunakan kertas saring dan residunya dicuci sampai tidak bersifat asam lagi. Residu kemudian dipindahkan secara kuantitatif ke dalam erlenmeyer lalu ditambah 200 ml NaOH dan direfluks kembali selama 30 menit sambil sesekali digoyang-goyangkan. Suspensi yang diperoleh disaring dengan menggunakan kertas saring yang telah diketahui beratnya sambil dicuci dengan K2SO4 10%, dan residunya dicuci dengan air mendidih dan alkohol 95% sebanyak ± 15 ml. Kertas saring beserta isinya dikeringkan dalam oven 110°C sampai bobotnya konstan (1-2 jam), didinginkan dalam desikator lalu ditimbang. Kadar serat kasar dapat diperoleh dengan persamaan berikut :
Kadar serat kasar (%) = bobot residu
bobot sampel awal x 100 %
f. Kadar karbohidrat (by difference) Kadar karbohidrat dihitung dengan rumus :
Karbohidrat (% bb) = 100 % - (% air + % abu + % protein + % lemak)1) Karbohidrat (% bk) = 100 % - (% abu + % protein + % lemak)2)
1) semua nilai dalam perhitungan menggunakan basis basah 2) semua nilai dalam perhitungan menggunakan basis kering
Analisis Komposisi Asam Amino (AOAC 1999)
Analisis asam amino dengan menggunakan HPLC terdiri atas 4 tahap, yaitu: (1) tahap pembuatan hidrolisat protein; (2) tahap pengeringan; (3) tahap derivatisasi; (4) tahap injeksi serta analisis asam amino.
a. Tahap pembuatan hidrolisat protein
Sampel sebanyak 30 mg ditimbang dan dihancurkan. Sampel yang telah hancur dihidrolisis asam menggunakan HCl 6 N sebanyak 1 ml yang kemudian dipanaskan dalam oven pada suhu 110 0C selama 24 jam. Pemanasan dalam oven dilakukan untuk menghilangkan gas atau udara yang ada pada sampel dan mempercepat reaksi hidrolisis.
b. Tahap pengeringan
Sampel yang telah dihidrolisis pada suhu kamar dipindahkan isinya ke dalam labu evaporator 50 ml, dibilas dengan 2 ml HCl 0.01 N dan cairan bilasan dimasukkan ke dalam labu evaporator. Proses ini diulangi hingga 2-3 kali. Sampel kemudian dikeringkan menggunakan freeze dryer dalam keadaan vakum untuk
mengubah sistein menjadi sistin, ditambahkan 10-20 ml air ke dalam sampel dan dikeringkan dengan freeze dryer. Proses ini diulangi hingga 2-3 kali.
c. Tahap derivatisasi
Larutan derivatisasi sebanyak 30 µl ditambahkan pada hasil pengeringan, larutan derivatisasi dibuat dari campuran larutan stok OPA dengan larutan buffer kalium borat pH 10.4 dengan perbandingan 1:2. Larutan stok OPA dibuat dengan cara mencampurkan 50 mg OPA ke dalam 4 ml metanol dan 0.025 ml merkaptoetanol, dikocok hati-hati dan ditambahkan larutan brij-30 30% sebanyak 0.050 ml dan buffer borat 1 M, pH 10.4 sebanyak 1 ml. Larutan stok pereaksi OPA disimpan pada botol berwarna gelap pada suhu 4 oC. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel. Selanjutnya dilakukan pengenceran dengan cara menambahkan 20 ml asetonitril 60% atau buffer natrium asetat 1 M, lalu dibiarkan selama 20 menit. Kemudian disaring menggunakan kertas saring Whatman.
d. Injeksi ke HPLC
Hasil saringan diambil sebanyak 5 µl untuk diinjeksikan ke dalam HPLC. Konsentrasi asam amino yang ada pada bahan ditentukan dengan pembuatan kromatogram standar dengan menggunakan asam amino yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel.
Kandungan asam amino dalam 100 gram bahan dapat dihitung dengan rumus: % asam amino = luas daerah sampel
luas daerah standar x
C x fp x BM
bobot sampel (μg) x 100 %
Keterangan: C = Konsentrasi standar asam amino (µg/ml)
fp = faktor pengenceran
BM = Bobot molekul dari masing-masing asam amino (g/ml)
Kondisi alat HPLC saat berlangsungnya analisis asam amino sebagai berikut: Temperatur : 27 0C (suhu ruang)
Jenis kolom HPLC : Ultra techspere (Coloum C-18) Kecepatan alir eluen : 1 ml/menit
Tekanan : 3000 psi
Fase gerak : Buffer Na-Asetat dan methanol 95% Detektor : Fluoresensi
Panjang gelombang : 254 nm Analisis Asam lemak (AOAC 1995)
Metode analisis yang digunakan memiliki prinsip mengubah asam lemak menjadi turunannya, yaitu metil ester sehingga dapat terdeteksi oleh alat kromatografi.
a. Ekstraksi
Terlebih dahulu lemak diekstraksi dari bahan lalu dilakukan metilasi sehingga terbentuk metil ester dari masing-masing asam lemak yang didapat. Analisis asam lemak dilakukan dengan menggunakan metode kromatografi gas. Tahap pertama dilakukan ekstraksi soxhlet untuk memperoleh lemak.
b. Pembentukan metil ester (metilasi)
Sebanyak 15-30 mg contoh lemak ditimbang dalam tabung bertutup teflon. Kemudian 1 ml NaOH 0.5 N ditambahkan dalam metanol dan dipanaskan dalam penangas air selama 20 menit. Selanjutnya ditambahkan 2 ml BF3 16 % dan 5 mg/ml standar internal, dipanaskan kembali selama 20 menit. Kemudian didinginkan dan ditambahkan 2 ml NaCl jenuh serta 1 ml isooktan, dikocok dengan baik. Lapisan isooktan dipindahkan dengan bantuan pipet tetes ke dalam tabung yang berisi 0.1 g Na2SO4 anhidrat, dibiarkan 15 menit. Fase cair dipisahkan dan selanjutnya diinjeksikan ke kromatografi gas.
c. Identifikasi dengan kromatografi gas.
Identifikasi asam lemak dilakukan dengan menginjeksikan metil ester pada alat kromatografi gas.
d. Analisis komponen asam lemak, sebagai FAME Kondisi alat diatur sebagai berikut :
Kolom : cyanopropil methyl sil (capilary column)
Dimensi kolom : p = 60 m, Ǿ dalam = 0.25 mm ; 0.25 µm film tickness
Laju alir N2 : 20 ml/menit
Laju alir H2 : 30 ml/menit
Laju alir udara : 200-250 ml/menit Suhu injektor : 2200C
Suhu detektor : 2400C
Suhu kolom : 1250C
Kolom temperatur : 1850C diam 5 menit 2250C diam 5 menit
Rate 100C/menit
Ratio : 1 : 8
Volume injeksi : 1 µl Kecepatan linear : 20 cm/sec
Pelarut sebanyak 1 µl diinjeksikan ke dalam kolom. Waktu retensinya dibandingkan standar untuk mendapatkan informasi mengenai jenis dari komponen-komponen dalam contoh. Contoh dan standar dilakukan secara terpisah, tidak ada penambahan larutan standar ke dalam contoh. Jumlah kandungan komponen dalam contoh dihitung sebagai berikut :
Kandungan asam lemak =
Ax
As x C standar gram sampel
Ket Ax = Area sampel As = Area standar
C = berat standar asam lemak. Analisis serat pangan (AOAC 1995)
Terlebih dahulu kertas saring yang telah dioven ditimbang (W1). Sampel kering bebas/rendah lemak ditimbang sebanyak 1 g dan dimasukkan kedalam erlenmeyer, kemudian ditambah sebanyak 50 ml MES-TRIS (buffer pH 8.2) dan
distirer sampai homogen. Selanjutnya ditambahkan sebanyak 50 µl α-amilase, disimpan di penangas air pada suhu 95-100oC selama 35 menit. Campuran didinginkan sampai mencapai suhu 60oC, dan dinding erlenmeyer dibilas dengan 10 ml air. Sebanyak 100 µl enzim protease ditambahkan dan diinkubasi pada suhu 60oC selama 30 menit. Selanjutnya sebanyak 0.561 N HCL ditambahkan sampai pH 4.5 (4.1-4.6) dan kemudian ditambahkan sebanyak 200 µl amyloglukosidase dan diinkubasi pada suhu 60oC selama 30 menit. Campuran diendapkan dengan 225 ml etanol 95% pada suhu 60oC. Endapan tersebut dibiarkan selama 1 jam pada suhu kamar. Kemudian disaring dengan menggunakan kertas saring yang telah diketahui bobotnya. Setelah itu dicuci dengan 10 ml etanol 78%, 10 ml etanol 95% dan 10 ml aseton dan dikeringkan dengan oven pada suhu 105oC selama semalam. Kertas saring ditimbang bersama residunya. Dilakukan juga koreksi terhadap kadar protein yang tidak tercerna dan kadar abu dalam residu. Perhitungan serat pangan total adalah sebagai berikut :
Serat pangan total : bobot rata-rata 2 residu-(gram protein+gram abu)
bobot sampel x 100%
Analisis vitamin E, metode HPLC (AOAC 1995) a. Preparasi sampel
sampel ditimbang ± 5 gram didalam erlemeyer berleher asah. Ditambah 0.5 gram asam askorbat dan 20 ml etanol p.a, dikocok sampai rata. Kemudian diambil 5 ml ditambah 5 ml KOH 60 %, kocok dengan strirrer ± 30 menit, kemudian ditambah lagi etanol 5 ml. Setelah semua tercampur, sampel disimpan ditempat gelap selama satu malam. Larutan strirrer kembali ± 30 menit sambil ditambah 25 ml campuran petrolium eter : dietil eter (1 : 1). Setelah itu, larutan dipindahkan ke corong pemisah dan erlemeyer dibilas dengan air suling, kemudian dikocok ± 2 menit. Larutan tersebut dibiarkan sampai terpisah, bagian atas ditampung dalam labu kocok yang lain, bagian bawah ditambahkan kembali 15 ml campura petrolium eter : dietil eter (1:1) kemudian dikocok ± 2 menit. Bagian atas disatukan dengan yang tadi, bagian bawah dicuci lagi dengan larutan (1:1). Larutan bawah dibuang, sedangkan larutan atas dicuci dengan air suling ± 5 x 50 ml, pencuci sampai bebas basa. Larutan di freeze dryer, selanjutnya ditambah air : acetonitril (200 ml : 200 ml) sebanyak 5 ml. Larutan diambil 1 ml kemudian ditambah air : actonitril (200 ml : 200 ml) sampai volumenya menjadi 5 ml. Filtrat dilewatkan ke dalam kolom berisi glass wall. Filtrat diambil sebanyak 5 µl dan diinjeksi ke dalam sistem HPLC.
b. Penyiapan larutan standar :
Larutkan 1 mg tokoferol ke dalam 100 ml metanol 95 %. Filtrat diambil 5 µl dan diinjeksi ke dalam sistem HPLC.
c. Kondisi HPLC :
Kondisi alat diatur sebagai berikut :
Kolom : C18.
Mobile fase : Metanol : air (95:5) Flow fase : 1,0 mL/menit.