(Thalassia hemprichii)
ARISTI PRAMADITA PUTRI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ARISTI PRAMADITA PUTRI. C34070031. Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Dugong (Thalassia hemprichii). Dibimbing oleh JOKO SANTOSO dan PIPIH SUPTIJAH.
Lamun dugong (Thalassia hemprichii) merupakan salah satu jenis lamun (seagrass) yang secara tradisional telah dimanfaatkan sebagai obat dan makanan kesehatan. Lamun dugong telah diketahui memiliki beberapa komponen fitokimia seperti steroid/triterpenoid, flavonoid, saponin, dan tannin. Komponen-komponen fitokimia tersebut diduga memiliki aktivitas sebagai antioksidan. Akan tetapi data-data ilmiah yang mendukung khasiat lamun dugong sebagai antioksidan belum pernah dilakukan. Sehingga perlu dilakukan pengkajian mengenai komponen antioksidan dan komponen fitokimia yang terkandung pada lamun dugong. Pengkajian ini dilakukan sebagai salah satu cara untuk mengetahui pemanfaatan lamun dugong di masa yang akan datang.
Tujuan dari penelitian ini adalah untuk menentukan komposisi proksimat, abu tidak larut asam, dan serat pangan serta untuk mengetahui pengaruh perbedaan pelarut dalam ekstraksi terhadap rendemen ekstrak, nilai total fenol, komponen fitokimia, dan aktivitas lamun dugong. Pengujian yang dilakukan meliputi analisis proksimat, uji serat pangan, uji total fenol, uji aktivitas antioksidan dengan metode DPPH dan uji fitokimia.
Lamun dugong pada penelitian ini berasal dari Pulau Pramuka, Taman Nasional Kepulauan Seribu, Jakarta. Lamun dugong mengandung air (86,26%), lemak (0,78%), protein (0,81%), abu (2,34%), karbohidrat (9,81%), dan abu tidak larut asam (0,39%). Total serat pangan yang dikandung oleh lamun dugong sebesar 15,38 g/100g dengan nilai serat pangan larut dan tidak larut masing-masing sebesar 7,83 g/100g dan 7,55 g/100g.
Perbedaan pelarut mempengaruhi karakteristik ekstrak lamun dugong yang dihasilkan. Ekstraksi menggunakan pelarut metanol menghasilkan nilai rendemen, total fenol, dan aktivitas antioksidan yang tertinggi. Rendemen ekstrak lamun dugong dalam pelarut n-heksana, etil asetat, dan metanol berturut-turut yaitu 0,74%, 0,64%, dan 17,11%. Kandungan total fenol ekstrak lamun dugong pada pelarut metanol, etil asetat, dan n-heksana berturut-turut yaitu sebesar 1022,58 mg GAE/1000g ekstrak, 36,19 mg GAE/1000g ekstrak, dan 5,23 mg GAE/1000g ekstrak. Ekstrak kasar lamun dugong memiliki aktivitas
(Thalassia hemprichii)
ARISTI PRAMADITA PUTRI C34070031
Skripsi
Sebagai salah satu syarat untuk mendapatkan gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Aristi Pramadita Putri NRP : C34070031
Departemen : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Joko Santoso, Msi Dra. Pipih Suptijah, MBA NIP . 19670922 199203 1 003 NIP. 19531020 198503 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP.19580511 198503 1 002
Dengan ini saya menyatakan bahwa skripsi yang berjudul
”Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Dugong (Thalassia hemprichii)” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juli 2011
Penulis dilahirkan di Jakarta pada tanggal 25 Januari 1990. Penulis merupakan anak pertama dari dua
bersaudara dari pasangan Bapak Mulyadi, SE, MM dan Ibu Ir. Siti Kamarijah, M.Si.
Pendidikan formal yang ditempuh Penulis dimulai dari TK ABA Socah (tahun 1993-1995). Penulis kemudian melanjutkan pendidikan dasarnya ke SDN Sepanjang Jaya VI Bekasi (tahun
1995-2001). Penulis kemudian melanjutkan pendidikan ke SLTPN 16 Bekasi (tahun 2001-2004) dan melanjutkan ke SMAN 2 Bekasi (tahun 2004-2007). Pada tahun 2007, Penulis diterima sebagai mahasiswa Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis aktif di dalam kegiatan intra kampus seperti organisasi mahasiswa daerah Keluarga Mahasiswa Bekasi (KEMSI) periode 2008-2009 sebagai sekretaris II, Teater Air Fakultas Perikanan dan Ilmu Kelautan periode 2008-2010 sebagai anggota, Fisheries Processing Club (FPC) periode 2008-2010, dan beberapa kegiatan kepanitiaan lainnya. Penulis juga aktif sebagai asisten mata kuliah Teknologi Industri Tumbuhan Laut 2010-2011.
iii
KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah memberikan rahmat dan hidayah-Nya kepada Penulis sehingga dapat menyelesaikan penyusunan skripsi yang berjudul ”Kandungan Fenol, Komponen Fitokimia dan Aktivitas Antioksidan Lamun Dugong (Thalassia hemprichii)”. Skripsi ini disusun sebagai salah satu syarat untuk mendapatkan Gelar Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dan memberi dukungan kepada penulis selama penyusunan skripsi ini, terutama kepada:
1. Dr. Ir. Joko Santoso, MSi dan Dra. Pipih Suptijah, MBA sebagai komisi pembimbing yang telah memberikan pengarahan dan bimbingan dalam penyusunan skripsi ini.
2. Dr. Ir. Ruddy Suwandi, MS, MPhil selaku Ketua Departemen Teknologi Hasil Perairan.
3. Dr. Ir. Agoes M. Jacoeb, Dipl.-Biol selaku dosen penguji dan Ketua Program Studi Departemen Teknologi Hasil Perairan.
4. Keluarga tercinta terutama Bapak dan Ibu serta adikku Akmal yang selalu menyayangi dan menyemangati penulis setiap waktu.
5. Seluruh staff dosen, staff TU, staff laboratorium,dan staff penunjang lainnya, terima kasih atas kerja sama, bantuan bimbingan, dan saran yang sangat berharga bagi penulis.
6. Ir. Sri Andajani, M.Si selaku Kepala Balai Taman Nasional Kepulauan Seribu beserta seluruh staff khususnya M.Firdiansyah yang telah membimbing penulis selama di lapangan.
7. Keluarga besar Laboratorium Uji Biofarmaka khususnya Mba Ina dan Mas Endy atas bantuannya dalam melakukan penelitian.
iv
9. Teman-teman THP 44 yang telah memberikan semangat, dorongan dan bantuan kepada penulis selama masa perkuliahan dan khususnya dalam penyusunan skripsi ini.
10.Rekan-rekan THP 43dan 45 yang telah membantu penulis dalam menyelesaikan penyusunan skripsi ini.
11.Semua pihak yang tidak dapat disebutkan satu per satu disini, penulis mengucapkan terima kasih banyak atas bantuan dan kerjasamanya dalam penyusunan skripsi ini.
Penulis menyadari masih terdapat kekurangan dalam penyusunan skripsi ini. Oleh karena itu, penulis mengharapkan kritik dan saran yang dapat membangun dalam penyempurnaan penyusunan skripsi ini. Penulis berharap semoga penelitian ini bermanfaat dan sesuai dengan yang diharapkan.
Bogor, Juli 2011
v
2.1 Deskripsi dan Klasifikasi Lamun Dugong (Thalassia hemprichii) ... 4
2.2 Ekstraksi Senyawa Aktif ... 5
2.4.2 Triterpenoid/ Steroid... 12
2.4.3 Flavonoid ... 13
2.4.4Saponin ... 13
2.4.5 Fenolhidrokuinon... 14
2.4.6 Tanin ... 14
3.3.1 Pengambilan dan preparasi sampel... 18
3.3.2 Analisis proksimat dan abu tidak larut asam ... 20
3.3.3 Analisis serat pangan ... 22
3.3.4 Ekstraksi bahan aktif ... 24
3.3.5 Uji total fenol ... 24
3.3.6 Uji fitokimia ... 25
vi
3.4 Rancangan Percobaan dan Analisis Data ... 27
4 HASIL DAN PEMBAHASAN ... 29
4.1 Kondisi Perairan Lokasi Penelitian ... 29
4.2 Komposisi Proksimat dan Abu Tidak Larut Asam Lamun Dugong ... 30
4.3 Serat Pangan Lamun Dugong... 33
4.4 Rendemen Ekstrak Lamun Dugong ...34
4.5 Kandungan Total Fenol Lamun Dugong ...36
4.6 Komponen Fitokimia ...37
4.7 Aktivitas Antioksidan dengan Metode DPPH ...40
KESIMPULAN DAN SARAN ... 44
DAFTAR PUSTAKA ... 45
vii
DAFTAR GAMBAR
No Hal
1. Lamun dugong (Thalassia hemprichii) ... 4
2. Struktur Diphenylpycrilhydrazil dan Diphenylpycrilhydrazine ... 11
3. Diagram alir penelitian ...19
4. Kondisi perairan lokasi penelitian ...29
5. Kandungan serat pangan lamun dugong ...33
6. Ekstrak kasar metanol, etil asetat, dan n-heksana ... 35
7. Nilai rendemen ekstrak kasar lamun dugong ... 35
8. Nilai total fenol lamun dugong ... 37
9. Hasil uji steroid/triterpenoid ekstrak lamun dugong ...39
10. Hasil uji flavonoid ekstrak lamun dugong ...40
11. Hasil uji fenolhidrokuinon ekstrak lamun dugong ...40
viii
DAFTAR TABEL
No Hal
ix
DAFTAR LAMPIRAN
No Hal
1. Perhitungan analisis proksimat dan abu tidak larut asam ... 50
2. Perhitungan analisis serat pangan ... 52
3. Data rendemen ekstrak lamun dugong ... 53
4. Hasil analisis ragam dan uji Duncan rendemen ekstrak ... 54
5. Persamaan regresi standar asam tanat ... 55
6. Nilai kandungan total fenol ... 55
7. Hasil analisis ragam dan uji Duncan total fenol ... 57
8. Perhitungan pengenceran DPPH,BHT,dan ekstrak lamun dugong ... 58
9. Perhitungan persen inhibisi dan penentuan IC50 ... 59
10. Hasil analisis ragam dan uji Duncan aktivitas antioksidan ... 65
11. Perubahan warna ekstrak setelah ditambahkan DPPH ... 65
1 PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan kebutuhan utama manusia untuk dapat menjalankan aktivitas tubuh dengan optimal. Tubuh yang sehat akan mendukung manusia dalam memenuhi berbagai kebutuhan hidupnya, sebaliknya kondisi tubuh yang tidak sehat akan menghambat pemenuhan berbagai hajat hidup. Dalam kondisi kesehatan yang prima, pada dasarnya tubuh memiliki antibodi yang dapat melawan dan menangkal infeksi virus, jamur, maupun bakteri. Hal tersebut dapat terjadi jika manusia mengkonsumsi pangan yang mengandung karbohidrat, serat, dan vitamin. Namun pola makan di kota-kota besar saat ini telah berubah dari pola tradisional yang banyak mengandung karbohidrat dan serat menjadi pola modern dengan kandungan protein, lemak, gula, dan garam yang tinggi tetapi miskin serat (Muchtadi 2001).
Pola makan seperti inilah yang memicu timbulnya penyakit degeneratif seperti kanker, katarak, diabetes, dan tekanan darah tinggi akibat radikal bebas dalam tubuh. Reaksi radikal bebas secara umum dapat dihambat oleh antioksidan tertentu baik alami maupun sintetis. Penggunaan antioksidan sintetik di bidang industri telah banyak digunakan karena murah, aman, dan mudah didapatkan. Namun, konsumen saat ini merasa khawatir mengonsumsi pangan berbahan kimia sintetik sehingga antioksidan alami menjadi pilihan lain karena diduga lebih aman dan lebih dapat diterima oleh tubuh (Pokorny et al. 2001). Beberapa studi epidemiologi menunjukkan bahwa peningkatan konsumsi antioksidan fenolik alami yang terdapat dalam buah, sayuran, dan tanaman serta produk-produknya mempunyai manfaat besar terhadap kesehatan yakni dapat mengurangi resiko terjadinya penyakit jantung koroner (Lim et al. 2002). Sebagian besar antioksidan alami berasal dari tumbuhan, antara lain berupa senyawaan tokoferol, karatenoid, flavon, antosianin, asam askorbat, fenol, dan flavonoid (Juniarti et al. 2009; Pokorny et al. 2001; Lim et al. 2002).
organisme perairan tropis lainnya, lamun dugong memproduksi produk alam metabolit sekunder berupa antioksidan sehingga lamun ini sangat prospektif digunakan sebagai sumber obat-obatan dan sebagai makanan kesehatan yakni dapat mencegah munculnya berbagai penyakit degeneratif (Setyati et al. 2003). Akan tetapi kajian ilmiah yang mendukung khasiat lamun dugong sebagai obat-obatan dan makanan kesehatan masih belum banyak dilakukan. Sehingga perlu dilakukan pengkajian ilmiah mengenai metabolit sekunder khususnya aktivitas antioksidan dan komponen fitokimia yang terkandung dalam lamun dugong mengingat lamun dugong berpotensi untuk digunakan sebagai bahan baku
nutraceutical. Oleh karena itu diperlukan suatu proses ekstraksi untuk memperoleh metabolit sekunder yang terkandung dalam lamun dugong.
Ekstraksi merupakan peristiwa pemindahan zat terlarut (solut) antara dua pelarut yang tidak saling bercampur. Proses ekstraksi yang dilakukan pada penelitian ini menggunakan pelarut dengan tingkat kepolaran yang berbeda, yaitu metanol (polar), etil asetat (semipolar), dan n-heksana (nonpolar). Pemberian pelarut dengan tingkat kepolaran berbeda ini dilakukan guna mendapatkan kandungan total fenol, komponen bioaktif dan aktivitas antioksidan yang terbaik serta rendemen ekstrak yang optimal. Sifat-sifat komponen yang akan diekstraksi dan sifat-sifat pelarut merupakan faktor yang menentukan metode ekstraksi yang akan digunakan. Ekstraksi menggunakan pelarut dengan tingkat kepolaran berbeda biasanya menggunakan sampel yang telah dikeringkan. Penggunaan sampel kering ini disebabkan oleh adanya resapan membran sel sampel sehingga
ekstrak metabolit endoseluler yang dihasilkan dari bahan lebih banyak (Colegate dan Molyneux 2008). Rivai et al. (2009) juga menyatakan pengeringan
sampel akan meningkatkan perolehan rendemen ekstrak, kadar senyawa fenolat dan aktivitas antioksidan.
perolehan rendemen ekstrak, kadar senyawa fenolat dan aktivitas antioksidan dapat mencapai hasil yang optimal.
1.2 Tujuan
Tujuan dilakukannya penelitian mengenai aktivitas antioksidan dan komponen bioaktif pada lamun dugong (Thalassia hemprichii) ini adalah:
1) Menentukan komposisi proksimat (air, abu, lemak, protein, dan karbohidrat), abu tak larut asam dan serat pangan lamun dugong;
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Lamun Dugong (Thalassia hemprichii)
Lamun dugong (Thalassia hemprichii) merupakan salah satu tumbuhan dari kelas Angiospermae dan termasuk ke dalam kelompok lamun. Lamun (seagrass) adalah tumbuhan berbunga (Angiospermae) yang sudah sepenuhnya menyesuaikan diri hidup terbenam di dalam laut (Dahuri 2003). Berikut ini klasifikasi taksonomis dari lamun dugong (Thalassia hemprichii) menurut Phillips dan Menez (1988) dalam Soedharma (2007).
Divisi : Anthophyta Kelas : Angiospermae Subkelas : Monocotyledoneae Ordo : Helobiae
Famili : Hydrocharitaceae Genus : Thalassia
Spesies : Thalassia hemprichii
Morfologi lamun dugong dapat dilihat pada Gambar 1.
Gambar 1 Lamun dugong (Thalassia hemprichii)
(Sumber: koleksi pribadi)
ujung daun membulat serta memiliki akar yang berbuku-buku yang pendek. Pada umumnya, lamun dugong ditemukan pada dasar berlumpur dan berpasir, hidup bersama dengan jenis lamun lain yaitu Enhalus acoroides dan Halophila ovalis
(Setyawan et al. 2009).
Pertumbuhan lamun diduga sangat dipengaruhi oleh faktor-faktor internal seperti kondisi fisiologis dan metabolisme, serta faktor eksternal seperti zat-zat hara dan tingkat kesuburan pertanian. Kecepatan tumbuh daun lamun dugong adalah 4,51 mm hari-1 untuk daun baru maupun daun lama (Dahuri 2003). Lamun dugong mampu tumbuh dan berkembang dalam kondisi tak beroksigen
(anoxia) atau berkadar oksigen rendah yang merupakan sifat habitat pasang surut yang dangkal. Hal ini disebabkan karena lamun ini mempunyai strategi metabolik (dengan mikrozoma akar aerobik) sehingga mampu berkoloni di habitat laut dangkal dengan berhasil dan mengusir sebagian kelompok tumbuh-tumbuhan lainnya (Romimohtarto dan Juwana 2007).
Lamun yang dijumpai di Asia Tenggara berjumlah 20 jenis dan hanya 12 jenis lamun yang dijumpai di perairan Indonesia. Penyebaran padang lamun di Indonesia mencakup perairan Jawa, Sumatera, Bali, Kalimantan, Sulawesi, Maluku, Nusa Tenggara, dan Irian Jaya. Lamun dugong (T. hemprichii)
merupakan spesies yang dominan dan dijumpai hampir di seluruh Indonesia (Dahuri 2003).
Pemanfaatan lamun secara umum hingga saat ini yaitu sebagai bahan kerajinan, bahan kasur, atap rambai, bahan upholstery dan kemasan, pupuk, penyaring limbah, stabilisator pantai, bahan untuk pabrik kertas, sumber bahan kimia penting, dan fooder (makanan hewan/ternak) (KLH 2001). Ekosistem
padang lamun sangat penting artinya bagi kehidupan penyu hijau (Chelonia mydas) dan dugong (Dugong dugon), karena tumbuhan tersebut
merupakan sumber makanan bagi kedua jenis hewan air itu. Thalassia hemprichii
merupakan salah satu jenis lamun yang dikonsumsi oleh penyu hijau (Dahuri 2003).
2.2 Ekstraksi Senyawa Aktif
mengambil zat terlarut tersebut dari satu pelarut ke pelarut yang lain (Rahayu 2009). Sudjadi (1986) juga menyatakan bahwa ekstraksi merupakan
teknik yang sering digunakan bila senyawa organik dilarutkan atau didispersikan dalam air. Pelarut yang tepat ditambahkan pada fase larutan dalam airnya. Larutan organik dan air akan terpisah dan senyawa organik akan mudah diambil ulang dari lapisan organik dengan menguapkan pelarutnya. Teknik ekstraksi bermanfaat untuk memisahkan campuran senyawa dengan berbagai sifat kimia yang berbeda. Ekstraksi meliputi distribusi zat terlarut diantara dua pelarut yang tidak dapat tercampur. ekstraksi dapat dilakukan dengan dua cara yaitu aqueus phase dan
organic phase. Cara aqueus phase dilakukan dengan menggunakan air, sedangkan
cara organic phase dilakukan dengan menggunakan pelarut organik (Rahayu 2009).
Sifat penting yang harus diperhatikan dalam pemilihan pelarut adalah kepolaran senyawa yang dilihat dari gugus polarnya (seperti gugus OH, COOH, dan lain sebagainya). Hal ini yang perlu diperhatikan dalam pemilihan pelarut adalah selektivitas, kelarutan, kemampuan tidak saling bercampur, kerapatan, reaktivitas dan titik didih. Ekstrak dan pelarut biasanya harus dipisahkan dengan cara penguapan, destilasi atau rektifikasi, maka titik didih kedua bahan tidak boleh terlalu dekat (Rahayu 2009).
Menurut Kurnia (2010), ekstraksi dengan pelarut dapat dilakukan dengan cara dingin dan cara panas. Cara dingin yaitu metode maserasi dan perkolasi, sedangkan cara panas antara lain dengan refluks, soxhlet, digesti, destilasi uap dan infuse. Harborne (1987) mengelompokkan metode ekstraksi menjadi dua, yaitu ekstraksi sederhana dan ekstraksi khusus. Ekstraksi sederhana terdiri atas:
a) Maserasi, yaitu metode ekstraksi dengan cara meredam sampel dalam pelarut dengan atau tanpa pengadukan;
b) Perkolasi, yaitu metode ekstraksi secara berkesinambungan;
Ekstraksi khusus terdiri atas:
a) Sokletasi, yaitu metode ekstraksi secara berkesinambungan untuk melarutkan sampel kering dengan menggunakan pelarut bervariasi;
b) Arus balik, yaitu metode ekstraksi secara berkesinambungan dimana sampel dan pelarut saling bertemu melalui gerakan aliran yang berlawanan;
c) Ultrasonik, yaitu metode ekstraksi dengan menggunakan alat yang menghasilkan frekuensi bunyi atau getaran antara 25-100 KHz
2.3 Antioksidan
Antioksidan adalah senyawa-senyawa yang mampu menghilangkan, membersihkan, menahan pembentukan ataupun memadukan efek spesies oksigen reaktif (Muchtadi 2001). Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal bebas. Antioksidan juga merupakan senyawa yang dapat menghambat reaksi oksidasi, dengan mengikat radikal bebas, dan molekul yang sangat reaktif sehingga kerusakan sel akan dihambat (Winarsi 2007).
2.3.1 Fungsi antioksidan
Penggunaan senyawa antioksidan juga antiradikal saat ini semakin meluas seiring dengan semakin besarnya pemahaman masyarakat tentang peranannya dalam menghambat penyakit degeneratif. Penyakit degeneratif yang ditimbulkan akibat efek dari radikal bebas seperti tekanan darah tinggi, jantung koroner, diabetes dan kanker yang didasari oleh proses biokimiawi dalam tubuh. Masalah-masalah ini berkaitan dengan kemampuan antioksidan untuk bekerja sebagai
inhibitor (penghambat) reaksi oksidasi oleh radikal bebas reaktif (Kuncahyo dan Sunardi 2007).
Radikal bebas yang dihasilkan secara terus menerus selama proses metabolisme normal, dianggap sebagai penyebab terjadinya kerusakan fungsi sel-sel tubuh yang akhirnya menjadi pemicu timbulnya penyakit degeneratif. Reaksi radikal bebas secara umum dapat dihambat oleh antioksidan tertentu baik alami maupun sintetis (Juniarti et al. 2009). Di dalam tubuh kita terdapat senyawa yang disebut antioksidan yaitu senyawa yang dapat menetralkan radikal bebas seperti enzim Superoksida Dismutase (SOD), gluthatione peroksidase, dan katalase. Selain itu, antioksidan dapat diperoleh dari asupan makanan yang banyak mengandung vitamin C, vitamin E dan betakaroten serta senyawa fenolik (Andayani et al. 2008).
Menurut Hariyatmi (2004), antioksidan memiliki beberapa fungsi yaitu sebagai pemutus rantai reaksi pembentuk radikal bebas dengan menyumbangkan atom H, pereduksi dengan mentransfer atom H atau oksigen, pengikat logam dan mampu mendekomposisi hidroperoksida menjadi bentuk stabil. Fungsi antioksidan lainnya yaitu dapat digunakan sebagi upaya untuk memperkecil terjadinya proses oksidasi dari lemak dan minyak, memperkecil terjadinya proses kerusakan dalam makanan, memperpanjang masa pemakaian dalam industri makanan, meningkatkan stabilitas lemak yang terkandung dalam makanan serta mencegah hilangnya kualitas sensori dan nutrisi (Kuncahyo dan Sunardi 2007). Selain itu, antioksidan juga berperan penting untuk mempertahankan mutu produk pangan. Berbagai kerusakan seperti ketengikan, perubahan nilai gizi, perubahan warna dan aroma, serta kerusakan fisik lain pada produk pangan karena oksidasi dapat dihambat oleh antioksidan (Trilaksani 2003).
2.3.2 Jenis antioksidan
sintetis untuk tujuan komersial. BHA memiliki kemampuan antioksidan (carry through, kemampuan antioksidan baik dilihat dari ketahanannya terhadap tahap-tahap pengolahan maupun stabilitasnya pada produk akhir) yang baik pada lemak hewan dalam sistem makanan panggang, namun relatif tidak efektif pada minyak tanaman. BHA bersifat larut lemak dan tidak larut air, berbentuk padat putih dan dijual dalam bentuk tablet atau serpih serta bersifat volatil. Antioksidan sintetik BHT memiliki sifat serupa BHA, akan memberi efek sinergis bila dimanfaatkan bersama BHA, berbentuk kristal padat putih dan digunakan secara luas karena relatif murah. TBHQ dikenal sebagai antioksidan paling efektif untuk lemak dan minyak, khususnya minyak tanaman karena memiliki kemampuan antioksidan yang baik pada penggorengan tetapi rendah pada pembakaran (Trilaksani 2003).
Antioksidan alami yang terdapat dalam bahan pangan dapat dikategorikan menjadi dua golongan, yaitu pertama yang tergolong zat gizi, yaitu: vitamin A dan karatenoid, vitamin E, vitamin C, vitamin B2, seng (Zn), tembaga (Cu), selenium (Se) dan protein, dan yang kedua tergolong sebagai zat non-gizi, seperti biogenik amin, fenol, polifenol, tanin dan komponen tetrapirolik (Muchtadi 2001). Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan spesies oksigen reaktif, mampu menghambat terjadinya penyakit degeneratif serta mampu menghambat peroksidase lipida pada makanan. Meningkatnya minat untuk mendapatkan antioksidan alami terjadi beberapa tahun terakhir ini. Antioksidan alami umumnya mempunyai gugus hidroksi dalam struktur molekulnya (Kuncahyo dan Sunardi 2007).
Antioksidan alami ditemukan hampir di semua jenis tanaman, mikroorganisme, jamur, dan jaringan hewan. Bahan pangan yang dapat dijadikan sebagai sumber antioksidan alami, seperti rempah-rempah, coklat, biji-bijian, buah-buahan, dan sayur-sayuran. Umumnya, antioksidan alami terdiri dari komponen fenol dan kelompok antioksidan alami terpenting yaitu tokoferol, flavonoid, dan asam fenol (Pokorny et al. 2001).
2.3.3 Mekanisme kerja antioksidan
oksigen reaktif, mengubah jenis oksigen reaktif menjadi kurang toksik, mencegah kemampuan oksigen reaktif, memperbaiki kerusakan yang timbul. Antioksidan yang baik akan bereaksi dengan radikal bebas segera setelah senyawa tersebut terbentuk. Mekanisme antioksidan dalam menghambat oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi, dapat disebabkan oleh empat macam mekanisme reaksi, yaitu pelepasan hidrogen dari antioksidan, pelepasan elektron dari antioksidan, adisi lemak ke dalam cincin aromatik pada antioksidan, dan pembentukan senyawa kompleks antara lemak dan cincin aromatik dari antioksidan (Ketaren 1986).
Sesuai mekanisme kerjanya, antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan yang mempunyai fungsi utama tersebut sering disebut antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara tepat ke radikal lipida atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Beberapa contoh antioksidan primer adalah superoksida dismutase (SOD),
2.4 Uji Aktivitas Antioksidan
Salah satu uji untuk menentukan aktivitas antioksidan penangkap radikal adalah metode 1,1 diphenyl-2-picrylhidrazyl (DPPH). Metode ini memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. Penangkapan radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Kuncahyo dan Sunardi 2007).
Metode serapan radikal DPPH merupakan metode yang sederhana, mudah, waktu pengujian singkat dan sampel yang digunakan sedikit serta tidak membutuhkan banyak reagen seperti halnya uji lain (xantin-xantin oksidase, metode Tiosianat, antioksidan total). Hasil pengukuran menunjukkan kemampuan antioksidan sampel secara umum tidak berdasarkan jenis radikal yang dihambat. Pada metode ini, DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari bahan uji, dimana DPPH akan bereaksi dengan antioksidan tersebut membentuk 1,1-difenil-2-pikril hidrazin (Juniarti et al. 2009). Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan dapat dilihat pada Gambar 2.
Diphenylpicrylhydrazyl (radikal bebas) Diphenylpicrylhydrazine (non radikal) Gambar 2 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan
(Sumber: Molyneux 2004)
semakin tinggi aktivitas antioksidan. Secara spesifik suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 0,05 mg/ml, kuat untuk IC50 antara 0,05-0,10 mg/ml, sedang jika IC50 bernilai 0,10-0,15 mg/ml dan lemah jika IC50 bernilai 0,15-0,20 mg/ml (Molyneux 2004).
2.5 Fitokimia
Fitokimia merupakan senyawa bioaktif dari tanaman yang dapat melindungi kesehatan manusia dari penyakit degeneratif. Kelompok utama fitokimia yang diduga berkontribusi dengan antioksidan tanaman yaitu polifenol,
karotenoid, dan antioksidan vitamin seperti vitamin C dan vitamin E (Lako et al. 2007). Fitokimia memiliki peran penting dalam penelitian obat yang
dihasilkan dari tumbuh-tumbuhan. 2.5.1 Alkaloid
Alkaloid adalah suatu golongan senyawa organik yang terbanyak ditemukan di alam. Hampir seluruh senyawa alkaloid berasal dari tumbuh-tumbuhan dan tersebar luas dalam berbagai jenis tumbuh-tumbuhan. Semua alkaloid mengandung paling sedikit satu atom nitrogen yang biasanya bersifat basa dan dalam sebagian besar atom nitrogen ini merupakan bagian dari cincin heterosiklik (Lenny 2006). Alkaloid mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem siklik (Harborne 1987).
Hampir semua alkaloid yang ditemukan di alam mempunyai keaktifan biologis tertentu, ada yang sangat beracun tetapi ada pula yang sangat berguna dalam pengobatan. Jenis dan konsentrasi alkaloid dapat menjadi sangat beracun, salah satu jenis alkaloid yang beracun adalah nikotin. Alkaloid memiliki kegunaan dalam bidang medis, antara lain sebagai analgetika dan narkotika, mengubah kerja jantung, penurun tekanan darah, obat asma, sebagai antimalari, stimulan uterus, dan anastesi lokal (Sirait 2007).
2.5.2 Triterpenoid/ Steroid
terbentuk dari dua atau lebih banyak satuan isoprene (C5) (Sirait 2007). Secara umum triterpenoid diekstrak dari jaringan tumbuhan memakai eter minyak bumi, eter atau kloroform dan dapat dipisahkan secara kromatografi pada silika gel atau alumina memakai pelarut tersebut. Terpenoid terdiri atas beberapa macam senyawa yaitu komponen minyak atsiri, diterpenoid, giberelin, triterpenoid, steroid dan karotenoid (Lenny 2006).
2.5.3 Flavonoid
Senyawa flavonoid adalah suatu kelompok senyawa fenol yang terbesar yang ditemukan di alam. Senyawa-senyawa ini merupakan zat warna merah, ungu dan biru serta sebagai zat warna kuning yang ditemukan dalam tumbuh-tumbuhan. Secara biologis flavonoid memainkan peranan penting dalam kaitan penyerbukan tanaman oleh serangga. Sejumlah flavonoid mempunyai rasa pahit sehingga dapat bersifat menolak jenis ulat tertentu (Lenny 2006).
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada satu atau lebih grup hidroksil fenolik. Flavonoid terdapat pada seluruh bagian tanaman termasuk pada buah, tepung sari, dan akar. Flavonoid berperan terhadap warna dalam organ tumbuhan seperti bunga, buah, daun, atau warna pada pigmen. Flavonoid pada tumbuhan berguna untuk menarik serangga dan binatang lain untuk membantu proses penyerbukan dan penyebaran biji (Sirait 2007). Flavonoid sebagai antioksidan berfungsi sebagai pengikat logam, mampu mengikat zat peroksida, seperti Fe dan Cu (Hariyatmi 2004). 2.5.4 Saponin
bukti terpercaya akan adanya saponin. Saponin jauh lebih polar dari pada sapogenin karena ikatan glikosidanya (Harborne 1987).
Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada epitel hidung, bronkus, dan ginjal. Stimulasi pada ginjal diperkirakan menimbulkan efek diuretika. Sifat menurunkan tegangan muka yang ditimbulkan oleh saponin dapat dihubungkan dengan daya ekspentoransia, dengan sifat ini lendir akan dilunakkan atau dicairkan. Saponin dapat juga sebagai prekursor hormon steroid (Sirait 2007).
2.5.5 Fenolhidrokuinon
Kuinon adalah senyawa berwarna dan memiliki kromofor dasar. Kuinon dapat dibagi menjadi empat kelompok yaitu, benzokuinon, naftokuinon.
antrakuinon, dan kuinon isoprenoid. Senyawa kuinon yang terdapat sebagai
glikosida sedikit larut dalam air, kuinon lebih mudah larut dalam lemak dan akan terekstraksi dalam tumbuhan bersama-sama dengan karotenoid dan klorofil. Reaksi yang khas adalah reduksi bolak-balik yang mengubah kuinon menjadi senyawa tanpa warna, kemudian warna kembali lagi bila terjadi oksidasi oleh udara. Reduksi dapat dilakukan dengan menggunakan natrium borohidrida (Harbone 1987).
2.5.6 Tanin
Tanin adalah senyawa organik yang terdiri dari campuran senyawa polifenol kompleks, dibangun dari elemen C, H dan O serta sering membentuk molekul besar dengan berat molekul lebih besar dari 2000. Tanin dapat dijumpai pada hampir semua jenis tumbuhan hijau di seluruh dunia baik tumbuhan tingkat tinggi maupun tingkat rendah dengan kadar dan kualitas yang berbeda-beda. Senyawa ini memiliki sifat antara lain dapat larut dalam air atau alkohol karena tanin banyak mengandung fenol yang memiliki gugus OH, dapat mengikat logam berat, serta adanya zat yang bersifat antirayap dan jamur. Tanin yang terdapat pada kulit kayu dan kayu dapat berfungsi sebagai penghambat
2.6 Serat Pangan (Dietary Fiber)
Serat pangan merupakan komponen dari jaringan tanaman yang tahan terhadap proses hidrolisis oleh enzim dalam lambung dan usus kecil. Serat-serat tersebut banyak berasal dari dinding sel berbagai sayuran dan buah-buahan. Secara kimia dinding sel tersebut terdiri dari beberapa jenis karbohidrat seperti selulosa, hemiselulosa, pektin, dan nonkarbohidrat seperti polimer lignin,
beberapa gum, dan mucilage. Karena itu dietary fiber pada umumnya merupakan
karbohidrat atau polisakarida. Berbagai jenis makanan nabati pada umumnya
banyak mengandung dietary fiber (Winarno 2008).
Walaupun demikian serat kasar tidaklah identik dengan dietary fiber.
Menurut Scala (1975) dalam Winarno (2008) kira-kira hanya seperlima sampai
setengah dari seluruh serat kasar yang benar-benar berfungsi sebagai dietary fiber.
Kadang-kadang juga digunakan istilah “residu non-nutritif“ untuk menunjukkan
bagian dari makanan yang tidak dapat dicerna dan diserap oleh tubuh. Akan tetapi sesungguhnya residu non-nutritif tersebut tidak sama dengan serat pangan, meskipun ada bagian-bagian pangan yang tercakup pada keduanya. Perbedaan utama antara keduanya adalah pada residu non-nutritif terkandung dinding sel bakteri (mikroflora) usus yang juga tidak dapat dicerna oleh enzim-enzim pencernaan.
Secara umum serat pangan (dietary fiber) didefinisikan sebagai kelompok
polisakarida dan polimer-polimer lain yang tidak dapat dicerna oleh sistem gastrointestinal bagian atas tubuh manusia. Terdapat beberapa jenis komponennya yang dapat dicerna (difermentasi) oleh mikroflora dalam usus besar menjadi
produk-produk terfermentasi. Serat pangan total (total dietary fiber, TDF) terdiri
dari komponen serat pangan larut (soluble dietary fiber, SDF) dan serat pangan
tidak larut (insoluble dietary fiber, IDF). SDF diartikan sebagai serat pangan yang
Serat pangan larut dan tidak larut memiliki manfaat yang berbeda namun keduanya akan bekerja sama dan saling melengkapi. Serat larut akan membentuk gel sehingga makanan yang mengandung serat larut dalam lambung akan menimbulkan rasa kenyang dan makanan akan tinggal lebih lama. Hal ini dikarenakan penyerapan makanan pada dinding usus berlangsung lambat dan juga serat akan terikat pada gel yang terbentuk. Berbeda halnya dengan serat tidak larut, serat ini tidak dapat membentuk gel dalam proses pencernaan namun tetap akan menimbulkan efek kenyang dalam lambung. Rasa kenyang yang didapat tidak akan berbeda dengan makanan tanpa serat. Namun demikian, dengan mengonsumsi serat asupan kalori yang didapatkan lebih rendah (Yuliarti 2008).
Pada masa lalu, serat pangan hanya dianggap sebagai sumber energi yang
tidak tersedia (non-available energy source) dan hanya dikenal mempunyai efek
sebagai pencahar perut. Akan tetapi berdasarkan penelitian Muchtadi (2001) dapat diketahui bahwa terdapat suatu hubungan erat antara konsumsi serat pangan dan insiden timbulnya berbagai macam penyakit. Salah satu contohnya yaitu pengaruh
konsumsi dietary fiber pada kadar kolesterol tinggi telah dibuktikan pada pasien
sukarelawan, yang kemudian juga dibuktikan pada hewan percobaan, bahwa pasien yang memiliki kandungan kolesterol tinggi tetapi rendah konsumsi serat
bahan makanan, dengan meningkatkan konsumsi dietary fiber akan nyata turun
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Februari sampai dengan Mei 2011. Sampel lamun diambil dari Pulau Pramuka, Taman Nasional Kepulauan Seribu. Proses preparasi sampel dilakukan di Laboratorium Karakteristik Bahan Baku. Analisis proksimat dan abu tidak larut asam dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan. Analisis serat pangan dilakukan di Laboratorium Biokimia
Pangan, Fakultas Teknologi Pertanian. Proses ekstraksi (maserasi) dan uji aktivitas antioksidan dilakukan di Laboratorium Uji Biofarmaka Pusat Studi
Biofarmaka LPPM IPB. Uji total fenol dan fitokimia dilakukan di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan, IPB.
3.2 Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah lamun dari jenis
Thalassia hemprichii yang diperoleh dari perairan Pulau Pramuka yang terletak di wilayah Taman Nasional Kepulauan Seribu. Bahan-bahan yang digunakan untuk analisis proksimat adalah dietil eter, K2SO4, HgO, H2SO4, H2O2, H3BO3,
bromcherosol green, methyl red, NaOH-Na2S2O3, dan HCl. Bahan-bahan untuk uji serat pangan, antara lain akuades, etanol 95%, etanol 78%, aseton, buffer fosfat, enzim thermamyl, HCl 4N, pepsin, NaOH 4N, pankreatin, dan Na2PO4 anhidrat. Jenis pelarut teknis yang digunakan dalam ekstraksi yaitu metanol (pelarut polar), etil asetat (pelarut semipolar), dan n-heksana (pelarut nonpolar). Bahan-bahan untuk uji aktivitas antioksidan adalah ekstrak lamun
Thalassia hemprichii, 1,1-diphenil-2-picryhydrazyl (DPPH), metanol, dan
Alat-alat yang digunakan untuk analisis proksimat, abu tidak larut asam dan serat pangan meliputi timbangan digital, pisau, sudip, cawan perselen, aluminium foil, gegep, desikator, oven, kompor listrik, tanur pengabuan, kertas saring Whatman 42 bebas abu dan bebas lemak, kapas bebas lemak, labu lemak, kondensator, tabung soxhlet, penangas air, labu kjeldahl, desikator, labu Erlenmeyer, buret, pipet volumetrik. Alat-alat yang digunakan untuk ekstraksi meliputi pipet tetes, corong kaca, botol vial, labu Erlenmeyer, kertas saring Whatman 42, gelas ukur, gelas piala, magnetic stirrer dan vacuum rotary evaporator. Alat-alat yang digunakan untuk uji total fenol antara lain timbangan digital, spektrofotometer UV-VIS, tabung reaksi dan vortex. Alat-alat yang digunakan untuk uji fitokimia meliputi tabung reaksi, pipet dan plate tetes. Alat-alat yang digunakan untuk uji aktivitas antioksidan meliputi timbangan digital, tabung reaksi, sudip, pipet mikro, mikroplate dan elisa reader.
3.3 Tahapan Penelitian
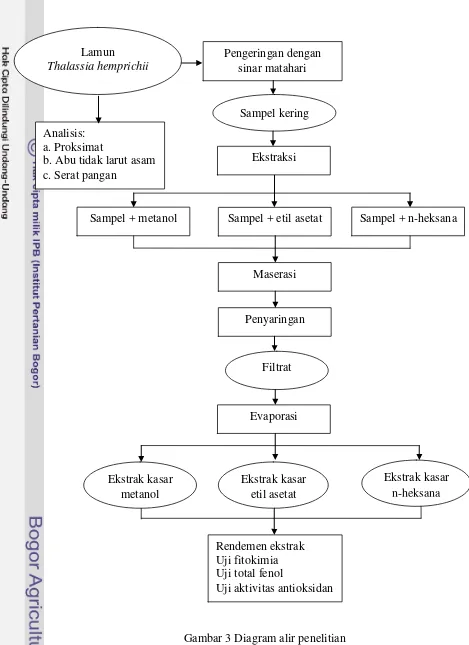
Thalassia hemprichii di perairan Pulau Pramuka yang terletak di wilayah Taman Nasional Kepulauan Seribu, Jakarta. Lamun yang diambil dari perairan segera dibersihkan dari kotoran-kotoran yang menempel dengan menggunakan air tawar untuk menghilangkan garam-garam yang masih menempel pada lamun. Lamun yang digunakan berupa lamun utuh dan tidak dipisahkan antar bagiannya. Sampel segar untuk analisis proksimat dan abu tidak larut asam dimasukkan ke dalam plastik kecil dan sebagian lagi dikeringkan dengan sinar matahari selama tiga hari. Sampel yang sudah kering kemudian dihancurkan dengan menggunakan blender
Gambar 3 Diagram alir penelitian Evaporasi
Filtrat
Ekstrak kasar metanol
Sampel + metanol Sampel + etil asetat Sampel + n-heksana
Maserasi
Penyaringan Pengeringan dengan
sinar matahari
Analisis: a. Proksimat
b. Abu tidak larut asam c. Serat pangan
Ekstraksi Lamun
Thalassia hemprichii
Sampel kering
Ekstrak kasar etil asetat
Ekstrak kasar n-heksana
Rendemen ekstrak Uji fitokimia Uji total fenol
3.3.2 Analisis proksimat dan abu tidak larut asam
Analisis proksimat merupakan suatu analisis yang dilakukan untuk
memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis
kadar air, lemak, protein, abu, dan karbohidrat.
(a) Kadar air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah
mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 1 jam.
Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) atau
dibiarkan hingga beratnya konstan kemudian ditimbang. Sebanyak 5 gram contoh
dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada
suhu 105 oC selama 5 jam atau hingga beratnya konstan. Cawan tersebut
kemudian dimasukkan ke dalam desikator dan dibiarkan sampai beratnya konstan,
selanjutnya ditimbang kembali.
Perhitungan kadar air :
(b) Kadar lemak (AOAC 2005)
Contoh seberat 1 gram (W1) dimasukkan ke dalam kertas saring pada kedua
ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke
dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan
dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan
dengan tabung Soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor
tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana). Kemudian
dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak
didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan
tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke
dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada
suhu 105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya
Perhitungan kadar lemak :
Keterangan : W1 = Berat sampel (g)
W2 = Berat labu lemak kosong (g)
W3 = Berat labu lemak dengan lemak (g)
(c) Kadar protein (AOAC 1980)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap,
yaitu destruksi, destilasi dan titrasi. Pengukuran kadar protein dilakukan dengan
metode mikro Kjeldahl. Sampel ditimbang sebanyak 0,25 gram dimasukkan ke
dalam labu Kjeldahl 100 ml. Sebanyak 0,25 gram Selenium dan 3 ml H2SO4 pekat
serta sampel didestruksi (pemanasan dalam keadaan mendidih) pada suhu 410 oC
selama 1 jam sampai larutan jernih. Setelah dingin ditambahkan 50 ml aquades
dan 20 ml NaOH 40%, lalu didestilasi dengan suhu destilator 100 oC. Hasil
destilasi ditampung dalam labu Erlenmeyer yang berisi campuran 10 ml H3BO3 2% dan 2 tetes indikator bromcherol green-methyl red berwarna
merah muda (1:2). Setelah volume hasil tampungan (destilat) menjadi 40 ml dan
berwarna hijau kebiruan, destilasi dihentikan dan destilat dititrasi dengan
HCl 0,10 N sampai berwarna merah muda. Perlakuan yang sama dilakukan juga
terhadap blanko. Dengan metode ini diperoleh kadar nitrogen total yang dihitung.
Kadar protein dihitung dengan rumus sebagai berikut:
(d) Kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu
105 oC, kemudian didinginkan selama 15 menit di dalam desikator hingga
didapatkan berat yang konstan dan ditimbang. Sampel sebanyak 5 gram
dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen
hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan
dengan suhu 400 oC selama 1 jam, kemudian dimasukkan dalam desikator hingga
Kadar abu dihitung dengan rumus sebagai berikut:
(e) Kadar abu tidak larut asam menurut SNI 01-3836-2000 (BSN 2000)
Abu hasil penetapan kadar abu total dilarutkan dalam 25 ml HCl 10% dan
dididihkan selama 5 menit. Larutan tersebut kemudian disaring dengan kertas
saring bebas abu dan dicuci dengan air suling sampai bebas klorida. Kertas saring
kemudian dikeringkan dalam oven. Abu yang telah kering kemudian diabukan
kembali dalam tanur dengan menggunakan wadah cawan porselen. Cawan
porselen tersebut kemudian didinginkan dalam desikator dan ditimbang hingga
beratnya tetap (BSN 2000).
Kadar abu tidak larut asam ditentukan dengan rumus:
3.3.3 Analisis serat pangan (dietary fiber) (Asp et al. 1983)
kemudian dilakukan pengaturan pH kembali dengan menggunakan HCl 4N hingga diperoleh larutan sampel dengan pH 4,5.
1) Analisis serat pangan tak larut air (IDF)
Analisis serat pangan tak larut air dilakukan dengan menyaring larutan sampel pH 4,5 dengan kertas saring Whatman 40 hingga diperoleh filtrat dan residu. Residu yang diperoleh dibilas dengan akuades dan dicuci dengan 50 ml etanol 78%. Selanjutnya dilakukan pencucian kembali dengan menggunakan aseton lalu dipanaskan dalam oven dengan suhu 105 0C selama 3 jam. Setelah dioven. sampel didinginkan dan ditimbang kemudian diarangkan dan ditanur dalam suhu 550 0C. Selanjutnya sampel didinginkan dan ditimbang lalu dilakukan perhitungan dengan rumus berikut.
Keterangan : A = Berat sampel
B = Berat kertas saring kosong
C = Berat kertas saring + residu setelah dioven D = Berat cawan porselen kosong
E = Cawan porselen + abu setelah ditanur 2) Analisis serat pangan larut air (SDF)
Keterangan : A = Berat sampel
F = Berat kertas saring kosong
G = Berat kertas saring + residu setelah dioven H = Berat cawan porselen kosong
I = Cawan porselen + abu setelah ditanur 3) Total serat pangan (TDF)
Total serat pangan dapat diendapkan langsung dengan cara menambahkan 4 volume alkohol 95% ke dalam hasil digesi setelah tahap penentuan pH menjadi 4,5 menggunakan HCl kemudian disaring tahapan pada metode penentuan serat yang larut. Perhitungan total serat pangan ditentukan dengan rumus berikut.
TDF (g/100g) = IDF (g/100g) + SDF (g/100g) 3.3.4 Ekstraksi bahan aktif (Andayani et al. 2008)
Ekstraksi bahan aktif dilakukan dengan menggunakan tiga jenis pelarut yaitu metanol (polar), etil asetat (semipolar), dan n-heksana (nonpolar). Lamun yang sudah dikeringkan dan dihaluskan dengan blender, ditimbang sebanyak 25 g dan ditambahkan pelarut sebanyak 200 ml. Langkah selanjutnya adalah maserasi sampel dalam pelarut selama 48 jam menggunakan orbital shaker pada suhu ruang. Kemudian sampel disaring dengan menggunakan kertas saring Whatman nomor 42 sehingga diperoleh filtrat. Filtrat ditampung dalam botol. Setelah diperoleh ekstrak hasil penyaringan, pelarut dari setiap ekstrak diuapkan dengan menggunakan vacuum rotary evaporator pada suhu 40 oC. Ekstrak kasar yang diperoleh kemudian dilakukan uji total fenol, uji fitokimia, dan uji aktivitas antioksidan dengan metode DPPH.
3.3.5 Uji total fenol (Yanthong et al. 2009)
dengan spektrofotometer UV-Visible (UV-Vis) pada panjang gelombang 725 nm. Kurva standar fenol dibuat dengan menggunakan standar asam galat (25-200 µg/ml) sebagai pengganti sampel dengan perlakuan yang sama. Standar asam galat yang digunakan menggunakan konsentrasi 0,10,20,30,40,50,60 dan 70 ppm. Kemudian serapan standar tersebut diukur panjang gelombangnya dan dibuat kurva kalibrasi dari hubungan antara konsentrasi asam galat dengan absorban. Kandungan total fenol diinterpretasikan sebagai milligram ekivalen asam galat (GAE= Galic Acid Equivalent) per 1000 g sampel (mg GAE/1000 g sampel). 3.3.6 Uji fitokimia (Harborne 1987)
Uji fitokimia berdasarkan Harborne (1987) meliputi uji alkaloid, uji steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, Molisch, Benedict,
Biuret dan Ninhidrin. Uji ini dilakukan untuk mengetahui ada tidaknya komponen-komponen bioaktif yang terdapat pada ekstrak kasar lamun dugong (Thalassia hemprichii) yang memiliki aktivitas antioksidan tertinggi
(a) Alkaloid
Uji alkaloid dilakukan dengan melarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji positif diperoleh bila terbentuk endapan putih kekuningan dengan pereaksi Meyer, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1,36 HgCl2 dengan 0,5 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml
(b) Terpenoid/ Steroid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Lalu, ke dalamnya ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
(c) Flavonoid
Sejumlah sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid. (d) Saponin (uji busa)
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
(e) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 ml etanol 70%. Ekstrak yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan.
(f) Tanin
Sejumlah sampel ditambahkan FeCl3 kemudian campuran dihomogenkan. Reaksi positif ditunjukkan dengan terbentuknya warna merah pada campuran 3.3.7 Uji aktivitas antioksidan (Aranda et al. 2009)
Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai absorbansi sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan presentase pengahambatan aktivitas radikal bebas. Nilai konsentrasi penghambatan aktivitas radikal bebas sebanyak 50 % (IC50) dihitung dengan menggunakan persamaan regresi. Nilai IC50 diperoleh dengan memasukkan Y=50 serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50 dapat dihitung dengan persamaan :
y = A + B ln(x) Keterangan : y = persen inhibisi
A = slope
B = intercept
x = konsentrasi sampel (mg/l) 3.4 Rancangan Percobaan dan Analisis Data
Perlakuan pada penelitian ini dalah penggunaan jenis pelarut polar yaitu n-heksana, etil asetat, dan metanol. Semua perlakuan dilakukan sebanyak dua kali ulangan. Hipotesis rancangan acak lengkap (RAL) terhadap rendemen ekstrak, total fenol, dan aktivitas antioksidan adalah sebagai berikut:
H0 : jenis pelarut tidak berpengaruh nyata terhadap nilai rendemen, total fenol, dan aktivitas antioksidan (αi = 0)
H1 : jenis pelarut berpengaruh nyata terhadap nilai rendemen (αi ≠ 0)
Rancangan percobaan yang digunakan untuk menganalisis data rendemen ekstrak hasil, uji kandungan total fenol, dan aktivitas antioksidan adalah rancangan acak lengkap (RAL) dengan model sebagai berikut.
Yij= µ + αi+ εij Keterangan ;
Yij = hasil pengamatan faktor jenis pelarut taraf ke-i (i=1,2,3) pada ulangan ke-j (j=1,2)
µ = rataan umum
αi = pengaruh faktor jenis pelarut taraf ke-i
εj = pengaruh galat jenis pelarut (i) pada ulangan ke-j
Keterangan :
Sy = significant range
KTS = kuadran tengah sisa r = ulangan
qa‘ = significant studentized range
4 HASIL DAN PEMBAHASAN
4.1 Kondisi Perairan Lokasi Penelitian
Lamun dugong merupakan salah satu kelompok tumbuhan berbunga yang terdapat di lingkungan laut. Tumbuhan ini hidup di habitat perairan pantai yang dangkal dengan subtrat pasir berlumpur yang berbeda, pasir bermedium kasar, dan pecahan koral kasar (Dahuri 2003). Dalam perairan yang sangat jernih, beberapa jenis lamun bahkan ditemukan sampai kedalaman 8-15 meter dan 40 meter. Lamun memiliki jumlah yang berlimpah serta sering membentuk padang yang lebat dan luas di perairan tropik. Sifat-sifat lingkungan pantai cocok untuk pertumbuhan dan perkembangan lamun ini. Parameter lingkungan utama yang mempengaruhi distribusi dan pertumbuhan ekosistem padang lamun yaitu kecerahan, temperatur, salinitas, substrat dan kecepatan arus. Pengaruh gelombang, sedimentasi, pemanasan air, pergantian pasang dan surut serta curah hujan menyebabkan lamun harus melakukan penyesuaian morfologik terhadap kondisi habitat tersebut (Romimohtarto dan Juwana 2007). Kondisi perairan lamun dugong yang terdapat di perairan Pulau Pramuka, Kepulauan Seribu dapat dilihat pada Gambar 4.
Gambar 4 Kondisi perairan lokasi penelitian
baik, dan mampu melakukan penyerbukan serta daur generatif dalam keadaan terbenam (Dahuri 2003). Lamun dugong sering dominan pada padang lamun campuran dan biasa terbentuk di daerah intertidal yang lebih rendah dan subtidal yang dangkal. Padang lamun tumbuh dengan baik di daerah yang terlindung dan bersubstrat pasir, stabil serta dekat sedimen yang bergerak secara horizontal. Padang lamun yang tumbuh pada sedimen karbonat yang berasal dari patahan terumbu kurang dipengaruhi oleh faktor run off daratan yang berkaitan dengan kekeruhan, suplai nutrien pada musim hujan, dan fluktuasi salinitas (Dahuri 2003; Romimohtarto dan Juwana 2007).
4.2 Komposisi Proksimat dan Abu Tidak Larut Asam Lamun Dugong
Kandungan gizi pada lamun dugong dapat diketahui dengan analisis proksimat. Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk didalamnya kandungan air, lemak, protein, abu, dan karbohidrat. Kadar karbohidrat dalam lamun dugong diperoleh melalui perhitungan by difference. Selain analisis proksimat (kadar air, lemak, protein, abu, dan karbohidrat), pengujian abu tidak larut asam juga dilakukan. Pengujian ini dilakukan karena lamun dugong tumbuh di perairan yang dangkal dengan substrat pasir, lumpur, atau campuran dari keduanya. Sehingga lamun dugong diduga mengandung abu tidak larut asam yang berasal dari mineral-mineral dalam lumpur yang masih menempel pada tubuhnya akibat penanganan yang kurang baik. Hasil analisis proksimat lamun dugong dapat dilihat pada Tabel 1.
Tabel 1 Hasil uji proksimat dan abu tidak larut asam lamun dugong
Air merupakan komponen penting dalam bahan makanan karena air dapat mempengaruhi penampakan, tekstur, serta citra rasa makanan. Semua bahan pangan mengandung air dalam jumlah yang berbeda-beda, baik itu bahan makanan hewani maupun nabati. Air berperan sebagai pembawa zat-zat makanan dan sisa-sisa metabolisme, sebagai media reaksi yang menstabilkan pembentukan biopolimer, dan sebagainya. Kandungan air dalam bahan makanan ikut menentukan acceptability, kesegaran, dan daya tahan bahan itu. Sebagian besar dari perubahan-perubahan bahan makanan terjadi dalam media air yang
ditambahkan atau yang berasal dari bahan itu sendiri (Winarno 2008). Lamun dugong memiliki kadar air yang cukup tinggi sebesar yaitu 86,26%.
Tingginya kadar air ini menyebabkan kadar protein dan lemaknya rendah. Kadar air merupakan komponen terbesar dari sayuran dan kadarnya bervariasi berkisar antara 81,0% sampai 96,1% (Muchtadi 2001).
Abu merupakan zat anorganik sisa hasil pembakaran suatu bahan organik. Abu terdiri dari unsur-unsur mineral yang juga dikenal sebagai zat anorganik atau kadar abu (Winarno 2008). Kadar abu lamun dugong basis basah sebesar 2,34%. Nilai kadar abu lamun dugong basis kering yang diteliti (16,94%) memiliki nilai yang lebih rendah dibandingkan dengan kadar abu lamun dugong yang diteliti oleh Setyati et al. (2003), yaitu sebesar 62,43%. Tinggi rendahnya kadar abu dapat disebabkan oleh perbedaan habitat dan lingkungan hidup yang berbeda. Setiap lingkungan perairan dapat menyediakan asupan mineral yang berbeda-beda bagi organisme akuatik yang hidup di dalamnya. Selain itu juga, masing-masing individu organisme juga memiliki kemampuan yang berbeda-beda dalam meregulasi dan mengabsorbsi mineral, hal inilah yang nantinya akan memberikan pengaruh pada nilai kadar abu dalam masing-masing bahan.
kadar lemak lamun dugong (5,56 % bk) lebih rendah dibandingkan dengan lamun dugong yang terdapat di Pantai Bandengan, Jepara yaitu sebesar 7,38% bk. Kadar lemak yang rendah dapat disebabkan karena kandungan air lamun dugong sangat tinggi, sehingga secara proporsional persentase kadar lemak akan turun secara drastis. Hal ini sesuai dengan pendapat yang menyatakan bahwa kadar air umumnya berhubungan terbalik dengan kadar lemak.
Protein merupakan makromolekul yang terbentuk dari asam-asam amino yang berikatan péptida dan mengandung unsur-unsur C, H, O, dan N yang tidak dimiliki oleh lemak atau karbohidrat. Molekul protein mengandung unsur logam seperti besi dan tembaga. Protein memiliki bermacam-macam fungsi bagi tubuh, yaitu sebagai enzim, zat pengatur pergerakan, pertahanan tubuh, alat pengangkut, dan lain-lain (Winarno 2008). Hasil análisis menunjukkan kadar protein lamun dugong basis kering sebesar 5,91%. Hasil protein yang rendah ini juga ditemukan pada lamun dugong lainnya yaitu sebesar 8,35% (Setyati et al. 2003).
Abu tidak larut asam adalah garam-garam klorida yang tidak larut asam, yang sebagian merupakan garam-garam logam berat dan silika. Berdasarkan hasil pengujian kadar abu tidak larut asam dapat diketahui bahwa lamun dugong mengandung abu tidak larut asam sebesar 0,39%. Hal ini diduga masih terdapatnya kontaminasi material-material abu tidak larut asam seperti pasir, lumpur, silika dan batu yang berasal dari hábitat lamun dugong. Kadar abu tidak larut asam dapat digunakan sebagai kriteria dalam menentukan tingkat kebersihan dalam proses penanganan dan pengolahan suatu produk (Basmal et al. 2003).
dalam bahan nabati, baik berupa gula sederhana, heksosa, pentosa, maupun karbohidrat dengan berat molekul yang tinggi seperti pati, pektin, selulosa, dan lignin. Selulosa dan lignin berfungsi sebagai penyusun dinding sel tanaman. 4.2 Serat Pangan Lamun Dugong
Serat pangan merupakan komponen dari jaringan tanaman yang tahan terhadap proses hidrolisis oleh enzim dalam lambung dan usus kecil. Serat-serat tersebut banyak berasal dari dinding sel berbagai sayuran dan buah-buahan. Secara kimia dinding sel tersebut terdiri dari beberapa jenis karbohidrat seperti selulosa, hemiselulosa, pektin, dan nonkarbohidrat seperti polimer lignin,
beberapa gumi, dan mucilage. Karena itu dietary fiber pada umumnya merupakan
karbohidrat atau polisakarida. Berbagai jenis makanan nabati pada umumnya
banyak mengandung dietary fiber (Winarno 2008).
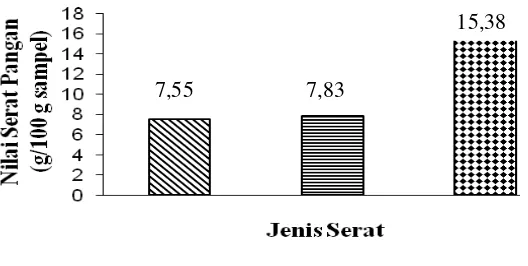
Komponen serat pangan total, serat pangan larut dan serat pangan tidak larut pada lamun dugong telah ditentukan dengan menggunakan metode multi enzim (Asp et al. 1983). Metode ini dapat memisahkan serat pangan larut (soluble dietary fiber atau SDF) dan serat makan tidak larut (insoluble dietary fiber atau IDF) dalam satu filtrasi tunggal, dimana SDF didapat dengan mengendapkan filtrat menggunakan etanol. Nilai SDF dan IDF diperoleh sebagai residu yang dikoreksi dengan residu protein dan abu. Nilai serat pangan total (total dietary fiber atau TDF) merupakan penjumlahan SDF dan IDF. Hasil analisis serat pangan lamun dugong dapat dilihat pada Gambar 5.
Gambar 5 Kandungan serat pangan lamun dugong
7,55 7,83
Berdasarkan analisis serat pangan diketahui bahwa nilai serat pangan larut (7,55 g/100g) tidak berbeda jauh dengan serat pangan tidak larut (7,83 g/100g). Fraksi SDF sebagian besar terdapat buah, sayuran, kacang-kacangan; sedangkan IDF paling banyak terkandung dalam sereal dan kacang-kacangan. Beberapa penelitian melaporkan bahwa secara fisiologis, SDF lebih efektif dalam mereduksi plasma kolesterol yaitu low density lipoprotein (LDL), meningkatkan kadar
high density lipoprotein (HDL), dan membuat perut merasa cepat kenyang, dan mereduksi absorpsi glukosa dalam usus. Serat pangan tidak larut (IDF) tidak terlalu signifikan sebagai agen hipokolesterolemik, tetapi peranannya sangat penting dalam pencegahan disfungsi alat pencernaan.
Total serat pangan lamun dugong yang diuji memiliki nilai sebesar 15,38 g/100g. Komponen serat pangan yang terkandung dalam suatu bahan dipengaruhi oleh spesies, tingkat kematangan, bagian tanaman, dan perlakuan terhadap bahan tersebut seperti perebusan, pengukusan, dan penumisan (Muchtadi 2001).
4.3 Rendemen Ekstrak Lamun Dugong
Ekstraksi merupakan proses penarikan komponen zat aktif suatu bahan dengan menggunakan pelarut tertentu. Proses ekstraksi dilakukan dengan tujuan untuk memperoleh bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif (Harborne 1987). Metode ekstraksi yang dilakukan pada penelitian ini yaitu maserasi tipe pelarut tunggal. Pelarut yang digunakan
adalah pelarut organik dengan tingkat kepolaran yang berbeda-beda yaitu n-heksana (nonpolar), etil asetat (semipolar), dan metanol (polar). Penggunaan
(polar), etil asetat (semipolar) dan n-heksana (nonpolar) dapat dilihat pada Gambar 6.
(a) (b) (c)
Gambar 6 Ekstrak kasar metanol (a), etil asetat (b) dan n-heksana (c) Rendemen ekstrak hasil ekstrasi tiga pelarut berbeda menmberikan nilai yang berbeda pula. Rendemen ekstrak merupakan perbandingan jumlah ekstrak yang dihasilkan dengan jumlah sampel awal yang diekstrak dan hasilnya dinyatakan dalam persen. Nilai rendemen ekstrak dari masing-masing pelarut dapat dilihat pada Gambar 7.
.
Angka-angka pada diagram batang yang diikuti huruf (a,b) menunjukkan jenis pelarut memberikan pengaruh berbeda nyata (p<0,05) terhadap nilai rendemen
Gambar 7 Nilai rendemen ekstrak kasar lamun dugong
Rendemen ekstrak lamun dugong dipengaruhi secara nyata oleh jenis pelarut. Rendemen ekstrak tertinggi dari sampel lamun dugong terdapat pada
0,74(a) 0,64(a)
ekstrak metanol (17,11%), diikuti oleh ekstrak n-heksana (0,74%), dan ekstrak etil asetat (0,64%). Data tersebut menunjukkan bahwa komponen bioaktif yang bersifat polar banyak terkandung pada jaringan lamun dugong, karena dapat larut dalam pelarut polar yaitu metanol sedangkan komponen bioaktif yang bersifat semipolar dan nonpolar terdapat dalam jumlah yang lebih kecil pada lamun dugong. Hal ini mengindikasikan bahwa lamun dugong mengandung senyawa-senyawa fenol yang cenderung larut dalam pelarut polar dan sangat banyak terdapat dalam tanaman (Harborne 1987).
4.4 Kandungan Total Fenol Ekstrak Lamun Dugong
Fenol merupakan senyawa yang mempunyai sebuah cincin aromatik dengan satu lebih gugus hidroksil. Fenol meliputi berbagai senyawa yang berasal dari tumbuhan. Senyawa-senyawa fenolat yang terkandung dalam tumbuhan ini memiliki aktivitas antioksidan karena senyawa ini dapat menangkap radikal-radikal peroksida dan dapat mengkelat logam besi yang mengkatalis peroksida lemak. Biasanya senyawa-senyawa yang memiliki aktivitas antioksidan adalah senyawa fenol yang mempunyai gugus hidroksi yang tersubstitusi pada posisi ortho dan para terhadap gugus –OH dan –OR (Andayani et al. 2008).
Flavonoid merupakan golongan fenol terbesar dan umumnya terdapat pada semua tumbuhan hijau sebagai glikosida dan terdapat pada seluruh bagian tanaman, termasuk pada buah, tepung sari, dan akar. Komponen bioaktif ini berperan terhadap warna dalam organ tumbuhan seperti bunga, buah, daun, atau warna pada pigmen (Sirait 2007). Selain itu flavonoid dapat juga menangkap spesies oksigen reaktif (ROS) yang terbentuk selama proses pencernaan makanan
di dalam tubuh (Pietta et al. 1996 dalam Muchtadi 2001).
Penentuan kandungan fenol total pada lamun dugong menggunakan pelarut Folin-Ciocalteu dan sebagai pembanding digunakan asam galat. Kadar total fenol dalam lamun dugong dihitung menggunakan persamaan regresi linier dengan terlebih dahulu menentukan konsentrasi larutan sampel dengan cara
mengukur absorban sampel kemudian menggunakan kurva kalibrasi. Kandungan
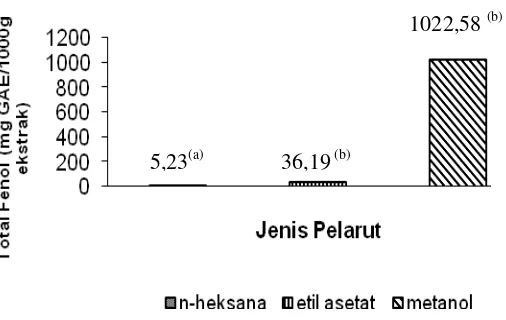
Angka-angka pada diagram batang yang diikuti huruf (a,b) menunjukkan jenis pelarut memberikan pengaruh berbeda nyata (p<0,05) terhadap nilai rendemen
Gambar 8 Nilai total fenol lamun dugong
Ekstrak lamun dugong dalam pelarut metanol memiliki kandungan total fenol tertinggi yaitu sebesar 1022,58 mg GAE/1000g ekstrak , diikuti oleh ekstrak etil asetat sebesar 36,19 mg GAE/1000g ekstrak dan ekstrak n-heksan sebesar 5,23 mg GAE/1000g ekstrak. Senyawa fenol cenderung larut dalam pelarut polar namun kelarutannya dapat berbeda pada setiap jenis pelarut dan sumbernya (Harborne 1987). Muchtadi (2001) juga menyebutkan bahwa kadar total fenol pada tumbuhan dipengaruhi oleh perbedaan komposisi sel, ketebalan dinding sel, dan permeabilitas membran plasma.
4.5 Komponen Fitokimia
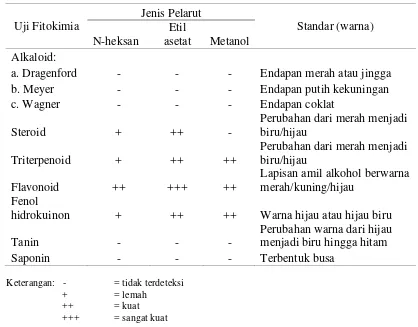
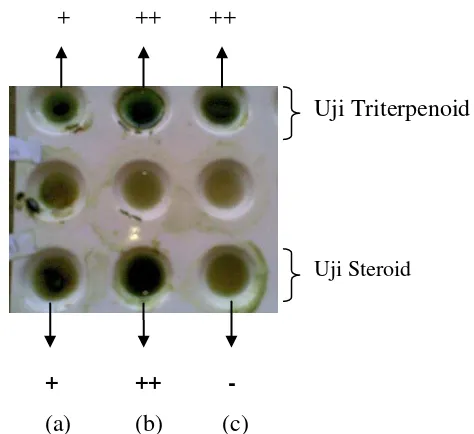
Pengujian komponen bioaktif pada ekstrak kasar n-heksana (nonpolar), etil asetat (semipolar), dan metanol (polar) dilakukan dengan menggunakan uji fitokimia. Fitokimia memiliki peran penting dalam penelitian obat yang dihasilkan dari tumbuh-tumbuhan. Uji fitokimia bertujuan untuk mengetahui komponen bioaktif yang terdapat pada masing-masing ekstrak kasar lamun dugong. Uji fitokimia yang dilakukan dalam penelitian ini meliputi uji alkaloid, steroid, triterpenoid, flavonoid, saponin, fenol hidrokuinon, dan tannin. Hasil uji fitokimia ekstrak lamun dugong dapat dilihat pada Tabel 3.
5,23(a) 36,19 (b)
Tabel 3 Hasil uji fitokimia ekstrak kasar lamun dugong
Secara umum, komponen fitokimia yang terdapat dalam lamun dugong yang diamati meliputi steroid, triterpenoid, flavonoid, dan fenol hidrokuinon. Ketiga ekstrak dengan pelarut yang berbeda mengandung keempat komponen bioaktif tersebut kecuali ekstrak dengan pelarut metanol tidak mengandung komponen steroid. Hal ini dikarenakan proses ekstraksi dengan pelarut yang memiliki kepolaran yang berbeda akan mengekstrak senyawa yang berbeda pula.