PURIFICATION OF GLUCOMANNAN BY ENZYMATIC HYDROLYSIS OF KONJAC (Amorphophallus oncophyllus) FLOUR
Reiza Mutia, Djumali Mangunwidjaja and Titi Candra Sunarti Department of Agroindustrial Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Dramaga Campus, PO BOX 220, Bogor, West Java,
Indonesia
Phone 62 251 8624622, e-mail: cuteprince_pup68@yahoo.co.id
ABSTRACT
Glucomannan is typical polysaccharide derived from konjac tuber. Conventional fractionation of glucomannan in konjac flour is by mechanical separation method, but it produces low purity glucomannan flour and needs further purification methods. This research is explored the glucomannan purification by enzymatic hydrolysis directly from konjac flour. Since konjac flour mainly consisted of starch, glucomannan and fiber, in this research sole thermophilic α-amylase enzyme and consortium of enzymes (amylase, xylanase and cellulose) were applied on 50 and 65 oC of incubation temperature for 2 hours. The results showed that consortium of enzymes can not be used for glucomannan purification; because glucomannan component is hydrolyzed by xylanase and cellulose. Glucomannan flour produced from sole α-amylase with incubation temperature of 50ᵒC has the highest yield (42.7%) compared to incubation temperature of 65ᵒC (31.6%). Duration of incubation also influenced to the glucomannan yield, and two hours of incubation time gave the best glucomannan flour with highest yield (37.0%), purity (46.1%), viscosity (42.3 cPs) and good whiteness (12.7%). Enzymatic hydrolysis of konjac flour also produced starch syrup (DE 55.6 – 77.9) as by- products.
I. PENDAHULUAN
1.1 LATAR BELAKANG
Tanaman iles-iles (Amorphophallus oncophyllus) dikenal dengan beberapa nama, antara lain ileus (Sunda) dan porang. Tanaman iles-iles menghasilkan umbi yang termasuk dalam umbi batang dan disebut dengan umbi iles-iles. Umbi iles-iles ini sudah dikenal sejak zaman pendudukan Jepang untuk diolah menjadi sejenis makanan tradisional Jepang berupa mie (shirataki) dan tahu (konyaku) (Sumadi 1979). Setelah pendudukan Jepang berakhir, tanaman ini menjadi langka dan tidak populer lagi bagi petani Indonesia (Hartanto 1994).
Iles-iles merupakan jenis talas-talasan yang tumbuh liar hampir di seluruh hutan Indonesia. Menurut Kurniawan et al. (2011), sentra produksi utama iles-iles adalah di Pulau Jawa, terutama Jawa Timur. Salah satu sentra pengembangan budidaya iles-iles adalah Kesatuan Pemangkuan Hutan (KPH) Saradan tepatnya di Desa Klangon, Kabupaten Madiun. Pada tahun 2005, produksi umbi iles-iles di Desa Klangon dapat mencapai 5,535 ton (Kurniawan et al, 2011.). Data dari Dinas Pertanian Tanaman Pangan dan Hortikultura Kabupaten Madiun, produksi umbi iles-iles di Kabupaten Madiun semakin meningkat, yaitu 7,314.29 ton (pada tahun 2007), 7,563.34 ton (pada tahun 2008) dan 8,803.32 ton (pada tahun 2009).
Umbi iles-iles tidak dapat dikonsumsi langsung karena memiliki kandungan kristal kalsium oksalat berkisar 0.15% – 0.23% yang dapat menyebabkan rasa gatal. Oleh karena itu, pada tingkat petani umbi iles-iles sering dijadikan chips kering untuk memasok industri tepung iles-iles atau tepung glukomanan (Arifin 2001). Menurut Kurniawan et al. (2011), saat ini sebagian besar iles-iles ditingkat petani dijual dalam bentuk segar atau chips kering kepada para eksportir untuk dikirim ke berbagai negara, terutama Jepang, China, Taiwan, Australia, Sri Lanka, Malaysia, Singapura dan negara lainnya.
Menurut data BPS (1997), volume ekspor tepung iles-iles cenderung meningkat dalam kurun waktu 1985 – 1995. Rata-rata peningkatan volume ekspor tersebut, yaitu 58.95% atau 34.78% tiap tahun. Lubis et al. (2004) juga menyebutkan volume ekspor iles-iles Indonesia pada tahun 1998 – 2001 bervariasi antara 179 – 260 ton. Namun, pada tahun 2007 volume ekspor tersebut kemudian menurun. Selain itu, permintaan pasar luar negeri sebesar 104 ton pun baru bisa dipenuhi 24 ton pada
tahun 2008 (Gumbira Sa’id dan Rahayu 2009).
Tidak hanya untuk ekspor, permintaan iles-iles dalam bentuk segar maupun chips kering di dalam negeri juga terus meningkat. Menurut Kurniawan et al. (2011), kebutuhan industri tepung iles-iles atau tepung glukomanan pada tahun 2009 sekitar 3,400 ton chips kering iles-iles-iles-iles, tetapi produksi iles-iles di Jawa Timur baru mencapai 600 – 1,000 ton chips kering iles-iles.
2 juga banyak digunakan dalam industri lain, yaitu sebagai bahan baku kertas, tekstil, perekat, pita seluloid, cat, bahan negatif film, kosmetik dan juga pembersih (Arifin 2001).
Walaupun Indonesia merupakan salah satu produsen umbi iles-iles, tepung iles-iles yang dihasilkan di dalam negeri biasanya diekspor untuk ditingkatkan mutunya menjadi tepung glukomanan, sedangkan tepung glukomanan komersial yang ada di pasaran didapatkan melalui impor dari luar negeri. Hal ini terjadi karena teknologi yang digunakan petani pengolah dan industri lokal pengolah tepung glukomanan saat ini masih belum optimum, sehingga tepung glukomanan yang dihasilkan kalah bersaing dengan tepung impor. Oleh karena itu, diperlukan upaya untuk memperbaiki teknologi permunian tepung glukomanan menjadi lebih baik sehingga dapat memberikan nilai tambah yang nyata baik bagi pelaku industri dan petani di dalam negeri serta berpotensi mengurangi ketergantungan impor.
Tepung glukomanan diperoleh dengan cara memisahkan komponen pati dan serat dari tepung iles-iles. Metode pemisahan yang sudah pernah dilakukan adalah dengan cara mekanis (pemisahan fraksi) seperti penghembusan, pengayakan dan penyosohan. Berdasarkan penelitian Nurjanah (2010), pemisahan fraksi hanya menghasilkan kemurnian tepung glukomanan sebesar 30% (bk).
Selain itu metode pemisahan lain yang juga sudah dilakukan adalah dengan cara kimiawi, salah satunya menggunakan etanol 95%. Berdasarkan penelitian Murtinah (1977), pemberian 13 ml etanol 95% per gram tepung iles-iles dapat menghasilkan tepung dengan kemurnian hingga 80% .
Selain kedua cara diatas, saat ini ditemukan pemurnian tepung glukomanan dengan cara enzimatis. Prinsip pemurnian secara enzimatis ini adalah hidrolisis pati oleh enzim, sehingga pati berubah menjadi komponen-komponen yang lebih kecil dan terlepas dari sel-sel manan. Adapun
enzim penghidrolisis pati yang digunakan adalah enzim α-amilase. Penggunaan enzim α-amilase dalam pemurnian tepung glukomanan sudah diteliti sebelumnya oleh Nurjanah (2010).
Pemurnian tepung glukomanan yang dilakukan oleh Nurjanah (2010) meliputi pemurnian tepung iles-iles dengan metode pengayakan (80 mesh) untuk memisahkan fraksi pati dan fraksi
glukomanannya, kemudian tepung glukomanan tersebut dimurnikan dengan enzim α-amilase untuk menghidrolisis pati yang masih tercampur. Berdasarkan studi kasus pada salah satu industri tepung glukomanan, jumlah limbah (fraksi pati) hasil pengayakan yang dihasilkan sebesar seperenam dari bobot awal tepung iles-iles, namun ternyata limbah ini masih mengandung glukomanan sekitar 20% (bk). Oleh karena itu untuk meminimumkan loss glukomanan pada tepung glukomanan yang dihasilkan, maka proses pemisahan fraksi pada penelitian ini ditiadakan.
Tepung iles-iles masih mengandung banyak komponen pengotor, baik pati maupun serat (selulosa dan hemiselulosa). Oleh karena itu, penggunaan enzim konsorsium diharapkan dapat memecah pati, selulosa, dan hemiseluosa tersebut sehingga dapat dihasilkan tepung glukomanan dengan kemurnian yang tinggi. Selain memurnikan tepung iles-iles menjadi tepung glukomanan, nantinya juga akan dihasilkan produk samping berupa oligosakarida.
1.2 TUJUAN
II. TINJAUAN PUSTAKA
2.1 TANAMAN ILES-ILES
2.1.1 Botani Iles-iles
Iles-iles dan sejenisnya merupakan tanaman yang berasal dari India dan Srilanka. Melalui Indocina, Malaka dan Sumatera, akhirnya iles-iles menyebar di Jawa hingga Filipina dan Jepang (Sunarto 1986). Menurut Indo (1983) dalam Ermiati dan Laksamanaradja (1996), iles-iles yang termasuk kedalam marga Amorphophallus, terdiri atas 80 jenis. Di Indonesia, yang paling banyak dijumpai adalah A. campanulatus, A. oncophyllus, A. variabilis, A. spectabilis, A. decumsilvae, A. mulleri dan A. titanium yang dikenal sebagai bunga bangkai (Sufiani 1993).
Jenis iles-iles yang dibudidayakan dan dipergunakan sebagai bahan makanan dan industri adalah A. campanulatus, A. oncophyllus dan A. variabilis. Di Pulau Jawa, A. campanulatus disebut suweg sedangkan A. oncophyllus dan A. variabilis disebut iles-iles (Jawa), kembang bangke (Melayu), acung (Sunda), badur (NTB), lacong atau kruwu (Madura). Suweg ternyata tidak mengandung glukomanan dan berbatang halus, sedangkan iles-iles banyak mengandung glukomanan terutama spesies A. oncophyllus dan berbatang kasar (Ohtsuki 1968). Suweg sudah biasa ditanam di perkarangan sebagai sumber pangan di musim paceklik terutama di daerah Jawa Tengah, sedangkan iles-iles tumbuh di hutan-hutan secara liar dan tidak dapat dimakan sebelum diolah terlebih dahulu.
Umbi suweg tersebar di seluruh Pulau Jawa. Di Jawa Tengah dan Jawa Timur banyak dijumpai tanaman suweg akan tetapi belum dibudidayakan secara besar-besaran melainkan sebagai tanaman sampingan. Suweg juga banyak tersebar di Filipina, Malaysia sampai ke Pasifik dan telah dibudidayakan di daerah Chitoor dan Taluk (Kriswidarti 1980). Berbeda dengan suweg, iles-iles kuning (A. oncophyllus) ditemukan dalam jumlah besar disebelah utara Gunung Tangkuban Perahu dan Bukit Tunggul, sekitar Gunung Cereme, sebelah selatan Pekalongan yaitu di daerah sebelah utara Pegunungan Kendeng dan di lereng selatan Gunung Raung. Selain tersebar di Pulau Jawa, A. oncophyllus tersebar pula di luar Pulau Jawa yaitu di daerah Sulawesi dan Flores (Soedarsono dan Abdulmanap 1963). A. variabilis banyak terdapat di daerah sekitar Purwekerto, Surakarta, Surabaya dan beberapa daerah di Pulau Madura. Selain itu, A. variabilis juga terdapat di pegunungan kapur dan hutan-hutan tropis.
Iles-iles biasanya tumbuh alami di daerah vegetasi sekunder, di tepi-tepi hutan dan belukar, hutan jati, atau hutan desa. Tanaman iles-iles pada umumnya dapat tumbuh pada jenis tanah apa saja, namun demikian agar usaha budidaya tanaman iles-iles dapat berhasil dengan baik perlu diketahui hal-hal yang merupakan syarat-syarat tumbuh tanaman iles-iles, terutama yang menyangkut iklim dan keadaan tanahnya.
Tanaman tersebut dapat tumbuh pada daerah dengan ketinggian hingga 700 m di atas permukaan laut, namun paling baik pada ketinggian antara 100 – 600 m diatas permukaan laut. Dengan rata-rata suhu optimum berkisar antara 25ºC – 35ºC dan suhu optimal tanah 22ºC – 30ºC. Tanaman ini cocok tumbuh pada jenis tanah liat berpasir. Derajat keasaman tanah yang ideal adalah antara pH 6 – 7 serta pada kondisi jenis tanah apa saja, tetapi tanah liat saja dapat menghambat perkembangan umbi tersebut. Walaupun demikian, tanaman jenis tersebut lebih menyukai tanah-tanah dengan drainase baik (tidak tergenang air) dengan kandungan humus yang tinggi. Iles-iles yang dibudidayakan pada galian dengan ukuran tertentu, diberikan pupuk, terutama pupuk kandang dan penyiangan terhadap rumput gulma.
4 cahaya maksimum sampai 40%. Hal ini disebabkan oleh, terik sinar matahari yang berlebihan dapat menyebabkan daun menjadi layu dan tanaman tidak tumbuh optimal, bahkan mati (Gumbira Sa’id dan Rahayu 2009). Naungan yang ideal untuk tanaman Iles-iles adalah jenis tanaman jati, mahoni sono dan lain-lain. Tingkat kerapatan naungan minimal 40% sehingga semakin rapat naungan maka semakin baik untuk tanaman iles-iles (Mastrianto 2010). Selain itu, menurut Syaefulah (1990), tanaman iles-iles dapat ditanam bersama-sama dengan tanaman pisang, jahe, pinang, kacang tanah dan jagung serta cocok sebagai tanaman sela diperkebunan karet, cengkeh, kopi, cokelat, kelapa sawit dan jati.
Perkembangbiakan tanaman Iles-iles dapat dilakukan dengan cara generatif maupun vegetatif. Perbanyakan tanaman secara vegetatif dari bagian-bagian umbi merupakan kegiatan budidaya iles-iles yang paling umum dilakukan karena lebih mudah dan dapat dilakukan dengan cepat. Menurut Mastrianto (2010), secara umum perkembangbiakan tanaman iles-iles dapat dilakukan melalui berbagai cara, yaitu: perkembangbiakan dengan umbi, perkembangbiakan dengan bulbil (umbi biji), perkembangbiakan dengan umbi batang dan perkembangbiakan dengan buah atau biji.
2.1.2 Komposisi Kimia Umbi
Umbi iles-iles mengandung polisakarida yang mampu menyerap air yang disebut manan atau lebih tepatnya glukomanan. Fungsi glukomanan yang serupa dengan serat pangan memiliki kelebihan-kelebihan tertentu, yaitu: meningkatkan fungsi pencernaan dan sistem imun, menurunkan kadar kolesterol dan gula darah, serta membantu menurunkan berat badan (Zhang et al. 2005). Keberadaan glukomanan inilah yang menjadi pembeda antara iles-iles (A. oncophyllus) dengan umbi lain sejenis (A. campanulatus). Tidak hanya glukomanan, umbi iles-iles juga mengandung kristal kalsium oksalat yang jika dimakan mentah akan membuat mulut, lidah dan kerongkongan terasa tertusuk-tusuk atau gatal. Kristal kalsium oksalat ini merupakan produk buangan dari metabolisme sel yang tidak digunakan lagi oleh tanaman dan terdapat di dalam dan di luar sel manan. Adapun komposisi kimia umbi iles-iles kuning selengkapnya dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia umbi iles-iles kuning (Amorphophallus oncophyllus) Nutrisi Umbi iles-iles (%bk)
Air 81.05 (%bb)
Abu 4.31
Protein 6.38
Lemak 0.98
Karbohidrat 91.79
Serat kasar 10.61
Glukomanan 23.52
Ca-Oksalat 0.85
5
2.2 GLUKOMANAN
Glukomanan adalah salah satu komponen kimia terpenting yang terdapat dalam umbi iles-iles yang merupakan polisakarida dari jenis hemiselulosa. Glukomanan termasuk heteropolisakarida yang memiliki ikatan rantai utama glukosa dan manosa. Ohtsuki (1968) menyebutkan bahwa hasil analisa hidrolisa-asetolisis dari glukomanan dihasilkan suatu trisakarida yang tersusun oleh dua D-mannosa dan satu D-glukosa, sehingga dalam satu molekul glukomanan terdapat D-mannosa sejumlah 67% dan D-glukosa sejumlah 33%. Hasil analisis secara metilasi menunjukkan bahwa glukomanan terdiri atas komponen penyusun berupa D-glukopiranosa dan D-manopiranosa dengan ikatan β-1,4 glikosidik. Menurut Parry (2010), glukomanan memiliki gugus asetil setiap 10-19 unit gugus karbon pada posisi C2, C3 dan C6. Gugus asetil tersebut berperan pada sifat fisikokimia glukomanan seperti sifat kelarutan glukomanan dalam air panas maupun air dingin.
Glukomanan memiliki bobot molekul relatif tinggi, yaitu 200,000 – 2,000,000 Dalton dengan ukuran antara 0.5 – 2 mm, 10 – 20 kali lebih besar dari sel pati. Struktur kimia glukomanan dapat dilihat pada Gambar 6.
Gambar 1. Struktur kimia glukomanan (Anonim 2002)
Bobot molekul yang relatif tinggi membuat glukomanan memiliki karakteristik antara selulosa dan galaktomanan, yaitu dapat mengkristal dan membentuk struktur serat-serat halus. Keadaan tersebut menyebabkan glukomanan dapat dimanfaatkan lebih luas dibandingkan selulosa dan galaktomanan. Menurut Deptan (2010), senyawa glukomanan mempunyai sifat-sifat khas sebagai berikut:
(1)Larut dalam air
Glukomanan dapat larut dalam air dingin dan membentuk larutan yang sangat kental. Tetapi, bila larutan kental tersebut dipanaskan sampai menjadi gel, maka glukomanan tidak dapat larut kembali di dalam air.
(2)Membentuk gel
Karena glukomanan dapat membentuk larutan yang sangat kental di dalam air. Dengan penambahan air kapur zat glukomannan dapat membentuk gel, di mana gel yang terbentuk mempunyai sifat khas dan tidak mudah rusak.
(3)Merekat
6 (4)Mengembang
Glukomanan mempunyai sifat mengembang yang besar di dalam air dan daya mengembangnya mencapai 138 – 200%, sedangkan pati hanya 25%.
(5)Transparan (membentuk film)
Larutan glukomanan dapat membentuk lapisan tipis film yang mempunyai sifat transparan dan film yang terbentuk dapat larut dalam air, asam lambung dan cairan usus. Tetapi jika film dari glukomannan dibuat dengan penambahan NaOH atau gliserin maka akan menghasilkan film yang kedap air.
(6)Mencair
Glukomanan mempunyai sifat mencair seperti agar sehingga dapat digunakan dalam media pertumbuhan mikroba.
(7)Mengendap
Larutan glukomanan dapat diendapkan dengan cara rekristalisasi oleh etanol dan kristal yang terbentuk dapat dilarutkan kembali dengan asam klorida encer. Bentuk kristal yang terjadi sama dengan bentuk kristal glukomanan di dalam umbi, tetapi bila glukomanan dicampur dengan larutan alkali (khususnya Na, K dan Ca) maka akan segera terbentuk kristal baru dan membentuk massa gel. Kristal baru tersebut tidak dapat larut dalam air walaupun suhu air mencapai 100ºC ataupun dengan larutan asam pengencer. Dengan timbal asetat, larutan glukomanan akan membentuk endapan putih stabil.
2.3 PENGOLAHAN TEPUNG GLUKOMANAN
Pengolahan iles-iles biasa dilakukan dengan cara mengeringkan umbi kemudian dibuat menjadi chips kering lalu tepung iles. Syaefullah (1990) menyebutkan bahwa kadar air dalam umbi iles-iles relatif tinggi, yaitu 70% - 85% sehingga bagian dalam umbi mudah rusak oleh aktivitas enzim dan mikroba. Oleh karena itu, penyimpanan iles-iles dalam bentuk produk kering lebih efektif dilakukan.
Pengeringan memiliki beberapa keuntungan, antara lain: bahan menjadi lebih tahan lama disimpan dan volume menjadi lebih kecil sehingga mempermudah dan menghemat ruang pengangkutan dan pengepakan. Berat bahan juga menjadi berkurang sehingga memudahkan transportasi, dengan demikian diharapkan biaya produksi menjadi lebih murah (Muchtadi 1997). Sufiani (1993) juga menyebutkan glukomanan dapat diperoleh dalam kadar yang cukup tinggi jika umbi iles-iles dikeringkan secepatnya.
Menurut Ermiati dan Laksamanahardja (1996), pengolahan tepung glukomanan dapat dilakukan melalui tahapan-tahapan berikut, yaitu: pengupasan kulit umbi, pencucian umbi hingga bersih agar tidak ada lagi kotoran yang melekat dan pengirisan umbi dengan tebal 5 – 7 mm. Umbi yang sudah diiris direndam dalam larutan garam dapur 5% atau natrium bisulfit yang dapat mencegah terjadinya proses pencoklatan pada irisan umbi. Irisan umbi tersebut kemudian dijemur untuk dikeringkan hingga kadar air mencapai 12%. Adapun indikator visual irisan umbi yang telah kering
yaitu bunyi “krek” yang timbul saat chips kering dipatahkan.
7 mutunya, tebal irisan tepat dan seragam, teknik pengeringan yang baik dan kontrol terhadap pengeringan dilakukan dengan intensif.
Pengeringan umbi iles-iles dapat dilakukan dengan sinar matahari atau alat pengering. Pengeringan dengan sinar matahari lebih mudah dan murah, tetapi mudah pula dikotori oleh debu dan pasir. Selain itu, pengeringan dengan matahari tergantung pada cuaca, jika cuaca baik, maka pengeringan cukup selama dua sampai tiga hari atau 16 jam pengeringan efektif. Tetapi, jika cuaca mendung, maka pengeringan akan memakan waktu yang lebih lama (Murtinah 1977).
Pengeringan dengan alat pengering lebih mahal namun menghasilkan irisan-irisan yang bersih dan kecepatan peneringan dapat dipertahankan karena tidak tergantung pada cuaca. Pengeringan dengan alat (oven) pada suhu 70ºC selama 16 jam dapat memberikan hasil kadar manan yang optimum. Tetapi, chips kering tersebut mempunyai kandungan glukomanan yang lebih rendah (18.15%) dibandingkan dengan pengeringan sinar matahari (22.79%) dalam waktu yang sama (Murtinah 1977).
Irisan umbi yang telah kering atau chips kering, merupakan bahan baku dalam pembuatan tepung iles-iles dengan cara digiling terlebih dahulu. Tepung iles-iles tersebut kemudian dapat dimurnikan untuk menjadi tepung glukomanan. Proses pemurnian tepung glukomanan dapat dilakukan baik dengan cara mekanis maupun cara kimiawi. Pemurnian dengan cara mekanis terbagi atas tiga cara, yaitu: penghembusan, pengayakan dan penyosohan. Pemurnian cara pertama dilakukan dengan menggiling chips kering terlebih dahulu untuk dijadikan tepung, kemudian dilakukan pemisahan berdasarkan bobot jenis dan ukuran partikel. Glukomanan merupakan polisakarida yang mempunya bobot jenis serta ukuran partikel terbesar dan bertekstur lebih keras dibandingkan dengan partikel-partikel komponen tepung lainnya. Oleh karena itu, penghembusan yang dilakukan dapat menyebabkan glukomanan jatuh di dekat pusat blower, sedangkan komponen lain yang lebih ringan seperti dinding sel, garam oksalat dan pati akan jatuh dengan jarak yang lebih jauh.
Pemurnian cara kedua dilakukan dengan mengayak chips kering yang sudah digiling, dimana bagian yang halus akan turun melalui ayakan, sedangkan glukomanan akan tertinggal di ayakan. Pemurnian cara ketiga dilakukan dengan cara menggosok tepung iles-iles diantara dua kain terpal oleh alat penggosok yang dilengkapi dengan ayakan (ukuran 0.5 – 0.8 mm) dan penghisap. Hal ini mengakibatkan fraksi kecil seperti dinding sel, garam oksalat dan pati terhisap oleh penghisap serta glukomanan akan terkumpul tepat di bawah ayakan (Murtinah 1977).
Pemurnian tepung glukomanan dengan cara kimiawi dilakukan dengan penambahan bahan kimia untuk melarutkannya. Cara kimiawi ini jarang dilakukan karena biaya proses mahal akibat penggunaan medium yang larut air dalam jumlah yang cukup besar, yaitu 1.5 kali berat umbi. Proses pemisahan tersebut juga tetap melalui rantai proses yang panjang yaitu penggilingan palu, penggilingan silinder, pemisahan sentrifugal, penyosoh gerinda dan pengeringan (Shimizu dan Shimahara 1973 diacu dalam Widyotomo 2002).
2.4 HIDROLISIS PATI SECARA ENZIMATIS
Enzim adalah biomolekul berupa protein yang berfungsi sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis bereaksi) dalam suatu reaksi kimia organik. Molekul awal yang disebut substrat akan dipercepat perubahannya menjadi molekul lain yang disebut produk.
8
α-amilase
berbeda-beda karena enzim adalah protein, yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Di luar suhu atau pH yang sesuai, enzim tidak dapat bekerja secara optimal atau strukturnya akan mengalami kerusakan. Hal ini akan menyebabkan enzim kehilangan fungsinya sama sekali. Selain itu, kerja enzim juga dipengaruhi oleh molekul lain. Inhibitor adalah molekul yang menurunkan aktivitas enzim, sedangkan aktivator adalah molekul yang meningkatkan aktivitas enzim. Hidrolisis dengan menggunakan enzim memiliki berbagai keuntungan antara lain enzim bekerja secara spesifik pada percabangan tertentu sehingga produk yang dihasilkan sesuai dengan keinginan. Selain itu, enzim dalam jumlah yang sedikit dapat mengencerkan sejumlah besar substrat sehingga biaya yang dibutuhkan relatif lebih murah (Pomeranz 1991). Keuntungan lain dalam penggunaan enzim, yaitu: kondisi proses dalam penggunaan enzim dapat dikontrol dan juga produk samping yang dihasilkan lebih sedikit serta kerusakan warna juga dapat diminimalkan.
2.4.1 Enzim
α
-amilase
Enzim α-amilase merupakan enzim ekstraseluler yang mampu menghidrolisis ikatan α-1,4 glikosidik pada pati. Enzim α-amilase dapat diperoleh dari hewan, tumbuhan dan mikroorganisme. Enzim tersebut bekerja spesifik pada proses perombakan pati menjadi glukosa. Berikut ini adalah reaksi hidrolisis pati secara enzimatis, yaitu:
(C6H10O5) n n C6H12O6
Proses hidrolisis pati oleh α-amilase berlangsung dalam dua tahap, yaitu degradasi amilosa dan degradasi amilopektin. Degradasi amilosa menghasilkan maltosa dan maltotriosa yang terjadi secara acak. Hal ini diikuti dengan menurunnya viskositas dengan cepat. Selain itu, α-amilase juga dapat menurunkan intensitas warna biru iod (Reilly 1985). Kemudian, pada tahap kedua terjadi penguraian membentuk glukosa dan maltosa sebagai hasil akhir dan tidak acak. Pada tahap ini pembentukan terjadi relatif sangat lambat
Tahap kedua yaitu degradasi amilopektin oleh α-amilase. Pada tahap ini dihasilkan glukosa, maltosa dan suatu bagian kecil yang tertinggal sebagai campuran polisakarida yang tidak terhidrolisis
yang disebut α-limit dekstrin, serta oligosakarida yang terdiri dari empat atau lebih glukosa yang
mengandung ikatan α-1,6 glikosidik.
Hidrolisis dengan α-amilase dapat menghasilkan beberapa produk hidrolisat pati dengan sifat-sifat tertentu yang didasarkan pada nilai DE (dextrose equivalent). Nilai DE 100 adalah murni dekstrosa sedangkan nilai DE 0 adalah pati alami. Hidrolisat dengan nilai DE 3 – 20 adalah maltodekstrin, hidrolisat dengan nilai DE 42 – 63 adalah sirup campuran, hidrolisat dengan nilai DE 48 – 63 adalah sirup maltosa, sedangkan hidrolisat dengan nilai DE antara 96 – 98 adalah sirup glukosa (Kennedy et al. 1995).
2.4.2 Enzim Selulase
9 yang terdiri dari suatu kompleks campuran dari enzim dengan spesifisitas berbeda dalam menghidrolisis ikatan glikosidiknya (Howard et al. 2003).
Enzim selulase terdiri dari tiga komponen besar yakni endoglukanase atau endo-1,4-β -glukanase (Cx), ekso-1,4-β-glukanase atau selobiohidrolase (C1) serta β-glukosidase atau selobiase. Endoglukanase (Cx) yang sering disebut karboksimetilselulosa (CM)-selulase, berperan dalam memulai serangan acak pada sisi internal daerah amorf dari serat selulosa sehingga sisi yang terbuka dapat diserang oleh selobiohidrolase. Selobiohidrolase (C1) mampu menghidrolisis daerah kristalin selulosa, kemudian bekerjasama dengan endoglukanase membebaskan selobiosa dari serat selulosa. Selobiosa merupakan produk akhir yang menghambat selobiohidrolase dan juga tidak dapat dihidrolisis oleh endoglukanase. Oleh karena itu, selobiosa kemudian dihidrolisis oleh β-glukosidase sehingga menghasilkan glukosa. Mekanisme kerja enzim selulase disajikan pada Gambar 2.
Gambar 2. Mekanisme kerja ketiga tipe enzim selulase (Anonim 2005)
2.4.3 Enzim Xilanase
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa dalam hal ini ialah xilan atau polimer dari xilosa dan xilooligosakarida. Xilanase umumnya merupakan protein kecil dengan berat molekul antara 15,000 – 3,000 Dalton, aktif pada suhu 55ºC dengan pH 9 (Richana 2008). Xilanase lebih stabil pada suhu 60ºC dan pH normal.
10
β-1,4 glikosidik pada bagian dalam rantai xilan secara acak menjadi xilooligosakarida dan xilosa, sedangkan eksoxilanase mampu memutus rantai xilan pada ujung reduksi, sehingga menghasilkan xilosa sebagai produk utama dan sejumlah xilooligosakarida rantai pendek. Xilooligosakarida rantai pendek tersebut kemudian dihidrolisis oleh β-xilosidase menjadi monomernya yaitu xilosa yang juga merupakan inhibitor bagi enzim β-xilosidase. Jumlah rantai xilooligosakarida dapat mempengaruhi
aktivitas β-xilosidase, dimana peningkatan rantai xilooligosakarida akan menurunkan aktivitas enzim tersebut (Reilly 1985).
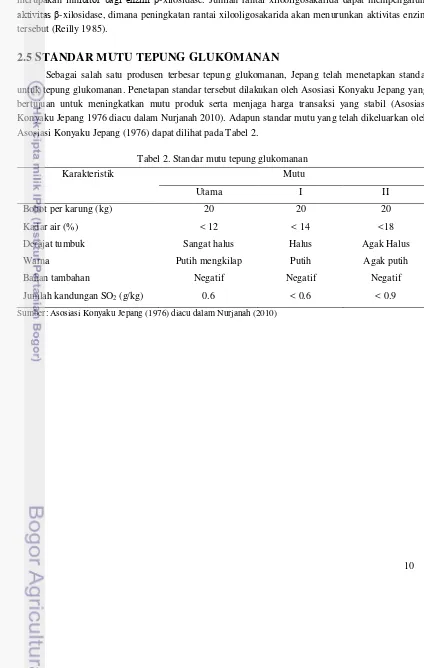
2.5 STANDAR MUTU TEPUNG GLUKOMANAN
Sebagai salah satu produsen terbesar tepung glukomanan, Jepang telah menetapkan standar untuk tepung glukomanan. Penetapan standar tersebut dilakukan oleh Asosiasi Konyaku Jepang yang bertujuan untuk meningkatkan mutu produk serta menjaga harga transaksi yang stabil (Asosiasi Konyaku Jepang 1976 diacu dalam Nurjanah 2010). Adapun standar mutu yang telah dikeluarkan oleh Asosiasi Konyaku Jepang (1976) dapat dilihat pada Tabel 2.
Tabel 2. Standar mutu tepung glukomanan
Karakteristik Mutu
Utama I II
Bobot per karung (kg) 20 20 20
Kadar air (%) < 12 < 14 <18
Derajat tumbuk Sangat halus Halus Agak Halus
Warna Putih mengkilap Putih Agak putih
Bahan tambahan Negatif Negatif Negatif
Jumlah kandungan SO2 (g/kg) 0.6 < 0.6 < 0.9
III. METODE PENELITIAN
3.1 BAHAN DAN ALAT
Bahan baku yang digunakan dalam penelitian ini adalah chips kering iles-iles kuning (Amorphophalus oncophyllus) yang diperoleh dari KPH Saradan, Desa Klangon, Kabupaten Madiun, dengan kadar air chips antara 8 – 10%. Bahan yang digunakan dalam pemurnian
tepung glukomanan adalah larutan bufer fosfat sitrat, enzim α-amilase, enzim xilanase,
enzim selulase, larutan etanol 95% dan aquades. Bahan yang digunakan dalam analisis adalah larutan NaOH, larutan HCl, larutan kalium iodida, larutan H2SO4, larutan heksan,
larutan KMnO4, larutan dinitrosalisilat, larutan fenol, larutan H3PO4, larutan Pb asetat,
CuSO4 hablur, Na2SO4 hablur, larutan H3BO3, Na2CO3 hablur, larutan indikator merah metil,
larutan Na2S2O3, larutan Luff Schroll, larutan kanji dan larutan iod.
Alat-alat yang digunakan dalam pemurnian tepung glukomanan adalah inkubator,
sentrifuse, tabung sentrifuse, kain saring, pengaduk, saringan, termometer dan penangas air. Peralatan untuk melakukan analisis adalah cawan aluminium, cawan porselen, oven, tanur,
Viscometer Brookfield LV, whiteness meter model C100, soxhlet, kertas saring, hot plate, buret, kjeltec, labu Kjeldahl, spektrofotometer Hach, mikroskop cahaya terpolarisasi dan peralatan gelas lainnya.
3.2 TATA LAKSANA PENELITIAN
Sistematika penelitian ini terdiri atas persiapan dan karakterisasi bahan baku, penentuan aktivitas dan kondisi kerja enzim yang akan digunakan, pemurnian glukomanan serta karakterisasi fisikokimia tepung glukomanan dan hidrolisat setelah dimurnikan.
3.2.1 Persiapan dan Karakterisasi Bahan Baku
Pembuatan tepung iles-iles dilakukan dengan cara menggiling chips dengan menggunakan disc mill kemudian diayak dengan ayakan berukuran 40 mesh sehingga dihasilkan tepung iles-iles yang siap untuk dimurnikan. Tepung iles-iles kemudian dianalisis komponen proksimatnya, meliputi: air, abu, serat, lemak, protein dan karbohidrat (by difference). Komponen serat yang dianalisis meliputi ADF (Acid Detergent Fiber), NDF (Neutral Detergent Fiber) dan selulosa, sedangkan komponen karbohidrat yang dianalisis, meliputi kadar pati, gula pereduksi dan kadar glukomanan. Prosedur analisis tersebut disajikan pada Lampiran 1.
3.2.2 Penentuan Aktivitas dan Kondisi Kerja Enzim α
-amilase, Selulase dan
Xilanase
12
3.2.3 Pemurnian Glukomanan
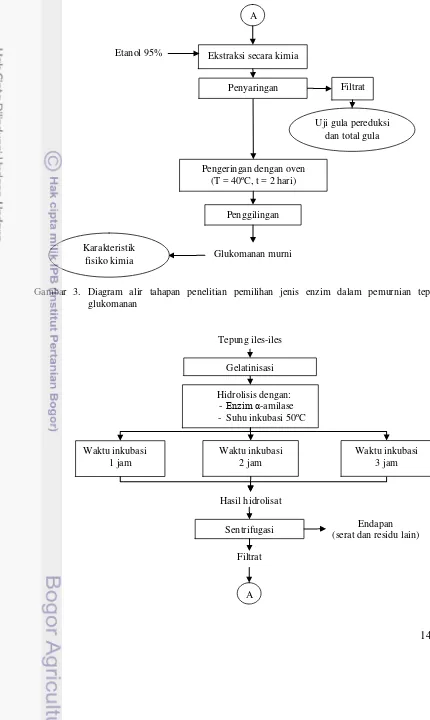
A. Pemilihan jenis enzim dalam pemurnian glukomanan
Pemurnian glukomanan dilakukan dengan menghidrolisis pati dan serat pada tepung iles-iles dengan cara: tepung iles-iles dibuat menjadi larutan 5%, kemudian dipanaskan selama 2 jam dalam waterbath sampai larutan tergelatinisasi. Larutan kemudian ditambahkan enzim α-amilase dan konsorsium sesuai dengan konsentrasi yang telah ditentukan. Pada tahap ini digunakan dua faktor perlakuan sebagai berikut:
(i) Suhu hidrolisis pada suhu 50ºC dan 65ºC.
(ii)Enzim α-amilase yang ditambahkan yaitu sebesar 3 U/g dan konsorsium enzim dengan konsentrasi masing-masing enzim 3 U/g untuk α-amilase, 10 U/g untuk selulase dan 10 U/g untuk enzim xilanase.
Sebagai pembanding, tepung iles-iles juga dimurnikan dengan perlakuan enzim α-amilase (3U/g) pada suhu hidrolisis 95ºC selama 30 menit. Pembanding ini merupakan perlakuan terbaik dari hasil penilitian Nurjanah (2010). Glukomanan yang telah dimurnikan kemudian diisolasi secara kimiawi dengan cara: larutan hasil hidrolisis disentrifugasi sehingga terbentuk dua fase, yaitu: larutan kental yang mengandung campuran oligosakarida dan glukomanan serta bagian bawah adalah serat atau komponen yang tidak terhidrolisis. Larutan yang kental tersebut kemudian dimasukkan ke dalam erlenmeyer, didinginkan dalam lemari es selama satu jam dan ditambahkan etanol 95% berlebih, yaitu 13 ml etanol 95% untuk tiap gram tepung. Etanol ditambahkan sedikit demi sedikit sambil diaduk-aduk kemudian dibiarkan sampai terjadi pemisahan antara hidrolisat dengan endapan glukomanan. Glukomanan yang mengendap dipisahkan dengan cara penyaringan vacuum menggunakan kain saring. Diagram alir penelitian pada tahap ini disajikan pada Gambar 3.
Filtrat hasil penyaringan tersebut dianalisa gula pereduksi dan total gulanya, sedangkan endapan glukomanan dicuci dengan etanol dan dikeringkan dalam oven pada suhu 40ºC selama 48 jam. Tepung glukomanan yang dihasilkan dikarakterisasi sifat fisikokimianya, meliputi rendemen, kadar glukomanan, viskositas dan analisa mikroskopik. Prosedur analisis disajikan pada Lampiran 1. B. Pengaruh waktu hidrolisis α-amilase terhadap pemurnian glukomanan
Pemurnian glukomanan pada tahap ini juga menggunakan metode yang sama dengan
pemurnian sebelumnya, namun perlakuan yang digunakan yaitu penambahan enzim α-amilase dengan konsentrasi enzim 3 U/g pada suhu 50ºC dan perlakuan waktu inkubasi 1, 2 dan 3 jam. Filtrat hasil penyaringan juga dianalisa gula pereduksi dan total gulanya, sedangkan tepung glukomanan yang dihasilkan dikarakterisasi sifat fisikokimianya, meliputi rendemen, kadar glukomanan, viskositas dan derajat putih. Diagram alir selengkapnya disajikan pada Gambar 4.
3.3 RANCANGAN PERCOBAAN
Rancangan percobaan yang digunakan adalah rancangan acak lengkap pada percobaan faktorial dengan dua ulangan. Model rancangan percobaan penelitian adalah sebagai berikut (Gaspersz 1994):
13
Dimana:
Yij = Nilai pengamatan dari penggunaan waktu hidrolisis ke-i pada ulangan ke-j µ = Rataan
Ai = Pengaruh faktor penggunaan waktu hidrolisis ke-i (i = 1,2,3)
ɛij = Pengaruh galat percobaan dari perlakuan ke-i pada ulangan ke-j
Dalam hidrolisis tepung glukomanan, perlakuan waktu hidrolisis diberi simbol A sehingga dengan perlakuan waktu 1, 2 dan 3 jam diberi simbol berturut-turut A1, A2 dan A3. Tepung glukomanan yang menjadi pembanding diberi simbol A0.
Hidrolisis dengan enzim
Enzim α-amilase Enzim konsorsium Tepung iles-iles
Hasil hidrolisat Karakterisasi
komposisi kimia
Suhu inkubasi: 50ºC
Konsentrasi α -amilase 3U/g Waktu inkubasi:
2 jam
Suhu inkubasi: 50ºC
Konsentrasi enzim: -α-amilase :
3U/g -xilanase:
10U/g -selulase :
10U/g
Waktu inkubasi: 2 jam
Suhu inkubasi: 65ºC
Konsentrasi enzim: - α-amilase :
3U/g - xilanase:
10U/g - selulase :
10U/g
Waktu inkubasi: 2 jam
Suhu inkubasi: 65ºC
Konsentrasi α -amilase 3U/g Waktu inkubasi:
2 jam
Filtrat
Sentrifugasi Endapan
(serat dan residu lain)
14
Filtrat Hasil hidrolisat Hidrolisis dengan:
- Enzim α-amilase - Suhu inkubasi 50ºC Tepung iles-iles
Waktu inkubasi 1 jam
Waktu inkubasi 3 jam Waktu inkubasi
2 jam
Sentrifugasi Endapan
(serat dan residu lain) Gelatinisasi
A
Gambar 3. Diagram alir tahapan penelitian pemilihan jenis enzim dalam pemurnian tepung glukomanan
A
Pengeringan dengan oven (T = 40ºC, t = 2 hari)
Penggilingan
Glukomanan murni Karakteristik
fisiko kimia
Ekstraksi secara kimia Etanol 95%
Uji gula pereduksi dan total gula
15
Gambar 4. Diagram alir tahapan penelitian pengaruh waktu hidrolisis α-amilase terhadap pemurnian glukomanan
Uji gula pereduksi dan total gula Ekstraksi secara kimia
Etanol 95%
Pengeringan (T = 40ºC, t = 2 hari)
Penggilingan
Glukomanan murni Karakteristik
fisiko kimia
Filtrat Penyaringan
IV. HASIL DAN PEMBAHASAN
4.1 KARAKTERISTIK KOMPOSISI KIMIA TEPUNG ILES-ILES
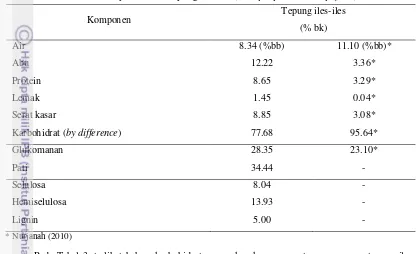
Umbi iles-iles merupakan umbi batang dengan kadar air yang tinggi. Penelitian ini menggunakan tepung iles-iles yang merupakan hasil dari penghancuran chips kering umbi dan lolos ayakan 40 mesh. Hasil uji proksimat tepung iles-iles disajikan pada Tabel 3.
Tabel 3. Komposisi kimia tepung iles-iles (Amorphophallus oncophyllus)
Komponen Tepung iles-iles
(% bk) Air Abu Protein Lemak Serat kasar
Karbohidrat (by difference)
8.34 (%bb) 12.22 8.65 1.45 8.85 77.68 11.10 (%bb)* 3.36* 3.29* 0.04* 3.08* 95.64* Glukomanan Pati 28.35 34.44 23.10* - Selulosa Hemiselulosa Lignin 8.04 13.93 5.00 - - -
* Nurjanah (2010)
Pada Tabel 3, terlihat bahwa karbohidrat merupakan komponen utama penyusun tepung iles-iles yaitu sebesar 77.68% (bk). Hal ini juga didukung oleh Zahid dan Siregar (1991) yang menyebutkan bahwa iles-iles dapat dijadikan sebagai sumber karbohidrat karena kandungan karbohidratnya hingga 85%. Karbohidrat pada tepung iles-iles terdiri atas pati, serat dan glukomanan. Glukomanan merupakan komponen karbohidrat yang paling penting dalam iles-iles. Menurut Erniati dan Laksamanahardja (1994), kadar glukomanan pada umbi iles-iles segar berkisar antara 44 – 46% tergantung dari varietas tanaman iles-iles tersebut. Salah satu jenis iles-iles yang mempunyai kadar glukomanan tinggi adalah iles-iles kuning (Amorphophallus oncophyllus) yaitu sekitar 55 – 65% dari total padatan. Selain itu, jenis lain yang juga mengandung glukomanan dalam jumlah yang cukup tinggi adalah iles-iles putih yaitu sekitar 10 – 15% dari total padatan (Gumbira Sa’id dan Rahayu 2009). Sumarwoto (2004) juga menyebutkan bahwa umur panen dapat mempengaruhi tinggi rendahnya kadar glukomanan pada umbi iles-iles, dimana umur umbi 6, 17 dan 24 bulan akan menghasilkan kadar glukomanan berturut-turut sebesar 37.99, 47.34 dan 48.54%.
17 pengirisan), umur panen, bagian-bagian yang digiling, alat yang digunakan, kecepatan putaran alat penggiling dan ulangan waktu penggilingan (Arifin 2001). Komponen karbohidrat lain, selain glukomanan adalah pati. Pati dalam tepung iles-iles terikat secara fisik dengan sel-sel manan yang merupakan komponen utama dalam umbi. Pati tersebut menyelimuti semua permukaan sel-sel manan dan tidak dapat dihilangkan jika masih dalam bentuk umbi iles-iles. Oleh karena itu, umbi iles-iles perlu diolah menjadi tepung terlebih dahulu sebelum dimurnikan dengan enzim. Kadar pati merupakan salah satu kriteria mutu untuk tepung, baik sebagai bahan pangan maupun non-pangan. Kadar pati yang didapatkan dalam tepung iles-iles pada penelitian ini sebesar 34.44% (bk). Menurut Ambarwati dan Murti (2001), kandungan glukomanan umbi berkorelasi positif sangat nyata terhadap kandungan pati. Hal tersebut berarti meningkatnya kandungan glukomanan akan berpengaruh terhadap kandungan pati, dimana semakin tinggi kandungan glukomanan akan selalu diikuti dengan bertambah tingginya kandungan pati umbi.
Selain glukomanan dan pati, serat juga merupakan bagian dari karbohidrat. Dari pengujian serat kasar, didapatkan data serat kasar tepung iles sebesar 8.85% (bk). Kadar serat tepung iles-iles ini juga lebih besar dibandingkan kadar serat pada penelitian Nurjanah (2010) yaitu 3.08% (bk). Hal tersebut disebabkan oleh kadar serat tepung dan pati dipengaruhi oleh umur panen umbi segarnya. Jika kadar pati pada umbi telah mencapai optimum, maka selanjutnya pati pada umbi akan terus turun secara perlahan dan mulai terjadi perubahan pati menjadi serat (Wahid et al. 1992).
Komponen serat terdiri atas selulosa, hemiselulosa dan sedikit lignin. Berdasarkan hasil analisa dengan menggunakan pereaksi ADF dan NDF, didapatkan kadar selulosa, hemiselulosa dan lignin dalam bahan berturut-turut 8.04%, 13.93% dan 5%. Dari data tersebut, terlihat bahwa kadar hemiselulosa pada bahan lebih tinggi dibandingkan dengan selulosanya. Tingginya kadar hemiselulosa ini diduga karena umbi iles-iles memiliki kadar glukomanan yang cukup tinggi. Hasil analisis tersebut juga didukung oleh hasil penelitian Kusmiyati (2009), dimana kandungan hemiselulosa pada umbi iles-iles kering lebih tinggi dibandingkan dengan kadar selulosanya
Selain kadar selulosa dan hemiselulosa, kadar lignin yang terdapat pada tepung iles-iles juga cukup tinggi. Begitu juga dengan kadar lignin umbi iles-iles kering yang didapatkan oleh Kusmiyati (2009). Tingginya kandungan lignin tersebut diduga akibat tidak dilakukannya proses pengupasan kulit umbi pada pembuatan tepung iles-iles. Selain itu, waktu atau umur panen juga dapat mempengaruhi kandungan bahan pada umbi. Jika panen dilakukan terlalu awal, maka kadar pati dalam umbi masih rendah. Jika panen dilakukan melebihi umur panen, maka kandungan lignin pada iles-iles akan meningkat dan kandungan patinya akan menurun (Djuwardi 2008).
Namun berdasarkan data analisis serat kasar dan komponennya, ternyata total persentasi selulosa, hemiselulosa dan lignin (26.97%) tidak sama dengan persentase serat kasar (8.85%), bahkan lebih besar. Ketidaksesuaian yang terjadi pada kedua hasil analisis ini disebabkan oleh larutnya hemiselulosa oleh asam sulfat pada pengujian kadar serat kasar. Hal ini juga disampaikan oleh Sitorus (2010) yang menyebutkan bahwa hemiselulosa relatif mudah dihidrolisis oleh asam menjadi komponen-komponen monomernya. Selain itu Suparjo (2010) menambahkan, serat kasar terutama mengandung selulosa dan hanya sebagian lignin, sehingga nilai ADF yang didapatkan lebih kurang 30% lebih tinggi dibandingkan serat kasar pada bahan yang sama.
18 antara lain pertumbuhan mikroba, reaksi pencoklatan dan hidrolisis lemak (deMan 1997). Oleh karena itu, penentuan kadar air dari suatu bahan pangan sangat penting agar dalam proses pengolahan maupun pendistribusian mendapat penanganan yang tepat.
Daya simpan suatu bahan dapat diperpanjang dengan menghilangkan sebagian air dalam bahan hingga mencapai kadar air tertentu. Batas kadar air minimum dimana mikroorganisme masih dapat tumbuh adalah sekitar 14 – 15% (Fardiaz 1989). Oleh karena itu, pengubahan umbi iles-iles menjadi tepung merupakan salah satu cara untuk mengurangi kadar air bahan sampai mencapai batas tertentu sehingga pertumbuhan mikroorganisme dan aktivitas enzim penyebab kerusakan pada tepung iles-iles ataupun tepung glukomanan dapat dihambat.
Berdasarkan hasil analisis, kadar air tepung iles-iles yang menjadi bahan baku pada penelitian ini adalah 8.34% (bb). Jika dibandingkan dengan kadar air pada penelitian sebelumnya, kadar air tersebut lebih rendah dibandingkan hasil penelitian Nurjanah (2010) yaitu 11.10% (bb). Kedua hasil analisis kadar air pada tepung iles-iles tersebut telah mencapai kadar air antara 8% sampai 12% dan diperkirakan sudah dapat menghambat pertumbuhan jasad renik dan aktivitas enzim (Arifin 2001).
Sekitar 96% bahan makanan, terdiri dari zat organik dan air, sementara sisanya terdiri dari unsur-unsur mineral yang merupakan zat anorganik. Dalam proses pembakaran, zat organik dalam bahan akan terbakar tetapi zat anorganiknya tidak sehingga disebut abu. Oleh karena itu, penentuan kadar abu berhubungan erat dengan kandungan mineral yang terdapat dalam suatu bahan. Menurut Syaefullah (1990), kandungan mineral yang dominan pada umbi iles-iles kuning adalah Ca, P, Fe, Na dan K.
Berdasarkan hasil analisis kadar abu pada tepung iles-iles, didapatkan kadar abu yang cukup tinggi yaitu sebesar 12.22% (bk). Kadar abu pada tepung iles-iles ini lebih tinggi dibandingkan kadar abu hasil analisis Nurjanah (2010) yaitu 3.36% (bk). Tingginya kadar abu pada tepung iles-iles diduga akibat proses pengolahan umbi yang kurang baik, seperti proses pencucian umbi yang kurang bersih, kulit umbi yang tidak dikupas terlebih dahulu, kontaminasi dari peralatan dan tempat pengolahan yang kotor serta air yang digunakan. Selain itu, kadar abu juga dipengaruhi oleh kondisi tempat tumbuh umbi tersebut, dimana umbi iles-iles yang berasal dari tempat tumbuh yang berbeda akan menghasilkan karakteristik yang berbeda pula. Hal tersebut juga dikemukakan oleh Soebito (1988) yang mengatakan bahwa secara kuantitatif, kandungan mineral yang diperoleh dapat berasal dari umbi segar, penggunaan pupuk dan juga kontaminasi tanah dan udara selama pengolahan.
Selain kadar air dan abu, dilakukan juga analisis terhadap protein kasar dalam bahan. Protein sendiri berarti senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan peptida. Bobot molekul protein bervariasi antara 5,000 sampai jutaan. Molekul protein mengandung karbon, hidrogen, oksigen, nitrogen dan kadang kala sulfur serta fosfor yang tidak dimiliki oleh lemak dan karbohidrat (Anonim 2011).
19 terbaca. Oleh karena itu, penggunaan pupuk tanaman yang mengandung nitrogen seperti urea juga bisa menjadi penyebab tingginya kadar protein tersebut.
Komponen proksimat terakhir yang juga dianalisa pada tepung iles-iles adalah lemak kasar. Lemak merupakan sekelompok besar molekul-molekul alam yang terdiri atas unsur-unsur karbon, hidrogen dan oksigen meliputi asam lemak, sterol, monogliserida, digliserida, fosfolipid, glikolipid, terpenoid (termasuk di dalamnya getah dan steroid) dan lain-lain. Lemak terdapat hampir pada semua jenis bahan pangan, tetapi dengan kandungan yang berbeda-beda tergantung dari sumber bahan pangan tersebut. Lemak dalam bahan pangan biasanya berpengaruh pada perubahan mutu selama penyimpanan, dimana kerusakan lemak dapat menurunkan nilai gizi serta menyebabkan penyimpangan rasa dan bau.
Berdasarkan analisis kadar lemak kasar, didapatkan hasil bahwa lemak yang terdapat pada tepung iles-iles ini cukup tinggi yaitu sebesar 1.45% (bk). Kadar lemak ini juga lebih tinggi jika dibandingkan dengan hasil penelitian Nurjanah (2010) yang hanya 0.04% (bk). Tingginya kadar lemak ini diduga disebabkan oleh tingginya zat-zat yang terlarut dalam lemak seperti sterol, phospholipid, asam lemak bebas, pigmen karotenoid atau klorofil.
Kadar lemak yang terlampau tinggi kurang menguntungkan dalam proses penyimpanan tepung karena dapat mempengaruhi ketengikan. Biasanya lemak dalam tepung akan mempengaruhi sifat amilografinya dimana lemak akan berikatan kompleks dengan amilosa yang membentuk heliks pada saat gelatinisasi pati sehingga menghambat keluarnya amilosa dari granula pati. Selain itu, sebagian besar lemak akan diabsorbsi oleh permukaan granula sehingga berbentuk lapisan lemak yang bersifat hidrofobik di sekeliling granula. Lapisan lemak tersebut akan menghambat pengikatan air oleh granula pati. Hal ini menyebabkan kekentalan dan kelekatan pati berkurang akibat jumlah air berkurang untuk terjadinya pengembangan granula pati (Collison 1968).
4.2
PENENTUAN AKTIVITAS DAN KONDISI KERJA ENZIM
-AMILASE,
XILANASE DAN SELULASE
Aktivitas enzim disebut juga sebagai kinetik enzim, yaitu kemampuan enzim dalam membantu reaksi kimia. Aktivitas enzim dipengaruhi oleh beberapa faktor, yaitu: suhu, pH, kadar substrat, kadar enzim, inhibitor dan aktivator. Aktivitas enzim dapat dihitung dengan mengukur jumlah produk yang terbentuk, menghitung berkurangnya substrat dalam satuan waktu tertentu atau dengan peningkatan dan penurunan koenzim. Metode yang digunakan dalam menghitung aktivitas enzim adalah dengan mengukur perubahan absorbans dalam satuan waktu, pH dan suhu tertentu sewaktu reaksi berjalan.
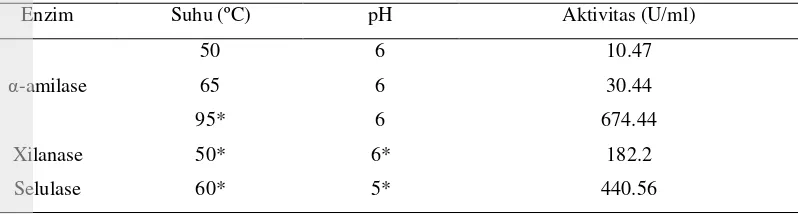
Enzim yang digunakan dalam penelitian ini terdiri atas tiga jenis, yaitu: α-amilase, xilanase dan selulase. Ketiga aktivitas dan kondisi kerja enzim tersebut disajikan pada Tabel 4.
20 Tabel 4. Aktivitas enzim α-amilase, xilanase dan selulase
Enzim Suhu (ºC) pH Aktivitas (U/ml)
α-amilase
50 6 10.47
65 6 30.44
95* 6 674.44
Xilanase 50* 6* 182.2
Selulase 60* 5* 440.56
*Derosya (2010)
Menurut Naz (2002), enzim -amilase akan menunjukkan aktivitas maksimum pada kondisi asam dengan kisaran pH antara 4.5 – 7.0. Namun, bentuk kurva aktivitas dan titik optimal pH berbeda-beda tergantung dari asal enzim tersebut. Dalam menentukan pH optimum enzim ini, digunakan buffer fosfat (0.1 M) sitrat (0.2 M) pH 5.0, 5.2, 5.4, 5.6, 5.8 dan 6.0. Adapun tujuan dari penggunaan buffer ini adalah untuk membuat pH relatif konstan selama proses karena aktivitas enzim sensitif terhadap perubahan pH. Selain itu, Sunarti et al. (2004) juga menyebutkan penggunaan buffer asam lemah maupun basa lemah bertujuan untuk mengurangi dampak yang tidak diinginkan dari reaksi yang terjadi.
Berdasarkan hasil pengujian, dari keenam pH yang digunakan aktivitas optimum enzim α -amilase berada pada pH 6 yaitu sebesar 674.44 U/ml. Dari informasi mengenai pH optimum tersebut, maka hidrolisis pati pada tepung iles-iles dilakukan pada pH 6 agar diperoleh kondisi proses yang terbaik sehingga hasil yang optimal dapat tercapai.
Selain pH, suhu juga merupakan faktor penting yang mempengaruhi aktivitas enzim. Suhu dimana konsentrasi produk yang dihasilkan paling tinggi dinyatakan sebagai suhu optimal. Selain penentuan aktivitas enzim pada suhu optimumnya yaitu 95ºC, dilakukan juga penentuan aktivitas α -amilase pada suhu 50ºC dan 65ºC. Hal ini dilakukan karena pada penelitian utama akan diberi dua perlakuan suhu, yaitu: 50ºC dan 65ºC. Penggunaan suhu yang rendah ini dilakukan berdasarkan penelitian Nurjanah (2010) yang menyebutkan bahwa perlakuan suhu hidrolisis berpengaruh nyata terhadap kekentalan tepung glukomanan, dimana kekentalan akan semakin menurun dengan semakin tingginya suhu. Hal tersebut juga sesuai dengan pendapat Glicksman (1969) yang menyebutkan bahwa kekentalan larutan dipengaruhi oleh suhu, konsentrasi, muatan, perlakuan panas dan perlakuan mekanis. Selain itu, enzim xilanase dan selulase yang digunakan memiliki aktivitas tertinggi pada
suhu rendah, namun hal tersebut tidak berlaku pada enzim α-amilase yang termostabil. Oleh karena itu, dilakukan perpanjangan waktu hidrolisis selama 2 jam. Melalui pengujian aktivitas enzim, maka didapatkan aktivitas enzim α-amilase pada suhu 50ºC dan 65ºC masing-masing 10.47 U/ml dan 30.44 U/ml.
Xilanase merupakan kelompok enzim yang memiliki kemampuan menghidrolisis hemiselulosa dalam hal ini ialah xilan atau polimer dari xilosa dan xilooligosakarida. Xilanase umumnya merupakan protein kecil dengan berat molekul antara 15,000 – 30,000 Dalton, aktif pada suhu 55°C dengan pH 9 (Richana 2008). Richana (2008) juga menyebutkan bahwa xilanase lebih stabil pada suhu 60°C dan pH normal.
21 sebesar 182.2 U/ml. Adapun pH dan suhu yang digunakan dalam penentuan aktivitas ini berbeda dengan pH dan suhu yang disebutkan oleh Richana (2008). Hal ini terjadi karena asal enzim dapat mempengaruhi bentuk kurva aktivitas dan titik optimal pH enzim tersebut.
Selulase adalah nama untuk semua enzim yang dapat memutuskan ikatan glikosidik β-1,4 glikosidik dalam selulosa, selodekstrin dan selobiosa serta turunan selulosa lainnya. Selulase sesungguhnya adalah enzim yang kompleks sehingga dapat mendegradasi selulosa membentuk monosakaridanya yaitu glukosa.
Dalam penentuan aktivitas selulase, kondisi kerja enzim yang digunakan yaitu buffer fosfat sitrat pH 5 dengan suhu inkubasi 50ºC. Penggunaan pH 5 dan suhu 60ºC ini juga berdasarkan penelitian terdahulu yang telah dilakukan oleh Derosya (2010). Setelah dilakukan pengujian, didapatkan aktivitas enzim selulase pada pH 5 dan suhu 60ºC yaitu sebesar 440.56 U/ml. Dengan diketahuinya aktivitas optimum enzim selulase ini, maka dapat diketahui banyaknya volume enzim yang akan ditambahkan saat hidrolisis selulosa pada tepung iles-iles dengan konsentrasi enzim tertentu.
4.3 PEMILIHAN JENIS ENZIM DALAM PEMURNIAN GLUKOMANAN
Pemurnian tepung iles-iles secara enzimatis dilakukan dengan menghidrolisis pati dan serat
dengan menggunakan perlakuan dua jenis enzim, yaitu: enzim tunggal α-amilase dan konsorsium
(gabungan enzim α-amilase, xilanase dan selulase). Selain jenis enzim, proses pemurnian ini juga diberi perlakuan dua suhu inkubasi, yaitu 50ºC dan 65ºC selama 2 jam.
Konsentrasi enzim yang ditambahkan untuk hidrolisis sebesar 3 U/g enzim α-amilase dan 10 U/g enzim xilanase serta selulase, sedangkan pH yang digunakan adalah pH optimum masing-masing
enzim, yaitu: pH 5 untuk enzim selulase dan pH 6 untuk enzim α-amilase serta xilanase. Penggunaan enzim xilanase dan selulase dalam konsorsium enzim bertujuan untuk menghidrolisis serat yang masih banyak terkandung dalam tepung iles-iles yaitu 8.85% (bk). Oleh karena itu penggunaan kedua enzim ini diharapkan dapat menghidrolisis serat menjadi monomer-monomernya.
Setelah tahap hidrolisis pati dan serat, hidrolisat pati yang berasal dari perlakuan enzim α -amilase terpisah menjadi dua fase. Fase yang terdiri dari serat berada pada bagian bawah, sedangkan oligosakarida bercampur dengan glukomanan membentuk larutan kental yang berada pada bagian atas dan berwarna kecoklatan. Lain halnya dengan hidrolisat pati yang berasal dari perlakuan konsorsium enzim, oligosakarida dengan glukomanan membentuk larutan encer berwarna putih susu. Hidrolisat ini tidak membentuk dua fase karena serat yang ada dalam tepung iles-iles telah dihidrolisis oleh enzim xilanase dan selulase menjadi bentuk yang lebih sederhana. Perbedaan kedua jenis hidrolisat tersebut dapat dilihat pada Gambar 5.
22 mengekstraksi glukomanan. Untuk lebih jelasnya, visualisasi pemurnian tepung glukomanan disajikan pada Lampiran 2.
Keterangan:
a. Hidrolisat pati yang berasal dari perlakuan enzim α-amilase b. Hidrolisat pati yang berasal dari perlakuan konsorsium enzim
Gambar 5. Penampakan hidrolisat setelah tahap hidrolisis dengan dua jenis enzim yang berbeda
Dalam pemurnian glukomanan ini dihasilkan produk utama berupa tepung glukomanan dan hasil samping berupa hidrolisat. Untuk mengetahui karakteristik fisikokimia tepung dan hidrolisat yang dihasilkan, maka dilakukan analisis berupa rendemen, kadar glukomanan dan viskositas pada tepung glukomanan, sedangkan pada hidrolisat dilakukan analisis terhadap gula pereduksi dan total gula yang kemudian menghasilkan nilai dextrose equivalent (DE). Hasil analisis tepung glukomanan dan hidrolisat tersebut selengkapnya disajikan pada Tabel 5.
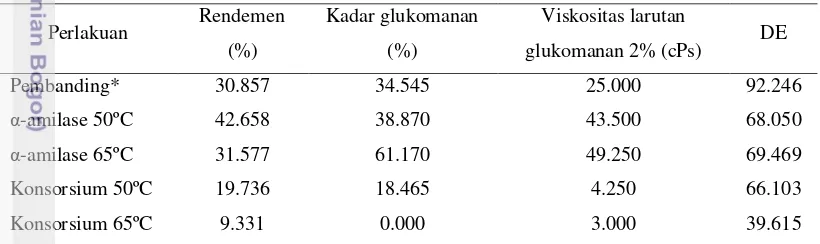
Tabel 5. Karakteristik fisikokimia tepung glukomanan hasil pemurnian secara enzimatis dan nilai DE pada hidrolisat
*Perlakuan enzim α-amilase (3U/g) dengan suhu inkubasi 95ºC selama 30 menit
Rendemen merupakan parameter dalam menentukan efisien tidaknya suatu proses. Semakin besar rendemen yang dihasilkan maka semakin efisien perlakuan yang diberikan, begitu pun sebaliknya. Nilai rendemen yang dimaksud dalam tabel ini merupakan perbandingan antara bobot tepung glukomanan setelah melewati proses pemurnian terhadap bobot awal tepung iles-iles.
Berdasarkan Tabel 5, terlihat bahwa rendemen tertinggi didapat dari perlakuan α-amilase pada suhu 50ºC yaitu sebesar 42.658%, sedangkan rendemen terendah didapat dari perlakuan konsorsium pada suhu 65ºC yaitu sebesar 9.331%. Tabel tersebut juga menunjukkan bahwa rendemen tepung glukomanan semakin rendah dengan semakin meningkatnya suhu.
Perlakuan Rendemen (%)
Kadar glukomanan (%)
Viskositas larutan
glukomanan 2% (cPs) DE
Pembanding* 30.857 34.545 25.000 92.246
α-amilase 50ºC 42.658 38.870 43.500 68.050
α-amilase 65ºC 31.577 61.170 49.250 69.469
Konsorsium 50ºC 19.736 18.465 4.250 66.103
Konsorsium 65ºC 9.331 0.000 3.000 39.615
a b
serat Campuran glukomanan, dekstrin dan gula sederhana
23
Tepung glukomanan yang dimurnikan dengan enzim α-amilase menghasilkan rendemen yang lebih tinggi dibandingkan dengan tepung glukomanan yang dihasilkan dari konsorsium enzim. Hal ini disebabkan oleh glukomanan yang ikut terhidrolisis oleh enzim xilanase dan selulase. Pada dasarnya, enzim bekerja spesifik bergantung pada ikatan glikosidik yang diputus, pola pemutusan, aktivitas yang dilakukan, spesifitas substrat dan produk yang dihasilkan. Enzim xilanase dan selulase yang digunakan dalam penelitian ini diharapkan bekerja spesifik terhadap substrat yaitu serat. Namun, spesifitas kerja kedua enzim yang digunakan pada penelitian ini lebih luas sehingga diduga xilanase dan selulase berperan dalam pemutusan glukomanan karena glukomanan termasuk dalam golongan
hemiselulosa dan juga memiliki ikatan β-1,4 glikosidik. Menurut Kato et al. (1970) diacu dalam Hanif (1991), dengan menggunakan metode kromatografi kertas, glukomanan yang terhidrolisis oleh enzim selulase akan menghasilkan beberapa komponen diantaranya manosa dan glukosa, mannobiosa, mannosil glukosa, mannotriosa, mannobiosil glukosa, mannotetraosa, mannotriosil glukosa dan mannotetraosilglukosa.
Selain rendemen tepung glukomanan, pada Tabel 5 juga disajikan data mengenai kadar glukomanan pada masing-masing perlakuan. Data kadar glukomanan ini diperoleh dari perbandingan antara bobot glukomanan murni terhadap bobot awal tepung glukomanan. Dari tabel tersebut terlihat bahwa kadar glukomanan semakin tinggi dengan meningkatnya suhu pada perlakuan α-amilase.
Berbeda dengan α-amilase, kadar glukomanan pada perlakuan konsorsium semakin rendah dengan meningkatnya suhu. Meningkatnya kadar glukomanan dengan semakin meningkatnya suhu pada
perlakuan α-amilase berkaitan erat dengan aktivitas enzim α-amilase. Hal ini terjadi karena α-amilase merupakan enzim termostabil yang berarti aktivitas enzim tersebut akan terus meningkat dengan semakin meningkatnya suhu dan mencapai optimum pada suhu 95ºC. Lalu peningkatan aktivitas enzim ini akan mempercepat reaksi hidrolisis pati sehingga proses reduksi pati akan semakin optimal. Walaupun bertolak belakang, perlakuan konsorsium pun memiliki prinsip kerja yang sama dengan
enzim α-amilase. Jika peningkatan suhu pada enzim α-amilase akan meningkatkan proses hidrolisis pati, maka peningkatan suhu pada konsorsium enzim akan meningkatkan proses hidrolisis serat dan juga glukomanan. Hal ini terlihat dari data kadar glukomanan untuk perlakuan konsorsium suhu 65ºC yaitu mencapai 0%.
Berdasarkan data yang didapatkan, perlakuan α-amilase pada suhu 65ºC menghasilkan kadar glukomanan tertinggi yaitu sebesar 61.17%, bahkan lebih tinggi dibandingkan dengan pembanding
yang juga mendapat perlakuan α-amilase pada suhu 95ºC yaitu sebesar 34.545%. Hal ini diduga terjadi karena tingginya suhu pembanding yang digunakan yaitu 95ºC sehingga menyebabkan terhidrolisisnya glukomanan dan kadar glukomanan pada tepung menjadi berkurang. Selain itu, bahan baku yang digunakan pada penelitian ini adalah tepung iles-iles yang tidak mengalami proses pemisahan fraksi pati, sehingga kandungan pati dalam tepung masih cukup tinggi dan membutuhkan waktu inkubasi yang cukup lama untuk mengoptimumkan proses hidrolisis dalam pemurnian glukomanan.
24 16.581% dan 10.659%. Untuk perlakuan konsorsium suhu 50ºC dan 65ºC, dihasilkan rendemen glukomanan murni berturut-turut sebesar 3.644% dan 0%.
Kekentalan suatu fluida merupakan ukuran penolakan fluida untuk mengalir, dimana kekentalan atau viskositas tersebut dipengaruhi oleh ikatan hidrogen gugus hidroksil polimer. Konsentrasi larutan glukomanan yang digunakan dalam pengukuran viskositas ini yaitu 2%. Berdasarkan hasil pengukuran tersebut, pada perlakuan α-amilase, viskositas semakin tinggi dengan
meningkatnya suhu. Berbeda dengan α-amilase, pada perlakuan konsorsium, viskositas semakin menurun dengan meningkatnya suhu. Hal ini sesuai dengan pendapat Nurjanah (2010) yang menyebutkan bahwa perlakuan suhu hidrolisis berpengaruh nyata terhadap viskositas tepung glukomanan.
Kurniawan et al. (2011) menyebutkan bahwa kadar glukomanan berbanding lurus dengan viskositas larutannya. Jika semakin tinggi kadar glukomanan, maka semakin tinggi pula viskositasnya. Hal ini dapat dilihat dari data yang diperoleh, dimana kadar glukomanan tertinggi yaitu 61.17% terjadi
pada perlakuan α-amilase suhu 65ºC sehingga viskositas tertinggi yaitu 49.5 cPs juga terjadi pada perlakuan tersebut. Begitu pula sebaliknya, kadar glukomanan dan viskositas terendah terjadi pada perlakuan konsorsium suhu 65ºC yaitu berturut-turut 0% dan 3 cPs. Oleh karena itu, dapat disimpulkan bahwa terdapat kaitan erat antara suhu, kadar glukomanan dan viskositas. Selain itu, rendahnya viskositas tepung glukomanan pada perlakuan konsorsium ini juga berkaitan dengan fenomena terhidrolisisnya glukomanan oleh enzim xilanase dan selulase. Jika semakin banyak glukomanan yang terhidrolisis, maka semakin rendah kadar glukomanannya sehingga viskositasnya juga semakin rendah.
Berdasarkan data tersebut, terlihat juga bahwa perlakuan α-amilase suhu 65ºC memiliki
viskositas yang cukup tinggi bahkan dibandingkan dengan pembanding yang menggunakan α-amilase dan suhu 95ºC. Rendahnya viskositas pembanding ini disebabkan oleh tingginya suhu inkubasi yang digunakan sehingga menyebabkan kerusakan pada glukomanan. Hal ini didukung oleh pendapat Nurjanah (2010) yang mengatakan bahwa walaupun suhu dekomposisi glukomanan menurut ISHS Acta (2009) adalah 280ºC, namun tidak menutup kemungkinan glukomanan akan rusak pada suhu 95ºC.
Glukomanan yang telah terhidrolisis terlihat jelas setelah dilakukan penambahan etanol 95%, dimana glukomanan yang terekstraksi tidak berbentuk benang-benang halus lagi tetapi telah menjadi gumpalan-gumpalan kecil berwarna putih. Penampakan glukomanan tersebut disajikan pada Gambar 6.
25 b
a c
Keterangan:
(a) Glukomanan yang masih utuh
(b) Glukomanan yang terhidrolisis oleh selulase dan xilanase
Gambar 6. Penampakan glukomanan setelah penambahan etanol 95% dengan perlakuan dua jenis enzim yang berbeda
4
1
1 1 2
3 4
4
Keterangan: 1
Glukomanan, 2Pati, 3Serat, 4Kalsium oksalat (a) tepung iles-iles tanpa perlakuan
(b) tepung iles-iles dengan penambahan α-amilase dan suhu inkubasi 50ºC selama 2 jam
(c) tepung iles-iles dengan penambahan konsorsium enzim dan suhu inkubasi 50ºC selama 2 jam Gambar 7. Penampakan tepung iles-iles tanpa perlakuan dan perlakuan dua jenis enzim yang berbeda
menggunakan mikroskop cahaya terpolarisasi, perbesaran 400x
Pada Gambar 7a, terlihat bahwa pati yang berwarna biru dan serat yang berwarna hitam masih menyelimuti partikel glukomanan. Dari gambar tersebut juga terlihat ukuran glukomanan yang cukup besar yang menandakan bahwa glukomanan tersebut masih utuh.
Pada gambar 7b, terlihat bahwa pati berwarna biru yang menyelimuti partikel glukomanan sudah tidak tampak, sedangkan serat yang berwarna hitam masih menempel pada permukaan glukomanan. Pada gambar tersebut juga terlihat ukuran glukomanan masih cukup besar yang menandakan bahwa pemurnian glukomanan dengan perlakuan α-amilase tidak menyebabkan terhidrolisisnya glukomanan.
Pada gambar 7c, terlihat bahwa pati yang berwarna biru dan serat yang berwarna hitam tidak tampak lagi pada permukaan glukomanan. Namun, ukuran glukomanan menjadi lebih kecil. Hal ini menunjukkan bahwa enzim xilanase dan selulase telah menghidrolisis serat yang terdapat pada tepung
26 tersebut. Namun tidak hanya serat, glukomanan yang berwarna kuning juga ikut terhidrolisis oleh kedua enzim ini yang ditandai dengan mengecilnya ukuran glukomanan pada gambar tersebut.
DE didefinisikan sebagai jumlah gula pereduksi total yang dinyatakan sebagai dekstrosa (glukosa murni) dan dihitung sebagai persentase dari bahan kering total. Menurut Dziedzic dan Kearsley (1995) diacu dalam Sunarti et al. (2008), dekstrosa murni adalah dekstrosa dengan derajat polimerisasi 1 (unit dekstrosa tunggal). Nilai DE diperoleh berdasarkan perbandingan jumlah gula pereduksi berdasarkan hasil hidrolisis terhadap total gula, baik gula pereduksi maupun non pereduksi, yang terdapat dalam bahan yang dianalisa dalam satuan persen. Semakin banyak gula preduksi atau glukosa yang terbentuk maka DE produk akan semakin meningkat. Berdasarkan Tabel 5, nilai DE semakin tinggi dengan meningkatnya suhu. Hal ini sesuai dengan pendapat Nurjanah (2010) yang mengatakan bahwa rata-rata nilai DE akan semakin meningkat dengan semakin tingginya suhu.
Peningkatan nilai DE ini terlihat pada perlakuan penambahan enzim α-amilase, dimana nilai DE pada suhu 65ºC lebih tinggi dibandingkan nilai DE pada suhu 50ºC. Lalu nilai DE tertinggi terjadi pada pembanding yang juga menggunakan enzim α-amilase dalam proses hidrolisis dengan suhu inkubasi 95ºC. Suhu 95ºC merupakan suhu dimana aktivitas enzim α-amilase mencapai optimum. Oleh karena itu nilai DE tertinggi terjadi pada suhu tersebut. Jika laju aktivitas enzim meningkat, maka hidrolisat yang terbentuk akan semakin banyak dan nilai DE semakin besar.
Pada perlakuan penambahan konsorsium enzim, nilai DE mengalami penurunan dengan semakin meningkatnya suhu. Hal tersebut diduga karena pati belum tergelatinisasi secara sempurna saat penambahan konsorsium enzim, sehingga diperoleh nilai DE yang lebih kecil. Selain α-amilase, pada konsorsium enzim juga terdapat enzim xilanase dan selulase yang menghidrolisis serat (hemiselulosa dan selulosa). Dalam menghidrolisis serat tersebut, diduga serat yang dihidrolisis tidak semuanya menjadi glukosa atau xilosa, tetapi masih ada yang berbentuk oligosakarida rantai pendek.
Selain untuk pemurnian tepung glukomanan, penggunaan enzim dalam penelitian ini juga bertujuan untuk memperoleh hasil samping berupa oligosakarida. Nilai DE pada hidrolisat tersebut dapat menunjukkan penggolongan hidrolisat tepung glukomanan ke dalam produk tertentu. Hidrolisat dengan nilai DE 3 – 20 adalah maltodekstrin, hidrolisat dengan nilai DE 42 – 63 adalah sirup campuran, hidrolisat dengan nilai DE 48 – 63 adalah sirup maltosa, sedangkan hidrolisat dengan nilai DE antara 96 – 98 adalah sirup glukosa (Kennedy et al. 1995). Berdasarkan data yang diperoleh, hidrolisat yang dihasilkan dari semua perlakuan baik jenis enzim maupun suhu hidrolisis tergolong dalam hidrolisat pati atau sirup campuran.
4.4
PENGARUH
WAKTU
HIDROLISIS
α
-AMILASE
TERHADAP
PEMURNIAN GLUKOMANAN
Pemurnian glukomanan dengan perlakuan konsorsium enzim pada penelitian sebelumnya menyebabkan terhidrolisisnya glukomanan. Oleh karena itu, tahap ini hanya menggunakan enzim α -amilase dan perlakuan waktu inkubasi 1, 2 dan 3 jam. Adapun suhu inkubasi yang digunakan 50ºC, karena pada penelitian sebelumnya suhu 50ºC memberikan rendemen tepung tertinggi dengan kadar glukomanan dan viskositas yang cukup baik.
27 Tabel 6. Karakteristik fisikokimia tepung glukomanan hasil pemurnian dengan α-amilase dan nilai
DE pada hidrolisat pati
Perlakuan Rendemen (%)
Kadar glukomanan
(%)
Viskositas larutan glukomanan 2% (cPs)
Derajat putih
(%) DE
Pembanding * 33.204 29.743 18.750 9.485 73.818
α-amilase 1 jam 24.640a 44.683 a 31.500 ab 11.950 a 55.562 a
α-amilase 2 jam 37.008 a 46.125 a 45.250 a 12.695 a 69.703 a
α-amilase 3 jam 27.388 a 44.265 a 15.500 b 13.910 a 77.951 a
Keterangan:
*Perlakuan enzim α-amilase (3U/g) dengan suhu inkubasi 95ºC selama 30 menit
Kode yang sama menunjukkan perlakuan tidak berbeda nyata dan kode yang berbeda menunjukkan perlakuan
berbeda nyata
Rendemen tepung glukomanan pada penelitian ini juga dihitung berdasarkan perbandingan bobot tepung glukomanan hasil proses pemurnian terhadap bobot tepung iles-iles. Berdasarkan Tabel 6, rendemen tepung glukomanan meningkat pada perlakuan waktu inkubasi 2 jam, kemudian kembali turun pada perlakuan 3 jam. Rendemen tertinggi didapat dari perlakuan 2 jam yaitu sebesar 37.008%. Rendemen ini juga lebih tinggi dibandingkan dengan rendemen pembanding yaitu 33.204%. Rendemen terendah didapat dari perlakuan 1 jam yaitu 24.640%. Namun secara statistik, rendemen tepung glukomanan pada ketiga perlakuan tidak berbeda nyata pada taraf uji beda nyata 5%.
Pada Tabel 6 juga terlihat bahwa kadar glukomanan meningkat pada perlakuan waktu inkubasi 2 jam, kemudian turun pada waktu inkubasi 3 jam. Kadar glukomanan tertinggi didapatkan pada perlakuan waktu inkubasi 2 jam yaitu sebesar 46.125% dan kadar glukomanan terendah didapatkan pada perlakuan waktu inkubasi 3 jam, yaitu 44.265%.
Ketiga perlakuan ini menghasilkan kadar glukomanan yang lebih tinggi dibandingkan dengan kadar glukomanan pembanding, yaitu 29.743%. Hal ini disebabkan oleh singkatnya waktu inkubasi pembanding yaitu hanya 30 menit, dibandingkan dengan perlakuan lain sehingga masih banyak komponen pengotor seperti pati yang belum terhidrolisis dalam tepung glukomanan tersebut. Namun secara statistik, kadar glukomanan tepung pada ketiga perlakuan waktu inkubasi tidak berbeda nyata pada taraf uji beda nyata 5%.
28 pendahuluan dan cara pengolahan umbi menjadi chips tidak dapat dikontrol sebelumnya untuk mempertahankan glukomanan dalam tepung.
Berdasarkan hasil perhitungan dari rendemen tepung dan kadar glukomanan, diketahui bahwa rendemen glukomanan murni terbaik dihasilkan dari perlakuan waktu inkubasi 2 jam, yaitu sebesar 17.069%. Untuk perlakuan waktu inkubasi 1 jam dan 3 jam dihasilkan rendemen glukomanan murni berturut-turut sebesar 11.009% dan 12.123%, sedangkan rendemen glukomanan murni yang dihasilkan pembanding adalah sebesar 9.876%.
Kadar glukomanan berbanding lurus dengan viskositas. Jika semakin tinggi kadar glukomanan, maka semakin tinggi pula viskositasnya begitu pun sebaliknya. Hal ini terlihat pada Tabel 6 yang menunjukkan bahwa perlakuan waktu inkubasi 2 jam yang menghasilkan kadar glukomanan tertinggi memiliki viskositas tertinggi, yaitu 45.250 cPs, sedangkan perlakuan waktu inkubasi 3 jam yang menghasilkan kadar glukomanan terendah juga memiliki viskositas terendah yaitu 15.5 cPs. Secara statistik, viskositas tepung glukomanan pada ketiga perlakuan tersebut berbeda nyata pada taraf uji beda nyata 5%. Hasil analisis uji lanjut Duncan menunjukkan bahwa perlakuan waktu inkubasi memberikan hasil tidak berbeda nyata pada perlakuan 2 jam dan 1 jam, begitu pula pada perlakuan 1 jam dan 3 jam. Namun, perlakuan 2 jam memberikan hasil yang berbeda nyata dengan perlakuan 3 jam.
Menurut Kurniawan et al. (2011), tepung iles-iles bermutu foodgrade yang terdapat di pasar internasional memiliki viskositas larutan tinggi yaitu 16,000 cPs untuk larutan 1%. Hal ini tidak sebanding dengan viskositas tertinggi yang didapatkan pada penelitian ini yaitu 45.25 cPs untuk larutan 2%. Menurut Kato dan Matzuda (1969) diacu dalam Nurjanah (2010), hasil analisis difraksi sinar-X polisakarida ma