SITHA ARILAH ICHSAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Merr.) Sebagai Antioksidan dan Antidiabetes Secara
In Vitro
. Dibimbing oleh
SYAMSUL FALAH dan WARAS NURCHOLIS.
Tanaman suren (
Toona sinensis
Merr.) merupakan tanaman herbal yang
daunnya dilaporkan memiliki aktivitas antioksidan dan antidiabetes. Kulit kayu
tanaman suren diduga memiliki aktivitas yang sama dengan daunnya. Penelitian
ini bertujuan menentukan aktivitas antioksidan dan antidiabetes ekstrak etanol
70% dan ekstrak air kulit kayu suren secara
in vitro
. Aktivitas antioksidan diamati
menggunakan parameter uji biokimia, yaitu aktivitas inhibisi radikal bebas DPPH
pada konsentrasi sampel 50, 30, 10, dan 5 ppm. Potensi antidiabetes diukur
melalui aktivitas penghambatan kerja enzim
-glukosidase pada konsentrasi
sampel 12.5, 6.3, 3.1, dan 1.6 ppm. Kadar air kulit kayu suren yang diuji adalah
9.04%. Ekstraksi dengan pelarut etanol 70 % dan air menghasilkan rendemen
sebesar 4.8% dan 2.6%. Hasil uji fitokimia menunjukkan kandungan senyawa
alkaloid, saponin, tanin, flavonoid, dan hidroquinon pada ekstrak etanol 70%.
Sementara ekstrak air kulit kayu suren menunjukkan adanya kandungan senyawa
saponin, flavonoid, dan hidroquinon. Hasil analisis aktivitas antioksidan ekstrak
etanol 70% dan air ditunjukkan dengan nilai IC
50secara berturut-turut yaitu 11.86
dan 17.78 ppm. Sementara nilai IC
50vitamin C yang digunakan sebagai
pembanding sebesar 3.31 ppm. Penghambatan enzim
-glukosidase memiliki nilai
IC
50sebesar 0.66 ppm untuk ekstrak etanol 70% dan 3.32 ppm pada ekstrak air,
sedangkan nilai IC
50acarbose
sebagai pembanding adalah sebesar 0.08 ppm.
Hasil pengujian tersebut menunjukkan kulit kayu suren memiliki aktivitas
antioksidan dan berpotensi sebagai antidiabetes.
Extracts as Antioxidant and Antidiabetic With
In Vitro
Analysis. Under the
direction of SYAMSUL FALAH and WARAS NURCHOLIS.
Suren (
Toona sinensis
Merr.) is a herbal plant that its leaves has been
reported have a antioxidant and antidiabetic activity. The bark of suren thought to
have antioxidant and antidiabetic activity as it leaves. This study was conducted to
investigate antioxidants and antidiabetic activity of ethanol 70% and water
extracts of suren bark using in vitro method. The antioxidant activity was
observed using the parameters of biochemical tests, through measurement of the
inhibitory activity to DPPH as free radical with concentration of samples 50, 30,
10, and 5 ppm. The potential antidiabetic activity was measured through
inhibition of
-glucosidase enzymes work at a sample concentration of 12.5, 6.3,
3.1, and 1.6 ppm. The moisture content of suren bark samples in the test is 9.04%.
Suren bark extracted with a solvent ethanol 70% and water has a yield of 4.8%
and 2.6%. Phytochemical test of ethanol 70% extract showed the present of
alkaloids, saponins, tannins, flavonoids, and hydroquinone. While the water
extract indicate a content of saponin compounds, flavonoids, and hydroquinone.
The results of the analysis of antioxidant activity indicated by IC
50value which is
11.86 ppm for ethanol 70% extracts and 17.78 ppm for water extract. While the
IC
50value of vitamin C used as a comparison is 3.31 ppm. Inhibition of
-glucosidase enzyme are also shown in the IC
50value which is 0.66 ppm for
ethanol 70% extract and 3.32 ppm for water extracts, whereas
acarbose
as a
comparison have IC
50value of 0.08 ppm. These results showed that suren bark
have an antioxidant and antidiabetic activity.
SITHA ARILAH ICHSAN
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM : G84070003
Disetujui
Komisi Pembimbing
Dr. Syamsul Falah, S.Hut., M.Si.
Ketua
Waras Nurcholis, M.Si
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
nikmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini
sebagai salah satu persyaratan untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia, Fakultas Matematika & IPA Institut Pertanian Bogor.
Tema yang dipilih pada penelitian ini ialah m
etabolisme, dengan judul “
Aktivitas
Ekstrak Kulit Kayu Suren (
Toona Sinensis
Merr.) Sebagai Antioksidan dan
Antidiabetes Secara
In Vitro
”
.
Penelitian ini dilaksanakan pada bulan Maret
hingga Juni 2011 di Laboratorium Biokimia Departemen Biokimia dan
Laboratorium Pusat Studi Biofarmaka Institut Pertanian Bogor
.
Terima kasih penulis ucapkan kepada Dr. Syamsul Falah, S.Hut., M.Si.
dan Waras Nurcholis, M.Si atas bimbingan, waktu, dan perhatiannya kepada
penulis selama penelitian dan penyusunan karya ilmiah. Ucapan terima kasih juga
penulis sampaikan kepada teknisi laboratorium Pusat Studi Biofarmaka yang telah
banyak membantu dalam teknis pelaksanaan penelitian, kepada kedua orang tua
dan seluruh keluarga tercinta atas segala doa, dukungan, kasih sayangnya, dan
selalu memberi inspirasi kepada penulis untuk selalu berjuang keras dan menjadi
lebih baik, dan kepada Fajri selaku rekan kerja, Maya, Dina, Leli, Restu, Rezana,
mbak Amel, dan kak Fahry atas dukungan dan bantuannya selama penelitian dan
penyusunan skripsi. Semoga karya ilmiah ini dapat bermanfaat bagi pembaca dan
ilmu pengetahuan, khususnya di bidang Biokimia dan Farmasi.
Bogor, November 2011
Sitha Arilah Ichsan
1989 dari ayahanda John Arifin dan ibunda Ilah Carsilah sebagai anak pertama
dari tiga bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 1 Praya
(Lombok) dan pada tahun yang sama penulis diterima di Institut Pertanian Bogor
melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis mengambil Mayor
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) dan
memilih Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian (FATETA)
sebagai minor.
Selama mengikuti perkuliahan, penulis pernah aktif di berbagai organisasi
kemahasiswaan. Tahun 2007-2008 penulis aktif sebagai Ketua Musholla
Al-Mahabbah di Asrama Putri TPB IPB. Tahun 2008-2010 penulis aktif di himpunan
profesi
Community of Research and Education of Biochemistry Student
(CREBs)
sebagai
Badan
Pengawas.
Pada
tahun
terakhir
perkuliahan,
penulis
berkesempatan sebagai penyaji makalah internasional pada
Annual Meeting of
Science and Technology Studies
(AMSTECS)-Jepang 2011.
Pengalaman profesi
penulis diantaranya adalah sebagai asisten praktikum Pengantar Penelitian
Biokimia untuk mahasiswa Departemen Biokimia FMIPA IPB pada tahun 2011.
Penulis pernah menjalani Praktik Lapang (PL) di Balai Penelitian Bioteknologi
Perkebunan Indonesia (BPBPI) pada tahun 2010 dan menulis laporan ilmiah yang
berjudul
“
Isolasi DNA Tanaman Karet dan Analisis RAPD Planlet Karet pada
Tahap Multiplikasi,
Conditioning
, dan
Rooting
”. Pada tahun 2008 sampai 2010,
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Suren (
Toona sinensis
Merr.) ... 2
Radikal Bebas dan Antioksidan ... 3
Diabetes Melitus ... 4
Metode DPPH ... 5
Inhibisi
-Glukosidase ... 6
BAHAN DAN METODE
Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Kadar Air Kulit Kayu Suren ... 8
Ekstraksi Kulit Kayu Suren ... 8
Uji Fitokimia ... 9
Daya Hambat Ekstrak Terhadap Radikal Bebas DPPH ... 10
Daya Inhibisi Ekstrak Terhadap Enzim
-Glukosidase ... ... 11
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 13
Halaman
1 Hasil ekstraksi kulit kayu suren ... 9
2 Hasil uji fitokimia ekstrak kulit kayu suren ... 9
3 Aktivitas antioksidan ekstrak kulit kayu suren dan vitamin C ... 10
4 Perubahan aktivitas antioksidan ekstrak etanol 70% dan ekstrak air pada
konsentrasi uji ... 11
5 Perubahan aktivitas antioksidan ekstrak etanol 70%, ekstrak air, dan
vitamin C dalam nilai IC
50... 11
6 Aktivitas inhibisi
-glukosidase ekstrak kulit kayu suren dan
acarbose
... 12
7 Perubahan aktivitas inhibisi
-glukosidase ekstrak etanol 70% dan ekstrak
air pada konsentrasi uji ... 12
8 Perubahan aktivitas inhibisi
-glukosidase ekstrak etanol 70%, ekstrak air,
dan
acarbose
dalam nilai IC
50... 13
DAFTAR GAMBAR
Halaman
1 Pohon suren ... 3
DAFTAR LAMPIRAN
Halaman
1 Gambaran umum penelitian ... 19
2 Prosedur uji aktivitas antioksidan ekstrak kulit kayu suren ... 20
3 Prosedur uji inhibisi enzim
-glukosidase ekstrak kulit kayu suren ... 21
4 Perhitungan kadar air serbuk kulit kayu suren dan hasil rendemen ekstrak
kulit kayu suren ... 22
5 Data nilai absorbansi dan % inhibisi ekstrak etanol 70% kulit kayu suren
sebagai antioksidan ... 23
6 Data nilai absorbansi dan % inhibisi ekstrak etanol air kulit kayu suren
sebagai antioksidan ... 24
7 Data nilai absorbansi dan % inhibisi ekstrak etanol 70% kulit kayu suren
sebagai inhibitor
-glukosidase ... 25
8 Data nilai absorbansi dan % inhibisi ekstrak air kulit kayu suren sebagai
inhibitor
-glukosidase ... 26
9 Hasil uji analisis statistik (tabel ANOVA) ekstrak kulit kayu suren sebagai
antioksidan ... 27
10 Hasil uji analisis statistik (tabel ANOVA) ekstrak kulit kayu suren sebagai
inhibitor
-glukosidase ... 28
11 Hasil uji analisis statistik (tabel ANOVA) nilai IC
50ekstrak kulit kayu suren
sebagai antioksidan ... 29
12 Hasil uji analisis statistik (tabel ANOVA) nilai IC
50ekstrak kulit kayu suren
PENDAHULUAN
Dibetes Melitus (DM) merupakan penyakit metabolik yang dicirikan oleh tingginya kadar glukosa dalam darah. Penyakit ini adalah salah satu penyakit kondisi kronis yang dapat diderita seumur hidup dan memiliki komplikasi (menyebabkan terjadinya penyakit lain) yang paling banyak. Hal ini berkaitan dengan kadar gula darah yang tinggi secara terus-menerus, sehingga berakibat rusaknya pembuluh darah, saraf, dan struktur internal lainnya (Sari 2010). Akibat tingginya kadar gula darah hingga mencapai fase diabetes dapat memicu resiko serangan jantung, stroke, gagal ginjal, penyakit pembuluh darah perifer, serta kondisi akut lainnya. Komplikasi kronis ditandai dengan kerusakan dan akhirnya kegagalan berbagai organ, seperti mata, ginjal, saraf, jantung, dan otak. Pada kondisi akut, diabetes dapat menyebabkan kebutaan bahkan kematian (Wijayakusumah 2004).
Badan Kesehatan Dunia, WHO (World Health Organization) menyebutkan bahwa pada tahun 2003 tercatat jumlah penderita diabetes berusia 20-79 tahun dari 3.8 milyar penduduk dunia adalah sebesar 194 juta jiwa dan diperkirakan jumlahnya akan meningkat menjadi 333 juta jiwa pada tahun 2025. Sementara itu, di Indonesia jumlah penderita diabetes menempati urutan keempat di dunia setelah Amerika Serikat, India, dan Cina dengan jumlah penderita mencapai lebih dari 13 juta jiwa (Depkes 2005).
Secara klinis, diabetes dapat dikategorikan menjadi diabetes tipe I, diabetes tipe II, dan
Gestational Diabetes Melitus. Diabetes tipe I merupakan tipe diabetes yang disebabkan oleh defisiensi insulin dalam tubuh. Diabetes tipe II merupakan gangguan toleransi glukosa. Penyakit ini sering disebut sebagai penyakit
non-insulin dependent diabetes melitus atau diabetes melitus tak tergantung insulin (DMTTI). DMTTI yang akut dapat membawa penderitanya ke penyakit diabetes tipe I (Stryer et al. 2007). Tipe lainnya dari diabetes adalah diabetes pada masa kehamilan atau sering juga disebut sebagai Gestational Diabetes Melitus (GDM). Penyakit ini dapat menjangkiti sebagian ibu hamil, baik penderita diabetes maupun yang sehat (Price & Wilson 1995).
Salah satu penyebab utama diabetes melitus dan berbagai penyakit degeneratif lainnya adalah radikal bebas (Putri 2010). Pada penderita diabetes melitus, stres
oksidatif akan menghambat pengambilan glukosa di sel otot dan sel lemak serta penurunan sekresi insulin oleh sel-β di pankreas. Stres oksidatif secara langsung mempengaruhi dinding vaskular, sehingga berperan penting dalam patofisiologi terjadinya komplikasi diabetes tipe 2 (Putri 2010). Memperbaiki stress oksidatif adalah strategi yang efektif untuk menurunkan perkembangan diabetes dan komplikasinya. Antioksidan dalam jumlah yang cukup sangat penting bagi penderita diabetes untuk mencegah komplikasi.
Pengobatan umum yang dilakukan untuk penderita diabetes bukanlah untuk menyembuhkan melainkan untuk membantu menurunkan konsentrasi gula darah. Penderita diabetes memiliki konsentrasi gula darah yang tinggi terus-menerus, maka pengobatannya juga perlu dilakukan secara terus-menerus sehingga kurang efektif. Salah satu pengobatan efektif untuk diabetes adalah dengan penyuntikan hormon insulin, tapi harga pengobatan ini sangatlah mahal, apalagi perlu dilakukan secara rutin.
Bentuk pengobatan lainnya untuk diabetes adalah dengan pengembangan obat diabetes
yang mampu menghambat kerja enzim α
-glukosidase. Enzim α-glukosidase bekerja pada saat proses penyerapan glukosa dalam usus. Pada penderita diabetes, hal ini merupakan salah satu hal yang harus dicegah. Semakin banyak glukosa yang terbentuk dari pemecahan pati, maka akan semakin tinggi kadar glukosa dalam darah penderita diabetes. Oleh karena itu pengembangan obat diabetes saat ini lebih difokuskan pada inhibisi kerja enzim ini (Murray et al. 2009).
Telah banyak obat-obatan sintetik yang berperan menghambat aktivitas enzim α -glukosidase, salah satunya adalah acarbose
yang biasa dikenal dengan merek dagang glucobay. Obat-obatan sintetik memiliki efek samping pada lambung (Neal 2002) diantaranya kembung, diare, dan kejang perut, sehingga penggunaannya perlu dibatasi (Lee
et al. 2007).
Pengembangan obat herbal yang mengandung senyawa aktif yang dapat berperan sebagai antidiabetes tengah menjadi
anthraquinones yang mampu manghambat aktivitas enzim α-glukosidase. Seperti halnya pada daunnya, kulit kayu tanaman suren diduga juga mengandung senyawa fitokimia yang memiliki mekanisme antioksidan dan
inhibisi α-glukosidase. Potensi tersebut belum banyak diteliti hingga saat ini sehingga diperlukan penelitian yang dapat memberikan gambaran aktivitas antioksidan dan potensi kulit kayu suren sebagai antidiabetes.
Penelitian ini bertujuan menguji ekstrak etanol 70% dan ekstrak air kulit kayu suren sebagai antioksidan dan antidiabetes secara in vitro. Hasil yang diperoleh akan dibandingkan secara langsung dengan acarbose (obat komersil diabetes melitus tipe II). Adapun parameter uji yang digunakan adalah persen penghambatan radikal DPPH dan persen penghambatan aktivitas enzim -glukosidase yang ditunjukkan dalam nilai IC50.
Hipotesis pada penelitian ini adalah kandungan senyawa fitokimia yang terdapat di dalam kulit kayu suren (Toona sinensis Merr.) memiliki aktivitas antioksidan dan antidiabetes. Senyawa fitokimia tersebut diduga dapat menghambat atau mencegah terjadinya pembentukan radikal bebas yang dapat meningkatkan perkembangan dan komplikasi penyakit diabetes. Selain itu, senyawa-senyawa tersebut juga diduga mampu menghambat aktivitas enzim -glukosidase yang berperan dalam proses penyerapan gula di usus. Hasil penelitian ini diharapkan dapat memberi nilai tambah bagi tanaman suren melalui pemanfaatan limbah kulit kayu suren dalam farmakologi sebagai upaya pencegahan dan pengobatan penyakit diabetes melitus.
TINJAUAN PUSTAKA
Suren (Toona sinensis Merr.)
Suren merupakan keluarga tanaman Meliaceae dengan ordo Sapindales. Suren adalah tanaman spermatophyte yang termasuk ke dalam divisi Magnoliophyta (tumbuhan berbunga) dan class Magnoliopsida dengan
subclass Rosidae. Pohon suren memiliki karakter khusus seperti harum yang khas apabila bagian daun atau buah diremas dan bila bagian batang dilukai atau ditebang. Bentuk batang suren lurus dan umumnya tidak bercabang hingga ketinggiannya mencapai 25 m dan tinggi pohon dapat mencapai 40-60 m. Kulit batangnya kasar dan pecah-pecah dan berwarna coklat. Daun suren berbentuk oval
dengan panjang 10-15 cm, menyirip tunggal dengan 8-30 pasang daun pada pohon berdiameter 1-2 m. Musim bunga tanaman ini dua kali dalam setahun yaitu sekitar bulan Februari hingga Maret dan September hingga Oktober (Djam’an 2002).
Tanaman suren (Gambar 1) merupakan komoditas tanaman kayu rakyat yang paling populer di Jawa Barat. Selain pertumbuhannya cepat, mudah tumbuh di berbagai tempat juga harga jualnya cukup tinggi untuk mendukung pendapatan petani. Kayu suren digunakan untuk tiang bangunan rumah, papan peti kemas, peti kas, perabotan rumah tangga, pagar, tangkai dan kotak korek api, pulp, kertas, dan lain-lain. Secara tradisional, petani menggunakan daun suren untuk menghalau hama serangga tanaman
(Djam’an 2002).
Kayu suren berbau harum sehingga tahan terhadap serangan rayap. Serbuk atau bubuk kayunya berwarna kemerahan. Tanaman ini tumbuh pada daerah bertebing dengan ketinggian 600-2.700 m dpl (di atas permukaa laut) dengan temperatur sekitar 22 ºC. Bagian tanaman yang dapat dimanfaatkan adalah kayunya sebagai bahan bangunan, furniture,
veneer, panel kayu. Selain itu, ekstrak daunnya dipakai sebagai antibiotik dan bio-insektisida, sedangkan kulit batang dan buahnya dapat disuling untuk menghasilkan minyak esensial (aromatik). Tajuknya yang tidak terlalu lebar membuat pohon suren biasa digunakan sebagai tanaman pelindung atau pembatas di ladang dan sebagai windbreak di perkebunan teh (Djam’an 2002).
Di Taiwan, Toona sinensis umum digunakan sebagai makanan untuk para vegetarian. Daunnya sering kali digunakan sebagai obat-obatan untuk menangani enteritis, disentri, dan gatal-gatal. (Hseu et al.
2008). Hasil penapisan fitokimia simplisia daun suren menunjukkan adanya senyawa golongan flavonoid, tanin dan steroid/triterpenoid yang penting sebagai
antioksidan (Djam’an 2002).
Ekstrak air daun tanaman suren memiliki efek antiproliferasi terhadap sel premyelocytic
fenolik lainnya. Senyawa fenolik yang paling banyak terkandung pada daun suren yang berperan sebagai antioksidan diantaranya gallic acid, galloylquinic acid, tri-O-galloyl-D-glucose, dan quercetin glucopyranoside. Jiang et al. (2007) dan Hseu et al. (2008) juga melaporkan bahwa daun tanaman suren memiliki aktivitas antioksidan yang cukup tinggi dengan pemutusan aktivitas radikal bebas DPPH dan lipid peroksida.
Ekstrak kasar daun tanaman ini dilaporkan dapat menginduksi apoptosis pada sel kanker paru-paru, mengurangi glukosa darah pada tikus diabetes, dan meningkatkan lipolisis dan kadar glukosa pada jaringan adiposa (Hseu et al. 2008). Daun tanaman suren juga mengandung sejumlah besar flavonoid, alkaloid, terpene, dan anthraquinones yang
mampu manghambat aktivitas enzim α -glukosidase (Zhao et al. 2009).
Gambar 1 Pohon suren.
Radikal Bebas dan Antioksidan
Saat ini ditemukan bahwa ternyata radikal bebas berperan dalam terjadinya berbagai penyakit. Hal ini dikarenakan radikal bebas adalah senyawa kimia yang memiliki pasangan elektron bebas di kulit terluar sehingga sangat reaktif dan mampu bereaksi dengan protein, lipid, karbohidrat, atau DNA. Reaksi antara radikal bebas dengan salah satu molekul tersebut berujung pada timbulnya suatu penyakit.
Radikal bebas dapat dihasilkan dari proses metabolisme tubuh secara alami (endogenous) maupun berasal dari factor eksternal (exogenous). Dalam tubuh, sekitar 5 persen dari oksigen pernafasan akan diubah secara alami menjadi radikal bebas. Selain itu proses autoksidasi, oksidasi enzimatik, fagositosis dalam respirasi, transpor elektron di
mitokondria, dan oksidasi ion-ion logam transisi juga merupakan penyebab munculnya radikal bebas dalam tubuh (Salma 1999). Radikal bebas yang berasal dari luar tubuh diantaranya disebabkan oleh asap rokok, asap kendaraan bermotor, sinar ultra violet, zat kimiawi dalam makanan, dan senyawa-senyawa polutan lainnya (Mardisadora 2010). Antioksidan adalah zat yang dapat menunda atau mencegah terjadinya reaksi oksidasi radikal bebas. Senyawa dikatakan memiliki sifat antioksidatif bila senyawa tersebut mampu mendonasikan satu atau lebih elektron kepada senyawa prooksidan, kemudian mengubah senyawa oksidan menjadi senyawa yang stabil (Packer 1995).
Antioksidan, berdasarkan sumbernya dibagi menjadi 2 kelompok, yaitu antioksidan sintetik dan antioksidan alami. Beberapa contoh antioksidan sintetik adalah Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT), propil galat, tert-butil hidroksi quinon (TBHQ) dan tokoferol, sedangkan antioksidan alami berasal dari tumbuhan, yang pada umumnya adalah senyawa fenolik atau polifenolik yang dapat berupa golongan flavonoid. Berdasarkan asal terbentuknya, antioksidan dibagi menjadi dua kelompok, yaitu antioksidan endogen dan eksogen. Sedangkan berdasarkan mekanisme kerjanya, antioksidan dapat dikelompokkan menjadi 3 kelompok, yaitu antioksidan primer, sekunder, dan tersier. Antioksidan primer adalah antioksidan endogen atau antioksidan enzimatis, contohnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase (GPx). Enzim-enzim ini mampu menekan atau menghambat pembentukan radikal bebas dengan cara memutus reaksi berantai dan mengubahnya menjadi produk lebih stabil. Antioksidan sekunder merupakan antioksidan eksogen atau antioksidan non enzimatis. Contoh antioksidan sekunder ialah
vitamin E, vitamin C, β-karoten, isoflavon, asam urat, bilirubin, dan albumin. Senyawa-senyawa ini dikenal sebagai penangkap radikal bebas (scavenger free radical), kemudian mencegah amplifikasi radikal. Antioksidan tersier contohnya adalah enzim metionin sulfoksida reduktase yang berperan dalam perbaikan biomolekul yang disebabkan oleh radikal bebas (Packer & Ong 1998).
dalam bekerja sebagai inhibitor (penghambat) reaksi oksidasi oleh radikal bebas reaktif yang menjadi salah satu penyebab penyakit-penyakit di atas (Packer & Ong 1998). Tubuh manusia dapat menghasilkan senyawa antioksidan secara alami, tetapi jumlahnya sering kali tidak cukup untuk menetralkan radikal bebas yang masuk ke dalam tubuh (Hernani & Rahardjo 2005). Antioksidan alami mampu melindungi tubuh terhadap kerusakan yang disebabkan oleh oksigen reaktif dan mampu menghambat terjadinya penyakit degeneratif serta mampu menghambat peroksida lipid pada makanan. Keseimbangan antara antioksidan dan radikal bebas menjadi kunci utama pencegahan stres oksidatif dan penyakit-penyakit kronis yang dihasilkan (Packer et al. 1995).
Stres oksidatif adalah keadaan ketidakseimbangan antara prooksidan dan antioksidan. Keadaan stres oksidatif dapat disebabkan oleh kurangnya antioksidan atau kelebihan produksi radikal bebas. Radikal bebas sebetulnya diproduksi secara fisiologis oleh sel sebagai konsekuensi logis pada reaksi biokimia dalam kehidupan aerobik. Namun, jika radikal bebas berlebihan dan antioksidan seluler tetap atau lebih sedikit, maka kelebihan radikal bebas ini tidak dapat dinetralkan dan akan berakibat pada kerusakan sel itu sendiri. Kondisi stres oksidatif yang berakibat pada kerusakan sel, dapat menyebabkan terjadinya percepatan proses penuaan, dan dapat menimbulkan penyakit jantung, kanker, dan diabetes melitus (Packer & Ong 1998).
Diabetes Melitus
Diabetes melitus merupakan penyakit yang dicirikan oleh adanya abnormalitas
penggunaan “bahan bakar” dalam tubuh
akibat glukosa terdapat dalam jumlah berlebihan namun tidak digunakan secara optimal oleh berbagai organ tubuh. Diabetes termasuk dalam kategori penyakit metabolisme yang paling serius, diamana jutaan masyarakat dunia telah menjadi korbannya. Jika telah berkembang penuh secara klinis, diabetes melitus akan ditandai oleh hiperglikemia (saat puasa), aterosklerosis, mikrongiopati, dan neuropati (Price & Wilson 1995). Diabetes melitus merupakan penyakit yang mampu memicu komplikasi munculnya penyakit lain dalam tubuh manusia. Gangguan metabolisme glukosa akibat diabetes akan mempengaruhi metabolisme karbohidrat, protein, lemak, dan
air, sehingga dapat menimbulkan kerusakan seluler pada beberapa jaringan tubuh. Diabetes kronis dapat menyebabkan disfungsi dan kerusakan berbagai organ, terutama mata, ginjal, saraf, jantung, dan pembuluh darah (ADA 2004).
Gejala umum yang timbul pada penderita diabetes mellitus diantaranya adalah sering haus dan sering buang air kecil sebagai efek mekanisme mempertahankan homeostatis tubuh. Penderita dibetes juga sering mengalami kesemutan, penglihatan yang terganggu, banyak makan tetapi berat badan cenderung turun, cepat merasa lelah, dan sering mengantuk (Purwakusumah 2003). Kadar gula darah normal adalah 100 mg/dL dan dapat mencapai 120 mg/dL setelah makan. Kadar gula darah penderita diabetes dapat melebihi 120 mg/dL pada saat 2 jam setelah makan (Soegondo 2004).
Diabetes dapat disebabkan oleh defisiensi insulin, kelebihan asupan glukosa dalam tubuh, kurangnya olahraga, kehamilan, obesitas, dan berbagai penyebab lainnya. Diabetes dapat disebabkan pula oleh faktor keturunan atau genetik karena penyakit ini termasuk penyakit yang terpaut kromosom seks. Selain itu, terdapat beberapa virus dan bakteri yang diduga dapat menyebabkan diabetes mellitus melalui mekanisme sitolitik
sel β pankreas. Beberapa bahan toksik yang mampu merusak sel β pankreas secara langsung diantaranya adalah alloxan, pyrinuron (rodentisida), dan streptozotocin (produk dari sejenis jamur).
Secara klinis, diabetes dapat dikategorikan menjadi tiga kelompok, yaitu diabetes tipe I, diabetes tipe II, dan Gestational Diabetes Melitus. Diabetes tipe I merupakan tipe diabetes yang disebabkan oleh defisiensi insulin dalam tubuh. Pada kondisi abnormal,
akan terjadi. Akibat paling jelas dari hal ini adalah meningkatnya kadar glukosa dalam darah, terutama setelah mengasup makanan kaya karbohidrat (Stryer et al. 2007). Diabetes tipe I ini biasanya diderita oleh anak-anak atau dewasa muda sehingga disebut pula sebagai
juvenile-onset diabetes. Diperlukan pengobatan insulin untuk penderita penyakit ini
Diabetes tipe II merupakan gangguan toleransi glukosa. Penyakit ini sering disebut sebagai penyakit non-insulin dependent diabetes melitus atau diabetes melitus tak tergantung insulin (DMTTI). Penyakit ini seringkali dihubungkan dengan obesitas dan kelebihan asupan karbohidrat dalam diet (Price & Wilson 1995). DMTTI merupakan tipe diabetes yang lebih umum terjadi. Penyakit ini umumnya menjangkiti orang-orang dewasa. Namun demikian, belakangan ini, jumlah penderita DMTTI dari kalangan remaja semakin meningkat. Pankreas pada penderita DMTTI masih mampu memproduksi insulin, walaupun jumlah insulin yang dihasilkan tidak mampu mempertahankan kadar normal gula darah. DMTTI yang akut dapat membawa penderitanya ke penyakit diabetes tipe I (Stryer et al. 2007). Selain itu, kondisi ini dapat pula disebabkan oleh gangguan akibat resistensi insulin yang menyebabkan jaringan tubuh menjadi kurang peka terhadap efek insulin. Faktor-faktor yang mempengaruhi timbulnya diabetes tipe II ini antara lain yaitu obesitas, usia lanjut, kurangnya aktivitas olahraga, dan lain-lain (ADA 2004).
Tipe lainnya dari diabetes adalah diabetes pada masa kehamilan atau sering juga disebut sebagai Gestational Diabetes Melitus (GDM). Seorang wanita hamil membutuhkan lebih banyak insulin untuk mempertahankan metabolisme karbohidrat, jika tidak maka kadar gula darah pada tubuh wanita yang sedang hamil dapat meningkat (Wijayakusuma 2004). Penyakit ini dapat menjangkiti sebagian ibu hamil, baik penderita diabetes maupun yang sehat (Price & Wilson 1995). Kondisi ini dapat membahayakan wanita yang sedang hamil dan bayi dalam kandungannya. Setelah proses kelahiran, kadar gula darah sang ibu dapat kembali normal, namun bayinya dapat menderita diabetes (ADA 2004).
Peningkatan gula darah pasca makan merupakan awal terganggunya metabolisme yang terjadi pada penderita diabetes. Kondisi ini mempercepat perkembangan penyakit diabetes mellitus yang disebekan toksisitas
glukosa dalam otot dan sel β pankreas, juga
menginisiasi perkembangaan awal komplikasi mikrovaskular dan makrovaskular. Salah satu cara terbaik untuk menurunkan kadar gula darah pasca makan adalah dengan memperlambat absorbsi glukosa melalui penghambatan kerja enzim yang dapat menghidrolisis karbohidrat seperti -glukosidase (Lee et al. 2007).
Metode DPPH
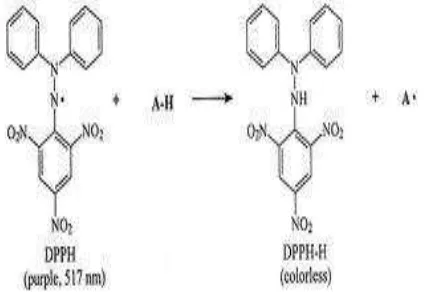
DPPH (difenil pikril hidrazil hidrat) menghasilkan radikal bebas aktif bila dilarutkan dalam alkohol. Radikal bebas tersebut stabil dengan absorpsi maksimum pada panjang gelombang 517 nm dan dapat direduksi oleh senyawa antioksidan (Praptiwi 2006).
Analisis kualitatif aktivasi antioksidan menggunakan 2,2-difenil-1-pikrilhidrazil (DPPH) sebagai uji dalam mencari kemampuan menangkap radikal suatu senyawa dalam ekstrak tumbuhan telah umum dilakukan. Metode ini lebih cepat, lebih sederhana, dan membutuhkan sampel dalam jumlah yang lebih sedikit dibandingkan dengan beberapa metode pengujian antioksidan lainnya seperti metode TBA (Mardisadora 2010).
Prinsip metode penangkapan radikal (Gambar 2) adalah pengukuran penangkapan radikal bebas sintetik DPPH dalam pelarut organik polar seperti etanol atau metanol pada suhu kamar oleh suatu senyawa yang mempunyai aktivitas antioksidan (Pokorni 2001). Metode DPPH dapat mengukur aktivitas donasi elektron komponen lain dalam campuran dan mengevaluasi aktivitas antioksidan karena adanya radikal bebas. Beberapa molekul dapat memberikan elektron atau hidrogen ketika beraksi DPPH, sehingga akan memudarkan warna DPPH, melalui
reaksi reduksi dengan perubahan warna ungu menjadi kekuningan oleh elektron dari senyawa antioksidan. Reaksi DPPH dengan gugus hiroksil menyebabkan substitusi homolik dari satu cincin fenil DPPH menghasilkan 2-(4-hidroksifenil)-2-fenil-1-pikrilhidrazin sebagai produk mayor yang juga dibentuk melalui proses sekunder. DPPH diketahui hanya dapat mengukur senyawa antioksidan yang terlarut dalam pelarut organik, khususnya alkohol. Walaupun metode DPPH secara luas digunakan untuk pengukuran dan perbandingan aktivitas antioksidan senyawa-senyawa fenolik, evaluasi aktivitas antioksidan dengan adanya perubahan serapan DPPH harus secara hati-hati dilakukan karena senyawa antioksidan yang akan beraksi dengan DPPH dapat didegradasi oleh cahaya, oksigen, pH, dan pelarut.
Inhibisi -Glukosidase
α-Glukosidase, dengan nama kimia -D-glikosida glukohidrolase, merupakan enzim yang berfungsi untuk memutus ikatan -1,4 glikosidik pada berbagai substrat dan menghasilkan -D-glukosa yang mampu diserap oleh usus (Gao et al. 2007). Enzim ini bekerja di dalam retikulum endoplasma kasar di sel-sel usus halus (Murray et al. 2009). Dengan adanya enzim ini, maka pati yang dikonsumsi oleh seseorang dapat diubah menjadi molekul-molekul glukosa yang dapat diubah menjadi energi melalui berbagai jalur metabolisme seperti glikolisis.
Enzim α-glukosidase bekerja pada saat proses penyerapan makanan dalam usus. Pada penderita diabetes, hal ini merupakan salah satu hal yang harus dicegah. Semakin banyak glukosa yang terbentuk dari pemecahan pati, maka akan semakin tinggi kadar glukosa dalam darah penderita diabetes. Oleh karena itu pengembangan obat diabetes saat ini lebih difokuskan pada inhibisi kerja enzim ini.
Namun demikian, defisiensi enzim α -glukosidase pada lisosom dapat mengakibatkan timbulnya penyakit Pompe. Pada penyakit ini, glikogen akan menumpuk pada lisosom dan dapat menyebabkan timbulnya gagal jantung (Murray et al. 2009). Inhibitor enzim -glukosidase adalah obat antihiperglikemia untuk pasien diabetes tipe 2, khususnya penderita postprandial hyperglycemia. Obat yang berperan sebagai inhibitor ini telah menjadi obat umum yang sering digunakan untuk penderita
hyperglycemia sejak tahun 1990an. Salah satu
obat sintetiknya adalah acarbose, maglitol, dan voglibose. Acarbose berperan sebagai inhibitor kompetitif. Obat ini dijual dalam bentuk tablet Glukobay. Jumlah acarbose
yang dapat terserap tubuh hanya sekitar 1-4%, sisanya dibuang melalui ginjal (Samson 2010). Kelemahan dari obat-obatan ini yaitu harus dimakan bersama makanan dan dapat menyebabkan pembentukan gas di perut. Selain itu, obat sintetik ini memiliki efek samping seperti kembung, diare, dan kram usus (Lee et al. 2007). Oleh karena itu banyak dikembangkan obat-obatan alami yang memiliki aktivitas antidiabetes menghambat -glukosidase dengan sedikit atau tanpa efek samping.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan yaitu kulit kayu suren, akuades, etanol 70%, enzim α -glukosidase, p-nitrofenil-α-D-glukopiranosida (p-NPG), larutan bufer fosfat pH 7, tablet
acarbose (glukobay), HCl 2 N, larutan DPPH 0.2mM, Na2CO3, H2SO4 2 M, pereaksi
Dragendorf, Mayer, dan Wagner, etanol 30%, etanol 70%, metanol, asam asetat anhidrat, H2SO4 pekat, FeCl3 1%, NaOH, eter, dan
metanol 30%.
Alat yang digunakan yaitu microplate,
microplate reader, lemari inkubasi, oven, neraca analitik, rotary evaporator, vortex, penangas, kertas saring, pipet mikro, pipet tetes, pipet Mohr, cawan porselin, labu Erlenmeyer, labu ukur, tabung reaksi, gelas piala, gelas ukur, bulb, batang pengaduk, dan sudip.
Metode Penelitian
Preparasi Sampel
Sampel kulit kayu diperoleh dari tanaman suren yang berasal dari daerah Sumedang, Indonesia. Kulit kayu tersebut dikeringkan dibawah sinar matahari secara langsung. Setelah kulit kayu tersebut benar-benar kering, kemudian dilakukan penggilingan dengan menggunakan mesin Wiley Mill hingga terbentuk serbuk berukuran 40 mesh.
Penentuan Kadar Air Kulit Kayu Suren (AOAC 1999 dalam Samson 2010)
105˚C selama 30 menit lalu didinginkan dalam desikator dan ditimbang. Sebanyak 2 g sampel serbuk kulit kayu suren dimasukkan dalam cawan dan dipanaskan pada suhu 105˚C selama 3 jam, kemudian didinginkan pada desikator dan ditimbang. Penentuan kadar air dilakukan sebanyak tiga kali ulangan.
Kadar air (%) = x 100%
Keterangan: A adalah bobot sampel (g) B adalah bobot bahan setelah dikeringkan (g)
Ekstraksi Kulit Kayu Suren (Toona
sinensis) (Ningappa 2008 dan Harjadi 1993)
Sebanyak 250 gram kulit kayu suren yang sudah berbentuk serbuk dimaserasi dengan cara direndam ke dalam 2500 mL etanol 70%. pada suhu kamar selama 24 jam untuk memperoleh ekstrak etanol 70%. Larutan tersebut diletakkan pada shaker orbital
dengan kecepatan 250 rpm. Hal ini bertujuan mempercepat proses ekstraksi. Ekstrak air diperoleh dengan merendam 120 gram serbuk kulit kayu suren di dalam 1200 mL akuades. Larutan ini dipanaskan pada suhu 100oC dan dilakukan pengadukan selama pemanasan 4 jam. Larutan hasil dipisahkan melalui penyaringan menggunakan kertas saring. Filtrat hasil penyaringan kemudian dipekatkan dengan menggunakan vacuum rotary evaporator pada suhu 40oC. Ekstrak yang diperoleh ditempatkan di dalam botol tertutup dan disimpan di dalam lemari es dengan suhu 4oC.
Analisis Fitokimia (Harbone 1987)
Uji Alkaloid. Ekstrak kulit kayu suren sebanyak 0.2 gram ditambahkan 2 mL kloroform dan 3 tetes NH4OH. Fraksi
kloroform dipisahkan dan diasamkan dengan ditambahkan 2 tetes H2SO4. Fraksi H2SO4
dimasukkan ke dalam 3 buah tabung reaksi, lalu ditambahkan pereaksi Dragendorf pada tabung pertama, pereaksi Meyer pada tabung kedua, dan pereaksi Wagner pada tabung ketiga. Terdapatnya alkaloid ditunjukkan dengan terbentuknya endapan putih oleh pereaksi Meyer, endapan merah oleh pereaksi Dragendorf, dan endapan coklat oleh pereaksi Wagner.
Uji Saponin. Ekstrak kulit kayu suren sebanyak 0.2 gram ditambahkan air sebanyak 3 mL dan dipanaskan selama 5 menit. Larutan tersebut didinginkan kemudian dikocok menggunakan vortex. Timbulnya busa sampai
selang waktu 10 menit menunjukkan adanya saponin.
Uji Flavonoid dan Senyawa Fenolik.
Ekstrak kulit kayu suren sebanyak 0.2 gram ditambah metanol 30% sampai terendam lalu dipanaskan selama 5 menit. Filtratnya ditambah NaOH 10% (b/v) atau H2SO4 pekat.
Terbentuknya warna merah karena penambahan NaOH menunjukkan adanya senyawa fenolik hidrokuinon sedangkan warna merah yang terbentuk akibat penambahan H2SO4 pekat menunjukkan
adanya senyawa flavonoid.
Uji Triterpenoid dan Steroid. Ekstrak kulit kayu suren sebanyak 0.2 gram ditambah 2 mL eter. Lapisan eter yang terbentuk dipipet lalu diuapkan dengan dipanaskan. Residu yang didapat kemudian ditambahkan dengan pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2SO4 pekat).
Warna merah atau ungu menunjukkan kandungan triterpenoid pada sampel sedangkan warna hijau menunjukkan adanya kandungan steroid.
Uji Tanin. Ekstrak kulit kayu suren
sebanyak 0.2 gram ditambahkan 2 mL akuades kemudian dididihkan selama 5 menit. Larutan ini disaring dan filtratnya ditambah 3 tetes FeCl3 1% (b/v). Warna biru tua atau
hitam kehijauan menunjukkan terdapatnya tanin.
Uji Aktivitas Antioksidan dengan Metode DPPH (Salazar et al. 2011)
Aktivitas antioksidan diuji dengan melarutkan 0.2 mg ekstrak dalam etanol agar konsentrasinya menjadi 1000 ppm dan divortex, kemudian konsentrasinya dibuat menjadi 50, 30, 10, dan 5 ppm. Larutan DPPH dibuat dengan melarutkan 5 mg DPPH dalam 2 mL etanol dan larutan disimpan dalam keadaan gelap. Larutan standar, blanko, dan sampel dimasukkan ke dalam sumur
diolah untuk menentukan IC50 (konsentrasi
yang menyebabkan inhibisi 50%).
Uji Inhibisi α-Glukosidase (Sancheti et al. 2009)
Pengujian aktivitas inhibisi α-Glukosidase dilakukan dengan microplate untuk uji α -glukosidase menggunakan sampel dengan konsentasi 12.5, 6.25, 3.125, dan 1.5625 ppm. Larutan standar, blanko, dan sampel dimasukkan ke dalam sumur microplate
sebanyak 50 L. Masing-masing sumur yang sudah berisi standar, blanko, sampel ditambahkan dengan 50 µL larutan bufer. Sebanyak 25 L enzim α-glukosidase dengan konsentrasi 1 mg/mL dalam bufer fosfat 0.01 M (pH 7.0) dimasukkan ke dalam sumur
microplate. Selanjutnya, substrat berupa campuran berisi bufer fosfat 0.1 M (pH 7.0) sebanyak 50 L dan 25 L 4-nitrophenyl α -D-glucopyranoside (p-NPG) 0.5 mM dalam 0.1 M bufer fosfat (pH 7.0) ditambahkan beberapa saat sebelum assay dimulai. Semua uji dilakukan sebanyak 3 kali ulangan. Inkubasi dilakukan pada suhu 37°C selama 30 menit. Reaksi enzim dihentikan dengan menambahkan 0.2 M Na2CO3 sebanyak 100
L. Hasil reaksi diukur dengan microplate reader pada panjang gelombang 400 nm. Selanjutnya dilakukan penghitungan % inhibisi untuk menentukan nilai IC50.
Analisis Data (Mattjik 2002)
Rancangan percobaan pada penelitian ini adalah rancangan acak lengkap (RAL) dengan tiga kali ulangan. Analisis data uji aktivitas antioksidan dengan metode DPPH menggunakan ANOVA dengan model rancang sebagai berikut:
Yij= µ + αi+ εij
Keterangan:
µ = pengaruh rataan umum
αi = pengaruh perlakuan ke-i, i = 1,2,3,4
εij = pengaruh galat perlakuan ke-i dan
ulangan ke-j, j = 1,2,3
i = 1 adalah ekstrak etanol/air kulit kayu suren 50 ppm
i = 2 adalah ekstrak etanol/air kulit kayu suren 30 ppm
i = 3 adalah ekstrak etanol/air kulit kayu suren 10 ppm
i = 4 adalah ekstrak etanol/air kulit kayu suren 5 ppm
Analisis data uji inhibisi α-glukosidase menggunakan ANOVA dengan model rancang sebagai berikut:
Yij= µ + αi+ εij
Keterangan:
µ = pengaruh rataan umum
αi = pengaruh perlakuan ke-i, i = 1,2,3,4
εij = pengaruh galat perlakuan ke-i dan
ulangan ke-j, j = 1,2,3
i = 1 adalah ekstrak etanol/air kulit kayu suren 12.5 ppm
i = 2 adalah ekstrak etanol/air kulit kayu suren 6.25 ppm
i = 3 adalah ekstrak etanol/air kulit kayu suren 3.125 ppm
i = 4 adalah ekstrak etanol/air kulit kayu suren 1.5625 ppm
HASIL DAN PEMBAHASAN
Kadar Air Kulit Kayu Suren
Kandungan air dalam sampel kulit kayu suren berukuran 40 mesh yang digunakan adalah sebesar 9.04%. Persen kadar air sampel tersebut menunjukkan bahwa kulit kayu suren yang digunakan dapat disimpan untuk jangka waktu panjang. Hal ini sesuai dengan Winarno (1992) yang menyatakan bahwa sampel yang baik untuk disimpan dalam jangka waktu panjang adalah sampel yang memiliki kadar air kurang dari 10% karena dapat terhindar dari pencemaran mikroorganisme dan jamur. Persen kadar air juga digunakan untuk mengetahui persen bahan kering dan sebagai faktor koreksi suatu sampel, jika sampel yang digunakan memiliki lingkungan agrobiofisik yang berbeda, sehingga dapat dipakai untuk memperkirakan jumlah bahan yang dibutuhkan jika ingin mengekstraksi bahan langsung dalam keadaan basah dan sebagai koreksi rendemen pada proses ekstraksi.
Menurut Harjadi (1993), penentuan kadar air dilakukan untuk mengetahui ketahanan suatu bahan dalam penyimpanan. Air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 100-105oC. Dalam penelitian ini, kandungan air pada sampel kulit kayu suren dihilangkan dengan cara pemanasan fisik menggunakan oven pada suhu 105oC.
Ekstraksi Kulit Kayu Suren
bahwa etanol 70% dapat mengekstrak lebih banyak metabolit sekunder yang terkandung di dalam kulit kayu suren dibandingkan ekstraksi menggunakan pelarut air. Hal ini dapat diperkuat dengan hasil analisis kandungan fitokimia dari masing-masing ekstrak.
Ekstraksi bertujuan untuk mengambil zat-zat yang terkandung dalam suatu campuran dengan bantuan pelarut tertentu. Sampel kulit kayu suren yang diekstrak berbentuk serbuk. Ini dapat meningkatkan efektifitas ekstraksi karena semakin kecil atau halus ukuran bahan yang digunakan maka semakin luas bidang kontak antara bahan dengan pelarutnya (Tuyet & Chuyen 2007).
Metode ekstraksi yang digunakan adalah maserasi dengan pelarut etanol 70% dan metode perebusan dengan pelarut air. Pemilihan metode maserasi dengan cara perendaman sampel dilakukan karena metode ini sederhana dan tidak menggunakan pemanasan sehingga dapat mencegah rusaknya senyawa metabolit sekunder yang tidak tahan terhadap suhu tinggi. Metode ektraksi lainnya yang digunakan yaitu metode perebusan yang didasarkan pada kebiasaan masyarakat yang sering mengkonsumsi bahan herbal dengan cara diseduh dengan air panas atau direbus. Metode ini murah dan praktis sehingga dapat dilakukan oleh masyarakat umum.
Ekstrak berupa cairan yang diperoleh setelah penyaringan kemudian dievaporasi untuk menguapkan sisa pelarut yang digunakan sehingga diperoleh ekstrak padatan berupa serbuk. Pemekatan dilakukan dengan menggunakan rotary evaporator pada suhu 40
o
C untuk mencegah kemungkinan terjadinya kerusakan komponen bahan aktif yang terkandung di dalam ekstrak. Hasil ekstrak ini kemudian dianalisis secara kualitatif untuk mengetahui kandungan fitokimianya.
Etanol dan air yang digunakan dalam ekstraksi termasuk golongan pelarut polar, namun derajat kepolaran air lebih besar dibandingkan etanol. Senyawa metabolit sekunder yang mudah larut dalam pelarut polar diantaranya adalah alkaloid dan flavonoid. Kedua metabolit ini menyebabkan suatu tanaman berpotensi sebagai antidiabetes
melalui penghambatan kerja enzim -glukosidase (Sari 2010).
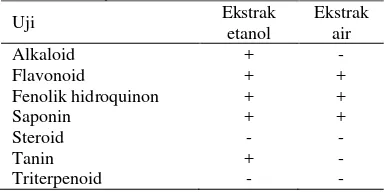
Uji Fitokimia
Berdasarkan hasil uji fitokimia ekstrak etanol dan air kulit kayu suren (Tabel 2), ekstrak etanol 70% kulit kayu suren menunjukkan adanya kandungan alkaloid, flavonoid, fenolik, saponin, dan tanin. Sementara hasil uji fitokimia terhadap ekstrak air kulit kayu suren menunjukkan kandungan flavonoid, fenolik, dan saponin. Senyawa-senyawa tersebut diduga memiliki aktivitas antioksidan dan penghambatan -glukosidase yang penting untuk pengobatan penyakit diabetes.
Winarti & Nurdjanah (2005) menyatakan bahwa beberapa senyawa fitokimia seperti karotenoid, fitosterol, saponin, glikosinolat, polifenol, inhibitor protease, monoterpen, fitoestrogen, sulfida, dan asam fitat memiliki fungsi fisiologis dan bersifat antioksidan aktif. Senyawa saponin yang terkandung di dalam ekstrak etanol 70% dan ekstrak air kulit kayu suren diharapkan memiliki aktivitas antioksidan.
Senyawa fitokimia yang diketahui memiliki peran sebagai antidiabetes diantaranya flavonoid, alkaloid, dan terpene (Zhao et al.
2009). Berdasarkan hasil uji, senyawa fitokimia yang diduga memiliki aktivitas antidiabetes di dalam ekstrak etanol 70% adalah flavonoid dan alkaloid, sedangkan pada ekstrak air adalah flavonoid.
Senyawa fitokimia yang terkandung dalam tanaman merupakan senyawa kimia yang memiliki peranan sangat penting bagi kesehatan dan pencegahan terhadap beberapa penyakit degeneratif. Analisis senyawa fitokimia merupakan uji pendahuluan yang bersifat kualitatif yang bertujuan untuk mengetahui kandungan metabolit sekunder yang terdapat di dalam sampel yang diduga mengandung bahan bioaktif. Metabolit sekunder yang biasanya terdapat di dalam tanaman antara lain alkaloid, flavonoid, tanin, polifenol, saponin, terpenoid, dan lain-lain.
Tabel 2 Hasil uji fitokimia ekstrak kulit kayu suren
Uji Ekstrak
etanol
Ekstrak air
Alkaloid + -
Flavonoid + +
Fenolik hidroquinon + +
Saponin + +
Steroid - -
Tanin + -
Triterpenoid - -
Tabel 1 Hasil ekstraksi kulit kayu suren
Pelarut Berat sampel (g) Berat ekstrak (g) Rendemen (%) Etanol 70%
250 12.0123 4.8
Perbedaan kandungan fitokimia pada jenis tanaman yang sama sering kali dapat terjadi karena beberapa faktor, yaitu jenis pelarut yang digunakan saat ekstraksi, variasi genetik, umur tanaman, serta lingkungan atau kondisi geografis tempat tanaman tersebut tumbuh (Kardono 2003).
Daya Hambat Ekstrak Terhadap Radikal Bebas DPPH
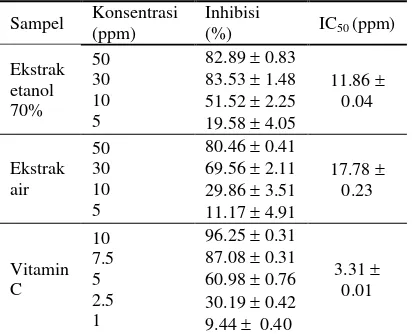
Pengujian daya hambat ekstrak terhadap radikal bebas DPPH ini menggunakan konsentrasi ekstrak masing-masing 50, 30, 10, dan 5 ppm untuk memperoleh nilai IC50.
Sedangkan konsentrasi vitamin C yang diujikan sebagai pembanding adalah 10, 7.5, 5, 2.5, dan 1 ppm. Hasil absorbansi sampel digunakan untuk memperoleh nilai persen inhibisinya (Tabel 3). Berdasarkan hasil pengukuran tersebut kemudian dibuat grafik yang menggambarkan hubungan antara konsentrasi dan persen inhibisi sampel, sehingga dari persamaan garis kurva dapat ditentukan nilai IC50 masing-masing sampel.
Berdasarkan nilai inhibisi yang terjadi terlihat bahwa makin tinggi konsentrasi ekstrak dan standar yang diujikan, nilai inhibisi juga semakin tinggi. Hal tersebut menunjukkan bahwa perubahan konsentrasi memberikan pengaruh terhadap radikal bebas DPPH.
Besarnya aktivitas antioksidan ditandai dengan nilai IC50, yaitu konsentrasi larutan
sampel yang dibutuhkan untuk menghambat 50 % radikal bebas DPPH. Nilai IC50
diperoleh dengan menggunakan persamaan regresi logaritmik yang menyatakan hubungan antara konsentrasi sampel (senyawa uji) dengan aktivitas penangkap radikal. Semakin kecil nilai IC50 maka senyawa uji tersebut
mempunyai keefektifan sebagai penangkap radikal yang lebih baik.
Hasil yang diperoleh menunjukkan ekstrak etanol 70% dari kulit kayu suren memiliki nilai IC50 sebesar 11.86 ppm dan pada ekstrak
air nilai IC50nya sebesar 17.78 ppm.
Sementara vitamin C yang digunakan sebagai senyawa pembanding memiliki nilai IC50 3.31
ppm. Jika dibandingkan, daya penangkap radikal (sebagai IC50) vitamin C 3.58 kali
lebih kecil daripada ekstrak etanol 70% dan 5.37 kali lebih kecil dibandingkan dengan ekstrak air kulit kayu suren. Hal ini menunjukkan bahwa ekstrak dan vitamin C mempunyai aktivitas antioksidan yang kuat karena mempunyai IC 50 kurang dari 200 µg/ml (Blouis 1958).
Nilai IC50 ekstrak etanol 70% lebih besar
daripada ekstrak air, hal ini dapat terjadi karena perbedaan kandungan senyawa fitokimia yang terdapat di dalam masing-masing ekstrak. Menurut Wang (2007), senyawa golongan flavonoid berperan sebagai antioksidan utama pada tanaman suren. Berdasarkan hasil uji fitokimia, ekstrak etanol 70% mengandung senyawa golongan flavonoid, alkaloid, hidroquinon, saponin dan tanin yang umum diketahui memiliki aktivitas antioksidan yang tinggi. Sementara pada ekstrak air, memiliki kandungan fitokimia yang sama dengan ekstrak etanol 70%, kecuali alkaloid dan tanin. Dengan demikian, perbedaan kandungan tersebut menyebabkan aktivitas antioksidan ekstrak air lebih rendah dibandingkan ekstrak etanol.
Nilai IC50 vitamin C lebih kecil dibanding
dengan nilai IC50 ekstrak etanol 70% dan
ekstrak air kulit kayu suren karena merupakan senyawa yang murni dibandingkan dengan kedua fraksi yang masih dalam bentuk campuran dari beberapa senyawa. Di samping itu, molekul vitamin C memiliki 2 situs penangkapan elektron, sehingga dapat menangkap radikal lain setelah yang pertama, hal ini menyebabkan perbandingan stoikiometrinya 2:1, artinya 2 molekul DPPH ditangkap atau direduksi oleh 1 molekul vitamin C. Vitamin C mudah mengalami oksidasi oleh radikal bebas karena mempunyai ikatan rangkap dan dengan adanya 2 gugus-OH yang terikat pada ikatan rangkap tersebut, radikal bebas akan mencabut atom hidogen dan menyebabkan muatan negatif pada atom oksigen yang selanjutnya akan didelokalisasi melalui resonansi, sehingga menghasilkan radikal bebas yang stabil dan tidak membahayakan (Cholisoh 2008). Vitamin C Tabel 3 Aktivitas antioksidan ekstrak kulit kayu
suren dan vitamin C
Sampel Konsentrasi (ppm)
Inhibisi
(%) IC50 (ppm)
Ekstrak etanol 70% 50 30 10 5
82.89 0.83 83.53 1.48 51.52 2.25 19.58 4.05
11.86 0.04 Ekstrak air 50 30 10 5
80.46 0.41 69.56 2.11 29.86 3.51 11.17 4.91
17.78 0.23 Vitamin C 10 7.5 5 2.5 1
96.25 0.31 87.08 0.31 60.98 0.76 30.19 0.42 9.44 0.40
digunakan sebagai pembanding positif karena vitamin C berfungsi sebagai antioksidan sekunder, dengan cara kerja yang sama dengan vitamin E, yaitu menangkap radikal bebas dan mencegah terjadinya reaksi berantai (Dalimartha & Soedibyo 1998).
Hasil analisis data statistik menggunakan ANOVA (=0.05) menunjukkan bahwa ekstrak etanol 70% dan ekstrak air kulit kayu suren pada berbagai konsentrasi yang diujikan memberikan pengaruh terhadap aktivitas radikal bebas DPPH. Besarnya daya hambat terhadap DPPH antara ekstrak etanol 70% pada konsentrasi 50 dan 30 ppm serta ekstrak air pada konsentrasi 50 ppm secara signifikan tidak berbeda nyata, namun menunjukkan hasil yang berbeda nyata bila dibandingkan dengan ekstrak pada konsentrasi lainnya. Hal ini dapat dilihat pada Tabel 4. Perubahan aktivitas antioksidan ekstrak dan vitamin C dalam nilai IC50 ditunjukkan pada Tabel 5.
Secara statistik, terdapat perbedaan yang nyata antara nilai IC50 ketiga kelompok
perlakuan tersebut pada taraf nyata 5%. Prinsip metode penangkapan radikal dalam penelitian ini yaitu pengukuran penangkapan radikal dalam pelarut organik polar. Pelarut yang dipakai dalam metode ini adalah etanol. Proses penangkapan radikal ini melalui mekanisme pengambilan atom hidrogen dari senyawa antioksidan oleh radikal bebas (Stanley 1988) sehingga radikal bebas menangkap satu elektron dari antioksidan.
Radikal bebas sintetik yang digunakan adalah DPPH. Senyawa DPPH bereaksi dengan senyawa antioksidan melalui pengambilan atom hidrogen dari senyawa antioksidan untuk mendapatkan pasangan elektron (Pokorni 2001). Panjang gelombang
maksimum ( maks) DPPH yang digunakan
untuk pengukuran aktivitas antioksidan dalam
penelitian ini yaitu 517 nm. Senyawa yang bereaksi sebagai penangkap radikal akan mereduksi DPPH yang dapat diamati dengan adanya perubahan warna DPPH dari ungu menjadi kuning ketika elektron ganjil dari radikal DPPH telah berpasangan dengan hidrogen dari senyawa penangkap radikal bebas yang akan membentuk DPPH-H tereduksi (Molyneux 2004). Terjadinya reaksi tersebut menyebabkan radikal bebas DPPH akan membentuk senyawa bukan radikal yaitu DPP Hidrazin yang stabil (Windono 2001). Apabila ekstrak yang di uji memiliki aktivitas antioksidan yang makin tinggi, maka warna larutan akan berubah dari ungu menjadi makin kuning.
Efek antioksidan terutama disebabkan karena adanya senyawa fenol seperti flavonoid dan asam fenolat. Biasanya senyawa-senyawa yang memiliki aktivitas antioksidan adalah senyawa fenol yang mempunyai gugus hidroksi yang tersubstitusi pada posisi ortho dan para terhadap gugus -OH dan –OR (Andayani et al. 2008).
Daya Inhibisi Ekstrak Terhadap Enzim
-Glukosidase
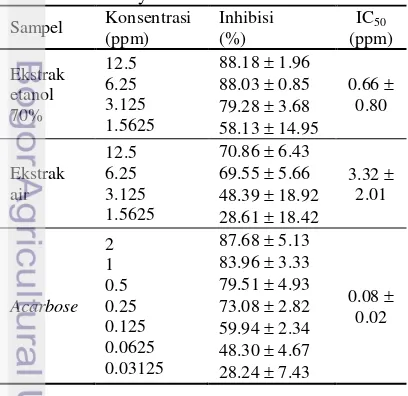
Kemampuan ekstrak sebagai inhibitor -glukosidase diukur dengan menggunakan 4 konsentrasi berbeda dan menghasilkan data % inhibisi yang sebanding dengan konsentrasi yang diujikan (Tabel 6). Acarbose digunakan sebagai pembanding daya inhibisi ekstrak. Berdasarkan hasil tersebut diperoleh grafik yang menggambarkan hubungan antara konsentrasi dan persen inhibisi ekstrak kulit kayu suren. Persamaan garis grafik tersebut dipakai untuk menentukan nilai IC50
masing-masing. Nilai persen inhibisi yang terjadi menunjukkan bahwa makin tinggi konsentrasi ekstrak dan standar yang diujikan, nilai inhibisi juga semakin tinggi. Hal ini berarti perubahan konsentrasi memberikan pengaruh terhadap reaksi antara enzim -glukosidase dengan substrat.
Tabel 4 Perubahan aktivitas antioksidan ekstrak etanol 70% dan ekstrak air pada konsentrasi uji
Perlakuan Inhibisi (%)
Ekstrak etanol 70% 50 ppm 82.89a Ekstrak etanol 70% 30 ppm 83.53a Ekstrak etanol 70% 10 ppm 51.52c Ekstrak etanol 70% 5 ppm 19.58e
Ekstrak air 50 ppm 80.46a
Ekstrak air 30 ppm 69.56b
Ekstrak air 10 ppm 29.86d
Ekstrak air 5 ppm 11.17f
Keterangan : Huruf yang berbeda pada kolom yang sama menunjukkan nilai berbeda nyata pada P<0.05.
Tabel 5 Perubahan aktivitas antioksidan ekstrak etanol 70%, ekstrak air, dan vitamin C dalam nilai IC50 Perlakuan Nilai IC50 (ppm) Ekstrak etanol 70% 11.86b
Ekstrak air 17.78a
Vitamin C 3.31c
Hasil uji menunjukkan bahwa aktivitas penghambatan kerja enzim -glukosidase ekstrak etanol 70% kulit kayu suren memiliki nilai IC50 sebesar 0.66 ppm dan IC50 untuk
ekstrak air sebesar 3.32 ppm. Daya inhibisi
acarbose sebagai kontrol positif memiliki nilai IC50 sebesar 0.08 ppm. Ini berarti nilai
IC50 acarbose 8.25 kali lebih kecil daripada
ekstrak etanol 70% kulit kayu suren dan 41.5 kali lebih kecil dibandingkan ekstrak air kulit kayu suren. Efektivitas acarbose yang ditinjukkan oleh nilai IC50 tersebut
menyebabkan acarbose digunakan sebagai obat diabetes. Namun, penggunaan obat sintetik ini menyebabkan efek samping seperti kembung, diare, dan kram usus (Hartika 2009).
Analisis data statistik menggunakan ANOVA (=0.05) memberikan hasil yang menunjukkan bahwa ekstrak etanol 70% dan ekstrak air kulit kayu suren pada berbagai konsentrasi yang diujikan memberikan pengaruh terhadap aktivitas enzim -glukosidase. Besarnya daya hambat terhadap kerja -glukosidase (Tabel 7) antara ekstrak etanol 70% pada konsentrasi 12.5, 6.25, dan 3.125 ppm tidak memberikan hasil yang berbeda nyata secara signifikan. Sedangkan ekstrak air pada konsentrasi 12.5 ppm dan 6.25 ppm juga tidak menunjukkan hasil yang berbeda nyata. Hasil yang berbeda nyata ditunjukkan oleh ekstrak etanol 70% pada konsentrasi 1.5625 ppm, ekstrak air pada konsentasi 3.125 ppm, dan ekstrak air pada konsentrasi 1.5625 ppm. Data pada Tabel 8 menunjukkan perubahan aktivitas inhibisi -glukosidase ekstrak dan acarbose dalam nilai IC50. Secara statistik pada taraf nyata 5%,
tidak terdapat perbedaan yang nyata antara nilai IC50 kelompok perlakuan ekstrak etanol
70% dengan acarbose. Perbedaan yang nyata terdapat pada nilai IC50 dari ekstrak air.
Enzim -glukosidase merupakan enzim yang berperan dalam pembentukan glukosa di usus halus manusia melalui pemecahan karbohidrat. Enzim ini bekerja optimum pada suasana basa (pH 7). Penghambatan terhadap kerja enzim ini dapat dilakukan untuk mencegah peningkatan secara drastis kadar glukosa di dalam tubuh penderita diabetes tipe 2 melalui penundaan proses pemecahan karbohidrat sehingga dapat menunda penyerapan glukosa oleh usus ke dalam darah (Sari 2010). Enzim -glukosidase terdapat pada lapisan luar usus halus manusia dan mamalia lainnya. Beberapa jenis organisme tingkat rendah seperti Bakesrs yeast dan
Bacillus stearothermophilus juga menghasilkan enzim -glukosidase ekstraseluler. Enzim -glukosidase adalah enzim kunci dalam pemecahan karbohidrat menjadi glukosa pada manusia (Pratama 2009).
Pengujian aktivitas inhibisi pada penelitian ini dilakukan secara in vitro melalui reaksi enzimatis yang terjadi yaitu hidrolisis oleh enzim -glukosidase terhadap substrat p-NPG menjadi glukosa dan p-nitrofenol yang berwarna kuning. Daya inhibisi terhadap aktivitas enzim diukur berdasarkan terbentuknya produk p-nitrofenol yang dihasilkan. Jumlah glukosa yang terbentuk sebanding dengan jumlah p-nitrofenol sehingga p-nitrofenol yang berwarna dijadikan sebagai indikator pengukuran aktivitas enzim -glukosidase. Intensitas warna kuning yang dihasilkan oleh p-nitrofenol menjadi indikator kemampuan suatu senyawa inhibitor untuk menghambat Tabel 6 Aktivitas inhibisi -glukosidase ekstrak
kulit kayu suren dan acarbose
Sampel Konsentrasi (ppm) Inhibisi (%) IC50 (ppm) Ekstrak etanol 70% 12.5 6.25 3.125 1.5625
88.18 1.96 88.03 0.85 79.28 3.68 58.13 14.95
0.66 0.80 Ekstrak air 12.5 6.25 3.125 1.5625
70.86 6.43 69.55 5.66 48.39 18.92 28.61 18.42
3.32 2.01 Acarbose 2 1 0.5 0.25 0.125 0.0625 0.03125
87.68 5.13 83.96 3.33 79.51 4.93 73.08 2.82 59.94 2.34 48.30 4.67 28.24 7.43
0.08 0.02
Tabel 7 Perubahan aktivitas inhibisi - glukosidase ekstrak etanol 70% dan ekstrak air pada konsentrasi uji
Perlakuan Inhibisi (%)
Ekstrak etanol 70% 12.5 ppm 88.18a Ekstrak etanol 70% 6.25 ppm 88.03a Ekstrak etanol 70% 3.125 ppm 79.28a Ekstrak etanol 70% 1.5625 ppm 58.13bc
Ekstrak air 12.5 ppm 70.86ba
Ekstrak air 6.25 ppm 69.55ba
Ekstrak air 3.125 ppm 48.39c
Ekstrak air 1.5625 ppm 28.61d
reaksi enzimatis yang terjadi. Aktivitas tersebut diukur berdasarkan absorbansi p-nitrofenol pada panjang gelombang 400 nm. Semakin besar aktivitas inhibisi dari suatu sampel, maka jumlah p-nitrofenol yang terbentuk semakin sedikit, sehingga intensitas warna kuning yang terbentuk semakin berkurang. Hal tersebut ditunjukkan dengan nilai absorbansi yang kecil ketika pengukuran. Apabila ekstrak yang di uji memiliki kemampuan menghambat kerja enzim maka p-nitrofenol yang dihasilkan akan berkurang sehingga warna larutan yang dihasilkan setelah inkubasi lebih cerah dibandingkan warna larutan tanpa inhibitor (Sugiwati 2005). Menurut Zhao et al. (2009), senyawa fitokimia yang mampu menghambat aktivitas enzim -glukosidase antara lain flavonoid, alkaloid, terpene, dan quinon. Berdasarkan hasil uji fitokimia, ekstrak etanol 70% mengandung senyawa golongan alkaloid sedangkan ekstrak air tidak. Dengan demikian, perbedaan kandungan tersebut menyebabkan aktivitas inhibisi -glukosidase ekstrak etanol 70% lebih tinggi dibandingkan ekstrak air.
Berdasarkan Kardono (2003), besarnya daya hambat terhadap kerja -glukosidase yang ditunjukkan oleh beberapa tanaman obat berbeda satu dengan yang lainnya. Perbedaan tersebut disebabkan adanya perbedaan senyawa metabolit sekunder yang terdapat di dalam suatu tanaman obat, adanya senyawa pengganggu, perbedaan metode ekstraksi, dan perbedaan jenis pelarut yang digunakan.
SIMPULAN DAN SARAN
Simpulan
Analisis kandungan fitokimia serta uji aktivitas antioksidan dan antidiabetes terhadap ekstrak kulit kayu suren telah berhasil dilakukan. Hasil uji fitokimia menunjukkan adanya kandungan senyawa alkaloid, saponin, tanin, flavonoid, dan hidroquinon pada ekstrak etanol 70%. Ekstrak air kulit kayu suren menunjukkan adanya senyawa saponin, flavonoid, dan hidroquinon. Hasil analisis secara in vitro untuk aktivitas antioksidan menunjukkan bahwa ekstrak etanol 70% memiliki nilai IC50 sebesar 1,5 kali lebih kecil
dibandingkan ekstrak air. Sementara itu, nilai IC50 ekstrak etanol 70% untuk aktivitas
antidiabetes 5 kali lebih kecil dibandingkan dengan ekstrak air. Hal tersebut menunjukkan kandungan senyawa fitokimia dalam ekstrak
etanol 70% dan ekstrak air kulit kayu suren memiliki kemampuan antioksidan dan antidiabetes melalui penghambatan kerja enzim -glukosidase.
Saran
Pengembangan alternatif obat herbal kaya antioksidan dan memiliki kemampuan antidiabetes dengan menggunakan kulit kayu suren perlu dilakukan. Uji lanjutan aktivitas antidiabetes melalui penghambatan enzim -amilase dan uji secara in vivo juga penting untuk dilakukan. Selain itu, diperlukan penelitian serupa terkait kulit kayu suren dengan cara penambahan jenis ekstrak dengan pelarut yang lebih berbeda kepolarannya maupun dengan menggunakan ekstrak tunggal senyawa bioaktif yang terkandung di dalamnya yang telah diketahui memiliki peran penting sebagai antioksidan dan antidiabetes.
DAFTAR PUSTAKA
ADA (American Diabetes Association). 2004. Diagnosis and classification of diabetes mellitus. Diabetes Care 27: s5-s10.
Andayani R, Lisawati Y, Maimunah. 2008. Penentuan aktivitas antioksidan, kadar fenolat total dan likopen pada buah tomat (Solanum lycopersicum L). Jurnal Sains dan Teknologi Farmasi 13: 1-9.
Blouis MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature
181: 1199-1200.
Chen H, Yan X, Lin W, Zheng L, Zhang W. 2004. A new method for screening a-glucosidase inhibitors and application to marine microorganism. Pharmaceutical Biology 42: 416-421.
Cheng Ka-Wing et al. 2009. Analysis of antioxidant activity and antioxidant constituents of Chinese toon. Journal of Functional Foods 1: 253-259.
Chiasson J et al. 2002. Acarbose for prevention of type 2 diabetes mellitus: the stop NIDDM randomized. Medical Progress 359: 2072-2077.
(archidendron jiringa) extract.
Pharmacon 9: 33-40.
[Depkes]. Departemen Kesehatan. 2005. Jumlah penderita diabetes Indonesia ranking-4 di dunia. [terhubung berkala]. http://www.depkes.go.id/index.php.html. [27 Desember 2010].
Dalimartha S, Soedibyo M. 1998. Awet Muda. Dengan Tumbuhan Obat dan Diet Suplemen. Jakarta: Agriwidya.
Dinna S. 2005. Antioksidan adan Radikal Bebas. Majalah ACID FMIPA Universitas Lampung Edisis III/Tahun V/Mei 2005. ISSN: 1410-1858. Lampung.
Djam’an DF. 2002. Toona sinensis (Blume)
Merr. Bogor: Indonesian Forest Seed Project.
Dwiyani R. 2008. Identifikasi golongan senyawa antioksidan pada daun Pepohonan (Pileatrinevea) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Fesenden, Fesenden. 1982. Kimia Organik Jilid 2. Jakarta: Erlangga.
Fesenden, Fesenden. 1982. Radikal bebas dan antioksidan alami tumbuh-tumbuhan.
Jurnal Kesehatan No. 28(1): 221-245.
Floris et al. 2005. A-glucosidase inhibitors for patiens with type 2 diabetes. Diabetes Care 28: 154-163.
Ganesya N. 2010. Aktivitas fraksi kloroform buah makasar (Brucea javanica [L.] Merr.) sebagai inhibitor enzim α -glukosidase. [skripsi]. Bogor: FMIPA Institut Pertanian Bogor.
Gao H, Huang Y, Gao B, Kawabata J. 2008. Chebulagic acid is a potent a-glucosidase inhibitor. Biosci Biotechnol Biochem 72: 601-603.
Garret RH, Grisham CM. 2002. Biochemistry and Molecular Biology Education. New Orleans: Wiiley Intersci.
Gaspersz V. 1994. Metode Percancangan Percobaan untuk Ilmu-Ilmu Pertanian, Ilmu-Ilmu Teknik, dan Ilmu Biologi. Bandung Armico.
Harborne JB. 1996. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata k dan Soediru I, penerjemah. Bandung: ITB Pr. Terjemahan dari: Phytochemical Methods.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama.
Hartika R. 200λ. Aktivitas inhibisi α -glukosidase ekstrak senyawa golongan flavonoid buah mahkota dewa. [skripsi]. Bogor: FMIPA Institut Pertanian Bogor.
Heath HB, Reineocius G. 1986. Flavor Chemistry and Technology. Westport: The AVI Publishing.
Hernani, Raharjo M. 2005. Tanaman Berkhasiat Antioksidan. Jakarta: Penebar Swadya.
Hseu You Cheng et al. 2008. Antioxidant activities of Toona Sinensis leaves extracts using different antioxidant models. Food and Chemical Toxicology 46: 105-114.
Indraswari A. 2008. Optimasi pembuatan ekstrak daun dewandaru (Eugenia uniflora L.) menggunakan metode maserassi dengan parameter kadar total senyawa fenolik dan flavonoid. [skripsi]. Surakarta: Fakultas Farmasi Universitas Muhamadiyah Surakarta.
Jiang Shen Hua et al. 2007. Antioxidant properties of the extract and subfractions from old leaves of Toona sinensis roem (Meliaceae). Food Biochemistry33: 425-441.
Kikuzaki H, Nakatani N. 1993. Antioxidant Effect of Some Ginger Constituents. J Food Sci 58: 1407-1410.
Koolman J, Rohm KH. 2001. Atlas Berwarna dan Teks Biokimia. Wanadi SI, penerjemah. Jakarta: Hipokrates. Terjemahan dari: Color Atlas of Biochemistry.
Lee et al. 2007. Inhibitory activity of
Euonymus alatus against -glucosidase in vitro and in vivo. J nutr Re Pract 1: 184-188.
Lee SH et al. 2008. A-glucosidase and a-amylase inhibitory activity of phlorotannin derivatives of Ecklonia cava. J Biotechnol 22: 5588.
Mardisadora O. 2010. Identifikasi dan potensi antioksidan flavonoid kulit kayu mahoni (Swietenia macrophylla KING). [skripsi]. Bogor: FMIPA Institut Pertanian Bogor.
Markham KR. 1988. Cara Mengidentifikasikan Flavonoid.
Padmawinata K, penerjemah; Niksolihin s, editor. Bandung: ITB Pr. Terjemahan dari: Techniques of Flavonoid Idenctification.
Mathur R, Shiel WC. 2003. Diabetes Mellitus. [terhubung berkala]. http://www.medicine.com/diabetesmellit us/article.html. [7 Juni 2011].
Matsumoto K et al. 2002. A novel method for the assay of -glucosidase inhibitory activity using a multi-channel oxygen sensor. J Anal Sci 18: 1351-1319.
Mattjik AA. 2002. Rancangan Percobaan. Bogor: IPB Press.
Miller Al. 1996. Antioxidant flavonoids: structure, function, and clinical usage.
Alt Med Rev 1: 103-111.
Mohamad H et al. 2004. DPPH free radical scavenger components from the fruits of
Alpinia rafflesiana (Zingiberaceae). Z Naturforsch 59: 811-815.
Molyneux P. 2004. Use of DPPH to est