KAJIAN KOMBINASI PENAMBAHAN
Spirulina platensis
PADA PAKAN DAN PENYUNTIKAN OODEV TERHADAP
KINERJA REPRODUKSI IKAN NILA
FIRSTY RAHMATIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Kombinasi Penambahan Spirulina platensis pada Pakan dan Penyuntikan Oodev Terhadap Kinerja Reproduksi Ikan Nila adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
RINGKASAN
FIRSTY RAHMATIA. Kajian Kombinasi Penambahan Spirulina platensis pada Pakan dan Penyuntikan Oodev Terhadap Kinerja Reproduksi Ikan Nila. Dibimbing oleh NUR BAMBANG PRIYO UTOMO dan AGUS OMAN SUDRAJAT.
Pembenihan merupakan bagian penting dari kegiatan budidaya ikan. Secara alami waktu pemijahan ikan bergantung pada signal lingkungan. Apabila lingkungan sudah memberikan signal maka sistem reproduksi akan bekerja. Signal lingkungan dapat dimanipulasi salah satunya dengan penyuntikan hormon seperti PMSG. Kelancaran proses reproduksi juga bergantung pada status nutrisi tubuh, karena materi yang bekerja berasal dari pakan yang dikonsumsi. Oleh karena itu, pemberian pakan bernutrien optimal diperlukan agar mampu mendukung kebutuhan pertumbuhan gonad pada induk ikan. Bahan pakan merupakan faktor penentu nutrien yang terkandung dalam pakan. Pakan dapat ditambahkan dengan suatu bahan yang mangandung kandungan nutrien tertentu yang mampu mendukung aktivitas reproduksi, salah satu bahan yang memiliki sifat tersebut adalahSpirulina.
Penelitian ini dilakukan untuk mengevaluasi dan menganalisa kombinasi penggunaan Spirulina platensis sebagai bahan tambahan pada pakan dan penyuntikan Oodev yang mengandung hormon PMSG + antidopamin terhadap kinerja reproduksi ikan nila. Ikan ini dijadikan model mewakili ikan-ikan yang pemijahannya bersifat parsial. S. platensis mengandung banyak nutrien penting yang berguna dalam proses reproduksi, seperti asam lemak esensial dan protein yang cukup tinggi. Sedangkan Oodev terdiri atas PMSG yang banyak mengandung Folicle Stimulating Hormone (FSH) berperan penting pada proses pematangan gonad awal atau vitelogenesis.
Pada penelitian ini, dosis S. Platensis yang ditambahkan pada pakan terdiri atas empat taraf; yaitu 0%, 1%, 2%, and 3%. Sementara itu dosis Oodev yang disuntikkan pada ikan terdiri atas dua taraf; yaitu 0 IU/kg 10 IU/kg. Dengan demikian, total perlakuan yang diujikan pada penelitian adalah delapan perlakuan. Parameter yang diamati terdiri atas parameter produksi seperti diameter telur, fekunditas telur, derajat tetas telur, dan sintasan larva. Parameter lain yang diamati adalah frekwensi pemijahan, analisa kimia telur, serta analisa kimia larva.
Berdasarkan hasil yang diperoleh, penambahan S. platensis pada pakan dan penyuntikan Oodev mampu meningkatkan kinerja reproduksi ikan Nila dan jumlah serta frekwensi pemijahan. Perlakuan yang memberikan hasil terbaik adalah kombinasi penambahanS. platensisdosis 2% pada pakan dan penyuntikan Oodev 10 IU/kg. Hasil yang diperoleh adalah diameter telur rata-rata 2.93 mm, fekunditas rata-rata 1114 butir telur/200 g bobot induk, derajat tetas telur rata-rata 99.6%, dan sintasan larva rata-rata 93.5%. Adapun hasil parameter kimia menunjukkan bahwa protein telur pada perlakuan ini adalah 62.49% dan protein larva adalah 65.5%.
SUMMARY
FIRSTY RAHMATIA. Combination Study of Spirulina platensis Added in Feed and Oodev Injection on Tilapia Reproduction Performance. Supervised by NUR BAMBANG PRIYO UTOMO and AGUS OMAN SUDRAJAT.
Hatchery is one of important parts in aquaculture. This activity hopefully will go on continuously whole year in order to fulfill the seed required with good quantity and quality. Naturally, fish spawning time depends on environment signal. If environment have given the signal, the phisiological body system will work very well. The environment signal can be manipulated by hormone injection such as PMSG. Spawning fluency also depends on body nutrition status, because the material proceed from consumed feed. Therefore, fed by optimum nutrient is needed to improve gonad development. The raw material is determinant of consisted nutrient in. Feed can be added with any material which have ability to sustain reproduction activity, such asSpirulina.
This study was held to evaluate and analyze combination between S. Platensis added in feed and Oodev (containing PMSG+antidopamin) injection on tilapia reproduction performance. Tilapia as object of this study represented unsyncronize fish. S. platensis consist of many importance nutrients for reproduction, such as high essential fatty acid and high protein. Oodev consist of PMSG containing Folicle Stimulating Hormone (FSH) that has important role in early maturation or vitellogenesis.
The doses of S. Platensis added were 0%, 1%, 2%, and 3%. The doses of Oodev injected were 0 IU/kg and 10 IU/kg. Thereby, total treatments were eight combinations. The parameters that observed were egg diameter, fecundity, hatching rate, survival rate, spawning frequency, spawning time, egg quality, and larvae quality.
In conclusion, the addition of S. platensis in feed and Oodev injection concurrently able to increase tilapia reproduction performance and total spawned fish. Based on this study, the best treatment was combination of S. platensis addition 2% and Oodev 10 IU/kg which showed average egg diameter 2.93 mm,average fecundity 1114 eggs/200 g body weight, average hatching rate 99.6%, and average larvae survival rate 93.5%. Egg and larvae protein respectively 62.49% and 65.5%.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KAJIAN KOMBINASI PENAMBAHAN
Spirulina platensis
PADA PAKAN DAN PENYUNTIKAN OODEV TERHADAP
KINERJA REPRODUKSI IKAN NILA
FIRSTY RAHMATIA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
T : P P P y R ! " N : # Ry
N!M : $%&%%%'()%
*
P +
* ! N , + PU-MS
* ! .+O / -0/ 1 .++
*
* , y P
* ! S -M1
* / 2 1
* ! * Sy -0/ 1 .+
T++ U 3 (4/ ('%)
Puji dan syukur penulis panjatkan kepada Allah :;<=>?>=; wa ta ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2013 ini ialah nutrisi reproduksi, dengan judul Kajian Kombinasi Penambahan Spirulina platensis pada Pakan dan Penyuntikan Oodev Terhadap Kinerja Reproduksi Ikan Nila.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Nur Bambang Priyo Utomo, MSi dan Bapak Dr Ir Agus Oman Sudrajat, MSc selaku pembimbing yang telah banyak memberi arahan dan bimbingan. Terima kasih kepada Ibu Dr Ir Mia Setiawati, MSi selaku dosen penguji dan Bapak Dr Ir Kukuh Nirmala, MSc. Selanjutnya kepada seluruh dosen dan segenap pegawai Departemen Budidaya Perairan khususnya Laboratorium Nutrisi Ikan (Pak Wasjan, Mbak Retno, Bang Yosi), staf akuatik SEAMEO BIOTROP (Pak Didi), serta BPBIA Wanayasa atas bimbingan, dukungan dan bantuannya.
Ucapan terima kasih yang tidak terhingga juga disampaikan kepada Ayahanda Lenis, SP, Ibunda Asnarliati, SPd., dan Adinda Fadhli Nishfi atas curahan cinta, kasih sayang dan motivasi. Sahabat-sahabat (Nurika, Novia, Ide, Yayan, Pak Armen, Aziz, Sahrul, Fariq, Kak Adni, Kak Dewi, Mas Hanif, Mas Epro, Kak Angga, Bu Veni, Arfizon, Balqis, Nurazmi, dan seluruh AKU 2011) atas kebersamaan, kasih sayang, dan semangatnya. Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2013
@ABC ADE FE
DAFTAR TABEL Vii
DAFTAR GAMBAR Vii
DAFTAR LAMPIRAN Vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Kerangka Pemikiran Tujuan Penelitian
2 3
Manfaat Penelitian 3
Hipotesis 4
TINJAUAN PUSTAKA 4
Ikan Nila 4
Perkembangan Gonad Ikan Nila 4
Peranan Spirulina 6
Peranan Hormon 6
METODE 7
Waktu dan Tempat Penelitian 7
Bahan dan Alat 7
Metode Penelitian 8
Analisis Statistik 10
HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 20
SIMPULAN DAN SARAN 23
DAFTAR PUSTAKA 24
GHIJ HKJ HL MN
1 Kandungan asam lemak padaOPQR ST QUVsp. 6
2 Perlakuan penelitian 8
3 Hasil proksimat (% bobot kering) danWVX XVT QUY TZ UQ[V[Q\(% dari total
lemak) pakan yang disuplementasi dengan dosis O] PT V^Z U_ Q_ yang
berbeda
11
4 Diameter telur, fekunditas telur, derajat tetas telur, dan sintasan larva ikan Nila dengan pemberian dosis suplementasi O] PT V^Z U_ Q_ dan
penyuntikan dosis Oodev yang berbeda
12
5 Jumlah dan hari pemijahan ikan Nila selama 40 hari pemeliharaan 13 6 Hasil analisis proksimat ikan, telur, dan larva ikan yang diberi perlakuan
dosis suplementasi O] PTV^ Z U_ Q_ yang berbeda pada pakan dan dosis
penyuntikan Oodev yang berbeda
19
G HIJHK `HaLHK
1 Kerangka pemikiran 3
2 Ikan Nila NIRWANA 4
3 Peranan hormon dalam proses pematangan gonad 7 4 Diameter dan fekunditas telur ikan Nila dengan pemberian dosis
suplementasiO]PTV^ Z U_ Q_dan penyuntikan dosis Oodev yang berbeda
12
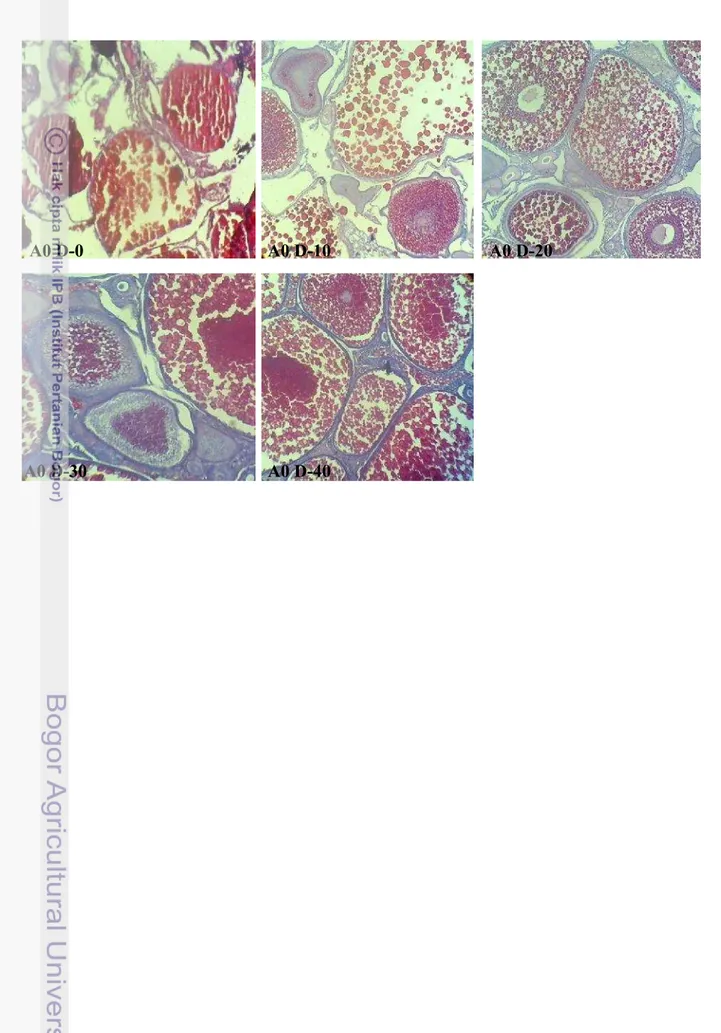
5 Gonadosomatic Index(GSI) induk ikan Nila selama pemeliharaan 14 6 Hepatosomatic Index(HSI) induk ikan Nila selama pemeliharaan 14 7 Gambaran histologi gonad perlakuan A0 hari ke-0, A0 hari ke-10, A0
hari ke-20, A0 hari ke-30, dan A0 hari ke-40 (perbesaran 10x10)
15
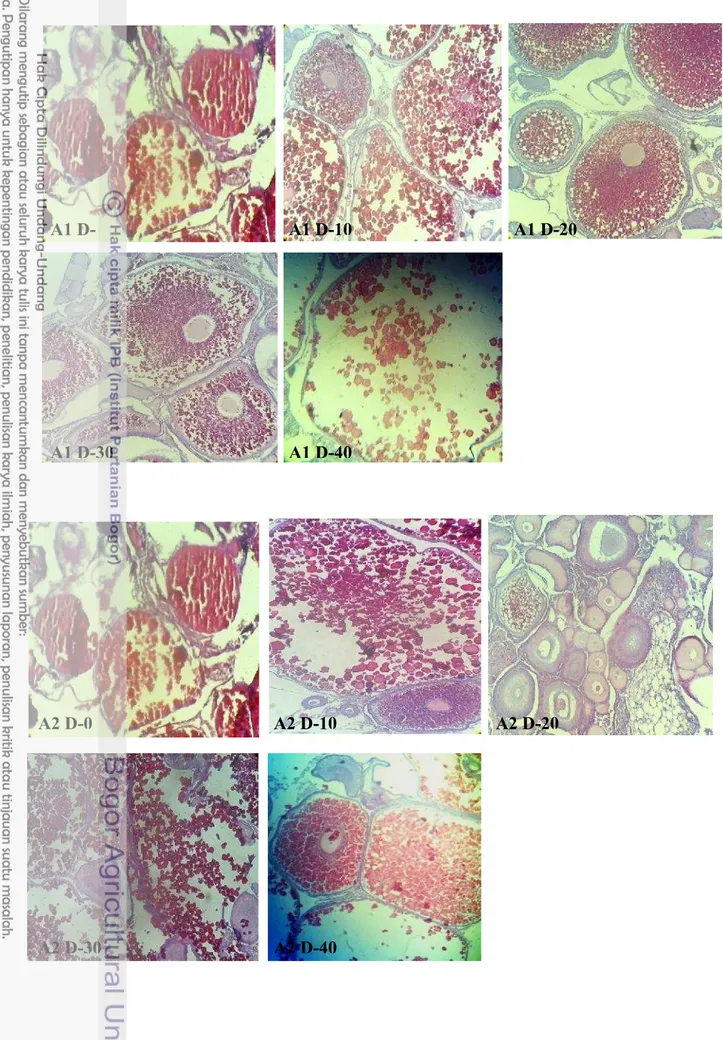
8 Gambaran histologi gonad perlakuan A1 hari ke-0, A1 hari ke-10, A1 hari ke-20, A1 hari ke-30, dan A1 hari ke-40 (perbesaran 10x10)
16
9 Gambaran histologi gonad perlakuan A2 hari ke-0, A2 hari ke-10, A2 hari ke-20, A2 hari ke-30, dan A2 hari ke-40 (perbesaran 10x10)
16
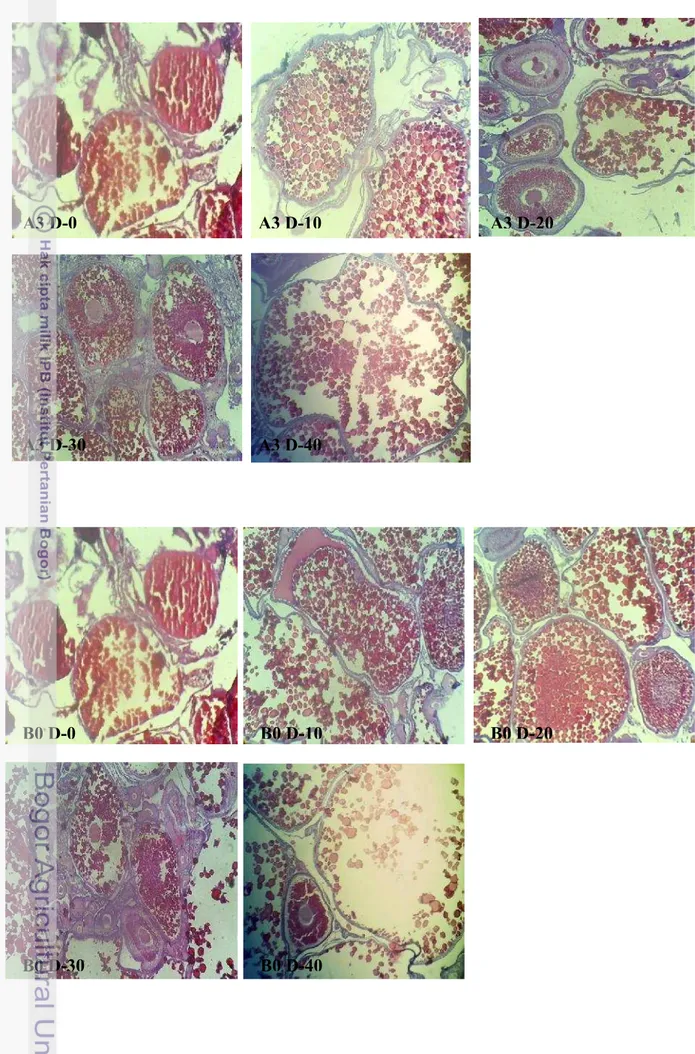
10 Gambaran histologi gonad perlakuan A3 hari ke-0, A3 hari ke-10, A3 hari ke-20, A3 hari ke-30, dan A3 hari ke-40 (perbesaran 10x10)
17
11 Gambaran histologi gonad perlakuan B0 hari ke-0, B0 hari ke-10, B0 hari ke-20, B0 hari ke-30, dan B0 hari ke-40 (perbesaran 10x10)
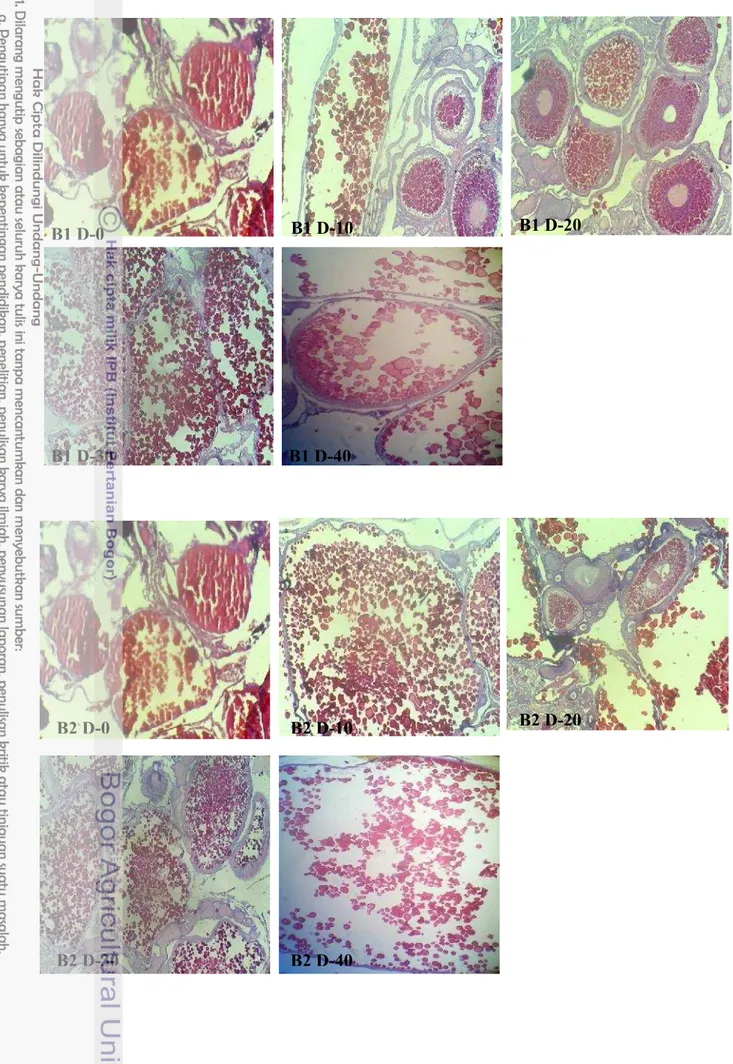
17
12 Gambaran histologi gonad perlakuan B1 hari ke-0, B1 hari ke-10, B1 hari ke-20, B1 hari ke-30, dan B1 hari ke-40 (perbesaran 10x10)
18
13 Gambaran histologi gonad perlakuan B2 hari ke-0, B2 hari ke-10, B2 hari ke-20, B2 hari ke-30, dan B2 hari ke-40 (perbesaran 10x10)
18
14 Gambaran histologi gonad perlakuan B3 hari ke-0, B3 hari ke-10, B3 hari ke-20, B3 hari ke-30, dan B3 hari ke-40 (perbesaran 10x10)
bcdecf gc hij fck
1 Prosedur analisis proksimat 26
2 Hasil pengukuran kualitas air selama pemeliharaan ikan Nila 29 3 Uji Kruskal-Wallis diameter telur, fekunditas, derajat tetas telur, dan
sintasan larva
1 PENDAHULUAN
Latar Belakang
Pembenihan merupakan bagian penting dari kegiatan budidaya ikan. Kegiatan ini diharapkan mampu berlangsung secara kontinu sepanjang tahun agar kebutuhan benih dengan kuantitas dan kualitas yang baik dapat terpenuhi pada saat dibutuhkan. Secara alami waktu pemijahan ikan bergantung pada sinyal lingkungan. Beberapa tahun terakhir, waktu kematangan gonad sudah dapat dimanipulasi dengan penyuntikan hormon. Penambahan hormon dari luar mampu mempercepat kematangan gonad. Salah satu contoh bahan yang bisa digunakan adalah Oodev yang mengandung lmnopqpr sqmn t nrumuv pqwv rropin (PMSG) dan antidopamin, hormon ini banyak mengandung unsur daya kerja xv yizle
t rimulqring {ormo ne (FSH) yang berperan dalam pematangan gonad awal atau vitelogenesis (Bolamba et qy| 1992). Penyerapan vitelogenin akan membuat oosit mencapai ukuran tertentu yang kemudian siap untuk diovulasikan. Bahan yang banyak digunakan oleh pembudidaya saat ini adalah Ovaprim. Perbedaan Oodev dengan Ovaprim adalah kandungan hormon yang terkandung didalamnya. Ovaprim mengandung LHRH yang berperan untukfipqy mqr}m qrion (pematangan gonad akhir) atau ovulasi.
Sistem reproduksi tubuh akan bekerja apabila hormon sudah memberikan signal. Kelancaran proses reproduksi juga bergantung pada status nutrisi tubuh, karena materi yang bekerja berasal dari pakan yang dikonsumsi. Oleh karena itu, pemberian pakan bernutrien optimal diperlukan agar mampu mendukung kebutuhan pertumbuhan gonad pada induk ikan. Bahan pakan merupakan faktor penentu nutrien yang terkandung dalam pakan. Pakan dapat ditambahkan dengan suatu bahan yang mangandung kandungan nutrien tertentu yang mampu mendukung aktivitas reproduksi, salah satu bahan yang memiliki sifat tersebut adalah ganggangt~rulipq .
Ganggang ini memiliki kandungan nutrisi yang cukup tinggi (Angka dan Suhartono 2000) dan kaya akan asam lemak esensial yang yang merupakan faktor paling menentukan dalam kesuksesan reproduksi. Kandungan omega 6 Spirulina mencapai 30% dari total lipid, yang terdiri atas uqmq linoleniz ziw (GLA),
y~ qolenizlin ziw (ALA), leizoin ziw (LA) dan mqzhiwv pz zwi (ARA). Omega 3 mencapai 18% dari total lipid yang terdiri atast reqm wv pz ziw (SDA), Eizv q~ nntqnoniz ziw (EPA), dan vzv q nxqenoiz ziw (DHA). Asam lemak esensial mempengaruhi metabolisme, pematangan gonad, stereidogenesis (Izquierdoet qy| 2001), kualitas telur, dan embriogenesis (Mokoginta 1992).
2
Berdasarkan hal di atas, pada penelitian ini dilakukan penambahanruli
p l
nsis pada pakan yang juga dikombinasikan dengan penyuntikan Oodev. Kombinasi kedua perlakuan ini diharapkan dapat meningkatkan kinerja reproduksi dengan kuantitas dan kualitas yang lebih baik pada semua jenis ikan, baik itu pada ikan yang karakter pemijahannya non-parsial maupun parsial. Ikan uji yang digunakan pada percobaan adalah ikan Nila strain NIRWANA. Ikan ini dijadikan model mewakili ikan-ikan yang pemijahannya bersifat parsial (berkali-kali memijah dalam satu periode pemijahan). Penelitian kombinasi PMSG dan suplementasi ruli pada pakan untuk ikan yang pemijahannya bersifat non-parsial (sekali memijah dalam satu periode pemijahan) salah satunya telah dilakukan oleh Mayasari (2012), yaitu pada ikan Lele.
Perumusan Masalah
Upaya rekayasa hormonal untuk kematangan gonad induk ikan dilakukan guna meningkatkan frekwensi pemijahan dan memperpendek periode pematangan kembali (rematurasi). Hormon yang dapat digunakan salah satunya adalah PMSG yang berperan dalam proses pematangan awal atau vitelogenesis. Pemberian PMSG akan mampu merangsang sistem reproduksi untuk bekerja lebih cepat sehingga kematangan gonad akan terjadi lebih awal. Namun, hal tersebut tidak akan berjalan sempurna tanpa didukung oleh status nutrisi induk yang baik pula, materi yang digunakan selama proses berlangsung bergantung pada nutrien yang tersedia. Oleh karena itu, akan lebih baik apabila diberikan bahan tambahan pada pakan agar pakan tersebut memiliki kandungan nutrien tinggi sehingga mampu memenuhi kebutuhan perkembangan gonad. Salah satu bahan yang dapat digunakan sebagai suplemen adalahruli .
Penggabungan hormon dan nutrien diharapkan mampu memberikan pengaruh terhadap semua jenis ikan baik yang bersifat pemijahan non-parsial maupun parsial. Namun, hingga saat ini belum diketahui mekanisme dan peran kombinasi hormon dan nutrien terhadap kinerja reproduksi ikan yang pemijahannya bersifat parsial. Penelitian-penelitian yang telah dilakukan sebelumnya menggunakan ikan yang bersifat non-parsial seperti ikan Patin, Lele, dan Belut.
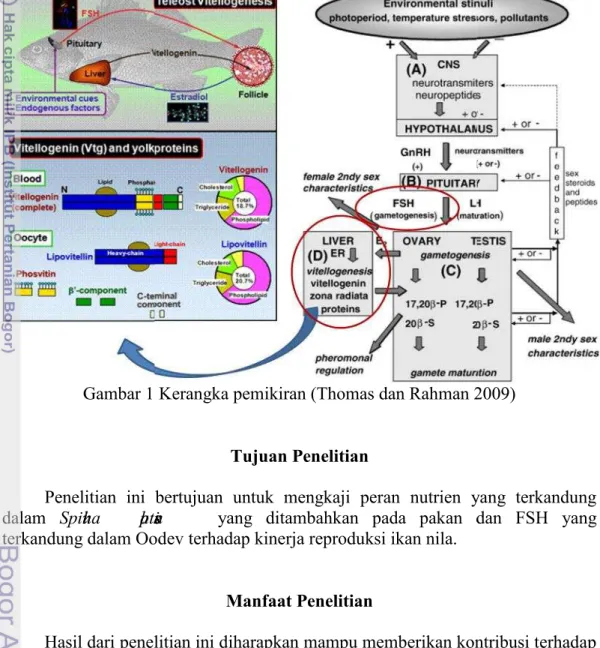
Kerangka Pemikiran
Penyuntikan hormon PMSG dari luar akan membantu produksi il
imul i orm (FSH) oleh kelenjar pituitari yang selanjutnya merangsang ovarium melakukan pematangan gonad awal dan vitelogenesis. Jika pematangan gonad semakin cepat dan frekwensi pemijahan semakin sering maka jumlah hasil reproduksi akan meningkat.
3
induk (us fee ng ), fekunditas (jumlah telur yang dihasilkan induk), dan embriogenesis. Pada penelitian ini dicobakan penambahan ruli pl ensis
pada pakan guna dikaji dan diteliti perannya dalam pemenuhan nutrisi reproduksi induk sehingga memberikan performa reproduksi optimal. Apabila dilakukan penggabungan atau kombinasi hormon dan nutrien, maka diharapkan mampu memberikan hasil yang lebih baik. Dengan demikian, setelah penelitian ini akan dapat diketahui peran Oodev dan ruli pl ensis pada pakan terhadap perbaikan kinerja reproduksi ikan.
Gambar 1 Kerangka pemikiran (Thomas dan Rahman 2009)
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji peran nutrien yang terkandung dalam ruli plensis yang ditambahkan pada pakan dan FSH yang terkandung dalam Oodev terhadap kinerja reproduksi ikan nila.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan mampu memberikan kontribusi terhadap peningkatan performa reproduksi induk ikan nila sehingga mampu menghasilkan benih yang berkualitas.
3
induk (e neus fee ng ), fekunditas (jumlah telur yang dihasilkan induk), dan embriogenesis. Pada penelitian ini dicobakan penambahan ruli pl ensis pada pakan guna dikaji dan diteliti perannya dalam pemenuhan nutrisi reproduksi induk sehingga memberikan performa reproduksi optimal. Apabila dilakukan penggabungan atau kombinasi hormon dan nutrien, maka diharapkan mampu memberikan hasil yang lebih baik. Dengan demikian, setelah penelitian ini akan dapat diketahui peran Oodev dan ruli pl ensis pada pakan terhadap perbaikan kinerja reproduksi ikan.
Gambar 1 Kerangka pemikiran (Thomas dan Rahman 2009)
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji peran nutrien yang terkandung dalam ruli plensis yang ditambahkan pada pakan dan FSH yang terkandung dalam Oodev terhadap kinerja reproduksi ikan nila.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan mampu memberikan kontribusi terhadap peningkatan performa reproduksi induk ikan nila sehingga mampu menghasilkan benih yang berkualitas.
3
induk (e neus fee ng ), fekunditas (jumlah telur yang dihasilkan induk), dan embriogenesis. Pada penelitian ini dicobakan penambahan ruli plensis pada pakan guna dikaji dan diteliti perannya dalam pemenuhan nutrisi reproduksi induk sehingga memberikan performa reproduksi optimal. Apabila dilakukan penggabungan atau kombinasi hormon dan nutrien, maka diharapkan mampu memberikan hasil yang lebih baik. Dengan demikian, setelah penelitian ini akan dapat diketahui peran Oodev dan ruli pl ensis pada pakan terhadap perbaikan kinerja reproduksi ikan.
Gambar 1 Kerangka pemikiran (Thomas dan Rahman 2009)
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji peran nutrien yang terkandung dalam ruli pl ensis yang ditambahkan pada pakan dan FSH yang terkandung dalam Oodev terhadap kinerja reproduksi ikan nila.
Manfaat Penelitian
4
Hipotesis
Kombinasi penambahan ruli pl nsis pada pakan dan penyuntikan Oodev mampu meningkatkan kuantitas parameter produksi seperti diameter telur, fekunditas, derajat tetas telur, serta sintasan larva, tanpa menurunkan kualitas (komposisi kimia telur dan larva) hasil pemijahan ikan Nila.
2 TINJAUAN PUSTAKA
Ikan Nila
Induk ikan Nila bersifat nt yang akan mengerami dan menjaga telur hingga menetas menjadi larva dalam rongga mulut. Secara alami ikan ini dapat memijah sepanjang tahun di daerah tropis, namun pada umumnya memijah pada musim hujan. Pemijahan terjadi beberapa kali ( i ni ) dengan pasangan yang sama maupun berbeda. Telur ikan Nila berdiameter 2.8 mm berwarna abu-abu terkadang berwarna kuning, tidak lengket, dan tenggelam di dasar perairan. Telur yang telah dibuahi dierami dalam mulut induk betina yang selanjutnya akan menetas dalam waktu 4-5 hari (Gomez-Marquez t 2003).
Gambar 2 Ikan Nila NIRWANA
Perkembangan Gonad Ikan
Menurut Lagler t ¡¢ (1977), perkembangan gonad pada ikan dapat dibagi menjadi dua tahap, yaitu tahap pertumbuhan gonad hingga mencapai tingkat dewasa kelamin dan tahap pematangan produksi seksual. Tahap pertumbuhan berlangsung sejak ikan menetas hingga dewasa kelamin, sedangkan tahap pematangan berlangsung setelah ikan dewasa. Tahap pematangan akan terus berlangsung dan berkesinambungan selama fungsi reproduksi berjalan normal.
Dadzie dan Wangila (1980) membagi Tingkat Kematangan Gonad (TKG) ikan Nila menjadi lima tingkatan, yaitu :
4
Hipotesis
Kombinasi penambahan £¤¥ruli¦¡ pl¡§ nsis pada pakan dan penyuntikan Oodev mampu meningkatkan kuantitas parameter produksi seperti diameter telur, fekunditas, derajat tetas telur, serta sintasan larva, tanpa menurunkan kualitas (komposisi kimia telur dan larva) hasil pemijahan ikan Nila.
2 TINJAUAN PUSTAKA
Ikan Nila
Induk ikan Nila bersifat ¤¡¨ nt¡¢ ©¡¨ yang akan mengerami dan menjaga telur hingga menetas menjadi larva dalam rongga mulut. Secara alami ikan ini dapat memijah sepanjang tahun di daerah tropis, namun pada umumnya memijah pada musim hujan. Pemijahan terjadi beberapa kali (¤¡¨ §i¡¢ ª ¤¡«ni¦¬ ) dengan pasangan yang sama maupun berbeda. Telur ikan Nila berdiameter 2.8 mm berwarna abu-abu terkadang berwarna kuning, tidak lengket, dan tenggelam di dasar perairan. Telur yang telah dibuahi dierami dalam mulut induk betina yang selanjutnya akan menetas dalam waktu 4-5 hari (Gomez-Marquez t ¡¢ 2003).
Gambar 2 Ikan Nila NIRWANA
Perkembangan Gonad Ikan
Menurut Lagler t (1977), perkembangan gonad pada ikan dapat dibagi menjadi dua tahap, yaitu tahap pertumbuhan gonad hingga mencapai tingkat dewasa kelamin dan tahap pematangan produksi seksual. Tahap pertumbuhan berlangsung sejak ikan menetas hingga dewasa kelamin, sedangkan tahap pematangan berlangsung setelah ikan dewasa. Tahap pematangan akan terus berlangsung dan berkesinambungan selama fungsi reproduksi berjalan normal.
Dadzie dan Wangila (1980) membagi Tingkat Kematangan Gonad (TKG) ikan Nila menjadi lima tingkatan, yaitu :
4
Hipotesis
Kombinasi penambahan ruli pl nsis pada pakan dan penyuntikan Oodev mampu meningkatkan kuantitas parameter produksi seperti diameter telur, fekunditas, derajat tetas telur, serta sintasan larva, tanpa menurunkan kualitas (komposisi kimia telur dan larva) hasil pemijahan ikan Nila.
2 TINJAUAN PUSTAKA
Ikan Nila
Induk ikan Nila bersifat nt yang akan mengerami dan menjaga telur hingga menetas menjadi larva dalam rongga mulut. Secara alami ikan ini dapat memijah sepanjang tahun di daerah tropis, namun pada umumnya memijah pada musim hujan. Pemijahan terjadi beberapa kali ( i ni ) dengan pasangan yang sama maupun berbeda. Telur ikan Nila berdiameter 2.8 mm berwarna abu-abu terkadang berwarna kuning, tidak lengket, dan tenggelam di dasar perairan. Telur yang telah dibuahi dierami dalam mulut induk betina yang selanjutnya akan menetas dalam waktu 4-5 hari (Gomez-Marquez t 2003).
Gambar 2 Ikan Nila NIRWANA
Perkembangan Gonad Ikan
Menurut Lagler t (1977), perkembangan gonad pada ikan dapat dibagi menjadi dua tahap, yaitu tahap pertumbuhan gonad hingga mencapai tingkat dewasa kelamin dan tahap pematangan produksi seksual. Tahap pertumbuhan berlangsung sejak ikan menetas hingga dewasa kelamin, sedangkan tahap pematangan berlangsung setelah ikan dewasa. Tahap pematangan akan terus berlangsung dan berkesinambungan selama fungsi reproduksi berjalan normal.
5
TKG I : ovarium masih kecil, transparan, dan oosit muda hanya terlihat dengan menggunakan mikroskop.
TKG II : ovarium berwarna kuning terang, oosit dapat dilihat dengan mata. TKG III : ovarium besar, berwarna kuning gelap dan ada oosit yang mulai
mengandung kuning telur.
TKG IV : ovarium besar, berwarna coklat, banyak oosit berukuran maksimal dan mudah dipisahkan.
TKG V : ovarium berwarna kuning terang, ukuran berkurang karena telur yang sudah matang telah dilepaskan, ovarium berisi oogonia, oosit berprotoplasma, dan sedikit oosit mengandung kuning telur, dan banyak dijumpai folikel pecah.
Tingkat kematangan gonad merupakan parameter kualitatif, perubahan yang terjadi pada gonad secara kuantitatif dapat dinyatakan dengan suatu indeks gonad somatik atau ®¯°±²¯ ³¯´ ±µi¶ ·°²¸x (GSI) (Effendie 1997). Selama proses reproduksi, sebagian energi akan dipakai untuk perkembangan gonad, sehingga bobot gonad ikan akan mencapai maksimum sesaat sebelum ikan memijah dan kemudian akan menurun dengan cepat selama proses pemijahan berlangsung hingga selesai.
Effendie (1997) menyatakan umumnya pertambahan bobot gonad ikan betina pada saat stadium matang gonad dapat mencapai 10-25% dari bobot tubuh dan pada ikan jantan 5-10%. Selain itu, disebutkan pula bahwa dengan semakin meningkatnya tingkat kematangan gonad, diameter telur yang ada dalam gonad juga akan semakin besar. Ukuran telur berperan dalam kelangsungan hidup ikan karena kuning telur pada telur yang berukuran besar lebih banyak, sehingga larva yang dihasilkan mempunyai persediaan makanan yang cukup dan daya tahan tubuh yang lebih tinggi (Bagenal 1969).
6
PerananSpirulina
ru
li merupakan ganggang yang mengandung nutrien tinggi, diantaranya mengandung m linoleni i (GLA), l linoleni i ( ), inolei i (LA), te i (SDA), Ei nt eoni i
(EPA), xenoi i (DHA), dan hi i (ARA) (Tabel 1). Selain itu juga mengandung vitamin dan mineral seperti vitamin B1, B2, B3, B6, B9, B12, Vitamin C, Vitamin D dan Vitamin E, potasium, kalsium, krom, tembaga, besi, magnesium, mangan, fosfor, selenium, sodium, dan seng. Adapun berdasarkan hasil analisis proksimat, ruli pl ensis mengandung protein 67.80%, lemak 0.53%, dan karbohidrat 24.87%.
Tabel 1 Kandungan Asam Lemak pada ruli sp.
Sumber : Earthrise Farms (1995) dalam Mayasari (2012)
Asam lemak esensial adalah prekursor untuk prostaglandin tubuh (PGE1), yaitu hormon utama yang mengontrol banyak fungsi tubuh. PGE1 terlibat dalam banyak tugas termasuk pengaturan tekanan darah, sintesis kolesterol, inflamasi dan proliferasi sel. James et (2009) dalam penelitiannya memberikan hasil bahwa penggunaan kombinasi dosis rulin sebesar 30 g/kg pakan dan penambahan vitamin E 300 mg menghasilkan pertumbuhan, berat gonad dan fekunditas ikan maskoki us us yang lebih baik dibandingkan perlakuan lainnya (P<0.01).
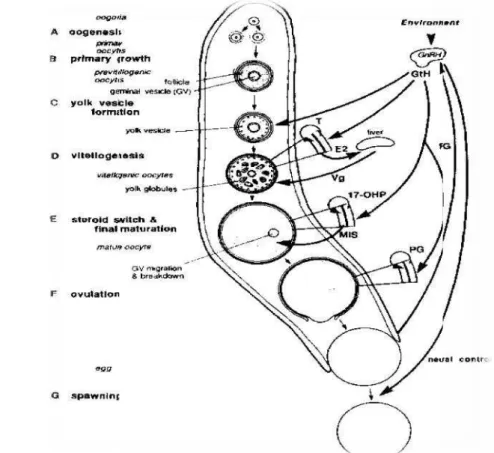
Peranan Hormon
7
kerja FSH dan sedikit LH. i l imul i orm (FSH) atau GTH I akan merangsang terjadinya lonjakan kadar GnRH yang selanjutnya mempengaruhi kelenjar pituitari untuk memproduksi gonadotropin (Bolamba t 1992). Setelah itu gonadotropin akan merangsang ovarium untuk proses pematangan telur pada ikan.
Gambar 3 Peranan hormon dalam proses pematangan gonad (Harvey dan Carolsfeld 1993)
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Februari hingga Agustus 2013 di SEAMEO BIOTROP Bogor, Jawa Barat. Analisis kimia dilaksanakan di Laboratorium Nutrisi Ikan, Laboratorium Kesehatan Ikan, dan Laboratorium Terpadu Institut Pertanian Bogor.
Bahan dan Alat
Pakan uji
Pakan yang digunakan, yaitu pakan komersil dengan kadar protein 28% (sebelum penambahan pl nsis ). pl nsis yang digunakan sudah berbentuk 7
kerja FSH dan sedikit LH. ¹ º»i¼l½¾¿luimÀ¿ÁÂi ÃormºÁ ½ (FSH) atau GTH I akan merangsang terjadinya lonjakan kadar GnRH yang selanjutnya mempengaruhi kelenjar pituitari untuk memproduksi gonadotropin (Bolamba½t À» 1992). Setelah itu gonadotropin akan merangsang ovarium untuk proses pematangan telur pada ikan.
Gambar 3 Peranan hormon dalam proses pematangan gonad (Harvey dan Carolsfeld 1993)
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Februari hingga Agustus 2013 di SEAMEO BIOTROP Bogor, Jawa Barat. Analisis kimia dilaksanakan di Laboratorium Nutrisi Ikan, Laboratorium Kesehatan Ikan, dan Laboratorium Terpadu Institut Pertanian Bogor.
Bahan dan Alat
Pakan uji
Pakan yang digunakan, yaitu pakan komersil dengan kadar protein 28% (sebelum penambahan ¾ÄplÀ¿½nsis ). ¾ÄplÀ¿½nsis yang digunakan sudah berbentuk 7
kerja FSH dan sedikit LH. i l imul i orm (FSH) atau GTH I akan merangsang terjadinya lonjakan kadar GnRH yang selanjutnya mempengaruhi kelenjar pituitari untuk memproduksi gonadotropin (Bolamba t Ȁ1992). Setelah itu gonadotropin akan merangsang ovarium untuk proses pematangan telur pada ikan.
Gambar 3 Peranan hormon dalam proses pematangan gonad (Harvey dan Carolsfeld 1993)
3 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai Februari hingga Agustus 2013 di SEAMEO BIOTROP Bogor, Jawa Barat. Analisis kimia dilaksanakan di Laboratorium Nutrisi Ikan, Laboratorium Kesehatan Ikan, dan Laboratorium Terpadu Institut Pertanian Bogor.
Bahan dan Alat
Pakan uji
8
tepung yang diperoleh dari PT. Polaris Indonesia. Pakan kemudian digiling dan dilakukanÅ ÆÇÆllÆtiÈÉ dengan menambahkanÊËÌÍÎÏ Ænsis berbagai dosis, yaitu 0% (kontrol), 1%, 2%, dan 3%. Pakan dioven pada suhu 60oC selama 12 jam. Pakan kemudian dianalisis proksimat untuk melihat kandungan nutriennya meliputi protein, lemak, dan karbohidrat (Takeuchi 1988).
Hewan Uji
Induk ikan Nila ÐreÑÒhomis nilotiÒus strain NIRWANA yang digunakan berasal dari Balai Pengembangan Benih Ikan Air Tawar (BPBIA), Wanayasa, Purwakarta, Jawa Barat. Penelitian menggunakan induk betina yang belum pernah memijah dengan bobot 30-75 gram. Ikan yang digunakan adalah induk Nila yang sudah diseragamkan tingkat kematangan gonadnya. Untuk mendapatkannya dilakukan dengan memijahkan induk terlebih dahulu. Induk jantan dan induk betina digabungkan dalam satu kolam, kemudian pemeriksaan dilakukan secara berkala (per sepuluh hari). Induk yang sudah mengerami telur dipisahkan dan telur tersebut dikeluarkan dari mulutnya hingga kosong. Induk inilah yang kemudian digunakan untuk pengujian. Jumlah induk yang digunakan adalah 16 ekor per pelakuan, sembilan ekor untuk histologi gonad, GSI, dan HSI, tujuh ekor untuk pengamatan kinerja reproduksi.
Hormon yang digunakan
Hormon yang digunakan adalah merk dagang Oodev yang dikembangkan oleh Laboratorium Reproduksi dan Genetika Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Oodev mengadung hormon PMSG dan antidopamin. Dosis Oodev yang diberikan adalah 0 IU/kg ikan dan 10 IU/kg ikan.
Wadah
Wadah yang digunakan sebagai wadah perlakuan berupa 8 hapa masing-masing berukuran 2 m x 2 m. Selain itu juga dipersiapkan wadah pemijahan berupa hapa berukuran 1 m x 1 m. Induk yang telah matang gonad akan dipindahkan ke wadah pemijahan dan dipasangkan dengan induk jantan dengan perbandingan 1:1. Wadah lain yang digunakan adalah toples kaca berdiameter 20 cm sebanyak 24 buah untuk wadah inkubasi telur, penetasan, dan pemeliharaan larva.
Metode Penelitian
Perlakuan
9
Keterangan :
A0 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 0 %, penyuntikan Oodev 0 IU/kg A1 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 1 %, penyuntikan Oodev 0 IU/kg A2 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 2 %, penyuntikan Oodev 0 IU/kg A3 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 3 %, penyuntikan Oodev 0 IU/kg B0 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 0 %, penyuntikan Oodev 10 IU/kg B1 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 1 %, penyuntikan Oodev 10 IU/kg B2 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 2 %, penyuntikan Oodev 10 IU/kg B3 = PenambahanÖ×ØruliÙÚ plÚÛ Ünsis 3 %, penyuntikan Oodev 10 IU/kg
Parameter yang Dievaluasi
Dalam penelitian ini, parameter yang diamati adalah sebagai berikut :
1) Pengamatan kematangan gonad, yang dilakukan dengan membuat preparat histologis ovarium. Pengamatan ini akan dilakukan setiap sepuluh hari yaitu bersamaan dengan waktu penyuntikan Oodev.
2) Diameter telur. Pengamatan dilakukan dengan menggunakan mikroskop yang dilengkapi mikrometer okuler dengan perbesaran 4 x 10.
3) Fekunditas relatif yang diperoleh dengan menghitung jumlah telur yang dikeluarkan oleh setiap induk dalam satu kali pemijahan dan kemudian dibandingkan dengan bobot tubuhnya.
4) Derajat Tetas Telur (DTT) diperoleh dengan membandingkan jumlah telur yang menetas dengan telur yang ditetaskan.
(%) = 100%
5) Survival rate larva (SR7), perhitungan SR ini dilakukan sebanyak lima kali
dan hasilnya dirata-ratakan.
(%) = 7 100%
6) ÝÞÙÚßÞàÞ áÚÛiâãÙß Üx(GSI)
= 100%
7) ä×ÚÛe ÚÛosomi âãÙß Üx(HSI)
10
8) Frekwensi pemijahan ikan Nila selama 40 hari pemeliharaan.
9) Analisis proksimat åæ plçè énsis , pakan perlakuan, ikan, telur, dan larva (Takeuchi 1988).
10) Analisis asam lemak pada telur (metode gas chromatografi).
Pelaksanaan Penelitian
Wadah pemeliharaan induk diperiksa kerusakannya sebelum digunakan. Wadah kemudian diletakkan pada kolam beton berukuran 3 m x 5 m, diisi air dengan kedalaman 80 cm. Pergantian air pada penelitian ini dilakukan bersamaan dengan waktu sampling. Sebelum dilakukan percobaan, ikan uji diadaptasikan selama 10 hari. Selama periode adaptasi, ikan diberi pakan komersil sebanyak 3% bobot tubuh per hari. Dua ekor ikan uji juga dikorbankan untuk dianalisis proksimat. Ikan uji yang digunakan dalam penelitian ini ditandai secara individu dengan menggunakan tçêêë ìê sirip. Setiap perlakuan menggunakan satu kolam dan tiap kolam diisi 16 ekor induk betina. Selama penelitian yaitu 40 hari masa pemeliharaan, ikan tersebut diberi pakan uji 2 kali sehari dengan FR sebesar 3% dari bobot tubuh. Pengukuran parameter kualitas air (Lampiran 2) untuk suhu dilakukan pada pagi dan siang hari. Kandungan oksigen terlarut (DO) dan pH diukur pada awal, tengah, dan akhir penelitian, demikian pula dengan kandungan Total Ammonia Nitrogen (TAN). Pengamatan perkembangan gonad dilakukan setiap 10 hari bersamaan dengan waktu penyuntikan hormon. Setiap sampling dimulai dengan penimbangan induk untuk menentukan jumlah hormon yang disuntikkan dan pakan yang akan diberikan. Tiga ekor induk diambil dan dibedah guna dilakukan pengamatan histologi gonad, GSI, HSI, fekunditas, dan diameter telur.
Induk yang telah matang gonad segera dipindahkan ke wadah lain untuk persiapan pelaksanaan pemijahan alami. Induk dicampur dengan induk jantan dengan perbandingan 1:1. Pemeriksaan dilakukan pada hari ketiga setelah pencampuran induk. Telur yang telah dikeluarkan dan dierami dikumpulkan dan ditimbang. Sebanyak 5-10 g sampel telur diambil untuk analisis proksimat dan asam lemak. Telur-telur yang tersisa dipindahkan ke wadah inkubasi untuk diamati derajat penetasannya. Pemeliharaan larva tetap dilakukan di wadah penetasan hingga 7 hari setelah larva menetas. Jumlah larva yang masih hidup sampai dengan 7 hari pemeliharan kemudian dihitung untuk mendapatkan nilai SR7.
Analisis Statistik
11
4 HASIL DAN PEMBAHASAN
Hasil
Pakan yang telah diberi íî plïð ñnsis dengan dosis yang berbeda dianalisis proksimat untuk mengetahui kandungan nutrien yang terdapat dalam pakan tersebut. Selain proksimat, dilakukan pula analisis asam lemak, dalam hal ini salah satu asam lemak esensial yang diutamakan adalah òïmmï linolñnió ï óiô . Hasil proksimat pakan tersaji dalam Tabel 3.
Tabel 3 Hasil proksimat (% bobot kering) danòïmïmlinolñnióï óiô (% dari total lemak) pakan yang disuplementasi dengan dosis íî plïð ñnsis yang berbeda
Pakan Protein Lemak Kadar
Abu
Karbohidrat
Gamma-linolenic Acid (GLA)
Serat Kasar BETN
Pakan 0 30.12 7.88 9.47 2.10 50.43 0.04
Pakan 1 31.09 8.24 10.09 3.32 47.23 0.08
Pakan 2 33.48 8.23 10.07 1.72 46.50 0.13
Pakan 3 34.15 7.97 10.11 1.14 46.62 0.23
Kandungan protein pakan meningkat seiring dengan peningkatan dosis suplementasi íî plïðñnsis , yaitu suplementasi 0% (kontrol) sebesar 30.12%, suplementasi 1% sebesar 31.09%, suplementasi 2% sebesar 33.48%, dan suplementasi 3% sebesar 34.15%. Berbeda halnya dengan kandungan lemak pakan, menurun pada suplementasi 3%. Namun, kandungan lemak pada pakan yang disuplementasi dengan íî ïðñpl nsis dosis berbeda memberikan nilai yang lebih tinggi daripada pakan kontrol (Tabel 3).
Pemberian pakan perlakuan dilakukan selama 40 hari pemeliharaan, yang kemudian dievaluasi beberapa parameter yang terkait dengan kinerja reproduksi. Selama pemeliharaan juga dilakukan penyuntikan Oodev setiap 10 hari dengan dosis 0 IU/kg sebagai kontrol dan dosis 10 IU/kg. Berikut ini adalah parameter-parameter yang telah diamati :
Parameter produksi
12
Tabel 4 Diameter telur, fekunditas telur, derajat tetas telur, dan sintasan larva ikan Nila dengan pemberian dosis suplementasi pl nsis dan dosis penyuntikan Oodev yang berbeda
Keterangan : Hurufõö÷ørskrip tyang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata (P<0.10).
Jika disajikan dalam bentuk grafik, maka hasil diameter telur dan fekunditas yang diperoleh adalah sebagai berikut :
Gambar 4 Diameter dan fekunditas telur ikan Nila dengan pemberian dosis suplementasiù nsis dan dosis penyuntikan Oodev yang berbeda
Faktor pemberian perlakuan dosis suplementasi pl nsis yang berbeda pada pakan memberikan pengaruh yang berbeda nyata terhadap diameter telur ikan Nila (P<0.10). Namun, faktor hormon tidak memberikan pengaruh yang nyata (P>0.10), serta terjadi adanya interaksi antara kedua faktor terhadap diameter telur. Dosis ùú pl nsis yang memberikan nilai berbeda nyata dibandingkan dengan kontrol adalah dosis suplementasi 2% dan merupakan diameter tertinggi. Jika dibandingkan antar kombinasi perlakuan, perlakuan yang berbeda nyata dengan kontrol (A0) adalah perlakuan A1 (suplementasi p
l
ûüønsis 1%, Oodev 0 IU/kg), A2 (suplementasi pl nsis 2%, Oodev 0 IU/kg) dan B2 (suplementasi ùú plû nsis 2%, hormon Oodev 10 IU/kg). Perlakuan A0 memberikan hasil diameter 2.43±0.29 mm, sementara A1 dengan diameter
2,43 2,87 ikan Nila dengan pemberian dosis suplementasi ùú plûüønsis dan dosis penyuntikan Oodev yang berbeda
Keterangan : Huruf ørskrip tyang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata (P<0.10).
Jika disajikan dalam bentuk grafik, maka hasil diameter telur dan fekunditas yang diperoleh adalah sebagai berikut :
Gambar 4 Diameter dan fekunditas telur ikan Nila dengan pemberian dosis suplementasiùú÷ý ûüønsis dan dosis penyuntikan Oodev yang berbeda
Faktor pemberian perlakuan dosis suplementasi ùú plûüønsis yang berbeda pada pakan memberikan pengaruh yang berbeda nyata terhadap diameter telur ikan Nila (P<0.10). Namun, faktor hormon tidak memberikan pengaruh yang nyata (P>0.10), serta terjadi adanya interaksi antara kedua faktor terhadap diameter telur. Dosis plûüønsis yang memberikan nilai berbeda nyata dibandingkan dengan kontrol adalah dosis suplementasi 2% dan merupakan diameter tertinggi. Jika dibandingkan antar kombinasi perlakuan, perlakuan yang berbeda nyata dengan kontrol (A0) adalah perlakuan A1 (suplementasi p
l nsis 1%, Oodev 0 IU/kg), A2 (suplementasiùúplûüønsis 2%, Oodev 0 IU/kg) dan B2 (suplementasi plûüønsis 2%, hormon Oodev 10 IU/kg). Perlakuan A0 memberikan hasil diameter 2.43±0.29 mm, sementara A1 dengan diameter
2,81 2,34 2,67 2,51 2,93
10,38 12,13 10,19 ikan Nila dengan pemberian dosis suplementasi pl nsis dan dosis penyuntikan Oodev yang berbeda
Keterangan : Huruf rskrip tyang berbeda pada kolom yang sama menunjukkan hasil yang berbeda nyata (P<0.10).
Jika disajikan dalam bentuk grafik, maka hasil diameter telur dan fekunditas yang diperoleh adalah sebagai berikut :
Gambar 4 Diameter dan fekunditas telur ikan Nila dengan pemberian dosis suplementasi nsis dan dosis penyuntikan Oodev yang berbeda
Faktor pemberian perlakuan dosis suplementasi pl nsis yang berbeda pada pakan memberikan pengaruh yang berbeda nyata terhadap diameter telur ikan Nila (P<0.10). Namun, faktor hormon tidak memberikan pengaruh yang nyata (P>0.10), serta terjadi adanya interaksi antara kedua faktor terhadap diameter telur. Dosis pl nsis yang memberikan nilai berbeda nyata dibandingkan dengan kontrol adalah dosis suplementasi 2% dan merupakan diameter tertinggi. Jika dibandingkan antar kombinasi perlakuan, perlakuan yang berbeda nyata dengan kontrol (A0) adalah perlakuan A1 (suplementasi ùú
p
l nsis 1%, Oodev 0 IU/kg), A2 (suplementasi pl nsis 2%, Oodev 0 IU/kg) dan B2 (suplementasi pl nsis 2%, hormon Oodev 10 IU/kg). Perlakuan A0 memberikan hasil diameter 2.43±0.29 mm, sementara A1 dengan diameter
2,48 10,33
13
2.87±0.10 mm, A2 2.81±0.16 dan B2 2.93±0.30 mm. Untuk fekunditas telur, semua perlakuan menunjukkan hasil yang tidak berbeda nyata (P>0.10).
Faktor dosis suplementasi þÿ pl nsis yang berbeda pada pakan tidak berpengaruh nyata (P>0.10) terhadap derajat tetas telur, sementara sebaliknya faktor penyuntikan Oodev berpengaruh nyata (P<0.10). Penyuntikan hormon dengan dosis 10 IU/kg memberikan nilai derajat tetas telur yang lebih tinggi daripada ikan yang tidak diberi hormon. Kemudian tidak ditemui adanya interaksi antaraþÿ pl nsis dan Oodev terhadap derajat tetas telur. Jika dibandingkan antar kombinasi perlakuan, derajat tetas telur terendah adalah pada perlakuan kontrol (A0) yaitu 98.9%, selanjutnya diikuti oleh perlakuan A1 (99.2%), A2 (99.2%), A3 (99.5%), B2 (99.6%), B3 (99.8%). Derajat tetas telur tertinggi dihasilkan oleh perlakuan B0 dan B1 yaitu sebesar 100% (Tabel 4).
Dosis suplementasiþÿplnsis pada pakan yang berbeda tidak berpengaruh nyata (P>0.10) terhadap sintasan larva sampai dengan hari ketujuh. Namun, faktor penyuntikan Oodev berpengaruh nyata (P<0.10). Penyuntikan hormon dengan dosis 10 IU/kg memberikan nilai derajat tetas telur yang lebih tinggi daripada ikan yang tidak diberi hormon. Kemudian tidak ditemui adanya interaksi antara þÿ
p
lnsis dan hormon terhadap sintasan larva. Semua perlakuan menunjukkan nilai sintasan yang cukup tinggi, yaitu lebih besar dari 70%.
Parameter selanjutnya yang diamati adalah frekwensi pemijahan. Hasil ini dapat dijadikan sebagai indikator kuantitas kinerja reproduksi ikan nila yang diberi pakan dengan dosis suplementasi þÿ plnsis yang berbeda dan penyuntikan Oodev.
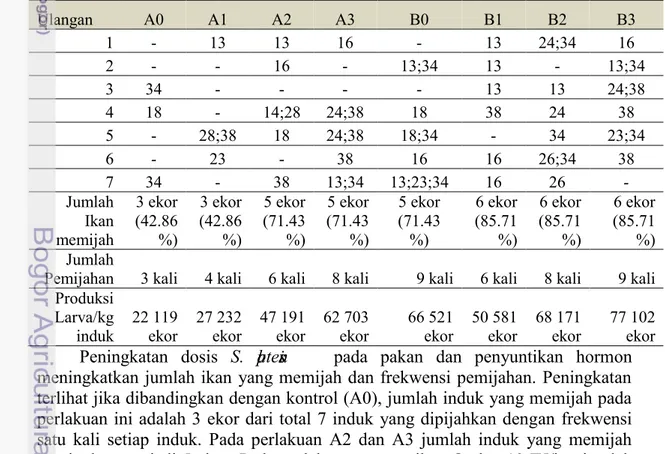
Tabel 5 Jumlah dan hari pemijahan ikan Nila selama 40 hari pemeliharaan
Ulangan A0 A1 A2 A3 B0 B1 B2 B3
14
ikan yang memijah semakin bertambah. Untuk perlakuan B0 (suplementasi p
l nsis 0%, penyuntikan Oodev 10 IU/kg), jumlah induk yang memijah sama dengan perlakuan A2 dan A3, yaitu 5 ekor. Sementara perlakuan kombinasi penambahan pl nsis pada pakan dan penyuntikan Oodev 10 IU/kg (B1, B2, B3) menghasilkan jumlah induk memijah yang lebih tinggi lagi, yaitu sebanyak 6 ekor dari total tujuh ekor ikan yang dipijahkan. Frekwensi pemijahan yang tinggi ditunjukkan oleh perlakuan A3 dan B2 yaitu 8 kali, serta B0 dan B3 dengan frekwensi tertinggi yaitu 9 kali.
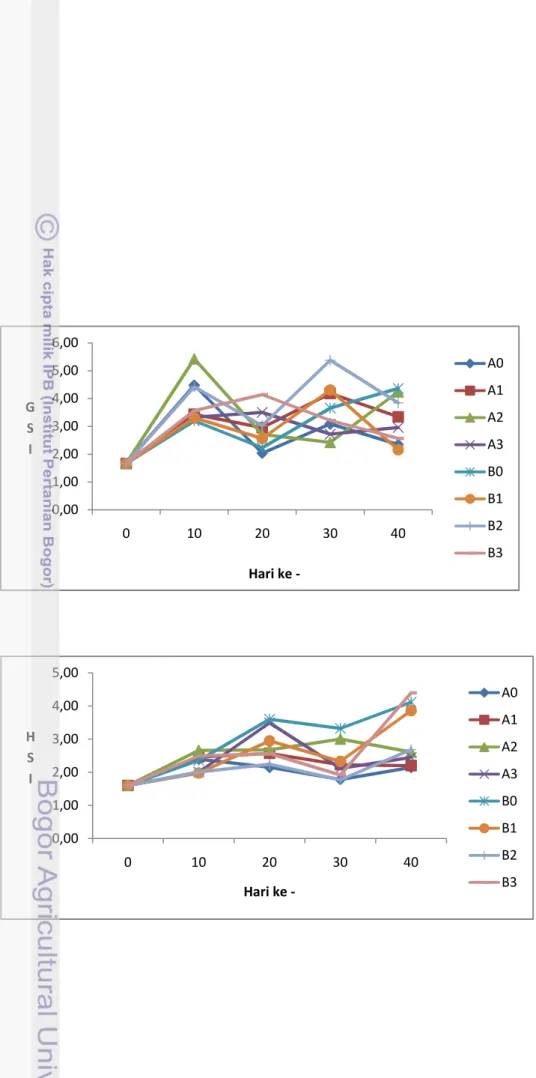
Parameter GSI, HSI, dan histologi
Parameter lain yang diamati pada penelitian adalah i i x ,
h
e osomi i x , dan histologi gonad. Parameter ini digunakan untuk menggambarkan proses yang terjadi pada sistem reproduksi selama pemeliharaan.
Gambar 5 mi x (GSI) induk ikan Nila selama pemeliharaan
Gambar 6 e o so mi x (HSI) induk ikan Nila selama pemeliharaan
15
Selain GSI dan HSI dilakukan pula pengamatan kematangan gonad dengan membuat preparasi gonad induk setiap perlakuan. Melalui gambar ini dapat diketahui status kematangan gonad dan bentuk jaringan gonad.
Gambar 7 Gambaran histologi gonad perlakuan A0 hari ke-0, A0 hari ke-10, A0 hari ke-20, A0 hari ke-30, dan A0 hari ke-40 (perbesaran 10 x10)
A0 D-0 A0 D-10 A0 D-20
16
Gambar 8 Gambaran histologi gonad perlakuan A1 hari ke-0, A1 hari ke-10, A1 hari ke-20, A1 hari ke-30, dan A1 hari ke-40 (perbesaran 10 x10)
Gambar 9 Gambaran histologi gonad perlakuan A2 hari ke-0, A2 hari ke-10, A2 hari ke-20, A2 hari ke-30, dan A2 hari ke-40 (perbesaran 10 x10)
A1 D-0
A1 D-10 A1 D-20
A1 D-30 A1 D-40
A2 D-0 A2 D-10 A2 D-20
17
Gambar 10 Gambaran histologi gonad perlakuan A3 hari ke-0, A3 hari ke-10, A3 hari ke-20, A3 hari ke-30, dan A3 hari ke-40 (perbesaran 10 x10)
Gambar 11 Gambaran histologi gonad perlakuan B0 hari ke-0, B0 hari ke-10, B0 hari ke-20, B0 hari ke-30, dan B0 hari ke-40 (perbesaran 10 x10)
B0 D-0 B0 D-10 B0 D-20
B0 D-30 B0 D-40
A3 D-0 A3 D-10 A3 D-20
18
Gambar 12 Gambaran histologi gonad perlakuan B1 hari ke-0, B1 hari ke-10, B1 hari ke-20, B1 hari ke-30, dan B1 hari ke-40 (perbesaran 10 x10)
Gambar 13 Gambaran histologi gonad perlakuan B2 hari ke-0, B2 hari ke-10, B2 hari ke-20, B2 hari ke-30, dan B2 hari ke-40 (perbesaran 10 x10)
B1 D-0 B1 D-10 B1 D-20
B1 D-30 B1 D-40
B2 D-0 B2 D-10 B2 D-20
19
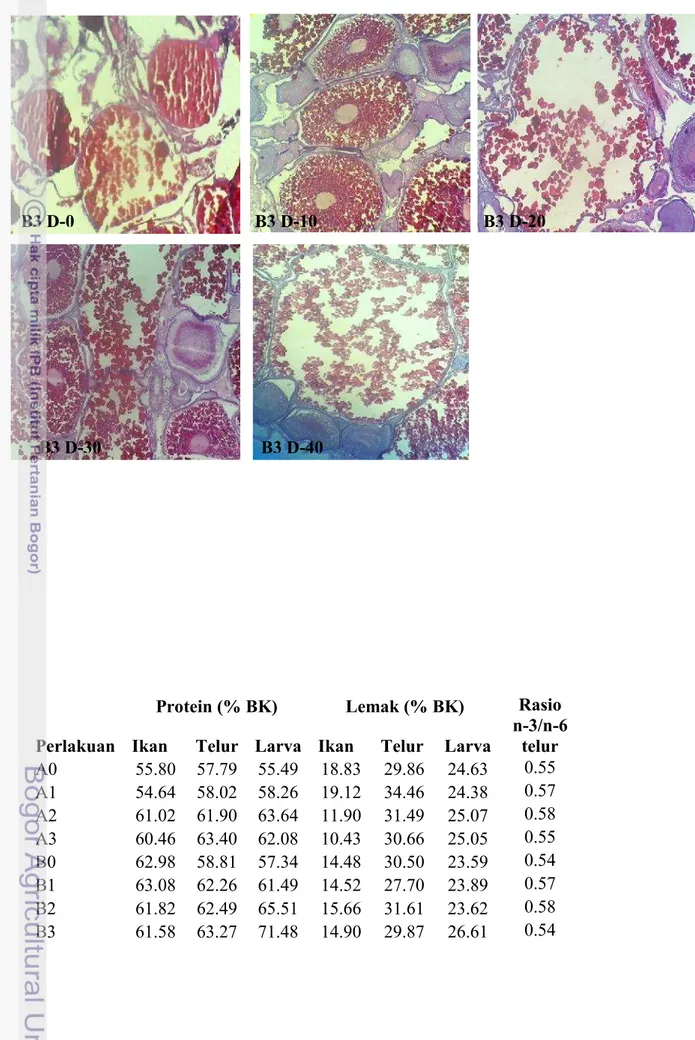
Gambar 14 Gambaran histologi gonad perlakuan B3 hari ke-0, B3 hari ke-10, B3 hari ke-20, B3 hari ke-30, dan B3 hari ke-40 (perbesaran 10 x10)
Parameter kimia (analisis proksimat)
Parameter kimia berupa analisis proksimat dilakukan terhadap induk di akhir pemeliharaan, telur dan larva hari ke-7. Hasil analisis proksimat tersaji pada Tabel 6.
Tabel 6 Hasil analisis proksimat ikan, telur, dan larva ikan yang diberi perlakuan dosis suplementasi pl nsis yang berbeda pada pakan dan dosis penyuntikan Oodev yang berbeda
Perlakuan
Protein (% BK) Lemak (% BK) Rasio n-3/n-6
telur Ikan Telur Larva Ikan Telur Larva
A0 55.80 57.79 55.49 18.83 29.86 24.63 0.55 A1 54.64 58.02 58.26 19.12 34.46 24.38 0.57 A2 61.02 61.90 63.64 11.90 31.49 25.07 0.58 A3 60.46 63.40 62.08 10.43 30.66 25.05 0.55 B0 62.98 58.81 57.34 14.48 30.50 23.59 0.54 B1 63.08 62.26 61.49 14.52 27.70 23.89 0.57 B2 61.82 62.49 65.51 15.66 31.61 23.62 0.58 B3 61.58 63.27 71.48 14.90 29.87 26.61 0.54
Nilai protein maupun lemak ikan, telur, maupun larva pada perlakuan suplementasi pl nsis 1%, 2%, dan 3% cenderung lebih tinggi dibandingkan dengan perlakuan yang tidak diberi penambahan nsis (0%).
B3 D-0 B3 D-10 B3 D-20
20
Pembahasan
Pertumbuhan ikan terbagi atas dua jenis, yaitu pertumbuhan tubuh (somatik) dan pertumbuhan organ reproduksi (gonad). Penelitian ini merupakan salah satu upaya untuk meningkatkan kuantitas dan kualitas pertumbuhan gonad ikan, yaitu dengan memberikan suplementasiruli pl nsis pada pakan dan penyuntikan Oodev yang mengandung hormon PMSG. Ikan yang dijadikan objek adalah ikan Nila.
Ikan Nila dipelihara selama 40 hari dan diamati kinerja reproduksinya. Berdasarkan Tabel 4 diperoleh hasil bahwa perlakuan penambahan pl nsis pada pakan mempengaruhi diameter telur (P<0.10). Diameter telur mengindikasikan jumlah energi yang tersimpan di dalam telur yang selanjutnya akan digunakan untuk perkembangan embrio. Suplementasi pl nsis berpengaruh karena mekanisme pengaturan ukuran telur ikan dalam gonad bergantung pada kecukupan nutrien yang tersedia. ruli mengandung asam lemak esensial yang mempengaruhi fluiditas membran yang selanjutnya akan mempengaruhi metabolisme sel melalui perubahan aktivitas enzim-enzim pada membran sel (Sargent t 2002).
Penambahan pl nsis pada pakan memperbaiki fluiditas membran sel sehingga vitelogenin dapat diserap dengan lebih baik sehingga ukuran maksimum diameter telur lebih tinggi. Namun demikian, meningkatnya status nutrisi pakan ternyata tidak selalu diiringi dengan peningkatan diameter telur. Diameter terkecil justru dihasilkan oleh ikan yang diberi pakan bersuplementasi 3%, baik itu yang tidak diberi hormon A3 (2.34±0.25 mm) maupun yang diberi hormon B3 (2.48±0.25 mm). Hal tersebut diduga terjadi karena pada perlakuan suplementasi 3% ini, fekunditas yang dihasilkan cenderung lebih tinggi dibandingkan dengan perlakuan lainnya (Tabel 4). Sehingga pada ukuran gonad yang sama, dengan jumlah telur yang lebih banyak, ukuran telur yang ada sudah tentu akan lebih kecil. Ukuran diameter telur dan fekunditas memiliki kaitan yang erat. Ikan betina dengan fekunditas yang besar cenderung memiliki ukuran telur yang relatif kecil (Blaxter 1988 dalam Mayasari 2012).
Fekunditas yang dihitung pada penelitian ini adalah jumlah telur yang dihasilkan oleh 200 g induk pada satu kali pemijahan (Tabel 4). Namun berdasarkan uji statistik, ternyata penambahan pl nsis pada pakan dan penyuntikan Oodev tidak memberikan pengaruh yang berbeda nyata terhadap fekunditas telur (P>0.10). Kamler (1992) menyatakan bahwa fekunditas memiliki hubungan yang lebih kuat dengan bobot tubuh dan diameter telur daripada dengan pakan yang dikonsumsi. Hewan yang diberi pakan dengan kualitas yang buruk memang akan menurun jumlah telurnya, namun ikan memiliki keistimewaan lain, dimana mereka mampu bereaksi terhadap defisiensi nutrien pakan sehingga fekunditasnya tetap terjaga. Penelitian-penelitian terdahulu seperti pada il m dan us hetelitus bahkan menunjukkan bahwa faktor yang mampu mempengaruhi fekunditas adalah suhu, semakin tinggi suhu maka fekunditas akan semakin meningkat.
21
penambahanpl nsis pada pakan tidak memberi pengaruh yang berbeda nyata. Telur yang dihasilkan oleh induk yang diberi penyuntikan Oodev menunjukkan derajat penetasan yang lebih tinggi yaitu mendekati 100%. Hal senada juga terlihat dari penelitian sebelumnya, Fitriliyani (2005) dan Mayasari (2012) melaporkan bahwa hormon PMSG menghasilkan derajat penetasan yang lebih tinggi dibandingkan perlakuan tanpa pemberian hormon pada ikan gabus dan ikan lele. Hormon PMSG mampu merangsang pertumbuhan sel interstisial ovarium, pertumbuhan, dan pematangan folikel. Hormon mampu memberi signal kepada organ target untuk bekerja optimum dalam memanfaatkan nutrien penting yang tersedia untuk meningkatkan perkembangan morfologi telur seperti pembentukan membran sehingga telur tidak rentan terhadap kerusakan dan derajat penetasan menjadi lebih baik.
Telur-telur yang telah menetas dilanjutkan pemeliharaannya hingga tujuh hari pasca penetasan untuk dihitung sintasan larva. Faktor yang memberi pengaruh nyata terhadap sintasan larva adalah penyuntikan Oodev (P<0.10), sedangkan dosis suplementasi pl ns is pada pakan tidak berpengaruh nyata (P>0.10) terhadap sintasan larva sampai dengan hari ketujuh. Kemudian tidak ditemui adanya interaksi antara plnsis dan hormon terhadap Sintasan larva. Semua perlakuan menunjukkan nilai sintasan yang cukup tinggi, yaitu lebih besar dari 70% (Tabel 4). Perlakuan yang diberikan kombinasi penambahanpl nsis 1%, 2%, 3% dan penyuntikan Oodev 10 IU/kg (B1, B2, B3) bahkan memberikan nilai sintasan lebih dari 90%. Hal ini membuktikan bahwa kombinasi hormon dan nutrisi ternyata memang mampu meningkatkan produksi pemijahan.
Selain parameter produksi, diamati pula frekwensi pemijahan yang terjadi dari setiap perlakuan. Berdasarkan Tabel 5, peningkatan dosis pl nsis pada pakan dan penyuntikan hormon meningkatkan jumlah ikan yang memijah dan frekwensi pemijahan. Pada perlakuan kontrol (A0), jumlah induk yang memijah dari total tujuh induk yang diamati adalah tiga ekor, dengan frekuensi pemijahan masing-masing induk adalah satu kali selama kurun waktu 40 hari. Pada perlakuan A1 (suplementasi plnsis 1%, Oodev 0 IU/kg), jumlah induk yang memijah tiga ekor namun ada satu induk yang frekweensi pemijahannya dua kali, yaitu pada hari ke-28 dan ke-38. Pada induk yang diberi perlakuan penyuntikan Oodev 10 IU/kg, jumlah yang memijah semakin bertambah. Untuk perlakuan B0 (suplementasi pl nsis 0%, penyuntikan Oodev 10 IU/kg), jumlah induk yang memijah sama dengan perlakuan A2 dan A3, yaitu 5 ekor. Sementara perlakuan kombinasi penambahan pl nsis pada pakan dan penyuntikan Oodev 10 IU/kg (B1, B2, B3) menghasilkan jumlah induk memijah yang lebih tinggi lagi, yaitu sebanyak 6 ekor dari total tujuh ekor ikan yang dipijahkan.
22
n-6) sebagai faktor nutrien yang paling menentukan keberhasilan reproduksi berperan dalam metabolisme, stereidogenesis, dan perbaikan kualitas telur.
Penambahan pl nsis pada pakan mengakibatkan peningkatan kandungan !"#$%& $' (y )ty * +i( (PUFA) yang mampu mengatur produksi ei
+"& % ",( terutama prostaglandin. Prostaglandin berperan dalam proses produksi seperti produksi hormon steroid dan perkembangan gonad. Ovarium ikan memiliki kapasitas yang besar dalam menghasilkan ei+"& % ",( yang diturunkan dari aktifitas +y+loxyge%& dan lip%&oxyge e . Produk dari aktifitas tersebut terkait dan terlibat dalam pematangan oosit (Asturiano 1999 dalam Izquierdo et
#2001).
Perlakuan tanpa suplementasi plensis dan diberi penyuntikan Oodev IU/kg (B0) menunjukkan jumlah pemijahan dan frekwensi yang tinggi pula. Hal ini disebabkan oleh FSH yang terkandung dalam Oodev merangsang pematangan gonad pada ikan nila. Penyuntikan hormon dari luar memberikan sinyal sehingga lapisan teka pada oosit akan mensintesa testosteron, selanjutnya diubah menjadi estradiol-17 yang akan merangsang hati mensintesis vitelogenin yang merupakan bakal kuning telur. Vitelogenin selanjutnya dibawa oleh aliran darah dan diserap oleh folikel oosit sampai mencapai ukuran maksimum, kemudian menunggu sinyal untuk pemijahan (Zairin 2003).
Kombinasi penambahan plensis 1%, 2%, 3% pada pakan dan penyuntikan Oodev 10 IU/kg (B1, B2, B3) ternyata memberikan hasil yang lebih baik lagi. Jumlah induk yang memijah bertambah banyak, yaitu sejumlah enam ekor dari total tujuh ekor yang diamati. Hal ini terjadi karena adanya gabungan fungsi dari dua faktor yang mendukung proses reproduksi, yaitu nutrisi dan endokrin. Sinyal yang diberikan akibat penyuntikan hormon didukung oleh status nutrisi induk yang baik dengan penambahanplensis pada pakan menciptakan hubungan yang sinergis. Apabila dilihat dari jumlah larva yang dihasilkan, kombinasi penambahan plensis pakan dan penyuntikan Oodev mampu meningkatkan produksi larva hingga mencapai 300% bila dibandingkan dengan kontrol (Tabel 5).
Selama pemeliharaan, bersamaan dengan waktu sampling juga dilakukan penimbangan gonad dan hati terhadap ikan untuk mengetahui -"%( "somi+ i
23
Nilai HSI justru berbanding terbalik dengan nilai GSI, hal ini ditunjukkan oleh Gambar 6. Apabila nilai GSI tinggi maka nilai HSI menunjukkan angka yang rendah begitu pula sebaliknya. Hal ini menunjukkan bahwa proses vitellogenesis atau sintesis vitelogenin dilakukan di hati dan disalurkan ke dalam gonad ikan. Ketika nilai GSI memuncak, nilai HSI cenderung rendah karena sebagian besar vitelin telah disalurkan ke gonad hingga mencapai ukuran maksimal. Sebaliknya ketika gonad ikan telah matang dan terjadi ovulasi (GSI menurun), hati melakukan proses vitelogenesis kembali yang ditunjukkan dengan nilai HSI yang mengalami peningkatan untuk persiapan kematangan selanjutnya. Hal ini diperkuat pula oleh gambaran jaringan pada gonad (Gambar 7- Gambar 14). Pada hari ke-10, ke-30 dan ke-40, hampir di semua perlakuan menunjukkan adanya telur yang telah matang dan siap untuk diovulasikan namun dengan proporsi yang berbeda. Bila dibandingkan antar gambar histologi, perlakuan A1, A2, A3, B0, B1, B2, B3 (Gambar 8-Gambar 14) menunjukkan proporsi sel telur berukuran maksimal yang lebih banyak dibandingkan dengan kontrol A0 (Gambar 7). Hal tersebut mengindikasikan bahwa perlakuan penambahan 23 pl456nsis pada pakan dan penyuntikan Oodev mampu mempercepat perkembangan sel telur dan kematangan gonad.
Berdasarkan hasil analisis kimia pada induk, telur, dan larva (Tabel 6) kualitas protein telur yang terbaik diperoleh oleh telur yang diberi suplementasi23
78456nsis 3%. Demikian juga halnya dengan larva, secara umum, meningkatnya dosis suplementasi cenderung meningkatkan kandungan protein. Untuk kadar lemak, menunjukkan nilai yang fluktuatif. Namun demikian, dari Tabel 6 ini jelas terlihat bahwa pada proses reproduksi, nutrien terpenting yang dibutuhkan adalah lemak. Selisih antara kadar lemak telur dan kadar lemak larva mencapai 4-10%, sementara selisih protein telur dan larva hanya berkisar 3%. Hal ini memperjelas bahwa pada proses embriogenesis, sumber energi dan nutrien utama yang dimanfaatkan adalah berasal dari lemak. Selain itu, komposisi nutrien ikan, telur, dan larva pada perlakuan dengan frekwensi pemijahan yang tinggi ( 6 kali) yaitu A2, A3, B0, B1, B2, dan B3 tidak jauh berbeda dengan perlakuan A0 dan A1 (3-4 kali pemijahan). Hasil tersebut menunjukkan bahwa meskipun lebih sering memijah, kualitas kimia hasil pemijahan ikan Nila tidak mengalami penurunan.
SIMPULAN DAN SARAN
Simpulan
24
Saran
Kinerja reproduksi ikan Nila dapat ditingkatkan dengan cara kombinasi penambahan 9:;ruli<= pl=> ?nsis pada pakan dan penyuntikan Oodev. Kemudian perlu dilakukan penelitian lebih lanjut mengenai pengaruh dosis suplementasi 9@
p l
=>?nsis dan Oodev yang lebih tinggi serta kombinasi antara keduanya terhadap kinerja reproduksi ikan.
Daftar Pustaka
Angka SL, Suhartono MT. 2000. A ;ot?knolBC; D =E ;l FD=E;l G=H>. Bogor (ID): Pusat Kajian Sumberdaya Pesisir dan Lautan, Institut Pertanian Bogor. Bagenal TB. 1969. Relationship between egg size and fry survival in Brown Trout
(Salmo truta L).I@J;sh @A ;ol . 1: 349-353.
Bolamba D, Matton P, Estrada R, Dufour JJ. 1992. Effect of Pregnant Mare Serum Gonadotropin on follicular population and ovulation rates in prepubertal gilts with two morphologically different ovarium types. I@
K<;m@9Li@70: 1916-1992.
Boyd CE. 1990. M=>er NH =Oity inP B<QE for KRH =Lulture . Birmingham (AL): Birmingham Publishing Co.
Dadzie S, Wangila BCC. 1980. Reproductive biology, length-weight relationship and relative condition of pond raisedSil=:;=zilli (gervais).I@J; ET@A ;ol . 17: 295-306.
Darwisito S. 2006. Kinerja reproduksi ikan nila UreBLhromis nilotiLus yang mendapat tambahan minyak ikan dan vitamin E dalam pakan yang dipelihara pada salinitas media berbeda [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Effendie MI. 1997. VetBQ= A ;ologi P ?rik=<=< . Bogor (ID): Penerbit Yayasan Dewi Sri.
Gomez-Marquez JL, Mendoza BP, Urgate IHS, Arroyo MG. 2003. Reproductive aspect ofUreBLhromis nilotiLus (perciformes : cichlidae) at Coatetelco leke, Morelos, Mexico.W ?v@Aiol@Srop . 51: 221-228.
Fitriliyani I. 2005. Pembesaran larva ikan gabus XT=<<= stri=> = dan efektifitas induksi hormon gonadotropin untuk pemijahan induk [tesis]. Bogor (ID): Institut Pertanian Bogor
Harvey B, Carolsfeld J. 1993.Y<QH LeQAZeeQ;ng inSL=Oroip J;shXulture . Ottawa (CA): International Development Research Centre.
Izquierdo MS, Ferna´ndez-Palacios H, Tacon AGJ. 2001. Effect of broodstock nutrition on reproductive performance of fish.KRH =Lulture 197: 25 42. James R, Vasudhevan I, Sampath K. 2009. Interaction of Spirulina with Different
Levels of Vitamin E on Growth, Reproduction, and Coloration in Goldfish (X=Z =E E ;us =HZ=>us ).YEZ=?li I @KRH =L. 61(4): 330-338.
Lagler KF, Bordach JE, Miller RR, Passino DRM. 1977. YLhthyology . New York (US): John Willey & Sons Inc.
25
Mayasari N. 2012. Pemacuan kematangan gonad ikan Lele dumbo [l\ri\] sp. betina dengan kombinasi hormon PMSG dan Spirulina [tesis]. Bogor (ID): Institut Pertanian Bogor
Meng-Umphan K. 2009. Growth performance, sex hormone levels and maturation ability of pla poa (^ \_`\] aus bcdourtie fed with Spirulina supplementary pellet and hormone application.fntghgi` jad gkaol . 11: 458 462.
Sargent JR, Tocher DR, Bell JG. 2002.lashmutrition gEd ke-3. Halver JE, Hardy RW, editor. New York (US) : Academic Press.
Takeuchi T. 1988.n\bc j \oory work [hemid \p Ev\p q\oion of riet\js mutrien ts, in : Watanabe T. l ashmutrition \_ t u\ja dulture . Tokyo (JP): Tokyo University of Fisheries.
Thomas P, Rahman MS. 2009. Biomarker of hypoxia exposure and reproductive function in Atlantic croaker : A review with some preliminary findings from northern gulf of Mexico hypoxic zone. hc qj_ \l of Exp\periment u\jane
kaology \_ tvdology g381: S38-S50.
Woynarovich E, Hovart L. 1980. The artificial propagation of warm water finfish. FAO Fisheries Technical Paper No. 201. FIR/T 201.
Zairin M. 2003. Endokrinologi dan perannya bagi masa depan perikanan Indonesia. Orasi ilmiah guru besar tetap Ilmu Fisiologi Reproduksi dan Endokrinologi Hewan Air. Bogor (ID): Institut Pertanian Bogor
26
Lampiran 1 Prosedur analisis proksimat
Prosedur analisis kadar air
Kadar air = (X1+ A) X2 x 100%
A
Prosedur analisis kadar abu
Kadar abu = (X2 X1) x 100%
A
Prosedur analisis kadar protein
1. Tahap oksidasi
Panaskan cawan pada suhu 105-110OC selama 1 jam, dinginkan dalam desikator dan timbang(X1)
Timbang bahan 2-3 gram(A)
lalu masukkan ke dalam cawan
Cawan dan bahan dipanaskan selama 4 jam pada suhu 105-110OC, dinginkan dan timbang(X2)
Panaskan cawan pada suhu 105-110OC selama 1 jam, dinginkan dalam desikator dan timbang(X1)
Timbang bahan 2-3 gram(A)
lalu masukkan ke dalam cawan
Cawan dan bahan dipanaskan di dalam tanur dengan suhu 600OC, dinginkan dan timbang(X2)
Timbang bahan 0,5 gram(A) Timbang katalis 3 gram H2SO4pekat 10 ml
27
2. Tahap destruksi
3. Tahap titrasi
Kadar protein = 0,0007 x 6,25 x ( BLANKO SAMPLE) x 20 x 100%
A
Prosedur analisis kadar lemak
Masukkan 5 ml larutan hasil oksidasi ke dalam labu destilasi
10 ml H2SO40,05 N 2-3 tetes indikator Phenolpthalein
Masukkan ke dalam erlenmeyer 250 ml
Destruksi selama 10 menit dari tetesan pertama
BLANKO
SAMPLE
Titrasi hasil destruksi dengan NaOH 0,05 N
Tirasi hingga 1 tetes setelah larutan menjadi bening
Catat ml titran( )
Panaskan labu pada suhu 104-110OC selama 1 jam, dinginkan dalam desikator dan timbang(X1)
Timbang bahan 2-3 gram(A)
lalu masukkan ke dalam selongsong
Panaskan labu di atasyz{pl|{} hingga larutan perendam selongsong dalam Sochlet berwarna bening
Masukkan ke dalam tabung Sochlet dan beri 100-150 ml N-Hexan hingga selongsong terendam. Sisa N-Hexan dimasukkan ke dalam labu
28
Kadar Lemak = (X2 X1) x 100%
A
Prosedur analisis kadar serat kasar
Kadar serat kasar = (X2 X3 X1) x 100%
A
Timbang bahan 0,5 gram(A)
lalu masukkan ke dalam erlenmeyer 250 ml
Tambahkan 50 ml H2SO40,3 N
lalu panaskan di atas~pl
Setelah 30 menit tambahkan 25 ml NaOH 1,5 N lalu panaskan kembali selama 30 menit
Pasang kertas saring pada labu Buchner yang telah terhubung denganvumm pump
Panaskan kertas saring dalam oven, dinginkan, dan timbang(X1)
Lakukan penyaringan larutan bahan dengan pembilasan secara berurutan sebagai berikut :
1. 50 ml air panas 2. 50 ml H2SO40,3 N
3. 50 ml air panas 4. 25 ml Aceton
Masukkan kertas saring hasil penyaringan ke dalam cawan porselin
Panaskan cawan porselin pada suhu 105-110oC selama
1 jam lalu dinginkan
Panaskan pada suhu 105-110oC selama 1 jam, dinginkan, dan timbang(X2)
29
Lampiran 2 Hasil pengukuran kualitas air selama pemeliharaan ikan Nila
Kolam Suhu (⁰C) pH DO(mg/L) TAN(mg/L)
1 27-30 6.03-6.77 4.29-5.53 0.02-0.04 2 27.5-29.5 6.01-6.76 4.26-5.56 0.02-0.06 3 27-30 6.07-6.79 4.24-5.34 0.01-0.04 4 26.6-29 6.00-6.72 4.28-5.30 0.03-0.04
Literatur 25 30oC (Boyd 1990)
6.5-9
(Boyd, 1990)
>3 mg/L (Boyd, 1990)
30
Lampiran 3 Uji Kruskal-Wallis diameter telur, fekunditas, derajat tetas telur, dan sintasan larva
31
Test Statisticsb,c
Diameter Telur
Chi-Square .013
Df 1
Asymp. Sig. .908
Monte Carlo Sig.
Sig. .918a
99% Confidence Interval
Lower
Bound .911
Upper
Bound .925
a. Based on 10000 sampled tables with starting seed 299883525.
b. Kruskal Wallis Test
32
Ranks
Perla
kuan N
Mean Rank
Diameter 1 3 8.00
2 3 13.00
3 3 20.17
4 3 9.00
5 3 17.50
6 3 19.00
7 3 5.00
8 3 8.33
Total 24
Test Statisticsb,c
Diameter
Chi-Square 13.949
Df 7
Asymp. Sig. .052
Monte Carlo Sig.
Sig. .020a
99% Confidence Interval
Lower
Bound .017
Upper
Bound .024
a. Based on 10000 sampled tables with starting seed 2000000.
b. Kruskal Wallis Test
33
34
Test Statisticsb,c
Derajat Tetas Telur
Chi-Square 6.870
Df 1
Asymp. Sig. .009
Monte Carlo Sig.
Sig. .008a
99% Confidence Interval
Lower
Bound .006
Upper
Bound .011
a. Based on 10000 sampled tables with starting seed 299883525.
b. Kruskal Wallis Test
c. Grouping Variable: Dosis Hormon
Ranks
Spirul ina dan Horm
on N
Mean Rank
DTT 1 5 10.90
2 5 28.00
3 5 15.40
4 5 28.00
5 5 19.00
6 5 20.60
7 5 19.90
8 5 22.20