ABSTRAK
FIRDAUS. Shigella, Leukosit, dan Hematokrit dari Penderita Diare di Puskesmas Cangkurawok, Dramaga, Bogor. Dibimbing oleh SRI BUDIARTI POERWANTO dan TRI HERU WIDARTO.
Diare merupakan salah satu penyakit penyebab kematian balita dan anak-anak. Pada tahun 2008 di indonesia terjadinya KLB (Kejadian Luar Biasa) diare di 15 provinsi (penderita sebanyak 8.433 orang dan jumlah kematian 209 orang). Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi bakteri Shigella, melihat jumlah dan deferensiasi leukosit, dan kadar hematokrit pada penderita diare. Sebanyak 100 sampel tinja. berhasil diisolasi dari penderita diare di puskesmas Cangkurawok dengan metode rectal swab pada media Salmonella Shigella Agar (SSA) dan pengambilan darah dengan metode mikrohematokrit. Identifikasi dengan beberapa uji biokimia, yaitu uji MR-VP, Uji Urea, Uji H2S pada TSIA, uji fermentasi karbohidrat, uji indol, dan uji sitrat Sepeluh dari bakteri yang diduga Shigella, hanya tujuh sampel yang berhasil menunjukkan bakteri Shigella.Ketujuh sampel tersebut kadar hematokritnya normal, satu sample menunjukkan jumlah leukosit yang tinggi dengan persentase limfosit yang tinggi dan neutofil yang rendah.
ABSTRACT
FIRDAUS. Shigella, Leucocytes, and Hematocrit from Diarrheal Patient in Cangkurawok Healt Center, Dramaga, Bogor. Under direction of SRI BUDIARTI POERWANTO dan TRI HERU WIDARTO.
1
PENDAHULUAN
Latar Belakang
Diare merupakan salah satu penyakit penyebab nomor dua kematian balita dan anak-anak di seluruh dunia (WHO 2010). Dari data profil kesehatan Indonesia tahun 2009 penderita diare pada tahun 2003-2008 mengalami peningkatan, kecuali ditahun 2007. Pada tahun 2006 penderita diare sebesar 10.980 orang menurun menjadi 3.661 orang pada tahun 2007, pada tahun 2008 dilaporkan terjadinya KLB (Kejadian Luar Biasa) diare di 15 provinsi dengan penderita sebanyak 8.433 orang dan jumlah kematian 209 orang (DEPKES 2009). Dengan semakin meningkatnya penderita diare di Indonesia (terutama di Bogor) dari tahun ke tahun dan masih lemahnya data mikrobiologi penderita diare terutama yang disebabkan oleh Shigella (Shigellosis), maka dilakukan penelitian ini
Diare adalah buang air besar dengan tinja cair atau setengah cair yang mengandung tinja biasanya 200 g atau 200ml setiap 24 jam, lebih dari 3 kali per hari dengan atau tanpa lendir dan darah. Diare ada yang menyebabkan infeksi dan non infeksi (Adisasmito 2007).
Penyebab diare diantaranya karena kontaminasi makanan, air, dan sanitasi lingkungan (Adisasmito 2007). Diare infeksi dapat disebabkan oleh bakteri, virus atau parasit. Salah satu bakteri yang menyebabkan diare adalah Shigella sp. Berdasarkan hasil penelitian pada tahun 2003 di Brazil ditemukan 53,40% kasus (141 dari 260 pasien) (Santoso et al. 2005), di Mesir pada tahun 1993 sebanyak 30% (258 dari 6278 pasien) (Wasfy et al. 2000), dan berdasarkan penelitian Jiang et al. (2002) kasus diare akibat Shigella di India, Kenya, dan Jamaika hanya sekitar 10%, 9%, dan 0,3%.
Shigella merupakan bakteri gram negatif, tidak motil, dan bersifat fakultatif anaerob. Koloni Shigella berbentuk basil (bulat), transparan dengan pinggiran utuh, mencapai diameter kira-kira 2 mm dalam 24 jam. Bakteri ini tidak meragikan laktosa tetapi meragikan karbohidrat dan glukosa. Menghasilkan asam tetapi tidak menghasilkan gelembung (Jawets et al.
1986). Shigella adalah anggota dari enterobakteri yang memiliki hubungan dekat dengan genus Eschericia. Genus Shigella
memiliki 4 spesies, yaitu Shigella dysentriae, Shigella flexneri, Shigella boydii,
Shigella sonnei. Semua spesies Shigella
tidak dapat menghasilkan hydrogen sulfida dan kebanyakan Shigella menghasilkan katalase (Greenwood et al. 1992).
Shigella menyebabkan disentri basiler. (Shigellosis), karena reaksi inflamasi oleh Shigella yang menyerang usus. Penyakit ini ditularkan melalui makanan atau air, fases, dan lalat (Willey et al. 2009). Shigellosis biasanya ditandai oleh suhu tubuh yang panas, rasa sakit pada perut, fases biasanya berlendir dan berdarah (Echeverria et al 1991). Shigella pertama kali menyerang sel mukosa pada sel epitel di saluran pencernaan. Di dalam sel Shigella
memperbanyak diri kemudian menginvasi sel epitel lainnya dan menyerang sistem kekebalan tubuh. Selanjutnya terbentuk abses. (Tortora et al 2007). Adanya reaksi invasi disebabkan racun shiga yang dikeluarkan Shigella (Sur et al. 2004).
Diare yang menyebabkan infeksi meningkatkan sel darah putih (leukosit). Leukosit berperan membantu melawan infeksi di dalam tubuh. Di dalam darah manusia normal jumlah rata-rata leukosit adalah 4.300-10.800 sel/mm3. Leukosit ada yang bergranula dan tidak bergranula. Leukosit bergranul terdiri atas neutrofil (kadar normal 54-62%), basofil (kadar normal kurang dari 1%), dan eosinofil (kadar normal 1-3 %). Leukosit yang tidak bergranul adalah limfosit yang kadarnya 25-33% dan monosit yang kadarnya hanya 3-9% (Fox 2004). Diare juga dapat menyebabkan penderita menjadi dehidrasi. Dehidrasi dapat dilihat dari kadar hematokrit. Kadar hematokrit digunakan untuk melihat perbandingan kadar air dan komponen sel darah dalam darah. Kadar hematokrit normal untuk pria adalah 45%-52%, wanita 37%-48%, sedangkan kadar hematokrit normal untuk anak-anak dan balita 29%-41% (Fox 2004).
Tujuan
2
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Februari sampai bulan Oktober 2010 di Puskesmas Cangkurawok, Laboratorium Mikrobiologi, dan Laboratorium Biosistematika dan Ekologi Hewan, Departermen Biologi, FMIPA, IPB, Bogor.
BAHAN DAN METODE
Pengambilan sampel
Pengambilan sampel dilakukan di puskesmas Cangkurawok dengan metode usap rektum (rectal swab) dengan menggunakan cotton but steril untuk mendapatkan tinja, kemudian disimpan di botol spot yang berisi PBS steril 2ml (Adkins & Santiago 1987). Pengambilan darah dilakukan dengan metode mikrohematokrit. Pertama jari pasien dibersihkan dengan alkohol 70%, kemudian dijepit dengan lanset steril, setelah itu darah dimasukkan ke hematokrit berheparin (Mariendfeld) dan disimpan di atas lilin (Dalimonthe 2002). Pengambilan sampel dilakukan sesuai etika dan prosedur yang sesuai, serta mendapatkan izin dari pasien. Kerja nyata ini dilengkapi dengan surat izin yang tersaji pada Lampiran 1.
Isolasi bakteri
Hasil fases yang didapat diambil sebanyak 0,1 ml denagn pipet volumetrik 1 ml kemudian disebar dengan batang penyebar steril di media Salmonella Shigella Agar (SSA/Criteroin), setelah itu dinkubasi dengan inkubator (K Gemmy Co model IN-010 seri 502050) selama 24-48 jam pada suhu 350 C, hingga diperoleh koloni yang berwarna bening (Shigella), selanjutnya koloni tersebut dipindahkan ke SSA cawan kuadran. Hasil goresan tersebut diinkubasi kembali selama 24-48 jam pada suhu 350 C. Jika diperoleh kembali koloni tunggal berwarna bening maka digoreskan ke Nutrient Agar (NA/ Criteroin) miring (pada tabung reaksi) dan SSA miring (sebagai penyimpanan).
Identifikasi Shigella
Identifikasi dilakukan dengan pewarnaan gram dan uji fisiologis. Satu lup akuades steril diletakkan di atas kaca objek yang sudah diberi tanda lingkaran, kemudian sedikit biakan dipindahkan dengan lup inokulasi dari agar miring SSA ke atas tetesan air pada kaca objek. Hasil tersebut dicampurkan dan disebarkan hingga rata. Olesan bakteri kemudian dibiarkan kering
udara, setelah itu difiksasi dengan dilalui kaca objek tersebut beberapa kali di atas api bunsen. Selanjutnya olesan bakteri yang telah kering diwarnai dengan pewarna ungu kristal selama 1 menit, kelebihan warna dibilas dengan akuades. Dilanjutkan dengan pewarna iodium selama 2 menit kelebihan warna dibilas dengan akuades. Kemudian dilakuan pemucatan warna dengan alkohol 95% dan dibilas lagi dengan akuades. Setelah itu olesan diwarnai dengan safranin selama 30 detik, dibilas dengan akuades dan sisa-sisa air diserap dengan kertas serap hingga kering, lalu diamati dibawah mikroskop dengan perbesaran 1000 X (Tortora et al. 2007). Adapun uji-uji fisiologis yang dilakukan untuk mengetahui adanya bakteri Shigella (Madigan et al.
2009) meliputi:
1. Uji MR-VP (Metil Red-Voges Proskauer) Biakan Shigella yang telah disimpan pada media SSA miring, masing-masing dipindahkan ke MR-VP (DifcoTm) broth
sebanyak satu lup. Setelah itu diinkubasi selama 4 hari dengan suhu 370 C. Setelah empat hari biakan untuk MR ditetesi 3-4 indikator merah metil. Sedangkan biakan VP ditetesi 10 tetes reagen barrit dan 10 tetes larutan KOH. Hasil positif kedua uji ini ditunjukkan dengan medium yang berwarna merah, sedangkan hasil negatif ditunjukkan dengan medium yang berwarna kuning.
2. Uji Urea
Koloni yang diduga Shigella diinokulasi dari SSA miring ke medium kaldu urea (DifcoTm). Kemudian diinkubasi selama 4 hari dengan suhu 370 C. Hasil positif ditunjukkan dengan medium berwarna merah keunguan, sedangkan hasil negatif ditunjukkan dengan medium berwarna merah.
3. Uji H2S pada Triple Sugar Iron Agar
(TSIA)
Koloni yang diduga Shigella digoreskan dari media SSA miring ke medium TSIA (DifcoTm) miring dan ditusukkan ke bagian bawah medium. Setelah itu diinkubasi selama satu hari dengan suhu 370 C. Hasil positif ditunjukkan dengan bagian dasar media berwarna hitam,, sedangakan hasil negatif sebaliknya.
4. Uji Fermentasi Karbohidrat
3
tabung reaksi dengan tabung durham yang diletakkan terbalik. Kemudian biakan dinkubasi selama satu hari dengan suhu 370 C. Hasil positif ditunjukkan dengan dengan medium yang berwarna kuning, sedangkan hasil negatif ditunjukkan dengan medium berwarna hijau.
5. Uji Indol
Sebanyak satu lup bakteri yang diduga
Shigella dipindahkan dari medium SSA ke Tripton broth (BactoTm). Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Setelah itu ditetesi dengan reagen kovac
sebanyak 10-12 tetes. Hasil positif ditunjukkan dengan terbentuknya cincin merah pada medium, sedangkan hasil negatif ditunjukkan dengan terbentuknya cincin kuning pada medium.
6. Uji Sitrat
Koloni yang diduga Shigella digores dari medium SSA ke agar miring simon sitrat (Acumedia) sebanyak satu lup. Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Hasil positif ditunjukkan dengan agar yang berwarna biru, sedangkan hasil negatif ditunjukkan dengan agar yang berwarna hijau.
Identifikasi hematokrit dan leukosit
Darah yang disimpan di hematokrit berheparin disentrifugasi dengan sentrifugasi P selecta ISO 9001 ± 12.000 rpm selama 5 menit, kemudian dihitung persen kadar hematokritnya. Setelah itu darah dikeluarkan dengan bantuan jarum dan diletakkan di efendorf, kemudian setetes darah diambil untuk awetan preparat dengan metode deferensial dan sisa darah pada tabung diambil dengan menggunakan pipet leukosit sampai batas ± 0,5. Kemudian dicampur dengan larutan turk sampai batas 11. Setelah itu larutan dikocok membentuk angka 8 (sekitar 12 kali). Larutan ini kemudian diteteskan pada hemasitometer, ditutup dengan kaca penutup dan terakhir diamati dibawah mikroskop dengan perbesaran 10x10 (Simons 1976)
Metode deferensiasi dilakukan dengan mengulas darah pada kaca preparat, setelah darah kering difiksasi dengan methanol 70% selama 2-3 menit, kemudian dikeringkan kembali dan diwarnai dengan giemsa selama 20 menit, diangkat dan dikering udarakan, dan terakhir diamati di mikroskop dengan perbesaran 10x10 (Dalimonthe 2002)
HASIL
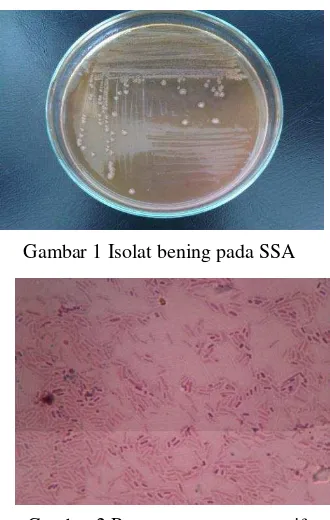
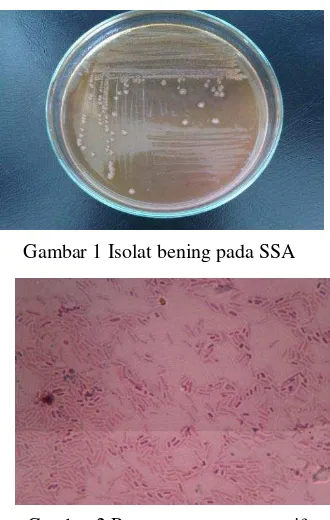
Sampel penderita diare berjumlah 100, yang terdiri dari 13 orang bayi (0-1 tahun) ), 2 orang batita (1-3 tahun), 13 orang balita (3-5 tahun), 13 orang anak-anak (5-18 tahun), dan 13 orang dewasa (>18 tahun) berhasil diisolasi. Data lengkap 100 sampel disajikan pada Lampiran 2. Sepuluh sampel menunjukkan koloni yang berwarna bening pada SSA yang diduga bakteri Shigella
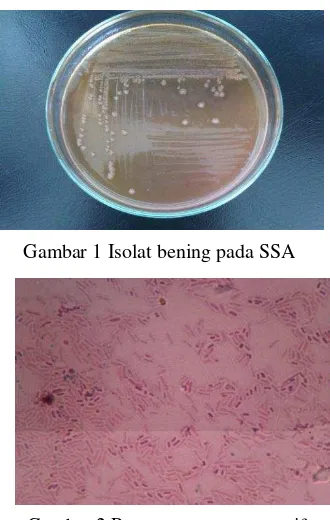
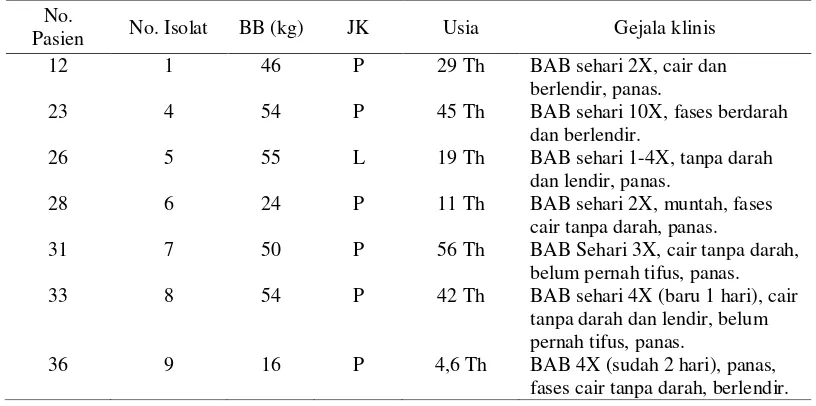
(Gambar 1), dan kesepuluh sampel tersebut juga menunjukkan ciri gram negatif yang menghasilkan warna merah muda (Gambar 2).
Uji biokimia berhasil dilakukan terhadap sepuluh sampek yang diduga Shigella. Dua sampel menunjukkan hasik yang positif pada uji MR (isolat no. 2 dan 4), uji sitrat (isolat no. 1 dan 3), dan uji indol (isolat no. 2 dan 4). Pada uji urea dan H2S (TSIA). Kesepuluh sampel tersebut menunjukkan hasil negatif, tetapi pada uji fermentasi glukosa ke sepuluh sampel tersebut menunjukkan hasil sebaliknya (Tabel 1).
Hasil uji biokimia diperoleh tujuh sampel yang menunjukkkan Shigella. Satu dari tujuh sampel yang terinfeksi Shigella mengalami diare berlendir dan berdarah yaitu pafa pasien no. 23. Semua pasien yang terinfeksi
Shigella mengalami panas pada suhu tubuhnya kecuali pada pasien no. 23. (Tabel 2).
Gambar 1 Isolat bening pada SSA
3
tabung reaksi dengan tabung durham yang diletakkan terbalik. Kemudian biakan dinkubasi selama satu hari dengan suhu 370 C. Hasil positif ditunjukkan dengan dengan medium yang berwarna kuning, sedangkan hasil negatif ditunjukkan dengan medium berwarna hijau.
5. Uji Indol
Sebanyak satu lup bakteri yang diduga
Shigella dipindahkan dari medium SSA ke Tripton broth (BactoTm). Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Setelah itu ditetesi dengan reagen kovac
sebanyak 10-12 tetes. Hasil positif ditunjukkan dengan terbentuknya cincin merah pada medium, sedangkan hasil negatif ditunjukkan dengan terbentuknya cincin kuning pada medium.
6. Uji Sitrat
Koloni yang diduga Shigella digores dari medium SSA ke agar miring simon sitrat (Acumedia) sebanyak satu lup. Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Hasil positif ditunjukkan dengan agar yang berwarna biru, sedangkan hasil negatif ditunjukkan dengan agar yang berwarna hijau.
Identifikasi hematokrit dan leukosit
Darah yang disimpan di hematokrit berheparin disentrifugasi dengan sentrifugasi P selecta ISO 9001 ± 12.000 rpm selama 5 menit, kemudian dihitung persen kadar hematokritnya. Setelah itu darah dikeluarkan dengan bantuan jarum dan diletakkan di efendorf, kemudian setetes darah diambil untuk awetan preparat dengan metode deferensial dan sisa darah pada tabung diambil dengan menggunakan pipet leukosit sampai batas ± 0,5. Kemudian dicampur dengan larutan turk sampai batas 11. Setelah itu larutan dikocok membentuk angka 8 (sekitar 12 kali). Larutan ini kemudian diteteskan pada hemasitometer, ditutup dengan kaca penutup dan terakhir diamati dibawah mikroskop dengan perbesaran 10x10 (Simons 1976)
Metode deferensiasi dilakukan dengan mengulas darah pada kaca preparat, setelah darah kering difiksasi dengan methanol 70% selama 2-3 menit, kemudian dikeringkan kembali dan diwarnai dengan giemsa selama 20 menit, diangkat dan dikering udarakan, dan terakhir diamati di mikroskop dengan perbesaran 10x10 (Dalimonthe 2002)
HASIL
Sampel penderita diare berjumlah 100, yang terdiri dari 13 orang bayi (0-1 tahun) ), 2 orang batita (1-3 tahun), 13 orang balita (3-5 tahun), 13 orang anak-anak (5-18 tahun), dan 13 orang dewasa (>18 tahun) berhasil diisolasi. Data lengkap 100 sampel disajikan pada Lampiran 2. Sepuluh sampel menunjukkan koloni yang berwarna bening pada SSA yang diduga bakteri Shigella
(Gambar 1), dan kesepuluh sampel tersebut juga menunjukkan ciri gram negatif yang menghasilkan warna merah muda (Gambar 2).
Uji biokimia berhasil dilakukan terhadap sepuluh sampek yang diduga Shigella. Dua sampel menunjukkan hasik yang positif pada uji MR (isolat no. 2 dan 4), uji sitrat (isolat no. 1 dan 3), dan uji indol (isolat no. 2 dan 4). Pada uji urea dan H2S (TSIA). Kesepuluh sampel tersebut menunjukkan hasil negatif, tetapi pada uji fermentasi glukosa ke sepuluh sampel tersebut menunjukkan hasil sebaliknya (Tabel 1).
Hasil uji biokimia diperoleh tujuh sampel yang menunjukkkan Shigella. Satu dari tujuh sampel yang terinfeksi Shigella mengalami diare berlendir dan berdarah yaitu pafa pasien no. 23. Semua pasien yang terinfeksi
Shigella mengalami panas pada suhu tubuhnya kecuali pada pasien no. 23. (Tabel 2).
Gambar 1 Isolat bening pada SSA
4
Tabel 1 Hasil uji biokimia isolat bening pada SSA
Keterangan: *Bukan Shigella +: reaksi positif - : reaksi negatif
MR : Metil Red VP:Voges-Prouskauer H2S: Hidrogen Sulfida
Tabel 2 Kondisi pasien yang terinfeksi Shigella
* JK: Jenis Kelamin; P: Perempuan ; L: Laki-laki ** Usia: Th: Tahun
*** Gejala klinis: BAB: Buang Air Besar
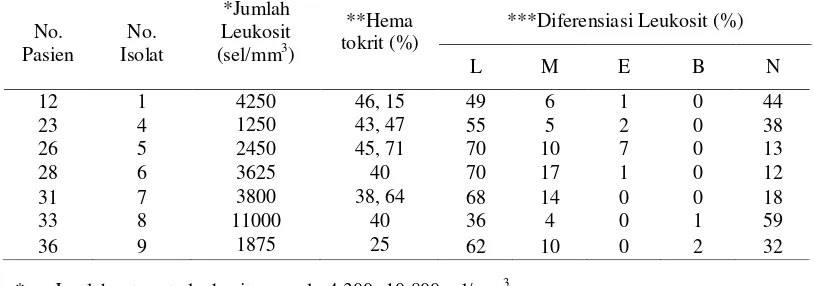
Jumlah leukosit tujuh pasien penderita diare akibat Shigella menunjukkan hasil yang bervariasi. Enam dari tujuh pasien mengalami penurunan jumlah leukosit (leukopenia). Kadar hematokrit pada tujuh isolat penderita diare karena Shigella
menunjukkan kadar hematokrit normal. Diferensiasi leukosit pada tujuh pasien terinfeksi Shigella bervariasi. Persentase
limfosit ke tujuh pasien tersebut meningkat, empat dari tujuh pasien persentase monositnya meningkat. Dua pasien persentase basofilnya meningkat yaitu pada isolat no. 8 dan 9. Satu dari tujuh pasien persentase eosinofil meningkat, sedangkan persentase neutrofil pada ke tujuh sampel terinfeksi Shigella mengalami penurunan ( Tabel 3).
No
Pasien No.Isolat
Uji MR
Uji VP
Uji Urea
Uji
H2S Uji Sitrat
Uji Indol
Uji Fermentasi
Glukosa
12 1 + - - - + - +
*13 2 - - - + +
*14 3 - - - - + - +
23 4 + - - - - + +
26 5 - + - - + - +
28 6 - + - - + - +
31 7 - + - - + - +
33 8 - + - - + - +
36 9 - + - - + - +
*53 10 - - - - + - +
No.
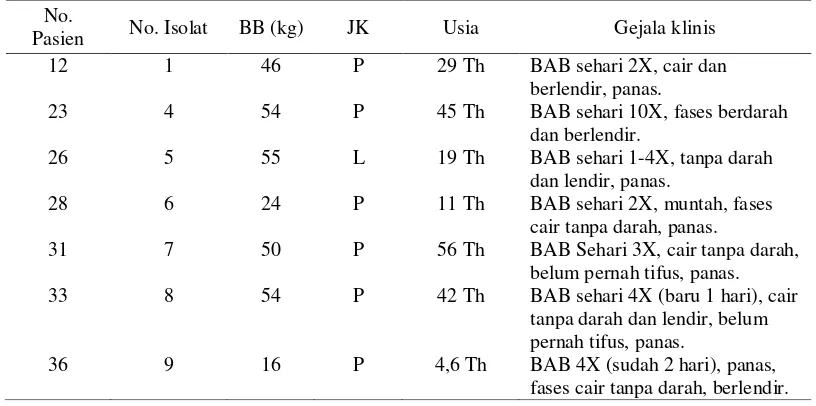
Pasien No. Isolat BB (kg) JK Usia Gejala klinis 12 1 46 P 29 Th BAB sehari 2X, cair dan
berlendir, panas.
23 4 54 P 45 Th BAB sehari 10X, fases berdarah dan berlendir.
26 5 55 L 19 Th BAB sehari 1-4X, tanpa darah dan lendir, panas.
28 6 24 P 11 Th BAB sehari 2X, muntah, fases cair tanpa darah, panas.
31 7 50 P 56 Th BAB Sehari 3X, cair tanpa darah, belum pernah tifus, panas. 33 8 54 P 42 Th BAB sehari 4X (baru 1 hari), cair
tanpa darah dan lendir, belum pernah tifus, panas.
5
Tabel 3. Jumlah dan diferensiasi leukosit, serta kadar hematokrit pada sampel terinfeksi Shigella
* Jumlah rata-rata leukosit normal : 4.300- 10.800 sel/mm3
** Kadar Hematokrit normal: Pria :45-52% ; Wanita: 37-48%; Balita dan anak-anak: 29-42% *** Diferensiasi Leukosit : L: Limfosit (25-33%); M: Monosit (3-9%); E: Eosinofil (1-3%); B: Basofil (<1%); N: Neutrofil (54- 62%)
PEMBAHASAN
Shigella dan Salmonella merupakan bakteri yang tidak dapat memfermentasikan laktosa sehingga kedua bakteri tersebut menampakkan warna bening pada media SSA (Pollock & Dahlgren 1974, Bailey & Scott 1974). Menurut Thomason et al. (1961) bakteri yang dapat memfermentasikan laktosa menghasilkan warna merah pada SSA, karena pada media tersebut terdapat indikator neutral red.
Salmonella dibedakan dari Shigella dengan adanya bintik hitam di pusat koloni karena
Salmonella memproduksi H2S (Madigan et al. 2009). Shigella merupakan bakteri gram negatif yang tidak menyerap pewarna kristal violet dan iodium pada pewarnaan gram, tetapi menyerap safranin sehingga menghasilkan warna merah muda (Tortora et al. 2007). Mengacu pada metode standar dalam Biology of Microorganism maka diperlukan uji biokimia untuk lebih meyakinkan dalam pengidentifikasian.
Uji Merah Metil (MR) adalah uji yang bertujuan menunjukkan adanya asam campuran. Hasil positif pada uji ini ditandai dengan medium berwarna merah dengan penambahan indikator merah metil. Uji VP menunjukkan adanya bakteri yang memfermentasikan glukosa dengan jalur 2,3-butanadiol. Dengan adanya reagen barrit dapat dengan mudah mendeteksi adanya asetoin yang merupakan prekursor 2,3-butandiol. Reagen ini terdiri dari α-naftol dan KOH yang mengubah warna medium dari kuning menjadi merah (Yu & Washington 1985). Pada penelitaian ini dua isolat menghasilkan reaksi positif dan
delapan lainnya menghasilkan reaksi negatif pada uji MR, sedangkan pada ujii VP lima isolat menghasilkan reaksi positif dan lima lainnya menghasilkan reaksi negatif. Menurut Madigan et. al (2009) pada uji MR
Shigella menghasilkan reaksi positif, sedangkan pada uji VP menghasilkan reaksi negatif. Hasil berbeda ditunjukkan oleh Dodd & Jones (1982) yang melaporkan spesies lain dari Shigella menunjukkan hasil yang sebaliknya pada uji MR-VP. Hasil uji biokimia MR-VP dapat dilihat pada Gambar 3.
Uji urea bertujuan untuk membedakan Shigella dari anggota enterobacteriacea yang memiliki enzim urease. Kaldu urea merupakan larutan ekstrak khamir dan urea yang diberi larutan penyangga. Medium tersebut mengandung merah fenol sebagai indikator pH. Jika organisme menghasilkan urease pada uji ini maka amoniak yang dilepaskan dari molekul urea akan merubah pH menjadi alkalin dan hal ini dapat diditeksi dengan indikator No.
Pasien
No. Isolat
*Jumlah Leukosit (sel/mm3)
**Hema tokrit (%)
***Diferensiasi Leukosit (%)
L M E B N
12 1 4250 46, 15 49 6 1 0 44
23 4 1250 43, 47 55 5 2 0 38
26 5 2450 45, 71 70 10 7 0 13
28 6 3625 40 70 17 1 0 12
31 7 3800 38, 64 68 14 0 0 18
33 8 11000 40 36 4 0 1 59
36 9 1875 25 62 10 0 2 32
A B
Gambar 3 Uji MR-VP
6
merah fenol yang akan merubah larutan dari merah jingga menjadi merah ungu (Goh et al. 1994). Pada penelitian sepuluh sampel yang diduga Shigella menghasilkan reaksi negatif pada uji urea (Gambar 4). Hasil ini sesuai Madigan et. al (2009) bahwa Shigella
tidak dapat menghidrolisis urea menjadi amioniak.
Uji H2S menggunakan agar TSI. Agar TSI digunakan untuk mengetahui terjadinya fermentasi karbohidrat serta mengetahui terjadinya produksi H2S. Agar TSI terdiri dari 10% sukrosa, 10% laktosa, dan 1% glukosa (Yu dan Washington 1985). Fermentasi glukosa ditandai dengan warna kuning dibagian dasar dan merah pada bagian miring agar. Warna kuning pada keseluruhan agar menunjukkan fermentasi sukrosa dan laktosa. Produksi H2S ditandai dengan adanya warna hitam pada bagian dasar medium. Gas H2S yang terbentuk dapat berasal dari reduksi tiosulfat atau reaksi yang melibatkan sisteina. Enzim desulfhidrase mengkatalisis pembentukan H2S, amonia, dan piruvat dari sitein pada mikro organisme. Shigella merupakan bakteri yang tidak dapat menghasilkan H2S sehingga pada uji menghasilkan reaksi negatif (Madigan et al. 2009). Pada kesepuluh isolat yang diduga Shigella
menghasilkan reaksi negatif. Hasil uji biokimia H2S ditunjukkan pada Gambar 5.
Uji fermentasi karbohidrat menggunaan tabung durham yang berisi kaldu glukosa dengan indikator merah fenol. Uji ini dilakukan untuk membedakan
Shigella dengan bakteri yang dapat memfermentasikan karbohidrat (glukosa, sukrosa, dan laktosa). Bakteri yang memfermentasikan karbohidrat akan mengakumulasikan asam hasil fermentasi dengan perubahan warna medium dari merah menjadi kuning. Bila pada tabung kecil (durham) yang diletakan terbalik di dalam tabung medium menghasilkan gas, maka hal ini ditandai dengan adanya gelembung pada tabung durham tersebut (Kurniasih 1995). Kesepuluh isolat yang diduga Shigella menghasilkan reaksi positif tanpa adanya gas pada medium (Gambar 6). Hal ini sesuai Madigan et. al (2009) bahwa
Shigella dapat memfermentasikan karbohidrat tanpa menghasilkan gas pada uji fementasi karbohidrat.
Uji indol digunakan untuk mengidentifikasi bakteri yang menggunakan tripton sebagai sumber karbon satu-satunya. Bakteri ini dapat menghidrolisis asam amino triptofan menjadi indol dan asam piruvat melalui enzim triptofanase. Uji menggunakan kaldu tripton (1%) yang kaya akan triptofan. Hasil positif dari uji ini ditunjukkan dengan lapisan cincin berwarna merah pada medium setelah ditetesi dengan reagen kovac (Bailey & Scott 1974). Pada penelitian ini hanya dua isolat yang menghasilkan reaksi positif, sedangkan delapan lainnya menghasilkan reaksi negatif yang ditandai dengan cincin berwarna kuning (Gambar 7). Berdasarkan Madigan
et al. (2009) Shigella menghasilkan reaksi yang bervariasi pada uji indol.
Gambar 4 Hasil negatif uji urea
Gambar 5 Uji H2S
7
Uji sitrat adalah uji yang digunakan untuk mengetahui kemampuan bakteri dalam menggunakan sitrat sebagai sumber karbon dan energi. Uji ini menggunakan agar simon sitrat yang mengandung sitrat sebagai sumber karbon, garam amonium sebagai sumber nitrogen, dan indikator biru bromtimol yang dapat merubah warna agar dari hijau ke biru dalam keadaan alkali (Bailey & Scott 1974). Shigella merupakan bakteri yang tidak dapat menggunakan sitrat sebagai sumber karbonnya (Madigan et al. 2009), tetapi berdasarkan Dodd & Jones 1982 ada beberapa spesies Shigella yang mengasilkan reaksi positif pada uji ini Pada penellitian ini dari sepuluh isolat yang diduga Shigella, hanya dua sampel yang menghasilkan reaksi negatif yang ditandai dengan tidak adanya perubahan agar (Gambar 8).
Tujuh isolat menunjukkan adanya
Shigella berdasarkan hasil uji biokimia. Pada penelitian ini satu isolat nomor empat telah diidentifikasi dengan menggunakan kit (Microbact 2000) yang hasilnya sama dengan uji biokimia.
Ada tiga tipe diare dari sampel yang terinfeksi Shigella, yaitu cair, berlendir, dan berdarah (Tabel 2). Menurut Katz et al. (2004) tipe diare Shigella bervariasi mulai dari diare yang cair sampai berdarah. Satu sampel diare terinfeksi Shigella tidak
mengalami demam, sedangkan enam sampel lainnya demam. Demam terjadi karena bakteri mengeluarkan endotoksin didalam makrofag yang telah menelannya sehingga dengan hal ini merangsang makrofag mengeluarkan interleukin-1 (IL-1). Kemudian IL-1 mengalir bersama aliran darah menuju ke hipotalamus pada otak yang menghasilkan prostagladins sehingga menyebabkan temperatur tubuh naik yang akhirnya menyebabkan demam (Tortora et al. 2007). Berdasarkan penelitian Kotloff et al. (2000) sampel yang mengalami diare terinfeksi Shigella tidak mengalami panas pada tubuhnya, hal ini diduga oleh Shigella
yang telah mengalami mutasi.
Diare menyebabkan dehidrasi akibat terjadinya invasi yang dilakukan bakteri yang merusak sel dan jaringan tubuh, akan tetapi tidak selalu diare menyebabkan dehidrasi pada penderitanya (Sue et al. 2004). Seseorang dinyatakan dehidrasi atau tidak dapat dilihat dari kadar hematokritnya. Hematokrit adalah proporsi atau persentase pengukuran sel darah merah dalam seluruh volume (Martini & Federic 1992). Kadar hematokrit menjadi rendah akibat beberapa alasan, yaitu anemia, kehilangan darah (luka trauma, operasi, pendarahan), dan defisiensi gizi. Kadar hematokrit yang meningkat diantaranya disebabkan oleh dehidrasi, penyakit paru-paru, kanker, orang yang hidup di dataran tinggi dan sebagainya (Guyton & Hall 2007).
Leukosit merupakan unit sistem pertahanan tubuh yang mobil. Leukosit sebagian dibentuk di sumsum tulang belakang dan sebagian lagi di jaringan limfe. Terjadinya penurunan jumlah leukosit pada tubuh disebut leukopenia. Leukopenia terjadi bila sumsum tulang belakang sedikit memproduksi sel darah putih, sehingga banyak bakteri dan parasit lain yang masuk menginvasi jaringan. Leukopenia juga disebabkan adanya radiasi tubuh oleh sinar gamma atau sinar X, terkena bahan kimia dan obat-obatan yang mengandung inti benzene yang menyebabkan aplasia sumsum tulang belakang (Guyton & Hall 2007). Diare yang menyebabkan infeksi meningkatkan leukosit. Hal ini sesuai dengan penelitian Guerrant et al. (1992)
A B C
Gambar 8 Uji sitrat
A)Positif B) Negatif C) Kontrol
A B C
Gambar 7 Uji indol
8
bahwa diare yang disebabkan oleh infeksi dari Shigella (Shigellosis) pada fasesnya terdapat leukosit dan jumlah leukosit tersebut meningkat. Tidak terjadinya peningkatan leukosit pada enam isolat penderita diare bukan berarti tidak mengalami infeksi akan tetapi kemungkinan disebabkan sistem imun tubuh yang rendah akibat stres dan depresi (Fatmah 2006) atau bisa disebabkan malnutrisi yang menyebabkan sistem imun tubuh menurun sehingga dengan mudah berbagai penyakit masuk ke tubuh (Nassar et al. 2009).
Diferensiasi leukosit pada sampel diare terinfeksi Shigella menunjukkan nilai limfosit yang tinggi dan neutrofil yang rendah, hal ini memungkinkan bahwa pasien yang mengalami infeksi karena adanya virus, material asing, maupun bakteri lain selain Shigella. Limfosit merupakan sel pertahanan tubuh yang berperan dalam membunuh dan menyerang kuman di dalam tubuh. Limfosit menjadi tinggi karena adanya infeksi atau bakteri. Monosit merupakan sel yang dapat melawan infeksi, memakan kuman, dan memberi sinyal pada sistem kekebalan tubuh mengenai kuman yang ditemukan. Jumlah monosit yang tinggi menunjukkan adanya infeksi bakteri. Eosinofil merupakan sel yang terlibat dengan alergi dan reaksi terhadap parasit. Basofil diketahui merupakan sel yang terlibat dalam reaksi alergi jangka panjang. Sedangkan neutrofil berfungsi melawan infeksi bakteri (Fox 2004).
SIMPULAN DAN SARAN Simpulan
Diduga 10% penderita diare di puskesmas Cangkurawok terinfeksi Shigella, tetapi hanya 7% yang menunjukkan adanya bekteri Shigella. Uji biokimia dua sampel menghasilkan asam campuran, lima menghasilkan asetoin. Semua sampel tidak menghasilkan urea dan H2S, tetapi menghasilkan asam. Dua sampel menggunakan triptofan sebagai sumber karbon satu-satunya, tetapi tidak menggunakan sitrat. Tujuh orang penderita diare yang terinfeksi Shigella tidak mengalami dehidrasi dan satu orang mengalami peningkatan jumlah leukosit dengan persentase limfodit tinggi, sedangkan neutrofilnya rendah.
Saran
Perlu dilakukan uji identifikasi sampai ke tingkat spesies dan serotipe, uji
patogenitas dari bakteri Shigella tersebut, serta diperlukan pemeriksaan diare secara mikrobiologis dengan bakteri yang berbeda.
DAFTAR PUSTAKA
Adisasmito W. 2007. Faktor Resiko Diare pada Bayi dan Balita di Indonesia: Systematic Review Penelitian Akademi Bidang Kesehatan Masyarakat. J Markara 11:1-10
Adkins JH dan Santiago LT. 1987. Increased Recovery of Enteric Pathogens by Use of Both Stool and Rectal Swab Speciment.
J clin microbiol 2:158-159.
Bailey WR & Scott EG. 1974. Diagnostic Microbiology ed ke- 4. Saint Luis: C.V Mosby Company.
[DEPKES] Departemen Kesehatan RI. 2009. Profil Kesehatan Indonesia 2009. Jakarta : Depkes RI 2009
Dalimonthe NZ. 2002. Penilain Sediaan Hapus Darah Tepi dan Sumsum Tulang Dalam: Kursus Penyegar Morfologi Sedian Hapus Darah dan Sumsum Tulang. Bandung: Patologi Klinik FK UNPAD.
Dood CER, Jones D. 1982. A Numerical Taxonomy Study of The Genus Shigella.
J General Microbiol 128: 1933-1957. Echeverria P, Sethabutr O, Pitarangsih C.
1991. Microbial and Diangnosis of Infections with Shigella and Enteroinvasive Eschericia coli. Rev Infectious Diseases 13: 220-225.
Fatmah. 2006. Respon Imunitas yang Rendah pada Tubuh Manusia Usia Lanjut. J Makara Kesehatan 10: 47-53. Fox SI. 2004. Human Physyology ed ke-8.
Boston: Mc-GrawHill.
Goh KL, Parasakhi N, Peh SC, Puthucheary SD, Wong NW. 1994. The rapid urease test in the diagnosis of Helicobacter pylori infection. Singapore Med J
35:161-162.
Greenwood D, Slack RCB, Peuthere JF. 1992. Medical Microbiology. Inggris: ELBS
Guerrant et al. 1992. Measurement of Fecal Lactoferin as a Marker of Fecal Leukocytes. J Clin Microbiol 30:1238-1242
8
bahwa diare yang disebabkan oleh infeksi dari Shigella (Shigellosis) pada fasesnya terdapat leukosit dan jumlah leukosit tersebut meningkat. Tidak terjadinya peningkatan leukosit pada enam isolat penderita diare bukan berarti tidak mengalami infeksi akan tetapi kemungkinan disebabkan sistem imun tubuh yang rendah akibat stres dan depresi (Fatmah 2006) atau bisa disebabkan malnutrisi yang menyebabkan sistem imun tubuh menurun sehingga dengan mudah berbagai penyakit masuk ke tubuh (Nassar et al. 2009).
Diferensiasi leukosit pada sampel diare terinfeksi Shigella menunjukkan nilai limfosit yang tinggi dan neutrofil yang rendah, hal ini memungkinkan bahwa pasien yang mengalami infeksi karena adanya virus, material asing, maupun bakteri lain selain Shigella. Limfosit merupakan sel pertahanan tubuh yang berperan dalam membunuh dan menyerang kuman di dalam tubuh. Limfosit menjadi tinggi karena adanya infeksi atau bakteri. Monosit merupakan sel yang dapat melawan infeksi, memakan kuman, dan memberi sinyal pada sistem kekebalan tubuh mengenai kuman yang ditemukan. Jumlah monosit yang tinggi menunjukkan adanya infeksi bakteri. Eosinofil merupakan sel yang terlibat dengan alergi dan reaksi terhadap parasit. Basofil diketahui merupakan sel yang terlibat dalam reaksi alergi jangka panjang. Sedangkan neutrofil berfungsi melawan infeksi bakteri (Fox 2004).
SIMPULAN DAN SARAN Simpulan
Diduga 10% penderita diare di puskesmas Cangkurawok terinfeksi Shigella, tetapi hanya 7% yang menunjukkan adanya bekteri Shigella. Uji biokimia dua sampel menghasilkan asam campuran, lima menghasilkan asetoin. Semua sampel tidak menghasilkan urea dan H2S, tetapi menghasilkan asam. Dua sampel menggunakan triptofan sebagai sumber karbon satu-satunya, tetapi tidak menggunakan sitrat. Tujuh orang penderita diare yang terinfeksi Shigella tidak mengalami dehidrasi dan satu orang mengalami peningkatan jumlah leukosit dengan persentase limfodit tinggi, sedangkan neutrofilnya rendah.
Saran
Perlu dilakukan uji identifikasi sampai ke tingkat spesies dan serotipe, uji
patogenitas dari bakteri Shigella tersebut, serta diperlukan pemeriksaan diare secara mikrobiologis dengan bakteri yang berbeda.
DAFTAR PUSTAKA
Adisasmito W. 2007. Faktor Resiko Diare pada Bayi dan Balita di Indonesia: Systematic Review Penelitian Akademi Bidang Kesehatan Masyarakat. J Markara 11:1-10
Adkins JH dan Santiago LT. 1987. Increased Recovery of Enteric Pathogens by Use of Both Stool and Rectal Swab Speciment.
J clin microbiol 2:158-159.
Bailey WR & Scott EG. 1974. Diagnostic Microbiology ed ke- 4. Saint Luis: C.V Mosby Company.
[DEPKES] Departemen Kesehatan RI. 2009. Profil Kesehatan Indonesia 2009. Jakarta : Depkes RI 2009
Dalimonthe NZ. 2002. Penilain Sediaan Hapus Darah Tepi dan Sumsum Tulang Dalam: Kursus Penyegar Morfologi Sedian Hapus Darah dan Sumsum Tulang. Bandung: Patologi Klinik FK UNPAD.
Dood CER, Jones D. 1982. A Numerical Taxonomy Study of The Genus Shigella.
J General Microbiol 128: 1933-1957. Echeverria P, Sethabutr O, Pitarangsih C.
1991. Microbial and Diangnosis of Infections with Shigella and Enteroinvasive Eschericia coli. Rev Infectious Diseases 13: 220-225.
Fatmah. 2006. Respon Imunitas yang Rendah pada Tubuh Manusia Usia Lanjut. J Makara Kesehatan 10: 47-53. Fox SI. 2004. Human Physyology ed ke-8.
Boston: Mc-GrawHill.
Goh KL, Parasakhi N, Peh SC, Puthucheary SD, Wong NW. 1994. The rapid urease test in the diagnosis of Helicobacter pylori infection. Singapore Med J
35:161-162.
Greenwood D, Slack RCB, Peuthere JF. 1992. Medical Microbiology. Inggris: ELBS
Guerrant et al. 1992. Measurement of Fecal Lactoferin as a Marker of Fecal Leukocytes. J Clin Microbiol 30:1238-1242
Shigella, LEUKOSIT, DAN HEMATOKRIT DARI PENDERITA
DIARE DI PUSKESMAS CANGKURAWOK, DRAMAGA,
BOGOR
FIRDAUS
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
8
bahwa diare yang disebabkan oleh infeksi dari Shigella (Shigellosis) pada fasesnya terdapat leukosit dan jumlah leukosit tersebut meningkat. Tidak terjadinya peningkatan leukosit pada enam isolat penderita diare bukan berarti tidak mengalami infeksi akan tetapi kemungkinan disebabkan sistem imun tubuh yang rendah akibat stres dan depresi (Fatmah 2006) atau bisa disebabkan malnutrisi yang menyebabkan sistem imun tubuh menurun sehingga dengan mudah berbagai penyakit masuk ke tubuh (Nassar et al. 2009).
Diferensiasi leukosit pada sampel diare terinfeksi Shigella menunjukkan nilai limfosit yang tinggi dan neutrofil yang rendah, hal ini memungkinkan bahwa pasien yang mengalami infeksi karena adanya virus, material asing, maupun bakteri lain selain Shigella. Limfosit merupakan sel pertahanan tubuh yang berperan dalam membunuh dan menyerang kuman di dalam tubuh. Limfosit menjadi tinggi karena adanya infeksi atau bakteri. Monosit merupakan sel yang dapat melawan infeksi, memakan kuman, dan memberi sinyal pada sistem kekebalan tubuh mengenai kuman yang ditemukan. Jumlah monosit yang tinggi menunjukkan adanya infeksi bakteri. Eosinofil merupakan sel yang terlibat dengan alergi dan reaksi terhadap parasit. Basofil diketahui merupakan sel yang terlibat dalam reaksi alergi jangka panjang. Sedangkan neutrofil berfungsi melawan infeksi bakteri (Fox 2004).
SIMPULAN DAN SARAN Simpulan
Diduga 10% penderita diare di puskesmas Cangkurawok terinfeksi Shigella, tetapi hanya 7% yang menunjukkan adanya bekteri Shigella. Uji biokimia dua sampel menghasilkan asam campuran, lima menghasilkan asetoin. Semua sampel tidak menghasilkan urea dan H2S, tetapi menghasilkan asam. Dua sampel menggunakan triptofan sebagai sumber karbon satu-satunya, tetapi tidak menggunakan sitrat. Tujuh orang penderita diare yang terinfeksi Shigella tidak mengalami dehidrasi dan satu orang mengalami peningkatan jumlah leukosit dengan persentase limfodit tinggi, sedangkan neutrofilnya rendah.
Saran
Perlu dilakukan uji identifikasi sampai ke tingkat spesies dan serotipe, uji
patogenitas dari bakteri Shigella tersebut, serta diperlukan pemeriksaan diare secara mikrobiologis dengan bakteri yang berbeda.
DAFTAR PUSTAKA
Adisasmito W. 2007. Faktor Resiko Diare pada Bayi dan Balita di Indonesia: Systematic Review Penelitian Akademi Bidang Kesehatan Masyarakat. J Markara 11:1-10
Adkins JH dan Santiago LT. 1987. Increased Recovery of Enteric Pathogens by Use of Both Stool and Rectal Swab Speciment.
J clin microbiol 2:158-159.
Bailey WR & Scott EG. 1974. Diagnostic Microbiology ed ke- 4. Saint Luis: C.V Mosby Company.
[DEPKES] Departemen Kesehatan RI. 2009. Profil Kesehatan Indonesia 2009. Jakarta : Depkes RI 2009
Dalimonthe NZ. 2002. Penilain Sediaan Hapus Darah Tepi dan Sumsum Tulang Dalam: Kursus Penyegar Morfologi Sedian Hapus Darah dan Sumsum Tulang. Bandung: Patologi Klinik FK UNPAD.
Dood CER, Jones D. 1982. A Numerical Taxonomy Study of The Genus Shigella.
J General Microbiol 128: 1933-1957. Echeverria P, Sethabutr O, Pitarangsih C.
1991. Microbial and Diangnosis of Infections with Shigella and Enteroinvasive Eschericia coli. Rev Infectious Diseases 13: 220-225.
Fatmah. 2006. Respon Imunitas yang Rendah pada Tubuh Manusia Usia Lanjut. J Makara Kesehatan 10: 47-53. Fox SI. 2004. Human Physyology ed ke-8.
Boston: Mc-GrawHill.
Goh KL, Parasakhi N, Peh SC, Puthucheary SD, Wong NW. 1994. The rapid urease test in the diagnosis of Helicobacter pylori infection. Singapore Med J
35:161-162.
Greenwood D, Slack RCB, Peuthere JF. 1992. Medical Microbiology. Inggris: ELBS
Guerrant et al. 1992. Measurement of Fecal Lactoferin as a Marker of Fecal Leukocytes. J Clin Microbiol 30:1238-1242
9
Jawetz E, Mellnick JL, Alserberg EA. 1986.
Mikrobiologi (Untuk Profesi Kesehatan). Jakarta : CV. EGC.
Katz DE et al. 2004. Two studies evaluating the safty and immunogenicity of a live, attenuates Shigella flexneri 2avaccine (SC602) and excretion of vaccine organism in North Amarica volunteers.
Infection and Immunity. 72(2):923-930. Kotloff KL et al. 2000. Shigellaflexineri 2a
strain CVD 1207, with specific deletions in virG, sen, set, and guaBA, is highly attenuated in humans. Infection and immunity 68(3): 1034-1039.
Kurniasih DA. 1995. Identifikasi Escherichia coli Enteropatogenik dari Fases Penderita Diare di RSU Ciawi Bogor dan Uji Kepekaannya terhadap Beberapa Jenis Antibiotik [Skipsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Madigan MT, John MM, Paul VD, David PC. 2009. Brock (Biology of Microorganism) ed ke-12. San Fransisco: Person Benjamin Cumming Inc.
Martini Frederic. 1992. Fundamental of Anatomy and Physyology 2nd ed. Engleewood cliffs: Prentice-Hall. Nassar MF, SR El-Batrawy, NM Nagy.
2009. CD95 Expression in White Blood Cells of Malnourshed Infant During Hospitalization and Catch-up Growth.
Eastern Mediterranean Heal J 15: 574-583.
Pollock HM & Dahlgren BJ. 1974. Clinical Evaluation of Enteric Media in The Primary Isolation of Salmonella and Shigella. Appl. Microbiol 27: 197-201. Santos DRD, Santana JS, Baretto JR,
Andrade MGM, Silva LR. 2005. Epidemiological and Microbiological Aspect of Acute Bacterial Diarrhea in Children from Salasavador, Bahia, Brazil. BJID 9:77-83.
Simmons A. 1976. Technical Hematology 2nd ed. Toronto: J.B. Lippincot Co. Sur D, Ramamurthy T, Deen J, Bhattabharya
SK. 2004. Shigellosis: Clannge & Menagement Issues. Indian J Med Res
120: 454-462.
Thomason BM, Cherry WB, Pomales-Lebron A, Ewing WH. Rapid presumptive identification of Enteropathogenic Escherichia coli in faecal smears by means of fluorescent antibody. Bull. Org. mond. Sante Bull. Wld Hlth Org. 25: 159-171.
Totora JG, Funke RB, Case LC. 2007.
Microbiology an Introduction Ed. 9th. San Fransisco: Person Benjamin Cummings.
Wasfy MO et al. 2000. Isolation and Antibiotic Suscepsibility of Salmonella, Shigella, and Camphylobacter from Acute Enteric Infection in Egypt. J Healt Papul Nurt 18: 33-38
Willey JM., Sherwood LM, Woolverton CJ. 2009. Microbiology Ed. 7th (Prescott,
Harley, and Klein’s). New York : Mc.
Graw Hill.
WHO [World Health Organization]. 2010. World Healt Statistics 2010. Switzerland : WHO press.
Shigella, LEUKOSIT, DAN HEMATOKRIT DARI PENDERITA
DIARE DI PUSKESMAS CANGKURAWOK, DRAMAGA,
BOGOR
FIRDAUS
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FIRDAUS. Shigella, Leukosit, dan Hematokrit dari Penderita Diare di Puskesmas Cangkurawok, Dramaga, Bogor. Dibimbing oleh SRI BUDIARTI POERWANTO dan TRI HERU WIDARTO.
Diare merupakan salah satu penyakit penyebab kematian balita dan anak-anak. Pada tahun 2008 di indonesia terjadinya KLB (Kejadian Luar Biasa) diare di 15 provinsi (penderita sebanyak 8.433 orang dan jumlah kematian 209 orang). Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi bakteri Shigella, melihat jumlah dan deferensiasi leukosit, dan kadar hematokrit pada penderita diare. Sebanyak 100 sampel tinja. berhasil diisolasi dari penderita diare di puskesmas Cangkurawok dengan metode rectal swab pada media Salmonella Shigella Agar (SSA) dan pengambilan darah dengan metode mikrohematokrit. Identifikasi dengan beberapa uji biokimia, yaitu uji MR-VP, Uji Urea, Uji H2S pada TSIA, uji fermentasi karbohidrat, uji indol, dan uji sitrat Sepeluh dari bakteri yang diduga Shigella, hanya tujuh sampel yang berhasil menunjukkan bakteri Shigella.Ketujuh sampel tersebut kadar hematokritnya normal, satu sample menunjukkan jumlah leukosit yang tinggi dengan persentase limfosit yang tinggi dan neutofil yang rendah.
ABSTRACT
FIRDAUS. Shigella, Leucocytes, and Hematocrit from Diarrheal Patient in Cangkurawok Healt Center, Dramaga, Bogor. Under direction of SRI BUDIARTI POERWANTO dan TRI HERU WIDARTO.
Shigella, LEUKOSIT, DAN HEMATOKRIT DARI PENDERITA
DIARE DI PUSKESMAS CANGKURAWOK, DRAMAGA,
BOGOR
FIRDAUS
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul :
Shigella
, Leukosit, dan Hematokrit dari Penderita Diare di Puskesmas
Cangkurawok, Dramaga, Bogor.
Nama : Firdaus
NIM : G34061991
Disetujui,
Pembimbing I
Pembimbing II
Dr.dr Sri Budiarti
Ir. Tri Heru Widarto, M.Sc
NIP. 19580813 1 99303 2 001 NIP. 19620513 2 98703 1 002
Diketahui,
Ketua Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, M.Si.
NIP. 19641002 198903 1 002
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 11 September 1988 dari ayah H. Abdul Razak dan ibu Hj. Rosada. Penulis merupakan putri ke empat dari enam bersaudara.
Tahun 2006 penulis lulus dari SMA Muhammadiyah 5 Tebet, Jakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk (USMI) IPB. Penulis diterima sebagai mahasiswi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT atas rahmat dan karuniaNya sehingga
penulis dapat menyelesaikan laporan penelitian ini tepat pada waktunya. Laporan ini ditulis
berdasarkan hasil kegiatan penelitian sejak bulan Februari-Oktober yang dilaksanakan di
Puskesmas Cangkurawok, Dramaga, Bogor. Laporan ini disusun sebagai salah satu syarat
kurikulum program sarjana Biologi.Penulis menyusun laporan ini dengan judul “ Shigella, Leukosit, dan Hematokrit dari Penderita Diare di Puskesmas Cangkurawok, Dramaga, Bogor”.
Ucapan terima kasih penulis sampaikan kepada Dr. dr. Sri Budiart yang telah
membimbing dan membiayai penelitian ini. Ir. Tri Heru Widarto, M.SC yang juga bersedia
membimbing penelitian ini. dr. Deasy dan para staf puskesmas Cangkurawok yang telah
membantu dalam pengambilan sampel. Ucapan terima kasih juga penulis sampaikan kepada Bapak
Jaka dan Ibu Heni selaku laboran di Laboratorium Mikrobiologi, Ibu Tini dan Ibu Ani selaku
laboran di Laboratorium Biosistematika dan Ekologi Hewan yang membantu bekerja di
laboratorium. Bapak Achmad Farajallah yang membantu membiayai dalam isoslasi darah. ibu
Sulistijorini sebagai penguji dan membantu memberi saran dalam penulisan. Orang tua, keluarga,
sahabat seperjuangan (Ega, Tari, Sira), Evi, Widi, Desi, Sarah, Nijma, KerZjakru, G4, dan
teman-teman biologi 43 yang memberi dukungan dan semangat.
Laporan ini tidak akan terwujud tanpa adanya bantuan dari semua pihak yang telah
membantu penulis dalam penyusunan laporan ini. Sebagaimana halnya penulis tidak luput dari
kesalahan dan kekurangan, untuk itu sudilah kiranya para pembaca memakluminya. Akhir kata
penulis menyadari bahwa laporan ini masih banyak kekurangan, untuk itu penulis mengharapkan
kritik dan saran yang bersifat membangun dalam perbaikan di masa mendatang.
Bogor, Januari 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ...vii
DAFTAR GAMBAR ...vii
DAFTAR LAMPIRAN ...vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 2
BAHAN DAN METODE ... 2
Pengambikan sampel... 2
Isolasi bakteri ... 2
Identifikasi Shigella ... 2
1. Uji MR-VP ... 2
2. Uji Urea ... 2
3. Uji H2S pada TSIA ... 2
4. Uji Fermentasi karbohidat ... 2
5. Uji Indol ... 3
6. Uji Sitrat ... 3
Identifikasi hematokrit dan leukosit... 3
HASIL ... 3
PEMBAHASAN ... 5
SIMPULAN DAN SARAN ... 8
Simpulan... 8
Saran... 8
DAFTAR PUSTAKA ... 8
DAFTAR GAMBAR
Halaman 1 Hasil uji biokimia isolat bening pada SSA...4 2 Kondisi pasien yang terinfeksi Shigella...4 3 Jumlah dan deferensiasi leukosit, serta kadar hematokrit pada sampel terinfeksi
Shigella...5
DAFTAR GAMBAR
Halaman 1 Isolat bening pada SSA...3 2 Pewarnaan gram negatif...3 3 Uji MR-VP...5 4 Hasil negatif uji urea...6 5 Uji H2S...6 6 Uji Fermentasi karbohidrat...6 7 Uji Indol...7 8 Uji Sitrat...7
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Diare merupakan salah satu penyakit penyebab nomor dua kematian balita dan anak-anak di seluruh dunia (WHO 2010). Dari data profil kesehatan Indonesia tahun 2009 penderita diare pada tahun 2003-2008 mengalami peningkatan, kecuali ditahun 2007. Pada tahun 2006 penderita diare sebesar 10.980 orang menurun menjadi 3.661 orang pada tahun 2007, pada tahun 2008 dilaporkan terjadinya KLB (Kejadian Luar Biasa) diare di 15 provinsi dengan penderita sebanyak 8.433 orang dan jumlah kematian 209 orang (DEPKES 2009). Dengan semakin meningkatnya penderita diare di Indonesia (terutama di Bogor) dari tahun ke tahun dan masih lemahnya data mikrobiologi penderita diare terutama yang disebabkan oleh Shigella (Shigellosis), maka dilakukan penelitian ini
Diare adalah buang air besar dengan tinja cair atau setengah cair yang mengandung tinja biasanya 200 g atau 200ml setiap 24 jam, lebih dari 3 kali per hari dengan atau tanpa lendir dan darah. Diare ada yang menyebabkan infeksi dan non infeksi (Adisasmito 2007).
Penyebab diare diantaranya karena kontaminasi makanan, air, dan sanitasi lingkungan (Adisasmito 2007). Diare infeksi dapat disebabkan oleh bakteri, virus atau parasit. Salah satu bakteri yang menyebabkan diare adalah Shigella sp. Berdasarkan hasil penelitian pada tahun 2003 di Brazil ditemukan 53,40% kasus (141 dari 260 pasien) (Santoso et al. 2005), di Mesir pada tahun 1993 sebanyak 30% (258 dari 6278 pasien) (Wasfy et al. 2000), dan berdasarkan penelitian Jiang et al. (2002) kasus diare akibat Shigella di India, Kenya, dan Jamaika hanya sekitar 10%, 9%, dan 0,3%.
Shigella merupakan bakteri gram negatif, tidak motil, dan bersifat fakultatif anaerob. Koloni Shigella berbentuk basil (bulat), transparan dengan pinggiran utuh, mencapai diameter kira-kira 2 mm dalam 24 jam. Bakteri ini tidak meragikan laktosa tetapi meragikan karbohidrat dan glukosa. Menghasilkan asam tetapi tidak menghasilkan gelembung (Jawets et al.
1986). Shigella adalah anggota dari enterobakteri yang memiliki hubungan dekat dengan genus Eschericia. Genus Shigella
memiliki 4 spesies, yaitu Shigella dysentriae, Shigella flexneri, Shigella boydii,
Shigella sonnei. Semua spesies Shigella
tidak dapat menghasilkan hydrogen sulfida dan kebanyakan Shigella menghasilkan katalase (Greenwood et al. 1992).
Shigella menyebabkan disentri basiler. (Shigellosis), karena reaksi inflamasi oleh Shigella yang menyerang usus. Penyakit ini ditularkan melalui makanan atau air, fases, dan lalat (Willey et al. 2009). Shigellosis biasanya ditandai oleh suhu tubuh yang panas, rasa sakit pada perut, fases biasanya berlendir dan berdarah (Echeverria et al 1991). Shigella pertama kali menyerang sel mukosa pada sel epitel di saluran pencernaan. Di dalam sel Shigella
memperbanyak diri kemudian menginvasi sel epitel lainnya dan menyerang sistem kekebalan tubuh. Selanjutnya terbentuk abses. (Tortora et al 2007). Adanya reaksi invasi disebabkan racun shiga yang dikeluarkan Shigella (Sur et al. 2004).
Diare yang menyebabkan infeksi meningkatkan sel darah putih (leukosit). Leukosit berperan membantu melawan infeksi di dalam tubuh. Di dalam darah manusia normal jumlah rata-rata leukosit adalah 4.300-10.800 sel/mm3. Leukosit ada yang bergranula dan tidak bergranula. Leukosit bergranul terdiri atas neutrofil (kadar normal 54-62%), basofil (kadar normal kurang dari 1%), dan eosinofil (kadar normal 1-3 %). Leukosit yang tidak bergranul adalah limfosit yang kadarnya 25-33% dan monosit yang kadarnya hanya 3-9% (Fox 2004). Diare juga dapat menyebabkan penderita menjadi dehidrasi. Dehidrasi dapat dilihat dari kadar hematokrit. Kadar hematokrit digunakan untuk melihat perbandingan kadar air dan komponen sel darah dalam darah. Kadar hematokrit normal untuk pria adalah 45%-52%, wanita 37%-48%, sedangkan kadar hematokrit normal untuk anak-anak dan balita 29%-41% (Fox 2004).
Tujuan
2
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Februari sampai bulan Oktober 2010 di Puskesmas Cangkurawok, Laboratorium Mikrobiologi, dan Laboratorium Biosistematika dan Ekologi Hewan, Departermen Biologi, FMIPA, IPB, Bogor.
BAHAN DAN METODE
Pengambilan sampel
Pengambilan sampel dilakukan di puskesmas Cangkurawok dengan metode usap rektum (rectal swab) dengan menggunakan cotton but steril untuk mendapatkan tinja, kemudian disimpan di botol spot yang berisi PBS steril 2ml (Adkins & Santiago 1987). Pengambilan darah dilakukan dengan metode mikrohematokrit. Pertama jari pasien dibersihkan dengan alkohol 70%, kemudian dijepit dengan lanset steril, setelah itu darah dimasukkan ke hematokrit berheparin (Mariendfeld) dan disimpan di atas lilin (Dalimonthe 2002). Pengambilan sampel dilakukan sesuai etika dan prosedur yang sesuai, serta mendapatkan izin dari pasien. Kerja nyata ini dilengkapi dengan surat izin yang tersaji pada Lampiran 1.
Isolasi bakteri
Hasil fases yang didapat diambil sebanyak 0,1 ml denagn pipet volumetrik 1 ml kemudian disebar dengan batang penyebar steril di media Salmonella Shigella Agar (SSA/Criteroin), setelah itu dinkubasi dengan inkubator (K Gemmy Co model IN-010 seri 502050) selama 24-48 jam pada suhu 350 C, hingga diperoleh koloni yang berwarna bening (Shigella), selanjutnya koloni tersebut dipindahkan ke SSA cawan kuadran. Hasil goresan tersebut diinkubasi kembali selama 24-48 jam pada suhu 350 C. Jika diperoleh kembali koloni tunggal berwarna bening maka digoreskan ke Nutrient Agar (NA/ Criteroin) miring (pada tabung reaksi) dan SSA miring (sebagai penyimpanan).
Identifikasi Shigella
Identifikasi dilakukan dengan pewarnaan gram dan uji fisiologis. Satu lup akuades steril diletakkan di atas kaca objek yang sudah diberi tanda lingkaran, kemudian sedikit biakan dipindahkan dengan lup inokulasi dari agar miring SSA ke atas tetesan air pada kaca objek. Hasil tersebut dicampurkan dan disebarkan hingga rata. Olesan bakteri kemudian dibiarkan kering
udara, setelah itu difiksasi dengan dilalui kaca objek tersebut beberapa kali di atas api bunsen. Selanjutnya olesan bakteri yang telah kering diwarnai dengan pewarna ungu kristal selama 1 menit, kelebihan warna dibilas dengan akuades. Dilanjutkan dengan pewarna iodium selama 2 menit kelebihan warna dibilas dengan akuades. Kemudian dilakuan pemucatan warna dengan alkohol 95% dan dibilas lagi dengan akuades. Setelah itu olesan diwarnai dengan safranin selama 30 detik, dibilas dengan akuades dan sisa-sisa air diserap dengan kertas serap hingga kering, lalu diamati dibawah mikroskop dengan perbesaran 1000 X (Tortora et al. 2007). Adapun uji-uji fisiologis yang dilakukan untuk mengetahui adanya bakteri Shigella (Madigan et al.
2009) meliputi:
1. Uji MR-VP (Metil Red-Voges Proskauer) Biakan Shigella yang telah disimpan pada media SSA miring, masing-masing dipindahkan ke MR-VP (DifcoTm) broth
sebanyak satu lup. Setelah itu diinkubasi selama 4 hari dengan suhu 370 C. Setelah empat hari biakan untuk MR ditetesi 3-4 indikator merah metil. Sedangkan biakan VP ditetesi 10 tetes reagen barrit dan 10 tetes larutan KOH. Hasil positif kedua uji ini ditunjukkan dengan medium yang berwarna merah, sedangkan hasil negatif ditunjukkan dengan medium yang berwarna kuning.
2. Uji Urea
Koloni yang diduga Shigella diinokulasi dari SSA miring ke medium kaldu urea (DifcoTm). Kemudian diinkubasi selama 4 hari dengan suhu 370 C. Hasil positif ditunjukkan dengan medium berwarna merah keunguan, sedangkan hasil negatif ditunjukkan dengan medium berwarna merah.
3. Uji H2S pada Triple Sugar Iron Agar
(TSIA)
Koloni yang diduga Shigella digoreskan dari media SSA miring ke medium TSIA (DifcoTm) miring dan ditusukkan ke bagian bawah medium. Setelah itu diinkubasi selama satu hari dengan suhu 370 C. Hasil positif ditunjukkan dengan bagian dasar media berwarna hitam,, sedangakan hasil negatif sebaliknya.
4. Uji Fermentasi Karbohidrat
3
tabung reaksi dengan tabung durham yang diletakkan terbalik. Kemudian biakan dinkubasi selama satu hari dengan suhu 370 C. Hasil positif ditunjukkan dengan dengan medium yang berwarna kuning, sedangkan hasil negatif ditunjukkan dengan medium berwarna hijau.
5. Uji Indol
Sebanyak satu lup bakteri yang diduga
Shigella dipindahkan dari medium SSA ke Tripton broth (BactoTm). Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Setelah itu ditetesi dengan reagen kovac
sebanyak 10-12 tetes. Hasil positif ditunjukkan dengan terbentuknya cincin merah pada medium, sedangkan hasil negatif ditunjukkan dengan terbentuknya cincin kuning pada medium.
6. Uji Sitrat
Koloni yang diduga Shigella digores dari medium SSA ke agar miring simon sitrat (Acumedia) sebanyak satu lup. Kemudian diinkubasi selama 24 jam dengan suhu 350 C. Hasil positif ditunjukkan dengan agar yang berwarna biru, sedangkan hasil negatif ditunjukkan dengan agar yang berwarna hijau.
Identifikasi hematokrit dan leukosit
Darah yang disimpan di hematokrit berheparin disentrifugasi dengan sentrifugasi P selecta ISO 9001 ± 12.000 rpm selama 5 menit, kemudian dihitung persen kadar hematokritnya. Setelah itu darah dikeluarkan dengan bantuan jarum dan diletakkan di efendorf, kemudian setetes darah diambil untuk awetan preparat dengan metode deferensial dan sisa darah pada tabung diambil dengan menggunakan pipet leukosit sampai batas ± 0,5. Kemudian dicampur dengan larutan turk sampai batas 11. Setelah itu larutan dikocok membentuk angka 8 (sekitar 12 kali). Larutan ini kemudian diteteskan pada hemasitometer, ditutup dengan kaca penutup dan terakhir diamati dibawah mikroskop dengan perbesaran 10x10 (Simons 1976)
Metode deferensiasi dilakukan dengan mengulas darah pada kaca preparat, setelah darah kering difiksasi dengan methanol 70% selama 2-3 menit, kemudian dikeringkan kembali dan diwarnai dengan giemsa selama 20 menit, diangkat dan dikering udarakan, dan terakhir diamati di mikroskop dengan perbesaran 10x10 (Dalimonthe 2002)
HASIL
Sampel penderita diare berjumlah 100, yang terdiri dari 13 orang bayi (0-1 tahun) ), 2 orang batita (1-3 tahun), 13 orang balita (3-5 tahun), 13 orang anak-anak (5-18 tahun), dan 13 orang dewasa (>18 tahun) berhasil diisolasi. Data lengkap 100 sampel disajikan pada Lampiran 2. Sepuluh sampel menunjukkan koloni yang berwarna bening pada SSA yang diduga bakteri Shigella
(Gambar 1), dan kesepuluh sampel tersebut juga menunjukkan ciri gram negatif yang menghasilkan warna merah muda (Gambar 2).
Uji biokimia berhasil dilakukan terhadap sepuluh sampek yang diduga Shigella. Dua sampel menunjukkan hasik yang positif pada uji MR (isolat no. 2 dan 4), uji sitrat (isolat no. 1 dan 3), dan uji indol (isolat no. 2 dan 4). Pada uji urea dan H2S (TSIA). Kesepuluh sampel tersebut menunjukkan hasil negatif, tetapi pada uji fermentasi glukosa ke sepuluh sampel tersebut menunjukkan hasil sebaliknya (Tabel 1).
Hasil uji biokimia diperoleh tujuh sampel yang menunjukkkan Shigella. Satu dari tujuh sampel yang terinfeksi Shigella mengalami diare berlendir dan berdarah yaitu pafa pasien no. 23. Semua pasien yang terinfeksi
Shigella mengalami panas pada suhu tubuhnya kecuali pada pasien no. 23. (Tabel 2).
Gambar 1 Isolat bening pada SSA
4
Tabel 1 Hasil uji biokimia isolat bening pada SSA
Keterangan: *Bukan Shigella +: reaksi positif - : reaksi negatif
MR : Metil Red VP:Voges-Prouskauer H2S: Hidrogen Sulfida
Tabel 2 Kondisi pasien yang terinfeksi Shigella
* JK: Jenis Kelamin; P: Perempuan ; L: Laki-laki ** Usia: Th: Tahun
*** Gejala klinis: BAB: Buang Air Besar
Jumlah leukosit tujuh pasien penderita diare akibat Shigella menunjukkan hasil yang bervariasi. Enam dari tujuh pasien mengalami penurunan jumlah leukosit (leukopenia). Kadar hematokrit pada tujuh isolat penderita diare karena Shigella
menunjukkan kadar hematokrit normal. Diferensiasi leukosit pada tujuh pasien terinfeksi Shigella bervariasi. Persentase
limfosit ke tujuh pasien tersebut meningkat, empat dari tujuh pasien persentase monositnya meningkat. Dua pasien persentase basofilnya meningkat yaitu pada isolat no. 8 dan 9. Satu dari tujuh pasien persentase eosinofil meningkat, sedangkan persentase neutrofil pada ke tujuh sampel terinfeksi Shigella mengalami penurunan ( Tabel 3).
No
Pasien No.Isolat
Uji MR
Uji VP
Uji Urea
Uji
H2S Uji Sitrat
Uji Indol
Uji Fermentasi
Glukosa
12 1 + - - - + - +
*13 2 - - - + +
*14 3 - - - - + - +
23 4 + - - - - + +
26 5 - + - - + - +
28 6 - + - - + - +
31 7 - + - - + - +
33 8 - + - - + - +
36 9 - + - - + - +
*53 10 - - - - + - +
No.
Pasien No. Isolat BB (kg) JK Usia Gejala klinis 12 1 46 P 29 Th BAB sehari 2X, cair dan
berlendir, panas.
23 4 54 P 45 Th BAB sehari 10X, fases berdarah dan berlendir.
26 5 55 L 19 Th BAB sehari 1-4X, tanpa darah dan lendir, panas.
28 6 24 P 11 Th BAB sehari 2X, muntah, fases cair tanpa darah, panas.
31 7 50 P 56 Th BAB Sehari 3X, cair tanpa darah, belum pernah tifus, panas. 33 8 54 P 42 Th BAB sehari 4X (baru 1 hari), cair
tanpa darah dan lendir, belum pernah tifus, panas.
5
Tabel 3. Jumlah dan diferensiasi leukosit, serta kadar hematokrit pada sampel terinfeksi Shigella
* Jumlah rata-rata leukosit normal : 4.300- 10.800 sel/mm3
** Kadar Hematokrit normal: Pria :45-52% ; Wanita: 37-48%; Balita dan anak-anak: 29-42% *** Diferensiasi Leukosit : L: Limfosit (25-33%); M: Monosit (3-9%); E: Eosinofil (1-3%); B: Basofil (<1%); N: Neutrofil (54- 62%)
PEMBAHASAN
Shigella dan Salmonella merupakan bakteri yang tidak dapat memfermentasikan laktosa sehingga kedua bakteri tersebut menampakkan warna bening pada media SSA (Pollock & Dahlgren 1974, Bailey & Scott 1974). Menurut Thomason et al. (1961) bakteri yang dapat memfermentasikan laktosa menghasilkan warna merah pada SSA, karena pada media tersebut terdapat indikator neutral red.
Salmonella dibedakan dari Shigella dengan adanya bintik hitam di pusat koloni karena
Salmonella memproduksi H2S (Madigan et al. 2009). Shigella merupakan bakteri gram negatif yang tidak menyerap pewarna kristal violet dan iodium pada pewarnaan gram, tetapi menyerap safranin sehingga menghasilkan warna merah muda (Tortora et al. 2007). Mengacu pada metode standar dalam Biology of Microorganism maka diperlukan uji biokimia untuk lebih meyakinkan dalam pengidentifikasian.
Uji Merah Metil (MR) adalah uji yang bertujuan menunjukkan adanya asam campuran. Hasil positif pada uji ini ditandai dengan medium berwarna merah dengan penambahan indikator merah metil. Uji VP menunjukkan adanya bakteri yang memfermentasikan glukosa dengan jalur 2,3-butanadiol. Dengan adanya reagen barrit dapat dengan mudah mendeteksi adanya asetoin yang merupakan prekursor 2,3-butandiol. Reagen ini terdiri dari α-naftol dan KOH yang mengubah warna medium dari kuning menjadi merah (Yu & Washington 1985). Pada penelitaian ini dua isolat menghasilkan reaksi positif dan
delapan lainnya menghasilkan reaksi negatif pada uji MR, sedangkan pada ujii VP lima isolat menghasilkan reaksi positif dan lima lainnya menghasilkan reaksi negatif. Menurut Madigan et. al (2009) pada uji MR
Shigella menghasilkan reaksi positif, sedangkan pada uji VP menghasilkan reaksi negatif. Hasil berbeda ditunjukkan oleh Dodd & Jones (1982) yang melaporkan spesies lain dari Shigella menunjukkan hasil yang sebaliknya pada uji MR-VP. Hasil uji biokimia MR-VP dapat dilihat pada Gambar 3.
Uji urea bertujuan untuk membedakan Shigella dari anggota enterobacteriacea yang memiliki enzim urease. Kaldu urea merupakan larutan ekstrak khamir dan urea yang diberi larutan penyangga. Medium tersebut mengandung merah fenol sebagai indikator pH. Jika organisme menghasilkan urease pada uji ini maka amoniak yang dilepaskan dari molekul urea akan merubah pH menjadi alkalin dan hal ini dapat diditeksi dengan indikator No.
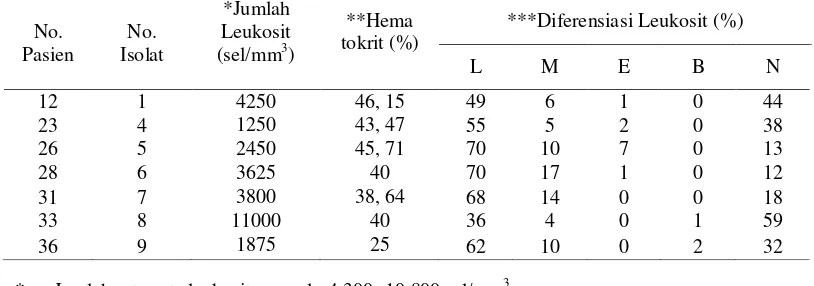
Pasien
No. Isolat
*Jumlah Leukosit (sel/mm3)
**Hema tokrit (%)
***Diferensiasi Leukosit (%)
L M E B N
12 1 4250 46, 15 49 6 1 0 44
23 4 1250 43, 47 55 5 2 0 38
26 5 2450 45, 71 70 10 7 0 13
28 6 3625 40 70 17 1 0 12
31 7 3800 38, 64 68 14 0 0 18
33 8 11000 40 36 4 0 1 59
36 9 1875 25 62 10 0 2 32
A B
Gambar 3 Uji MR-VP
6
merah fenol yang akan merubah larutan dari merah jingga menjadi merah ungu (Goh et al. 1994). Pada penelitian sepuluh sampel yang diduga Shigella menghasilkan reaksi negatif pada uji urea (Gambar 4). Hasil ini sesuai Madigan et. al (2009) bahwa Shigella
tidak dapat menghidrolisis urea menjadi amioniak.
Uji H2S menggunakan agar TSI. Agar TSI digunakan untuk mengetahui terjadinya fermentasi karbohidrat serta mengetahui terjadinya produksi H2S. Agar TSI terdiri dari 10% sukrosa, 10% laktosa, dan 1% glukosa (Yu dan Washington 1985). Fermentasi glukosa ditandai dengan warna kuning dibagian dasar dan merah pada bagian miring agar. Warna kuning pada keseluruhan agar menunjukkan fermentasi sukrosa dan laktosa. Produksi H2S ditandai dengan adanya warna hitam pada bagian dasar medium. Gas H2S yang terbentuk dapat berasal dari reduksi tiosulfat atau reaksi yang melibatkan sisteina. Enzim desulfhidrase mengkatalisis pembentukan H2S, amonia, dan piruvat dari sitein pada mikro organisme. Shigella merupakan bakteri yang tidak dapat menghasilkan H2S sehingga pada uji menghasilkan reaksi negatif (Madigan et al. 2009). Pada kesepuluh isolat yang diduga Shigella
menghasilkan reaksi negatif. Hasil uji biokimia H2S ditunjukkan pada Gambar 5.
Uji fermentasi karbohidrat menggunaan tabung durham yang berisi kaldu g