HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus
ASAL
TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR
MOCHAMAD YADI NURJAYADI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus
ASAL
TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR
MOCHAMAD YADI NURJAYADI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MOCHAMAD YADI NURJAYADI. HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus ASAL TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR. Dibimbing oleh LISDAR A MANAF dan DEDY DURYADI S.
Jamur Lentinus merupakan jamur pelapuk kayu yang berpotensi sebagai obat yang tersebar di berbagai kawasan daerah tropis dan subtropis. Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan jamur Lentinus isolat tropis berdasarkan sifat mikroskopik kultur dan sifat molekular. Sampel yang digunakan ialah Lentinus isolat LU3, LU10 (L. torulosus), LC4, LC6 (L. cladopus), LSC1, LSC7 (L. Sajor-caju), LP9 (L. quarrosulus), dan HS serta JTP (Pleurotus). Media yang digunakan adalah agar ekstrak malt pepton (AEMP) dan agar ekstrak malt (AEM) pada suhu 35°C untuk isolat Lentinus dan ±29°C untuk isolat HS dan JTP. Struktur mikroskopik kultur setiap isolat diamati setelah isolat berumur 2 dan 4 minggu. Analisis molekular dilakukan dengan mengamplifikasi DNA berdasarkan metode PCR-RAPD dengan menggunakan 2 primer acak tunggal 10-mer, yaitu RP1 dan RP3. Sifat mikroskopik kultur dan molekular dinyatakan ke dalam data biner dan diolah dengan program MEGA 4.1. Hasil pengamatan menunjukkan bahwa beberapa isolat Lentinus yang ditumbuhkan pada media AEMP memiliki penampakan koloni yang berbeda dengan penampakan koloni pada media AEM. Berdasarkan pohon kekerabatan mikroskopik kultur dan molekular, isolat Pleurotus (JTP) berada di luar kelompok A (kelompok Lentinus dan HS) sebagai out group. Kelompok A terbagi menjadi dua cabang yaitu HS dan kelompok Lentinus (B, C, D). Berdasarkan sifat molekular kelompok Lentinus terdiri dari kelompok B dengan nilai konsistensi (NK) 57% yang terdiri dari LP9 dan LSC1 (NK=89%) dan kelompok C dengan NK 20%. Kelompok C terdiri dari LSC7 dan LC6 (NK=65%) dan kelompok D dengan NK=45%. Kelompok D terdiri dari isolat LU10 dan isolat LC4 dan LU3 (NK=46%). Hubungan kekerabatan Lentinus berdasarkan molekular belum spesifik sehingga perlu dianalisis kembali dengan penambahan primer lain.
ABSTRACT
MOCHAMAD YADI NURJAYADI. PHYLOGENY RELATIONSHIP OF SEVERAL TROPICAL Lentinus BASED ON MICROSCOPIC AND MOLECULAR CHARACTERS.
Supervised by LISDAR A MANAF and DEDY DURYADI S.
Judul Skripsi : Hubungan Kekerabatan Beberapa isolat
Lentinus
Asal Tropis
Berdasarkan Sifat Mikroskopik Kultur dan Molekular
Nama
: Mochamad Yadi Nurjayadi
NIM
: G34104080
Menyetujui,
Mengetahui :
Ketua Departemen,
Dr. Ir. Ence Darmo Jaya Supena, M. Si
NIP 19641002 198903 1 002
Tanggal Lulus :
Pembimbing I
Dr. Ir. Lisdar A. Manaf
NIP 19591018 198403 2 001
Pembimbing II
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT, karena atas rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi hasil penelitian ini. Penelitian yang berlangsung dari bulan Oktober 2008 hingga Juni 2009 ini berjudul Hubungan Kekerabatan Beberapa Isolat Lentinus Asal Tropis Berdasarkan Sifat Mikroskopik dan Molekular.
Terima kasih penulis sampaikan kepada ibu Dr. Ir. Lisdar A Manaf dan bapak Dr. Ir. Dedy Duryadi Solihin, DEA selaku pembimbing atas bimbingan, saran dan arahan selama proses penelitian dan penyelesaian skripsi ini. Terima kasih juga penulis ucapkan kepada Dr. Nunik Sri Ariyanti M.Si. selaku dosen penguji atas semua masukan yang telah diberikan.
Terima kasih juga penulis sampaikan kepada bapak Iwa K selaku teknisi Laboratorium Mikrobiologi dan Biokimia dan Bapak Heri selaku teknisi Laboratorium Biologi Molekular PPSHB IPB, dan kepada seluruh staf Departemen Biologi atas fasilitas, saran, dan bantuannya.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada kedua orang tua dan kakak-kakak tersayang atas segala doa, dukungan, dan kasih sayang. Terima kasih juga penulis sampaikan kepada teman-teman biologi angkatan 41 khususnya anak-anak ”8” (Uma, Moris, Andik, Pams, Kushi, Muza, Budi), Deny K, Tina, Iffa, Disti, Achied, Melput, Idha, Forhuman (Romzie, Rizal, Ajeng, Nurul, Winda) dan anak-anak Lamin Dentis (Zein, Farid, Okoy, Bogie, Awang, Dede) atas semua kebersamaan dan hari-hari indah yang telah dijalani. Tidak lupa penulis juga manyampaikan terima kasih kepada ibu-ibu, bapak-bapak, dan mba-mba yang ada di Laboratorium Biologi Molekular khususnya Mba Andri, Bu Septi, Bu Rossa, Bu Suri, dan Mba Handay atas dukungan, nasihat, dan kebersamaannya.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna. Oleh karena itu, kritik dan saran yang membangun sangat diharapkan. Semoga laporan ini dapat bermanfaat.
Bogor, Desember 2009
RIWAYAT HIDUP
Penulis dilahirkan tanggal 12 Nopember 1986 di Cirebon, Jawa Barat. Anak kelima dari lima bersaudara pasangan Bapak Iing Sanjaya dan Ibu Dasih.
Tahun 2004 penulis lulus dari SMUN 3 Cirebon dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama masa perkuliahan, penulis aktif berorganisasi di dalam maupun di luar kampus. Selain itu, penulis juga aktif mengikuti berbagai kegiatan yang bersifat kerohanian, kewirausahaan, pelatihan motivasi, dan latihan kepemimpinan. Tahun 2006 - 2009 penulis aktif menjadi asisten praktikum, yaitu mata kuliah Pendidikan Agama Islam, Fisiologi Tumbuhan, Biologi Cendawan, dan Biologi Dasar.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE Bahan dan Alat... 2
Metode Penelitian ... 2
Pengamatan Struktur Koloni dan Mikroskopik ... 2
Perbanyakan Biakan Isolat ... 2
Perbanyakan Koloni dan Isolasi DNA ... 2
Analisis PCR-RAPD ... 3
Analisis Molekular ... 3
HASIL Penampakan Koloni dan Sifat Mikroskopik Kultur ... 3
Analisis PCR-RAPD ... 5
PEMBAHASAN Penampakan Koloni dan Sifat Mikroskopik Kultur ... 6
Hubungan kekerabatan ... 7
SIMPULAN ... 9
SARAN ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1. Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP)di media AEMP dan AEM ... 4 2. Sifat mikroskopik kultur isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) di media AEMP dan AEM pada minggu ke-2 dan 4... 5
DAFTAR GAMBAR
Halaman
1. Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) berdasarkan sifat mikroskopik kultur... 4 2. Hasil amplifikasi DNA isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) dengan metode PCR-RAPD dengan menggunakan primer RP1 (a) dan RP3 (b) ... 6 3. Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS,dan Pleurotus (JTP) berdasarkan sifat molekular.. ... 6 4. Struktur mikroskopik: (a) hifa terwarnai isolat LP9, (b) sambungan apit isolat HS,
(c) artrospora isolat LU3, (d) hifa berdinding tebal dan tipis isolat LU10, (e) sel gembung isolat LSC1, (f) ujung hifa gembung isolat LC4, (g) klamidospora isolat
LSC1, (h) konidia dan konidiofor isolat HS, (i) kristal isolat LC4 ... 8
DAFTAR LAMPIRAN
Halaman
1. Komposisi media dalam satu liter ... 12 2. Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP)pada media AEMP dan AEM ... 13 3. Istilah penampakan koloni ... 15 4. Bilangan biner berdasarkan keberadaan pita dalam primer RP1 dan RP3
pada isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan
PENDAHULUAN
Latar Be lakang
Jamur Lentinus seperti halnya Ganoderma, Trametes, Polyporus, dan Fomes merupakan salah satu jamur pelapuk kayu yang tersebar di berbagai kawasan tropis dan subtropis. Jamur Lentinus termasuk kelas Basidiomycetes, ordo Polyporales dengan famili Lentinaceae yang memiliki tubuh buah makroskopik dengan struktur liat dan kokoh serta tahan lama (Sudirman 1995). Pada umumnya jamur ini memiliki ciri-ciri sebagai berikut: berbentuk seperti payung; berukuran sedang; warna beragam; permukaan tudung (pileus) halus, berbulu atau bersisik dengan bagian tengah melengkung ke bawah (depressed), berlekuk ke dalam (umbilicate); tangkai pada umumnya tidak di tengah atau eksentrik, kadang-kadang membentuk beberapa cabang sehingga terlihat seperti tandan; lamela rapat dan turun mencapai tangkai (decurrent); spora berwarna putih (Pegler dan Young 1983).
Beberapa jenis Lentinus dapat menghasilkan senyawa aktif yang dapat menghambat patogen penyakit (antimikrob, antibakteri, antifungi) dan berkhasiat sebagai antikolesterol dan antihipertensi selain dapat sebagai bahan pangan. Diantara jenis Lentinus asal tropis yang telah diteliti adalah L. cladopus, L. sajor-caju, L. squarrosulus, dan L. torulosus (Sudirman 2005).
Untuk melihat morfologi dan perkembangan tubuh beberapa spesies Lentinus yang diisolasi dari alam telah dicoba ditumbuhkan pada substrat serbuk gergaji. Dari hasil penelitian tersebut terlihat adanya keragaman morfologi pada tubuh buah dewasa, walaupun pada tubuh buah yang belum dewasa tidak menunjukkan perbedaan bentuk dan warna (Sudirman 1995).
Telaah fisiologi dapat dilakukan dengan membandingkan pertumbuhan kultur miselium pada berbagai kondisi lingkungan dan melakukan uji reaksi oksidasi pada media agar dalam menumbuhkan kultur. Rosa (1996) telah melakukan uji sifat fisiologi pada isolat-isolat Lentinus yang telah dikulturkan dari alam yang meliputi LPM, LSC, LPT, LP, LU, LCEL, dan LC. Hasil penelitian yang diperoleh adalah seluruh isolat mampu tumbuh optimal pada beberapa kondisi lingkungan dan memiliki reaksi positif pada uji oksidasi di media agar asam galat (AAG) dan agar asam tanat (AAT). Sedangkan uji pada asam tirosin (AT) menghasilkan reaksi negatif. Kesamaan sifat fisiologi tersebut
kemudian dibagi menjadi tiga kelompok. Kelompok yang pertama meliputi LPM, LSC, dan LPT. Bagian kelompok kedua mencakup isolat LP. Untuk kelompok ketiga terdiri dari LU, LCEL, dan LC.
Keanekaragaman spesies dapat disebabkan karena telah terjadi perubahan susunan nukleotida penyusun DNA. Perubahan ini dapat mempengaruhi fenotipe suatu organisme atau mempengaruhi reaksi individu terhadap lingkungan tertentu. Secara umum keanekaragaman genetik dari suatu populasi dapat terjadi karena adanya mutasi, rekombinasi, atau migrasi gen dari satu tempat ke tempat lain (Pereira et al. 2008). Tingkat kekerabatan genus Lentinus dapat dilakukan baik berdasarkan kesamaan sifat morfologi tubuh buah, sifat fisiologi, sifat mikroskopik di media kultur maupun berdasarkan sifat molekular.
Metode PCR-RAPD merupakan teknik penanda molekular yang digunakan untuk mempelajari keragaman genetik spesies. Dasar analisis RAPD adalah menggunakan mesin PCR yang mampu mengamplifikasi sekuen DNA secara in vitro. Teknik ini menggunakan sepasang primer random yang masing-masing berukuran 10 basa. Penggunaan penanda RAPD relatif sederhana dan mudah dalam hal preparasi. Teknik RAPD memberikan hasil yang lebih cepat dibandingkan dengan teknik molekular lainnya. Teknik ini juga mampu menghasilkan jumlah karakter yang relatif tidak terbatas, sehingga sangat membantu untuk keperluan analisis keanekaragaman organisme yang tidak diketahui latar belakang genomnya. Teknik RAPD sering digunakan untuk membedakan organisme tingkat tinggi (eucaryote) (Saunders dan Helen 1999).
Penelitian tentang kekerabatan Lentinus isolat tropis belum banyak yang melakukannya. Berdasarkan penelitian terdahulu, Noverita (2005) telah melakukan pengelompokkan isolat Pleurotus liar dan domestik melalui sifat molekular dengan metode PCR-RAPD. Pada penelitian tersebut digunakan isolat Lentinus sebagai out group.
Tujuan
Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan jamur Lentinus isolat tropis berdasarkan struktur sifat kultur mikroskopik dan sifat molekular.
Waktu dan Tempat
Laboratorium Biologi dan Molekular Pusat Penelitan Sumberdaya Hayati dan Bioteknologi IPB (PPSHB-IPB) kampus IPB Dramaga, Bogor mulai bulan Oktober 2008 sampai dengan Juni 2009.
BAHAN DAN METODE
Bahan dan Alat
Sampel yang digunakan ialah isolat koleksi Dr. Ir. Lisdar A Manaf meliputi isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), isolat HS, dan isolat Pleurotus (JTP), media agar ekstrak malt pepton (AEMP), media agar ekstrak malt (AEM), media agar sukrosa kentang (ASK), ekstrak malt pepton cair (EMPC) (Lampiran 1), larutan KOH, larutan eosin 1%, larutan purifikasi cetyltrimethylammonium bromide (CTAB) buffer, gel agarosa 1.2%, etidium bromida, 2 primer acak tunggal (RP-1, RP-3), akuabides, larutan amplifikasi (Tris-HCl pH8, KCl, ethylenediaminetetraacetic acid (EDTA), dithiothreitol (DTT), gliserol, MgCl2, dNTP, enzim Taqpolymerase.
Alat yang digunakan adalah: cawan Petri, Erlenmeyer 250 ml, gelas ukur, cord borer, scalpel, pipet pastur, lampu spirtus, autoclaf, laminar air flow, incubator, kertas saring Whatman no 1, tabung Eppendorf, mesin PCR, alat elektroforesis, sinar UV transiluminator.
Me tode Pe nelitian
Pengamatan Penampakan Koloni dan Sifat Mikroskopik Kultur. Kultur masing-masing isolat diamati penampakan dan sifat kulturnya secara mikroskopik setelah ditumbuhkan di media AEM dan AMP. Penampakan koloni diamati setelah umur isolat berumur 6 hingga 7 hari. Sedangkan sifat mikroskopik kultur diamati pada saat isolat berumur 2 dan 4 minggu. Pengamatan dilakukan dengan cara mengambil miselium dan struktur koloni yang kemudian diletakkan di atas preparat yang telah diberi larutan KOH (Kalium hidroksida) dan larutan pewarna eosin 1%.
Keberadaan sifat mikroskopik kultur kemudian divisualisasikan ke dalam bentuk pohon kekerabatan melalui program MEGA 4.1. Penampakan yang dilihat meliputi sambungan apit, klamidospora, konidia, oidia, basidia, basidiospora, seta, sel veskikular, cabang stag-horn, hifa terwarnai larutan eosin, hifa tidak terwarnai larutan eosin, hifa incrusted, kristal, sel gembung, ujung hifa
gembung, dan hifa besar berdinding tipis. Metode yang dilakukan berdasarkan angka bilangan biner, yaitu angka 1 menunjukkan ada struktur mikroskopik dan angka 0 tidak ada. Selanjutnya dimasukkan ke dalam program MEGA 4.1 metode parsimoni maksimum.
Pe rbanyakan Biakan Isolat. Koloni masing-masing isolat Lentinus diinokulasi pada media AMP dengan teknik aseptik. Isolat yang telah diinokulasi kemudian diinkubasi pada suhu 35oC selama 7 hari. Pada hari terakhir miselium akan menutupi seluruh permukaan media cawan (Rosa 1996).
Pe rbanyakan Koloni dan Isolasi DNA.
Kultur yang sudah berumur 7 hari pada AEMP, dipotong dengan cord borer steril yang berdiameter 7 mm dan diambil dengan menggunakan scalpel steril. Kemudian satu inokulum diinokulasikan pada permukaan larutan 100 ml media EMPC steril dalam Erlenmeyer 250 mlI sebanyak dua ulangan dan diinkubasikan pada suhu 35oC dalam keadaan statik (Rosa 1996). Bila permukaan medium telah dipenuhi oleh miselium jamur maka miselium jamur dipanen dan dipisahkan dari medium cair dengan kertas saring Whatman No.1.
HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus
ASAL
TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR
MOCHAMAD YADI NURJAYADI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus
ASAL
TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR
MOCHAMAD YADI NURJAYADI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MOCHAMAD YADI NURJAYADI. HUBUNGAN KEKERABATAN BEBERAPA ISOLAT
Lentinus ASAL TROPIS BERDASARKAN SIFAT MIKROSKOPIK KULTUR DAN
MOLEKULAR. Dibimbing oleh LISDAR A MANAF dan DEDY DURYADI S.
Jamur Lentinus merupakan jamur pelapuk kayu yang berpotensi sebagai obat yang tersebar di berbagai kawasan daerah tropis dan subtropis. Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan jamur Lentinus isolat tropis berdasarkan sifat mikroskopik kultur dan sifat molekular. Sampel yang digunakan ialah Lentinus isolat LU3, LU10 (L. torulosus), LC4, LC6 (L. cladopus), LSC1, LSC7 (L. Sajor-caju), LP9 (L. quarrosulus), dan HS serta JTP (Pleurotus). Media yang digunakan adalah agar ekstrak malt pepton (AEMP) dan agar ekstrak malt (AEM) pada suhu 35°C untuk isolat Lentinus dan ±29°C untuk isolat HS dan JTP. Struktur mikroskopik kultur setiap isolat diamati setelah isolat berumur 2 dan 4 minggu. Analisis molekular dilakukan dengan mengamplifikasi DNA berdasarkan metode PCR-RAPD dengan menggunakan 2 primer acak tunggal 10-mer, yaitu RP1 dan RP3. Sifat mikroskopik kultur dan molekular dinyatakan ke dalam data biner dan diolah dengan program MEGA 4.1. Hasil pengamatan menunjukkan bahwa beberapa isolat Lentinus yang ditumbuhkan pada media AEMP memiliki penampakan koloni yang berbeda dengan penampakan koloni pada media AEM. Berdasarkan pohon kekerabatan mikroskopik kultur dan molekular, isolat Pleurotus (JTP) berada di luar kelompok A (kelompok Lentinus dan HS) sebagai out group. Kelompok A terbagi menjadi dua cabang yaitu HS dan kelompok Lentinus (B, C, D). Berdasarkan sifat molekular kelompok Lentinus terdiri dari kelompok B dengan nilai konsistensi (NK) 57% yang terdiri dari LP9 dan LSC1 (NK=89%) dan kelompok C dengan NK 20%. Kelompok C terdiri dari LSC7 dan LC6 (NK=65%) dan kelompok D dengan NK=45%. Kelompok D terdiri dari isolat LU10 dan isolat LC4 dan LU3 (NK=46%). Hubungan kekerabatan Lentinus berdasarkan molekular belum spesifik sehingga perlu dianalisis kembali dengan penambahan primer lain.
ABSTRACT
MOCHAMAD YADI NURJAYADI. PHYLOGENY RELATIONSHIP OF SEVERAL TROPICAL Lentinus BASED ON MICROSCOPIC AND MOLECULAR CHARACTERS.
Supervised by LISDAR A MANAF and DEDY DURYADI S.
Judul Skripsi : Hubungan Kekerabatan Beberapa isolat
Lentinus
Asal Tropis
Berdasarkan Sifat Mikroskopik Kultur dan Molekular
Nama
: Mochamad Yadi Nurjayadi
NIM
: G34104080
Menyetujui,
Mengetahui :
Ketua Departemen,
Dr. Ir. Ence Darmo Jaya Supena, M. Si
NIP 19641002 198903 1 002
Tanggal Lulus :
Pembimbing I
Dr. Ir. Lisdar A. Manaf
NIP 19591018 198403 2 001
Pembimbing II
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT, karena atas rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi hasil penelitian ini. Penelitian yang berlangsung dari bulan Oktober 2008 hingga Juni 2009 ini berjudul Hubungan Kekerabatan Beberapa Isolat Lentinus Asal Tropis Berdasarkan Sifat Mikroskopik dan Molekular.
Terima kasih penulis sampaikan kepada ibu Dr. Ir. Lisdar A Manaf dan bapak Dr. Ir. Dedy Duryadi Solihin, DEA selaku pembimbing atas bimbingan, saran dan arahan selama proses penelitian dan penyelesaian skripsi ini. Terima kasih juga penulis ucapkan kepada Dr. Nunik Sri Ariyanti M.Si. selaku dosen penguji atas semua masukan yang telah diberikan.
Terima kasih juga penulis sampaikan kepada bapak Iwa K selaku teknisi Laboratorium Mikrobiologi dan Biokimia dan Bapak Heri selaku teknisi Laboratorium Biologi Molekular PPSHB IPB, dan kepada seluruh staf Departemen Biologi atas fasilitas, saran, dan bantuannya.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada kedua orang tua dan kakak-kakak tersayang atas segala doa, dukungan, dan kasih sayang. Terima kasih juga penulis sampaikan kepada teman-teman biologi angkatan 41 khususnya anak-anak ”8” (Uma, Moris, Andik, Pams, Kushi, Muza, Budi), Deny K, Tina, Iffa, Disti, Achied, Melput, Idha, Forhuman (Romzie, Rizal, Ajeng, Nurul, Winda) dan anak-anak Lamin Dentis (Zein, Farid, Okoy, Bogie, Awang, Dede) atas semua kebersamaan dan hari-hari indah yang telah dijalani. Tidak lupa penulis juga manyampaikan terima kasih kepada ibu-ibu, bapak-bapak, dan mba-mba yang ada di Laboratorium Biologi Molekular khususnya Mba Andri, Bu Septi, Bu Rossa, Bu Suri, dan Mba Handay atas dukungan, nasihat, dan kebersamaannya.
Penulis menyadari bahwa laporan ini masih jauh dari sempurna. Oleh karena itu, kritik dan saran yang membangun sangat diharapkan. Semoga laporan ini dapat bermanfaat.
Bogor, Desember 2009
RIWAYAT HIDUP
Penulis dilahirkan tanggal 12 Nopember 1986 di Cirebon, Jawa Barat. Anak kelima dari lima bersaudara pasangan Bapak Iing Sanjaya dan Ibu Dasih.
Tahun 2004 penulis lulus dari SMUN 3 Cirebon dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru).
Selama masa perkuliahan, penulis aktif berorganisasi di dalam maupun di luar kampus. Selain itu, penulis juga aktif mengikuti berbagai kegiatan yang bersifat kerohanian, kewirausahaan, pelatihan motivasi, dan latihan kepemimpinan. Tahun 2006 - 2009 penulis aktif menjadi asisten praktikum, yaitu mata kuliah Pendidikan Agama Islam, Fisiologi Tumbuhan, Biologi Cendawan, dan Biologi Dasar.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE Bahan dan Alat... 2
Metode Penelitian ... 2
Pengamatan Struktur Koloni dan Mikroskopik ... 2
Perbanyakan Biakan Isolat ... 2
Perbanyakan Koloni dan Isolasi DNA ... 2
Analisis PCR-RAPD ... 3
Analisis Molekular ... 3
HASIL Penampakan Koloni dan Sifat Mikroskopik Kultur ... 3
Analisis PCR-RAPD ... 5
PEMBAHASAN Penampakan Koloni dan Sifat Mikroskopik Kultur ... 6
Hubungan kekerabatan ... 7
SIMPULAN ... 9
SARAN ... 9
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1. Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP)di media AEMP dan AEM ... 4 2. Sifat mikroskopik kultur isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) di media AEMP dan AEM pada minggu ke-2 dan 4... 5
DAFTAR GAMBAR
Halaman
1. Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) berdasarkan sifat mikroskopik kultur... 4 2. Hasil amplifikasi DNA isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP) dengan metode PCR-RAPD dengan menggunakan primer RP1 (a) dan RP3 (b) ... 6 3. Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS,dan Pleurotus (JTP) berdasarkan sifat molekular.. ... 6 4. Struktur mikroskopik: (a) hifa terwarnai isolat LP9, (b) sambungan apit isolat HS,
(c) artrospora isolat LU3, (d) hifa berdinding tebal dan tipis isolat LU10, (e) sel gembung isolat LSC1, (f) ujung hifa gembung isolat LC4, (g) klamidospora isolat
LSC1, (h) konidia dan konidiofor isolat HS, (i) kristal isolat LC4 ... 8
DAFTAR LAMPIRAN
Halaman
1. Komposisi media dalam satu liter ... 12 2. Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9),
HS, dan Pleurotus (JTP)pada media AEMP dan AEM ... 13 3. Istilah penampakan koloni ... 15 4. Bilangan biner berdasarkan keberadaan pita dalam primer RP1 dan RP3
pada isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan
PENDAHULUAN
Latar Be lakang
Jamur Lentinus seperti halnya Ganoderma, Trametes, Polyporus, dan Fomes merupakan salah satu jamur pelapuk kayu yang tersebar di berbagai kawasan tropis dan subtropis. Jamur Lentinus termasuk kelas Basidiomycetes, ordo Polyporales dengan famili Lentinaceae yang memiliki tubuh buah makroskopik dengan struktur liat dan kokoh serta tahan lama (Sudirman 1995). Pada umumnya jamur ini memiliki ciri-ciri sebagai berikut: berbentuk seperti payung; berukuran sedang; warna beragam; permukaan tudung (pileus) halus, berbulu atau bersisik dengan bagian tengah melengkung ke bawah (depressed), berlekuk ke dalam (umbilicate); tangkai pada umumnya tidak di tengah atau eksentrik, kadang-kadang membentuk beberapa cabang sehingga terlihat seperti tandan; lamela rapat dan turun mencapai tangkai (decurrent); spora berwarna putih (Pegler dan Young 1983).
Beberapa jenis Lentinus dapat menghasilkan senyawa aktif yang dapat menghambat patogen penyakit (antimikrob, antibakteri, antifungi) dan berkhasiat sebagai antikolesterol dan antihipertensi selain dapat sebagai bahan pangan. Diantara jenis Lentinus asal tropis yang telah diteliti adalah L. cladopus, L. sajor-caju, L. squarrosulus, dan L. torulosus (Sudirman 2005).
Untuk melihat morfologi dan perkembangan tubuh beberapa spesies Lentinus yang diisolasi dari alam telah dicoba ditumbuhkan pada substrat serbuk gergaji. Dari hasil penelitian tersebut terlihat adanya keragaman morfologi pada tubuh buah dewasa, walaupun pada tubuh buah yang belum dewasa tidak menunjukkan perbedaan bentuk dan warna (Sudirman 1995).
Telaah fisiologi dapat dilakukan dengan membandingkan pertumbuhan kultur miselium pada berbagai kondisi lingkungan dan melakukan uji reaksi oksidasi pada media agar dalam menumbuhkan kultur. Rosa (1996) telah melakukan uji sifat fisiologi pada isolat-isolat Lentinus yang telah dikulturkan dari alam yang meliputi LPM, LSC, LPT, LP, LU, LCEL, dan LC. Hasil penelitian yang diperoleh adalah seluruh isolat mampu tumbuh optimal pada beberapa kondisi lingkungan dan memiliki reaksi positif pada uji oksidasi di media agar asam galat (AAG) dan agar asam tanat (AAT). Sedangkan uji pada asam tirosin (AT) menghasilkan reaksi negatif. Kesamaan sifat fisiologi tersebut
kemudian dibagi menjadi tiga kelompok. Kelompok yang pertama meliputi LPM, LSC, dan LPT. Bagian kelompok kedua mencakup isolat LP. Untuk kelompok ketiga terdiri dari LU, LCEL, dan LC.
Keanekaragaman spesies dapat disebabkan karena telah terjadi perubahan susunan nukleotida penyusun DNA. Perubahan ini dapat mempengaruhi fenotipe suatu organisme atau mempengaruhi reaksi individu terhadap lingkungan tertentu. Secara umum keanekaragaman genetik dari suatu populasi dapat terjadi karena adanya mutasi, rekombinasi, atau migrasi gen dari satu tempat ke tempat lain (Pereira et al. 2008). Tingkat kekerabatan genus Lentinus dapat dilakukan baik berdasarkan kesamaan sifat morfologi tubuh buah, sifat fisiologi, sifat mikroskopik di media kultur maupun berdasarkan sifat molekular.
Metode PCR-RAPD merupakan teknik penanda molekular yang digunakan untuk mempelajari keragaman genetik spesies. Dasar analisis RAPD adalah menggunakan mesin PCR yang mampu mengamplifikasi sekuen DNA secara in vitro. Teknik ini menggunakan sepasang primer random yang masing-masing berukuran 10 basa. Penggunaan penanda RAPD relatif sederhana dan mudah dalam hal preparasi. Teknik RAPD memberikan hasil yang lebih cepat dibandingkan dengan teknik molekular lainnya. Teknik ini juga mampu menghasilkan jumlah karakter yang relatif tidak terbatas, sehingga sangat membantu untuk keperluan analisis keanekaragaman organisme yang tidak diketahui latar belakang genomnya. Teknik RAPD sering digunakan untuk membedakan organisme tingkat tinggi (eucaryote) (Saunders dan Helen 1999).
Penelitian tentang kekerabatan Lentinus isolat tropis belum banyak yang melakukannya. Berdasarkan penelitian terdahulu, Noverita (2005) telah melakukan pengelompokkan isolat Pleurotus liar dan domestik melalui sifat molekular dengan metode PCR-RAPD. Pada penelitian tersebut digunakan isolat Lentinus sebagai out group.
Tujuan
Penelitian ini bertujuan untuk mengetahui hubungan kekerabatan jamur Lentinus isolat tropis berdasarkan struktur sifat kultur mikroskopik dan sifat molekular.
Waktu dan Tempat
Laboratorium Biologi dan Molekular Pusat Penelitan Sumberdaya Hayati dan Bioteknologi IPB (PPSHB-IPB) kampus IPB Dramaga, Bogor mulai bulan Oktober 2008 sampai dengan Juni 2009.
BAHAN DAN METODE
Bahan dan Alat
Sampel yang digunakan ialah isolat koleksi Dr. Ir. Lisdar A Manaf meliputi isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), isolat HS, dan isolat Pleurotus (JTP), media agar ekstrak malt pepton (AEMP), media agar ekstrak malt (AEM), media agar sukrosa kentang (ASK), ekstrak malt pepton cair (EMPC) (Lampiran 1), larutan KOH, larutan eosin 1%, larutan purifikasi cetyltrimethylammonium bromide (CTAB) buffer, gel agarosa 1.2%, etidium bromida, 2 primer acak tunggal (RP-1, RP-3), akuabides, larutan amplifikasi (Tris-HCl pH8, KCl, ethylenediaminetetraacetic acid (EDTA), dithiothreitol (DTT), gliserol, MgCl2, dNTP, enzim Taqpolymerase.
Alat yang digunakan adalah: cawan Petri, Erlenmeyer 250 ml, gelas ukur, cord borer, scalpel, pipet pastur, lampu spirtus, autoclaf, laminar air flow, incubator, kertas saring Whatman no 1, tabung Eppendorf, mesin PCR, alat elektroforesis, sinar UV transiluminator.
Me tode Pe nelitian
Pengamatan Penampakan Koloni dan Sifat Mikroskopik Kultur. Kultur masing-masing isolat diamati penampakan dan sifat kulturnya secara mikroskopik setelah ditumbuhkan di media AEM dan AMP. Penampakan koloni diamati setelah umur isolat berumur 6 hingga 7 hari. Sedangkan sifat mikroskopik kultur diamati pada saat isolat berumur 2 dan 4 minggu. Pengamatan dilakukan dengan cara mengambil miselium dan struktur koloni yang kemudian diletakkan di atas preparat yang telah diberi larutan KOH (Kalium hidroksida) dan larutan pewarna eosin 1%.
Keberadaan sifat mikroskopik kultur kemudian divisualisasikan ke dalam bentuk pohon kekerabatan melalui program MEGA 4.1. Penampakan yang dilihat meliputi sambungan apit, klamidospora, konidia, oidia, basidia, basidiospora, seta, sel veskikular, cabang stag-horn, hifa terwarnai larutan eosin, hifa tidak terwarnai larutan eosin, hifa incrusted, kristal, sel gembung, ujung hifa
gembung, dan hifa besar berdinding tipis. Metode yang dilakukan berdasarkan angka bilangan biner, yaitu angka 1 menunjukkan ada struktur mikroskopik dan angka 0 tidak ada. Selanjutnya dimasukkan ke dalam program MEGA 4.1 metode parsimoni maksimum.
Pe rbanyakan Biakan Isolat. Koloni masing-masing isolat Lentinus diinokulasi pada media AMP dengan teknik aseptik. Isolat yang telah diinokulasi kemudian diinkubasi pada suhu 35oC selama 7 hari. Pada hari terakhir miselium akan menutupi seluruh permukaan media cawan (Rosa 1996).
Pe rbanyakan Koloni dan Isolasi DNA.
Kultur yang sudah berumur 7 hari pada AEMP, dipotong dengan cord borer steril yang berdiameter 7 mm dan diambil dengan menggunakan scalpel steril. Kemudian satu inokulum diinokulasikan pada permukaan larutan 100 ml media EMPC steril dalam Erlenmeyer 250 mlI sebanyak dua ulangan dan diinkubasikan pada suhu 35oC dalam keadaan statik (Rosa 1996). Bila permukaan medium telah dipenuhi oleh miselium jamur maka miselium jamur dipanen dan dipisahkan dari medium cair dengan kertas saring Whatman No.1.
etanol absolut 2X volume dan disimpan di dalam freezer selama 30 menit. Kemudian sampel disentrifugasi dengan kecepatan 13000 rpm selama 5 menit. Larutan etanol absolut di dalam tabung Eppendorf dibuang dan diganti dengan larutan etanol 70% sebanyak 400 µl. Sampel disentrifugasi kembali dengan kecepatan 13000 rpm selama 3 menit dan larutan etanol 70% dibuang. Setelah tahapan ini akan terbentuk endapan putih yang merupakan ekstrak DNA. Ekstrak DNA kemudian dikeringanginkan selama 30 menit hingga dinding bagian dalam Eppendorf kering. Setelah itu, ekstrak DNA ditambah larutan TE (tris-EDTA buffer) sebanyak 50-100 µl dan diinkubasi pada suhu 37°C selama 15 menit. Sampel ekstrak DNA lalu di simpan di dalam freezer.
Ekstrak DNA yang dihasilkan dari masing-masing sampel diuji kemurnian dan kualitasnya dengan menggunakan 1.2 % gel agarosa elektroforesis pada voltase 85 Volt selama 45 menit di dalam larutan penyangga 1 x TBE (TrisBoric EDTA) kemudian diamati dan difoto dengan menggunakan alat UV-transiluminator.
Analisis PCR-RAPD. Analisis PCR-RAPD mengikuti metode Williams et al. (1990). Ekstrak DNA diamplifikasi dengan menggunakan 2 primer acak tunggal 10-mer: RP1 dan RP3 dengan bantuan mesin PCR (Gene Amp PCR System 2400 Perkin-Elmer). Volume campuran untuk amplifikasi adalah sebanyak 50μ l dengan kandungan: 34.75μ l akuabides, 5 μ l Buffer amplifikasi 10x (20mM Tris-HCl pH8, 100mM KCl, 0.1 mM EDTA, 50% gliserol), 3 μ l (25mM) MgCl2, 1.0 μ l
dNTP, 4.0 μ l primer RP1 atau RP3, 0.25 μ l (1 unit/reaksi) Taq polymerase. Campuran dibuat di dalam tabung Eppendorf 0.2 ml.
Amplifikasi DNA dengan mesin PCR melalui tahapan-tahapan sebagai berikut: tahap pertama, pra-amplifikasi selama 3 menit pada temperatur 94oC; tahap kedua, yaitu pemisahan utas DNA genom (denaturasi) pada temperatur 94oC selama 45 detik yang berlangsung sebanyak 35 siklus selanjutnya penempelan primer (annealing) pada temperatur 37oC selama 1 menit, elongasi pada temperatur 72oC selama 1.5 menit; dan tahap ketiga pasca amplifikasi pada
temperatur 72oC selama 5 menit. Hasil amplifikasi DNA akan dilanjutkan dengan tahap elektroforesis pada gel agarose dengan konsentrasi 1.2% pada voltase 85 Volt selama 45 menit di dalam larutan penyangga 1 x TBE kemudian diamati dan difoto dengan menggunakan alat UV-transiluminator.
Analisis Mo le kular. Data dianalisis berdasarkan hasil pemotretan gel berupa pola pita DNA, kemudian diterjemahkan ke dalam bilangan biner. Setiap pita dianggap mewakili satu karakter dan diberi nilai 1 bila pita ada dan 0 bila pita tidak ada. Penentuan dilakukan dengan mengambil garis lurus secara horisontal dengan membandingkan masing-masing fragmen DNA hasil PCR. Bilangan biner lalu dirubah menjadi urutan nukleotida. Pengelompokkan data disusun berdasarkan matrik kesamaan secara berpasangan (cluster analysis) dan pembuatan pohon kekerabatan dilakukan dengan metode parsimoni maksimum dengan program MEGA versi 4.1. Konsistensi pohon kekerabatan diuji dengan melakukan uji Bootstrap dengan 1000 ulangan.
HASIL
Pe nampakan Koloni dan Sifat Mikroskopik Kultur
Tabel 1 Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) di media AEMP dan AEM
Sifat mikroskopik kultur setiap isolat Lentinus, HS, dan Pleurotus yang ditumbuhi di media AEMP dan AEM pada minggu ke-2 dan ke-4 memiliki struktur yang sama (Tabel 2). Isolat Lentinus, HS, dan Pleurotus berubah menjadi hifa yang terwarnai (staining hyphae) setelah dilakukan pewarnaan larutan eosin. Struktur sambungan apit (clamp connection) ditemui hampir pada seluruh isolat Lentinus, HS, dan Pleurotus kecuali isolat LC4 dan LSC1. Sebagian besar isolat membentuk modifikasi hifa berupa sel gembung (swollen cell), ujung hifa gembung (swollen hyphal tip), hifa besar dan berdinding tipis (large thin-walled hyphae). Struktur klamidospora hanya terbentuk pada isolat LC4 dan LSC1. Sedangkan artrospora hanya dibentuk oleh isolat LU3 dan LSC7. Isolat HS memiliki
struktur modifikasi hifa berupa konidiofor dan konidia yang terletak diantara sambungan apit. Seluruh isolat Lentinus, HS, dan Pleurotus membentuk kristal (crystal) setelah penambahan larutan KOH dan pewarnaan eosin.
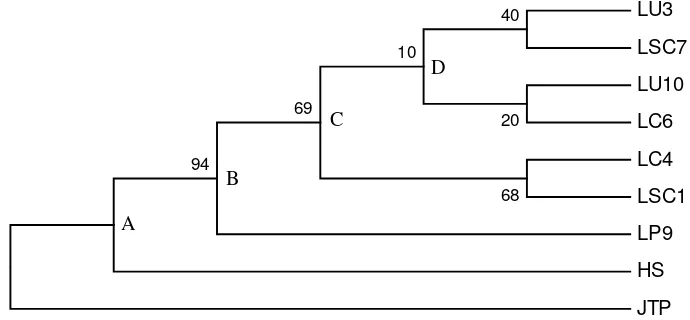
Hasil pohon kekerabatan berdasarkan penampakan mikroskopik kultur menunjukkan bahwa isolat JTP terpisah dari kelompok A. Pada kelompok A terbagi menjadi dua cabang yaitu isolat HS yang mengelompok sendiri dari kelompok Lentinus dan kelompok B, C, dan D (LP9, LSC1, LC4, LC6, LU10, LSC7, LU3). Nilai Konsistensi terbesar berada pada pangkal cabang kelompok B sebesar 94 % sedangkan nilai terkecil terdapat pada pangkal cabang kelompok D, yaitu 10 % (Gambar 1).
No Isolat Media
AEMP AEM
1 LU3 Plumose Silky
2 LU10 Plumose Lateral wolly
3 LC4 Plumose Concentric silky
4 LC6 Plumose Plumose
5 LSC1 Pulverulent Pulverulent 6 LSC7 Plumose Plumose
7 LP9 Silky Appressed
8 HS Concentric
cottony Plumose
9 JTP Concentric
cottony Plumose
Gambar 1 Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) berdasarkan sifat mikroskopik kultur. Angka pada setiap kelompok merupakan nilai konsistensi (%) yang diuji dengan uji Bootstrap 1000 ulangan melalui metode parsimoni maksimum.
[image:22.595.195.420.117.291.2] [image:22.595.141.486.558.718.2]Tabel 2 Sifat mikroskopik kultur isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) di media AEMP dan AEM pada minggu ke-2 dan 4 (Davidson et al. 1945)
Keter angan :
Tanda + : memiliki sifat mikroskopik kultur Tanda - : tidak memiliki sifat mikroskopik kultur Tanda ¹ : pertumbuhan miselium di dalam media agar
Tanda ² : pertumbuhan miselium di atas permukaan media agar
Analisis PCR-RAPD
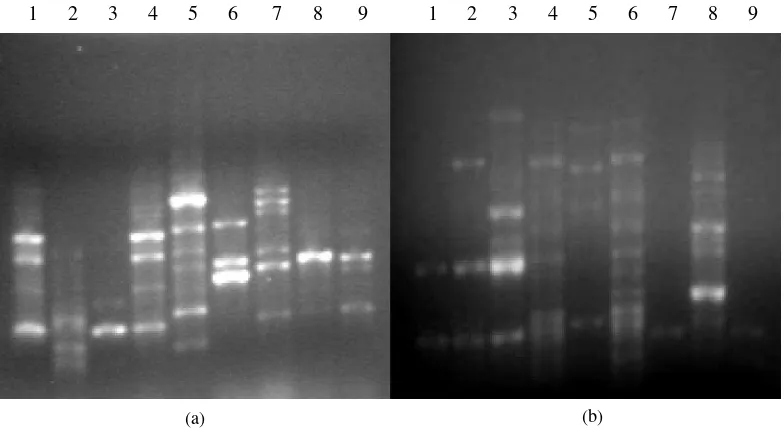
Hasil analisis yang dilakukan dengan menggunakan teknik PCR-RAPD ternyata dapat menghasilkan lebih dari satu fragmen DNA di setiap isolat Lentinus, HS, dan Pleurotus (Gambar 2). Metode ini dilakukan dengan menggunakan dua macam primer, yaitu RP1 dan RP3. Kedua primer ini berhasil mengamplifikasi seluruh isolat Lentinus, HS dan Pleurotus.
Hasil pohon filogenetik yang diperoleh menunjukkan bahwa isolat JTP memiliki perbedaan yang sangat jauh dengan isolat-isolat pada kelompok A. Kelompok A dapat
terbagi menjadi dua cabang, yaitu isolat HS yang mengelompok sendiri di luar dari isolat Lentinus lainnya dan cabang lainnya, yaitu kelompok B, C, D (LP9, LSC1, LSC7, LC6, LU10, LC4, LU3).
Kelompok B mencakup dua cabang, yaitu kelompok yang terdiri dari LSC1 dan LP9 dan kelompok C, D (LSC7, LC6, LU10, LC4, LU3). Tingkat konsistensi tertinggi sebesar 89% dan nilai paling kecil adalah 20% (Gambar 3). Hasil data biner dan pengelompokkan matrik kesamaan disajikan pada Lampiran 4.
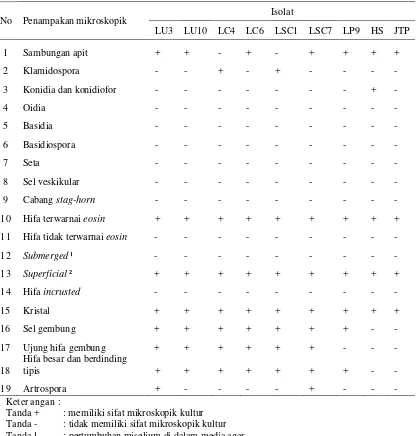
No Penampakan mikroskopik Isolat
LU3 LU10 LC4 LC6 LSC1 LSC7 LP9 HS JTP
1 Sambungan apit + + - + - + + + +
2 Klamidospora - - + - + - - - -
3 Konidia dan konidiofor - - - + -
4 Oidia - - - -
5 Basidia - - - -
6 Basidiospora - - - -
7 Seta - - - -
8 Sel veskikular - - - -
9 Cabang stag-horn - - - -
10 Hifa terwarnai eosin + + + + + + + + +
11 Hifa tidak terwarnai eosin - - - -
12 Submerged ¹ - - - -
13 Superficial ² + + + + + + + + +
14 Hifa incrusted - - - -
15 Kristal + + + + + + + + +
16 Sel gembung + + + + + + + - -
17 Ujung hifa gembung + + + + + + - - -
18
Hifa besar dan berdinding
tipis + + + + + + + - -
[image:23.595.107.523.121.557.2]1 2 3 4 5 6 7 8 9 1 2 3 4 5 6 7 8 9
Gambar 2 Hasil amplifikasi DNA isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) dengan metode PCR-RAPD dengan menggunakan primer RP1 (a) dan RP3 (b). Ket : 1: LU3, 2: LU10, 3: LC4, 4: LC6, 5: LSC1, 6: LSC7, 7: LP9, 8: HS, 9: JTP.
Gambar 3 Pohon kekerabatan isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) berdasarkan sifat molekular. Angka pada setiap kelompok merupakan nilai konsistensi (%) yang diuji dengan Bootstrap 1000 ulangan melalui metode parsimoni maksimum.
PEMBAHASAN
Pe nampakan Koloni dan Sifat Mikroskopik Kultur
Isolat Lentinus, HS, dan Pleurotus memiliki perbedaan penampakan koloni pada saat ditumbuhkan di media yang berbeda, yaitu media AEM dan AEMP. Pada media AEM seluruh isolat cenderung lebih tipis dan lambat dibandingkan dengan media AEMP. Penampakan koloni isolat Lentinus mengalami pertumbuhan yang lebih lebat dan cepat setelah ditumbuhkan di media AEMP
(Rosa 1996). Pertumbuhan miselium akan lebih optimal ketika diinkubasi pada suhu 35°C (Rosa 1996; Isla dan Noemia 2007). Kandungan pepton pada media AEMP lebih tinggi dibandingkan dengan media AEM. Pepton sebagai sumber nitrogen yang mampu meningkatkan jumlah biomassa miselium isolat Lentinus (Wu et al. 2008; Nwanze et al. 2005). Namun, Isla dan Noemia (2007) melaporkan bahwa Lentinus strigosus lebih optimal tumbuh di media ADK (agar dekstrosa kentang). Sedangkan isolat HS dan JTP lebih optimum tumbuh di media ASK
LU3
LC4
LU10
LC6
LSC7
LSC1
LP9
HS
JTP 89
65 46 45
20
57
(a) (b)
A
C
B
[image:24.595.112.504.84.299.2] [image:24.595.146.457.371.515.2]dalam suhu ± 29°C (Nurapriliani 2005; Noverita 2005).
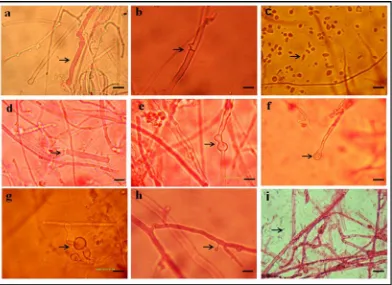
Hifa terwarnai merupakan penampakan yang terjadi pada hifa setelah diberi larutan eosin. Larutan ini memberikan warna kemerahan pada hifa (Gambar 4a). Seluruh isolat Lentinus, HS, dan Pleurotus memiliki struktur hifa yang terwarnai. Berdasarkan hasil kunci identifikasi jamur pelapuk kayu dari isolasi pohon oak menunjukkan bahwa hifa Pleurotusostreatus dan Lentinustigrinus tidak terwarnai oleh eosin (Davidson et al. 1945).
Sebagian besar isolat Lentinus, HS dan Pleurotus membentuk struktur sambungan apit (Gambar 4b). Beberapa jamur pelapuk kayu (wood decay fungi) mampu membentuk sambungan apit di setiap hifa septat secara teratur, ada yang tidak teratur, atau hanya pada hifa tertentu saja bahkan ada yang sama sekali tidak membentuk sambungan apit (Boidin 1971 diacu dalam Rayner & Lynne 1995). Hal ini dibuktikan pada isolat Lentinus, yaitu LC4 dan LSC1 yang tidak membentuk sambungan apit.
Pada isolat LU3 dan LSC7 membentuk struktur artrospora berupa fragmen-fragmen hifa yang berserakan (Gambar 4c). Struktur ini terbentuk ketika kondisi lingkungan media mengalami kondisi kering dan suhu yang panas (Schmidt 2006). Beberapa jamur pelapuk kayu yang dapat membentuk struktur ini diantaranya Serpula lacrymans, Coniophora puteana, Donkiopora expansa, Gloeophyllum trabeum, dan Lentinuslepideus (Schmidt 2006).
Struktur hifa besar dan berdinding tipis (Gambar 4d), sel gembung (Gambar 4e), ujung hifa gembung (Gambar 4f), dan klamidospora (Gambar 4g) merupakan bagian dari struktur modifikasi hifa juga yang terbentuk ketika kondisi lingkungan tidak menguntungkan. Spora aseksual lebih tahan terhadap kekeringan, panas, dan mampu menjadi cadangan makanan dibandingkan miseliumnya (Schmidt 2006). Struktur klamidospora terbentuk di bagian hifa interkalar, terminal, atau lateral. Perkembangannya dimulai ketika sel hifa vegetatif berdinding tipis menggembung (Clemencon 2003) yang kemudian dinding tersebut menebal dengan warna dinding sel kecoklatan (Schmidt 2006).
Struktur konidia dan konidiofor hanya dimiliki oleh isolat HS dengan bentuk seperti tetesan air (Gambar 4h). Tipe konidia ini
adalah blastokonidia, yaitu konidia yang dibentuk dari konidiogen yang menjadi satu konidia saja (soliter), beberapa konidia (catenulate) atau dalam bentuk kelompok (botryos) (Schmidt 2006). Bentuk tipe ini dimiliki pada spesies Heterobasidion annosum, Polyporus metamorphosus, dan Tyromyces amarus (Rayner dan Lynne1995). Pembentukan kristal terjadi setelah larutan KOH ditetesi pada preparat basah (Gambar 4i). Larutan KOH berfungsi untuk menyerap kandungan air yang ada di dalam miselium sehingga pengamatan akan tampak jelas tanpa adanya manipulasi (Davidson et al. 1945). Pembentukan kristal sering terdapat di bagian terminal maupun di dalam atau di atas struktur hifa interkalar. Sering pula, kristal terbentuk di dalam media pertumbuhan (Rayner dan Lynne 1995).
Hubungan Kekerabatan
Berdasarkan pohon kekerabatan pengamatan mikroskopik kultur, isolat Pleurotus (JTP) berada di luar kelompok isolat Lentinus dan HS. Pada analisis molekular yang telah dilakukan, isolat JTP tetap berada di luar kelompok kekerabatan dari isolat Lentinus dan HS dengan membentuk suatu out group. Hal ini membuktikan bahwa isolat JTP memang berbeda dengan isolat Lentinus dan HS.
Isolat HS berada di dalam kelompok A pada pohon kekerabatan pengamatan mikroskopik kultur maupun analisis molekular. Isolat ini terpisah dari isolat Lentinus dengan membentuk kelompok sendiri. Isolat HS memiliki tubuh buah agak lunak yang berada diantara isolat Lentinus dengan tubuh buah yang liat dan isolat Pleurotus yang memiliki tubuh buah lunak (Sudirman Komunikasi pribadi). Berdasarkan sifat fisiologi, isolat HS memiliki kesamaan dengan isolat Pleurotus (Nurapriliani 2005; Noverita 2005).
Hasil pohon kekerabatan pengamatan mikroskopik kultur pada kelompok B terpisah menjadi dua cabang yaitu isolat LP9 berada di kelompok sendiri dan kelompok B, C, D. Nilai konsistensi pada pangkal cabang kelompok B sebesar 94%, artinya dua cabang dari kelompok ini memiliki peluang untuk tetap mengelompok. Berdasarkan hasil analisis molekular terlihat bahwa kelompok B memiliki dua cabang yaitu isolat LP9 mengelompok dengan LSC1 dan kelompok B, C, D. Hasil analisis molekular menunjukkan terjadi pengelompokkan yang lebih spesifik dengan menempatkan LP9 berkerabat dengan LSC1 dengan konsistensi yang tinggi sebesar 89%. Namun nilai dari pangakal cabang kelompok B hanya 57% sehingga memungkinkan kelompok B, C, D berubah susunan kelompoknya.
Kelompok C pada pohon kekerabatan mikroskopik kultur terbagi menjadi dua cabang yaitu LC4 yang bergabung dengan LSC1 dan kelompok D. Berdasarkan analisis molekularnya, kelompok C terpisah menjadi dua yaitu LC6 dengan LSC7 dan kelompok D. Hasil ini berbeda dengan hipotesis awal yang
seharusnya LU3 berkerabat dengan LU10 dengan nama L. torulosus, LC4 dan LC6 berasal dari tubuh buah L. cladopus, LSC1 dan LSC7 adalah L. sajor-caju sedangkan isolat LP9 adalah L. squarrosulus (Sudirman Komunikasi pribadi). Namun, Sudirman (2005) telah melaporkan bahwa antara LC4 dengan LC6 memiliki perbedaan berdasarkan sifat fisiologinya.
Secara taksonomi, isolat Lentinus dengan Pleurotus berbeda famili dalam pengelompokkan. Pada awalnya Lentinus dan Pleurotus berada dalam satu famili Tricholomataceae. Hal ini didasari adanya persamaan lamela himenofor dan jejak spora yang berwarna putih (Miller 1973). Namun, pengelompokkan tersebut berubah setelah ada penelitian lebih lanjut. Genus Lentinus lalu masuk ke dalam famili Lentinaceae (Sudirman 2005). Berdasarkan analisis PCR-RFLP, ternyata genus dari Tricholomataceae berada sebagai out group dalam kekerabatan dengan Lentinus (Hibbet dan Rytas 1991).
[image:26.595.118.510.86.371.2]SIMPULAN
Pertumbuhan miselium pada media AEMP lebih lebat dibandingkan dengan media AEM sedangkan berdasarkan penampakan koloni, kedua media memiliki perbedaan struktur penampakan. Hubungan kekerabatan berdasarkan sifat mikroskopik kultur dan analisis molekular menunjukkan bahwa seluruh isolat Lentinus berkumpul dalam satu kelompok tetapi pengelompokan spesies belum spesifik. Isolat HS berada di luar kelompok Lentinus dan Pleurotus sedangkan isolat JTP berada di luar kelompok Lentinus dan HS sebagai out group.
SARAN
Perlu adanya penambahan primer dalam analisis PCR-RAPD agar hubungan kekerabatan isolat Lentinus dapat spesifik.
DAFTAR PUSTAKA
Boidin J. 1971. Nuclear Behaviour in the Mycelium and The Evolution of Basidiomycetes, in Evolution in The Higher Basidiomycetes. Knoxville, University of Tennessee Press.
Clemencon H. 2003. Stellate chlamydospores and thromboplerous hyphae in the mycelium of the Agaric Lepista flaccid. Mycological Progress 2(1): 69–72.
Davidson RW, Campbell WA, Dorothy BV. 1945. Fungi causing decay of living oaks in the estern united state and their cultural identification. Technical Bul 785.
Hibbett DS, Rytas V. 1991. Evolution relationship to the polyporaceae: evidence from restriction analysis of enzymatically amplified ribosomal DNA. Mycologia 83(4): 425-439. Isla RV, Noemia KI. 2007. Optimal
conditions of in vitro mycelial growth of Lentinus strigosus, an edible mushroom isolated in the Brazilian Amazon. Mycoscience 49: 215-219.
Miller. 1973. Mushrooms of North America. New York: E.P. Dutton.
Noverita. 2005. Analisis keanekaragaman isolat Pleurotus spp. liar dan domestik berdasarkan sifat morfologi, fisiologi, genetik dan molekular. [disertasi]. Bogor : Institut Pertanian Bogor.
Nurapriliani Y. 2005. Telaah fisiologi produksi dan uji aktivitas antimikrob ekstrak miselium isolat Escherichia coli enteropatogen. [skripsi]. Bogor: Institut pertanian Bogor.
Nwanze PI, Khan AU, Ameh JB, Umoh. 2005. The effect of media, oil type and rate on the mycelia wet and dry weights of Lentinus squarrosulus (Mont.) singer and Psathyrella atroumbonata Pegler in submerged liquid culture. Afr. J. of Biotechnol. 4 (3): 326-331.
Pegler D, Young TWK. 1983. Anatomy of the Lentinus hymenophore. Trans. Br. Soc. 80(3): 469-482.
Pereira F, Corneiro J, Antonio A. 2008. Identification of species with DNA-based technology: current progress and challenges. Recent Patent on DNA & Gene Sequences 2008(2): 187-200.
Rayner ADM, Lynne B. 1995. Fungal Decomposition of Wood: Its Biology and Ecology. Great Britain, Antony Rowe Ltd.
Rosa Y. 1996. Telaah fisiologi Lentinus spp. dalam usaha mencari kondisi pertumbuhan optimal dan identifikasi isolat. [skripsi]. Bogor: Institut Pertanian Bogor.
Saunders GC, Helen CP. 1999. Analytical Molecular Biology: Quality and Validation. UK, Redwood Books Ltd.
Schmidt O. 2006. Wood and Tree Fungi: Biology, Damage, Protection, and Use. Germany, Springer.
Solichin DD. 2004. Isolasi DNA dari Cendawan. Manual Laboratorium Biologi Molekular. Bogor, PSIH-LPPM IPB.
_______. 2005. Deteksi senyawa antimikrob yang diisolasi dari beberapa Lentinus tropis dengan metode bioautografi. Hayati: 67-72.
Thorn RG, Barron GL. 1986. Nematoctonus and the tribe resupinate in Ontario, Canada. Mycotaxon 25(2): 321-453. William JGK, Kubelik AR, Livak KJ,
Rafalski JA, Tingey SV. 1990. DNA polymorphysm amplified by arbitrary
primers are useful as genetic markers. Nucleic Acids Res. 18: 6531-6535.
Lampiran 1 Komposisi media dalam satu liter akuades
1.Agar ekstrak malt (AEM)
Ekstrak malt 15 gram
Agar-agar 15 gram
Air destilata 1000 ml
2.Agar ekstrak malt pepton (AEMP)
Ekstrak malt 15 gram
D-glukosa 20 gram
Bacteriologiocal peptone 5 gram
Agar-agar 15 gram
Air destilata 1000 ml
3.Agar sukrosa kentang (ASK)
Kentang 200 gram
Sukrosa 10 gram
Agar-agar 15 gram
Air destilata 1000 ml
4.Ekstrak malt pepton cair (EMPC)
Ekstrak malt 15 gram
D-glukosa 20 gram
Bacteriological peptone 5 gram
Lampiran 2 Penampakan koloni isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP) pada media AEMP dan AEM
No Isolat Media AEMP Penampakan
Koloni Media AEM
Penampakan Koloni
1 LU3 Plumose Silky
2 LU10 Plumose Lateral wolly
3 LC4 Plumose Concentric silky
4 LC6 Plumose Plumose
6 LSC7 Plumose Plumose
7 LP9 Silky Appressed
8 HS Concentric
cottony Plumose
9 JTP Concentric
Lampiran 3 Istilah penampakan koloni
1. Appressed : Koloni tidak timbul di atas media agar
2. Concentric cottony : Koloni timbul dan membentuk lingkaran pada bagian tengah, miselium tegak agak panjang, menyebar ke segala arah
3. Concentric silky : Koloni membentuk lingkaran pada bagian tengah dengan benang-benang miselium panjang dan paralel yang menyerupai benang sutra yang disisir 4. Cottony : Koloni timbul, miselium tegak agak panjang, menyebar ke segala arah 5. Downy : Koloni dengan miselium berupa rambut halus longgar dan pendek yang
tersebar di seluruh permukaan media
6. Felty : Koloni dengan miselium berupa rambut-rambut yang menjalin menyerupai bulu kempa (felt)
7. Floccose : Koloni tipis, cottony berupa bulu-bulu pendek dan halus (pubescence) yang terkumpul dalam kelompok kecil
8. Nodulose : Koloni dengan/kelompok-kelompok yang jelas
9. Plumose : Koloni dengan rumbai miselium dari sumbu sentral dan dari sumbu ini terbentuk hifa pendek radial
10.Pulverulent : Penampakan koloni bertepung dan berdebu
11.Raised : Koloni dengan gundukan miselium di atas media agar
12.Silky : Koloni dengan benang-benang miselium panjang dan paralel yang menyerupai benang sutra yang disisir
13.Tufted : Pembentukan koloni yang berkelompok
Lampiran 4 Bilangan biner berdasarkan keberadaan pita dalam primer RP1 dan RP3 pada isolat Lentinus (LU3, LU10, LC4, LC6, LSC1, LSC7, LP9), HS, dan Pleurotus (JTP)
Primer RP1
No LU3 LU10 LC4 LC6 LSC1 LSC7 LP9 HS JTP
1 0 1 0 0 0 0 0 0 0
2 0 1 0 0 1 0 0 0 0
3 1 0 1 1 0 0 0 0 0
4 0 0 0 0 1 0 1 0 0
5 0 0 0 0 0 0 0 0 1
6 0 0 0 0 0 1 0 0 0
7 0 0 0 0 0 0 0 0 1
8 0 0 0 0 1 0 1 0 0
9 1 0 0 1 0 1 0 0 0
10 0 0 0 0 0 0 0 1 1
11 0 0 0 0 1 0 1 0 0
12 1 0 0 1 0 0 0 0 0
13 0 0 0 0 1 1 0 0 0
14 0 0 0 0 1 0 1 0 0
15 0 0 0 0 0 0 1 0 0
Primer RP3
No LU3 LU10 LC4 LC6 LSC1 LSC7 LP9 HS JTP
1 1 1 1 0 0 0 1 0 0
2 0 0 0 0 0 0 0 0 1
3 0 0 0 1 0 1 0 0 0
4 0 0 0 0 0 1 0 1 0
5 1 1 1 0 0 0 0 0 0
6 0 0 1 0 0 1 0 0 0
7 0 0 0 0 0 1 0 1 0
8 0 0 1 0 0 0 0 0 0
9 0 0 0 1 0 1 0 0 0
10 0 0 0 0 0 0 0 1 0
11 0 0 0 0 1 0 0 0 0
12 0 1 0 1 0 1 0 0 0
Bilangan biner diterjemahkan ke dalam susunaan nukleotida dengan ketentuan
Angka 1 untuk A atau G
Angka 0 untuk T atau C
Sehingga urutan nukleotida setiap isolat sebagai berikut :
#RAPD LENTINUS
#LU3 TTATTTTTATTATTTATTTATTTTTTTT
#LU10 AATTTTTTTTTTTTTATTTATTTTTTAT
#LC4 TTATTTTTTTTTTTTATTTAATATTTTA
#LC6 TTATTTTTATTATTTTTATTTTTATTAT
#LSC1 TATATTTATTATAATTTTTTTTTTTATT
#LSC7 TTTTTATTATTTATTTTAATAATATTAT
#LP9 TTTATTTATTATTAAATTTTTTTTTTTT
#HS TTTTTTTTTATTTTTTTTATTATTATTT
#JTP TTTTATATTATTTTTTATTTTTTTTTTT
Matrik jarak kesamaan masing-masing pasangan isolat Lentinus, HS, dan Pleurotus
1
2
3
4
5
6
7
8
9
1. LU3
2. LU10
6.00
3. LC4
5.00
7.00
4. LC6
5.00
9.00
10.00
5. LSC1
12.00 10.00
13.00
13.00