AB
STRAK
Syafni. Induksi Keragaman Genetik Gloxinia (Siningia speciosa. Benth) melalui radiasi sinar gamma. Dibimbing oleh Dr. Ir. Agus Purwito dan Prof. Dr. G.A Wattirnena.
Masalah yang sering dihadapi untuk mendapatkan varietas baru pada tanaman gloxinia secara konvensional adalah lamanya masa berbunga. Salah satu usaha untuk mendapatkan varietas baru adalah dengan teknik kultur in viiro dengan rnemberikan radiasi sinar gamma. Tujuan utarria dari pemberian mutagen secara fisik adalah untuk meningkatkan keragaman somaklonal. Keragaman somaklonal adalah keragaman genetik dari tmaman yang dihasilkan melalui kultur jaringan. Deteksi keragaman yang terjadi pada tanaman dapat dilakukan secara morfologi, biokimia dan molekuler.
Penelitian ini bertujuan untuk menciptakan keragaman genetik dan melihat keragaman genetik dengan deteksi morfologi, biokimia dan melalui teknik RAPD. Penelitian ini terdiri dua percobaan. Percobaan I Studi regenerasi tanarnan dengan ekspian daun dari kultur in vitro rnenggunakan media dasar MS dengan perlakuan BAP 0.5, 1.0, 1.5, 2.0, 2.5 dan 3.0 mgll. Rancangan percobaan yang digunakan Rancangan Acak Lengkap dengan 10 ulangan. Percobaan I1 Induksi Mutasi dengan eksplan daun dan tunas samping dengan perlakuan radiasi 0, 10, 20 dan 30 Gy. Rancangan percobaan yang digunakan Rancangan Acak Lengkap dengan 10 ulangan dimana setiap ulangan terdiri dari 3 eksplan.
INDUKSI KERAGAMAN GENETIK GLOXINIA
(Siniizgia
speciosa.
Benth) MELALUI
RADIASI SINAR GAMMA
SYAFNI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul :
Induksi Keragaman Genetik Gloxinia (Siningia speciosa.Benth) melalui radiasi sinar gamma. Adalah benar merupakan hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenaramya.
Bogor, Maret 2006
Syafni
AB STRAK
Syafni. Induksi Keragaman Genetik Gloxinia (Siningia speciosa. Benth) melalui radiasi sinar gamma. Dibimbing oleh Dr. Ir. Agus Purwito dan Prof. Dr. G.A Wattimena.
Masalah yang sering dihadapi untuk mendapatkan varietas baru pada tanaman gloxinia secara konvensional adalah lamanya masa berbunga. Salah satu usaha untuk mendapatkan varietas baru adalah dengan teknik kultur in vitro dengan memberikan radiasi sinar gamma. Tujuan utama dari pemberian mutagen secara fisik adalah untuk meningkatkan keragaman somaklonal. Keragaman somaklonal adalah keragaman genetik dari tananan yang dihasilkan melalui kultur jaringan. Deteksi keragaman yang terjadi pada tanaman dapat dilakukan secara morfologi, biokimia dan molekuler.
Penelitian ini bertujuan untuk menciptakan keragaman genetik dan melihat keragaman genetik dengan deteksi morfologi, biokimia dan melalui teknik RAPD. Penelitian ini terdiri dua percobaan. Percobaan I Studi regenerasi tanaman dengan eksplan daun dari kultur in vifro menggunakan media dasar MS dengan perlakuan BAP 0.5, 1.0, 1.5, 2.0, 2.5 dan 3.0 mgll. Rancangan percobaan yang digunakan Rancangan Acak Lengkap dengan 10 ulangan. Percobaan 11 Induksi Mutasi dengan eksplan daun dan tunas samping dengan perlakuan radiasi 0, 10, 20 dan 30 Gy. Rmcangan percobaan yang digunakan Rancangan Acak Lengkap dengan 10 ulangan dimana setiap ulangan terdiri dari 3 eksplan.
INDUKSI KERAGAMAN GENETIK GLOXINIA ( Siningia speciosa. Benth)
MELALUI RADIASI SINAR GAMMA
SYAFNI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Tesis : Induksi Keragaman Genetik Gloxinia ( Siningia speciosa.Benth) melalui radiasi sinar gamma.
Nama : Syafni
NRP : 99629
Program studi : Bioteknologi
1. Komisi Pembiinbing
p ! ! !
Dr. 1 gus Purwito, MSc prof. Dr. Ir G.A. Wattimena, MSc
Ketua Anggota
Diketahui
2. Ketua Program Studi Bioteknologi
PRAKATA
Dengan mengucapkan syukur Alhamdulillah yang tidak habis-habisnya atas rahrnat dan hidayahnya sehingga tesis ini dapat diselesaikan dengan judul: "Induksi Keragaman Genetik Gloxinia ( Siningia speciosa. Benth) melalui radiasi sinar gamma" ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Sekolah Pasca Sarjana, lnstitut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan rasa terima kasih yang tak terhingga kepada Bapak Dr. Ir.Agus Punvito MSc, sebagai ketua Komisi Pembimbing dan Bapak Prof. G.A Wattimena yang telah melimpahkan ilmu, serta meluangkan waktu untuk membimbing, menasihati serta memberikan arahan dengan penuh kesabaran dan keikhlasan sehingga penelitian ini dan penulisan tesis ini dapat diselesaikan.
Ucapan terima kasib juga penulis sampaikan pada ARMP I1 yang telah memberikan kesempatan dan Beasiswa untuk melaksanakan studi ini. Demikian pula kepada Dekan Sekolah Pasca Sarjana IPB beserta Asisten Direktur dan Staf yang telah menerima penulis untuk melaksanakan tugas belajar pada Program Studi Bioteknologi di Sekolah Pascasarjana IPB.
Tidak lupa ucapan terima kasih kepada Bapak Dr. Toto Sutater MS yang pada saat itu merupakan Kepala Balai Penelitian Tanaman Hias yang telah memeberikan kesempatan untuk melanjutkan pendidikan ke Strata I1
selesai. Juga kepada kedua anakku Emir Aulia dan Afif Azmi yang telah memberikan ketenangan atas tawa dan lucunya, keluargaku tercinta Ayah, am&, adikku Silvia yang telah memberikan dukungan dan do'a yang tiada hentinya kepada penulis.
Tidak lupa penulis ucapkan terima kasih pada ibu Nurhaemi Haxis dan Bapak Tolhas atas bantuan dan bimbingan teknis laboratorium, diskusi dan masukan yang berharga, demikian juga pada teh Indri, teh Nia dan Mbak Iif yang telah membantu terlaksananya penelitian ini.
Rekan-rekan sesama mahasiswa Pascasarjana yang bekerja di Laboratorium Kultur Jaringan BDP Nurhasanah, Hasnah atas dukungan serta kerjasamanya selama ini.
Semoga Allah SWT mencatat berbuatan baik dan memberikan yang balasan lebih baik. Akhirnya penulis berharap semoga tulisan ini dapat memberikan manfaat bagi pengembangan ilmu pengetahuan.
Bogor, Maret 2006
RIWAYAT HIDUP
Penulis dilahirkan di Pariaman Sumatera Barat pada tanggal 7 Oktober 1964 dari pasangan Bapak Syarifbddin dan ibu Ruwaida sebagai anak kedua dari tujuh bersaudara.Penulis telah menikah dengan Ir.Zulhayadi dan telah dikaruniai 2 orang anak Emir Aulia ( 6 ih ) dan Afif a m i ( 1,5 th).
Penulis menamatkan pendidikan Sekolah Dasar di SD negeri 19 Padang. Sekolah lanjutan Pertama di SMP Pertiwi I Padang dan Sekolah Menengah Atas di SMA negeri 2 Padang. Penulis mendapatkan gelar sarjana dari jurusan Biologi, FMIPA Universitas Andalas pada tahun 1991.
DAFTAR IS1
DAFTAR TABEL
...
DAFTAR GAMBAR
...
DAFTAR LAMPIRAN
...
PENDAHULUAN
...
Latar Belakang
...
. .
Tujuan Penel~tlan
...
Hipotesis...
TINJAUAN PUSTAKA
...
...
Botani dan Sistimatika GloxiniaKultur Jaringan Tanaman
...
Keragaman Genetik (variasi somaklonal)...
. .
Morfogenesis menggunakan radlasl
...
Teknik analisis keragaman genetik...
BAHAN DAN METODE
...
...
Waktu dan Tempat PenelitianBahan dan Alat Percobaan
...
. .
Metode Penelltlan
...
Analisis Isoenzim.
...
.
...
A n a l ~ s ~ s RAPD...
HASIL DAN PEMBAHASAN...
Percobaan I.
Studi regenerasi...
Percobaan I1.
Induksi Mutasi...
Perubal~an morfologi secara in vitroAnalisa Isoenzim
...
Verifikasi dengan RAPDDAPTAR TABEL
No Teks
1. Pongaruh ZPT terhadap induksi kalus dan tunas dari eksplan daun 6
...
minggu setelah tanam2.
Jumlah tunas, tinggi tanaman, jumlah dam dan jumlah akar padatanaman yang tumbuh dari eksplan daun setelah 6 minggu
. .
radiast...
3. Jumlah tunas, jumlah daun, lebar daun dan jumlah akar pada eksplan mata tunas setelah 6 minggu setelah radiasi..
...
4 Morfologi tanaman yang mengalami perubahan pada kultur in vilro
5 Jumlah daun dan lebar daun setelah 8 minggu di lapang..
...
...
6 Perubahan morfologi tanaman dilapang..DAFTAR GAMBAR
No Teks
1 Pengaruh tingkat kosentrasi BAP terhadap inisiasi tunas dan kalus pada kultur daun Siningia speciosa..
. ... . .
. .
. .
. .. . .
2 Penampakan plantlet setelah diradiasi dengan sinar gamma(a) DR20K14 (b) DRlOK6..
. . .
. .
. .
.
. . .
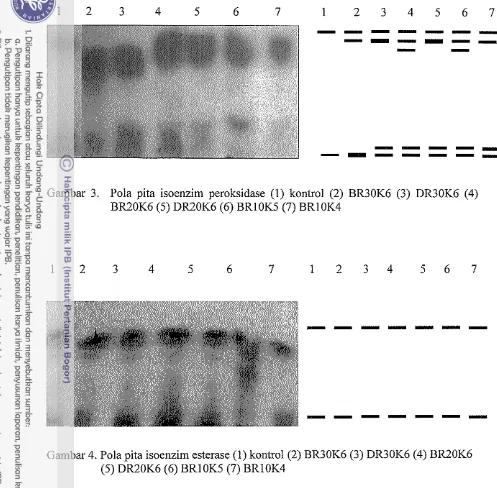
3 Pola pita isoenzim peroksidase (1) Kontrol(2)BR30K6 (3) DR30K6 (4) BR20K6 (5) DR20K6 (6) BRlOK5 (7) BRlOK4
... . . .... . . ...
4 Pola pita isoenzim esterase (1) Kontrol(2) BR30K6 (3) DR30K6 (4) BR20K6 (5) DR20K6 (6) BRlOK5 (7) BRlOK4...
5 Profil pita DNA 6 klon berbeda... . . .. . . ... . . ... . .
6 Dendogram UPGMA dari hasil analisis RAPD dan matrik kesamaangenetik dari 7 genotip tanaman Gloxinia menggunakan 2
prlmer
...
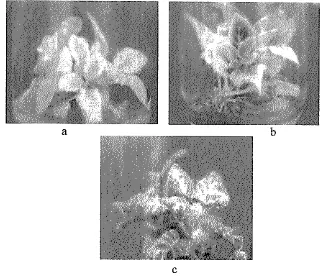
7 Penampakan tanaman setelah ditanam di lapang selama 8 minggu (a)BRlOK4 (b) BRlOK5 (c)BR30K6
....
.
.. . . ... . . ... . . .. . . ...
DAFTAR LAMPIRAN
Teks Halaman
1 Komposisi media Murashige dan Skoog (1962) (sterilisasi otoklaf
1 lS°C, selama 30 menit).
...
49 2 Komposisi larutan pewarna Isoenzim.. ... 503 Komposisi pereaksi dan buffer untuk analisis
. .
DNA
tanamanGloxmm..
...
5 I 4 Susunan nukleotida, kandungan C/G dari 30 primer dekamer acakyang diseleksi..
...
52 5 Profil pitaDNA
Gloxillia yang diamplifikasi oleh 6 primer yang 53...
terseleksi... . .
I .
PENDAHULUAN
1.1. Latar Belakang
Gloxinia (Siningia speciosa. Benth) merupakan salah satu tanaman hias pot yang memiliki potensi untuk dikembangkan. Daya tarik dari tanaman ini terletak pada daun, warna, bentuk dan ukuran bunganya. Tanaman ini akan lebih menarik dan mempunyai nilai tarnbah apabila menghasilkan bunga dengan warna, bentuk dan ukuran yang unik dan lebih beragam.
Usaha-usaha untuk mendapatkan varietas-varietas baru yang lebih indah dan menarik telah banyak dilakukan antara lain melalui introduksi dari luar negeri yang disertai dengan adaptasi dan seleksi, maupun melalui metode konvensional dengan cara menyilangkan berbagai varietas yang telah ada.
Alternatif untuk memperoleh keragaman bunga selain dengan metoda konvensional dapat pula dilakukan melalui teknik kultur in vilro (Skirvin et al.,
1993). Variasi ini berasal dari keragaman genetik eksplan dan keragaman yang terjadi selama subkultur pada kultur jaringan.
Selain itu keragaman somaklonal tidak hanya mengandalkan dari kultur secara spontan, tetapi dapat diinduksi dengan menggunakan mutagen baik fisik maupun kimia. Menurut Ancora dan Sonino (1987), keragaman somaklonal dapat ditingkatkan dengan pemberian mutagen pada eksplan, baik secara fisik (sinar - X, sinar gamma) maupun secara kimia (EMS, DEMS, NMV). Radiasi sinar gamma dapat menimbulkan mutasi pada sel tanaman, jika radiasi diterima sedemikan rupa sehingga dapat merubah kode genetik (Djoyosubagio, 1988).
Pada tanaman Vitis venifera, pemberian sinar gamma dengan dosis 5 sampai 100 Gy dapat meningkat kalus embriogenik sebanyak 7,6% (Valeria et al., 1997). Walter dan Suer dalam Ibrahim el al., (1998) mengatakan bahwa kultur in vitro yang diberikan beberapa perlakuan radiasi telah mengasilkan bunga yang mengalami mutasi baik pada warna, ukuran dan bentuk bunga. Larkin 1987 dalam Handayati el al., (2001 mendapatkan keragaman sebesar 43% pada tanaman Begonia iisinalis
yang dicirikan dengan keragaman warna, ukuran dan bentuk bunga.
Pahan (1987) melakukan penelitian terhadap tanaman Petunia (Petunia kybvida
.
Vilm) yang menunjukan bahwa kultur pucuk yang diradiasi dengan sinar gamma dosis 0,2,4, 8, 16, dan 32 gy menghasilkan perbedaan pada warna.Analisa keragaman suatu populasi dapat dilakukan baik secara morfologi,
didukung melalui penggunaan teknik biokimia dan teknik molekuler (Aswidinoor, 1991).
Secara biokimia, keragaman genetik suatu populasi dapat diamati pada tingkat protein. Teknik yang sudah banyak digunakan, yaitu teknik elektroforesis untuk penyidikan protein atau isoenzim yang turut aktif dalsun metabolisme, antara lain esterase, peroksidase dan beberapa isoenzim lainnya (Glaszmann et al., 1988)
Teknik molekuler dapat memberikan gambaran yang cukup tinggi tentang perbedaan genetik individu, haik pada tingkat species maupun dengan kerabat jauh. Melchinger (1990) mengatakan bahwa penggunaan teknik molekuler dapat memberikan informasi. yang akurat karena memberikan jumlah penanda yang tidak terbatas, tidak dipengaruhi ole11 umur, kondisi fisiologi, jaringan dan lingkungan serta hasil analisis diperoleh dalam waktu yang singkat.
Salah satu teknik molekuler yang digunakan untuk mendeteksi keragaman genetik tingkat DNA adalah RAPD. Menurut Isabel et al., (1993) teknik RAPD memiliki heberapa kelebihan dibandingkan dengan teknik molekuler lainnya antara lain tidak membutuhkan latar belakang genom, relatif mudah dilakukan, tidak memerlukan urutan nukleotida specifik, tidak memerlukan waktu yang lama dan biaya yang tinggi, dapat mendeteksi sebagian atau keseluruhan genom hanya dengan menggunakan jumlah DNA yang sedikit.
Penggunaan teknik RAPD sudah berhasil untuk menganalisa keragaman genetik beberapa tanaman diantaranya, Musa spp (Gimenez et al., 2001), Zea ?nays
(Beaumont et al., 1996), Glycine nznx (Doldi el al., 1997), Liliunl ZongiJlorurn
1.2. Tujuan Penelitian
Mendapatkan keragaman tanaman gloxinia melalui radiasi sinar gamma dan mengetahui keragaman genetiknya meldui analisa morfologi, biokimia dan molekular.
1.3. Hipotesis
1. Radiasi sinar gamma dapat menciptakan keragaman genetik
11. TINJAUAN PUSTAKA
2.1. Botani dan Sistimatika Gloxinia
Gloxinia (Siningia speciosa var&fiana) termasuk dalarn famili Gesneriaceae dan genus Siningia. Gloxinia berkerabat dekat dengal Sainlpaulia (african violet) dan Espicia, yang sama-sama termasuk dalam famili Gesneriaceae. Gesneriaceae terdiri dari 125 genus dan lebih dari 2000 species, namun dari jumlah tersebut baru kira-kira 300 species yang telah dibudidayakan. Species-species ini banyak ditemukan di Amerika, Asia, Spanyol dan Afrika. Species-species tersebut banyak ditemukan pada karang kapur, hutan hujan, dasar lautan dan pegunungan-pegunungan dengan ketinggian lebih dari 15000 kaki (Burtt, 1967)
berwarna hijau pucat dan urat daun berwarna agak putih. Siningia speciosa ada yang tumbuh tegak dan ada yang mendatar, mempunyai umbi dengan akar muncul disekelilingnya. Bunga berbentuk lonceng, berbulu halus dengan diameter 7.5 cm -
15.0 cm, bermahkota tunggal dengan lebih dari lima atau ganda dengan banyak cuping (Crockett, 1974).
2.2. Kultur Jaringan Tanaxiian
Konsep menumbuhkan tanaman dari sel-sel individu pertama kali diperkenalkan pada tahun 1902 oleh Haberlandt. Ia mencoba menumbuhkan sel-sel daun dalam suatu larutan mineral yang sederhana (Drew, 1980). Sejak itu teknik kultur jaringan terus berkembang. Prinsip kultur jaringan adalah teori totipotensi, artinya sel hidup dapat tumbuh dan berkembang menjadi tanaman sempurna (Winata, 1988). Ekksplan yang ditanamkan pada media dalam lingkungan aseptik dapat tumbuh langsung menjadi embrio atau membentuk kalus. Arah pertumbuhan ini dapat diatur dengan menggunakan jenis dan konsentrasi zat pengatur tumbuh tertentu (Harney,
1982).
2.2.1. Sumber eksplan
Menurut George dan Sherrington (1984) organ kecil atau sepotong jaringan dari tanaman yang digunakan dalam kultur jaringan disebut eksplan. Secara teoritis tiap-tiap sel yang diambil dari bagian tanaman akan mampu tumbuh menjadi tanaman yang sempurna bila diletakkan dalam lingkungan yang sesuai (Suryowinoto, 1976).
2.2.2. Media Tumbuh Kultur
fisik media dan lingkungan media. Komposisi media secara umum berbeda untuk setiap tanaman, oleh karena itu banyak penelitian mengenai komposisi media secara kimiawi yang sesuai dan tepat untuk perkembangan dan perkembangan kultur jaringan tanaman tertentu. Perbedaan media-media tersebut terletak pada konsentrasi bahan-bahan kimia penyusunnya. Media yang sering digunakan secara luas untuk banyak jenis tanaman adalah media Murashige dan Skoog 1962
.
Komposisi media tersebut mengandung unsur hara makro dan mikro yang lebih lengkap dibandingkan dengan komposisi media lainnya. Media Murashige dan Skoog 1962 ini sesuai untuk kultur meristem, morfogenesis dan regerasi tananlan tanaman (Evans el al., 1981).2.2.3. Pengaruh Zat Pengatur Tumbuh
Dalam kultur jaringan ada dua kelompok zat pengatur tumbuh yang sangat penting untuk mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Zat pengatur tumbuh tersebut adalah dari golongan auksin dan
sitokinin (Winata, 1988)
.
Konsentrasi zat pengatur tumbuh yang digunakan tergantung dari macam jaringan yang digunakan sebagai eksplan, kandungan hormon endogen dan pola pertumbuhan yang diinginkan (Bojwani dan Razdan, 1983). Menurut Winata (1988) penambahan auksin atau sitokinin eksogen dalam media akan mengubah tingkatan zat pengatur tumbuh endogen sel. Tingkatan zat pengatur tumbuh ini kemudian nierupakan trigering faktor untuk proses-proses pertumbuhan d m morfogenesis.
Auksin dalam kultur jaringan berperan dalam pembelahan dan pembesaran sel, pembentukan kalus dan pembentukan akar. Secara alami beberapa eksplan memproduksi auksin dalam jumlah yang cukup, tetapi pada umumnya membutuhkan tambahan dari luar. Penambahan auksin dalam jumlah besar cenderung menyebabkan terbentuknya kalus dan menghambat regenerasi pucuk tanaman. Sitokinin merupakan golongan zat pengatur tumbuh yang penting dalam pembelahan sel dalam j&ingan yang dibuat eksplan dan merangsang pertumbuhan tunas daun (Gamborg dan Shyluk,
1981).
eksplan, pemberian 0.3 dan 0.7 ppm kinetin yang dikombinasikan dengan 1.6 - 1.8 ppm IAA merangsang proliferasi tunas adventif gkoksinia dan memperoleh 1-10 tanaman per eksplan.
2.3. Keragaman genetik (Variasi somaklonal )
Studi keragaman genetik pada prinsipnya bertujuan untuk mengkaji komposisi genetik individu di dalam atau antar populasi. Keragaman genetik dapat terjadi karena adanya perubahan susunan sejumlah rantai nukleotida DNA.
Keraganlan genetik yang terjadi didalam kultur jaringan disebabkan jumlah kromosom akibat fusi atau endomitosis, perubahan struktur kromosom akibat pindah silang mitosislsomatik, perubahan gen dan perubahan sitoplasma (Evan dan Sharp, 1986)
Ada tiga cara untuk mendapatkan variasi somaklonal yaitu regenerasi langsung maupun tidak langsung, kultur sel dan kultur protoplas. Variasi genetik dapat ditingkatkan dengan pemberian mutagen pada eksplan baik secara fisik (radiasi) maupun kimia (Wattimena dan Mattjik, 1992)
Secara umum faktor-faktor yang berpengamh terhadap terjadinya variasi somaklonal adalah genotip, lingkungan kultur, sumber eksplan dan lama fase kalus (Karp, 1995).
juga dapat terjadi pada fase yang berdiferensiasi yang relatif panjang (Evans dan Sharp, 1986).
Beberapa penelitian yang bertujuan untuk mendapatkan keragaman somaklonal telah dilakukan pada Petunia sp (Pahan, 1987), Gerbera (Prasetyorini, 1991), Mawar mini (Handayati., el al2001). Walter dan Suer dalarn Ibrahim (1998) melaporkan bahwa kultur in vitro pada beberapa tanaman hias yang diberi perlakuan radiasi telah menghasilkan bunga yang mengalami mutasi baik dari warna, ukuran dan jumlah petal.
Variasi somaklonal pada dasamya terjadi akibat peristiwa mutasi, yaitu perubahan suatu karakter yang diwariskan yang disebabkan oleh herubahnya pembawa sifat menurun baik pada tingkat DNA atau gen yang disebut mutasi titik, maupun pada tingkat kromosom yang disebut mutasi kromosom (Crowder, 1997).
Mutasi titik adalah perubahan sekuen nukleotida pada gen yang menghasilkan perubahan asam amino dan protein produk mutan atau sebagai perubahan satu bentuk alel ke bentuk alel lainnya dimana perubahan tersebut terjadi dalam satu lokus kromosom (Hartana,l992; Suzuki,1993). Transisi adalah penggantian satu basa purin dengan satu basa purin, atau penggantian satu basa pirimidin dengan pirimidin. Transversi adalah penggantian satu basa pirimidin oleh basa purin atau sebaliknya. Delesi adalah hilangnya pasangan basa tertentu sehingga terjadi susunan nukleotida yang berbeda. Inversi adalah terjadinya perubahan orientasi susunan pasangan basa (Crowder, 1990)
dimana jumlah kromosom tetap tetapi terjadi perubahan komposisi dan susunan bahan kromosom, yaitu delesi, duplikasi, inversi dan translokasi. Perubahan jurnlah kromosom adalah adanya penambahan atau pengurangan kromosom-kromosom utuh atau satu set kromosom lengkap (genom), perubahan ini dapat menyebabkan
keragaman genetik yang akan nampak pada keragaman fenotipe sepert sifat morfologi dan fisiologi (Crowder, 1990)
Mutasi dapat terjadi secara spontan dan dapat juga diinduksi dengan menggunakan mutagen. Di alam mutasi akan selalu terjadi walaupun dalam frekwensi yang rendah. Mutasi tersebut terjadi karena proses evolusi secara alami yang berkaitan dengan faktor-faktor dialam, mutasi tersebut disebut dengan mutasi spontan. Mutasi spontan Lunumnya akan terjadi disebabkan oleh kesalahan dalam replikasi DNA, kerusakan pada DNA, dan perpindahan materi genetik seperti DNA (Suzuki et al., 1993). Sedangkan mutasi buatan adalah mutasi yang terjadi karena adanya unsur-unsur kesengajaan d m sering digunakan sebagai salah satu cara untuk menimbulkan keragaman genetik. Penggunaan mutagen juga dapat menimbulkan variasi somaklonal, dengan kata lain bahwa keragaman somaklonal tidak hanya mengandalkan dari kultur secara spontan, namun bisa terjadi dengan adanya induksi dari luar. Dalam ha1 ini adalah penggunaan mutagen baik secara kimia ataupun secara fisik (Ismachin, 1988).
2.4. Morfogenesis menggunakau Radiasi
elektron. Sinar- x merupakan peralihan antara sinar gamma dan ultra violet karena mempunyai pengaruh ionisasi dan eksitasi (Grosch dan Hopwood, 1983).
Sinar gamma dan sinar-X adalah elektron magnetik, dimana protonnya akan meresap kedalam materi dengan proses dimana sebagian atau seluruh proton ditransfer ke energi kinetik suatu elektron. Elektron kemudian akan kehilangan energinya karena berinteraksi dengan atom molekul materi dan melepaskan elektron lain (Ismachin, 1988).
Brigggs dan Constantin (1977) melaporkan bahwa radiasi elektromagnetik dapat meningkatkan keragaman genetik, karena pengaruh radiasi dapat menimbulkan perubahan struktur gen, struktur kromosom ataupun jumlah kromosom
Meskipun dengan dosis yang sangat rendah kemungkinan terjadinya
pengaruh genetik yang berarti. Perubahan-perubahan yang kecil dalam komposisi basa suatu DNA dapat mengakibatkan mutasi dan efek radiasi terhadap basa lebih penting dan berperan secara langsung dalam proses mutasi gen, seperti terjadinya substitusi, penambahan atau hilangnya basa dalam molekul DNA. (Djojosubagio,l988).
Radiasi dapat nlenginduksi perubahan struktur kromosom yaitu terjadinya
pematahan kromosom. Pada dosis yang rendah dapat menyebabkan terjadinya delesi, seinakin tinggi akan menimbulkan duplikasi, inversi dan translokasi (Crowder,1997)
inti dan kromosom interfase, serta faktor genetis yaitu adanya perbedaan kepekaan terhadap radiasi (Ismachin, 1998)
Ibrahim et a1 (1998) telah melakukan aplikasi radiasi pada tanaman mawar secara in vifro dengan dosis 25,50 dan 100 gy. Hasilnya menunjukan perbedaan yang nyata terhadap pembentukan mata tunas. Sedangkan Mandal el a1 (2000), pemberian perlakuan radiasi pada tunas krisan dengan dosis 1.5, 2.0 dan 2.5 krad telah didapatkan hasil bahwa dengan radiasi 2.5 krad telah memperlihatkan hasil yang lebih baik dibandingkan dengan perlakuan yang lain dimana 55% daun varigata dan 5% lainnya mengalami mutasi.
Pada tanaman mawar mini varietas Romantica Meilandina yang diradiasi 1 sampai 10 krad bunga berubah dari warna pink menjadi warna putih. Untuk eksplan Prince Meilandina yang diradiasi 1 sampai 8 krad dari merah tua berubah menjadi merah agak muda (Handayati ef al., 2001)
2.4. Teknik analisis Keragainan Genetik
Keragaman genetik dapat dianalisis secara morfologi, biokimia maupun molekuler. Penanda morfologi adalah penanda yang diamati dengan mata telanjang, seperti warna bunga, wama kulit biji, bentuk biji, wama bulu dan sebagainya. Keuntungan dari penanda jenis ini adalah pengamatannya yang mudah, namun demikian penanda ini memiliki kelemahan karena dapat dipengaruhi oleh kondisi lingkungan dan mempunyai tingkat keragaman yang rendah (Tanskley et al., 1989).
Enzim adalah biokatalisator untuk proses-proses fisiologis yang penggandaan dan pengaturannya dikontrol secara genetis. Isozim dapat digunakan sebagai penanda genetik untuk mempelajari keanekaragaman antar individu dalam populasi serta mengidentifikasi varietas (Cort et al., 2000). Isozim adalah ragam yang berbeda dari enzim yang sama, tetapi memiliki mobilitas yang sama pada individu yang sama dan memiliki mobilitas elektroforesis yang berbeda. Struktur isoenzim terdiri dari asam- asam amino yang mengandung gugus karboksil dan gugus asam amino tertentu
Analisis isozim dapat dilakukan dengan cepat dan murah, serta telah banyak digunakan untuk mempelajari keragaman genetik tanaman pada populasinya seluruh tanaman. Penggunaan penanda isozim mempunyai keterbatasan karena isozim merupakan ekspresi gen sedangkan umur tanaman berpengaruh terhadap pola pita yang dihasilkan. Disamping itu polimorfisme yang dihasilkan sangat rendah sehingga sulit untuk membedakan antar kultivar yang berkerabat dekat (Asin et al., 1995)
Adanya kemajuan di bidang biologi molekuler dan penemuan-penemuan sarana pendukungnya telah memberikan sumbangan yang berarti bagi pcrnacuan teknologi termasuk untuk keperluan analisis keragaman genetik pada tingkat molekul DNA, sehingga menghasilkan penanda yang baru yang potensial antara lain
Penanda RFLP dan AFLP dapat memberikan tingkat polimorfisme dan stabilitas yang tinggi, namun demikian teknik ini memerlukan beberapa tahapan pelaksanaan, biaya tinggi dan radioisotop (Lin et al., 1996). Sedangkan teknik RAPD dapat dilakukan dengan teknik yang lebih sederhana dan lebih murah. Perbedaannya terletak pada penggunaan primer oligonukleotida (dengan panjang 10 basa) yang sekuennya dibuat secara random. Genom pada hampir setiap organisme tersusun dari jutaan nukleotida, yang secara teorilis akan banyak yang memiliki sekuemya sama dengan random oligonukleotida primer yang orientasinya berlawanan arah (inverted orientation) dan yang hanya berjarak beberapa ratus atau ribu pasang basa antara satu dengan yang lain yang akan dapat teramplifikasi dalam mesin PCR. Berbagai ukuran potongan DNA hasil amplifikasi ini akan mudah dipisahkan berdasarkan ukurannya dengan menggunakan teknik elektroforesis dan hasilnya dapat dilihat sebagai pita- pita DNA dengan berbagai ukuran (Williams et al., 1990).
Di pilihnya RAPD untuk analisa keragaman genetik karena alasan sebagai berikut : (1) tidak memerlukan latar belakang genom yang diteliti (2) primer yang digunakan secara universal dapat digunakan untuk organisme prokariot, maupun eukariot (3) mampu menghasilkan karakter yang relatif tidak terhatas jumlahnya, (4) bahan-hahan yang digunakan relatif murah, (5) mudah dalam ha1 preparasi dan (6) memberikan hasil lebih cepat dibandingkan dengan analisis keragaman molekuler lainnya (Weeden et al., 1992 ; Weising et al., 1995)
Untuk keperluan keragaman genetik, teknik RAPD cukup potensial karena mampu menghasilkan karakter yang tidak terbatas jumlahnya. Teknik ini telah banyak digunakan untuk berbagai studi tanaman diantaranya Padi (Virh et aL, 1995)
Cannabis sativa (Faeti et al., 1996), Kelapa (Lengkong et al., 1998) Liliurn longiflorurn (Punvantoro et al., 1999) Nilam (Nuryani et al., 2000)
Menurut Hoelzel dan Green (1992) dan Weising et a1 (1995), bahwa adanya hanyak faktor yang herpengaruh terhadap keberhasilan PCR, diantaranya adalah komposisi dan konsentasi yang optimal dari pereaksi PCR, serta profil perputaran panas dan jumlah siklus.
Pereaksi PCR yang digunakan untuk amplifikasi adalah catakan DNA, primer oligonukleotida, enzirn Tag DNA polimerase, campuran empat prekusor deoksiribonukleotida yaitu (dATP, dGTP, dCTP dan dTTP), ion Mg 2' dan bufer reaksi. Optimasi konsentrasi cetakan DNA sangat penting untuk mendapatkan pola RAPD yang haik. Untuk permulaan dapat dicoba DNA cetakan 5 - 500 ng dengan menyertakan kontrol negatif (tanpa cetakan). Konsentrasi cetakan 10 - 50 ng per
400 ng. Kemurnian cetakan DNA juga mempengaruhi hasil reaksi Weising et al.,
(1995).
Primer adalah rantai DNA pendek yang terdiri atas beberapa nukleotida yang berperan sebagai pemula pada proses sintesis DNA dengan PCR. Primer yang umum dipakai terdiri atas sepuluh atau lebih susunan nukleotida (oligonukleotida).
Konsentrasi primer 0,l - 2,O pM biasanya optimal. Konsentrasi primer yang lebih
tinggi dapat membuat kesalahan primer yaitu akumulasi produk non spesifik, sedangkan konsentasi primer yang lebih rendab menghasilkan lebih rendah produk yang diinginkan Hoezel dan Green (1992) d m Weising et aL, (1995).
Konsentrasi cetakan DNA dan Tag DNA polimerase dapat mempengaruhi efisiensi amplifikasi. Kira-kira 100 ng DNA genomik biasanya sesuai, namun demikian juga tergantung pada kwalitas DNA. Terlalu banyak DNA dapat menghambat amplifikasi. Konsentrasi Tag DNA polimerase biasanya bervariasi dari
0,5 - 2,O unit per 50 p1 volume reaksi. Konsentrasi Tag yang terlalu sedikit akan membatasi sejumlab produk, sedangkan terlalu banyak dapat menghasilkan produk non spesifik yang tidak diinginkan.
Ketidakseimbangan campuran dNTP (konsentrasi s e l h basa nitrogen tidak sama) akan mengurangi fungsi Tag DNA polimerase. Secara kwantitatif dNTP mengikat M ~ ~ " , sehingga banyak pengaturan konsentrasi dNTP memerlukan
imbangan MgC12. Konsentrasi yang tinggi dapat memacu penggabungan yang salah oleh polimerisasi. Ion M ~ ~ + merupakan kofaktor penting dalam katalisis enzimatik
juga berinteraksi dengan kelompok fosfat negatif dari dNTP yang cukup kuat, dimana ~ g ' ' menarik secara ionik terhadap PO; yang tersedia untuk meggiatkan kofaktor enzimatik. Untuk itu konsentrasi ~ g ' + diperlukan lebih tinggi dari pada konsentrasi dNTP. Konsentrasi optimal MgCl2 dapat bervariasi dari 0,5 - 5 rnM. Konsentrasi bebas ~ g ' + tergantung pada konsentrasi campuran yang mengikat ion, meliputi dNTP, pirophosphat bebas dan EDTA. Konsentrasi maksimal sekitar 6 rnM, diatas level ini aktifitas Tag DNA polimerase cenderung turun (Hoezel dan Green, 1992; Tingey e l a1.,1994).
Bufer reaksi PCR memegang peranan penting untuk keberhasilan proses amplifikasi. Bufer reaksi untuk PCR meliputi Tris -HC1 dengan konsentrasi sampai 10 - 50 mM, lamtan KC1 dengan konsentrasi sampai 50 mM yang berguna untuk membantu proses penempelan primer, sedangkan detergen ionik dengan konsentrasi 0,05 - 0,1% untuk membantu kestabilan enzim dan mencegah penguapan (Weising el aL, 1995).
Pada tahap penempelan primer (annealing), primer akan menempel pada DNA pita tunggal yang komplemen dengan urutan nukleotida dari primer. Pada tahap ini suhu dan lamanya waktu annealing bergantung pada komposisi, panjang dan konsentrasi primer. Menurut Weising el a1 (1995) bahwa suhu annealing dipengaruhi oleh panjang primer dan persentase GIC dalam primer serta konsentrasi garam larutan penyangga (buffer). Annealing hanya memerlukan waktu beberapa detik, biasanya berkisar 30 detik sampai 2 menit sudah cukup. Pemilihan suhu annealing ini merupakan faktor penting, jika suhu terlalu tinggi, annealing tidak terjadi, jika suhu terlalu rendah, annealing non spesifik &an meningkat.
Perpanjangan primer secara normal terjadi pada 72OC, sebagai suhu optimum Tag DNA polimerisasi. Waktu perpanjangan primer tergantung pada panjang dan sekuen target. Estimasi dari tingkat Tag DNA polimerisasi bervariasi dari 35 - 100 nukleotida per detik, tergantung pada komposisi buffer dan cetakan. Sebagai patokan,
1 menit per kb kemungkinan sudah cukup produk yang lebih besar dari 2 kb jarang memerlukan lebih dari satu menit dan produk yang melebihi 5 kb memerlukan waktu perpanjangan yang lebih lama Weising et a1 (1995).
111. BAHAN DAN METODE
3.1. Tempat penelitian:
Penelitian dilakukan di Laboratorium Bioteknologi Tanaman Departemen Budi Daya Pertanian dan laboratorium Biologi Molekuler Tumbuhan Bioteknologi IPB Bogor.
3.2. Bahan dan Alat Percobaan
Bahan
Tanaman berasal dari laboratorium Bioteknologi tanaman yang dikulturkan pada media Murashige dan Skoog (1962 ) tanpa hormon selama 6 minggu. Eksplan
almaeda Tech), larutan buffer primer, enzim Taq DNA polimerase (Promega), larutan stok dNTPs, larutan ion ~ ~ 2 + .
Bahan tanaman yang digunakan untuk diaklimatisasi adalah tanaman yang berasal dari percobaan mutasi. Bahan media yang digunakan adalah arang sekam padi dan tanah, pot plastik dengan diameter 15 cm
.
Alat
Alat yang digunakan adalah larninar air flow, autoklaf, PCR Thermolyne- Amplitron, kamera polaroid 665, translurninator T 2201, sentrifuge high sonic Sorvall RC-55 Dupont, sentrzfuge high sonic MR 1812, inkubator, neraca analitik (4 desimal) sartorius, oven, spektrofometer Beckrnan DU 650, pengocok Thermolyne tipe 16700,
microwave National, penangas air, pipet mikro, Ependorf (0.5-10p1, 10-100p1, 100-
1000 pl), pipet Mohr (Iml, 2m1, 5m1, lOml), pipet tetes, tips eppendorf, mortar, pH
meter, erlen meyer, gelas ukur, gelas piala, spatula, pinset skalpel, lampu spiritus dan corong.
3.3. Metode Penelitian
Penelitian ini terdiri dari 2 percobaan yaitu 1) studi regenerasi tanaman dan 2) induksi keragaman genetik melalui radiasi sinar gamma dengan sumber radiasi adalah
'37 CS.
3.3.1. Percobaan I. Studi regenerasi tanaman
setiap botol terdiri dari 1 daun. Eklsplan yang digunakan adalah daun in vitro. Peubah yang diamati adalah waktu tumbuhnya kalus, bentuk dam, tinggi plantlet, jumlah daun
.
Media optimum akan dipakai untuk regenerasi eksplan yang diradiasi.3.3.2. Percobaan 11. Induksi Mutasi
Radiasi dilakukan di Laboratorium Radiobiologi Bioteknologi IPB dengan menggunakan Irradiator Gammacell. Eksplan yang dipakai adalah daun dan tunas
samping masing-masing dengan dosis 0, 10, 20, 30 gy. Pada eksplan daun setiap perlakuan diulang 10 kali, dimana setiap ulangan terdapat 1 eksplan. Sedangkan pada eksplan tunas samping terdiri dari 10 ulangan dimana setiap ulangan terdiri dari 3 eksplan. Pada eksplan daun media yang digunakan adalah media optimum regenerasi sedangkan pada eksplan tunas samping adalah Murashige dan Skoog (1 962) tanpa hormon. Keduanya menggunakan rancangan acak lengkap dan merupakan percobaan yang terpisah. Tanaman dikulturkan pada suhu 27'C dan intensitas cahaya 1000 lux dengan lama penyinaran 24 jam per hari. Peubah yang diamati adalah bentuk dam, tinggi plantlet, warna daun, jumlah daun, jumlah akar terhadap 20 klon pada masing- masing perlakuan yang diambil secara acak.
3.3.3. AKLIMATISASI
dengan 3 tanaman. Pengamatan dilakukan setiap minggu dengan peubah tinggi lanaman, jumlah daun, lebar daun dan munculnya bunga.
3.3.4. ANALISIS ISOENZIM
Enzim yang akan dianalisis adalah enzim peroksidase (PER) dan esterase (EST). Bahan tanaman yang digunakan adalah daun dari kultur in vitro yang berumur 6 minggu dari seluruh klon yang diperoleh. Analisa pola pita isoenzim dan pewarnaan dilakukan menurut metoda Soltis et aL, (1 992)
.
3.3.4.1. Pembuatan bufer pengekstrak
Bufer ekstrak dibuat dari carnpuran 10 mM L- asain askorbat 0,07 gram, 40 mM L-sistein 0,1939 gram, Triton-X-100 0,12 ml
,
PVP - 40 sebanyak 0,25 gram dan 0,lM NA2HP04.H20 dan ditambahkan akuades sampai volume 100 ml pada pH 7.0. Larutan sebanyak untuk 40 ml.3.3.4.2. Pembuatan bufer gel
Bufer gel terdiri dari 5mM L-Histidim monohidrat 1,040 gram yang dilarutkan dengan akuades sampai volume 11 dengan pH 6.0.
3.3.4.3. Pembuatan bltfer elektroda
50 mM asanl sitrat monohidrat 10,55 gram dan 150mM tris hidroksimetil aminometan 18,16 gram dilarutkan dalam aquades sampai volume larutan 11 dengan pH 6.0
3.3.4.4. Pembuatan gel pati
Setelah matang diangkat lalu dicampurkan dengan carnpuran pati dan kemudian
dimasak lagi sampai kelihatan bening lalu divakum gelembung udara dalam gel habis. Selanjutnya gel secepatnya dituang pada cetakan yang terlebih dahulu telah diolesi parafin cair dan lubang pada kaki cetakan ditutup dengan selotip. Sesudah gel dingin, ditutup dengan plastik yang telah diolesi dengan parafin. Gel disinipan pada suhu 5 - 10°C
3.3.4.5. Ektraksi enzim
Daun segar 200 mg digunting halus ke dalam setiap mortar yang telah berisi pasir kuarsa, dengan menambahkan bufer ekstrak 0,5 ml, lalu digerus sampai halus. Cairannya diserap dengan kertas saring Whatman 0,5 x 0,5 cm dan disisipkan pada potongan gel dalam cetakan. Pada salah satu lubang contoh yang paling pinggir disisipkan kertas saring yang telah diberi indikator mobilitas elektroforesis (bromphenol biru).
3.3.4.6. Elektroforesis
Cetakan yang sudah siap dimasuk ke dalam tray yang telah berisi bufer elektroda. Sebelum dimasukkan selotip pada kaki cetakan dilepas, dan kaki cetakan harus terendam dalam lamtan bufer elektroda lalu diletakkan dalam lemari es pada suhu 5 - 10°C. Selanjutnya diawal elektroforesis selama 30 menit pada 100 volt dan elektroforesis tetap pada 150 volt selama 3-4 jam sampai indikator melewati jarak 9 cm.
3.3.4.7. Pembuatan Larutan pewarna
sebelum elektroforesis selesai. Setelah pewarnaan selesai pola pita isoenzim digambar diatas kertas grafik, kemudian difoto dengan lembaran gelnya.
3.3.5. Analisa RAPD
3.3.5.1. Isolasi DNA
Metode ekstraksi dilakukan menurut metode Orosco Castillo et al., ( 1994). Sebanyak 0,3 g daun muda dimasukkan ke dalam mortar porselein ditambahkan nitrogen cair ke dalamnya kemudian digerus dan ditambahkan PPVP sebanyak 0,02 g ke dalam gerusan. Penggerusan dilanjutkan hingga daun menjadi bubuk halus, kemudian secepatnya dimasukkan ke dalam buffer ekstraksi. Buffer dan bubuk halus dikocok dan divortex selama beberapa menit. Campuran diinkubasi pada suhu 65OC selanla 30 menit dalani penangas air dan setiap 10 menit sekali dikocok perlahan. Selanjutnya campuran didinginkan pada suhu ruang.
Isolasi DNA dilakukan dengan pemberian larutan TE sebanyak 500p1 ke
dalam pelet perlahan-lahan sehingga pelet larut. Kemudian ditambahkan RNAse sebanyak 10pl. Larutan diinkubasi pada 37OC selama ljam dalam penangas air.
Setelah itu ditambahkan natrium asetat pH 5,2 sebanyak 50p1 dan etanol absolut
dingin sebanyak 1 ml, di dikocok secara perlahan sehingga terbentuk benang-benang DNA dan disimpan pada suhu -20°C selama 30 menit. Campuran disentrifusi pada kecepatan 10.000 rpm selama 10 menit. Fase cair dibuang, pelet DNA dicuci dengan
etanol 70% dingin (500 p1) kemudian pelet dibiarkan kering. Kedalam tabung berisi
DNA ditambahkan lan~tan TE 200 pi lalu pelet dilarutkan, kemudian disimpan pada
3.3.5.2. Penetapan Kuantitas DNA
Penetapan kuantitas DNA dilakukan dengan cara elektroforesis (Sanbrook.,
1989). Sebanyak 4 pI DNA contoh ditambahkan 1 p1 loading bzgfer, kemudian uji kuantitas DNA dilakukan dengan cara clektroforesis menggunakan agarose 2%
.
Gel agarose dibuat dengan melarutkan 0.80 gram bubuk agarose dalam 40ml
larutan Tris Asetat EDTA (TAE) lX, dan dipanaskan dalam iizicrowave selama 2 menit. Selanjutnya larutan dikocok secara perlahan dan dituangkan ke dalam cetakan elektroforesis yang telah berisi TAE l x sampai gel terendam. DNA contoh sebanyak
1 2 ~ 1 dimasukkan ke dalam masing-masing sumur gel. Elektroforesis dijalankan pada
tegangan 50 volt selama lebih kurang 12 jam. Untuk menetapkan konsenttasi DNA, hasil DNA diamati dibawah UV transluminator.
3.3.5.3. Seleksi primer
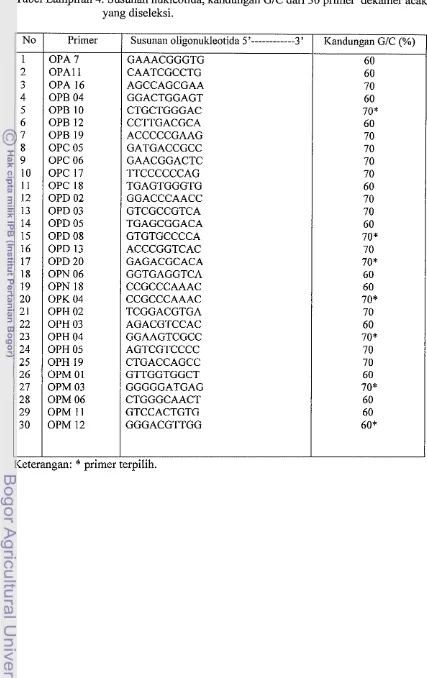
Amplifikasi fragmen dilakukan dengan Polymerase Chain Reaction (PCR) menggunakan primer acak berdasarkan metode William et aL, (1990). Seleksi primer dilakukan terhadap 30 primer dekamer acak. Disajikan dalam (Tabel lampiran 3). Sebelum melakukan amplifikasi terlebih dahulu dibuat 25p1 campuran larutan
akuades steril 18.8p1, lox bufer
+
MgC12 2.5 p1, 0.2 mM dNTPs 2.5~1, 10 pmoldiakhiri dengan ekstension pada suhu 72OC selama 4 menit dengan jumlah siklus 45 kali
Ke dalam tabung hasil amplifikasi DNA ditambahkan 5pl loading buffer kemudian difraksinasi dengan elektroforesis 1.4% gel agarose yang mengandung 2.5
p1 ethidium bromida 1% di dalam bak elektroforesis yang berisi l x bufer TAE
IV. HASIL DAN PEMBAHASAN
4.1. Percobaan I. Studi regenerasi
Respon daun dalam membentuk kalus dan tunas terhadap beberapa kombinasi perlakuan zat pengatur tumbuh adalah sangat berbeda nyata bila dibandingkan dengan kontrol seperti terlihat pada Tabel 1.
Tabel 1. Pengaruh ZPT terhadap induksi kalus dan tunas dari eksplan daun 6 minggu setelah tanam.
BAP(
mdl)
Jumlah Tinggi Ju~nlahtunas tanaman daun % berkalus
0 0 d 0,73 b 0,73 c 0 0,5 9,8 a 1,56 a 3,36 a I00 (20120) 1 ,o 2,l b 1,52 a 3,25 ab 95 (19120)
1,5 2,O b 1,53 a 3,29 ab 95 ( 19/20) 2,o 1,0 c 1,6 a 3,09 b 90 (1 8120) 2,s 0 d 0,73 b 0,73 c 90 (18120) 3,O 0 d 0,.73 b 0,73 c 90 ( 18120)
Keterangan : Angka yang diikuti huruf yang berbeda pada kolom yang sama berbeda nyata menurut uji Duncan pada taraf 5%.
minggu ke 6 kalus tersebut coklat dan akhirnya mati. Takuhara dan Mii (1994) menyebutkan pemberian zat pengatur tumbuh yang semakin tinggi konsentrasinya dapat menyebabkan pencoklatan jaringan. Penambahan BAP 0.5 mg/l dapat menginduksi tunas terbanyak yaitu 9.80 dibandingkan dengan perlakuan lainnya. Penambahan zat pengatur tumbuh BAP tidak memperlihatkan perbedaan yang nyata terhadap tinggi tanaman, pada semua perlakuan tidak mampu menghasilkan akar. Pada kontrol (MS tanpa ZPT) daun hanya melebar kemudian coklat dan mati. Hal ini diduga karena tingginya kosentrasi BAP yang diberikan. Menurut Wattimena (1992) bahwa pada konsentrasi tinggi sitokinin mendorong proliferasi tunas sebaliknya menghambat perkembangan a k a .
Gambar. 1 Pengaruh tingkat konsentrasi BAP terhadap inisiasi tunas dan kalus pada kultur daun Siningia speciosa
.
(a) MS+
vit+
0.1 mg/l IAA tanpa BAP, (b) MS+
vit+
0.1 mg/l IAA+
0.5 mg/l BAP, (c) MS+
vit+
0.1 mg/l IAA+
1.0 mg/l BAP, (d) MS+
vit+
0.1 mg/l IAA+
1.5 mg/l BAP, (e) MS+
vit+
0.1 mg/l IAA+
2.0 mg/l BAP, (f) MS+
vit+
0.1 mg/l IAA4.2. Percobaan 11. Induksi Mutasi
4.2.1. Eksplan daun
Pengamatan secara in vit1.o terhadap pel-tumbuhan eksplan daun 6 minggu setelab radiasi disajikan pada Tabel 2
Tabel 2. Jumlah tunas, tinggi tanaman, jumlah daun dan jumlab akar pada tanaman yang tumbuh dari eksplan setelah 6 minggu radiasi
Jumlah Tinggi
(a)
tunas tanaman (cm) Ju~nlall daun Jumlah akar % kalus 0 1,00 d 1,61 a 2,68 b 0,70 b 100 10 3,70 a 1,56 a 3,36 a 1,73 a 100 20 2,80 b 1,76 a 3,02 a 1,76 a 41,6 30 1,90 c 1,71 a 3,15 a 1,95 a 28,O Keterangan: Angka yang diikuti huruf yang berbeda pada kolom yang sama berbeda nyatamenurut uji Duncan pada taraf 5%
Jumlah Tunas, I= scdikit (I-lo), 2= sedang ( I 1-20), 3=bnnyak (21-30), 4 = banyak sekali (>31)
Daun yang diradiasi dengan 10 gy memperlihatkan persentase tumbuh kalus paling tinggi yaitu 100%, pada 20gy sebanyak 41,6% dan 30gy hanya 28,0 %.
Pemberian radiasi pada daun yang kernudian berubah menjadi kalus ternyata tidak menghambat regenerasi kalus membentuk tunas dan akar. Kerusakan seluler pada daun dapat menghambat pertumbuhan kearah pembentukan organ, tetapi pada dosis tertentu sebaliknya. Menurut Ichikawa dan Ikusima (1967) keadaan ini dapat disebabkan hilangnya kemampuan sebagian sel pada meristem untuk membelah diri dan menyebabkan aktifitas sel-sel lainnya lebih meningkat. Jumlah total klon tanaman yang diperoleh dari percobaan ini adalah 57 klon yang diambil secara acak dari regenerasi yang dihasilkan,
4.2.2. Eksplan mata tunas
Pengamatan secara in vitro terhadap pertumbuhan plantlet setelah 6 minggu radiasi diperoleh hasil sebagai berikut (Tabel 3).
Tabel 3. Jumlah tunas, jumlah daun, lebar daun dan jumlah akar pada eksplan mata tunas.
Dosis
(a)
Jumlah tunas Jumlah daun Lebar daun Jumlah akar30 1122 c 2186 c 1126 0,97 c
Keterangan: Angka yang diikuti huruf yang berbeda pada kolom yang sama berbeda nyata menurut uji Duncan pada tataf 5 %
tunas akan menghasilkan pertumbuhan plantlet yang lebih baik bila dibandingkan dengan menggunakan eksplan daun. Menurut Wattimena (1992) bahwa sumber asal eksplan dapat mempengaruhi pertumbuhan dan morfogenetik tanaman. Pertumbuhan akar lebih baik pada selnua perlakuan dosis radiasi bila dibandingkan dengan kontrol, sedangkan jumlah akar paling banyak pada perlakuan radiasi 20gy. Jumlah total klon tanaman yang didapat pada percobaan ini adalah 60 klon yang diambil secara acak
dari tunas yang dihasilkan.
4.3. Perubahan morfologi secara in vitro
Semua plantlet yang diamati perubahan morfologinya secara in vitro
herjumlah 118 klon dimana 57 klon tanaman berasal dari eksplan daun dan 60 klon tanaman asal eksplan mata tunas dan 1 klon tanaman kontrol. Pada plantlet berasal dari eksplan daun telah terjadi perubahan morfologi pada 13 klon tanaman (11.1%), sedangkan pada plantlet asal eksplan mata tunas sama sekali tidak memperlihatkan perbedaan morfologi secara in vitro (Tabel 4 )
Tabel 4. Morfologi tanaman yang mengalami perubahan pada kultur in vitro
DR10K33 DRI OK2 DRIOKII DRlOK12 DR20K14 DRIOK28 DRl OK23
Warna Daun Kuning Kuning Merah ja~nbu Merah jambu Merah jambu Merah jambu Pinggir daun m.jambu Pinggir daun m.jambu Pinggir daun m.jambu Pinggir daun m.jambu Pinggir daun m.jambu Pinggir daun m. jambu Pinggir daun m. jambu
Hijau Hijau Nijau Hijau Hijau Hijau Merah jambu Hijau Hijau Hijau Hijau Hijau Hijau Hijau Hijau Bentuk daun Oval Oval Oval Oval Oval Oval Oval Oval Oval Oval Oval Oval Oval Oval Total
Jumlah klon
1
1
1
C
Gambar 2. Penampakan plantlet Siningia speciosa setelah diradiasi dengan sinar gamma a. DR20K14, adalah klonl4 liasil radiasi daun dengan dosis 20 gy
b. DRlOK6, adalah klon 6 hasil radiasi daun dengan i Ogy
c Kontrol.
4.4. Analisa isoenzim
Gambar 3. Pola pita isoenzim peroksidase (1) kontrol (2) BR30K6 (3) DR30K6 (4) BR20K6 (5) DR20K6 (6) BRlOK5 (7) BRI OK4
1 2 3 4 5 6 7 1 2 3 4 5 6 7
OPB 08 OPB 10
Gambar 5. Pita DNA 6 klon yang berbeda (1) kontrol (2) BRlOK4; (3)BRlOK5; (4)DR20K6; (5) BR30K6; (6) DR30K6; (7) BR30K6; (8) Ikb DNA Ladder; (9) Kontrol; 10) BRIOK4; (Il)BRlOK5; (12)DR20K6; (13 BR30K6; (14) DR30K6; (1 5) BR30K6
4.5. Verifikasi dengan RAPD
4.5. Seleksi primer
[image:49.544.76.517.57.259.2]4.5.2. Analisa RAPD
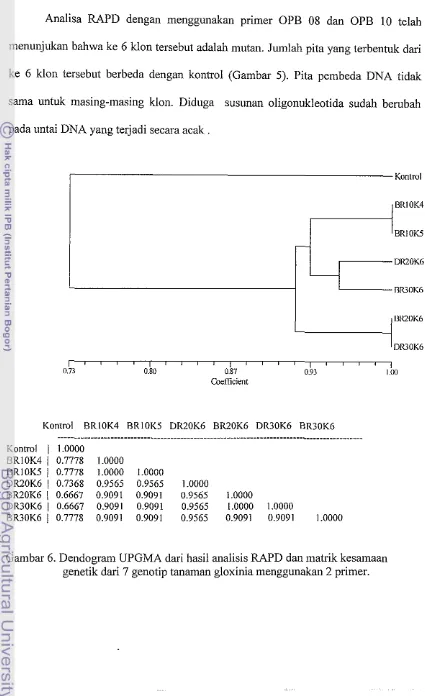
Analisa RAPD dengan menggunakan primer OPB 08 dan OPB 10 telah menunjukan bahwa ke 6 klon tersebut adalah mutan. Jumlah pita yang terbentuk dari ke 6 klon tersebut berbeda dengan kontrol (Gambar 5). Pita pembeda DNA tidak sama untuk masing-masing klon. Diduga susunan oligonukleotida sudah berubah pada untai DNA yang terjadi secara acak
.
Konhol BR I OK4 BRI OK5 DR20K6 BR20K6 DR30K6 BR30K6
I
I BRI OK4I t I I ' I ~ " ' I r ' " I ~ I I ( I
0.73 0.80 0.87 0.93 I M)
Coefficient
[image:50.547.79.504.65.761.2]Konhol BRIOK4 BRIOKS DR20K6 BR20K6 DR30K6 BR30K6
Dari analisis NTSys untuk ke 7 genotip tanaman gloxinia yang diuji menunjukan bahwa jarak genetik berkisar 0.88 - 1.00. Berdasarkan adanya pola pita yang sama dendogram dari masing-masing primer menunjukan adanya pengelompokan. Ke 7 genotip tersebut membentuk 3 kelompok (kluster) yaitu kontrol (cluster I), BRlOK4, BRlOK5, DR20K6, BR30K6 (cluster 2), BR20K6, DR30K6 (cluster 3). Terlihat bahwa antar kelompok tersebut mamiliki keragaman genetik yang cukup tinggi, namun antara BR30K6 dan DR30K6 memiliki jar& genetik yang sama. Hasil matrik kesamaan genetik menunjukan bahwa kesamaan genetik antara BRlOK4 dan BRlOK5 adalah loo%, kesaman genetik antara BRlOK4 dengan DR20K6 adalah 95%, kesamaan genetik antara BR30K6 dengan BRlOK4 adalah 90 % sedangkan kesamaan genetik antara BR20K6 dan DR30K6 adalah 100%. Kemungkinan perbedaan antara ke 6 klon tanaman jika dibedakan dengan kontrol terletak pada perubahan susunan beberapa basa DNA-nya yang terjadi akibat mutasi pada sel somatik sehingga terjadi perubahan genotipnya.
4.6. Aklimatisasi
Delapan minggu setelah pengamatan di lapang pada tanaman asal eksplan
Tabel 5. Jumlah daun dan lebar daun setelah 8 minggu di lapang
Dosis Daun Mata tunas
jumlah lebar(cn1) jumlah lebar(cm)
0 2,98 b 1,65 b 3,09 c 1,58 c
10 4,27 a 2,08 a 4,24 b 1,85 ab
20 4,76 a 1,6S b 4,93 a 1,70 b
30 4,22 a 1,93 ab 4,44 ab 1,92 a
Keterangan : Angka yang diikuti huruf yang berheda pada kolom yang sama berbeda nyata menurut
uji duncan pada taraf 5%
Delapan minggu setelah pengamatan perubahan di lapang perubahan terjadi hanya pada tanaman asal eksplan mata tunas sedangkan pada tanaman yang berasal dari eksplan daun tidak ada perubahan. Perubahan morfologi terlihat pada warna daun, bulu-bulu pada daun maupun munculnya bunga (Tabel 6).
Tabel 6. Perubahan morfologi tanaman di lapang
Klon Asal eksplan Warna daun Bulu daun Masa berbunna - Ukuran daun Kontrol Mata tunas Hijau Sedang Belum berbunga Sedang BR3OK6 Mata tunas Kecoklatan Banyak Belum berbunga - Kecil sekali BRl OK4 Mata tunas Hijau Sedang Kuucup Lebar BRlOK5 Mata tunas Hiau Sedang Kuncup Lebar
[image:52.541.90.521.337.408.2]KESIMPULAN
1. Percobaan I, medium yang paling baik untuk regenerasi tunas adalah MS dengan menambahkan BAP 0,5 mg/l dan IAA 0,l mg/l.
2. Percobaan 11, pemberian sinar gamma dosis 10,20 dan 30 Gy dapat meningkatkan jumlah akar dan tunas.
3. Pemberian sinar gamma dosislO Gy dapat meningkatkan keragaman.
4.
Diperbldh 6 klon tanaman yang berbeda dengan ihdukriya yaitu Dk20K6, DR30K6 asal eksplan daun dan BRlOK4, BRlOK5, BR20K6, BR30K6 asal eksplan mata tunas.1. Dalam pengamatan fenotipik sebaiknya jumlah pengamatan karakter morfologi perlu dipefbanyak untuk mendaptitkan informasi yang akurat.
DAFTAR PUSTAKA
Ancora, G. and A. Sonnino. 1987. In vitro Induction of Potato Breeding. In Y.P.S Bajaj (ed) Biotechnology in Agriculture and Forestry .3 Potato. Tokyo. Asin, M. J., R. Herrero, and L. Navarro. 1995. Factors Effecting Citrus Three
lsozyme Gene Expression. Theor Appl. Genet. 90.
Aswidinoor, H. 1991. Rekayasa Genetika. Dalam S. Harran dan N. Ansory (ed). Bioteknologi Pertanian 11. PAU. Bioteknologi. IPB. Bogor.
Baudendistel, R. F. 1982. Horticulture Abasic Awereness (2 ed). Reston Publ.Co. Inc. Reston Virginia.
Balasubramanian, R, and G. Kumaravelu. 1981. Isoenzyms of leaf peroxidases to distinguish clones of Tecfona grandis. J. Ind Forest. (4)
Beaumont, V. H., J. Mantet, and J. Rochford. 1996. Comparison of RAPD and RFLP marker for mapping F2 generation in maze (Zea mays L). Theor. Appl. Genet.
Bhojwani, S. S, and M. K. Razdan. 1983. Plant Tissue Culture Theory and Practice. Elsevier Amsterdam. Oxford. New York. Tokyo.
Bilkey, P. C, and E. C. Cocking. 1981. Increased plant vigor by in vitro propagation of Saintyaulia ionantha wendl from epidermal tissue. Hort Sci. 16 (5). Brown, P. T. H, F. D. Lange, E. Kranz, and H. Lorz. 1993. Analysis of Single
Protoplas and Regenerated Plants by PCR and RAPD technology. Mol. Genet. 237.
Burtt, B. L. 1967. Gesneriads of family. Plant garden. 23.
Brigg, R. W, and M. J. Constantin. 1977. Radiation types and radiation sources tech. Pepps. Sr. No. 119 Manual on mutation breeding IAEA. Vienna.
Corts, M. R, and M. C. Martinez. 2000. Variation of PGM and IDH isozymes for identification of alfalfa varieties. Euphytica 112.
D'Amato, F. 1986. Spontaneous mutation and somaclonal variation. Di dalam Proc Nucl Tech. In Vitro Cult for Plant Improv. IAEA.
Doldi, M. L., J. Vollann., and T. Lelley. 1997. Genetic diversity in soybeans determined by RAPD and microsatellite analysis. Plant Breed.
Drew, R. A. 1980. Tissue culture in horticultural crop. Queesl. Agric. J. 106.
Djoyosubagio, 1988. Dasar-dasar Radio Isotop dan Radiasi dalam Biologi. PAU. IPB. Bogor.
Evans, D. A, W. R, Sharp., and C. E. Flick.1981. Growth and behavior of cell culture. Embriogenesis and Organogenesis. In T. A. Thorpe (ed). Plant Tissue Culture Methods and Aplication in Agriculture. Academic Press. New York. Evan, D. A. and W. R. Sharp. 1986. Somaclonal and gametoclonal variation. hz Evans,D. A, W. R.Sharp., and P.V. Arnirato (eds). Hand Book of Plant cell culture. Volume 4. Mc. Millan Publ. New York
Faeti, V., G, Mandolino, and P. Ranalli. 1996. Genetic diversity of Cannabis saliva germplasm based on RAPD markers. Plant Breeding
.
11 5Djoyosoebagio, S. 1988. Dasar-dasar Radioisotop dan Radiasi dalam Biologi. Pusat Antar Universitas. IPB.
Gamborg, 0 . P, and J. P. Shyluk
.
1981. Nutrition, Media and Characteristic of Plant cell and Tissue Culture 21-24 In T. A .Thorpe (ed). Plant Tissue Culture Method and Application in Agriculture. Academic Press. New York.George, E. F and P. D. Sherrington. 1984. Plant Propagation by Tissue Culture. Hand Book and Directory of Commercial Laboratories. Exegetics Limited. England.
Ghesquiere, M. 1984. Enzyme polymorphism in oil palm (Elaeis quineensis Jacq) I. Genetic Control of nine enzyme systems. Oleagineux. 39 (12)
Gimenez, C., D. G. Eva, X.D.E. Nereida, and I. Blanca. 2001. Somaclonal variation in Banana: Cytogenetic and molecular characterization of the somaclonal varian Cien BTA-03. In Viiro Cell. Dev. Biol. 37.
Grosch, D. S, and L. E.Hopwood. 1983. Biological Effect of Radiation 2 ed
.
Acad. Press. New York.Handayati, W., Darliah, I. Mariska, and R. Purnamaningsih. 2001. Peningkatan keragaman genetik mawar mini melalui kultur in-vitro dan radiasi sinar mma. Berita Biologi 5 (4 ).
Handoyo, D, and A. Rudiretna. 2000. Prinsip mum dan Pelaksanaan Polymerase Chain Reaction (PCR). Pusat Studi Bioteknologi Universitas Surabaya. Unitas. Vol 9(1).
Haramaki, C and T. Murashige. 1972. In - vitro culture of Gloxinia. Hort Sci 7 (3).
Harney, P. M. 1982. Tissue culture propagation of some herbaceous horticultural plant. In D. T. Tomes (ed) Application of Plant Cell and tissue Culture to Agriculture and Industry. The University of Guelph, Guelph.
Hoelzel, A. R and A. Green. 1992. Analysis of Population Level Variation by Sevenchy PCR Amplified DNA. In Hoezel, ATR (ed): Molecular Genetic Analysis of Population a Practical Approuch. Oxford University Press. New York.
Ibrahim, R., W. Mondelaerss, and C. D. Piere. 1998. Effect of x-irradiation on adventitious bud regeneration from in-vilro leaf explants of Rosa Hybrida.
Plant Cell Tissue and Culture 54
.
Ichikawa, S, and Y. Ikushima. 1967. A developmend study of diploid oats by means of radiation induced somatic mutation. Rad of Botanical 7.
Isabel,N., L. Trembay, M. Michaud, F.M. Tremlay, and J. Bousquet. 1993. RAPDs as An Aid to Evaluate The Genetic Integrity Of Somatic Embryogenesis Derived Populations Of Picea mariana (Mill).B. S. P Theor. Appl. Genet. 86.
Ismachin, M. 1988. Pemuliaan Tanaman dengan Mutasi Buatan. Pusat Aplikasi Isotop Radiasi. BATAN. Jakarta.
Lengkong, E. F., A.Hartana, and Suharsono. 1998. Keragaman genetik beberapa kultivar kelapa berdasarkan penanda RAPD (Random Amplified Polymorphic DNA). Dalam Prosiding Seminar sehari Hasil-hasil Penelitian Bidang Ilinu Hayat. 3 Septenlber 1998. PAU. IPB. Bogor.
Lin, J. J., J. Kuo, J. Ma, J. A. Sauders, H. S. Beard, M. H. Mac Donald, W. Kenworthy, G. H. Lide and B. F. Mathews. 1996. Identification of molekuler markers on Soybean comparing RFLP, RAPD and AFLP DNA mapping techniques. Plant Mol. Biol Rep. 14 (2).
Mandal,
A.
K. A., D. Chakrabarty and S. K. Datta.2000. Application of in vilro techniques in mutation breeding of Chrysanthemum. Plant cell, tissue and organ culture. 60Melchinger, A. E. 1990. Use Molecular Marker Inbreeding for Oligogenic Disease Resistence. Plant Breeding. 104.
Murashige, T, and F, Skoog
.
1962. A resvised medium for rapid growth and bioassay with tabacco tissue cultures. Physiol. Plant. 15.Murashige, T. 1974. Plant propagation through tissue cultures. Plant Physiol. 25. Nuryani,Y., C, Syukur, and N. Toiuan. 2000. Analisa keragaman genetik nilam
dengan teknik Randomly Amplyfied Polymorphic DNA (RAPD). Prosiding hasil Penelitian dan Pengembangan Bioteknologi 111. Cibinong.
Nienhuis, J., J, Tirang and P. Skroch. 1994. Analysis of Genetic Relationship among Genotypes based on Moleculer Marker Data. In Analysis of Moleculer Marker Data, Joint Plant Breeding Symposia Series, Corvalis, Oregon 5-6 Agustus. CSSA. Am. Sac. Hart. Sci and Am. Genet. Assoc.
Orazo-Castillo, K. J., Cbalmers, R. E Waugh, and W. Powell. 1994. Detection of Genetic Diversity and Selective Gene Introgression in Coffe using RAPD markers. Theorh. Appl Genet. 87.
Pahan, I. 1987. Variation of pitunia (Pytunia hybrida Vilm) flower derived from in vitro shoot cultures treated with gamma ray radiation. Buletin Peragi 2(1). Pierik, R. L. M. 1987. In Vitro Culture of Higher Plant. Martinus Nijhaoff Publisher
Dordrecht. Boston. Lancaster.
Prosetyorini. 1991. Pengaruh radiasi sinar gamma dan jenis eksplan terhadap keragaman somaklonal pada tanaman gerberra (Gerberra jamesonii Bolus ex Hook). Tesis Pasca Sarjana. IPB. Bogor.
Sanbrook, J. E., E.
F.
Frisch, and T. Maniatis.
1989. Molecular Cloning A Laboratory Manual. Cold Spring Harbour Laboratory CSH. New York. Serret, N. D., S. M. Udupa, and F. Weigand. 1997. Assesment of genetic diversity ofkultivated chickpea using microsatellite derived RFLP markers implication for origin. Plant Breeding. 116.
Skirvin, R. M., M. Norton, and K. D. Mc Pheeters. 1993. Somaclonal variations. Has it proved useful for plant improvement in vitro culture. Acta Horticulturae. Sporrow, A. H. 1961. Types of ionizing radiation and their cytogenic effect. In J. D.
Luckett (ed). Mutation and plant Breeding National Academic. Science National Research Council. Washington. D.C.
Suryowinoto, M. 1976. Prospect tissue culture di Indonesia dalam Pekan Anggrek Indonesia Jakarta.
Suzuki,
D.
T., A. J.F.
GriMiths, J. H. Miller, and R. C. Lewontin. 1993. An Introduction to Geneticc Analysis. W. EI. Freeman and Co. New York. Soltis, D. E., and P. S. Soltis. 1992. Isozymes in Plant Biology. Discorides Press.Portland. Oregon.
Tanskley, S. D, and T. J. Orton
.
1983. Isozymes in Plant Genetic and Breeding. Part A. Elsevier. Publ. Co. Inc. Netherlands.Tingey, S. V., J. A. Rafalski, and M. K. Hanafey. 1994. Genetic Analysis with RAPD markers.
In
Coruzzi. G and Puigdormenech. P. (ed). Plant Molecular Biology. Springer- verlag. Berlin Heidelberg.Valeria, B. Kuksova, M. P Nikolai and Y. G. Yari. 1997. Somaclonal variation and in
vitro induced mutagenesis in grapine. Plant cell, tissue and organ culture. 49. Virh, P.S., H. J. Newbury, M. T. Jakcson, and B. V. Ford Loid. 1995. The Identification of Duplicate Accesions Within a Rice Germplasm Collection using RAPD. Theor. Appl. Genet. 90.
William, J.G.L., A.R. Kubelik., K.J. Livak., J.A .Rafalski and S.V. Tingey. 1990. DNA Polymorphism amplified by arbitrary primers are useful as genetic marker. Nuclei Acid Res.
Winarno, E., Aryanti, Yulidar, dan R. Ratma. 1993. Analisis isoenzim iutuk penyidikan sejunlah mutan kedelai. Pusat Aplikasi Isotop dan Radiasi. BATAN.
Weeden, N. F., G. M. Timmernlan, M. Hemmat, B. E. Kneen, and M. A.Lodhi. 1992. Inheritance and reability of RAPD markers. In Application of RAPD Technology to Plant Breeding. Joint Plant Breeding Symposia Series. November.1. Minneapolis. Minnesota.
Weising, K., K. H. Nybon, W. Wolff, and W. Meyer. 1995. DNA Fingerprinting in Plant and Fungi. CRG Press. Boca Raton. Florida.
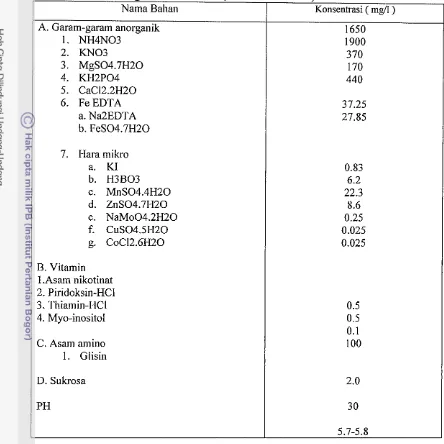
Tabel Lampiranl. Komposisi media Murashige dan Skoog (MS ) 1962 ( Sterilisasi dengan otoklaf 11 5" C, selama 30 menit )
6. Fe EDTA
a. Na2EDTA b. FeS04.7H20
Nama Bahan A. Garam-garam anorganik
1. NH4N03 2. KN03
7. Hara mikro a. KI
b. H3B03 c. MnS04.4H20 d. ZnS04.7H20 e. NaMo04.2H20 f. CuS04.5H20 g. CoC12.6H20
Konsentrasi ( mg/l) 1650 1900 370
B. Vitamin
1 .Asam nikotinat 2. Piridoksin-HC1 3. Thiamin-HCI 4. Myo-inositol
C. Asam amino 1. Glisin
Esterase
'abel Lampiran 2. Komposisi larutan pewarna Isoenzim
100 mM Sodium fosfat pH 7.0 100 ml
1- Naftil Asetat 50 mg
2- -Naftil asetat 50 mg
Aseton 5 ml
Fast blue RR salt 100 mg
No
I
Sistim Enzim Komponen pewarr~aI
I
2. Peroksidase 50 mM Na asetet pH 5.0 I00 ml
CaC12 50 mg
H202 0.5 ml
Tabel lampiran 3. Komposisi pereaksi dan buffer untuk analisis DNA tanaman Gloxinia
Larutan
Larutan TE
Komposisi
Buffer ekstrak Orozco-Castillo et al(1994)
Larutan TAE SOX
10% CTAB 5 M NaCl
0.2 % Merkaptoetanol 0.5 M EDTA pH 8
1 M Tris-HCI pH 8
Buffer amplifikasi 10 x
1 M Tris-HCI pH 8 0.5 M EDTA pH 8
24.2 g Tris base 5.7 asam asetat glasial
10 ml EDTA 0.5 M pH 8 51nM Tris-HC1 pH 8 10 mM NaCl 0.1 mM EDTA 0.2 1% Triton
Loadirzg buffer 2.5 % Brolnofenol biru
Tabel Lampiran 4. Susunan nukleotida, kandungan GIC dari 3 0 primer dekamer acak yang diseleksi. No 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Primer OPA7 OPAll OPA 16 OPB04 OPB 10 OPB 12 OPB19 OPCO5 OPC06 OPC17 OPC18 OPD02 OPD03 OPDOS OPD08 OPD13 OPD20 OPN 06 OPN18 OPK 04 OPH02 OPH 03 OPH 04 OPH 05 OPH 19 OPMOI OPM 03 OPM 06 OPM 11 OPM12
Keterangan:
*
primerSusunan oligonukleotida 5'---3' GAAACGGGTG CAATCGCCTG AGCCAGCGAA GGACTGGAGT CTGCTGGGAC CCTTGACGCA ACCCCCGAAG GATGACCGCC GAACGGACTC TTCCCCCCAG TGAGTGGGTG GGACCCAACC GTCGCCGTCA TGAGCGGACA GTGTGCCCCA ACCCGGTCAC GAGACGCACA GGTGAGGTCA CCGCCCAAAC CCGCCCAAAC TCGGACGTGA AGACGTCCAC GGAAGTCGCC AGTCGTCCCC CTGACCAGCC GTTGGTGGCT GGGGGATGAG CTGGGCAACT GTCCACTGTG GGGACGTTGG terpilih.
Kandungan G/C (%)
Lampiran 5.Profil pita DNA gloxinia yang diamplifikasi oleh 6 primer yang terseleksi
1 2 3 4 5 6 7 8 7 6 5 4 3 2 1
OPM 03 OPM 12
OPB 08 OPB 10
Keterangan : Pita DNA plantlet Gloxinia hasil amplifikasi 6 primer, lajur (1) Kontrol,
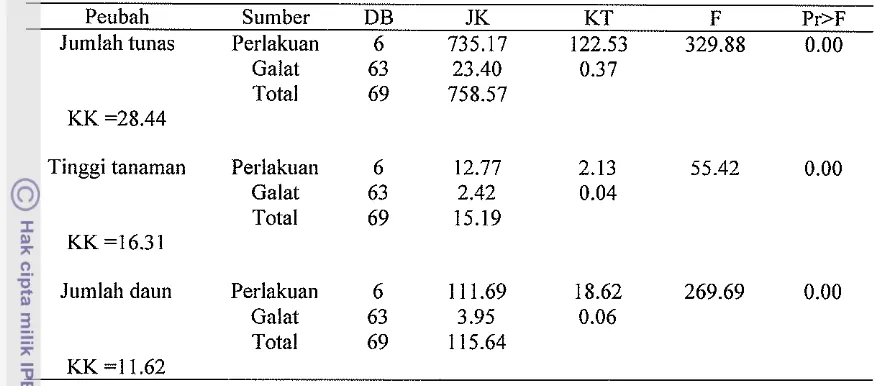
Tabel Lampiran 6. Hasil analisa sidik ragam untuk jumlah tunas, tinggi tanaman dan junilali daun pada regerasi daun gloxinia
Peubali Sumber DB JK KT F Pr>F
Jumlah tunas Perlakuan 6 735.17 122.53 329.88 0.00
Galat 63 23.40 0.37
Total 69 758.57
KK =28.44
Tinggi tanaman Perlakuan 6 12.77 2.13 55.42 0.00
Galat 63 2.42 0.04
Total 69 15.19
KK =16.31
Jumlah daun Perlakuan 6 11 1.69 18.62 269.69 0.00
Galat 63 3.95 0.06
[image:67.541.73.510.97.290.2] [image:67.541.80.509.355.634.2]Total 69 115.64
Tabel Lampiran 7.Hasil a~ialisa sidik ragam jumlah tunas, tinggi tanaman, jumlah daun dan jumlah akar pada eksplan daun sesudah radiasi tanaman gloxinia
Peubali Sumber DB JK KT F Pr>F
Juml tunas Perlakuan 3 40.5 13.5 105.65 0.00
Galat 36 4.6 0.3
Total 39 45.'1
KK= 15.21
TT Perlakuan 3 0.34 0.12 1.84 0.15
Galat 36 2.24 0.06
Total 39 2.59
KK= 15.15
Jumlah daun Perlakuan 3 2.19 0.73 2.27 0.97
Galat 36 11.61 0.32
Total 39 13.80
KK =18.66
Jumlah akar Perlakuan 3 9.28 3.1 3.8 0.18
Galat 36 29.33 0.81
Total 39 38.62
KK=59.75
Tabel Lampiran 8. Hasil analisa sidik ragam untukjumlah tunas, tinggi tanaman, jumlah daun dan jumlah akar pada eksplan tunas sesudah radiasi
Peubah Sumber DB JK KT F Pr>F
Jumlah tunas Perlakuan 3 2.29 0.77 21.66 0.00
Galat 36 1.27 0.04
Total 39 3.57
KK =13.16
Tinggi tanaman Perlakuan 3 0.77 0.26 3.69 0.02
Galat 36 2.50 0.07
Total 3.28 KK =15.73
Jumlah daun Perlakuan 3 7.22 2.41 9.47 0.00
Galat 36 9.15 0.25
Total 39 16.38
KK= 15.96
Jumlah akar Perlakuan 3 32.08 10.69 25.57 0.00
Galat 36 15.00 0.42
Total 39 47.08
KK= 37.70
Tabel Lampiran 9. Hasil analisa sidik ragam jumlah daun dan lebar daun tanaman asal radiasi daun gloksinia di lapang.
Peubah Sumber DB JK KT F Pr>F
Ju