PENGARUH AUKSIN (2,4-D) DAN SITOKININ (BAP)
DALAM KULTUR IN VITRO
BUAH MAKASAR (Brucea javanica [L.] Merr.)
LISBETH YUNI SANTI MANURUNG
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
RINGKASAN
Lisbeth Yuni Santi Manurung. E34102001. Pengaruh Auksin (2,4-D) dan Sitokinin (BAP) dalam Kultur In Vitro Buah Makasar (Brucea javanica [L.] Merr.). Dibawah bimbingan Ir. Edhi Sandra, M.Si (Pembimbing Pertama) dan Dr. Ir. Agus Hikmat, MSc.F (Pembimbing Kedua).
Buah makasar merupakan salah satu potensi tumbuhan obat yang hidup di hutan tropis Indonesia. Tumbuhan ini dimanfaatkan masyarakat untuk mengobati berbagai penyakit antara lain kanker, disentri, dan malaria. Para ahli banyak meneliti tumbuhan ini yang terkait dengan bahan bioaktif yang terkandung di dalamnya untuk meningkatkan manfaatnya mengobati berbagai penyakit. Hanya saja tumbuhan ini sudah susah dijumpai di Indonesia. Sedangkan perbanyakan secara bioteknologi belum dilakukan dimana selama ini buah makasar diperbanyak secara konvensional dengan biji. Hal ini lama kelamaan dapat mengancam kelestarian buah makasar. Oleh karena itu, berdasarkan permasalahan tersebut maka dilakukan penelitian perbanyakan buah maksar melalui kultur in vitro dengan menggunakan media tumbuh MS ditambah zat pengatur tumbuh (ZPT) auksin dan sitokinin. Tujuan penelitian ini adalah untuk mengetahui pengaruh penggunaan ZPT berupa sitokinin (BAP) dan auksin (2,4-D) dalam pertumbuhan buah makasar (Brucea javanica [L.] Merr.) secara kultur in vitro.
Penelitian dilaksanakan di Unit Kultur Jaringan Laboratorium Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan, Institut Pertanian Bogor. Pengambilan data primer dilaksanakan selama 2 bulan dari bulan September sampai dengan November 2006. Bahan tanaman yang digunakan (eksplan) adalah biji buah makasar (Brucea javanica [L.] Merr.) dari tanaman koleksi Bapak Ir. Edhi Sandra, M.Si di Bogor yang berumur kurang lebih 6 bulan. Tanaman induk sebagai sumber eksplan pada waktu pengambilan sedang berbuah lebat dengan tinggi sekitar 2,5 meter. Eksplan ditanam pada media MS yang diberi perlakuan hormon auksin 2,4-D yang terdiri dari 4 taraf konsentrasi, yaitu: 0 mg/l, 0.5 mg/l, 1 mg/l, 2 mg/l dan sitokinin BAP yang terdiri dari 7 taraf konsentrasi, yaitu: 0,5 mg/l, 1 mg/l, 1,5 mg/l, 2 mg/l, 4 mg/l, 6 mg/l dan 8 mg/l. Perlakuan disusun dalam rancangan acak lengkap (RAL) dengan 7 ulangan, setiap unit contoh terdiri dari 1 eksplan sehingga terdapat 84 satuan unit contoh. Pengamatan dilakukan setiap minggu terhadap parameter persentase kontaminasi, persentase pembentukan kalus, persentase pembentukan tunas dan pembentukan plantlet (jumlah akar dan daun). Untuk mengetahui pengaruh yang diberikan pada percobaan tersebut maka dilakukan uji F, selanjutnya uji Duncan untuk mengetahui beda antar perlakuan dengan menggunakan perangkat lunak Stastical Product and Service Solution (SPSS) 12.
perlakuan ZPT kecuali media kontrol (MSo). Eksplan pada media MS yang mengandung ZPT 2,4-D, terinduksi seluruhnya menjadi kalus sedangkan pada media dengan penambahan BAP, kalus terbentuk di bagian pangkal batang. Dalam hal ini eksplan telah mengalami pertumbuhan membentuk batang, daun dan calon akar (radicula).Semakin tinggi konsentrasi ZPT yang diberikan maka semakin tinggi pula persentase pembentukan kalus yang dihasilkan setiap minggunya sampai 8 minggu pengamatan. Eksplan pada semua perlakuan berhasil membentuk tunas kecuali pada media MSo karena pada media Mso eksplan langsung terdeferensiasi membentuk akar (radicula), daun, dan batang. Eksplan yang dikulturkan pada media yang mengandung BAP menghasilkan tunas dalam jumlah banyak jika dibandingkan dengan eksplan yang ditumbuhkan pada media yang mengandung 2,4-D yang maksimal hanya menghasilkan 2 tunas sampai 8 minggu pengamatan. Semakin tinggi konsentrasi BAP yang diberikan maka semakin tinggi pula persentase pembentukan tunas yang dihasilkan setiap minggunya sampai 8 minggu pengamatan. Dari semua media perlakuan hanya media Mso yang berhasil membentuk plantlet sampai pada 8 MST. Pada perlakuan BAP 0,5-2 mg/l, eksplan berhasil membentuk batang dengan beberapa jumlah daun tetapi tidak terbentuk akar. Jumlah daun terbanyak dihasilkan pada media yang mengandung BAP 1,5 mg/l dan paling sedikit pada media BAP 8 mg/l. Keadaan ini menunjukan semakin tinggi konsentrasi BAP maka semakin sedikit pula jumlah daun yang dihasilkan. BAP dengan konsentrasi yang tinggi akan mendorong sel untuk membentuk tunas dalam jumlah banyak. BAP 1,5 mg/l merupakan konsentrasi optimum untuk menghasilkan jumlah daun yang banyak. Daun yang dihasilkan akan membentuk calon plantlet. Oleh karena itu, BAP 1,5 mg/l juga merupakan konsentrasi yang optimum dalam pertumbuhan biji buah makasar untuk tujuan perbanyakan.
PENGARUH AUKSIN (2,4-D) DAN SITOKININ (BAP)
DALAM KULTUR IN VITRO
BUAH MAKASAR (Brucea Javanica [L.] Merr.)
LISBETH YUNI SANTI MANURUNG
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kehutanan
Departemen Konservasi Sumberdaya Hutan dan Ekowisata
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
Judul Penelitian : Pengaruh Auksin (2,4-D) dan Sitokinin (BAP) dalam
Kultur In vitro Buah Makasar (Brucea javanica [L] Merr.)
Nama Peneliti : Lisbeth Yuni Santi Manurung
NIM : E34102001
Departemen : Konservasi Sumberdaya Hutan dan Ekowisata
Disetujui,
Komisi Pembimbing
Ir. Edhi Sandra, M.Si Dr. Ir. Agus Hikmat, MSc.F
Ketua Anggota
Diketahui,
Dekan Fakultas Kehutanan Institut Pertanian Bogor
Prof. Dr. Ir. Cecep Kusmana, MS NIP. 131430799
RIWAYAT HIDUP
Penulis dilahirkan di Asahan, Sumatera Utara, 27 Juni 1984 merupakan
anak dari pasangan Bapak Manar Manurung dan Ibu Nurhaida Sitorus. Penulis
merupakan anak kedua dari empat bersaudara.
Jenjang pendidikan formal dimulai tahun 1990 di SD INPRES BP.
Mandoge selama 6 tahun. Kemudian penulis melanjutkan ke SLTPN 3 Pematang
Siantar dan lulus tahun 1999. Pendidikan selanjutnya ditempuh di SMUN 3
Pematang Siantar dan lulus tahun 2002. Pada tahun yang sama penulis diterima di
IPB melalui jalur USMI (Undangan Seleksi Masuk IPB) di Fakultas Kehutanan
Jurusan Konservasi Sumberdaya Hutan dan Ekowisata.
Selama mengikuti perkuliahan di IPB, penulis pernah melakukan kegiatan
Praktek Pengenalan Hutan di Cagar Alam Leuweung Sancang dan Kamojang,
Praktek Pengelolaan Hutan di KPH Tasikmalaya serta Praktek Kerja Lapang
Profesi (PKLP) di Taman Nasional Ujung Kulon.
Sebagai salah satu syarat untuk meraih gelar sarjana di Fakultas
Kehutanan IPB, maka penulis menyusun skripsi dengan judul “Pengaruh Auksin
(2,4-D) dan Sitokinin (BAP) dalam Kultur In Vitro Buah Makasar (Brucea
javanica [L.] Merr.)” dibawah bimbingan Ir. Edhi Sandra, M.Si dan Dr. Ir. Agus
KATA PENGANTAR
Puji dan syukur atas berkat dan karunia Allah yang maha kuasa sehingga
skripsi ini dapat diselesaikan. Skripsi ini disusun sebagai salah satu syarat untuk
mendapatkan gelar Sarjana Kehutanan pada Fakultas Kehutanan IPB dengan judul
“Pengaruh Auksin (2,4-D) dan Sitokinin (BAP) dalam Kultur In Vitro Buah
Makasar (Brucea javanica [L.] Merr.)”.
Buah makasar merupakan salah satu potensi tumbuhan obat yang hidup di
hutan tropis Indonesia. Tumbuahan ini dimanfaatkan masyarakat untuk mengobati
berbagai penyakit antara lain kanker, disentri, dan malaria. Para ahli banyak
meneliti tumbuhan ini yang terkait dengan bahan bioaktif yang terkandung di
dalamnya untuk meningkatkan manfaatnya mengobati berbagai penyakit. Hanya
saja tumbuhan ini sudah susah dijumpai di Indonesia. Sedangkan perbanyakan
secara bioteknologi belum dilakukan dimana selama ini buah makasar
diperbanyak secara konvensional dengan biji. Oleh karena itu, berdasarkan
permasalah tersebut penulis mencoba melakukan perbanyakan buah maksar
melalui kultur in vitro yang nantinya diharapkan dapat menjaga kelestarian buah
makasar dan dapat memenuhi bahan baku obat dari tumbuhan tersebut.
Penulis menyadari bahwa skripsi ini belum sempurna. Namun demikian,
penulis berharap skripsi ini dapat memberikan manfaat bagi yang membacanya.
Akhirnya penulis ingin mengucapkan terima kasih kepada Ir. Edhi Sandra,
M.Si dan Dr.Ir. Agus Hikmat, MSc.F yang telah membimbing penulis hingga
selesainya skripsi ini.
Bogor, Januari 2007
DAFTAR ISI
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
TINJAUAN PUSTAKA Tinjauan Umum Tanaman Buah Makasar (Brucea javanica [L.] Merr.) Taksonomi dan Morfologi ... 3
Habitat dan Penyebaran... 4
Kandungan kimia ... 4
Kegunaan ... 4
Perbanyakan ... 5
Kultur Jaringan Teknik Kultur Jaringan ... 5
Manfaat Kultur Jaringan ... 6
Media Kultur ... 7
Zat Pengatur Tumbuh ... 7
BAP (Benzylaminopurin) ... 9
2,4-D (Diclrophenoxy Acetic Acid) ... 9
Lingkungan Kultur ... 9
Penelitian Buah Makasar ... 11
METODE PENELITIAN Lokasi dan Waktu Penelitian ... 12
Bahan dan Alat Penelitian ... 12
Metode Penelitian ... 13
HASIL DAN PEMBAHASAN Presentase Kontaminasi ... 17
Pengaruh BAP dan 2,4-D Pembentukan Kalus ... 19
Pembentukan Tunas ... 24
VI. KESIMPULAN DAN SARAN
Kesimpulan ... 31
Saran ... 32
DAFTAR PUSTAKA ... 33
LAMPIRAN ... 36
DAFTAR TABEL
Nomor Halaman
1. Zat pengatur tumbuh yang digunakan secara komersial dalam
mikropropagasi tanaman ... . .... . ... 8
2. Penelitian buah makasar ... . .... . ... 11
3. Jumlah kultur yang kontaminan pada tiap perlakuan pada 8 MST .. . ... 18
4. Uji lanjut faktor perlakuan konsentrasi 2,4-D dan BAP terhadap
persentase pembentukan kalus ... ... 22
5. Uji lanjut faktor perlakuan konsentrasi 2,4-D dan BAP terhadap
persentase pembentukan tunas ... ... 27
DAFTAR GAMBAR
Nomor Halaman
1. Buah makasar (Brucea javanica [L.] Merr.) ... ...4
2. Kontaminasi kultur: (a) kontaminasi oleh cendawan, (b) kontaminasi oleh bakteri, (c) kontaminasi oleh cendawan yang telah menyebar menutupi media ... ...19
3. Tahap pertumbuhan kalus pada media dengan penambahan
ZPT 2,4-D ... .... ...20
4. Tahap pertumbuhan kalus pada media MS dengan penambahan
ZPT BAP ... .... ...21
5. Grafik pembentukan kalus untuk media perlakuan pada berbagai konsentrasi dari 1-8 MST pengamatan ... ...22
6. Tahap pertumbuhan eksplan pada media MSo ... .... ...24
7. Tunas pada media yang mengandung BAP ... ...25
8. Grafik pembentukan tunas untuk media perlakuan
pada berbagai konsentrasi dari 1-8 MST pengamatan ... ...26
9. Grafik rata-rata pertambahan jumlah daun untuk media
perlakuan pada berbagai konsentrasi dari 1-8 MST pengamatan . ...28
10. Eksplan yang telah mengalami pertumbuhan pada media
DAFTAR LAMPIRAN
Nomor Halaman
1. Kontaminasi kultur ... . .... . ... 36 2. Persentase pembentukan kalus, tunas dan jumlah daun kultur buah
makasar (Brucea javanica [L.] Merr.) ... ... 37
3. Hasil sidik ragam persentase pembentukan kalus, tunas dan jumlah
daun kultur buah makasar (Brucea javanica [L.] Merr.) ... ... 39
4. Komposisi media MS ... ... 40
5. Prosedur pembuatan media MS ... ... 41
6. Gambar eksplan pada media yang mengandung 2,4-D, BAP dan MSo
PENDAHULUAN
Latar Belakang
Hutan tropis mengandung berbagai keanekaragaman hayati yang secara
bersamaan membentuk mata rantai kehidupan yang bermanfaat bagi manusia.
Keanekaragaman hayati ini memiliki kegunaan tertentu baik yang telah diketahui
atau dimanfaatkan maupun yang belum. Salah satu yang dimanfaatkan adalah
berbagai jenis tumbuhan obat.
Indonesia termasuk negara yang memilki hutan alam tropika yang kaya
akan keanekaragaman spesies tumbuhan obat. Diperkirakan mencapai kurang
lebih 1300 spesies tumbuhan yang telah diketahui secara pasti berkhasiat obat dan
terdapat di hutan tropika Indonesia, dimana sebagian besar spesies tersebut tidak
dimilki oleh negara lain di dunia (Zuhud et al., 1994).
Buah makasar (Brucea javanica [L.] Merr.) merupakan salah satu jenis
tumbuhan obat tropika yang dimiliki Indonesia. Tumbuahn ini dimanfaatkan
masyarakat untuk mengobati berbagai penyakit antara lain kanker, disentri, dan
malaria.
Buah makasar dulu tersedia melimpah di hutan kawasan Bogor, Jawa
Barat. Sekarang, tanaman tersebut sudah sangat susah dijumpai di Indonesia.
Ironisnya, di luar negeri, buah makasar sedang gencar dipromosikan sebagai obat
kanker paru-paru dan penyakit yang disertai perdarahan. Industri farmasi Jepang
pun dengan gesit menyambar peluang dengan mengekspor obat yang diekstrak
dari buah makasar (Mardiyah et al., 2002).
Kandungan kimia penting berupa alkaloid (brucamarine, yatanine),
glikosida (brucealin, yatanoside A dan B, kosamine), dan phenol (brucenol,
bruceolic acid) yang terkandung dalam buah makasar mendorong para ahli untuk
melakukan penelitian terkait dengan bahan bioaktif buah makasar tersebut. Tetapi
sebagian besar penelitian yang dilakukan lebih kepada peningkatan manfaat buah
makasar untuk mengobati berbagai penyakit sedangkan perbanyakan tanaman
secara bioteknologi belum dilakukan. Dengan meningkatnya harga obat
therapy semakin meningkat sehingga kebutuhan akan bahan baku juga semakin
banyak. Hal ini lama kelamaan dapat mengancam kelestarian buah makasar.
Perbanyakan secara in vitro merupakan cara yang tepat saat ini untuk
melakukan upaya konservasi buah makasar sehingga dapat memenuhi kebutuhan
bahan baku buah makasar tanpa mengancam kelestariannya di alam karena akan
dihasilkan bibit dalam jumlah banyak dan dalam waktu singkat.
Pertumbuhan dan morfogenesis tanaman secara in vitro dikendalikan oleh
keseimbangan dan interaksi dari zat pengatur tumbuh yang ada di dalam tanaman
(Gunawan, 1992). Dalam kultur in vitro, komposisi media dasar dan zat pengatur
tumbuh yang tepat dan seimbang serta kondisi internal (dalam botol kultur) yang
steril dan eksternal (lingkungan laboratorium) yang stabil dapat membantu dan
menjaga pertumbuhan dan perkembangan eksplan tanaman yang dikulturkan.
Di Indonesia sendiri, teknik kultur in vitro sudah banyak dilakukan untuk
perbanyakan tanaman pertanian dan hias. Tetapi untuk jenis tanaman obat
terutama untuk tanaman obat hutan masih jarang dilakukan. Dengan semakin
banyaknya penelitian tentang perbanyakan tanaman secara bioteknologi
diharapkan tanaman obat tetap lestari terutama untuk jenis langka dan tingkat
eksploitasinya tinggi.
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh penggunaan ZPT
berupa sitokinin (BAP) dan auksin (2,4-D) dalam pertumbuhan buah makasar
(Brucea javanica [L.] Merr.) secara kultur in vitro.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memperoleh komposisi ZPT yang
terbaik yang memacu pertumbuhan buah makasar secara kultur in vitro, dan
diperoleh bibit buah makasar yang berkualitas yang pada akhirnya dapat
TINJAUAN PUSTAKA
Tinjauan Umum Tanaman Buah makasar (Brucea javanica [L.] Merr.)
Taksonomi dan Morfologi
Menurut Heyne (1987), tumbuhan buah makasar memilki taksonomi
sebagai berikut:
Brucea javanica [L.] Merr. memiliki sinonim, diantaranya B. amarissima
Desv., B. gracilis DC., B. sumatrana Roxb., Gonus amarissima Lour., Lussa
amarissima O. Ktze., Rhus javanica L. Di Indonesia, jenis ini lebih dikenal
dengan nama dadih-dadih, tambar sipago, t. sipogu, t. bui, malur, sikalur, belur
(Sumatera), kendung peucang, ki padesa, kuwalot, trawalot, walot (Sunda), kwalot
(Jawa), tambara marica (Makasar) dan nagas (Ambon) (Dalimartha, 2000).
Buah makasar merupakan perdu tegak, menahun, tinggi 1-2,5 m, berambut
halus warna kuning. Daunnya berupa daun majemuk menyirip ganjil, jumlah anak
daun 5-13, bertangkai, letak berhadapan. Helaian anak daun berbentuk lanset
memanjang, ujung meruncing, pangkal berbentuk baji, tepi bergerigi kasar,
permukaan atas berwarna hijau, permukaan bawah berwarna hijau muda, panjang
5-10 cm, lebar 2-4 cm. Bunga majemuk berkumpul dalam rangkaian berupa malai
padat yang keluar dari ketiak daun, warna ungu kehijauan. Buahnya buah batu
berbentuk bulat telur, panjang sekitar 8 mm, jika sudah masak berwarna hitam.
Bijinya bulat, berwarna putih. Di Indonesia, buahnya disebut biji makasar
-Gambar 1. Buah makasar (Brucea javanica [L.] Merr.)
Habitat dan Penyebaran
Buah makasar tumbuh liar di hutan, kadang-kadang ditanam sebagai
tanaman pagar. Di Indonesia banyak tumbuh di Jawa dan Madura, yaitu di tepi
sungai, hutan jati dan hutan sekunder muda. Buah makasar tumbuh pada
ketinggian 1-500 m dpl (Dalimartha, 2000).
Kandungan Kimia
Buah makasar mengandung alkaloid (brucamarine, yatanine), glikosida
(brucealin, yatanoside A dan B, kosamine), dan phenol (brucenol, bruceolic
acid). Bijinya mengandung brusatol dan bruceine A, B, C, E, F, G, H. Daging
buahnya mengandung minyak lemak, asam oleat, asam, linoleat, asam stearat, dan
asam palmitoleat. Buah dan daunnya mengandung tanin (Dalimartha, 2000).
Kegunaan
Hampir semua bagian dari tanaman buah makasar dapat digunakan untuk
mengobati berbagai penyakit. Buah digunakan untuk pengobatan: malaria; disentri
amuba; diare kronis akibat terinfeksi Trichomonas sp.; keputihan; wasir
(hemoroid); cacingan (nematoda, taenia); papiloma di pangkal tenggorokan
(laring), pita suara, liang telinga luar, dan gusi; kanker pada kerongkongan
digunakan untuk pengobatan malaria, demam dan keracunan makanan. Dan daun
digunakan untuk mengobati sakit pinggang (Dalimartha, 2000).
Buahnya di toko obat Jakarta dikenal dengan nama ko som ci, tetapi lebih
dikenal dengan biji makasar (Heyne, 1987).
Perbanyakan
Buah makasar dapat diperbanyak dengan biji. Perbanyakan tanaman ini
secara bioteknologi belum dilakukan.
Kultur Jaringan
Teknik Kultur Jaringan
Kultur jaringan (tissue culture) adalah suatu teknik mengisolasi
bagian-bagian tanaman (sel, protoplasma, tepung sari, ovari dan sebagainya),
ditumbuhkan secara tersendiri, dipacu untuk memperbanyak diri, akhirnya
diregenerasikan kembali menjadi tanaman lengkap dalam suatu lingkungan yang
aseptik. Teknik ini juga disebut kultur in vitro (in vitro culture) yang artinya
kultur di dalam wadah gelas (Wattimena et al., 1992).
Prinsip dasar dari kultur jaringan adalah teori totipotensi yang menyatakan
bahwa di dalam masing-masing sel tumbuhan mengandung informasi genetik dan
atau sarana fisiologis tertentu yang mampu membentuk tanaman lengkap bila
ditempatkan dalam lingkungan yang sesuai (Wetherell, 1982).
Kultur jaringan terdiri atas beberapa tahap kegiatan. Profesor Murashige
dari Universitas California membagi kultur in vitro dalam tiga tahap, yaitu tahap I
meliputi persiapan eksplan untuk ditumbuhkan pada media kondisi yang aseptik.
Tahap II adalah penggandaan propagul dengan cara meningkatkan jumlah cabang
aksiler ataupun pembentukan tunas-tunas baru. Tahap III adalah pendewasaan
lebih lanjut calon tanaman dengan merangsang pembentukan akar dan
pertumbuhan (aklimatisasi) (Wetherell, 1982). Tahapan-tahapan ini kemudian
disempurnakan oleh Deberg dan Maena (1981) dalam Wattimena et al.(1992)
menjadi 5 tahap, yaitu: 1) Seleksi tanaman induk, 2) Pemantapan kultur aseptik,
3) Produksi propagul, 4) Persiapan plantet sebelum diaklimatisasi, dan 5)
Faktor-faktor yang mempengaruhi pertumbuhan dan morfogenesis
tanaman dalam kultur jaringan dapat digolongkan menjadi 4 golongan utama,
yaitu:
1. Genotipe dari sumber bahan tanaman yang digunakan
2. Media, mencakup tentang komponen penyusun media dan juga zat
pengatur tumbuh tanaman yang digunakan
3. Lingkungan tumbuh tanaman yaitu keadaan fisik tempat kultur
ditumbuhkan
4. Fisiologi jaringan tanaman sebagai eksplan.
Kempat faktor tersebut dapat berinteraksi satu dengan yang lainnya (Wattimena et
al., 1992).
Manfaat Kultur Jaringan
Menurut Rahardja dan Wiryanta (2003), beberapa manfaat yang didapat
dari pembudidayaan tanaman secara kultur jaringan adalah:
1. Melestarikan sifat unggul tanaman induk
2. Menghasilkan tanaman yang memilki sifat seragam
3. Menghasilkan tanaman baru dalam jumlah besar
4. Menghasilkan tanaman yang bebas virus yang dilakukan dengan cara
mengambil jaringan muda yang bebas virus
5. Bisa dijadikan media untuk melestarikan plasma nutfah yang mulai langka
dan sulit dikembangkan dengan cara-cara konvensional
6. Menghasilkan tanaman dengan tingkat produksi tinggi.
7. Bisa menghasilkan tanaman diploid homozigot melalui kultur kepala sari.
Tanaman yang dihasilkan adalah haploid. Tanaman haploid ini diberi zat
kimia tertentu seperti colchicine yang menyebabkan terjadinya duplikasi
kromosom, sehingga tanaman haploid hasil kultur jaringan bermutasi
menjadi diploid homozigot
8. Untuk menciptakan varietas baru melalui rekayasa genetika. Sel yang telah
direkayasa dikembangkan mealui kultur sel sehingga menjadi tanaman
Selain kelebihan, teknik perbanyakan melalui kultur jaringan ini juga
memilki beberapa kekurangan, yaitu:
1. Dibutuhkan biaya awal yang relatif tinggi untuk laboratorium dan bahan
kimia
2. Dibutuhkan keahlian yang khusus untuk melaksanakannya
3. Tanaman yang dihasilkan berukuran kecil, aseptic, dan terbiasa hidup di
tempat yang berkelembaban tinggi sehingga memerlukan aklimatisasi ke
lingkungan eksternal. Aklimatisasi merupakan salah satu tahapan kritis
yang sering menjadi kendala dalam produksi bibit secara massal (Ariana,
2005).
Media Kultur
Keberhasilan dalam teknologi serta penggunaan metode in vitro terutama
disebabkan pengetahuan yang lebih baik tentang kebutuhan hara sel dan jaringan
yang dikulturkan. Hara terdiri dari komponen yang utama dan komponen
tambahan. Komponen utama meliputi garam mineral, sumber karbon (gula),
vitamin dan pengatur tumbuh. Komponen lain, seperti senyawa nitrogen organik,
berbagai asam organik, metabolit dan ekstrak tambahan tidak mutlak, tetapi dapat
menguntungkan ketahanan sel dan perbanyakannya (Wetter & Constabel, 1982).
Media hara ini dapat berbentuk padat, semi padat dan cair (Wattimena et al.,
1992).
Banyak formulasi media yang ada, masing-masing berbeda dalam hal
kuantitas maupun kualitas komponennya. Dari sekian banyak formulasi yang ada,
beberapa buahnya telah sering dipakai. Antara lain seperti yang telah
dikemukakan oleh Toshio Murashige dan dipublikasikan oleh Murashige dan
Skoog pada tahun 1962 (Wetherell, 1982).
Zat Pengatur Tumbuh
Ada 2 jenis hormon tanaman yang sekarang banyak dipakai dalam
propagasi in vitro yaitu auksin dan sitokinin (Wetherell, 1982).
Auksin merupakan salah satu golongan fitihormon, baik yang alamiah
maupun yang sintetik, menginduksi pemanjangan sel dan juga dalam kasus
dominansi apikal, penghambatan pucuk aksilar dan adventif, serta inisiasi
pengakaran (Wattimena et al., 1992).
Auksin sintetis yang sering digunakan dalam kultur jaringan adalah:
Indole-3-Acetic Acid (IAA); 2,4-Dichlorophenoxy Acetic Acid (2,4-D);
Nephtaleine Acetic Acid (NAA); Indole Butyric Acid (IBA); Naphtoxy Acetic
acid (4-CPA); 2,4,5-Trichloro Acetic Acid (2,4,5-T); 3,6-Dichloro Anisic Acid
(Dicamba); $-Amino-3,5,6-Trichloro Picolinic Acid (Picloram) dan IAA
conjugate (IAA-L-alanine dan IAA-Glycine) (Gunawan, 1987).
Sitokinin merupakan turunan adenin, berperan dalam mendorong
pembelahan sel atau jaringan yang dipergunakan sebagai eksplan dan merangsang
perbanyakan pucuk-pucuk tunas. Sitokinin yang digunakan secara komersial
dalam propagasi in vitro adalah: Bensiladenin (6-bensilaminopurin); Kinetin;
Isopentiladeni (dimetil aminopurin); Adenin sulfat (Wetherell, 1982). Tetapi
Bensiladenin (6-bensilaminopurin) atau disingkat BAP lebih sering digunakan,
karena sifatnya yang stabil, tidak mahal, mudah diperoleh dan lebih efektif
dibangdingkan Kinetin (Zaer dan Mapes, 1982 dalam Muchtar, 1996).
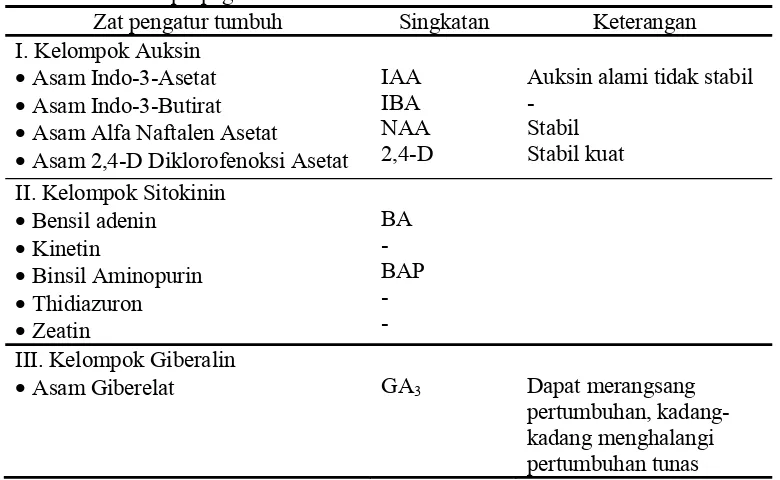
Tabel 1. Zat pengatur tumbuh yang digunakan secara komersial dalam mikropropagasi tanaman
Zat pengatur tumbuh Singkatan Keterangan
I. Kelompok Auksin •Asam Indo-3-Asetat •Asam Indo-3-Butirat •Asam Alfa Naftalen Asetat
•Asam 2,4-D Diklorofenoksi Asetat
IAA IBA NAA 2,4-D
Auksin alami tidak stabil -
•Asam Giberelat GA3 Dapat merangsang
BAP (Benzylaminopurin)
BAP (Benzylaminopurin) adalah zat pengatur tumbuh (ZPT) yang
tergolong ke dalam sitokinin sintetik, yang dalam penggunaannya dipengaruhi
oleh ZPT lainnya. Sitokinin mempengaruhi berbagai proses fisiologi di dalam
tanaman. Aktivitas yang utama dari sitokinin adalah sitokenesis atau pembelahan
sel. Aktivitas ini yang menjadi kriteria utama untuk menggolongkan suatu zat
pengatur tumbuh ke dalam sitokinin (Wattimena, 1988).
Salah satu jenis hormon dari kelompok sitokinin yang paling banyak
digunakan adalah BAP. Hal ini karena BAP dinilai lebih stabil, tidak mahal dan
lebih efektif dibandingkan kinetin. BAP biasanya digunakan untuk induksi kalus
tapi yang terpenting adalah BAP dapat menginduksi formasi tunas, pucuk atau
kecambah (Bonga & Durzan, 1982 dalam Ariana, 2005).
2,4-D (Dichlorophenoxy Acetic Acid)
2,4-D merupakan jenis auksin sintetis yang sering digunakan dalam kultur
jaringan. Hal yang menarik dari senyawa 2,4-D dilihat dari segi aktivitasnya yaitu
jika dibandingkan dengan IAA menunjukan aktivitas yang lebih (Wattimena,
1992). Rantai yang mempunyai gugus karboksil dipisahkan oleh karbon atau
karbon dan oksigen akan memberikan aktivitas yang optimal (Abidin, 1985).
Lingkungan Fisik Kultur
Faktor-faktor lingkungan yang berpengaruh terhadap perkembangan kultur
jaringan antara lain pH, kelembaban, cahaya dan temperatur. Faktor lingkugan
tersebut berpengaruh terhadap proses pertumbuhan dan diferensiasi sel-sel
tanaman yang dikembangkan dengan teknik kultur jaringan (Ariana, 2005).
Bentuk fisik medium kultur jaringan berupa medium padat, semi padat dan
cair. Kondisi fisik medium dapat berpengaruh pada pertumbuhan kultur dan laju
pembentukan tunas (Wattimena et al., 1992).
Keberhasilan dalam penggunaan metode kultur jaringan sangat bergantung
pada media yang digunakan. Media kultur jaringan tanaman menyediakan tidak
hanya unsur hara makro dan mikro, tetapi juga karbohidrat yang pada umumnya
berupa gula untuk menggantikan karbon yang biasanya didapat dari atmosfir
dalam media tersebut ditambahkan vitamin-vitamin, asam amino dan zat pengatur
tumbuh (ZPT).
Pengaturan pH media selain memperhatikan kepentingan fisiologi sel, juga
harus mempertimbangkan faktor-faktor: 1) Kelarutan dari garam-garam penyusun
media, 2) Pengambilan dari zat pengatur tumbuh dan garam-garam lain, dan 3)
Efisiensi pembekuan agar (Gunawan, 1987). Sampai saat ini belum ada penelitian
mengenai pH optimum spesifik setiap tanaman. Namun secara umum dapat
dikatakan bahwa kebanyakan bagian tanaman, tumbuh dengan baik pada media
yang mengandung buffer lemah pada pH antara 5-6 (Wetherell, 1982).
Ada tiga hal dalam pemberian cahaya yang mempengaruhi pertumbuhan
dan kultur secara in vitro, yaitu: panjang gelombang cahaya, intensitas cahaya,
dan photoperiodisme. Pertumbuhan organ tanaman secara in vitro yang optimal
seringkali memerlukan adanya cahaya. Namun, pada awal proses pembelahan sel
dari eksplan yang dikulturkan dan pertumbuhan kalus kadang-kadang dihambat
oleh adanya cahaya.
Suhu juga memegang peranan penting dalam mempengaruhi laju dan
perbanyakan jaringan. Pada banyak tanaman, jaringannya tumbuh baik pada 170C
sampai 320C. Kebanyakan suhu ruang inkubasi dalam kultur in vitro diatur sama,
baik siang maupun malam. Namun, ada juga yang menggunakan suhu ruang
inkubasi yang disesuaikan dengan suhu alami tempat tumbuh tanaman tersebut
secara in vitro, pada siang hari diberikan suhu lebih tinggi dari rata-rata, dan pada
malam hari lebih rendah 60C sampai 80C (Wattimena et al., 1992).
Kelembaban udara penting untuk mencegah kultur mengalami kekeringan.
Jika kelembaban ruangan rendah maka penguapan air dari media kultur akan
terlalu besar. Dan sebaliknya, jika kelembaban ruangan tinggi akan menyebabkan
terjadinya pertumbuhan mikroba di luar wadah kultur atau alat-lat sehingga akan
menaikkan derajat kontaminasi. Kelembaban relatif ruang tumbuh kultur jaringan
kurang lebih 70%, di dalam botol menghendaki kelembaban yang lebih tinggi
Penelitian buah makasar
Penelitian tentang buah makasar di Indonesia masih sangat jarang
dilakukan. Beberapa penelitian buah makasar yang pernah dilakukan adalah:
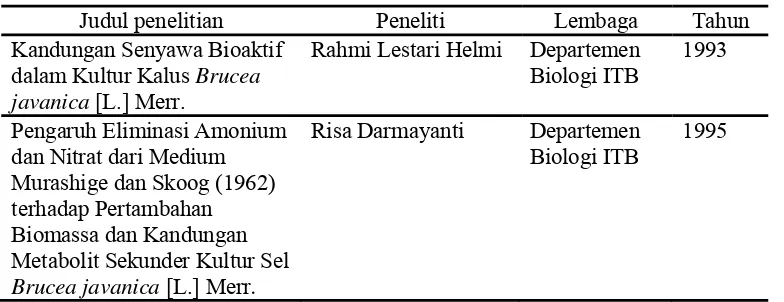
Tabel 2. Penelitian buah makasar
Judul penelitian Peneliti Lembaga Tahun
Kandungan Senyawa Bioaktif dalam Kultur Kalus Brucea javanica [L.] Merr.
Rahmi Lestari Helmi Departemen
Biologi ITB
1993
Pengaruh Eliminasi Amonium dan Nitrat dari Medium Murashige dan Skoog (1962) terhadap Pertambahan Biomassa dan Kandungan Metabolit Sekunder Kultur Sel Brucea javanica [L.] Merr.
Risa Darmayanti Departemen
Biologi ITB
1995
Penelitian Helmi (1993) tentang kandungan senyawa bioaktif buah
makasar dengan tujuan untuk mengetahui pengaruh penambahan zat pengatur
tumbuh auksin dan sitokinin terhadap pertumbuhan dan biosintesis senyawa
bioaktif dalam kalus. Kalus dibentuk dengan menggunakan eksplan daun buah
makasar. Pertumbuhan kalus terbaik didapatkan pada media MS + 5.10-6 M 2,4-D
+ 7,5.10-6 M Kinetin dan 1,5.10-6 M 2,4-D + 10-5 M BAP. Sedangkan Darmayanti
(1995) yang menguji pengaruh eliminasi amonium dan nitrat dari medium
Murashige dan Skoog (1962) terhadap pertambuhan biomassa dan kandungan
metabolit sekunder kultur sel buah makasar memperoleh hasil bahwa penambahan
nitrogen dalam bentuk nitrat dapat meningkatkan pertumbuhan sel dan brusein A
sedangkan penambahan nitrogen dalam bentuk amonium dapat meningkatkan
kandungan brusein A tetapi menghambat pertumbuhan biomassa sel.
Penelitian buah makasar yang pernah dilakukan tersebut di atas hanya
sebatas kepada pengujian senyawa bioaktif yang terkandung di dalamnya yang
dilakukan secara kultur in vitro. Tetapi untuk tujuan perbanyakan belum
dilakukan. Mengingat pada saat ini buah makasar sudah sangat jarang dijumpai,
keadaan ini bisa dipandang serius. Karena itu, perlu dilakukan usaha budidaya
yang tepat sehingga keberadaan buah makasar di alam tetap lestari dan dapat
METODE PENELITIAN
Lokasi dan Waktu Penelitian
Penelitian dilaksanakan di Unit Kultur Jaringan Laboratorium Konservasi
Tumbuhan Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas
Kehutanan, Institut Pertanian Bogor. Pengambilan data primer dilakukan selama 2
bulan dari bulan September sampai dengan November 2006.
Bahan dan Alat Penelitian
Bahan
a. Bahan Media
Media yang digunakan dalam penelitian ini adalah media MS (Murashige
& Skoog) yang telah dimodifikasi dengan penambahan vitamin, asam amino dan
sukrosa. Selain itu, ke dalam media ditambahkan zat pengatur tumbuh (BAP dan
2,4-D ) dengan konsentrasi yang sesuai dengan perlakuan.
b. Bahan Tanaman
Bahan tanaman yang digunakan adalah biji buah makasar (Brucea
javanica [L.] Merr.) dari tanaman koleksi Bapak Ir. Edhi Sandra, M.Si, Bogor
yang berumur kurang lebih 6 bulan. Tanaman induk sebagai sumber eksplan pada
waktu pengambilan sedang berbuah lebat dengan tinggi sekitar 2,5 meter.
c. Bahan Sterilisasi
Sterilisasi dilakukan terhadap bahan dan alat-alat yang digunakan. Bahan
sterilisasi yang digunakan adalah Detergen, Alkohol 70 %, larutan Baycline
(Natrium hipoklorit ) 5% dan Aquades steril.
Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi botol kultur,
petridish, pembakar spiritus, pisau, scalpel, pinset, erlenmeyer, gelas piala, gelas ukur, pipet, pH meter, autoklaf, neraca analitik, pengaduk magnetik, laminar air
Metode Penelitian
Sterilisasi
a. Sterilisasi lingkungan kerja
Kebersihan lingkungan kerja dapat dijaga dengan membatasi orang yang
masuk ruangan serta membersihkannya dengan disenfektan. Sebelum, selama dan
setelah digunakan, permukaan tempat kerja dibersihkan dengan kapas yang telah
dicelupkan dalam alkohol 70 %. Blower atau peniup udara pada laminar air flow
cabinet dinyalakan sebelum dan selama pemakaian untuk menghindari
kontaminan.
b. Sterilisasi Alat-alat dan Media Kultur
Alat-alat yang digunakan dalam penelitian harus selalu dalam keadaan
steril. Gelas (petridish, botol-botol kosong, pipet, dan lain-lain), alat-alat logam
(pinset, gunting, gagang scalpel, dan lain-lain) dan kertas saring dibungkus rapi
dengan kertas tebal. Semuanya itu disterilkan dengan autoklaf pada suhu 121°C
(250°F) pada tekanan 17,5 psi selama 1 jam. Penghitungan waktu sterilisasi
dimulai setelah tekanan yang diinginkan tercapai.
Alat-alat tanam seperti pinset, gunting, dan mata pisau scalpel disterilkan
dengan pembakaran di atas api bunsen, setelah sebelumnya dicelupkan dalam
alkohol 70%.
Media tanam dan aquades juga disterilkan dengan autoklaf. Aquades
disterilkan dengan waktu, suhu, dan tekanan yang sama untuk sterilisasi alat-alat
sedangkan media disterilkan dengan autoklaf pada suhu 121°C (250°F) pada
tekanan antara 15-17,5 psi selama 20-25 menit.
c. Sterilisasi bahan tanaman
Bahan tanaman (eksplan) yang akan ditanam, sebelumnya diberi perlakuan
sterilisasi. Tahapan sterilisasi untuk biji Buah makasar dilakukan dengan metode
sebagai berikut:
1. Buah makasar dicuci bersih dengan air mengalir kemudian direndam dengan
deterjen cair selama 7 menit sambil dikocok-kocok. Tujuan dari perendaman ini
adalah untuk memecahkan dormansi biji. Setelah direndam dalam deterjen cair
2. Di dalam laminar air flow cabinet biji dibilas dengan air steril. Kemudian
direndam dengan alkohol 70% selama 10 menit kemudian dibilas. Setelah
direndam di dalam larutan alkohol 70%, selanjutnya buah direndam di dalam
larutan Baycline (Natrium hipoklorit ) 5% selama 10 menit sambil
dikocok-kocok.
3. Setelah itu buah dibilas dengan air steril sebanyak 3 kali
4. Masih di dalam laminar air flow cabinet, buah dikupas sehingga hanya
menyisakan biji bagian dalamnya saja atau yang sering disebut dengan inti biji.
Dalam pengupasan ini digunakan cawan petri sebagai alas dan pinset serta pisau
untuk mengupas. Sebelum digunakan, pisau dan pinset tersebut dibakar di atas api
bunsen agar alat-alat tersebut bebas dari mikroorganisme. Dalam pengupasan ini
harus hati-hati jangan sampai melukai bagian dalam biji.
5. Bahan eksplan berupa biji yang telah dikupas yaitu berupa inti biji ditanaman
dalam media perlakuan.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS (Murashige
& Skoog) dengan penambahan zat pengatur tumbuh 2,4-D (0,5; 1; 1,5 dan 2 mg/l)
dan BAP (0; 0,5; 1; 1,5; 2; 4; 6 dan 8 mg/l) sesuai rancangan berikut:
Langkah awal adalah pembuatan larutan induk (stok) yang terdiri dari
larutan induk makro, larutan induk mikro, larutan vitamin dan larutan induk
Fe-EDTA. Pembuatan larutan induk bertujuan untuk menghemat pekerjaan
menimbang bahan yang berulang-ulang setiap kali membuat media. untuk
membuat satu liter media kultur dengan konsentrasi yang sesuai dengan
perlakuan, maka dilakukan pengenceran larutan induk dengan air mineral hingga
Pada media perlakuan ditambahkan zat pengatur tumbuh sesuai dengan
perlakuan pH dalam media berkisar 5,6-5,8, apabila media bersifat asam (pH<5,6)
maka ditambahkan KOH sedangkan bila bersifat basah (pH>5,8) ditambahkan
HCL. Ke dalam larutan media tersebut ditambahkan agar-agar 7 g/l dan
ditambahkan gula pasir 30 g, kemudian dipanaskan sampai mendidih. selanjutnya
media MS tersebut ditambahkan zat pengatur tumbuh sesuai perlakuan.
Media perlakuan yang sudah jadi dituang ke dalam botol kultur dan diberi
label sesuai dengan perlakuan kemudian ditutup dengan tutup plastik. Botol-botol
tersebut kemudian disterilkan dengan autoklaf pada tekanan antara 15-17,5 psi
dan suhu 1210C selama 30 menit.
Penanaman
Bahan eksplan berupa biji yang telah dikupas dan disterilisasi ditanam
dalam media perlakuan. Setiap botol kultur ditanam satu biji. Proses pemindahan
dan penanaman dilakukan di laminar air flow cabinet dalam kondisi steril.
Pengamatan
Pengamatan dilakukan pada seluruh eksplan yang ditanam dalam setiap
satuan perlakuan meliputi visual kalus dan tunas yang dihasilkan. Persentase
pembentukan kalus dan tunas, pembentukan plantlet yang terkait dengan jumlah
daun dan jumlah akar. Selain itu, juga dilakukan pengamatan secara visual
terhadap kontaminasi kultur. Pengamatan dilakukan setiap minggu selama 2
bulan.
Rancangan Percobaan dan Analisis Data
Rancangan yang digunakan dalam penelitian ini adalah rancangan acak
lengkap (RAL). Percobaan terdiri dari 12 perlakuan dan tujuh ulangan sehingga
terdapat 84 unit contoh pengamatan. Faktor atau perlakuan yang digunakan adalah
konsentrasi auksin (2,4-D) dan sitokinin (BAP) yang ditambahkan dalam media
Model umum rancangan yang digunakan adalah sebagai berikut:
Yij = μ + αi + Σij Keterangan:
Yij = hasil pengamatan terhadap eksplan buah makasar pada pengaruh
zat pengatur tumbuh BAP ke-i dan ulangan ke-j atau 2,4-D ke-i dan
ulangan ke-j
μ = nilai rata-rata umum
αi = pengaruh zat pengatur tumbuh BAP ke-i atau 2,4-D ke-i
Σij = pengaruh galat percobaan pada eksplan buah makasar yang memperoleh perlakuan konsentrasi BAP ke-i atau 2,4-D ke-i
Untuk mengetahui pengaruh yang diberikan pada percobaan tersebut maka
dilakukan uji F. Apabila hasil sidik ragam memberikan hasil berpengaruh nyata
maka dilakukan uji lanjutan wilayah Duncan untuk mengetahui beda antar
perlakuan. Pengolahan data dilakukan dengan menggunakan perangkat lunak
HASIL DAN PEMBAHASAN
Persentase Kontaminasi
Salah satu faktor pembatas dalam kultur in vitro adalah kontaminasi.
Kontaminasi dapat terjadi pada media dan atau pada eksplan. Tingkat kontaminasi
dipengaruhi oleh sterilisasi yang dilakukan. Kontaminasi dapat disebebkan oleh
cendawan dan atau bakteri.
Penanaman eksplan dari alam berupa biji yaitu bagian inti biji pada 2
minggu setelah tanam (MST) sudah mengalami kontaminasi. Tingkat kontaminsi
terus meningkat setiap minggunya dengan jumlah paling tinggi 5,95% yaitu pada
6 MST (Lampiran 1 dan Tabel 1).
Dari Tabel 1 terlihat bahwa kontaminasi tertinggi disebabkan oleh
cendawan yaitu 20,24%. Kontaminasi oleh cendawan ini mulai terlihat pada 3
MST. Kontaminasi cendawan pada umumnya diawali dengan adanya bintik putih
di sekitar eksplan dan terus menyebar menutupi permukaan media (Gambar 2).
Kontaminasi yang disebabkan oleh bakteri lebih sedikit dibandingkan
oleh cendawan yaitu sebesar 2,38%. Kontaminasi yang disebakan oleh bakteri
sudah terlihat pada 2 MST yaitu pada media MS + BAP 0,5 mg/l dan media MS +
BAP 1,5 mg/l. Gejala yang ditimbulkan oleh bakteri ditandai dengan munculnya
lendir di sekitar eksplan, lendir ini terus bertambah dan warnanya berubah dari
bening menjadi kemerahan dan menyebabkab kematian pada eksplan (Gambar 2).
Kontaminasi pada eksplan disebabkan karena eksplan berasal dari alam,
sehingga diduga sudah terinfeksi sebelum disterilasasi. Eksplan yang berasal dari
alam mempunyai tingkat kontaminasi permukaan yang berbeda, tergantung dari:
jenis tanaman, bagian tanaman yang dipergunakan, morfologi permukaan
(misalnya: berbulu atau tidak), lingkungan tumbuhnya (green house atau
lapangan), musim waktu mengambil (musim hujan/kemarau), umur tanaman
(seedling atau tanaman dewasa) dan kondisi tanmannya (sakit atau dalam keadaan
sakit) (Gunawan, 1987). Hal ini akan menjadi pertimbangan dalam melakukan
kegiatan sterilisasi terutama yang menyangkut teknik dan bahan sterilisasi yang
digunakan. Faktor lain yang juga dapat menyebabkan kontaminasi adalah
Tabel 3. Jumlah kultur yang kontaminan pada tiap perlakuan pada 8 MST Taraf
Konsentrasi
Jumlah Awal
Kultur Terkontaminasi Jumlah
Akhir
Dari tabel di atas dapat dilihat jumlah akhir eksplan yang hidup atau bebas
dari kontaminasi sampai pada 8 MST yaitu sebesar 77,38%. Nilai ini menunjukan
bahwa bahan dan teknik steriliasi yang digunakan sudah efektif. Hal ini juga
disebabkan karena eksplan yang digunakan adalah bagian dalam biji (inti biji) jadi
resiko kontaminasi dari alam sangat kecil.
Beberapa hal yang bisa dilakukan untuk mengurangi kontaminasi adalah
pemilihan bahan tanaman yang sehat dan mencegah masuknya organisme atau
spora yang masuk ke dalam botol kultur. Cara yang dapat dilakukan adalah
menjaga ruang kultur tetap steril, penutupan botol kultur yang baik dan
pelaksanaan prosedur kerja yang tepat dan hati-hati. Kultur yang sudah terlihat
gejala timbulnya kontaminasi pada media tetapi belum menyerang eksplan masih
dapat diselamatkan dengan memindahkan eksplan ke media yang baru. Hal ini
sering dilakukan pada kultur yang terkontaminasi oleh cendawan.
Kontaminasi bakteri dapat dicegah dengan penambahan anti mikroba
seperti antibiotik (rifampicin, kanamycin, streptomycin dan cerbenicillin). Selang
konsentrasi yang digunakan membutuhkan pengujian tetapi mulai 200-400 mg/l.
Senyawa ini mengurangi tekanan tumbuh kultur tetapi efeknya hanya sesaat dan
(a) (b) (c)
Gambar 2. Kontaminasi kultur: (a) kontaminasi oleh cendawan, (b) kontaminasi oleh bakteri, (c) kontaminasi oleh cendawan yang telah menyebar menutupi media
Pengaruh BAP dan 2,4-D
Pemberian sitokinin BAP dan auksin 2,4-D pada beberapa taraf
konsentrasi telah memberikan respon yang berbeda terhadap pertumbuhan eksplan
biji buah makasar. Dengan kata lain, BAP dan 2,4-D telah mempengaruhi
pertumbuhan biji buah makasar. Secara visual pengaruh yang ditimbulkan oleh
BAP dan 2,4-D yaitu eksplan membentuk kalus, tunas dan plantlet. Respon sel,
jaringan dan organ yang dikulturkan secara in vitro dipengaruhi oleh kondisi
kultur, genotip tanaman dan tipe eksplan (Gunawan, 1992).
Pembentukan Kalus
Kalus adalah suatu kumpulan sel yang tidak beraturan yang terjadi dari
sel-sel yang membelah diri secara terus menerus. Dalam keadaan in vivo, kalus
pada umumnya terbentuk pada bekas-bekas luka akibat serangan infeksi
mikroorganisme. Sel-sel penyusun kalus adalah sel-sel parenkim yang
mempunyai ikatan yang renggang dengan sel-sel lain. Dalam kultur in vitro, kalus
dapat dihasilkan dari potongan organ yang telah steril dalam media yang
mengandung kambium, maka kalus dapat terbentuk tanpa perlakukan zat pengatur
tumbuh. Kalus dapat diinisiasi dari hampir semua bagian tanaman, tetapi organ
yang berbeda menunjukan perbedaan kecepatan pembelahan sel yang membentuk
eksplan tersebut. Bagian tanaman seperti : embrio muda, hipokotil, kotiledon dan
batang muda, merupakan bagian yang muda untuk dideferensiasi dan
menghasilkan kalus (Gunawan, 1987).
Dalam proses pembentukan kalus terdapat 4 lapisan sel yang berbeda.
Lapisan-lapisan sel yang berbeda terlihat jelas tiga hari setelah kultur terdiri dari :
1. Lapisan luar dengan sel-sel yang pecah
2. Lapisan kedua terdiri dari dua lapisan sel dorman
3. Lapisan dengan sel yang aktif membelah
4. Lapisan tengah (core) yang selnya tidak membelah (Gunawan, 1987).
Dari hasil pengamatan, kalus tumbuh pada semua media perlakuan ZPT
kecuali media kontrol (MSo). Eksplan pada media MS yang mengandung ZPT
2,4-D, terinduksi seluruhnya menjadi kalus (Gambar 3). Tetapi tidak demikian
halnya dengan media MS yang mengandung ZPT BAP. Pada media dengan
penambahan BAP, kalus terbentuk di bagian pangkal batang. Dalam hal ini
eksplan telah mengalami pertumbuhan membentuk batang, daun dan calon akar
(radicula) (Gambar 4).
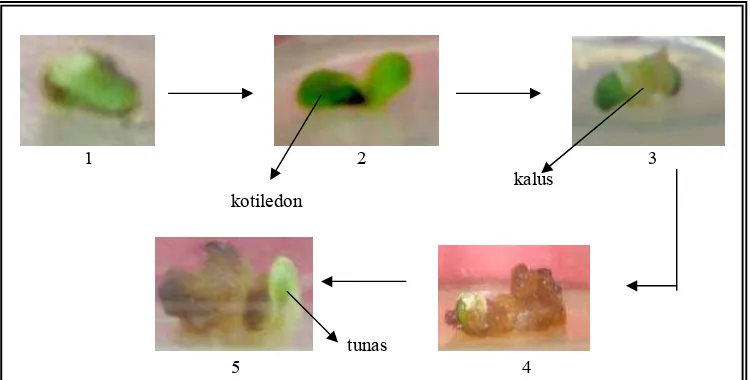
1 2 3
kalus
kotiledon
tunas
5 4
Dari gambar 3 tersebut dapat dilihat bahwa pembentukan kalus pada
media yang mengandung 2,4-D diawalai dengan pecahnya kotiledon. Dari dalam
pecahan kotiledon tersebut atau dari sumbu embrio, kalus mulai terbentuk dan
pada akhirnya seluruh bagian eksplan terinduksi menjadi kalus. Kotiledon adalah
daun yang merupkan bagian dari embrio biji, yang melekat pada sumbu embrio
dengan hipokotil. Kotiledon merupakan daun pertama suatu tumbuhan
(Tjitrosoepomo, 1988).
Gambar 4. Tahap pertumbuhan kalus pada media MS dengan penambahan ZPT BAP
Pada gambar di atas terlihat bahwa pembentukan kalus pada media yang
mengandung BAP diawali dengan pecahnya kotiledon. Kemudian pertumbuhan
dilanjutkan dengan munculnya calon akar (radicula) dan batang (cauliculus).
Calon akar mengalami pembesaran dan akhirnya terinduksi menjadi kalus.
Pembentukan kalus pada media 2,4-D (0.5-2 mg/l) mulai terlihat pada 3
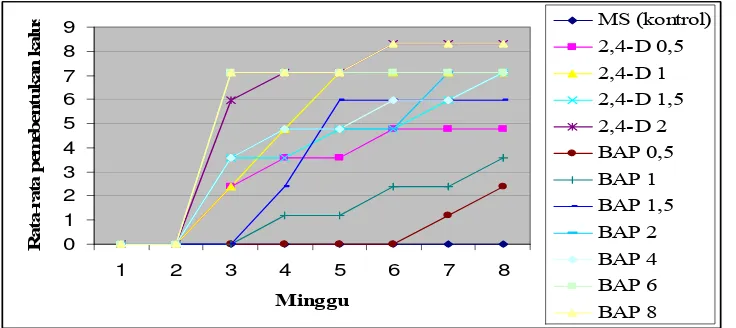
MST. Persentase pembentukan kalus cenderung meningkat dengan semakin
tingginya tingkat konsentarsi 2,4-D. Demikian halnya dengan penambahan BAP,
kalus mulai terbentuk pada 3 MST. Persentase pembentukan kalus setiap
minggunya juga cenderung meningkat dengan semakin tingginya tingkat
konsentrasi BAP (Lampiran 2 dan Tabel 1). Persentase pembentukan kalus yang
cenderung meningkat dengan semakin tingginya konsentrasi 2,4-D atau BAP, hal
ini kemungkinan disebabkan karena konsentrasi 2,4-D atau BAP yang tinggi telah
mempengaruhi kerja sel-sel atau jaringan penyusun eksplan, sehingga sel akan
terus menerus membelah dan menghambat pertumbuhan organ.
1 2 3
kotiledon
Tabel 4. Uji lanjut faktor perlakuan konsentrasi 2,4-D dan BAP terhadap persentase pembentukan kalus
Perlakuan Subset
Keterangan: Kelompok perlakuan yang terdapat pada kolom (subset) yang sama menunjukan bahwa tidak terdapat perbedaan yang nyata dalam persentase pembentukan kalus
Berdasarkan hasil yang diperoleh dari tabel uji lanjut Duncan terhadap
persentase pembentukan kalus menunjukan bahwa perlakuan BAP 0,5 mg/l
berbeda sangat nyata dengan BAP 8 mg/l demikian juga dengan perlakuan 2,4-D
0,5 berbeda sangat nyata dengan 2,4-D 2 mg/l. dan nilai persentase pembentukan
kalus tertinggi adalah 2,4-D 2 m/l dilanjutkan dengan BAP 8 mg/l. Hal ini jelas
terlihat bahwa semakin tinggi konsentrasi ZPT yang diberikan maka semakin
tinggi pula persentase pembentukan kalus yang dihasilkan setiap minggunya
sampai 8 minggu pengamatan.
0
Penambahan 2,4-D yang menginduksi semua bagian eksplan menjadi
kalus sedangkan pada BAP hanya pada bagian calon akar. Hal ini sesuai dengan
pendapat Gardner et al. (1985) yang menyatakan bahwa auksin adalah senyawa
yang merupakan hormon dan dapat menyebabkan pembesaran sel dalam jaringan
serta sering digunakan dalam kultur aseptik untuk menginduksi jaringan kalus.
Gati dan Mariska (1992) dalam Kurniawati (2004) menyatakan bahwa 2,4-D
merupakan ZPT yang paling sering digunakan pada kultur kalus karena
aktivitasnya yang kuat untuk memacu proses dediferensiasi sel, menekan
oragonogenesis serta menjaga pertumbuhan kalus. Dan jika dibandingkan dengan
auksin lainnya seperti IAA, 2,4-D menunjukan aktivitas yang lebih kuat
(Wattimena, 1992). Aktivitas 2-4-D yang kuat dan optimal ini disebabkan karena
gugus karboksil yang dipisahkan oleh karbon atau karbon dan oksigen
(Abidin,1985).
Mengingat buah makasar merupakan salah satu tanaman yang memilki
senyawa aktif yang berkhasiat obat dan banyaknya kalus yang terbentuk pada
eksplan, maka dapat dimanfaatkan untuk mendapatkan senyawa metabolit (aktif)
yang berfungsi sebagai obat. Jadi untuk mendapatkan senyawa metabolit yang
dikandung oleh tanaman buah makasar tidak perlu melalui pembentukan tanaman
utuh dan menunggu sampai dewasa.
Pemanfaatan teknik kultur jaringan tanaman dengan kultur kalus adalah
salah satu cara untuk menghasilkan senyawa metabolisme sekunder (George &
Sherrington, 1984). Beberapa keuntungan pemanfaatan teknik kultur jaringan
dalam produksi senyawa metabolit sekunder dibandingkan dengan cara
konvensional adalah (1) menghasilkan senyawa metabolit sekunder yang lebih
konsisten dan dalam waktu singkat (2) faktor lingkungan dapat diatur dan
dikendalikan sehingga tidak dipengaruhi iklim, hama dan penyakit, musim dan
faktor lainnya (3) biasanya mutu dari senyawa metabolit sekunder yang
diproduksi lebih baik dan sistem produksi dapat diatur (Ernawati, 1992 dalam
Harahap, 2005).
Pada media dengan penambahan BAP beberapa eksplan berhasil
membentuk plantlet tanpa akar karena calon akar terinduksi menjadi kalus. Dalam
dapat memacu pembentukan akar sedangkan kalus diambil untuk menghasilkan
senyawa metabolit yang dapat digunakan sebagai bahan obat. Hal ini sangat
menguntungkan secara ekonomis karena dari satu eksplan biji dapat dihasilkan
lebih dari satu tanaman dan senyawa metabolit tanpa menunggu atau merusak
tanaman inang. Tentu saja jika kalus akan digunakan sebagai sumber untuk
mendapatkan senyawa metabolit maka perlu dilakukan penelitian lebih lanjut dan
mempertimbangkan faktor ekonomi lainnya.
Pembentukan Tunas
Eksplan pada semua perlakuan berhasil membentuk tunas kecuali pada
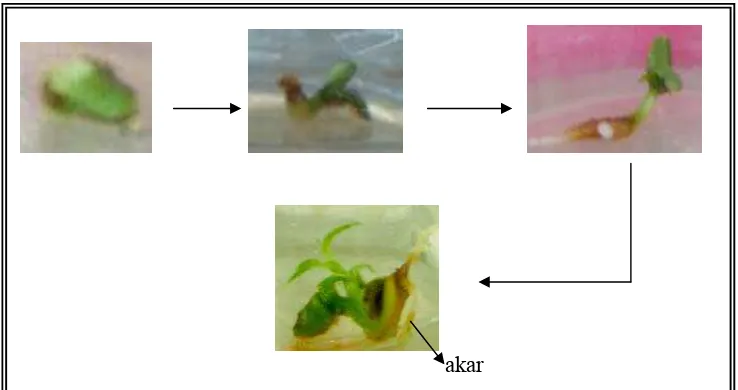
media MSo karena pada media MSo eksplan langsung terdeferensiasi membentuk
akar (radicula), daun, dan batang (Gambar 6). Tunas dalam hal ini adalah tunas
yang tumbuh dari kalus. Eksplan yang dikulturkan pada media yang mengandung
BAP menghasilkan tunas dalam jumlah banyak jika dibandingkan dengan eksplan
yang ditumbuhkan pada media yang mengandung 2,4-D yang hanya
menghasilkan 1-2 tunas sampai pada 8 MST. Tunas pada BAP muncul secara
bergerombol dan dalam jumlah banyak sehingga sulit untuk dilakukan
penghitungan jumlah tunas pada setiap eksplannya (Gambar 7).
akar
Tunas mulai tumbuh pada 4 MST baik itu pada BAP ataupun 2,4-D
(Lampiran 2 dan Tabel 2). Eksplan yang ditumbuhkan pada media yang
mengandung BAP menghasilkan banyak tunas dibandingkan eksplan yang
ditumbuhkan pada media yang mengandung 2,4-D. Hal ini sesuai dengan
pendapat Davies (1987) dalam Husni et al. (1994) yang menyatakan bahwa
aktivasi BAP lebih kuat dibandingkan 2,4-D karena BAP mengandung gugus
benzyl sehingga lebih dapat merangsang inisiasi dan pertumbuhan tunas baru
melalui peningktan pembelahan sel dibandingkan 2,4-D. Selain itu, penambahan
sitokinin BAP ke dalam media kultur dapat menstimulasi sintesis protein di dalam
jaringan tanaman, sehingga mampu mendorong organogenesis kultur tunas in
vitro (Salisbury & Ross, 1995). George dan Sherrington (1984) juga menyatakan
bahwa BAP merupakan sitokinin yang banyak berperan dalam pembentukan dan
pengggandaan tunas dan pengaruhnya lebih kuat dibandingkan sitokinin lainnya
seperti kinetin ataupun 2-iP.
0
Gambar 8. Grafik pembentukan tunas untuk media perlakuan pada berbagai konsentrasi dari 1-8 MST pengamatan
Persentase pembentukan tunas semakin meningkat dengan semakin
meningkatnya konsentrasi BAP. Bhojwani dan Razdan (1983) menyatakan bahwa
semakin tinggi konsentrasi sitokinin maka jumlah tunas yang tumbuh semakin
banyak tetapi pertumbuhan masing-masing tunas terhambat (Lampiran 2 dan
Tabel 2). Dalam hal ini BAP 8 mg/l memilki persentase pembentukan tunas yang
paling tinggi. Untuk media yang mengandung 2,4-D pada konsentrasi 0,5-1 mg/l,
persentase pembentukan tunas cenderung meninglkat tetapi dari konsentrasi 1,5-2
mg/l, persentase pembentukan tunas cenderung menurun. Dalam hal ini 2,4-D 1,5
mg/l merupakan konsentrasi optimum untuk pembentukan tunas bagi perlakuan
2,4-D.
Berdasarkan pengamatan visual pada media yang mengandung BAP,
jumlah tunas semakin banyak dengan meningkatnya konsentrasi BAP yaitu pada
konsentrasi BAP 0,5- 1,5 mg/l. Pada perlakuan 0,5 mg/l, jumlah tunas lebih
sedikit diandingkan 1 mg/l dan jumlah tunas semakin banyak pada perlakuan 1,5
mg/l. Sedangkan pada BAP 2-8 mg/l, jumlah tunas yang dihasilkan banyak dan
Tabel 5. Uji lanjut faktor perlakuan konsentrasi 2,4-D dan BAP terhadap persentase pembentukan tunas
Perlakuan Subset
Keterangan: Kelompok perlakuan yang terdapat pada kolom (subset) yang sama menunjukan bahwa tidak terdapat perbedaan yang nyata dalam persentase pembentukan tunas
Berdasarkan hasil yang diperoleh dari tabel uji lanjut Duncan terhadap
persentase pembentukan tunas menunjukan bahwa perlakuan BAP 0,5 mg/l
berbeda sangat nyata dengan BAP 8 mg/l dan nilai persentase pembentukan tunas
tertinggi adalah BAP 8 mg/l. Hal ini jelas terlihat bahwa semakin tinggi
konsentrasi sitokinin yaitu BAP yang diberikan maka semakin tinggi pula
persentase pembentukan tunas yang dihasilkan setiap minggunya sampai 8
minggu pengamatan.
Pembentukan Plantlet (Jumlah Daun dan Jumlah Akar)
Plantlet adalah tanaman lengkap (artinya memilki akar, batang dan daun)
hasil regenerasi dalam kultur jaringan atau disebut juga tanaman mini
(Soerianegara, 1994). Dari semua media perlakuan hanya media MSo sajalah
yang berhasil membentuk plantlet sampai pada 8 MST. Pada perlakuan BAP 0,5-2
mg/l, eksplan berhasil membentuk batang dengan beberapa jumlah daun tetapi
tidak terbentuk akar.
Media MSo berhasil membentuk plantlet adalah karena dalam biji dimana
yang dijadikan eksplan pada penelitian ini adaah inti biji yang terdiri dari lembaga
(embryo) dan putih lembaga (albumen). Lembaga adalah calon tumbuhan baru,
syarat yang diperlukan. Lembaga di dalam biji telah memperlihatkan bagian
utama tumbuhan yaitu akar lembaga atau calon akar (radicula), daun lembaga
(cotyledon), dan batang lembaga (cauliculus) (Tjitrosoepomo, 1988).
Biji yang ditanam pada media MSo telah mendapatkan apa yang
diperlukannya untuk tumbuh sehingga eksplan tersebut dapat tumbuh menjadi
plantlet. Sedangkan pada media yang mengandung BAP eksplan tidak berhasil
membentuk plantlet adalah karena penambahan hormon sitokinin tersebut telah
menghambat kerja sel untuk membentuk organ. Salisbury dan Ross (1995)
melaporkan bahwa sitokinin hanya berperan dalam sitokinesis tetapi tidak dapat
meningktakan pertumbuhan organ. Perlakuan BAP dapat meningkatkan jumlah
tunas dan daun serta mempunyai kecenderungan menurunkan jumlah akar dan
tinggi tunas (Tjandra, 2000 dalam Kurniawati, 2004). Menurut Pierik (1987)
peningkatan konsentrasi BAP cenderung menekan pertumbuhan akar karena BAP
termasuk jenis sitokinin yang dapat menghambat inisiasi akar dan pertumbuhan
akar, terutama bila diberikan dalam konsentrasi yang tinggi.
Pada media MSo daun mulai terbentuk pada 3 MST sedangkan pada
media dengan penambahan BAP daun sudah mulai terbentuk pada 2 MST yaitu
pada media BAP 0,5-1,5 mg/l (Lampiran 2 dan Tabel 3). Dalam hal ini BAP telah
memacu pertumbuhan daun. Tjandra (2000) dalam Kurniawati (2004)
menyatakan bahwa BAP dapat meningkatkan jumlah tunas dan daun serta
mempunyai kecenderungan menurunkan jumlah akar dan tinggi tunas.
0
Dari grafik di atas terlihat bahwa jumlah daun terbanyak dihasilkan pada
media yang mengandung BAP 1,5 mg/l dan paling sedikt pada media BAP 8 mg/l.
Keadaan ini menunjukan semakin tinggi konsentrasi BAP maka semakin sedikt
pula jumlah daun yang dihasilkan. BAP dengan konsentrasi yang tinggi akan
mendorong sel untuk membentuk tunas dalam jumlah banyak.
Tabel 6. Uji lanjut faktor perlakuan terhadap pertambahan jumlah daun Perlakuan Subset
Keterangan: Kelompok perlakuan yang terdapat pada kolom (subset) yang sama menunjukan bahwa tidak terdapat perbedaan yang nyata dalam jumlah daun
Berdasarkan hasil yang diperoleh dari tabel uji lanjut Duncan terhadap
pertambahan jumlah daun menunjukan bahwa perlakuan BAP 8 mg/l berbeda
sangat nyata dengan BAP 1.5 mg/l dan jumlah daun terbanyak adalah BAP 1,5
mg/l. Hal ini jelas terlihat bahwa semakin tinggi konsentrasi sitokinin yaitu BAP
yang diberikan maka semakin sedikit pula jumlah daun yang dihasilkan setiap
minggunya sampai 8 minggu pengamatan. Pada BAP 0,5-1,5 mg/l, jumlah daun
mengalami peningkatkan tetapi pada konsentrasi BAP 2-8 mg/l jumlah daun
semakin menurun dan paling sedikit pada konsentrasi BAP tertinggi yaitu 8 mg/l.
Menurut Husni et al. (1994) makin tinggi konsentrasi sitokinin maka semakin
sedikit jumlah daun yang terbentuk. Dalam hal ini BAP 1,5 mg/l merupakan
konsentrasi yang optimum untuk menghasilkan jumlah daun yang banyak. Daun
Gambar 10. Eksplan yang telah mengalami pertumbuhan pada media BAP 1,5 mg/l
BAP 1,5 mg/l berhasil membentuk beberapa calon plantlet dari tunas yang
dihasilkan. Eksplan yang pada awalnya hanya 1 biji sudah dihasilkan lebih dari
satu calon tanaman baru. BAP 1,5 mg/l merupakan konsentrasi yang optimum
untuk pertumbuhan biji buah makasar secara in vitro untuk tujuan perbanyakan.
Hal ini didukung oleh banyaknya jumlah daun yang dihasilkan dari tunas yang
terbentuk dan terbentuknya beberapa calon plantlet dari eksplan yang berupa 1 biji
KESIMPULAN DAN SARAN
Kesimpulan
1. Pemberian sitokinin BAP dan auksin 2,4-D dengan berbagai taraf
konsentrasi telah memberikan respon yang berbeda terhadap pertumbuhan
eksplan biji buah makasar.
2. Kalus terbentuk pada semua media perlakuan kecuali media MSo. Eksplan
pada media yang mengandung 2,4-D terinduksi seluruhnya menjadi kalus
sedangkan pada media yang mengandung BAP, kalus terbentuk pada calon
akar (radicula). Semakin tinggi konsentrasi BAP ataupun 2,4-D maka
semakin tinggi pula persentase pembentukan kalus.
3. Tunas terbentuk pada semua media perlakuan kecuali media MSo yaitu
tunas yang tumbuh dari kalus. Media dengan perlakuan BAP
menghasilkan banyak tunas sedangkan pada 2,4-D hanya menghasilkan
1-2 tunas. Semakin tinggi konsentrasi BAP maka semakin tinggi pula
persentase pembentukan tunas.
4. Dari semua media perlakuan hanya media MSo yang berhasil membentuk
plantlet (memiliki daun, batang dan akar).
5. Daun terbentuk pada media yang mengandung BAP dan MSo.
Jumlah daun terbanyak diperoleh pada media BAP 0,5-1,5 mg/l dan
tertinggi pada BAP 1,5 mg/l. Pada konsentrasi BAP 2- 8 mg/l, jumlah
daun semakin menurun dan paling sedikit pada konsentrasi BAP 8 mg/l.
BAP 1,5 mg/l merupakan konsentrasi optimum untuk menghasilkan daun
dalam jumlah banyak. Semakin tinggi konsentrasi BAP maka semakin
sedikit pula jumlah daun yang dihasilkan.
6. BAP 1,5 mg/l merupakan konsentrasi yang optimum dalam pertumbuhan
Saran Perlu dilakukan penelitian lanjutan dengan:
1. Menggunakan kombinasi penambahan zat pengatur tumbuh lainnya
2. Menggunakan konsentrasi BAP dan 2,4-D pada interval yang lebih sempit
DAFTAR PUSTAKA
Abidin, Z. 1985. Dasar-dasar Pengetahuan tentang Zat Pengatur Tumbuh. Angkasa. Bandung.
Ariana, E. 2005. Pengaruh Konsentrasi BAP (Benzylaminopurin) terhadap Pertumbuhan Mimba (Azadirachta indica A. Juss) secara Kultur In Vitro. Skripsi. Departemen Konservasi Sumberdaya Hutan. Fakultas Kehutanan. Institut Pertanian Bogor. Bogor.
Bhojwani, S.S. dan M.K. Rajdan. 1983. Plant Tissue Culture, Theory and Practise. Elsevier Scientific Pub Amsterdam.
Dalimartha, S. 2000. Atlas Tumbuhan Obat Indonesia. Jilid Dua. Trubus Agriwidya. Jakarta.
Gardner, F.P., R. Brent, P., Roger, L.M. 1991. Fisiologi Tanaman Budidaya (Terjemahan). UI-Press. Jakarta.
George, E.F. dan Sherrington, P.D. 1984. Plant Propagation By Tissue Culture. Eastern Press. London.
Gunawan, L.W. 1987. Pengenalan Teknik In vitro. Laboratorium Kultur Jaringan Tanaman, Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan dan Kebudayaan. Bogor.
1992. Teknik Kultur Jaringan Tanaman. Laboratorium Kultur Jaringan
Tanaman, Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan dan Kebudayaan. Bogor.
Harahap, R.A. 2005. Studi Kultur Kalus Tanaman Pegagan (Centella asiatica L.) untuk Menghasilkan Senyawa Asiatikosida. Sekolah Pascasaejana. IPB. Bogor.
Heyne, K. 1987. Tumbuhan Berguna Indonesia. Volume III. Yayasan Sarana Wana Jaya. Jakarta.
Indarjo, I. 2003. Pengaruh Pemberian Zat Pengatur Tumbuh NAA dan 2,4-D terhadap Pembentukan Kalus pada Kultur In vitro Polen Anggrek Dendrobium Jakarta Molek. Skripsi. Departemen Konservasi Sumberdaya Hutan. Fakultas Kehutanan. Institut Pertanian Bogor. Bogor.
Kurniawati, M. 2004. Pengaruh 2,4-D, BAP, dan Kinetin untuk Induksi Kalus Tunas Mentha arvensis Var. Tempaku. Skripsi. Departemen Biologi. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor. Bogor.
Mardiyah, T. Lebang dan Febrianti. 2002. Daun-daun Kehidupan yang Hilang. http://www.tempo.co.id/majalah/min/kes-1.html. [24 Mei 2006].
Rahardja, P.C dan W. Wiryanta. 2003. Aneka Cara Memperbanyak Tanaman. PT Agromedia Pustaka. Jakarta.
Salisburry, F.B. dan C.W. Ross. 1995. Fisiologi Tumbuhan Jilid 1-3 (Terjemahan). Institut Teknologi Bandung. Bandung.
Soerianegara, I. 1994. Teknologi Kultur Jaringan. Badan Penelitian dan Pengembangan Departemen Kehutanan. Jakarta.
Tjitrosoepomo, G. 1988. Morfologi Tumbuhan. Gadjah Mada University Press. Yogyakarta.
Wattimena, G.A., L.W. Gunawan, N.A. Mattjik, E. Syamsudin, N.M.A. Wiendi dan A. Ernawati. 1992. Bioteknologi Tanaman. Laboratorium Kultur Jaringan, Pusat Antar Universitas Bioteknologi-IPB. Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan dan Kebudayaan. Bogor.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas Bioteknologi-IPB bekerja sama dengan Lembaga Sumberdaya Informasi-IPB. Bogor.
Wetherell, D.F. 1982. Pengantar Propagasi Tanaman Secara In Vitro. IKIP Semarang Press. Semarang.
Yahya, A.F. 2001. Pertumbuhan, Biomassa dan Kandungan Alakaloid Akar Pule Pandak (Rauwolfia serpentina Benth) Hasil Kultur In Vitro . Skripsi. Jurusan Konservasi Sumberdaya Hutan, Fakultas Kehutanan, Institut Pertanian Bogor. Bogor.
Lampiran 1. Kontaminasi kultur
Tabel 1. Jumlah kultur yang kontaminan pada tiap perlakuan pada minggu ke-1 hingga ke-8 pengamatan
Perlakuan/MST Minggu ke-
1 2 3 4 5 6 7 8 Σ
MS (Kontrol) 2 2
2,4-D 0,5 1 1 2
2,4-D 1 1 1
2,4-D 1,5 1 1
2,4-D 2 1 1
BAP 0,5 1* 1 2
BAP 1 1 1 2
BAP 1,5 1* 1 2
BAP 2 1 1
BAP 4 1 1 2
BAP 6 1 1
BAP 8 2 2
Σ 0 2 1 2 3 5 4 2 19
Lampiran 2. Persentase pembentukan kalus, tunas dan jumlah daun kultur buah makasar(Brucea javanica [L.] Merr.)
Tabel 1. Pembentukan kalus kultur buah makasar (Brucea javanica [L.] Merr.) pada pengamatan minggu ke-1 hingga ke-8 pengamatan
Perlakuan Minggu ke-
1 2 3 4 5 6 7 8
Tabel 2. Pembentukan tunas kultur buah makasar (Brucea javanica [L.] Merr.) pada pengamatan minggu ke-1 hingga ke-8 pengamatan
Perlakuan Minggu ke-
Tabel 3. Pertumbuhan jumlah daun kultur buah makasar (Brucea javanica [L.] Merr.) pada pengamatan minggu ke-1 hingga ke-8 pengamatan
Perlakuan Minggu ke-
1 2 3 4 5 6 7 8
MS (Kontrol) 0 0 0.857 1.714 1.714 2.400 3.200 3.200
2,4-D 0,5 mg/l 0 0 0 0 0 0 0 0
2,4-D 1 mg/l 0 0 0 0 0 0 0 0
2,4-D 1,5 mg/l 0 0 0 0 0 0 0 0
2,4-D 2 mg/l 0 0 0 0 0 0 0 0
BAP 0,5 mg/l 0 0.833 0.833 2.000 2.333 2.333 2.800 3.200
BAP 1 mg/l 0 0.571 1.143 2.833 3.000 3.000 4.000 4.800
BAP 1,5 mg/l 0 0.666 2.000 4.000 4.800 5.000 6.000 6.400
BAP 2 mg/l 0 0 0.429 0.571 0.857 1.667 1.667 2.500
BAP 4 mg/l 0 0 0 0.666 0.666 1.200 2.200 2.800
BAP 6 mg/l 0 0 0.286 0.286 0.333 0.833 1.667 1.667
Lampiran 3. Hasil sidik ragam persentase pembentukan kalus, tunas dan jumlah daun kultur buah makasar (Brucea javanica [L.] Merr.)
Tabel 1. Hasil sidik ragam pembentukan kalus kultur buah makasar (Brucea javanica [L.] Merr.) sampai minggu ke-8 pengamatan
Sumber keragaman JK db KT Nilai F P-value
perlakuan 305.148 10 30.515 15.944 0.000*
Galat 105.263 55 1.914
Total 2044.848 66
* = Berbeda nyata pada α = 0.05
Tabel 2. Hasil sidik ragam pembentukan tunas kultur buah makasar (Brucea javanica [L.] Merr.) sampai minggu ke-8 pengamatan
Sumber keragaman JK db KT Nilai F P-value
perlakuan 252.79 10 25.28 10.12 0.000*
Galat 109.89 44 2.50
Total 1124.38 55
* = Berbeda nyata pada α = 0.05
Tabel 8. Hasil sidik ragam pertumbuhan jumlah kultur buah makasar (Brucea javanica [L.] Merr.) sampai minggu ke-8 pengamatan
Sumber keragaman JK db KT Nilai F P-value
perlakuan 71.081 7 10.154 7.114 0.000*
Galat 68.511 48 1.427
Total 317.071 56
Lampiran 4. Komposisi media MS (Murashige dan Skoog)
Larutan Nama Bahan
Kimia Konsentrasi (gr/ l)
Lampiran 5. Prosedur pembuatan media MS
S
Gelas ukur 1L, Ditambahkan aquades hingga
volume yang diinginkan
Masukkan ZPT (BAP) Sesuai dengan perlakuan
Cukupkan larutan menjadi 1L dengan penambahan aquades dan atur pH hingga 5,6-5,8
Didihkan pada Hot-plate
tambahkan agar-agar 7gr dan didihkan kembali
Tuang dan bagikan ke dalam botol kultur
Tutup dengan plastikdan disterilkan menggunakan Autoklaf selama 20 menit dengan tekanan 17.5 Psi 121°C
Inkubasi selama 1 minggu sebelum melakukan inisiasi
Larutan A, Larutan B, Larutan C, Larutan D
Larutan E, Larutan F Vitamin, Myo- inositol sesuai
konsentrasi penggunaan
Lampiran 6. Gambar eksplan pada media yang mengandung 2,4-D, BAP dan MS (Kontrol) pada minggu ke-8 pengamatan
2,4-D 0,5 mg/l
2,4-D 1 mg/l
2,4-D 1,5 mg/l
2,4-D 2 mg/l
Gambar 1. Eksplan pada media yang mengandung 2,4-D pada minggu ke-8
MS (Kontrol)
BAP 0,5 mg/l
BAP 1 mg/l
BAP 1,5 mg/l
BAP 2 mg/l
BAP 4 mg/l
BAP 6 mg/l
BAP 8 mg/l
PENGARUH AUKSIN (2,4-D) DAN SITOKININ (BAP)
DALAM KULTUR IN VITRO
BUAH MAKASAR (Brucea javanica [L.] Merr.)
LISBETH YUNI SANTI MANURUNG
DEPARTEMEN KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA FAKULTAS KEHUTANAN
![Gambar 1. Buah makasar (Brucea javanica [L.] Merr.)](https://thumb-ap.123doks.com/thumbv2/123dok/568628.340926/16.612.148.491.94.284/gambar-buah-makasar-brucea-javanica-l-merr.webp)