4.1. Tujuan Percobaan
- Membuat larutan standar kalium permanganat 0,1 N.
- Standardisasi larutan kalium permanganat dengan larutan natrium oksalat.
- Menentukan konsentrasi Fe2+ dan kadar Fe dalam FeSO
4.7H2O
- Menentukan kemurnian/kadar nitrit dalam garam nitrit (NaNO2).
4.2. Tinjauan pustaka
Permanganometri adalah titrasi yang didasarkan pada reaksi redoks. Dalam reaksi ini, ion MnO4- bertindak sebagai oksidator. Ion MnO4- akan berubah menjadi ion
Mn2+ dalam suasana asam. Teknik titrasi ini biasa digunakan untuk menentukan kadar
oksalat atau besi dalam suatu sampel.[8]
Istilah titrasi merujuk ke proses pengukuran volume titran yang diperlukan untuk mencapai titik ekivalen. Sejumlah zat yang diselidiki direaksikan dengan larutan baku (standard) yang kadar atau konsentrasinya telah diketahui secara teliti dan reaksinya berlangsung secara kuantitatif. Suatu larutan standar (baku) dapat dibuat dengan cara melarutkan sejumlah senawa tertentu yang sebelumnya senyawa tersebut ditimbang secara tepat dalam volume larutan yang diukur dengan tepat. Larutan standar ada dua macam, yaitu:
- Larutan baku primer
Larutan baku primer mempunyai kemurnian yang tinggi
- Larutan baku sekunder
[image:1.595.215.463.505.651.2]Larutan baku sekunder harus dibakukan dengan larutan baku primer. Suatu proses dimana larutan baku sekunder dibakukan dengan larutan baku primer disebut dengan standardisasi.
Gambar 4.2.1. Alat titrasi
Keterangan: 1. Klem 2. Buret 3. Statif 4. Erlenmeyer
Pada permanganometri, titran yang digunakan adalah kalium permanganat. Kalium permanganat mudah diperoleh dan tidak memerlukan indikator kecuali digunakan larutan yang sangat encer. Kalium permanganat bukan merupakan bahan
33 1
2
4
34
kimia standar primer. Permanganat selalu tercampur dengan oksidanya. Air sebagai pelarut sering mengandung bahan pereduksi. Keberadaan bahan kimia tersebut semakin meningkatkan terbentuknya oksida mangan.
Kalium permanganat menghasilkan warna ungu bila dilarutkan dalam air, yang merupakan ciri khas untuk ion permanganat. Kalium permanganat merupakan zat pengoksid kuat, yang bekerja berlainan menurut pH dari medium.[5] Kelemahannya
adalah dalam medium HCl, Cl- dapat teroksidasi, demikian juga larutannya mempunyai
kestabilan yang terbatas. Titik akhir permanganat tidak permanen dan warnanya dapat hilang. Tetapi beberapa zat memerlukan pemanasan atau penggunaan katalis untuk mempercepat reaksinya. Kelebihan yang sedikit dari permanganat yang ada pada titik akhir suatu titrasi dapat menyebabkan pengendapan beberapa MnO2. Akan tetapi
reaksinya lambat, maka MnO2 biasanya tidak diendapkan pada akhir titrasi
permanganat.[8] Manfaat titrasi permanganometri yaitu, reaksi ini berjalan lambat
sehingga tidak mengendapkan MnO2 pada titik akhir titrasi.[5] Kalium permanganat tidak
memerlukan indikator, setetes permanganat memberikan suatu warna merah muda yang jelas kepada volume larutan dalam suatu titrasi.[8]
Suatu zat berwarna dapat bertindak sebagai indikatornya sendiri. Misalnya, larutan kalium permanganat begitu tua warnanya sehingga sedikit sekali berlebih reagensia ini dalam suatu titrasi, dapat dengan mudah dideteksi.[1] Titrasi tanpa indikator
mungkin dilakukan jika semua zat pereduksi teroksidasi oleh permanganat dalam
larutan asam. Warna ungu lembayung (purple violet) dari ion MnO4- akan hilang karena
tereduksi menjadi ion Mn2+ yang tidak berwarna. Ketika semua zat pereduksi telah
dititrasi, maka kelebihan satu tetes permanganat akan menjadikan larutan berwarna merah muda. Indikator redoks berubah warna ketika potensial larutan yang dititrasi mencapai harga tertentu.[29]
Setelah permanganat 0,1 N memberikan warna merah muda yang tampak, kepada larutan yang volumenya lazim digunakan dalam titrasi. Warna ini digunakan untuk menyatakan berlebihnya reagensia itu. Permanganat bereaksi secara beraneka,
karena mangan dapat memiliki keadaan oksidasi +2, +3, +4, +6, +7.[1]
MnO4- + 8H+ → Mn2+ + 4H2O R. Reduksi
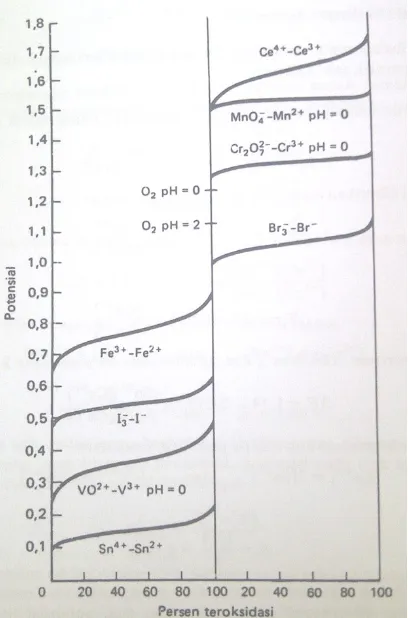
Gambar 4.2.2. Kurva perubahan potensial menurut persen teroksidasi 4.3. Tinjauan Bahan
A. Aquadest (H2O)
- Bentuk : cair
- Warna : bening
- Kelarutan/terlarut : tercampur dalam semua proporsi
- Titik lebur/titik didih : 27,5 oC-29,3 oC
- pH : <1
- Dekomposisi temperatur : mempercepat dekomposisi (SADT) dengan rilis
oksigen dari 55 oC (131 oF)
B. Asam sulfat (H2SO4)
- Rumus : H2SO4
- Bentuk : cair
- Warna : tidak berwarna
- Bau : tidak berbau
- pH : 0,3
- Titik lebur : -20 oC
- Titik didih : 335 oC
- Kelarutan dalam air : 20 oC
C. Besi sulfat (FeSO4.7H2O)
- Rumus : FeSO4.7H2O
- Bentuk : padatan
- Berat molekul : 151,9 g/mol + H2O
36
- pH : tidak ada
- Titik didih : tidak ada
- Titik lebur : tidak ada
D. Kalium permanganat (KMnO4)
- Rumus : KMnO4
- Bentuk : padat
- Berat molekul : 158,03 g/mol
- Warna : Ungu
- pH : tidak ada
- Titik didih : tidak ada
- Titik lebur : terurai
E. Natrium nitrit (NaNO2)
- Rumus : NaNO2
- Bentuk : padat
- Bau : Tak berbau
- Warna : putih
- pH : 9
- Titik lebur : 280 oC
- Titik didih : 320 oC
- Densitas : 2,1 g/cm3
- Kelarutan dalam air : 820 g/L
F. Natrium oksalat (Na2C2O4)
- Rumus : Na2C2O4
- Bentuk : padatan (kristal)
- Berat molekul : 134 g/mol
- Warna : putih
- pH : tidak ada
- Titik didih : tidak ada
- Titik lebur : 260 oC (500 oF)
4.4. Alat dan Bahan
A. Alat
- Batang pengaduk
- Beakerglass
- Buret
- Botol aquadest
- Erlenmeyer
B. Bahan
- Aquadest (H2O)
- Asam sulfat (H2SO4)
- Besi sulfat (FeSO4.7H2O)
- Kalium permanganat (KMnO4)
- Natrium nitrit (NaNO2)
- Corong
- Gelas arloji
- Kertas saring
- Labu ukur
- Neraca analitik
- Pipet ball
- Pipet tetes
- Pipet volume
- Statif dan klem
- Thermometer
- Waterbath
4.5. Prosedur Percobaan
A. Preparasi larutan
- Membuat larutan kalium permanganat 0,1 N, sebanyak 500 mL (larutkan menggunakan aquadest yang sudah dididihkan)
- Membuat larutan asam sulfat 2 N, sebanyak 50 mL
- Membuat larutan besi sulfat 0,1 N, sebanyak 100 mL
- Membuat larutan natrium oksalat 0,1 N, sebanyak 100 mL
- Membuat larutan natrium nitrit 0,1 N, sebanyak 100 mL
B. Standardisasi larutan kalium permanganat dengan larutan natrium oksalat
- Memipet 10 mL larutan natrium oksalat ke dalam erlenmeyer, tambahkan 5 mL
asam sulfat 2 N, kemudian panaskan sampai 70 oC
- Mentitrasi dengan larutan kalium permanganat sampai dicapai titik akhir
- Mengulangi prosedur tersebut sebanyak tiga kali
C. Menentukan konsentrasi Fe2+ dan kadar Fe dalam FeSO
4.7H2O
- Memipet 10 mL larutan besi sulfat ke dalam erlenmeyer, tambahkan 5 mL
larutan asam sulfat 2 N, kemudian panaskan sampai 70 oC
- Mentitrasi dengan larutan kalium permanganat sampai dicapai titik akhir
- Mengulangi prosedur sebanyak tiga kali
D. Menentukan kadar kemurnian garam nitrit
- Memipet 10 mL larutan natrium nitrit 0,1 N ke dalam erlenmeyer, tambahkan 5
mL larutan asam sulfat 2 N, kemudian panaskan sampai suhu 70 oC
- Mentitrasi dengan larutan kalium permanganat sampai dicapai titik akhir
- Mengulangi prosedur tersebut sebanyak tiga kali
4.6. Data Pengamatan
Tabel 4.6.1. Data pengamatan standardisasi larutan kalium permanganat dengan natrium oksalat 0,1 N
Keterangan I II III
Volume larutan yang dititrasi (mL) 15 mL 15 mL 15 mL
Volume larutan peniter (mL) 13 mL 12,1 mL 13,5 mL
Tabel 4.6.2. Data pengamatan penentuan konsentrasi Fe2+ dan kadar Fe dalam
FeSO4.7H2O
Keterangan I II III
Volume larutan yang dititrasi (mL) 15 mL 15 mL 15 mL
Volume larutan peniter (mL) 6 mL 6 mL 6 mL
38
Keterangan I II III
Volume larutan yang dititrasi (mL) 15 mL 15 mL 15 mL
Volume larutan peniter (mL) 4,5 mL 4,3 mL 3,5 mL
4.7. Persamaan Reaksi
- Persamaan reaksi antara natrium oksalat dan asam sulfat
Na2C2O4 + H2SO4 → Na2SO4 + H2C2O4
(natrium oksalat) (asam sulfat) (natrium sulfat) (asam oksalat) (putih) (putih)
- Persamaan reaksi antara natrium nitrit dan asam sulfat
2NaNO2 + H2SO4 → Na2SO4 + 2HNO2
(natrium nitrit) (asam sulfat) (natrium sulfat) (asam nitrit) (putih)
- Reaksi penguraian natrium oksalat
Na2C2O4 → 2Na+ + C2O42-
(natrium oksalat) (natrium) (oksalat) (putih)
- Reaksi penguraian kalium permanganat
KMnO4 → K+ + MnO4
-(kalium permanganat) -(kalium) (permanganat) (ungu)
- Reaksi penguraian ferro sulfat
FeSO4 → Fe2+ + SO4
2-(besi sulfat) (ferro) (sulfat) (kekuningan)
- Reaksi penguraian asam nitrit
HNO2 → H+ + NO2
-(asam nitrit) (hidrogen) (nitrit)
- Reaksi reduksi oksidasi (redoks) antara oksalat dan permangan
R. Reduksi : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O × 2
R. Oksidasi : C2O42- ,→ 2CO2 + 2e- × 5
2MnO4- + 16H+ + 10e- → 4Mn2+ + 8H2O
5C2O42-→ 10CO2 + 10e-
2MnO4- + 5C2O42- + 16H+ → 4Mn2+ + 10CO2 + 8H2O
(permanganat)(oksalat) (hidrogen) (mangan) (karbon dioksida) (air) (merah rosa)
- Reaksi reduksi oksidasi (redoks) antara ferro dan permangan
R. Reduksi : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O × 1
R. Oksidasi : Fe2+ → Fe3+ + e- × 5
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
5Fe2+ → 5Fe3+ + 5e-
MnO4- + 8H+ + 5Fe2+ → Mn2+ + 5Fe3+ + 4H2O
(permanganat) (hidrogen) (ferro) (mangan) (ferri) (air) (merah rosa)
R. Reduksi : MnO4- + 8H+ + 5e- → Mn2+ + 4H2O × 2
R. Oksidasi : 2NO2- + 2H2O → 2NO3- + 4H+ + 2e- × 5
2MnO4- + 16H+ + 10e- → 2Mn2+ + 8H2O
10NO2- + 10H2O → 10NO3- + 20H+ + 10e-
2MnO4- + 10NO2- + 2H2O → 2Mn2+ + 10NO3- + 4H+
(permanganat) (nitrit) (air) (mangan) (nitrat) (hidrogen) (merah rosa)
4.8. Pembahasan
A. Preparasi larutan
- Pelarut yang digunakan pada percobaan yaitu aquadest. KMnO4 dilarutkan
dengan menggunakan aquadest yang sudah dididihkan, karena permanganat bereaksi dengan cepat dengan banyak zat pereduksi. Tetapi, beberapa zat memerlukan pemanasan atau katalis untuk mempercepat reaksi. Dalam mempersiapkan larutan permanganat, biasanya melarutkan kristal terlebih dahulu, kemudian pemanasan untuk memusnahkan zat pereduksi. Namun, tidak dibolehkan menaikkan temperatur untuk mempercepat oksidasi, karena larutan tersebut akan berlangsung pada laju yang cukup nyata.
- Larutan kalium permanganat harus disimpan dalam tempat gelap atau dalam
botol gelas berwarna gelap, karena cahaya mempercepat dekomposisi KMnO4.
- Besi sulfat dilarutkan dengan menggunakan aquadest lalu ditutup dengan plastik agar tidak terdekomposisi dengan udara. Larutan besi sulfat pada saat titrasi digunakan untuk menentukan kadar besi dalam besi sulfat.
- Natrium oksalat dilarutkan dengan menggunakan aquadest lalu ditutup dengan
plastik agar tidak terdekomposisi dengan udara. Larutan natrium oksalat digunakan untuk standardisasi larutan kalium permanganat.
- Natrium nitrit ditutup dengan plastik setelah dilarutkan, agar tidak terdekomposisi dengan udara. Natrium nitrit pada saat titrasi digunakan untuk menentukan kadar kemurnian garam nitrit.
- Larutan kalium permanganat akan terurai menjadi MnO2 akibat terkena sinar
sehingga pada titik akhir titrasi akan diperoleh pembentukan presipitat coklat, karena pada buret percobaan dilakukan dalam waktu yang lama.
- Kemungkinan kesalahan terjadi karena larutan kalium permanganat terkena cahaya pada saat meletakkan di dalam buret.
B. Standardisasi larutan kalium permanganat dengan larutan natrium oksalat
- Larutan natrium oksalat ditambahkan dengan larutan asam sulfat (digunakan
untuk mengasamkan larutan), lalu dipanaskan agar larutan tersebut cepat bereaksi.
- Titrasi dilakukan sampai larutan baku primer berwarna merah rosa.
- Hasil dari standardisasi kalium permanganat dengan larutan natrium oksalat
menghasilkan konsentrasi sebesar 0,0778 N.
C. Menentukan konsentrasi Fe2+ dan kadar Fe dalam FeSO
4.7H2O
- Larutan besi sulfat ditambahkan dengan larutan asam sulfat (digunakan untuk
mengasamkan larutan), lalu dipanaskan agar larutan tersebut cepat bereaksi.
- Titrasi dilakukan sampai larutan baku primer berubah warna dari kekuningan
40
- Hasil perhitungan konsentrasi Fe2+ dalam larutan sebesar 0,25 N, dan kadar Fe
dalam larutan FeSO4.7H2O sebesar 30,0719%.
D. Menentukan kadar kemurnian garam nitrit
- Larutan natrium nitrit ditambahkan dengan larutan asam sulfat (digunakan untuk mengasamkan larutan), lalu dipanaskan agar larutan tersebut cepat bereaksi.
- Titrasi dilakukan sampai larutan baku primer berwarna merah rosa.
- Hasil perhitungan kemurnian/kadar nitrit dalam garam nitrit (NaNO2) sebesar
99,52%.
4.9. Kesimpulan
- Standardisasi larutan kalium permanganat dengan larutan natrium oksalat menghasilkan konsentrasi sebesar 0,0778 N.
- Konsentrasi Fe2+ dalam larutan sebesar 0,25 N, dan kadar Fe dalam larutan
FeSO4.7H2O sebesar 30,0719%.