1. Pengertian
Perhatikan contoh senyawa karbon di bawah ini:
Apa yang dapat dilihat dari dua struktur senyawa di atas? Apa perbedaannya? Propana dapat menjadi propanol jika satu atom H-nya digantikan oleh gugus-OH.
Dari contoh senyawa di atas, apa itu alkohol?
2. Tata nama Alkanol (Alkohol) Rumus umum :
Perhatikan contoh-contoh senyawa alkanol pada tabel berikut:
Rumus Nama IUPAC NamaTrivial
CH3–OH Metanol Metil alkohol
CH3–CH2–OH Etanol Etil alkohol
CH3–CH2–CH2–OH Propanol n-propil alkohol
Karena rumus umum alkana adalah CnH2n+2, maka rumus umum alkanol (alkohol) adalah CnH2n+1OH.
Alkohol adalah senyawa turunan alkana yang mengandung gugus fungsi hidroksil (OH) pada rantai atom karbon.
Dari contoh-contoh nama senyawa alkanol di atas, bagaimanakah aturan penamaan untuk senyawa alkanol?
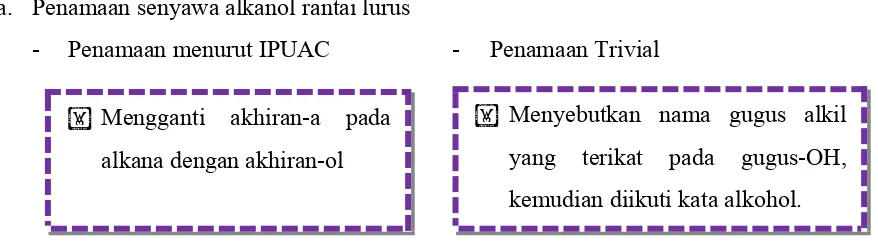
a. Penamaan senyawa alkanol rantai lurus
- Penamaan menurut IPUAC - Penamaan Trivial
langkah-langkah penamaan alkohol yang memiliki cabang 1. Tentukan gugus alkohol dan rantai utama/rantai induk. 2. Tentukan cabang dan nama cabang
3. Beri penomoran pada rantai induk sehingga atom C yang mengikat gugus-OH mendapat nomor serendah mungkin.
4. Beri nama, urutan penamaannya:
5. no cabang-nama cabang-nama rantai induk (alkanol)
Tabel nama-nama cabang (alkil) dan alkohol Jumlah
atom C RumusAlkil Nama Alkil RumusAlkohol NamaAlkohol
1 CH3 Metil CH3OH Metanol
2 C2H5 Etil C2H5 OH Etanol
3 C3H7 Propil C3H7 OH Propanol
4 C4H9 Butil C4H9 OH Butanol
5 C5H11 Pentil C5H11 OH Pentanol
6 C6H13 Heksil C6H13 OH Heksanol
7 C7H15 Heptil C7H15 OH Heptanol
8 C8H17 Oktil C8H17 OH Oktanol
9 C9H19 Nonil C9H19 OH Nonanol
10 C10H21 Dekil C10H21 OH Dekanol
Contoh soal:
1. Tulislah nama dari senyawa berikut berdasarkan IUPAC
a. CH3–CH–CH3 2-propanol
2. Tulislah nama dari senyawa berikut berdasarkan IUPAC
a. CH3–CH–CH3 isopropil alkohol OH
b. CH3–CH2–CH2–CH2–OH n-butil alkohol
c. CH3–CH–CH2–CH3 sek-butil alkohol
OH
d. CH3–CH–CH2–OH isobutil alkohol
CH3
CH3
e. CH3–C–OH ters-butil alkohol
CH2–CH2 CH2–CH –CH2
OH OH OH OH OH
1,2-etanadiol 1,2,3-propanatriol
Berdasarkan jenis atom karbon yang mengikat gugus –OH, alkohol dibedakan atas alcohol primer, sekunder dan alcohol tersier.
Contoh:
OH CH3 CH3–CH–CH2–OH CH3–CH2–CH–CH2–CH3 CH3–C–CH3 CH3 OH alkohol primer alkohol sekunder alkohol tersier
3. Keisomeran pada Alkohol Keisomeran kerangka
Contoh : keisomeran 1-pentanol dengan 2-metil-1-butanol
berisomer dengan
Keisomeran kerangka mempunyai rumus molekul dan gugus fungsi yang sama, tetapi berbeda rantai induknya.
pada atom C primer Gugus-OH terikat pada atom C sekunder Gugus-OH terikat pada atom C tersier Pemberian nama IUPAC dari senyawa
polialkohol sama seperti pada monoalkohol, tetapi jumlah dan posisi
CH3—CH2—OH
Etanol dimetil eterCH3—O—CH3
Contoh : keisomeran antara 1-propanol dan 2-propanol (keduanya mempunyai kerangka dan gugus fungsi sama)
Keisomeran posisi merupakan senyawa yang mempunyai rumus molekul dan gugus fungsi serta kerangka yang sama, tetapi berbeda letak posisi gugus fungsinya.
Keisomeran gugus fungsi
Contoh : keisomeran antara etanol dan dimetil eter,yang mempunyai rumus molekul C2H6O
Keisomeran posisi merupakan senyawa yang memiliki rumus molekul sama, tetapi berbeda gugus fungsinya.
4. Sifat- sifat Alkohol
TD alkohol > TD alkena dengan jumlah unsur C yang sama (etanol = 78oC, etena = -88,6oC)
Alkohol rantai pendek (metanol, etanol) larut dalam air (=polar)
a. Sifat Kimia Alkohol
1. Reaksi dengan Logam Natrium
Alkohol dapat bereaksi dengan logam Na membentuk alkoksida dan gas hidrogen. Contoh reaksi etanol dengan logam natrium
C2H5 – OH + Na ⎯⎯→ C2H5ONa + H2
Etanol Na-etoksida
Reaksi ini dapat dipergunakan sebagai reaksi untuk pengenalalkohol.
2. Reaksi Oksidasi
a. Alkohol primer teroksidasi membentuk aldehid dan dapat teroksidasi lebih
lanjut membentuk asam kar-boksilat.
b. Alkohol sekunder teroksidasi membentuk keton.
Alkohol sekunder dioksidasi menjadi keton. Sebagai contoh, jika alkohol sekunder, propan-2-ol, dipanaskan dengan larutan natrium atau kalium dikromat(VI) yang diasamkan dengan asam sulfat encer, maka akan terbentuk propanon.
Perubahan-perubahan pada kondisi reaksi tidak akan dapat merubah produk yang terbentuk.
3. Reaksi dengan Hidrogen Halida
Jika alkohol direaksikan dengan hidrogen halida akan terbentuk haloalkana dan air dengan reaksi:
CH3 – OH + HCl → CH3 – Cl + H2O
4. Reaksi esterifikasi
Reaksi esterifikasi berlangsung lambat dan dapat balik (reversibel). Persamaan untuk reaksi antara sebuah asam RCOOH dengan sebuah alkohol R’OH (dimana
5. Reaksi Dehidrasi Alkohol
Alkohol jika dipanaskan dengan asam kuat, maka akan terjadi alkena dan air. Contoh:
CH3– CH2 – CH2 – OH → CH2 – CH = CH2 + H2O
n – propanol 1 – propena
5. Kegunaan Alkohol
Dalam kehidupan sehari-hari alkohol banyak digunakan, antara lain sebagai berikut. 1. Dalam bidang farmasi (obat-obatan), sebagai pelarut senyawa organik,
misalnya etanol dan butanol.
2. Dalam bidang biologi atau industri digunakan sebagai disinfektan, misalnya etanol dan methanol.
3. Sebagai bahan bakar, misalnya spiritus (campuran antara methanol dan etanol).
Eter adalah nama senyawa kimia yang memiliki gugus eter (atom oksigen yang diikat 2 substituen (alkil/aril)). Senyawa eter biasanya dipakai sebagai pelarut dan obat bius. Molekul eter tidak dapat membentuk ikatan hidrogen sehingga titik didihnya rendah. Eter sedikit polar (lebih polar dari alkena). Eter dapat dikatakan sebagai basa lewis dan dapat membentuk polieter.
1. Struktur
Eter tersusun dari unsur C, H, dan O dengan rumus umum O-R’ atau Ar-O-Ar’ atau R-O-Ar. Dimana :
-O- : gugus fungsi eter R,R’ : Alkil
Ar,Ar’ : Aril
Jika R=R’ atau Ar=Ar’ maka dinamakan eter simitrik (eter sederhana) Jika R≠R’ atau Ar≠Ar’ maka dinamakan eter asimitrik (eter campuran) Sudut yang dibentuk oleh gugus eter (-O-) sebesar 109,50 dan panjang ikatan C-O- 0,142 nm.
Contoh struktur :
2. Tatanama Eter a. IUPAC
Contoh :
b) Tentukan nomor terikatnya gugus alkoksi.
Contoh :
c) Gugus alkoksi merupakan salah satu substituen , sehingga penulisan namanya harus berdasarkan urutan abjad huruf pertama nomor substituen.
Contoh :
Contoh :
b. Trivial
a) Tentukan gugus-gugus alkil (substituen) yang mengikat gugus eter (-O-).
Contoh :
b) Tambahkan akhiran “eter” setelah nama-nama subtituen.
Contoh :
c) Penulisan substituen alkil tidak harus menurut urutan abjad.
3. Sifat fisik dan kimia a. Sifat Fisik
Eter adalah cairan tidak berwarna yang mudah menguap dengan bau yang khas. Eter tidak larut air, akan tetapi larut dalam pelarut nonpolar.
Eter mudah terbakar dengan nyala bening yang jernih karena uap eter membentuk campuran yang eksplosif dengan udara.
b. Sifat Kimia a) Oksidasi
Oksidasi suatu eter dengan campuran kalium bikromat dan asam sulfat akan menghasilkan aldehida.
Contoh :
b) Reaksi dengan asam sulfat
Eter dapat bereaksi dengan asam sulfat menghasilkan suatu alcohol dan asam alkana sulfonat.
Contoh :
c) Reaksi dengan asam iodida
Eter dapat bereaksi dengan asam iodida menghasilkan campuran alkohol dengan alkil halida.
Contoh :
d) Hidrolisis
Hidrolisis dengan asam sulfat suatu eter akan menghasilkan alkohol.
Contoh :
e) Halogenasi
Contoh :
4. Pembuatan dan Kegunaan eter a. Pembuatan Eter
a) Mereaksikan alkil halida dengan alkoksida
Eter dapat dibuat dengan mereaksikan antara alkil halida dengan natrium alkoksida. Hasil samping diperoleh garam natrium halida.
Contoh :
b) Mereaksikan alkil halida dengan perak(I) oksida
Alkil halida bereaksi dengan perak(I) oksida menghasilkan eter. Hasil samping diperoleh garam perak halida.
Contoh :
c) Dehidrasi alkohol primer
Eter dapat dibuat dengan dehidrasi alkohol primer dengan asam sulfat dan katalis alumina.
Contoh :
Eter digunakan sebagai pelarut.
Dietil eter digunakan sebagai obat bius pada operasi.
Metil ters-butil eter (MTBE) digunakan untuk menaikkan angka oktan bensin.
b. Dampak