i;
,
KAPASITAS ANTIOKSIDAN DAN HUBUNGANNYA
DENGAN NILAI TOTAL
PENOL EKSTRAK
SAYURAN INDIGENOUS
DINY AGUSTINI SANDRASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kapasitas Antioksidan dan
Hubungannya dengan Nilai Total Fenol Ekstrak Sayuran Indigenous adalah karya saya
dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun
kepada perguruan tinggi manapun. Sumber informasi yang berasal atau d i i t i p dari
karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebut
dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, September 2008
This present study was carried out to evaluate antioxidant capacity and its relationship with total phenolic content of indigenous vegetables extracts.
The antioxidant capacity of indigenous vegetables extract was evaluated by four different methods @PPH and ABTS, radical scavenging activity; reducing power and
TBA, inhibition of peroxide formation). Total phenolic conteilts were determined using spectrophotometric technique, based on the Folin-Ciocalteau reagent and calculated as gallic acid equivalents, GAEIg dw. Total phenolic cohtent ranged frbm 42.24
-
141.10 pg GAEImg extract.Alinier positive relationship existed between total phenolic content and DPPH and ABTS scavenging activity (r = 0.9431 and r = 0.9702 respectively), between total phenolic content and reducing power (r = 0.8659), beween reducing power and DPPH and ABTS (r = 0.8992 and 0.9033 respectively), also between total phenolic content and inhibition of peroxide formation (r = 0.8395).
DINY AGUSTINI SANDRASARI. Kapasitas Antioksidan dan Hubungannya dengan Nilai Total Fenol Ekstrak Sayuran Indigenous. Dibimbing oleh HANNY WIJAYA dan NURI A N D A R W A N .
Hasil pengujian epidemiologi menunjukkan bahwa mengkonsumsi buah-buahan dan sayur-sayuran yang banyak mengandung senyawa fenol dapat menurunkan resiko terkena penyakit jantung dan kanker. Hal ini dikarenakan, senyawa fenolik yang banyak terdapat dalam tumbuhan dapat berfungsi sebagai antioksidan. Antioksidan didefinisikan sebagai senyawa yang dapat menunda, memperlambat dan mencegah terjadinya reaksi antioksidasi radikd bebas dalam oksidasi lipid. Salah satu jenis sayuran yang dapat berfmgsi sebagai antioksidan adalah sayuran indigenous. Sayuran indigenous merupakan sayuran yang banyak mengandung senyawa fenolik berupa flavonoid. Batari (2007) menunjukkan bahwa sayuran indigenous meilgandung senyawa flavonoid yang berupa flavonol dan flavone.
Penelitian ini bertujuan untuk mengetahui kapasitas antioksidan ekstrak sayuran indigenous dan rnelakukan analisis data mengenai hubungan antam nilai total fen01 ekstrak antioksidan sayuran indigenous dengan kapasitas antioksidan sebagai radikal scavenger, kemampuan mereduksi dan pengharnbat oksidasi lipid lanjut. Sayuran indigenous yang digunakan dalam penelitian ini adalah daun kenikir, beluntas, mangkokan, kemangi, pohpohan, katuk, antanan, ginseng, kedondong cina, bunga kecombrang dan krokot. Pembuatan ekstrak antioksidan dari sayuran ini dilakukan dengan menggunakan pelarut metanol. Data hasil penelitian yang menyatakan hubungan antara nilai total fenol dan kapasitas antioksidan sebagai radikal scavenger, dan kemampuan mereduksi serta hubungan antara kemampuan mereduksi dan kapasitas antioksidan sebagai radikal scavenger d i t u n g menggunakan persamaan regresi linier dan dinyatakan sebagai koefisien korelasi. Persen penghambatan oksidasi lipid lanjut didapat dari rata-rata nilai malonaldehid (MDA) yang terbentuk dibagi dengan rata-rata MDA tiap perlakuan yang terbentuk dikalikan 100%.
@ Hak Cipta milik IPB, tahun 2008. Hak Cipta dilindungr Undang-Undang.
I. Dilarang mengut@ sebagian atau seluruh k q a tulis ini tanpa mencantzcmkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan katya ilmiah, penyusunan laporan, pemrlisan kritik atau tinjauan suatu masalah.
b. Peizgutipan tidak inerugikan kepentingan yang wajar IPB.
KAPASITAS ANTIOKSIDAN DAN HUBUNGANNYA
DENGAN NILAI TOTAL FENOL EKSTRAK
SAYURAN INDIGENOUS
DINY AGUSTINI SANDRASARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEICOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Kapasitas Antioksidan dan Hubungannya dengan Nilai Total Fen01 Ekstrak Sayuran Indigenous.
Nama : Diny Agustini Sandrasari
NRP : F 251040021
Disetujui
Komisi Pembimbing
Ketua
Diketahui
d /
Dr. Ir. N ~ a n u u l a n . MS /mz3Jta
Ketua Program Studi Ilmu Pangan
&W
Dr. Ir. Ratih Dewanti-Hariyadi, MSCPRAKATA
Bismillahirrohmanirrohim
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas berkat dan rahmatNya penulis dapat menyelesaikan tesis yang bejudul Kapasitas Antioksidan dan Hubungamya dengan Nilai Total Fenol Ekstrak Sayuran Indigenuus, sebagai salah satu syarat untuk memperoleh gelar Master Sains pada Program Studi Ilmu Pangan, Sekolah Pascasacja, Institut Pertanian Bogor.
RIWAYAT HIDUP
Penulis didahirkan di Jakarta pada tanggal 3 Agustus 1970. Penulis adalah anak ke tiga dari empat bersaudara pasangan Eddy Sukirman dan Murniati.
Pada tahun 1983 penulis lulus dari Sekolah Dasar Negeri 03 Pagi Cibubur. Tahun 1986 penulis lulus dari Sekolah Menengah Pertama Negeri 49 Jakarta dan lulus dari Sekolah Menengah Atas Negeri 39 Jakarta pada tahun 1989. Pada Tahun 1989, penulis diterima di Akademi Kimia Analis (AKA) Bogor dan lulus pada tahun 1992. Pada tahun yang sama penulis melanjutkan pendidikan di Fakultas Teknik Program Studi Teknologi Pangan Universitas Sahid Jakarta dan lulus pada tahun 1996. Dengan berbekal ilmu dari AKA-Bogor, pada tahun 1993 penulis diterima bekerja sebagai laboran di Laboratorium Kimia, Pusat Penelitian dan Pengembangan Ekologi Kesehatan Lingiwngan, Departemen Kesehatan hingga awal tahun 1997.
DAFTAR IS1
Halaman
DAFTAR ISI..
. . .
. .. . .
.
. .
.
. . .
.. . .
.. . .
.. . .
. . .. . .
.. . .
..
I. . .
DAFTAR TABEL..
.
. . .
.. . .
. . .. . .
. .. . .
. ..
.. . .
.. . .
..
111DAFTAR GAMBAR..
.
..
.. . .
.. . .
. .. . .
.. . .
. . .. . .
. .. . .
. . . .. . .
..
.. . . ..
ivDAFTAR LAMPIRAN..
. . .
.. . . .
. ..
.. . .
. .. . .
. .. . .
..
.. . . .
..
..
.. . .
...
vPENDAHULUAN Latar Belakang.
. .
..
. . .
.. . .
. . . .. . . .
. . .. . .
.. . .
. . .. . .
..
. .. . .
. . .. . .
1Tujuan Penelltlan..
. .
. . . .
. .. . .
. . .. . .
.. . .
.. . .
.. . .
. .. . .
. . . .. .. . ..
.. .
....
3Hipotesis Penelltian.. .
.
. . .. . .
. . .. . .
.. . .
. . .. . .
.. . .
..
... . .
. . .. . .
..
3TINJAUAN PUSTAKA
. .
. .
Oksidasi Llpid... . .
. .. . .
. . .
. . .. . .
. .
. . .
.
. . . .
..
.
.
. . .
.
. . .
.
. . . ..
.
5kntioksidan..
. . .
.
. . .
. .
. . .
.
. . .
.
. . .
.
.
7Sayuran Indigenous..
.
. . .
.. . .
..
. . . ..
.. . . ..
.
. . .
.
. . . .
..
. . . .. .
19Senyawa Fenolik..
. . .
.. . .
.. . .
.. . . .
. .
. . .
.. . .
..
.. . .
.. . .
.
.
. . .
. . .
21METODOLOGI Telnpat dan Waktu.. . . .
. . .
.. . . .
. . .. . . .
. .. . . .
.
.
.. . . .
. . .. . .
. . . .. . .
24Bahan dan Alat..
. .
. . . .
..
.. . . .
.. . .
.. . .
. .. . . .
..
.. . .
. . .. . .
.. . . . ..
24Metode Peneht~an..
. . .
..
. . . .. . .
. .. . .
. .. . .
..
.. . . . ..
25Pengainatan..
. . .
.
.. . .
.. . .
. . .. . .
.. .
.
. .
.. . .
.. . . ...
29Analisis Data..
. . .
. ..
. . .
. .. . .
.. . .
. .. . .
..
. .. . .
.
. . . .. .
. 35HASIL DAN PEMBAHASAN Karakterisasi Sifat Fisik dan Kimia Ekstrak Antioksidan Sayuran Indigenous 39 Ekstraksi Komponen Antioksidan..
. .. . .
.. . .
. . .. . .
.
...
39Rendemen dan Bahan Kering Ekstrak..
. ... . .
. ... . . .
. . . .. . . .
.
.
.. . .. .
40Analisis Data Hubu~lgan
.
.
Nilai Total Fenol Ekstrak Antioksidan dengan Kapasitas Antloksidan... . .
.. . .
.
. . . .
.
. . .
.. . .
.
. . .
... . . .
...
42Analisis Total Fenol dan Kapasitas Antioksidan Sayurail Indigenous 42 Hubungan Nilai Total Fenol dengan Kapasitas Antioksidan Sebagai Radikal Scavenger..
.
. . .
.
. . .
. . .
. . .
.
.
.
.
.
. . .
. . . .
. . .
.
. . .
.
.
.
. . . ..
48Hubungan Nilai Total Fenol dengan Kemampuan Mereduksi..
. . . .
...
52Hubungan Nilai Total Fenol dengan Kapasitas Antioksidan Sebagai Penghambat Oksidasi Lipid Lanjut..
. . .
.. . . .
..
.. . . .
.. . .
. .
. . . ..
53Ilubungan Kemampuan Mereduksi dengan Kapasitas Antioksidan Sebagai Radikal Scaveizger..
. . . .
. . .. . . .
.
.. . . .
. . .. . .
. .. . .
.. . .
. .. . ..
55 Hubungan Ke~nampuan Mereduksi dengan Nilai Total Flavonol danSIMPULAN DAN SARAN
Simpillan
...
60 Saran...
60DAFTAR TABEL
Halaman
Tabel 1 Nilai total fenol dan kandungan flavonol dan flavon pada sayuran
Indigenous
... ....
...
20Tabel 2 Bentuk substitusi dari flavonoid yang mempunyai aktivitas antiradikal 23
Tabel 3 Hasil pengamatan karakterisasi sifat fisik dan kimia ekstralc antioksidan
.
.
Sayuran znd~genous..
...
4 1Tabel 4 Nilai total fenol, flavonol, flavonol dan flavon, dan kapasitas antioksidan
[image:12.595.34.500.32.806.2]DAFTAR GAMBAR
Halaman
Gambar 1 Gambar 2 Gambar 3
.
Gambar 4 Gambar 5 Gambar 6 Gambar 7 Gambar 8 Ganbar 9 Gambar 10.
Gambarl 1Gambar 12
.
Gambar 1'3.
Gambar 14.
Gambar 15Gambar 16
Gambar 17 Gambar IS Gambar 19 Gambar 20
Gambar 21
Gambar 22
Gambar 23
Gambar 24
.
Reaksi autooksidasi lipid
...
...
S t d m r Trolox
Reaksi penghambatan antioksidan primer terhadap radikal lipida Antioksidan bertindak sebagai prooksidan pada konsentrasi tinggi
...
Mekanisme reaksi elektron transfer
Reaksi antara DPPH dan antioksidan
...
Mekanisme realtsi radikal ABTS
...
Struktur kompleks MDA-TBA
...
Sbulctur beberapa senyawa flavonoid
...
. .
Struktur flavonoid dengan aktivitas antiradikal yang tmgg...
Bentuk substitusi senyawa flavonoid yang terdapat pada sayuran...
Indigenous
Bagan alir pe~nbuatan bubuk sayuran indigenozrs
...
Bagan alir proses ekstraksi komponen antioksidan...
Hasil pengukuran pembentukan hidroperoltsida asam linoleat...
Grafik hubungan nilai total fenol dengan kapasitas antioksidan menggunakan radikal bebas DPPH...
Grafik Hubungan Nilai Total Fen01 dengan Icapasitas Antioksidan Menggunakan Radikal Bebas DPPH dan ABTS ... Reaksi scrivenging DPPH' oleh flavonoid
. .
...
Reaksi radikal ABTS dengan ant~oks~dan...
.
.
...
Grafik bubungan nilai total fen01 dengan ke~nampua~l mereduksi...
Grafik hubungan antara nilai total fenol dengan ke Penghambatan
Pembentukan MDA
...
54 Grafik hubungan kemampuan mereduksi dengan kapasitasantioksidan menggunakan radikal DPPH
...
56 Grafik llubungan kemampuan mereduksi dengall kapasitasantioksidan sebagai radikal scavenger
...
57 Grafik hubungan kemampuan mereduksi dengan nilai total flavonolDAFTAR LAMPIRAN
Halaman
Lampiran 1
Lampiran 2 Lampiran 3
Lampiran 4
Lampiran 5 Lampiran 6 Lampiran 7 Lampiran 8
Lampiran 9
Lampiran 11 Lampiran 12
Lampiran 13
Lampiran 15 Lampiran 16
Larnpiran 17
Lampiran 18
Lampiran 19
Lampiran 20
Rekapitulasi hasil pengukuran kadar air sayuran segar, kadar air bubuk kering, rendemen dan kadar bahan kering.
.. .. . ...
Hasil pengukuran kadar air berbagai jellis sayuran indigenous Hasil pengukuran kadar air bubuk kering berbagai sayuran Indigenous...
.
.
.
.. . .
. . .
. . .
. . .
. .. . .
..
. .. . .
.. . .
Hasil pengukuran kadar bahan kering ekstrak sayuran
. .
rndrgelzous. . .
. . .
. . .
Hasil pengukuran rendemen ekstrak sayuran indigenous... . .
Hasil pengukuran nilai total fenol ekstrak sayuran indigenous Kurva standar asam galat...
..
. ... ... ... ... . ...
...
Hasil pengukuran kemampuan mereduksi elcstrak sayuran Indigenot~~.. . .
..
.
..
. .
. . .
Hasil pengulturan kapasitas antioksidan ekstrak sayuran Indigenous menggunakan radikal DPPH..
. . .
.. . .
.
..
Hasil pengukuran kapasitas antioksidan ekstrak sayuran I~idigenotts menggunakan radikal ABTS..
. . .
.. . .
.
. .
..
. .. .
.
. .
.
[image:14.595.61.467.119.806.2]Hasil pengukuran kapasitas antioksidan metode FTC..
. . . .. .
Masil pengukuran kapasitas antioksidan ekstrak sayuran Iiidigenotrs metode TBA... . .
.. . .
. . ..
. . .. .
. ..
.
. . ...
Grafik hubungan nilai total fenol dan kapasitas antioksidan meilggunakan radikal DPPH..
. . .
.. . . .
. .. .
. . ..
.. .
Grafik hubungan nilai total fenol dan kapasitas antioksidan Sebagai radikal scavenger..
. . .
.. . .
. .
.
.
. . .
Grafik hubungan nilai total fen01 dan kemampuan mereduksi Grafik hubungan nilai total fen01 d m kemampuan penghanlbatan oksidasi lipid lanjut..
.
.
.
.
. . . ...
Grafik hubungan kemampuan mereduksi dan kapasitas antioksidan menggunakan radikal DPPH... .
.
.
.. . .
. . .
Grafik hubungan kemampuan mereduksi dan kapasitas antioksidan sebagai radikal scavenger..
. .
. . .
..
. . . .. . . ..
Grafik hubungan kemampuan mereduksi dengan nilai total flavonol dan flavon
...
... . .. .. . ... ...
..
.
.. ... ......
. ...
PEND AHULUAN
La tar Wakang
Radikal bebas adalah molekul yang kehilangan elektron, sehingga molelrul tersebut menjadi tidak stabil dan selalu bermaha malgambil elektron dari moleM
atau sel lain.. Radikal bebas dianggap berbahaya karena bersifat tidak stabil dan menjadi sangat reaktif dalam upaya mendapatkan pasangan elektronnya sehingga
menyebabkan terbentuknya radilcal baru. Pembentukan radikal baru ini @at meninbulkan kemsakan berbagai komponen sel dalam tubuh seped DNA, dan juga
dapat menyebabkan terjadinya peroksidasi lipid. Peroksidasi lipid m e ~ p a k a n reaksi
yang tqadi antara radikal bebas dengan asam lemak tidak jenuh ganda yang
menyusun membran sel sehingga terbenhk radikal lipid peroksida (Anonim,
2008a).
Salah satu mekanisme untuk mengatasi radikal bebas adalah melalui
antioksidasi. Unhk menjalankan mekanisme tersebut diperlukan antioksidan Aniioksidan adalah suatu senyawa yang dapat menghambat tejadinya proses
ohidasi dengan cara menghambat terjadinya reaksi oksidasi pada tahap inisiasi atau
propagasi (Velioglu et al. 1998). Terdapat dua katagori antioksidan yaitu antioksidan
alami dan antioksidan sintetik Antioksidan alami dapat bempa senyawa fenolik (tokoferol, flavonoids, dan asam fenolat), senyawa nitrogen (alkaloids, turunan
Irlorofil, asam amino dan amina), atau karotenoid seperti asam askorbat (Apak et al.
2007).
Flavonoid memili ikatan difenilpropana yang diketahui dapat berfmgsi
sebagai antimutagenik dan anfikarsiogenik. Selain itu, senya\va ini juga mempunyai
sifat sebagai antioksidan, antiperadangan, antialergi dan dapat menghambat oksidasi
LDL (Low Density Lipoprotein). Eklund et al. (2005) mengataka bahwa senyawa
flavonoid yang banyak terdapat dalam antioksidan alami mempunyai pen@
biologis yang kuat hususnya sebagai antialergi, antibakten, antivirus, anti-
inflammatori, dan antihombotik Beberapa penelitian tentang &ivitas antiohidan
dari senyawra flavonoid telah dilaporkan dan dikatakan bahwa s t d w r dari senyatva
dari flavonoid sangat bergantung pada jumlah dan lokasi gugus fenolik -OH yang
berperan dalam menetralkan radikal bebas. Terdapat tiga strubkr yang
memungkmkan aktivitas scavenging radikal dari flavonoid adalah adanya 3,4-
dihidroksil misalnya o-dihidroksil (stnk-tur katekol) pada cinch B, berperan sebagai donor elektron dan menjadi target radikal. Struktur 3-OH dari cinch C juga menguntungkan untuk aktivitas antioksidan flavonoid. Konjugasi ikatan rangkap pada C2-C3 dengan gugus 4-keto, berperan untuk delokalisasi elektron dari cinch B, meningkatkan kapasitas scavenging radial. Selain ini adanya gugus 3-OH dan 5-
OH dalam kombinasi dengan fungsi Ckarboni! dan &an rangkap C2-C3
menaikkan ak-tivitas scavenging radikal (Amic et 01.2002).
Sayuran indigenous merupakan sayuran lokal yang sudah lama dikonsumsi
oleh masyarakat Indonesia terutama masyarakat Jawa Barat yang diietahui memiliki khasiat tertentu dan sangat potensial untuk dikernbangkan sebagai pangan yang
bemilai tinggi. ~ a y k a n ini seringkali digunakan sebagai obat-obatan maupun jamu-
jamuan karena mengandung senyawa fitokimia yang beriungsi sebagai antioksidan
yang sangat menguntungkan bagi kesehatan (Exarchou el al. 2002). Diketahui pula bahwa sayuran ini mempunyai potensi yang sangat baik untuk menjaga kesehatan
dan melindungi dari penyakit jantung koroner dan kanker. Efek antiohidatif dari
sayuran ini terutama disebabkan oleh kandungan senyawa fenoliknya.
Sayuran ir~digenous seperti kenikir, beluntas, mangkokan, ginseng, antanan,
pohpohan, kah& kedondong cina, kemangi: bunga kewmbrang dan lcrokot
merupakan sayuran yang diketahui mengandung senyawa fenol yang berupa golongan flavonoid. Hasil penelitian yang dilakukan oleh Batari (2007)
menunjukkan bahwa sayuran indigenous sebagaimana disebutkan di atas
mengandung senyawa flavonoid yang berupa flavonol (quercetiq miricetin dan
kaempferol) dan flavone (luteolin dan epigenin). Flavonol dan flavone merupakan
flavonoid penting yang terdapat dalam tanaman sebab senyawa tersebut diketahui
mernpunyai aktivitas antioksidan dan bersifat sebagai scavenging radikal bebas.
Kedua senyawa tersebut dibedaitan berdasarkan jumlah dan bentuk substitusi dari
gugus hidroksilnya
Metode pengujian terhadap aktivitas antioksidan yang berasal dari ekstrak
pengujian ini dikelompokkan dalam dua kategori yaitu berdasarkan elektron transfer
(ET) dan transfer atom hidrogen (HAT). Pengujian berdasarkan transfer atom
hidrogen dilakukan untuk men@ jumlah atom hidrogen yang dilepaskan pada
reaksi radikal berantai. Lebii jauh dikatakan bah~va HAT me~pakan reaksi
kompetisi antara antioksidan dan substrat membentuk radikal peroksil melalui
dekomposisi senyawa azo. Metode ini meliputi penghambatan dari reaksi lipid lanjut yang dapat diuji dengan metode TBA Sedangkan pengujian berdasarkan ET dilakukan untuk mengukur kapasitas antioksidan dalam mereduksi oksidan Pada
reaksi ini tejadi perubahan wama dirnana tingkat pembahan wama berhubungan dengan konsentrasi antioksidan yang terdapat dalam sampel. Metode pengujian ini
meliputi pengujian total fenol dengan reagen Folin Ciocalteau (FCR), radikal ABTS,
dan DPPH serta kemampuan mereduksi (Apak et 01.2007).
Berdasarkan uraian diatas, dapat diketahui bahwa meskipun telah banyak penelitian mengenai ak4vitas antioksidan pada berbagai tanamq tetapi belum ada
penelitian mengenai hubungan antara nilai total fenol dari suatu flavoncid
khususnya yang berasal dari sayuran indigenous dan kemampuan senyawa tersebut
sebagai radikal scavenger, kemampuan mereduksi d m penghambat tejadinya oksidasi lipid lanjut.
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui kapasitas antioksidan
ekstrak sayuran indigenous dan melakukan analisis data mengenai hubungan antara
nilai total fenol ekstrak antioksidan sayuran indigenous dengan kapasitas
antioksidan sebagai radikal scavenger, kemampuan mereduksi dan penghambat
oksidasi lipid lanjut
Hipotesis
Sayuran indigenous merupakan sayuran yang mengandung senyawa
fenolik berupa flavonoid yaitu flavonol dan flavon yang dapat berperan sebagai
lokasi gugus fenolik -OH yang berperan dalam menetralkan radikal bebas. Kemampuan flavonoid dalam menekan perkembangan radikal bebas tersebut berkaitan erat dengan kemampuannya dalam mendonorkan elektronnya. Berdasarkan uraian diatas maka:
Semakin tinggi nilai total fen01 rnaka semakin tinggi kemampuan antioksidan dalam mendonorkan elektromya sehingga semakin tinggi kemampuannya dalam menekan perkembangan radikal bebas, semakin meningkat kemampuan mereduksi, dan semakin meningkat kemampuannya dalam menghambat oksidasi lipid lanjut.
TINJAUAN PUSTAKA
Oksidasi Lipid
Lipid mempakan biomolekul yang paling rentan terhadap oksidasi terutama asam-asam lemak tak jenuh. Tingkat ketidak jenuhan, jumlah dan ikatan rangkap suatu asam lemak berhubungan langsung dengan kerentanan terhadap oksidasi. Oksidasi pada lipid sering disebut sebagai autooksidasi karena reaksi dapat terjadi walaupun tanpa ada zat pengoksidasi. Oksidasi lipid biasanya berlangsung melalui proses pembentukan radikal bebas yang terdiri dari tiga proses dasar yaitu inisiasi, propagasi dan terminasi (Buck, 1991).
Inisiasi :
RH h R '
+
B'
ROOH+ Mn+ RO' + M("+"' +OH ROOK+ M("'*
---,
ROO' + M"++
H+
2 ROOH
--+
ROO' + RO' + HzOPropagasi :
R'
+
0 2 ---+ ROO'ROO'
+
RH ----a- ROOH+
R'RO' + RH ---+ ROH + R'
Terminasi :
R'
+
R'----+
RR R'+
ROO' ----+ ROOR [image:19.605.91.481.66.653.2]ROO' + ROO'
---+
ROOR+
0 2Gambar 1 Reaksi autooksidasi lipid (Kochhar, 1990)
RH, R', RO', ROO', ROOH dan M bertumt-turut merupakan simbol untuk asam lemak tidak jenuh atau ester dengan atom H pada atom karhon alilik, radikal alkil, radikal alkoksi, radikal peroksi, hidroperoksida dan logam transisi (Kochhar,
Pa& tahap awal reaksi terjadi pelepasan hidrogen dari asam lemak tidak jenuh secara homolitik sehingga terbentuk radikal alkil yang terjadi karena adanya inisiator (panas, oksigen aktif, logam atau cahaya). Reaksi oksidasi lipid juga dapat diinisiasi oleh beberapa faktor seperti molekul H202, ROOH, '02.
Tahap propagasi dimulai dengan penambahan molekul oksigen pada radikal alkil. Pada keadaan normal radikal alkil cepat bereaksi dengan oksigen membentuk radikal peroksi dimana radikal peroksi ini bereaksi lebih lanjut dengan asam lemak tidak jenuh membentuk hidroperoksida dengan radial alkil, kemudian radikal alkil yang terbentuk bereaksi dengan oksigen. Dengan demikian reaksi autoksidasi adalah reaksi berantai radikal bebas(Gutteridge, 1995).
Antioksidan
Antioksidan adalah suatu senyawa yang dapat mencegah kerusakan pada makanan yang mengandung lemak. Adanya antioksidan dalam lemak akan mengurangi kecepatan proses oksidasi. Secara umum, antioksidan didefinisikan sebagai senyawa yang dapat menunda, memperlarnbat atau mencegah terjadinya proses oksidasi lipida. Dalarn arti k h m q antioksidan adalah zat yang dapat menunda atau mencegah teijadinya reaksi autooksidasi radikal bebas dalam oksidasi lipida
@dash et
d.
2006).Berdasarkan fimgsinya, antioksidan dikelompokkan menjadi antioksidan primer d m antioksidan sekmder. Antioksidan primer (antioksidan pemecah rantai) yaitu antioksidan yang dapat bereaksi dengan radikal lipida lalu mengubahnya kebentuk yang lebii stabil. Lebii jauh dijelaskan bahwa suatu molekul antioksidan
dapat disebut sebagai antioksidan piimei (AH), jika dapat mendonorkan atom hidrogennya secara cepat ke radikal lipida
(RO')
dan radial turunan antioksidan tersebut (A*) lebih stabil dibandingkan radikal lipida atau mengubahnya ke bentuklebii stabil (Gordor, 1990).
Gordon (1990) mendefinisikan bahwa antioksidan sekunder mempakan antioksidan pencegah yaitu suatu senyawa yang dapat memperlambat laju reaksi autooksidasi lipida. Antioksidan ini bekeja dengan berbagai mekanisme seperti mengikat ion metal, menangkap oksigen, memecah hidroperoksida ke bentuk- bentuk non radikal, menyerap radiasi ultra violet atau mendeaktifkan singlet oksigen.
Berdasarkan sumber asalnya, antioksidan dibedakan menjadi dua kelompok yaitu antioksidan sintetik dan antioksidan alami. Antioksidan sintetik adalah antioksidan yang diperoleh dari hasil sintesa reaksi kimia. Sedangkan antioksidan alami adalah antioksidan hasil ekstraksi bahan alami (Ardiansyah, 2008).
ButiI Hidroksi Quinon (TBHQ, Propil Galaf dan Tokoferol. Antioksidan tokoferol merupakan antioksidan alami yang telah diproduksi secara sintetis untuk tujuan komersial (Buck, 1991).
BHA memiliki kemampuan antioksidan yang baik pada lemak hewan dalam system makanan panggang, namun relatif tidak efekti pada minyak tanaman. BHA bersifat sangat larut dalam lemak dan tidak larut dalam air, berbentuk padat putih, dan dijual dalam bentuk tablet atau serpih bersifat volatile sehingga berguna ke material pengemas (Buck, 1991).
Menurut Sherwin (1990) antioksidan sintetik BHT memiliki sifat serupa BHA sehingga antioksian ini dapat memberikan efek sinergis bila dimanfaatkan bersama dengan
BHA,
berbentuk kristal putih, dan digunakan secara luas karena harganya yang relatif murah.Propil galat merupakan kristal putih yang mempunyai karakteristik sensitif terhadap panas dan terdekomposisi pada titik cair 14S°C, dapat membentuk kompleks warna dengan ion metal sehingga kemampuan antioksidamya rendah. Antioksidan ini memberikan efek sinergis dengan BHA dan BHT (Buck, 1991).
TBHQ merupakan antioksidan paling efektif untuk lemak dan minyak khususnya minyak tanaman karena memiliki kamampuan antioksidan yang baik pada penggorengan dan kurang baik pada pembakaran. TBHQ yang dikombinasiican dengan BHA akan memiliki kemampuan antioksidn yang baik pada pemanwgan.
Tokoferol merupakan antioksidan alami yang dapat ditemukan hampir disetiap minyak tanaman tetapi saat ini telah diproduksi secara kimia. Tokoferol memiliki karakteristik berwama kuning terang, larut dalam lipida karena mempunyai rantai C yang panjang. Pengaruh nutrisi secara lengkap dari tokoferol belum diketahui tetapi a-tokoferol dikenal sebagai sumber vitamin E. Di dalam jaringan hidup, aktivitas antioksidan tokoferol cenderung a->f3->x->6-tokoferol,
tetapi dalam makanan aktivitas tokoferol terbalik 6-%->f3->a-tokoferol (Belitz dan Grosch, 1987). Sedangkan menurut Sherwin (1990) urutan tersebut kadang bervariasi tergantung pada substrat dan kondisi lain seperti suhu.
Trolox me~pZ+kan padatan tidak b e m a , dan tidak berasa. Trolox stabil pada suhu
22-45'~ (Madhavi et ~2.1996).
Gambar 2 Struktur Trolox (Madhavi et ~1.1996).
Trolox mempunyai aktivitas antioksidan 2 sampai 4 kaii lebii besar daripada
BHA dan BHT dalam minyak tumbuhan dan lemak hewan. Disamping itu trolox juga dilaporkan bersifat lebih aktif dibandigkan dengan a-tokoferol, propil galat secta
askorbil palmitat (Madhavi et al. 1996).
Antioksidan alami di dalam makanan dapat berasal dari (a) senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan, (b) senyawa antioksidan yang t e h t u k dari reaksi-reaksi selama proses pengolahan, (c) senyawa antioksidan yang diisolasi dari sumber alami dan ditamhhkm ke makanan sebagai M a n
pangan
.
Menurut Pratt dan Hudson (1992), kebanyakan senyawa antioksidan yang diisolasi dari sumber alami adalah berasal dari tumbuhan. Isolasi antioksidan alami telah dilakukan dari tumbuhan yang dapat dimakan, tetapi tidak selalu dari bagian yang dapat diiakan. Antioksidan alami tersebar di beberapa bagian tanaman seperti pada kayu, kulit kayu, akar, daun, buah, bunga, biuji dan serbuk sari.
pereduksi, @) penangkap r a d i a l bebas, (c) pengkelat logam, (d) peredam
terbentuknya singlet oksigen (Javanmardi et al. 2003)
Menurut Ivkukham (1988), kira-kira 2% dari seluruh k a b n yang dii~to~ntesis oleh tumbuhan diubah menjadi flavonoid atau senyawa yang behitan
erat
dengannya, sehingga flavonoid melupakan salah satu golongan fenol alam terbesar. Lebi lanjut disebutkan bahwa sebenamya flavonoid terdapat ddam semua tumbuhan hijau, sehingga @lab ditemukan pula p& setiap telaah ekstmk tumbuhan. Ditulii oleh Pratt danHudson (1992), kebanyakan golongan dari 5avonoid dan senyawa yang behitan erat dengannya memiliki sifatsifaf antioksidan baik di
&lam
lipida cair maupun dalammakanan berlipida,
Berdasarkan mekanisme kejanya, antioksidan memiliii dua fungsi. Fungsi pertama adalah sebagai pemberi atom hidrogen. Antioksidan (AH) yang nempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogennya secara cepat ke radikal lipida
(R', ROO') atau mengubahnya ke bentuk yang lebih stabil, sementara turunan radikal antioksidan (A') tersebut memiliki keadaan lebih stabil dibanding mdikal lipida. Fungsi kedua melupakan hngsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk yang lebih stabil (Gordon, 1990).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lemak dan minyak. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi (Gambar 3). Radikal-radikal antioksidan (A') yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk m d i i l lipida baru. Menurut Apak et
Tahap inisiasi:
L*
+
AH-
LH+
A Radikal lipidaTahap Propagasi: LO*
+
AH-
LQH+ A
LOO'+ AH
---+
LOOH+
AGambar 3. Reaksi penghambatan antioksidan primer terhadap radikal lipida (Apak et al. 2007)
Konsentrasi antioksidan yang ditambahkan dapat berpengaruh pada laju oksidasi. Pada konsentrasi tinggi, aktivitas antioksidan grup fenolik sering lenyap bahkan antioksidan tersebut lenyap menjadi prooksidan (Gambar 4). Pengaruh jumlah konsentrasi pada laju oksidasi tergantung pada struktur antioksidan,
kondisi dan sampel yang diujikan.
AH
+
0 2-
A'+
HOUAH+
ROOHI
Gambar 4 Antioksidan bertindak sebagai prooksidan pada konsentrasi tinggi (Gordon, 1990).
Antioksidan sekunder merupakan senyawa yang menghambat laju reaksi autooksidasi lipid melalui m e h i s m e yang berbeda dari antioksidan primer. Antioksidan sekunder seperti asam sitrat, asam askorbat, clan estemya, sering ditambahkan pada lemak dan minyak sebagai kombiiasi dengan antioksidan primer. K o m b i i i tersebut dapat memberi efek sinergis sehiigga menambah keefektifan kerja antioksidan primer. Antioksidan sekunder ini beke j a dengan satu atau lebih mekanisme berikut (a) memberikan suasana asam pada medium (sistem makanan), (b) meregenemi antioksidan utama, (c) mengkelat atau m e n d e a k t i i kontaminan prooksidan, (d) menangkap oksigen, (e) mengikat singlet oksigen dan mengubahnya ke bentuk triplet oksigen (Godon, 1990).
Antioksidan sebaiknya ditambahkan ke lipida seawal mungkin untuk menghasilkan efek maksimum. Menurut Coppen (1983), antioksidan hanya akan benar-benar efektif bila ditambahkan seawal mungkin selama periode induksi, yaitu suatu periode pada awal oksidasi lipida te jadi d i a n a oksidasi masih lmjalan secara lambat dengan laju kecepatan
semgam.
Faktor-Faktor yang Mempengamhi Aktivitas Antioksidan
Beberapa faktor yang berpengaruh terhadap oksidasi lipid juga mempengaruhi aktivitas antioksidan seperti s~lbstrat lipid, faktor fisik serta keadaan fisiko kimia sistem lipid. Disamping itu, aktivitas antioksidan juga sangat dipengaruhi oleh faktor lain seperti struktur dan konsentrasi antioksidan.
Aktivitas antioksidan secara mum dipengaruhi oleh konsentrasi dan shuktur
kimia dari 5avonoid Tiga sk&m yang berpengaruh terfiadap aktivitas antioksidan
adalah : (1) struktur odihidroksi (btekol) pada cinch B, berperan sebagai donor elektron dan menjadi target radiil. Struktur 3-0H dari cinch C juga menguntungkan untuk
aktivitas antioksidan 5avonoid; (2) Konjugasi ikatan rangkap
pada
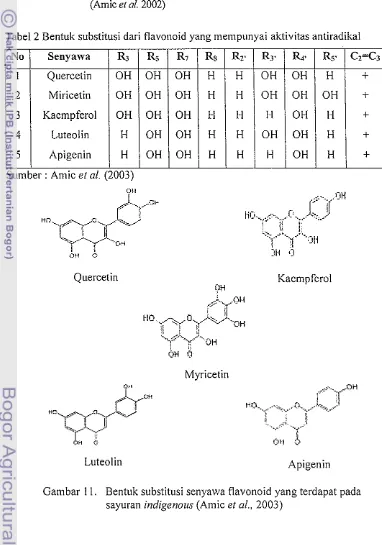
C2C3 dengan gugus 4ket0, berperan untuk delokalisasi elektron dari cinch B, menin- kapasitasscavenging radikal; (3) adanya gugus 3-OH dan 5-OH dalam kombinasi dengan h g s i 4- karb.mil dan ikatan rangkap C2C3 menaikkan aktivitas scavenging radikal (Amic et al. 2003).
Metode Pengujian AMivitas Antiohidan
Berdasarkan reaksi kimia yang terjadi, metode pengujian aktivitas antioksidan dapat dibagi dalam dua katagori yaitu: (I) berdasarkan transfer atom hidrogen (hydrogen atom fransrfer, HAT) dan (2) berdasarkan transfer elektron
(electron tranfer, ET). Pengujian dengan metode HAT didasarkan pada reaksi kinetik, dan melibatkan reaksi kompetisi dimana antioksidan dan substrat bersaing membentuk radikal peroksil yang dihasilkan melalui dekomposisi senyawa azo (Huang et al. 2005). HAT digunakan untuk mengukur kemampuan antioksidan dalam menghambat radikal bebas (radikal peroksil) oleh donor atom hidrogen. Mekanisme HAT dari antioksidan yaitu atom hidrogen yang berasal dari phenol (Ar-OH) ditransfer pada radikal ROO, reaksi yang terjadi adalah sebagai berikut :
ROO'
+
AWArOH---+
ROOH+
A- 1ArO'
Radikal ariloksi (ArO') dibentuk dari reaksi antioksidan phenol dengan peroksil radikal yang distabilisasi dengan resonansi. Oksidan dan antioksidan bereaksi dengan ROO', aktivitas antioksidan dapat diukur dari kompetisi kinetik dengan cara mengukur penghilangan wama oksidan karena kahadiran antioksidan (Huang
et al. 2005).
wama pada saat reaksi reduksi terjadi. Mekanisme reaksi elektron transfer
sebagaimana dapat dilihat pada Gambar 5.
RQQ'
+
AWArQklRQQ'
+ AH+
I&Q@A H C I A ~ O P
+ H 2 0
-
A-/ArO'+
~ 3 0 'ROQ'
+ H3Q'-
ROQH +H2Q
Gambar 5 Mekanisme reaksi elektron transfer (Ou et al. 2002)
Pada metode ET, reaksi berjalan lebih lambat dibandiigkan dengan
metode HAT dan reaksi dipengaruhi oleh jenis pelarut dan kondisi pH. Metode ini
merupakan metode yang sangat popuier. Termasuk dalam metode ini adalah
pengukuran total fenol menggunakan reagen Folin-Ciccalteau (FCR),
TEACIABTS, DPPH dan reducing power. Dalam reaksinya, metode ini
dipengaruhi oleh dua komponen yaitu antioksidan dan oksidan. Dasar dari reaksi
ini adalah reaksi transfer elektron. Oksidan yang memperoleh elektron dari
antioksidan akan mengalami pembahan wama. Tingkat pembahan wama
sebanding dengan konsentrasi antioksidan. Titik akhir reaksi dicapai ketika
perubahan wama sudah tidak terjadi lagi. Perubahan nilai absorbansi diplot
terhadap konsentrasi antioksidan yang digambarkan pada kurva linier. Slope kurva
menunjukkan kapasitas reduksi dari antioksidan, yang diekspresikan sebagai
Polox equivalen (TE) atau gaNic acid equivalent (GAE) untuk pengujian total
fenol (Huang et al. 2005).
1. Metode Pengujian DPPH (2,2-diphenyl-I-picrylhidracyr)
DPPH adalah salah satu radikal bebas yang secara komersial tersedia
dalam bentuk radikal nitrogen dan mempunyai penghambatan maksimum pada
panjang gelombang 515 nm. Pada saat reduksi, wama larutan akan menghilang
dan selanjutnya dapat diukur dengan menggunakan spektrofotometer. Huang et al.
(2005) melaporkan bahwa DPPH merupakan metode pengujian yang didasarkan
Aktivitas antioksidan dapat diukur dengan menggunakan metode penangkapan radikal bebas stabil DPPH (2,2-diphenyl-I-picrylhidracyl). DPPH adalah suatu radial bebas stabil yang dapat bereaksi dengan radikal lain membentuk suatu senyawa stabil. Selain itu DPPH juga dapat bereaksi dengan atom hidrogen @erasal dari suatu antioksidan) membentuk DPPH tereduksi @PP Hidrazin) yang stabil (Molyneux, 2004). Prinsip pengujian aktivitas antioksidan dengan metode ini adalah mengukur daya peredaman sampel (ekstrak sayuran indigenous) terhadap radial bebas DPPH. DPPH akan bereaksi dengan atom hidrogen dari senyawa peredam radikal bebas membentuk DPP Hidrazin yang lebih stabil. Senyawa peredam radikal bebas yang bereaksi dengan DPPH akan menjadi radial baru yang stabil atau senyawa bukan radikal. Aktivitas antioksidan dinyatakan dengan persentase penghambatan (inhibisi) yang diperoleh dari nilai absorbansi blanko dikurangi absorbansi sample (Singh et al. 2002).
Untuk mengetahui aktivitas antioksidan suatu ekstrak tumbuhan, metode DPPH adalah metode yang cepat, mudah, dan sensitive. Reaksi peredaman (scnvenging) antara radikal DPPH dan flavonoid dapat ditulis sebagai berikut :
DPPH
...-
Gambar 6 Reaksi antara DPPH dan antioksidan (Prakash et al. 2008)
Antioksidan bereaksi dengan DPPH' yang menstabilkan radikal bebas dan mereduksi DPPH. Sebagai konsekuensinya penyerapan radikal DPPH* menurun ke bentuk DPPH-H. Derajat diskolorasi menunjukkan potensi peredaman radikal bebas dari substansi antioksidan atau ekstrak dengan memberikan hidrogen. DPPH yang bereaksi dengan antioksidan akan mengalami perubahan warna dari ungu ke kuning, intensitas warna tergantung kemampuan dari antioksidan (Molineux et al. 2004).
tetapi suatu senyawa dapat digunakan sebagai peredam radikal bebas yang bermanfaat jika setelah bereaksi dengan radikal bebas akan menghasilkan radikal baru yang stabil atau senyawa bukan radikal. Pada radial bebas stabilitasnya dapat disebabkan oleh pengaruh resonansi, halangan ruang maupun besamya molekul (Apak et al. 2007).
2. Metode Pengujian TEAUABTS
Metode TEACIABTS pertama kali dikembangkan oleh Miller dan Rice- Evans pada tahun 1993 dan saat ini telah banyak mengalami perkembangan. Re et al. mengembangkan pengujian radikal kation ABTS menggunakan persulfat dari 2,2'-azinobis(3-ethylbenzothiazole-6-sulfoic acid) (ABTs'.) sebagai oksidan. Metode TEAC dikembangkan dalam tiga periode, TEAC I (ABTs' dihasilkan secara enzimatik dengan metmioglobin dan hidrogen peroksidase), TEAC I1 (radikal dihasilkan dengan fiitrasi menggunakan MnOz sebagai oksidan) dan TEAC 111 (dengan KzSaOs sebagai oksidan). Dari ketiga metode tersebut, metode TEACIABTS mempunyai kelebihan dibanding yang lainnya yaitu pengujian sederhana, mudah diulang. dan yang paling penting adalah fleksibel dan dapat diynakan untuk mengukur aktivitas antioksidan yang bersifat hidrophilik maupun lipophilik dalam ekstrak makanan dan cairan (Apak et al. 2007).
Metode TEAC/ABTS merdpakan metode pengujian untuk mengukur jumlah radikal yang dapat ditangkal oleh antioksidan yang dikenal dengan kapasitas antioksidan (Lien et al. 1999). Senyawa yang biasa digunakan untuk pengujian metode TEAC adalah trolox. Trolox bereaksi sangat cepat dengan AJ3TS', hanya dalam beberapa detik reaksi berjalan sempuma. Cara terbaru yang dikembangkan pada metode ini adalah dengan menambahkan larutan ABTS radikal (ABTS') kedalam antioksidan dan setelah stabil diukur dengan menggunakan spektrofotometer (Berg van den et al. 1999). Penurunan konsentrasi ABTS' dinyatakan sebagai konsentrasi antioksidan, ekivalen dengan trolox dan dinyatakan sebagai nilai TEAC dari antioksidan.
ABTS' dapat dioperasikan pada range pH yang besar, mudah, murah, berkorelasi terhadap aktivitas antioksidan dalam system biologis dan ' lebih cepat
dibandingkan dengan metode DPPH (Arts et al. 2004).
Prinsip pengujian dengan metode ini adalah mengukur daya peredaman antioksidan terhadap radikal bebas ABTS. Sebagai pembandig digunakan standar Trolox, dan hasil pengujian dinyatakan sebagai Trolox Ekivalen. Radikal kation ABTs" akan bereaksi dengan atom hidrogen dari senyawa peredam radikal bebas dan menjadi ABTS yang lebih stabil. Senyawa peredam radikal bebas yang bereaksi dengan ABTs+ akan menjadi mdikal baru yang stabil atau senyawa bukan radikal.
Gambar 7 Mekanisme reaksi radikal ABTS (Huang et al. 2005)
3. Metode Pengujian TBA
Efektivitas suatu antioksidan baik sintetik maupun alami dapat diukur dengan menentukan stabilitas oksidatif lipid. Penentuan stabilitas oksidatif lipid dapat dibagi menjadi dua yaitu pembahan primer dan perubahan sekunder. Pembahan primer pada umumnya diukur dengan memonitor (1) hilangnya asam- asam lemak tidak jenuh, (2) oxygen uptake, (3) biIangan peroksida, (4) bilangan diena terkonjugasi. Perubahan sekunder mengukur secara kuantitatif pembentukan
(1) senyawa karbonil, (2) malonaldehid serta hidrokarbon (Shahidi dan Wanasundara, 1997).
Pada metode FTC ini, reaksi antara ~ e ~ + hasil oksidasi FeClz oleh
hidroperoksida dengan SCN menghasilkan senyawa kompleks benvarna merah
Fe[Fe(SCN)6] dengan serapan maksimum pada panjang gelombang 500 nm.
2 ~ e ' +
+
6 S C N ----) Fe[Fe(SCN)6]Absorbansi dari kompleks berwama merah tersebut berbanding lums
dengan konsentrasi hidroperoksida asam linoleat yang terbentuk. Oleh karena itu
dilakukan pengukuran absorbansi setiap 24 jam hingga tercapai absorbansi
maksimum.
Beberapa faktor yang mempengaruhi autooksidasi asam linoleat adalah
panas, pH, cahaya, oksigen, ion logam katalitk dan radikal lipid itu sendiri
(Buck, 1991). Pada sistem ini, asam linoleat ditempatkan pada botol gelap bertutup kemudian diinkubasi selama 6 hari pada suhu 40°C. Inkubasi sampel
dikondisikan sedemikian mpa sehingga hanya panas, oksigen, pH dan radikal lipid
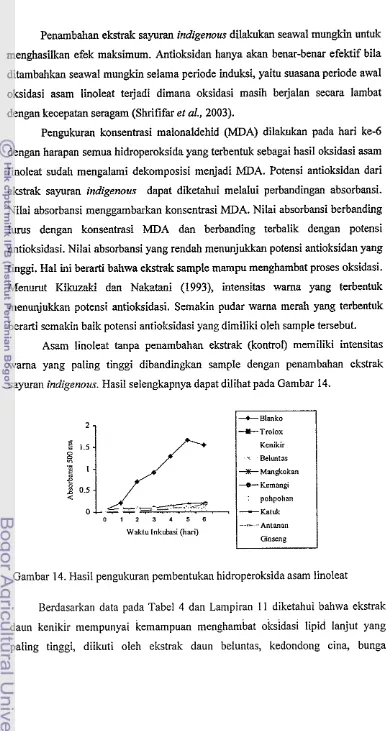
yang mempengaruhi oksidasi asam linoleat.
Pada tahap awal oksidasi asam linoleat (fase lag) akan terbentuk
hidroperoksida. Selanjutnya diikuti tahap propagasi dimana kadar hidroperoksida
terus meningkat dan mencapai nilai maksimum pada hari ke-5. Kemudian disusul
dengan tahap terminasi dimana hidroperoksida akan mengalami dekomposisi
membentuk malonaldehid.
Menurut Chen (1998) nilai absorbansi pada hari ke-0 hams dibawah 0.3,
karena jika absorbansinya lebih dari 0.3 menunjukkan asam linoleat telah msak
(teroksidasi). Waktu selama absorbansi masih di bawah 0.3 dinyatakan sebagai
periode induksi dari autooksidasi lipida Periode induksi juga menunjukkan
lamanya tahap inisiasi berlangsung.
Peroksidasi lipid akan menghasilkan produk akhir berupa senyawa
malonaldehid (MDA), yaitu senyawa aldehida berkarbon tiga yang reaktif dengan
lemak tak jenuh rantai panjang. Peroksidasi lipid mudah tejadi pada asam lemak berantai panjang dengan lebii dari satu ikatan rangkap seperti linoleat, linolenat, dan arakidonat (Murray et al. 2003).
Gambar 8 Struktur kompleks MDA-TBA (Anonim, 2008b)
Senyawa MDA yang dihasilkan dari peroksidasi lipid tersebut dapat diukur dengan metode TBA (Thiobarbituric Acid), karena MDA dapat bereaksi dengan TBA membentuk produk berwarna yang dapat diukur pada panjang gelombang 532 nm. Pada penelitian ini, MDA akan bereaksi dengan TBA menghasilkan kompleks MDA-TBA yang dapat dilihat pada Gambar 8 dengan menghasilkan warna merah muda (pink) dengan serapan maksimum pada panjang gelombang 532 nm (Behbahani et al. 2007)
Sayuran Itzdrgetww
Sayuran indigenous adalah spesies sayuran asli Indonesia yang berasal dari daerah tertentu, termasuk spesies pendatang dari daerah atau wilayah lain yang telah berevolusi dengan iklim dan geografis wilayah Indonesia. Sayuran lokal di Indonesia ini memiliki potensi yang cukup baik dalam kontribusi terhadap kandungan flavonoidnya.
Batari (2007) teiah melakukan penelitian terhadap kandungan senyawa flavonoid yang terdapat dalam sayuran indigenous (beluntas, kenikir, mangkokan, kemangi, pohpohan, katuk, antanan, ginseng, kedondong cina, bunga kecombrang dan krokot). Hasil penelitian menunjukkan bahwa semua sayuran indigenous yang diuji mengandung senyawa flavonoid. Komponen flavonoid yang diperoleh berupa senyawa flavonol dan flavon. Perbedaan yang paling utama antara flavonol dan flavon yaitu pada flavonol terdapat gugus hidroksil pada C3. Kedua senyawa ini banyak terdapat pada daun dan bagian luar dari tanaman, dan hanya sedikit sekali ditemukan pada bagian tanaman yang berada di bawah permukaan tanah (Hertog et al. 1992). Robinson (1995) menambahkan bahwa flavonol dan flavon merupakan dua dari jenis flavonoid yang paling banyak ditemukan pada sayur- sayuran.
Flavonol terdiri dari quercetin, yang umumnya merupakan komponen terbanyak dalam tanaman, miricetin dan kaempferol. Sedangkan flavon terdiri atas apigenin dan luteolin. Kandungan flavonoid yang terdapat dalam sayuran indigenous sebagaimana dapat dilihat pada Tabel 1.
Tabel 1 Nilai total fenol dan kandungan flavonol dan flavon pada sayuran
Sumber : Batari (2007)
mengandung senyawa quercetin. Senyawa quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan mempakan senyawa paling aktif dibanding senyawa f~avonol laimya (Fuhrman dan Aviram, 2002).
Polifenol yang banyak terdapat dalam tanaman adalah senyawa hidroksil aromatik, yang biasa ditemukan dalam sayuran, buah-buahan dan sumber makanan lain. Senyawa tersebut merupakan komponen penting dalam diet makanan. Polifenol memiliki struktur kimia yang sangat baik dalam aktivitas
scavenging radikal dan menunjukkan aktivitas antioksidasi yang lebih efektif secara in vitro dibandingkan dengan asam askorbat dan a-tokoferol. Aktivitas antioksidasi dari polifenol ini ditandai dengan aktivitas yang relatif tinggi sebagai donor hidrogen atau elektron dan kemampuan dari turunan radikal polifenol untuk menstabilkan dan memindahkan elektron yang tidak berpasangan (fungsi pemutusan rantai) juga kemampuan untuk mengkelat transisi iogam (Apak et al.
2007)
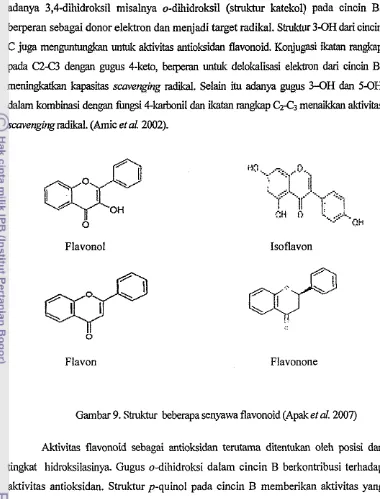
Flavonoid merupakan salah satu golongan fenol alam yang terbesar. Golongan flavonoid mencakup banyak pigmen yang paling umum dan terdapat pada seluruh dunia tumbuhan mulai dari fungus sampai angiospennae. Flavonoid mempunyai sifat yang khas yaitu bau yang sangat tajam, sebagian besar merupakan pigmen benvarna kuning, dapat larut dalam air dan pelarut organik, mudah temrai pada temperatur tinggi. Flavonoid merupakan persenyawaan glukosida yang terdiri dari gula yang terikat dengan flavon.Golongan flavonoid dapat digambarkan sebagai deret senyawa C6-C3-C6 artinya kerangka karbonnya terdiri atas dua gugus C6 (cincin benzena tersubtitusi) disambungkan oleh rantai alifatik ketiga karbon. Flavonoid mempunyai struktur bervariasi yang menunjukkan perbedaan tipe, misalnya flavonol, flavon, isoflavon dan flavonone sebagaimana ditunjukkan pada Gambar 9.
adanya 3,4dihidroksil misalnya o-diidroksil (sldctu~ katekol) pada cincin B, berperan sebagai donor elektron dan menjadi target radikal. Strukhu 3 0 H dari cinch C j u g menguntungkan untuk aktivitas antioksidan flavonoid. Konjugasi
ikatan
rangkap pada C2C3 dengan gugus 4ket0, berpemn untuk delokalii elektmn dari cincin B, meningkatkan kapdltas s w e r g h g mdikal. Selain itu adanya gugus 3-OH dan 5 0 H dalam k d i i dengan h g s i 4 k a h n i l dan ikatan rangkap CZC3 menaikkan aktivitasswengingradikal. (Amic et
d
2002).Flavonol Isoflavon
[image:36.599.93.473.91.590.2]Flavon Flavonone
Gambar 9. Struktur beberapa senyawa flavonoid (Apak et al. 2207)
Aktivitas flavonoid sebagai antioksidan terutama ditentukan oleh posisi dan tingkat hidroksilasinya. Gugus o-dihidroksi dalam cincin B berkontribusi terhadap aktivitas antioksidan. Struktur p-quinol pada cincin B mernberikan aktivitas yang lebih besar dibandingkan dengan struktur o-quinol. Sernentara konfigurasi meta tidak memiliki efek terhadap aktivitas antioksidan. Semua flavonoid dengan konfigurasi 3', 4'-dihidroksilasi memiliki aktivitas sebagai antioksidan (Amic et 01.
..
@
I
5:'-.
O H '. . 7~ 't!o
- ; l . I -
-c-
1
OK
OH
.. ,
Galnbar 10. Struktur flavonoid dengan aktivitas antiradikal yang tinggi Gambar yang diligkari merniliki aktivitas antiradikal bebas (Amic et al. 2002)
[image:37.595.85.467.194.739.2]Quercetin
Tabel 2 Bentuk substitusi dari flavonoid yang melnpunyai aktivitas antiradikal
Kaempferol
Myricetin
,.s-;P"
I
11
"0 ...<...& ,_.. 4
..
...I 2 222,22.+ , R
! . , i
,_,>
._.,
OH :: ov,
4
No 1 2 3 4 5
Luteolin Apigenin
Sumber : Amic et al. (2003)
Gambar 11. Bentuk substitusi senpawa flavonoid yang terdapat pada sayuran indigenozrs (Amic et al., 2003)
Senyawa Quercetin Miricetin Kaempferol Luteolin Apigenin R8 H H H H H R3- OH OH H OH H R r H H H H H R33 OH OH OH OH OH R7 OH OH OH OH OH R3 OH OH OH H H Rs OH OH OH OH OH Rp H OH H H H
C Z = C ~
METODOLOGI
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kimia SEAFAST, Laboratorium Kimia Pusat Studi BIOFARMAKA, Institut Pertanian Bogor dan Laboratorium Kimia Universitas Sahid Jakarta. Penelitian berlangsung mulai bulan Agustus sampai dengan Maret 2008.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan untuk membuat ekstrak sayuran, bahan untuk membuat lamtan standar dan bahan-bahan untuk analisa. Bahan-bahan yang digunakan dalam pembuatan ekstrak sayuran indigenous adalah d a m kemangi (Ocimum americanum L), daun katuk (Sauropus androgynus (L.) Merr), daun mangkokan (Nothopanax scutellarius (Burm.f.) Merr), daun kenikir (Cosmos caudatus H.B.K.), daun beluntas (Pluchea indica (L)Less), daun pohpohan (Pilea melastonzides (Poir.) BI), daun antanan (Centella asiatica (L) Urb), daun ginseng (Talinum friangulare (Jacq.) Willd.), bunga kecombrang (Etlingera elatior (Jack) R.M.Sm), daun dan batang krokot (Portulaca oleracea L) dan daun kedondong cina (Polyscias pinnata) yang diperoleh dari pasar lokal yang berada di daerah Bogor, metanol. Bahan-bahan dalam pembuatan larutan standar adalah standar asam galat d a l trolox (6-hydroxy-2,5,7,8-
tetramethylchrornan-2-carboxylic acid). Sedangkan bahan-bahan yang digunakan untuk analisa meliputi metanol, etanol, reagent Folii-ciocalteau,
Alat-ala? yang digunakan dalam penelitian ini meliputi alat untuk ekstraksi, alat untuk membuat larutan standar dan alat untuk analisa. Alat untuk membuat ekstrak sayuran terdiri dari freeze dryer, freezer, neraca analitik, blender kering, labu takar, erlenmeyer, gelas ukur, kertas saring Whatman 41, shaker, water bath, vaccumfilter, rotavapor, pipet Mohr, pipet tetes dan pisau. AIat-alat untuk msmbuat larutan standar adalah labu takar, gelas ukur, erlenmeyer, tabung reaksi, pipet tetes, dan spatula. Sedangkan alat-alat yang digunakan untuk analisis terdiri dari spectrofotometer, dan
tabung reaksi.
Metode Penelitian
Penelitian ini dibagi dalam dua tahap dengan rincian sebagai berikut: Tahap Persiapan Sampel
Tahapan ini dimulai dengan mengidentifikasi/determinasi sayuran indigenous. Pengidentifikasian sayuran ini dilakukan di Herbarium Bogoriense, bidang botani, Pusat Penelitian Biologi-LIPI, Bogor (Lampiran 20). Pembuatan bubuk sayuran indigenous, ekstraksi komponen antioksidan, dan karakterisasi sifat fisik dan kimia ekstrak sayuran indigenous.
Karakterisasi sifat fisik ekstrak antioksidan sayuran indigenous yang diamati meliputi pengamatan terhadap warna ekstrak dan penghitungan rendemen.. Sedangkan karakterisasi sifat kimia yang diamati meliputi analisa kadar air
sayuran segar, kadar air bubuk kering, kadar bahan kering ekstrak, dan total fen01 ekstrak antioksidan sayuran indigenous.
Pembuatan Bubuk Sayuran
Sayuran indigenous yang digunakan adalah daun kemangi (Ocimum
americanum L), daun katuk (Sauropus androg~nus (L) Men), daun mangkokan (Nothopanax scutellarius (Burm.f.) Merr), daun kenikir (Cosmos
(Pilea melastornoides (Poir.) Bl), d a m antanan (Centella asiatica), daun ginseng (Talinurn triangulare (Jacq.) Willd), bunga kecombrang (Etlingera elatior (Jack) R.M.Srn), daun dan batang krokot (Portulaca oleracea) dan d a m kedondong cina (Polyscias pinnata). Bagian tanaman yang digunakan dalam penelitian ini adalah bagian daun yang masih muda (lima pucuk pertama). Bagian tanaman krokot yang digunakan adalah batang dan daunnya, tanaman antanan yang digunakan adalah seluruh bagiannya, sedangkan bunga kecombrang yang digunakan adalah bunga kec0rnbrar.g yang telah mekar. Pernilihan bagian-bagian tersebut didasarkan pada bagian yang biasa diionsumsi oleh masyarakat.
Sayuran-sayuran indigenous tersebut yang diperoleh dari pasar lokal yang berada di daerah Bogor, pertama-tarna disiangi untuk diambil bagian yang akan diteliti, dicuci sarnpai bersih kemudian ditiriskan. Setelah itu sayuran dibekukan dalam freezer selama satu malam untuk memudahkan proses pengeringan vakum. Sayuran yang sudah beku tersebut selanjutnya dikering bekukan dengan alat freeze dryer selama 48 jam. Proses pengeringan dengan cara dibekukan ini mernpunyai kelebihan yaitu dapat mencegah kerusakan atau kehilangan komponen aktif dari sayuran tersebut. Pengeringan ini dirnaksudkan untuk menurunkan kandungan air dari sayuran indigenous sehingga dapat menurunkan efisiensi ekstraksi yang akan dilakukan.
Sayuran indigenous
I
Penyiangan dan pencucianPengeringan Beku
(Freeze dryer, 48 jam)
[image:41.599.226.382.122.406.2]Penghancuran sayuran kering
Gambar 12. Bagan alir pembuatan bubuk sayuran indigenous
Ekstraksi Komponen Antioksidan
Tujuan dari tahap ini adalah mengekstrak komponen-komponen antioksidan yang tedapat dalam sayuran tersebut. Ekstraksi dilakukan dengan menggunakan metode Harnrnersshcmidt dan Pratt (1978). Ekstraksi dimulai dengan menimbang bubuk sayuran indigenous kering sebaxiyak 6 @am (bk) lalu diekstraksi dengan 100 ml metanol menggunakan penggoyang
dengan tekanan rendah (13.5 kgf/cm2). Ekstrak yang diperoleh selanjutnya
ditempatkan pada veal-veal dan disimpan dalam freezer. Bagan alir proses
ekstraksi dapat dilihat pada Gambar 13.
I
Bubuk Sayuran Ind.qenousI
Ekstraksi dengan Metanol (Hammerschmidt dan Pratt, 1978)
.
I
PenyaringanI
I
f
Pencucian dengan Metanol
4
Penghilangan Metanol
I
[image:42.595.184.368.172.433.2]Ekstrak Antioksidan
Gambar 13. Bagan alir proses ekstraksi komponen antioksidan
Karakterisasi Sifat Fisik dan Kimia Ekstrak Antioksidan Sayuran
Indigettous
Pengujian karakterisasi ekstrak antioksidan sayuran indigenous
meliputi sifat fisik dan k i i i a ekstrak. Pengamatan terhadap sifat fisik ekstrak
terdiri dari pengamatan terhadap warna dan rendemen ekstrak. Sedangkan
pengamatan terhadap sifat kimia ekstrak terdiri dari analisis kadar air, kadar
Tahap Pengujian Kapasitas Antioksidan
Pengujian kapasitas anfioksidan ekstrak sayuran indigenous t e r d i dari pengujian kapasitas antioksidan sebagai radikal scavenger dengan menggunakan metode DPPH dan ABTS, kapasitas mereduksi menggunakan metode ferisianida dan pengujian kapasitas antioksidan sebagai penghambat oksidasi lipid lanjut.
Pengamatan
Pengamatan yang dilakukan terhadap ekstrak antioksidan sayuran
indigenous adalah sebagai berikut:
Karakterisasi Sifat Fisik Ekstrak Antioksidan Sayuran indigenous
Warna Ekstrak
Pengamatan terhadap warna ekstrak dilakukan dengan mengamati warna yang terbentuk setelah proses ekstraksi.
Rendemen Ekstrak
Penghitungan terhadap rendemen ekstrak dilakukan untuk mengetahui
berapa banyak bahan baku yang dibutuNcan untuk mendapatkan sejumlah tertentu ekstrak sayurannya. Rendemen ekstrak d i t u n g dengan cara menirnbang ekstrak yang diperoleh dibagi dengan bobot awal sayuran segar
dikurang bobot kering sayuran segar.
W e b m k
Rendemen Ekstrak (% bb) = x 100%
W awal - W nwal kering
Keterangan:
W rl;sbal; = bobot ekstrak yang diperoleh (g)
w
a ~ a ~ = bobot awal sampel yang akan diekstrak (g)Karakterisasi Sifat Kimia Ekstrak Antiohidan Sayuran Indigenous
Karakterisasi sifat kimia yang diamati meliputi analisa kadar air (dilakukan terhadap sampel sayuran segar dan bubuk sayuran), analisa kadar bahan kering ekstrak dan nilai total fen01 ekstrak sayuran indigenous.
Kadar Air (AOAC, 1984)
Penetapan kadar air merupakan cara
untuk
mengukur banyaknya air yang terdapat di dalam suatu bahan pangan. Analisis kadar air dilakukanterhadap sampel sayuran segar (awal) dan pada sampel bubuk sayuran kering (setelah fieeze drying). Penentuan kadar air ini dilakukan dengan menggunakan metode pengeringan dengan oven biasa. Prinsip dari metode ini adalah air dikeluarkan dari sampel dengan cara menguapkan
air
yang terdapat dalam bahan pangan.Cawan aluminium dikeringkan dalam oven pada suhu 103OC selama 15 menit kemudian didinginkan dalam desikator dan dilakukan penirnbangan untuk mengetahui bobot kosong daricawan aluminium tersebut. Sampel ditimbang sebanyak 5 g kemudian dikeringkan dalam oven pada suhu 103°C kemudian didinginkan dalam desikator lalu dilakukan penimbangan. Penimbangan dilakukan hingga diperoleh bobot tetap.
W-(W1-W2)
Kadar air (%) = x 100%
W
Keterangan : W = bobot contoh sebelum diieringkan (g)
WI = bobot (contoh + cawan) sesudah dikeringkan (g)
w2
= bobot cawan kosong (g)Kadar Bahan Kering Ekstrak
Tujuan dari pengukuran ini adalah
untuk
mengetahui berat komponen kering dari ekstrak per 100 mg ekstrak. Prosedur yang dilakukan adalah menyiapkan cawan porselen bersih, bebas lemak dan kotoran. Cawanditimbang. Sampel ekstrak diambil sebanyak 2.5 mg lalu dikeringkan dalam
oven pada suhu 4OvC selama kurang lebii 6 jam. Pengeringan dilakukan pada suhu 40°C dimaksudkan agar komponen-komponen volatile yang terdapat dalam ekstrak tidak ikut teruapkan. Ekstrak kering kemudian diieluarkan dari oven dan didinginkan lalu ditimbang hingga diperoleh bobot tetap.
- (W1- W2)
Kadar bahan kering
(YO)
-x
100%W
I I
Keterangan : W = bobot contoh sebelum d i i e ~ g k a n (mg)
W, = bobot {mntoh
+
cawan) sesudah diieringkan {ntg) W2 = bobot cawan kosong (mg)Nilai Total Fen01 Ekstrak
Pengukuran nilai total fenol pada tahap ini bertujuan untuk mengetahui kandungan fenol yang terdapat dalam ekstrak sampel, dan selanjutnya nilai ini digunakan sebagai standar atau dasar penggunaan bahan baku tersebut dalam pengujian kapasitas antioksidan dari masing-masing sampel.
Total fenol ekstrak diukur dengan reagent Folin-Ciocalteau menggunakan metode Javanmardi et al. (2003) dengan sediit modifikasi. Prosedur pengukuran dilakukan dengan cara menimbang sampel sebanyak lebih kurang 5 mg untuk masing-masing sampel lalu ditambahkan 0.5 ml metanol, 2.5 ml aquadest, dan 2.5 ml reagent Folin-Ciocalteau 50%.
Campuran didiamkan selama 5 menit kemudian ditambahkan 2 ml NazCO3
7.5% dan divorteks lalu d i i i b a s i selama 15 menit pada suhu 45OC.
Absorbansi kesemua sampel diukur pada panjang gelombang 765 nm dengan menggunakan spektrofotometer. Hasil pengukuran diekspresikan sebagai mg ekuivalen asam galat per gram berat kering sampel (mg GAE/g bk).
Standar yang digunakan dalam penentuan nilai total fenol ekstrak adalah asam ga!at. Standar asam galat dibuat dengan variasi konsentrasi
Tahap Pengujian Kapasitas antioksidan Ekstrak Sayuran Indigenous Tahapan ini meliputi pengujian kapasitas antioksidan sebagai radikal scavenger yang diuji dengan menggunakan metode DPPH dan ABTS, kapasitas mereduksi yang diuji dengan metode ferisianida. Hasii pengujian ketiga metode tersebut dinyatakan sebagai TEAC (Trolox Equivalent
Antioxydant Capacity). Selain itu pengujian kapasitas antioksidan juga dilakukan terhadap antioksidan sebagai penghambat oksidasi lipid lanjut yang diuji dengan metode TBA.
Pengujian Kapasitas Antioksidan Sebagai Radical Scavenger
Menggunakan Metode DPPH
Pengujian kapasitas antioksidan diukur dengan menggunakan metode Payet et 01. (2005). Ekstrak sampel dibuat dalam konsentrasi 100 ppm berdasarkan nilai total fen01 untuk masing-masing sampel. Sebanyak 5 ml dari 0.1 mM larutan DPPH dalam metanol ditambahkan ke dalam masing- masing sampel kemudian dikocok hingga homogen. Selanjutnya sampel disimpan pada suhu 27OC selama 20 menit. Kontrol disiapkan tanpa
penambahan ekstrak sampel dan metanol digunakan sebagai koreksi. Absorbansi sampel diukur pada panjang gelombang 517 nm. Kapasitas antioksidan diekspresikan sebagai persen inhibisi (penghambatan) dan
dihitung dengan menggunakan rumus :
Abs kontro~ - Abs sampel
Penghambatan (YO) =
x
100Abs liontro~
Nilai perhitungan persen penghambatan dinyatakan pula dalam TEAC dengan cara :
TEAClDPPH = x [Trolox]
Pengujian Kapasitas Antioksidan sebagai Radikal Scavenger dengan metode TEACIABTS"
Nilai total kapasitas antioksidan (TAA) diestimasikan sebagai Trolox Equivalent Antioxidant Capacity (TEAC) assay menggunakan metode Lee et
al. (2006). Pengujian didasarkan pada kemampuan dari masing-masing substansi untuk membentuk kation radikal ABTs* yang dibandingkan dengan
standar (Trolox). Kation radikal disiapkan dengan mencampurkan 7 mM
larutan stok ABTS dengan 2.45 mM potassium persulfat (111, v/v) dan dibiarkan bercampur selama 4
-
8 jam hingga reaksi bejalan sempurnayang ditandai dengan absorbansi yang stabil. Larutan BTS" dilarutkan dengan etanol hingga absorbansinya mencapai 0.700 F 0.05 pada panjang gelombang 734 nm. Pengukuran dilakukan dengan mengambil 0.9 ml dari
larutan ABTS'+ dan 0.1 ml ekstrak sampel yang dilarutka dalam metanol.
Campuran dikocok selama 45 detik dan segera dilakukan pengukuran untuk mengetahui absorbansinya pada panjang gelombang 734 nm setelah 1 menit.
Standar yang digunakan dalam penentuan nilai total fen01 ekstrak adalah trolox. Standar trolox dibuat dengan variasi konsentrasi antara 0-0.5
PM
Pengujian Kapasitas antioksidan Sebagai Kapasitas Mereduksi Menggunakan Metode Ferisianida
Pengujian kemampuan mereduksi dilakukan dengan menggunakan
metode Duh et al. (2004). Sebanyak 0-500 mg/mL ekstrak dalam buffer phosphate (2.5 mL., 0.2 M, pH 6.6) ditambahkan potassium ferisianat (2.5
mL., 10 mgIrnL) lalu campuran diinkubasi pada suhu 50°C selama 20 menit.
selama 10 menit. Sebanyak 2.5 mL supematan dicampurkan dengan 2.5 mL air destilasi clan feri klorida (0.5 mL., 10 m a ) . Kemudian diukur absorbansinya diukur dengan alat spektrofotometer pada panjang gelombang 700 nm. Semakin tinggi absorbansi meagindiiasikan kemampuan mereduksi
yang semakin baik.
Kemampuan mereduksi dinyatakan dalam TEAC dengan cara membagi absorbansi kontrol dengan absorbansi sampel. Hasil penghitungan perbandigan tersebut selanjutnya dikonversikan dengan hasil penghitungan kemampuan mereduksi dari standar trolox dengan cara membaginya dengan nilai reduksi trolox.
Pengujian Kapasitas antioksidan Sebagai Penghambat Oksidasi Lipid Lanjut Menggunakan Metode TBA (Aqil et aL 2006)
Sebelum pengukuran potensi antioksidan dari ekstrak sayIran
indigenous dilakukan pengukuran hidroperoksida sebagai produk primer asam linoleat yang teroksidasi dengan metode FTC.
Metode yang digunakan sebagaimana dijelaskan dalam Aqil et al, (2006). Campuran yang terdiri dari 4 mg ekstrak sampel dalam 4 ml etanol absolut, 4.1 ml asam linoleat dalam etanol 2.52%, 8 ml buffer phosphate @H 7) 0.05 M dan 3.9 ml air diletakkan dalam vial yang ditutup rapat dan disimpan dalam oven dengan suhu 40°C. Sebanyak 0.1 ml dari campuran tersebut ditambahkan dengan etanol 75%, 0.1 ml ammonium tiocianat 30% dan 0.1 ml fero klorida 0.02 M dalam 3.5% HC1. Absorbansi warna merah diukur pada panjang gelombang 500 nm setiap 24 jam sampai 1 hari setelah absorbansi kontrol mencapai nilai tertinggi. Trolox digunakan sebagai standar positif dan kontrol tanpa sampel sebagai kontrol negatif.