HASIL DAN PEMBAHASAN
Karakterisasi Sifat Fisik dan Kimia Ekstrak Antioksidan Sayuran indigenous
Ekstraksi Komponen Antioksidan
Proses ekstraksi bertujuan untuk mendapatkan ekstrak sayurm indigenous (kenikir, beluntas, mangkokan, kemangi, katuk, kedondong cina, pohpohan, ginseng, antanan, dan bunga kecombrang) yang mengandung komponen aktif yang dapat bekerja sebagai antioksidan. Metode yang digunakan pada proses ekstraksi sayuran indigenous adalah metode ekstraksi dengan menggunakan pelarut organik yaitu metanol. Sayuran indigenous yang digunakan adalah sayutan segar dengan kandungan air sebagaimana disajikan pada Lampiran 1. Berdasarkan data teeebut dapat diketahui bahwa kadar air sayuran indigenous segar berkisar antara 81.31%
-
90.84 % berat basah. Kadar air tertinggi diiiliki oleh daun ginseng (90.84%) dan kadar air terendah adalah daun mangkokan (81.31%).Sayuran tersebut sebelum diekstrak, dikeringkan terlebih dahulu dengan menggunakan alat pengering beku Vreeze dryer) selama 48 jam. Pengeringan dengan cara ini dimaksudkan untuk mencegah terjadinya kerusakan pada senyawa metabolit sekunder khususnya senyawa flavonoid. Setelah proses pengeringan beku, kesemua sayuran yang diteliti dihancurkan dengan cam diblender, kemudian diayak dengan ayakan ukuran 30 mesh, agar diperoleh serbukfbubuk sayuran dengan kehalusan yang tinggi. Adapun tujuan pembuatan bubuk sayuran ini adalah untuk memperkecil dan menyeragamkan ukuran partikelnya agar mempermudah kontak antara bahan dan pelarutnya, sehingga ekstraksi dapat berlangsung dengan baik. Bubuk kering sayuran yang diperoleh selanjutnya ditentukan kadar aimya sebagaimana dapat dilihat pada Lampiran 1. Berdasarkan hasil analisis kadar air pada bubuk kering diketahui bahwa kadar air sampel sayuran kering berkisar antara 7.31% - 10.33%.
Pelarut yang digunakan untuk mengekstraksi sayuran indigenous adalah pelarut polar metanol. Menurut Larson (1988), senyawa antioksidan di dalam tanaman tingkat tinggi selain berupa protein, senyawa bernitrogen, karotenoid, vitamin C adalah senyawa fenolik. Senyawa fenolik yang berhngsi sebagai
antioksidan primer dalam tanaman bersifat polar. Pada penelitian ini diasumsikan bahwa komponen aktif antioksidan yang terkandung dalam sayuran indigenous
adalah senyawa fenolik karena antioksidan yang paling umum terdapat pada tanaman adalah kelompok senyawa fenolik (Pratt, 1992). Menurut Hougton clan
Raman (1998) komponen fenolik yang umumnya terdapat dalam tanaman berada dalam bentuk fenol bebas dan glikosidik. Senyawa fenolik cenderung relatif polar karena banyak mengandung gugus OH dan larut dalam pelarut metanol. Oleh karena itu, metanol dipilih sebagai pelarut dalam penelitian ini. Dari beberapa hasil penelitian diketahui bahwa ekstrak polar antioksidan menghasilkan aktivitas tertinggi. Hasil penelitian yang dilakukan oleh Velioglu et al. (1998) menyatakan bahwa ekstrak buah-buahan, sayur-sayuran dan biji-bijian dengan menggunakan pelarut metanol menunjukkan kapasitas antioksidan yang sangat h a t .
Pada penelitian ini proses ekstraksi dilakukan berdasarkan prinsip kelarutan yaitu pelamt polar akan melamtkan senyawa polar, dan sebaliknya. Flavonoid-o-glikosida memiliki molekul gula dimana molekul gula diketahui memiliki gugus hidroksil sehingga akan mudah larut dalam pelarut dengan kepolaran tinggi. Semakin banyak gugus monosakarida yang berikatan dengan senyawa flavonoid (ikatan glikosida) maka akan lebih bersifat polar. Hal ini disebabkan karena semakin bertambahnya gugus hidroksil.
Hasil ekstraksi daun kenikir dan beluntas memberikan wama hijau tua, ekstrak daun mangkokan, kemangi, pohpohan, antanan, katuk, ginseng, kedondong cina, dan krokot benvama hijau, sedangkan ekstrak bunga kecombrang benvama merah kecoklatan. Semakin pekat wama yang dihasilkan mengindikasikan semakin banyaknya komponen antioksidan yang terekstrak. Hasil ekstraksi selengkapnya dapat dilihat pada Tabel 3.
Rendernen dan Bahan Kering Ekstrak
Penghitungan rendemen sampel dimaksudkan untuk mengetahui banyaknya komponen antioksidan yang terekstrak dibandingkan dengan jumlah sampel yang digunakan. Selain rendemen, perlu dihitung pula kadar bahan kering ekstrak. Pengukuran kadar bahan kering ekstrak ini dilakukan dengan cara mengambil sejumlah ekstrak yang dimiliki dalam ukuran berat. Kemudian ekstrak tersebut ditempatkan pada cawan porselen yang bersih, dan bebas lemak, kering
oven serta sudah diketahui beratnya. Selanjutnya diiasukkan ke dalam oven dan dibiarkan hingga kering pada suhu 40°C. Penggunaan suhu 40°C dimaksudkan untuk mencegah terjadinya perubahan kimia yang tidak diinginkan pada sampel. Suhu ini relatif aman serta mencegah terjadinya kerusakan pada senyawa metabolit sekunder tertentu, khususnya senyawa flavonoid. Flavonoid merupakan golongan senyawa fen01 yang memiliki sistem aromatik terkonjugasi. Sistem aromatik terkonjugasi ini mudah rusak pada suhu tinggi. Selain itu, beberapa golongan fenolik memiliki ikatan glikosida dengan molekul gula. Ikatan glikosida ini akan mudah rusak dan putus pada suhu tinggi. Hasil penghitungan kadar bahan
kering ekstrak sayuran indigenous sebagaimana dapat dilihat pada Tabel 3 dan Lampiran 4.
Dari hasil penghitungan rendemen ekstrak diketahui bahwa rendemen terbesar dihasilkan dari ekstrak daun katuk sedangkan rendemen terendah adalah dari bunga kecombrang. Hasil penelitian yang dilakukan oleh Batari (2007) diketahui bahwa daun katuk mempunyai kandungan flavonoid yang terdiri dari senyawa flavone dan flavonol sebesar 142.64 mg/100 g sample segar. Kandungan flavonoid yang dimiliki oleh daun katuk mempunyai nilai tertinggi jika dibandingkan dengan sayuran indigenous yang lain yang diujikan pada penelitian ini. Sedangkan bunga kecombrang mempunyai kandungan flavonoid sebesar 1.18 mg/100 g sample segar. Kandungan flavonoid yang terdapat pada bunga kecombrang merupakan nilai kedua terendah setelah krokot. Tingginya Tabel 3. Hasil pengamatan karakterisasi sifat fisik dan kimia ekstrak antioksidan
sayuran indigenous Jenis Ekstrak Beluntas Kenikir Mangkokan Kemangi Pohpohan Katuk Antanan Ginseng Kedondong C i a Bunga Kecombrang Kmkot Warna Ekstrak Hijau Tua Hijau Tua Hujau Hijau Hijau Hijau Hijau Hijau Hijau M m h Kecoklatan Hijau Kadar Bahan Kering (% b k) 93.68 f 1.04 98.43 + 1.12 94.35 i 0.95 98.37
+
1.19 98.29% 1.38 98.83 i 0 . 5 6 91.17i0.70 98.17+
0.91 95.83 + 3.05 94.60+
3.06 93.60 0.04 Rendemen (%) Sampel Segar 1.90+0.03 2.29 f.O.11 3.35 0.1 1 1.38i0.08 1.12 i 0 . 0 4 4 . 8 8 i 0.15 2.58k0.15 1.57 2 0.03 2.95 + 0.13 0.91+
0.13 2.26 f 0.09 Sampel Bubuk 21.59+ 1.36 26.07+ 1.99 30.07 if: 0.73 18.18 f 0.47 15.04 f 0.47 38.39 i 0.92 3 4 . 0 6 i 1.75 26.92 & 1.50 33.63 + 2.80 14.04 2 1.38 31.22+
0.33kandungan flavonoid dari katuk inilah ymg menyebabkan daun katuk mempunyai rendemen tertinggi.
Hasil perhitungan kadar bahan kering ekstrak antioksidan diketahui bahwa daun katuk menghasilkan kadar bahan kering ekstrak tertinggi yaitu sebesar 98.84 mg/100g ekstrak jika dibandiigkan ekstrak antioksidan yang lainnya. Sedangkan ekstrak bahan kering terendah dimiliki oleh antanan yaitu sebesar 91.89 mg/100 g ekstrak. Tingginyz kandungan bahan kering ekstrak pada daun katuk berkaitan dengan tingginya kandungan senyawa flavonoid yang dirniliki oleh daun katuk yaitu sebesar 142.64 mg/100 g sample segar.
Analisis Data Hubungan Nilai Total Fenol Ekstrak Antioksidan dengan Kapasitas Antioksidan
Analisis Total Fenol dan Kapasitas Antioksidan Sayuran Indigenous
Penentuan total fenol pada setiap ekstrak dilakukan untuk menentukan kadar senyawa fenol yang terdapat dalam setiap ekstrak. Flavonoid mempakan golongan senyawa fenol terbesar yang terdapat di alam, sehingga penentuan total fenol bertujuan untuk mengetahui kadar fenol yang terdapat dalam setiap ekstrak.
Kandungan senyawa fenolik pada ekstrak sayuran indigenous di uji dengan menggunakan reagen Folin - Ciocalteu dan pengukuran dilakukan pada panjang gelombang 760 nm. Hasil yang diperoleh dinyatakan sebagai ekivalen asam galat (GAE). Asam galat merupakan standar untuk mengukur sampel pada makanan atau minuman yang diperkirakan mengandung senyawa fenol. Pengujian ini dilakukan karena senyawa fenolik berkontribusi langsung terhadap kapasitas antioksidan. Nilai absorbansi yang temkur menyatakan intensitas senyawa fenol yang terdapat pada sampel. Semakin besar nilai absorbansi yang dihasilkan maka kandungan senyawa fenol pada ekstrak sayuran tersebut semakin tinggi.
Folin : Mo (VI) bx,i,,)
+
e- (dari AH)--+
Mo(V) (tinr)Tabel 4 dan Lampiran 9 menunju'xkan bahwa kapasitas antioksidan ekstrak d a m beluntas (86.65%) > ekstrak daun kenikii (84.13%) > ekstrak bunga kecombrang (32.13%) > ekstrak antanan (27.29%) > ekstrak daun kemangi (213.72%) > ekstrak daun pohpohan (21.51%) > ekstrak krokot (21.18%) > ekstrak daun mangkokan (19.54%) > ekstrak daun ginseng (16.90%) > ekstrak daun kedondong cina (9.55%) 2 ekstrak daun katuk (7.1 1%).
Secara spesifik dikatakan bahwa suatu senyawa dikatakan mempunyai aktivitas antioksidan sangat kuat jika mampu menghambat perkembangan r a d i a l bebas lebih dari 80%, dikatakan sedang jika mampu menghambat sebesar 50-80%, dan dikatakan lemah jika mempunyai kemampuan penghambatan kurang dari 50%. Berdasarkan data pada Tabel 4 dapat diketahui bahwa ekstrak daun beluntas dan ekstrak daun kenikir mempunyai aktivitas antioksidan yang sangat h a t , ha1 ini ditunjukkan dengan kemampuannya menghambat perkembangan radikal bebas lebih dari 80%. Sedangkan ekstrak sample lainnya mempunyai aktivitas dibawah 50% yang berarti mempunyai aktivitas antioksidan yang lemah. Tingginya kemampuan antioksidan pada ekstrak daun beluntas dan kenikir disebabkan karena terdapatnya senyawa quercetin dalam eksttak tersebut sebagaimana dapat dilihat pada Tabel 1. Quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan merupakan komponen yang paling aktif dan paling kuat dibanding senyawa yang laimya (Fuhnnan dan Aviram, 2002).
Berdasarkan data pada Tabel 4 dan Lampiran 9 dapat dilihat bahwa kapasitas antioksidan yang dinyatakan dalam TEAC diketahui bahwa nilai terendah yaitu sebesar 45.08 pmol trolox ekivalen dengan penghambatan radikal DPPH sebesar 7.11% ditunjukkan pada ekstrak daun katuk dan nilai tertinggi yaitu sebesar 1195.14 pmol trolox ekivalen dengan penghambatan DPPH sebesar 86.65% ditunjukkan pada eksttak daun beluntas. Ekstrak daun beluntas pada konsentrasi 100 ppm mampu menghambat oksidasi DPPH sebesar 86.65 %, nilai tersebut ekivalen dengan 0.84 pmol trolox. Sedangkan pada konsentrasi yang sama untuk ekstrak daun katuk menunjukkan rendahnya aktivitas antioksidan yaitu hanya sebesar 7.1 1%, nilai ini ekivalen dengan 0.07 pmol trolox.
Hasil yang sama juga ditunjukkan pada kapasitas antioksidan yang dinyatakan sebagai nilai TEAC (Tabel 4, Lampiran 9 dan 10). Kapasitas antioksidan ekstrak daun beiuntas mempunyai nilai TEAC tertinggi baik yang
diuji dengan radikal DPPH (1195.14 p o l TEACImg ekstrak) maupun dengan r a d i a l ABTS (46.42 pnol TEAC/mg ekstrak) kemudian diikuti oleh ekstrak daun keniku dengan nilai TEACtDPPH sebesar 902.66 p o l TEACImg ekstrak dan nilai TEACIABTS sebesar 37.99 p o l TEACImg ekstrak. Sedangkan kapasitas antioksidan dengan nilai TEAC terendah ditunjukkan pada ekstrak krokot yaitu sebesar 79.40 p o l TEACImg ekstrak yang diuji dengan radikal bebas DPPH dan sebesar 7.59 p o l TEACImg ekstrak yang diuji dengan radikal bebas ABTS.
Hasil penelitian yang dilakukan oleh Batari (2007) sebagaimana dapat dilihat pada Tabel 1 menunjukkan bahwa daun beluntas mengandung senyawa flavonoid miricetin (0.88 mgI100 g sample segar), quercetin (5.46 mgI100 g sample segar) dan kaempferol (0.19 mhf100 g sample segar). Sedangkan daun kenikir mengandung quercetin (54.56 mgI100 g sample segar) d m kaempferoi (0.79 mg1100 g sample segar). Berdasarkan kandungan flavonoid tersebut dapat dijelsskan bahwa kandungan quercetin daun kenikii Iebih tinggi dibandingkan quercetin pada daun beluntas namun daun kenikir mempunyai kandungan kaempferol yang lebih tinggi dibandingkan dengan kaempferol pada daun beluntas. Struktur yang memungkinkan aktivitas scavenging radikal dari flavonoid adalah adanya 3,4-hidroksil pada cincin B yang berperan sebagai donor elektron dan menjadi target radikal. Orto-dihidroksilasi dari cincin B berkontribusi terhadap aktivitas antioksidan. Struktur para quinol pada cincin B memberikan aktivitas yang lebih tinggi dibandingkan orto quinol. Sementara konfigurasi meta tidak memiliki efek terhadap aktivitas antioksidan (Pratt, 1992). Senyawa kaempferol tidak memiliki gugus 3,4-hidroksil pada cincin B, oleh karena itu adanya kandungan kaempferol dapat menyebabkan penurunan aktivitas a n t i o k ~ i d ~ .
Pada pengujian kemampuan mereduksi (reducing power) diperoleh hasil bahwa ekstrak daun kenikir mempunyai kemampuan mereduksi yang paling tinggi, diikuti oleh ekstrak daun beluntas, pohpohan, antanan, kemangi, katuk, bunga kecombrang, kedondong cina, ginseng, dan krokot. Tingginya kemampuan mereduksi dari ekstrak daun kenikir disebabkan adanya kandungan quercetin pada ekstrak tersebut.
Pengujian kapasitas antioksidan yang lain dari sayliran indigenous ditunjukkan dari kemampuannya menghambat proses oksidasi lipid lanjut.
Hidroperoksida asam linoleat (LOOH) merupakan salah satu produk primer oksidasi asam linoleat yang mampu mengoksidasi Fez+ menjadi Fe3'. Reaksi oksidasi yang dikemukakan oleh Fenton di dalam Mathews (2000) adalah sebagai berikut:
LOOH
+
~ e ' ++
2 K+
L(0Hfi+
Fe3+Pada pengujian ini, reaksi antara Fe3+ hasil oksidasi FeClz oleh hidroperoksida dengan S C N menghasilkan senyawa kompleks benvarna merah FeFe(SCN)6] dengan serapan maksimum pada panjang gelombang 500 nm.
2 Fe3+
+
6 S C N--+
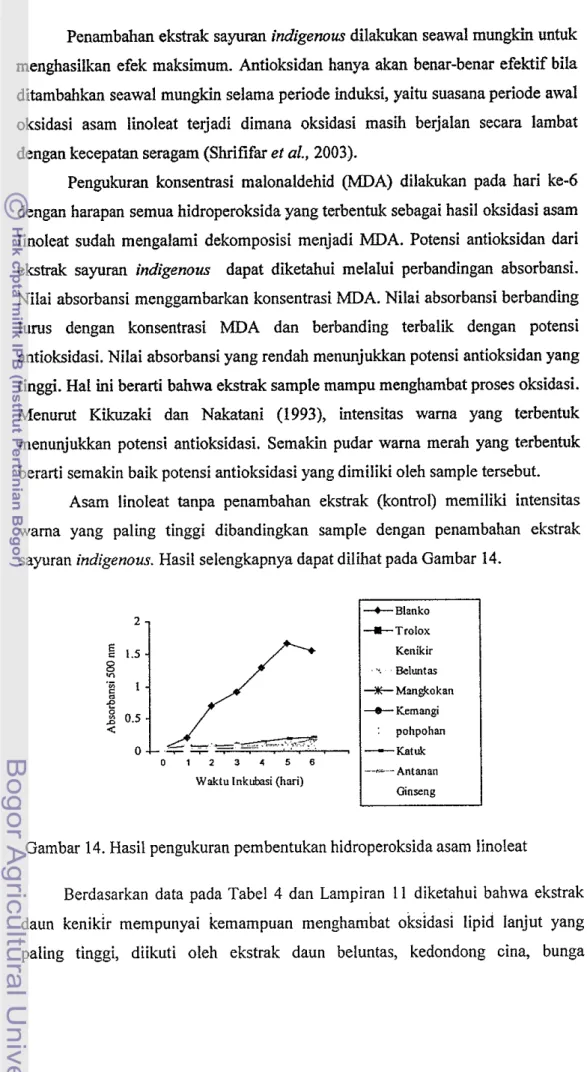
Fepe(SCN)6]Absorbansi dari kompleks berwarna merah tersebut berbanding lurus dengan konsentrasi malonaldehid yang terbena.. Oleh karena itu dilakukan pengukuran absorbansi setiap 24 jam hingga tercapai absorbansi maksimum. Hasil analisis ini sebagaimana dapat dilihat pada Gambar 14 dan Lampiran 11.
Beberapa faktor yang mempengamhi autooksidasi asam linoleat adalah panas, pH, cahaya, oksigen, ion logam katalitik, dan radikal lipid itu sendiri (Buck, 1991). Pada sistem ini, asam linoleat ditempatkan pada botol gelap bertutup kemudian diinkubasi selama 6 hari pada suhu 40°C. Inkubasi sampel dikondisikan sedemikian rupa sehingga hanya panas, oksigen, pH dan radikal lipid yang mempengaruhi oksidasi asam linoleat.
Pada tahap awal oksidasi asam linoleat (fase lag) akan terbentuk hidroperoksida. Selanjutnya diikuti tahap propagasi dimana kadar hidroperoksida terus meningkat dan mencapai nilai maksimum pada hari ke-5. Kemudian disusul dengan tahap terminasi dimana hidroperoksida akan mengalami dekomposisi membentuk malonaldehid.
Menumt Chen (1996) nilai absorbansi pada hari ke-0 hams dibawah 0.3, karena jika absorbansinya lebih dari 0.3 menunjukkan asam linoleat telah rusak (teroksidasi). Waktu selama absorbansi masih di bawah 0.3 dinyatakan sebagai periode induksi dari autooksidasi lipida Periode induksi juga menunjukkan lamanya tahap inisiasi berlangsung.
Penambahan ekstrak sayuran indigenous dilakukan seawal mungkii untuk menghasilkan efek maksimum. Antioksidan hanya akan benar-benar efektif bila ditambahkan seawal mungkin selama periode induksi, yaitu suasana periode awal oksidasi asam linoleat terjadi dimana oksidasi masih berjalan secara lambat dengan kecepatan seragam (Shriftfar et al., 2003).
Pengukuran konsentrasi malonaldehid (MDA) dilakukan pada hari ke-6 dengan harapan semua hidroperoksida yang terbentuk sebagai hasil oksidasi asam linoleat sudah mengalami dekomposisi menjadi MDA. Potensi antioksidan dari ekstrak sayuran indigenous dapat diketahui melalui perbandingan absorbansi. Nilai absorbansi menggambarkan konsentrasi MDA. Nilai absorbansi berbanding lums dengan konsentrasi MDA dan berbanding terbalik dengan potensi antioksidasi. Nilai absorbansi yang rendah menunjukkan potensi antioksidan yang tinggi. Hal ini berarti bahwa ekstrak sample mampu menghambat proses oksidasi. Menurut Kikuzaki dan Nakatani (1993), intensitas warna yang terbentuk menunjukkan potensi antioksidasi. Semakin pudar warna merah yang terbentuk berarti semakin baik potensi antioksidasi yang dimiliki oleh sample tersebut.
Asam linoleat tanpa penambahan ekstrak (kontrol) memiliki intensitas wama yang paling tinggi dibandingkan sample dengan penambahan ekstrak sayuran indigenous. Hasil selengkapnya dapat dilihat pada Gambar 14.
+Blank0 1.5
5
'r Belunta~ +Mangkakan t Kemangi3
0.5 : pohpohan ' -Kat"k 0 1 2 3 4 5 6 -.,--. AntananWaktu lnkutasi (hixi)
Ginwng
Gambar 14. Hasil pengukuran pembentukan hidroperoksida asam linoleat
Berdasarkan data pada Tabel 4 dan Lampiran 11 diketahui bahwa ekstrak daun kenikir mempunyai kemampuan menghambat oksidasi lipid lanjut yang paling tinggi, diikuti oleh ekstrak daun beluntas, kedondong cina, bunga
kecombrang, mangkokan, pohpohan, ginseng, kemangi, krokot, antanan dan yang paling rendah adalah ekstrak daun katuk.
Hubungan Nilai Total Fenol dengan Kapasitas Antioksidan Sebagai Radikal Scavenger
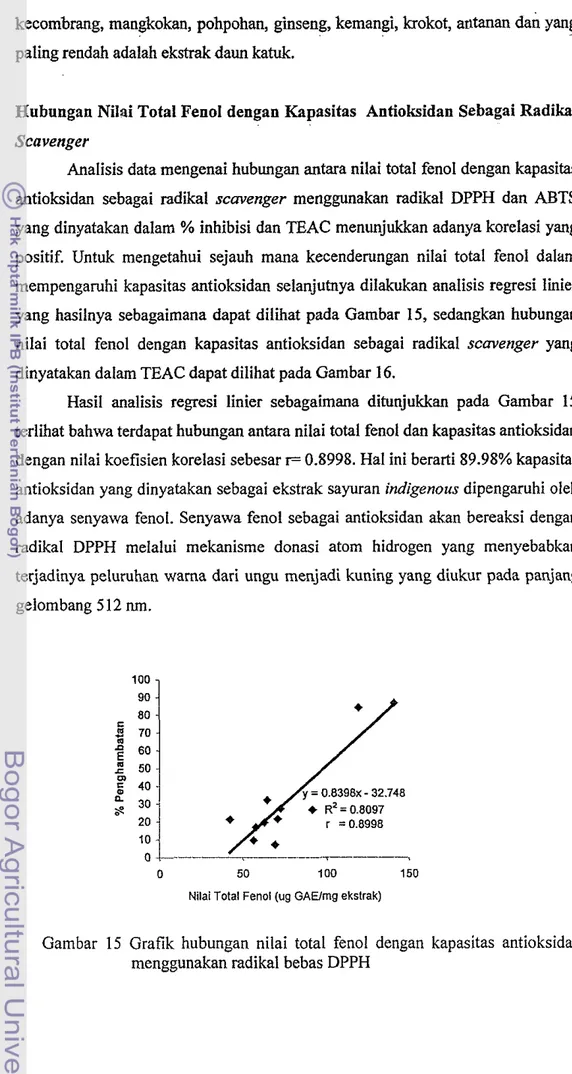
Analisis data mengenai hubungan antara nilai total fenol dengan kapasitas antioksidan sebagai radikal scavenger menggunakan radial DPPH dan ABTS yang dinyatakan dalam % inhibisi clan TEAC menunjukkan adanya korelasi yang positif. Untuk mengetahui sejauh mana kecenderungan nilai total fenol dalam mempengaruhi kapasitas antioksidan selanjutnya dilakukan analisis regresi linier yang hasilnya sebagaimana dapat dilihat pada Gambar 15, sedangkan hubungan nilai total fenol dengan kapasitas antioksidan sebagai radikal scavenger yang dinyatakan dalam TEAC dapat dilihat pada Gambar 16.
Hasil analisis regresi linier sebagaimana ditunjukkan pada Gambar 15 terlihat bahwa terdapat hubungan antara nilai total fenol dan kapasitas antioksidan dengan nilai koefisien korelasi sebesar I= 0.8998. Hal ini berarti 89.98% kapasitas
antioksidan yang dinyatakan sebagai ekstrak sayuran indigenous dipengaruhi oleh adanya senyawa fenol. Senyawa fenol sebagai antioksidan &an bereaksi dengan radikal DPPH melalui mekanisme donasi atom hidrogen yang menyebabkan terjadinya peluruhan wama dari ungu menjadi kuning yang diukur pada panjang gelombang 5 12 nm.
0 50 100 150
Nilai Total Fenol (ug GAOmg ekslrak)
Gambar 15 Grafik hubungan nilai total fenol dengan kapasitas antioksidan menggunakan radikal bebas DPPH
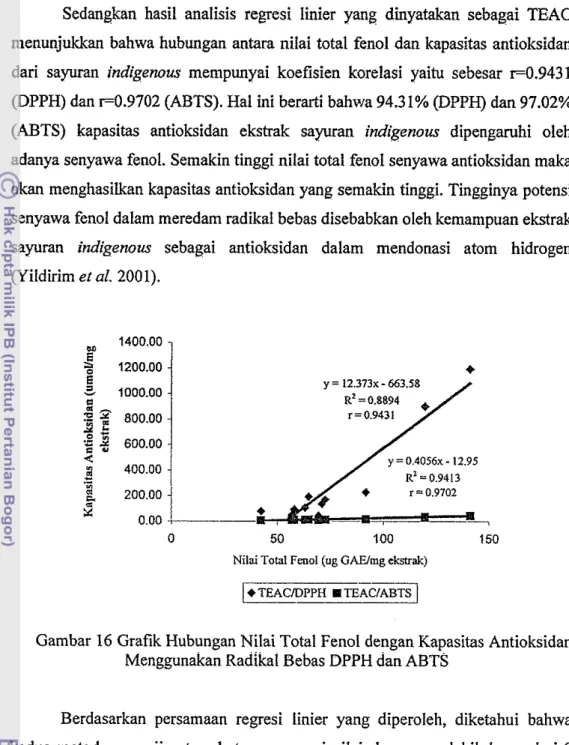
Sedangkan hasil analisis regresi linier yang dimyatakan sebagai TEAC menunjukkan bahwa hubungan antara nilai total fenol dan kapasitas antioksidan dari sayuran indigenous mempunyai koefisien korelasi yaitu sebesar ~ 0 . 9 4 3 1
@PPH) dan ~ 0 . 9 7 0 2 (ABTS). Hal ini berarti bahwa 94.3 1% (DPPH) dan 97.02%
(ABTS) kapasitas antioksidan ekstrak sayuran indigenous dipengaruhi oleh adanya senyawa fenol. Semakin tinggi nilai total fenol senyawa antioksidan maka akan menghasikan kapasitas antioksidan yang semakin tinggi. Tingginya potensi senyawa fenol dalam meredam radikal bebas disebabkan oleh kemampuan ekstrak sayuran indigenous sebagai antioksidan dalam mendonasi atom hidrogen (Yildirim et al. 2001).
0 50 100 150
Nil& Total F a a l (ug GAElmg ckstrak)
Gambar 16 Grafik Hubungan Nilai Total Fenol dengan Kapasitas Antioksidan Menggunakan Radikal Bebas DPPH dan ABTS
Berdasarkan persamaan regresi linier yang diperoleh, diketahui bahwa kedua metode pengujian tersebut mempunyai nilai slope yang lebih besar dari 0 (slope > 0). Hal ini berarti bahwa kapasitas antioksidan (Y) tergantung pada nilai total fenol (X). Perhitungan matematis memperlihatkan bahwa kapasitas antioksidan sebagai radikal scavenger yang diuji dengan metode DPPH mempunyai nilai slope yang lebih tinggi yaitu 12.373 dibandingkan dengan metode AE3TS yaitu 0.4056. Nilai slope yang lebih tinggi menunjukkan bahwa ekstrak antioksidan dinilai kurang mampu meredam radikal bebas DPPH dibandingkan dengan radikal bebas ABTS untuk membentuk senyawa yang lebih
stabil. Pada Gambar 16 terliat bahvra keinampuan ekstrak daun beluntas dalam menghambat perkembangan radikal bebas DPPH setara dengan 1195.14 pmol trolox/mg ekstrak. Nilai ini jauh lebih tinggi jika dibandingkan kemampuan ekstrak daun beluntas dalam menghambat perkembangan radikal ABTS yaitu setara dengan 46.42 jmol trolox/mg ekstrak. Untuk melihat sejauh mana nilai slope berpengaruh terhadap kemampuan meredam radikal bebas dilakukan analisis varian pada a = 0.05. Hasil perhitungan menunjukkan bahwa nilai slope untuk kedua persamaan regresi diatas berpengamh terhadap besar kecilnya kapasitas antioksidan. Wang et al. (1998) mengatakan bahwa suatu senyawa yang mempunyai aktivitas penghambatan terhadap radikal bebas ABTS tidak menunjukkan kemampuan penghambatan terhadap radikal DPPH, dan Arts et al. (2004) menemukan bahwa suatu senyawa yang mampu menghambat radikal ABTS akan mempunyai kapzsitas antioksidan yang lebih tinggi.
Berdasarkan persamaan regresi linier pada Gambar 15 dan 16 diketahui bahwa kapasitas antioksidan sangat dipengamhi oleh konsentrasi senyawa phenolik yang terdapat dalam senyawa antioksidan. Aktivitas antioksidasi dari polifenol ini ditandai dengan aktivitas reaktif yang tinggi sebagai donor hydrogen atau elektron dan kemampuan dari turunan radikal polifenol untuk menstabilkan dan memindahkan elektron yang tidak berpasangan (fungsi pemutusan rantai).
Fungsi antioksidan flavonoid sebagai scavenger radikal bebas adalah dengan memberikan atom hidrogen pada radikal. Kapasitas antioksidan dari flavonoid berhubungan dengan stmktur flavonoid. Secara umum, aktivitas
scavenging radikal flavonoid tergantung pada stmktur molekuler dan bentuk substitusi dari gugus hidroksil. Aktivitas stmktur (structure-activity relationship)
dari flavonoid penting diketahui yaitu jumlah dan lokasi gugus OH yang berperan dalam menetralkan radikal bebas. Struktur yang memungkinkan aktivitas
scavenging radikal dari flavonoid adalah adanya 3,4-dihidroksil misalnya o-
dihidroksil (stmktur katekol) pada cincin B, berperan sebagai donor elektron dan menjadi taiget radikal. Struktur 3-OH dari cincin C juga menguntungkan untuk kapasitas antioksidan flavonoid. Konjugasi ikatan rangkap pada C2-C3 dengan 4- keto, berperan untuk delokalisasi elektron cincin B, meningkatkan kapasitas
scavenging radikal. Juga adanya gugus 3-OH dan 5-OH dalam kombinasi dengan fungsi 4-karbonil dan ikatan rangkap C2-C3 menaikkan aktivitas scavenging
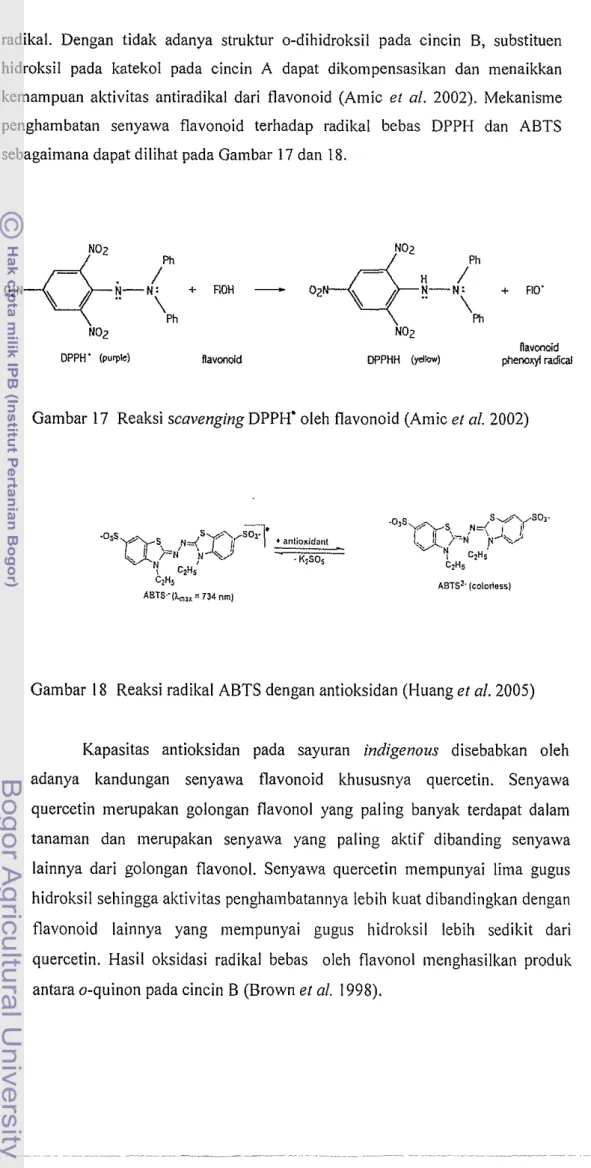
radikal. Dengan tidak adanya struktur o-dihidroksil pada cincin B, substituen hidroksil pada katekol pada cincin A dapat dikompensasikan dan menaikkan kemampuan aktivitas antiradikal dari flavonoid (Amic et 01. 2002). Mekanisme penghambatan senyawa flavonoid terhadap radikal bebas DPPH dan ABTS sebagaimana dapat dilihat pada Gainbar 17 dan 18.
"N: + F:OH
-
+ FIO'\
Ph Ph
NO2 NO2
Aavonoid
DPPH' (PUP!=) Aavonoid OPPHH ( y e l h l phmxyl mdld
Gambar 17 Reaksi scavenging DPPH' oleh flavonoid (Amic e l nl. 2002)
Gambar 18 Reaksi radikal ABTS dengan antioksidan (Huang et nl. 2005)
Kapasitas antioksidan pada sayuran indigenous disebabkan oleh adanya kandungan senyawa flavonoid khususnya quercetin. Senyawa quercetin merupakan golongan flavonol yang paling banyak terdapat dalam tanaman dan rnerupakan senyawa yang paling aktif dibanding senyawa lainnya dari golongan flavonol. Senyawa quercetin mempunyai lima gugus hidroksil sehingga aktivitas pengharnbatannya lebih kuat dibandingkan dengan flavonoid lainnya yang rnempunyai gugus hidroksil lebih sedikit dari quercetin. Hasil oksidasi radikal bebas oleh flavonol inenghasilkan produk antara o-quinon pada cincin B (Brown et 01. 1998).
Hubungan Nilai Total Fenol dengan Kemampuan Mereiluksi Antioksidan
Kemampuan mereduk,i merupakan salah satu indikator yang digunakan untuk mengetahui potensi kapasitas antioksidan (Meir et al., 1995). Pada pengujian ini, keberadaan antioksidan dalam sampel akan mereduksi Fe3+/ferisianida komplek menjadi ion Fe2+. Pembentukan Fez+ dapat dilihat dengan menguhvr warna biru Prussian pada 700 nm. Ptrningkatan absorbansi mengindikasikan adanya peningkatan kemampuan mereduksi. Persamaan reaksi yang terjadi adalah sebagai berikut:
Prussian Blue : F ~ ( c N ) ~ ~ -
+
ArOH---+
F ~ ( c N ) ~+
ArO
+
H+ F ~ ( c N ) ~ ~ -+
Fe3+ + K++
KFe[Fe(CN)6]L,
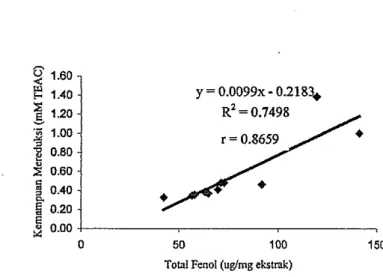
= 700 nrnHasil analisis data mengenai hubungan antara nilai total fenol dengan kemampuan mereduksi antioksidan menunjukkan adanya korelasi yang positif. Untuk mengetahui sejauh mana kecenderungan nilai total fenol masing- masing ekstrak pada pengujian kemampuan mereduksi antioksidan dilakukan analisis regresi linier yang hasilnya dapat dilihat pada Gambar 19. Hasil analisis regresi linier menunjukkan bahwa terdapat hubungan antara nilai total fenol dengan kemampuan mereduksi antioksidan yang ditunjukkan dengan nilai koefisien korelasi (r) sebesar 0.8659. Hal ini berarti bahwa 86.59% kemampuan mereduksi antioksidan dipengaruhi oleh nilai total fenol yang terkandung dalam ekstrak sayuran indigenous. Hasil penelitian yang dilakukan oleh Yildirim et al. (2005) menyatakan bahwa semakin tinggi nilai total fenol ekstrak maka kemampuan mereduksi atau kapasitas mereduksi akan semakin meningkat. Kemampuan mereduksi suatu senyawa berhubungan dengan kemampuan senyawa tersebut untuk melepaskan elektron. Lebih jauh dikatakan bahwa kemampuan mereduksi merupakan indikator yang potensial untuk menyatakan aktivitas antioksidan.
2
0.W -10 50 100 150
Total Fenol (uglmg ebtcak)
Gambar 19 Grafk hubungan nilai total fenol dengan kemampuan mereduksi
Menumt Lucarini el a1 (2002), jumlah, jenis serta lokasi substituen dari senyawa fenolik sangat berpengamh tzrhadap kekuatan ikatan A-H pada fenol. Terdapatnya substituen/gugus pada posisi orto dan para pada senyawa fenolik dapat meningkatkan densitas elektron pada gugus hidroksii melalui efek induktif. Peningkatan densitas elekeon pada OH akan Inenu~tIkan energi ikat oksigen- hidrogen sehingga berakibat pada meningkatnya reaktivitas senyawa tersebut. Disamping itu, gugus hidroksi yang terdapat pada senyawa fenolik berperan dalarn menumnkan energi disosiasi ikatan senyawa fenol. Oleh karena itu adanya substituen-substituen tersebut menghasilkan senyawa dengan rendah.
Hasil penelitian yang dilakukan oleh Batari (2007) menunjukkan bahwa senyawa flavonoid yang banyak terdapat pada sayuran indigenous adalah quercetin. Quercetin mempunyai lima gugus hidroksil yang dapat beperan dalam menumnkan energi disosiasi ikatan. Semakin rendah nilai suatu senyawa maka akan semakin reaktif.
Hubungan Nilai Total Fenol dengan Kapasitas Antioksidan sebagai Penghambat Oksidasi Lipid Lanjut
Hasil pengujian memperlihatkan bahwa ekstrak sayuran indigenous mempunyai daya penghambatan pembentukan malonaldehid (MDA) yang cukup tinggi. Tingginya daya penghambatan pembentukan malonaldehid (MDA) ini menegaskan bahwa sayuran indigenous mampu menghambat oksidasi asam linoleat. Hubungan antara nilai total fenol dari ekstrak sayuran indigenous dengan
kapasitas antioksidan sebagai penghambatan oksidasi lipid lanjut menunjukkan adanya korelasi yang positif. Hal ini berarti bahwa terdapat hubungan antara nilai total fenol dengan daya penghambatan pembentukan MDA menggunakan metode
TBA. Untuk mengetahui sejauh mana nilai total fenol dalam menghambat pembentukan malonaldehid selanjutnya dilakukan analisis regresi linier yang hasilnya sebagaimana dapat dilihat pada Gambar 20.
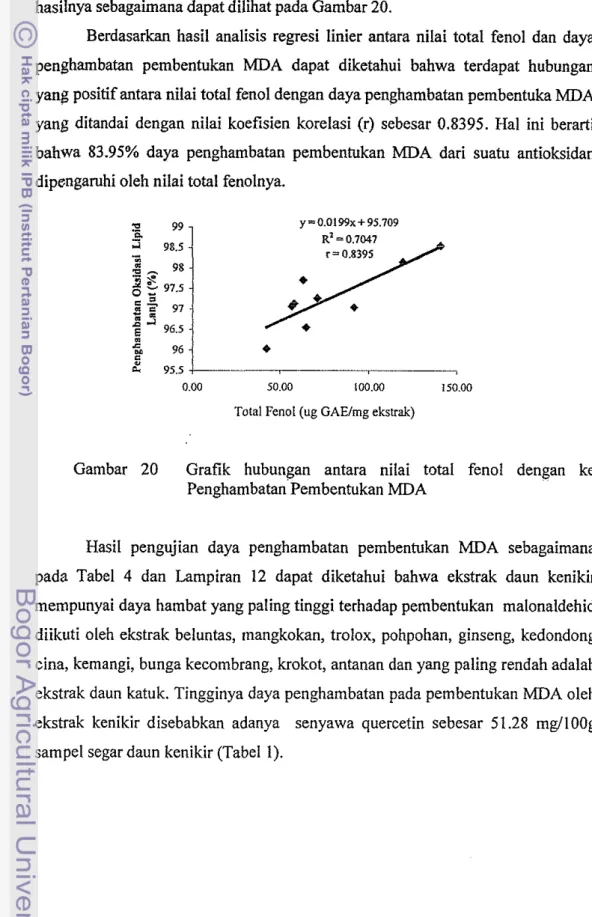
Berdasarkan hasil analisis regresi linier antara nilai total fenol dan daya penghambatan pembentukan MDA dapat diketahui bahwa terdapat hubungan
yang positif antara nilai total fenol dengan daya penghambatan pembentuka MDA
yang ditandai dengan nilai koefisien korelasi (r) sebesar 0.8395. Hal ini berarti bahwa 83.95% daya penghambatan pembentukan MDA dari suatu antioksidan
dipengamhi oleh nilai total fenolnya.
O.W 50.W 1W.W 150.00
Total Fenol (ug GAEImg ekstrak)
Gambar 20 Grafik hubungan antara nilai total fenol dengan ke Penghambatan Pembentukan MDA
Hasil pengujian daya penghambatan pembentukan MDA sebagaimana
pada Tabel 4 dan Lampiran 12 dapat diketahui bahwa ekstrak daun kenikir mempunyai daya hambat yang paling tinggi terhadap pembentukan malonaldehid diikuti oleh ekstrak beluntas, mangkokan, trolox, pohpohan, ginseng, kedondong cina, kemangi, bunga kecombrang, krokot, antanan dan yang paling rendah adalah ekstrak daun katuk. Tingginya daya penghambatan pada pembentukan MDA oleh
ekstrak kenikir disebabkan adanya senyawa quercetin sebesar 51.28 mg/100g sampel segar daun kenikir (Tabel 1).
Dari hasil pengujian daya hambat pembeatukan malonaldehid pada oksidasi asam lemak, diduga bahwa sayuran indigenous mempakan antioksidan primer yang mampu memutuskan rantai radikal-radikal peroksil menghasilkan senyawa yang lebih stabil. Hal h i sesuai dengan teori yang dikemukakan oleh Hudson (1990) yang menyatakan bahwa senyawa fenol terutama flavonoid mempakan antioksidan primer yang mampu bereaksi dengan radikal-radikal peroksil menghasilkan produk-produk yang lebih stabil.
Pada reaksi oksidasi lipid, antioksidan primer atau pemutus rantai, menangkap radikal bebas lipid (radial peroksil, ROO') sehingga menghambat tahap propagasi dalam reaksi oksidasi lipid (Maslarova, 2001). Reaksi antara antioksidan fenolik hindered (terintangi) dan radikal lipid menghasilkan pembentukan radikal fenoksil. Radikal fenoksil distabilkan oleh delokalisasi elektron dalam cinch aromatik serta oleh gugus alkil pada posisi orto (Rajalaksmi dan Narasimhan, 1996). Stabilitas radikal fenoksil juga dapat mereduksi laju propagasi reaksi berantai karena tahap propagasi dari radikal antioksidan berlangsung lambat dibandingkan dengan radikal lipid. Menurut Gordon (1990) efektivitas antioksidan senyawa fenolik tergantung pada konsentrasinya. Pada konsentrasi yang tinggi, antioksidan fenolik dapat bersifat prooksidan. Hal tersebut disebabkan keterlibatan dalam menginisiasi reaksi oksidasi.
Mekanisme lain dari aktivitas antioksidasi substansi fenolik adalah kemampuan dari flavonoid untuk mencegah peroksidasi dengan memodifikasi pengemasan lipid dan penurunan fiuiditas membran. Perubahan ini dapat menghambat difusi radikal bebas dan memutuskan reaksi peroksidasi. Penelitian akhir-akhir ini menunjukkan bahwa substansi fenolik terlibat dalam scavenging
hidrogen peroksida di dalam slel tumbuhan (Blokhina et al. 2003).
Hubungan Kemampuan Mereduksi dengan Kapasitas antioksidan sebagai Radikal Scavenger
Hubungan kemampuan mereduksi ekstrak sayuran indigenous dengan kapasitas antioksidan sebagai radikal scavenger menunjukkan adanya korelasi yang positif. Untuk melihat sejauh mana kecenderungan kemampuan mereduksi tnasing-masing ekstrak antioksidan dalam mempengaruhi kapasitas antioksidan
di!akukan analisis regresi yang hasilnya dapat diiihat pada Gambar 21 dan Gambar 22. Pada Gambar 20 terlihat bahwa hasil analisis regresi linier menunjukkan b a h ~ d korelasi antara kemampuan mereduksi dan kapasitas antioksidan dari sayuran indigenozrs yang diuji dengan menggunakan radikal DPPH mempunyai mempunayi koefisien korelasi (r) sebesar 0.8943.
0
- -v
0.00 0.50 1.00 1.50 2.00
Kmampuan Mercduksi (mM TEAC)
Gambar 21 Grafik hubungan kemampuan mereduksi dengan kapasitas antioksidan menggunakan radika! DPPH
Sedangkan pada Gambar 22 terlihat bahwa hasil analisis regresi linier mengenai hubungan kemampuan mereduksi dan kapasitas antioksidan sebagai radikal scavenger yang dinyatakan sebagai TEAC (DPPH dan ABTS) mempunyai koefisien korelasi yaitu 1-0.8992 (DPPH) dan r0.9033 (ABTS). Hal ini berarti bahwa 89.92% @PPH) dan 90.33% (ABTS) kapasitas antioksidan ekstrak sayuran indigenous sebagai radikal scavenger dipengaruhi oleh kemampuan antioksidan tersebut dalam mereduksi ion menjadi ion ~ e " .
Berdasarkan persamaan regresi linier yang diperoleh, diketahui bahwa kedua metode pengujian tersebut mempunyai nilai slope yang lebih besar dari 0 (slope z 0). Hal ini berarti bahwa kapasitas antioksidan (Y) tergantung pada kemampuan mereduksi senyawa antioksidan tersebut (X).
1400
5
y = 1035.4~ - 27359-
1200 j m 1000 : in r - 0 U 800 , .- I2
5
600 i . = 33 142r + 0.26Si in 3 4001
.-
in rn 1 = 0 9033 200 :z
0.00 0.50 1.00 1 5 0Kemampuan mereduksi (mM TEAC) ,.. . .. . . .~ .. -~
I
*
TEACIOPPH kS T E A C I A B ~-.--. -. .... -~ .. -~~ ~
Ga~nbar 22 Grafik hubungan kemampuan mereduksi dengan kapasitas antioksidan sebagai radikal sca~lenger.
Perhitungall mateinatis memperlihatkan bahwa kapasitas antioksidan sebagai radikal scavenger yang diuji de~igan rnetode DPPH mempunyai nilai slope yang lebih besar (1035.4) dibandingkan dengan metode ABTS (33.135). Nilai slope yang lebih besar menunjukkan bahwa ekstrak antioksidan dinilai kurang mampu mereduksi radikal bebas DPPH dibandingkan dengan radikal bebas ABTS untuk membentuk senyawa yang lebih stabil. Untuk rnelihat sejauh lnana nilai slope itu berpengaruh terhadap kemampuan mereduksi dari suatu antioksidan maka dilakukan analisis varian pada a = 0.05. Hasil perhitungan lnenunjukkan bahwa nilai slope untuk kedua persamaan regresi diatas berpengaruh terhadap besar kecilnya kapasitas antioksidan.
Metode ABTS' lebih baik dibandingkan dengan metode DPPH', ha1 ini disebabkan karena metode ABTS' dapat dioperasikan pada range pH yang besar, dan berkorelasi terhadap aktivitas antioksidan dalam system biologis serta lebih cepat dibandingkan dengan metode DPPH (Arts et al. 2004).
Semakin kuat kemampuan mereduksi suatu senyawa antioksidan maka kapasitas antioksidannya akan semakin tinggi atau dengan kata lain sernakin mudah antioksidan mereduksi ion ~ e ~ ' menjadi ion ~e~~ maka semakin besar kapasitas antioksidannya.
Dari hasil pengujian terhadap kemampuan mereduksi dan kapasitas antioksidan, diduga bahwa sayuran indigenous merupakan antioksidan primer
yang mampu mentransfer elektronnya menghasilkan senyawa yang lebih stabil. Suatu molekul dapat berfungsi sebagai antioksidan primer bila dapat mentranferkan elektronnya dengan cepat pada radikal dan radikal antioksidan yang dihasilkan bersifat lebih stabil. Adanya gugus alkil pada posisi 2,4,6 pada molekul fenol, dapat meningkatkan densitas elektron pada gugus hidroksil melalui efek induktif. Dengan demikian reaktifitas senyawa fenolik terhadap radikal akan meningkat. (Gordon, 1990).
Hubungan Kemampuan Mereduksi dengan Nilai Total Flavonol d a n Nilai Total Flavon
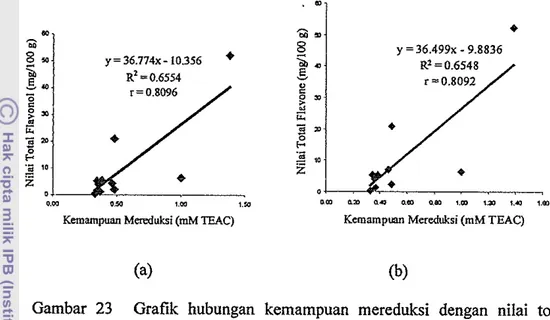
Nilai total flavonol dan juga nilai total flavonol dan flavon yang digunakan dalam analisis data untuk mengetahui hubungan antara kema~npuan mereduksi dengan nilai total flavonol dan juga nilai total flavonol dan flavon menggunakan data sekunder hasil penelitian Batari (2007) sebagaimana dapat dilihat pada Tabel 4. Pada Tabel 4 terlihat bahwa nilai total flavonol pada daun katuk (142.64 mg1100 g sampel segar) dan pada daun antanan (21.01 mgI100 g sampel segar). Nilai ini jauh lebih besar dibandingkan dengan nilai total flavonol daun lainnya. Oleh karena itu pada analisis ini kedua nilai tersebut
Hasil analisis data menunjukkan adanya korelasi pang positif antara ke~nanipuan mereduksi dengan nilai total flavonol dan juga dengan nilai total flavonol dan flavon. Untuk mengetahui sejauh mana kecenderungan nilai total flavonol dan juga nilai total flavonol dan flavon dari masing-masing ekstrak pada pengujian kema~npuan mereduksi antioksidan dilakukan analisis regresi linier yang hasilnya dapat dilihat pada Gambar 23. Hasil analisis regresi linier menunjukkan bahwa terdapat hubungan antara kemampuan mereduksi dengan nilai total flavonol (23a) dan juga nilai total flavonol dan flavon (23b) yang menghasilkan koefisien korelasi sebesar masing-masing r = 0.8096 dan r = 0.8092. ha1 ini berarti bahwa 80.96 % dan 80.92% ke~nampuan mereduksi antioksidan dipengaruhi oleh nilai total flavonol dan juga nilai total flavonol dan flavon yang terkandung dalam ekstrak. Aktivitas antioksidan dari flavonol dan flavon ditandai dengan aktivitas reaktif yang tinggi sebagai donor hidrogen atau elektron dan juga kemampuannya untuk menstabilkan serta memindahkan elektron yang tidak berpasangan. Aktivitas antioksidan dari flavonol dan flavon
berhubungan dengan struktur molekuler dan bentuk substitusi dari gugus hidroksilnya (Amic et al. 2002).
Kernampma M d u k s i (mM TEAC) Kcrnamptmn Mcredukai (mM TEAC)
Gambar 23 Grafik hubungan kemampuan mereduksi dengan nilai total flavonol (a) dan nilai total flavonol dan flavon (b)
Kapasitas antioksidan pada sayuran indigenous disebabkan oleh adanya kandungan senyawa flavonoid yaitu flavonol (quercetin, kaempferol dan miricetin) dan flavon (apigenin dan luteolin). Reaksi oksidasi senyawa flavonol dapat dilihat pada Gambar 24.
R = OH, quercetin; R = H, kaempferol.
Gambar 24. Hasil oksidasi radikal bebas DPPH oleh quercetin (Brown et al.