SKRIPSI
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
Oleh: OLGA YULIA
F24102024
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Olga Yulia. F24102024. Pengujian Kapasitas Antioksidan Ekstrak Polar, Nonpolar, Fraksi Protein dan Nonprotein Kacang Komak (Lablab purpureus (L.) sweet). Di bawah bimbingan Ir. Arif Hartoyo, MSi.
ABSTRAK
Indonesia merupakan negara yang kaya akan sumber hayati, salah satunya adalah kacang-kacangan. Kacang-kacangan dikenal sebagai sumber protein nabati, karbohidrat kompleks, oligosakarida, mineral, fitokimia dan serat pangan yang bermanfaat bagi tubuh. Selama ini, penelitian tentang kacang-kacangan masih relatif sedikit kecuali kacang kedelai. Oleh karena itu, perlu dilakukan eksplorasi terhadap jenis kacang-kacangan yang lain, salah satunya adalah kacang komak (Lablab purpureus (L.) sweet).
Berdasarkan penelitian Khodijah (2003); Purnamasari (2002); dan Suwarno (2003), kacang komak telah terbukti memiliki karakter fraksi protein dan sifat fungsional protein yang hampir sama dengan kedelai. Oleh karena itu, diduga kacang komak memiliki sifat biologis yang hampir sama juga dengan kedelai. Salah satu sifat biologis yang perlu dikaji adalah potensi antioksidan kacang komak. Hal ini diharapkan dapat meningkatkan pemanfaatan kacang komak, terutama sebagai pangan fungsional.
Aspek yang akan dikaji dalam penelitian ini adalah pengukuran aktivitas antioksidan dengan uji DPPH dan uji kemampuan mereduksi, total fenol, asam fitat dan uji fitokimia. Sampel kacang komak disediakan dalam bentuk ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol dan ekstrak etil asetat.
Aktivitas antioksidan dengan uji DPPH menunjukkan bahwa ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol dan ekstrak etil asetat memiliki aktivitas antioksidan berturut-turut adalah 10.22, 7.10, 2.63, 1.92, dan 3.13 AEAC. Aktivitas antioksidan yang paling tinggi terdapat pada ekstrak air yaitu 10.22 AEAC. Angka ini menunjukkan bahwa ekstrak air memiliki aktivitas antioksidan 10.22 kali lebih besar daripada asam askorbat pada konsentrasi yang sama. Sedangkan uji aktivitas antioksidan dengan uji kemampuan mereduksi menunjukkan bahwa ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol, dan ekstrak etil asetat memiliki kemampuan mereduksi berturut-turut adalah 0.432, 0.272, 0.270, 0.337 dan 0.285. Sejalan dengan uji DPPH, kemampuan mereduksi yang paling tinggi terdapat pada ekstrak air yaitu sebesar 0.432.
terdapat pada ekstrak air yaitu fenol hidrokuinon, saponin, tanin, steroid, triterpenoid dan alkaloid yang dapat bersifat sebagai antioksidan.
RIWAYAT HIDUP
Penulis dilahirkan di Koto Tangah, Kabupaten 50 Kota, Sumatera Barat pada tanggal 14 juli 1984. Penulis adalah puteri dari pasangan Bapak Afriwandi dan Ibu Heni Zuita dan merupakan anak kedua dari tiga bersaudara.
Penulis menempuh pendidikan di Taman Kanak-Kanak Aisyiyah Bustanul Athfal di Koto Tangah, cabang Suliki, daerah
50 Kota, Sumatera Barat pada tahun 1989-1990, pendidikan sekolah dasar di SD Negeri 02 Koto Tangah di Kecamatan Suliki Gunung Mas, Kabupaten 50 Kota pada tahun 1990-1996, pendidikan lanjutan tingkat pertama di SLTP Negeri 2 Suliki Gunung Mas di Limbanang, Kabupaten 50 kota pada tahun 1996-1999, dan pendidikan lanjutan tingkat atas di SMU Negeri 1 Suliki Gunung Mas, Lima Puluh Kota pada tahun 1999-2002. Pada tahun 2002, penulis melanjutkan pendidikan di Institut Pertanian Bogor pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor yang diterima melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama menempuh pendidikan di Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor, penulis terlibat dalam beberapa organisasi yaitu HIMITEPA (Himpunan Mahasiswa Teknologi Pangan), dan Food Chat. Selain itu, penulis juga terlibat dalam beberapa kepanitiaan yaitu LLS (Lepas Landas Sarjana) dan Baur.
KATA PENGANTAR
Alhamdulillahi robbil’alamin, puji dan syukur kehadirat Allah SWT atas limpahan rahmat dan karuniaNya sehingga penulis dapat melaksanakan dan menyelesaikan penelitian yang berjudul “Pengujian Kapasitas Antioksidan Ekstrak Polar, Nonpolar, Fraksi Protein dan Nonprotein Kacang Komak (Lablab purpureus (L.) sweet). Skripsi ini merupakan hasil nyata dari penelitian yang dilakukan oleh penulis.
Penulisan skripsi ini tidak terlepas dari bantuan berbagai pihak, baik moral maupun material. Oleh karena itu, penulis mengucapkan terima kasih kepada: 1. Keluargaku tercinta: Ama, Apa dan adikku tersayang Aufa yang selalu
memberikan do’a, kasih sayang, nasehat dan motivasi tiada henti.
2. Bapak Ir. Arif Hartoyo MSi selaku dosen pembimbing yang telah membimbing penulis dalam penelitian dan penulisan.
3. Bapak Dr. Nugraha Edhi Suyatma DEA, STP atas nasehat, saran, masukan dan kesediaannya sebagai dosen penguji.
4. Bapak Dr. Sukarno atas kesediaannya sebagai dosen penguji, terima kasih atas nasehat, saran dan masukannya kepada penulis.
5. Semua teknisi dan laboran: Pak Wahid, Pak Gatot, Teh Ida, Pak Edi, Pak Rojak, Pak Sobirin, Pak Solihin, Bu Rubiah, Pak Koko, Pak Taufik, Pak Yahya; terima kasih atas saran, bantuan dan kerja samanya selama penulis melakukan penelitian.
6. Paktuo Hasbi, Maktuo Emi, Tek iyet, Pak etek Andi, Tek inel, Tek An, Abah, Tek Titin, Maktuo Iyar, Maktuo Wal, Da Depi, Bang Eja, Teh Melia; terima kasih atas kasih sayang, nasehat, saran dan bantuannya. Semoga segala kebaikannya dibalas oleh Allah SWT.
7. Wito Mariswan yang selalu memberikan do’a, kasih sayang, nasehat, saran, dukungan dan semangat kepada penulis, semoga Allah membalasnya dengan kebaikan.
9. Tina yang telah membantu penulis dalam pengolahan data, terima kasih atas semua bantuannya.
10. Eva, Manginar, Christ, Mumus, Ica dan Novi; terima kasih atas persahabatan, bantuan, saran, nasehat, dukungan, semangat dan hari-hari kebersamaan selama di IPB, terima kasih telah membuat hari-hari penulis lebih bermakna. 11. Ririn, Dhenok, Sinta; terima kasih atas bantuannya.
12. Teman-teman ITP 39, terima kasih atas bantuan dan kerjasamanya selama penulis melakukan penelitian.
13. Ibu Endang dan Ibu Didah yang telah memberikan saran dan masukan kepada penulis.
14. Bapak Budi Nurtama, terima kasih atas saran dan masukannya kepada penulis. 15. Bapak-bapak pustakawan FATETA: Pak Dunung, Pak Agus, Pak Marga dan Pak Kosasih; terima kasih telah membantu penulis dalam pencarian literatur. 16. Ibu dan Bapak pustakawan di PAU dan LSI yang telah membantu dalam
pencarian literatur untuk penyusunan skripsi ini.
17. Puteri 26: Ni Zia, Rahmi, Ana, Bibi, Anti, Tina, Vina, Riyah, Beti, Imel. 18. Teman-teman LA PRIEZTA: Mba Lia, Nilam, Mba Iyo, Mba Wiwin, Eri,
Erda, Ayu, Betty, Maria, Christ, Yuris.
19. Pihak-pihak yang tidak dapat disebutkan satu per satu.
Penulis menyadari dalam penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran dari berbagai pihak. Penulis berharap semoga skripsi ini dapat bermanfaat.
Bogor, Januari 2007
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
SKRIPSI
Sebagai salah satu syarat memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: OLGA YULIA
F24102024
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
SKRIPSI
Sebagai salah satu syarat memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: OLGA YULIA
F24102024
Dilahirkan pada tanggal 14 Juli 1984 Di Koto Tangah, Sumatera Barat
Lulus pada tanggal: 10 Januari 2007
Menyetujui, Bogor, Januari 2007
DAFTAR ISI
5. Triterpenoid... 13
6. Steroid... 14
7. Saponin... 14
F. ASAM FITAT... 14
III. METODOLOGI PENELITIAN... 16
A. BAHAN DAN ALAT... 16
B. METODOLOGI PENELITIAN... 16
a. Penyediaan Sampel... 16
1. Pembuatan Tepung Kacang Komak... 16
2. Pembuatan Fraksi Protein dan Nonprotein Kacang Komak... 17
5. Pembuatan Ekstrak Etil Asetat... 18
b. Perhitungan Rendemen Ekstrak... 18
c. Analisis... 19
1. Analisis Kadar Air... 19
2. Analisis Kadar Protein... 19
3. Analisis Kadar Total Fenol... 20
4. Analisis Fitokimia... 21
a. Fenol hidrokuinon... 21
b. Flavonoid... 21
c. Tanin... 21
d. Alkaloid... 21
e. Triterpenoid... 22
f. Steroid... 22
g. Saponin... 22
5. Analisis Kadar Asam Fitat... 22
6. Aktivitas Antioksidan... 23
a. Uji DPPH... 23
b. Uji Aktivitas Kemampuan Mereduksi... 24
7. Analisis Statistik... 24
IV. HASIL DAN PEMBAHASAN... 25
A. EKSTRAKSI KACANG KOMAK... 25
B. PEMBUATAN FRAKSI PROTEIN DAN NONPROTEIN... 26
D. AKTIVITAS ANTIOKSDAN... 28
1. Uji DPPH... 28
2. Uji Aktivitas Kemampuan Mereduksi... 30
C. UJI KIMIA... 32
1. Total Fenol... 32
SKRIPSI
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
Oleh: OLGA YULIA
F24102024
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
Olga Yulia. F24102024. Pengujian Kapasitas Antioksidan Ekstrak Polar, Nonpolar, Fraksi Protein dan Nonprotein Kacang Komak (Lablab purpureus (L.) sweet). Di bawah bimbingan Ir. Arif Hartoyo, MSi.
ABSTRAK
Indonesia merupakan negara yang kaya akan sumber hayati, salah satunya adalah kacang-kacangan. Kacang-kacangan dikenal sebagai sumber protein nabati, karbohidrat kompleks, oligosakarida, mineral, fitokimia dan serat pangan yang bermanfaat bagi tubuh. Selama ini, penelitian tentang kacang-kacangan masih relatif sedikit kecuali kacang kedelai. Oleh karena itu, perlu dilakukan eksplorasi terhadap jenis kacang-kacangan yang lain, salah satunya adalah kacang komak (Lablab purpureus (L.) sweet).
Berdasarkan penelitian Khodijah (2003); Purnamasari (2002); dan Suwarno (2003), kacang komak telah terbukti memiliki karakter fraksi protein dan sifat fungsional protein yang hampir sama dengan kedelai. Oleh karena itu, diduga kacang komak memiliki sifat biologis yang hampir sama juga dengan kedelai. Salah satu sifat biologis yang perlu dikaji adalah potensi antioksidan kacang komak. Hal ini diharapkan dapat meningkatkan pemanfaatan kacang komak, terutama sebagai pangan fungsional.
Aspek yang akan dikaji dalam penelitian ini adalah pengukuran aktivitas antioksidan dengan uji DPPH dan uji kemampuan mereduksi, total fenol, asam fitat dan uji fitokimia. Sampel kacang komak disediakan dalam bentuk ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol dan ekstrak etil asetat.
Aktivitas antioksidan dengan uji DPPH menunjukkan bahwa ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol dan ekstrak etil asetat memiliki aktivitas antioksidan berturut-turut adalah 10.22, 7.10, 2.63, 1.92, dan 3.13 AEAC. Aktivitas antioksidan yang paling tinggi terdapat pada ekstrak air yaitu 10.22 AEAC. Angka ini menunjukkan bahwa ekstrak air memiliki aktivitas antioksidan 10.22 kali lebih besar daripada asam askorbat pada konsentrasi yang sama. Sedangkan uji aktivitas antioksidan dengan uji kemampuan mereduksi menunjukkan bahwa ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol, dan ekstrak etil asetat memiliki kemampuan mereduksi berturut-turut adalah 0.432, 0.272, 0.270, 0.337 dan 0.285. Sejalan dengan uji DPPH, kemampuan mereduksi yang paling tinggi terdapat pada ekstrak air yaitu sebesar 0.432.
terdapat pada ekstrak air yaitu fenol hidrokuinon, saponin, tanin, steroid, triterpenoid dan alkaloid yang dapat bersifat sebagai antioksidan.
RIWAYAT HIDUP
Penulis dilahirkan di Koto Tangah, Kabupaten 50 Kota, Sumatera Barat pada tanggal 14 juli 1984. Penulis adalah puteri dari pasangan Bapak Afriwandi dan Ibu Heni Zuita dan merupakan anak kedua dari tiga bersaudara.
Penulis menempuh pendidikan di Taman Kanak-Kanak Aisyiyah Bustanul Athfal di Koto Tangah, cabang Suliki, daerah
50 Kota, Sumatera Barat pada tahun 1989-1990, pendidikan sekolah dasar di SD Negeri 02 Koto Tangah di Kecamatan Suliki Gunung Mas, Kabupaten 50 Kota pada tahun 1990-1996, pendidikan lanjutan tingkat pertama di SLTP Negeri 2 Suliki Gunung Mas di Limbanang, Kabupaten 50 kota pada tahun 1996-1999, dan pendidikan lanjutan tingkat atas di SMU Negeri 1 Suliki Gunung Mas, Lima Puluh Kota pada tahun 1999-2002. Pada tahun 2002, penulis melanjutkan pendidikan di Institut Pertanian Bogor pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor yang diterima melalui jalur USMI (Undangan Seleksi Masuk IPB).
Selama menempuh pendidikan di Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor, penulis terlibat dalam beberapa organisasi yaitu HIMITEPA (Himpunan Mahasiswa Teknologi Pangan), dan Food Chat. Selain itu, penulis juga terlibat dalam beberapa kepanitiaan yaitu LLS (Lepas Landas Sarjana) dan Baur.
KATA PENGANTAR
Alhamdulillahi robbil’alamin, puji dan syukur kehadirat Allah SWT atas limpahan rahmat dan karuniaNya sehingga penulis dapat melaksanakan dan menyelesaikan penelitian yang berjudul “Pengujian Kapasitas Antioksidan Ekstrak Polar, Nonpolar, Fraksi Protein dan Nonprotein Kacang Komak (Lablab purpureus (L.) sweet). Skripsi ini merupakan hasil nyata dari penelitian yang dilakukan oleh penulis.
Penulisan skripsi ini tidak terlepas dari bantuan berbagai pihak, baik moral maupun material. Oleh karena itu, penulis mengucapkan terima kasih kepada: 1. Keluargaku tercinta: Ama, Apa dan adikku tersayang Aufa yang selalu
memberikan do’a, kasih sayang, nasehat dan motivasi tiada henti.
2. Bapak Ir. Arif Hartoyo MSi selaku dosen pembimbing yang telah membimbing penulis dalam penelitian dan penulisan.
3. Bapak Dr. Nugraha Edhi Suyatma DEA, STP atas nasehat, saran, masukan dan kesediaannya sebagai dosen penguji.
4. Bapak Dr. Sukarno atas kesediaannya sebagai dosen penguji, terima kasih atas nasehat, saran dan masukannya kepada penulis.
5. Semua teknisi dan laboran: Pak Wahid, Pak Gatot, Teh Ida, Pak Edi, Pak Rojak, Pak Sobirin, Pak Solihin, Bu Rubiah, Pak Koko, Pak Taufik, Pak Yahya; terima kasih atas saran, bantuan dan kerja samanya selama penulis melakukan penelitian.
6. Paktuo Hasbi, Maktuo Emi, Tek iyet, Pak etek Andi, Tek inel, Tek An, Abah, Tek Titin, Maktuo Iyar, Maktuo Wal, Da Depi, Bang Eja, Teh Melia; terima kasih atas kasih sayang, nasehat, saran dan bantuannya. Semoga segala kebaikannya dibalas oleh Allah SWT.
7. Wito Mariswan yang selalu memberikan do’a, kasih sayang, nasehat, saran, dukungan dan semangat kepada penulis, semoga Allah membalasnya dengan kebaikan.
9. Tina yang telah membantu penulis dalam pengolahan data, terima kasih atas semua bantuannya.
10. Eva, Manginar, Christ, Mumus, Ica dan Novi; terima kasih atas persahabatan, bantuan, saran, nasehat, dukungan, semangat dan hari-hari kebersamaan selama di IPB, terima kasih telah membuat hari-hari penulis lebih bermakna. 11. Ririn, Dhenok, Sinta; terima kasih atas bantuannya.
12. Teman-teman ITP 39, terima kasih atas bantuan dan kerjasamanya selama penulis melakukan penelitian.
13. Ibu Endang dan Ibu Didah yang telah memberikan saran dan masukan kepada penulis.
14. Bapak Budi Nurtama, terima kasih atas saran dan masukannya kepada penulis. 15. Bapak-bapak pustakawan FATETA: Pak Dunung, Pak Agus, Pak Marga dan Pak Kosasih; terima kasih telah membantu penulis dalam pencarian literatur. 16. Ibu dan Bapak pustakawan di PAU dan LSI yang telah membantu dalam
pencarian literatur untuk penyusunan skripsi ini.
17. Puteri 26: Ni Zia, Rahmi, Ana, Bibi, Anti, Tina, Vina, Riyah, Beti, Imel. 18. Teman-teman LA PRIEZTA: Mba Lia, Nilam, Mba Iyo, Mba Wiwin, Eri,
Erda, Ayu, Betty, Maria, Christ, Yuris.
19. Pihak-pihak yang tidak dapat disebutkan satu per satu.
Penulis menyadari dalam penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran dari berbagai pihak. Penulis berharap semoga skripsi ini dapat bermanfaat.
Bogor, Januari 2007
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
SKRIPSI
Sebagai salah satu syarat memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: OLGA YULIA
F24102024
2007
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGUJIAN KAPASITAS ANTIOKSIDAN EKSTRAK POLAR, NONPOLAR, FRAKSI PROTEIN
DAN NONPROTEIN KACANG KOMAK (Lablab purpureus (L.) sweet)
SKRIPSI
Sebagai salah satu syarat memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh: OLGA YULIA
F24102024
Dilahirkan pada tanggal 14 Juli 1984 Di Koto Tangah, Sumatera Barat
Lulus pada tanggal: 10 Januari 2007
Menyetujui, Bogor, Januari 2007
DAFTAR ISI
5. Triterpenoid... 13
6. Steroid... 14
7. Saponin... 14
F. ASAM FITAT... 14
III. METODOLOGI PENELITIAN... 16
A. BAHAN DAN ALAT... 16
B. METODOLOGI PENELITIAN... 16
a. Penyediaan Sampel... 16
1. Pembuatan Tepung Kacang Komak... 16
2. Pembuatan Fraksi Protein dan Nonprotein Kacang Komak... 17
5. Pembuatan Ekstrak Etil Asetat... 18
b. Perhitungan Rendemen Ekstrak... 18
c. Analisis... 19
1. Analisis Kadar Air... 19
2. Analisis Kadar Protein... 19
3. Analisis Kadar Total Fenol... 20
4. Analisis Fitokimia... 21
a. Fenol hidrokuinon... 21
b. Flavonoid... 21
c. Tanin... 21
d. Alkaloid... 21
e. Triterpenoid... 22
f. Steroid... 22
g. Saponin... 22
5. Analisis Kadar Asam Fitat... 22
6. Aktivitas Antioksidan... 23
a. Uji DPPH... 23
b. Uji Aktivitas Kemampuan Mereduksi... 24
7. Analisis Statistik... 24
IV. HASIL DAN PEMBAHASAN... 25
A. EKSTRAKSI KACANG KOMAK... 25
B. PEMBUATAN FRAKSI PROTEIN DAN NONPROTEIN... 26
D. AKTIVITAS ANTIOKSDAN... 28
1. Uji DPPH... 28
2. Uji Aktivitas Kemampuan Mereduksi... 30
C. UJI KIMIA... 32
1. Total Fenol... 32
DAFTAR GAMBAR
Gambar 1. Visualisasi tanaman kacang komak... 3 Gambar 2. Visualisasi biji kacang komak... 4 Gambar 3. Reaksi Fenton………... 8 Gambar 4. Reaksi Haber-Weiss... 8 Gambar 5. Reaksi peredaman radikal bebas DPPH oleh antioksidan... 9 Gambar 6. Struktur kimia komponen fenolik... 11 Gambar 7. Proses pembuatan fraksi protein dan nonprotein
kacang komak... 17 Gambar 8. Aktivitas antioksidan ekstrak kacang komak
(metode DPPH) ... 29 Gambar 9. Aktivitas antioksidan ekstrak kacang komak
DAFTAR TABEL
Tabel 1. Komposisi kimia kacang komak………. 5 Tabel 2. Komposisi asam amino kacang komak... 5 Tabel 3. Seri larutan standar asam tanat... 20 Tabel 4. Seri larutan standar Ca-Fitat... 23 Tabel 5. Rendemen ekstrak kacang komak... 26 Tabel 6. Kadar air dan kadar protein fraksi protein dan nonprotein
kacang komak... 27 Tabel 7. Hasil uji fitokimia ekstrak kacang komak... 35 Tabel 8. Hasil analisis fitokimia terhadap sampel produk
DAFTAR LAMPIRAN
Lampiran 1. Penentuan kurva standar DPPH ………. 50 Lampiran 2. Pengukuran aktivitas antioksidan dengan
metode DPPH ………... 51 Lampiran 3. Nilai absorbansi uji aktivitas kemampuan mereduksi... 52 Lampiran 4. Penentuan kurva standar total fenol ………... 53 Lampiran 5. Pengukuran kadar total fenol sampel... 54 Lampiran 6. Penentuan kurva standar Ca-fitat... 55 Lampiran 7. Pengukuran kadar asam fitat sampel... 56 Lampiran 8. Hasil pengolahan statistik data hasil pengukuran aktivitas
antioksidan (metode DPPH)... 57 Lampiran 9. Hasil pengolahan statistik data hasil pengukuran aktivitas
I. PENDAHULUAN
A. LATAR BELAKANG
Indonesia merupakan negara yang kaya sumber alam dan memiliki sumber hayati seperti kacang-kacangan dan biji-bijian yang melimpah. Namun, sebagian besar kacang-kacangan dan biji-bijian tersebut masih belum dieksplorasi. Oleh sebab itu, perlu dilakukan eksplorasi terhadap potensi sumber daya alam Indonesia, salah satunya adalah terhadap jenis kacang-kacangan yaitu kacang komak (Lablab purpureus (L.) sweet).
Kacang komak merupakan salah satu jenis kacang-kacangan yang memiliki potensi ekonomi yang cukup tinggi. Kacang komak dapat tumbuh di daerah tropis dan subtropis dan mudah dibudidayakan karena tanaman ini sangat toleran terhadap kekeringan. Hasil panen rata-rata biji kacang komak adalah sebesar 1.460 kg/ha (Duke, 1983). Di Asia, panen rata-rata biji kacang komak adalah sebesar 56-67 kg/ha (Kay, 1979). Skerman (1977) menyatakan bahwa di New South Wales, dalam satu hektar tanaman kacang komak dapat menghasilkan 1.500 kg protein sehingga kacang komak sangat potensial sebagai sumber protein nabati. Selain itu, kacang komak juga bermanfaat dalam menyuburkan tanah karena kandungan nitrogennya yang cukup tinggi sehingga dapat digunakan sebagai pupuk hijau (Duke, 1983).
Berdasarkan penelitian-penelitian terdahulu, kacang komak telah terbukti memiliki karakter fraksi protein dan sifat fungsional yang hampir sama dengan kedelai. Pada penelitian Khodijah (2003), hasil analisis protein globulin 7S dan 11S dari kacang komak memiliki pola elektroforesis yang hampir sama dengan kedelai. Menurut Purnamasari (2002), fraksi globulin rata-rata kedua varietas kacang komak DL-40 dan DL-58 (70.58%) mendekati fraksi globulin kacang tanah (70%) dan kacang kedelai (74%). Suwarno (2003) juga telah meneliti tentang sifat fungsional isolat protein kacang komak dan didapatkan bahwa sifat fungsional isolat protein kacang komak dan kacang kedelai memiliki banyak kesamaan. Hal ini dapat dilihat dari sifat daya serap air, daya serap minyak, dan daya emulsi isolat kacang komak dan kacang kedelai yang tidak berbeda nyata.
Berdasarkan hal di atas, kemungkinan kacang komak juga mempunyai sifat biologis yang sama dengan kacang kedelai. Komponen dalam kacang kedelai seperti diketahui mempunyai manfaat bagi kesehatan tubuh diantaranya adalah sifat anti radikal bebas (antioksidan). Oleh karena itu, perlu dilakukan penelitian untuk membuktikan sifat anti radikal bebas pada kacang komak. Dengan dilakukannya penelitian tentang pengujian kapasitas antioksidan ekstrak polar, nonpolar, fraksi protein dan nonprotein kacang komak (Lablab purpureus (L.) sweet) ini diharapkan pemanfaatan kacang komak (Lablab purpureus (L.) sweet) secara tepat dapat diketahui, sehingga dapat meningkatkan dan memperluas pemanfaatan kacang komak.
B. TUJUAN PENELITIAN
II. TINJAUAN PUSTAKA
A. KACANG KOMAK
Kacang komak (Lablab purpureus (L.) sweet) diklasifikasikan ke dalam subkelas Dicotyledonae, ordo Leguminosae, famili Fabaceae dan genus
Dolichos. Kacang komak mempunyai berbagai nama lain seperti hyacinth bean, Bonavist, Chicaros, Chink, Egyption bean, Pharao, Seem, Val, Dolichos
lablab L., Dolichos purpureus L., lablab niger Medik., lablab vulgaris Savi.,
Dolichos albus lour., Dolichos cultratus Thunb., Dolichos lablab var hortensis,
lablab leucocarpos Davi, lablab nankinicus Savi, lablab perennans DC.,
lablab vulgaris var niger DC (Duke, 1983). Tanaman ini merupakan tanaman
asli dari Asia dan juga ditemukan di Afrika (Allan, 1981). Sebelum abad
pertengahan, kacang komak sudah dibudidayakan di India, China, Jepang,
Sudan dan Mesir.
Kacang komak dapat tumbuh di daerah tropis dan subtropis. Suhu yang
baik untuk tanaman adalah 18°-30°C. Namun, suhu yang tinggi tidak
mempengaruhi perkembangannya. Tanaman ini sangat toleran terhadap
kekeringan dan beradaptasi dengan baik pada lahan kering dengan curah hujan
Kacang komak memiliki batang yang keras, berserat dan berbulu dengan
tinggi 2-3 m, dan dapat mencapai tinggi hingga 10 m. Warna bunga dari
kacang komak berbeda-beda sesuai dengan jenisnya. Daun kacang komak
lebar dan tebal dengan panjang 7.5-15 cm. Daun bercabang tiga (trifoliolate) pada setiap sisi tangkainya (Skerman, 1977). Deskripsi tanaman kacang komak
dapat dilihat pada Gambar 1.
Biji kacang komak terdapat dalam polong. Setiap polong terdapat 3-6 biji
kacang komak. Polong kacang komak memiliki panjang 5-20 cm dengan lebar
1-5 cm (Kay, 1979), sedangkan panjang biji kacang komak adalah 0.6-1.3 cm
(Duke, 1983). Ukuran dan warna biji beragam dari hitam, coklat, dan
kekuningan (Allan, 1981). Visualisasi biji kacang komak dapat dilihat pada
Gambar 2.
Gambar 2.Visualisasi biji kacang komak (Lablab purpureus (L.) sweet)
Kacang komak mempunyai nilai gizi yang cukup tinggi, berupa
karbohidrat, protein, serat, serta memiliki susunan asam amino yang baik.
Selain itu, kacang komak juga mengandung lemak, mineral seperti abu,
kalsium, fosfor, zat besi, dan vitamin seperti asam nikotinat dan vitamin C
Tabel 1. Komposisi kimia kacang komak.
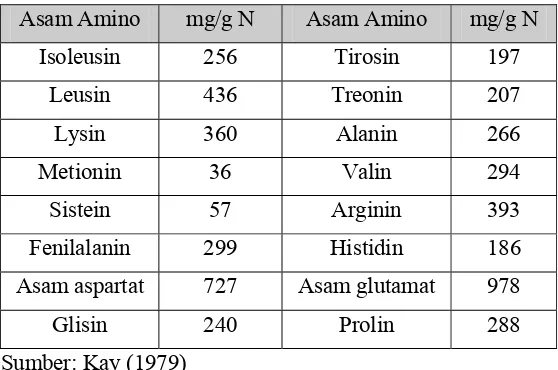
Kacang komak memiliki susunan asam amino yang mendekati pola
protein kedelai, yaitu kurang mengandung asam amino yang mengandung
belerang (metionin dan sistein), tetapi kaya akan asam amino lisin. Tingginya
asam amino lisin pada kacang komak dapat dimanfaatkan untuk pembuatan
bahan makanan campuran yang tersusun dari kacang-kacangan yang
umumnya kekurangan asam amino lisin. Komposisi asam amino dari kacang
komak dapat dilihat pada Tabel 2.
Tabel 2. Komposisi asam amino dari kacang komak
Asam Amino mg/g N Asam Amino mg/g N
Isoleusin 256 Tirosin 197
Leusin 436 Treonin 207
Lysin 360 Alanin 266
Metionin 36 Valin 294
Sistein 57 Arginin 393
Fenilalanin 299 Histidin 186
Asam aspartat 727 Asam glutamat 978
Glisin 240 Prolin 288
Kacang komak dapat diolah menjadi berbagai jenis makanan. Biji kacang
komak dapat dimasak dan dimakan sebagai sayuran atau salad. Kulit (polong)
yang masih muda dan biji yang sudah kering juga dapat dikonsumsi sebagai
makanan. Di Mesir, biji kacang komak digiling dan digunakan sebagai bahan
pembuat kue yang disebut dengan ”tanniah” (Duke, 1983). Di Asia Tenggara,
kacang komak populer sebagai sayuran polong muda atau digunakan dalam
sayur kari, biji mudanya yang masih hijau dimakan setelah direbus atau
disangrai, daun, pucuk, dan perbungaannya dimanfaatkan sebagai
kacang-kacangan, sebagai dhal yaitu kacang yang dibelah dan dihilangkan kulit bijinya (Maesen dan Somaatmaja, 1993). Sedangkan di beberapa daerah di
Indonesia, seperti di Bondowoso Situbondo dan Probolinggo sering digunakan
sebagai campuran dari nasi beras (Syarifudin, 2003). Kacang komak juga
digunakan sebagai makanan ternak dan pupuk hijau (Duke, 1983).
Selain sebagai sumber makanan, kacang komak juga dapat digunakan
sebagai obat antara lain obat sakit perut dan kencing nanah (gonorrhea) (Duke, 1983). Jus dari kulit biji kacang komak digunakan sebagai obat radang telinga
dan tenggorokan. Di cina, jenis kacang ini digunakan sebagai obat tradisional
untuk mengobatai penyakit gembur-gembur (curing dropsy), diare dan digunakan sebagai tonik (Li, 1973).
B. RADIKAL BEBAS
Radikal bebas merupakan atom, molekul atau senyawa-senyawa yang
mengandung satu atau lebih elektron yang tidak berpasangan yang bersifat
sangat reaktif dan tidak stabil (Surai, 2003). Agar menjadi stabil, radikal bebas
memerlukan elektron yang berasal dari pasangan elektron di sekitarnya,
sehingga terjadi perpindahan elektron dari molekul donor ke molekul radikal
Senyawa radikal yang terdapat dalam tubuh (prooksidan) dapat berasal
dari luar tubuh (eksogen) atau terbentuk di dalam tubuh (endogen) dari hasil
metabolisme zat gizi secara normal (Muchtadi, 2000). Secara eksogen,
senyawa radikal antara lain berasal dari polutan, makanan atau minuman,
radiasi, ozon dan pestisida (Supari, 1996). Sedangkan secara endogen, senyawa
radikal dapat timbul melalui beberapa macam mekanisme seperti otooksidasi,
aktivitas oksidasi dan sistem transpor elektron. Menurut Madhavi et al. (1996), radikal bebas diproduksi terus menerus di dalam sel di dalam sistem transpor
elektron mitokondria, membran plasma, sitosol, retikulum endoplasma, dan
peroksisom. Semua senyawa radikal yang terbentuk, selanjutnya manjadi
inisiator pada proses peroksidasi lipid, sehingga menimbulkan kerusakan
jaringan tubuh (Zakaria et al., 1996).
Menurut Madhavi et al. (1996), radikal bebas dapat menimbulkan kerusakan protein pada lensa mata yang mengakibatkan terjadinya katarak.
Madhavi et al. (1996) juga menyatakan bahwa radikal bebas dapat merusak membran sel terutama komponen penyusun membran berupa asam lemak tidak
jenuh ganda, merusak bagian dalam pembuluh darah yang mempermudah
pengendapan berbagai zat termasuk kolesterol sehingga menyebabkan
aterosklerosis. Sedangkan Wang et al. (2002) menyatakan bahwa.radikal bebas dapat menyebabkan oksidasi DNA sehingga DNA termutasi dan menimbulkan
kanker. Senyawa radikal juga menyebabkan terjadinya proses penuaan akibat
rusaknya sel-sel jaringan tubuh serta dapat menimbulkan penyakit autoimun
(Muchtadi, 2000).
C. ANTIOKSIDAN
Antioksidan adalah zat yang dapat melawan pengaruh bahaya dari
radikal bebas atau Reactive Oxygen Species (ROS) yang terbentuk sebagai hasil dari metabolisme oksidatif yaitu hasil dari reaksi-reaksi kimia dan proses
metabolik yang terjadi dalam tubuh (Goldberg, 2003). Senyawa antioksidan
dapat berfungsi sebagai penangkap radikal bebas, pembentuk kompleks dengan
logam-logam prooksidan dan berfungsi sebagai senyawa pereduksi (Andlauer
radikal bebas sehingga menghambat mekanisme oksidatif yang merupakan
penyebab penyakit-penyakit degeneratif seperti penyakit jantung, kanker,
katarak, disfungsi otak dan artritis.
Antioksidan dapat digolongkan menjadi antioksidan primer ( Chain-breaking antioxidant) dan antioksidan sekunder (preventive antioksidant) (Gordon, 1990). Antioksidan primer dapat bereaksi dengan radikal lipid dan
mengubahnya menjadi bentuk yang lebih stabil.Sebuah senyawa dapat disebut
sebagai antioksidan primer apabila senyawa tersebut dapat mendonorkan atom
hidrogennya dengan cepat ke radikal lipid dan radikal antioksidan yang
dihasilkan lebih stabil dari radikal lipid atau dapat diubah menjadi produk lain
yang lebih stabil (Gordon, 1990). Senyawa yang termasuk dalam kelompok
antioksidan primer (Chain-breaking antioxidant) adalah vitamin E (tokoferol), vitamin C (asam askorbat), β-karoten, glutation dan sistein (Taher, 2003).
Antioksidan sekunder berfungsi sebagai antioksidan pencegah yaitu
menurunkan kecepatan inisiasi dengan berbagai mekanisme, seperti melalui
pengikatan ion-ion logam, penangkapan oksigen dan penguraian
hidroperoksida menjadi produk-produk nonradikal (Gordon, 1990). Pada
dasarnya tujuan antioksidan sekunder (preventive antioksidant) adalah mencegah terjadinya radikal yang paling berbahaya yaitu radikal hidroksil
(Taher, 2003). Proses pembentukan radikal hidroksil terjadi melalui reaksi
Fenton (Gambar 3) dan reaksi Haber-Weiss (Gambar 4).
Fe2+ (Cu+) + H2O2 Fe3+ (Cu2+) + OH- + •OH
Gambar 3. Reaksi Fenton
Fe3+ (Cu2+) + O2• - Fe2+ (Cu+) + O2 (tahap 1)
Fe2+ (Cu+) + H2O2 Fe3+ (Cu2+) + OH- + •OH (tahap 2)
Gambar 4. Reaksi Haber-Weiss
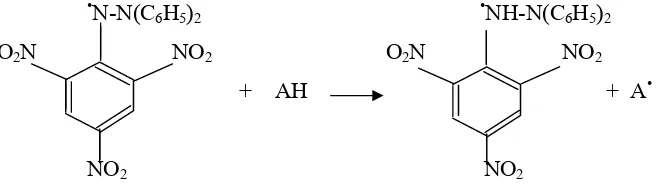
Metode DPPH merupakan salah satu metode aktivitas antioksidan yang
sederhana dengan menggunakan 1,1-diphenyl-2-picrylhydrazil (DPPH) sebagai senyawa pendeteksi (Miller et al., 2000). DPPH (1,1-diphenyl
-2-picrylhydrazil) adalah senyawa radikal bebas yang stabil yang dapat bereaksi dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH
tereduksi (Simanjuntak et al., 2004). Reaksi antara DPPH dengan senyawa antioksidan dapat dilihat pada Gambar 5. Pengukuran kapasitas antioksidan
dengan metode DPPH menggunakan spektrofotometer dengan panjang
gelombang 517 nm (Kubo et al., 2002). Penurunan absorbansi menunjukkan adanya aktivitas scavenging (aktivitas antioksidan).
•N-N(C6H5)2 •NH-N(C6H5)2
O2N NO2 O2N NO2
+ AH + A•
NO2 NO2
Gambar 5.Reaksi peredaman radikal bebas DPPH oleh antioksidan
Metode aktivitas kemampuan mereduksi digunakan untuk menentukan
antioksidan total pada sampel (Kardono dan Dewi, 1998). Aktivitas
antioksidan diukur sebagai kemampuan mereduksi Kalium Ferri Sianida.
Pengukuran aktivitas kemampuan mereduksi diukur dengan spektrofotometer
pada panjang gelombang 700 nm. Absorbansi yang tinggi menunjukkan
kemampuan mereduksi yang tinggi (Yang et al., 2000).
D. EKSTRAKSI
Ekstraksi adalah proses pemisahan komponen-komponen terlarut dari
komponen yang tidak larut dari suatu campuran dengan pelarut yang sesuai
(Leniger dan Beverloo, 1975). Proses ekstraksi dipengaruhi oleh lama
ekstraksi, suhu dan jenis pelarut yang digunakan. Semakin lama waktu yang
digunakan dan semakin tinggi suhu yang digunakan, semakin sempurna
proses ekstraksi. Semakin dekat tingkat kepolaran pelarut dengan komponen
kepolaran yang sama dengan zat yang diekstrak. Jika komponen yang
diekstrak belum diketahui tingkat kepolarannya, biasanya digunakan beberapa
pelarut dengan tingkat kepolaran yang berbeda.
Sebelum memulai ekstraksi, dilakukan persiapan bahan baku yang
mencakup pengeringan bahan sampai kadar air tertentu dan penggilingan
bahan untuk mempermudah proses ekstraksi (Purseglove et al., 1981). Selain itu, tingkat kemudahan ekstraksi bahan kering masih ditentukan oleh ukuran
partikel bahan. Bahan yang akan diekstrak sebaiknya berukuran seragam
untuk mempermudah kontak antar bahan dengan pelarut (Purseglove et al., 1981).
Metode ekstraksi yang dilakukan tergantung pada beberapa faktor antara
lain tujuan ekstraksi, skala ekstraksi, sifat komponen yang akan diekstrak, dan
sifat pelarut yang akan digunakan (Hougton dan Raman, 1998). Beberapa
metode umum ekstraksi yang biasa dilakukan adalah ekstraksi dengan pelarut,
distilasi, Supercritical Fluid Extraction (SFE), pengepresan mekanik, dan sublimasi. Diantara metode-metode tersebut, metode yang banyak dilakukan
adalah distilasi dan ekstraksi menggunakan pelarut (Hougton dan Raman,
1998). Prinsip ekstraksi menggunakan pelarut adalah bahan yang akan
diekstrak kontak langsung dengan pelarut selama selang waktu tertentu dan
komponen yang akan diekstrak akan terlarut dalam pelarut.
E. FITOKIMIA
Senyawa-senyawa yang dihasilkan dari sintesis tanaman kebanyakan
merupakan senyawa aktif yang memiliki fungsi fisiologis bagi tubuh (Lin,
1994). Senyawa tersebut dinamakan senyawa fitokimia. Senyawa fitokimia
potensial mencegah berbagai penyakit seperti penyakit degeneratif dan
kardiovaskuler (Lin, 1994). Menurut Bidlack dan Wang (2000), beberapa
1. Fenol
Senyawa fenol meliputi berbagai senyawa yang berasal dari
tumbuhan yang memiliki ciri yang sama yaitu cincin aromatik yang
mengandung satu atau dua gugus hidroksil (Harborne, 1987) (Gambar 6).
Senyawa fenol diantaranya adalah senyawa fenol sederhana seperti
monofenol dengan satu cincin benzen (3-etilfenol, 3,4-dimetilfenol) yang
banyak ditemukan pada kacang-kacangan, grup asam hidroksi sinamat
(asam ferulat dan kafeat), flavonoid dan glikosidanya (katekin,
proantosianin, antosianidin, dan flavonol) dan tanin yang merupakan
senyawa fenol yang kompleks dengan berat molekul yang tinggi (Johnson,
2001). Senyawa fenol cenderung mudah larut dalam air karena umumnya
berikatan dengan gula sebagai glikosida (Harborne, 1987).
OH
Gambar 6.Struktur kimia komponen fenolik
Senyawa fenol pada kacang-kacangan terdiri dari senyawa fenol
sederhana dan kompleks. Kacang-kacangan mengandung campuran
beberapa senyawa fenol yang dapat berfungsi sinergis dengan komponen
lain dan berfungsi sebagai antioksidan dan pencegahan berbagai penyakit
(Meskin et al., 2002). Menurut Mukhopadhiay (2000), polifenol memiliki kemampuan untuk berikatan dengan metobolit lain seperti protein, lemak
dan karbohidrat membentuk senyawa kompleks yang stabil sehingga
menghambat mutagenesis dan karsinogenesis. Polifenol memiliki sifat
antioksidatif dan antitumor (Mukhopadhiay, 2000). Menurut Bidlack dan
Wang (2000), polifenol dapat digunakan sebagai pencegah penyakit
kardiovaskuler dan kanker.
Shahidi dan Wanasundara (1992) di dalam Bidlack dan Wang
(2000) menyatakan bahwa senyawa fenol terbukti sebagai sumber
antioksidan yang efektif, penangkap radikal bebas dan pengkelat ion-ion
atau metoksi pada posisi orto atau para dari turunan asam benzoat,
penilpropanoid atau flavonoid (isoflavon) diketahui dapat meningkatkan
aktivitas antioksidan dari senyawa fenol (Meskin et al., 2002). Sementara keberadaan dua grup hidroksil pada posisi orto atau para dapat
menghasilkan struktur quinoid yang stabil, dan grup metoksi pada posisi
orto atau para adalah elektron donor yang efektif dalam menstabilkan
radikal bebas yang terbentuk, sehingga meningkatkan aktivitas dari
senyawa fenol. Penilpropanoid merupakan antioksidan yang lebih efektif
dibandingkan dengan senyawa fenol lainnya.
2. Flavonoid
Flavonoid merupakan golongan terbesar dari senyawa fenol
(Harborne, 1987). Jenis utama flavonoid yang terdapat dalam tanaman
antara lain dihidrokalkon, kalkon, flavan, katekin (flavan-3-ol),
leukoantosianidin (flavan-3,4-diol), flavanon, flavanonol (dihidroflavonol),
flavon, flavonol, garam flavilium, antosianidin dan auron. Berdasarkan
struktur, flavonoid dapat diklasifikasikan menjadi flavonoid
(1,3-diarilpropan), isoflavonoid (1,2-diarilpropan) dan neoflavonoid
(1,1-diarilpropan). Senyawa-senyawa isoflavonoid dan neoflavonoid hanya
ditemukan dalam beberapa jenis tumbuhan, terutama suku leguminosa
(kacang-kacangan). Pada kacang kedelai, semua flavonoid yang ditemukan
adalah isoflavon (Pratt dan Hudson, 1990).
Flavonoid sangat efektif digunakan sebagai antioksidan (Johnson,
2001). Senyawa flavonoid dapat mencegah penyakit kardiovaskuler dengan
menurunkan oksidasi Low Density Protein (LDL) (Johnson, 2001). Senyawa isoflavon (genistein dan daidzein) pada kacang kedelai
bermanfaat dalam mencegah oksidasi dari partikel lipid dan menurunkan
3. Tanin
Tanin merupakan salah satu senyawa fenol kompleks yang terdapat
pada kacang-kacangan (Meskin et al., 2002). Tanin terkondensasi dihasilkan melalui polimerisasi flavonoid dan banyak terdapat pada
tanaman kayu yaitu pada lapisan biji. Tanin dapat bersifat sebagai
antioksidan karena kemampuannya dalam menstabilkan fraksi lipid dan
keaktifannya dalam penghambatan lipoksigenase (Zeuthen dan Sørensen,
2003).
4. Alkaloid
Senyawa alkaloid umumnya mencakup senyawa bersifat basa yang
mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem
siklik (Harborne, 1987). Berdasarkan cincin heterosiklik nitrogen, alkaloid
dapat diklasifikasikan antara lain pirolidin, piperidin, isokuinolin, indol,
kuinolin.
Senyawa alkaloid memiliki aktifitas fisiologis sehingga banyak
digunakan dalam bidang pengobatan. Kuinin, morfin dan striknin adalah
contoh alkaloid yang memiliki pengaruh fisiologis dan psikologis. Alkaloid
pirolizidin diketahui memiliki aktivitas antikanker (Mukhopadhyay, 2000).
5. Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari
enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon
C30 asiklik, yaitu skualena (Harborne, 1987). Senyawa ini berstruktur siklik
yang nisbi rumit, kebanyakan berupa alkohol, aldehida atau asam
karboksilat. Senyawa triterpenoid yang terdapat pada tumbuhan tingkat
tinggi adalah fitosterol yang terdiri dari sitosterol (β-sitosterol), stigmasterol
dan kampesterol. Pada kacang-kacangan seperti kacang kedelai terdapat
senyawa triterpenoid yaitu sitosterol dan stigmasterol (Goldberg, 2003).
Senyawa terpenoid dapat digunakan untuk pengobatan dan terapi
6. Steroid
Steroid merupakan golongan dari senyawa triterpenoid (Harborne,
1987). Senyawa steroid dapat diklasifikasikan menjadi steroid dengan atom
karbon tidak lebih dari 21 (steroid sederhana) dan steroid dengan atom
karbon lebih dari 21 seperti sterol, sapogenin, alkaloid steroid, glikosida
jantung dan vitamin D (Hogiono dan Dangi, 1994). Menurut Hogiono dan
Dangi (1994), steroid alami berasal dari berbagai transformasi kimia dua
triterpen yaitu lanosterol dan sikloartenol. Pada umumnya, steroid
tumbuhan berasal dari sikloartenol. Senyawa steroid dapat digunakan
sebagai bahan dasar untuk pembuatan obat (Hogiono dan Dangi, 1994).
7. Saponin
Saponin merupakan senyawa aktif permukaan yang dihasilkan dari
grup steroid atau triterpen yang berikatan dengan gula (Meskin et al., 2002). Saponin bersifat seperti sabun dan dapat dideteksi berdasarkan
kemampuannya membentuk busa (Harborne, 1987). Senyawa saponin dapat
ditemukan pada kacang-kacangan seperti pada kacang kedelai (Meskin et al., 2002). Senyawa ini memiliki pengaruh biologis yang menguntungkan yaitu bersifat sebagai hipokolesterolemik dan antikarsinogen serta dapat
meningkatkan sistem imun (Rao dan Koratkar, 1997 di dalam Meskin et al., 2002).
F. ASAM FITAT
Asam fitat adalah suatu mio-inositol 1, 2, 3, 4, 5, 6 heksakis (dihidrogen
fosfat), dan merupakan sumber utama unsur fosfor dalam kacang-kacangan
(Koswara, 1992). Menurut Salunke et al. (1985), pada kacang-kacangan 60-80 % fosfor terdapat dalam bentuk asam fitat. Asam fitat yang terdapat pada
Asam fitat dapat membentuk kompleks dengan protein dan pati
sehingga disebut sebagai senyawa antinutrisi (Meskin et al., 2002). Asam fitat juga dapat mengikat senyawa-senyawa mineral seperti seng, kalsium,
magnesium dan besi (Koswara, 1992). Asam fitat dapat mengkelat ion logam
(ion besi) penyebab oksidasi. Karena kemampuannya dalam mengkelat ion
besi, asam fitat berpotensi menghambat pembentukan radikal hidroksil yang
disebabkan oleh ion besi (Meskin et al., 2002). Rickard dan Thompson (1997) di dalam Meskin et al. (2002) menyatakan bahwa asam fitat bersifat sebagai antikanker di dalam usus besar dan di dalam kelenjer susu pada hewan
percobaan, serta memiliki sifat hipokolesterolemik. Selain itu, asam fitat juga
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan baku yang digunakan adalah kacang komak. Bahan-bahan yang digunakan untuk analisis kimia adalah etil asetat, kloroform, metanol, HCl, NaOH 2N, etanol 95 %, air bebas ion, aquades, reagen Folin-Ciocalteau 50 % (v/v), Na2CO3 5 % (b/v), asam tanat, buffer fosfat (0.2M, pH 6.60),
K3Fe(CN)6 1 %, larutan trikhloroasetat (TCA) 10 %, larutan FeCl3, buffer
asetat 100 mM (pH 5.50), DPPH 3 mM, asam askorbat, K2SO4, HgO, H2SO4,
H3BO3, indikator merah metil dan metilen blue, NaOH-Na2S2O3, H2SO4 2N,
iodin, kalium iodida, HgCl2, asam asetat glasial, Pb-asetat jenuh, etanol 70 %,
HNO3 0.5M, Amonium tiosianat, Ca-fitat 0.2 mM dan amil alkohol.
Peralatan yang digunakan untuk pembuatan tepung kacang komak adalah oven, wileymill dan ayakan. Peralatan untuk ekstraksi diantaranya adalah shaker, magnetic stirrer, penyaring vakum, dan rotavapor. Peralatan untuk analisis adalah tabung reaksi, sudip, pipet tetes, pipet mohr, vorteks, spektrofotometer, labu takar, inkubator, sentrifuse, pHmeter, water bath, gelas piala, pHmeter, termometer, labu Kjeldahl, alat destilasi lengkap, buret, erlenmeyer, aluminium foil, mikropipet, tips, neraca kasar dan neraca analitik.
B. METODOLOGI PENELITIAN a. Penyediaan Sampel
1. Pembuatan Tepung Kacang Komak
2. Pembuatan Fraksi Protein dan Nonprotein Kacang Komak
Pembuatan fraksi protein dan nonprotein kacang komak dapat dilihat pada Gambar 7 (Suwarno, 2003):
ditambah 1 liter aquades (1:10) bersuhu 60ºC
diaduk dengan magnetic stirrer
diatur pH 8.5 – 8.7 dengan NaOH 2N
diekstrak 60ºC selama 30 menit
disentrifuse 2000 rpm selama 15 menit Æ endapan (fraksi nonprotein)
diatur pH supernatan menjadi 4.5 dengan HCl 2 N
disentrifuse 2000 rpm selama 15 menit Æ supernatan (fraksi nonprotein)
ditambah endapan dengan air 200ml (dicuci)
disentrifuse
dikeringkan
digiling
Gambar 7. Proses pembuatan fraksi protein dan nonprotein kacang komak fraksi protein
3. Pembuatan Ekstrak Air
Sejumlah tepung kacang komak direndam dengan akuades dan diekstrak selama 4 jam sambil diaduk dengan magnetic stirrer. Campuran kemudian disaring atau disentrifuse. Ekstrak yang diperoleh dikeringbekukan menggunakan freeze dryer.
4. Pembuatan Ekstrak Kloroform-metanol (Monago dan Alumanah, 2005)
Sejumlah tepung kacang komak direndam dengan pelarut kloroform-metanol dengan perbandingan 2:1 dan diekstrak selama 18 jam pada alat shaker. Campuran disaring dan filtrat diekstrak ulang dengan air dengan volume yang sama. Ekstrak yang diperoleh dihilangkan residu pelarutnya menggunakan rotavapor lalu dikeringkan dengan oven vakum.
5. Pembuatan Ekstrak Etil Asetat
Sejumlah tepung kacang komak direndam dalam pelarut etil asetat dan diekstrak semalam pada alat shaker. Campuran disaring dengan penyaring vakum dan ekstrak yang diperoleh dihilangkan residu pelarutnya menggunakan vacuum evaporator.
b. Perhitungan Rendemen Ekstrak
Rendemen menunjukkan jumlah ekstrak kacang komak yang diperoleh dari setiap gram sampel tepung kacang komak yang diekstrak (%w/w). Perhitungan rendemen adalah sebagai berikut:
c. Analisis
1. Analisis Kadar Air Metode Oven (AOAC, 1995)
Mula-mula cawan kosong dikeringkan dengan oven selama 15 menit dan didinginkan dalam desikator, kemudian ditimbang. Sebanyak 4 – 5 gram contoh dimasukkan dalam cawan yang telah ditimbang dan selanjutnya dikeringkan dalam oven bersuhu 1000C – 105 0C selama 6 jam. Cawan yang telah berisi contoh tersebut dipindahkan ke desikator, didinginkan, dan ditimbang. Pengeringan dilakukan kembali sampai diperoleh berat konstan. Kadar air dihitung berdasarkan kehilangan berat yaitu selisih berat awal dengan berat akhir. Penetapan kadar air berdasarkan perhitungan:
Kadar air (% bb) = ( a – b ) x 100% a
(% bk) = ( a – b ) x 100% b
Keterangan : a = berat bahan awal b = berat bahan akhir
bb = berat basah bk = berat kering
2. Analisis Kadar Protein Metode Kjeldhal (AOAC, 1995)
Sampel sebanyak 0.2 gram ditimbang dan dipindahkan ke labu kjeldahl, ditambahkan 1.9 gram K2SO4, 40 mg HgO dan 2.0 ml H2SO4
pekat. Campuran didestruksi di ruang asam selama + 1.5 jam sampai cairan menjadi bening. Setelah dingin, campuran ditambahkan akuades secara perlahan. Isi labu kjeldhal dipindahkan ke dalam alat destilasi dan dibilas beberapa kali dengan aquades. Erlenmeyer yang berisi larutan 5 ml H3BO3 3 % dan 3 tetes indikator merah metil dan metilen blue
destilat dalam erlenmeyer. Destilat yang tertampung kemudian dititrasi dengan HCl 0.02N sampai terjadi perubahan warna. Hal yang sama dilakukan terhadap blanko. Perhitungan kadar protein adalah sebagai berikut:
% N = (ml HCl-ml blanko) x N HCl x 14.007 x100 mg sampel
% protein = % N x faktor konversi Faktor konversi = 6.25
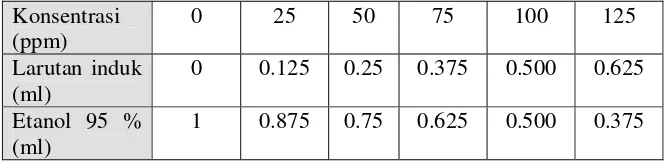
3. Analisis Kadar Total Fenol dengan Metode Chandler dan Dodds yang Dimodifikasi (Shetty et al., 1995 di dalam Radianti, 2005)
Sebanyak 1 ml sampel dimasukkan ke dalam tabung reaksi yang bersih dan ditambahkan 1 ml etanol 95 % dan 5 ml air bebas ion. Selanjutnya ditambahkan pada masing-masing sampel 0.5 ml reagen Folin-Ciocalteu 50 % (v/v) lalu diencerkan dengan air bebas ion. Setelah 5 menit, 1 ml Na2CO3 5 % (w/v) ditambahkan dan diencerkan kembali
dengan air bebas ion (jika terlalu pekat). Setelah itu divorteks dan disimpan pada ruangan gelap selama 60 menit. Sampel dihomogenisasi (divorteks) kembali, dan absorbansinya diukur pada 725 nm.
Sebagai standar digunakan asam tanat. Pembuatan standar asam tanat yaitu dengan cara membuat larutan induk 200 ppm. Penentuan kurva standar dilakukan sama dengan penentuan sampel. Perhitungan total fenol sampel berdasarkan hasil ploting nilai absorbansi pada kurva standar. Seri larutan standar dipersiapkan seperti tabel di bawah ini:
Tabel 3. Seri larutan standar asam tanat Konsentrasi
(ppm)
0 25 50 75 100 125
Larutan induk (ml)
4. Analisis Fitokimia ( Houghton dan Raman, 1998, Dep Kes RI, 2000, di dalam Azima, 2004)
a. Fenol hidrokuinon (Pereaksi FeCl3)
Ekstrak kacang komak sebanyak 0.05 gram dilarutkan dalam 1 ml etanol 70 %. Ekstrak sampel diambil 0.5 ml kemudian ditambahkan 2 tetes larutan FeCl3 5 %. Terbentuknya warna hijau atau
hijau biru menunjukkan adanya senyawa fenol dalam bahan. Senyawa fenol kemungkinan terdapat dalam tanaman dalam bentuk bebas atau dalam bentuk glikosidik.
b. Flavonoid
Ekstrak kacang komak sebanyak 1 mg dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Kemudian larutan ditambahkan beberapa tetes Pb-asetat jenuh. Terbentuknya larutan berwarna merah atau jingga tua menunjukkan reaksi positif. Warna jingga tua menunjukkan adanya senyawa kalkon dan warna merah menunjukkan adanya senyawa auron.
c. Tanin (Pereaksi FeCl3)
Ekstrak kacang komak sebanyak 50 mg ditambahkan air dan dididihkan selama beberapa menit, kemudian ditambahkan beberapa tetes FeCl3 1 %. Terbentuknya warna biru tua atau hitam kehijauan
menunjukkan adanya tanin.
d. Alkaloid
Pereaksi Wagner, dibuat dengan cara: dipipet 1.25 ml akuades ditambahkan 0.31 gram iodin dan 0.25 gram kalium iodida. Kemudian dilarutkan dan diencerkan dengan akuades menjadi 25 ml dalam labu takar. Pereaksi ini berwarna coklat.
Pereaksi Meyer, dibuat dengan cara: 0.136 gram HgCl2
ditambahkan 0.05 gram kalium iodida. Kemudian dilarutkan dan diencerkan dengan akuades menjadi 10 ml dalam labu takar. Pereaksi ini tidak berwarna.
e. Triterpenoid (Uji Liebermann-Burchard)
Ekstrak kacang komak sebanyak 0.05 gram ditambahkan 0.2 ml asam asetat glasial, kemudian ditambahkan 3 tetes asam sulfat pekat. Apabila sampel mengandung terpenoid maka reaksi positif ditandai dengan terbentuknya warna merah dan berubah ke biru.
f. Steroid (Uji Liebermann-Burchard)
Ekstrak kacang komak sebanyak 0.05 gram dilarutkan dalam 0.5 ml kloroform dalam tabung reaksi yang kering. Kemudian ke dalam larutan ditambahkan 0.125 ml asam asetat glasial dan 0.038 ml asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali, kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
g. Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2N, menunjukkan adanya saponin.
disaring untuk mendapatkan filtratnya. Sebanyak 0.5 ml filtrat dimasukkan ke dalam tabung reaksi kering, ditambahkan 0.9 ml HNO3
0.5 M dan 1 ml FeCl3 (dalam tabung reaksi bertutup), divorteks dan
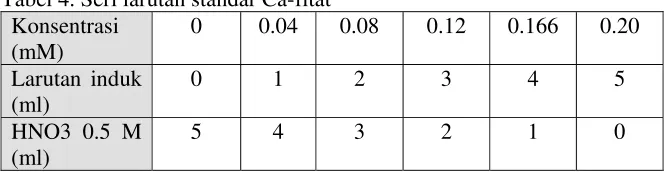
direndam dalam penangas air mendidih selama 20 menit, lalu didinginkan. Campuran dipindahkan ke tabung sentrifuse dan ditambahkan 5 ml amil alkohol lalu divorteks. Sebanyak 0.1 ml amonium tiosianat ditambahkan ke dalam campuran (15 menit sebelum pengukuran absorbansi). Campuran kemudian divorteks dan disentrifuse 1500 rpm selama 2 menit. Lapisan amil alkohol diukur absorbansinya pada panjang gelombang 465 nm (15 menit setelah penambahan amonium tiosianat).
Sebagai standar digunakan Ca-fitat. Penentuan kurva standar dilakukan sama dengan penentuan sampel. Perhitungan fitat sampel berdasarkan hasil ploting nilai absorbansi pada kurva standar. Seri larutan standar dipersiapkan seperti pada Tabel 4.
Tabel 4. Seri larutan standar Ca-fitat Konsentrasi
a. Uji DPPH (Kubo et al., 2002 di dalam Radianti, 2005)
b. Uji Aktivitas Kemampuan Mereduksi dengan Metode Baku (Oyaizu, 1986 di dalam Kardono dan Dewi, 1998)
Ekstrak (10-1000 µg) dalam 1 ml air suling dicampur dengan dapar fosfat (2.5 ml, 0.2M, pH 6.60 dan kalium ferri sianida (K3Fe(CN)6) (2.5 ml, 1 %) dan campuran diinkubasi pada suhu 50ºC
selama 20 menit. Sebanyak 2.5 ml larutan trikholoasetat (TCA) 10 % ditambahkan pada campuran, kemudian disentifuse pada 3000 rpm selama 10 menit. Lapisan atas dari larutan (2.5 ml) ditambahkan dengan air suling (2.5 ml) dan larutan FeCl3 (0.5 ml, 0.1%) dan
serapan diukur pada panjang gelombang 700 nm. Peningkatan absorbansi menunjukkan kekuatan mereduksi yang tinggi.
7. Analisis Statistik
IV. HASIL DAN PEMBAHASAN
A. EKSTRAKSI KACANG KOMAK
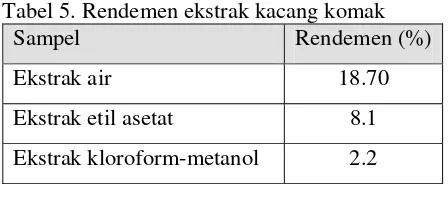
Ekstraksi adalah proses pemisahan komponen-komponen terlarut dari komponen yang tidak larut dari suatu campuran dengan pelarut yang sesuai. Pelarut yang digunakan dalam penelitian ini adalah air, etil asetat dan kloroform-metanol yang memiliki tingkat polaritas yang berbeda-beda. Hal ini bertujuan agar semua komponen yang terdapat pada bahan dapat terwakili.
Air merupakan pelarut yang bersifat polar. Ekstraksi dengan pelarut air diharapkan dapat membawa komponen-komponen polar yang terdapat pada tepung kacang komak. Etil asetat adalah pelarut yang bersifat semipolar. Pemilihan etil asetat sebagai pelarut didasarkan pada asumsi bahwa etil asetat mampu menggabungkan gugus polar dan nonpolar sehingga komponen pada tepung kacang komak yang bersifat polar dan nonpolar dapat terekstrak.
Pelarut kloroform-metanol digunakan pada penelitian ini dengan perbandingan 2:1. Kloroform merupakan pelarut yang bersifat nonpolar sehingga cenderung melarutkan komponen yang bersifat nonpolar. Sedangkan metanol adalah pelarut yang relatif bersifat polar yang cenderung melarutkan komponen yang bersifat polar. Penggabungan pelarut kloroform-metanol dengan perbandingan 2:1 dimaksudkan agar komponen nonpolar lebih banyak terekstrak daripada komponen polar.
Sebelum dilakukan ekstraksi, kacang komak dikeringkan terlebih dahulu. Pengeringan harus dilakukan dalam keadaan terkontrol untuk mencegah terjadinya perubahan kimia yang terlalu banyak (Harborne, 1987). Pada penelitian ini, kacang komak dikeringkan dengan oven pada suhu 50°C. Tujuan pengeringan pada suhu rendah adalah untuk mencegah kerusakan yang terjadi akibat perubahan kimia. Selain itu, keberadaan air dalam jumlah tinggi akan mempengaruhi polaritas pelarut (pengekstrak).
sehingga proses ekstraksi berlangsung lebih baik. Partikel sampel yang halus akan memperluas daya pelarutan sehingga pelarutan komponen pada sampel dapat lebih merata.
Pada tahap akhir ekstraksi dilakukan pemisahan pelarut. Untuk pelarut air dilakukan pemisahan dengan freeze drier. Sedangkan kloroform-metanol dan etil asetat diuapkan dengan rotary vacuum evaporator pada suhu 40°C. Penggunaan suhu penguapan yang relatif rendah diharapkan dapat mencegah kerusakan komponen kimiawi bahan.
Tabel 5. Rendemen ekstrak kacang komak
Sampel Rendemen (%)
Ekstrak air 18.70
Ekstrak etil asetat 8.1 Ekstrak kloroform-metanol 2.2
perbandingan 1:10 dan diatur pH alkali sekitar 8.5 – 8.7 dengan tujuan untuk melarutkan protein. Menurut Cheftel et al. (1985), pemilihan suasana basa sebagai pH selama ekstraksi berdasarkan pada kenyataan bahwa sebagian besar asam amino akan bermuatan negatif pada pH di atas titik isoelektriknya, muatan yang sejenis cenderung untuk tolak menolak, hal ini menyebabkan minimumnya interaksi antara residu-residu asam amino yang berarti kelarutan protein akan meningkat. Setelah diekstrak dan diatur pH menjadi 8.5-8.7, protein yang terlarut dipisahkan dari komponen non protein yang tidak larut dengan cara sentrifuse pada 2000 rpm selama 15 menit. Supernatan yang berupa protein terlarut diendapkan menggunakan HCl 2N pada pH 4.5, yang diperkirakan merupakan titik isoelektriknya. Menurut Thanh & Shibasaki (1976) di dalam Suwarno (2003), pada titik isoelektriknya muatan total masing-masing asam amino dalam protein sama dengan nol, artinya terjadinya keseimbangan antara gugus bermuatan positif dengan gugus bermuatan negatif. Interaksi elektrostatik antara asam amino akan maksimum karena muatan yang tidak sejenis cenderung untuk tarik menarik, fenomena ini dapat diamati dengan terjadinya penggumpalan protein. Protein yang menggumpal kemudian dipisahkan/diendapkan dengan sentrifuse 2000 rpm selama 15 menit. Setelah itu, protein dicuci dan dikeringkan menggunakan freeze-drier.
Tabel 6. Kadar air dan kadar protein fraksi protein dan nonprotein kacang komak
Kadar air rata-rata (%)
Kadar Protein rata-rata (%)
Sampel
Berat basah Berat kering Berat basah Berat kering Fraksi protein
76.45 324.66 3.07 13.06
kadar protein dalam padatan sisa, dilakukan analisis protein menggunakan metode kjeldahl. Hasil kadar protein pada fraksi nonprotein kacang komak yaitu 3.07% (b.b) dan 13.06% (b.k). Kadar air dan kadar protein fraksi protein dan fraksi nonprotein kacang komak dapat dilihat pada Tabel 6.
Fraksi protein memiliki rendemen sebesar 6.70 %. Sedangkan fraksi nonprotein memiliki rendemen sepuluh kali lebih besar dari fraksi protein yaitu sebesar 70.62 %. Komponen yang paling banyak terdapat dalam fraksi nonprotein ini adalah karbohidrat. Menurut Duke (1983), kacang komak memiliki kandungan karbohidrat sebesar 61.4 %. Komponen lain yang terdapat pada fraksi nonprotein ini adalah serat, abu dan lemak. Komposisi kimia kacang komak dapat dilihat pada Tabel 1.
C. AKTIVITAS ANTIOKSIDAN 1. Uji DPPH
Uji DPPH merupakan salah satu metode uji pengukuran aktivitas antioksidan di dalam bahan pangan. Uji DPPH memiliki beberapa kelebihan antara lain uji ini tidak spesifik untuk keterangan komponen antioksidan, tetapi digunakan untuk pengukuran kapasitas antioksidan total pada bahan pangan. Pengukuran total kapasitas antioksidan akan membantu untuk memahami sifat-sifat fungsional bahan pangan. Kelebihan uji DPPH yang lain adalah metode uji pengukuran kapasitas antioksidan yang dilakukan sederhana, cepat dan murah. Berdasarkan alasan tersebut, maka pada penelitian ini digunakan uji DPPH untuk pengukuran aktivitas antioksidan pada ekstrak kacang komak.
maka semakin tinggi kapasitas antioksidan dan dapat dilihat dari semakin pudar warna ungu yang dihasilkan.
Uji DPPH pada penelitian ini menggunakan standar asam askorbat 0, 0.5, 1.0, 1.5, 2.0, 2.5 mM. Dengan demikian, satuan pengukuran dinyatakan sebagai AEAC (Ascorbic Acid Equivalent Antioksidant Capacity). Kurva standar asam askorbat dapat dilihat pada Lampiran 1.
Berdasarkan hasil pengukuran (Gambar 8), aktivitas antioksidan ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol, dan ekstrak etil asetat berturut-turut adalah 10.22, 7.10, 2.63, 1.92, dan 3.13 AEAC. Aktivitas antioksidan yang paling tinggi terdapat pada ekstrak air yaitu sebesar 10.22 AEAC. Sedangkan aktivitas antioksidan yang paling rendah terdapat pada ekstrak kloroform-metanol yaitu sebesar 1.92 AEAC. Angka ini menunjukkan bahwa ekstrak air memiliki aktivitas antioksidan 10.22 kali lebih besar daripada asam askorbat pada konsentrasi yang sama, dan ekstrak kloroform-metanol memiliki aktivitas antioksidan 1.92 kali lebih besar daripada asam askorbat pada konsentrasi yang sama.
EA= Ekstrak Air; FP= Fraksi Protein; FNP= Fraksi Nonprotein; EKM= Ekstrak Kloroform-Metanol; EEA= Ekstrak Etil Asetat
Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan nilai tidak berbeda nyata (uji Duncan α = 5%)
Tingginya aktivitas antioksidan ekstrak air menunjukkan pada ekstrak air banyak terdapat senyawa yang bersifat sebagai antioksidan. Hal ini didukung oleh kadar total fenol dan asam fitat yang tinggi pada ekstrak air serta komponen fitokimia yang banyak terdapat pada ekstrak air seperti fenol hidrokuinon, saponin, tanin, steroid, triterpenoid dan alkaloid yang dapat bersifat sebagai antioksidan. Hasil pengukuran aktivitas antioksidan sampel dengan metode DPPH dapat dilihat pada Lampiran 2.
Selanjutnya data hasil pengukuran aktivitas antioksidan dengan metode DPPH dianalisis secara statistik dengan menggunakan analisis ragam (ANOVA) dan dilanjutkan dengan uji lanjut Duncan pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran aktivitas antioksidan dengan metode DPPH dapat dilihat pada Lampiran 8.
Data hasil pengolahan analisis ragam menunjukkan bahwa nilai signifikansi sampel adalah 0.000 sedangkan nilai signifikansi level adalah 0.05. Nilai signifikansi sampel yang lebih kecil daripada nilai signifikansi level menunjukkan bahwa pada selang kepercayaan 95%, sampel ekstrak kacang komak yang diujikan berbeda nyata.
Data hasil pengolahan dengan uji lanjut Duncan (Lampiran 8) menunjukkan bahwa kelima sampel terbagi dalam tiga subset. Sampel 1 (ekstrak air) berbeda nyata dengan sampel 2 (fraksi protein). Sampel 3 (fraksi nonprotein) tidak berbeda nyata dengan sampel 4 (ekstrak kloroform-metanol) dan tidak berbeda nyata dengan sampel 5 (ekstrak etil asetat). Ketiga sampel ini berbeda nyata dengan sampel 1 (ekstrak air) dan berbeda nyata dengan sampel 2 (fraksi protein).
2. Uji Aktivitas Kemampuan Mereduksi
dilihat dengan cara mengukur absorbansi sampel. Besarnya nilai absorbansi menunjukkan besarnya kemampuan mereduksi pada sampel.
Berdasarkan hasil pengukuran (Gambar 9), uji aktivitas antioksidan dengan uji kemampuan mereduksi menunjukkan bahwa ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol, dan ekstrak etil asetat memiliki absorbansi berturut-turut adalah 0.432, 0.272, 0.270, 0.337 dan 0.285. Absorbansi yang paling tinggi terdapat pada ekstrak air yaitu sebesar 0.432. Nilai ini menunjukkan bahwa ekstrak air memiliki kemampuan mereduksi yang paling tinggi yaitu sebesar 0.432. Hal ini sejalan dengan uji DPPH, serta didukung oleh kadar total fenol dan asam fitat yang tinggi pada ekstrak air dan komponen fitokimia yang banyak terdapat pada ekstrak air seperti fenol hidrokuinon, saponin, tanin, steroid, triterpenoid dan alkaloid yang dapat bersifat sebagai antioksidan. Hasil pengukuran selengkapnya dapat dilihat pada Lampiran 3.
EA= Ekstrak Air; FP= Fraksi Protein; FNP= Fraksi Nonprotein; EKM= Ekstrak Kloroform-Metanol; EEA= Ekstrak Etil Asetat Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan nilai tidak berbeda nyata (uji Duncan α = 5%)
Gambar 9. Aktivitas Antioksidan Ekstrak Kacang Komak (Metode Uji Aktivitas Kemampuan Mereduksi)
kacang komak untuk pengujian kemampuan mereduksi. Menurut Rajeshwar et al. (2005), kemampuan mereduksi Mucuna pruriens (velvet beans) meningkat dengan meningkatnya jumlah sampel. Pada konsentrasi 0.125 mg/ml, Mucuna pruriens (velvet beans) memiliki absorbansi sebesar 0.485. Sedangkan ekstrak air kacang komak yang memiliki absorbansi yang paling tinggi yaitu sebesar 0.432 membutuhkan konsentrasi sebesar 5 mg/ml ekstrak kacang komak.
Data hasil pengukuran aktivitas antioksidan dengan metode uji aktivitas kemampuan mereduksi selanjutnya dianalisis secara statistik dengan menggunakan analisis ragam dan dilanjutkan dengan uji lanjut Duncan pada selang kepercayaan 95%. Hasil pengolahan statistik data hasil pengukuran aktivitas antioksidan dengan metode uji aktivitas kemampuan mereduksi dapat dilihat pada Lampiran 9.
Data hasil pengolahan analisis ragam menunjukkan bahwa nilai signifikansi sampel adalah 0.000 sedangkan nilai signifikansi level adalah 0.05. Nilai signifikansi sampel yang lebih kecil daripada nilai signifikansi level menunjukkan bahwa pada selang kepercayaan 95%, sampel ekstrak kacang komak yang diujikan berbeda nyata.
Data hasil pengolahan dengan uji lanjut Duncan (Lampiran 9) menunjukkan bahwa kelima sampel terbagi dalam empat subset. Sampel 1 (ekstrak air) berbeda nyata dengan sampel 4 (ekstrak kloroform-metanol), berbeda nyata dengan sampel 5 (ekstrak etil asetat) serta berbeda nyata dengan sampel 2 (fraksi protein) dan sampel 3 (fraksi nonprotein). Sampel 2 (fraksi protein) tidak berbeda nyata dengan sampel 3 (fraksi nonprotein).
D. UJI KIMIA 1. Total Fenol
sebagian besar antioksidan dalam bahan asal tanaman merupakan senyawa polifenol. Menurut Shahidi dan Marian (1995), pengujian total fenol bertujuan untuk menentukan total senyawa fenolik yang terkandung di dalam sampel, sehingga diduga bila kandungan senyawa fenolik di dalam sampel tinggi maka aktivitas antioksidannya akan tinggi.
Analisis ini menggunakan kurva standar yang dipersiapkan dengan menggunakan asam tanat di dalam 95 % etanol. Kurva standar menggunakan asam tanat dengan konsentrasi 0, 25, 50, 75 dan 100 ppm. Dari hasil pengujian diperoleh persamaan kurva standar adalah sebagai berikut: Y = 0.0078x – 0.0057 dengan R2 = 0.9997. Kurva standar asam tanat pada analisis total fenol dapat dilihat pada Lampiran 4.
Berdasarkan hasil pengukuran, kadar total fenol ekstrak air, fraksi protein, fraksi nonprotein, ekstrak kloroform-metanol, dan ekstrak etil asetat berturut-turut adalah 23285.64, 4585.64, 4738.21, 5304.87, dan 15722.82 ppm (Gambar 10). Hasil pengukuran total fenol selengkapnya dapat dilihat pada Lampiran 5.
EA= Ekstrak Air; FP= Fraksi Protein; FNP= Fraksi Nonprotein; EKM= Ekstrak Kloroform-Metanol; EEA= Ekstrak Etil Asetat
Nilai yang diikuti oleh huruf yang sama pada grafik menunjukkan nilai tidak berbeda nyata (uji Duncan α = 5%)
Gambar 10. Kadar Total Fenol Ekstrak Kacang Komak
terhadap kadar total fenol. Pelarut yang sesuai untuk mengekstrak total fenol adalah pelarut yang bersifat polar seperti air. Menurut Harborne (1987), senyawa fenol cenderung larut dalam pelarut air karena umumnya berikatan dengan gula sebagai glikosida.
Ekstrak air kacang komak memiliki kadar total fenol yang tinggi. Kadar total fenol ekstrak air kacang komak (23285.64 ppm) lebih besar bila dibandingkan dengan kadar total fenol ekstrak air dan ekstrak etanol dari kacang kedelai. Hasil penelitian McCuoa et al. (2004) menunjukkan bahwa ekstrak air dari kacang kedelai mengandung 11330 ppm dan ekstrak etanol dari kacang kedelai mengandung 5840 ppm. Kadar total fenol kacang komak (23285.64 ppm) juga lebih tinggi dibandingkan dengan kadar total fenol biji kering kacang hijau. Hasil penelitian Anggraeni (2003) menunjukkan bahwa biji kering kacang hijau varietas No. 129, Gelatik, Merak, Merpati dan Betet berturut-turut adalah 230, 210, 164, 177 dan 179 ppm. Sedangkan Bila dibandingkan dengan Mucuna pruriens (velvet beans), kadar total fenol ekstrak kacang komak (23285.64 ppm) lebih rendah. Rajeshwar et al. (2005) menemukan bahwa kadar total fenol yang terdapat pada Mucuna pruriens (velvet beans) adalah sebesar 32000 ppm.
Ekstrak air dari kacang komak diduga memiliki antioksidan yang tinggi, karena mengandung total fenol yang tinggi. Hal ini sejalan dengan uji aktivitas antioksidan metode DPPH dan uji kemampuan mereduksi serta didukung oleh kadar asam fitat yang tinggi pada ekstrak air dan komponen fitokimia yang banyak terdapat pada ekstrak air seperti fenol hidrokuinon, saponin, tanin, steroid, triterpenoid dan alkaloid yang dapat bersifat sebagai antioksidan. Menurut Meskin et al. (2002), kacang-kacangan mengandung campuran beberapa senyawa fenol yang dapat berfungsi sebagai antioksidan dan pencegahan berbagai penyakit.