TESIS
SINTESIS PORFIRIN PEMBAWA GUGUS KARBOKSILAT
SEBAGAI LIGAN UNTUK KIT RADIOFARMAKA
OLEH:
HENNY SRI WAHYUNI
NIM 087014016
PROGRAM STUDI MAGISTER DAN DOKTOR ILMU FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
SINTESIS PORFIRIN PEMBAWA GUGUS KARBOKSILAT
SEBAGAI LIGAN UNTUK KIT RADIOFARMAKA
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh Gelar Magister Sains dalam Ilmu Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
HENNY SRI WAHYUNI
NIM 087014016
PROGRAM STUDI MAGISTER DAN DOKTOR ILMU FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN TESIS
Nama Mahasiswa : Henny Sri Wahyuni No. Induk Mahasiswa : 087014016
Program Studi : Magister Farmasi
Judul Tesis : Sintesis Porfirin Pembawa Gugus Karboksilat Sebagai Ligan Untuk Kit Radiofarmaka
Tempat dan Tanggal Ujian Lisan Tesis : Medan, 4 Agustus 2011
Menyetujui:
Komisi Pembimbing,
Ketua, Anggota,
Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt Prof. Dr. Daryono Hadi Tjahjono, M.Sc. NIP 195306191983031001 NIP 131994284
Ketua Program Studi, Dekan,
PENGESAHAN TESIS
Nama Mahasiswa : Henny Sri Wahyuni No. Induk Mahasiswa : 087014016
Program Studi : Magister Farmasi
Judul Tesis : Sintesis Porfirin Pembawa Gugus Karboksilat Sebagai Ligan Untuk Kit Radiofarmaka
Telah diuji dan dinyatakan LULUS di depan Tim Penguji Tesis pada hari Kamis, tanggal 4, bulan Agustus, tahun 2011
Mengesahkan:
Tim Penguji Tesis
Ketua Tim Penguji : Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt.
Anggota Tim penguji : Prof. Dr. Daryono Hadi Tjahjono, M.Sc.
Dr. M. Pandapotan NST,MPS., Apt.
ABSTRAK
Senyawa porfirin dan turunannya banyak dipelajari sebagai fotosensitizer dalam terapi fotodinamik sebagai salah satu metode pengobatan dan diagnosa kanker ataupun tumor. Porfirin dapat dimodifikasi strukturnya baik pada substituen meso atau pada pusat molekulnya melaui kompleksasi dengan ion logam sehingga mudah dilabel dengan radionuklida. Selain dapat meningkatkan kelarutan, modifikasi struktur molekul porfirin juga dapat diarahkan untuk mendesain senyawa ligan dalam pembuatan kit radiofarmaka untuk diagnosis dan terapi kanker.
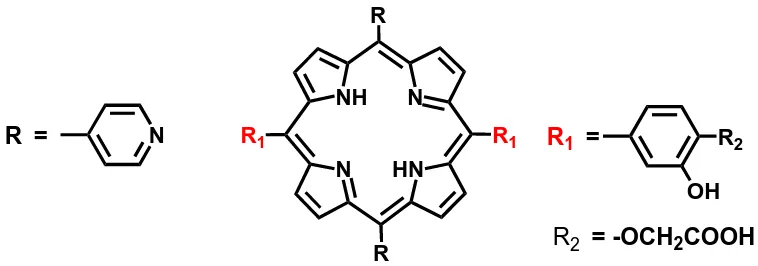
Penelitian ini bertujuan untuk mensintesis senyawa porfirin dengan substituen meso yang mengandung gugus yang dapat dilabel sebagai kandidat senyawa ligan yang akan dikembangkan menjadi kit radiofarmaka dalam diagnosis kanker. Sintesis senyawa porfirin menggunakan 3-hidroksi-4-karboksimetilenoksibenzaldehid, pirol dan 4-piridinkarboksaldehid dalam asam propanoat dilakukan pada suhu 150oC-160oC selama 4 jam pada lingkungan atmosfer nitrogen. Karakterisasi senyawa porfirin yang dihasilkan berdasarkan titik leleh, spektrum sinar tampak, spektrum infra merah, dan spektrum 1H RMI.
5,10,15,20-tetrakis(piridil)porfirin (H2TPyP) dan
5,10-bis(piridil)-15,20-bis[(3-hidroksi-4-karboksimetilenoksi)fenil]porfirin (H2BPyCP). H2TPyP berupa
serbuk ungu yang meleleh pada suhu di atas 300oC. Panjang gelombang absorpsi maksimum (λmax/nm) pada spektrum sinar tampak adalah 416, 512, 545, 587, dan
642. Spektrum infra merah (cm-1) menunjukkan adanya pita =NH pada 3367,1 dan C=C pada 1457,9.Pergeseran kimia ( /ppm) H2TPyP dengan 1H RMI (500
MHz, CDCl3, TMS) adalah –2,93 (s, 2H, inner N-H), 7,12 (s, 8H, pirol -H),
8,16-8,17 (d, 8H, piridin 2-H dan 4-H), 9,07-9,08 (d, 8H, piridin 1-H dan 5-H). H2TPyP dapat disintesis dengan rendemen sebesar 10,4% (51 mg). H2BPyCP
berupa serbuk hijau kecoklatan yang meleleh pada suhu 192oC-195oC. Panjang gelombang absorpsi maksimum (λmax/nm) pada spektrum sinar tampak adalah
415, 511, 546, 588, dan 644. Spektrum infra merah (cm-1) menunjukkan adanya gugus OH dari COOH pada 3428,8, C=O pada 1558,2 dan CO pada 1415,49. Pergeeseran kimia ( /ppm) 1H-RMI (500 Hz, D2O/DMSO, TMS) menunjukkan
sinyal geseran kimia proton pada –3,09 (s, 2H, inner N-H), 4,62 (s, 4H, CH2
pada benzen karboksilat), 7,02-7,03 (d, 2H, benzen karboksilat 1’-H), 7,33 (s, 2H, benzen karboksilat 4’-H), 7,45-7,46 (d, 2H, benzen karboksilat 2’-H), 7,72-7,73 (d, 4H, piridin 2-H dan 4-H), 8,45 (s, 4H, pirol -H), 8,59-8,61 (d, 4H, piridin 1-H dan 5-H), 9,69 (s, 4H, pirol -H). Senyawa H2BPyCP dapat disintesis
dengan rendemensebesar 33,42% (213 mg).
ABSTRACT
Porphyrin and its derivatives are widely investigated as photosensitizers for photodynamic therapy in diagnoses and treatment of cancer or tumor. Structure of the porphyrin can be modified either at the meso position or in the center of the molecule with metal ions thus it is easily labeled with small radionuclides. Beside to improve its solubility, modification of the molecular structure of porphyrin can also be used to design ligand for radiopharmaceutical kit for the diagnosis and therapy of cancer.
The purposes of this research was to synthesize porphyrin with meso -substituent which bearing function group for labelling with radionuclide as ligand candidate to be developed as a radiopharmaceutical kits for cancer diagnosis. Synthesis of porphyrin was performed using 4-caboxymethylenoxybenzaldehyde, pyrrole and 4-pyridinecarboxaldehyde in propionic acid and was conducted at temperature of 150oC-160oC for 4 hours in nitrogen atmosphere. Reaction produced 5,10,15,20-tetrakis(pyridyl)porphyrin (H2TPyP) and
5,10-bis(pyridyl)-15,20-bis[(3-hydroxy-4-carboxymetilenoxy)phenyl]porphyrin (H2BPyCP). Caracterizations of
synthesized porphyrins were based on melting point, visible absorption spectrum, infra-red spectrum and the 1H-NMR spectrum.
H2TPyP is purple solid (51 mg, 10.35% yield) with melting point of
above 300oC. It has maximum absorption at wavelengths (λmax/nm) of 416, 512,
545, 587, and 642. Infra-red spectrum (cm-1) showed a band of =NH at 3367.1 and C=C at 1457.92.Chemical shifts ( /ppm) of H2TPyP (1H-NMR, 500 MHz,
CDCl3, TMS) were –2.93 (s, 2H, inner N-H), 7.12 (s, 8H, pyrrol -H), 8.16-8.17
(d, 8H, pyridine 2-H dan 4-H), 9.07-9.08 (d, 8H, pyridine 1-H and 5-H). H2BPyCP was brownish green solid (213 mg, 33.42% yield) with melting point
of 192oC-195oC. Maximum absorption wavelengths (λmax/nm) of H2BPyCP were
415, 511, 546, 588, and 644. Infra-red spectrum (cm-1) showed a band of OH group of –COOH at 3428.81, C=O at 1558.2 and CO at 1415.49. Chemical shifts ( /ppm) of H2BPyCP(1H-NMR, 500 Hz, D2O/DMSO, TMS) were –3.09 (s, 2H,
inner N-H), 4.62 (s, 4H, CH2 of benzene), 7.02-7.03 (d, 2H, benzene 1’-H), 7.33
(s, 2H, benzene 4’-H), 7.45-7.46 (d, 2H, benzene 2’-H), 7.72-7.73 (d, 4H, pyridine 2-H dan 4-H), 8.45 (s, 4H, pyrrol -H), 8.59-8.61 (d, 4H, pyridine 1-H and 5-H), 9.69 (s, 4H, pyrrol -H).
KATA PENGANTAR
Puji syukur penulis panjatkan ke hadirat Allah SWT atas rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan tesis dengan judul “Sintesis
Porfirin Pembawa Gugus Karboksilat Sebagai Ligan Untuk Kit Radiofarmaka” sebagai
salah satu syarat untuk mencapai gelar Magister Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara.
Selama menyelesaikan penelitian dan tesis ini penulis telah banyak
mendapatkan bantuan dan dorongan dari berbagai pihak, baik moril maupun
materil. Untuk itu penulis ingin menghaturkan penghargaan dan terima kasih
yang tiada terhingga kepada :
1. Prof. Dr. rer. nat. Effendy De Lux Putra, SU., Apt dan Prof. Dr. Daryono
Hadi Tjahjono, M.Sc. sebagai pembimbing, atas segala saran, bimbingan, dan
nasehatnya selama penelitian berlangsung dan selama penulisan tesis ini.
2. Dekan Fakultas Farmasi Universitas Sumatera Utara, Bapak Prof. Dr.
Sumadio Hadisahputra, Apt., yang telah menyediakan fasilitas dan
kesempatan bagi penulis menjadi mahasiswa Program Studi Magister
Farmasi Fakultas Farmasi.
3. Dekan Sekolah Farmasi Institut Teknologi Bandung, Bapak Prof. Dr.
Daryono Hadi Tjahjono, M.Sc. dan Bapak Prof. Dr. Slamet Ibrahim
Surantaatmadja (KK Farmakokimia-Fakultas Farmasi ITB) atas kesediaannya
memberikan izin penggunaan fasilitas laboratorium Farmakokimia ITB
4. Ibu Sofa Fajriani atas bantuannya dalam pengukuran spektrum RMI di LIPI
Serpong.
5. Orangtua, keluarga tercinta, Bapak Fauzan Zein, Ibu Asmiyenti Djaliasrin,
dan teman-teman seperjuangan di Pascasarjana Sekolah Farmasi ITB dan
USU yang telah bersedia membantu, memberikan doa dan dukungan moral
selama penulis menyelesaikan tesis ini.
6. Staf dan karyawan Sekolah Farmasi ITB dan USU yang telah banyak
membantu selama penulis menyelesaikan tesis ini.
Serta buat semua pihak yang tidak dapat penulis sebutkan satu per satu
yang telah banyak membantu dalam penelitian tesis ini. Kiranya Allah SWT
memberikan balasan yang berlipat ganda atas kebaikan dan bantuan yang telah
diberikan kepada penulis.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan,
sehingga penulis mengharapkan kritik dan saran yang bersifat membangun.
Semoga tesis ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya
bidang farmasi.
Medan, September 2011 Penulis,
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
PERSETUJUAN TESIS ... iii
PENGESAHAN TESIS ... iv
ABSTRAK ... v
ABSTRACT ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... ix
DAFTAR SINGKATAN DAN LAMBANG ... xii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN... xvi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Kerangka Pikir Penelitian ... 4
1.3 Perumusan masalah ... 4
1.4 Hipotesis ... 5
1.5 Tujuan Penelitian ... 5
1.6 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1.1 Sintesis Porfirin ... 7
2.1.2 Aksi Fotodinamik ... 8
2.2 Modifikasi Molekul ... 9
2.3 Radiofarmasi ... 10
2.4 Kromatografi ... 11
2.4.1 Kromatografi Lapis Tipis ... 11
2.4.2 Kromatografi Kolom... 12
2.4.3 Kromatografi Pertukaran Ion ... 13
2.5 Spektrofotometri Ultra Violet dan Tampak ... 13
2.6 Spektrofotometri Infra Merah ... 15
2.7 Spektrometri Resonansi Magnet Inti (RMI) ... 17
BAB III METODOLOGI PENELITIAN ... 19
3.1 Desain Penelitian ... 19
3.2 Tempat dan Waktu Penelitian ... 19
3.3 Alat-alat... 19
3.4 Bahan-bahan... 20
3.5 Pelaksanaan Penelitian ... 20
3.5.1 Sintesis Senyawa Benzaldehid Karboksilat ... 20
3.5.2 Analisis Hasil Sintesis Senyawa Benzaldehid Karboksilat ... 21
3.5.2.1 Identifikasi dan Uji Kemurnian Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat ... 21
3.5.2.2 Karakterisasi Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat ... 21
3.5.2.2.2 Analisis Spektrum 1H-RMI dan 13C-RMI .... 22
3.5.3 Sintesis Senyawa Porfirin ... 22
3.5.4 Analisis Hasil Sintesis Senyawa Porfirin ... 22
3.5.4.1 Pemisahan Zat Hasil Sintesis Senyawa Porfirin ... 22
3.5.4.2 Pemisahan Pita 4 Hasil Kromatografi Kolom... 23
3.5.4.3 Pemurnian Pita-Pita Hasil Kromatografi Kolom ... 23
3.5.4.3.1 Pemurnian Pita 4 dengan Kromatografi Kolom Resin Ion Exchange ... 23
3.5.4.3.2 Rekristalisasi Pita 1 dan Pita 4 ... 23
3.5.4.4 Identifikasi dan Uji Kemurnian Pita-Pita Hasil Kromatografi Kolom... 24
3.5.4.4.1 Identifikasi dan Uji Kemurnian Pita 1 ... 24
3.5.4.4.2 Identifikasi dan Uji Kemurnian Pita 4 ... 24
3.5.4.4.3 Penentuan Titik Lebur... 25
3.5.4.5 Karakterisasi Pita-Pita Hasil Kromatografi Kolom... 25
3.5.4.5.1 Analisis Spektrum Serapan UV-Vis ... 25
3.5.4.5.2 Analisis Spektrum Infra Merah... 25
3.5.4.5.3 Analisis Spektrum 1H-RMI... ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
BAB V SIMPULAN DAN SARAN ... 53
DAFTAR SINGKATAN DAN LAMBANG
Singkatan Nama Pemakaian
pertama kali
Photo Dynamic Therapy Deoxyribonuclei acid
Kromatografi Lapis Tipis
Retardation factor Infra Red
Kromatografi Lapis Tipis Kinerja Tinggi
DAFTAR TABEL
Halaman
Tabel 4.1 Nilai Rf 3-hidroksi-4-karboksimetilenoksibenzaldehid Pada
Berbagai Komposisi Pengembang ... 28
Tabel 4.2 Bilangan Gelombang dan Gugus Fungsi
3-hidroksi-4-karboksimetilenoksibenzaldehid... 30
Tabel 4.3 Nilai Rf Senyawa Pita 1 Pada Berbagai Komposisi
Pengembang ... 39
Tabel 4.4 Nilai Rf Senyawa Pita 4 Pada Berbagai Komposisi
Pengembang ... 41
Tabel 4.5 Bilangan Gelombang Dan Gugus Fungsi Senyawa
Porfirin Pita 1 ... 45
Tabel 4.6 Bilangan Gelombang Dan Guus Fungsi Senyawa
Porfirin Pita 4 ... 46
Tabel 4.7 Interpretasi Pergeseran Kimia Dengan Struktur Yang
Beresonansi Pada Senyawa Pita 1... 48
Tabel 4.8 Interpretasi Pergeseran Kimia Dengan Struktur Yang
DAFTAR GAMBAR
Halaman
Gambar 1.1 Struktur Kimia Senyawa Kationik Porfirin
dengan meso-substituen ... 2
Gambar 1.2 Modifikasi Struktur Senyawa Kationik Porfirin dengan meso-substituen piridin dan karboksilat... 3
Gambar 2.1 Cincin Tetrapirol Porfirin... 6
Gambar 2.2 Spektrum Sinar Tampak Senyawa Porfirin... 7
Gambar 2.3 Energi Transisi Elektronik ... 14
Gambar 4.1 Skema Reaksi Sintesis 3-hidroksi-4-karboksimetilenoksibenzaldehid... 27
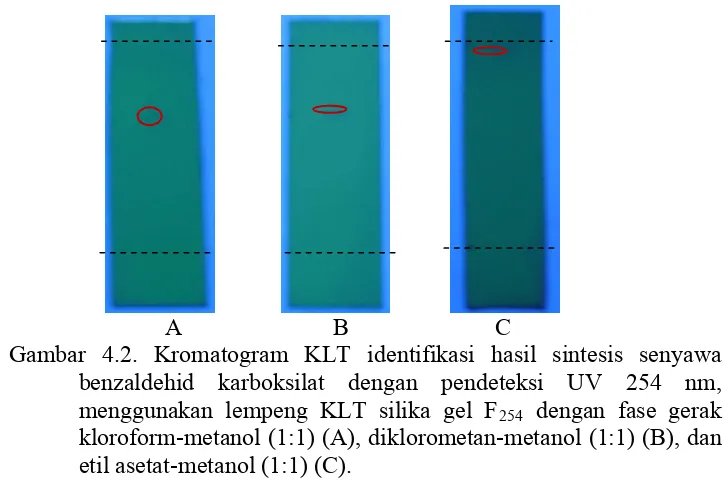
Gambar 4.2 Kromatogram KLT Identifikasi Hasil Sintesis Senyawa Benzaldehid Karboksilat dengan Pendeteksi UV 254 nm ... 28
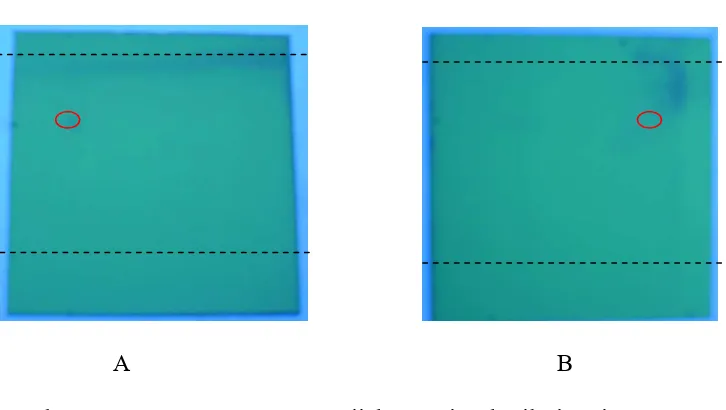
Gambar 4.3 Kromatogram KLT Uji Kemurnian Hasil Sintesis Senyawa Benzaldehid Karboksilat dengan Pendeteksi UV 254 nm ... 29
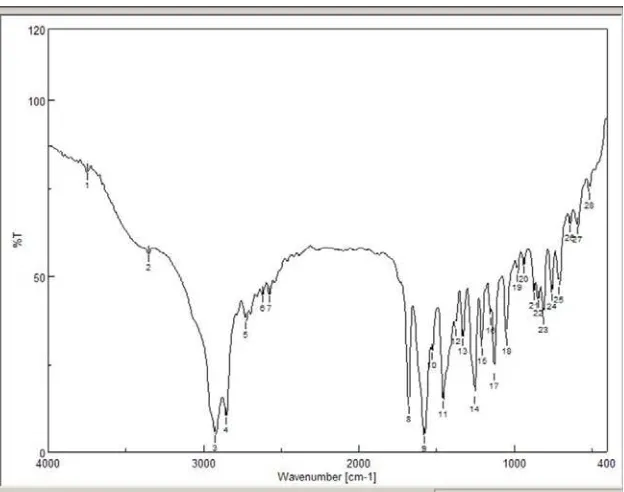
Gambar 4.4 Spektrum Infra Merah 3-hidroksi-4-karboksimetilenoksibenzaldehid... 30
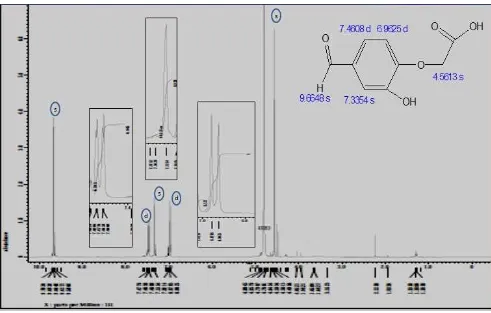
Gambar 4.5 Spektrum 1H-RMI 3-hidroksi-4-karboksimetilenoksibenzaldehid dalam Pelarut D2O ... 31
Gambar 4.7 Reaksi Sintesis Porfirin ... 35
Gambar 4.8 Kromatogram KLT Pemisahan Pita 4 Dengan Fase Diam Silika gel F254 dan Pengembang Etil Asetat-Metanol (1:2) .... 37
Gambar 4.9 Kromatogram KLT Identifikasi Pita 1 Dengan Pendeteksi UV 254 nm ... 38
Gambar 4.10 Kromatogram KLT Uji Kemurnian Senyawa Porfirin Pita 1 dengan Pendeteksi UV 254 nm... 39
Gambar 4.11 Kromatogram KLT Identifikasi Pita 4 dengan Pendeteksi UV 254 nm... 40
Gambar 4.12 Kromatogram KLT Uji Kemurnian Seyawa Porfirin Pita 4 dengan Pendeteksi UV 254 nm... 42
Gambar 4.13 Spektrum Serapan Sinar Tampak Senyawa Porfirin Pita 1... 43
Gambar 4.14 Spektrum Serapan Sinar Tampak Senyawa Porfirin Pita 4... 43
Gambar 4.15 Spektrum Infra Merah Senyawa Porfirin Pita 1 ... 45
Gambar 4.16 Spektrum Infra Merah Senyawa Porfirin Pita 4 ... 46
Gambar 4.17 Spektrum 1H-RMI Senyawa Porfirin Pita 1 ... 47
DAFTAR LAMPIRAN
Halaman
Lampiran1. Perbandingan Spektrum Infra Merah Senyawa Pita1
(dengan keempat substituen piridin) dengan
Bahan baku tetra metil piridil porfirin para toluensulfonat ... 57
Lampiran 2. Spektrum 1H-RMI bahan baku
ABSTRAK
Senyawa porfirin dan turunannya banyak dipelajari sebagai fotosensitizer dalam terapi fotodinamik sebagai salah satu metode pengobatan dan diagnosa kanker ataupun tumor. Porfirin dapat dimodifikasi strukturnya baik pada substituen meso atau pada pusat molekulnya melaui kompleksasi dengan ion logam sehingga mudah dilabel dengan radionuklida. Selain dapat meningkatkan kelarutan, modifikasi struktur molekul porfirin juga dapat diarahkan untuk mendesain senyawa ligan dalam pembuatan kit radiofarmaka untuk diagnosis dan terapi kanker.
Penelitian ini bertujuan untuk mensintesis senyawa porfirin dengan substituen meso yang mengandung gugus yang dapat dilabel sebagai kandidat senyawa ligan yang akan dikembangkan menjadi kit radiofarmaka dalam diagnosis kanker. Sintesis senyawa porfirin menggunakan 3-hidroksi-4-karboksimetilenoksibenzaldehid, pirol dan 4-piridinkarboksaldehid dalam asam propanoat dilakukan pada suhu 150oC-160oC selama 4 jam pada lingkungan atmosfer nitrogen. Karakterisasi senyawa porfirin yang dihasilkan berdasarkan titik leleh, spektrum sinar tampak, spektrum infra merah, dan spektrum 1H RMI.
5,10,15,20-tetrakis(piridil)porfirin (H2TPyP) dan
5,10-bis(piridil)-15,20-bis[(3-hidroksi-4-karboksimetilenoksi)fenil]porfirin (H2BPyCP). H2TPyP berupa
serbuk ungu yang meleleh pada suhu di atas 300oC. Panjang gelombang absorpsi maksimum (λmax/nm) pada spektrum sinar tampak adalah 416, 512, 545, 587, dan
642. Spektrum infra merah (cm-1) menunjukkan adanya pita =NH pada 3367,1 dan C=C pada 1457,9.Pergeseran kimia ( /ppm) H2TPyP dengan 1H RMI (500
MHz, CDCl3, TMS) adalah –2,93 (s, 2H, inner N-H), 7,12 (s, 8H, pirol -H),
8,16-8,17 (d, 8H, piridin 2-H dan 4-H), 9,07-9,08 (d, 8H, piridin 1-H dan 5-H). H2TPyP dapat disintesis dengan rendemen sebesar 10,4% (51 mg). H2BPyCP
berupa serbuk hijau kecoklatan yang meleleh pada suhu 192oC-195oC. Panjang gelombang absorpsi maksimum (λmax/nm) pada spektrum sinar tampak adalah
415, 511, 546, 588, dan 644. Spektrum infra merah (cm-1) menunjukkan adanya gugus OH dari COOH pada 3428,8, C=O pada 1558,2 dan CO pada 1415,49. Pergeeseran kimia ( /ppm) 1H-RMI (500 Hz, D2O/DMSO, TMS) menunjukkan
sinyal geseran kimia proton pada –3,09 (s, 2H, inner N-H), 4,62 (s, 4H, CH2
pada benzen karboksilat), 7,02-7,03 (d, 2H, benzen karboksilat 1’-H), 7,33 (s, 2H, benzen karboksilat 4’-H), 7,45-7,46 (d, 2H, benzen karboksilat 2’-H), 7,72-7,73 (d, 4H, piridin 2-H dan 4-H), 8,45 (s, 4H, pirol -H), 8,59-8,61 (d, 4H, piridin 1-H dan 5-H), 9,69 (s, 4H, pirol -H). Senyawa H2BPyCP dapat disintesis
dengan rendemensebesar 33,42% (213 mg).
ABSTRACT
Porphyrin and its derivatives are widely investigated as photosensitizers for photodynamic therapy in diagnoses and treatment of cancer or tumor. Structure of the porphyrin can be modified either at the meso position or in the center of the molecule with metal ions thus it is easily labeled with small radionuclides. Beside to improve its solubility, modification of the molecular structure of porphyrin can also be used to design ligand for radiopharmaceutical kit for the diagnosis and therapy of cancer.
The purposes of this research was to synthesize porphyrin with meso -substituent which bearing function group for labelling with radionuclide as ligand candidate to be developed as a radiopharmaceutical kits for cancer diagnosis. Synthesis of porphyrin was performed using 4-caboxymethylenoxybenzaldehyde, pyrrole and 4-pyridinecarboxaldehyde in propionic acid and was conducted at temperature of 150oC-160oC for 4 hours in nitrogen atmosphere. Reaction produced 5,10,15,20-tetrakis(pyridyl)porphyrin (H2TPyP) and
5,10-bis(pyridyl)-15,20-bis[(3-hydroxy-4-carboxymetilenoxy)phenyl]porphyrin (H2BPyCP). Caracterizations of
synthesized porphyrins were based on melting point, visible absorption spectrum, infra-red spectrum and the 1H-NMR spectrum.
H2TPyP is purple solid (51 mg, 10.35% yield) with melting point of
above 300oC. It has maximum absorption at wavelengths (λmax/nm) of 416, 512,
545, 587, and 642. Infra-red spectrum (cm-1) showed a band of =NH at 3367.1 and C=C at 1457.92.Chemical shifts ( /ppm) of H2TPyP (1H-NMR, 500 MHz,
CDCl3, TMS) were –2.93 (s, 2H, inner N-H), 7.12 (s, 8H, pyrrol -H), 8.16-8.17
(d, 8H, pyridine 2-H dan 4-H), 9.07-9.08 (d, 8H, pyridine 1-H and 5-H). H2BPyCP was brownish green solid (213 mg, 33.42% yield) with melting point
of 192oC-195oC. Maximum absorption wavelengths (λmax/nm) of H2BPyCP were
415, 511, 546, 588, and 644. Infra-red spectrum (cm-1) showed a band of OH group of –COOH at 3428.81, C=O at 1558.2 and CO at 1415.49. Chemical shifts ( /ppm) of H2BPyCP(1H-NMR, 500 Hz, D2O/DMSO, TMS) were –3.09 (s, 2H,
inner N-H), 4.62 (s, 4H, CH2 of benzene), 7.02-7.03 (d, 2H, benzene 1’-H), 7.33
(s, 2H, benzene 4’-H), 7.45-7.46 (d, 2H, benzene 2’-H), 7.72-7.73 (d, 4H, pyridine 2-H dan 4-H), 8.45 (s, 4H, pyrrol -H), 8.59-8.61 (d, 4H, pyridine 1-H and 5-H), 9.69 (s, 4H, pyrrol -H).
BAB I PENDAHULUAN
1.1 Latar Belakang
Penyakit kanker menjadi penyebab kematian sekitar 7 juta penduduk
dunia pada tahun 2008 dengan jumlah kasus baru pada tahun yang sama sekitar
12 juta (Boyle dan Levin, 2008).
Selama ini penanganan/pengobatan penyakit kanker dilakukan dengan
penyinaran, kemoterapi, atau kombinasi keduanya, dan pengangkatan jaringan
kanker. Pengobatan dengan penyinaran hingga kini masih belum dapat
memberikan hasil yang memuaskan, sedangkan kemoterapi sering
menimbulkan/menginduksi kanker primer kedua sebagai akibat dari sifat
karsinogenik yang umumnya juga dimiliki oleh senyawa yang digunakan.
Demikian juga pengangkatan jaringan kanker juga masih sering tidak sempurna
(Penn, 1986). Oleh karena itu, usaha untuk menemukan senyawa baru dengan
aktivitas antikanker yang aman dalam penggunaannya dan pengembangan teknik
penanganan penyakit kanker sangat giat dilakukan oleh industri farmasi dan
pusat-pusat riset di seluruh dunia.
Porfirin dan turunannya telah banyak dipelajari sebagai fotosensitizer
untuk terapi fotodinamik sebagai salah satu metode pengobatan kanker maupun
tumor (Bonnet, 2000; Hargus, 2005). Turunan porfirin ini memiliki toksisitas
yang rendah untuk jaringan yang sehat dan kelarutannya juga rendah dalam air
yang rendah maka beberapa penelitian banyak mensintesis turunan porfirin yang
dimodifikasi strukturnya, bentuk kationiknya serta memformulasinya dengan
suatu pembawa yang dapat meningkatkan kelarutan porfirin dalam air (Kralova
et. al. 2010; Schiavon, et al. 2000; Tjahjono, et. al., 1999, 2000).
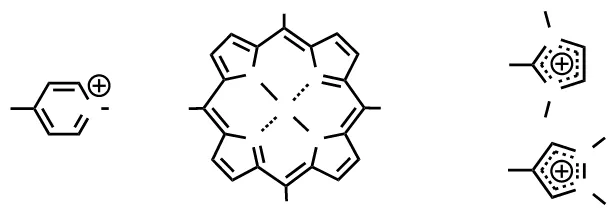
Dari penelitian sebelumnya telah disintesis senyawa kationik porfirin
dengan meso-substituen aromatis bercincin lima, yaitu imidazolium dan
pyrazolium (Gambar 1.1).
Gambar 1.1. Struktur kimia senyawa kationik porfirin dengan meso-substituen: (a) pyridinium, (b) imidazolium dan (c) pyrazolium; M = H2, Cu(II), Zn(II),
Ni(II), Mn(III) (Tjahjono, et. al., 1999, 2000).
Senyawa ini dapat memodifikasi struktur dan sifat fisik DNA melalui
interaksi non-kovalen dan sekaligus mampu memotong DNA secara selektif dan
efektif (Tjahjono, et.al., 1999, 2000, 2001, 2006). Disamping itu senyawa
kationik porfirin telah diketahui dapat berikatan secara selektif dengan sel kanker
dan/atau DNA sel kanker dan mempunyai konstanta ikatan lebih besar dibanding
dengan DNA sel normal (Izbicka, et.al., 1999; Hurley, et.al., 2000).
Senyawa porfirin dapat dimodifikasi struktur kimianya, baik pada meso
-substituennya, atau pada pusat molekulnya dengan ion logam. Oleh karena itu
senyawa ini dengan mudah dilabel dengan radionuklida, baik pemancar
digunakan sebagai ligan untuk pembuatan kit radiofarmaka untuk diagnosis dan
terapi kanker. Namun demikian, karena radionuklida baik pemancar maupun
pemancar , seperti 99mTc dan 188Re memiliki radius atom yang cukup besar
maka koordinasi radionuklida tersebut dengan keempat inner nitrogen sangat
sulit dilakukan dan membutuhkan waktu yang lama (Tjahjono, dkk., 2006). Oleh
karena itu salah satu alternatif untuk melabel senyawa kationik porfirin adalah
dengan menambahkan atom pendonor pada substituen meso yang dapat
membentuk ikatan koordinasi dengan radionuklida tersebut, seperti struktur yang
sedang dikembangkan saat ini (Gambar I.2)
R
Gambar 1.2. Modifikasi struktur senyawa kationik porfirin dengan
meso-substituen piridinium dan karboksilat
Berdasarkan pemaparan di atas, maka perlu dilakukan penelitian untuk
mendesain dan mensintesis senyawa porfirin dengan substituen meso yang
berbeda yang dapat dilabel dengan radionuklida pemancar sebagai calon ligan
1.2Kerangka Pikir Penelitian
Variabel bebas Variabel terikat
Parameter
KLT: Harga Rf
Kromatografi Kolom Rekristalisasi: Titik lebur
Elusidasi struktur: Spektrofotometri
UV-Vis
Spektrofotometri IR
RMI Senyawa benzaldehid
karboksilat
Senyawa porfirin
Senyawa piridylaldehid
1.3 Perumusan Masalah
Berdasarkan uraian pada latar belakang yang dijabarkan di atas, maka
rumusan masalah penelitian adalah apakah senyawa porfirin dengan substituen
meso yang memiliki gugus yang dapat dilabel dengan radionuklida dapat
disintesis untuk menjadi calon senyawa ligan yang akan dikembangkan menjadi
1.4 Hipotesis Penelitian
Berdasarkan rumusan masalah penelitian di atas, maka hipotesis
penelitian adalah senyawa porfirin dengan substituen meso yang memiliki gugus
yang dapat dilabel dengan radionuklida dapat disintesis untuk menjadi calon
senyawa ligan yang akan dikembangkan menjadi kit radiofarmaka untuk
diagnosis kanker.
1.5 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mensintesis senyawa porfirin dengan
substituen meso yang yang memiliki gugus yang dapat dilabel dengan
radionuklida sebagai calon senyawa ligan yang akan dikembangkan menjadi kit
radiofarmaka untuk diagnosis kanker.
1.6 Manfaat Penelitian
Penelitian ini diharapkan akan memberikan kontribusi yang sangat berarti
bagi pengembangan ilmu pengetahuan dan teknologi khususnya di bidang
farmasi dan kedokteran, dan dalam jangka panjang diharapkan akan membantu
masyarakat dalam memperoleh kemudahan dan terjangkaunya biaya diagnosis
BAB II
TINJAUAN PUSTAKA
2.1Porfirin
Porfirin merupakan suatu senyawa organik yang banyak terdapat di alam.
Paling dikenal sebagai pigmen dalam sel darah merah. Porfirin merupakan
senyawa aromatik heterosiklik makrosiklik yang tersusun oleh empat cincin pirol
dan dihubungkan oleh empat jembatan metin interpirol. Struktur cincin tetrapirol
pada porfirin ditunjukkan oleh Gambar 2.1. Adanya jembatan metin akan
menghasilkan senyawa makrosiklik porfirin dengan ikatan rangkap yang
terkonjugasi (Ongayi, 2005).
Gambar 2.1 Cincin tetrapirol porfirin.
Porfirin memiliki karakteristik berupa kristal berwarna ungu tua yang
dalam kloroform akan memberikan larutan berwarna ungu kemerahan dan
menunjukkan fluoresensi merah yang kuat pada radiasi daerah ultraviolet.
Porfirin merupakan senyawa berbentuk planar, larut sempurna dalam pelarut
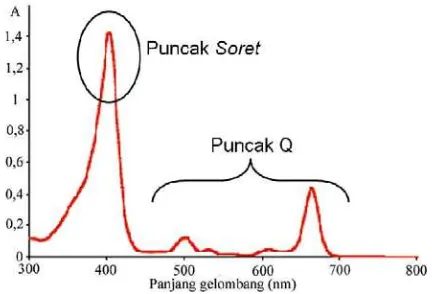
tampak porfirin sangat khas. Pada sekitar 400 nm terdapat puncak yang kuat ( ~
200000) disebut puncak Soret atau B, sedangkan di daerah 500-600 nm biasanya
terdapat 4 pita yang berbeda, yang disebut puncak Q seperti yang terdapat pada
gambar 2.2 (Bonnett, 2000).
Gambar 2.2. Spektrum Sinar Tampak Senyawa Porfirin
Variasi yang terjadi pada gugus samping dari cincin porfirin,
pembentukan kompleks dengan logam, dan perubahan pH akan mengakibatkan
sedikit pergeseran pada intensitas dan panjang gelombang absorpsi, yang
umumnya hanya mempengaruhi puncak Q, sedangkan apabila cincin porfirin
rusak, akan mengakibatkan hilangnya puncak Soret. Setiap sistem tetrapirol
bersifat unik sehingga akan memiliki warna yang berbeda-beda (Jiao, 2007).
2.1.1 Sintesis Porfirin
Sintesis kimia senyawa porfirin merupakan subjek yang berkembang
dengan baik. Metode dasar untuk sintesis porfirin pertama kali dikembangkan
oleh Hans Fischer. Sampai dengan saat ini, beberapa metode telah dikembangkan
untuk mensintesis porfirin dari berbagai senyawa, seperti tetramerisasi monopirol
dipirometan (metode Fischer dan metode MacDonald), dan siklisasi dari rantai
tetrapirol yang terbuka. Substituen divariasikan untuk memberikan jangkauan
dari kemampuan ikatan hidrogen untuk mengubah kelarutan, polaritas, dan
interaksi dengan sisi reseptor (Bonnett, 2000; Gottumukkala, 2006).
2.1.2 Aksi Fotodinamik
Aksi fotodinamik merupakan ungkapan dari efek fotodinamik, yakni
perusakan jaringan hidup oleh radiasi sinar tampak dengan keberadaan
fotosensitizer dan oksigen. Porfirin memiliki tiga keuntungan secara umum
sebagai zat fotodinamik yaitu: absorbsi yang kuat di daerah sinar tampak,
sehingga bahan yang dibutuhkan hanya sedikit; stabilitas terhadap cahaya; dan
secara umum toksisitasnya rendah dalam kondisi gelap (Bonnett, 2000).
Terapi fotodinamik merupakan teknik terapi yang mengkombinasikan
akumulasi fotosensitizer pada sel target dengan penyinaran, oleh karena itu
teknik terapi ini selektif. Radiasi yang diberikan akan menembus jaringan tubuh,
menyebabkan fotosensitizer tereksitasi yang kemudian akan bereaksi dengan
molekul oksigen dan substrat dan menghasilkan spesi yang sangat sitotoksik,
seperti oksigen singlet, anion superoksida, dan radikal hidroksi, yang akan
menyebabkan kerusakan sel tumor (Pandey dan Zheng, 2000).
Kation porfirin juga dapat bertindak sebagai penghambat telomerase
manusia, suatu reseptor untuk peptida dan pembelah DNA. Sejauh ini meso
-tetrakis(N-metil-piridinium-4-yl)porfirin (H2TMPyP) dan derivatnya dikenal
sebagai kation porfirin dengan substituen siklik bercincin 6 pada posisi meso.
interkalasi dan dua mode ikatan pada sisi luar DNA. Mode ikatan luar yang
pertama adalah ikatan sisi luar dengan penempatan porfirin pada celah minor
melalui interaksi elektronik dengan gugus fosfat, dan mode ikatan luar kedua dari
interaksi di sisi luar adalah porfirin teragregasi disepanjang untai DNA. Pada
umumnya ikatan porfirin terhadap DNA distabilkan oleh interaksi elektronik
antara substituen meso yang bermuatan positif pada perifer porfirin dan muatan
negatif atom oksigen-fosfat dari DNA (Tjahjono et al., 2000).
Kation porfirin terutama TMPyP4 merupakan penghambat telomerase
pada konsentrasi mikromolar rendah. Lebih jauh lagi porfirin ini relatif non
toksik terhadap sel (baik tumor dan normal) pada level yang dapat menghambat
telomerase. Telemorase sudah menunjukkan peranan langsung dalam mitosis,
suatu blok fisik dalam pemisahan kromosom anafase yang disebabkan oleh
mutasi dari model telomerase. Suatu implikasi dari hal ini adalah bahwa porfirin
(sebagai agen interaktif telomere) dapat menangkap sel-sel dalam mitosis
(Izbicka, et al.,1999).
2.2 Modifikasi Molekul
Modifikasi molekul merupakan metode yang digunakan untuk
mendapatkan obat baru dengan aktivitas yang dikehendaki, antara lain yaitu
meningkatkan aktivitas obat, menurunkan efek samping atau toksisitas,
meningkatkan selektivitas obat, memperpanjang masa kerja obat, meningkatkan
kenyamanan penggunaan obat dan meningkatkan aspek ekonomis obat
Menurut Siswandono dan Soekardjo (2000), dasar modifikasi molekul
adalah mengembangkan struktur senyawa induk yang telah diketahui aktivitas
biologisnya, kemudian disintesis dan diuji aktivitas homolog atau analognya.
Modifikasi molekul mempunyai beberapa keuntungan sebagai berikut:
a. Kemungkinan besar senyawa homolog atau analog mempunyai sifat
farmakologi serupa dengan senyawa induk, dibanding dengan senyawa yang
didapatkan dengan cara seleksi atau sintesis secara acak.
b. Kemungkinan lebih besar untuk mendapatkan produk dengan aktivitas
farmakologi lebih tinggi.
2.3 Radiofarmasi
Menurut Depkes RI (1979), sediaan radiofarmasi adalah sediaan yang
mengandung satu jenis radionuklida atau lebih. Nuklida merupakan jenis atom
yang dapat dikenal karena:
a. Banyaknya proton dan netron yang terdapat dalam inti atomnya
b. Tingkat energi tinggi.
Bahan radioaktif sering dihubungkan dengan pengobatan kanker. Oleh
karena itu, hampir 80% digunakan dalam tehnik diagnosa untuk jangkauan
penyakit yang luas. Radionuklida digunakan dalam pengobatan yang memiliki
batas kehidupan fisik yang berarti bahwa radioaktivitasnya berkurang dengan
2.4 Kromatografi
Kromatografi merupakan cara pemisahan berdasarkan partisi cuplikan
antara fase yang bergerak, dapat berupa gas atau zat cair, dan fase diam, dapat
berupa zat cair atau zat padat (Johnson dan Stevenson, 1991).
Pada hakikatnya kromatografi digunakan untuk pemakaian kualitatif,
kuantitatif, dan preparatif. Pertama, pemakaian kromatografi secara kualitatif
mengungkapkan ada atau tidak adanya senyawa tertentu dalam cuplikan.
Campuran dikromatografi pada berbagai kondisi dan bahkan dengan beberapa
cara atau cara gabungan. Jumlah bercak atau puncak menunjukkan jumlah
minimum komponen campuran. Dua keuntungan utama kromatografi sebagai
metode kualitatif yaitu cuplikan senyawa yang dibutuhkan untuk analisis sangat
sedikit dan biasanya waktu analisis pendek. Kedua, kromatografi kuantitatif
menunjukkan banyaknya masing-masing komponen campuran, nisbi terhadap
komponen lain atau sebagai kuantitatif mutlak jika memakai standar
(pembanding baku) dan kalibrasi yang sesuai. Ketiga, kromatografi preparatif
dipakai untuk memperoleh komponen campuran dalam jumlah yang memadai
dalam keadaan murni sehingga komponen itu dapat dicirikan lebih lengkap atau
dipakai pada reaksi berikutnya. KLT preparatif yang dilakukan pada lapisan
sampai setebal 1 cm (kromatografi lapis tebal) mempunyai keuntungan sederhana
dan murah (Gritter dkk., 1991).
2.4.1 Kromatografi Lapis Tipis
Kromatografi lapis tipis (KLT) merupakan salah satu bentuk kromatografi
Cara ini bergantung pada antaraksi khas linarut dengan permukaan serbuk halus
penjerap (Johnson dan Stevenson, 1991). Setiap analit yang terlarut dalam fase
gerak bila melewati fase diam akan teradsorpsi dengan afinitas yang berbeda
sehingga terjadi pemisahan analit dari campurannya (Braithwaite dan Smith,
1999).
KLT dapat dipakai pada beberapa tingkat kerumitan. KLT dengan
kerumitan yang meningkat adalah KLT pada kaca objek atau lapisan tipis, KLT
berukuran besar, KLT preparatif, KLT kuantitatif, dan KLTKT (Gritter dkk.,
1991).
Menurut Mulja dan Suharman (1995), perilaku senyawa tertentu di dalam
sistem kromatografi tertentu dinyatakan dengan harga Rf (faktor retardasi).
Faktor retardasi untuk tiap-tiap noda kromatogram dapat didefenisikan sebagai:
2.4.2 Kromatografi Kolom
Kromatografi kolom merupakan bentuk kromatografi cair. Cara
mengemas kolom ada dua yaitu cara kering dan cara lumpuran. Fase diam
ditempatkan di dalam tabung kaca berbentuk silinder, pada bagian bawah
tertutup dengan katup atau keran, dan fase gerak dibiarkan mengalir ke bawah
melaluinya karena gaya berat. Campuran yang dipisahkan diletakkan berupa pita
pada bagian atas kolom penjerap yang berada dalam tabung kaca, tabung logam,
atau bahkan tabung plastik. Mekanisme pemisahannya berdasarkan perbedaan
migrasi komponen-komponen akibat perbedaan distribusi pada dua fase yang
adsorpsi (fase diam berupa zat padat dan fase gerak berupa zat cair) atau partisi
(fase diam dan fase gerak berupa zat cair) (Gritter dkk., 1991; Johnson dan
Stevenson, 1991).
2.4.3. Kromatografi Pertukaran Ion
Kromatografi pertukaran ion dilakukan jika cuplikan mengandung
komponen analisis berupa ion dan larut dalam air. Fase gerak biasanya
mengandung ion lawan yang muatannya berlawanan dengan muatan gugus ion
permukaan. Ion lawan tersebut berkesetimbangan dengan damar dalam bentuk
pasangan ion. Adanya ion linarut yang muatannya sama dengan muatan ion
lawan menimbulkan kesetimbangan. Pada proses pertukaran kation, ion lawan
ialah Na(+) dan pada pertukaran anion, ion lawannya Cl(-) (Johnson dan
Stevenson, 1991).
2.5 Spektrofotometri Ultra Violet dan Tampak
Spektrofotometri ultraviolet dan tampak merupakan teknik analisis
spektroskopik yang memanfaatkan sumber radiasi elektromagnetik ultra violet
dekat (190-380 nm) dan sinar tampak (380-780 nm) dengan menggunakan
instrumen spektrofotometer (Mulja dan Suharman, 1995).
Apabila pada suatu molekul dikenakan radiasi elektromagnetik maka
akan terjadi eksitasi elektron ke tingkat energi yang lebih tinggi yang dikenal
sebagai orbital elektron “anti bonding”. Eksitasi elektron (σ σ*) memberikan
energi yang terbesar dan terjadi pada daerah ultra violet jauh yang diberikan oleh
rangkap dua dan tiga juga menjadi pada daerah ultra violet jauh. Pada gugus
karbonil akan terjadi eksitasi elektron (n σ*) yang terjadi pada daerah ultra
violet jauh. Senyawa-senyawa organik dan semua gugus yang mengabsorbsi
radiasi uv-vis yang disebut sebagai kromofor. Pada senyawa organik dikenal pula
gugus auksokrom, adalah gugus fungsionil yang mempunyai elektron bebas
seperti –OH, O-NH2 dan OCH3 yang memberikan transisi (n - σ*). Terikatnya
gugus auksokrom oleh gugus kromofor akan mengakibatkan pergeseran pita
absorpsi menuju ke panjang gelombang yang lebih panjang (pergeseran merah =
batokromik) (Mulja dan Suharman, 1995).
Gambar 2.3 Energi transisi elektronik (http://www.chemicalforums.com).
Suatu molekul yang sederhana apabila dikenakan radiasi elektromagnetik
akan mengabsorbsi radiasi elektromagnetik yang energinya sesuai. Interaksi
tersebut akan meningkatkan energi potensial elektron pada tingkat keadaan
eksitasi. Apabila pada molekul yang sederhana tadi hanya terjadi transisi
elektronik pada satu macam gugus, maka akan terjadi satu absopsi yang
Menurut Satiadarma dkk. (2004), persamaan untuk menghitung
serapan/absorbansi (A) yang dikenal dengan hukum Lambert-Beer, yaitu :
A= . l . c
Keterangan: A = besarnya serapan
= absortivitas molar (M-1cm-1)
l = tebal kuvet (cm)
c = konsentrasi larutan (M)
2.6 Spektrofotometri Infra Merah
Daerah infra merah terletak antara spektrum radiasi elektromagnetik
cahaya tampak dan spektrum radiasi radio, yakni antara 4000 dan 400 cm-1. Jika
radiasi inframerah dilewatkan melalui sampel senyawa organik, maka
terdapat sejumlah energi yang diserap dan yang ditransmisikan tanpa diserap.
Molekul yang menyerap energi infra merah akan mengalami perubahan energi
vibrasi dan perubahan tingkat energi rotasi sehingga menghasilkan suatu frekuensi
yang khas (Silverstein, et al., 2005; Skoog, et al., 1998).
Terdapat dua macam getaran molekul, yaitu getaran ulur (stretching)
dan getaran tekuk (bending). Getaran ulur adalah suatu gerakan berirama di
sepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang.
Getaran tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara
ikatan-ikatan pada sebuah atom, atau karena gerakan sebuah gugusan atom
terhadap sisa molekul tanpa gerakan nisbi atom-atom di dalam gugusan
Bentuk dan struktur molekul juga menjadi penentu terjadinya interaksi
radiasi infra merah dengan molekul. Molekul yang simetris dalam arti kata
kedua gugus molekul atau atom mempunyai keelektronegatifan yang sama
sehingga tidak terjadi perbedaan muatan listrik pada kedua kutub. Dengan
demikian medan listrik infra merah tidak berinteraksi dengan molekul dan
lebih jauh molekul itu tidak akan mengalami perubahan-perubahan vibrasi
karena tidak menyerap radiasi infra merah. Sebaliknya untuk molekul yang
tidak simetris akan terjadi perbedaan muatan listrik pada kedua kutubnya.
Molekul tersebut tiap-tiap gugus akan mempunyai vibrasi alamiah yang
besarnya berbeda-beda. Apabila vibrasi alamiah gugus molekul cocok
dengan frekuensi radiasi infra merah maka akan terjadi interaksi medan
listrik yang menyebabkan perubahan-perubahan vibrasi yang menandakan
terjadinya absorbsi radiasi infra merah oleh gugus molekul. Perubahan energi
vibrasi molekul pasti akan diikuti perubahan amplitudo vibrasi molekul yang
dikenal sebagai tanggapan radiasi infra merah (sinyal) (Mulja dan Suharman,
1995).
Spektrum serapan radiasi yang terbentuk, khas untuk molekul senyawa
organik yang bersangkutan dan dapat digunakan untuk analisis kualitatif,
sedangkan serapan pada frekuensi khas tertentu sebanding dengan banyaknya
molekul yang menyerap radiasi dan dapat digunakan untuk analisis kuantitatif
2.7 Spektrometri Resonansi Magnet Inti (RMI)
Spektrometri Resonansi Magnet Inti merupakan bentuk lain dari
spektrometri serapan. Dalam RMI senyawa menyerap energi pada daerah
frekuensi radio dari spektrum elektromagnetik dibawah pengaruh medan magnet
yang kuat. Radiasi pada daerah frekuensi radio digunakan untuk mengeksitasi
atom, biasanya atom proton atau karbon-13 (Silverstein et al., 2005; Watson,
1999).
Proton yang akan ditentukan dengan spektrometer RMI berada di dalam
lingkungan atom-atom yang lain. Momen magnet inti setiap atom di dalam
molekul berbeda-beda besarnya. Karena setiap proton di dalam molekul zat
organik beraneka ragam maka setiap proton di dalam molekul zat organik
memberikan tetapan perisai (σ) yang berbeda. Pergeseran kimia ( ) adalah posisi
frekuensi resonansi sebuah proton tertentu dalam pengaruh medan magnet luar
berkekuatan tertentu yang posisinya berbeda terhadap proton standar internal.
Pergeseran kimia dinyatakan sebagai ppm (part per million). Jika proton berada
dalam lingkungan kerapatan elektron yang tinggi maka akan menunjukkan harga
σ yang tinggi, demikian juga akan bergeser pada harga yang tinggi. Sebaliknya
akan rendah pada keadaan lingkungan proton dengan kerapatan elektron rendah
(Silverstein et al., 2005)
Pada spektrometer RMI tampak puncak-puncak kasar (satu puncak)
karena kemampuan resolusi spektrometer RMI masih rendah. Akan tetapi saat ini
sudah dikenal spektrometer proton RMI dengan daya resolusi tinggi yang akan
memberikan puncak-puncak halus dan dapat langsung menggambarkan jumlah
spin-spin splitting. Proton-proton yang berdekatan dan mempunyai perbedaan
lingkungan elektronik (tidak setara) akan saling mempengaruhi, dan akibatnya
akan terjadi pemisahan tiap-tiap sinyal (Skoog, et al., 1998).
Spektrometri 1H-RMI didasarkan pada penyerapan gelombang radio oleh
inti-inti tertentu dalam molekul organik menggunakan hidrogen sebagai proton.
Begitu juga halnya dengan spektrometri 13C-RMI yang akan memberikan
informasi keadaan atom-atom karbon dalam sebuah molekul organik. Walaupun
inti-inti 13C yang bertetangga dalam sebuah molekul akan memecahkan sinyal,
tetapi pada akhirnya tidak terjadi pola pemisahan 13C satu dengan lainnya pada
spektrum 13C. Spektrum 13C tidak akan dapat diintegrasi, hal ini disebabkan
adanya proses pengendoran pada proses hilangnya energi yang diserap oleh 13C.
Luas di bawah puncak pada spektrum 13C-RMI tidak harus menunjukkan
kesetaraan dengan jumlah atom 13C sebagai akibat pengendoran energi pada 13C.
Satu hal lagi yang sangat menguntungkan pada 13C-RMI yaitu terjadinya
pergeseran kimia yang lebih besar ke arah bawah medan dari puncak TMS,
dibandingkan pergeseran kimia pada proton. Geseran kimia ( ) pada proton 0-10
ppm bawah medan puncak TMS, sedangkan pada 13C di dapat variasi harga =
0-200 ppm. Pelebaran rentang akan lebih menyederhanakan spektrum RMI 13C
dibanding spektrum RMI proton sebab pada 13C kemungkinan terjadinya
BAB III
METODOLOGI PENELITIAN
Penelitian ini adalah penelitian deskriptif (descriptif research), karena
penelitian bertujuan menggambarkan sifat dari suatu keadaan yang terdapat pada
sintesis serta karakterisasi senyawa porfirin dengan meso-substituen
piridin-karboksaldehid dan benzaldehid karboksilat.
3.1 Desain Penelitian
Penelitian ini dilakukan melalui beberapa tahapan kerja, yaitu: sintesis,
pemurnian dan karakterisasi senyawa benzaldehid karboksilat; sintesis,
pemurnian dan karakterisasi senyawa porfirin.
3.2 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Kelompok Keilmuan Farmakokimia
Sekolah Farmasi ITB dan LIPI Serpong. Waktu penelitian adalah mulai
November 2010 sampai dengan Juni 2011.
3.3 Alat-alat
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas
laboratorium sesuai dengan kebutuhan, neraca analitik (Mettler AE 200),
seperangkat alat desikator vakum, penguap putar vakum, alat kromatografi, hot
(Macherey-nagel), alat penentu titik lebur (Melting Point Apparatus SMP 30), corong
buchner, oven, seperangkat alat destilasi, spektrofotometer UV-Vis Beckman
coulter DU 720, FT/IR-4200 JASCO, spektrometer massa (Waters LCT Premier
XE ESI TOFF), 1H-NMR JEOL JNM ECA 500 MHz. Lampu UV dengan
panjang gelombang 254 nm.
3.4 Bahan-bahan
Bahan-bahan yang digunakan dalam penelitian meliputi kalium karbonat
(Sigma), 3,4-dihidroksi benzaldehid 97% (Fluka), aseton p.a (Merck),
etilkloroasetat 99% (Sigma), pirol (Sigma), piridinkarboksaldehid 97% (Sigma),
kertas saring, lempeng aluminium KLT silika gel F254 (Merck), lempeng
aluminium KLT alumina (Merck), silika gel 60 (Merck), alumina basa (Merck),
dowex X-8. Pelarut yang digunakan dalam penelitian ini berderajat kemurnian
pro analisis yaitu asam propanoat, metanol, kloroform, diklorometan, n-heksan,
etil asetat; berderajat teknis yaitu metanol, koroform, etil asetat, dan air suling.
3.5 Pelaksanaan Penelitian
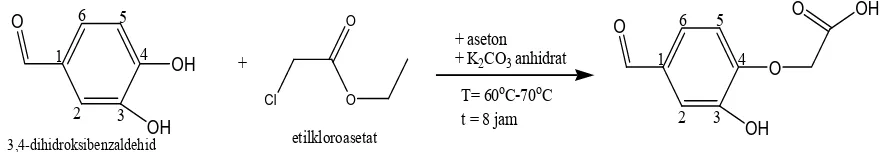
3.5.1 Sintesis Senyawa Benzaldehid Karboksilat
Sebanyak 5,0153 g kalium karbonat anhidrat dimasukkan ke dalam labu
reaksi. Ditambahkan 75 ml aseton dan ditambahkan 35 ml (0,3 mol)
etilkloroasetat. Campuran reaksi dipanaskan hingga mendidih pada suhu 60o
C-70oC. Kemudian ditambahkan 3,5 g (0,3 mol) 3,4-dihidroksibenzaldehid.
Campuran reaksi direfluks selama 8 jam hingga terbentuk endapan. Endapan
dengan menggunakan pelarut kloroform:air destilasi (1:1). Fraksi yang larut
dalam air destilasi diuapkan dan disaring. Padatan yang diperoleh kemudian
dikarakterisasi.
3.5.2 Analisis Hasil Sintesis Senyawa Benzaldehid Karboksilat
3.5.2.1 Identifikasi dan Uji Kemurnian Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat
Identifikasi dan uji kemurnian dilakukan menggunakan lempeng
aluminium KLT silika gel F254 dengan menggunakan 3 jenis pengembang dan
secara 2 dimensi. Pengembang yang digunakan untuk identifikasi dan uji
kemurnian terdiri dari pengembang kloroform:metanol (1:1),
diklorometan:metanol (1:1), dan etil asetat: metanol (1:1), Untuk uji kemurnian
secara 2 dimensi, dimensi pertama menggunakan pengembang campuran
kloroform:metanol (1:1) dan dimensi kedua menggunakan campuran
diklorometan:metanol (1:1). Bercak yang dihasilkan dideteksi menggunakan
lampu UV 254 nm.
3.5.2.2 Karakterisasi Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat 3.5.2.2.1 Analisis Spektrum Infra Merah
Sebanyak 1 bagian serbuk senyawa aldehid dicampur dengan 100 bagian
KBr, digerus hingga homogen. Campuran dikempa menjadi plat yang tipis dan
transparan. Kemudian lempeng tersebut diidentifikasi dengan JASCO FT/IR
3.5.2.2.2 Analisis Spektrum 1H-RMI dan 13C-RMI
Pengukuran spektrum 1H-RMI dan 13C-RMI dilakukan di Laboratorium
RMI Pusat Penelitian Kimia-LIPI Serpong dengan menggunakan pelarut D2O
dengan frekuensi 500 MHz.
3.5.3 Sintesis Senyawa Porfirin
Sebanyak 60 ml asam propanoat direfluks hingga mendidih dengan suhu
150o-160oC. Kemudian ditambahkan 0,5 g (1,6 mmol)
3-hidroksi-4-karboksimetilenoksibenzaldehid, 151 µl (1,6 mmol) 4-piridinkarboksaldehid dan
224 µl (3,2 mmol) pirol. Campuran reaksi direfluks selama 4 jam. Kemudian
pelarut dievaporasi sampai kering. Hasil reaksi yang terbentuk dicek
spektrumnya dengan spektrofotometri UV, diisolasi dan dimurnikan.
3.5.4 Analisis Hasil Sintesis Senyawa Porfirin
3.5.4.1 Pemisahan Zat Hasil Sintesis Senyawa Porfirin
Pemisahan zat hasil sintesis senyawa porfirin dilakukan dengan
menggunakan KLT dan kromatografi kolom. Endapan hasil sintesis
ditambahkan beberapa tetes NaOH 0,01 N kemudian ditotolkan pada lempeng
KLT alumina basa. Lempeng tersebut dikembangkan dengan menggunakan
campuran kloroform-metanol (2:1). Setelah dikembangkan, hasil kromatografi
lapis tipis dilihat di bawah lampu UV 254 nm. Kemudian dilanjutkan dengan
kromatografi kolom dengan sistem bertahap (stepwise elution). Fase diam yang
kemudian metanol dan air suling sedangkan yang masih tertinggal pada fase
diam dilarutkan dalam larutan NaOH 0,01 N. Diperoleh 4 pita dari hasil
kromatografi kolom. Masing-masing pita yang diperoleh dari hasil kromatografi
kolom diuapkan dan dikeringkan dalam desikator vakum.
3.5.4.2 Pemisahan Pita 4 Hasil Kromatografi Kolom
Pita 4 hasil kromatografi kolom dalam larutan NaOH 0.01 N diisolasi
kembali dengan menggunakan KLT dan kromatografi kolom. Pita 4 ditotolkan
pada lempeng KLT silika gel F254. Lempeng tersebut dikembangkan dengan
menggunakan pengembang etil asetat-metanol (1:2). Setelah dikembangkan,
hasil kromatografi lapis tipis dilihat di bawah lampu UV 254 nm. Kemudian
dilanjutkan dengan kromatografi kolom dengan fase diam silika gel F254 dan fase
gerak campuran etil asetat-metanol (1:2). Hasil elusi yang diperoleh diuapkan
dan dikeringkan dalam desikator vakum.
3.5.4.3 Pemurnian Pita-Pita Hasil Kromatografi Kolom
3.5.4.3.1 Pemurnian Pita 4 dengan Kromatografi Kolom Resin Ion Exchange Hasil kromatografi kolom pita 4 yang kedua dimurnikan kembali dengan
sistem kromatografi kolom resin ion exchange. Fase diam damar (Dowex X-8)
dengan fase gerak air suling dan HCl 0,01 N. Hasil elusi yang diperoleh diuapkan
dan dikeringkan dalam desikator vakum.
3.5.4.3.2 Rekristalisasi Pita 1 dan 4
Larutan pita 1 dan 4 masing-masing dipekatkan hingga tepat jenuh.
terjadi kekeruhan. Dibiarkan selama tiga puluh menit kemudian disaring
menggunakan corong buchner.
3.5.4.4 Identifikasi dan Uji Kemurnian Pita-Pita Hasil Kromatografi Kolom 3.5.4.4.1 Identifikasi dan Uji Kemurnian Pita 1
Sedikit serbuk pita 1 dilarutkan dalam kloroform dan diidentifikasi
menggunakan plat alumina basa dengan tiga jenis pengembang dan diuji
kemurniannya secara dua dimensi. Pengembang yang digunakan terdiri dari
campuran kloroform-metanol (1:1), campuran diklorometan-metanol-air destilasi
(2:2:1), campuran kloroform-etil asetat (4:1). Untuk uji kemurnian secara dua
dimensi, dimensi pertama menggunakan pengembang campuran
kloroform-metanol (1:1) dan dimensi kedua campuran diklorometan-kloroform-metanol-air suling
(2:2:1). Setelah dikembangkan, hasil kromatografi lapis tipis dilihat di bawah
lampu UV 254 nm.
3.5.4.4.2 Identifikasi dan Uji Kemurnian Pita 4
Sedikit serbuk pita 4 dilarutkan dalam air suling dan diidentifikasi
menggunakan plat silika gel F254 dengan tiga jenis pengembang dan diuji
kemurniannya secara dua dimensi. Pengembang yang digunakan terdiri dari
campuran etil asetat-metanol (1:1), campuran diklorometan-metanol (1:1), dan
campuran metanol-air destilasi (1:2). Untuk uji kemurnian secara dua dimensi,
dimensi pertama menggunakan pengembang campuran etil asetat-metanol (1:1)
dan dimensi kedua campuran diklorometan-metanol (1:1). Setelah dikembangkan
3.5.4.4.3 Penentuan Titik Lebur
Penentuan titik lebur dilakukan dengan menggunakan alat Elektrotermal
9100. Masing-masing serbuk pita 1 dan pita 4 yang telah digerus halus dan
dikeringkan dalam desikator, dimasukkan secukupnya ke dalam pipa kapiler
kaca yang salah satu ujungnya terbuka. Kemudian dimampatkan dan diukur titik
leburnya
3.5.4.5 Karakterisasi Pita-Pita Hasil Kromatografi Kolom 3.5.4.5.1 Analisis Spektrum Serapan UV-Vis
Pita 1, 2, 3, dan 4 masing-masing diukur secara spektrofotometri
menggunakan spektrofotometer UV-Vis Beckman coulter DU 720 pada rentang
panjang gelombang 300-700 nm.
3.5.4.5.2 Analisis Spektrum Infra Merah
Sebanyak 1 bagian serbuk pita 1 dicampur dengan 100 bagian KBr,
digerus hingga homogen. Campuran dikempa menjadi plat yang tipis dan
transparan. Kemudian lempeng tersebut diidentifikasi dengan JASCO FT/IR
4200 pada rentang bilangan gelombang 4000-400 cm-1. Hal yang sama dilakukan
untuk pita 4.
3.5.4.5.3 Analisis Spektrum 1H-RMI
Pengukuran spektrum 1H-RMI pita 1 dan pita 4 dilakukan di
Laboratorium RMI Pusat Penelitian Kimia-LIPI Serpong dengan menggunakan
BAB IV
HASIL DAN PEMBAHASAN
4.1 Sintesis Senyawa Benzaldehid Karboksilat
Pada penelitian ini dilakukan asetilasi gugus hidroksi pada 3,4
dihidroksibenzaldehid menghasilkan suatu ester dan dilanjutkan dengan reaksi
hidrolisis. Diawali dengan penambahan etilkloroasetat yang direaksikan dengan
3,4 dihidroksibenzaldehid dan dihidrolisis dengan adanya air (Shetty et al.,
1995). Adapun skema dan kondisi reaksinya dapat diihat pada gambar 4.1.
Perubahan yang terjadi selama proses sintesis yaitu larutan berwarna
putih pada saat pencampuran kalium karbonat dan etilkloroasetat dalam aseton.
Kemudian penambahan 3,4 dihidroksibenzaldehid ke dalam campuran
menghasilkan larutan berwarna kecoklatan. Selama proses reaksi terjadi
perubahan dari larutan coklat menghasilkan endapan berwarna putih kekuningan
pada hasil reaksi. Campuran reaksi diuapkan. Endapan yang terbentuk dipisahkan
dengan disaring dan dicuci.
Reaksi hidrolisis pada hasil reaksi ini terjadi pada saat endapan
diekstraksi dengan campuran kloroform:air destilasi (1:1). Melarutnya endapan
pada fraksi air, menunjukkan bahwa senyawa
3-hidroksi-4-karboksimetilenoksibenzaldehid yang bersifat polar telah terbentuk. Proses
ekstraksi bertujuan untuk memisahkan hasil reaksi dari zat-zat pengotor serta
menghidrolisis hasil reaksi sehingga diperoleh senyawa benzaldehid yang
OH
Gambar 4.1.Skema reaksi sintesis 3-hidroksi-4-karboksimetilenoksibenzaldehid
Secara teoritis kemungkinan reaksi yang terjadi pada sintesis senyawa
3-hidroksi-4-karboksimetilenoksibenzaldehid adalah penggantian atom hidrogen
dari gugus hidroksil dengan suatu gugus asetil (CH3CO) menghasilkan suatu
ester yang khas. Setelah proses asetilasi terbentuk, dilanjutkan dengan reaksi
hidrolisis. Molekul air menyerang karbon karbonil dan membentuk suatu zat
antara tetrahedral. Perpindahan proton dari ion hidronium ke molekul air kedua
menghasilkan suatu ester hidrat. Pemindahan proton dalam molekul
menghasilkan gugus pergi alkohol, dan pada hasil akhirnya akan terbentuk suatu
asam dan karboksilat (Sarker dan Nahar, 2009).
4.2 Analisis Hasil Sintesis Senyawa Benzaldehid Karboksilat
4.2.1 Identifikasi dan Uji Kemurnian Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat
Identifikasi padatan hasil sintesis senyawa benzaldehid karboksilat secara
KLT dilakukan dengan menggunakan lempeng KLT silika gel F254 dengan
beberapa kombinasi pengembang. Identifikasi dengan menggunakan
pengembang kloroform-metanol (1:1), diklorometan-metanol (1:1) dan etil
asetat- metanol (1:1) memberikan pemisahan yang baik, yaitu telah menunjukkan
A B C
Gambar 4.2. Kromatogram KLT identifikasi hasil sintesis senyawa benzaldehid karboksilat dengan pendeteksi UV 254 nm, menggunakan lempeng KLT silika gel F254 dengan fase gerak
kloroform-metanol (1:1) (A), diklorometan-metanol (1:1) (B), dan etil asetat-metanol (1:1) (C).
Nilai Rf dari hasil sintesis senyawa aldehid dapat dilihat pada tabel 4.1.
Munculnya bercak yang hanya satu pada plat KLT, menunjukkan bahwa
kemungkinan hasil sintesis senyawa aldehid sudah murni.
Tabel 4.1 Nilai Rf 3-hidroksi-4-karboksimetilenoksibenzaldehid pada Berbagai Komposisi Pengembang.
Uji kemurnian dua dimensi dilakukan dengan menggunakan pengembang
kloroform-metanol (1:1) dan dimensi kedua menggunakan pengembang
diklorometan-metanol (1:1). Hasil KLT dua dimensi juga telah menunjukkan satu
A B
Gambar 4.3. Kromatogram KLT uji kemurnian hasil sintesis senyawa benzaldehid karboksilat dengan pendeteksi UV 254 nm, menggunakan lempeng KLT silika gel F254 dengan fase gerak
dimensi pertama kloroform-metanol (1:1) (A), dan dimensi kedua diklorometan-metanol (1:1) (B).
Secara makroskopik, senyawa yang dihasilkan berupa serbuk berwarna putih dan
bersifat polar, ditandai dengan kelarutannya di dalam air.
4.2.2 Karakterisasi Zat Hasil Sintesis Senyawa Benzaldehid Karboksilat 4.2.2.1 Analisis Spektrum Infra Merah
3-hidroksi-4-karboksimetilenoksibenzaldehid merupakan turunan
senyawa aldehid. Spektrum IR pada gambar 4.4 menunjukkan adanya gugus CH
dari aldehid (2854,13 cm-1) dan gugus karbonil (1577,49 cm-1) serta gugus
Gambar 4.4. Spektrum Infra Merah 3-hidroksi-4-karboksimetilenoksibenzaldehid
Tabel 4.2 Bilangan gelombang dan gugus fungsi 3-hidroksi-4-karboksimetilenoksibenzaldehid
Bilangan gelombang (cm-1) Mode Vibrasi 3351,68
2923,56
Grup OH pada –COOH -CH (alifatis) pada CH2
2854,13 -CH pada –COH
1577,49 C=O 1253,5-1126,22 C-O
Pita absorbsi spektrum CH dari aldehid yang khas, pita gugus OH dari
COOH yang melebar serta adanya pita C=O menunjukkan adanya gugus asam
4.2.2.2 Analisis Spektrum 1H-RMI dan 13C-RMI
Identifikasi struktur senyawa aldehid hasil sintesis ini dilakukan dengan
pengukuran spektrum 1H-RMI dan 13C-RMI. Spektrum 1H-RMI terlihat pada
gambar 4.5 dan 13C-RMI pada gambar 4.6.
Gambar 4.5. Spektrum 1H-RMI 3-hidroksi-4-karboksimetilenoksibenzaldehid dalam pelarut D2O
Dari spektrum 1H-RMI produk hasil sintesis terlihat adanya sinyal yang
kuat pada pergeseran kimia 4,56 ppm menunjukkan adanya sinyal atom H dari
CH2 yang terikat pada gugus karboksilat. Hal ini menunjukkan bahwa hasil
sintesis telah memiliki gugus karboksilat dan reaksi asetilasi gugus karboksilat
pada gugus hidroksida sudah terjadi. Sinyal atom H yang terikat pada gugus
Sedangkan sinyal yang menunjukkan atom H pada cincin benzen terdapat pada
daerah pergeseran kimia 6,96 - 7,46 ppm. Pada hasil sintesis ini, reaksi asetilasi
hanya terjadi pada salah satu posisi gugus hidroksi dari
3,4-dihidroksibenzaldehid. Hal ini dapat diketahui dari integral 1H-RMI pada atom H
yang terikat sebagai -CH2- memiliki perbandingan integral 2:1 dengan atom H
dari -CH- yang terdapat pada senyawa yang dianalisis. Namun, pada pengukuran
1
H-RMI ini, gugus OH tidak terdeteksi. Hal ini disebabkan oleh terdeterasinya
atom H dari OH yang reaktif akibat penggunaan pelarut D2O pada proses analisa.
O
OH
O O
O
H
112,61 126,32
152,42 114,94 129,88
145,68
195,07 67,41
175,84
Gambar 4.6. Spektrum 13C-RMI 3-hidroksi-4-karboksimetilenoksibenzaldehid dalam pelarut D2O
Pada spektrum 13C-RMI dapat dilihat bahwa terdapat sinyal atom C dari
pula halnya dengan gugus karboksilat yang sinyal atom C nya terdapat pada
pergeseran kimia 175,84 ppm karena adanya pengaruh dari C=O dan OH
sehingga pergeseran kimianya lebih ke daerah downfield. Pada 13C-RMI jumlah
sinyal yang muncul pada spektrum menunjukkan banyaknya jumlah atom C yang
terdapat pada senyawa yang dianalisis.
Berdasarkan data spektrum infra merah, spektrum 1H-RMI dan spektrum
13
C-RMI diduga bahwa telah terjadi asetilasi pada 3,4-dihidroksibenzaldehid
dan hidrolisis menghasilkan senyawa
3-hidroksi-4-karboksimetilenoksibenzaldehid.
4.3 Sintesis Senyawa Porfirin
Pada penelitian ini senyawa porfirin yang ingin disintesis adalah porfirin
dengan empat gugus samping yaitu gugus benzaldehid karboksilat dan piridin
yang terikat pada posisi meso. Oleh karena itu dipakai metode Lindsey dan Adler
dengan tahapan proses yang terjadi yaitu proses kondensasi dan oksidasi
(Bonnet, 2000., Tjahjono et.al., 1999). Untuk dapat memasukkan gugus samping
pada posisi meso, gugus samping yang akan dimasukkan harus terikat dengan
gugus karbonil yang kemudian akan berkondensasi dengan pirol dan membentuk
jembatan metin interpirol di antara dua molekul pirol.
Agar reaksi antara 3-hidroksi-karboksimetilenoksibenzaldehid,
4-piridinkarboksaldehid dapat terjadi dengan pirol, maka diperlukan katalis asam.
Asam yang digunakan sebagai katalis dalam penelitian ini adalah asam
propanoat. Adanya asam akan menyebabkan protonasi pada gugus karbonil
oleh pirol. Setelah protonasi gugus karbonil, tahap berikutnya adalah serangan
nukleofilik oleh pirol terhadap atom C karbonil sehingga terjadi proses
polimerisasi dan siklisasi yang akan menghasilkan cincin porfirin.
Hal yang harus diperhatikan dalam reaksi sintesis porfirin ini adalah
sistem harus terbebas dari air karena dalam proses polimerisasi dan siklisasi,
dilepaskan molekul air sebagai hasil dari reaksi kondensasi. Molekul air yang
dilepaskan harus didesak keluar dari larutan karena reaksi sintesis porfirin yang
terjadi merupakan reaksi kesetimbangan. Jika tidak, maka rendemen produk yang
dihasilkan akan lebih sedikit dari yang seharusnya. Dalam hal ini digunakan gas
nitrogen yang dialirkan terus menerus selama reaksi berlangsung untuk
mendesak molekul air keluar dari sistem. Setelah proses kondensasi berlangsung,
dilanjutkan dengan oksidasi porfirinogen yang terbentuk menjadi porfirin yang
planar dengan adanya pemanasan.
Dari hasil sintesis terlihat perubahan warna campuran larutan dari
berwarna putih kekuningan setelah pencampuran asam dengan
3-hidroksi-4-karboksimetilenoksibenzaldehid dan pirol menjadi kecoklatan dengan
penambahan 4-piridinkarboksaldehid dan diaduk selama 4 jam dengan
NH
4.4 Analisis Hasil Sintesis Senyawa Porfirin
4.4.1 Pemisahan Zat Hasil Sintesis Senyawa Porfirin
Hasil sintesis senyawa porfirin diisolasi dengan menggunakan lempeng
KLT alumina basa dengan menggunakan berbagai pengembang, salah satunya
kloroform-metanol (2:1). Namun, masih menghasilkan pemisahan yang kurang
baik. Sehingga pemisahan dilanjutkan dengan menggunakan kromatografi kolom
dimana fase diam alumina basa dan fase gerak sistem bertahap (stepwise elution),
dengan tingkat kepolaran pelarut dimulai dari yang kurang polar hingga ke polar.
Proses elusi dimulai menggunakan pelarut kloroform, menghasilkan pita 1 yang
berwarna merah lembayung. Selanjutnya dielusi dengan metanol, menghasilkan
pita 2 yang berwarna coklat kehijauan. Kemudian dilanjutkan dengan elusi
menggunakan air destilasi menghasilkan pita 3 yang berwarna kuning coklat, dan
yang tertinggal pada fase diam dilarutkan dalam NaOH 0,01 N menghasilkan pita
4 yang berwarna hijau kehitaman.
4.4.2 Pemisahan Pita 4 Hasil Kromatografi Kolom
Pita 4 yang dilarutkan dalam NaOH 0,01 N dipisahkan kembali melalui
KLT dengan menggunakan fase diam silika gel F254 dan pengembang etil
asetat-metanol (1:2) menghasilkan pemisahan yang cukup baik menghasilkan 2 bercak
yang terpisah meskipun masih ada yang tertinggal pada tempat penotolan.
Gambar 4.8. Kromatogram KLT pemisahan pita 4 dengan fase diam silika gel F254 dan pengembang etil asetat-metanol (1:2)
Pemisahan dilanjutkan dengan menggunakan kromatografi kolom. Fase
diam dan fase gerak yang digunakan sama halnya seperti pada sistem KLT. Hasil
pemisahan dengan kromatografi kolom ini diuapkan dan dimurnikan kembali.
4.4.3 Pemurnian Pita-Pita Hasil Kromatografi Kolom
4.4.3.1 Pemurnian Pita 4 dengan Kromatografi Kolom Resin Ion Exchange Hasil pemisahan 4.4.2 dimurnikan kembali dengan kromatografi kolom
resin ion exchange. Senyawa pita 4 mengandung gugus karboksilat (bermuatan
negatif) yang dapat bertukar dengan ion lawan (Cl-) dan menjadi pasangan dari
ion muatan tetap pada permukaan resin (bermuatan positif). Fraksi yang tinggal
pada resin dilarutkan dengan HCl 0,01 N sehingga ion karboksilat terlepas dari
resin dan menghasilkan larutan berwarna hijau yang kemudian pelarutnya
4.4.3.2 Rekristalisasi Pita 1 dan 4
Rekristalisasi pita 1 menghasilkan serbuk berwarna ungu tua yang larut
dalam kloroform dengan rendemen sebesar 10,36%. Sedangkan pita 4
menghasilkan serbuk berwarna hijau kecoklatan yang larut dalam air destilasi
dengan rendemen sebesar 33,42%.
4.4.4 Identifikasi dan Uji Kemurnian Pita-Pita Hasil Kromatografi Kolom 4.4.4.1 Identifikasi dan Uji Kemurnian Pita 1
Identifikasi pita 1 dilakukan dengan sistem KLT menggunakan plat
alumina basa dengan 3 macam pengembang. Kromatogram hasil KLT dengan 3
macam pengembang dapat dilihat pada gambar 4.9 dan harga Rfnya dapat dilihat
pada tabel 4.3.
Gambar 4.9. Kromatogram KLT identifikasi pita 1 dengan pendeteksi UV 254 nm, menggunakan lempeng KLT alumina basa dengan fase gerak kloroform-metanol (1:1) (A), diklorometan-metanol-air destilasi (2:2:1) (B), dan kloroform-etil asetat (4:1) (C).
Pengembang
Rf
Kloroform-metanol (1:1)
Diklorometan-metanol-air destilasi (2:2:1)
Kloroform-etilasetat (4:1)
Senyawa
porfirin pita 1 0,84 0,86 0,89
Kromatogram KLT pita 1 pada berbagai komposisi pengembang telah
menunjukkan satu bercak, dengan harga Rf yang berbeda tergantung pada
komposisi pengembang. Namun, masih dilanjutkan dengan uji kemurnian pita 1
yang dilakukan secara KLT dua dimensi. KLT dua dimensi juga telah
menunjukkan satu bercak. Hasil KLT dua dimensi dapat dilihat pada gambar
4.10.
A B
4.4.4.2 Identifikasi dan Uji Kemurnian Pita 4
Identifikasi pita 4 dilakukan dengan sistem KLT menggunakan plat silika
gel F254 dengan 3 komposisi pengembang yang berbeda. Kromatogram KLT pita
4 dengan 3 komposisi pengembang dapat dilihat pada gambar 4.11 dan harga
Rfnya dapat dilihat pada tabel 4.4.
Gambar 4.11. Kromatogram KLT identifikasi pita 4 dengan pendeteksi UV 254 nm, menggunakan lempeng KLT silika gel F254 dengan
Tabel 4.4 Nilai Rf Senyawa Pita 4 pada Berbagai Komposisi Pengembang
Pengembang
Rf
Diklorometan-metanol (1:1)
Etil asetat-metanol (1:1)
Metanol-air destilasi (1:2)
Senyawa
porfirin pita 4 0,86 0,88 0,93
Kromatogram KLT pita 4 dengan 3 komposisi pengembang yang berbeda
telah menunjukkan 1 bercak noda dengan harga Rf yang berbeda tergantung pada
komposisi pengembang. Kemudian dilakukan uji kemurnian dengan KLT dua
dimensi. Pada gambar 4.11 dapat kita lihat bahwa kromatogram dengan sistem
pengembang (C) menghasilkan bercak noda dengan harga Rf yang paling besar
sedangkan pengembang (A) dan (B) memiliki harga Rf yang berdekatan sehingga
digunakan pengembang diklorometan-metanol (1:1) untuk dimensi pertama, dan
etil asetat-metanol (1:1) untuk dimensi kedua. Kromatogram KLT dua dimensi