PENGGUNAAN AGENSIA HAYATI Trichoderma koningii Oud.
UNTUK MENEKAN JAMUR AKAR COKELAT
(Phellinus noxius) PADA PEMBIBITAN TANAMAN KAKAO
DI RUMAH KASSA
SKRIPSI
ALPRISNI SURBAKTI 060302005
HPT
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGGUNAAN AGENSIA HAYATI Trichoderma koningii Oud.
UNTUK MENEKAN JAMUR AKAR COKELAT
(Phellinus noxius) PADA PEMBIBITAN TANAMAN KAKAO
DI RUMAH KASSA
SKRIPSI
ALPRISNI SURBAKTI 060302005
HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian
Universitas Sumatera Utara, Medan.
Disetujui oleh, Komisi Pembimbing
Ir. Lahmuddin Lubis, MP Ir. Mukhtar Iskandar Pinem, M. Agr
Ketua Anggota
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
ABSTRACT
Alprisni Surbakti, “The Utilization of Biological Agent Trichoderma koningii Oud. to Emphasize Brown Root Rot (Phellinus noxius) on Cacao Nursery in Green House”. Supervised by Lahmuddin Lubis and Mukhtar Iskandar Pinem. The thump of modern system plantation that very depend on synthetic fungicide awaked our consciousness to set back biological management sketch in our plantation system now. The research aimed to know the potential of T. koningii Oud. to emphasize brown root rot (Phellinus noxius) in cacao nursery at several media and dossage. The research was held in Green House of
Agriculture Faculty, University of North Sumatera, Medan. The research used Randomized Block Design non-factorial with 10 treatment (T0 (control), T1 (T. koningii in corn media 15 g/ polybag), T2 (T. koningii in corn media 25 g/ polybag), T3 (T. koningii in corn media 35 g/ polybag), T4 (T. koningii in rice
media 15 g/ polybag), T5 (T. koningii in rice media 25 g/ polybag), T6 (T. koningii in rice media 35 g/ polybag), T7 (T. koningii in bran media 15 g/
polybag), T8 (T. koningii in bran media 25 g/ polybag), and T9 (T. koningii in bran media 35 g/ polybag)) with three replications.
ABSTRAK
Alprisni Surbakti, “Penggunaan Agensia Hayati Trichoderma koningii Oud. Untuk Menekan Jamur Akar Cokelat (Phellinus noxius) Pada Pembibitan Tanaman Kakao Di Rumah Kassa”.
Dibimbing oleh Lahmuddin Lubis dan Mukhtar Iskandar Pinem. Dampak sistem budidaya tanaman modern yang sangat tergantung pada fungisida sintetik menggugah kesadaran kita untuk menempatkan kembali kerangka pengendalian hayati secara klasik dalam sistem budidaya tanaman kita saat ini. Penelitian ini bertujuan untuk mengetahui kemampuan Trichoderma koningii Oud. dalam menekan perkembangan penyakit jamur akar cokelat (Phellinus noxius) pada pembibitan tanaman kakao dalam berbagai dosis dan media. Penelitian
dilaksanakan di Rumah Kassa, Fakultas Pertanian, Universitas Sumatera Utara, Medan. Penelitian ini menggunakan Rancangan Acak Kelompok non-faktorial dengan 10 perlakuan (T0 (kontrol), T1 (T. koningii dalam media jagung 15 g/ polibag), T2 (T. koningii dalam media jagung 25 g/ polibag), T3 (T. koningii dalam media jagung 35 g/ polibag), T4 (T. koningii dalam media beras 15 g/ polibag), T5 (T. koningii dalam media beras 25 g/ polibag), T6 (T. koningii dalam media beras 35 g/ polibag), T7 (T. koningii dalam media dedak 15 g/ polibag), T8 (T. koningii dalam media dedak 25 g/ polibag), T9 (T. koningii dalam media dedak 35 g/ polibag) ) dengan tiga ulangan.
RIWAYAT HIDUP
Alprisni Surbakti lahir pada 15 April 1986 di Rantau, Aceh Timur. Merupakan anak kelima dari enam bersaudara pasangan Bapak Neken Surbakti dan Ibu Saminah br. Tarigan.
Pendidikan yang telah ditempuh penulis adalah sebagai berikut: - Lulus dari SD YKPP 1 Prabumulih pada tahun 1998
- Lulus dari SLTP YKPP Prabumulih pada tahun 2001 - Lulus dari SMA Negeri 11 Yogyakarta pada tahun 2004
- Tahun 2006 diterima di Fakultas Pertanian Universitas Sumatera Utara, Medan, Departemen Hama dan Penyakit Tumbuhan melalui jalur SPMB.
Semasa kuliah penulis aktif dalam beberapa organisasi kemahasiswaan yakni menjadi Anggota Ikatan Mahasiswa Perlindungan Tanaman (IMAPTAN) (2006-2011), Pengurus Badan Kenadziran Musholla (BKM) Al- Mukhlisin (2007-2009), Anggota Komunikasi Muslim (KOMUS) HPT (2006-2011). Penulis juga pernah menjadi asisten laboratorium pada beberapa praktikum yaitu Dasar Perlindungan Tanaman (2007-2010), Mikologi dan Bakteriologi (2008), Penyakit Penting Tanaman Utama Perkebunan (2009), Mikrobiologi Pertanian (2009) dan Pengendalian Hama dan Penyakit Terpadu (2010). Penulis melakukan Praktik Kerja Lapangan (PKL) di PTPN III Afd. VII Kebun Rambutan pada tahun 2010 dan melaksanakan penelitian skripsi di Rumah Kassa Fakultas Pertanian
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah Swt karena atas rahmat dan hidayah-Nya penulis dapat menyelesaikan tulisan ini dengan baik.
Adapun judul dari skripsi ini adalah “PENGGUNAAN AGENSIA HAYATI Trichoderma koningii Oud. UNTUK MENEKAN JAMUR AKAR COKELAT (Phellinus noxius) PADA PEMBIBITAN TANAMAN KAKAO DI RUMAH KASSA” yang disusun sebagai salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada komisi pembimbing Ir. Lahmuddin Lubis, MP selaku ketua dan Ir. Mukhtar Iskandar Pinem, M. Agr selaku anggota yang telah banyak memberikan masukan dan arahan kepada penulis dalam menyelesaikan penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini dimasa yang akan datang.
Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat.
Medan, Juni 2011
DAFTAR ISI
Biologi Penyebab Penyakit ... 8
Daur Hidup ... 11
Gejala Serangan... 12
Pengelolaan Penyakit ... 13
Trichoderma koningii Oud ... 14
Biologi Trichoderma koningii Oud ... 15
Ekologi Trichoderma koningii Oud ... 16
Fisiologi Trichoderma.koningii Oud ... 19
Komposisi Nutrisi Media Organik ... 21
Jagung dan Beras ... 21
Pelaksanaan Penelitian ... 25
Penyediaan Sumber Inokulum Phellinus noxius... ... 25
Penyediaan Jamur Trichoderma koningii Oud... ... 26
Perbanyakan Trichoderma koningii Oud... 26
Persiapan Benih... ... 26
Pengaplikasian Trichoderma koningii Oud ... 28
Penanaman Benih ... 28
Pembuatan Food Base Phellinus noxius ... 29
Inokulasi Food Base Phellinus noxius ... 30
Pemeliharaan ... 30
Peubah Amatan ... 30
Persentase Serangan (Kejadian Penyakit) P. noxius... 30
Intensitas Penyakit (%) P. noxius ... 31
Jumlah Konidia T. koningii Pada Media Organik ... 32
Panjang Akar Tunggang... 33
Derajat Kemasaman Tanah (pH tanah) ... 33
HASIL DAN PEMBAHASAN Persentase Serangan (Kejadian Penyakit) P. noxius... 34
Intensitas Penyakit (%) P. noxius ... 35
Jumlah Konidia T. koningii Pada Media Organik ... 37
Panjang Akar Tunggang... 38
Derajat Kemasaman Tanah (pH tanah) ... 39
KESIMPULAN DAN SARAN Kesimpulan... 41
Saran ... 41 DAFTAR PUSTAKA
DAFTAR TABEL
No. Judul Hlm. 1. Komposisi nutrisi jagung putih pipilan dan beras giling (sosoh) ... 21 2. Data pengamatan persentase serangan (kejadian penyakit)
pada pengamatan 10, 12 dan 14 msi ... 34 3. Data pengamatan intensitas penyakit (%) pada pengamatan 10, 12
dan 14 msi... 36
4. Data pengamatan jumlah konidia T. koningii pada pengamatan
9, 17 dan 25 hsi pada media jagung, beras, dedak ... 37 5. Data panjang akar tunggang akibat pengaplikasian jamur T. koningii
DAFTAR GAMBAR
No. Judul Hlm. 1. a) Basidiocarp tipis dan datar pada media serbuk gergaji
b) Arthrospora dari Phellinus noxius pada media PDA
c) Trichocyst dari Phellinus noxius pada media PDA ... 10
2. Biakan murni Phellinus noxius pada media PDA ... 11
3. Daur penyakit jamur akar cokelat ... 11
4. Tubuh buah P. noxius di lapangan (a) muda (b) tua ... 12
5. Biakan murni Trichoderma koningii pada media PDA... 15
6. Trichoderma koningii ... 16
7. Sketsa penanaman benih ... 29
DAFTAR LAMPIRAN
No. Judul Hlm. 1. Bagan percobaan penelitian ... 45 2. Bagan plot penelitian ... 46 3. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan
tanaman kakao di rumah kassa (10 msi) ... 47 4. Sidik ragam kejadian penyakit 10 msi ... 47 5. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan
tanaman kakao di rumah kassa (12 msi) ... 48 6. Sidik ragam kejadian penyakit 12 msi ... 48 7. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan
tanaman kakao di rumah kassa (14 msi) ... 49 8. Sidik ragam kejadian penyakit 14 msi ... 49 9. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan
tanaman kakao di rumah kassa (10 msi) ... 50 10. Sidik ragam intensitas penyakit 10 msi ... 50 11. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan
tanaman kakao di rumah kassa (12 msi) ... 51 12. Sidik ragam intensitas penyakit 12 msi ... 51 13. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan
19. Biakan murni Phellinus noxius pada media PDA ... 55
20. Gejala serangan bagian atas akibat adanya gangguan pada bagian akar (beberapa daun tampak menguning dan layu) ... 55
21. Gejala serangan pada bagian akar akibat jamur akar cokelat (skala 1) 56 22. Biakan murni Trichoderma koningii pada media PDA... 56
23. Trichoderma koningii pada media (a) jagung (b) beras (c) dedak ... 57
24. Food base yang sudah diinokulasi P. noxius umur 1 bulan ... 57
25. Foto lahan penelitian ... 58
ABSTRACT
Alprisni Surbakti, “The Utilization of Biological Agent Trichoderma koningii Oud. to Emphasize Brown Root Rot (Phellinus noxius) on Cacao Nursery in Green House”. Supervised by Lahmuddin Lubis and Mukhtar Iskandar Pinem. The thump of modern system plantation that very depend on synthetic fungicide awaked our consciousness to set back biological management sketch in our plantation system now. The research aimed to know the potential of T. koningii Oud. to emphasize brown root rot (Phellinus noxius) in cacao nursery at several media and dossage. The research was held in Green House of
Agriculture Faculty, University of North Sumatera, Medan. The research used Randomized Block Design non-factorial with 10 treatment (T0 (control), T1 (T. koningii in corn media 15 g/ polybag), T2 (T. koningii in corn media 25 g/ polybag), T3 (T. koningii in corn media 35 g/ polybag), T4 (T. koningii in rice
media 15 g/ polybag), T5 (T. koningii in rice media 25 g/ polybag), T6 (T. koningii in rice media 35 g/ polybag), T7 (T. koningii in bran media 15 g/
polybag), T8 (T. koningii in bran media 25 g/ polybag), and T9 (T. koningii in bran media 35 g/ polybag)) with three replications.
ABSTRAK
Alprisni Surbakti, “Penggunaan Agensia Hayati Trichoderma koningii Oud. Untuk Menekan Jamur Akar Cokelat (Phellinus noxius) Pada Pembibitan Tanaman Kakao Di Rumah Kassa”.
Dibimbing oleh Lahmuddin Lubis dan Mukhtar Iskandar Pinem. Dampak sistem budidaya tanaman modern yang sangat tergantung pada fungisida sintetik menggugah kesadaran kita untuk menempatkan kembali kerangka pengendalian hayati secara klasik dalam sistem budidaya tanaman kita saat ini. Penelitian ini bertujuan untuk mengetahui kemampuan Trichoderma koningii Oud. dalam menekan perkembangan penyakit jamur akar cokelat (Phellinus noxius) pada pembibitan tanaman kakao dalam berbagai dosis dan media. Penelitian
dilaksanakan di Rumah Kassa, Fakultas Pertanian, Universitas Sumatera Utara, Medan. Penelitian ini menggunakan Rancangan Acak Kelompok non-faktorial dengan 10 perlakuan (T0 (kontrol), T1 (T. koningii dalam media jagung 15 g/ polibag), T2 (T. koningii dalam media jagung 25 g/ polibag), T3 (T. koningii dalam media jagung 35 g/ polibag), T4 (T. koningii dalam media beras 15 g/ polibag), T5 (T. koningii dalam media beras 25 g/ polibag), T6 (T. koningii dalam media beras 35 g/ polibag), T7 (T. koningii dalam media dedak 15 g/ polibag), T8 (T. koningii dalam media dedak 25 g/ polibag), T9 (T. koningii dalam media dedak 35 g/ polibag) ) dengan tiga ulangan.
PENDAHULUAN
Latar belakang
Kakao merupakan salah satu komoditas andalan nasional dan berperan penting bagi perekonomian Indonesia, terutama dalam penyediaan lapangan kerja, sumber pendapatan petani dan sumber devisa bagi negara disamping mendorong
berkembangnya agribisnis kakao dan agroindustri (Anonimus, 2008). Kakao (Theobroma cacao L.) yang daerah asalnya adalah lereng timur
bawah Pegunungan Andes, Amerika Selatan sudah ditanam di pekarangan-pekarangan Minahasa pada akhir abad ke-18. Namun kakao baru diperkebunkan sebagai perkebunan besar sekitar tahun 1880 di Jawa Tengah. Penanaman disini
dipacu oleh rusaknya kebun-kebun kopi Arabika karena penyakit karat (Hemileia vastatrix) sekitar tahun 1880 tersebut (Semangun, 2000).
Cokelat merupakan produk popular dan eksotis yang terbuat dari biji kakao. Pada umumnya, biji kakao diperdagangkan dalam bentuk kering fermentasi. Di dunia, volume transaksi biji kakao mencapai 3 juta ton per tahun (ICCO, 2007) dengan tiga produsen utamanya adalah Pantai Gading, Ghana dan Indonesia. Tingkat produksi kakao meningkat sebesar 2-5% setiap tahunnya menurut data ICCO (2007) (Rahmadi, 2008).
Untuk mengetahui patogennya dengan tepat harus dilakukan pemeriksaan
terhadap leher akar dan perakaran tanaman (Anonimus, 2008). Dari ketiga penyakit jamur akar diatas, penyakit jamur akar cokelat dinilai
paling merugikan dan paling berbahaya pada tanaman kakao. Jamur ini banyak
dijumpai pada pertanaman kakao diseluruh wilayah Indonesia (Anonimus, 2008).
Trichoderma menghasilkan enzim kitinase dan glukanase yang masing-masing mampu melisiskan dinding hifa jamur dari kelas basidiomycetes dan askomycetes serta tidak ada satupun dinding hifa jamur yang tahan terhadap kitinase Trichoderma khususnya jamur patogen yang berasal dari klas askomycetes dan basidiomycetes. Endokitinase dan eksokitinase (N-acetyl-β -D-glukosaminidase) dan ketobiosidase dari Trichoderma aktivitasnya 100 kali lebih aktif daripada kitinase tanaman (Anonimus, 2009).
Dampak sistem budidaya tanaman modern yang sangat tergantung pada fungisida sintetik menggugah kesadaran kita untuk menempatkan kembali kerangka pengendalian hayati secara klasik dalam sistem budidaya tanaman saat ini. Penggunaan agens hayati dalam budidaya tanaman memiliki tiga keuntungan yaitu: a) permanen: agens mapan dalam ekosistem sehingga populasi penyakit dijaga dalam keadaan seimbang. b) aman: relatif tidak memilki efek samping terhadap lingkungan dan c) ekonomis: menjaga agar eksistensi agens terjaga dalam ekosistem (Anonimus, 2009).
maka mikroba yang pertama kali akan mendominasi tanah tersebut adalah Trichoderma (Soepena, 1993).
Sehubungan dengan hal itu, maka penulis tertarik untuk melakukan penelitian lebih lanjut mengenai usaha pengendalian terhadap penyakit jamur akar cokelat (Phellinus noxius) pada tanaman kakao dengan menggunakan agensia hayati, dalam hal ini Trichoderma koningii Oud.
Tujuan Penelitian
Untuk mengetahui kemampuan Trichoderma koningii Oud. dalam menekan perkembangan penyakit jamur akar cokelat (Phellinus noxius) pada pembibitan tanaman kakao dalam berbagai dosis dan media.
Hipotesa Penelitian
Penyakit akar cokelat (Phellinus noxius) pada tanaman kakao dapat ditekan dengan penggunaan jamur antagonis Trichoderma koningii Oud. dengan berbagai dosis dan media.
Kegunaan Penelitian
- Sebagai salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Sistematika Tanaman
Sistematika tanaman kakao adalah sebagai berikut: Divisi : Spermatophyta
Sub divisi : Angiospermae Kelas : Dicotyledoneae Sub kelas : Dialypetalae Ordo : Malvales Famili : Sterculiaceae Genus : Theobroma
Spesies : Theobroma cacao L. (Anonimus, 2008).
Botani Tanaman
Akar
Akar kakao atau cokelat adalah akar tunggang (radix primaria). Pertumbuhan akar kakao bisa sampai 8 meter ke arah samping dan 15 meter ke
arah bawah (Anonimusa, 2011). Akar kecambah yang telah berumur 1-2 minggu biasanya menumbuhkan
Batang dan Cabang
Tanaman kakao bersifat dimorfisme. Artinya mempunyai dua bentuk tunas vegetatif. Tunas yang arah pertumbuhannya ke atas disebut tunas ortotrop atau tunas air (wiwilan atau chupon), sedangkan tunas yang arah pertumbuhannya ke samping disebut plagiotrop (cabang kipas atau fan) (Anonimus, 2008).
Tanaman kakao asal biji, setelah mencapai tinggi 0,9-1,5 meter akan berhenti tumbuh dan membentuk jorket (jorquette). Jorket adalah tempat percabangan dari pola percabangan ortotrop ke plagiotrop dan khas hanya pada tanaman kakao (Anonimus, 2008).
Daun
Sama dengan sifat percabangannya, daun kakao juga bersifat dimorfisme. Pada tunas ortotrop, tangkai daunnya panjang, yaitu 7,5-10 cm sedangkan pada tunas plagiotrop panjang tangkai daunnya hanya sekitar 2,5 cm (dalam Hall, 1932). Tangkai daun bentuknya silinder dan bersisik halus, bergantung pada tipenya (Anonimus, 2008).
Salah satu sifat khusus daun kakao yaitu adanya dua persendian (articulation) yang terletak di pangkal dan ujung tangkai daun. Dengan persendian ini dilaporkan daun mampu membuat gerakan dengan arah datangnya sinar matahari (Anonimus, 2008).
pada kultivarnya. Panjang daun dewasa 30 cm dan lebarnya 10 cm. Permukaan daun licin dan mengilap (Anonimus, 2008).
Bunga
Tanaman kakao bersifat kaulifori, artinya bunga tumbuh dan berkembang dari bekas ketiak daun pada batang dan cabang. Tempat tumbuh bunga tersebut semakin lama semakin membesar dan menebal atau biasa disebut dengan bantalan bunga (cushion) (Anonimus, 2008).
Bunga kakao mempunyai rumus K5C5A5+5G(5). Artinya, bunga disusun
oleh 5 daun kelopak yang bebas satu sama lain, 5 daun mahkota, 10 tangkai sari yang tersusun dalam 2 lingkaran dan masing-masing terdiri dari 5 tangkai sari tetapi hanya 1 lingkaran fertil dan 5 daun buah yang bersatu. Bunga kakao berwarna putih, ungu atau kemerahan. Tangkai bunga kecil tetapi panjang (1-1,5 cm). Daun mahkota panjangnya 6-8 mm, terdiri atas dua bagian. Bagian pangkal berbentuk seperti kuku binatang (claw) dan biasanya terdapat dua garis merah.
Bagian ujung berupa lembaran tipis, fleksibel dan berwarna putih (Anonimus, 2008).
Buah dan Biji
Buah akan masak setelah berumur enam bulan. Pada saat itu ukurannya beragam, dari panjang 10 hingga 30 cm, bergantung pada kultivar dan faktor-faktor lingkungan selama perkembangan buah (Anonimus, 2008).
Biji tersusun dalam lima baris mengelilingi poros buah. Jumlahnya beragam, yaitu 20-50 butir per buah. Jika dipotong melintang, tampak bahwa biji disusun oleh dua kotiledon yang saling melipat dan bagian pangkalnya menempel pada poros lembaga (embryo axis). Biji dibungkus oleh daging buah (pulpa) yang berwarna putih, rasanya asam manis dan diduga mengandung zat penghambat perkecambahan. Biji kakao tidak memiliki masa dorman (Anonimus, 2008).
Syarat Tumbuh
Tanah
Kemasaman (pH) tanah yang baik untuk kakao adalah netral atau berkisar 5,6-6,8. Sifat ini khusus berlaku untuk tanah atas (top soil), sedangkan pada tanah bawah (sub soil) keasaman tanah sebaiknya netral, agak asam, atau agak basa. Tanaman kakao membutuhkan tanah berkadar bahan organik tinggi, yaitu diatas 3% (Anonimus, 2008).
Iklim
Iklim mempengaruhi pertumbuhan dan produksi kakao. Karena itu, unsur ini perlu diperhatikan dalam membuat penilaian kesesuaian lahan. Sebaran curah hujan lebih berpengaruh terhadap produksi kakao dibandingkan dengan jumlah curah hujan yang tinggi. Jumlah curah hujan mempengaruhi pola pertunasan kakao (flush). Pertumbuhan dan produksi kakao banyak ditentukan oleh ketersediaan air sehingga kakao dapat tumbuh dan berproduksi dengan baik ditempat yang curah hujannya relatif sedikit tetapi merata sepanjang tahun (Anonimus, 2008).
Proses fisiologi tanaman kakao juga dipengaruhi oleh suhu udara. Suhu udara yang rendah akan menghambat pembentukan tunas dan bunga (Alvim, 1979 dalam Anonimus, 2008), sedangkan suhu udara yang tinggi dapat menghambat
pertumbuhan pucuk dan mendorong pertumbuhan cabang serta mengakibatkan daun-daun kurang berkembang (Wood, 1975 dalam Anonimus, 2008).
Kelembaban udara berkaitan erat dengan curah hujan dan suhu udara. Kecepatan angin juga menentukan keberhasilan usaha tani kakao. Kecepatan angin yang tinggi dan berlangsung lama jelas akan merusak daun kakao, sehingga daun menjadi rontok dan tanaman menjadi gundul (Anonimus, 2008).
Biologi Penyebab Penyakit
Penyakit akar cokelat dapat diklasifikasikan sebagai berikut: Kingdom : Fungi
Divisio
Ordo : Aphyllochorales (Polyporales) Famili : Hymenochaetaceae
Genus : Phellinus (Fomes) Spesies : Phellinus noxius (Agrios, 1996).
Penyakit akar cokelat disebabkan oleh jamur Phellinus lamaoensis (Murr) Hein sinonimnya Fomes noxius Corner,
Fomes lamaoensis Murr. Penularan terjadi dengan kontak langsung antara akar
sakit dan sehat. Pada umumnya jamur menyerang akar tunggang dan selanjutnya menyerang ke akar-akar yang lebih kecil. Apabila seluruh permukaan akar
tunggang telah ditutupi kerak, maka tanaman segera menguning kemudian mati (Anonimus, 2008).
Jamur-jamur akar tersebut jarang membentuk tubuh buah. Tubuh buah hanya terbentuk bila penyakit sudah sangat lanjut dan tanaman sudah mati (Semangun, 2000).
P. noxius adalah makhluk hidup dengan pertumbuhan cepat. Angka
pertumbuhan linear dapat menjadi 35 mm/ hari pada PDA pada 300 C. Jamur memproduksi koloni cokelat pada PDA dengan dengan garis-garis cokelat gelap tak beraturan. Arthrospora dan trikhosis tetapi bukan clamp connection seringkali
a) b) c)
Gambar 1: a) Basidiocarp tipis dan datar pada media serbuk gergaji b) Arthrospora dari Phellinus noxius pada media PDA c) Trichocyst dari
Phellinus noxius pada media PDA Sumber: (Ann, et al. , 2002)
P. noxius adalah makhluk hidup dengan temperatur tinggi dengan
pertumbuhan optimal berkisar 300 C dan tidak ada pada suhu 80 C. Ini menjelaskan kawasan geografis dari penyakit ini yaitu kawasan tropik dan subtropik. Jamur ini lebih suka kondisi asam dan dapat tumbuh pada pH serendah 3,5. Pertumbuhan terhambat pada pH 7,5 (Ann, et al. , 2002).
Gambar 2. Biakan murni Phellinus noxius pada media PDA (Sumber: Anonimus, 2010a)
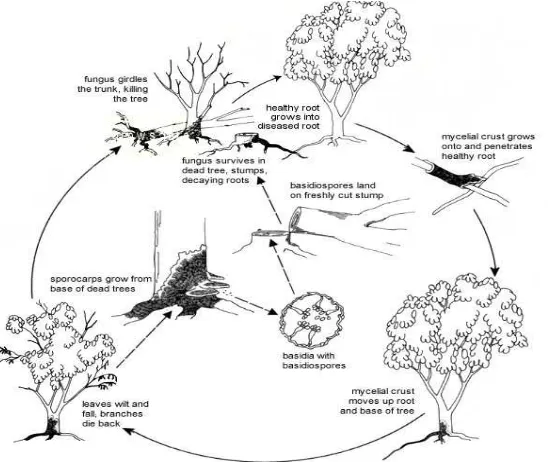
Daur Hidup Penyakit
Akar-akar yang sehat akan terjangkit jamur akar bila bersinggungan dengan akar yang sakit atau dengan sisa-sisa akar yang mengandung jamur yang bersangkutan. Dalam akar-akar yang besar jamur dapat bertahan selama bertahun-tahun, khususnya jamur akar merah dan jamur akar cokelat (Semangun, 2000).
Gambar 3. Daur penyakit jamur akar cokelat Sumber: (Bartz, F. , 2007)
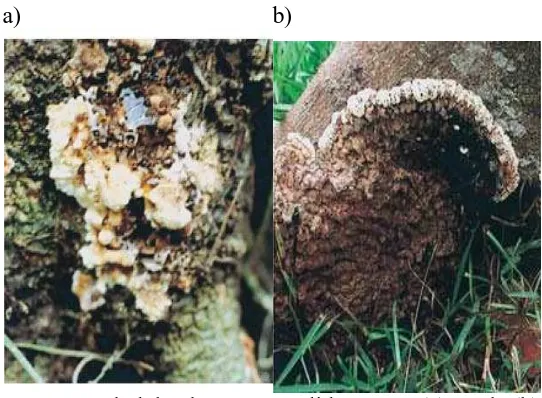
Gejala Serangan
Busuk akar cokelat mungkin terjadi disemua umur tanaman. Perkembangan penyakit dihampir semua jenis tanaman cepat. Daun-daun pada tanaman yang sakit berganti warna dari warna normal menjadi hijau pucat kemudian cokelat antara satu sampai dua bulan (Ann, et al. , 2002).
a) b)
Gambar 4. Tubuh buah P. noxius di lapangan (a) muda (b) tua Sumber: (Ann, et al. , 2002)
Pada penyakit akar cokelat permukaan akar diliputi oleh benang-benang jamur yang mengikat butir-butir tanah dengan sangat erat, sehingga menjadi kerak tanah yang sukar terlepas meskipun dicuci. Jika diperhatikan diantara butir-butir tanah terdapat hifa jamur yang berwarna cokelat tua. Didalam kayu terdapat garis-garis cokelat yang terdiri atas jaringan jamur (Semangun, 2000).
ini sudah ada sejak dulu dan perkembangannya lambat. Padahal kerusakan yang diakibatkannya sangat fatal (Anonimus, 2008).
Tanaman yang menunjukkan gejala sakit biasanya telah terserang parah sehingga tidak bisa ditolong lagi. Sebenarnya serangan jamur akar ini tidak boleh dianggap ringan, walaupun perkembangannya lambat tetapi bisa mematikan tanaman. Disamping menyerang tanaman kakao, jamur akar juga sering menyerang tanaman peneduh dan tanaman sekeliling kebun. Kerusakan pada tanaman lain juga bisa menular ke tanaman kakao. Begitu juga sebaliknya kerusakan pada tanaman kakao dapat menyebabkan tanaman peneduh tertular dan mengalami kematian (Anonimus, 2008).
Pengelolaan Penyakit
1. Kerugian karena penyakit akar dapat dicegah dengan membersihkan sisa-sisa tanaman lama pada waktu membuka kebun kakao. Khususnya hal ini perlu mendapat perhatian jika akan menanam kakao di bekas kebun karet yang mendapat banyak gangguan jamur akar (Semangun, 2000).
2. Tanaman yang sakit dibongkar, sisa-sisa akar dibersihkan dan dibakar (Semangun, 2000).
dibongkar apabila telah mati atau menunjukkan gejala serangan berat (Semangun, 2000).
4. Untuk mencegah penyebaran ke tanaman lain, perlu dibuat parit isolasi sedalam sekitar 80 cm pada daerah satu baris diluar tanaman mati. Hal ini untuk mencegah penularan jamur akar terutama yang terjadi kontak akar atau perantaraan rhizomorf (Anonimus, 2008).
5. Tanaman yang berada disekitar tanaman mati perlu dilakukan pemeriksaan akar tunggangnya. Pada serangan awal akan tampak adanya tanda-tanda berupa miselium atau rhizomorf pada permukaan akar. Miselium tersebut harus dibersihkan dengan sikat kemudian akar dioles dengan fungisida khusus untuk jamur akar. Ada beberapa fungisida yang cukup efektif misalnya Fomac 2, Calixin CP, Sheel Collar Protectan, Ingro Paste (Anonimus, 2008).
6. Pada areal pertanaman, tanaman kakao yang terserang berat dibongkar sampai ke akarnya dan dibakar ditempat itu juga. Lubang bekas bongkaran dibiarkan terkena sinar matahari selama 1 tahun. Minimal 4 pohon disekitarnya diberi Trichoderma sp. 200 gr/pohon pada awal musim hujan dan diulang setiap 6 bulan
sekali sampai tidak ditemukan gejala penyakit akar di areal pertanaman kakao tersebut (Anonimus, 2004).
Trichoderma koningii Oud.
Sifat antagonis jamur Trichoderma sp. telah diteliti sejak lama. Inokulasi Trichoderma sp. ke dalam tanah dapat menekan serangan penyakit layu yang
petri. Spesies lain dari jamur ini telah diketahui bersifat antagonistik atau parasitik terhadap jamur patogen tular tanah yang banyak menimbulkan kerugian pada tanaman pertanian (Khairul, 2001)
Gambar 5. Biakan murni Trichoderma koningii pada media PDA Sumber: (Anonimus, 2003)
Biologi Trichoderma koningii Oud.
Jamur ini dapat diklasifikasikan sebagai berikut: Kingdom : Fungi
Sub divisio : Deuteromycotina Kelas : Hyphomycetes
Ordo : Hyphales (Moniliales) Famili : Moniliaceae
Genus : Trichoderma
Spesies : Trichoderma koningii Oud. (Agrios, 1996)
Jamur antagonis Trichoderma koningii mempunyai stadium teleomorf, yaitu Hypocrasea ceramica Ellis & Everh. dan Hypocrea brunneo-lutea Doi. Koloninya mencapai diameter 3-5 cm dalam waktu lima hari pada suhu 200 C di
Trichoderma viride, tetapi konidiumnya berdinding lembut, agak kasar, berbentuk
silinder pendek dengan bagian dasar terpotong, dan berukuran (3-4,8) x (1,9-2,8) µ m (Soesanto, 2008).
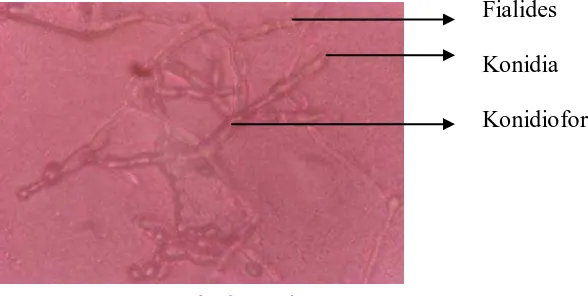
Trichoderma koningii sering diragukan dengan Trichoderma pseudokoningii Rifai, yang mempunyai kemiripan fialida dan
konidium. Akan tetapi, pada spesies Trichoderma pseudokoningii tersebut, fialidanya sering muncul secara tunggal dan mendatar, serta keseluruhan sistem konidiofor berbentuk agak memanjang dari piramid (Soesanto, 2008).
Fialides
Konidia Konidiofor
Gambar 6. Trichoderma koningii Sumber: Foto langsung
Ekologi Trichoderma koningii Oud.
serasah lembab hutan pohon berdaun jarum (Danielson & Davey, 1973; Widden & Abitbol, 1980).
Jamur antagonis ini sering diisolasi dari tanah hutan, misalnya dibawah pohon pinus atau berdaun jarum, acacia, nothofagus, pohon berdaun lebar lainnya, pada pembibitan tanaman hutan, tanah hutan yang subur dibawah tetumbuhan pioner dalam komunitas tanaman hutan, sangat sering diisolasi dari tanah pertanian, tanah padang rumput, perkebunan jeruk, tanah kebun, kebun anggur, tanah lapang gambut, tanah rawa, tanah bergaram, tanah berpasir tanah coklat, podsolik, gua, dan disemua jenis tanah di dunia. Jamur ini sering dijumpai di lapisan permukaan tanah, tetapi juga pada kedalaman tanah 120 cm, dan umumnya pada habitat yang agak asam. Jamur juga sering dijumpai pada tanah yang diperlakukan dengan alil alkohol atau beragam fungisida (Soesanto, 2008).
Jamur antagonis ini juga umum ditemukan di sisa-sisa tanaman , misalnya
dari Abies firma, Abies grandis, Picea sitchensis, Pinus sylvestris, Ginkyo biloba, Castanea sativus, Allium ascalonicum, Spartina townsendii,
Heraclium sphdylium, kayu yang terdedah ke tanah, tunggul Lentinus edoa, akar
gandum, buncis, bit gula, pinus, rizosfer cengkeh, kacang tanah, alfalfa, ketumbar, kopi, kentang, gandum, oat, mikoriza Suilus luteus pada Pinus strobus, biji kapri, Avena fatua, ampas jagung, sarang burung, bubur kertas, dan lainnya.
Perkecambahan konidium relatif tak peka terhadap mikostasis tanah. Pertumbuhan in vitro tampak dihentikan oleh kontak hifa dengan tuber melanosporum (Soesanto, 2008).
kondisi netral, pengaruh keasaman dapat dikurangi dengan penggunaan ekstrak kecambah (Soesanto, 2008).
Suhu optimum untuk pertumbuhannya adalah 260 C atau lebih tinggi, tergantung pada asal isolat. Suhu maksimumnya 32-400 C dan optimum pH 3,7-6,0 pada tekanan CO2 normal. Pertumbuhan sangat dihambat oleh ion HCO3-,
tumbuh dengan baik pada potensi air -30 bar dan tidak dibawah -110 bar (Soesanto, 2008).
Pertumbuhan optimum terjadi pada amino-N, diikuti oleh amonium, urea, dan nitrat; yang diketahui sebagai sumber C yang sesuai termasuk fruktosa, ribosa, selubiose, melibiosa, trehalosa, gliserol, meso-eritritol, dekstrin, D-manosa, D-glukosa, D-silosa, maltosa, fruktosan, dan asam fumarat. Penguraian selulosa dengan produksi C1, C2, β-glukosidase dan 1,4-β-glukan selobiohidrolase;
amilase, β-fruktofuranosidase, α-glukosidae, dan endo-1,3-β-silanase telah dicatat.
Trichoderma koningii juga akan tumbuh pada sodium polipektat dan pektin, dan
dua endopoligalaturonase; kitin dan tanin digunakan, dan ribonuklease, fenol oksidase, dan enzim proteolisis dihasilkan. Dieldrin dilaporkan dapat diuraikan oleh Trichoderma koningii in vitro (Soesanto, 2008).
Fisiologi Trichoderma koningii Oud.
Jamur antagonis Trichoderma koningii dalam mekanisme antagonisnya membentuk senyawa dengan sifat mikostatis dan juga senyawa anti jamur,
meskipun belum dapat diidentifikasi. Di laboratorium, jamur Trichoderma koningii mampu menghambat pertumbuhan jamur patogen
Rigidoporus lignosus, penyebab penyakit akar putih pada tanaman karet. Pada
tanah kebun jeruk, jamur tidak dapat menghambat jamur patogen Fusarium spp. Akan tetapi, jamur mampu membelit hifa Lentinus edodes dan beberapa jamur saprofit atau parasit lainnya. Beberapa isolat dijumpai mampu merangsang produksi oospora dari Phytophthora cinnamomi. Pada tanah dengan kandungan 104_105 propagul g-1, Trichoderma koningii menghasilkan becak 70-100% pada bibit jagung. Jamur tampak mempunyai toleran yang tinggi terhadap CO2
(Soesanto, 2008).
Isolat Trichoderma koningii mampu membunuh sklerotium antara
62-100%. Jamur mikoparasit ini dengan mudah mengganti penempatan Trichoderms viride. Trichoderma koningii juga memarasit hifa hidup dari
Trichoderma koningii dan spesies Trichoderma lainnya merupakan jamur
tular tanah, yang sekali diberikan dan menetap didalam tanah akan selamanya menetap. Trichoderma koningii mampu berperan sebagai agensia penekan terhadap patogen berbahaya, seperti Gaeumannomyces graminis var. tritici pada gandum. Keaktifan Trichoderma koningii dipengaruhi oleh pH, yang menjadi lebih besar pada tanah asam. Penambahan mikoparasit ini pada tanah asam juga menyebabkan penekanan patogen yang diperlama, sedangkan penekanan tidak
akan terjadi bila ditambahkan pada tanah berkapur. Penambahan Trichoderma koningii buatan ke tanah yang terinfestasi patogen meningkatkan
potensi inokulumnya, mengurangi potensi inokulum patogen, dan menurunkan keberadaan penyakit. Jamur antagonis mampu menghambat jamur patogen pembentuk sklerotium, seperti Sclerotina sclerotium, Corticium rolfsii, dan Rhizoctonia solani (Soesanto, 2008).
Keberadaan spora yang hidup pada suatu cendawan dengan media tempat tumbuhnya menentukan persentase jumlah spora hidup yang dihasilkan (Syatrawati, 2008).
Komposisi Nutrisi Media Organik
Jagung dan Beras
Biji jagung terdiri dari kulit ari, lembaga, tip cap dan endosperma. Sebagian besar pati (85 %) terdapat pada endosperma. Pati terdiri dari fraksi amilopektin (73 %) dan amilosa (27 %). Serat kasar terutama terdapat pada kulit ari. Komponen utama serat kasar adalah hemiselulosa (41,16 %). Gula terdapat pada lembaga (57 %) dan endosperma (15 %). Protein sebagian besar terdapat
pada endosperma (Anonimus, 2005). Beras (Oryza sativa) terdiri dari dua jenis, yaitu Japonica yang ditanam di
tanah yang mempunyai musim dingin, dan Indica atau Javanica yang ditanam di daerah tropis. Bagian yang berharga dari tanaman padi adalah gabah. Bila gabah kering dikelupaskan kulit bijinya, diperoleh sekam yang berwarna kuning sampai ungu kotor dengan jumlah sampai 20 % dari gabah kering dan isi biji yang disebut dengan beras pecah kulit. Untuk perdagangan beras pecah kulit disosoh untuk
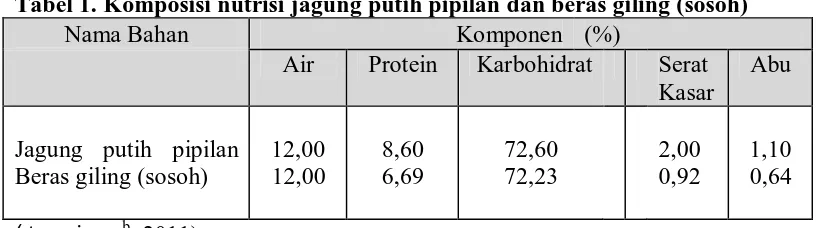
membuang kulit arinya (Anonimus, 2005). Komposisi nutrisi jagung putih pipilan lebih tinggi dibandingkan beras
giling. Hal ini bisa dilihat pada tabel 1:
Tabel 1. Komposisi nutrisi jagung putih pipilan dan beras giling (sosoh)
Dedak Padi
Dedak padi (hu’ut dalam bahasa sunda) merupakan hasil sisa dari penumbukan atau penggilingan gabah padi. Dedak tersusun dari tiga bagian yang masing masing berbeda kandungan zatnya. Ketiga bagian tersebut adalah; kulit gabah yang banyak mengandung serat kasar dan mineral, selaput perak yang kaya akan protein dan vitamin B1 juga lemak dan mineral, serta lembaga beras yang sebagian besar terdiri dari karbohidrat yang mudah dicerna (Anonimusc, 2011).
BAHAN DAN METODE
Waktu dan Tempat Percobaan
Penelitian ini dilaksanakan di Rumah Kassa Fakultas Pertanian USU dengan ketinggian tempat ± 25 m dpl. Pelaksanaan dimulai bulan November 2010 sampai April 2011.
Bahan dan Alat
Adapun bahan yang digunakan dalam penelitian ini adalah benih kakao lindak hibrida F1 TSH 858, pupuk kandang, top soil, air, polibag ukuran 3 kg, aquades, biakan murni Trichoderma koningii, inokulum jamur Phelinus noxius, Potato Destrose Agar (PDA), tissu gulung, klorox, jagung giling, beras, dedak, dan potongan akar sehat yang akan dibuat menjadi food base P. noxius.
Adapun alat yang dipergunakan adalah cangkul, alat pemotong akar (pisau/ gergaji), timbangan, cork borer diameter 0,5 cm, erlenmeyer, petridish, gelas ukur, beaker glass, mikroskop, pipet tetes, haemocytometer, jarum inokulasi, inkubator, object glass, pinset, bunsen, aluminium foil, cling wrap, selotip, otoklaf, meteran, kukusan tanah, ayakan tanah, handsprayer, kalkulator, pH-meter dan alat tulis.
Metode Penelitian
T0 = Kontrol (tanpa dosis)
T1 = Trichoderma koningii dalam media jagung sebanyak 15 g/ polibag
T2 = Trichoderma koningii dalam media jagung sebanyak 25 g/ polibag
T3 = Trichoderma koningii dalam media jagung sebanyak 35 g/ polibag
T4= Trichoderma koningii dalam media beras sebanyak 15 g/ polibag
T5= Trichoderma koningii dalam media beras sebanyak 25 g/ polibag
T6= Trichoderma koningii dalam media beras sebanyak 35 g/ polibag
T7= Trichoderma koningii dalam media dedak sebanyak 15 g/ polibag
T8= Trichoderma koningii dalam media dedak sebanyak 25 g/ polibag
T9= Trichoderma koningii dalam media dedak sebanyak 35 g/ polibag
Ulangan sebanyak 3 kali diperoleh dari: (t-1) (r-1) ≥ 15
(10-1) (r-1) ≥ 15 9r-9 ≥ 15
r ≥ 24/ 9 r = 2,667 r = 3
Model linier dari rancangan yang digunakan adalah : Yij = µ + ρi + τj + εij
dimana :
Yij = hasil pengamatan pada blok ke-i dan perlakuan ke-j
µ = rataan atau nilai tengah umum ρi = efek dari blok ke-i
εij = efek error dari blok ke-i dan perlakuan ke-j
(Bangun, 1990).
Jika sidik ragam menunjukkan efek yang nyata maka dilanjutkan dengan uji jarak berganda duncan (DMRT).
Jumlah perlakuan = 10 perlakuan Jumlah ulangan = 3 ulangan Jumlah polibag per perlakuan = 5 polibag Jumlah tanaman per polibag = 1 tanaman Jumlah seluruh perlakuan = 30 perlakuan Jumlah tanaman seluruhnya = 150 tanaman
Jumlah sampel yang diamati = 3 tanaman per perlakuan Jarak antar perlakuan = 50 cm
Jarak antar polibag = 30 x 30 cm
Pelaksanaan Penelitian
Penyediaan Sumber Inokulum Phellinus noxius
Sumber inokulum diambil dari akar tanaman kakao yang terserang Phellinus noxius. Bagian akar yang terinfeksi dibersihkan dengan air steril, lalu
dipotong-potong (0,5 cm), kemudian disterilkan dengan klorox 1% selama 3 menit. Potongan akar dibersihkan kembali dengan air steril. Hal ini diulangi sebanyak tiga kali. Selanjutnya potongan tersebut dikeringkan di atas tissue dan ditanam dalam media PDA. Kultur tersebut disimpan dalam inkubator.
Penyediaan Jamur Trichoderma koningii Oud.
Isolat Trichoderma koningii diperoleh dari Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBP2TP). Isolat T. koningii kemudian ditanam di dalam media PDA (disegarkan) dan diinkubasi selama 3 hari untuk memperoleh biakan murni.
Perbanyakan Trichoderma koningii Oud.
Disediakan air bersih untuk membasahi dan membersihkan media perbanyakan. Disiapkan media organik yang akan digunakan (jagung giling, beras dan dedak). Media jagung dan media beras dibersihkan terlebih dahulu dari kulit ari/ ampas dan kotoran. Setelah itu semua media perbanyakan dibasahi secara merata dengan air. Karena media dedak cukup halus penambahan air harus dilakukan lebih hati-hati. Kemudian untuk melembabkan media tersebut didiamkan selama ±45 menit. Setelah itu media ditakar sesuai dosis yang ditentukan, dimasukkan kedalam plastik bening tahan panas, dan diikat dengan karet, kemudian diotoklaf selama 15 menit pada suhu 120° C pada tekanan 1,2 atm. Setelah itu media didinginkan selama dua jam kemudian diinokulasikan sebanyak tiga buah bulatan cork borer dari biakan murni T. koningii dan diinkubasi selama 7 hari pada suhu ruangan 28° C.
Persiapan Benih
berwarna jingga kemerahan, produktivitas tinggi, mencapai 1.766 kg/ ha/ tahun, bobot rata-rata biji kering 1,15 g, kadar lemak biji 56% dan moderat terhadap penyakit busuk buah (Anonimus, 2010).
Tanaman kakao yang akan diambil benihnya sebaiknya dari kebun induk yang mempunyai sifat-sifat; kondisinya sehat, pertumbuhannya normal dan kokoh, menghasilkan produksi tinggi (antara 70-90 tongkol/ pohon/ tahun), berumur 12-18 tahun (Sunanto, 1992).
Benih cokelat yang baik adalah benih berasal dari buah yang normal bentuknya, sehat dan cukup tua (masak atau matang dipohon), cirinya adalah sebagai berikut: warnanya kuning, pada jenis cokelat yang kulit buahnya merah yang kuning adalah alurnya, sedangkan jenis cokelat yang kulit buahnya hijau berubah menjadi kekuning-kuningan atau oranye, jika buah diguncang timbul suara yang menandakan bahwa biji-biji cokelat tersebut sudah lepas dari rekatan daging buah dan jika diketuk dengan tangan suaranya bergema (Sunanto, 1992).
Persiapan Media Tanam
Tanah top soil dan pupuk kandang yang akan digunakan 3:1 diayak terlebih dahulu. Media campuran tersebut disterilkan dengan menggunakan uap panas untuk membunuh mikroorganisme pada media tanam. Sterilisasi dilakukan dengan menggunakan drum pengukus/ kukusan tanah.
Suhu yang baik untuk sterilisasi tanah dengan sempurna apabila suhu pada bagian tanah yang paling dingin sedikitnya tetap bertahan pada 820 C selama 30 menit (Agrios, 1996).
Media yang telah dipanaskan dikeluarkan dari kukusan, lalu dikering-anginkan di atas plastik di ruangan tertutup sampai dingin. Setelah itu, tanah tersebut dimasukkan ke dalam polibag masing-masing ukuran 3 kg. Polibag-polibag yang telah diisi tanah tersebut kemudian disusun rapi.
Pengaplikasian Trichoderma koningii Oud.
Sebelum dilakukan penanaman, media tanam dalam masing-masing polibag terlebih dahulu dicampur dengan Trichoderma koningii Oud. sesuai dengan perlakuan. Pemberiannya dilakukan dengan cara diaduk merata sampai kedalaman 5 cm dari permukaaan tanah.
Penanaman Benih
dimasukkan, diberikan pupuk TSP 1 gr/ polibag. Adapun pemberiannya adalah dengan cara penugalan disalah satu tempat di daerah radius sekitar benih. Benih yang sudah ditanam kemudian disiram dengan air untuk merangsang pertumbuhan akar.
Gambar 7. Sketsa penanaman benih Keterangan: 1. polibag, 2. benih kakao, 3. radikula
Pembuatan Food Base Phellinus noxius
PDA steril (cair) dituang kedalam beaker glass steril, setelah dingin masukkan tiga potongan cork borer biakan murni P. noxius. Lalu ditutup dengan aluminium foil dan direkatkan dengan cling wrap. Diinkubasi ± 3 hari sebelum potongan food base dimasukkan.
Akar kakao yang sehat atau tidak terinfeksi dicuci dengan air yang mengalir dibersihkan dari kotoran atau tanah yang melekat, dan dipotong-potong ukuran ± 2x1x1 cm. Kemudian dimasukkan kedalam plastik tahan panas atau beaker glass dan diotoklaf selama 15 menit pada suhu 1200 C tekanan 1,2 atm. Lalu setelah dingin dimasukkan kedalam beaker glass yang sudah berisi biakan murni P. noxius, ditutup dengan aluminium foil kemudian sekelilingnya direkatkan dengan cling wrap. Potongan akar tersebut lalu diinkubasi selama 1 bulan dan siap menjadi food base P. noxius.
2 3
Inokulasi Food Base Phellinus noxius
Food base umur satu bulan yang sudah diinkubasi dibuka dan dua buah
potongan akar yang masing-masing sudah terkolonisasi dengan baik oleh P. noxius ditanam pada kedalaman sekitar 5 cm kontak dengan akar pada
masing-masing tanaman di polibag. Perkembangan penyakit diamati dan dicatat secara mingguan interval waktu enam bulan (Farid, dkk. , 2005).
Pemeliharaan
Pemeliharaan tanaman kakao meliputi aktivitas penyiraman yang dilakukan dua kali sehari (pagi dan sore), penyemprotan insektisida untuk mengendalikan hama belalang, penyiangan gulma dan pemupukan.
Peubah Amatan
Persentase Serangan (Kejadian Penyakit) P. noxius
n
Intensitas Penyakit (%) P. noxius
Pengamatan terhadap intensitas penyakit dilakukan dengan cara membongkar satu sampel tanaman dalam setiap plot pada masing-masing blok yang menunjukkan gejala tampak atas terparah. Waktu pembongkaran bersamaan dengan waktu pengamatan kejadian penyakit. Adapun rumus yang digunakan adalah:
Adapun salah satu cara mengkategorikan serangan pada tanaman yang berakar tunggang adalah sebagai berikut:
0= bila tanaman tidak terserang sama sekali.
3= bila kulit dan kayu akar utama/ tunggang telah busuk seluas <90 derajat (kurang dari ¼ lingkar akar) atau ada <50 % dari jumlah akar cabang telah busuk hingga layu.
4= bila kulit dan kayu akar utama/ tunggang busuk seluas >90 derajat (lebih dari ¼ lingkar akar) atau >50 % dari jumlah akar cabang telah busuk hingga layu. (Syahnen, 2006).
Jumlah Konidia T. koningii Pada Media Organik
Pembuatan media organik yang diinokulasi dengan Trichoderma koningii dilakukan sama dengan cara kerja perbanyakan jamur Trichoderma koningii, lalu dilakukan penghitungan jumlah konidia pada umur 9, 17, 25 hsi dengan cara sebagai berikut:
- Ditimbang media jamur antagonis yang telah diinokulasi sebanyak 1 gram. - Dimasukkan kedalam erlenmeyer dan ditambahkan air sebanyak 100 ml. - Dishaker selama 30 menit dengan kecepatan 10 rpm.
- Diambil kurang lebih 1 cc dengan pipet tetes kemudian diteteskan pada haemocytometer hingga suspensi mengalir kebawah kaca obyek dan
mengisi ruang hitung.
- Dihitung jumlah konidia dalam 5 kotak besar yang masing-masing dilakukan dibawah mikroskop, penghitungan dilakukan 2x, dengan rumus sebagai berikut;
Jumlah konidia= Rata- rata konidia x d x 106 80 x 0,25
Keterangan: d = pengencer
(Sudarna, 2010).
Panjang Akar Tunggang
Sampel akar tanaman yang diukur merupakan sampel akar yang sama dengan sampel intensitas serangan. Pengukuran dilakukan dengan menggunakan penggaris dari pangkal akar sampai ujung terpanjang akar tunggang.
Derajat Kemasaman Tanah (pH tanah)
Prosedur kerja untuk menghitung derajat kemasaman tanah adalah sebagai berikut:
- Ditimbang 10 gram tanah kering udara (kering normal). - Ditambahkan 25 ml H2O (aquades).
- Dishaker 30 menit setelah itu dibiarkan sebentar sampai homogen. - Diukur pH tanah dengan alat pH-meter.
HASIL DAN PEMBAHASAN
Persentase Serangan (Kejadian Penyakit) P. noxius
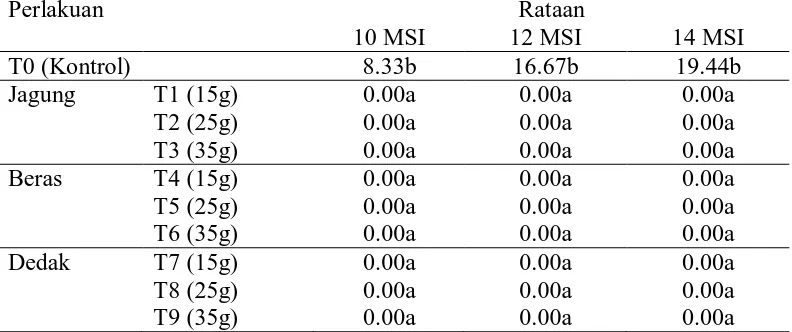
Data pengamatan kejadian penyakit 10, 12 dan 14 minggu setelah inokulasi (msi) dan hasil analisis sidik ragam dapat dapat dilihat pada lampiran 3 sampai dengan 8. Hasil analisis sidik ragam menunjukkan bahwa perlakuan aplikasi jamur T. koningii melalui media jagung, beras dan dedak menunjukkan perbedaan yang nyata dengan kontrol (C1) terhadap peubah amatan kejadian penyakit pada pengamatan 10, 12 dan 14 msi.
Rataan dari kejadian penyakit pada pengamatan 10, 12 dan 14 msi dapat dilihat pada tabel 2.
Tabel 2. Data pengamatan persentase serangan (kejadian penyakit) pada pengamatan 10, 12 dan 14 msi
Perlakuan Rataan
Ket: Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak berganda duncan (DMRT).
perlakuan kontrol sedangkan pada perlakuan yang diaplikasikan jamur T. koningii tidak terjadi serangan (kejadian penyakit sama dengan nol). Hal ini sesuai dengan Khairul (2001) sifat antagonis jamur Trichoderma sp. telah diteliti sejak lama. Inokulasi Trichoderma sp. ke dalam tanah dapat menekan serangan penyakit layu yang menyerang di persemaian, hal ini disebabkan oleh adanya pengaruh toksin yang dihasilkan jamur ini yang dapat diisolasi dari biakan yang ditumbuhkan di dalam petri. Spesies lain dari jamur ini telah diketahui bersifat antagonistik atau parasitik terhadap jamur patogen tular tanah yang banyak menimbulkan kerugian pada tanaman pertanian. Tabel 2 juga menunjukkan bahwa gejala penyakit pada penelitian timbul pada ± 10 msi.
Intensitas Penyakit (%) P. noxius
Data pengamatan intensitas penyakit 10, 12 dan 14 msi dan hasil analisis sidik ragam dapat dapat dilihat pada lampiran 9 sampai dengan 14. Hasil analisis sidik ragam menunjukkan bahwa perlakuan aplikasi jamur T. koningii melalui media jagung, beras dan dedak menunjukkan perbedaan yang nyata dengan kontrol (C1) pada peubah amatan intensitas penyakit pada pengamatan 10, 12 dan 14 msi.
Tabel 3. Data pengamatan intensitas penyakit (%) pada pengamatan 10, 12
Ket: Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak berganda duncan (DMRT).
Jumlah Konidia T. koningii Pada Media Organik
Tabel 4. Data penghitungan jumlah konidia T. koningii pada pengamatan 9, 17 dan 25 hsi pada media jagung, beras, dedak (x 108)
Ket: Angka-angka hasil penghitungan pada kolom diatas tidak diolah secara statistik.
Pada tabel 4 terlihat bahwa terjadi peningkatan jumlah konidia pada masing- masing hari pengamatan. Didapatkan hasil bahwa media yang paling baik untuk pertumbuhan T. koningii yaitu pada media jagung yakni dengan jumlah konidia tertinggi pada 25 hari setelah inokulasi (hsi) yakni 0,88 x 108 diikuti dedak 0,33 x 108 dan beras 0,2 x 108. Terlihat bahwa terjadi kenaikan jumlah konidia pada media jagung pada setiap waktu pengamatan, namun sebaliknya pada media beras dan dedak meski terjadi kenaikan jumlah konidia pada pengamatan 17 dan 25 hsi namun tidak begitu terlihat (hanya sedikit). Hal tersebut sesuai dengan pernyataan Syatrawati (2008) yaitu fase pertumbuhan mikroorganisme yang pada fase awal pertumbuhannya lamban disebut lag phase, kemudian diikuti oleh suatu periode pertumbuhan yang cepat disebut fase logaritmik atau fase eksponensial, kemudian mendatar (fase statis), dan akhirnya diikuti oleh suatu penurunan populasi sel-sel hidup (fase kematian atau fase penurunan). Terlihat bahwa terjadi perbedaan pertambahan jumlah konidia antara media jagung, beras, dedak pada 9, 17, 25 hsi. Hal itu kemungkinan disebabkan oleh tidak adanya faktor penghambat pertumbuhan pada jagung sehingga produksi konidia yang bersifat viable tetap meningkat. Hal ini sesuai dengan Syatrawati
Media Jumlah konidia per ml (x 108)
9 HSI 17 HSI 25 HSI
Jagung 0,22 0,44 0,88
Beras 0,135 0,155 0,2
(2008) yang menyatakan keberadaan spora yang hidup pada suatu cendawan dengan media tempat tumbuhnya menentukan persentase jumlah spora hidup yang dihasilkan dan Howell (1991) yang menyatakan substrat atau media organik tempat tumbuh cendawan antagonis berpengaruh dalam menghasilkan berbagai bentuk spora, zat anti cendawan maupun anti bakteri. Kombinasi cendawan antagonis dan media organik yang tepat harus digunakan agar dapat menekan penyakit dengan baik.
Panjang Akar Tunggang
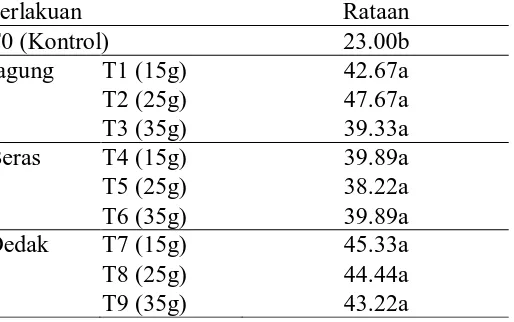
Data pengamatan panjang akar tunggang dan hasil analisis sidik ragam dapat dilihat pada lampiran 15 dan 16. Hasil analisis sidik ragam menunjukkan bahwa perlakuan aplikasi jamur T. koningii melalui media jagung, beras dan dedak menunjukkan perbedaan yang nyata dengan kontrol (C1).
Rataan dari panjang akar tunggang akibat pengaplikasian jamur T. koningii melalui media jagung, beras dan dedak dapat dilihat pada tabel 5.
Tabel 5. Data panjang akar tunggang akibat pengaplikasian jamur T. koningii melalui media jagung, beras dan dedak (cm)
Perlakuan Rataan
Dari tabel 5 terlihat bahwa perlakuan pemberian jamur T. koningii melalui media jagung, beras dan dedak menunjukkan perbedaan yang nyata dengan kontrol. Tabel 5 menunjukkan bahwa rataan akar tunggang terpanjang terdapat pada perlakuan (T2) 47,67 cm yang tidak berbeda nyata dengan perlakuan T1, T3, T4, T5, T6, T7, T8, dan T9 dan yang terpendek terdapat pada perlakuan kontrol (T0) yaitu 23 cm yang berbeda nyata dengan perlakuan lainnya. Hal ini dikarenakan media organik mengandung komposisi seperti air, protein, lemak, abu yang dapat diuraikan oleh tumbuhan sebagai nutrisi untuk pertumbuhan akar.
Derajat Kemasaman Tanah (pH tanah)
Data pengamatan pH tanah dan hasil analisis sidik ragam dapat dilihat pada lampiran 17 dan 18. Hasil analisis sidik ragam menunjukkan bahwa perlakuan aplikasi jamur T. koningii melalui media jagung, beras dan dedak menunjukkan perbedaan yang tidak nyata terhadap parameter pH tanah.
Rataan dari pH tanah akibat dari pengaplikasian T. koningii dapat dilihat pada tabel 6.
Tabel 6. Rataan pH tanah akibat pengaplikasian T. koningii
Perlakuan Rataan
terlihat bahwa terjadi penurunan pH yang tidak nyata dengan pemberian jamur T. koningii dimana pada perlakuan kontrol pH tanah menunjukkan skala 7 dan
setelah diaplikasikan jamur T. koningii terjadi penurunan pH yang secara statistik
penurunan tersebut tidak signifikan. Namun, walau begitu pemberian T. koningii pada perlakuan T1 sampai T9 membuat kondisi tanah lebih masam
daripada perlakuan T0 (kontrol) ini terjadi karena ada mekanisme antagonis pada perlakuan T1 sampai T9 seperti yang dinyatakan Anonimus (2009) bahwa Trichoderma menghasilkan enzim kitinase dan glukanase yang masing-masing mampu melisiskan dinding hifa jamur dari kelas basidiomycetes dan askomycetes serta tidak ada satupun dinding hifa jamur yang tahan terhadap kitinase Trichoderma khususnya jamur patogen yang berasal dari klas askomycetes dan basidiomycetes. Endokitinase dan eksokitinase (N-acetyl-β-D-glukosaminidase) dan ketobiosidase dari Trichoderma aktivitasnya 100 kali lebih aktif daripada kitinase tanaman. Hal ini berhubungan dengan aktivitas antagonis yang dilakukan Trichoderma sp., dengan dihasilkannya zat-zat berupa enzim dan toksin sebagai
KESIMPULAN DAN SARAN
Kesimpulan
1. Intensitas serangan dan kejadian penyakit hanya terdapat pada perlakuan T0 (kontrol) yaitu 19,44% dan 77,78% pada pengamatan 14 msi.
2. Jumlah spora tertinggi sampai pengamatan 25 hsi terdapat pada media jagung yaitu 0,88 x 108 dan yang terendah terdapat pada media beras 0,2 x 108. 3. Rataan akar tunggang terpanjang sampai 14 msi terdapat pada perlakuan T2 (T. koningii dalam media jagung 25 g/ polibag) yaitu 47,67 cm dan terpendek pada perlakuan T0 (kontrol) yaitu 23 cm.
4. Dosis 15 g T. koningii dalam media jagung, beras, dan dedak sudah dapat menekan perkembangan jamur akar cokelat pada pembibitan kakao.
Saran
DAFTAR PUSTAKA
Agrios, G. N. 1996. Ilmu Penyakit Tumbuhan. Edisi Ketiga. Terjemahan M. Busnia. GMU Press. Yogyakarta.
Alvim, P. de T. 1980. Environtmental Requirement of Cocoa with Emphasis on Responses to Shade and Moisture Stress. Proceeding International Conference Cocoa and Coconut. Kualalumpur.
Ann, PJ., TT. Chang and WH. Ko. 2002. Phellinus noxius Brown Root Rot of Fruit and Ornamental Trees in Taiwan. Plant Disease. Vol. 86 No. 8. Hlm. 820-826.
Anonimus. 2003. What Are The Common Contaminants Of The Mushroom Culture.
Agustus 2010.
Anonimus. 2004. Musuh Alami, Hama dan Penyakit Tanaman Kakao. Edisi keempat. Bagian Proyek Pengendalian Hama Terpadu Perkebunan Rakyat Pusat. Departemen Pertanian. Jakarta.
Anonimus. 2005. Tanaman Penghasil Pati.
10 Juli 2011.
. 2008. Panduan Lengkap Budidaya Kakao. Edisi revisi. Agromedia Pustaka. Jakarta.
. 2009. Bundel Hasil Kegiatan Pengembangan Teknologi Perlindungan Perkebunan. Medan.
. 2011. Budidaya Kakao. http// gatsgarden.com//bibit-tanaman-buah/ budidaya kakao. htm. Diakses 24 Juni 2011.
c. 2011. Terminologi Bahan Pakan dari Hasil Ikutan Industri Pangan. http// manglayang. blogsome.com. Diakses 15 April 2011.
Bangun, M. K. 1990. Rancangan Percobaan. Fakultas Pertanian. Universitas Sumatera Utara. Medan.
Bartz, F. 2007. Pathogen Profile: Phellinus noxius (Corner) G. Cunningham. http// www. ncsu. edu. A Class Project for Soilborne Plant Pathogens Department of Plant Pathology. North Carolina State University. Spring. pp. 728. Diakses 15 April 2010.
Danielson, R. M. & Davey, C. B. 1973. The Abundance of Trichoderma
Propagules and The Distribution of Species in Forest Soils. Soil Biology & Biochemistry 5. Hlm. 485-494.
Domsch, K. H., Gams, W. & Anderson, T.-H. 1980. Compendium of Soil Fungi. Academic Press. London, New York.
Hagn, A., Pritsch, K., Schloter, M. & Munch, J. C. 2003. Fungal Diversity in Agricultural Soil Under Different Farming Management Systems, with Special Reference to Biocontrol Strains of Trichoderma spp. Biology & Fertility of Soils 38. Hlm. 236-244.
Hall, C. J. J. van. 1932. Cacao. Mac Millan & Co Lim. London.
ICCO. 2007. Annual Report in The International Cocoa Organization. London, UK.
Howell. 1991. Biological Control of Pythium Damping-Off of Cotton with Seed-Coating Preparation of Gliocladium virens. Phytopathology. 81: 738-741.
Khairul, U. 2001. Pemanfaatan Bioteknologi untuk Meningkatkan Produksi Pertanian. Makalah Falsafah Sains (PPs 702) Program Pasca Sarjana/ S3 Institut Pertanian Bogor. Bogor.
Mohd Farid, A., Lee, S. S., Mohd Rosli, H., Maziah, Z. and Norwati, M. 2005. Basal Root Rot, A New Disease of Teak (Tectona grandis) in Malaysia caused by Phellinus noxius. Malaysian Journal Of Microbiology. Vol 1(2) 2005. Hlm. 40-45.
Rahmadi, A. 2008. Peningkatan Kualitas Mutu Biji Kakao Kering dan Pencegahan Kontaminasi Mikotoksin pada Produk Kakao Masyarakat di Propinsi Kalimantan Timur. Jurusan Teknologi Hasil Pertanian Fakultas Pertanian. Universitas Mulawarman.
Roiger, D. J., Jeffers, S. N. & Caldwell, R. W. 1991. Occurrence of
Biology & Biochemistry 23. Hlm. 353-359.
Semangun, H. 2000. Penyakit-Penyakit Tanaman Perkebunan di Indonesia. GMU Press. Yogyakarta.
Sinaga, M.S. 2006. Dasar-Dasar Ilmu Penyakit Tumbuhan. Penebar Swadaya. Jakarta.
Soepena, H. 1993. Pemberantasan Jamur Akar Putih dengan Trichoderma. Pusat Penelitian Karet. Disampaikan dalam Rapat Panitia Kultura Karet (PAKULRET) Sungei Putih, 14-15 April 1993. Warta Perkebunan. Vol 12(1) 1993. Hlm. 17-22.
Sudarna, S. 2010. Juklak/ Juknis Pengembangan Agensia Hayati Tahun 2007 Kegiatan Pengembangan PHT Tanaman Perkebunan. http// www.disbun.jabarprov.go.id. Diakses 27 maret 2011.
Sunanto, H. 1992. Cokelat Budidaya, Pengolahan Hasil dan Aspek Ekonominya. Kanisius. Yogyakarta.
Supriadi, E.M Adhi, D. Wahyuno, S. Rahayuningsih, N. Karyani, M. Dahsyat. 2004. Brown Root Disease of Cashew in West Nusa Tenggara: Distribution and Its Causal Organism. Indonesian Journal of Agricultural Science 5(1) 2004: 32-36.
Soesanto, L. 2008. Pengantar Pengendalian Hayati Penyakit Tanaman Suplemen ke Gulma dan Nematoda. Rajawali Press. Jakarta. Hlm. 299-304.
Syahnen. 2006. Prosedur Operasi Standar/ Perbanyakan Jamur Trichoderma. Balai Pengembangan Proteksi Tanaman Perkebunan. Medan.
Syatrawati. 2008. Produksi Senyawa Biofungisida Berbahan Aktif Gliocladium sp. Pada Berbagai Medium Limbah Organik. Jurnal
Agrisistem. Vol. 4 No. 2 ISSN 1858-4330. Politeknik Pertanian Negeri Pangkep.
Waksman, S. A. 1952. Soil Microbiology. Wiley, J. New York.
Widden, P. & Abitbol, J. J. 1980. Seasonality of Trichoderma Species in a Spruce-Forest Soil. Mycologia 72. Hlm 775-784.
Lampiran 1. Bagan percobaan penelitian
T1 = Trichoderma koningii dalam media jagung sebanyak 15 g/ polibag
T2 = Trichoderma koningii dalam media jagung sebanyak 25 g/ polibag
T3 = Trichoderma koningii dalam media jagung sebanyak 35 g/ polibag
T4= Trichoderma koningii dalam media beras sebanyak 15 g/ polibag
T5= Trichoderma koningii dalam media beras sebanyak 25 g/ polibag
T6= Trichoderma koningii dalam media beras sebanyak 35 g/ polibag
T7= Trichoderma koningii dalam media dedak sebanyak 15 g/ polibag
T8= Trichoderma koningii dalam media dedak sebanyak 25 g/ polibag
T9= Trichoderma koningii dalam media dedak sebanyak 35 g/ polibag
Jumlah perlakuan = 10 perlakuan Jumlah ulangan = 3 ulangan Jumlah polibag per perlakuan = 5 polibag Jumlah tanaman per polibag = 1 tanaman Jumlah seluruh perlakuan = 30 perlakuan
Lampiran 3. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (10 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 4. Sidik ragam kejadian penyakit 10 msi
Lampiran 5. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (12 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 6. Sidik ragam kejadian penyakit 12 msi
Lampiran 7. Data pengamatan kejadian penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (14 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 8. Sidik ragam kejadian penyakit 14 msi
Lampiran 9. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (10 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 10. Sidik ragam intensitas penyakit 10 msi
Lampiran 11. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (12 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 12. Sidik ragam intensitas penyakit 12 msi
Lampiran 13. Data pengamatan intensitas penyakit (%) P. noxius pada pembibitan tanaman kakao di rumah kassa (14 msi)
Perlakuan Blok Total Rataan
I II III
Lampiran 14. Sidik ragam intensitas penyakit 14 msi
Lampiran 15. Data panjang akar pada pembibitan tanaman kakao di rumah kassa
Perlakuan Blok Total Rataan
I II III
Lampiran 16. Sidik ragam panjang akar
Lampiran 17. Data pengamatan analisis pH tanah
Perlakuan Blok Total Rataan
I II III
Lampiran 18. Sidik ragam pH tanah
Lampiran 19. Biakan murni Phellinus noxius pada media PDA
Lampiran 21. Gejala serangan pada bagian akar akibat jamur akar cokelat (skala 1)
Lampiran 22. Biakan murni Trichoderma koningii pada media PDA
Lampiran 23. Trichoderma koningii pada media;
a) jagung b) beras
c) dedak
Lampiran 25. Foto lahan penelitian