SINTESIS DAN KARAKTERISASI SERTA UJI PENDAHULUAN AKTIVITAS ANTIKANKER BEBERAPA SENYAWA
ORGANOTIMAH(IV) 3-NITROBENZOAT TERHADAP SEL LEUKEMIA L-1210
Oleh
SISKA DWI ARYANI
(Skripsi)
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRAK
SINTESIS DAN KARAKTERISASI SERTA UJI PENDAHULUAN AKTIVITAS ANTIKANKER BEBERAPA SENYAWA
ORGANOTIMAH(IV) 3-NITROBENZOAT TERHADAP SEL LEUKEMIA L-1210
Oleh Siska Dwi Aryani
Pada penelitian ini telah dilakukan sintesis senyawa dibutiltimah(IV) di-nitrobenzoat, difeniltimah(IV) di-di-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat dengan berat padatan putih masing-masing senyawa 87,10%, 84,06%, dan 83,64%, pada waktu refluks optimum empat jam. Hasil karakterisasi spektrofotometer IR menunjukkan adanya serapan C=O untuk senyawa tersebut berturut-turut adalah pada 1591,89 cm-1, 1705,36 cm-1, dan 1597,94 cm-1 yang
menandakan terdapatnya gugus karbonil yang berasal dari asam 3-nitrobenzoat.
Senyawa hasil sintesis berupa senyawa dibutiltimah(IV) di-3-nitrobenzoat, difeniltimah(IV) di-3-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat juga dikarakterisasi dengan spektrofotometer UV-Vis untuk melihat pergeseran panjang gelombangnya. Data mikroanalisis menggunakan microelemental analyzer menunjukkan bahwa senyawa hasil sintesis telah murni dengan perbedaan hasil mikroanalisis dengan perhitungan secara teori berkisar 1-5%. Pengujian antikanker menunjukkan nilai IC50 masing-masing senyawa hasil yaitu 20,59;
ABSTRACT
SYNTHESIS, CHARACTERIZATION, AND IN VITRO ANTICANCER ACTIVITY OF SOME ORGANOTIN(IV) 3-NITROBENZOAT
COMPOUNDS AGAINST LEUKEMIA CELL L-1210
By
Siska Dwi Aryani
In this research, the synthesis of dibutyltin(IV) di-3-nitrobenzoate, diphenyltin(IV) di-3-nitrobenzoate, and triphenyltin(IV) 3-nitrobenzoate were performed which produced the white solid of 87.10%, 84.06%, and 83.64%, respectively in the optimum reflux time of 4 hours. The result of IR spectrophotometer characterization showed that there were absorption of C=O for those compounds at 1591.89 cm-1, 1705.36 cm-1, and 1597.94 cm-1 which indicated that there was carbonil group from 3-nitrobenzoate acid.
The compounds synthesized as dibutyltin(IV) di-3-nitrobenzoate, diphenyltin(IV) di-3-nitrobenzoate, and triphenyltin(IV) 3-nitrobenzoate were also characterizated using UV-Vis spectrophotometer in order to see the shift of their wavelength. The microanalysis data using microelemental analyzer showed that the compound synthesized were quite pure with the difference of microanalysis result and the theoretically calculation was in the range of 1-5%. In vitro activity test showed that the IC50 value of each compound synthesized were 20.59; 9.29;
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 5
II. TINJAUAN PUSTAKA ... 6
A. Senyawa Organologam ... 6
B. Senyawa Organotimah ... 8
1. Senyawa organotimah halida ... 10
2. Senyawa organotimah hidroksida dan oksida ... 11
3. Senyawa organotimah karboksilat ... 12
C. Timah ... 12
D. Asam 3-nitrobenzoat ... 14
E. Aplikasi Senyawa Organotimah ... 14
F. Analisis Senyawa Organotimah ... 15
1. Analisis spektroskopi IR senyawa organotimah ... 15
2. Analisis spektroskopi UV-Vis senyawa organotimah ... 17
3. Analisis unsur dengan menggunakan microelemental analyzer ... 19
G. Analisis Probit ... 19
H. Aktivitas Kanker ... 20
1. Aktivitas senyawa organotimah(IV) 3-nitrobenzoat terhadap sel kanker ... 22
2. Pengujian aktivitas antikanker senyawa organotimah terhadap sel leukemia L-1210 ... 23
III. METODOLOGI PENELITIAN ... 25
A. Waktu dan Tempat Penelitian ... 25
B. Alat dan Bahan ... 25
C. Metode Penelitian... 26
1. Sintesis senyawa dibutiltimah(IV) oksida ... 26
3. Sintesis senyawa difeniltimah(IV) dihidroksida... 27
4. Sintesis senyawa difeniltimah(IV) di-3-nitrobenzoat ... 28
5. Sintesis senyawa trifeniltimah(IV) hidroksida ... 28
6. Sintesis senyawa trifeniltimah(IV) 3-nitrobenzoat ... 29
7. Pengujian aktivitas antikanker terhadap sel leukemia L-1210 ... 29
IV. HASIL DAN PEMBAHASAN ... 33
A. Sintesis ... 33
1. Sintesis senyawa dibutiltimah(IV) oksida ... 33
2. Sintesis senyawa dibutiltimah(IV) di-3-nitrobenzoat ... 34
3. Sintesis senyawa difeniltimah(IV) dihidroksida ... 35
4. Sintesis senyawa difeniltimah(IV) di-3-nitrobenzoat ... 36
5. Sintesis senyawa trifeniltimah(IV) hidroksida ... 37
6. Sintesis senyawa trifeniltimah(IV) 3-nitrobenzoat ... 38
B. Karakterisasi Menggunakan Spektrofotometer IR ... 40
1. Asam 3-nitrobenzoat ... 40
2. Senyawa dibutiltimah(IV) oksida dan dibutiltimah(IV) di-3-nitrobenzoat ... 41
3. Senyawa difeniltimah(IV) dihidroksida dan difeniltimah(IV) di-3-nitrobenzoat ... 42
4. Senyawa trifeniltimah(IV) dihidroksida dan trifeniltimah(IV) 3-nitrobenzoat... 44
C. Karakterisasi Menggunakan Spektrofotometer UV-Vis ... 46
1. Senyawa asam 3-nitrobenzoat ... 46
2. Senyawa dibutiltimah(IV) oksida dan dibutiltimah(IV) di-3-nitrobenzoat ... 47
3. Senyawa difeniltimah(IV) dihidroksida dan difeniltimah(IV) di-3-nitrobenzoat ... 48
4. Senyawa trifeniltimah(IV) hidroksida dan trifeniltimah(IV) 3-nitrobenzoat... 50
D. Analisis Unsur Menggunakan Microelemental Analyzer ... 52
E. Uji Aktivitas Antikanker Terhadap Sel Leukemia L-1210 ... 52
V... SIMPULAN DAN SARAN ... 59
A.Simpulan ... 59
B.Saran ... 60
DAFTAR PUSTAKA ... 61
I. PENDAHULUAN
A. Latar Belakang
Kanker merupakan penyebab kematian paling banyak kedua setelah serangan jantung (American Cancer Society, 2010). Jumlah penderita kanker di dunia setiap tahun bertambah 6,25 juta jiwa, dua pertiga dari penderita kanker di dunia berada di negara-negara yang sedang berkembang termasuk Indonesia (Padmi, 2001). Menurut GLOBOCAN, dengan jumlah penduduk 230 juta, terdapat kasus penyakit kanker sebanyak 292.600 pada tahun 2008 (GLOBOCAN, 2010). GLOBOCAN merupakan agensi internasional yang mengadakan penelitian mengenai jumlah rata-rata penderita kanker di seluruh dunia pada tahun 2008.
Kanker adalah suatu penyakit yang disebabkan oleh pertumbuhan jaringan yang tidak normal akibat hilangnya mekanisme kontrol sel. Ada beberapa faktor yang menyebabkan hilangnya mekanisme kontrol tersebut, antara lain virus dan beberapa proses fisika dan kimia termasuk reaksi radikal bebas. Akibat adanya serangan dari faktor-faktor tersebut, suatu sel normal dapat mengalami
Pengobatan yang umum dilakukan pada penyakit kanker antara lain dengan pembedahan, kemoterapi, dan radioterapi (Apantaku, 2002). Namun, terapi kanker secara pembedahan tidak dapat dilakukan khususnya pada sel kanker yang telah menyebar, sementara pengobatan kemoterapi dan radiasi dapat menimbulkan efek samping meskipun pengobatan kemoterapi mampu mengeluarkan
keseluruhan kanker (Hawariah, 1998). Oleh karena itu, usaha pencarian agen dengan efek samping minimum sangat diperlukan dalam pengobatan penyakit kanker, salah satunya yaitu dengan menggunakan senyawa organotimah.
Senyawa organotimah merupakan senyawa dimana atom-atom karbon dari gugus organik terikat pada logam timah. Senyawa organotimah dapat berbentuk mono, di, tri, dan tetraorganotimah bergantung pada gugus alkil (R) atau aril (Ar) yang terikat pada Sn. Anion yang terikat (X) biasanya berupa klorida, oksida,
hidroksida, merkaptoester, suatu karboksilat, atau suatu thiolat (Pellerito and Nagy, 2002). Senyawa organotimah(IV) merupakan senyawa yang dikenal memiliki berbagai aktivitas biologis. Kereaktifan biologis dari senyawa organotimah(IV) ditentukan oleh jumlah dasar dari gugus organik yang terikat pada atom pusat Sn. Anion yang terikat dalam senyawa organotimah(IV)
walaupun hanya sebagai penentu sekunder kereaktifan senyawa organotimah(IV), namun berperan penting dan dapat meningkatkan kereaktifan dalam berbagai uji biologis (Pellerito and Nagy, 2002; Szorcsik et al., 2002). Senyawa
Diantara berbagai kompleks organotimah dengan molekul biologi, kompleks organotimah karboksilat mendapat perhatian khusus karena senyawa ini memiliki aktivitas biologis yang lebih kuat dibandingkan dengan kompleks organotimah lainnya. Senyawa organotimah(IV) karboksilat dipilih dalam penelitian ini berdasarkan aktivitas biologisnya sebagai antikanker dengan asam 3-nitrobenzoat sebagai ligannya. Penelitian sebelumnya (Aini, 2010) dilaporkan aktivitas
antikanker senyawa organotimah(IV) salisilat dengan asam salisilat sebagai ligannya diperoleh nilai IC50 3,86 µg/mL. Pada penelitian selanjutnya (Sari,
2011) aktivitas antikanker senyawa organotimah(IV) benzoat diperoleh nilai IC50
5,32 µg/mL dan pada penelitian lain (Sulistriani, 2012) aktivitas antikanker senyawa organotimah(IV) 3-hidroksibenzoat diperoleh nilai IC50 3,10 µg/mL.
Jika nilai IC50dari senyawa ini ≤ 50 µg/mL, maka senyawa organotimah(IV) 3
-nitrobenzoat berpotensi sebagai antikanker (Mans et al., 2000). Oleh sebab itu, pada penelitian ini diharapkan IC50 yang diperoleh dapat lebih kecil dari
penelitian sebelumnya.
dan memiliki tingkat pertumbuhan 100%. Jika suatu zat toksik terhadap sel leukemia L-1210, maka umumnya juga bersifat toksik terhadap sel-sel abnormal lainnya (Bulan dkk., 2004). Setelah diketahui data aktivitas awalnya, maka untuk penelitian selanjutnya akan lebih mudah pengembangannya sebagai new metal-based drugs yang berguna dalam bidang farmasi dan kedokteran.
B. Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut:
1. Mensintesis senyawa dibutiltimah(IV) 3-nitrobenzoat, difeniltimah(IV) di-3-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat.
2. Mengkarakterisasi senyawa awal dibutiltimah(IV) diklorida, difeniltimah(IV) diklorida, dan trifeniltimah(IV) klorida serta senyawa hasil sintesis
dibutiltimah(IV) di-3-nitrobenzoat, difeniltimah(IV) di-3-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat, dengan rendemen tertinggi dari variasi waktu refluks menggunakan spektrofotometer UV-Vis, spektrofotometer IR, dan microelemental analyzer (tidak termasuk asam 3-nitrobenzoat).
3. Menguji dan membandingkan aktivitas antikanker dari senyawa
C. Manfaat Penelitian
II. TINJAUAN PUSTAKA
A. Senyawa Organologam
Senyawa organologam merupakan senyawa dimana minimal terdapat satu atom karbon dari gugus organik yang berikatan langsung dengan logam. Istilah organologam biasanya didefinisikan agak longgar, dan senyawa yang
mengandung ikatan karbon dengan fosfor, arsen, silikon, ataupun boron termasuk dalam katagori ini. Tetapi untuk senyawa yang mengandung ikatan antara atom logam dengan oksigen, belerang, nitrogen, ataupun dengan suatu halogen tidak termasuk sebagai senyawa organologam. Sebagai contoh suatu alkoksida seperti (C3H7O4)Ti tidaklah termasuk senyawa organologam, karena gugus organiknya
terikat pada Ti melalui atom oksigen. Sedangkan senyawa (C6H5)Ti(OC3H7)3
adalah senyawa organologam karena terdapat satu ikatan langsung antara karbon C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa
organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
a. Senyawaan ionik dari logam elektropositif
Senyawaan organo dari logam yang relatif sangat elektropositif umumnya bersifat ionik, tidak larut dalam pelarut organik, dan sangat reaktif terhadap udara dan air. Senyawa ini terbentuk bila suatu radikal pada logam terikat pada logam dengan keelektropositifan yang sangat tinggi, misalnya logam alkali atau alkali tanah. Kestabilan dan kereaktifan senyawaan ionik ditentukan dalam satu bagian oleh kestabilan ion karbon. Garam logam ion-ion karbon yang kestabilannya diperkuat oleh delokalisasi elektron lebih stabil walaupun masih relatif reaktif. Adapun contoh gugus organik dalam garam-garaman tersebut seperti (C6H5)3C-Na+ dan (C5H5)2Ca2+.
b. Seyawaan yang memiliki ikatan -σ (sigma)
Senyawaan organo dimana sisa organiknya terikat pada suatu atom logam dengan suatu ikatan yang digolongkan sebagai ikatan kovalen (walaupun masih ada karakter-karakter ionik dari senyawaan ini) yang dibentuk oleh kebanyakan logam dengan keelektropositifan yang relatif lebih rendah dari golongan
pertama di atas, dan sehubungan dengan beberapa faktor berikut:
1.Kemungkinan penggunaan orbital d yang lebih tinggi, seperti pada SiR4
yang tidak tampak dalam CR4.
2.Kemampuan donor alkil atau aril dengan pasangan elektron menyendiri. 3.Keasaman Lewis sehubungan dengan kulit valensi yang tidak penuh seperti
ada BR2 atau koordinasi tak jenuh seperti ZnR2.
c. Senyawaan yang terikat secara nonklasik
Dalam banyak senyawaan organologam terdapat suatu jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk ionik atau pasangan
elektron/kovalensi. Misalnya, salah satu kelas alkil terdiri dari Li, Be, dan Al yang memiliki gugus-gugus alkil berjembatan. Dalam hal ini, terdapat atom yang memiliki sifat kekurangan elektron seperti atom boron pada B(CH3)3.
Atom B termasuk atom golongan IIIA, dimana memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk konfigurasi oktet dalam senyawaannya. Ada kecenderungan untuk memanfaatkan orbital-orbital kosong pada atom B dengan menggabungkannya pada gugus suatu senyawa yang memiliki kelebihan pasangan elektron menyendiri. Senyawa ini terbagi menjadi dua golongan:
1. Senyawa organologam yang terbentuk antara logam-logam transisi dengan alkena, alkuna, benzena, dan senyawa organik tak jenuh lainnya.
2. Senyawa organologam yang memiliki gugus-gugus alkil berjembatan. (Cotton dan Wilkinson, 1989).
B. Senyawa Organotimah
Senyawa organotimah adalah senyawa organometalik yang disusun oleh satu atau lebih ikatan antara atom timah dengan atom karbon (Sn-C). Senyawa ini
umumnya adalah senyawa antropogenik, kecuali metiltin yang mungkin dihasilkan melalui biometilasi di lingkungan. Atom Sn dalam senyawa organotimah umumnya berada dalam tingkat oksidasi +4. Rumus struktur
aril (seperti: metil, butil, fenil, oktil), sedangkan X adalah spesies anionik (seperti: klorida, oksida, hidroksida, merkaptoester, karboksilat, dan sulfida).
Bertambahnya bilangan koordinasi bagi timah dimungkinkan terjadi, karena atomnya memiliki orbital d (Sudaryanto, 2001). Tetraorganotimah dan
triorganotimah klorida umumnya digunakan sebagai intermediet pada preparasi senyawaan organotimah lainnya. Tetrafeniltimah larut dalam pelarut organik dan tidak larut dalam air. Senyawaan organotimah cenderung memiliki karakter satu atau lebih ikatan kovalen antara timah dan karbon.
Dari sisi fisika dan kimia, senyawa organotimah merupakan monomer yang dapat membentuk makromolekul stabil, padat (metiltimah, feniltimah, dan dimetiltimah) dan cairan (butiltimah) yang sangat mudah menguap, menyublim, dan tidak berwarna serta stabil terhadap hidrolisis dan oksidasi. Atom halogen, khususnya klor yang dimiliki oleh senyawa organotimah mudah lepas dan berikatan dengan senyawa-senyawa yang mengandung atom dari golongan IA atau golongan IIA sistem periodik atau ion logam positif lainnya. Meskipun kekuatan ikatannya bervariasi, akan tetapi atas dasar sifat itulah senyawa-senyawa turunan
organotimah dapat disintesis (Grenwood and Earshaw, 1990).
Beberapa metode untuk sintesis senyawaan organotimah telah banyak dikenal. Starting material (material awal) seperti SnCl4 dan triorganotimah halida lazim
digunakan sebagai starting material untuk mensintesis berbagai senyawaan organotimah. Beberapa metode yang umum digunakan diantaranya:
ini memerlukan kondisi reaksi yang inert, jauh dari nyala api secara langsung, dan bersifat in situ.
4 RCl + 4 Mg 4 RMgCl
4 RMgCl + SnCl4 R4Sn + 4 MgCl4
b. Metode Wurst, persamaan reaksinya dituliskan sebagai berikut: 8 Na + 4 RCl 4 R-Na+ + 4 NaCl
4 R-Na+ + SnCl4 SnR4 + 4 NaCl
c. Metode dengan menggunakan reagen alkil aluminium, metode ini mulai dikenal pada awal tahun 1960-an. Adapun persamaan reaksinya dituliskan sebagai berikut:
4 R3Al + 3 SnCl4 3 R4Sn + 4 AlCl3
(Purnomo, 2008)
1. Senyawa organotimah halida
Senyawa organotimah halida dengan rumus umum RnSnX4-n (n = 1-3; X = Cl,
Br, I) pada umumnya merupakan padatan kristalin dan sangat reaktif.
Organotimah halida ini dapat disintesis secara langsung melalui logam timah, Sn(II) atau Sn(IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis langsung ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi:
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dangan timah(IV) klorida. Caranya dengan mengubah perbandingan material awal, seperti pada persamaan reaksi berikut:
SnR4
+ 3 SnCl4 4 RSnCl3
SnR4 + SnCl4 2 R2SnCl2
3 SnR4+ SnCl4 4 R3SnCl
Ketiga persamaan reaksi di atas merupakan reaksi redistribusi Kocheshkov. Reaksinya berlangsung dalam atmosfer bebas uap air. Yield yang diperoleh dengan metode di atas cukup tinggi.
Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut:
R4SnCl4-n + (4-n) MX R4SnX4-n + (4-n) MCl
(X = F, Br atau I; M = K, Na, NH4) (Cotton dan Wilkinson, 1989).
2. Senyawa organotimah hidroksida dan oksida
Produk kompleks yang diperoleh melalui hidrolisis dari trialkiltimah halida dan senyawa yang berikatan R3SnX merupakan rute utama pada trialkiltimah oksida
dan trialkiltimah hidroksida. Prinsip tahapan intermediet ditunjukkan pada reaksi berikut ini:
OH
R3SnX R2Sn XR2SnOSnR2X XR2SnOSnR2OH R2SnO
X atau
R3SnOH
3. Senyawa organotimah karboksilat
Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan asam karboksilat, dan dari organotimah halidanya dengan garam karboksilat. Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal.
Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksinya adalah sebagai berikut:
RnSnCl4-n + (4-n) MOCOR RnSn(OCOR)4-n + (4-n) MCl
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada reaksi berikut:
R2SnO + β R’COOH R2Sn(OCOR’)2 + H2O
R3SnOH + R’COOH R3SnOCOR’ + H2O
(Cotton dan Wilkinson, 1989).
C. Timah
dikarakterisasi ialah tetrahedral seperti CCl4. Pada suhu ruang, keduanya cairan
tidak berwarna dengan titik didih masing-masing 114°C dan 77°C (pada tekanan atmosfer). Di luar keadaan tersebut, keduanya menunjukkan karakter yang cukup berbeda. Perbedaan tersebut dapat dijelaskan karena ukuran atom Sn yang lebih besar dibandingkan atom C dan dimilikinya orbital 5d pada atom Sn. Kedua faktor tersebut, membuat Sn memungkinkan untuk “berikatan lebih” (ekstra koordinasi) dengan ligan-ligannya. Dalam hal tersebut, timah memiliki fleksibilitas valensi yang lebih besar, yaitu memiliki bilangan koordinasi yang dapat lebih dari empat (Purnomo, 2008).
Timah dalam bentuk senyawaannya memiliki tingkat oksidasi +2 dan +4, tingkat oksidasi +4 lebih stabil daripada +2. Pada tingkat oksidasi +4, timah
menggunakan seluruh elektron valensinya, yaitu 5s2 5p2 dalam ikatan, sedangkan pada tingkat oksidasi +2, timah hanya menggunakan elektron valensi 5p2 saja. Tetapi perbedaan energi antara kedua tingkat ini rendah (Cotton dan Wilkinson, 1989).
Timah atau Stannum (Sn) memiliki tiga bentuk alotrop, yaitu timah abu-abu (α), timah putih ( ) dan timah rombik ( ). Pada suhu ruang, timah lebih stabil sebagai
D. Asam 3-nitrobenzoat
Asam 3-nitrobenzoat memiliki rumus molekul C6H4(NO2)COOH dengan berat
molekul 167,12 gram/mol. Senyawa ini berbentuk padatan kristal kuning dengan
titik leleh 139C dan titik didih 341C. Struktur dari asam 3-nitrobenzoat dapat dilihat pada Gambar 1.
Gambar 1. Struktur asam 3-nitrobenzoat.
Asam 3-nitrobenzoat memiliki nilai pKa 3,47 dan 10 kali lebih asam daripada asam benzoat (Maki, 2002). Senyawa ini larut dalam air dan stabil dibawah kondisi dan temperatur ruang. Asam 3-nitrobenzoat banyak dimanfaatkan dalam zat pewarna, dalam ilmu kedokteran misalnya dalam preparasi obat-obatan, sebagai reagen, dan serbaguna dalam sintesis organik.
E. Aplikasi Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa
(Pellerito and Nagy, 2002). Senyawa organotimah yang umum digunakan sebagai katalis dalam sintesis kimia yaitu katalis mono- dan diorganotimah. Senyawa organotimah merupakan katalis yang bersifat homogen yang baik untuk pembuatan polisilikon, poliuretan, dan untuk sintesis poliester (Van der Weij, 1981).
Dalam beberapa penelitian, telah didapat dan diisolasi senyawa organotimah(IV) karboksilat yang menunjukkan sifat sebagai antimikroorganisme sehingga dapat berfungsi sebagai antifungi dan antimikroba (Bonire et al., 1998). Diketahui kompleks di- dan triorganotimah halida dengan berbagai ligan yang mengandung nitrogen, oksigen, dan sulfur memiliki aktivitas biologi dan farmakologi, serta digunakan sebagai fungisida dalam pertanian, bakterisida, dan agen antitumor (Jain et al., 2002).
F. Analisis Senyawa Organotimah
Pada penelitian yang dilakukan, hasil yang diperolah dianalisis dengan
menggunakan spektrofotometer IR, spektrofotometer UV-Vis, dan analisis unsur C dan H menggunakan alat microelemental analyzer.
1. Analisis spektroskopi IR senyawa organotimah
Pada spektroskopi IR, radiasi inframerah dengan rentang panjang gelombang dan intensitas tertentu dilewatkan terhadap sampel. Molekul-molekul senyawa pada sampel akan menyerap seluruh atau sebagian radiasi itu. Penyerapan ini
yang berikatan secara kovalen pada molekul-molekul itu. Penyerapan ini juga berhubungan dengan adanya perubahan momen dari ikatan kovalen pada waktu terjadinya vibrasi. Bila radiasi itu diserap sebagian atau seluruhnya, radiasi itu akan diteruskan. Detektor akan menangkap radiasi yang diteruskan itu dan mengukur intensitasnya (Supriyanto, 1999).
Spektra IR memberikan absorpsi yang bersifat aditif atau bisa juga sebaliknya. Sifat aditif disebabkan karena overtone dari vibrasi-vibrasinya. Penurunan absorpsi disebabkan karena kesimetrian molekul, sensitifitas alat, dan aturan seleksi. Aturan seleksi yang mempengaruhi intensitas serapan IR ialah perubahan momen dipol selama vibrasi yang dapat menyebabkan molekul menyerap radiasi IR. Dengan demikian, jenis ikatan yang berlainan (C-H, C-C, atau O-H)
menyerap radiasi IR pada panjang gelombang yang berlainan. Suatu ikatan dalam molekul dapat mengalami berbagai jenis getaran, oleh sebab itu suatu ikatan tertentu dapat menyerap energi lebih dari satu panjang gelombang. Puncak-puncak yang muncul pada daerah 4000-1450 cm-1biasanya berhubungan dengan energi untuk vibrasi uluran diatomik. Daerahnya dikenal dengan group frequency region (Sudjadi, 1985).
Secara umum, spektrum serapan IR dapat dibagi menjadi tiga daerah: a. Inframerah dekat, dengan bilangan gelombang antara 14.300 hingga
4.000 cm-1. Fenomena yang terjadi ialah absorpsi overtone C-H. b. Inframerah sedang, dengan bilangan gelombang antara 4.000 hingga
c. Inframerah jauh, dengan bilangan gelombang 650 hingga 200 cm-1. Fenomena
[image:24.595.119.505.229.599.2]yang terjadi ialah penyerapan oleh ligan atau spesi lainnya yang berenergi rendah.
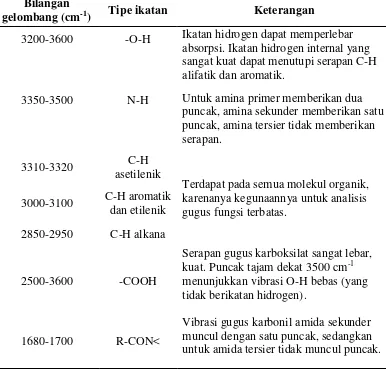
Tabel 1. Serapan inframerah gugus fungsional senyawa organik.
Bilangan
gelombang (cm-1) Tipe ikatan Keterangan
3200-3600 -O-H Ikatan hidrogen dapat memperlebar absorpsi. Ikatan hidrogen internal yang sangat kuat dapat menutupi serapan C-H alifatik dan aromatik.
3350-3500 N-H Untuk amina primer memberikan dua puncak, amina sekunder memberikan satu puncak, amina tersier tidak memberikan serapan.
3310-3320 asetilenik C-H
Terdapat pada semua molekul organik, karenanya kegunaannya untuk analisis gugus fungsi terbatas.
3000-3100 C-H aromatik dan etilenik 2850-2950 C-H alkana
2500-3600 -COOH
Serapan gugus karboksilat sangat lebar, kuat. Puncak tajam dekat 3500 cm-1 menunjukkan vibrasi O-H bebas (yang tidak berikatan hidrogen).
1680-1700 R-CON<
Vibrasi gugus karbonil amida sekunder muncul dengan satu puncak, sedangkan untuk amida tersier tidak muncul puncak. (Purnomo, 2008).
2. Analisis spektroskopi UV-Vis senyawa organotimah
atau pasangan elektron bebas dan orbital antiikatan. Panjang gelombang serapan merupakan ukuran perbedaan tingkat-tingkat energi dari orbital-orbital. Agar elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada 120-200 nm (1 nm = 10-7cm = 10 Å). Daerah ini dikenal sebagai daerah ultraviolet hampa, karena pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur.
Diatas 200 nm merupakan daerah eksitasi elektron dari orbital p, d, dan orbital π terutama sistem π terkonjugasi mudah pengukurannya dan spektrumnya
memberikan banyak keterangan. Kegunaan spektrofotometer UV-Vis ini terletak pada kemampuannya mengukur jumlah ikatan rangkap atau konjugasi aromatik di dalam suatu molekul. Spektrofotometer ini dapat secara umum membedakan diena terkonjugasi dari diena tak terkonjugasi, diena terkonjugasi dari triena dan sebagainya. Letak serapan dapat dipengaruhi oleh subtituen dan terutama yang berhubungan dengan subtituen yang menimbulkan pergeseran dalam diena terkonjugasi dari senyawa karbonil (Sudjadi, 1985).
karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam molekul (Day dan Underwood, 1998).
3. Analisis unsur dengan menggunakan microelemental analyzer
Mikroanalisis adalah penentuan kandungan unsur penyusun suatu senyawa yang dilakukan dengan menggunakan microelemental analyzer. Unsur yang umum ditentukan adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Sehingga alat yang biasanya digunakan untuk tujuan mikroanalisis ini dikenal sebagai CHNS microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, perbedaan biasanya antara 1–5%, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costecsh
Analytical Technologies, 2011).
Prinsip dasar dari microelemental analyzer yaitu sampel dibakar pada suhu tinggi. Produk yang dihasilkan dari pembakaran tersebut merupakan gas yang telah dimurnikan kemudian dipisahkan berdasarkan masing-masing komponen dan dianalisis dengan detektor yang sesuai. Pada dasarnya, sampel yang diketahui jenisnya dapat diperkirakan beratnya dengan menghitung setiap berat unsur yang diperlukan untuk mencapai nilai kalibrasi terendah atau tertinggi (Caprette, 2007).
G. Analisis Probit
majalah Science oleh Cester Ittner Bliss pada tahun 1934 yang digunakan untuk mengetahui efektivitas suatu pestisida dengan memplotkan kurva hubungan antara dosis dan respon pada berbagai konsenterasi dan diperoleh kurva berbentuk sigmoid (Bliss, 1934). Bliss mengembangkan ide untuk mengubah kurva sigmoid tersebut ke dalam persamaan garis lurus. Pada tahun 1952 seorang profesor statistik dari Edinburgh yang bernama David Finney menggunakan ide Bliss dan menulis buku yang berjudul Analisis Probit. Sampai saat ini analisis probit masih merupakan metode statistik yang banyak digunakan dalam memahami hubungan antara dosis dan respon (Cochran and David, 1979).
H. Aktivitas Kanker
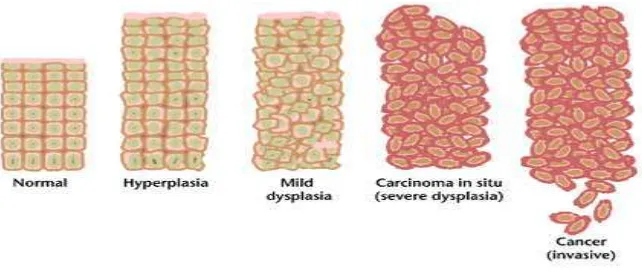
Gambar 2. Perkembangan sel normal menjadi sel kanker (Anand and Kunnumakkara, 2008).
Beberapa jenis virus tumor penting dapat dilihat pada Tabel 2. Beberapa tipe Adenovirus diketahui menyebabkan transformasi pada sel hewan tertentu. Virus Epstein-Barr telah mendapat perhatian besar karena berkaitan dengan penyakit limfoma Burkitt dan karsinoma nasofaring pada manusia. Virus hepatitis B merupakan agen etiologik utama pada kanker hati (Murray et al., 2003).
Tabel 2. Beberapa jenis virus tumor penting.
Kelompok Anggota
Virus DNA
Papovavirus Poliomavirus, virus SV40, virus papiloma manusia (misal, HPV-16)
Adenovirus Adenovirus 12, 18, dan 31 Herpesvirus Virus Epstein-Barr
Hepadnavirus Virus hepatitis B
Virus RNA
Retrovirus tipe C Virus leukemia dan virus sarkoma murin, virus leukemia dan sarkoma avian,
virus leukemia sel T manusia tipe I dan I Retrovirus tipe B Virus tumor mammae mencit I
Di dalam darah manusia terdapat leukosit (sel darah putih), yaitu komponen sel darah yang memiliki inti dan berperan untuk menahan invasi patogen (misalnya bakteri dan virus) melalui proses fagositosis, menghancurkan sel–sel abnormal, dan membersihkan debris dari sel yang mati atau cedera dengan cara memfagosit (Guyton and Hall, 1997). Jumlah leukosit dalam darah manusia normal berkisar antara 4.000-11.000 sel/mm3. Apabila di dalam darah jumlah leukosit lebih dari
11.000 sel/mm3 disebut leukositosis (menderita penyakit leukemia) dan bila kurang dari 4.000 sel/mm3 disebut leukopenia (Playfair and Chain, 2001).
Leukemia adalah penyakit keganasan pada jaringan hematopoietik yang ditandai dengan penggantian elemen sumsum tulang normal oleh sel darah abnormal atau sel leukemik. Hal ini disebabkan oleh proliferasi tidak terkontrol dari klon sel darah immatur yang berasal dari sel induk hematopoietik. Sel leukemik tersebut juga ditemukan dalam darah perifer dan sering menginvasi jaringan
retikuloendotelial seperti limpa, hati, dan kelenjar limfe (Wirawan, 2003).
1. Aktivitas senyawa organotimah(IV) 3-nitrobenzoat terhadap sel kanker
Reaksi senyawa organotimah(IV) 3-nitrobenzoat terhadap sel kanker dapat dianalogikan dengan reaksi antara cisplatin, cis-dichlorodiammineplatinum(II) terhadap sel kanker. Cisplatin telah digunakan secara luas sebagai obat
antikanker testikular, kanker ovarium, dan sel tumor lainnya (Bakalova, 2006). Senyawa organotimah(IV) 3-nitrobenzoat melalui atom timah (Sn) akan
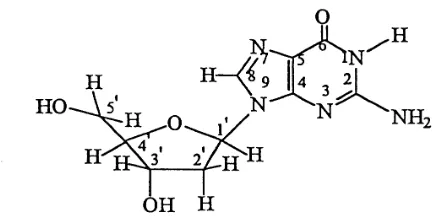
Gambar 3. Struktur nukleosida guanosin.
Gugus karboksilat dari ligan pada kompleks organotimah(IV) ini berperan untuk membantu menembus membran sel permeabel dan akan terputus ketika bereaksi sehingga atom pusat Sn dapat berikatan dengan basa-N7 guanosin. Untuk dapat berikatan, atom pusat Sn harus bermuatan positif. Makin banyak gugus alkil atau aril yang bersifat penarik elektron (yang terikat pada atom pusat Sn) maka makin efektif karena akan menyebabkan atom pusat Sn bermuatan lebih positif.
2. Pengujian aktivitas antikanker senyawa organotimah terhadap sel leukemia L-1210
L-1210. Sel tersebut dilarutkan dalam suatu larutan dan dialirkan ke dalam haemocytometer Neubauer improved. Jumlah sel yang masih hidup dihitung di bawah mikroskop. Sel hidup terlihat sebagai bulatan bening dengan bintik biru inti sel di tengah bulatan, sedangkan sel mati terlihat sebagai bercak biru pekat yang bentuknya tidak teratur. Sebagai ukuran aktivitas sitotoksik ditentukan nilai IC50 dari ekstrak kasar tersebut. Aktivitas isolat (kristal) dikatakan aktif sebagai
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan April sampai dengan Juni 2013 di
Laboratorium Kimia Anorganik FMIPA Universitas Lampung. Analisis senyawa menggunakan spektrofotometer UV-Vis dilakukan di Laboratorium Kimia
Anorganik FMIPA Universitas Lampung dan analisis senyawa menggunakan spektrofotometer IR dilakukan di Laboratorium Instrumentasi FMIPA Universitas Islam Indonesia. Analisis unsur dengan menggunakan microelemental analyzer dilakukan di School of Chemical and Food Technology, Universiti Kebangsaan Malaysia. Sedangkan uji aktivitas antikanker dilakukan di Laboratorium Kimia Bahan Alam, Pusat Aplikasi Teknologi Isotop dan Radiasi (PATIR) BATAN, Jakarta Selatan.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini yaitu, gelas ukur, erlenmeyer, gelas kimia, satu set alat refluks, hot plate stirrer, kertas saring Whatman No. 42, desikator, spektrofotometer IR (karakterisasi), spektrofotometer UV-Vis,
Fuch Rosental (0,200 mm x 0,0625 mm2) dan alat multi well plate tissue’s culture
(uji aktivitas antikanker).
Bahan-bahan yang digunakan dalam penelitian ini yaitu, dibutiltimah(IV) diklorida, difeniltimah(IV) diklorida, trifeniltimah(IV) klorida, NaOH, metanol p.a., akuabides, asam 3-nitrobenzoat, toluen, dan isolat sel leukemia L-1210 BATAN, Jakarta Selatan.
C. Metode Penelitian
Prosedur untuk sintesis masing-masing senyawa organotimah(IV) karboksilat pada penelitian ini diadopsi dari prosedur yang dilakukan oleh Szorscik et al. (2002); Hadi et al.(2008); Hadi et al. (2009); dan Hadi and Rilyanti (2010). Untuk proses rekristalisasi terhadap senyawa hasil sintesis diadopsi dari prosedur yang dilakukan oleh Bonire et al. (1998).
1. Sintesis senyawa dibutiltimah(IV) oksida [(C4H9)2SnO]
Dibutiltimah(IV) diklorida [(C4H9)2SnCl2] sebanyak 0,045 mol (13,68 gram)
sampai dihasilkan (C4H9)2SnO. Kristal (C4H9)2SnCl2 dan (C4H9)2SnO kemudian
dikarakterisasi dengan spektrofotometer IR dan spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), serta dianalisis kandungan unsur C dan H dengan alat microelemental analyzer.
2. Sintesis senyawa dibutiltimah(IV) di-3-nitrobenzoat [(C4H9)2Sn(m-OCOC6H4NO2)2]
Senyawa dibutiltimah(IV) oksida [(C4H9)2SnO] sebanyak 0,747 gram direaksikan
dengan asam 3-nitrobenzoat (m-C6H4NO2COOH) sebanyak 1,002 gram dengan
perbandingan mol 1:2 dalam 30 mL pelarut metanol p.a. dan direfluks dengan
variasi waktu 3, 4, 5, dan 6 jam dengan pemanas pada suhu 60C. Setelah reaksi
sempurna, metanol diuapkan dan dikeringkan di dalam desikator sampai diperoleh kristal kering. Kemudian direkristalisasi dengan pelarut toluen sebanyak 10 mL. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi menggunakan spektrofotometer IR, spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer serta diuji sifat antikankernya terhadap sel leukemia L-1210. Sebagai perbandingan, asam 3-nitrobenzoat juga dikarakterisasi dengan spektrofotometer IR dan
spektrofotometer UV-Vis.
3. Sintesis senyawa difeniltimah(IV) dihidroksida [(C6H5)2Sn(OH)2]
Difeniltimah(IV) diklorida [(C6H5)2SnCl2]sebanyak 0,045 mol (15,48 gram)
No. 42, lalu dicuci dengan akuabides dan metanol p.a., kemudian didiamkan dalam desikator sampai dihasilkan (C6H5)2Sn(OH)2. Kristal (C6H5)2SnCl2 dan
(C6H5)2Sn(OH)2 dikarakterisasi dengan spektrofotometer IR, spektrofotometer
UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer.
4. Sintesis senyawa difeniltimah(IV) di-3-nitrobenzoat [(C6H5)2Sn(m-OCOC6H4NO2)2]
Senyawa difeniltimah(IV) dihidroksida[(C6H5)2Sn(OH)2]sebanyak 0,921 gram
direaksikan dengan asam 3-nitrobenzoat (m-C6H4NO2COOH) sebanyak 1,002
gram dengan perbandingan mol 1:2 dalam 30 mL pelarut metanol p.a. dan
direfluks dengan variasi waktu 3, 4, 5 dan 6 jam dengan pemanas pada suhu 60oC. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam desikator sampai diperoleh kristal kering. Kemudian direkristalisasi dengan 10 mL pelarut toluen. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks siap untuk dikarakterisasi dengan spektrofotometer IR, spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer serta diuji sifat antikankernya terhadap sel leukemia L-1210.
5. Sintesis senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH]
Trifeniltimah(IV) klorida [(C6H5)3SnCl] sebanyak 0,045 mol (17,325 gram)
didiamkan dalam desikator sampai dihasilkan (C6H5)3SnOH. Kristal (C6H5)3SnCl
dan (C6H5)3SnOH dikarakterisasi dengan spektrofotometer IR, spektrofotometer
UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), dan dianalisis kandungan unsur C dan H dengan alat microelemental analyzer.
6. Sintesis senyawa trifeniltimah(IV) 3-nitrobenzoat [(C6H5)3Sn(m-OCOC6H4NO2)]
Senyawa trifeniltimah(IV) hidroksida [(C6H5)3SnOH] sebanyak 1,101 gram
direaksikan dengan asam 3-nitrobenzoat (m-C6H4NO2COOH) sebanyak 0,501
gram dengan perbandingan mol 1:1 dalam 30 mL pelarut metanol p.a. dan direfluks dengan variasi waktu 3, 4, 5, dan 6 jam dengan pemanas pada suhu
60C. Setelah reaksi sempurna, metanol diuapkan dan dikeringkan di dalam desikator sampai diperoleh kristal kering. Kemudian direkristalisasi dengan pelarut toluen sebanyak 10 mL. Kristal hasil senyawa dengan rendemen tertinggi dari variasi waktu refluks tersebut siap untuk dikarakterisasi dengan
spektrofotometer IR dan spektrofotometer UV-Vis yang diukur pada panjang gelombang 190-380 nm (Sudjadi, 1985), serta dianalisis kandungan unsur C dan H dengan alat microelemental analyzer serta diuji sifat antikankernya terhadap sel leukemia L-1210.
7. Pengujian aktivitas antikanker terhadap sel leukemia L-1210
1,3 gram NaHCO3 dilarutkan dalam 50 mL air steril (larutan B). Sebanyak 25 mL
larutan B ditambahkan ke dalam 475 mL larutan A, maka diperoleh 500 mL media (larutan C). Untuk keperluan uji, 15 mL calf bovine serum ditambahkan ke dalam 85 mL larutan C. Semua pekerjaan dilakukan di ruang steril. Sel leukemia L-1210 yang menjadi target uji aktivitas antikanker ini adalah sel leukimia yang diperoleh dari sel limfosit tikus putih betina jenis DBA (Dilute Brown Non-Agouti Mouse) yang berumur 8 bulan. Sel leukemia ini diperoleh dari The Institute of Physical and Chemical Research, Japan. Sel leukemia disuspensikan ke dalam media yang telah mengandung calf bovine serum sehingga jumlah sel sekitar 2 x 106 sel/mL.
Pengujian aktivitas dilakukan terhadap sampel uji yang dilarutkan dalam metanol. Pengujian aktivitas sitotoksik sampel uji dilakukan dengan 5 variasi dosis yaitu 1, 2, 4, 8, dan 16 µg/mL. Media yang telah mengandung suspensi sel leukemia L-1210 (2 x 106 sel/mL) dimasukkan ke dalam multi well plate tissue’s culture
sebanyak 1 mL dalam setiap sumuran. Sebagai kontrol digunakan 10 µL metanol yang telah ditambahkan 990 µL suspensi sel. Percobaan dilakukan triplo,
[image:37.595.169.399.599.722.2]selanjutnya suspensi sel yang telah diisi zat uji diinkubasi selama 48 jam pada suhu 37°C dalam inkubator 5% CO2.
Perhitungan sel dilakukan menggunakan haemocytometer Neubauer improved. Haemocytometer Neubauer improved merupakan alat yang digunakan untuk menghitung atau menentukan jumlah sel per satuan volume. Di dalam
haemocytometer terdapat sebuah ruang yang digunakan untuk menghitung sel tersebut (Caprette, 2007). Suspensi sel dimasukkan ke dalam ruang dan harus cukup encer, agar sel atau partikel lain tidak tumpang tindih satu sama lain di grid dan harus merata. Jumlah sel yang hidup digunakan untuk menentukan persentase inhibisi zat uji terhadap sel leukemia L-1210 tersebut.
Untuk membedakan antara sel hidup dengan sel mati maka sebelum dilakukan penghitungan, 90 µL suspensi dimasukkan ke dalam sero cluster plate (96 sumuran) dan ditambah 10 µL larutan 1% larutan tryphan blue dan
[image:38.595.152.429.462.599.2]dihomogenkan. Campuran sampel uji yang telah diwarnai tryphan blue sebanyak 10 µL larutan dialirkan ke dalam haemocytometer Neubauer improved.
Gambar 5. Haemocytometer Neubauer improved (Caprette, 2007).
Persentase penghambatan zat uji terhadap pertumbuhan sel leukemia L-1210 dihitung sebagai berikut:
A: jumlah sel hidup dalam media yang mengandung zat uji.
B: jumlah sel hidup dalam media yang tidak mengandung zat uji (kontrol).
Selanjutnya data persentase inhibisi diplotkan ke tabel probit untuk memperoleh nilai probit, kemudian dibuat grafik antara log konsentrasi (x) dan probit (y) sehingga diperoleh persamaan regresi linier y = a + bx. Selanjutnya memasukkan nilai y = 5 (probit dari 50%), maka diperoleh nilai x (log konsentrasi), nilai IC50
dengan mengkonversikan nilai log konsentrasi ke bentuk antilog. IC50 yaitu
V. SIMPULAN DAN SARAN
A. Simpulan
Dari penelitian yang telah dilakukan, diperoleh simpulan sebagai berikut : 1. Diperoleh produk padatan berwarna putih senyawa dibutiltimah(IV)
di-nitrobenzoat, difeniltimah(IV) di-di-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat dengan rendemen masing-masing 87,10%, 84,06%, dan 83,64% dengan waktu refluks optimum 4 jam.
2. Hasil karakterisasi dengan menggunakan spektrofotometer IR terdapat serapan C=O untuk senyawa dibutiltimah(IV) nitrobenzoat, difeniltimah(IV) di-3-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat berturut-turut adalah pada 1591,89 cm-1, 1705,36 cm-1, dan 1597,94 cm-1 yang menandakan bahwa dalam senyawa tersebut terdapat gugus karbonil yang berasal ligan dari asam 3-nitrobenzoat.
3. Hasil karakterisasi dengan menggunakan spektrofotometer UV-Vis terdapat transisi elektron ππ* dan nπ* untuk senyawa dibutiltimah(IV)
di-nitrobenzoat, difeniltimah(IV) di-nitrobenzoat dan trifeniltimah(IV) 3-nitrobenzoat masing-masing pada λmax 215,00 nm dan 258,00 nm; 216,00 nm
4. Berdasarkan data mikroanalisis dengan menggunakan microelemental analyzer menunjukkan bahwa senyawa hasil sintesis telah murni.
5. Berdasarkan data IC50 yang diperoleh senyawa dibutiltimah(IV)
di-3-nitrobenzoat lebih berpotensi sebagai obat antikanker dibandingkan dengan difeniltimah(IV) di-3-nitrobenzoat, dan trifeniltimah(IV) 3-nitrobenzoat.
B. Saran
DAFTAR PUSTAKA
Aini, N.Q. 2010. Sintesis dan Karakterisasi serta Uji Pendahuluan Aktivitas Antikanker Beberapa Senyawa Organotimah(IV) Salisilat terhadap Sel Leukemia L-1210. (Skripsi). Universitas Lampung. Bandar Lampung. 81 halaman.
American Cancer Society. 2010. Cancer Statistic 2010. American Cancer Society.
Anand, P. and A.B. Kunnumakkara. 2008. Canseris a Preventable Disease that Requires Major Lifestyle Changes. Pharm Research. 25 (9): 2097-2116. Apantaku, L.M. 2002. Breast-Conserving Surgery for Breast Cancer. American
Family Physician. 66 (12): 2271-2278.
Bakalova, A. 2006. Perspective Towards Development of Novel Non-Classical Anticancer Platinum(II) Complexes. Journal of the University of Chemistry Technology and Metallurgy. 41 (2): 119-124.
Bliss, C.I. 1934. The Method of Probits. Science. 79: (2038).
Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil, and A.A. Omachi. 1998. Synthesis and Antifungal Activity of Some Organotin(IV) Carboxylates. Metal-Based Drugs. 5 (4): 233-236.
Bulan, R., S. Soedigdo, S. Achmad, dan Buchari. 2004. Lantaden XR Glikosida
dari Daun Lantana camara L. Jurnal Matematika dan Sains. 9 (1): 209-213.
Caprette, D.R. 2007. Using a Caunting Chamber. Lab Guides. Rice University.
Cochran, W.G. and D.J. Finney. 1979. Chester Ittner Bliss, 1899-1979. Biometrics. 35 (4): 715-717.
Cotton, F.A. dan G. Wilkinson. 1989. Kimia Anorganik Dasar. Terjemahan oleh S. Suharto. UI Press. Jakarta.
Day, R.A. dan A.L. Underwood. 1998. Analisis Kimia Kuantitatif Edisi Keenam. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
Fessenden, R.J. and J.S. Fessenden. 1986. Kimia Organik Dasar Edisi Ketiga. Jilid 2. Terjemahan oleh A.H. Pudjaatmaka. Erlangga. Jakarta.
GLOBOCAN. 2010. Cancer Incedence and Mortality Worldwide in 2008. http://globocan.iarc.fc/. Diakses 10 Februari 2013.
Greenwood, N.N. and A. Earnshaw. 1990. Chemie der Elemente. Willey-VCH Verlags gesellschaft mbH. Weinheim.
Guyton, A.J. and Hall, J.E. 1997. Buku Ajar Fisiologi Kedokteran Edisi 9. EGC. Jakarta. 150-70.
Hadi, S., B. Irawan, and Efri. 2008. The Antifungal Activity Test of Some Organotin(IV) Carboxylates. Journal of Applied Sciences Research. 4 (11): 1521-1525.
Hadi, S., M. Rilyanti, and Nurhasanah. 2009. Comparative Study on the Antifungal Activity of Some Di and Tributyltin(IV) Carboxylate Compounds. Modern Applied Science. 3 (1): 12-17.
Hadi, S. and M. Rilyanti. 2010. Synthesis and In Vitro Anticancer Activity of Some Organotin(IV) Benzoate Compounds. Oriental Journal of Chemistry. 26 (3): 775-17.
Hawariah, A.L.P. 1998. Memahami Kanser. Universiti Putra Malaysia. Serdang.
Hoshino, A., A.M. Albrecht, J.L. Biedler and D.J. Hutchison. 1966.
Amethopterin Resistance in Clonal Lines of L1210 Mouse Leukemia: Some Associated Biologic and Biochemical Alterations. Cancer Research. 26: 1397-1407.
Jain, M.G., K. Agarwal, and R.V. Singh. 2003. Studies on Nematicidal, Fungicidal and Bacterial Activities of Organotin(IV) Complexes with Heterocyclic Sulphonamide Azomethine. Chemistry: An Indian Journal. 1: 378-391.
Maki, T and K. Takeda. 2002. Benzoic Acid and Derivatives in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. Weinheim.
Mans, D.R.A., da Rocha, A.B., and Schwartsmann, G. 2000. Anti-Cancer Drug Discovery and Development in Brazil: Targeted Plant Collction As a Rational Strategy to Acquire Candidate Anti-cancer Compounds. The Oncologist. 5 (3): 185-198.
Murray, K.R., D.A. Granner, P.A. Mayes, and V.W. Rodwell. 2003. Biokimia Harper. Penerbit Buku Kedokteran, EGC: Mc Graw Hill. Jakarta. Nafriadi dan G. Sulastia. 2007. Farmakologi dan Terapi. Gaya Baru. Jakarta.
National Institute of Health. 2006. Regenerative Medicine.
http://stemcells.nih.gov/info/2006report/. Diakses pada 13 Februari 2013. Padmi, T.H. 2001. Mapping Kanker di Semarang dan Sekitarnya. Media
Medika Indonesia. Vol 36 no 2.
Pellerito, L. and L. Nagy. 2002. Organotin (IV)n+ Complexes Formed with Biologically Active Ligands: Equilibrium and Structural Studies and Some Biological Aspect. Coordination Chemistry Review. 224: 111–50.
Petra, E.D.L. 2012. Ikatan yang terlibat pada interaksi obat reseptor. http//www.ocw.usu.ac.id/…/fek 310
slide_ikatan_yang_terlibat_pada_interaksi. Diakses pada 10 Februari 2013. Petruci, R.H. 1999. Kimia Dasar, Prinsip dan Terapan Modern. Erlangga.
Jakarta.
Playfair, J.H.L. and Chain, B.M. 2001. Immunology at a Glance Seventh edition. Blackwell Publishing Company. London: 8-63.
Purcell, K.F. and F. Keith. 1980. An Introduction To Inorgnic Chemistry. Souders collage. Philadelphia.
Purnomo, W.F. 2008. Sintesis dan Karakterisasi Senyawa Organotimah(IV) Karboksilat: Trimetiltimah N-maleoilglisinat. (Skripsi). Universitas Indonesia. Depok. 66 halaman.
Sari, M.D.F. 2011. Sintesis dan Karakterisasi serta Uji Pendahuluan Aktivitas Antikanker Senyawa Organotimah(IV) Benzoat terhadap Sel Leukemia L-1210. (Skripsi). Universitas Lampung. Bandar Lampung. 102 halaman. Sudaryanto, A. 2001. Pencemaran Laut oleh Senyawa Organotin. JTL. 2:3,
Sudjadi. 1985. Penentuan Struktur Senyawa Organik. Ghalia Indonesia. Jakarta.
Sukarjo. 1992. Kimia Koordinasi. P.T. Bina Aksara. Jakarta.
Sulistriani, A. 2012. Sintesis dan Karakterisasi serta Uji Pendahuluan Aktivitas Antikanker Senyawa Organotimah(IV) 3-hidroksibenzoat terhadap Sel Leukemia L-1210. (Skripsi). Universitas Lampung. Bandar Lampung. 109 halaman.
Supriyanto, R. 1999. Buku Ajar Kimia Analitik III. Universitas Lampung. Bandar Lampung.
Syarif, A. 1995. Farmakologi dan Terapi. Bagian Farmakologi Fakultas Kedokteran Universitas lndonesia edisi-4. Jakarta.
Szorcsik, A., L. Nagy, L. Pellerito, T. Yamaguchi, and K. Yoshida. 2002. Preparation and Structural Studies of Organotin(IV) Complexes Formed with Organic Carboxylic Acids. Journal Radioanalytical and Nuclear Chemistry. 256 (1): 3-10.
Van Der Weij, F.W. 1981. Kinetics and Mechanism of Urethane Formation Catalysed by Organotin Compound. Journal Science Polymer Chemistry. 19 (2): 381-388.