PENGARUH KENAIKAN CO2 TERHADAP KADAR
TRIMETILAMINA (TMA) DAN PERUBAHAN
KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES
DESTILASI PADA PEMURNIAN
METANOL DI PT KALTIM
METHANOL INDUSTRI
BONTANG
KARYA ILMIAH
IKHSAN RAMADHAN
102401041
PROGRAM STUDI DIPLOMA 3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH KENAIKAN CO2 TERHADAP KADAR
TRIMETILAMINA (TMA) DAN PERUBAHAN
KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES
DESTILASI PADA PEMURNIAN
METANOL DI PT KALTIM
METHANOL INDUSTRI
BONTANG
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh Ahli Madya
IKHSAN RAMADHAN
NIM : 102401041
PROGRAM STUDI DIPLOMA 3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Pengaruh Kenaikan Co2 Terhadap Kadar
Trimetilamina (TMA) Dan Perubaahan Kandungan Tma Setelah Memasuki TMA Catchpot Dalam Proses Destilasi Pada Pemurnian Metanol Di PT Kaltim Methanol Industri
Kategori : Karya Ilmiah Nama : Ikhsan Ramadhan Nomor Induk Mahasiswa : 102401041
Program Studi : Diploma III (D3) Kimia Industri Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan
Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Juli 2013
Diketahui
Program Studi D III Kimia Industri Dosen Pembimbing
Ketua
Dra. Emma Zaidar Nst, MSi Helmina Br Sembiring, S.Si. MSi NIP.195512181987012001 NIP.19762022000122002
Diketahui/disetujui oleh
Departemen Kimia FMIPA USU
Ketua
PERNYATAAN
PENGARUH KENAIKAN CO2 TERHADAP KADAR TRIMETILAMINA (TMA) DAN PERUBAHAN KANDUNGAN TMA SETELAH
MEMASUKI TMA CATCHPOT DALAM PROSES DESTILASI PADA PEMURNIAN METANOL
DI PT KALTIM METHANOL INDUSTRI BONTANG
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, 15 Juli 2013
IKHSAN RAMADHAN
PENGHARGAAN
Bismillaahhirrohmaanirrohiim.
Alhamdulillaahi Robbil aalamiin Penulis ucapkan sebagai suatu ungkapan rasa syukur kepada Allah SWT yang Maha Esa atas kuasanya yang tetap mencurahkan berkah, rahmat, nikmat kesehatan jasmani dan rohani, serta taufiq dan hidayahnya sehingga Penulis dapat menjalani hidup dengan penuh makna dan insyaallah akan lebih bermakna lagi. Shalawat dan salam Penulis hantarkan kepada Nabi Muhammad SAW yang telah mengemban risalah dan mengalirkan nilai-nilai islam dalam rangkaian tarbiah kepada seluruh umat. Alhamdulillah tidak habisnya Penulis ucapkan rasa syukur, Atas ridho Allah SWT Penlis dapat menyelesaikan Karya Ilmiah ini sebagai salah satu syarat untuk meraih gelar Ahli Madya (AMD) pada program studi Kimia Industri Diploma III di Fakultas Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara.
Karya Ilmiah ini ditulis berdasarkan pengamatan dan pengalaman Penulis selama menjalani Praktek Kerja Lapangan (PKL) di PT. Kaltim Methanol Industri dari tangal 11 Februari sampai dengan 1 Maret 2013. Penulis menyadari sepenuhnya bahwa KARYA ILMIAH ini masih jauh dari kesempurnaan karena adanya keterbatasan pada Penulis, baik dari segi pengetahuan, waktu, maupun keterbatasan penulis. Meski demikian Penulis mengharapkan karya ilmiah ini dapat bermanfaat bagi Penulis dan semua pihak yang telah membaca karya ilmiah ini serta dapat bermanfaat bagi Universitas Sumatera Utara.
Pada masa penyelesaian karya ilmiah ini, Penulis telah banyak mendapatkan dukungan, bantuan dan juga dari berbagai pihak-pihak yang terlibat. Oleh karena itu, dengan rasa keikhlasan dan kerendahan hati penulis ingin menyampaikan rasa terima kasih dan penghargaan kepada :
1. Keluarga tercinta, Ayahanda Irwanto Syam, SE dan Ibunda Desi Heldia, adinda Miranti serta kakanda Ira Utari Handayani yang selalu memberikan kasih sayang dan mendo’akan yang terbaik untuk Penulis serta bantuan berupa moril dan materil, tanpa mereka penulis bukanlah apa-apa.
2. Helmina Sembiring, S.Si., M.Si. selaku dosen pembimbing yang dengan sabar membimbing dan meluangkan waktunya kepada penulis dalam penyusunan Karya Ilmiah ini.
4. Dr. Rumondang Bulan, M.S, selaku ketua Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. 5. Dra. Emma Zaidar, M.Sc, selaku ketua Program Studi D-III Kimia Industri
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
6. Seluruh staf pengajar Fakultas Matematika dan Ilmu Pengetahuan Alam Khususnya jurusan Kimia yang telah mendidik penulis dalam menyelesaikan karya ilmiah ini.
7. Wali laki-laki saya dr. Yazid Wastam Dimyati, SpA K dan Wali perempuan dr. Nuraisani
8. Mas Dedy Ehsanuddin ST selaku Pembimbing saya selama melakukan kerja praktek di PT. Kaltim Methanol Industri.
Penulis sudah berupaya semaksimal mungkin dalam menyusun dan menyelesaika karya ilmiah ini, namun penulis mengharapkan kritik dan saran yang bersifat membangun dari pembaca.
Akhir kata penulis mengucapkan Terima Kasih kepada semua pihak yang telah banyak membantu demi selesainya karya ilmiah ini dan penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Medan, Juli 2013
Penulis,
PENGARUH KENAIKAN CO2 TERHADAP KADAR TRIMETILAMINA
(TMA) DAN PERUBAHAN KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES DESTILASI PADA PEMURNIAN
METANOL DI PT. KALTIM METHANOL INDUSTRI BONTANG
ABSTRAK
Telah dilakukaan percobaan mengenai pengaruh kenaikan CO2 terhadap kadar trimetilamina (TMA) dan perubahan kandungan TMA setelah memasuki TMA catchpot dalam proses destilasi pada pemurnian metanol. Dari percobaan diperoleh kadar CO2 sebesar 8.68, 10.03, 9.89, 9.56, dan 9.77 pada raw methanol dan juga diperoleh kadar TMA didalam raw methanol sebelum memasuki TMA catchpot adalah sebesar 118.76, 202.27, 195.45, 122.72, 133.63, dan kadar TMA setelah memasuki TMA catchpot adalah sebesar 2.237, 2.289, 2.57, 2,311, dan 2.156. Dari percobaan tersebut terlihat bahwa semakin besar kadar CO2 dalam
EFFECT ON LEVELS INCREASE CO2 TRIMETHYLAMINE (TMA)
TMA CONTENT AND CHANGES AFTER ENTERING THE TMA CATCHPOT DISTILLATION PROCESS PURIFICATION OF
METHANOL IN PT. KALTIM METHANOL INDUSTRY BONTANG
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Bab 1. Pendahuluan
1.1. Latar Belakang 1
1.2. Perumusan Masalah 2
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka
2.1. Gas Alam 4
2.1.1. Komposisi Kimia 7
2.2. Metanol 7
2.2.1. Pembuatan Metanol 9
2.2.2. Kualitas Metanol 14
2.2.3. Aplikasi Metanol 14
2.3. Destilasi 17
2.3.1. Spesifikasi Produk 20
2.4. Karbon Dioksida 21
2.5. Trimetilamin 22
2.5.2. Reaksi Pembentukan Trimetilamin 23
Bab 3. Bahan Dan Metode
3.1. Alat- Alat 25
3.2. Bahan- Bahan 25
3.3. Prosedur Percobaan 25
Bab 4. Hasil dan Pembahasan
4.1. Hasil dan Pembahasan 26
4.1.1. Hasil Percobaan 26
4.2. Pembahasan 27
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 29
5.2. Saran 29
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Kandungan CO2 Dalam Raw Methanol dan TMA dalam 26
PENGARUH KENAIKAN CO2 TERHADAP KADAR
TRIMETILAMINA (TMA) DAN PERUBAHAN
KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES
DESTILASI PADA PEMURNIAN
METANOL DI PT KALTIM
METHANOL INDUSTRI
BONTANG
KARYA ILMIAH
IKHSAN RAMADHAN
102401041
PROGRAM STUDI DIPLOMA 3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH KENAIKAN CO2 TERHADAP KADAR
TRIMETILAMINA (TMA) DAN PERUBAHAN
KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES
DESTILASI PADA PEMURNIAN
METANOL DI PT KALTIM
METHANOL INDUSTRI
BONTANG
KARYA ILMIAH
Diajukan untuk melengkapi tugas dan memenuhi syarat memperoleh Ahli Madya
IKHSAN RAMADHAN
NIM : 102401041
PROGRAM STUDI DIPLOMA 3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERSETUJUAN
Judul : Pengaruh Kenaikan Co2 Terhadap Kadar
Trimetilamina (TMA) Dan Perubaahan Kandungan Tma Setelah Memasuki TMA Catchpot Dalam Proses Destilasi Pada Pemurnian Metanol Di PT Kaltim Methanol Industri
Kategori : Karya Ilmiah Nama : Ikhsan Ramadhan Nomor Induk Mahasiswa : 102401041
Program Studi : Diploma III (D3) Kimia Industri Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan
Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Juli 2013
Diketahui
Program Studi D III Kimia Industri Dosen Pembimbing
Ketua
Dra. Emma Zaidar Nst, MSi Helmina Br Sembiring, S.Si. MSi NIP.195512181987012001 NIP.19762022000122002
Diketahui/disetujui oleh
Departemen Kimia FMIPA USU
Ketua
PERNYATAAN
PENGARUH KENAIKAN CO2 TERHADAP KADAR TRIMETILAMINA (TMA) DAN PERUBAHAN KANDUNGAN TMA SETELAH
MEMASUKI TMA CATCHPOT DALAM PROSES DESTILASI PADA PEMURNIAN METANOL
DI PT KALTIM METHANOL INDUSTRI BONTANG
KARYA ILMIAH
Saya mengakui bahwa karya ilmiah ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, 15 Juli 2013
IKHSAN RAMADHAN
PENGHARGAAN
Bismillaahhirrohmaanirrohiim.
Alhamdulillaahi Robbil aalamiin Penulis ucapkan sebagai suatu ungkapan rasa syukur kepada Allah SWT yang Maha Esa atas kuasanya yang tetap mencurahkan berkah, rahmat, nikmat kesehatan jasmani dan rohani, serta taufiq dan hidayahnya sehingga Penulis dapat menjalani hidup dengan penuh makna dan insyaallah akan lebih bermakna lagi. Shalawat dan salam Penulis hantarkan kepada Nabi Muhammad SAW yang telah mengemban risalah dan mengalirkan nilai-nilai islam dalam rangkaian tarbiah kepada seluruh umat. Alhamdulillah tidak habisnya Penulis ucapkan rasa syukur, Atas ridho Allah SWT Penlis dapat menyelesaikan Karya Ilmiah ini sebagai salah satu syarat untuk meraih gelar Ahli Madya (AMD) pada program studi Kimia Industri Diploma III di Fakultas Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara.
Karya Ilmiah ini ditulis berdasarkan pengamatan dan pengalaman Penulis selama menjalani Praktek Kerja Lapangan (PKL) di PT. Kaltim Methanol Industri dari tangal 11 Februari sampai dengan 1 Maret 2013. Penulis menyadari sepenuhnya bahwa KARYA ILMIAH ini masih jauh dari kesempurnaan karena adanya keterbatasan pada Penulis, baik dari segi pengetahuan, waktu, maupun keterbatasan penulis. Meski demikian Penulis mengharapkan karya ilmiah ini dapat bermanfaat bagi Penulis dan semua pihak yang telah membaca karya ilmiah ini serta dapat bermanfaat bagi Universitas Sumatera Utara.
Pada masa penyelesaian karya ilmiah ini, Penulis telah banyak mendapatkan dukungan, bantuan dan juga dari berbagai pihak-pihak yang terlibat. Oleh karena itu, dengan rasa keikhlasan dan kerendahan hati penulis ingin menyampaikan rasa terima kasih dan penghargaan kepada :
1. Keluarga tercinta, Ayahanda Irwanto Syam, SE dan Ibunda Desi Heldia, adinda Miranti serta kakanda Ira Utari Handayani yang selalu memberikan kasih sayang dan mendo’akan yang terbaik untuk Penulis serta bantuan berupa moril dan materil, tanpa mereka penulis bukanlah apa-apa.
2. Helmina Sembiring, S.Si., M.Si. selaku dosen pembimbing yang dengan sabar membimbing dan meluangkan waktunya kepada penulis dalam penyusunan Karya Ilmiah ini.
4. Dr. Rumondang Bulan, M.S, selaku ketua Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara. 5. Dra. Emma Zaidar, M.Sc, selaku ketua Program Studi D-III Kimia Industri
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara.
6. Seluruh staf pengajar Fakultas Matematika dan Ilmu Pengetahuan Alam Khususnya jurusan Kimia yang telah mendidik penulis dalam menyelesaikan karya ilmiah ini.
7. Wali laki-laki saya dr. Yazid Wastam Dimyati, SpA K dan Wali perempuan dr. Nuraisani
8. Mas Dedy Ehsanuddin ST selaku Pembimbing saya selama melakukan kerja praktek di PT. Kaltim Methanol Industri.
Penulis sudah berupaya semaksimal mungkin dalam menyusun dan menyelesaika karya ilmiah ini, namun penulis mengharapkan kritik dan saran yang bersifat membangun dari pembaca.
Akhir kata penulis mengucapkan Terima Kasih kepada semua pihak yang telah banyak membantu demi selesainya karya ilmiah ini dan penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Medan, Juli 2013
Penulis,
PENGARUH KENAIKAN CO2 TERHADAP KADAR TRIMETILAMINA
(TMA) DAN PERUBAHAN KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES DESTILASI PADA PEMURNIAN
METANOL DI PT. KALTIM METHANOL INDUSTRI BONTANG
ABSTRAK
Telah dilakukaan percobaan mengenai pengaruh kenaikan CO2 terhadap kadar trimetilamina (TMA) dan perubahan kandungan TMA setelah memasuki TMA catchpot dalam proses destilasi pada pemurnian metanol. Dari percobaan diperoleh kadar CO2 sebesar 8.68, 10.03, 9.89, 9.56, dan 9.77 pada raw methanol dan juga diperoleh kadar TMA didalam raw methanol sebelum memasuki TMA catchpot adalah sebesar 118.76, 202.27, 195.45, 122.72, 133.63, dan kadar TMA setelah memasuki TMA catchpot adalah sebesar 2.237, 2.289, 2.57, 2,311, dan 2.156. Dari percobaan tersebut terlihat bahwa semakin besar kadar CO2 dalam
EFFECT ON LEVELS INCREASE CO2 TRIMETHYLAMINE (TMA)
TMA CONTENT AND CHANGES AFTER ENTERING THE TMA CATCHPOT DISTILLATION PROCESS PURIFICATION OF
METHANOL IN PT. KALTIM METHANOL INDUSTRY BONTANG
ABSTRACT
DAFTAR ISI
Halaman
Persetujuan i
Pernyataan ii
Penghargaan iii
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel ix
Bab 1. Pendahuluan
1.1. Latar Belakang 1
1.2. Perumusan Masalah 2
1.3. Tujuan Penelitian 3
1.4. Manfaat Penelitian 3
Bab 2. Tinjauan Pustaka
2.1. Gas Alam 4
2.1.1. Komposisi Kimia 7
2.2. Metanol 7
2.2.1. Pembuatan Metanol 9
2.2.2. Kualitas Metanol 14
2.2.3. Aplikasi Metanol 14
2.3. Destilasi 17
2.3.1. Spesifikasi Produk 20
2.4. Karbon Dioksida 21
2.5. Trimetilamin 22
2.5.2. Reaksi Pembentukan Trimetilamin 23
Bab 3. Bahan Dan Metode
3.1. Alat- Alat 25
3.2. Bahan- Bahan 25
3.3. Prosedur Percobaan 25
Bab 4. Hasil dan Pembahasan
4.1. Hasil dan Pembahasan 26
4.1.1. Hasil Percobaan 26
4.2. Pembahasan 27
Bab 5. Kesimpulan dan Saran 5.1. Kesimpulan 29
5.2. Saran 29
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Kandungan CO2 Dalam Raw Methanol dan TMA dalam 26
PENGARUH KENAIKAN CO2 TERHADAP KADAR TRIMETILAMINA
(TMA) DAN PERUBAHAN KANDUNGAN TMA SETELAH MEMASUKI
TMA CATCHPOT DALAM PROSES DESTILASI PADA PEMURNIAN
METANOL DI PT. KALTIM METHANOL INDUSTRI BONTANG
ABSTRAK
Telah dilakukaan percobaan mengenai pengaruh kenaikan CO2 terhadap kadar trimetilamina (TMA) dan perubahan kandungan TMA setelah memasuki TMA catchpot dalam proses destilasi pada pemurnian metanol. Dari percobaan diperoleh kadar CO2 sebesar 8.68, 10.03, 9.89, 9.56, dan 9.77 pada raw methanol dan juga diperoleh kadar TMA didalam raw methanol sebelum memasuki TMA catchpot adalah sebesar 118.76, 202.27, 195.45, 122.72, 133.63, dan kadar TMA setelah memasuki TMA catchpot adalah sebesar 2.237, 2.289, 2.57, 2,311, dan 2.156. Dari percobaan tersebut terlihat bahwa semakin besar kadar CO2 dalam
EFFECT ON LEVELS INCREASE CO2 TRIMETHYLAMINE (TMA)
TMA CONTENT AND CHANGES AFTER ENTERING THE TMA CATCHPOT DISTILLATION PROCESS PURIFICATION OF
METHANOL IN PT. KALTIM METHANOL INDUSTRY BONTANG
ABSTRACT
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Metanol adalah senyawa Alkohol dengan 1 rantai Karbon. Rumus Kimia CH3OH,
dengan berat molekul 32. Titik didih 640-650C (tergantung kemurnian), dan berat
jenis 0,7920-0,7930 (juga tergantung kemurnian). Secara fisik Metanol
merupakan cairan bening, berbau seperti alkohol, dapat bercampur dengan air,
etanol, chloroform dalam perbandingan berapapun, hygroskopis, mudah menguap
dan mudah terbakar dengan api yang berwarna biru (kalau siang tidak kelihatan)
(Winarso,L.1998).
Metanol merupakan salah satu bahan kimia industri yang penting. Sebagai
bahan kimia industri, metanol telah digunakan secara luas untuk produksi
berbagai bahan kimia yang lain. Sekitar sepertiga dari produksi metanol
digunakan untuk membuat formaldehida dan selebihnya digunakan untuk
pembuatan MTBE (Methyl Tertiary Buthyl Eter), asam asetat, pelarut, metaklirat,
bahan bakar, dan lain-lain (Othmer, 1994).
Metanol dapat diperoleh dari proses penyulingan kayu, gasifikasi batu bara
muda dan sintesis gas alam, PT. Kaltim Metahanol Industri memanfaatkan gas
alam sebagai bahan baku pembuatan metanol dengan proses multi tahap. Secara
singkat gas alam dan uap air dibakar dalam tungku untuk membentuk gas
hidrogen dan karbon monoksida, kemudian gas hidrogen dan karbon monoksida
metanol. Metanol disintesis dalam reaktor metanol. Pada pembentukan metanol
didalam reaktor metanol juga terjadi konversi CO menjadi CO2 dan pembentukan
trimetilamina (TMA). TMA adalah senyawa organik dengan rumus N(CH3)3.
Senyawa ini tak berwarna, higroskopik, dan mudah terbakar dimana amina tersier
memiliki bau kuat amis rendah konsentrasi dan amonia seperti bau pada
konsentrasi yang lebih tinggi (Engler,2001).
Pada proses pembuatan metanol pada PT. KMI, TMA terbentuk dari reaksi
antara amoniak dan metanol yang terjadi didalam reaktor metanol. TMA tersebut
tidak diinginkan dalam metanol karena TMA menimbulkan bau amis, warna yang
keruh yang mempengaruhi kualitas metanol yang dihasilkan, sehingga diupayakan
agar kadar TMA didalam metanol itu serendah mungkin. Untuk meminimalkan
kadar TMA pada metanol, maka pada proses destilasi dilengkapi dengan suatu
alat yaitu TMA catchpot, yang diharapkan mampu menurunkan kadar TMA di
dalam metanol (Putro, 2009).
Berdasarkan uraian tersebut maka penulis ingin mengetahui bagaimana
pengaruh kenaikan CO2 terhadap kadar TMA dan perubahan kandungan TMA
setelah memasuki TMA catchpot dalam proses destilasi pada pemurnian metanol.
1.2 Perumusan Masalah
1. Bagaimanakah pengaruh CO2 pada kenaikan kandungan TMA dalam
metanol.
2. Bagaimanakah perubahan kadar TMA sebelum dan sesudah memasuki
1.3 Tujuan Penilitian
1. Untuk mengetahui pengaruh kenaikan CO2 terhadap kadar TMA dalam
produksi metanol.
2. Untuk mengetahui perubahan kandungan TMA dalam TMA catchpot pada
proses destilasi pada pemurnian metanol.
1.4 Manfaat Penelitian
1. Dapat mengetahui pengaruh CO2 terhadap kenaikan kandungan TMA
dalam metanol pada proses pembuatan metanol.
2. Dapat mengetahui perubahan kandungan TMA dalam metanol dalam TMA
BAB 2
TINJAUAN PUSTAKA
2.1 Gas Alam
Gas alam sering juga disebut sebagai gas bumi atau gas rawa, adalah bahan bakar
fosil berbentuk gas yang terutama terdiri dari metana (CH4). Gas alam dapat
ditemukan di ladang minyak, ladang gas bumi, dan juga tambang batu bara.
Ketika gas yang kaya dengan metana diproduksi melalaui pembusukan oleh
bakteri anaerobik dari bahan-bahan organik selain fosil, maka gas alam disebut
biogas.
Sistem transportasi gas alam pada dasarnya meliputi:
Transportasi melalui pipa salur.
Transportasi dalam bentuk Liquefield Natural Gas (LNG) dengan kapal
tanker LNG untuk pengangkutan jarak jauh.
Transportasi dalam bentuk Compressed Natural Gas (CNG), baik di
daratan dengan road tanker maupun dengan kapal tanker CNG di laut,
untuk jarak dekat dan menengah (antar pulau).
Untuk metode penyimpanan gas alam, dilakukan dengan ”Natural Gas
Underground Storage”, yakni suatu ruangan raksasa di bawah tanah. Terdapat 3
tipe penyimpanan gas alam di bawah tanah, yaitu depleted fields, aquifers, dan
Depleted fields merupakan tipe yang paling banyak digunakan karena
berupa formasi geologis bawah tanah yang sudah tersedia secara alami, sehingga
hanya perlu dikembangkan saja. Dibandingkan dengan tipe yang lain, tipe ini
merupakan tipe yang paling murah, mudah dikembangkan, mudah dioperasikan,
dan mudah dipelihara.
Tipe aquifers berupa rongga-rongga bawah tanah, tersusun dari batuan
yang permeable, yang bertindak sebagai penyimpanan air alami. Pada situasi
tertentu, formasi ini dapat direkondisikan dan digunakan sebagai fasilitas
penyimpanan gas alam. Fasilitas penyimpanan dengan tipe ini adalah yang paling
mahal dan paling jarang digunakan dibandingkan dengan tipe yang lain
disebabkan oleh beberapa alasan, diantaranya harus dilakukan berbagai macam tes
untuk memastikan karakteristik geologis dari formasi batuan . Kemudian, harus
dibangun semua infrastruktur terkait dengan pengembangan fasilitas penyimpanan
ini, dengan biaya yang tidak sedikit. Oleh karena itu, tipe ini biasanya hanya
digunakan apabila tidak terdapat depleted reservoirs.
Tipe salt caverns terbentuk akibat adanya deposit garam di bawah tanah.
Ada dua bentuk deposit garam di bawah tanah, yaitu salt domes dan salt beds.
Walaupun biaya pengembangan untuk tipe ini cukup mahal, tapi tipe ini
merupakan tipe yang memiliki tingkat deliverability paling tinggi dan juga dapat
Secara garis besar pemanfaatan gas alam dibagi atas 3 kelompok yaitu :
• Gas alam sebagai bahan bakar, antara lain sebagai bahan bakar
Pembangkit Listrik Tenaga Gas/Uap, bahan bakar industri ringan,
menengah dan berat, bahan bakar kendaraan bermotor (BBG/NGV),
sebagai gas kota untuk kebutuhan rumah tangga hotel, restoran dan
sebagainya.
• Gas alam sebagai bahan baku, antara lain bahan baku pabrik pupuk,
petrokimia, metanol, bahan baku plastik (LDPE = low density
polyethylene, LLDPE = linear low density polyethylene, HDPE = high
density polyethylen, PE= poly ethylene, PVC=poly vinyl chloride, C3 dan
C4-nya untuk LPG, CO2-nya untuk soft drink, dry ice pengawet makanan,
hujan buatan, industri besi tuang, pengelasan dan bahan pemadam api
ringan.
• Gas alam sebagai komoditas energi untuk ekspor, yakni Liquefied Natural
Gas (LNG).
Teknologi mutakhir juga telah dapat memanfaatkan gas alam untuk air
conditioner (AC=penyejuk udara), seperti yang digunakan di bandara Bangkok,
Thailand dan beberapa bangunan gedung perguruan tinggi di Australia
2.1.1 Komposisi Kimia
Komponen utama dalam gas alam adalah metana (CH4), yang merupakan
molekul hidrokarbon rantai terpendek dan teringan. Gas alam juga mengandung
molekul-molekul hidrokarbon yang lebih berat, seperti etana, propana, butana,
selain juga gas-gas yang mengandung sulfur (belerang). Selain itu nitrogen,
helium karbondioksida, hidrogen sulfida, air dapat juga terkandung di dalam gas
alam, merkuri dapat juga terkandung dalam jumlah kecil. Komposisi gas alam
bervariasi sesuai dengan ladang gasnya (Caulson,1983)
PT. Kaltim Methanol Industri merupakan suatu industri pembuatan metanol
yang memanfaatkan gas alam pada bahan baku utamanya. Gas alam yang
dimanfaatkan pada proses pembuatan methanol tersebut antara lain nitrogen (N2),
karbondioksida (CO2), metana (CH4), hidrogen sulfida (H2S), hidrogen (H) dan
uap air (H2O) (PT. KMI, 1997).
2.2. Metanol
Metanol adalah senyawa Alkohol dengan 1 rantai Karbon. Rumus Kimia CH3OH,
dengan berat molekul 32. Titik didih 640-650C (tergantung kemurnian), dan berat
jenis 0,7920-0,7930 (juga tergantung kemurnian). Secara fisik Metanol
merupakan cairan bening, berbau seperti alkohol, dapat bercampur dengan air,
etanol, chloroform dalam perbandingan berapapun, hygroskopis, mudah menguap
dan mudah terbakar dengan api yang berwarna biru (kalau siang tidak kelihatan).
Metanol lebih racun dari pada alkohol (Etanol) dan dalam jumlah sedikitpun
metanol sering di beri warna (biru) akibat di beri tambahan senyawa cupri
sulphate untuk membedakan metanol teknis dengan alkohol dan dijual dengan
nama spiritus.
Metanol merupakan cairan polar yang dapat bercampur dengan air, alkohol
– alkohol lain, ester, keton, eter, dan sebagian besar pelarut organik. Metanol
sedikit larut dalam lemak dan minyak. Secara fisika metanol mempunyai afinitas
khusus terhadap karbon dioksida dan hidrogen sulfida. Titik didih metanol berada
pada 64,7oC dengan panas pembentukan (cairan) –239,03 kJ/mol pada suhu 25 oC.
Metanol mempunyai panas fusi 103 J/g dan panas pembakaran pada 25 oC sebesar
22,662 J/g. Tegangan permukaan metanol adalah 22,1 dyne/cm sedangkan panas
jenis uapnya pada 25 oC sebesar 1,370 J/(gK) dan panas jenis cairannya pada suhu
yang sama adalah 2,533 J/(gK)[4] ( Spencer, 1988).
Metanol juga dikenal sebagai metil alkohol, wood alcohol atau spiritus,
adalah senyawa kimia dengan rumus kimia CH3OH. Ia merupakan bentuk alkohol
paling sederhana. Pada keadaan atmosfer metanol berbentuk cairan yang ringan,
mudah menguap, tidak berwarna, mudah terbakar dan beracun dengan bau yang
khas (berbau lebih ringan daripada etanol). Metanol digunakan sebagai bahan
pendingin anti beku, pelarut, bahan bakar dan sebagai bahan aditif bagi etanol
industri.
Metanol juga merupakan produk samping dari destilasi kayu. Saat ini
metanol dihasilkan melalui proses multi tahap. Secara singkat gas alam dan uap
air dibakar dalam tungku untuk membentuk gas hidrogen dan karbonmonoksida,
dengan bantuan katalis untuk menghasilkan metanol. Tahap pembentukannya
adalah endotermik dan tahap sintesisnya adalah eksotermik (Engler,2001)
Metanol adalah salah satu bahan kimia industri yang penting. Sebagai bahan
kimia industri, metanol telah digunakan secara luas untuk produksi berbagai
bahan kimia yang lain. Sekitar sepertiga dari produksi metanol digunakan untuk
membuat formaldehida dan selebihnya digunakan untuk pembuatan MTBE
(Methyl Tertiary Buthyl Eter), asam asetat, pelarut, metaklirat, bahan bakar, dan
lain-lain. Sementara itu, formaldehida yang ditemukan oleh Butlerov pada tahun
1859 adalah suatu senyawa yang dapat bereaksi dengan hampir semua senyawa
kimia baik organik maupun anorganik. Penggunaan terbesar formaldehida adalah
sebagai bahan dasar pembuatan resin-resin formaldehida seperti urea
formaldehida, melamin formaldehida, dan fenol formaldehida. (Othmer, 1994).
2.2.1. Pembuatan metanol
Secara teori metanol dapat dibuat dari proses penyulingan kayu, gasifikasi batu
bara muda dan sintesis gas alam, tapi yang akan saya tulis di sini adalah
sintesis metanol dari gas alam, sintesa metanol dari gas alam inilah yang saat
ini teknologinya di pakai pada pembuatan metanol skala industri besar dimana
di Indonesia sendiri baru ada 2 pabrik yang mengolahnya yaitu kilang Metanol
Bunyu di Tarakan, Kaltim dengan kapasitas produksi 1000 MT/hari dan kilang
Metanol Kaltim Metanol Industri di Bontang juga di Kaltim dengan kapasitas
Reaksi pembuatan metanol dengan sintesis gas alam adalah sebagai
berikut:
CH4 + H2O ⇌ 3 H2 + CO
CO + 2 H2⇌ CH3OH
CO2 + 3 H2⇌ CH3OH + H2O
Adapun secara ringkas, tahapan proses sintesis metanol adalah sebagai
berikut (di pakai di kilang KMI Bontang) :
Prereform:
gas alam direaksikan dengan steam superheated, dengan reaksi sebagai berikut
CnH2n+2 + n H2O ⇌ CO + (2n+1)H2 -Q
CO + 3 H2 ⇌ CH4 + H2O +Q
CO + H2O ⇌ CO2 + H2 + Q
Reforming :
merubah CH4 menjadi CO dan H2 dengan bantuan steam, reaksi
CH4 + H2O ⇌ 3 H2 + CO – Q
Reaksi 3. Reaksi perubahan CH4 menjadi CO dan H2
Autotermal:
Merubah sisa-sisa CH4 dengan steam dan O2, di mana reaksi partial dan
sempurna berlangsung sekaligus, reaksi
2 CnH2n+2 + (3+1n)O2⇌ 2nCO2 + (2n+2)H2O+Q
CH4 + 2O2⇌ CO2 + 2H2)+ Q
CH4 + O2⇌ CO + H2 + H2O+Q
Sintesis :
CO + 2H2⇌ CH3OH
CO2 + 3H2⇌ CH3OH + H2O
Gas-gas CO, CO2, dan H2 lalu disintesis dalam reaktor dengan katalis Cu
Destilasi:
Hasil dari sintesis gas di unit reactor kemurniannya masih berkisar 70 %, maka
dilakukan tahap akhir yaitu destilasi untuk mendapatkan Methanol dengan
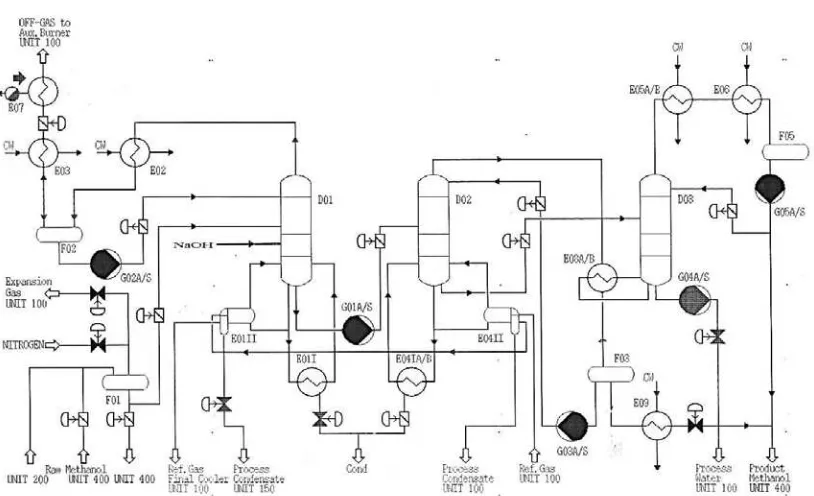
kemurnian tinggi. Berikut proses singkat destilasi pada PT. KMI :
raw methanol dari methanol separator dialirkan ke expansion vessel
(tekanan 5,5 bar ke 3,72 bar untuk memisahkan gas-gas terlarut dalam metanol)
menghasikan prerun methanol refluks vessel berupa outlet liquid kemudian
dialirkan ke prerun coulumn (030D01) yang bertujuan untuk menghilangkan gas
low boiling. Kemudian diumpankan ke liquid expansion vessel dimana hasil atas
berupa gas yang dialirkan ke off gas cooler untuk mengembunkan metanol yang
masih tersisa untuk dikembalikan ke kolom melalui refluks. Hasil bawah berupa
metanol yang telah bebas low boiler dengan kandungan metanol 79% (sisanya air
dan high boiling ). Hasil bawah yang berupa metanol diumpankan ke pressure
coulumn (030D02) yaitu destilasi pada kolom kedua yang bertujuan untuk
menghilangkan gas high boiling. Metanol murni yang keluar dari atas menara
dikondensasikan ke reboiler atmospheric coulumn, sedangkan sebagian dialirkan
dikembalikan ke pressure coulumn untuk diproses kembali. Pada pressure
coulumn hasil bawah berupa 67% metanol dan 32% air seperti yang ditunjukan
pada gambar 2.1. High boiling product dari pressure coulumn diumpankan ke
atmospheric coulumn bertujuan untuk memisahkan metanol dari air dan high
boiling. Hasil akhir dari unit ini merupakan metanol dengan kemurnian 99,85%.
[image:36.595.132.539.302.550.2]Berikut bagan proses destilasi metanol pada PT. KMI:
Gambar 2.1 bagan proses destilasi metanol pada PT. KMI (Winarso,
1998)
Metanol diproduksi dalam skala industri terutama berdasarkan perubahan
katalik dari gas sintesa (catalityc conversion of syntehesis gas). berdasarkan
1. Proses tekanan tinggi.
Pada proses ini pembuatan metanol dioperasikan pada tekanan 300bar,
menggunakan katalis krom oksida – seng oksida untuk perubahan katalitik
dari CO dan CO2 dengan H2 menjadi metanol pada suhu 320-400 oC.
kekuragan proses ini adalah mahalnya komponen yang diperlukan untuk
tekana tinggi, biaya energi yang lebih tinggi, serta biaya perlatan yang
tinggi.
2. Proses tekanan rendah
Pada proses ini, tekanan yang diberikan adalah 50-150 bar dan suhu
200-500 oC. Jenis katalis yang digunakan adalah tembaga (copper based
catalyst). Keunggulan dari proses ini adalah biaya investasi yang lebih
rendah, biaya produksi yang lebih rendah, kemampuan operasi yang lebih
baik dan lebih fleksibel dalam penentuan ukuran pabrik.
Berdasarkan perbandingan dua proses diatas maka proses tekana
rendah dengan pertimbangan sebagai berikut:
1. Biaya investasi yang relatif rendah
2. Biaya produksi yang lebih rendah
3. Kemampuan operasi yang lebih baik
4. Lebih fleksibel dalam penentuan ukuran pabrik. (Bergeyk,1982)
Metanol dapat diproduksi secara alami oleh metabolisme anaerobik oleh
bakteri. Hasil proses tersebut adalah uap metanol (dalam jumlah kecil) diudara.
Setelah beberapa hari uap metanol tersebut akan teroksidasi oleh oksigen
Reaksi kimia metanol yang terbakar diudara dan membentuk
karbondioksida dan air adalah sebagai berikut:
2CH3OH + 3O2→ 2CO2 + 4H2O
Api dari metanol biasanya tidak berwarna. Oleh karena itu kita harus
berhati-hati bila berada dekat metanol yang terbakar untuk mencegah cedera
akibat api yang tidak terlihat. Karena sifatnya beracun metanol sering digunakan
sebagai zat aditif bagi pembuatan alkohol untuk pengunaan industri. Penambahan
“racun” ini akan menghindarkan industri dari pajak yang dapat dikenakan karena
etanol merupakan bahan utama yang digunakan untuk minuman keras (minuman
berakohol) (Engler,2001).
2.2.2. Kualitas Methanol
Menurut standard IMPCA (International Methanol Producers and
Consumer Assocation) kualitas Methanol tertinggi adalah Grade AA dengan
kandungan Metanol minimal 99,85 %, dan kandungan Etanol maksimal 10 ppm
(Winarso, 1998).
2.2.3. Aplikasi Metanol
Proses oksidasi parsial metana menjadi metanol dan formaldehida telah
lama menjadi objek penelitian para peneliti. Umumnya, para peneliti
memfokuskan studi bagaimana cara memperoleh konversi dan selektifitas metanol
dan selektif. Berbagai katalis telah dicoba oleh beberapa peneliti untuk
mendapatkan konversi dan selektifitas yang tinggi. (Parkyns, 1991).
Metanol memiliki satu gugus OH dalam molekulnya. Oksigen yang inheren
di dalam molekul metanol tersebut membantu penyempurnaan pembakaran antara
campuran udara-bahan bakar di dalam silinder. Tentunya metanol menjadi mudah
bereaksi dengan oksigen, dalam arti memerlukan suhu lingkungan yang rendah
untuk terjadi campuran gas dengan oksigen. Campuran gas ini biasa disebut
mixture. Metanol juga memiliki panas penguapan yang tinggi, yakni 842 KJ/Kg.
Titik didih metanol sekitar 690 C dan metanol memiliki satu gugus OH dalam
molekulnya. Oksigen yang inheren di dalam molekul metanol tersebut membantu
mempercepat pembakaran antara campuran udara dengan bahan bakar di dalam
silinder. Tentunya metanol menjadi mudah bereaksi dengan oksigen, sehingga
memerlukan suhu lingkungan yang rendah untuk terjadi pembakaran. Bensin yang
diuapkan biasanya meninggalkan sisa berbentuk getah padat yang melekat pada
permukaan saluran dan bagian-bagian mesin.
Kegunaan bahan bakar untuk kendaraan bermotor metanol digunakan secara
terbatas dalam mesin pembakaran dalam, dikarenakan metanol tidak mudah
terbakar dibandingkan dengan bensin. Metanol juga digunakan sebagai campuran
utama untuki bahan bakar model radio kontrol dan pesawat model. Salah satu
kelemahan metanol jika digunakan dalam konsentrasi tinggi adalah sifat korosif
terhadap beberapa logam, termasuk aluminium. Metanol, meskipun merupakan
asam lemah, menyerang lapisan oksida yang biasanya melindungi alumunium dari
korosi :
Ketika diproduksi dari kayu atau bahan organik lainnya, metanol organik
tersebut merupakan bahan bakar terbaharui yang dapat menggantikan
hidrokarbon. Namun mobil modren pun masih tidak dapat menggunakan BA100
(100% bioalkohol) sebagai bahan bakar tanpa modifikasi. Disamping sebagai
bahan bakar, metanol juga dapat digunakan sebagai pelarut dan sebagai antibeku,
dan fluida pencuci kaca depan mobil. Tetapi penggunaan metanol terbanyak
adalah sebagai bahan pembuat bahan kimia lain (Anggriawan, 2008).
Saat ini terdapat kecenderungan pengembangan sel bahan bakar yang
menggunakan hidrokarbon cair sebagai sumber gas hidrogen. Salah satu
hidrokarbon cair yang dapat digunakan sebagai sumber hidrogen adalah metanol.
Melalui reaksi terkatalisis pada suhu tidak terlalu tinggi (200oC – 400oC), metanol
dapat diubah menjadi gas yang kaya dengan hidrogen. Kelebihan lainnya, metanol
mudah diperoleh dan dapat dihasilkan dari sumber terbarukan.
Proses produksi gas hidrogen secara langsung dari hidrokarbon cair harus
memenuhi beberapa syarat agar dapat diterapkan pada sel bahan bakar. Proses
tersebut harus efisien, praktis, dan gas yang dihasilkannya mengandung CO
sangat rendah. Pada konsentrasi beberapa ppm gas CO dapat meracuni sel bahan
bakar dengan mendeaktifkan katalis (terutama Pt) pada anoda. Hidrogen dapat
diperoleh secara langsung dari metanol melalui tiga proses yaitu dekomposisi
metanol, oksidasi parsial metanol dan reformasi kukus metanol. Proses
dekomposisi metanol dan oksidasi parsial metanol menghasilkan produk samping
gas CO. Reformasi kukus metanol menjadi alternatif. terbaik untuk sintesis gas
hidrogen dari metanol. Reaksi ini menghasilkan gas H2/CO2 dengan rasio mol 3:1
demikian, reformasi kukus metanol menjadi proses yang cocok untuk produksi
hidrogen secara langsung pada sel bahan bakar pada kendaraan.
Reformasi kukus metanol merupakan kebalikan reaksi sintesis metanol dari
campuran gas hidrogen dan CO2. Dengan demikian, dapat diasumsikan bahwa
katalis untuk sintesis metanol juga memiliki keaktifan yang tinggi dalam reaksi
kebalikannya. Katalis Cu/ZnO/Al2O3 yang secara komersial telah digunakan
dalam reaksi pergeseran gas suhu rendah (low-temperature gas shift) dan sintesis
metanol telah digunakan dalam reaksi reformasi kukus metanol. Katalis
Cu/ZnO/Al2O3 memiliki keaktifan tinggi namun memiliki ketahanan termal
rendah dan mengalami pendeaktifan selama reaksi.4 Pada katalis Cu/ZnO/Al2O3
yang bertindak sebagai pusat aktif adalah logam Cu. (Marsih,2006).
2.3. Destilasi
Destilasi merupakan suatu proses pemisahan dua atau lebih komponen zat cair
berdasarakan pada perbedaan titik didihnya. Secara sederhana destilasi dengan
memanaskan/menguapkan zat cair lalu uap tersebut didinginkan kembali supaya
jadi cair dengan kondensor. Berikut macam-macam destilasi :
1. Destilasi sederhana
Destilasi sederhana digunakan untuk memisahkan zat cair dengan zat
padat atau minyak.
2. Destilasi bertingkat
Proses ini digunakan untuk komponen yang memiliki titik didih yang
sehingga mampu memisahkan dua komponen yang memiliki titik didih
yang bertekanan.
3. Destilasi azeotrop
Digunakan dalam memisahkan azeotrop (campuran yang memiliki dua
atau lebih komponen yang sulit dipisahkan), biasanya dalam prosesnya
digunakan senyawa lain yang dapat memecah ikatan azeotrop tersebut,
atau dengan menggunakan tekanan tinggi.
4. Destilasi vakum
Destilasi ini adalah destilasi dengan tekanan rendah, yaitu yang digunakan
untuk zat yang tak tahan suhu tinggi atau bisa rusak pada pemanasan yang
tinggi.
5. Destilasi kering
Destilasi yang prinsipnya memanaskan material padat untuk fase uap dan
cairnya, contohnya untuk mengambil cairan bahan bakar dari kayu atau
batubata.
Tujuan utama destilasi adalah untuk memisahkan bahan baku yang
diberikan kedalam hasil yang lebih bernilai. Nilai dari produk sepenuhnya
tergantung pada produk pada kualitasnya. Hal ini membuat kontrol kualitas yang
mempertimbangkan perntingnya didalam suatu operasi kolom pada destilasi,
tetapi spesifikasi kualitas disatukan hanya pada suatu aspek kolom kontrol : suatu
operasi juga harus menguntungkan dan memenuhi tujuan produksi. Ada tiga
sasaran yaitu kualitas, laba, dan produksi yang memiliki kaitan yang erat. (Kister,
Umumnya proses distilasi dalam skala industri dilakukan dalam menara,
oleh karena itu unit proses dari distilasi ini sering disebut sebagai
(MD). Menara distilasi biasanya berukuran 2-5 meter dalam
berkisar antara 6-15
jenuh, yaitu cairan yang dengan berkurang tekanan sedikit saja sudah akan
terbent
lebi
Menara distilasi terbagi dalam 2 jenis kategori besar :
1. Menara Distilasi tipe Stagewise, menara ini terdiri dari banyak piringan
yang memungkinkan kesetimbangan terbagi-bagi dalam setiap
piringannya, dan
2. Menara Distilasi tipe Continous, yang terdiri dari pengemasan dan
kesetimbangan cair-gasnya terjadi di sepanjang
Umumnya pada proses destilasi metanol menggunakan jenis proses destilasi
fraksinasi. Dimana destilasi fraksinasi ini berdasarkan perbedaan titik didihnya
namun perbedaan titik didihnya hampir sama, dimana titik didih metanol adalah
64,7oC, dengan bahan pencampurnya yaitu etanol 79oC,aseton 56,53oC, dan air
100oC. Dalam proses tersebut maka metanol murni akan dipisahkan dari
pencampur-pencampurnya ataupun impuritis (zat pengotor) yang ada pada
Diagram pada destilasi :
1. Diagram titik didih
Diagram titik didih adalah diagram yang menyatakan hubungan antara
temperatur atau titik didih dengan komposisi uap dan cairan yang
berkeseimbangan.
2. Diagram keseimbangan uap-air
Diagram kesimbangan uap air adalah diagram yang menyatakan hubungan
keseimbangan antara komposisi uap dengan komposisi cairan.
3. Diagram Entalpi-Komposisi
Diagram entalpi-komposisi adalah diagram yang menyatakan hubungan
antara entalpi dengan komposisi sesuatu sistem pada tekanan tertentu.
2.3.1. Spesifikasi Produk
Metanol merupakan cairan polar yang dapat bercapur dengan air, alkohol-alkohol
lain, ester, keton, eter, dan sebagian besar pelarut organik. Metanol sedikit larut
dalam lemak dan minyak. Secara fisika metanol mempunyai afinitas khusus
terhadap karbon dioksida dan hidrogen sulfida. Titik didih metanol berada pada
64,7oC dengan panas pembentukan cairan -239,03 kj/mol pada suhu 25oC.
metanol mempunyai panas fusi 103 J/g dan panas pembakaran metanol pada 25oC
sebesar 22,662 J/g. Tegangan permukaan metanol adalah 22,1 dyne/cm sedangkan
panas jenis uapnya pada 25oC sebesar 1,370 J/(gK) dan panas jenis cairannya pada
suhu yang sama adalah 2,533 J/(gK). Sebagai alkohol alifatik yang paling
Metanol bereaksi melalui pemutusan ikatan C-O atau O-H yang dikarakterisasi
dengan penggantian grup –H atau –OH. (stichlmair,1998).
2.4 Karbon dioksida
Karbon dioksida adalah sejenis senyawa kimia yang terdiri dari dua atom oksigen
yang terikat secara kovalen dengan sebuah atom karbon. Berbentuk gas pada
keadaan temperatur dan tekanan standart dan hadi di atmosfir bumi. Karbon
dioksida dihasilkan oleh semua hewan, tumbuh-tumbuhan, fungi, dan
mikroorganisme pada proses
dalam
pembakaran
1997).
Karbon dioksida merupakan senyawa kimia yang terbentuk melalui
penggabungan antara satu atom karbon dengan dua atom oksigen, dan
dilambangkan dengan rumus molekul CO2. Senyawa ini memiliki struktur
geometri linier dengan sudut ikat O-C-O sebesar 180o. Ikatan antara atom karbon
dengan masing-masing atom oksigen terdiri atas satu ikatan C dan satu ikatan O.
Ikatan C=O pada molekul CO2 memiliki energi ikat sebesar 178 kkal/mol dan
panjang ikatan sebesar 1,20 Å (Stecher, 1968).
Karbon dioksida memiliki massa molekul relatif 44,01 g per mol,
merupakan gas tak berwarna, tak berbau, tidak mudah terbakar, berasa masam,
kritis 72,9 atm, kalor pembentukan 94,05 kkal/mol, panas laten penguapan 83,12
kkal/mol, serta panas spesifik sebesar 0,19-0,21 Btu/lb. Senyawa ini bersifat larut
dalam air dengan kelarutan sebesar 88 mL per 100 mL air pada temperatur 20oC.
Karbon dioksida juga larut dalam sejumlah pelarut organik seperti etanol dan
metanol, namun dengan nilai kelarutan lebih kecil dibandingkan dengan
kelarutannya dalam air (Stecher, 1968).
Pada PT. Kaltim Methanol Industri gas karbon dioksida (CO2) mengalami
proses sintesis yang bereaksi dengan hidrogen dan menghasilkan metanol. Reaksi
tersebut bersifat eksotermis dan dilakukan dengan bantuan katalis seperti Zn, Cu,
dan Al2O3. Pada PT. KMI CO2 juga merupakan senyawa yang menyebabkan
kenaikan kandungan TMA pada metanol. CO2 tersebut merupakan zat
pengganggu pada proses penetralan TMA dalam proses destilasi pada pemurnian
methanol. CO2 tersebut cenderung bereaksi dengan basa NaOH yang merupakan
senyawa penetral pada proses penetralan TMA tersebut. (PT. KMI, 1997).
2.5Trimetilamin
2.5.1. Sifat Trimetilamin
Trimethylamine, atau biasa di kenal denga NMe3, N(CH)3 atau TMA, bersifat
tidak berwarna, higroskopis, dan merupakan senyawa amine sederhana. Senyawa
ini relatif mudah terbakar dengan ciri berbau amis pada konsentrasi rendah dan
2.5.2. Reaksi Pembentukan Trimetilamin
TMA terbentuk dalam reaktor sintesis metanol dan ditemukan diunit pemurnian
raw metanol. Didalam reaktor sintesis, TMA terbentuk sebagai hasil dari reaksi
antara amoniak dan metanol. Amoniak (NH3) dihasilkan dalam proses sintesis
metanol dari reaksi antara Nitrogen dan Hidrogen. Berikut reaksi pembentukan
TMA oleh amoniak dan metanol.
NH3 + CH3OH ⇌ NH2CH3+ H2O Monometilamin
MMA + CH3OH ⇌ NH(CH3)2 + H2
Dwimetilamin
DMA + CH3OH⇌ N(CH)3 + H2O Trimetilamin
Trimetilamin dapat berbentuk TMA bebas (free TMA) yang memiliki titik
didih normal 3,5o atau dalam bentuk larutan senyawa asam (acidic coumpounds)
seperti yang dijumpai pada raw metanol.(Perry, 1997)
Rumus bangun masing-masing senyawa dapat dilihat pada gambar 2.2.
TMA bebas dapat dengan mudah dipisahkan dari metanol. Namun, TMA dalam
bentuk acidic compound bersifat tidak volatil dan sulit dipisahan dari metanol
dengan destilasi.
Cl
Gambar 2.2. Rumus bangun senyawa TMA bebas (kiri), dan dalam senyawa
Di PT Kaltim Methanol Industri, TMA dalam raw methanol dapat dirubah
menjadi free TMA melalui netralisasi acidic raw methanol dengan penambahan
NaOH. TMA bebas akan terpisah dalam Prerun Column 030D01 dan keluar
melalui bagian atas kolom bersama dengan pengotor lain yang memiliki derajat
volatilitas rendah. (PT. KMI, 1997).
Pada aplikasinya trimetilamina digunakan dalam sintesis kolin, hidroksida
tetramethylammonium, pengatur pertumbuhan tanaman, sangat dasar resin
pertukaran anion, dan pewarna agen meratakan. Gas sensor untuk menguji
BAB 3
BAHAN DAN METODE
3.1Alat - Alat
1. Prerun column
2. Autothermal reactor
3. desulfurizer
4. raw methanol tank
5. TMA Cathpot
6. Gas Chromatography Shimadzu 2010 plus
3.2Bahan-Bahan 1. Gas Alam
2. NaOH
3. Katalis nikel
3.3 Prosedur Percobaan
Make up gas dilewatkan melalui seperator kemudian dialirkan menuju
reaktor metanol, sehingga terbentuk raw methanol yang mengandung CO2 dan
TMA. Kemudian diukur kadar CO2 yang terdapat didalam raw methanol tersebut.
Selanjutnya raw methanol didestilasi didalam pressure coloumn yang dilengkapi
oleh alat yang bernama TMA catchpot (F07) dan selanjutnya diukur kadar TMA
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil dan Pembahasan 4.1.1 Hasil Percobaan
Raw methanol yang diperoleh dari reaktor metanol mengandung CO2 dan TMA.
Kemudian dalam proses destilasi diperoleh perubahan kadar TMA setelah
memasuki TMA catchpot pada proses destilasi tersebut. Seperti yang ditunjukan
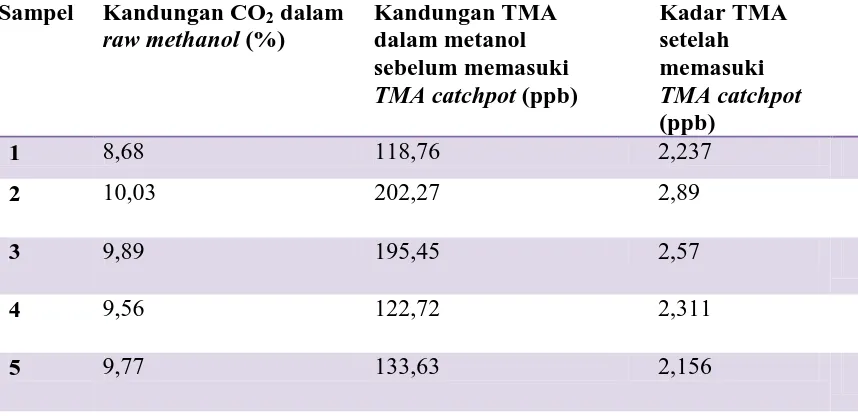
[image:50.595.109.538.448.656.2]dalam tabel 4.1 dibawah ini.
Tabel 4.1. Kandungan CO2 dalam raw methanol dan TMA dalam raw methanol
dan kandungan TMA setelah proses destilasi.
Sampel Kandungan CO2 dalam raw methanol (%)
Kandungan TMA dalam metanol sebelum memasuki
TMA catchpot (ppb)
Kadar TMA setelah memasuki
TMA catchpot
(ppb)
1 8,68 118,76 2,237
2 10,03 202,27 2,89
3 9,89 195,45 2,57
4 9,56 122,72 2,311
4.2. Pembahasan
Make up gas (gas alam keluaran dari proses pertama/proses reforming di dalam
unit 100) yang mengandung CO, CO2, H2, N2, serta H2O dilewatkan melalui
seperator kemudian dialirkan menuju reaktor metanol. Sehingga diperoleh raw
methanol. Di dalam seperator terjadi pemisahan gas dari liquid condesate agar
yang masuk ke reaktor tersebut adalah komponen gas tanpa ada cairan, sedangkan
di dalam reaktor tersebut metanol terbentuk dari CO, CO2 dan H2. Di dalam
reaktor metanol tersebut terbentuk metanol dan juga terbentuk TMA.
Reaksi pembentukan metanol dari CO, CO2 dan H2 di dalam reaktor metanol.
CO + 2H2⇌ CH3OH
CO2 + 3H2⇌ CH3OH + H2O
Dari tabel 4.1 terlihat bahwa semakin tinggi kadar CO2 maka kadar TMA
juga semakin tinggi. Hal ini disebabkan karena CO2 bereaksi dengan NaOH
membentuk Na2CO3 dengan reaksi sebagai berikut:
2NaOH + CO2⟶ Na2CO3 ↓ + H2O
Jadi jika kandungan CO2 tersebut tinggi dalam metanol, maka NaOH akan
lebih cenderung bereaksi dengan CO2 tersebut sehingga akan mengganggu reaksi
NaOH dengan TMA garam.
TMA dalam metanol cenderung membentuk garam karena TMA tersebut
bereaksi dengan gas Klor dan Hidrogen akibat suhu yang tinggi, dengan reaksi
sebagai berikut:
Garam TMA tidak bersifat volatil sehingga akan menimbulkan kekeruhan
pada metanol. Untuk mengubah garam TMA menjadi TMA bebas dibutuhkan
larutan NaOH, dengan reaksi sebagai berikut:
N(CH3)3Cl+ NaOH → N(CH3)3 + NaCl + H2O
Di dalam TMA catchpot, NaOH berfungsi untuk mengikat dan
menetralkan ion H+ pada TMA yang bersifat garam Didalam TMA catchpot,
NaOH berfungsi untuk mengikat dan menetralkan ion H+ pada TMA yang bersifat
asam, sehingga TMA yang awalnya berupa garam dan nonvolatil akan
menghasilkan TMA bebas yang bersifat volatil dan air dan menguap. Karena titik
didih TMA bebas adalah 3,5oC, jadi akan mudah menguap. Jadi pada unit F07
(TMA catchpot) tersebut, TMA akan menguap dari metanol, sehingga akan
menghasilkan produk metanol dengan kadar TMA yang sedikit.
Didalam metanol produk masih diperoleh kadar TMA, namun kadar TMA
tersebut masih dibawah standart yang di tentukan, yaitu di bawah 5 ppb sesuai
BAB 5
KESIMPULAN DAN SARAN
5.1Kesimpulan
1. Dari percobaan yang dilakukan diperoleh kadar CO2 dalam raw methanol
sebesar 8.68, 10.03, 9.89, 9.56 dan 9.77, dan kadar TMA didalam raw
methanol sebesar 118.76, 202.27, 195.45, 122.72, dan 133.63.
2. Semakin besar kadar CO2 dalam raw methanol maka kadar TMA juga
semakin besar.
3. Kadar TMA didalam metanol produk mengalami penurunan setelah
memasuki TMA catchpot pada proses destilasi pada pemurnian metanol.
5.2 Saran
Sebaiknya dilakukan penelitian yang lebih spesifik untuk mengetahui
penyebab lain dari naiknya kandungan TMA dan penyebab terbentuknya
DAFTAR PUSTAKA
Anggriawan, F. 2008. Menentukan konversi CO yang menjadi metanol pada metanol reaktor. Laporan Kerja Praktek. Yogyakarta. Universitas Pembangunan Nasional.
Caulson, J. 1983. An Introduction to Chemical Engineering Design, Chemical Engineering. Vol 6. Pergamon Press Inc. Singapore .
Engler, D. 2001. From Odor Sniffing to Highly Accurate Analytical Method, Lurgi LP Methanol Licensees’ Conference 2001. Germany Vol. 2. pp. 1-2.
Kister, H, Z. 1989. Distillation Operation. McGraw-Hill: New York. pp. 4-11.
Larian, M, G. 1958. Fundamental Of Chemical engineering Operation. New York: Prentice Hall.
Marsih. 2006. Sintesis Hidrogen dari Metanol dengan Katalis Cu/ZnO/Al2O3. FMIPA-ITB. Jurnal Kimia Indonesia. Vol. 1 (1)
Orthmer, K. 1994. Encyclopedia of chemical technology. Fourth edition. vol. II. Interscience. New York.
Parkyns N. D. 1991. Progressin the partial oxidation of methane tomethanol and formaldehyde, CatalysisToday. 8, 305-335.
Perry J, H. 1997. Perry’s Chemical Engineers’ Handbook. 7th ed. New York: McGraw-Hill. pp. 2-64.
PT KALTIM METHANOL INDUSTRI. 1997. Petunjuk Operasi Pabrik Methanol 200 MTPD Unit 300, Distillation Methanol.
Putro, I. K. 2009. Pemurnian Methanol Di PT Kaltim Methanol Industri. Jurnal Rekayasa Proses. Vol 3. No 2. Bontang.
Stecher, P.G., 1968, The Merck Index, 8th Edition, Merck & Co., Inc., Rahway, USA, 29-30, 207-208.
Stichlmair, J., G. 1998. Distillation Principles and Practice. Wiley-Vch. New York.