PERAKITAN VEKTOR EKSPRESI PROTEIN G SUBUNIT
α
DARI
KEDELAI (
Glycine max
) KULTIVAR SLAMET
RIAN PRATIWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
PERAKITAN VEKTOR EKSPRESI PROTEIN G SUBUNIT
α
DARI
KEDELAI (
Glycine max
) KULTIVAR SLAMET
RIAN PRATIWI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
RIAN PRATIWI. Perakitan Vektor Ekspresi Protein G subunit α dari Kedelai (Glycine max) Kultivar Slamet. Dibimbing oleh UTUT WIDYASTUTIdan SUHARSONO.
Protein heterotrimerik G terdiri atas tiga subunit yaitu α, , dan . Protein Gα teraktivasi oleh adanya cekaman biotik atau abiotik di luar sel. Protein Gα di duga berperan penting dalam ketahanan tanaman kedelai kultivar Slamet terhadap cekaman aluminium (Al). Untuk mempelajari peran Gα dalam ketahanan tanaman terhadap cekaman Al, gen Gα harus diekspresikan di dalam tanaman transgenik. Untuk itu vektor ekspresi gen Gα harus dikonstruksi. Tujuan penelitian ini adalah untuk merakit vektor ekspresi untuk protein G subunit α dari kedelai kultivar Slamet. Vektor eskpresi pMSH1-Gα telah berhasil dirakit dengan menyisipkan gen Gα yang berukuran 1380 pb ke dalam plasmid pMSH1 yang berukuran 14000 pb dibawah kendali promotor 35S CaMV sehingga, plasmid rekombinan pMSH1-Gα berukuran 15380 pb. Plasmid rekombinan telah berhasil diintroduksikan ke dalam bakteri Escherichia coli galur DH5α.
Kata kunci: Gen Gα, pMSH1, konstruksi, plasmid rekombinan, transformasi
ABSTRACT
RIAN PRATIWI. Construction of expression vector of G protein subunit α of soybean (Glycine maxI) cultivar Slamet. Supervised by UTUT WIDYASTUTIand SUHARSONO.
Heterotrimeric G protein consists of three subunits α, , and . Activation of Gα protein is induced by biotic or abiotic stress. It is supposed that Gα protein has an important role in the Al tolerance in soybean cv. Slamet. To study the role of Gα in the tolerance to Al stress in the plant, the gene encoding for Gα had to be expressed in the transgenic plant. For this reason, the expression vector of this Gα gene has to constructed. So, this research had an objective to construct the expression vector of Gα gene of soybean cv Slamet. The expression vector pMSH1-Gα was succesfully constructed by inserting 1380 bp Gα gene into pMSH1 plasmid under 35S CaMV promoter, so this size of recombinant plasmid is 15380 bp. This recombinant plasmid was succesfully introduce into Escherichia coli DH5α strains.
PERAKITAN VEKTOR EKSPRESI PROTEIN SUBUNIT
α
DARI
KEDELAI (
Glycine max
) KULTIVAR SLAMET
RIAN PRATIWI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
Judul : Perakitan Vektor Ekspresi Protein G Subunit
α
dari Kedelai (
Glycine
max
) Kultivar Slamet
Nama : Rian Pratiwi
NIM :
G34070045
Disetujui
Dr. Ir. Utut Widyastuti, M.Si Prof. Dr. Ir. Suharsono, DEA
Pembimbing I Pembimbing II
Diketahui
Dr. Ir. Ence Darmo Jaya Supena, M.Si
Ketua Departemen Biologi
PRAKATA
Puji dan rasa syukur penulis sampaikan kepada Allah SWT atas segala rahmat dan karunia-Nya yang telah diberikan sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2011 ini ialah Perakitan Vektor Ekspresi Protein G Subunit α dari Kedelai (Glycine max) Kultivar Slamet .
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Utut Widyastuti, M.Si dan Bapak Prof. Dr. Ir. Suharsono, DEA selaku pembimbing yang telah banyak memberi saran selama penelitian dan penulisan laporan karya ilmiah ini. Disamping itu, ucapan terima kasih juga penulis sampaikan kepada Dr. Ir. R. R. Dyah Perwitasari, M.Sc sebagai dosen penguji yang telah memberikan saran dan masukan dalam penulisan karya ilmiah. Penulis mengucapkan terima kasih kepada Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB Darmaga berserta seluruh staf dan karyawan atas sarana dan prasarananya selama penulis melakukan penelitian di Laboratorium BIORIN (Biotechnology Research Indonesia-The Netherland). Penulis mengucapkan terima kasih kepada hibah bersaing XII dengan nomor 317/SP3/PP/DP2M/II/2006 dan proyek KKP3T dengan nomor 635/LB. 620/1.1/2/2009/ atas nama Dr. Ir. Utut Widyastuti, M.Si dan Prof. Dr. Ir Suharsono, DEA.
Penulis juga sampaikan terima kasih kepada Ratna, Pepi, Fajri, Ulung, Muchdar, Mulya, keluarga besar Lab Biorin, dan teman-teman biologi angkatan 44 yang telah membantu selama berlangsungnya kegiatan karya ilmiah. Ucapan terima kasih juga disampaikan kepada orang tua, serta keluarga atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Baru Rambang, Muara Enim pada tanggal 15 Maret 1989 dari ayah Fahrudin dan ibu Nurlina. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2007 penulis lulus dari SMA Negeri 3 Prabumulih dan pada tahun yang sama lulus seleksi masuk IPB melalui Seleksi Penerimaan Mahasiswa Baru IPB. Penulis terpilih masuk Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar pada semester ganjil 2010/2011, semester genap 2010/2011, mata kuliah Genetika Molekuler pada tahun ajaran 2010/2011 dan mata kuliah Genetika Dasar pada tahun ajaran 2011/2012. Penulis aktif sebagai staf Infokom Himpunan Mahasiswa Biologi pada tahun 2010-2011.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ...
ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN Latar Belakang Penelitian... 1
Tujuan Penelitian ... 1
BAHAN DAN METODE Waktu dan Tempat ... 1
Bahan... 1
Metode Penelitian ... 2
Isolasi DNA Plasmid pSL 16... 2
Isolasi Gen Gα dari Plasmid pSL16…... 2
Persiapan Vektor Ekspresi... 2
Ligasi Sisipan dan Vektor Ekspresi... 3
Introduksi Hasil Ligasi ke dalam Bakteri E.coli... 3
HASIL Isolasi Plasmid pSL16 dan Isolasi Gen Gα dari Plasmid pSL16... 3
Persiapan Vektor Ekspresi ... 4
Ligasi Sisipan dan Vektor Ekspresi ... 4
Introduksi Hasil Ligasi ke dalam bakteri E.coli... 4
PEMBAHASAN ... 5
SIMPULAN ... 6
SARAN ... 6
DAFTAR GAMBAR
Halaman
1 Hasil isolasi plasmid pSL16 dan gen Gα ... 4
2 pMSH1 hasil isolasi dan pemotongan dengan enzim restriksi SpeI & XbaI... 4
3 PCR dari hasil ligasi pMSH1 dan Gα ... 4
4 Bakteri yang dibiakan di media LB ... 4
5 Peta fisik daerah T-DNA dari plasmid rekombinan pMSH1-Gα ... 5
DAFTAR LAMPIRAN
Halaman 1 Komposisi media LB cair ditambah antibiotik ... 8
2 Komposisi larutan solution 1... 9
3 Komposisi larutan solution 2... 10
4 Komposisi larutan solution 3... 11
5 Komposisi larutan buffer TAE 1x ... 12
6 Komposisi larutan TFB ... 13
7 Komposisi larutan media 2YT ... 14
1
PENDAHULUAN
Latar Belakang Penelitian
Protein G subunit α merupakan komponen dari protein heterotrimerik G yang mengandung 3 subunit (α, , ) yang diaktivasi oleh sinyal ekstrakseluler (Albert et al. 2002). Pada keadaan tidak aktif protein protein heterotrimerik berada dalam bentuk ikatan GDP (guanosin difosfat) dan akan aktif dengan mengubah GDP ke bentuk GTP (guanosin trifosfat) yang berikatan pada subunit α. GTP subunit α akan terpisah dari subunit dan keduanya akan berinteraksi dengan efektor yang berada di down stream. Penurunan aktivitas GTP-subunit α menjadi GDP-subunit α melalui aktivitas GTPase
menyebabkan pembentukan kembali bentuk heterotrimerik tidak aktif (Kolle 1997).
Kedelai kultivar Slamet diketahui merupakan kedelai toleran terhadap cekaman aluminium (Al) (Anwar 1999). Protein G subunit α pada tanaman kedelai kultivar Slamet telah berhasil diisolasi dan diklon ke dalam plasmid pGEMT dengan nama pSL16 (Suharsono & Suharsono 2004). Kedelai varietas Slamet memiliki satu kopi gen Gα
pada genomnya (Suharsono & Suharsono 2004), sehingga untuk mempelajari fungsi gen ini salah satunya dapat dilakukan dengan men-knockout gen tersebut.
Ion Al3+ merupakan bentuk paling toksik pada tanaman. Cekaman Al pada tanaman dapat menurunkan integritas membran, menginduksi pembentukan peroksidasi lipid dan kalosa sehingga menghambat pertumbuhan perpanjangan akar primer tumbuhan (Yamamoto et al. 2001). Cekaman Al juga dapat menginduksi ekspresi sejumlah gen yang berperan dalam sistem pertahanan tumbuhan. Salah satu gen yang diduga terlibat adalah gen penyandi protein G subunit α.
Keterlibatan protein Gα terhadap toleransi Al telah diketahui dari hasil analisis ekspresi gen pada kultivar Lumut dan Slamet melalui pemberian cekman Al 1,6 mM. Kedelai kultivar Slamet mengalami peningkatan ekspresi gen Gα setelah diberikan perlakuan tersebut dibandingkan dengan kultivar Lumut yang merupakan tanaman peka terhadap Al yang tidak mengalami peningkatan ekspresi gen Gα (Suharsono & Suharsono 2006). Penambahan mastoparan yang merupakan aktivator protein Gα dapat meningkatkan sistem pertahanan tanaman kedelai terhadap cekaman Al melalui pertambahan perpanjangan akar, penurunan kandungan Al,
peroksidasi lipid, dan kalosa serta peningkatan integritas membran (Srimulyati 2007).
Hartini (2008) melakukan pendekatan
reversegenetic dengan menonaktifkan gen Gα melalui irradiasi sinar gamma dan berhasil mendapatkan 10 kandidat mutan. Ciri morfologi mutan gen Gα yaitu tanaman pendek (Fujisawa et al. 1999) dan dengan stomata menutup. Analisis keterlibatan protein Gα pada mekanisme toleransi cekaman Al dilakukan pada mutan kedelai kultivar Slamet yaitu Slm 103 dan Slm 338. Hasil analisis menunjukkan adanya keterlibatan protein Gα pada tanaman yang diberi cekaman Al 1,6 mM, dengan gejala akar pendek dan kerusakan sel di bagian epidermis sampai korteks mutan gen Gα (Giok 2010). Oleh karena itu untuk mempelajari fungsi gen ini lebih lanjut penelitian tanaman transgenik yang mengekspresikan gen ini harus dilakukan. Vektor ekspresi yang membawa gen Gα sangat diperlukan untuk perakitan tanaman transgenik sehingga penelitian untuk mengkonstruksi vektor ekspresi perlu dilakukan.
Tujuan Penelitian
Penelitian ini bertujuan melakukan perakitan vektor ekspresi untuk protein G subunit α dari kedelai kultivar Slamet.
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari - Desember 2011 di Laboratorium BIORIN Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, LPPM IPB.
Bahan
Bahan yang digunakan adalah bakteri
Escherichia coli yang membawa gen Gα pada plasmid pSL16 (Suharsono & Suharsono 2004). Primer SL-F sebagai primer forward
dengan sekuen nukleotidanya sebagai berikut
(5’TCTAGAGCTTCACACTTCACACTTA
A3’) dan SL-R bertindak sebagai primer
reverse dengan sekuen nukleotidanya sebagai berikut (5’ACTAGTATATTGTTG TATA CCTGACCTC3’) yang digunakan untuk mengamplifikasi gen Gα. Plasmid pMSH1 (koleksi Prof. Yokota, NAIST, Japan), digunakan untuk perakitan vektor ekspresi. Primer 35S dengan sekuen nukleotidanya sebagai berikut (5’AAACCTCCTCGGATTC CATT3’) bertindak sebagai primer forward
dan L4 bertindak sebagai primer reverse
dengan sekuen nukleotidanya sebagai berikut
2
(5’CTTAGGACCCACTCAAAAACGTTCC3 ’) digunakan untuk melakukan verifikasi hasil ligasi dan transformasi genetik DH5α. Enzim
XbaI (TCTAGA) dan SpeI (ACTAGT) yang digunakan untuk memotong plasmid pMSH1.
E. coli DH5α digunakan sebagai sel inang
bagi vektor ekspresi.
Metode Penelitian
Isolasi DNA Plasmid pSL16
Metode isolasi DNA plasmid mengikuti metode Suharsono et al. (2002). Sebanyak 100 l biakan bakteri E. coli yang mengandung gen Gα pada plasmidnya dengan kode SL16 disubkultur di dalam 5 ml media
Luria Bertani (LB) cair yang mengandung 50 mg/L ampisilin (Lampiran 1). Bakteri ditumbuhkan selama satu malam pada suhu 37ºC pada kecepatan 250 rpm didalam inkubator bergoyang. Biakan bakteri dipindahkan ke dalam tabung mikro dan disentrifugasi dengan kecepatan 4000 rpm selama 5 menit pada suhu 4ºC. Endapan hasil sentrifugasi ditambahkan 150 l larutan
solution 1 (Lampiran 2) dan dilarutkan kembali. Campuran kemudian ditambahkan 250 l larutan solution 2 (Lampiran 3) untuk melisis sel dan diinkubasi pada suhu ruang selama 5 menit. Campuran tersebut ditambahkan 200 l larutan solution 3 (Lampiran 4) dan diinkubasi di dalam es selama 10 menit. Campuran kemudian disentrifugasi dengan kecepatan 10000 rpm selama 10 menit pada suhu 4ºC sehingga diperoleh supernatan. Supernatan yang diperoleh dipindahkan ke tabung mikro, kemudian ditambahkan larutan 1x volume fenol-klorofrom-isoamilalkohol(PCI)
(25:24:1). Campuran disentrifugasi dengan kecepatan 10000 rpm selama 10 menit pada suhu 4ºC. Supernatan yang diperoleh ditambahi dengan 1 ml alkohol absolut, kemudian diinkubasi di dalam es selama 5 menit. Campuran disentrifugasi dengan kecepatan 10000 rpm selama 10 menit pada suhu 4ºC. Endapan yang merupakan DNA ditambahkan dengan 1 ml alkohol 70 %. Campuran disentrifugasi dengan kecepatan 10000 rpm selama 5 menit pada suhu 4ºC. Endapan DNA yang dihasilkan kemudian dikeringkan dengan pengering kedap udara. DNA plasmid yang berupa endapan dilarutkan kembali dengan menambahkan 10-20 µl ddH2O. DNA plasmid yang sudah larut ditambahkan 0,2 x volume RNAse (1 mg/ml) untuk mendegradasi RNA kemudian diinkubasi pada suhu 37 ºC selama 10 menit dilanjutkan inaktif RNAse selama 10 menit.
Hasil isolasi diketahui dengan elektroforesis agarosa 1% (b/v) menggunakan buffer TAE 1x (Lampiran 5). Langkah-langkah elektroforesis yaitu sebanyak 5 µl dicampur dengan 1 µl 6x loading dye, dimasukan ke dalam gel agarosa 1 % (b/v) dan dimigrasikan menggunakan buffer TAE 1x selama 30 menit dengan tegangan 100 volt. Selanjutnya gel direndam dalam larutan ethidium bromida 0,5 g/ml selama 10 menit, dibilas dengan akuades, kemudian pita DNA dilihat menggunakan UV transluminator dan dikuantifikasi dengan spektrofotometer UV- VIS pada panjang gelombang 260 nm dan 280 nm.
Isolasi Gen Gα dari Plasmid pSL16
Isolasi gen Gα dari plasmid pSL16 dilakukan dengan PCR. PCR dilakukan dengan mencampur 100 ng plasmid sebanyak 1 l sebagai cetakan, 1 l buffer Taq 10x, 0,2 l dNTP 10 mM, 10 pmol primer SL-F , 10 pmol primer SL-R, 1 unit enzim Taq Polymerase dan ddH2O sampai volume akhir 10 l. Kondisi PCR yang digunakan adalah pra-PCR 95ºC selama 5 menit, denaturasi 94ºC selama 30 detik, penempelan primer 54 ºC selama 45 detik, pemanjangan 72ºC selama 1 menit dengan 34 siklus, pasca PCR 72 ºC selama 5 menit, dan pendinginan pada suhu 20 ºC selama 15 menit. Hasil PCR diperiksa dengan elektroforesis untuk itu sebanyak 5 µl hasil PCR dicampur dengan 1 µl 6x loading dye, dimasukkan ke dalam gel agarosa 1 % (b/v) dan dimigrasikan menggunakan buffer TAE 1x selama 30 menit dengan tegangan 100 volt. Selanjutnya gel direndam dalam larutan ethidium bromida 0,5 g/ml selama 10 menit, dibilas dengan akuades, kemudian pita dilihat menggunakan UV transluminator dan dielusi menggunakan Gel/PCR DNA fragment Extraction kit (Geneaid).
Persiapan Vektor Ekspresi
3
diinkubasi pada suhu 37 ºC selama satu malam (Sambrook 1989).
Ligasi Sisipan dan Vektor Ekpresi
DNA gen Gα hasil PCR diligasikan pada vektor ekspresi pMSH1. Proses ligasi menggunakan enzim ligase yaitu T4 DNA ligase. Proses ligasi dilakukan selama satu malam pada suhu 4 ºC mengikuti metode Promega 1999 (Frackman & Kephart 1999) untuk itu sebanyak 2 l (11, 866 ng) gen Gα dicampur dengan 5 l (33, 565 ng) vektor pMSH1, 1,5 l ddH2O, 5 l buffer ligasi (5x) dan 0,5 l (1,5 U) enzim ligasi T4 DNA ligase.
Hasil ligasi diverifikasi keberhasilannya dengan PCR mengunakan primer spesifik 35S dan L4. PCR dilakukan dengan mencampur 1 l plasmid rekombinan sebagai cetakan, 1 l buffer Taq 10x, 0,2 l dNTP 10 mM, 0,25 l primer 35S 10 pmol, 0,25 l primer L4 10 pmol, 1 unit enzim Taq Polymerase dan 7,2 l ddH2O dengan volume akhir mencapai 10 l. Kondisi PCR yang digunakan adalah pra-PCR 95ºC selama 5 menit, denaturasi 94ºC selama 30 detik, penempelan primer 54 ºC selama 45 detik, pemanjangan 72ºC selama 1 menit dengan 34 siklus, pasca PCR 72 ºC selama 5 menit, dan pendinginan pada suhu 20 ºC selama 15 menit. Hasil PCR sebanyak 5 µl dicampur dengan1 µl 6x loading dye, dimasukan ke dalam gel agarosa 1 % (b/v) dan dimigrasikan menggunakan buffer TAE selama 30 menit dengan tegangan 100 volt. Selanjutnya gel direndam dalam larutan ethidium bromida 0,5 g/ml selama 10 menit, dibilas dengan akuades, kemudian pita DNA dilihat menggunakan UV transluminator
Introduksi Hasil Ligasi ke dalam Bakteri
E.coli
Hasil ligasi antara plasmid pMSH1 dan gen Gα diintroduksikan ke dalam bakteri
E.coli galur DH5α. Bakteri tersebut terlebih dahulu dibuat kompeten mengikuti metode Suharsono et al. (2002). Bakteri DH5α
diambil dari koloni tunggal, dibiakkan di dalam media LB cair sebanyak 2 ml selama satu malam pada suhu 37 ºC dengan kecepatan 250 rpm dalam inkubator bergoyang. Sebanyak100 l bakteri disubkultur di dalam media LB cair 10 ml selama 2,5 jam sampai OD 0,4-0,6 yang diukur pada panjang gelombang 660 nm. Selanjutnya bakteri diinkubasi dalam es selama 5 menit, kemudian dipindahkan ke tabung mikro dan disentrifugasi pada kecepatan 5000 rpm selama 10 menit pada
suhu 4 ºC. Endapan ditambah dengan 495 l larutan TFB (Lampiran 6) dan dilarutkan kembali. Suspensi bakteri diinkubasi di dalam es selama 10 menit kemudian disentrifugasi pada kecepatan 5000 rpm selama 10 menit pada suhu 4 ºC. Endapan ditambah dengan 125 l larutan buffer transformasi (TFB) dan 8,8 l DMSO (dimetil sulfoksida) kemudian diinkubasi di dalam es dan sel kompeten siap digunakan.
Bakteri kompeten sebanyak 50 l ditambah dengan 10 l hasil ligasi kemudian diinkubasi selama 30 menit di dalam es. Campuran diberi perlakuan kejut panas selama 45 detik pada suhu 42 ºC kemudian diinkubasi di dalam es selama 5 menit. Sebanyak 100 l media 2YT (Lampiran 7) ditambahkan pada campuran lalu diinkubasi selama 30 menit pada suhu 37 ºC pada kecepatan 250 rpm dalam inkubator bergoyang. Selanjutnya bakteri tersebut disebar pada media LB padat yang mengandung antibiotik 50 mg/L higromisin dan 50 mg/L kanamisin (Lampiran 8) sebagai verifikasi hasil transformasi E.coli DH5α.
HASIL
Isolasi Plasmid pSL 16 dan Isolasi gen Gα
dari Plasmid pSL16
Proses isolasi mengikuti metode Suharsono et al. (2002) dengan cara lisis alkalin. Plasmid pSL16 berhasil diisolasi dari bakteri E.coli. Elektroforesis DNA plasmid pSL16 menghasilkan 3 pita yang bervariasi berdasarkan topologi plasmid (Gambar 1A2). Berdasarkan hasil kuantifikasi menggunakan spektrofotometer UV-VIS, konsentrasi DNA plasmid yang diperoleh adalah 5,933 ng/ l. Berdasarkan spektrofotometri kualitas DNA yang diisolasi adalah baik yang ditunjukkan dengan perbandingan nilai absorbansi pada panjang gelombang 260 nm dan 280 nm adalah 1,8.
Hasil isolasi berupa plasmid yang mengandung gen Gα dijadikan cetakan untuk mengisolasi gen Gα menggunakan PCR yang sudah ditambahkan situs pemotongan enzim
XbaI dan SpeI. Primer yang didesain dengan penambahan situs pemotongan enzim XbaI bertindak sebagai primer forward. Primer yang bertindak sebagai primer reverse adalah primer yang sudah ditambahkan situs pemotongan enzim SpeI. Hasil PCR menghasilkan 1 fragmen yang berukuran 1380 pb yang kemudian dielusi menggunakan
Gel/PCR DNA fragment Extraction kit
(Geneaid) (Gambar 1B)
Gambar 1 H
[image:13.595.400.489.115.247.2] [image:13.595.323.514.481.653.2]Persiapan V Vektor berhasil dii elekroforesi yang me Berdasarkan DNA yang konsentrasi isolasi kem enzim restrik
Gambar 2
Ligasi Sisip
Proses li vektor ekspr
T4 DNA lig
malam. Has menggunaka merupakan L4 merupak
1 2
A
Hasil isolasi Gen Gα. (A) isolasi, (1) p plasmid pSL hasil PCR m SL-F dann SL
Vektor Ekspr
berupa plas isolasi dari b
s menunjukk erupakan n hasil spektr g diisolasi 6,713 ng/ l. mudian dipo
ksi XbaI dan S
2 pMSH1 pemotongan restriksi S
pMSH1 pMSH1dipo dan XbaI , Plus DNA l
pan dan Vekt
igasi antara si resi pMSH1
gase dan diin sil ligasi kemu an primer sp bagian dari p kan bagian te
1000 pb
1 1650 pb
2
plasmid pSL ) Plasmid SL penanda 50
16, (B) Fragm menggunakan
L-R
resi
smid pMSH1 bakteri E.coli
kan adanya d plasmid p rofotometer U
berkualitas Vektor pMSH otong mengg
SpeI (Gamba
hasil isolas n dengan
SpeI & Xba
utuh, otong denga (3) DNA mar ladder
or Ekspresi
sipan gen Gα menggunakan nkubasi selam udian di PCR
pesifik 35S-F promotor pM engah gen Gα
B 12000 p 3 L16 dan 16 hasil ng, (2) men Gα
primer
1 telah
i. Hasil dua pita pMSH1. UV-VIS dengan H1 hasil gunakan ar 2). si dan enzim
aI. (1) (2) an SpeI rker 1kb dengan n enzim ma satu dengan F yang SH dan
α. Hasil j
pb 1380 pb
amplifikasi berukuran 12
Gambar 3 PC
Gα
Gα
Introduksi H
E.coli
Hasil liga bakteri E.coli
telah dibiakk mengandung dan 50 mg/L
Coli yang m koloni bakter ini. Bakteri juga tumbuh sedangkan b ditransformas mengandung
Gambar 4 Ba m di ba m an m a menghasilka 95pb (Gamba
CR dari hasil
α. (1) DNA m
α dengan prim
Hasil Ligasi
si telah diintro
i galur DH5α kan di medi
antibiotik 50 L kanamisin u
mengandung ri E. coli tumb
kompeten y h pada medi bakteri komp si tidak tumbu
antibiotik (Ga
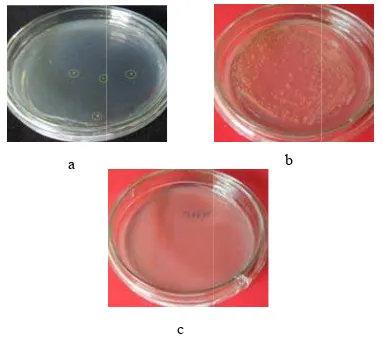
akteri E. Coli
edia LB. transformasi d akteri yang edia yang t ntibiotik (c) s engandung an 1 2
c
an satu fr ar 3).
ligasi pMSH marker (2) Fr mer 35S-F dan
ke dalam B
oduksikan ke dan E. Coli te ia LB padat
0 mg/L higro untuk menyele plasmid. Beb buh di media s yang ditransfo ia tanpa ant mpeten yang
uh pada media ambar 4).
i yang dibiak (a) bakteri di media selek
ditransforma tidak menga sel kompeten ntibiotik 1295 pb b 2 4 agmen H1 dan agmen n L4 Bakteri dalam ersebut t yang omisin eksi E.
berapa seleksi formasi tibiotik tidak a yang kkan di yang ksi ( b) asi ke andung n yang
Fragmen dengan pena restriksi Xba
melalui PCR enzim ini d dapat disisi pMSH1 pad untuk ekspre DNA ve dipergunaka memperbany dibawanya sering digun merupakan yang diwar 1989). Kar memiliki or
pengklonan Vektor pM menyandika antibiotik menyandika antibiotik k digunakan 1996).
Vektor p dipotong d menghasilka kurang lebih utuh yang linier karen (multiple cl
beberapa pa Vektor disisipi oleh Proses ligas
T4 DNA li
sudah tersisi dan daerah gen tersebut menggunaka yang didesa pMSH1 da berukuran 1
G
PEMBAH
n gen Gα tel ambahan situ
aI dan SpeI p R. Penambah dilakukan ag ipkan ke dal da posisi dan
esi. ektor adalah an untuk yak fragm (Lehninger nakan adalah materi genet riskan secar akteristik uta
rigin of repli
dan penanda MSH1 memba an enzim k higromisin an enzim k
kanamisin. K sebagai mar
pMSH1 yang dengan enzim an satu pita h 14000 pb leb
tidak dipoton na pemotongan
loning site) asang basa saja
pMSH1 yan h gen Gα m si menggunak
igase. Pembu ipi adalah den vektor yang t. Amplifikas an primer spe ain dari seku an Gα men 1295 pb. Frag
Gambar 5 Peta
HASAN
lah berhasil d us pemotongan pada kedua uj an situs pemo ar fragmen g lam vektor e orientasi yan molekul DN membawa men DNA 1994). Vekto plasmid bakte tik ekstra kro a tetap (Sa ama plasmid
ication, adany seleksi (Dale awa gen hp
ketahanan t dan gen ketahanan t Kedua gen rker seleksi
g telah diisol m XbaI dan
saja yang be bih kecil dari p ng. Plasmid m
n pada daera terjadi pengu a.
ng telah te melalui prores kan suatu liga uktian bahwa ngan mengiso g berdekatan si DNA denga esifik 35S-F uen vektor e nghasilkan f gmen tersebut a fisik daerah
diisolasi n enzim jungnya otongan gen Gα
ekspresi ng benar A yang dan yang or yang eri yang omosom ambrook adalah ya situs e 1995).
pt yang terhadap n npt
terhadap tersebut (Brown
lasi dan n SpeI erukuran pMSH1 menjadi ah MCS urangan erpotong s ligasi. se yaitu a vektor olasi gen dengan an PCR dan L4 ekspresi fragmen berasal p p
T-DNA dari p
dari amplifik (Cauliflower
363 pb yang t L4 yang terl tengah gen sehingga sec berukuran 12 Adanya bahwa vekt mengandung
SpeI. Ligas menghasilkan Gα yang beru penjumlahan 14000 pb d (Gambar 5).
Plasmid r diintroduksik DH5α. Bakte seleksi beru mengandung dan 50 mg/ koloni bakte seleksi m transformasi tersebut men mengandung mengandung mengandung
Gen np phosphotransf
antibiotik kan beracun. E mendetoksifik melalui fosfo Bakteri yang dapat tumbu tidak memilik gen yang phosfotransfe mendetoksifik Bakteri di tumbuh deng seleksi (Gam bahwa selam
Coli tidak plasmid rekom
kasi ujung pro
mosaic viru
terdapat pada letak pada ek
Gα yang b cara keseluru 95 pb. fragmen ters tor ekspresi gen Gα pa si pMSH1 n plasmid rek ukuran 15380
ukuran dar dan fragmen ekombinan ha kan ke dalam
eri tersebut tu upa media antibiotik 50 /L kanamisin eri yang tum
enunjukkan telah berh ngandung plas gen hpt dan
gen Gα m gen Gα.
ptII menya
sferase yang d namisin sehin Ekspresi g kasi senyaw forilasi (Chris
tidak mengan uh pada med ki gen nptII. G
menyand
erase
kasi antibiotik itransformasi gan baik di mbar 4). Hal ma proses tran mengalami mbinan pMSH
omoter 35S C
us) yang beru pMSH1 dan kson ke 10 b berukuran 93
uhan fragme sebut menunj i pMSH1 da situs Xba
dan gen kombinan pM
pb yang meru ri vektor pM
gen Gα 13 asil ligasi kem
bakteri E.coli
umbuh pada LB padat 0 mg/L higro n. Adanya k mbuh pada
bahwa hasil dan b
smid pMSH1 n npt II baik
maupun yang andikan ne
dapat mendeg ngga menjadi gen ini wa aminoglu
stou et al. ndung pMSH1 dia tersebut k Gen hpt meru ikan hygr
yang k higromisin.
dengan pMSH media tanpa l ini menunj nsformasi bak kerusakan H1-Gα 5 CaMV ukuran daerah bagian 32 pb, en ini jukkan sudah
aI dan n Gα
MSH1-upakan
MSH1 80 pb mudian
i galur media yang omisin koloni-media proses bakteri 1 yang k yang tidak omisin gradasi i tidak akan ukosida 1991). 1 tidak karena upakan omisin dapat H1-Gα a agen jukkan kteri E.
atau
kematian, selain itu bakteri ini digunakan untuk melihat kondisi sel kompeten. Adanya koloni yang tumbuh menunjukkan bakteri kompeten tersebut tidak mengalami kematian. Sedangkan bakteri kompeten tidak dapat hidup di media yang mengandung agen seleksi (Gambar 4c), menunjukkan bahwa agen seleksi berfungsi dengan baik. Gen hpt
dan npt II selain untuk seleksi E. coli yang mengandung plasmid pMSH1 juga digunakan untuk seleksi di dalam sel tanaman. Gen penanda seleksi ini digunakan untuk memudahkan seleksi sel atau jaringan yang tertransformasi (Stisklen 1991).
SIMPULAN
Vektor ekspresi rekombinan telah berhasil dikonstruksi dan dintroduksikan ke dalam bakteri E.coli galur DH5α. Bakteri yang diduga mengandung plasmid rekombinan pMSH1-Gα berhasil ditumbuhkan pada media seleksi yang mengandung antibiotik kanamisin dan higromisin.
SARAN
Koloni yang tumbuh di media seleksi perlu dianalisis dengan PCR, dengan menggunakan primer 35S dan L4 untuk mendapatkan bakteri yang mengandung plasmid rekombinan pMSH1-Gα.
DAFTAR PUSTAKA
Alberst et al. 2002. Molecular Biology of The Cell. New York: Garlan Science.
Anwar S. 1999. Pengklonan gen-gen yang diinduksi oleh aluminium pada kedelai (Glycine max (L). Merril) [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Brown TA. 1996. Genetic a Molecular Approach. India: Routledge Chapman & Hall.
Christou P, Ford TL, Kofron M. 1991. Production of transgenic rice (Oryza sativa
L) plants from agronomically important indica and japonica into immature zygotic embryos. Biotechnol 9: 957-966.
Dale JW.1995. Application of in Vitro Genetics. Di dalam: Willey, Sons, editor.
Molecular Genetic of Bactreia. 2nd edition. Jhon Willey & Sons. New York, hlm 229-232.
Frackman S, Kephart. 1999. Rapid Ligation for the pGEM®-T and pGEM®-T Easy Vector Systems. Promega notes 71: 1-8.
Fujisawa Y et al.1999. Suppression of the heterotrimeric G protein causes abnormal morphology, including dwarfism, in rice.
Proc Natl Acad Sci 96: 7575-7580.
Giok G. 2010. Studi anatomi dan histokimia pada akar kedelai (Glycine max (L). Merril) kandidat mutan protein Gα terhadap cekaman alumunium [skripsi]. Bogor: Fakultas Ilmu Pengetahuan Alam dan Matematika, Institut Pertanian Bogor. Hartini S. 2008. Induksi mutasi dengan
irradiasi sinar gamma pada kedelai (Glycine max (L). Merril) kultivar Slamet dan Lumut [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor. Kolle RM. 1997. A new family of G-protein
regulator-the RGS proteins. Cell Biol
9:143-147.
Lehninger. 1994. Dasar-Dasar Biokimia. Maggy Thenawijaya, penerjemah. Jakarta: Erlangga. Terjemahan dari: Fundamental of Biochemstry.
Sambrook J, Fritsch EK, Maniatis T. 1989.
Molecular Cloning: A laboratory Manual. New York: Cold Spring Harbor Laboratory Pr.
Sticklen MB. 1991. Direct somatic embryogenesis and fertile plants from rice root cultures. Plant Physiol 138:557-580 Srimulyati T. 2007. Keterlibatan protein
heterotrimerik Gα terhadap cekaman aluminium pada kedelai (Glycine max (L). Merril) melalui studi histokimia [skripsi]. Bogor: Fakultas Ilmu Pengetahuan Alam dan Matematika, Institut Pertanian Bogor. Suharsono et al. 2002. The heterotrimeric G
protein α subunit act upstream of the small GTPase Rac in disease resistance of rice.
Proc Natl Acad Sci 99 20: 13307-13312. Suharsono UW, Suharsono S. 2004. Analisis
gen penyandi protein heterotrimetrik G subunit α yang terlibat dalam sistem toleransi tanaman kedelai terhadap cekaman alumunium. Laporan Penelitian Hibah Bersaing tahun ke-I. Bogor: Institut Pertanian Bogor.
Suharsono UW, Suharsono S. 2006. Analisis gen penyandi protein heterotrimerik G subunit α yang terlibat dalam sistem toleransi tanaman kedelai terhadap cekaman aluminium. Laporan Akhir Penelitian Hibah Bersaing XII. Bogor: Institut Pertanian Bogor.
8
Lampiran 1 Komposisi media LB cair ditambah antibiotik Media LB:
Bacto Trypton : 10 g/L Bacto Yeast : 5 g/L NaCl : 10 g/L Antibiotik:
Antibiotik higromisin : 50 mg/L Antibiotik kanamisin : 50 mg/L
atau
9
10
Lampiran 3 Komposisi larutan solution 2 NaOH 200mM
11
12
13
Lampiran 6 Komposisi larutan TFB
MES pH 6,3 : 10 mM
CaCl2. 2H2O : 10 mM
[Co(NH3)6]Cl3 : 3 mM
KCL : 100 mM
Gliserol : 10 %
14
Lampiran 7 Komposisi media 2YT Bacto Trypton : 16 g/L Yeast ekstrak : 5 g/L
NaCl : 5 g/L
15
Lampiran 8 Komposisi media LB padat ditambah antibiotik Media LB:
Bacto Trypton : 10 g/L Bacto Yeast : 5 g/L NaCl : 10 g/L Bacto Agar : 25 g/L Akuades steril : 1L Antibiotik: