KONSTRUKSI PROMOTOR SPESIFIK AKAR KELAPA
SAWIT DENGAN MENGGUNAKAN METODE GATEWAY
RENDI PALAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis dengan judul Konstruksi Promotor Spesifik Akar Kelapa Sawit dengan Menggunakan Metode Gateway adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor , July 2011
ABSTRACT
RENDI PALAR.
Specific Promoters Root Construction of Oil Palm by Using Method of Gateway. Under direction of MARIA BINTANG and TETTYCHAIDAMSARY
Palm oil is one of the popular industrial product in the world today. With the growing number of new land-clearing case, was also attended by various production constraints such as diseases and pests that attack that caused the failure of production to the death of oil palm itself. Ganoderma is one of the pathogens that attack the disease of oil palm. It is well known proteins such as chitinase, glucanase, and stilbene synthetase are proteins that can inhibit the growth of Ganoderma. This study aims to construct a specific promoter (PSA) on the roots of oil palm to be able to express all three proteins earlier. Verification PSA oil palm has been tested using promoter prediction software and showed positive results
RINGKASAN
RENDI PALAR. Konstruksi Promotor Spesifik Akar Kelapa Sawit
dengan Menggunakan Metode Gateway. Dibimbing oleh MARIA
BINTANG dan TETTY CHAIDAMSARY
Kelapa sawit (Elaeis) adalah tumbuhan industri penting penghasil minyak masak, minyak industri, maupun bahan bakar (biodiesel). Perkebunan kelapa sawit menghasilkan keuntungan yang sangat besar sehingga banyak hutan dan perkebunan lama dikonversi menjadi perkebunan kelapa sawit. Di Indonesia penyebarannya di daerah Aceh, pantai timur Sumatra, Jawa, dan Sulawesi.
Berdasarkan data tahun 2006, Indonesia telah menjadi negara penghasil CPO (crude palm oil) terbesar di dunia dengan total produksi sekitar 16 juta ton. Sementara negara tetangga kita Malaysia yang selama ini berada pada posisi no.1, saat ini berada pada posisi ke-2 dengan total produksi sebesar 15.8 juta ton. Boleh dibilang, industri kelapa sawit ini dapat diharapkan menjadi motor pertumbuhan ekonomi nasional.
Di balik prestasi di atas, sederet permasalahan masih membelit industri ini. Agaknya, jika sebahagian permasalahan saja bisa diatasi, Indonesia akan mampu memperoleh devisa jauh lebih besar daripada yang dapat kita nikmati saat ini. Salah satu permasalahan utamanya adalah masih rendahnya muatan teknologi yang mampu diterapkan, sehingga mayoritas devisa dari industri ini berasal dari industri hulunya. Teknologi yang perlu dikembangkan yaitu teknologi produksi tanaman tersebut, salah satunya adalah teknik dalam penanggulangan penyakit yang efektif, misalnya jamur.
Jamur yang dikenal dengan nama Ganoderma bersifat patogenik terhadap tanaman kelapa sawit. Ganoderma adalah cendawan patogen. Serangannya dapat mengakibatkan pembusukan pada pangkal batang kelapa sakit. Oleh karena itulah disebut busuk pangkal batang (BPB). Jika pangkalnya busuk maka tanaman akan mati dan tumbang. Sementara ini hanya Ganoderma yang bisa menumbangkan pohon kelapa sakit dewasa. Karena ukurannya yang besar, Ganoderma tak ubahnya sebagai monster yang hidup di bawah permukaan tanah dan memakan setiap tanaman kelapa sawit baik yang masih muda maupun yang sudah tua (Darmono 2010).
Pengembangan teknologi terus dilakukan untuk memberantas hama penyakit kelapa sawit yang disebabkan oleh jamur Ganoderma ini. Penelitian ini diarahkan untuk meneliti promotor spesifik akar (PSA) kelapa sawit. Dengan adanya promotor spesifik akar diharapkan nanti gen-gen penghasil protein penghambat pertumbuhan Ganoderma ini terekspresikan sehingga dapat membuat kelapa sawit tahan terhadap hama jamur Ganoderma.
Gejala dini penyakit busuk pangkal batang kelapa sawit sukar dideteksi karena perkembangannya sangat lambat. Pada pangkal batang atau bagian tengah tanaman kelapa sawit mengalami pembusukan yang kadang-kadang diikuti tumbuhnya tubuh buah Ganoderma. Tetapi tidak semua tanaman bergejala menghasilkan tubuh buah, bahkan tidak ada gejala sedikitpun.
Penyebab penyakit busuk pangkal batang kelapa sawit di Indonesia adalah jamur Ganoderma boninense. Penularan penyakit ini sebagian besar melalui mekanisme kontak akar sawit sakit dan sangat kecil melalui basidiospora.
Primer spesifik didesain untuk mendapatkan promotor dari suatu gen. Primer spesifik ini didesain berdasarkan sekuen DNA target. Selain berdasarkan urutan DNA target, primer juga didesain sesuai vektor dan teknologi yang di gunakan. Dalam penelitian ini digunakan beberapa primer seperti M13 dan primer khusus gateway. M13 digunakan karena plasmid yang digunakan yaitu TOPO 2.1 (Shuman, 1991; Shuman, 1994) mempunyai sekuen M13 yang komplemen baik reverse dan forward. Primer khusus gateway dibuat menurut aturannya. Pembuatan primer gateway dalam penelitian ini memperhatikan sekuen att yang ditambahakan pada urutan DNA primer, dan urutan 4 basa guanin (GGGG) sebelum situs att.
Dari hasil sekuen terbaca DNA target memiliki 809 bp. Kemudian digunakan software bioinformatik untuk menentukan DNA target sebagai promotor. Software yang digunakan yaitu TSSP (transcription start positions predicts) dan NSITE (number site transcription elements) dari Softberry inc, serta software modENCODE Consortium yaitu Neural Network Promoter Prediction. Pemeriksaan data ditemukan motif promotor dari 23 spesies pada pemeriksaan pada 1816 element regulatory dari berbagai spesies.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi
KONSTRUKSI PROMOTOR SPESIFIK AKAR KELAPA
SAWIT DENGAN MENGGUNAKAN METODE GATEWAY
RENDI PALAR
Tesis
sebagai salah satu syarat memperoleh gelar Master Sains pada
Departemen Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul : Konstruksi Promotor Spesifik Akar Kelapa Sawit dengan Menggunakan Metode Gateway
Nama : Rendi Palar NIM : G851080021
Disetujui Komisi Pembimbing
Diketahui
Tanggal Ujian: 26 Juli2011 Tanggal Lulus : Prof Dr. drh. Maria Bintang,MSc
Ketua
Dr. Tetty Chaidamsari, M.Si. Anggota
Ketua Program Studi Biokimia
Prof Dr. drh. Maria Bintang,M.Sc
Dekan Sekolah Pascasarjana
RIWAYAT HIDUP
Penulis dilahirkan di Manado pada tanggal 3 November 1981 dari ayah Viktor Palar dan ibu Mieke Kilapong. Penulis merupakan putra kedua dari dua bersaudara.
PRAKATA
Dengan penuh syukur yang besar penulis panjatkan kehadirat Tuhan Allah YME atas segala limpahan dan karunia-Nya sehingga penulis dapat menyelesaikan tesis ini. Penulis menyampaikan terima kasih kepada semua pihak yang telah membantu dalam penyusunan tesis ini secara langsung maupun tidak langsung. Ucapan terima kasih penulis sampaikan kepada Prof Dr. drh. Maria Bintang,MSc sebagai pembimbing pertama dan Dr. Tetty Chaidamsari, M.Si sebagai pembimbing kedua pada Balai Penelitian Bioteknologi Perkebunan Indonesia. Juga kepada Papa-san, Mama, oma dan saudara-saudaraku atas segala perhatian, doa, dan kasih sayang serta motivasinya. Serta rekan-rekan se-asrama mahasiswa Sam Ratulangi di Bogor atas segala dorongan dan semangatnya.
Penulis menyadari berbagai kekurangan dalam tesis ini. Oleh karena itu, penulis mengharapkan saran dan kritik membangun yang diharapkan dapat berguna dalam pengembangan tesis ini. Semoga tesis ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Juli 2011
DAFTAR ISI
Penyakit Busuk Pangkal Batang Kelapa Sawit ... 8
Desain Primer untuk Gateway ... 11
Kloning PSA dengan menggunakan TOPO 2.1... 29
Metode Gateway... 32
Konfirmasi DNA target sebagai promotor ... 33
KESIMPULAN DAN SARAN ... 41
DAFTAR PUSTAKA ... 43
DAFTAR GAMBAR
Halaman
Gambar 1. Kelapa sawit Afrika (Elaeis guineensis) ... 4
Gambar 2. Mekanisme dan penyebaran Ganoderma boninense ... 9
Gambar 3. Ganodermaboninense ... 10
Gambar 4. Transfer DNA teknologi Gateway ke berbagai sistem vektor ... 12
Gambar 5. Reaksi BP ... 15
Gambar 6. Reaksi LR ... 15
Gambar 7. Reaksi BP menghasilkan entry clone ... 17
Gambar 8. Alat pengatur suhu reaksi pada teknik PCR ... 21
Gambar 9. Skematik siklus PCR. ... 22
Gambar 10. Hasil elektroforesis Plasmid PSA ... 30
Gambar 11. Letak primer M13 pada vektor TOPO 2.1 ... 31
Gambar 12. Hasil elektroforesis koloni PSA (TOPO 2.1) ... 31
Gambar 13. Hasil elektroforesis elusi PSA ... 32
Gambar 14. Hasil Elektroforesis amplifikasi primer gateway ... 32
Gambar 15. Hasil elektroforesis purifikasi PSA ... 33
DAFTAR TABEL
Halaman 1 Data dari kejadian busuk pangkal batang kelapa sawit di Sumatra Utara .... 112 Jalur lysogenic dan lytic ... 14
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis) adalah tumbuhan industri penting penghasil minyak masak, minyak industri, maupun bahan bakar (biodiesel). Perkebunan kelapa sawit menghasilkan keuntungan yang sangat besar sehingga banyak hutan dan perkebunan lama dikonversi menjadi perkebunan kelapa sawit. Di Indonesia penyebarannya di daerah Aceh, pantai timur Sumatra, Jawa, dan Sulawesi (Lötschert 1983
Berdasarkan data tahun 2006, Indonesia telah menjadi negara penghasil CPO (crude palm oil) terbesar di dunia dengan total produksi sekitar 16 juta ton. Sementara negara tetangga kita Malaysia yang selama ini berada pada posisi no.1, saat ini berada pada posisi ke-2 dengan total produksi sebesar 15.8 juta ton (berkas pidato sambutan kepala BPP Teknologi & berkas sambutan menteri perindustrian RI, BPPT 2007). Yang menarik dari data ini adalah, ternyata Indonesia mampu menjadi negara penghasil CPO nomor 1 di dunia 4 tahun lebih cepat dari prediksi sebelumnya, di mana Indonesia diperkirakan baru akan menjadi produsen CPO terbesar di dunia pada tahun 2010 (berkas pidato menteri riset dan teknologi, presentasi deputi kepala BPPT bidang teknologi informasi, industri dan material, BPPT 2007).
).
Dengan besarnya produksi CPO yang mampu dihasilkan, tentunya hal ini berdampak positif bagi perekenomian Indonesia, baik dari segi kontribusinya terhadap pendapatan negara, maupun besarnya tenaga kerja yang terserap di sektor industri ini yang mencapai 8.5 juta orang. Sektor ini juga mampu meningkatkan taraf hidup masyarakat di sekitar perkebunan sawit, di mana presentase penduduk miskin di areal ini kurang dari 6%, jauh lebih rendah dari angka penduduk miskin nasional sebesar 17% (berkas sambutan menteri negara riset dan teknologi, BPPT 2007). Boleh dibilang, industri kelapa sawit ini dapat diharapkan menjadi motor pertumbuhan ekonomi nasional.
yang mampu diterapkan, sehingga mayoritas devisa dari industri ini berasal dari industri hulunya. Teknologi yang perlu dikembangkan yaitu teknologi produksi tanaman tersebut, salah satunya adalah teknik dalam penanggulangan penyakit yang efektif, misalnya jamur.
Jamur yang dikenal dengan nama Ganoderma bersifat patogenik terhadap tanaman kelapa sawit. Ganoderma adalah cendawan patogen. Serangannya dapat mengakibatkan pembusukan pada pangkal batang kelapa sakit. Oleh karena itu disebut busuk pangkal batang (BPB). Jika pangkalnya busuk maka tanaman akan mati dan tumbang. Sementara ini hanya Ganoderma yang bisa menumbangkan pohon kelapa sakit dewasa. Karena ukurannya yang besar, Ganoderma tak ubahnya sebagai monster yang hidup di bawah permukaan tanah dan memakan setiap tanaman kelapa sawit baik yang masih muda maupun yang sudah tua (Darmono 2010).
Pengembangan teknologi terus dilakukan untuk memberantas hama penyakit kelapa sawit yang disebabkan oleh jamur Ganoderma ini. Penelitian ini diarahkan untuk meneliti promotor spesifik akar (PSA) kelapa sawit. Dengan adanya promotor spesifik akar diharapkan nanti gen-gen penghasil protein penghambat pertumbuhan Ganoderma ini terekspresikan sehingga dapat membuat kelapa sawit tahan terhadap hama jamur Ganoderma.
Rumusan Masalah
Berdasarkan latar belakang di atas maka didapat beberapa masalah yang memerlukan pengkajian khusus. Masalah-masalah itu adalah :
1. Penanganan penyakit yang disebabkan oleh jamur Ganoderma pada kelapa sawit belum bisa diatasi sampai sekarang secara efisien.
2. Perlu didapatkan terlebih dahulu suatu promotor spesifik dalam rangka untuk mengekspresikan gen-gen penghambat pertumbuhan Ganoderma ini.
3. Upaya rekombinasi PSA pada kelapa sawit belum pernah dilakukan. Tujuan Penelitian
Hipotesis
Hipotesis pada penelitian ini adalah plasmid rekombinan yang membawa DNA PSA dapat dikonstruksi dan disisipkan pada vektor ekspresi dengan metode Gateway.
Manfaat Penelitian
Setelah diketahui dan dapat di klon DNA PSA kelapa sawit dan dapat ditransferkan ke Agrobacterium, maka hal ini akan dapat membuka peluang untuk menyusun protein penghambat atau mekanisme serupa pada akar kelapa sawit yang merupakan media jangkit dari jamur Ganoderma ini, sehingga kelapa sawit bisa tahan serangan penyakit yang disebabkan oleh jamur Ganoderma ini.
Waktu dan Tempat Penelitian
TINJAUAN PUSTAKA
Kelapa Sawit (Elaeis guineensis)
Kelapa sawit berbentuk pohon. Tingginya dapat mencapai 24 meter. Akar serabut tanaman kelapa sawit mengarah ke bawah dan samping. Selain itu juga terdapat beberapa akar napas yang tumbuh mengarah ke samping atas.
Gambar 1. Kelapa sawit Afrika (Elaeis guineensis)
Seperti jenis palma lainnya, daunnya tersusun majemuk menyirip. Daun berwarna hijau tua dan pelepah berwarna sedikit lebih muda. Penampilannya agak mirip dengan tanaman salak, hanya saja dengan duri yang tidak terlalu keras dan tajam. Batang tanaman diselimuti bekas pelepah hingga umur 12 tahun. Setelah umur 12 tahun pelapah yang mengering akan terlepas sehingga penampilan menjadi mirip dengan kelapa. Tanaman Kelapa Sawit (Elaeis gunensis) termasuk kedalam Family Arecaceae, Ordo Arecales, dan Genus Elaeis.
jarang terjadi penyerbukan sendiri. Bunga jantan memiliki bentuk lancip dan panjang sementara bunga betina terlihat lebih besar dan mekar.
Buah sawit mempunyai warna bervariasi dari hitam, ungu, hingga merah tergantung bibit yang digunakan. Buah bergerombol dalam tandan yang muncul dari tiap pelapah.
Minyak dihasilkan oleh buah. Kandungan minyak bertambah sesuai kematangan buah. Setelah melewati fase matang, kandungan asam lemak bebas (FFA, free fatty acid) akan meningkat dan buah akan rontok dengan sendirinya.
Buah terdiri dari tiga lapisan:
Eksoskarp, bagian kulit buah berwarna kemerahan dan licin.
Mesoskarp, serabut buah
Endoskarp, cangkang pelindung inti
Inti sawit (kernel, yang sebetulnya adalah biji) merupakan endosperma dan embrio dengan kandungan minyak inti berkualitas tinggi.
Kelapa sawit berkembang biak dengan cara generatif. Buah sawit matang pada kondisi tertentu embrionya akan berkecambah menghasilkan tunas (plumula) dan bakal akar (radikula).
Syarat hidup Kelapa Sawit
Habitat aslinya adalah daerah semak belukar. Sawit dapat tumbuh dengan baik di daerah tropis (15° LU - 15° LS). Tanaman ini tumbuh sempurna di ketinggian 0-500 meter dari permukaan laut dengan kelembaban 80-90%. Sawit membutuhkan iklim dengan curah hujan stabil, 2000-2500 mM setahun, yaitu daerah yang tidak tergenang air saat hujan dan tidak kekeringan saat kemarau. Pola curah hujan tahunan memperngaruhi perilaku pembungaan dan produksi buah sawit.
Kelapa sawit yang dibudidayakan terdiri dari dua jenis: E. guineensis dan E. oleifera. Jenis pertama adalah yang pertama kali dan terluas dibudidayakan
orang. E. oleifera sekarang mulai dibudidayakan pula untuk menambah keanekaragaman sumber daya genetik.
Penangkar seringkali melihat tipe kelapa sawit berdasarkan ketebalan cangkang, yang terdiri dari :
Dura, Pisifera, dan Tenera.
Dura merupakan sawit yang buahnya memiliki cangkang tebal sehingga
dianggap memperpendek umur mesin pengolah namun biasanya tandan buahnya besar-besar dan kandungan minyak per tandannya berkisar 18%. Pisifera buahnya tidak memiliki cangkang namun bunga betinanya steril sehingga sangat jarang menghasilkan buah. Tenera adalah persilangan antara induk Dura dan jantan Pisifera. Jenis ini dianggap bibit unggul sebab melengkapi kekurangan masing-masing induk dengan sifat cangkang buah tipis namun bunga betinanya tetap fertil. Beberapa tenera unggul memiliki persentase daging per buahnya mencapai 90% dan kandungan minyak per tandannya dapat mencapai 28%. Untuk pembibitan massal, sekarang digunakan teknik kultur jaringan.
Minyak sawit digunakan sebagai bahan baku minyak makan, margarin, sabun, kosmetika, dan industri farmasi. Minyak sawit dapat digunakan untuk beragam peruntukan karena keunggulan sifat yang dimilikinya yaitu tahan oksidasi dengan tekanan tinggi, mampu melarutkan bahan kimia yang tidak larut oleh bahan pelarut lainnya, mempunyai daya melapisi yang tinggi dan tidak menimbulkan iritasi pada tubuh dalam bidang kosmetik.
Hasil tanaman
Minyak inti menjadi bahan baku minyak alkohol dan industri kosmetika. Bunga dan buahnya berupa tandan, bercabang banyak. Buahnya kecil, bila masak berwarna merah kehitaman. Daging buahnya padat. Daging dan kulit buahnya mengandung minyak. Minyaknya itu digunakan sebagai bahan minyak goreng, sabun, dan lilin. Ampasnya dimanfaatkan untuk makanan ternak. Ampas yang disebut bungkil inti sawit itu digunakan sebagai salah satu bahan pembuatan makanan ayam. Tempurungnya digunakan sebagai bahan bakar dan arang.
Buah diproses dengan membuat lunak bagian daging buah dengan temperatur 90 °C. Daging yang telah melunak dipaksa untuk berpisah dengan bagian inti dan cangkang dengan pressing pada mesin silinder berlubang. Daging inti dan cangkang dipisahkan dengan pemanasan dan teknik pressing. Setelah itu dialirkan ke dalam lumpur sehingga sisa cangkang akan turun ke bagian bawah lumpur. Sisa pengolahan buah sawit sangat potensial menjadi bahan campuran makanan ternak dan difermentasikan menjadi kompos.
Penyakit Busuk Pangkal Batang Kelapa Sawit
mengandung getah. Secara mikroskopis gejala internal akar yang terserang Ganoderma mirip pada batang yang terinfeksi. Jaringan korteks akar yang sakit
berubah warna dari putih menjadi coklat. Pada serangan yang sudah lanjut, jaringan korteks rapuh dan mudah hancur.
Penyebab penyakit busuk pangkal batang kelapa sawit di Indonesia adalah jamur Ganoderma boninense. Penularan penyakit ini sebagian besar melalui mekanisme kontak akar sawit sakit dan sangat kecil melalui basidiospora.
Gambar 2. Mekanisme dan penyebaran Ganoderma boninense
Di dalam tanah Ganoderma tumbuh menjadi berukuran besar melalui perantaraan akar tanaman sawit. Semula satu tanaman terinfeksi di bagian perakarannya. Karena akar tanaman sawit yang sudah dewasa saling bertemu dan membentuk bantalan perakaran seluas perkebunan itu sendiri, maka Ganoderma yang semula berukuran 4 m x 4 m x 1 m dengan mudah tumbuh membesar pada bantalan perakaran sawit di bawah permukaan tanah. Apalagi bahan tanaman kelapa sawit yang dikembangkan di Indonesia diketahui peka terhadap serangan Ganoderma. Ketika pangkal batang terserang, cepat atau lambat tanaman akan
Gambar 3. Ganoderma boninense
Para pekebun sering salah persepsi bahwa ukuran Ganoderma hanya sebesar tubuh buah yang terbentuk, kurang lebih sebesar cawan. Padahal kalau dibandingkan dengan ukuran sebenarnya, tubuh buah Ganoderma dapat diibaratkan hanya merupakan rambut-rambut kecil monster raksasa. Dengan demikian ketika tubuh buah dimatikan, Ganoderma yang ukurannya sebesar kapal selam tidak akan mati. Tunggul-tunggul tanaman yang terserang merupakan urat nadi Ganoderma, karena merupakan tempat di mana Ganoderma bertahan hidup ketika tanaman sudah mati.
Tabel 1. Data dari kejadian busuk pangkal batang kelapa sawit di Sumatra Utara yang berkorelasi dengan generasi kebun kelapa sawit (TBM : tanaman belum menghasilkan;
TM : Tanaman Menghasilkan; T : Tanaman Tua)
Desain Primer untuk Gateway
Pemilihan primer oligonukletida berguna untuk polymerase chain reaction (PCR), hibridisasi oligo dan sekuensing DNA. Desain primer yang tepat merupakan salah satu faktor penting dalam keberhasilan isolasi gen dan sekuensing DNA. Syarat oligonukleotida dapat digunakan sebagai primer untuk PCR bergantung pada beberapa faktor yakni, pergerakan asosiasi dan disosiasi template primer ganda pada suhu penempelan primer dan pemanjangan primer, kestabilan ganda nukleotida mismatched dan lokasinya, efisiensi polimerase yang dapat mengenali dan memperpanjang mismatched duplex (Abd-Elsalam 2003).
Desain yang benar dari primer attB untuk amplifikasi, pengklonan, dan ekspresi gen dalam Gateway membutuhkan pertimbangan penempatan yang tepat dari unsur ekspresi protein (pengenalan sekuens ribosom, start kodon, stop kodon, reading frame consideration) ke situs rekombinasi. Posisi yang tepat dari unsur
ekspresi ditentukan oleh bentuk dari protein (native, N-terminal fusion, C-terminal fusion). Informasi penurunan attB1 atau peningkatan attB2 harus
yang berkonstribusi dengan destination vector untuk N-terminal fusion atau termasuk dalam penurunan hasil PCR dari attB1 untuk native atau C-terminal fusion, stop kodon yang berkontribusi dengan destination vector untuk C-terminal
fusion atau termasuk dalam peningkatan hasil PCR dari attB2 untuk native atau N-terminal fusion.
Metode Teknologi Gateway
Teknologi Gateway merupakan metode kloning secara universal yang berdasarkan pada rekombinasi bagian site-specific dari bacteriophage lamda (Landy 1989). Teknologi Gateway menyediakan teknik yang cepat dan begitu efisien untuk memindahkan sekuen DNA ke berbagai sistem vektor untuk dilakukannya analisis fungsional dan ekspresi protein (Hartley et al,2000).
Gambar 4. Transfer DNA teknologi Gateway ke berbagai sistem vektor Keuntungan dengan menggunakan teknologi Gateway :
Dapat diperoleh hasil dengan cepat dan begitu efisien dalam transfer sekuen DNA kedalam berbagai sistem vektor untuk ekspresi protein dan analisis fungsional disaat yang sama bisa mempertahankan orientasi dan reading frame.
Restrction Endonuclease Digestion and Ligation
Memungkinkan penggunaan dan ekspresi dari berbagai tipe sekuen DNA (misalnya dari hasil PCR, clone cDNA, atau dari fragment restriksi).
Memudahkan pemindahan sejumlah besar sekuen DNA ke berbagai destination vector (lihat tabel 4).
Sangat cocok untuk adaptasi pada high-throughput (HTP) format.
Memungkinkan pengkorversian dari vektor yang kita miliki kedalam destination vector (lihat tabel 4).
Teknologi Gateway yang berdasarkan pada rekombinasi bacteriophage lambda site-specific ini difasilitasi dengan integrasi lambda ke dalam kromosom
E. Coli dan di switch diantara jalur lytic dan lysolitic (Ptashne 1992). Pada teknologi Gateway, komponen dari sistem rekombinasi lamda telah dimodifikasi untuk meningkatkan spesifitas dan efisiensi pada sistem (Bushman et al, 1985).
Rekombinasi berbasiskan lambda ini melibatkan dua komponen penting :
Sekuen DNA rekombinan (att sites) dan
Protein perantara pada reaksi rekombinasi ini (misalnya Clonase enzyme mix).
Interegasi lambda kedalam kromosom E. coli terjadi dengan melalui rekombinasi DNA intermolekular yang ditengahi oleh suatu campuran dari lambda dan rekombinasi protein E.coli-encoded. Berikut ini garis besar
rekombinasi lambda :
Rekombinasi terjadi diantara bagian spesifik attachment (att) pada molekul DNA yang berinteraksi.
Rekombinasi berlangsung secara konservatif (misalnya tidak terjadi penambahan atau pengurangan dari nukleotida) dan tidak dibutuhkan sintesis DNA. Segment DNA mengapit bagian rekombinasi yang di swicth, setelah itu bagian att menjadi sekuen hybrid yang terdiri dari
sekuen yang diberikan oleh masing-masing parental vector. Contohnya, attL sites terdiri dari sekuen yang berasal dari attB dan attP sites.
Rekombinasi dapat terjadi antara DNA dari topologi apa saja (misalnya supercoiled, linear, atau relaxed) dengan efisiensi yang bervariasi.
Rekombinasi lambda terjadi diantara bagian site-specific attachment (att) : attB pada kromosom E.coli dan attP pada kromosom lambda. Bagian att berfungsi sebagai binding site untuk rekombinasi protein yang berguna pada protein rekombinasi dan telah dikarakterisasi dengan baik (Weiberg & Landy 1983). Pada saat integrasi lambda, rekombinasi terjadi diantara bagian attB dan attP untuk menghasilkan bagian attL dan attR. Crossover sebenarnya terjadi diantara 15 bp homolog core regions pada kedua bagian, tetapi bagaimanapun juga daerah disekitar core regions sangat diperlukan karena mempunyai bagian binding sites untuk keperluan protein rekombinasi (Landy 1989).
Protein Rekombinasi
Rekombinasi lambda dikatalisis oleh sejenis campuran enzim yang dapat mengikat pada sekuen spesifik (daerah att), yang menyatukan daerah target, membelah mereka, dan secara kovalen melekatkan DNA. Rekombinasi terjadi setelah dua pasang untai bertukar dan DNA ligasi membentuk bentuk baru.
Jalur lysogenic dikatalisis oleh protein bacteriophage λ Integrase (Int) dan E.coli Integration Host Factor (IHF)(Enzim BP Clonase Mix) semantara pada
jalur lytic dikatalis oleh protein bacteriophage λ int dan Excisionase (Xis), dan protein E.coli Integration Host Factor (IHF)(LR Clonase enzyme mix).
Tabel 2. Jalur lysogenic dan lytic
Reaksi Rekombinasi Gateway
Teknologi gateway menggunakan sistem rekombinasi lambda untuk menfasilitasi pemindahan sekuen heterologous DNA (yang diapit oleh att site yang termodifikasi) diantara vektor (Harley et al, 2000). Ada dua reaksi rekombinasi yang merupakan basis dari teknologi Gateway :
menghasilkan attL yang mempunyai entry clone (lihat diagram di bawah). Reaksi ini dikatalisis oleh BP Clonase enzyme mix.
Gambar 5. Reaksi BP
Reaksi LR : menfasilitasi rekombinasi dari subtrat attL (entry clone) dengan subtrat attR (destination vector) untuk menghasilkan attB yang mempunyai expression clone (lihat diagram di bawah). Rekasi ini dikatalisis oleh LR Clonase enzyme mix.
Gambar 6. Reaksi LR
Daerah rekombinasi wild-type λ att telah dimodifikasi untuk meningkatkan efisiensi dan spesifikasi dari reaksi rekombinasi gateway BP dan LR. Bagian berikut ini akan menggambarkan modifikasi dan contoh bagaimana reaksi rekombinasi Gateway antara bagian attB x attp dan attL x attR.
Tabel 3. Dareah modifikasi pada att
Dalam sistem Gateway,daerah rekombinasi wild-type λ att telah di modifikasi seperti dibawah ini untuk meningkatkan efisiensi dan spesifitas dari reaksi rekombinasi Gateway BP dan LR:
Telah dilakukan mutasi pada core regions dari daerah att untuk menhapus kodon stop dan memastikan speksifitas dari reaksi rekombinasi untuk mempertahankan orientasi dan reading frame.
Mutasi telah di ketahui pada daerah pendek (5 bp) yang mengapit 15-bp core region dari daerah attB untuk memperkecil formasi struktur secondary pada bentuk untai tunggal dari plasmid attB (misalnya phagemid ss(single strand)DNA atau m(messenger)RNA)
Bagian 43 bp dari daerah att telah dihilangkan untuk in vitro reaksi attL x attR irreversible dan lebih efektif (Bushman et al, 1985).
Sebagai tambahan penjelasan modifikasi diatas, titik mutasi site-specific telah dibuat dengan beberapa daerah att untuk meningkatkan efisiensi rekombinasi. Sebagai hasilnya, variasi sekuen bisa ada hampir diseluruh daerah att. Contohnya, pDONR 201 attP1 sedikit bervariasi sekuennya dari pDONR 221
attP1. Variasi sekuen ini tidak memberikan efek spesifik dari reaksi rekombinasi
atau fungsionalitas vektor. Modifikasi daerah att mengikuti karakterisasi dan spesifitas.
Diagram (Gambar 7) di bawah menggambarkan reaksi rekombinasi BP antara produk attB-PCR dan vektor pDONR221 atau pDONR/Zeo untuk menghasilkan entry clone dan produk sampingannya.
Fitur-fitur dari daerah rekombinasi :
Pada daerah yang terasir berhubangan dengan transfer sekuens dari produk attbB-PCR kedalam entry clone selama rekombinasi. Sebagai catatan bahwa daerah attL tersusun dari sekuen attB dan attP.
Daerah yang dikota berhubungan denga transfer sekuen dari pDONR221 atau pDONR/ZEO kedalam produk samping selama
Gambar 7. Reaksi BP menghasilkan entry clone
Tabel 4. Perbedaan tiga tipe dari vektor yang di adopsi Gateway : Vektor Gateway Karakteristik
Vector Donor Mempunyai daerah attP
Digunakan pada klon produk PCR yang diapit attB
Entry vector Mempunyai daerah attL
Digunakan pada klon produk PCR atau fragmen restriction yang tidak mempunyai daerah att untuk menghasilkan entry clone
Destination vector Mempunyai daerah attR
Direkombinasikan dengan entry clone pada reaksi LR untuk menghasilkan suatu expression clone
Untuk memungkinkan kloning secara rekombinasi ini dan efisiensi pemilihan dari entry dan expression clone, kebanyakan vektor gateway mempunyai dua daerah att yang diapit suatu pita yang berisi :
Gen ccdB untuk kontrol negatif ( ada pada donor, destination, dan supercoiled entry vector)
Gen tahan terhadap Cloramphenicol (CmR) counterselection (ada pada donor dan destination vectors
Setelah reaksi rekombinasi BP dan LR, pita ini digantikan dengan gen yang kita miliki untuk menghasilkan entry clone dan expression clone, berlaku untuk masing-masing.
)
Kehadiran gen ccdB memungkinkan kontrol negatif pada donor dan destination (beberapa pada entry) vectors dalam E.coli bersamaan dengan tahap rekombinasi dan transformasinya. Protein ccdB terganggu dengan adanya DNA gyrase E.coli (Bernard & Couturier 1992), dengan demikian menghambat
pertumbuhan hampir semua strain E.coli (misalnya DH5α™, TOP10). Pada saat rekombinasi (misalnya antara destination vector dan entry clone atau donor vector dan produk attB-PCR), gen ccdB digantikan dengan gen milik kita. Sel yang
mengambil vektor tak beraksi dar i gen ccdB
atau molekul produk sampingan yang mempunyai gen ccdB akan gagal untuk bertumbuh. Hal ini memungkinkan efisiensi yang tinggi untuk mendapatkan klone yang kita inginkan.
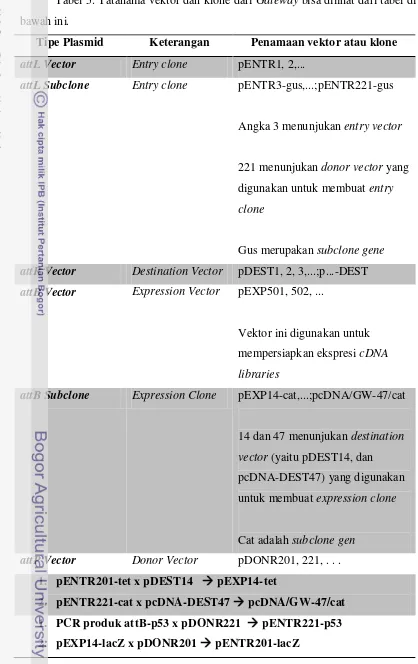
Tabel 5. Tatanama vektor dan klone dari Gateway bisa dilihat dari tabel di bawah ini.
Tipe Plasmid Keterangan Penamaan vektor atau klone
attL Vector Entry clone pENTR1, 2,...
attL Subclone Entry clone pENTR3-gus,...;pENTR221-gus
Angka 3 menunjukan entry vector
221 menunjukan donor vector yang digunakan untuk membuat entry clone
Gus merupakan subclone gene
attR Vector Destination Vector pDEST1, 2, 3,...;p...-DEST
attB Vector Expression Vector pEXP501, 502, ...
Vektor ini digunakan untuk mempersiapkan ekspresi cDNA libraries
attB Subclone Expression Clone pEXP14-cat,...;pcDNA/GW-47/cat
14 dan 47 menunjukan destination vector (yaitu pDEST14, dan
Agrobacterium tumefaciens
Agrobacterium tumefaciens adalah bakteri patogen pada tanaman yang
banyak digunakan untuk memasukkan gen asing ke dalam sel tanaman untuk menghasilkan suatu tanaman transgenik. Secara alami, A tumefaciens dapat menginfeksi tanaman dikotiledon melalui bagian tanaman yang terluka sehingga menyebabkan tumor mahkota empedu (crown gall tumor). Bakteri yang tergolong ke dalam gram negatif ini memiliki sebuah plasmid besar yang disebut plasmid-Ti yang berisi gen penyandi faktor virulensi penyebab infeksi bakteri ini pada tanaman (Gustavo 1998). Untuk memulai pembentukan tumor, A tumefaciens harus menempel terlebih dahulu pada permukaan sel inang dengan memanfaatkan polisakarida asam yang akan digunakan untuk mengkoloniasi/menguasai sel tanaman (Madigan 2000). Selain tanaman dikotil, tanaman monokotil seperti jagung, gandum, dan tebu telah digunakan untuk memasukkan sel asing ke dalam genom tanaman. A tumefaciens adalah bakteri patogen pada tanaman yang banyak digunakan untuk memasukkan gen asing ke dalam sel tanaman untuk menghasilkan suatu tanaman transgenik.
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) merupakan suatu teknik atau metode
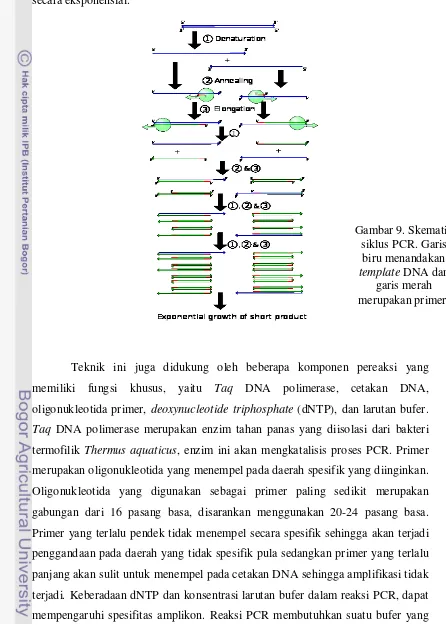
Gambar 8. Alat pengatur suhu reaksi yang biasanya digunakan pada teknik PCR Secara prinsip, PCR merupakan proses yang diulang-ulang antara 20–30 kali siklus. Setiap siklus terdiri atas tiga tahap. Berikut adalah tiga tahap bekerjanya PCR dalam satu siklus:
Tahap peleburan (melting) atau denaturasi. Pada tahap ini (berlangsung pada suhu tinggi, 94–96 °C) ikatan hidrogen DNA terputus (denaturasi) dan DNA menjadi berberkas tunggal. Biasanya pada tahap awal PCR tahap ini dilakukan agak lama (sampai 5 menit) untuk memastikan semua berkas DNA terpisah. Pemisahan ini menyebabkan DNA tidak stabil dan siap menjadi template (patokan) bagi primer. Durasi tahap ini 1–2 menit.
Tahap penempelan atau annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Ini dilakukan pada suhu antara 45–
60°C. Penempelan ini bersifat spesifik. Suhu yang tidak tepat menyebabkan tidak terjadinya penempelan primer di sembarang tempat. Durasi tahap ini 1–2 menit.
Tahap pemanjangan atau elongasi. Suhu untuk proses ini tergantung dari jenis DNA polimerase (ditunjukkan oleh P pada gambar) yang dipakai. Dengan Taq-polimerase, proses ini biasanya dilakukan pada suhu 76 °C. Durasi tahap ini biasanya 1 menit.
primer lain. Akhirnya terdapat berkas DNA yang panjangnya dibatasi oleh primer yang dipakai. Jumlah DNA yang dihasilkan berlimpah karena penambahan terjadi secara eksponensial.
Teknik ini juga didukung oleh beberapa komponen pereaksi yang memiliki fungsi khusus, yaitu Taq DNA polimerase, cetakan DNA, oligonukleotida primer, deoxynucleotide triphosphate (dNTP), dan larutan bufer. Taq DNA polimerase merupakan enzim tahan panas yang diisolasi dari bakteri
termofilik Thermus aquaticus, enzim ini akan mengkatalisis proses PCR. Primer merupakan oligonukleotida yang menempel pada daerah spesifik yang diinginkan. Oligonukleotida yang digunakan sebagai primer paling sedikit merupakan gabungan dari 16 pasang basa, disarankan menggunakan 20-24 pasang basa. Primer yang terlalu pendek tidak menempel secara spesifik sehingga akan terjadi penggandaan pada daerah yang tidak spesifik pula sedangkan primer yang terlalu panjang akan sulit untuk menempel pada cetakan DNA sehingga amplifikasi tidak terjadi. Keberadaan dNTP dan konsentrasi larutan bufer dalam reaksi PCR, dapat mempengaruhi spesifitas amplikon. Reaksi PCR membutuhkan suatu bufer yang
Gambar 9. Skematik siklus PCR. Garis
biru menandakan template DNA dan
mengandung MgCl2 karena aktivitas enzim polimerase dipengaruhi oleh
konsentrasi ion Mg2+. Ion Mg2+
Salah satu kegunaan PCR adalah untuk identifikasi suatu gen atau DNA yang spesifik. Identifikasi keberadaan suatu gen dapat dilakukan dengan mudah bila daerah pengapit (flanking region) telah diketahui. Daerah pengapit yang spesifik ini digunakan sebagai primer. Penggunaan PCR untuk identifikasi adanya suatu patogen penyebab suatu penyakit telah banyak dilakukan, seperti hepatitis B, TBC, AIDS, atau kelainan lainnya. Perbanyakan gen untuk berbagai keperluan, pengurutan DNA, ataupun kajian keragaman molekuler dapat pula dilakukan dengan PCR (Suharsono 2000).
BAHAN DAN METODE
Bahan dan Alat
Berbagai bahan yang digunakan dalam PCR-Colony (kit Fermentas) dan PCR (kit Invitrogen). Proses amplifikasi (PCR-Colony) menggunakan kit dari Fermentas yang memerlukan bahan-bahan seperti template PSA Aka(Promotor spesifik akar-Aka), primer M13 (M13F dan M13R,), buffer complete,
Deoxynucleotide Triphosphates (dNTPs), Taq polimerase, dan molecular water (aquabides). Proses amplifikasi (PCR) menggunakan kit dari Invitrogen yang memerlukan bahan-bahan seperti template PSA-Aka(Promotor spesifik akar-Aka), primer gateway PSA-AKA (reverse dan forward), buffer complete, MgCl, dNTPs, Taq polimerase, dan molecular water (aquabides). Berbagai bahan yang digunakan dalam elektroforesis yaitu gel agarosa (Sigma), bufer Tris-Borate-EDTA (TBE) 0.5x, Etidium bromida (EtBr) 5 µg/100mL, loading bufer (Bromfenol biru 2.5%, sukrosa 40%), dan marker 1 kb plus (Invitrogen). Tahap transformasi dibutuhkan bahan-bahan seperti sel kompeten E.coli XL-1 Blue, larutan Proteinase K, Donor vektor (pDONR 221), Enzim BP clonase, clonase reaction buffer, TE buffer, pH 8.0 (10 mM Tris-HCl, pH 8.0, 1 mM EDTA), Destination vector (150 ng/µ l dalam TE, pH 8.0), LR clonase enzyme mix, LR
Clonase reaction buffer, Medium S.O.C, LB-Glokosa (20mM), media Luria Bertani Agar (LBA) selektif (Kanamisin (50ppm), YEP (Yeast Extract Pepton), berbagai vektor Gateway.
Metode
Amplifikasi DNA PSA Aka dengan Primer Gateway (invitrogen)
Amplifikasi DNA PSA(Promotor spesifik akar) Aka menggunakan primer Gateway yakni:
Proses amplifikasi dimulai dengan menyiapkan komponen mix yang terdiri atas 2.5 µL buffer complete, 1 µL dNTPs, 0.5 µL Taq polimerase, dan 15 µL molecular water. Kemudian DNA (PSA Aka) dimasukkan ke dalam tabung mikro
sebanyak 1 µL. Gateway Reverse primer (primer R) ditambahkan sebanyak 1 µ L ke dalam tabung mikro kemudian ditambahkan pula sebanyak 1 µL Gateway forward primer (primer F) ke dalam tabung. Komponen mix yang telah
dipersiapkan sebelumnya ditambahkan setelah penambahan DNA, primer R, dan primer F. DNA PSA Aka diamplifikasi dengan mesin PCR selama 3 jam dengan program PCR: predenaturasi pada suhu 940C selama 7 menit, denaturasi pada suhu 940C selama 45 detik, penempelan primer (annealing) pada suhu 580C selama 45 detik, pemanjangan primer (extension) pada suhu 720C selama 2 menit, pascapemanjangan pada suhu 720C selama 5 menit, dan waktu penyimpanan pada suhu 100
Rekombinasi DNA PSA Aka dengan reaksi BP (metode Gateway yang dimodifikasi dari Hartley 2000; Landy 1989; Kertbundit et al. 1991)
C.
Rekombinasi DNA PSA Aka pada vektro entry dengan reaksi LR (metode Gateway yang dimodifikasi dari Hartley 2000; Landy 1989; Kertbundit et al. 1991)
Sebanyak 150 ng hasil rekombinasi pada entry vector dimasukkan ke dalam tabung mikro kemudian ditambahkan 150 ng destination vector. Setelah itu ditambahkan bufer TE hingga volume larutan mencapai 8 µL. Ke dalam tabung mikro ditambahkan sebanyak 2 µL LR Clonase kemudian diinkubasi pada suhu 250C selama 1 jam. Setelah inkubasi larutan kemudian ditambhkan 2 µ L proteinase K yang selanjutnya diinkubasi kembali pada suhu 370
Transformasi DNA PSA Aka ke Escherichia coli (Metode Chaidamsari 2005) C selama 15 menit. Hasil rekombianasi pada destination vector kemudian ditransformasikan ke dalam Escherichia coli (E. coli).
Sebanyak 10 µL hasil rekombinasi ditransformasikan ke dalam 200 µL sel kompeten E. coli XL-1 Blue secara perlahan dikocok perlahan hingga tercampur rata kemudian diinkubasi di dalam es selama 30 menit. Larutan hasil rekombinasi dan sel kompeten diberi kejut panas (heat shock) pada suhu 420C selama 50 detik yang selanjutnya segera dimasukkan ke dalam es selama 10 menit. Larutan hasil rekombinasi dan kompeten sel ditambahkan 800 µ L SOC atau Luria Bertani (LB) + glukosa 20 mM kemudian diinkubasi ke dalam inkubator bergoyang (shacker incubator) selama ± 1.5 jam pada suhu 37oC dengan kecepatan 150 rpm. Setelah dikocok dengan inkubator bergoyang, supernatan dibuang ± 800 µL sedangkan sisa supernatan 100 µL dan pelet diresuspensi kemudian ditumbuhkan dalam media LA yang terdiri atas tripton 10 g/L, yeast extract 5 g/L, NaCl 5 g/L dan bakto agar 15 g/L dan meratakannya dengan segitiga penyebar. Media diinkubasi dalam kondisi 370
Seleksi transforman dilakukan dengan pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah sel E.coli yang berhasil ditransformasi, sedangkan yang tidak berhasil ditransformasi akan mati akibat penambahan Kanamisin 50 ppm.
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan (Chaidamsari 2005)
HASIL DAN PEMBAHASAN
Desain PrimerPrimer spesifik didesain untuk mendapatkan promotor dari suatu gen. Primer spesifik ini didesain berdasarkan sekuen DNA target. Selain berdasarkan urutan DNA target, primer juga didesain sesuai vektor dan teknologi yang di gunakan. Dalam penelitian ini digunakan beberapa primer seperti M13 dan primer khusus gateway. M13 digunakan karena plasmid yang digunakan yaitu TOPO 2.1 (Shuman, 1991; Shuman, 1994) mempunyai sekuen M13 yang komplemen baik reverse dan forward. Primer khusus gateway dibuat menurut aturannya.
Pembuatan primer gateway dalam penelitian ini memperhatikan sekuen att yang ditambahakan pada urutan DNA primer, dan urutan 4 basa guanin(GGGG) sebelum situs att.
Tabel 6. Urutan DNA primer PSA tanpa att >Aka_F
GGGCCTCTAG---AACGTTAAAA 522
>Aka_R
TAGTACGGCC---TCGGATTCCC 554
Isolasi DNA PSA
Isolasi DNA merupakan tahap awal yang penting dan menentukan keberhasilan dari penelitian. Metode yang digunakan dalam penelitian ini adalah metode Chaimdamsari (2005).
Kloning PSA dengan menggunakan TOPO 2.1
Gambar10. Hasil elektroforesis Plasmid PSA yang sudah tersisipkan pada vektor TOPO 2.1
Vektor TOPO 2.1 memilki 3931 bp, sehingga di perkirakan DNA yang tersisipkan pada vektor berkisaran 1000 bp. Setelah mendapatkan ukuran vektor yang sudah tersisipkan DNA target, hal yang selanjutnya dilakukan periksaan adalah perkiraan DNA kita yang tersisip dengan menggunakan primer M13 (Gambar 11). Primer M13 dapat kita gunakan karena pada plasmid TOPO 2.1 yang kita gunakan urutan dari sekuen M13 telah tersedia.
12000 pb
1620 pb
1000 pb
850 pb
650pb
500 pb
400 pb
300pb
200 pb
100 pb 5000 pb
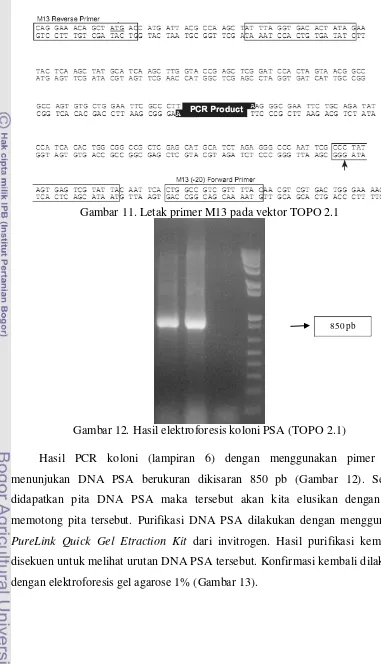
Gambar 11. Letak primer M13 pada vektor TOPO 2.1
Gambar 12. Hasil elektroforesis koloni PSA (TOPO 2.1)
Hasil PCR koloni (lampiran 6) dengan menggunakan pimer M13 menunjukan DNA PSA berukuran dikisaran 850 pb (Gambar 12). Setelah didapatkan pita DNA PSA maka tersebut akan kita elusikan dengan cara memotong pita tersebut. Purifikasi DNA PSA dilakukan dengan menggunakan PureLink Quick Gel Etraction Kit dari invitrogen. Hasil purifikasi kemudian
disekuen untuk melihat urutan DNA PSA tersebut. Konfirmasi kembali dilakukan dengan elektroforesis gel agarose 1% (Gambar 13).
Gambar 13. Hasil elektroforesis elusi PSA Metode Gateway
Pada metode ini yang akan digunakan adalah primer khusus gateway yang sudah kita konstruksi dengan menggunakan urutan khusus dimana terjadi penambahan urutan -GGGG- dan 20bp situs att pada primer PSA. Setelah itu dilakukan amplifikasi PSA dengan primer khusus gateway yang telah dikonstruksi. Setelah amplifikasi dilakukan pada proses PCR dengan suhu annaeling 450C, 500C, 550C didapatkan hasil berupa pita pada kisaran di bawah 850 pb. Hal ini menunjukan sedikit perbedaan dengan menggunakan primer M13 karena primer khusus gateway yang digunakan teramplifikasi lansgsung pada DNA PSA dengan ukuran yang lebih kecil (Gambar 14).
Gambar 14. Hasil Elektroforesis amplifikasi primer gateway dengan PSA pada ann 450C, 500C, 550C.
850 pb
Pita hasil amplifikasi kemudian dielusikan dan di cek lagi menggunakan elektroforesis 1%(Lampiran 6). Hasil purifikasi menunjukan smear yang positif (Gambar 15). Kemudian hasil dari purifikasi ini kembali sekuen untuk melihat
Gambar 15. Hasil elektroforesis purifikasi PSA Konfirmasi DNA Target sebagai Promotor
Dari hasil sekuen terbaca DNA target memiliki 809 bp. Kemudian digunakan software bioinformatik untuk menentukan DNA target sebagai promotor. Software yang digunakan yaitu TSSP (transcription start positions predicts) dan NSITE (number site transcription elements) dari Softberry inc, serta
software modENCODE Consortium yaitu Neural Network Promoter Prediction.
Untuk IUPAC Nucleotide Code lihat lampiran 7.
Berikut ini hasil sekuen DNA target PSA dengan 809 pb pada program TSSP (Solovyev & Salamov 1997; Solovyev 2001; Solovyev & Shahmuradov 2003). Hasil menunjukan terdapat dua element yang menandakan bahwa DNA target merupakan promotor yaitu promotor pos TATA box pada line 697 dan enhancer pos.
> test sequence
Length of sequence- 809
Thresholds for TATA+ promoters - 0.02, for TATA-/enhancers -
0.04
2 promoter/enhancer(s) are predicted
Enhancer Pos: 757 LDF- 0.05
Transcription factor binding sites/RegSite DB:
for promoter at position - 730
453 (+) RSP00512 cttgtaacCATCAgccaatcgaccagccaatcattc
530 (+) RSP00512 cttgtaacCATCAgccaatcgaccagccaatcattc
for promoter at position - 757
530 (+) RSP00512 cttgtaacCATCAgccaatcgaccagccaatcattc
Pemeriksaan data diatas ditemukan motif promotor dari 23 spesies pada pemeriksaan pada 1816 element regulatory dari berbagai spesies (Softberry Inc. 2001-2009; Last Update: 2009). Berikut ini adalah hasil pemeriksaan konfirmasi Regulatory Elements(RE) yang berasal dari RegSite DB PLANT division
(Softberry Inc. 2001-2009; Last Update: 2009) : for promoter at position - 730
562 (+) RSP00003 CCWWWWWWRG
AC: RSP00003//OS: arabidopsis (Arabidopsis thaliana) /GENE: Synthetic
oligonucleotides/RE: CArG1 (AGL3) /BF: AGL3; MADS-box containing positively
464 (+) RSP00016 caTGCAC
527 (+) RSP00026 gcttttgaTGACtTcaaacac
26. AC: RSP00026//OS: tobacco (Nicotiana tabacum) /GENE: G13/RE: -141
sequence /BF: TGA1a; PG13;
514 (+) RSP00076 AACGTT
519 (-) RSP00076 AACGTT
76. AC: RSP00076//OS: rice (Oryza sativa) /GENE: rifa-7-P-glucuronidase
transgene/RE: T-box /BF: bZIP factor
525 (+) RSP00161 WAAAG
567 (+) RSP00161 WAAAG
161. AC: RSP00161//OS: maize (Zea mays) /GENE: Synthetic
oligonucleotids/RE: Dof1 BSopt /BF: Dof1
464 (+) RSP00327 CATGCA
327. AC: RSP00327//OS: Brassica napus /GENE: napA/RE: RY /BF: ABI3
711 (+) RSP00438 GGCGGC
438. AC: RSP00438//OS: arabidopsis (Arabidopsis thaliana) /GENE: PR-1/RE:
PR-box /BF: unknown nuclear factor
662 (+) RSP00477 TTTAA
477. AC: RSP00477//OS: barley (Hordeum vulgare), Brassica napus /GENE:
rbcSF1/RE: S-box /BF: unknown nuclear factor
636 (+) RSP00483 GCCGC
482. AC: RSP00482//OS: maize (Zea mays) /GENE: Adh1/RE: GT-1 /BF:
unknown nuclear factor
453 (+) RSP00512 cttgtaacCATCAgccaatcgaccagccaatcattc
530 (+) RSP00512 cttgtaacCATCAgccaatcgaccagccaatcattc
512. AC: RSP00512//OS: oat (Avena fatua) /GENE: alpha-Amy2/A/RE: Inr /BF:
Data ini menunjukan bahwa urutan DNA mempunyai kemungkinan sebagai promotor setelah proses pencocokan motif DNA pada alat bioinformatika ini.
Pemeriksaan dilanjutkan dengan menggunakan program NSITE(hahmuradov et al 1986; Solovyev & Kolchanov 1994; Heinemeyer 1999). Pada hasil NSITE ditemukan kesamaan homologi regulatory element(RE) 80% dengan perbedaan pada RE bloks 20%. Ditemukan 10 motif yang sama pada pemeriksaan 1816 RE dengan 11 perbedaan RE bloks.
Program NSITE (Softberry Inc.) | Version 2.2004
Search for motifs of 1432 Regulatory Elements (REs) | SET of
REs: REGSITE DB: Plant Transcription Regulatory Sites [Last
Update: April 10, 2007]
NOTE: RE - Regulatory Element/Consensus | AC - Accession No of
RE in a given DB
OS - Organism/Species | BF - Binding Factor or One of
them
Mism. - Mismatches | Mean. Exp. Number - Mean Expected
Number | Up.Conf.Int. - Upper Confidence Interval
============================================================
QUERY: > test sequence
Length of Query Sequence: 809 bp | Nucleotide
Frequencies: A - 0.30 G - 0.20 T - 0.26 C - 0.23
...
RE: 201. AC: RSP00201//OS: maize (Zea mays) /GENE: rab17/RE:
GRA /BF: unknown nuclear factor
Motifs on "-" Strand: Mean Exp. Number 0.00935 Up.Conf.Int.
1 Found 1
34 CACTGGCgGCCg 23 (Mism.= 2)
...
RE: 397. AC: RSP00397//OS: tobacco (Nicotiana tabacum) /GENE:
Motifs on "-" Strand: Mean Exp. Number 0.00910 Up.Conf.Int.
RE: 757. AC: RSP00757//OS: potato (Solanum tuberosum) /GENE:
S2-RNase/RE: motif I /BF: unknown transcription factor
Motifs on "-" Strand: Mean Exp. Number 0.00250 Up.Conf.Int.
1 Found 1
60 AGGAAgA 54 --15-- 38 aTCACACT 31
(Mism.= 1/ 1)
...
RE: 864. AC: RSP00864//OS: arabidopsis (Arabidopsis thaliana)
/GENE: STK/RE: GA-5 /BF: BPC1
Motifs on "+" Strand: Mean Exp. Number 0.00335 Up.Conf.Int.
1 Found 2
570 AGAGAGAGA 578 (Mism.= 0)
572 AGAGAGAGA 580 (Mism.= 0)
...
RE: 1217. AC: RSP01209//OS: Lepidium africanum /GENE: LaCRC/RE:
EM1 (CArG box 1) /BF: MADS box proteins
Motifs on "-" Strand: Mean Exp. Number 0.00212 Up.Conf.Int.
1 Found 1
571 CTTTTTTTGG 562 (Mism.= 0)
...
RE: 1291. AC: RSP01283//OS: OS: soybean (Glycine max) /GENE:
gsa1/RE: GAGA element /BF: unknown nuclear factor
Motifs on "+" Strand: Mean Exp. Number 0.00096 Up.Conf.Int.
1 Found 1
565 aAaAaAGAGAGAGAGAA 581 (Mism.= 3)
...
RE: 1304. AC: RSP01296//OS: oat (Avena fatua) /GENE: Amy2/D/RE:
Motifs on "+" Strand: Mean Exp. Number 0.00868 Up.Conf.Int.
1 Found 1
700 CTATAAATA 708 (Mism.= 0)
...
RE: 1353. AC: RSP01345//OS: cucumber, Cucumis sativus /GENE:
ms/RE: IMH2 /BF: Unknown nuclear factor
Motifs on "+" Strand: Mean Exp. Number 0.00419 Up.Conf.Int.
1 Found 1
665 AAGCCCACCCT 675 (Mism.= 1)
...
RE: 1355. AC: RSP01347//OS: cucumber, Cucumis sativus /GENE:
ICL/RE: IMH2 /BF: Unknown nuclear factor
Motifs on "+" Strand: Mean Exp. Number 0.00419 Up.Conf.Int.
Pemeriksaan dengan software Neural Network Promoter Prediction (Reese & Eeckman1995; Reese et al 1996 ) menghasilkan data sebagai berikut :
Promoter predictions for 1 eukaryotic sequence with score cutoff 0.80 (transcription start shown in larger font):
Promoter predictions for seq0 : Start End Score
tingkat kesalahan dan 0,50% koefisien korelasi. Skor 1 menunjukan bahwa promotor 100% bukan berasal dari genome manusia.
KESIMPULAN DAN SARAN
KesimpulanDari data hasil pembacaan ketiga software yang digunakan maka hasil konstruksi promotor spesifik akar (PSA) Kelapa Sawit berhasil dikerjakan dengan baik sesuai dengan harapan dan dapat simpulkan bahwa DNA target merupakan promotor.
Saran
Penelitian ini masih dapat dilanjutkan kearah transformasi PSA ke agrobacterium kemudian ke tanaman model, dengan memasukan gen-gen yang
DAFTAR PUSTAKA
Bernard, P., and Couturier, M. (1992). Cell Killing by the F Plasmid CcdB Protein Involves Poisoning of DNA-Topoisomerase II Complexes. J. Mol. Biol. 226, 735-745.
Bernard, P., Kezdy, K. E., Melderen, L. V., Steyaert, J., Wyns, L., Pato, M. L., Higgins, P. N., and Couturier, M. (1993). The F Plasmid CcdB Protein Induces Efficient ATP-dependent DNA Cleavage by Gyrase. J. Mol. Biol. 234, 534-541.
Bushman, W., Thompson, J. F., Vargas, L., and Landy, A. (1985). Control of Directionality in Lambda Site Specific Recombination. Science 230, 906-911. Hartley, J. L., Temple, G. F., and Brasch, M. A. (2000). DNA Cloning Using in vitro Site-Specific Recombination. Genome Research 10, 1788-1795.
Chaidamsari T. 2005. Biotechnology for Cocoa Pod Borer Resistance in Cocoa. Ph.D Thesis. Wageningen University. 154 p.
Darmono T. 2010, Mengatasi Monster yang Mengancam Perkebunan Kelapa Sawit, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI).
Heinemeyer, T.; Chen, X.; Karas, H.; Kel, A. E.; Kel, O. V.; Liebich, I.; Meinhardt, T.; Reuter, I.; Schacherer, F.; Wingender, E. 1999. Expanding the TRANSFAC database towards an expert system of regulatory olecular. Landy, A. (1989). Dynamic, Structural, and Regulatory Aspects of Lambda
Site-specific Recombination. Ann. Rev. Biochem. 58, 913-949.
Lötschert, W., Beese, G (1983). Collins Guide to Tropical Plants. London: Collins.
Miki, T., Park, J. A., Nagao, K., Murayama, N., and Horiuchi, T. (1992). Control of Segregation of Chromosomal DNA by Sex Factor F in Escherichia coli. Mutants of DNA Gyrase Subunit A Suppress letD (ccdB) Product Growth Inhibition. J. Mol. Biol. 225, 39-52.
Paterson, R.R.M (2007). Ganoderma disease of oil palm—A white rot perspective necessary for integrated control. Crop Protection, Volume 26, Issue 9, Pages 1369-1376.
Reese, M.G; Eeckman, F.H. (1995). "Novel Neural Network Algorithms for Improved Eukaryotic Promoter Site Recognition". The Seventh International Genome Sequencing and Analysis Conference, Hilton Head Island, South Carolina.
Reese, M.G.; Harris, N.L.; Eeckman, F.H. 1996. "Large Scale Sequencing Specific Neural Networks for Promoter and Splice Site Recognition" Biocomputing: Proceedings of the 1996 Pacific Symposium edited by Lawrence Hunter and Terri E. Klein, World Scientific Publishing Co, Singapore, 1996, January 2-7, 1996.
Sambrook, J., Russel, D.W (2001). Molecular Cloning: A Laboratory Manual (3rd ed.). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press. Sambutan Menteri Negara Riset dan Teknologi RI pada Gelar Teknologi Industri
Kelapa Sawit, BPPT, 18-19 Juli 2007.
Sambutan Menteri Perindustrian RI pada Gelar Teknologi Industri Kelapa Sawit, BPPT, 18-19 Juli 2007.
Sambutan Kepala Badan Pengkajian dan Penerapan Teknologi pada Gelar Teknologi Industri Kelapa Sawit, BPPT, 18-19 Juli 2007.
Shuman, S. 1991. Recombination Mediated by Vaccinia Virus DNA Topoisomerase I in Escherichia coli is Sequence Specific. Proc. Natl. Acad. Sci. USA 88, 10104-10108.
Shuman, S. 1994. Novel Approach to Molecular Cloning and Polynucleotide Synthesis Using Vaccinia DNA Topoisomerase. J. Biol. Chem. 269, 32678-32684.
Solovyev V.V.; Kolchanov N.A. 1994. Search for functional sites using consensus In Computer analysis of Genetic macromolecules. (eds. Kolchanov N.A., Lim H.A.), World Scientific, p.16-21.
Solovyev V.V.; Salamov A.A. 1997. The Gene-Finder computer tools for analysis of human and model organisms genome sequences. In Proceedings of the Fifth International Conference on Intelligent Systems for Molecular Biology (eds.Rawling C.,Clark D., Altman R.,Hunter L.,Lengauer T.,Wodak S.), Halkidiki, Greece, AAAI Press,294-302.
Solovyev V.V. 2001.Statistical approaches in Eukaryotic gene prediction. In Handbook of Statistical genetics (eds. Balding D. et al.), John Wiley & Sons, Ltd., p. 83-127.
Lampiran 2. Tahapan penelitian Pertama
Amplifikasi DNA dengan primer khusus Isolasi DNA akar kelapa sawit
Membuat primer khusus promotor spesifik akar (PSA)
Elektroforesis gel agarosa 1%
Desain primer untuk Gateway
Amplifikasi PSA Aka dengan primer Gateway
Rekombinasi PSA Aka pada entry vector dan vektor Destinasi
Transformasi pada E. coli XL-1 Blue atau DH5α
Konfirmasi PSA Aka pada entry vector maupun vektor Destinasi
Transformasi PSA Aka pada E. coli ke Agrobacterium tumefaciens Lampiran 3. Tahapan penelitian Kedua
Analisis koloni transforman dengan teknik PCR (PCR koloni)
Pengklonan TOPO 2.1
Isolasi DNA plasmid
Sekuensing
Gambar A. Koloni E. coli XL1 Blue yang tumbuh
Gambar B. Hasil perbanyakan koloni E. coli XL1 Blue
Gambar A. Hasil elektroforesis PCR
Gambar B. Hasil elektroforesis untuk elusi
Standard IUPAC Nucleotide codedigunakan untuk menggambarkan situs
jelas dengan motif urutan DNA tertentu, di mana karakter tunggal dapat mewakili
lebih dari satu nukleotida. Kode ini ditunjukkan dalam tabel di bawah ini.
Lampiran 8. Perkiraan ketepatan prediksi untuk Neural Network Promoter
Perhitungan persentasi berdasarkan rumus berikut:
predicted promoters
correlation coefficient (CC) = --- ________________________________ V (TP+FN)x(TN+FP)x(TP+FP)x(TN+FN)
ABSTRACT
RENDI PALAR.
Specific Promoters Root Construction of Oil Palm by Using Method of Gateway. Under direction of MARIA BINTANG and TETTYCHAIDAMSARY
Palm oil is one of the popular industrial product in the world today. With the growing number of new land-clearing case, was also attended by various production constraints such as diseases and pests that attack that caused the failure of production to the death of oil palm itself. Ganoderma is one of the pathogens that attack the disease of oil palm. It is well known proteins such as chitinase, glucanase, and stilbene synthetase are proteins that can inhibit the growth of Ganoderma. This study aims to construct a specific promoter (PSA) on the roots of oil palm to be able to express all three proteins earlier. Verification PSA oil palm has been tested using promoter prediction software and showed positive results
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis) adalah tumbuhan industri penting penghasil minyak masak, minyak industri, maupun bahan bakar (biodiesel). Perkebunan kelapa sawit menghasilkan keuntungan yang sangat besar sehingga banyak hutan dan perkebunan lama dikonversi menjadi perkebunan kelapa sawit. Di Indonesia penyebarannya di daerah Aceh, pantai timur Sumatra, Jawa, dan Sulawesi (Lötschert 1983
Berdasarkan data tahun 2006, Indonesia telah menjadi negara penghasil CPO (crude palm oil) terbesar di dunia dengan total produksi sekitar 16 juta ton. Sementara negara tetangga kita Malaysia yang selama ini berada pada posisi no.1, saat ini berada pada posisi ke-2 dengan total produksi sebesar 15.8 juta ton (berkas pidato sambutan kepala BPP Teknologi & berkas sambutan menteri perindustrian RI, BPPT 2007). Yang menarik dari data ini adalah, ternyata Indonesia mampu menjadi negara penghasil CPO nomor 1 di dunia 4 tahun lebih cepat dari prediksi sebelumnya, di mana Indonesia diperkirakan baru akan menjadi produsen CPO terbesar di dunia pada tahun 2010 (berkas pidato menteri riset dan teknologi, presentasi deputi kepala BPPT bidang teknologi informasi, industri dan material, BPPT 2007).
).
Dengan besarnya produksi CPO yang mampu dihasilkan, tentunya hal ini berdampak positif bagi perekenomian Indonesia, baik dari segi kontribusinya terhadap pendapatan negara, maupun besarnya tenaga kerja yang terserap di sektor industri ini yang mencapai 8.5 juta orang. Sektor ini juga mampu meningkatkan taraf hidup masyarakat di sekitar perkebunan sawit, di mana presentase penduduk miskin di areal ini kurang dari 6%, jauh lebih rendah dari angka penduduk miskin nasional sebesar 17% (berkas sambutan menteri negara riset dan teknologi, BPPT 2007). Boleh dibilang, industri kelapa sawit ini dapat diharapkan menjadi motor pertumbuhan ekonomi nasional.
yang mampu diterapkan, sehingga mayoritas devisa dari industri ini berasal dari industri hulunya. Teknologi yang perlu dikembangkan yaitu teknologi produksi tanaman tersebut, salah satunya adalah teknik dalam penanggulangan penyakit yang efektif, misalnya jamur.
Jamur yang dikenal dengan nama Ganoderma bersifat patogenik terhadap tanaman kelapa sawit. Ganoderma adalah cendawan patogen. Serangannya dapat mengakibatkan pembusukan pada pangkal batang kelapa sakit. Oleh karena itu disebut busuk pangkal batang (BPB). Jika pangkalnya busuk maka tanaman akan mati dan tumbang. Sementara ini hanya Ganoderma yang bisa menumbangkan pohon kelapa sakit dewasa. Karena ukurannya yang besar, Ganoderma tak ubahnya sebagai monster yang hidup di bawah permukaan tanah dan memakan setiap tanaman kelapa sawit baik yang masih muda maupun yang sudah tua (Darmono 2010).
Pengembangan teknologi terus dilakukan untuk memberantas hama penyakit kelapa sawit yang disebabkan oleh jamur Ganoderma ini. Penelitian ini diarahkan untuk meneliti promotor spesifik akar (PSA) kelapa sawit. Dengan adanya promotor spesifik akar diharapkan nanti gen-gen penghasil protein penghambat pertumbuhan Ganoderma ini terekspresikan sehingga dapat membuat kelapa sawit tahan terhadap hama jamur Ganoderma.
Rumusan Masalah
Berdasarkan latar belakang di atas maka didapat beberapa masalah yang memerlukan pengkajian khusus. Masalah-masalah itu adalah :
1. Penanganan penyakit yang disebabkan oleh jamur Ganoderma pada kelapa sawit belum bisa diatasi sampai sekarang secara efisien.
2. Perlu didapatkan terlebih dahulu suatu promotor spesifik dalam rangka untuk mengekspresikan gen-gen penghambat pertumbuhan Ganoderma ini.
3. Upaya rekombinasi PSA pada kelapa sawit belum pernah dilakukan. Tujuan Penelitian
Hipotesis
Hipotesis pada penelitian ini adalah plasmid rekombinan yang membawa DNA PSA dapat dikonstruksi dan disisipkan pada vektor ekspresi dengan metode Gateway.
Manfaat Penelitian
Setelah diketahui dan dapat di klon DNA PSA kelapa sawit dan dapat ditransferkan ke Agrobacterium, maka hal ini akan dapat membuka peluang untuk menyusun protein penghambat atau mekanisme serupa pada akar kelapa sawit yang merupakan media jangkit dari jamur Ganoderma ini, sehingga kelapa sawit bisa tahan serangan penyakit yang disebabkan oleh jamur Ganoderma ini.
Waktu dan Tempat Penelitian
TINJAUAN PUSTAKA
Kelapa Sawit (Elaeis guineensis)
Kelapa sawit berbentuk pohon. Tingginya dapat mencapai 24 meter. Akar serabut tanaman kelapa sawit mengarah ke bawah dan samping. Selain itu juga terdapat beberapa akar napas yang tumbuh mengarah ke samping atas.
Gambar 1. Kelapa sawit Afrika (Elaeis guineensis)
Seperti jenis palma lainnya, daunnya tersusun majemuk menyirip. Daun berwarna hijau tua dan pelepah berwarna sedikit lebih muda. Penampilannya agak mirip dengan tanaman salak, hanya saja dengan duri yang tidak terlalu keras dan tajam. Batang tanaman diselimuti bekas pelepah hingga umur 12 tahun. Setelah umur 12 tahun pelapah yang mengering akan terlepas sehingga penampilan menjadi mirip dengan kelapa. Tanaman Kelapa Sawit (Elaeis gunensis) termasuk kedalam Family Arecaceae, Ordo Arecales, dan Genus Elaeis.
jarang terjadi penyerbukan sendiri. Bunga jantan memiliki bentuk lancip dan panjang sementara bunga betina terlihat lebih besar dan mekar.
Buah sawit mempunyai warna bervariasi dari hitam, ungu, hingga merah tergantung bibit yang digunakan. Buah bergerombol dalam tandan yang muncul dari tiap pelapah.
Minyak dihasilkan oleh buah. Kandungan minyak bertambah sesuai kematangan buah. Setelah melewati fase matang, kandungan asam lemak bebas (FFA, free fatty acid) akan meningkat dan buah akan rontok dengan sendirinya.
Buah terdiri dari tiga lapisan:
Eksoskarp, bagian kulit buah berwarna kemerahan dan licin.
Mesoskarp, serabut buah
Endoskarp, cangkang pelindung inti
Inti sawit (kernel, yang sebetulnya adalah biji) merupakan endosperma dan embrio dengan kandungan minyak inti berkualitas tinggi.
Kelapa sawit berkembang biak dengan cara generatif. Buah sawit matang pada kondisi tertentu embrionya akan berkecambah menghasilkan tunas (plumula) dan bakal akar (radikula).
Syarat hidup Kelapa Sawit
Habitat aslinya adalah daerah semak belukar. Sawit dapat tumbuh dengan baik di daerah tropis (15° LU - 15° LS). Tanaman ini tumbuh sempurna di ketinggian 0-500 meter dari permukaan laut dengan kelembaban 80-90%. Sawit membutuhkan iklim dengan curah hujan stabil, 2000-2500 mM setahun, yaitu daerah yang tidak tergenang air saat hujan dan tidak kekeringan saat kemarau. Pola curah hujan tahunan memperngaruhi perilaku pembungaan dan produksi buah sawit.
Kelapa sawit yang dibudidayakan terdiri dari dua jenis: E. guineensis dan E. oleifera. Jenis pertama adalah yang pertama kali dan terluas dibudidayakan
orang. E. oleifera sekarang mulai dibudidayakan pula untuk menambah keanekaragaman sumber daya genetik.
Penangkar seringkali melihat tipe kelapa sawit berdasarkan ketebalan cangkang, yang terdiri dari :
Dura, Pisifera, dan Tenera.
Dura merupakan sawit yang buahnya memiliki cangkang tebal sehingga
dianggap memperpendek umur mesin pengolah namun biasanya tandan buahnya besar-besar dan kandungan minyak per tandannya berkisar 18%. Pisifera buahnya tidak memiliki cangkang namun bunga betinanya steril sehingga sangat jarang menghasilkan buah. Tenera adalah persilangan antara induk Dura dan jantan Pisifera. Jenis ini dianggap bibit unggul sebab melengkapi kekurangan masing-masing induk dengan sifat cangkang buah tipis namun bunga betinanya tetap fertil. Beberapa tenera unggul memiliki persentase daging per buahnya mencapai 90% dan kandungan minyak per tandannya dapat mencapai 28%. Untuk pembibitan massal, sekarang digunakan teknik kultur jaringan.
Minyak sawit digunakan sebagai bahan baku minyak makan, margarin, sabun, kosmetika, dan industri farmasi. Minyak sawit dapat digunakan untuk beragam peruntukan karena keunggulan sifat yang dimilikinya yaitu tahan oksidasi dengan tekanan tinggi, mampu melarutkan bahan kimia yang tidak larut oleh bahan pelarut lainnya, mempunyai daya melapisi yang tinggi dan tidak menimbulkan iritasi pada tubuh dalam bidang kosmetik.
Hasil tanaman
Minyak inti menjadi bahan baku minyak alkohol dan industri kosmetika. Bunga dan buahnya berupa tandan, bercabang banyak. Buahnya kecil, bila masak berwarna merah kehitaman. Daging buahnya padat. Daging dan kulit buahnya mengandung minyak. Minyaknya itu digunakan sebagai bahan minyak goreng, sabun, dan lilin. Ampasnya dimanfaatkan untuk makanan ternak. Ampas yang disebut bungkil inti sawit itu digunakan sebagai salah satu bahan pembuatan makanan ayam. Tempurungnya digunakan sebagai bahan bakar dan arang.
Buah diproses dengan membuat lunak bagian daging buah dengan temperatur 90 °C. Daging yang telah melunak dipaksa untuk berpisah dengan bagian inti dan cangkang dengan pressing pada mesin silinder berlubang. Daging inti dan cangkang dipisahkan dengan pemanasan dan teknik pressing. Setelah itu dialirkan ke dalam lumpur sehingga sisa cangkang akan turun ke bagian bawah lumpur. Sisa pengolahan buah sawit sangat potensial menjadi bahan campuran makanan ternak dan difermentasikan menjadi kompos.
Penyakit Busuk Pangkal Batang Kelapa Sawit