AKTIVITAS EKSTRAK, FRAKSI PELARUT, DAN SENYAWA
FLAVONOID DAUN SUKUN (
Artocarpus altilis
) TERHADAP
ENZIM
α
-GLUKOSIDASE SEBAGAI ANTIDIABETES
NYI MAS ROSMEINI ANICA GUSTINA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NYI MAS ROSMEINI ANICA GUSTINA. Aktivitas Ekstrak, Fraksi Pelarut, dan
Senyawa Flavonoid Daun Sukun (
Artocarpus altilis
) terhadap Enzim
α
-Glukosidase sebagai Antidiabetes. Dibimbing oleh ANNA PRIANGANI
ROSWIEM dan TJANDRAWATI MOZEF.
Tanaman sukun merupakan tanaman herbal yang telah dilaporkan
memiliki sifat biologis, seperti antioksidan, sitotoksik, antiinflamasi, antimikroba,
inhibitor enzim 5
α
-reduktase, inhibitor enzim tirosinase, dan inhibitor chatepsin
K. Tujuan penelitian adalah untuk mengetahui aktivitas inhibisi ekstrak dan
senyawa flavonoid dalam daun sukun terhadap enzim
α
-glukosidase secara
in
vitro
. Sampel ekstrak, fraksi, dan senyawa flavonoid yang digunakan diperoleh
dari penelitian yang telah dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Bandung. Aktivitas inhibisi ditentukan dengan menentukan persentase
inhibisi dan dilanjutkan dengan penentuan nilai IC
50. Hasil penelitian
menunjukkan bahwa keempat ekstrak pelarut (etanol, etil asetat, butanol, dan
heksana) memiliki kemampuan menghambat aktivitas enzim
α
-glukosidase.
Berdasarkan nilai IC50 dan uji statistik, ekstrak pelarut etanol dan fraksi etil asetat
memiliki kemampuan menghambat enzim
α
-glukosidase. Aktivitas inhibisi fraksi
etil asetat daun sukun (IC50=6,01 µg/mL) terhadap enzim
α
-glukosidase lebih baik
dari ekstrak etanol daun sukun (IC50=8,89 µg/mL). Berdasarkan hasil penelitian
dari keempat senyawa turunan flavonoid tersebut, yang berpotensi sebagai
antidiabetes (menghambat kerja enzim
α
-glukosidase) yang terbaik adalah
senyawa
((1-(2,4-dihidroksifenil)-3-[8-hidroksi-2-metil-2-(4-metil-3-pentenil)-2H-1-benzopiran-5-yl]-1-propanon) dengan kode AC-31 (IC
50=16,23 µM).
Senyawa tersebut merupakan turunan flavonoid golongan dihidrokalkon.
ABSTRACT
NYI MAS ROSMEINI ANICA GUSTINA. Extract, Fractions, and Flavonoids
Compounds Activities from Breadfruit Leaves (
Artocarpus altilis
) against
α
-Glucosidase Enzyme as an Antidiabetic. Under the direction of ANNA
PRIANGANI ROSWIEM and TJANDRAWATI MOZEF.
Breadfruits plants is one of the herbal plants that its leaves has been
reported to have biological properties, such as antioxidant, cytotoxic,
antiinflammatory, antimicrobial, 5
α
-reductase enzyme inhibitors, tyrosinase
enzyme inhibitors, and chatepsin K inhibitors. This study was conducted to
investigate inhibitor activity of extracts and flavonoids compounds from
breadfruit leaves against
α
-glucosidase enzyme using
in vitro
method. Extract and
flavonoid compound are from Indonesian Science Intitute’s research. Inhibitor
activity was determined by inhibition percentage and followed by determining the
IC
50value. The results showed that extract ethanol, and three other solvent
fraction (ethyl acetate, butanol, and hexane) has ability to inhibit
α
-glucosidase
enzyme activity. Based on IC50 values and statistical tests, ethanol and ethyl
acetate extracts which has a potential ability to inhibit
α
-glucosidase enzyme.
Ethyl acetate fraction from breadfruit leaves (IC50=6,01 µg/mL) has a better to
inhibit
α
-glucosidase activity than ethanol extracts (IC
50=8,89 µg/mL). Based on
fourth flavonoid derivative compounds results, which has the best active
compound as an antidiabeticis
(1-(2,4-dihydroxyphenyl)-3-[8-hydroxy-2-methil-2-(4-methyl-3-pentenil)-2H-1-ben zopyran-5-yl]-1-propanon) with AC-31code
(IC50=16,23 µM). This compound is a flavonoids derivatives compound in
dihydrocalcon group.
AKTIVITAS EKSTRAK, FRAKSI PELARUT, DAN SENYAWA
FLAVONOID DAUN SUKUN (
Artocarpus altilis
) TERHADAP
ENZIM
α
-GLUKOSIDASE SEBAGAI ANTIDIABETES
NYI MAS ROSMEINI ANICA GUSTINA
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Ekstrak, Fraksi Pelarut, dan Senyawa Flavonoid Daun
Sukun (
Artocarpus altilis
) terhadap Enzim
α
-Glukosidase sebagai
Antidiabetes
Nama
: Nyi Mas Rosmeini Anica Gustina
NIM
:
G84070053
Disetujui
Komisi Pembimbing,
Dr. Anna Priangani Roswiem, MS.
Tjandrawati Mozef, M. Es, SC, DU
Ketua
Anggota
Diketahui,
Dr. I Made Artika, M. App. Sc
Ketua Departemen Biokimia
i
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat,
nikmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini sebagai
salah satu persyaratan untuk memperoleh gelar Sarjana Sains pada Departemen
Biokimia, Fakultas Matematika & Ilmu Pengetahuan Alam Institut Pertanian
Bogor. Karya Ilmiah ini ditulis dengan judul “Aktivitas Ekstrak, Fraksi Pelarut,
dan Senyawa Flavonoid Daun Sukun (
Artocarpus altilis
) terhadap Enzim
α
-Glukosidase sebagai Antidiabetes”. Penelitian ini dilaksanakan pada bulan Maret
hingga Juli 2011 di Laboratorium Kimia Lembaga Ilmu Pengetahuan Indonesia
(LIPI)-Bandung
.
Terima kasih penulis ucapkan kepada Dr. Anna Priangani Roswiem, MS.
dan Tjandrawati Mozef, M. Es, SC, DU atas bimbingan, waktu, dan perhatiannya
kepada penulis selama penelitian dan penyusunan karya ilmiah. Ucapan terima
kasih juga penulis sampaikan kepada Chandra Risdian, S.Si, selaku asisten
peneliti yang telah banyak membantu dalam teknis pelaksanaan penelitian, kepada
kedua orang tuaku (Hayat Gustina dan Siti Bajina Djumeini), Ibu Renata
Magdalena, adik-adikku (Adwina, Khansa, dan Aulianita) dan seluruh keluarga
tercinta atas segala doa, dukungan, dan kasih sayangnya penulis terus berjuang
dan menjadi lebih baik. Terima kasih juga saya ucapkan kepada Gara,
sahabat-sahabat tercinta (Nadia, Tyas, C’mie, Ekky, Taufan, Dheo, Rama, Reni, Dwi,
Thafa, Imus, Gama, Daonk, Didi, Dian, Awi, Anom, Rizky, John, Alan, Yudist,
Riza, Ozo, Ricky, Ipunk, Agric Basketball, dan Dyah), dan Euis Nurhayati selaku
rekan kerja atas dukungan dan bantuannya selama penelitian dan penyusunan
skripsi. Semoga karya ilmiah ini dapat bermanfaat bagi pembaca dan ilmu
pengetahuan, khususnya dibidang Biokimia dan Farmasi.
Bogor, Februari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 20 Mei 1989 dari pasangan Hayat
Gustina dan Siti Bajina Djumeini. Penulis adalah anak pertama dari dua
bersaudara. Penulis lulus dari SMA Negeri 47 Jakarta pada tahun 2007, pada
tahun yang sama melanjutkan studi pada Departemen Biokimia Institut Pertanian
Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
iii
DAFTAR ISI
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... iv
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Diabetes Mellitus ... 1
Pengobatan Diabetes Mellitus ... 2
Tanaman Sukun ... 3
Enzim α-Glukosidase ... 3
Flavonoid ... 4
Kuersetin ... 5
BAHAN DAN METODE ... 6
Alat dan Bahan ... 6
Metode ... 6
HASIL DAN PEMBAHASAN ... 7
Aktivitas Kuersetin terhadap Enzim α-Glukosidase ... 7
Daya Inhibisi Sampel Ekstrak dan Fraksi Pelarut terhadap Enzim α-glukosidase ... 8
Nilai IC50 Sampel Ekstrak dan Fraksi Pelarut Daun Sukun ... 9
Daya Inhibisi Sampel Senyawa Flavonoid terhadap Enzim α-glukosidase ... 10
Nilai IC50 Sampel Senyawa Flavonoid ... 11
SIMPULAN DAN SARAN ... 12
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
1
Tanaman Sukun (
Artocarpus altilis
) ... 3
2
Jenis-jenis flavonoid (Sumber: Grotewold (2007)). ... 4
3 Struktur senyawa AC-51, AC-31, AC-33, dan AA-3 ... 5
4 Struktur
kuersetin
...
6
5
Struktur flavon dan flavonol. ... 10
DAFTAR LAMPIRAN
1 Diagram alir penelitian... 16
2 Tahapan uji inhibisi enzim
α
-glukosidase ekstrak daun sukun ... 17
3 Pembuatan sampel ekstrak pelarut (Dewi 2007) ... 18
4 Pembuatan stok sampel ekstrak pelarut dan stok sampel senyawa ... 19
5 Nilai absorbansi, perhitungan, dan grafik kuersetin sebagai kontrol
pembanding
...
20
6 Nilai absorbansi, perhitungan, dan grafik ekstrak etanol ... 21
7 Nilai absorbansi, perhitungan, dan grafik fraksi butanol ... 22
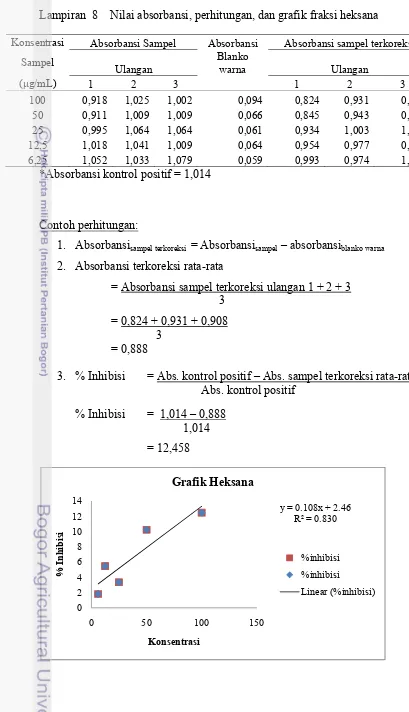
8 Nilai absorbansi, perhitungan, dan grafik fraksi heksana ... 23
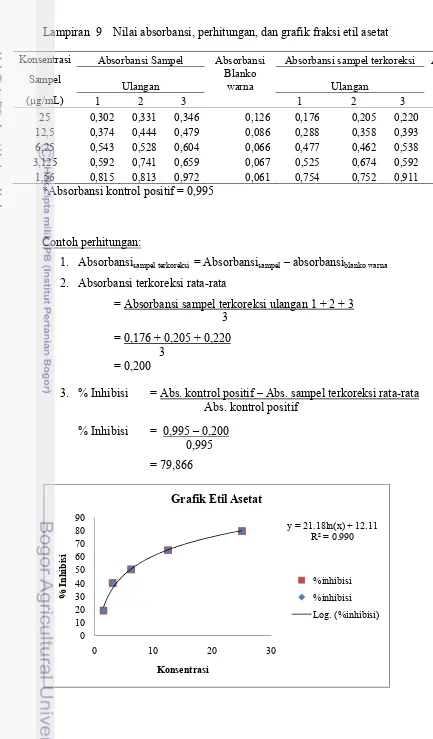
9 Nilai absorbansi, perhitungan, dan grafik fraksi etil asetat ... 24
10 Persentase inhibisi, persamaan logaritmik, dan IC50
ekstrak dan fraksi
pelarut...25
11 Nilai
absorbansi,
perhitungan, dan grafik senyawa AC-31 ... 26
12 Nilai
absorbansi,
perhitungan, dan grafik senyawa AC-51 ... 27
13 Nilai
absorbansi,
perhitungan, dan grafik senyawa AA-3 ... 28
14 Nilai
absorbansi,
perhitungan, dan grafik senyawa AC-33 ... 29
15 Persentase inhibisi, persamaan logaritmik, dan IC50 senyawa flavonoid ... 30
16 Hasil uji T-Test sampel ekstrak dan fraksi pelarut ... 31
17 Hasil uji T-test sampel senyawa flavonoid ... 32
18 Hasil uji aktivitas inhibisi sampel ekstrak pelarut dan sampel
senyawa flavonoid terhadap enzim
α
-glukosidase ... 33
19 Instrumen yang digunakan dalam penelitian ... 34
PENDAHULUAN
Indonesia merupakan negara yang memiliki flora yang sangat beragam yang banyak dimanfaatkan oleh rakyat Indonesia sebagai obat tradisional (Waji & Sugrani 2009). Hal ini disebabkan karena obat tradisional lebih mudah didapat, dan murah harganya. Pengobatan tradisional merupakan salah satu pengobatan yang menjadi tren saat ini. Namun, apabila penggunaan bahan alam yang digunakan untuk pengobatan tersebut kurang tepat, maka dapat menimbulkan efek samping yang merugikan. Oleh sebab itu, perlu diketahui kelebihan dan kekurangan dari tanaman obat tersebut agar dapat digunakan secara optimal.
Sukun (Artocarpus altilis) merupakan
salah satu tanaman yang terdapat di Indonesia dan dimanfaatkan untuk kehidupan sehari-hari. Buah tanaman ini dapat digunakan sebagai sumber alternatif makanan pokok. Selain itu, daun sukun digunakan sebagai obat alternatif, seperti obat hepatitis, jantung, ginjal, tekanan darah tinggi, diabetes, serta dapat digunakan sebagai bahan ramuan obat penyembuh kulit yang bengkak atau
gatal-gatal (Ramdhani 2009). Menurut Ermin et al.
(1991), sukun mengandung fenol, kuersetin, dan champorol, sedangkan menurut Ramdhani (2009), sukun banyak mengandung senyawa kimia yang berkhasiat, seperti saponin, polifenol, asam hidrosianat, asetilkolin, tanin, riboflavin, fenol, dan flavonoid. Senyawa turunan flavonoidnya adalah artoindonesianin, kuersetin, dan masih banyak lagi (Ramdhani 2009).
Diabetes Mellitus (DM) merupakan penyakit yang banyak diderita oleh penduduk di bumi ini. Berdasarkan data yang dikeluarkan World Health Organization (WHO), penderita diabetes di Indonesia pada tahun 2010 berjumlah 21,3 juta orang. Jumlah ini meningkat dari tahun 2000 yang hanya berjumlah 8,4 juta penderita. Holt dan Hanley (2007), telah memprediksi bahwa pada tahun 2025 jumlah penderita akan meningkat menjadi 324 juta orang. Jumlah tersebut menunjukkan kenaikan jumlah penderita diabetes dengan persentase sebanyak 72% (Holt & Hanley 2007). Selain itu, terdapat laporan kasus penyakit diabetes yang juga menyebabkan kematian. Oleh sebab itu, penyakit diabetes menjadi perhatian para peneliti.
Terdapat banyak faktor yang dapat menyebabkan penyakit diabetes, seperti pola hidup yang kurang baik, pola makan yang
tidak seimbang, obesitas, ataupun penyakit keturunan. Penyakit diabetes melitus dapat dicegah sebelum terjangkit dengan menjaga pola makan yang baik, sehat, dan seimbang.
Penyakit diabetes tidak dapat disembuhkan, namun resiko penyakit diabetes dapat diperkecil. Terapi diabetes dapat dilakukan dengan mengkonsumsi obat, baik secara tradisional ataupun modern, serta penting pula dilakukan diet makanan yang sehat dan seimbang. Berbagai macam jenis obat juga dikembangkan, mulai dari obat sintetis antidiabetes, pengobatan dengan insulin, obat yang bekerja pada enzim-enzim tertentu yang berperan dalam metabolisme glukosa, obat yang bekerja pada reseptor, maupun obat-obat yang langsung ke sel target dalam metabolisme glukosa.
Pengembangan jenis obat-obatan ini memerlukan tahapan-tahapan tertentu sebagai acuan dasar ilmiah. Tahapan-tahapan tersebut salah satunya adalah dengan melakukan
pengujian secara in vitro sebagai tahap
pengembangan obat tersebut. Uji secara in
vivo dari ekstrak daun sukun menunjukkan
penurunan kadar gula darah (Dewi 2007). Penurunan kadar gula darah ini salah satunya
melalui aktivitas enzim α-glukosidase,
sehingga komponen ekstrak daun sukun terhadap aktivitas α-glukosidase sebagai obat diabetes perlu diteliti lebih lanjut.
Penelitian ini bertujuan untuk mengetahui ekstrak dan senyawa flavonoid (31, AC-51, AA-3, dan AC-33) dari daun sukun
terhadap aktivitas enzim α-glukosidase yang
berperan dalam proses metabolisme glukosa secara in vitro. Hipotesis yang diajukan dalam penelitian ini adalah ekstrak daun sukun dan senyawa flavonoid di dalamnya diduga memiliki kemampuan menghambat aktivitas
enzim α-glukosidase. Hasil penelitian ini
diharapkan dapat digunakan sebagai salah satu dasar dalam pembuatan obat diabetes melitus (DM) dengan bahan dasar ekstrak daun sukun.
TINJAUAN PUSTAKA
Diabetes Mellitus
ditandai hiperglikemia kronik. Semua jenis penyakit diabetes mellitus pada metabolisme tersebut, umumnya ditandai dengan gejala yang mirip. Perkembangan dari penyakit ini adalah terjadinya kelainan, disfungsi, dan kerusakan beberapa organ khususnya mata, ginjal, saraf, jantung, dan pembuluh darah (Susanti 2006).
Hiperglikemia merupakan keadaan saat konsentrasi glukosa dalam darah melebihi batas normal. Keadaan ini diakibatkan karena defisiensi insulin relatif maupun absolut sehingga penyerapan glukosa yang masuk ke dalam sel tersebut terhambat. Saat keadaan normal, kira-kira 50% glukosa yang dikonsumsi mengalami metabolisme
sempurna menjadi CO2 dan air, 5% menjadi
glikogen, dan 30-40% menjadi lemak. Namun, proses ini terganggu pada pasien diabetes mellitus yang menyebabkan glukosa tidak dapat masuk ke dalam sel, dan energi yang diperoleh terutama berasal dari metabolisme protein dan lemak (Susanti 2006).
Diabetes mellitus terdiri atas tiga tipe penyakit, yaitu diabetes tipe 1, diabetes tipe 2, dan tipe lainnya yang biasa dialami oleh ibu-ibu hamil. Diabetes tipe 1 biasa disebut
dengan insulin-dependent diabetes atau
diabetes yang bergantung pada insulin. Diabetes tipe 1 ini disebabkan destruksi sel
beta (sel β) penghasil insulin pada pulau
Langerhans pankreas. Destruksi sel β pada
diabetes tipe 1 adalah kesalahan reaksi
autoimunitas yang menghancurkan sel β
pankreas. Reaksi autoimunitas tersebut dapat dipicu oleh adanya infeksi pada tubuh. Sampai saat ini dibetes mellitus tipe 1 hanya dapat diobati dengan insulin, dengan pengawasan yang teliti terhadap tingkat glukosa darah melalui alat monitor pengujian darah (Holt & Hanley 2007).
Diabetes tipe 2 atau diabetes yang tidak tergantung insulin, terjadi karena
kesalahan/ketidakteraturan (disorder) dalam
produksi insulin, resistensi terhadap insulin, atau berkurangnya sensitivitas sel terhadap insulin yang melibatkan reseptor di membran sel. Tahap awal yang utama adalah berkurangnya sensitivitas sel terhadap insulin, ditandai dengan meningkatnya kadar insulin dalam darah. Selain itu, diabetes tipe ini biasanya muncul perlahan dan tidak terlihat secara signifikan. Para penderita biasanya tidak menyadari adanya tanda-tanda penyakit ini. Penyakit ini biasanya disebabkan karena adanya penyakit keturunan (genetik) atau riwayat kesehatan
keluarga yang pernah mengalami penyakit ini serta pengaruh lingkungan, seperti pola makan, gaya hidup, serta obesitas (Holt & Hanley 2007).
Pengobatan Diabetes Mellitus
Penyembuhan diabetes dilakukan dengan melakukan diet dan olahraga. Namun,
saat diet dan olahraga tidak dapat
mempertahankan kondisi normal glukosa dalam darah, perlu ditambahkan pula agen/obat yang bersifat hipoglikemik yang diberikan secara oral. Pemberian agen/obat ini hanya digunakan sebagai tambahan saja, bukan untuk pengganti dari pola makan dan gaya hidup. Artinya, olahraga dan diet makanan yang juga perlu dilakukan agar kondisi gula dalam darah dapat tetap normal. Agen hipoglikemik oral tersebut me-
merlukan beberapa kapasitas dari
sisa sekresi insulin agar kerjanya menjadi
lebih efektif. Oleh karena itu, agen hipoglikemik ini tidak efektif apabila digunakan pada pasien dengan penyakit diabetes tipe 1. Berikut ini terdapat tiga kategori agen oral, yaitu insulin secretagoge, insulin sensitizer,dan inhibitor absorbsi glukosa yang terdapat pada saluran pencernaan. Namun, dapat pula dilakukan kombinasi dari masing-masing kategori obat tersebut sebagai peningkatan kadar glukosa dalam darah dengan hilangnya fungsi sel-β secara progresif (Holt & Hanley 2007).
Insulin secretagogues seperti sulfonilurea dan meglitinida, merupakan obat yang menstimulasi insulin yang diproduksi oleh pankreas. Obat ini dapat digunakan sebagai kombinasi obat untuk perawatan penderita resistensi insulin. Mekanisme kerja dari insulin secretagogus adalah dengan
merangsang pelepasan insulin dari sel-β
pankreas sebagai respon terhadap rangsangan glukosa yang berlebih, sehingga terjadi penutupan pompa kalium pada membran (Holt & Hanley 2007).
Mekanisme kerja dari insulin sensitizer
berbeda dengan insulin secretagogues. Obat
insulin sensitizer tidak berpengaruh pada sekresi insulin, namun obat ini meningkatkan efektivitas insulin yang terdapat dalam
sirkulasi darah. Contoh dari obat insulin
3
mengurangi penyerapan glukosa pada usus
kecil saat kelebihan metformin (Holt & Hanley 2007).
Sedangkan thiazolidinediones biasa disebut juga dengan glitazone. Obat ini digunakan secara klinis termasuk diantaranya pioglitazone dan rosiglitazone. Obat ini meningkatkan sensitivitas sel terhadap insulin yang terdapat pada jaringan adiposa, otot, dan hati. Inhibitor absorbsi glukosa yang terdapat pada saluran pencernaan digunakan untuk mengurangi penyerapan karbohidrat dari makanan. Contoh dari obat ini adalah
acarbose yang didisain untuk menghambat α
-glukosidase pada perbatasan antara usus kecil serta mengurangi penyerapan glukosa dari usus (Holt & Hanley 2007).
Tanaman Sukun
Tanaman sukun (Artocarpus altilis) dapat digolongkan menjadi sukun yang berbiji disebut breadnut dan yang tanpa biji disebut breadfruit. Sukun merupakan tanaman tropik sejati, yang dapat tumbuh paling baik di dataran rendah yang panas, namun juga dapat tumbuh di tempat yang basah (Ramdhani 2009). Sukun bukan buah bermusim meskipun biasanya berbunga dan berbuah dua kali setahun. Kulit buahnya berwarna hijau kekuningan dan terdapat segmen-segmen petak berbentuk poligonal. Segmen poligonal ini dapat menentukan tahap kematangan buah sukun (Mustafa 1998).
Gambar 1 Tanaman Sukun (Artocarpus
altilis) (Sumber: Hendalastuti & Rojidin 2006)
Sukun (Artocarpus altilis) adalah
tumbuhan dari genus Artocarpus dalam famili Moraceae yang banyak terdapat di kawasan tropika seperti Malaysia dan Indonesia. Ketinggian tanaman ini bisa mencapai 20 meter (Mustafa 1998). Di pulau Jawa tanaman ini dijadikan tanaman budidaya oleh
masyarakat. Buahnya terbentuk dari keseluruhan kelopak bunganya, berbentuk bulat atau sedikit bujur dan digunakan sebagai bahan makanan alternatif (Heyne 1987). Terdapat beberapa sinonim untuk tanaman
sukun, yaitu Artocarpus communis,
Artocarpus communis Forst, breadfruit, Artocarpus incisa L. f., Artocarpus altilis (Park.) Fosberg (Bappenas 2008). Berikut ini merupakan taksonomi dari tanaman sukun,
kingdom : plantae; divisi : magnoliophyta;
kelas : magnoliopsida; ordo : urticales; famili
: moraceae; genus : Artocarpus;
spesies: Artocarpus altilis(Sumber :
Syamsuhidayat & Hutapea 1991).
Penyebaran tanaman ini hampir merata di seluruh Indonesia, terutama Jawa Tengah dan Jawa Timur. Meratanya penyebaran sukun di sebagian besar kepulauan Indonesia, serta minimnya serangan hama dan penyakit yang membahayakan pada tanaman ini, memungkinkan sukun untuk dikembangkan (Ramdhani 2009). Pengembangan buah tanaman ini dapat digunakan sebagai sumber alternatif makanan pokok. Daun dari tanaman ini digunakan sebagai obat alternatif, seperti obat hepatitis, jantung, ginjal, tekanan darah tinggi, diabetes, serta dapat digunakan sebagai bahan ramuan obat penyembuh kulit yang bengkak atau gatal-gatal, karena mengandung fenol, kuersetin, dan champorol (Ermin et al. 1991).
Tanaman sukun memiliki beberapa kandungan kimia yang berkhasiat sehingga dapat digunakan sebagai tanaman herbal. Kandungan-kandungan tersebut diantaranya ialah saponin, polifenol, asam hidrosianat, asetilkolin, tanin, riboflavin, fenol. Daun tanaman ini juga mengandung kuersetin, champorol dan artoindonesianin. Artoindonesianin dan kuersetin merupakan senyawa turunan dari flavonoid (Soemyarso & Sjaifullah 2004). Berdasarkan penelitian
Syah et al (2006), terdapat dua senyawa
flavonoid tergeranilasi dari daun sukun, yaitu 2-geranil-2’,4’,3,4-tetrahidroksidihidrokalkon, dan 8-geranil-4’,5,7-trihidroksiflavanon. Kedua senyawa ini diisolasi dari ekstrak metanol daun sukun.
Enzim α-Glukosidase
Enzim α-glukosidase merupakan enzim
yang terdapat pada usus halus manusia. Enzim ini merupakan enzim kunci yang berperan dalam proses akhir pemecahan karbohidrat. Gao et al. (2007) menjelaskan bahwa enzim
α-glukosidase bekerja dengan cara
oligosakarida dan menghasilkan α -D-glikosida atau glukosa. Pengujian aktivitas enzim α-glukosidase dapat diukur secara in vitro dan in vivo.
Uji aktivitas enzim α-glukosidase
dilakukan untuk mengetahui adanya aktivitas ekstrakpelarut dan senyawa-senyawa yang terdapat dalam ekstrak daun sukun sebagai penghambat terbentuknya glukosa (antidiabetes). Penumpukan glukosa yang berlebihan merupakan salah satu pemicu terjadinya diabetes mellitus tipe II.
Vichayanrat, et al. (2002) menyatakan bahwa
pengobatan diabetes dengan inhibitor α
-glukosidase saat ini masih memiliki efek samping yang cukup serius, namun hal ini dapat diminimalisir dengan menggunakan
pengobatan secara alami. Menurut Jo S-H, et
al. (2009), telah ditegaskan bahwa inhibitor
alami yang berasal dari tumbuhan memiliki kemampuan inhibisi yang sangat baik dan efek samping yang sangat kecil, sehingga kemampuan inhibisi dari ekstrak daun sukun diduga dapat mencegah terjadinya penyakit diabetes mellitus tipe II.
Perkembangan ilmu pengetahuan dan teknologi dalam dunia biokimia dan kedokteran telah banyak memberikan informasi yang terkait dengan mekanisme
kerja enzim α-glukosidase. Informasi ini
membantu para ilmuwan untuk menemukan senyawa-senyawa baru yang dapat
menghambat aktivitas enzim α-glukosidase.
Inhibitor enzim α-glukosidase ini berperan
untuk mengatasi berbagai macam penyakit yang berhubungan dengan metabolisme karbohidrat, diantaranya diabetes mellitus, kanker, HIV, hepatitis, serta kegemukan (Liu et al. 2006).
Inhibitor enzim α-glukosidase merupakan
obat antihiperglikemia untuk pasien diabetes melitus tipe II. Karbohidrat yang dikonsumsi secara normal akan diubah terlebih dahulu menjadi monosakarida untuk dapat diserap oleh usus menjadi glukosa darah. Inhibitor
enzim α-glukosidase ini akan mencegah
pemecahan karbohidrat, seperti pati dan oligosakarida lainnya sehingga dapat mengurangi konsentrasi gula darah dari karbohidrat yang dikonsumsi (Chiasson 2002). Contoh obat dari jenis inhibitor enzim
α-glukosidase, diantaranya adalah acarbose,
maglitol, dan voglibose (Neal 2002).
Penghambatan aktivitas enzim α
-glukosidase dipelajari dengan cara pseudo
-substrat. Cara ini untuk mengetahui kemampuan sampel sebagai panghambat
reaksi hidrolisis glukosa pada substrat p
-nitrofenil-α-D-glukopiranosida (p-NPG).
Substrat yang terhidrolisis ini menghasilkan
α-D-glukosa (glukosa) dan p-nitrofenol yang
berwarna kuning (Sutedja 2003). Berikut merupakan reaksi kimia yang terbentuk:
p-NPG
Warna kuning yang dihasilkan ini menjadi indikator kemampuan sampel sebagai inhibitor penghambat reaksi. Sugiwati (2005) menyatakan bahwa produk yang dihasilkan berbanding lurus dengan warna kuning yang terbentuk dan berbanding terbalik dengan kemampuan inhibitor dalam menghambat produk.
Flavonoid
Flavonoid merupakan senyawa berbentuk fenol yang terbesar ditemukan di alam. Flavonoid merupakan senyawa yang terdiri atas 15 atom karbon, yang terdiri atas rantai propana (C-3) yang terikat pada dua cincin benzena (C-6). Golongan flavonoid yang terbesar mempunyai cincin piran yang menghubungkan rantai tiga-karbon dengan salah satu dari cincin benzena (Gambar 2). Flavonoid merupakan senyawa yang bersifat polar karena memiliki gugus gugus hidroksil yang tidak tersubstitusi. Oleh karena itu, pelarut polar seperti etanol, metanol, etil asetat, atau campuran pelarut dapat digunakan untuk mengekstrak flavonoid dari berbagai jaringan tumbuhan (Markham 1988).
Flavonoid yang tersedia di alam, sebagian besar dalam bentuk glikosida. Glikosida merupakan kombinasi antara suatu gula dan suatu alkohol yang terikat pada ikatan glikosidik. Flavonoid ditemui dalam bentuk mono-, di-, atau triglikosida. Oleh karena itu, unit-unit gugus hidroksil dalam flavonoid tersebut terikat oleh glukosa. Flavonoid digolongkan ke dalam beberapa golongan, yaitu flavonoid, isoflavonoid, dan neoflavonoid (Gambar 2). Pada tumbuhan tingkat tinggi, flavonoid terdapat pada bagian vegetatif maupun dalam bunga. Pada bunga, flavonoid berperan sebagai
5
pigmen bunga yang berperan dalam
menarik burung dan serangga penyerbuk. Selain itu, flavonoid juga berperan dalam pengaturan pertumbuhan, fotosintesis, antimikroba, dan antivirus (Robinson 1995).
Berbagai penelitian juga telah menyebutkan bahwa senyawa flavonoid berperan sebagai antidiabetes. Berdasarkan
penelitian Hartika (2009), Lukacinova et
al.(2008), dan Fawzy et al. (2008)
menunjukkan bahwa senyawa golongan flavonol dan flavon merupakan senyawa aktif yang berperan sebagai antidiabetes. Sampel senyawa flavonoid dari ekstrak daun sukun
ini direaksikan dengan p-NPG dan enzim α
-glukosidase. Sampel-sampel ini diharapkan dapat berkompetisi dengan substrat sehingga sampel dapat menempel pada sisi aktif enzim dan tidak terbentuk produk. Produk yang akan dihitung absorbansinya adalah p-nitrofenol yang berwarna kuning (Sutedja 2003). Semakin pekat warna p-nitrofenol menandakan bahwa semakin banyak jumlah produk p-nitrofenol yang terbentuk (Sugiwati 2005).
Berdasarkan jurnal yang ditulis oleh Syah (2005), senyawa-senyawa yang berasal dari tanaman sukun merupakan tanaman yang sangat bermanfaat dan memiliki potensi secara biologis. Senyawa ini telah dievaluasi sifat biologisnya terhadap berbagai sistem uji, yaitu meliputi sifat sitotoksik, antiinflamasi, antimalaria, antimikroba, sebagai inhibitor enzim 5α-reduktase, tirosinase, dan protease sistein chatepsin K. Secara fitokimia, sukun merupakan penghasil senyawa-senyawa flavonoid, stilbena dan 2-arilbenzofuran terprenilasi atau tergeranilasi. Terdapat berbagai macam senyawa yang telah diisolasi, seperti1-(2,4-dihidroksifenil)-3-[8-hidroksi-2- metil-(4-metil-3-pentenil)-2H-1-benzopiran-5-yl]-1-propanon yang diberi kode AC-31, 2-geranil-2’,3,4,4’-tetrahidroksidihidrokalkon yang diberi kode AC-51, siklokomunol yang diberi kode AA-3, 8-geranil-4’,5,7-trihidroksiflanon dengan kode AC-33, siklokomunin, artokomunol, dan masih banyak lagi (Gambar 3). Menurut Syah (2005), tanaman sukun belum dilaporkan mempunyai sifat biologis sebagai antidiabetes, namun hasil riset Dewi (2007) baik secara in vitro maupun secara in vivo, menunjukkan bakwa ekstrak daun sukun berpotensi sebagai antidiabetes.
Pada penelitian ini, beberapa senyawa yang telah diisolasi tersebut (AC-31, AC51, AC-33, dan AA-3) (Gambar 3) akan diuji
Gambar 3 Struktur senyawa: (a) (2-geranil-2’,3,4,4’-tetrahidroksidihidrokalkon)/ AC-51;
(b) ((1-(2,4-dihidroksifenil)-3-[8-hidroksi-2-metil-2-(4-metil-3-pentenil)-2H -1-benzopiran-5-yl]-1-propanon)/AC-31; (c)8-geranil-4’,5,7-trihidroksiflanon/AC-33); dan
(d) siklokomunol/AA-3 (Sumber: Syah (2005)).
sebagai antidiabetes. Syah (2005) telah menguji sifat biologis dari senyawa-senyawa diatas, yaitu senyawa AC-51 memiliki fungsi antitumor dan antiinflamasi dengan cara menginhibisi enzim 5-lipoksigenase; senyawa AA-3 memiliki fungsi sitotoksik, namun dari keempat senyawa diatas belum dilakukan pengujian untuk antidiabetes. Oleh sebab itu, keempat senyawa diatas akan diuji sebagai antidiabetes.
Kuersetin
Indonesia memiliki berbagai jenis flora, diantaranya banyak yang dimanfaatkan sebagai obat herbal. Namun, untuk mencapai fungsi yang baik perlu pengujian secara kimia, biologi, maupun biokimia.Uji fitokimia merupakan salah satu cara dalam penentuan senyawa yang terkandung dalam tanaman. Uji fitokimia mengkaji kandungan senyawa aktif yang terdapat pada tumbuhan. Senyawa aktif tersebut diharapkan memiliki efek farmakologis pada manusia atau kepentingan manusia itu sendiri. Salah satu contoh senyawa golongan flavonoid adalah kuersetin ( 3 , 3 ’ , 4 ’ , 5 , 7 - p e n t a h i d r o k s i f l a v o n o l )
(Gambar 4). Lee, et al. (2008) melaporkan
Gambar 4 Struktur kuersetin (3,3’,4’,5,7-pentahidroksiflavonol) (Sumber: Jo S-H, et
al.(2009))
Studi secara epidemiologi yang
dilakukan Griffiths, et al. (2002)
menjelaskan bahwa senyawa-senyawa flavonoid, termasuk kuersetin memiliki kemampuan pada penyakit diabetes tipe II.
Pada tahun 2009, Jo, et al. dalam jurnalnya
membuktikan bahwa kuersetin memiliki
kemampuan aktivitas inhibisi α
-glukosidase. Hasil penelitiannya juga menjelaskan bahwa kuersetin memiliki hasil yang signifikan dalam menginhibisi
α-glukosidase dibandingkan acarbose yang
selama ini sudah dijadikan obat diabetes. Sehingga dalam penelitian ini kuersetin dijadikan kontrol pembanding.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah pipet
mikro, multipipet, 96-well plate,
ELISA-reader, neraca analitik, lemari es (-20 0C), lemari beku (-80 0C), tip, waterbath, tabung Eppendorf, vorteks, tabung gelap 10 mL, laminar flow, spatula, inkubator CO2,
stopwatch, alat-alat gelas, dan shaker.
Bahan-bahan yang digunakan dalam penelitian ini adalah daun sukun, Dimetilsulfoksida (DMSO), buffer fosfat (pH
7), bovine serum albumin, enzim α
-glukosidase, p-nitrofenil-α-D-glukopiranosida
(p-NPG), larutan natrium bikarbonat
(Na2CO3), dan senyawa kuersetin.
Metode
Sampel
Sampel yang digunakan berasal dari Laboratoriun Kimia, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bandung. Sampel penelitian ini adalah ekstrak daun sukun menggunakan pelarut etanol, butanol, etil asetat, dan heksana. Serta senyawa-senyawa flavonoid yang diambil dari fraksi etil asetat, yang terdiri atas
((1-(2,4-dihidroksifenil)-3-[8-hidroksi-2-metil-2-(4-me til-3-pentenil)-2H-1-benzopiran-5-yl]-1-propa non)/AC-31, (2-geranil-2’,3,4,4’-tetrahidroksi dihidrokalkon)/AC-51, siklokomunol/AA-3, dan 8-geranil-4’,5,7-trihidroksiflanon/AC-33) yang berasal dari daun sukun.
Persiapan Sampel Ekstrak dan Fraksi Pelarut Daun Sukun
Sampel ekstrak daun sukun terdiri atas ekstrak etanol, fraksi butanol, fraksi etil asetat, dan fraksi heksana daun sukun. Ekstrak dan fraksi tersebut dalam bentuk serbuk, dan dibuat larutan eektrak dan fraksi pelarut dalam DMSO dengan konsentrasi 500 mg/mL (Lampiran 4). Sampel ini disebut stok sampel pelarut. Sampel ekstrak dan fraksi pelarut yang digunakan telah diperoleh dari penelitian sebelumnya. Sampel ekstrak dan fraksi pelarut ini pada awalnya didapatkan dengan mengekstraksi daun sukun. Ekstraksi pertama menggunakan metode maserasi dengan pelarut etanol 70%. Pelarut etanol digunakan karena pelarut etanol merupakan pelarut serbaguna, yang bersifat polar dan mampu mengekstrak senyawa-senyawa aktif secara optimal serta memperkecil jumlah pengotor yang ikut dalam larutan pengekstraksi. Selanjutnya ekstrak etanol tersebut difraksinasi berturut-turut menggunakan pelarut heksana, etil asetat, dan butanol (Dewi 2007). Partisi dengan heksana dan etil asetat untuk memisahkan senyawa yang bersifat non-polar dan senyawa yang non-polar sebagian (Lampiran 3).
Persiapan Sampel Senyawa Flavonoid
Sampel senyawa terdiri atas senyawaAC-31, AC-51, AA-3, dan AC-33 yang berasal dari ekstrak daun sukun. Keempat senyawa dalam bentuk serbuk, dan akan dibuat larutan sampel senyawa dalam DMSO dengan konsentrasi 50 mM (sampel ini disebut stok sampel senyawa) (Lampiran 4).
Uji Aktivitas Inhibisi Kuersetin terhadap Enzim α-Glukosidase
Berdasarkan jurnal yang ditulis oleh Jo, et
al., kuersetin merupakan salah satu senyawa
flavonoid yang dapat digunakan sebagai antidiabetes. Pengujian aktivitas inhibisi
kuersetin terhadap enzim α-glukosidase
dilakukan untuk membuktikan bahwa kuersetin dapat digunakan sebagai inhibitor
enzim α-glukosidase. Hasil positif akan
7
pembanding. Kuersetin diuji aktivitas inhibisi
dengan enzim α-glukosidase. Terdapat
beberapa konsentrasi kuersetin yang digunakan dalam uji inhibisi, yaitu 3,125 µM; 6,25 µM; 12,5 µM; 25 µM; 50 µM; 100 µM; dan 200 µM (Lampiran 5), serta dihitung persentase inhibisi dari masing-masing konsentrasi tersebut. Selanjutnya dihitung
nilai IC50 kuersetin yang dijadikan kontrol
pembanding untuk sampel-sampel yang digunakan (Lampiran 15).
Uji Aktivitas Inhibisi Enzim α-Glukosidase (Modifikasi Metode Sancheti et al. 2009)
Pengujian aktivitas inhibisi enzim α
-glukosidase menggunakan substrat p
-nitrofenil-α-D-glukopiranosida (p-NPG). La-rutan enzim dibuat dengan melarutkan 100 mL bufer fosfat (pH 7.0) dengan 200 mg bovine serum albumin, dan ditambahkan 1 mg
α-glukosidase. Enzim yang akan digunakan
dalam pengujian perlu diencerkan, yaitu sebanyak 0.1 mL larutan enzim dilarutkan dengan 5 mL bufer fosfat (pH 7.0). Pereaksi
yang digunakan terdiri atas 25 µL p
-nitrofenil-α-D-glukopiranosida 20 mM
sebagai substrat, 45 µL bufer fosfat (pH 7.0), dan 5 µL larutan sampel dalam DMSO yang diaduk hingga homogen. Pembuatan larutan
p-nitrofenil-α-D-glukopiranosida dilakukan
dengan melarutkan 15 mg p-NPG dalam 2.5
mL bufer fosfat.
Setelah ketiga pereaksi homogen,
sebanyak 25 µL larutan enzim α-glukosidase
ditambahkan dan diinkubasi selama 30 menit dengan suhu 37 0C. Reaksi tersebut dihentikan dengan menambahkan sebanyak 100 µL
Na2CO3 0,2 M. Selanjutnya diukur
padapanjang gelombang 400 nm
menggunakan ELISA-reader (Lampiran 2).
Blanko warna diisi menggunakan pereaksi
25 µL p-NPG, 5 µL sampel, dan 70 µL bufer
fosfat. Kontrol positif diisi dengan 5 µL
DMSO, 25 µL p-NPG, 25 µL enzim, dan 45
µL bufer fosfat. Sedangkan kontrol negatif sama perlakuannya dengan kontrol positif namun tidak menggunakan enzim. Semua perlakuan akan ditambahkan dengan 100 µL natrium karbonat (Na2CO3) (Lampiran 2).
Kontrol pembanding yang digunakan adalah kuersetin. Kuersetin yang akan digunakan sebelumnya perlu diketahui bobot molekulnya. Kemudian persiapan stok kuersetin yang akan digunakan sama seperti persiapan sampel.
Percobaan dilakukan sebanyak 3 kali ulangan dan dihitung dalam % inhibisi dengan rumus:
% C SC %
dengan ketentuan: C merupakan absorbansi kontrol positif dan S adalah absorbansi sampel terkoreksi. Contoh perhitungan dapat dilihat pada lampiran 6-9 dan lampiran 11-14.
Analisis Data (Mattjik 2002)
Rancangan percobaan pada penelitian ini adalah perbandingan antara kuersetin (sebagai antidiabetes) dengan senyawa-senyawa lainnya menggunakan uji T. Hipotesis yang digunakan adalah:
H0:µ1≤ µ2, dan H1: µ1 > µ2. Keterangan:
µ1= rataan kuersetin
µ2= rataan sampel masing-masing
ekstrak, fraksi, dan senyawa yang dibandingkan dengan kuersetin.
Analisis data dilakukan secara statistik, menggunakan program MINITAB 14. Pengaruh perlakuan secara signifikan
ditunjukkan dengan α = 0,01. Jika terdapat
perbedaan yang nyata antara kuersetin dengan sampel lain yang dibandingkan, maka disimpulkan bahwa sampel tersebut lebih baik sebagai antidiabetes (Lampiran 16 & 17).
HASIL DAN PEMBAHASAN
Aktivitas Kuersetin terhadap Enzim
α-Glukosidase
Pada pengujian yang dilakukan dalam penelitian ini, persentase inhibisi yang dinyatakan baik sebagai parameter antidiabetes yaitu sampel yang memiliki daya inhibisi lebih dari 50%. Nilai ini menunjukkan bahwa sampel memiliki kemampuan menginhibisi setengah atau
lebih enzim α-glukosidase, sehingga dapat
disebut antidiabetes karena menghambat pembentukan glukosa. Pengujian aktivitas
kuersetin terhadap enzim α-glukosidase
dengan persentase inhibisi berturut-turut sebesar 60,94 % dan 85,95 % (Tabel 1). Berdasarkan hasil ini, kuersetin dengan konsentrasi 200 µM memiliki kemampuan
menghambat aktivitas enzim α-glukosidase
sebesar 85,95%, sehingga membuktikan bahwa kuersetin dapat dijadikan sebagai inhibitor α-glukosidase.
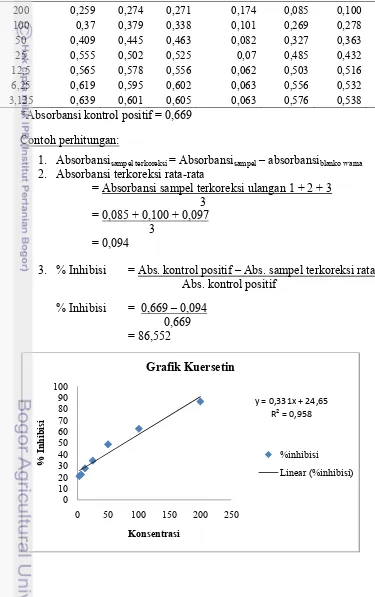
Grafik perbandingan antara konsentrasi dan persentase inhibisi kuersetin dinyatakan secara logaritmik. Persamaan yang didapat
adalah y = 15.35ln(x) - 6.008, dengan R2
sebesar 0,900 (Lampiran 5). Selain itu, hasil
perhitungan IC50 kuersetin dari konsentrasi
3,125 µM sampai 200 µM adalah sebesar 44,14 µM atau setara dengan 13,34 µg/mL (Lampiran 15).
Berdasarkan jurnal Fawzy et al. (2008)
yang membahas tentang kuersetin, kuersetin merupakan jenis flavonoid yang masuk dalam golongan flavonol. Fawzy et al. (2008) juga menjelaskan bahwa kuersetin merupakan senyawa aktif yang memiliki aktifitas antidiabetes yang dapat menurunkan kadar gula darah. Hal ini sesuai dengan penelitian yang dilakukan bahwa nilai inhibisi dari kuersetin memiliki hasil yang cukup besar, yaitu 86,55%. Nilai ini diperkuat dengan hasil
R2 sebesar 90% (Lampiran 5). Berdasarkan
persamaan logaritmik dari kuersetin, nilai IC50 kuersetin yang telah didapat, yaitu senilai
44,14 μM atau setara dengan 13,34 μg/mL
(Lampiran 15). Semakin kecil nilai IC50,
menunjukkan bahwa semakin baik kemampuan suatu senyawa untuk menginhibisi.
Berdasarkan nilai IC50 tersebut,
kuersetin dengan konsentrasi 44,14 μM
atau setara dengan 13,34 μg/mL, mampu
menghambat setengah aktivitas enzim α
-glukosidase untuk memproduksi glukosa.
Nilai ini menunjukkan bahwa nilai IC50
kuersetin sangat baik digunakan sebagai kontrol pembanding. Cara kerja dari kuersetin sebagai antidiabetes disebabkan adanya substituen gugus hidroksil pada
cincin C-3 (Lukacinova et al 2008)
(Gambar 4). Hidroksilasi cincin C-3 pada cincin karbon kerangka flavonol tersebut berperan penting dalam penghambatan
enzim α-glukosidase (Jo S-H 2009)
(Gambar 5). Tadera et al. (2006)
menyatakan bahwa aktivitas penghambatan enzim yang tinggi itu diakibatkan karena adanya reaksi hidroksilasi pada C-3 (C-3-OH) (Gambar 5).
Daya Inhibisi Sampel Ekstrak dan Fraksi Pelarut terhadap Enzim α-glukosidase
Pada pengujian aktivitas inhibisi sampel ekstrak dan fraksi pelarut terhadap enzim α -glukosidase, digunakan konsentrasi uji, yaitu
250 μg/mL; 125 μg/mL; 62,5 μg/mL; dan
31,25 μg/mL. Keempat variasi konsentrasi
tersebut tidak memberikan hasil yang optimal karena nilai persentase inhibisi dengan konsentrasi sampel tidak berbanding lurus, sehingga dilakukan pengulangan uji dengan konsentrasi yang lebih rendah hingga mendapatkan hasil yang optimal (Tabel 1). Hasil yang optimal ditunjukkan dengan nilai persentase inhibisi yang berbanding lurus dengan konsentrasi sampel, sehingga dapat
menghasilkan R2 yang mendekati 1,00
(Lampiran 6-10). Selain itu, dapat dilihat
dari nilai IC50 yang kecil dari variasi
konsentrasi tersebut (Lampiran 10).
Optimasi kedua dilakukan dengan lima variasi konsentrasi, dengan konsentrasi awal
100 μg/mL hingga 6,25 μg/mL. Pada variasi
konsentrasi ini hanya fraksi butanol dan fraksi heksana yang menunjukkan hasil yang sesuai (Lampiran 6 & 7). fraksi butanol menghasilkan persentase inhibisi yang cukup baik, yaitu 50,99–65,38% pada variasi
konsentrasi 12,5-100 μg/mL (Tabel 1).
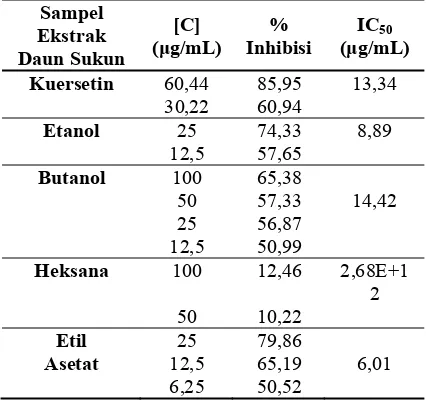
Sedangkan fraksi heksana, menghasilkan persentase inhibisi sangat rendah, yaitu kurang dari 50% (Tabel 1), sehingga fraksi heksana tidak dapat digunakan sebagai antidiabetes. Hasil ini sesuai dengan penelitian Ramdhani (2009) yang menyatakan Tabel 1 Daya inhibisi dan IC50 sampel ekstrak pelarut dengan kontrol pembanding (kuersetin).
Sampel Ekstrak Daun Sukun
[C] (μg/mL)
% Inhibisi
IC50 (μg/mL)
Kuersetin 60,44 85,95 13,34
30,22 60,94
Etanol 25 74,33 8,89
12,5 57,65
Butanol 100 65,38
50 57,33 14,42 25 56,87 12,5 50,99
Heksana 100 12,46 2,68E+1
2 50 10,22
Etil 25 79,86
Asetat 12,5 65,19 6,01
9
bahwa heksana tidak dapat melarutkan
senyawa-senyawa aktif dalam daun sukun. Berbeda dengan fraksi butanol dan fraksi heksana, ekstrak etanol dan fraksi etil asetat belum mendapatkan hasil yang optimal dengan pengulangan variasi kosentrasi di atas, sehingga dilakukan pengulangan uji dengan menggunakan konsentrasi yang lebih rendah. Variasi
konsentrasi tersebut adalah 25 μg/mL; 12,5
μg/mL; 6,25 μg/mL; 3,125 μg/mL; dan 1, 562
μg/mL. Berdasarkan variasi konsentrasi ini,
ekstrak etanol dan fraksi etil asetat memiliki hasil yang optimal. Ekstrak etanol memiliki persentase inhibisi di atas 50% pada
konsentrasi 25 μg/mL dan 12,5 μg/mL,
dengan nilai persentase inhibisi berturut-turut adalah 74,33 % dan 57,65 % (Lampiran 10). Sedangkan pada fraksi etil asetat memiliki inhibisi terbaik pada
konsentrasi 25 μg/mL; 12,5 μg/mL; dan
6,25 μg/mL, dengan nilai persentase
tertinggi 79,87 % pada konsentrasi 25
μg/mL (Tabel 1).
Grafik perbandingan antara konsentrasi sampel ekstrak dan fraksi pelarut dengan persentase inhibisi dibentuk berdasarkan persamaan logaritmik (Lampiran 6-9). Berdasarkan persamaan tersebut, nilai regresi tertinggi adalah sebesar 99% dari sampel fraksi etil asetat (Lampiran 9), diikuti sampel ekstrak etanol sebesar 98,8 % (Lampiran 6), fraksi butanol 93,1 % (Lampiran 7), dan fraksi heksana sebesar 83 % (Lampiran 8). Berdasarkan nilai regresi dan persentase inhibisi, ekstrak yang memiliki aktivitas antidiabetes terbaik adalah fraksi etil asetat dan ekstrak etanol. Hal ini disebabkan karena
dengan konsentrasi 25 μg/mL, fraksi etil
asetat mampu menginhibisi sebesar 79,86%, sedangkan ekstrak etanol mampu menginhibisi sebesar 74,33% (Tabel 1).
Berdasarkan hasil tersebut dapat disimpulkan bahwa aktivitas antidiabetes ekstrak dan fraksi pelarut berturut-turut adalah fraksi etil asetat (konsentrasi 25-6,25 μg/mL) > ekstrak etanol (konsentrasi
25-12,5 μg/mL) > fraksi butanol
(konsentrasi 100-12,5 μg/mL) > fraksi
heksana (konsentrasi 100-50 μg/mL). Hasil
ini sesuai dengan penelitian Ramdhani (2009) yang menyatakan kandungan senyawa aktif dalam daun sukun dapat larut dalam pelarut-pelarut di atas, kecuali heksana.
Nilai IC50 Sampel Ekstrak dan Fraksi Pelarut Daun Sukun
Tahapan selanjutnya dalam penelitian ini
adalah menentukan nilai IC50 masing-masing
sampel untuk mengetahui konsentrasi sampel yang dapat menghambat 50%
aktivitas enzim α-glukosidase. Semakin
rendah nilai IC50 maka semakin baik
digunakan sebagai antidiabetes, karena dengan nilai konsentrasi sampel yang sangat rendah dapat menghambat 50% aktivitas
enzim α-glukosidase sehingga pembentukan
glukosa akan terhambat. Nilai IC50
masing-masing ekstrak dihitung dari persamaan logaritmik yang telah didapat dari grafik
sampel ekstrak pelarut. Nilai IC50
masing-masing sampel ini dibandingkan dengan kontrol pembanding, yaitu kuersetin. Nilai
IC50 kuersetin setelah dikonversi ke dalam
satuan μg/mL adalah sebesar 13,34 μg/mL
(Tabel 1). Ekstrak yang memiliki nilai IC50
yang lebih kecil dari nilai IC50 kuersetin
merupakan nilai ekstrak yang memiliki aktivitas antidiabetes yang baik.
Hasil yang terlihat dalam tabel 1
menunjukkan bahwa nilai IC50 terendah
hingga tertinggi dimiliki oleh fraksi etil asetat, ekstrak etanol, fraksi butanol, serta fraksi heksana dengan nilai berturut-turut sebesar 6,01 μg/mL; 8,89 μg/mL; 14,42 μg/mL; dan
2,6x1012 μg/mL. Apabila dibandingkan
dengan nilai IC50 kuersetin (13,34 μg/mL), ekstrak dan fraksi pelarut terbaik yang dapat digunakan sebagai antidiabetes adalah fraksi etil asetat dan ekstrak etanol karena memiliki nilai IC50 yang lebih kecil dari kuersetin, yaitu
6,01 μg/mL dan 8,89 μg/mL (Lampiran 10).
Nilai tersebut diuji secara statistik untuk menentukan ketelitian hasil penelitian ini.
Berdasarkan nilai statistik uji T dengan tingkat kepercayaan 0.01, sampel ekstrak etanol dan fraksi etil asetat memiliki hasil yang berbeda nyata dengan kuersetin, sedangkan sampel fraksi butanol dan fraksi heksana tidak berbeda nyata (Lampiran 16). Hasil ini menunjukkan bahwa kedua sampel ini (fraksi etil asetat dan ekstrak etanol) lebih baik digunakan sebagai antidiabetes daripada kuersetin .
Hasil penelitian dan hasil statistik memiliki hasil yang sesuai, bahwa pelarut etanol dan pelarut etil asetat memiliki kemampuan dalam mengekstrak senyawa aktif daun sukun, sehingga mampu
menginhibisi aktifitas enzim α-glukosidase.
Gambar 5 Struktur: (a) flavon, dan (b)flavonol (Sumber: Grotewold (2007)).
dan memiliki nilai IC50 diatas kuersetin,
sehingga kedua pelarut tersebut tidak memberikan hasil yang signifikan dalam
menghambat enzim α-glukosidase.
Hasil uji fitokimia yang dilakukan oleh Dewi (2007) menunjukkan bahwa daun sukun sangat banyak mengandung senyawa flavonoid. Senyawa flavonoid tersebut diantaranya adalah flavonol, flavon, flavan, flavanon, dihidroflavonol, 3-ol, flavan-4-ol, dan flavan-3,4-diol (Grotewold 2007). Hasil penelitian Hartika (2009), Lukacinova et
al. (2008), dan Fawzy et al. (2008)
menunjukkan bahwa senyawa golongan flavonol dan flavon merupakan senyawa aktif yang berperan sebagai antidiabetes. Flavonol lebih polar dibandingkan dengan flavon karena flavonol memiliki gugus hidroksil pada posisi C-3 (Gambar 5). Pelarut etil asetat yang bersifat semi-polar baik untuk mengekstrak senyawa flavonol, sedangkan senyawa flavon dapat larut dalam pelarut butanol yang memiliki kepolaran yang lebih tinggi (Wijono 2003).
Nilai IC50 ekstrak etanol dan fraksi etil asetat tidak berbeda jauh (Tabel 1). Hal ini disebabkan karena etanol merupakan pelarut yang dapat melarutkan hampir semua senyawa-senyawa aktif. Pada penelitian ini, ekstrak etanol mampu mengekstrak senyawa-senyawa kimia yang bersifat polar maupun non-polar yang terdapat di dalam daun sukun, sehingga nilai IC50 etanol lebih rendah bila dibandingkan dengan kuersetin. Hasil tersebut menunjukkan kemampuan inhibisi dari ekstrak etanol lebih baik dibandingkan kuersetin. Nilai IC50 etil asetat menunjukkan hasil yang lebih kecil dari pelarut etanol. Hal ini menjelaskan bahwa senyawa-senyawa aktif yang dapat larut dalam etil asetat merupakan senyawa-senyawa yang dapat diekstrak dengan baik oleh pelarut etil asetat ini merupakan senyawa yang memiliki sifat semi-polar. Salah satu senyawa yang terdapat dalam fraksi etil asetat adalah flavonol (Wijono 2003). Senyawa yang larut dalam etil asetat ini sangat berpotensi sebagai antidiabetes karena nilai IC50 dalam pelarut
etil asetat bernilai 6,01 μg/mL lebih kecil
dibandingkan nilai IC50 pelarut etanol yang
bernilai 8,89 μg/mL. Hal ini diperkuat dengan hasil penelitian Hartika (2009), Lukacinova et
al. (2008), dan Fawzy et al. (2008), yang
menunjukkan bahwa flavonol merupakan salah satu senyawa yang berpotensi sebagai antidiabetes. Berdasarkan hasil penelitian ini, terbukti bahwa ekstrak daun sukun dalam pelarut etil asetat sangat baik digunakan sebagai antidiabetes karena memiliki nilai IC50 yang lebih kecil dibandingkan kuersetin sebagai kontrol pembanding dan pelarut etanol yang mampu mengekstrak hampir semua senyawa-senyawa aktif.
Daya Inhibisi Sampel Senyawa Flavonoid terhadap Enzim α-glukosidase
Sampel senyawa flavonoid yang digunakan adalah AC-31, AC-51, AC-33, dan AA-3 (Gambar 3). Variasi konsentrasi sampel senyawa yang digunakan dalam pengujian dimulai dengan lima variasi konsentrasi, yaitu
500; 250; 125; 62,5; dan 31,25 μM dengan
perlakuan yang sama. Berdasarkan kelima variasi konsentrasi tersebut hanya sampel senyawa AC-51, AA-3, dan AC-33 yang memiliki kemampuan inhibisi yang optimal (Lampiran 15). Sedangkan sampel senyawa AC-31 belum mendapatkan hasil yang optimal, sehingga perlu dilakukan pengulangan uji dengan variasi konsentrasi yang lebih rendah. Pengulangan uji sampel senyawa AC-31 dilakukan dengan lima variasi konsentrasi, yaitu 100; 50; 25; 12,5;
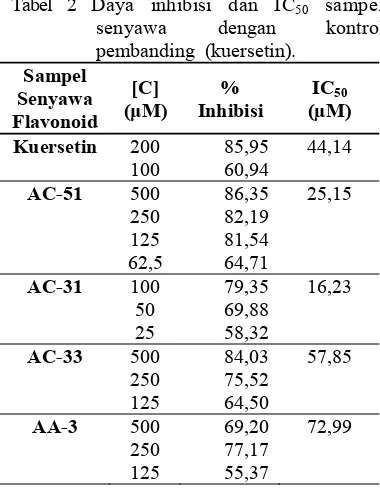
Tabel 2 Daya inhibisi dan IC50 sampel
senyawa dengan kontrol pembanding (kuersetin).
Sampel Senyawa Flavonoid
[C] (μM)
% Inhibisi
IC50 (µM)
Kuersetin 200 85,95 44,14
100 60,94
AC-51 500 86,35 25,15
250 82,19 125 81,54 62,5 64,71
AC-31 100 79,35 16,23
50 69,88 25 58,32
AC-33 500 84,03 57,85
250 75,52 125 64,50
AA-3 500 69,20 72,99
11
dan 6,25 µM. Berdasarkan variasi konsentrasi
tersebut dihasilkan persentasi inhibisi yang optimal (Lampiran 15).
Sampel senyawa AC-51 memiliki persentase inhibisi yang cukup besar dari kelima variasi konsentrasi di atas. Empat variasi konsentrasi, yaitu 500, 250, 125, dan 62,5 μM memiliki persentase inhibisi di atas 50%. Persentase tersebut berturut-turut sebesar 86,35 %; 82,19 %, 81,54 %; 64,71 % (Tabel 2). Grafik perbandingan antara konsentrasi dengan persentase inhibisi melalui persamaan logaritmik, dengan persamaan y=
13,74 ln(x) + 6,1 dan R2 sebesar 0,86
(Lampiran 12).
Pada sampel senyawa AA-3, persentase inhibisi di atas 50% ditunjukkan pada tiga konsentrasi tertinggi, yaitu 500, 250, dan 125 μM. Persentase inhibisi tersebut berturut-turut sebesar 69,20%; 77,17%; dan 55,37% (Tabel 2). Persamaan logaritmik yang didapat antara konsentrasi dengan persentase inhibisi
adalah y = 13.37 ln(x) - 7.216, dengan R2
senilai 0,841 (Lampiran 13). Persentase inhibisi terbaik pada sampel senyawa AA-3 adalah konsentrasi 250 mM (Tabel 2).
Hasil persentase inhibisi pada sampel senyawa AC-33 juga menghasilkan tiga variasi kosentrasi tertinggi, yaitu 500, 250,dan 125 μM. Ketiga konsentrasi tersebut memiliki persentase inhibisi sebesar 84,03%; 75,52%; dan 64,50% (Tabel 2). Berbeda dengan AA-3, persentase inhibisi terbesar pada AC-33adalah 84,03% dengan konsentrasi 500 mM (Tabel 2). Persamaan logaritmik yang ditunjukkan melalui grafik antara konsentrasi dengan persentase inhibisi adalah y = 13.18ln(x) -
4.958, dengan R2 sebesar 0,934 (Lampiran
14).
Pada sampel senyawa AC-31 didapatkan tiga variasi konsentrasi tertinggi yang memiliki persentase inhibisi di atas 50%. Konsentrasi tersebut adalah 100 μM, 50 μM,
dan 25 μM, dengan persentase inhibisi
berturut-turut adalah 79,35%; 69,88%; dan 58,32% (Tabel 2). Grafik antara konsentrasi dan persentase inhibisi pada senyawa AC-31 juga dinyatakan melalui persamaan logaritmik. Persamaan logaritmik yang didapat pada sampel senyawa AC-31 adalah y = 16.57ln(x) + 4.344, dengan R2 sebesar 0,992 (Lampiran 11).
Berdasarkan hasil nilai persentase inhibisi di atas, maka aktivitas antidiabetes senyawa flavonoid berturut-turut adalah: AC-51
(konsentrasi 500 μM-62,5 μM), AC-33
(konsentrasi 500 μM-125 μM), AC-31
(konsentrasi 100 μM-25 μM), dan AA-3
(konsentrasi 500 μM-125 μM). Namun,
apabila dibandingkan dengan kuersetin sebagai kontrol positif, nilai persentase inhibisi yang dimiliki AC-51 lebih kecil, karena persentase inhibisi yang dimiliki oleh kuersetin adalah 85,95% dengan konsentrasi
200 μM, sedangkan nilai persentase inhibisi
AC-51 adalah 86,35% pada konsentrasi
500μM (Tabel 2). Nilai ini menunjukkan
bahwa kuersetin memiliki kemampuan inhibisi lebih baik dibandingkan AC-51. Kuersetin memiliki kemampuan yang lebih baik karena dengan konsentrasi yang lebih kecil, senyawa ini memiliki daya inhibisi yang lebih besar. Sedangkan senyawa AC-51 yang memiliki daya inhibisi mendekati kuersetin, namun membutuhkan konsentrasi yang lebih besar.
Walaupun telah disebutkan sebelumnya bahwa berdasarkan nilai persentase inhibisi yang terbaik adalah AC-51, namun berdasarkan analisis data persentase inhibisi yang terbaik adalah AC-31 (Tabel 2). Hal ini disebabkan karena dengan konsentrasi 100
μM, senyawa AC-31 dapat menginhibisi
hingga 79,35% (Tabel 2) dan menghasilkan
R2 sebesar 0,9923 (Lampiran 15)). Apabila
dibandingkan dengan konsentrasi yang diujikan pada kuersetin maupun AC-51, aktivitas senyawa AC-31 terbukti lebih aktif
menghambat enzim α-glukosidase.
Nilai IC50 Sampel Senyawa Flavonoid
Berdasarkan hasil persentase daya inhibisi sampel senyawa flavonoid, telah disebutkan bahwa senyawa yang memiliki aktivitas inhibisi terbaik adalah AC-31, namun perlu dilakukan penentuan nilai IC50 masing-masing sampel senyawa flavonoid agar diketahui senyawa yang berpotensi sebagai antidiabetes.
Nilai IC50 didapatkan dari persamaan
logaritmik. Setelah didapatkan nilai IC50,
selanjutnya keempat sampel senyawa diuji
statistik dan membandingkannya dengan IC50
senyawa kuersetin. Nilai IC50 digunakan untuk menunjukkan keefektifan suatu senyawa atau zat tertentu dalam menginhibisi fungsi biologis maupun fungsi biokimia. Semakin
rendah nilai IC50 menunjukkan bahwa
senyawa tersebut memiliki kemampuan inhibisi yang baik.
Nilai IC50 pada tabel 2 menunjukkan
bahwa nilai IC50 tertinggi hingga terendah
adalah AA-3, AC-33, AC-51, dan AC-31 dengan nilai konsentrasi inhibisi berturut-turut 72,99; 57,85; 25,15; dan 16,23 (Tabel 2).
Apabila dibandingkan dengan IC50 kuersetin
AC-31 yang dapat digunakan sebagai
inhibitor enzim α-glukosidase. Namun, hasil
ini diuji secara statistik melalui uji T.
Berdasarkan data hasil uji T pada tingkat
kepercayaan α < 0.01, menunjukkan bahwa
sampel senyawa AC-31 memiliki hasil yang berbeda nyata dengan kuersetin, sedangkan sampel senyawa AC-51 memiliki hasil yangtidak berbeda nyata (Lampiran 17). Hasil ini menunjukkan bahwa hanya sampel AC-31yang baik digunakan sebagai antidiabetes dibandingkan kuersetin secara statistik.
Senyawa-senyawa yang digunakan dalam penelitian ini merupakan senyawa golongan flavonoid. Senyawa golongan flavonoid memiliki ciri umum yaitu terdiri atas rantai propana (C-3) yang terikat diantara dua cincin benzena (C-6) (Grotewold 2007). Keempat senyawa ini telah diisolasi dan diidentifikasi oleh Syah (2005), serta telah teruji memiliki beberapa sifat biologis. Berdasarkan publikasi tersebut, senyawa AC-31, senyawa AC-51, dan senyawa AC-33 termasuk ke dalam senyawa turunan flavonoid yang tergeranilasi. Senyawa AC-31 dan AC-51 ditemukan dalam bentuk dihidrokalkon, sedangkan senyawa AC-33 ditemukan dalam bentuk flavanon. Senyawa AA-3 juga merupakan senyawa flavonoid yang merupakan turunan dari flavon. Turunan flavon ini merupakan jenis piranoflavon.
Berdasarkan hasil penelitian, nilai IC50
senyawa AC-31 dan AC-51 memiliki nilai yang lebih kecil dibandingkan kuersetin. Sedangkan AC-33 dan AA-3 memiliki nilai
IC50 yang lebih tinggi dibandingkan
kuersetin (Tabel 2). Hasil ini menunjukkan bahwa senyawa flavonoid dalam bentuk dihidrokalkon memiliki aktvitas yang sangat
baik untuk menghambat aktivitas enzim α
-glukosidase, dibandingkan flavanon dan piranoflavon. Walaupun senyawa AC-31 dan AC-51 dalam jenis yang sama, yaitu dihidrokalkon, namun senyawa AC-31 lebih berpotensi sebagai antidiabetes bila dibandingkan senyawa AC-51. Hal ini dapat
dilihat dari nilai IC50 senyawa AC-31 yang
lebih kecil dari senyawa AC-51 dan dipertegas dengan hasil statistik yang menunjukkan bahwa hanya senyawa AC-31 yang berpotensi sebagai antidiabetes. Selain itu, apabila dilihat berdasarkan strukturnya, kedua senyawa ini memiliki perbedaan pada struktur gugus geranilnya (Gambar 3).
SIMPULAN DAN SARAN
Simpulan
Ekstrak etanol dan etil asetat daun sukun
dapat menghambat enzim α-glukosidase,
sehingga berpotensi sebagai antidiabetes. Daya inhibisi ekstrak etil asetat daun sukun
terhadap enzim α-glukosidase memiliki nilai
IC50 yang lebih tinggi, yaitu sebesar 6,01
µg/mL. Sedangkan nilai IC50 ekstrak etanol
daun sukun adalah sebesar 8,89 µg/mL. Senyawa ((1-(2,4-dihidroksifenil)-3-[8- hidroksi-2-metil-2-(4-metil-3-pentenil)-2H-1-benzopiran-5-yl]-1-propanon)/AC-31 memi- liki nilai inhibisi paling tinggi terhadap enzim
α-glukosidase, dengan nilai IC50 sebesar 16,23 µM dan merupakan turunan flavonoid dengan golongan dihidrokalkon.
Saran
Penelitian selanjutnya hendaknya melakukan uji fitokimia terhadap ekstrak dan dan fraksi pelarut yang digunakan. Selain itu, perlu dilakukan berapa unit produk yang terbentuk dari sampel-sampel yang digunakan sehingga diketahui kemampuan sampel dalam menginhibisi enzim α-glukosidase.
DAFTAR PUSTAKA
[Bappenas]. 2008. Program Nasional Bagi Anak Indonesia Kelompok Kesehatan. Bappenas. [terhubung berkala]. http://www.bappenas.go.id. [21 Februari 2011].
Chiasson J, Josse RG, Gomis R, Hanefeld
M, Karasik A, Laakso M. 2002.
Acarbose for prevention of type 2 diabetes mellitus: the stop NIDDM
randomized. Medical Progress 359:
2072-2077.
Dewi, PNL. 2007. Daun Sukun (Artocarpus
communis) sebagai Fitofarmaka Antidiabetes. Laporan Kemajuan Kegiatan Tahap I Riset Unggulan dan Kompetitif. Pusat Penelitian Kimia LIPI: Bandung.
Ermin T, Atmodjo D, Winarno, Soemantri
AG. 1991. Penatalaksanaan kegawatan
neonatus. Semarang: Balai Penerbit Fakultas Kedokteran Universitas Diponegoro hal.: 46-90.
Fawzy C, Abdallah HM, Mohamed SAM,
Fathy MS, dan Amany AS. 2008.
13
of Major Flavonoids of Cynanchum
acutum L. (Asclepiadaceae) Growing in Egypt. Z. Natureforsch 63: 658-662.
Gao H, Huang YN, Gao B, dan Kawabata J.
2007. Chebulagic acid is a potent α
-glucosidase inhibitor. Biosci Biotechnol Biochem 72:601-603.
Griffiths G, Trueman L, Crowther T, dan Thomas B. 2002. Onions, a global
benefit to health. Phytotherapy Res
17:603-615.
Grotewold, Erich. 2007. The Science of
Flavonoids. USA: Springer.
Hartika, Rolif. 2009. Aktivitas Inhibisi
α-Glukosidase Ekstrak Senyawa Golongan Flavonoid Buah Mahkota Dewa. [Skripsi]. Bogor: Institut Pertanian Bogor.
Hendalastuti, H.R dan Rojidin, A. 2006. Karakteristik Budidaya dan Pengolahan Buah Sukun: Studi Kasus di Solok dan
Kampar. Di dalam: Seminar Hasil
Litbang Hasil Hutan, Jakarta, 2006. Jakarta: Departemen Kehutanan. 220-232.
Heyne, K. 1987. Tumbuhan Berguna
Indonesia Jilid II. Badan Litbang Kehutanan: Jakarta.
Holt, RIG dan Hanley, NA. 2007. Essential
Endocrinology and Diabetes. United Kingdom: Blackwell Publishing.
Jo S-H, Ka E-H, Lee H-S, Apostolidis E, Jang H-D dan Kwon Y-I. 2009. Comparison of antioxidant potential and rat intestinal
α-Glucosidases inhibitory activities of
kuersetin, rutin, and isokuersetin. International Journal of Applied Research in Natural Products2 (4): 52-60.
Lee SK, Hwang JY, Kang MJ, Kim YM, Jung SH, Lee JH, and Kim JI. 2008. Hypoglycemic effect of onion skin extract in animal models of diabetes mellitus. Food Sci Biotech 17:130-134. Liu Y, Zou L, Lin M, Wen-Hua Chen, Bo
Wang. 2006. Synthesis and pharmacological activities of santhone derivatives as alfa-glucosidase
inhibitors. Bioorganica and medical
chemistry 14: 5683-5690.
Lukacinova, J. Mojzis, R. Benacka, J. Keller, T. Maguth, P. Kurila, L. Vasko, O. Racz,
dan F. Nistiar. 2008. Preventive effects of flavonoids on alloxan-induced
diabetes mellitus in rats. ACTA VET
BRNO (77): 175-182.
Markham KR. 1988. Cara Mengidentifikasi
Flavonoid. Bandung: Institut Teknologi
Bandung. Terjemahan dari: Techniques
of Flavonoid Identification.
Mattjik A.A. dan Sumertajaya IM. 2000. Perancangan Percobaan Jilid I. Bogor: IPB Press.
Mustafa, AM. 1998. Isi kandungan Artocarpus
communis. Food Science 9: 23.
Neal, MJ. 2002. Medical Pharmacology a
Glance. New York: Blackwell Publishing.
Ramdhani, AN. 2009. Uji Toksisitas Akut
Ekstrak Etanol Daun Sukun (Artocarpus altilis) terhadap Larva Artemia salina Leach denganmetode Brine Shrimp Lethality Test (BST). [Skripsi]. Semarang: Universitas Diponegoro.
Robinson, T. 1995. Kandungan Organik
Tumbuhan Tingkat Tinggi. Bandung: ITB.
Sancheti Shruti, Sandesh Sancheti and Sung-Yum Se. 2009. Chaenomeles sinensis: a potent α- and β-glucosidase inhibitor. American Journal of Pharmacology and Toxicology 4(1): 8-11.
Soemyarso, N dan Noer, MS. 2004. Gagal ginjal
akut pada nonatus. Lab/SMF Ilmu
Kesehatan Anak FK UNAIR/RSU Dr Soetomo. [terhubung berkala]. http://unmed.utah.edu/. [20 Februari 2011].
Sugiwati, S. 2005. Aktivitas Antihiperglikemik dari Ekstrak Buah Mahkota Dewa (Phaleria macrocarpa(Scheff) Boerl.) sebagai Inhibitor α-Glukosidase In Vitro dan In Vivo pada Tikus Putih. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Susanti, E. 2006. Hubungan Antara
Atherogenic Index of Plasma, LDL kecil padat, Lechitin Cholesterol Acyl Transferase, dan Cholesterol ester transfer perotein pada Diabetes Melitus Tipe 2 Terkontrol. Bandung: Laboratorium Klinik Prodia.
Sutedja, L. 2003. Bioprospekting Tumbuhan
Kemajuan Tahap II Riset Unggulan Terpadu, Pusat Penelitian Kimia-LIPI. Syah, YM. 2005. Fitokimia, Kemotaksonomi,
dan Sifat Biologis Metabolit Sekunder dar Tanaman Sukun (Kelewih)
[Review]. Bull.Soc. Nat. Prod. Chem
(Indonesia) 5: 33-50.
Syah, YM; Achmad, SA.; Bakhriar, E.; Hakim, E.H.; Juliawaty, L.D.; Latip, J. 2006. Dua flavonoid tergeranilasi dari
daun Sukun (Artocarpus altilis). ITB:
Bandung.
Syamsuhidayat, SS dan Hutapea, J.R. 1991. Inventaris Tanaman Obat Indonesia, edisi kedua. Jakarta: Departemen Kesehatan RI.
Tadera K, Minami Y, Takamatsu K, dan
Matsuoka T. 2006. Inhibition of α
-glucosidase and α-amylase by
flavonoids. J Nutr Sci Vitaminol 52:149-153.
Vichayanrat A, Ploybutr S, Tunlakit M, and Watanakejorn P. 2002. Efficacy and safety of voglibose in comparison with acarbose in type 2 diabetic patients. Diabetes Res Clin Pract 55(2):99-103.
Waji, RA dan Sugrani, A. 2009. Kimia
organik bahan alam: flavonoid (kuersetin).[Makalah]. Makassar: Universitas Hasanuddin.
WHO. 2010. Definition, Diagnosis and
Classification of Diabetes Melitus and it’s Complications. Geneva: WHO Publishing.
Wijono, S. 2003. Isolasi dan identifikasi
flavonoid pada daun katuk (Sauropus
Lampiran 1 Diagram alir penelitian
Ekstraksi daun sukun (Dewi 2007)
Persiapan sampel
Uji inhibisi kuersetin terhadap enzim
α
-glukosidase
Uji inhibisi enzim
α
-glukosidase dengan sampel
Penentuan persentase inhibisi sampel
Penentuan IC
50sampel
17
Lampiran 2 Tahapan uji inhibisi enzim
α
-glukosidase ekstrak daun sukun
Persiapan sampel uji ekstrak dan senyawa flavonoid
(Pengenceran sampel menjadi konsentrasi yang ditentukan)
Sebanyak 5 µL larutan sampel uji/DMSO dimasukkan dalam sumur
microplate
25 µL
p
-NPG 25 µL
p
-NPG 25 µL
p
-NPG 25 µL
p
-NPG 25 µL
p
-NPG
45 µL 45 µL
45 µL
70 µL 70 µL
Bufer fosfat Bufer fosfat Bufer fosfat Bufer fosfat Bufer fosfat
Penambahan 25 µL larutan enzim
α
-Glukosidase
Inkubasi selama 30 menit pada suhu 37
0C
Penambahan larutan Na
2CO
3sebanyak 100 µL
Baca serapan pada panjang gelombang 400 nm
*Keterangan:
- Blanko warna diisi dengan sampel, substrat (p-NPG), dan bufer fosfat.
- Kontrol (+) diisi dengan DMSO, substrat (p-NPG), bufer fosfat, dan enzim α -glukosidase.
- Kontrol (-) diisi dengan DMSO, substrat (p-NPG), dan bufer fosfat.
- Perlakuan diisi dengan sampel, substrat (p-nPG), bufer fosfat, dan enzim α -glukosidase.
Kontrol (+)
Kontrol Pembanding
(kuersetin)
Sampel uji Blanko warna
Lampiran 3 Pembuatan sampel ekstrak pelarut (Dewi 2007)
Daun sukun dikeringkan pada suhu 50
0C, dihaluskan
Direndam dalam etanol (maserasi)
Ekstak daun sukun diuapkan vakum
Ekstrak etanol daun sukun
Sebanyak 250 g ekstrak etanol daun sukun diambil dan ditambahkan pelarut
Heksana: H2O = 1:4
Fraksinasi larutan tersebut
Fraksi Heksana
Residu
Fraksinasi
dengan
etil
asetat
Fraksi
Residu
Etil Asetat
Fraksinasi dengan butanol
19
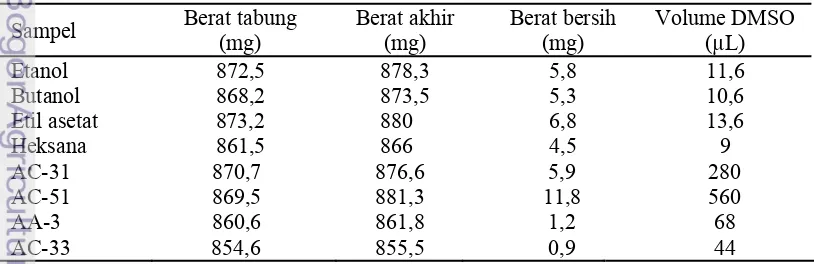
Lampiran 4 Pembuatan stok sampel ekstrak pelarut dan stok sampel senyawa
Pembuatan stok sampel fraksi pelarut didahului dengan menimbang tabung Eppendorf kosong menggunakan neraca analitik, kemudian masing-masing sampel dimasukkan ke dalamnya dan ditimbang kembali bobotnya. Hasil penimbangan tabung Eppendorf dengan sampel dikurangi bobot tabung Eppendorf kosong menjadi berat bersih sampel fraksi pelarut. Sampel fraksi tersebut dilarutkan dengan larutan dimetilsulfoksida (DMSO). Volume DMSO yang akan ditambahkan, dapat dihitung dengan contoh sebagai berikut:
Konsentrasi yang akan dibuat adalah 500 mg/mL, berat bersih fraksi adalah 5,8 mg. Maka volume DMSO yang ditambahkan adalah=
/ berat bersih fraksi pelarutvolume DMSO mL
/ volume DMSO mL,8 mg
volume DMSO mL , mL
Hal yang sama juga dilakukan untuk pembuatan stok sampel senyawa, yaitu menimbang tabung Eppendorf kosong menggunakan neraca analitik, kemudian masing-masing sampel dimasukkan ke dalamnya dan ditimbang kembali bobotnya. Hasil penimbangan tabung Eppendorf dengan sampel dikurangi bobot tabung Eppendorf kosong menjadi berat bersih sampel senyawa. Sampel senyawa ini juga dilarutkan dengan larutan dimetilsulfoksida (DMSO). Pada awalnya, bobot molekul masing-masing sampel senyawa harus diketahui. Setelah diketahui bobot molekul masing-masing sampel, dilakukan perhitungan dengan rumus:
sampel
*Bobot molekul (BM) AC-31= 408 g/mol; AC-33= 409 g/mol; AC-51= 410 g/mol; AA-3= 352 g/mol
Konsentrasi stok sampel yang akan dibuat adalah 50 mM. Konsentrasi tersebut diubah menjadi satuan mol/mL. Setelah didapatkan, selanjutnya dihitung dengan cara seperti di bawah ini:
. /
Tabel persiapan stok sampel ekstrak pelarut (500
μ
g/mL) dan sampel senyawa (50
μ
M)
Sampel Berat tabung (mg)
Berat akhir (mg)
Berat bersih (mg)
Volume DMSO (µL)
Etanol 872,5 878,3 5,8 11,6
Butanol 868,2 873,5 5,3 10,6
Etil asetat 873,2 880 6,8 13,6
Heksana 861,5 866 4,5 9
AC-31 870,7 876,6 5,9 280
AC-51 869,5 881,3 11,8 560
AA-3 860,6 861,8 1,2 68
Lampiran 5 Nilai absorbansi, perhitungan, dan grafik kuersetin sebagai kontrol
pembanding
Konsentrasi Absorbansi Sampel Absorbansi Absorbansi sampel terkoreksi Absorbansi
Sampel
Ulangan
Blanko
warna Ulangan terkoreksi
(μM) 1 2 3 1 2 3 rata-rata
200 0,259 0,274 0,271 0,174 0,085 0,100 0,097 0,094
100 0,37 0,379 0,338 0,101 0,269 0,278 0,237 0,261
50 0,409 0,445 0,463 0,082 0,327 0,363 0,381 0,357
25 0,555 0,502 0,525 0,07 0,485 0,432 0,455 0,457
12,5 0,565 0,578 0,556 0,062 0,503 0,516 0,494 0,504
6,25 0,619 0,595 0,602 0,063 0,556 0,532 0,539 0,542
3,125 0,639 0,601 0,605 0,063 0,576 0,538 0,542 0,552
*Absorbansi kontrol positif = 0,669
Contoh perhitungan:
1.
Absorbansisampel terkoreksi = Absorbansisampel – absorbansiblanko warna
2.
Absorbansi terkoreksi rata-rata
= Absorbansi sampel terkoreksi ulangan 1 + 2 + 3
3
= 0,085 + 0,100 + 0,097
3
=
0,094
3.
% Inhibisi
= Abs. kontrol positif – Abs. sampel terkoreksi rata-rata
Abs. kontrol positif
% Inhibisi
= 0,669 – 0,094
0,669
= 86,552
y = 0,331x + 24,65 R² = 0,958
0 10 20 3