i
PEMISAHAN PERAK DARI LIMBAH FIXER
DENGAN CARA ELEKTROLISIS
SUPRATNO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pemisahan Perak(Ag) dari Limbah Fixer dengan cara Elektrolisis adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
i
ABSTRACT
SUPRATNO. The Isolation of Silver (Ag) from Fixer Sludge with Electrolysis methode. Under direction of ZAINAL ALIM MAS’UD and ETI ROHAETI.
The isolation of silver with electrolysis methode on sludge silver was tried with the variations concentration, electrode of carbon, and voltages. The aim of research are looking for the easiest and eficient electrolysis. Among of 272.79 ppm of silver (impurities) could be produced from electrolysis fixer which used 300 times maintain the film. For 400, 500, and 600 times electrolysis were produced recently 49.42, 137.04, and 55.22 ppm. Futhermore, it was increased to 220.00 ppm from 700 times. These were possible because of density the solutions. From the electrode of carbon, 68.2222 g Ag (impurities) could be processed from size 14 cm x 3 cm x 3 cm. The next results 41.2050 g and 43.7559 g from the sizes 16 cm x 3 cm x 3 cm and 18 cm x 3 cm x 3 cm. The reasoned of this part any faster reaction on the most litle electrode. By the way, from voltages variation, the processed showed that 47.4575 g of Ag (impurities) could be produced from 11 volt. It’s caused the bigest voltages are also the bigest kinetics power on the reactions. Sampel and product were analized by AAS. Consentration has potential to be indicator, because of the used 700 times was given trend high Ag (impurities) became increase optimally at 11 volt, and much sediment that is 47.4575 g. The best rendemen is 13.33%. The other finding is that the strength of the time and the voltages strongly enfluence the electrolysis shown by the bigger result on F(calculation) than that of the F(table).
ii
RINGKASAN
SUPRATNO. Pemisahan Perak (Ag) dari Limbah Fixer dengan cara Elektrolisis. Dibimbing oleh ZAINAL ALIM MAS’UD dan ETI ROHAETI.
Perak terletak di golongan IB dan periode 5. Unsur bernomor atom 47 ini memiliki massa atom 107.870 g/mol, termasuk logam yang berkarakter fisik keras dan unik diantara logam-logam lainnya. Perak memiliki titik leleh 961.93 ˚C dan titik didih 2212 ˚C. Perak berada dalam keadaan terikat sebagai Ag2S (argentit),
AgCl, dan dalam bijih tembaga-nikel. Unsur logam transisi ini berwarna putih mengkilap, dapat ditempa, sedikit lebih keras dari emas, konduktivitasnya paling tinggi di antara semua logam, tahan terhadap udara murni dan air, tetapi tidak tahan terhadap udara yang mengandung belerang (timbul bercak hitam kemudian menjadi kusam) dan kurang reaktif dibandingkan dengan tembaga.
Pengambilan kembali ion perak dari limbah film foto ronsen telah dilakukan melalui proses pengendapan elektrolitik langsung, namun hasilnya masih kurang memuaskan. Rendemen pengendapan ion logam baru mencapai ±57.10%. Sementara itu, endapan masih belum semengkilap yang diharapkan. Warna endapan bervariasi dari abu-abu hingga kecokelatan yang mencerminkan bahwa produk perak belum mencapai tingkat kemurnian yang tinggi. Endapan merupakan campuran antara logam perak dengan oksida, hidroksida, dan sulfidanya. Uji spektrofotometrik menunjukkan bahwa kemurnian endapan perak menghasilkan 83.44%. Selain itu, pemakaian energi listrik untuk mengendapkan logam merupakan pemborosan cukup besar.
Digunakan metode daur ulang perak dari jenis limbah berdasarkan transisi dari perak ke dalam larutan, yaitu bentuk ionik dan kemudian dengan elektrolisis memproduksi logam perak. Proses produksi perak dari film dibagi menjadi dua kelompok, yaitu mekanik dan kimia yang dapat dikaitkan dengan pembentukkan pembawa gelatin asam oksalat dan melarutkan perak.
Usaha untuk mendapatkan perak telah diteliti dan dicoba, tetapi yang menjadi raw materialnya adalah foto klise. Perak yang terkandung dalam film fotografi diperkirakan antara 0.7-1%. Sebanyak 100 Kg film foto bekas dapat menghasilkan logam perak maksimal 700-1000 g. Pemisahan perak dari limbah fixer dengan metode elektrolisis diuji dengan menggunakan elektrode plat seng-plat stainless. Reaktor dioperasikan dengan variasi tegangan listrik, waktu, dan jarak elektroda. Pengujian menunjukkan bahwa pasangan elektroda seng-stainless yang terbaik memisahkan konsentrasi perak lebih banyak yaitu 2%. Pada variasi tegangan terhadap waktu efisiensi terbesar diperoleh pada rentang tegangan 3-5 volt dan pada waktu 30-60 menit dengan besar efisiensi 74%-92%. Pada variasi jarak efisiensi optimal diperoleh pada jarak 2 dan 4 cm dengan nilai efisiensi 74% dan 88%.
iii
Tiga percobaan telah dilakukan menggunakan variasi konsentrasi limbah fixer, elektroda karbon, dan tegangan. Elektrolisis dilakukan pada suhu kamar, dengan menggunakan metode yang dimodifikasi dari Tobing & Nathan (2003). Percobaan pertama dirancang untuk mengamati konsentrasi manakah yang terbanyak menghasilkan endapan, kemudian dilakukan ekstraksi, penyaringan, penggodogan, penambahan NaCl, dan pemurnian. Hasil endapan sebanyak 77.0742 g diperoleh dari fixer 800x pemakaian. Endapan elektrolisis limbah 300x pemakaian dianalisis dengan SSA dan hasilnya menunjukkan bahwa kadar Ag sebesar 272.79 ppm. Adapun fixer 700x pemakaian menunjukkan kadar Ag sebesar 220.00 ppm. Variasi konsentrasi memiliki potensi indikator karena semakin banyak pencelupan film terjadi tren peningkatan endapan.
Percobaan kedua dirancang untuk mengamati hasil penggunaan 3 ukuran elektrode karbon, yaitu 18 cm x 3 cm x 3 cm, 16 cm x 3 cm x 3 cm, dan 14 cm x 3 cm x 3 cm. Limbah dari pemakaian 800x celup diektrolisis selama 4 jam. Endapan yang diperoleh diolah seperti elektrolis pertama. Hasil elektrolisis terbanyak fase ini sejumlah 68.2222 g, yang diperoleh dari ukuran elektroda karbon terkecil. Hal ini disebabkan karena dengan elektroda tersebut terjadi akumulasi endapan di katode paling banyak. Pemeriksaan dengan SSA menunjukkan kadar Ag sebesar 1177.97 ppm.
Percobaan ketiga dirancang untuk mengamati hasil elektrolisis dengan menggunakan 6 varian tegangan, yaitu 3, 4.5, 6, 7.5, 9, dan 11 volt. Proses dilanjutkan dengan perlakuan seperti elektrolis pertama. Dengan variasi tegangan diperoleh endapan terbanyak sejumlah 47.4575 g dari 11 volt. Hal ini disebabkan karena dari tegangan tersebut terjadi efek reaksi terbesar yang menghasilkan endapan. Rendemen terbaik sebesar 13.33%. Ditemukan dengan perhitungan ANNOVA bahwa bila waktu dan voltase elektrolisis diperbesar Fhitung > Ftabel
iv
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
5
PEMISAHAN PERAK DARI LIMBAH FIXER
DENGAN CARA ELEKTROLISIS
SUPRATNO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
1
2
Judul Tesis : Pemisahan Perak dari Limbah Fixer dengan cara Elektrolisis
Nama Mahasiswa : Supratno
NRP : G451090211
Disetujui Komisi Pembimbing
Ketua
Dr. Zainal Alim Mas’ud, DEA.
Anggota Dr. Eti Rohaeti, MS.
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Dra. Purwantiningsih Sugita, MS. Dr. Ir. Dahrul Syah, M.Sc.Agr.
3
PRAKATA
Seraya mengucapkan puji syukur kehadirat Allah SWT, atas karunia yang dilimpahkan sehingga saya dapat menyelesaikan penelitian dengan judul Pemisahan Perak dari Limbah Fixer dengan cara Elektrolisis, yang dimulai sejak bulan Desember 2010.
Pada kesempatan ini ucapan terima kasih dan penghargaan saya sampaikan kepada Bapak Dr. Zainal Alim Mas’ud, DEA. selaku ketua Komisi Pembimbing dan Ibu Dr. Eti Rohaeti, MS. selaku anggota Komisi Pembimbing, tenaga penunjang di lingkungan Departemen Kimia, FMIPA IPB, khususnya Ibu Nunung Nuryanti, Ibu Nurhayati, Bapak Eman Suherman, Bapak Wawan dan Eko yang berpartisipasi membantu kami dalam pelayanan penelitian, administrasi maupun bantuan lainnya. Ucapan terima kasih juga saya sampaikan kepada rekan-rekan seangkatan pascasarjana Kimia 2009. Rekan-rekan guru Madrasah Aliyah Raudlatul ‘Ulum Anyer, (Alm) Ayahanda Soeadji, (Almh) Ibunda Sudjinah, istriku Rr. Dwi Legstyanti, Ahmad Nico Fitriadi, serta seluruh keluarga, atas doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2011
4
RIWAYAT HIDUP
Penulis dilahirkan di Demak pada tanggal 7 April 1965 sebagai anak ke-12 dari pasangan Bapak Soeadji (Alm) dan Ibu Sudjinah (Almh).
Tahun 1983 penulis lulus dari Sekolah Menengah Atas Abdi Negara Grogol Demak dan pada tahun yang sama lulus seleksi SIPENMARU di Institut Keguruan dan Ilmu Pendidikan Semarang. Penulis mengambil Program Studi D3 Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan lulus tahun 1987. Tahun 2000 lulus dari Program Studi Pendidikan Kimia Universitas Terbuka Jakarta. Pada tahun 2009 penulis diterima pada Program Studi Kimia, Sekolah Pascasarjana IPB. Beasiswa pendidikan pascasarjana diperoleh dari Kementerian Agama Republik Indonesia, dengan program Beasiswa Utusan Daerah (BUD), perwakilan Provinsi Banten.
5
Pelaksanaan Elektrolisis dan Pemurnian ... 18
Perhitungan Rendemen ... 19
HASIL DAN PEMBAHASAN ... 21
Pengamatan Umum ... 21
Hubungan Variasi Waktu dengan Voltase ... 25
Produk Elektrolisis dengan Variasi Konsentrasi ... 27
Produk Elektrolisis dengan Variasi Elektroda Karbon ... 28
Produk Elektrolisis dengan Variasi Voltase ... 28
Analisis Komprehensif Manfaat Elektrolisis Fixer ... 29
SIMPULAN DAN SARAN ... 30
DAFTAR PUSTAKA ... 31
6
DAFTAR TABEL
Halaman
1 Kandungan perak dalam material ... 5 2 Beberapa metode perolehan perak dari limbah fixer ... 10 3 Hasil elektrolisis dengan variasi konsentrasi dari pemakaian film ... 21 4 Hasil elektrolisis kedua dengan menggunakan elektroda karbon ... 23 5 Hasil elektrolisis ketiga dengan variasi voltase ... 24 6 Hasil penimbangan massa endapan elektrolisis keempat limbah
7
DAFTAR GAMBAR
Halaman
1 Perak kristal dan hiasan kerudung ... 4
2 Sel elektrolisis daur ulang perak ... 12
3 Hirarki manajemen limbah ... 13
4 Diagram SSA ... 15
5 Peralatan elektrolisis ... 17
6 Diagram alir elektrolisis pertama ... 19
7 Diagram alir elektrolisis limbah fixer encer dan pekat ... 20
8 Hasil pemeriksaan SSA endapan elektrolisis pertama ... 22
9 Hasil pemeriksaan SSA endapan elektrolisis kedua ... 23
10 Hasil pemeriksaan SSA ... 24
11 Kristal Ag hasil elektrolisis dengan variasi konsentrasi ... 28
12 Kristal Ag hasil elektrolisis dengan variasi ukuran elektroda karbon ... 28
8
DAFTAR LAMPIRAN
Halaman
1 Uji SSA sampel ... 36
2 Uji SSA endapan dengan variasi konsentrasi ... 37
3 Uji SSA endapan dengan variasi ukuran elektrode karbon ... 39
4 Uji SSA endapan dengan variasi voltase ... 40
5 Diagram alir elektrolisis ke-2 ... 41
6 Diagram alir elektrolisis ke-3 ... 42
7 Perhitungan rendemen hasil elektrolisis variasi konsentrasi ... 43
8 Perhitungan rendemen hasil elektrolisis variasi elektrode karbon .... 43
9 Perhitungan rendemen hasil elektrolisis elektrode tegangan ... 43
10 Pengolahan ANNOVA lengkap limbah fixer encer ... 44
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki sumber daya mineral yang variatif, baik jenis dan wujud materialnya. Beberapa jenis yang telah populer diantaranya emas, perak, tembaga, aluminium. Sebagai bahan tambang tidak dapat diperbaharui mineral seharusnya dikelola dengan baik, profesional dan multifungsional sehingga bermanfaat jangka panjang sebagai elemen pembangunan.
Perkembangan ilmu dan teknologi fotografi telah mendatangkan banyak manfaat, walaupun disisi lain menghasilkan limbah. Menurut Aryadi & Suryawan (2006), kemajuan teknologi industri fotografi begitu pesat sehingga produksi limbah yang dihasilkan dari kegiatan tersebut sudah sangat membahayakan apabila tidak ditangani secara serius.
Komposisi cairan fixer selama pencucian film kaya dengan logam Ag, Tobing & Nathan (2003) melaporkan bahwa jumlah perak yang terdapat dalam klise film kira-kira 1%, sedangkan menurut Khunprasert et al. (2006), jumlah perak sekitar 2%, akan menjadi upaya bernilai ekonomi bila dilakukan recovery disamping meminimalkan efek radioaktif limbah buangannya.
Beberapa penelitian yang telah dilakukan, di antaranya Mattuschka et al. (1996) melaporkan bahwa Pseudomonas stutzeri Ag-259 dan Streptomyces albus telah digunakan untuk mempelajari akumulasi perak. Akumulasi perak dari campuran logam sebanyak 142 µ mol/gram. Tobing & Nathan (2003) berhasil melakukan pemisahan perak sebanyak 0.7 kg dari 100 kg limbah film radiologi dengan cara ekstraksi menggunakan pelarut HNO3
Suyati et al. (2003) melakukan pengambilan kembali perak ionik dari limbah film melalui proses pengendapan elektrolit langsung, namun rendemen pengendapan metalik baru mencapai 57.10%, sementara endapan masih belum mengkilap seperti yang diharapkan. Uji spektrofotometrik menunjukkan bahwa kemurnian endapan perak hanya 83.44%. Selain itu pemakaian energi listrik untuk mengendapkan logam merupakan pemborosan cukup besar. Widya et al. (Tanpa Tahun) melakukan elektrolisis pemurnian endapan Ag yang maksimal pada durasi
2
30 menit 36.06% tanpa menggunakan elektroda platina dengan variasi waktu 30, 60, 90, dan 120 menit. Dalam pengujiannya dilakukan melalui tahapan berikut; penentuan konsentrasi Ag sampel dengan SSA, penentuan potensial elektrodeposisi dan elektrolisis pada potensial tetap.
Donal (2007) melakukan pemisahan perak dari limbah cair fixer film dengan menggunakan metode elektrolisis. Dalam pengujiannya digunakan elektrode plat seng dan stainless. Reaktor dioperasikan dengan variasi tegangan listrik, waktu, dan jarak elektroda. Pengujian terbaik menunjukkan bahwa pasangan elektroda seng-stainless memisahkan konsentrasi perak lebih banyak yaitu 52%. Pada variasi tegangan terhadap waktu, efisiensi terbesar diperoleh pada rentang tegangan 3-5 volt dan pada waktu 30-60 menit dengan efisiensi 74%-92%. Pada variasi jarak efisiensi optimal diperoleh pada jarak 2 dan 4 cm dengan efisiensi 74% dan 88%. Proses produksi perak dari film dapat dibagi menjadi dua kelompok, yaitu mekanik dan kimia yang dapat dikaitkan dengan pembentukan pembawa gelatin asam oksalat dan melarutkan perak (Marinkovic et al. 2006). Mufid (2008) melaporkan elektrolisis terhadap limbah fixer, sehingga diperoleh pengendapan Ag2S dari larutan encer dan pekat. Arus 5 A selama 8 jam
menghasilkan 26.03 g (sebelum pengenceran) dan 29.70 g (sesudah pengenceran), kuat arus maupun konsentrasi sangat berpengaruh pada elektrolisis. Tomonari et al. (2008) juga melaporkan bahwa Ag yang berukuran nano dapat disintesis dengan mengkondisikan sistem preparasi menggunakan proses kering 3-mercapto-propionic acid.
Tujuan Penelitian
Penelitian ini bertujuan memperoleh informasi ilmiah berkaitan dengan proses memisahkan perak (Ag) dari limbah fixer dengan metode elektrolisis menggunakan elektrode karbon.
Manfaat Penelitian
3
Hipotesis Penelitian
1. Limbah fixer pekat (banyak terpakai untuk mencelup film), akan menghasilkan perak semakin banyak.
2. Ukuran elektrode relatif kecil berakibat elektrolisis berlangsung cepat, sehingga produk perak dapat terbentuk secara maksimal.
4
TINJAUAN PUSTAKA
Perak(Ag)
Dalam sistem periodik unsur, perak terletak pada golongan IB dan periode 5. Unsur tersebut bernomor atom 47 dan memiliki massa atom 107.870 g/mol termasuk logam yang berkarakter fisik keras dan unik di antara logam-logam lainnya. Perak memiliki titik leleh 961.93 ˚C dan titik didih 2212 ˚C. Perak berada dalam keadaan terikat sebagai Ag2S (argentit), AgCl, dan dalam bijih
tembaga-nikel. Unsur bersifat logam transisi ini berwarna putih mengkilap, dapat ditempa, sedikit lebih keras dari emas, konduktivitasnya paling tinggi diantara semua logam, tahan terhadap udara murni dan air, tetapi tidak tahan terhadap udara yang mengandung belerang (timbul bercak hitam, menjadi kusam), dan kurang reaktif dibandingkan dengan tembaga. Sifat-sifat fisik dan kimia tersebut menjadikan perak mudah diolah (Gambar 1a), dan dibuat menjadi produk komersil (Gambar1b).
(a) (b)
Gambar 1 Perak kristal (a) dan hiasan kerudung (b)
5
Perak juga dapat larut dalam senyawa alkali sianida (NaCN/KCN), asam organik tiourea, dan tiosulfat membentuk garam kompleks perak, dengan reaksi sebagai berikut:
Beberapa penelitian berkaitan dengan sifat Ag, di antaranya Meng et al. (2004), melaporkan bahwa tiosulfat menunjukkan potensi yang besar dalam recovery perak dari limbahnya. Senyawa perak halida sangat peka terhadap cahaya. Perak halida akan tereduksi menjadi perak dan gas hidrogen saat disinari oleh gelombang ultraviolet, misalnya sinar matahari. Perak klorida berwarna putih kapur dan garam yang tidak larut dalam air. Larutan perak nitrat saat dicampur dengan alkali halogen, misalnya NaCl akan terbentuk endapan perak klorida, dengan reaksi sebagai berikut:
2+
AgNO3(l) + NaCl(l) AgCl (s) + NaNO3
Selanjutnya AgCl jika disinari matahari terurai menjadi Ag dan gas klor (l)
2AgCl(s) uv Ag (s) + Cl2
Menurut Khunprasert et al. (2004), kandungan perak cukup berbeda tajam antara film sinar-X asli, film sinar-X terpakai, dan larutan (Tabel 1).
(g) (Tobing & Nathan 2003)
Tabel 1 Kandungan perak dalam material Material Kandungan perak per unit
material (g Ag/m2
sampel yang ditambahHNO3 dan diterminasi dengan SSA b
larutan yang diukur dengan SSA langsung
c
total Ag terestimasi dari2 %Agdalam sejumlah film sinar X pada 2004
d
total Ag terestimasi dari 1,1 % s.d 1,3 % dalam sejumlah film sinar-X pada 2004
6
dimanfaatkan dalam banyak bidang, antara lain peralatan rumah tangga, medali, serta asesoris seperti jam tangan, bros maupun hiasan pada kerudung, pada plastik master, dan dunia kedokteran (bahan untuk ronsen).
Pengambilan perak dari limbah cuci cetak dapat dilakukan dengan metode membran cair berpendukung (SLM), sebagai membran pendukung digunakan polytetrafluoroethylen (PTFE) yang direndam selama 2 jam dalam senyawa pembawa asam Bis(2-etil heksil)fosfat (D2EHPA) 1 M dengan pelarut kerosen dan dilakukan pengadukan selama 6 jam. Untuk mengetahui kondisi optimum dalam recovery perak dilakukan variasi pH larutan umpan 1, 1.5, 2, 2.5, 3, 3.5, 4, larutan penerima HCl, HCl-EDTA, HNO3, HNO3-EDTA, H3PO4, H3PO4
Teresa et al. (1993) melaporkan bahwa perak sulfida memiliki kelarutan yang sangat rendah (Ksp 6 X 10
-EDTA, serta konsentrasi larutan limbah pemekatan ½ kali, pengenceran 0 kali, pengenceran 10 kali. Dari penelitian ini diperoleh % transpor perak dari limbah fotografi dengan variasi pH larutan umpan memberikan % transpor perak optimum pada pH 2,5 yaitu 96.44% dengan larutan penerima HCl, sedangkan untuk % transpor perak pada fasa penerima dengan variasi larutan penerima memberikan hasil optimum pada larutan penerima (HCl-EDTA) yaitu 63.85% dan untuk variasi konsentrasi larutan umpan memberikan hasil optimum pada pengenceran 10 kali.
-50
7
Cooper ( 1985) memeriksa dua kategori pertukaran ion, yaitu basa lemah dan basa kuat anionik. Mereka melaporkan bahwa hanya resin basa kuat dimuat sejumlah besar perak tetapi mereka lebih sulit mengelusi. Hubicki & Hubicka (1996) telah menguji selektif enam pertukaran ion, termasuk kelompok fungsional tiol, tiourea, isotiourea, dan polifenol. Penukar ion gugus fungsi -SH pada kerangka kopolimer stirena dengan divinilbensena menunjukkan faktor pemulihan perak tertinggi.
Menurut Beyzari et al. (1996), proses untuk menemukan perak dengan pengapungan dari sisa ekstrak basah seng telah berhasil menghasilkan perak lebih dari 89.5%. Teknologi lain yang memberi harapan untuk memperoleh perak adalah berdasarkan proses biologi. Mattuschka et al. (1996) melaporkan bahwa telah digunakan Pseudomonas stutzeri Ag-259 dan Streptomyces albus untuk mempelajari akumulasi perak. Akumulasi perak dari campuran logam adalah 142 µ mol/g.
Proses untuk memperoleh Ag biasanya elektrolisis, tidak mudah atau bahkan tidak mungkin untuk meramalkan produk-produk apa yang akan dihasilkan bila suatu arus listrik dilewatkan suatu larutan elektrolit. Di samping ion-ion yang berasal dari elektrolit itu, terdapat juga molekul air dan ion-ion air (H+ dan OH
-Untuk mempersempit daftar variabel bisa dipilih elektroda lamban, dimana ion logam lebih mudah direduksi daripada ion H
) yang dapat berperan serta dalam reaksi elektrokimia. Produk elektroda yang diperoleh dari larutan pekat seringkali berbeda dari yang diperoleh dari larutan encer.
+
. Elektrolisis larutan air dari garam-garamnya akan mengakibatkan terbentuknya logam pada katode. Misalnya, jika suatu larutan air dari CuCl2, AgNO3, atau HgCl2
Menurut Mufid (2008), elektrolisis dapat menghancurkan elektrolit dengan aliran listrik, elektrolisis dapat digunakan untuk pengambilan logam perak, dan kuat arus maupun konsentrasi sangat berpengaruh pada elektrolisis yang ditunjukkan dengan F(hitung) lebih besar dari F(tabel).
8
Fixer
Fixer adalah zat kimia berupa cairan pekat yang biasa dipakai untuk mencuci film dalam fotografi atau ronsen. Menurut Legsdyarso (wawancara tanggal 4 Desember 2010), fixer yang akan digunakan untuk mencuci film adalah larutan, yaitu campuran 5 L fixer dan 15 L air.
Komposisi fixer biasanya menggunakan tiosulfat untuk melarutkan perak halida dalam emulsi dengan reaksi sebagai berikut:
2AgCl + H2S2O3 Ag2(S2O3
Na
) + 2HCl (Tobing & Nathan 2003)
2S2O3 + AgBr Na2Ag(S2O3)2
Fixer juga mengandung sulfit biasanya Na-sulfit, untuk mengasamkan tiosulfat, pH bufer, asam asetat biasanya untuk fixer asam, hardener, pengeras tawas, lumpur inhibitor biasanya dipakai asam borat, tetapi asam polikarboksilat juga bisa digunakan
+ NaBr (Jauhari 2010)
berbahaya bagi kesehatan (Jumari et al. 2006).
Jenis-jenis Fixer
Secara umum fixer dapat dibagi menjadi tiga yakni; fixer netral,fixer asam dan fixer basa.
1. Fixer netral
Jenis fixer ini dulu sangat sering digunakan, tetapi karena waktu fixing yang dibutuhkan lebih lama, penggunaannya dewasa ini mulai jarang. Hanya orang tertentu yang fanatik dan untuk penggunaan khusus yang masih mau menggunakan fixer jenis ini. Fixer jenis ini tidak dijual dalam bentuk kemasan jadi, untuk membuat fixer ini harus meracik sendiri. Untungnya bahan yang digunakan sangat sederhana yaitu natrium tiosulfat sebanyak 500 g dicampur dengan air 1 L pada suhu sekitar 32 ˚C. Fixer jenis ini disebut netral karena memiliki pH mendekati normal meskipun natrium tiosulfat sendiri tergolong asam.
2. Fixer asam
9
digunakan adalah asam asetat. Dewasa ini sebagian besar fixer yang dijual umum merupakan fixer asam. Penggunaan fixer asam yang begitu luas mungkin disebabkan jaminan dari fixer asam yang lebih baik dibanding fixer jenis lain.
3. Fixer basa
Fixer basa banyak disebut sebagai fixer yang paling bagus, karena sifatnya yang alkali fixer ini mudah hilang (lepas) dari paper/film pada saat proses wash terutama paper jenis fibre base.
Elektrolisis
Elektrolisis adalah peristiwa penguraian zat elektrolit oleh arus listrik searah. Elektroda positif (+) yang disebut juga anoda, sedangkan elektroda negatif (-) disebut katoda.
Beberapa kegunaan sel elektrolisis adalah :
1. Penyepuhan, adalah proses pelapisan suatu logam dengan logam lain. Logam yang akan dilapisi digunakan sebagai katoda, sedangkan logam pelapis sebagai anoda.
2. Pembuatan beberapa senyawa. Elektrolisis terdiri dari dua wadah proses, misalnya reaksi sebagai berikut (memerlukan jembatan garam):
Anoda Zn Katoda Cu Reaksi sel di atas dapat dituliskan sebagai diagram sel:
2+
Zn/ZnSO4(xM)//CuSO4
Anoda katoda (yM)/Cu
dengan artinya perubahan keadaan/fasa,
artinya sambungan antar setengah sel x, y = konsentrasi larutan elektrolit
10
Dalam penyelidikan mengenai reaksi didalam larutan berkenaan dengan pengukuran listriknya dipakai sel elektrokimia. Peralatan dasarnya adalah
sel elektrokimia. Sel ini berupa konduktor logam yang dicelupkan ke dalam elektrolit konduktor ion (yang dapat berupa larutan, cairan atau padatan).
Elektroda dan elektrolitnya membentuk kompartemen elektroda. Kedua elektroda dapat menempati kompartemen yang sama. Jika elektrolitnya berbeda, kedua elektrolitnya dapat dihubungkan dengan jembatan garam, yaitu larutan elektrolit yang melengkapi sirkuit listrik dan memungkinkan sel itu berfungsi (Irma 1999). Menurut Mufid (2008) bahan elektrode yang umum digunakan sebagai katode adalah Pt, Pb, Ni, grafit/golongan C, polimer, steel, stainless steel, bahan yang punya potensial berlebih (misal Ni,Al/Ni, Ni/Zn), lapisan Ni-Mo-Fe, atau Ni-Mo-Cr, TiO4. Adapun sebagai anode adalah Pt, Pt/Ti, Ir/Ti, Pt/Ir, Ti,
grafit bentuk lain golongan C, Ni dalam alkali, campuran Ru/Ti, oksida Ti untuk Cl2, IrO2 dalam Ti untuk O2, magnetit (Fe3O4), konduktor keramik Ti4O7.
Tabel 2 Beberapa metode perolehan perak dari limbah fixer Beberapa metode perolehan perak dari limbah fixer ( Tabel 2).
11
Aplikasi lain yang tidak kalah pentingnya dari metode elektrokimia dan sekarang sedang marak dikembangkan oleh para peneliti adalah elektrosintesis. Teknik elektrosintesis adalah suatu cara untuk mensintesis suatu bahan yang didasarkan pada teknik elektrokimia. Pada metode ini terjadi perubahan unsur/senyawa kimia menjadi senyawa yang diinginkan.
12
Gambar 2 Sel elektrolisis daur ulang perak (Eastman Kodak Company 1999).
Adapun reaksi-reaksi yang terjadi sebagai berikut,
Katode: Ag(S2O3)23- + e Ag + 2 (S2O3)
Perak tiosulfat + e logam perak + tiosulfat atau
Anode: SO32- + H2O SO42- + 2H+
Sulfit + air ion H
+ 2e atau
+
Suzuki et al. (2000) melaporkan bahwa teknik elektrokimia ini sangat aman, efektif dan efisien, namun masih diusahakan untuk meningkatkan efisiensinya dengan cara melakukan pengambilan perak untuk digunakan kembali.
+ elektron
Pada akhirnya mengutip tulisan Eastern and Smelting Corp Refining (1997), bahwa praktek-praktek pemulihan perak telah memberikan beberapa hasil yang bermanfaat, seperti manfaat ekonomi dari pemulihan perak, sumber daya tak terbarukan dari daur ulang perak, dan pengurangan secara signifikan limbah berbahaya yang dibuang.
Prinsip Elektrosintesis
13
Sebagai contoh adalah proses elektrometalurgi, yang merupakan metode elektrolitik untuk mengekstrak logam dari mineral logam asal. Menurut Cambell et al. (1994), teknik ini didasarkan pada reaksi redoks yang terjadi pada permukaan elektroda yang meliputi tiga langkah, yaitu pertama penciptaan konsentrasi karena arus secara gradien, kedua transfer elektron untuk ion logam dan membentuk atom logam, ketiga difusi permukaan teradsorbsi atom di kisi kristal yang tumbuh dari deposit logam.
Pengolahan Limbah Cair
Tujuan utama pengolahan limbah adalah mereduksi volume dan mengkondisikan limbah, agar dalam penanganan selanjutnya pekerja radiasi, anggota masyarakat, dan lingkungan hidup aman dari paparan radiasi dan kontaminasi (Lubis 2010). Lasut (2006) menggambarkan hirarki manajemen limbah yang tersaji pada Gambar 3.
Gambar 3 Hirarki manajemen limbah (UIUC Waste Management Guide 2006).
14
daerah sekitarnya (Giyatmi et al. 2008). Menurut Sugikawa et al. (2000), limbah padat maupun cair organik terkontaminasi alfa perlu dikelola sampai mencapai batas aman untuk dibuang ke lingkungan atau didaur ulang.
Teknologi pengolahan yang dipilih harus sesuai dengan kemampuan teknologi masyarakat yang bersangkutan. Berbagai teknik pengolahan air buangan untuk menyisihkan bahan polutannya telah dicoba dan dikembangkan selama ini. Teknik-teknik pengolahan air buangan yang telah dikembangkan tersebut secara umum terbagi menjadi 3 metode pengolahan, yaitu pengolahan secara fisika, pengolahan secara kimia, dan pengolahan secara biologi. Untuk suatu jenis air buangan tertentu, ketiga metode pengolahan tersebut dapat diaplikasikan secara sendiri-sendiri atau secara gabungan.
Pada umumnya, sebelum dilakukan pengolahan lanjutan terhadap air buangan, diinginkan agar bahan-bahan tersuspensi berukuran besar dan yang mudah mengendap atau bahan-bahan yang terapung disisihkan terlebih dahulu. Penyaringan merupakan cara yang efisien dan murah untuk menyisihkan bahan tersuspensi yang berukuran besar. Bahan tersuspensi yang mudah mengendap dapat disisihkan secara mudah dengan proses pengendapan. Parameter desain yang utama untuk proses pengendapan ini adalah kecepatan mengendap partikel dan waktu detensi hidrolisis di dalam bak pengendap. Pemisahan cair-padatan dapat dilakukan dengan cara penapisan, pengendapan, penyaringan, pengapungan, filter membran, dan filtrasi lambat. Menurut Lubis (2010), untuk limbah radioaktif strategi pembuangan umumnya dibagi kedalam 2 konsep pendekatan, yaitu “encerkan dan sebarkan” (EDS) atau “pekatkan dan tahan” (PDT).
Spektrofotometri Serapan Atom (SSA)
Teori SSA
15
Cara kerja SSA berdasarkan penguapan larutan sampel, kemudian logam yang terkandung didalamnya diubah menjadi atom bebas. Atom tersebut mengabsorpsi radiasi dari sumber cahaya yang dipancarkan dari lampu katode (Hollow Catode Lamp) yang mengandung unsur yang akan ditentukan. Banyaknya penyerapan radiasi kemudian diukur pada panjang gelombang tertentu menurut jenis logamnya (Darmono 1995).
Instrumentasi SSA
Alat SSA terdiri dari rangkaian tersaji pada Gambar 4.
1 2 3 4 5 6 7
Gambar 4 Diagram SSA yang terdiri dari sumber sinar (1), pemilah/copper (2), nyala (3), monokromator (4), detektor (5), amplifier (6), dan meter/recorder (7) (Daulat 2009).
Menurut Daulat (2009), komponen-komponen dan fungsinya adalah sebagai berikut:
1. Sumber sinar, adalah Hallow Cathode Lamp (HCL). Setiap pengukuran SSA harus menggunakan HCL, misalnya menentukan tembaga dalam suatu cuplikan maka harus memakai Hallow Chatode khusus. Hallow Cathode ini akan memancarkan energi radiasi khusus sesuai untuk transisi elektron atom. 2. Sumber atomisasi, ada 2 yaitu sistem nyala dan tanpa nyala. Kebanyakan
instrumen adalah sistem nyala, dan sampel diintroduksikan dalam bentuk larutan. Sampel masuk ke nyala dalam bentuk aerosol. Dengan nyala itu kondisi untuk analit dapat ditentukan dengan metode emisi, absorbsi atau fluorosensi.
3. Monokromator, alat untuk memisahkan radiasi yang tidak diperlukan.
16
5. Sistem pengolah, untuk mengolah kuat arus dari detektor menjadi besaran daya serap atom transmisi yang selanjutnya diubah menjadi data sistem pembacaan.
6. Sistem pembacaan, merupakan bagian yang menampilkan angka/gambar yang dapat dibaca oleh mata.
17
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2010 sampai dengan Juni 2011, di Cilegon-Provinsi Banten, Laboratorium Bersama dan Laboratorium Analitik Departemen Kimia Institut Pertanian Bogor (IPB).
Alat dan Bahan
Alat-alat yang diperlukan antara lain sirkuit alat elektrolisis (Gambar 5), beker glass, erlenmeyer, corong, batang pengaduk, kaki tiga, asbes, termometer, statif, bunsen/kompor kecil, kain parasit, kertas saring, neraca analitik, dan peralatan SSA.
Bahan-bahan yang digunakan pada penelitian ini antara lain limbah fixer yang diperoleh dari RSUD Cilegon-Banten, air, HNO3 dan NaCl.
18
Prosedur Penelitian
Penyiapan Sampel
Limbah fixer (cairan yang terpakai mencelup film berturut-turut 300x, 400x, 500x, 600x, 700x, dan 800x) dikumpulkan dari Unit Radiologi Rumah Sakit setiap hari. Waktu rata-rata untuk menyiapkan sampel tahap ini 2 minggu, kecuali limbah dari pencelupan 600x, 700x, dan 800x diperlukan waktu 3-4 minggu. Percobaan pertama disiapkan 6 wadah @10 L. Percobaan kedua sebanyak 3 wadah @10 L dan percobaan ketiga sebanyak 6 wadah @10 L. Pada percobaan keempat disiapkan 24 wadah fixer @10 L, sebanyak 12 wadah limbah fixer encer dan 12 wadah limbah fixer pekat.
Pemeriksaan SSA Sampel dan Hasil
Pemeriksaan kadar Ag dilakukan dengan analisis SSA pada limbah yang terpakai mencelup film 800x (sampel) dan pada endapan elektrolisis 1-3.
Penyiapan Reagen
Asam nitrat pekat. Reagen ini dibuat dari asam nitrat pekat yang ada dengan metode pengenceran. Disiapkan asam nitrat 1 M dari asam nitrat 2 M, selanjutnya untuk tiga kali elektrolisis masing-masing memerlukan asam nitrat 1 M @40 mL.
Natrium Klorida. Reagen NaCl 1 M dibuat dari NaCl kristal dan aquades dengan perhitungan molaritas. Disiapkan NaCl 1 M selanjutnya untuk tiga kali elektrolisis masing-masing memerlukan NaCl 1 M @40 mL.
Pelaksanaan Elektrolisis dan Pemurnian
19
Hasil dari semua elektrolisis ditimbang dan bobot endapan terbanyak diekstraksi, difiltrasi, diuapkan, direaksikan dengan NaCl, dan dimurnikan dengan air. Percobaan keempat mengelektrolisis limbah fixer encer dan fixer pekat. Masing-masing dengan variasi voltase 3, 7.5, dan 9 volt. Percobaan dilakukan 4 kali pada durasi 1, 2, 3, dan 4 jam @10 L. Selanjutnya endapan hasil ditimbang 2 kali kemudian dihitung rata-ratanya. Pada tahap akhir diolah dengan ANNOVA untuk mengetahui pengaruh voltase dan waktu terhadap pengendapan Ag (Gambar 7).
Perhitungan Rendemen
Perhitungan rendemen dilakukan pada ketiga elektrolisis yang menunjukkan hasil analisis SSA tertinggi dengan rumus sebagai berikut:
kadar Ag hasil kadar Ag awal
x 100 %
Diagram Alir Elektrolisis
Limbah Fixer A, B, C, D, E, F --- Uji SSA
Elektrolisis)*
Endapan terpilih Endapan lain
Ekstraksi (+ HNO3) Penyaringan Penggodogan
Penjemuran dibawah sinar matahari Pemurnian (air t=100 ˚C) + NaCl Gambar 6 Diagram alir elektrolisis pertama (Modifikasi Tobing & Nathan 2003).
20
elektrolisis
Limbah fixer encer endapan
elektrolisis
Penimbangan massa 2x Limbah fixer pekat endapan
Hitung rata- rata (masing2)
Pengolahan data ANNOVA Gambar 7 Diagram alir elektrolisis limbah fixer encer dan pekat (Modifikasi
21
HASIL DAN PEMBAHASAN
Pengamatan Umum
Hasil pemeriksaan SSA sampel (limbah fixer) memiliki kadar Ag sebesar 6000.365 ppm. Kadar Ag tersebut apabila dikonversi setara dengan 0.6% (Khunprasert et al. 2004). Sampel diambil dari limbah pencelupan 800x film.
Berdasarkan hasil elektrolisis dengan variasi konsentrasi, elektrolisis pertama (Tabel 4), elektrolisis kedua (Tabel 5), dan elektrolisis ketiga (Tabel 6) menunjukkan bahwa elektrolisis berlangsung lancar dan menampakkan hasil berupa endapan berbentuk kristal. Bobot endapan berbanding lurus dengan semakin tinggi frekuensi pemakaian film (Tobing & Nathan 2003; Mufid 2008). Hal ini terlihat dari bobot kristal endapan yang meningkat dari hasil elektrolisis limbah fixer A-F.
Hasil elektrolisis pertama, limbah fixer dapat digolongkan atas dua kategori yaitu limbah encer (sampai 500x celup) dan limbah pekat (diatas 500-800x celup). Penggolongan didasarkan atas perolehan hasil elektrolisis (Tabel 3) dan hasil pemeriksaan SSA yang ekstrim (Gambar 8), maksudnya dari 6x pemeriksaan SSA terdapat tiga hasil yang berkadar Ag tinggi dan tiga hasil yang berkadar Ag rendah. Hasil elektrolis ke-1 dapat dibuat persamaan matematika,
y= 0,115x - 16,07, dengan x= banyaknya pencelupan, r= (koefisien korelasi) = 0,9969.
Tabel 3 Hasil elektrolisis dengan variasi konsentrasi dari pemakaian film
Fixer Bobot endapan
(g)
300x 17.4770
400x 32.5065
500x 40.1097
600x 52.6550
700x 63.1119
800x 77.0742
22
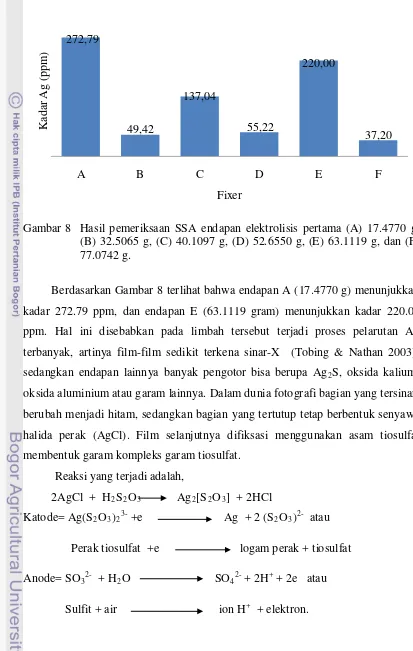
Gambar 8 Hasil pemeriksaan SSA endapan elektrolisis pertama (A) 17.4770 g, (B) 32.5065 g, (C) 40.1097 g, (D) 52.6550 g, (E) 63.1119 g, dan (F) 77.0742 g.
Berdasarkan Gambar 8 terlihat bahwa endapan A (17.4770 g) menunjukkan kadar 272.79 ppm, dan endapan E (63.1119 gram) menunjukkan kadar 220.00 ppm. Hal ini disebabkan pada limbah tersebut terjadi proses pelarutan Ag terbanyak, artinya film-film sedikit terkena sinar-X (Tobing & Nathan 2003), sedangkan endapan lainnya banyak pengotor bisa berupa Ag2
Reaksi yang terjadi adalah,
S, oksida kalium, oksida aluminium atau garam lainnya. Dalam dunia fotografi bagian yang tersinari berubah menjadi hitam, sedangkan bagian yang tertutup tetap berbentuk senyawa halida perak (AgCl). Film selanjutnya difiksasi menggunakan asam tiosulfat membentuk garam kompleks garam tiosulfat.
23
Limbah fixer A menghasilkan endapan sedikit tetapi menunjukkan kadar Ag tertinggi disebabkan Ag sebagai garam halida yang tertempel di film larut dalam jumlah besar sebagai garam kompleks perak tiosulfat.
Hasil elektrolis ke-2 dapat dibuat persamaan matematika, y = -6,116x + 148,9 , dengan x= ukuran elektrode karbon r= (koefisien korelasi)= 0,8197.
Percobaan ini masih memerlukan uji lanjutan dengan variasi ukuran elektrode karbon lebih banyak agar menghasilkan R2
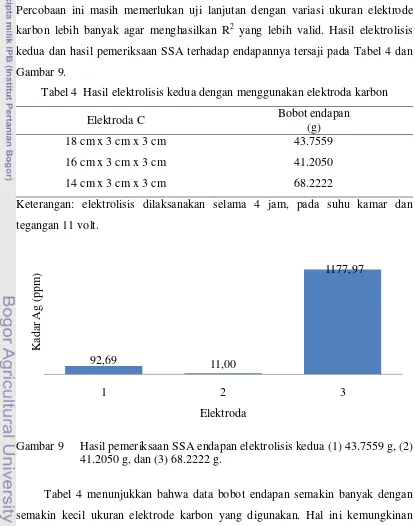
Tabel 4 Hasil elektrolisis kedua dengan menggunakan elektroda karbon yang lebih valid. Hasil elektrolisis kedua dan hasil pemeriksaan SSA terhadap endapannya tersaji pada Tabel 4 dan Gambar 9.
Elektroda C Bobot endapan
(g)
18 cm x 3 cm x 3 cm 43.7559
16 cm x 3 cm x 3 cm 41.2050
14 cm x 3 cm x 3 cm 68.2222
Keterangan: elektrolisis dilaksanakan selama 4 jam, pada suhu kamar dan tegangan 11 volt.
Gambar 9 Hasil pemeriksaan SSA endapan elektrolisis kedua (1) 43.7559 g, (2) 41.2050 g, dan (3) 68.2222 g.
Tabel 4 menunjukkan bahwa data bobot endapan semakin banyak dengan semakin kecil ukuran elektrode karbon yang digunakan. Hal ini kemungkinan
24
disebabkan pada elektroda terkecil laju reaksi berlangsung cepat, sehingga terjadi akumulasi endapan yang tinggi pada katode. Endapan yang banyak di katode juga disebabkan ukuran anode yang kecil dimana permukaan anode sebagai kutub positif menstimulasi elektron, sehingga reduksi Ag terjadi dan menghasilkan penumpukan endapan. Hasil analisis SSA menunjukkan bahwa kadar Ag yang tertinggi berasal dari endapan sejumlah 68,2222 g (elektrolisis dengan ukuran elektrode terkecil). Hasil elektrolisis ketiga dan hasil pemeriksaan SSA terhadap endapannya tersaji pada Tabel 5 dan Gambar 10.
Tabel 5 Hasil elektrolisis ketiga dengan variasi voltase Voltase
Keterangan: elektrolisis dilaksanakan pada suhu kamar selama 4 jam.
Gambar 10 Hasil pemeriksaan SSA (kiri ke kanan): 16.7134, 27.3983, 26.4612, 35.3709, dan 46.1097 gram.
Berdasarkan Tabel 5 terlihat bahwa semakin tinggi voltase ternyata hasil endapan semakin banyak, tetapi tidak serta merta dengan hasil analisis SSA. Hal ini dapat dijelaskan bahwa terdapat beberapa variabel yang berpengaruh terhadap
25
suatu proses elektrolisis, diantaranya listrik, elektroda, media elektrolisis dan pengadukan (Sindy 2006). Endapan sejumlah 47.4575 g tidak mengandung Ag. Hal ini disebabkan oleh 2 hal, pertama endapan tersebut seluruhnya adalah pengotor, kedua terjadi tegangan berlebih (over potensial) sehingga butir-butir Ag lepas tidak menempel di katoda. Limbah fixer A menghasilkan endapan sedikit tetapi menunjukkan kadar Ag tertinggi disebabkan Ag sebagai garam halida yang tertempel di film larut dalam jumlah besar sebagai garam kompleks perak tiosulfat. Selanjutnya data elektrolisis ke-2 dan hasil pemeriksaan SSA terhadap endapannya tersaji pada Tabel 4 dan Gambar 9.
Hasil elektrolis ke-3 dapat dibuat persamaan matematika, y = 3,950 x + 6,258 , dengan x= variasi voltase
r= ( koefisien korelasi) = 0,9654.
Hubungan Variasi Waktu dengan Voltase
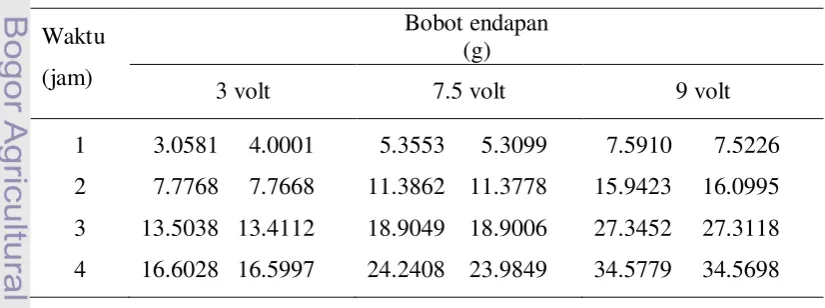
Berdasarkan ketiga percobaan awal terpilih 2 jenis limbah fixer yaitu limbah encer dan limbah pekat, diperoleh ukuran elektroda karbon efisien 14 x 3 x 3 cm, serta voltase terpilih 3 , 7,5 , dan 9 volt. Untuk mengetahui hubungan antara variasi waktu dan voltase terhadap endapan, dilakukan percobaan keempat (Gambar 7). Hasil penimbangan massa endapan elektrolisis keempat dari limbah encer tersaji pada Tabel 6.
Tabel 6 Hasil penimbangan massa endapan elektrolisis keempat limbah encer Waktu
26
terkumpul di katode pada elektrolisis selama 4 jam dan tegangan 9 volt. Hasil penimbangan massa endapan elektrolisis limbah pekat tersaji pada Tabel 7.
Tabel 7 Hasil penimbangan massa endapan elektrolisis limbah pekat Waktu
Berdasarkan Tabel 6 dan 7 menunjukkan bahwa elektrolisis limbah pekat secara umum menghasilkan endapan lebih banyak, kecuali durasi 4 jam pada tegangan 3 volt. Hal ini disebabkan pada limbah pekat terjadi pelarutan Ag lebih banyak atau akumulasi pengotor yang menempel pada katode yang lebih banyak. Bobot endapan yang dihasilkan (lihat Tabel 6 dan 7) bila kita cermati tampak bahwa dengan peningkatan waktu terjadi pengurangan. Hal ini sesuai dengan kaidah umum dalam kimia bahwa dalam reaksi yang searah produk reaksi akan mencapai hasil maksimal tetapi akan berkurang seiring dengan pertambahan waktu. Hasil dari Tabel 6 dan 7 selanjutnya dianalisis rancak seperti tersaji pada Tabel 8.
Tabel 8 Hasil analisis rancangan acak kelompok limbah encer dan pekat
27
Perhitungan terakhir adalah pengolahan ANNOVA limbah fixer encer dan pekat (Tabel 9 dan 10).
Tabel 9 Pengolahan ANNOVA limbah fixer encer Sumber variasi Varians Derajat
kebebasan Fhitung Ftabel Faktor waktu SSA 3 23.652 6.60 (α = 0.025)
waktu berpengaruh terhadap banyaknya endapan.
B > Ftabel voltase berpengaruh terhadap banyaknya endapan.
Tabel 10 Pengolahan ANNOVA limbah fixer pekat Sumber variasi Varians Derajat
kebebasan Fhitung Ftabel Faktor waktu SSA 3 14.208 6.60 (α = 0.025)
waktu berpengaruh terhadap banyaknya endapan.
B > Ftabel voltase berpengaruh terhadap banyaknya endapan.
Produk Elektrolisis dengan Variasi Konsentrasi
Perolehan endapan terbanyak elektrolisis tahap ini sebanyak 77.0742 gram, dihasilkan oleh limbah fixer pemakaian 800x. Hasilnya mula-mula berbentuk kristal, berwarna hitam dan berlapis Ag, setelah ekstraksi, disaring, diuapkan, direaksikan dengan NaCl, pemurnian dengan pembilasan air (t = 100 ˚C), digunakan air yang panas untuk melarutkan pengotor PbCl2, dan dijemur di bawah
28
yang mengandung kadar perak minimal 2 gram/liter. Faktor lain penyebab terjadi sulfidasi adalah konsentrasi sulfit dan pH fixer; konsentrasi sulfit yang rendah dan pH yang tinggi menyebabkan sulfidasi berlangsung. Upaya yang dapat dilakukan adalah memberikan agitasi yang lebih besar apabila arus listrik semakin tinggi selama elektrolisis.
Gambar 11 Kristal Ag hasil elektrolisis dengan variasi konsentrasi.
Produk Elektrolisis dengan Variasi Elektroda Karbon
E
Perolehan endapan terbanyak elektrolisis tahap ini sebanyak 68.2222 gram dari ukuran elektrode 14 cm x 3 cm x 3 cm. Produk pada tahap ini berupa kristal hitam tetapi agak kecil, setelah ekstraksi 2 jam, disaring dengan kain parasit untuk memisahkan larutan dari endapannya, diuapkan, direaksikan dengan NaCl, pemurnian dengan pembilasan air t = 100 ˚C dan dijemur di bawah sinar matahari kristal hasil berwarna keperakan agak buram (Gambar 12). Kadar Ag tertinggi elektrolisis variasi elektrode karbon sebesar 1177.97 ppm.
Gambar 12 Kristal Ag hasil elektrolisis dengan variasi ukuran elektroda karbon.
Produk Elektrolisis Variasi Voltase
Produk elektrolisis variasi voltase (Gambar 13) berupa kristal hitam-berlapis Ag. Endapan diekstraksi/direaksikan dengan HNO3 2 M agar Ag larut, kemudian
29
nitrat, direaksikan dengan NaCl agar terbentuk AgCl, pemurnian dengan pembilasan air (t = 100 ˚C), dan dijemur di bawah sinar matahari, hasilnya kristal berwarna keperakan.
uv
Reaksi=2 AgCl (s) 2 Ag + Cl2 (Tobing & Nathan 2003)
Kadar Ag tertinggi elektrolisis variasi voltase sebesar 108.50 ppm.
Gambar 13 Kristal Ag hasil elektrolisis dengan variasi voltase.
Analisis Komprehensif Manfaat Elektrolisis Fixer
Pemisahan perak berbahan baku limbah fixer dalam penelitian ini sejalan dengan program pemerintah dalam rangka penyelamatan lingkungan, seperti “go green” atau program” langit biru”. Fixer dari limbah radiologi ditampung dan diolah, kegiatan ini sangat bermanfaat, yaitu pertama menghindarkan bahaya akibat pencemaran lingkungan dan kedua pembukaan lahan pekerjaan. Ditinjau dari peralatan, bahan, dan metode, percobaan ini cukup simpel, limbah fixer mudah diperoleh dan reagen-reagen hanya memerlukan air, HNO3
Berdasarkan ketiga variasi yang digunakan maka elektrolisis limbah fixer akan berlangsung efisien bila ditunjang beberapa faktor (1) konsentrasi limbah fixer yang pekat dan pemeriksaan sampel dengan SSA yang tinggi, (2) ukuran elektrode karbon yang tepat, dan (3) pemilihan voltase secara tepat agar kinetika reaksi elektrolisis optimal.
30
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil yang diperoleh dalam penelitian ini maka dapat disimpulkan bahwa elektrolisis berbahan baku limbah fixer untuk memisahkan logam Ag cukup efisien. Endapan elektrolisis limbah pemakaian 300x celup menunjukkan kadar Ag sebesar 272.79 ppm, endapan elektrolisis dari ukuran elektrode C; 14 cm x 3 cm x 3 cm menunjukkan kadar Ag sebesar 1177.97 ppm dan endapan elektrolisis dari tegangan 9 volt menunjukkan kadar Ag sebesar 108.50 ppm. Rendemen Ag tertinggi sebesar 13.33% .
Saran
31
DAFTAR PUSTAKA
Anwar S. (Tanpa Tahun). Recovery perak dari limbah fotografi melalui membran cair berpendukung dengan senyawa pembawa asam di-2-etil heksil fosfat (D2EHPA). Foxit.
Aryadi, Suryawan I. 2006. Pengaruh berat membran zeolit pada penurunan kadar Ag dalam limbah fotografi di PTAPB-BATAN secara elektrodialisis. Yogyakarta, 19 September 2006. Yogyakarta: Pusat Teknologi Akselerator dan Proses Bahan.
Atkins PW. 1999. Kimia Fisika Jilid 1. Ed ke-4. Kartohadiprojo I, penerjemah. Jakarta: Erlangga Press.
Beyzari AN, Dittmann H, Rosenstock F. 1996. Process for the recovery of silver by floatation from the residue from the wet extraction of zinc. US Patent 5482535.
Brierley JA, Brierley CL, Gayak GM. 1996. Amt-Bioclaimtm – a new wastewater treatment and metal recovery technology. Di dalam: Lawrence RW, Bianion RMR, Ebner HG, editor. Fundamental and applied biohydrometallurgy. Elsevier Phantom.
Cambell DA, Dalrymple IM, Sunderland JG, Tilston D. 1994. The Electrochemical recovery of metals from effluent and process streams. Resources, Conservation and Recycling.
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. Jakarta: UI Press. Day RA, Underwood Jr. 1986. Analisa Kimia Kualitatif. Soendoro R, editor.
Bagian Kimia Fakultas Kedokteran UNAIR Surabaya. Erlangga Press. [EKC] Eastman Kodak Company. 2000. Material Safety Data Sheets (MSDS)
KODAK GBX Fixer. http://www.kodak.com/cgi-bin/web Ca. [15 Juni 2000].
[EKC] Eastman Kodak Company. 2000. Facilities. Kodak Publication No. J -212 CAT No. 8102436, ROCHESTER, NY 14650.
[ESR] Eastern Smelting Corp. 1997. Recovery from fixer waste of radiology.
32
Haris MCDA. 2003. Pemisahan logam berat menggunakan membran cair berpendukung dengan variabel konsentrasi ion logam dan pH fase umpan. Laboratorium Kimia Analitik, FMIPA, Universitas Diponegoro Semarang, JKSA Volume 6.
Hubicki Z, Hubicka H. 1996. Studies on the separation of silver (i) microquantities from macroquantities of salts of other elements on selective ion-exchangers. Hyrometallurgy 41:287.
Jansen B, Michiels F, Wynckel MVD. 1997. Silver Recovery Device and Process. US Patent 5605632.
Khopkar SM. 2002. Konsep Dasar Kimia Analitik. Saptoraharjo, penerjemah. Jakarta: UI Press. Terjemahan dari Basic Concept of Analytical Chemistry. Khunprasert P, Grisdanurak N, Traveesri J, Danutra V, Puttitatorn W. 2004.
Radiographic Film Waste Management in Thailand and Cleaner Technology for Silver Leaching. Pusat Riset Nasional bagi Lingkungan dan Hazardous Waste Management, Universitas Chulalongkorn, Bangkok, 10330, Thailand.
Lasut R. 2006. Implementasi manajemen bahan kimia dan limbah laboratorium kimia (Studi kasus di laboratorium PT. Pupuk Kaltim, Tbk) [tesis]. Semarang: Program Magister Ilmu Lingkungan, Program Pasca Sarjana UNDIP.
Lubis E. 2010. Pengolahan Limbah Radioaktif. http://puskaradim.blogspot/. [05 Juli 2011].
Marinković J, Korac M, Kamberovic Z, Matic I. 2006. Recycling of silver from exposed x-ray films. Acta Metallurgia 12:262-268.
Maria T, Albert N. 2003. Prosessing of Copper, Gold, and Siver. PIMTI, JABABEKA Bekasi. http://www.pimti-indo.com [10
Marta D. 2007. Studi efisiensi pemisahan perak dari limbah cair fixer film dengan metode elektrolisis [skripsi]. Bandung: Departemen of Civil Engineering, Faculty of Civil and Enviromental Engineering ITB.
September 2010].
Mattuschka B, Straube G, Trevors JT. 1994. Silver, copper, lead and zinc accumulation by pseudomonas stutzeri ag259 and streptomyces albus: electron microscopy and energy dispersive x-ray studies. BioMetals 201-208.
33
Mertz C, Chamberlain DB, Chen L, Corner C, Vandergrift. 1999. Decontamination of Actinide and Fission Product from stainless Steel Surfaces. ANL, Argon Illionis, Chicago USA.
Mufid. 2008. Proses pengendapan isolasi logam perak dari limbah fixer film dengan elektrolisis. Jurnal Teknologi Separasi 1.
Nakibognu, Toscali D, G¨urel N. 2001. A novel siver recovery methode from waste photographic film with NaOH Stripping, alakesir University of Scienceand Arts, Chemistry Department, Balkesir-TURKEY.
Riveros PA, Cooper WC. 1985. The extraction of silver from cyanide solution with ion exchange resins. Solv Extr Ion Exch.
Sindy EP. 2006. Elektrosintesis, metode elektrokimia untuk memproduksi senyawa kimia: pagi Tawaha. Departemen Ilmu Tanaman, Universitas Mc Gill, Kampus Mc Donald, 21111 Lakeshore., Ste-Anne-de-Belevue, 3 V9H9XQC, Canada.
Siregar D. 2009. Penggunaan nanokitosan sebagai penyalut karbon aktif untuk menyerap logam stannum dengan spektrofotometri serapan atom [tesis]. Medan: Sekolah Pascasarjana Universitas Sumatra Utara.
Sugikawa S, Umeda M. 2000. Alpha bearing waste treatment by electrochemical oxidation technique. Conferention on Safewaste.
Suyati L, Gunawan, Rahmanto H. 2003. Pengambilan kembali perak buangan berdasarkan metode reduksi kimiawi. Laporan Penelitian. Semarang: FMIPA UNDIP.
Suzuki Y, Maeda A, Sugikawa S, Takesita I. 2000. Waste management in NUCEF. Conference on Atlanta, Avignon, France.
Teresa M, Reis A, Carvalho JMR. 1993. Recovery of zinc from an industrial effluent by emulsion liquid membrane. J Membrane Sci.
Tomonari M, Ida K, Imanishi H, Yonezawa T, Mori K, Yamashita H.2006. Effect of preparation condition on the synthesis of nano-sized Ag metal particles by the wet –process using 3-mercapto-propionic acid. Division of Materials and Manufacturing Science, Graduate school of Engineering, Osaka University, 2-1 Yamada-Oka, Suita, Osaka 565-0871, Japan.
Tobing M, Nathan A. 2003. Prosessing of copper, gold, and siver. PIMTI, JABABEKA Bekasi. http://www.pimti-indo.com. [10
Widya P, Hastuti R, Haris A. (tanpa tahun). Pengaruh ligan KCN pada proses elektrolisis untuk pengambilan logam perak dari limbah cair fotografi, Jurusan Kimia FMIPA UNDIP.
34
______.2010. Limbah cair rumah sakit.
______.(tanpa tahun). Fixer.
_______.2010. Fixer.
collection
_______.(tanpa tahun). Elektrokimia.
35
36
Lampiran 1 Uji SSA sampel
37
Lampiran 2 Uji SSA endapan dengan variasi konsentrasi
38
Lampiran 2 (lanjutan)
Action Sample
True value (ppm)
Konsentrasi
(ppm) Abs. BG WF VF DF
Actual cons.
Actual cons. unit
% Rsd
UNK4-3 500 0.7432 0.1448 -0.0155 0.55 100 1 135.4479 ppm
UNK4-AV 500 0.752 0.1461 -0.0158 0.55 100 1 137.0482 ppm 1.16
UNK5-1 600 0.3785 0.0908 -0.019 0.66 100 1 56.9536 ppm
UNK5-2 600 0.3649 0.0888 -0.0184 0.66 100 1 54.9207 ppm
UNK5-3 600 0.3582 0.0878 -0.0177 0.66 100 1 53.9042 ppm
UNK5-AV 600 0.367 0.0891 -0.0184 0.66 100 1 55.2256 ppm 1.71
UNK6-1 700 1.9732 0.3269 -0.0171 0.9 100 1 218.8803 ppm
UNK6-2 700 1.9698 0.3264 -0.0167 0.9 100 1 218.5057 ppm
UNK6-3 700 2.0063 0.3318 -0.0167 0.9 100 1 222.5517 ppm
UNK6-AV 700 1.9833 0.3284 -0.0168 0.9 100 1 220.0042 ppm 0.91
UNK7-1 800 0.2386 0.0701 -0.0203 0.65 100 1 36.9924 ppm
UNK7-2 800 0.2434 0.0708 -0.0201 0.65 100 1 37.7253 ppm
UNK7-3 800 0.2373 0.0699 -0.0199 0.65 100 1 36.7829 ppm
39
Lampiran 3 Uji SSA endapan dengan variasi ukuran elektrode karbon
40
Lampiran 4 Uji SSA endapan dengan variasi voltase
Action Sample True
value Cons.
(ppm) Abs BG WF VF DF
Actual cons
Act. Con unit
% Rsd
UNK8-AV Electrolisis C - 1 0.5298 0.1132 0.0104 2.03 100 1 26.058 ppm 3.04 UNK9-1 Electrolisis C - 2 0.1083 0.0508 0.0103 2.13 100 1 5.0786 ppm
UNK9-2 Electrolisis C - 2 0.1056 0.0504 0.0106 2.13 100 1 4.9518 ppm UNK9-3 Electrolisis C - 2 0.1083 0.0508 0.0105 2.13 100 1 5.0786 ppm
UNK9-AV Electrolisis C - 2 0.1076 0.0507 0.0105 2.13 100 1 5.0469 ppm 0.46 UNK10-1 Electrolisis C - 3 0.0441 0.0413 0.0117 2.15 100 1 2.0486 ppm
UNK10-2 Electrolisis C - 3 0.0428 0.0411 0.0112 2.15 100 1 1.9859 ppm UNK10-3 Electrolisis C - 3 0.0414 0.0409 0.0108 2.15 100 1 1.9231 ppm
UNK10-AV Electrolisis C - 3 0.0428 0.0411 0.0112 2.15 100 1 1.9859 ppm 0.49 UNK11-1 Electrolisis C - 4 2.1866 0.3585 0.0147 2.3 100 1 94.989 ppm
UNK11-2 Electrolisis C - 4 2.1042 0.3463 0.015 2.3 100 1 91.409 ppm
UNK11-3 Electrolisis C - 4 2.1063 0.3466 0.015 2.3 100 1 91.497 ppm
UNK11-AV Electrolisis C - 4 2.1326 0.3505 0.0149 2.3 100 1 92.642 ppm 1.99 UNK11-AV Electrolisis C - 4 2.1326 0.3505 0.0149 2.3 100 1 92.642 ppm 1.99
UNK12-1 Electrolisis C - 5 2.4102 0.3916 0.0156 2.25 100 1 107.12 ppm UNK12-2 Electrolisis C - 5 2.4123 0.3919 0.0152 2.25 100 1 107.21 ppm
41
Lampiran 5 Diagram alir elektrolisis ke-2
Elektrolisis
Fixer dgn elektroda B Fixer dgn elektroda C
Fixer dgn elektroda A
42
Lampiran 6 Diagram alir elektrolisis ke-3
43
Lampiran 7 Perhitungan rendemen hasil elektrolisis variasi konsentrasi
Kadar Ag awal = 6000 mg/L X 10 liter = 60000 mg (60 gram) Kadar Ag akhir= 272.7 mg/L X 0.1 liter=27.27 mg
27.27 mg dalam 1000 mg sampel (1 gram)
1 gram
27.27 mg X bobot endapan
27.27 mg X 17.47 g 1 gram
= 476.40 mg (0.476 gram)
Jadi rendemen= hasil/awal X 100 = 0.476/60 X 100= 0.79%.
Lampiran 8 Perhitungan rendemen hasil elektrolisis variasi elektrode karbon
Kadar Ag awal = 6000 mg/L X 10 liter = 60000 mg (60 gram) Kadar Ag akhir= 1177 mg/L X 0.11 = 117.7 mg
117.7 mg dalam 1000 mg sampel (1 gram)
1 gram
117.7 mg X bobot endapan
117.7 mg X 68.2 g 1 gram
= 8027 mg (8 gram)
Jadi rendemen= hasil/awal X 100 = 8/60 X 100 = 13.33%
Lampiran 9 Perhitungan rendemen hasil elektrolisis elektrode tegangan
Kadar Ag awal = 6000 mg/LX 10 liter = 60000 mg (60 gram) Kadar Ag akhir =108.5 mg/L X 0.1 liter = 10.85 mg
10.85 mg dalam 1000 mg sampel (1 gram)
1 gram
10.85 mg X bobot endapan
10.85 mg X 46.1 g 1 gram
= 500 mg (0.5 gram)
44
Lampiran 10 Pengolahan ANNOVA lengkap limbah fixer encer
Voltase Kuadrat 269.567 1237.26 3562.74 5668.3281 10737.9
45
Lampiran 11 Pengolahan ANNOVA lengkap limbah fixer pekat Voltase
(volt)
Waktu (Jam)
Kuadrat
1 2 3 4 S
3 6.93 9.04 13.21 16.21 45.39 2060.32
7.5 8.59 15.43 19.83 28.40 72.25 5220.16
9 10.95 16.04 28.25 34.37 89.61 8029.61
26.46 40.51 61.30 78.98 207.25 15310.09 Kuadrat 700.121 1641.22 3757.09 6238.2511 12336.7
1 2 3 4
47.99 81.70 174.54 262.87 73.73 238.19 393.33 806.46
q 3
119.81 257.28 798.14 1181.36
p 4
241.5 577.2 1366.0 2250.7 4435.4 N 12
A 4112.23 SSA 532.86491 A - B
B 3579.36 SSB 248.15978 C - B
C 3827.52 SSR 75.01064 (D + B) - (A + C)
D 4435.40 SStotal 856.03533 SSA + SSB + SSR
A =(10737.9/3)
B =(186.57)2 C
/12 =(12585.17/4)
D =3882.3
Ftabel
FA 14.208 6.60 (α = 0.025)
FB 9.925 7.26 (α = 0.025)
i
ABSTRACT
SUPRATNO. The Isolation of Silver (Ag) from Fixer Sludge with Electrolysis methode. Under direction of ZAINAL ALIM MAS’UD and ETI ROHAETI.
The isolation of silver with electrolysis methode on sludge silver was tried with the variations concentration, electrode of carbon, and voltages. The aim of research are looking for the easiest and eficient electrolysis. Among of 272.79 ppm of silver (impurities) could be produced from electrolysis fixer which used 300 times maintain the film. For 400, 500, and 600 times electrolysis were produced recently 49.42, 137.04, and 55.22 ppm. Futhermore, it was increased to 220.00 ppm from 700 times. These were possible because of density the solutions. From the electrode of carbon, 68.2222 g Ag (impurities) could be processed from size 14 cm x 3 cm x 3 cm. The next results 41.2050 g and 43.7559 g from the sizes 16 cm x 3 cm x 3 cm and 18 cm x 3 cm x 3 cm. The reasoned of this part any faster reaction on the most litle electrode. By the way, from voltages variation, the processed showed that 47.4575 g of Ag (impurities) could be produced from 11 volt. It’s caused the bigest voltages are also the bigest kinetics power on the reactions. Sampel and product were analized by AAS. Consentration has potential to be indicator, because of the used 700 times was given trend high Ag (impurities) became increase optimally at 11 volt, and much sediment that is 47.4575 g. The best rendemen is 13.33%. The other finding is that the strength of the time and the voltages strongly enfluence the electrolysis shown by the bigger result on F(calculation) than that of the F(table).
1
PENDAHULUAN
Latar Belakang
Indonesia memiliki sumber daya mineral yang variatif, baik jenis dan wujud materialnya. Beberapa jenis yang telah populer diantaranya emas, perak, tembaga, aluminium. Sebagai bahan tambang tidak dapat diperbaharui mineral seharusnya dikelola dengan baik, profesional dan multifungsional sehingga bermanfaat jangka panjang sebagai elemen pembangunan.
Perkembangan ilmu dan teknologi fotografi telah mendatangkan banyak manfaat, walaupun disisi lain menghasilkan limbah. Menurut Aryadi & Suryawan (2006), kemajuan teknologi industri fotografi begitu pesat sehingga produksi limbah yang dihasilkan dari kegiatan tersebut sudah sangat membahayakan apabila tidak ditangani secara serius.
Komposisi cairan fixer selama pencucian film kaya dengan logam Ag, Tobing & Nathan (2003) melaporkan bahwa jumlah perak yang terdapat dalam klise film kira-kira 1%, sedangkan menurut Khunprasert et al. (2006), jumlah perak sekitar 2%, akan menjadi upaya bernilai ekonomi bila dilakukan recovery disamping meminimalkan efek radioaktif limbah buangannya.
Beberapa penelitian yang telah dilakukan, di antaranya Mattuschka et al. (1996) melaporkan bahwa Pseudomonas stutzeri Ag-259 dan Streptomyces albus telah digunakan untuk mempelajari akumulasi perak. Akumulasi perak dari campuran logam sebanyak 142 µ mol/gram. Tobing & Nathan (2003) berhasil melakukan pemisahan perak sebanyak 0.7 kg dari 100 kg limbah film radiologi dengan cara ekstraksi menggunakan pelarut HNO3
Suyati et al. (2003) melakukan pengambilan kembali perak ionik dari limbah film melalui proses pengendapan elektrolit langsung, namun rendemen pengendapan metalik baru mencapai 57.10%, sementara endapan masih belum mengkilap seperti yang diharapkan. Uji spektrofotometrik menunjukkan bahwa kemurnian endapan perak hanya 83.44%. Selain itu pemakaian energi listrik untuk mengendapkan logam merupakan pemborosan cukup besar. Widya et al. (Tanpa Tahun) melakukan elektrolisis pemurnian endapan Ag yang maksimal pada durasi
2
30 menit 36.06% tanpa menggunakan elektroda platina dengan variasi waktu 30, 60, 90, dan 120 menit. Dalam pengujiannya dilakukan melalui tahapan berikut; penentuan konsentrasi Ag sampel dengan SSA, penentuan potensial elektrodeposisi dan elektrolisis pada potensial tetap.
Donal (2007) melakukan pemisahan perak dari limbah cair fixer film dengan menggunakan metode elektrolisis. Dalam pengujiannya digunakan elektrode plat seng dan stainless. Reaktor dioperasikan dengan variasi tegangan listrik, waktu, dan jarak elektroda. Pengujian terbaik menunjukkan bahwa pasangan elektroda seng-stainless memisahkan konsentrasi perak lebih banyak yaitu 52%. Pada variasi tegangan terhadap waktu, efisiensi terbesar diperoleh pada rentang tegangan 3-5 volt dan pada waktu 30-60 menit dengan efisiensi 74%-92%. Pada variasi jarak efisiensi optimal diperoleh pada jarak 2 dan 4 cm dengan efisiensi 74% dan 88%. Proses produksi perak dari film dapat dibagi menjadi dua kelompok, yaitu mekanik dan kimia yang dapat dikaitkan dengan pembentukan pembawa gelatin asam oksalat dan melarutkan perak (Marinkovic et al. 2006). Mufid (2008) melaporkan elektrolisis terhadap limbah fixer, sehingga diperoleh pengendapan Ag2S dari larutan encer dan pekat. Arus 5 A selama 8 jam
menghasilkan 26.03 g (sebelum pengenceran) dan 29.70 g (sesudah pengenceran), kuat arus maupun konsentrasi sangat berpengaruh pada elektrolisis. Tomonari et al. (2008) juga melaporkan bahwa Ag yang berukuran nano dapat disintesis dengan mengkondisikan sistem preparasi menggunakan proses kering 3-mercapto-propionic acid.
Tujuan Penelitian
Penelitian ini bertujuan memperoleh informasi ilmiah berkaitan dengan proses memisahkan perak (Ag) dari limbah fixer dengan metode elektrolisis menggunakan elektrode karbon.
Manfaat Penelitian
3
Hipotesis Penelitian
1. Limbah fixer pekat (banyak terpakai untuk mencelup film), akan menghasilkan perak semakin banyak.
2. Ukuran elektrode relatif kecil berakibat elektrolisis berlangsung cepat, sehingga produk perak dapat terbentuk secara maksimal.
4
TINJAUAN PUSTAKA
Perak(Ag)
Dalam sistem periodik unsur, perak terletak pada golongan IB dan periode 5. Unsur tersebut bernomor atom 47 dan memiliki massa atom 107.870 g/mol termasuk logam yang berkarakter fisik keras dan unik di antara logam-logam lainnya. Perak memiliki titik leleh 961.93 ˚C dan titik didih 2212 ˚C. Perak berada dalam keadaan terikat sebagai Ag2S (argentit), AgCl, dan dalam bijih
tembaga-nikel. Unsur bersifat logam transisi ini berwarna putih mengkilap, dapat ditempa, sedikit lebih keras dari emas, konduktivitasnya paling tinggi diantara semua logam, tahan terhadap udara murni dan air, tetapi tidak tahan terhadap udara yang mengandung belerang (timbul bercak hitam, menjadi kusam), dan kurang reaktif dibandingkan dengan tembaga. Sifat-sifat fisik dan kimia tersebut menjadikan perak mudah diolah (Gambar 1a), dan dibuat menjadi produk komersil (Gambar1b).
(a) (b)
Gambar 1 Perak kristal (a) dan hiasan kerudung (b)
5
Perak juga dapat larut dalam senyawa alkali sianida (NaCN/KCN), asam organik tiourea, dan tiosulfat membentuk garam kompleks perak, dengan reaksi sebagai berikut:
Beberapa penelitian berkaitan dengan sifat Ag, di antaranya Meng et al. (2004), melaporkan bahwa tiosulfat menunjukkan potensi yang besar dalam recovery perak dari limbahnya. Senyawa perak halida sangat peka terhadap cahaya. Perak halida akan tereduksi menjadi perak dan gas hidrogen saat disinari oleh gelombang ultraviolet, misalnya sinar matahari. Perak klorida berwarna putih kapur dan garam yang tidak larut dalam air. Larutan perak nitrat saat dicampur dengan alkali halogen, misalnya NaCl akan terbentuk endapan perak klorida, dengan reaksi sebagai berikut:
2+
AgNO3(l) + NaCl(l) AgCl (s) + NaNO3
Selanjutnya AgCl jika disinari matahari terurai menjadi Ag dan gas klor (l)
2AgCl(s) uv Ag (s) + Cl2
Menurut Khunprasert et al. (2004), kandungan perak cukup berbeda tajam antara film sinar-X asli, film sinar-X terpakai, dan larutan (Tabel 1).
(g) (Tobing & Nathan 2003)
Tabel 1 Kandungan perak dalam material Material Kandungan perak per unit
material (g Ag/m2
sampel yang ditambahHNO3 dan diterminasi dengan SSA b
larutan yang diukur dengan SSA langsung
c
total Ag terestimasi dari2 %Agdalam sejumlah film sinar X pada 2004
d
total Ag terestimasi dari 1,1 % s.d 1,3 % dalam sejumlah film sinar-X pada 2004
6
dimanfaatkan dalam banyak bidang, antara lain peralatan rumah tangga, medali, serta asesoris seperti jam tangan, bros maupun hiasan pada kerudung, pada plastik master, dan dunia kedokteran (bahan untuk ronsen).
Pengambilan perak dari limbah cuci cetak dapat dilakukan dengan metode membran cair berpendukung (SLM), sebagai membran pendukung digunakan polytetrafluoroethylen (PTFE) yang direndam selama 2 jam dalam senyawa pembawa asam Bis(2-etil heksil)fosfat (D2EHPA) 1 M dengan pelarut kerosen dan dilakukan pengadukan selama 6 jam. Untuk mengetahui kondisi optimum dalam recovery perak dilakukan variasi pH larutan umpan 1, 1.5, 2, 2.5, 3, 3.5, 4, larutan penerima HCl, HCl-EDTA, HNO3, HNO3-EDTA, H3PO4, H3PO4
Teresa et al. (1993) melaporkan bahwa perak sulfida memiliki kelarutan yang sangat rendah (Ksp 6 X 10
-EDTA, serta konsentrasi larutan limbah pemekatan ½ kali, pengenceran 0 kali, pengenceran 10 kali. Dari penelitian ini diperoleh % transpor perak dari limbah fotografi dengan variasi pH larutan umpan memberikan % transpor perak optimum pada pH 2,5 yaitu 96.44% dengan larutan penerima HCl, sedangkan untuk % transpor perak pada fasa penerima dengan variasi larutan penerima memberikan hasil optimum pada larutan penerima (HCl-EDTA) yaitu 63.85% dan untuk variasi konsentrasi larutan umpan memberikan hasil optimum pada pengenceran 10 kali.
-50